Brian E. Harrington e Miguel Angel Reina
INTRODUZIONE
I mal di testa posturali a seguito di interventi che interrompono l'integrità meningea sono più comunemente etichettati come mal di testa da puntura postdurale (PDPH). Questa terminologia è stata ufficialmente adottata nella Classificazione internazionale dei disturbi della cefalea e viene utilizzata in questa sezione. Tuttavia, l'uso della parola postdurale è stato criticato come confuso e probabilmente impreciso, risultando nella proposta di un termine alternativo, mal di testa da puntura meningea (MPH), che i lettori potrebbero incontrare sempre più. È anche importante riconoscere che i riferimenti alla "puntura durale" in tutta la letteratura medica descrivono effettivamente la puntura della dura-aracnoide e sono più correttamente definiti e pensati come "puntura meningea". Indipendentemente dalla terminologia, il PDPH è ben noto ai molti clinici la cui pratica include procedure che accedono allo spazio subaracnoideo.
Tuttavia, la nostra comprensione di questa grave complicazione rimane sorprendentemente incompleta. Questa sezione riassume lo stato attuale delle conoscenze relative a questo familiare problema iatrogeno, nonché agli argomenti strettamente correlati della puntura durale accidentale o non intenzionale (rispettivamente ADP o UDP) e del cerotto epidurale (EBP).
STORIA E RILEVANZA ATTUALE
Essendo una delle prime complicazioni riconosciute dell'anestesia regionale, la PDPH ha una storia lunga e colorata. Il Dr. August Bier notò questo effetto avverso nel primo paziente sottoposto ad anestesia spinale con successo il 16 agosto 1898 (Figure 1 ). Bier ha osservato: "Due ore dopo l'operazione, la schiena e la gamba sinistra sono diventate doloranti e il paziente ha vomitato e si è lamentato di un forte mal di testa. Il dolore e il vomito sono presto cessati, ma il giorno successivo era ancora presente il mal di testa” (corsivo aggiunto). La settimana successiva, Bier e il suo assistente, il dottor August Hildebrandt, eseguirono esperimenti di cocainizzazione del midollo spinale su se stessi. In una descrizione del PDPH appena migliorata in un secolo intermedio, Bier in seguito riferì in prima persona la sua esperienza nei giorni a seguire: "Avevo una sensazione di pressione molto forte sul mio cranio e sono diventato piuttosto stordito quando mi sono alzato rapidamente dalla sedia. Tutti questi sintomi sono svaniti in una volta quando mi sono sdraiato, ma sono tornati quando mi sono alzato. … Fui costretto a mettermi a letto e vi rimasi nove giorni, perché tutte le manifestazioni si ripresentavano appena mi alzavo. ... I sintomi si sono finalmente risolti nove giorni dopo la puntura lombare. Nella storia medica, poche complicazioni sono state associate così strettamente a una tecnica specifica come PDPH con anestesia spinale. Impiegando i metodi dell'inizio del XX secolo, l'anestesia spinale è stata spesso seguita da un mal di testa grave e prolungato, che ha gettato una lunga ombra sullo sviluppo e sull'accettazione di questa modalità. Le indagini sulla causa di questi sintomi preoccupanti alla fine hanno portato alla conclusione che erano dovuti alla perdita persistente di liquido cerebrospinale (CSF) a causa dello strappo creato nelle meningi. Gli sforzi di successo più notevoli per ridurre al minimo la perdita di liquido cerebrospinale sono stati l'uso di aghi di calibro più piccolo e "non taglienti" (come dimostrato in modo convincente negli anni '20 rispettivamente da Vandam e Dripps e Hart e Whitacre). Nonostante questi significativi progressi nella prevenzione, il PDPH è rimasto un evento frustrantemente comune.
L'ampia ricerca di trattamenti efficaci per PDPH risale ai tempi di Bier. Tuttavia, gli sforzi della prima metà del 20° secolo, sebbene spesso intensi e creativi, sono stati discutibili. In una monografia intesa come una rassegna completa del PDPH dal 1890 al 1960, il dottor Wallace Tourette e colleghi hanno citato dozzine di raccomandazioni terapeutiche separate e di vasta portata, inclusi interventi come etanolo per via endovenosa, raggi X al cranio, blocchi simpatici e manipolazione della colonna vertebrale. Sfortunatamente, prima dell'introduzione dell'EBP non esistevano misure terapeutiche che potessero essere descritte come miglioramenti significativi nel semplice passare del tempo. Nel suo libro di testo del 1955, Complications of Regional Anesthesia, il dottor Daniel C. Moore ha descritto in dettaglio un protocollo di trattamento completo di 3 giorni per PDPH. Ha concluso osservando che 3 giorni era la durata abituale dei mal di testa da lievi a moderati non trattati, ma che "tuttavia, il paziente sente che si sta compiendo un tentativo di risolvere il suo problema". L'EBP, una procedura medica sorprendentemente unica, si è rivelata la principale svolta nel trattamento del PDPH. Il concetto di utilizzare sangue autologo per "rattoppare" un buco nelle meningi è stato introdotto alla fine del 1960 dal dottor James Gormley, un chirurgo generale.
Tuttavia, il breve rapporto di Gormley è passato in gran parte inosservato per quasi un decennio perché, per i praticanti dell'epoca, un ematoma epidurale iatrogeno ha sollevato serie preoccupazioni di cicatrici, infezioni e danni ai nervi. La procedura è stata resa popolare solo in seguito nei circoli di anestesiologia ed eseguita come una vera iniezione epidurale, in gran parte grazie al lavoro dei dott. Anthony Di Giovanni e Burdett Dunbar. La procedura EBP è stata ulteriormente perfezionata negli anni '1970 quando il volume di sangue comunemente utilizzato è aumentato a 20 ml. Oggi, l'EBP è quasi universalmente impiegato come pietra angolare per il trattamento del PDPH grave. Il mal di testa da puntura postdurale rimane una preoccupazione clinica di primo piano fino ai giorni nostri. In gran parte a causa delle modifiche nella pratica che hanno seguito l'identificazione dei fattori di rischio, i tassi di PDPH dopo l'anestesia spinale sono costantemente diminuiti, da un'incidenza superiore al 50% ai tempi di Bier, a circa il 10% negli anni '1950, fino ad oggi un tasso dell'1% o ci si può ragionevolmente aspettare meno. Tuttavia, come forse il gruppo a più alto rischio, uno sfortunato 1.7% dei pazienti ostetrici continua a sperimentare PDPH dopo l'anestesia spinale utilizzando aghi Whitacre calibro 27. Con l'intenzione di evitare la puntura meningea, le tecniche epidurali sono un'alternativa interessante all'anestesia spinale.
Tuttavia, l'ADP occasionale, sia con l'ago che con il catetere, è inevitabile (e potrebbe non essere riconosciuta all'epoca in oltre il 25% dei pazienti che alla fine sviluppano PDPH). In situazioni non ostetriche (p. es., iniezioni di steroidi epidurali interlaminari), il tasso di ADP dovrebbe essere inferiore allo 0.5%. Tuttavia, l'ADP è di grande preoccupazione nell'ambito dell'anestesia ostetrica, dove l'incidenza di questo evento avverso è di circa l'1.5%. Oltre la metà di tutti i pazienti che soffrono di ADP con aghi epidurali svilupperanno infine sintomi di mal di testa, con molti studi su popolazioni ostetriche che riportano tassi di PDPH del 75% o superiori. Di ulteriore preoccupazione, è stato anche notato che l'ADP nelle partorienti è associato a mal di testa cronico e mal di schiena che viene ridotto, ma non del tutto eliminato, dall'EBP. Oltre agli interventi di anestesia, la PDPH rimane una complicanza iatrogena troppo comune dopo la mielografia e la puntura lombare diagnostica/terapeutica (LP). In queste situazioni, i tassi di MPH di circa il 10% sono ancora comunemente citati poiché i professionisti spesso continuano a utilizzare aghi Quincke di grosso calibro, considerati necessari a causa della viscosità del materiale di contrasto e per facilitare la raccolta tempestiva del liquido cerebrospinale. Di conseguenza, ci sono prove che suggeriscono che la maggior parte dei casi di PDPH ora ha un'origine non correlata all'anestesia.
Consigli NYSORA
• PDPH può comportare un rischio di responsabilità medico-legale.
• L'ADP può provocare mal di testa cronico e mal di schiena.
• Le procedure anestetiche con rischio di PDPH richiedono un adeguato consenso informato.
Il significato pratico di PDPH è illustrato dalla notazione nel database dell'American Society of Anesthesiologists Closed Claims Project come una delle richieste più frequenti per negligenza che coinvolge l'anestesia ostetrica, l'anestesia regionale e la gestione del dolore cronico. Giustamente, il mal di testa è il rischio più comunemente rilevato quando si ottiene il consenso per l'anestesia spinale ed epidurale. La natura potenzialmente grave di questa complicanza richiede l'inclusione nel consenso informato che coinvolga qualsiasi procedura che possa causare PDPH. Nell'ambito di questa discussione, i pazienti dovrebbero anche essere informati della normale insorgenza ritardata dei sintomi e ricevere istruzioni chiare per la tempestiva fornitura di consigli o la gestione in caso di effetti avversi.
FISIOPATOLOGIA
È stato a lungo accettato che il PDPH derivi da un'interruzione della normale omeostasi del liquido cerebrospinale. Tuttavia, nonostante una grande quantità di dati di ricerca e di osservazione, la fisiopatologia del PDPH rimane incompleta. Il liquido cerebrospinale viene prodotto principalmente nel plesso coroideo ad una velocità di circa 0.35 ml/min e viene riassorbito attraverso la villa aracnoidea. Il volume totale del liquido cerebrospinale negli adulti si mantiene intorno a 150 ml, di cui circa la metà è extracranico, e dà luogo a normali pressioni di apertura lombare di 5–15 cm H2O in posizione orizzontale (40–50 cm H2O in posizione eretta). È stato dimostrato sperimentalmente che la perdita di circa il 10% del volume totale del liquido cerebrospinale determina prevedibilmente lo sviluppo di sintomi tipici di PDPH, che si risolvono prontamente con la ricostituzione di questo deficit. È generalmente accettato che il PDPH sia dovuto alla perdita di liquido cerebrospinale a causa di una perdita persistente nelle meningi. A questo proposito, è stato postulato che l'aracnoide cellulare (contenente frequenti giunzioni strette e giunzioni occludenti) è forse più importante della dura madre più permeabile e acellulare nella generazione dei sintomi. In cadaveri freschi, Reina et al hanno studiato le lesioni del sacco durale umano prodotte da diversi aghi spinali e diversi orientamenti di smusso. La dura madre ha uno spessore di circa 400 μm, ed è formata da fibre distribuite casualmente, disposte intorno a 80 strati concentrici, detti lamine durali, mentre lo strato aracnoideo ha uno spessore di circa 40 μm1 (Figure 2 ).
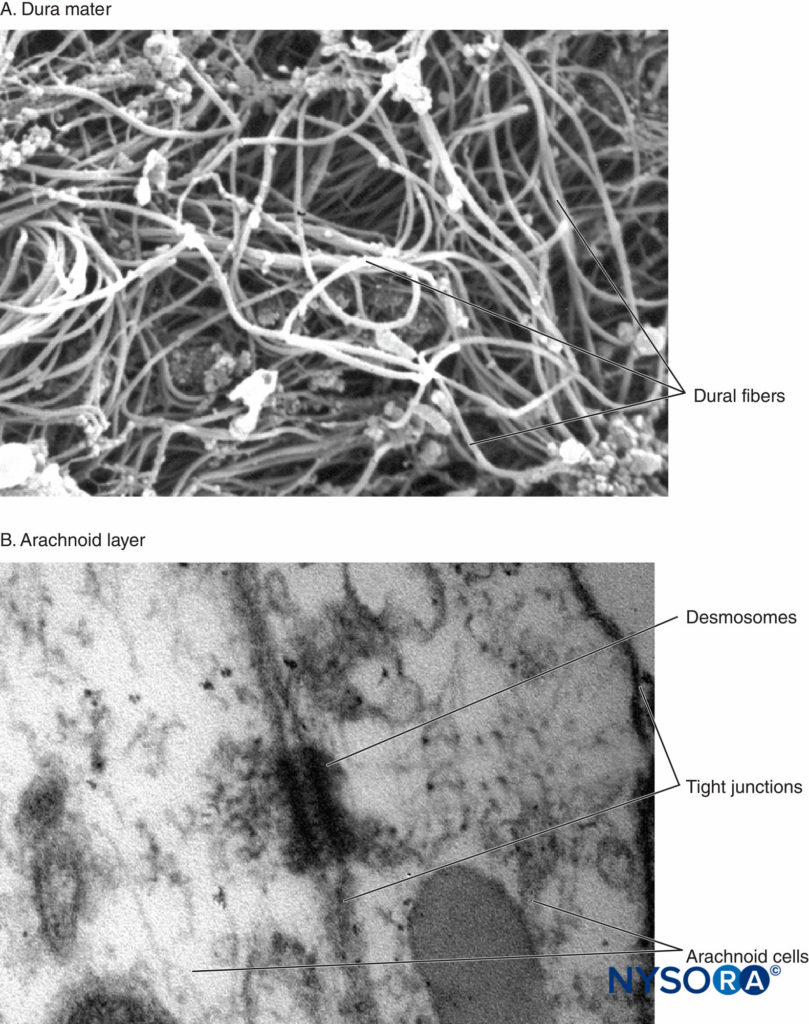
FIGURA 2. A: Dura madre spinale umana. Fibre di collagene in una direzione casuale. Microscopia elettronica a scansione. Ingrandimento x6500. Riprodotto con il permesso di Dittmann M, Reina MA, López García A: Nuovi risultati nella visualizzazione della dura madre spinale con la microscopia elettronica a scansione. Anestesista. 1998 maggio;47(5):409-413. B: Strato aracnoideo spinale umano. Cellule aracnoidee. Microscopia elettronica a trasmissione. Ingrandimento x150000. Riprodotto con il permesso di Reina MA1, Prats-Galino A, Sola RG, et al: Struttura dello strato aracnoide delle meningi spinali umane: una barriera che regola la permeabilità del sacco durale. Rev Esp Anestesiol Reanim. 2010 ottobre;57(8):486–492.
Recentemente, questi Autori hanno riportato la possibile importanza dello strato aracnoideo nella chiusura delle lesioni durali e aracnoidee. La membrana aracnoidea può presentare chiusura tissutale in relazione alla dura perché la sua funzione principale è quella di fungere da barriera; pertanto, potrebbe mancare delle proprietà elastiche dello strato durale. Lo strato aracnoideo limita la fuoriuscita del fluido, quindi la quantità di liquido cerebrospinale perso attraverso l'orifizio perforato è probabilmente correlata alla velocità di chiusura della lesione aracnoidea (Figure 3 a 6).
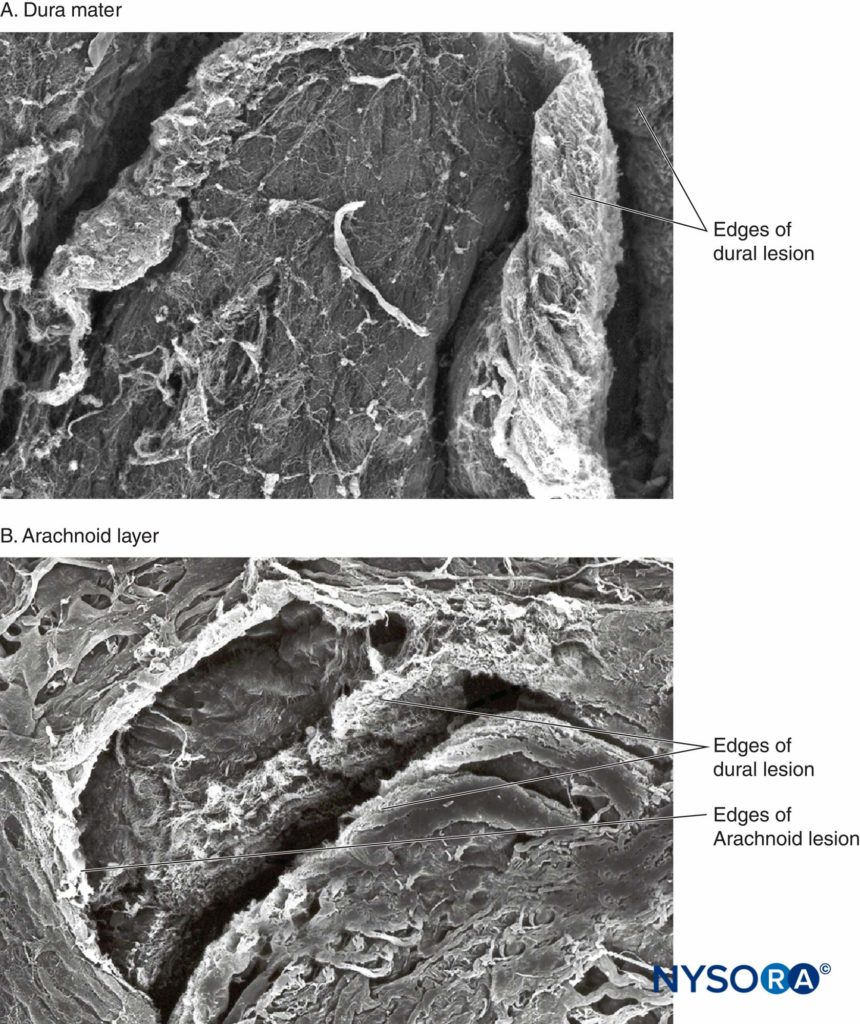
FIGURA 3. Dura madre umana. Lesione dura-aracnoidea prodotta dall'ago di Quincke calibro 25. Microscopia elettronica a scansione. Ingrandimento ×200. A: Superficie dura. B: Superficie aracnoidea.
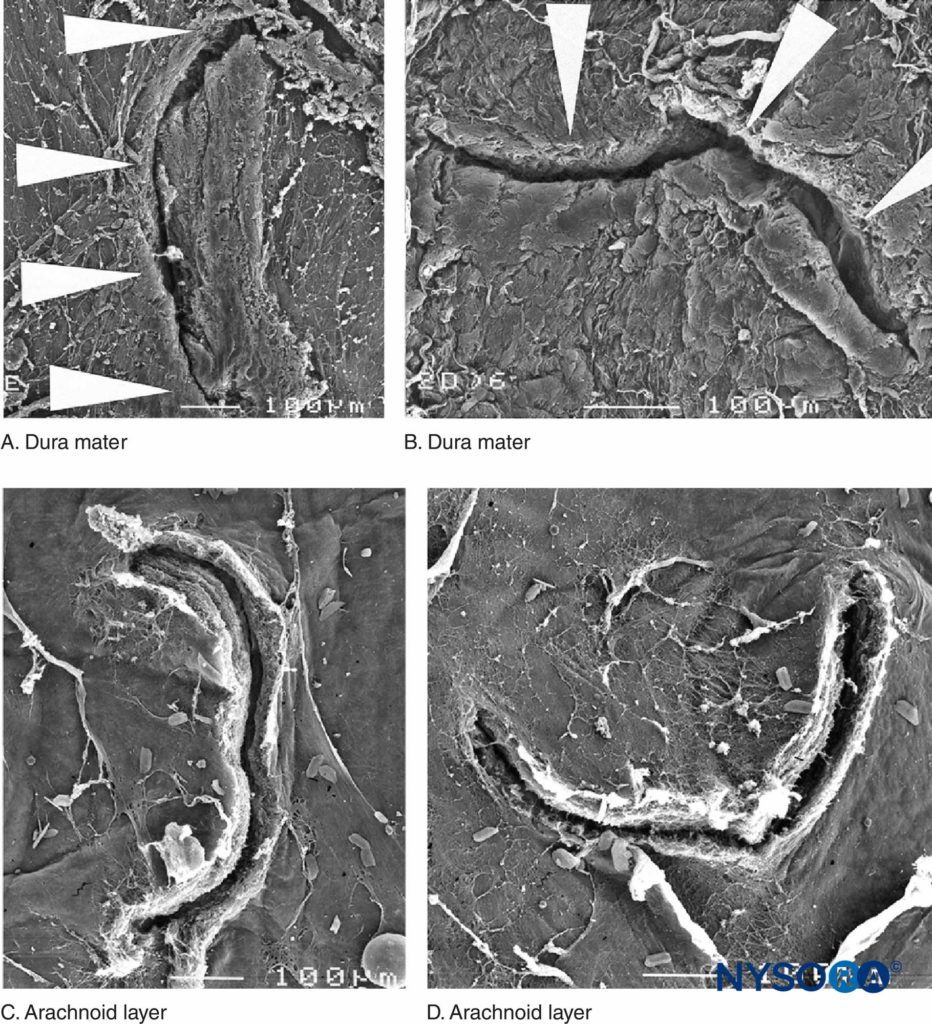
FIGURA 4. Lesione dura-aracnoidea umana prodotta dall'ago di Quincke calibro 22. Microscopia elettronica a scansione. Ingrandimento ×100. A e B: Superficie dura. C e D: Superficie aracnoidea. (Riprodotto con il permesso di Reina MA, López A, Badorrey V, et al: lesioni dura-aracnoidee prodotte da aghi spinali di Quincke di 22 gauge durante una puntura lombare. J Neurol Neurosurg Psychiatry. 2004 Jun;75(6):893–897. )
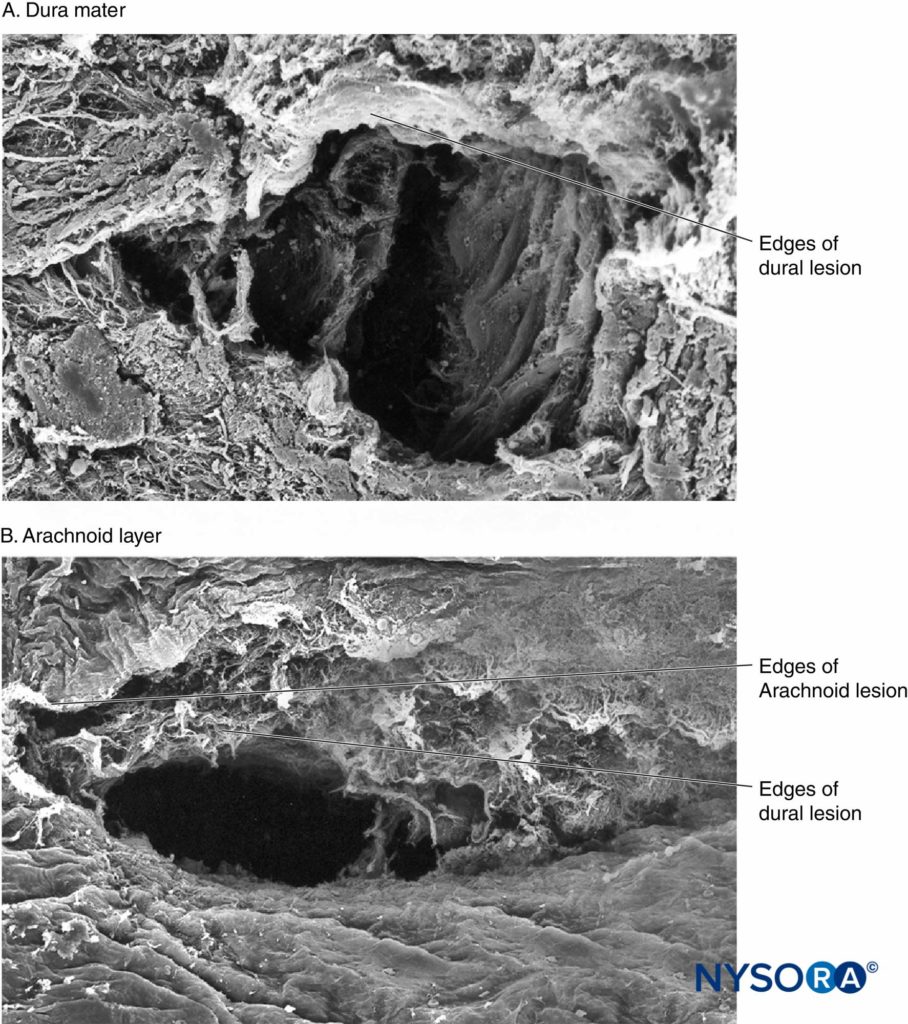
FIGURA 5. Lesione dura aracnoidea umana prodotta da ago Whitacre calibro 25. Microscopia elettronica a scansione. Ingrandimento ×200. A: Superficie dura. B: Superficie aracnoidea. (Riprodotto con il permesso di Reina MA, López-García A, de Andrés-Ibáñez JA, et al: microscopia elettronica delle lesioni prodotte nella dura madre umana da Quincke smussato e aghi Whitacre. Rev Esp Anestesiol Reanim. 1997 Feb; 44( 2):56–61)
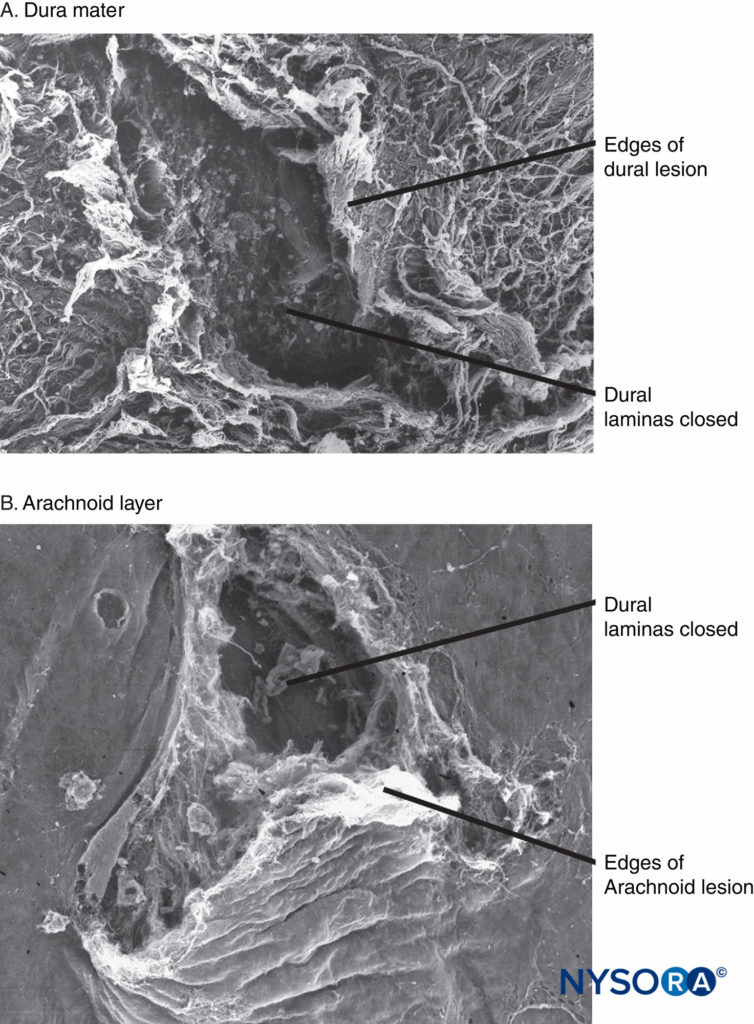
FIGURA 6. Dura madre spinale umana. Lesione dura-aracnoidea prodotta da un ago di Whitacre calibro 25. Microscopia elettronica a scansione. Ingrandimento ×200. R: Superficie dura. B: superficie aracnoidea. (Riprodotto con il permesso di Reina MA, de Leon-Casasola OA, Lopez A, et al: Uno studio in vitro sulle lesioni durali prodotte da aghi Quincke e Whitacre di calibro 25 valutati mediante microscopia elettronica a scansione. Reg Anesth Pain Med. 2000 luglio- 25 agosto (4): 393–402.)
Pertanto, il termine cefalea da puntura meningea (MPH) anatomicamente supportato è stato proposto come alternativa al piuttosto ambiguo mal di testa da puntura postdurale (PDPH). L'apparente ruolo dell'aracnoide in questo disturbo mette ulteriormente in discussione il significato di molti studi pubblicati che coinvolgono la dura madre isolata in vitro. Il vero mezzo con cui l'ipotensione del liquido cerebrospinale genera cefalea è alquanto controverso e attualmente attribuito a un meccanismo bimodale che coinvolge sia la perdita del supporto intracranico che la vasodilatazione cerebrale (prevalentemente venosa). Si ritiene che il ridotto supporto galleggiante consenta al cervello di abbassarsi in posizione eretta, con conseguente trazione e pressione sulle strutture sensibili al dolore all'interno del cranio (dura, nervi cranici, vene a ponte e seni venosi). La vasodilatazione mediata dall'adenosina può verificarsi secondariamente a una diminuzione del liquido cerebrospinale intracranico (secondo l'ipotesi di Monro-Kellie, che afferma che il volume intracranico deve rimanere costante) e riflessivamente secondaria alla trazione sui vasi intracranici. Molteplici percorsi neurali sono coinvolti nella generazione dei sintomi di PDPH. Questi includono il ramo oftalmico del nervo trigemino (nervo cranico [CN] V1) nel dolore alla testa frontale, i nervi cranici IX e X nel dolore occipitale e i nervi cervicali C1-C3 nel dolore al collo e alla spalla. La nausea è attribuita alla stimolazione vagale (CN X). I sintomi uditivi e vestibolari sono secondari alla comunicazione diretta tra il liquido cerebrospinale e il perilinfa attraverso l'acquedotto cocleare, che si traduce in una diminuzione delle pressioni perilinfatiche nell'orecchio interno e in uno squilibrio tra endolinfa e perilinfa. Si ritiene che disturbi visivi significativi rappresentino una paralisi transitoria dei nervi che forniscono i muscoli extraoculari dell'occhio (CN III, IV e VI). Qui, il più delle volte è coinvolto il muscolo retto laterale, che è attribuito al lungo e vulnerabile decorso intracranico del nervo abducente (CN VI). Sono state riportate anche altre paralisi dei nervi cranici molto meno frequenti dei nervi trigemino (CN V), facciale (CN VII) e uditivo (CN VIII).
PRESENTAZIONE CLINICA E CARATTERISTICHE
Sebbene siano state descritte molte variazioni cliniche, la maggior parte dei casi di PDPH è caratterizzata dall'esordio tipico, dalla presentazione e dai sintomi associati.
Consigli NYSORA
La maggior parte dei casi di PDPH sarà tipica (vedi testo per i dettagli) in
• Esordio: spesso ritardato, ma entro 48 ore
• Presentazione: cefalea simmetrica bilaterale
• Sintomi associati: più probabili con forte mal di testa
Inizio
L'insorgenza dei sintomi è generalmente ritardata, con mal di testa che di solito inizia 12-48 ore e raramente più di 5 giorni dopo la puntura meningea. Nel loro importante studio osservazionale, Vandam e Dripps hanno riportato l'insorgenza di sintomi di mal di testa entro 3 giorni dall'anestesia spinale nell'84.8% dei pazienti per i quali tali dati erano disponibili. Più recentemente, Lybecker e colleghi hanno eseguito un'analisi dettagliata di 75 pazienti consecutivi con PDPH dopo anestesia spinale (utilizzando principalmente aghi a punta di taglio 25 gauge). Sebbene nessuno dei loro pazienti abbia notato l'insorgenza dei sintomi durante la prima ora dopo la puntura meningea, il 65% ha manifestato sintomi entro 24 ore e il 92% entro 48 ore. L'insorgenza dei sintomi entro 1 ora dalle procedure neuroassiali è sospetta per il pneumocefalo, specialmente nel contesto di una tecnica di perdita di resistenza epidurale mediante aria. Rapporti occasionali di insorgenza insolitamente ritardata di PDPH evidenziano l'importanza di cercare una storia della strumentazione neuroassiale centrale ogni volta che vengono valutati mal di testa posizionali.
Presentazione del concorso
La caratteristica cardinale del PDPH è la sua natura posturale, con sintomi di mal di testa che peggiorano in posizione eretta e alleviati, o almeno migliorati, con il decubito. I criteri diagnostici della International Headache Society (IHS) descrivono ulteriormente questa qualità posizionale come un peggioramento entro 15 minuti da seduti o in piedi e un miglioramento entro 15 minuti dopo aver sdraiato. La cefalea è sempre bilaterale, con distribuzione frontale (25%), occipitale (27%) o entrambe (45%). Il mal di testa è generalmente descritto come "sordo/dolorante", "palpitante" o "tipo di pressione". La gravità dei sintomi del mal di testa, una caratteristica con importanti ramificazioni per il trattamento, varia considerevolmente tra i pazienti. Sebbene non esista una scala di gravità universalmente accettata, un approccio pratico consiste nel fare in modo che i pazienti valutino semplicemente l'intensità del loro mal di testa utilizzando una scala analogica a 10 punti, con 1–3 classificati come “lievi”, 4–6 “moderati” e 7–10 "acuto." Lybecker et al. hanno ulteriormente classificato i pazienti in base alla restrizione dell'attività fisica, al grado di confinamento a letto e alla presenza di sintomi associati. Utilizzando questo sistema di classificazione, hanno determinato in modo prospettico che l'11% dei casi di PDPH dopo l'anestesia spinale era lieve, il 23% moderato e il 67% grave.
Sintomi associati
I criteri IHS per PDPH richiedono che il mal di testa sia accompagnato da almeno uno dei seguenti sintomi: rigidità del collo, tinnito, ipoacusia, fotofobia e nausea. Tuttavia, potrebbe essere necessario rivedere questi criteri poiché molti pazienti (29% in uno studio recente) hanno notato che soffrono di PDPH in assenza di qualsiasi sintomo a parte il mal di testa stesso. Si può dire che più forte è il mal di testa, più è probabile che sia accompagnato da sintomi associati.
Consigli NYSORA
I criteri IHS per PDPH sono i seguenti:
• Mal di testa accompagnato da almeno uno di questi sintomi:
• rigidità del collo
• tinnito
• ipoacusia
• fotofobia
• nausea
Il sintomo associato più comune è la nausea, che può essere segnalata dalla maggior parte dei pazienti (soprattutto se interrogata in modo specifico) e può portare al vomito. Anche dolore e rigidità al collo e alle spalle sono comuni e si osservano in quasi la metà di tutti i pazienti che soffrono di PDPH. Insolitamente, i pazienti possono manifestare sintomi uditivi o visivi e il rischio per entrambi sembra essere direttamente correlato alla dimensione dell'ago. Nell'ampio studio osservazionale di Vandam e Dripps sul PDPH, i sintomi uditivi e visivi sono stati osservati ciascuno nello 0.4% dei pazienti. I sintomi uditivi includono perdita dell'udito, tinnito e persino iperacusia e possono essere unilaterali. È interessante notare che la perdita dell'udito subclinica, specialmente nelle frequenze più basse, è risultata comune dopo l'anestesia spinale, anche in assenza di PDPH. Strettamente associati a una funzione uditiva, possono verificarsi anche disturbi vestibolari (capogiri o vertigini). I problemi visivi includono visione offuscata, difficoltà di adattamento, lieve fotofobia e diplopia. Contrariamente ai disturbi della cefalea, che sono costantemente bilaterali, quasi l'80% degli episodi di diplopia secondari alla puntura meningea coinvolgono paralisi unilaterali dei nervi cranici.
FATTORI DI RISCHIO
I fattori di rischio per PDPH possono essere ampiamente classificati in caratteristiche del paziente e dettagli procedurali.
Caratteristiche del paziente
La caratteristica del paziente che ha il maggiore impatto sul rischio di PDPH è l'età. Raramente segnalato nei bambini di età inferiore ai 10 anni, il PDPH ha un picco di incidenza negli adolescenti e nei primi anni '20. L'incidenza poi diminuisce nel tempo, diventando molto meno frequente nei pazienti di età superiore ai 50 anni. Anche il sesso è un fattore di rischio significativo, con le femmine non gravide che hanno circa il doppio del rischio di PDPH rispetto ai soggetti maschi della stessa età. Sebbene l'eziologia alla base di questa differenza di genere non sia stata delucidata in modo convincente, sono state proposte numerose spiegazioni fisiologiche, anatomiche, sociali, percettive e comportamentali.
Consigli NYSORA
I principali fattori di rischio correlati al paziente per PDPH includono:
• Età: è raro nei pazienti di età inferiore a 10 anni; il picco di incidenza è negli anni dell'adolescenza e nei primi anni '20.
• Sesso: le femmine non gravide hanno il doppio del rischio rispetto agli uomini di pari età.
La gravidanza è stata tradizionalmente considerata un fattore di rischio per PDPH, ma questa considerazione riflette in gran parte una giovane coorte femminile, nonché l'elevata incidenza di ADP nella popolazione gravida. Sebbene controverso, è stato segnalato che la spinta durante la seconda fase del travaglio, pensata per promuovere la perdita di liquido cerebrospinale attraverso un buco nelle meningi, influenzi il rischio di PDPH a seguito di ADP. Angle e colleghi hanno notato che la durata cumulativa del cuscinetto era correlata al rischio di sviluppare PDPH nei pazienti che avevano sperimentato l'ADP.41 Hanno anche scoperto che i pazienti che evitavano del tutto di spingere (hanno proceduto al parto cesareo prima di raggiungere il secondo stadio del travaglio) avevano un incidenza molto più bassa di PDPH (10%) rispetto a coloro che hanno spinto (74%). Inoltre, hanno notato una marcata differenza nel requisito per l'EBP di trattare il PDPH tra coloro che hanno spinto e coloro che non lo hanno fatto (81% contro 0%). L'indice di massa corporea (BMI) sembra essere un fattore di rischio misto. L'obesità patologica presenta evidenti difficoltà tecniche per le procedure neuroassiali centrali, aumentando la probabilità di passaggi multipli dell'ago e ADP. Tuttavia, è stato segnalato che un basso BMI è un fattore di rischio indipendente per PDPH e un BMI elevato (cioè l'obesità) può effettivamente ridurre il rischio, possibilmente secondario a un effetto benefico dell'aumento della pressione intra-addominale. Recentemente, un'analisi retrospettiva ha riportato che il fumo di sigaretta è associato a un minor rischio di PDPH. Si può sperare che questa osservazione promuova ulteriori approfondimenti sul meccanismo dei sintomi di PDPH e sulle opzioni di trattamento farmacologico. Il mal di testa post-puntura sembra avere un'interessante associazione con altri mal di testa. È stato osservato che i pazienti che riferiscono di aver avuto mal di testa nella settimana prima dell'LP hanno una maggiore incidenza di PDPH. A un'ulteriore analisi, solo quelli con cefalea di tipo tensivo bilaterale cronico sono risultati a rischio aumentato. Una storia di mal di testa unilaterale o emicrania non è stata collegata a un aumento del rischio di PDPH. Il ciclo mestruale, un fattore nell'emicrania, non ha influenzato il tasso di PDPH in un piccolo studio pilota. I pazienti con una storia di precedente PDPH, in particolare le donne, sembrano avere un rischio maggiore di nuovo PDPH dopo l'anestesia spinale. Con le procedure epidurali, è stato dimostrato che i pazienti con una storia di ADP presentano un rischio leggermente aumentato per un altro ADP (e successivo PDPH).
Dettagli procedurali
La dimensione dell'ago e il design della punta sono i fattori procedurali più importanti relativi al PDPH. La dimensione dell'ago è direttamente correlata al rischio di PDPH. La puntura meningea con aghi più grandi è associata a una maggiore incidenza di PDPH, mal di testa più gravi, sintomi più associati, una maggiore durata dei sintomi e una maggiore necessità di misure terapeutiche definitive. Anche il design della punta dell'ago ha una grande influenza, con aghi "non taglienti" chiaramente associati a una ridotta incidenza di PDPH rispetto agli aghi "taglienti" (di solito Quincke) dello stesso calibro (Figure 7 ). In generale, gli aghi non taglienti hanno un'apertura arretrata rispetto a una punta affusolata ("punta a matita") e includono gli aghi Whitacre, Sprotte, European, Pencan e Gertie Marx. Aggiungendo a questa terminologia alquanto confusa, gli aghi non taglienti a volte vengono ancora erroneamente definiti aghi "atraumatici", questo nonostante sia stato dimostrato con la microscopia elettronica per produrre uno strappo più traumatico nella dura madre rispetto agli aghi taglienti (forse risultando in una migliore risposta di guarigione infiammatoria ). L'influenza della dimensione dell'ago sul rischio di PDPH sembra essere maggiore per gli aghi da taglio (in altre parole, la riduzione osservata nell'incidenza di PDPH tra le taglie 22 e 26 è maggiore per gli aghi da taglio rispetto agli aghi non taglienti). L'inserimento di aghi da taglio con lo smusso parallelo all'asse lungo della colonna vertebrale riduce significativamente l'incidenza di PDPH. Questa osservazione è stata per molti anni attribuita alla diffusione piuttosto che al taglio delle fibre durali orientate longitudinalmente. Tuttavia, la microscopia elettronica a scansione ha rivelato che la dura madre è composta da molti strati di fibre dirette concentricamente e si ritiene che l'importanza dell'inserimento dello smusso dell'ago sia dovuta alla tensione longitudinale sulle meningi, in particolare in posizione eretta, e alla sua influenza sul liquido cerebrospinale perdite attraverso fori con orientamenti diversi.
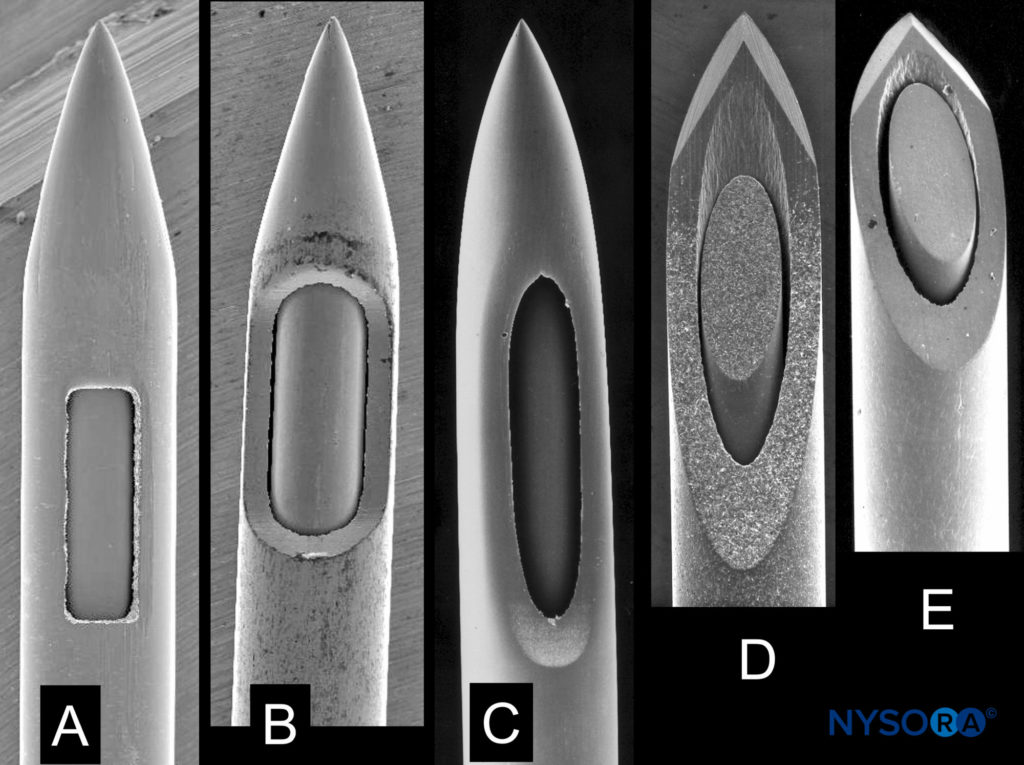
FIGURA 7. Aghi spinali di diversi produttori con lo stesso diametro esterno. A: Tipo biancocre. B: Tipo spinale. C: Tipo Sprite. RE, MI: tipo Quincke. Microscopia elettronica a scansione. Ingrandimento ×40. (Riprodotto con il permesso di Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
Consigli NYSORA
• I dettagli più importanti relativi all'attrezzatura per il rischio di PDPH sono il calibro dell'ago (più grande > più piccolo) e il design della punta dell'ago (taglio > non tagliente).
Non sorprende che l'esperienza/comfort/abilità dell'operatore sembrino essere fattori significativi nello sviluppo del PDPH. È stato dimostrato che un numero maggiore di punture meningee, spesso associate a inesperienza, aumenta il tasso di PDPH. De Almeida et al hanno notato tassi più elevati di PDPH quando l'LP è stato eseguito da fornitori inesperti. Tassi più elevati di ADP sono stati costantemente riportati quando le procedure epidurali sono eseguite dai residenti. Il rischio di ADP sembra essere più elevato anche per le procedure eseguite di notte, suggerendo fortemente un contributo significativo dell'affaticamento dell'operatore. Un certo numero di dettagli procedurali non sembrano influenzare il tasso di sviluppo del PDPH, inclusa la posizione del paziente al momento della puntura meningea, il "colpo di sangue" durante l'anestesia spinale, l'aggiunta di oppiacei al blocco spinale e il volume del liquido cerebrospinale rimosso (per finalità diagnostiche).
PREVENTION
Sebbene la profilassi sia semplicemente pensata come prevenzione di qualsiasi sintomo di PDPH, nel contesto clinico questo problema è ingannevolmente complesso. È importante comprendere che una "prevenzione" significativa può comprendere una serie di altri endpoint, come una ridotta incidenza di PDPH grave, una durata più breve dei sintomi o una ridotta necessità di EBP. Sfortunatamente, nonostante la chiara rilevanza di questo problema, la qualità complessiva delle prove per le misure preventive è generalmente debole.
Misure generali
Come per tutte le tecniche regionali, un'appropriata selezione del paziente è fondamentale per ridurre al minimo le complicanze. Poiché l'età è un importante fattore di rischio, le indicazioni per l'anestesia spinale devono essere valutate rispetto ai rischi di PDPH nei pazienti di età inferiore ai 40 anni, a meno che i benefici non siano sufficientemente convincenti (come nella popolazione ostetrica). I professionisti (e allo stesso modo i pazienti) potrebbero anche voler considerare attentamente le tecniche neuroassiali centrali in quelli con una precedente storia di ADP o PDPH (in particolare le femmine). Altri fattori correlati al paziente (p. es., obesità) dovrebbero essere considerati caso per caso, soppesando i rischi di PDPH con i benefici dell'anestesia regionale. Sebbene utilizzato solo di recente per le tecniche neuroassiali, l'uso degli ultrasuoni per l'anestesia regionale può promettere di ridurre il rischio di PDPH. L'ecografia può ridurre il numero di passaggi dell'ago necessari per le procedure regionali e ha dimostrato di prevedere con precisione la profondità dello spazio epidurale. Sono in corso ulteriori studi per definire questo potenziale degli ultrasuoni per ridurre l'incidenza di ADP e PDPH. Mentre più agenti farmacologici sono stati provati e studiati per la prevenzione del PDPH, l'efficacia di varie strategie rimane poco chiara. Ad esempio, è stato recentemente dimostrato che il desametasone per via endovenosa in studi randomizzati controllati (RCT) diminuisce, ma non influenza e persino aumenta il rischio di PDPH.
Una recente revisione della terapia farmacologica per la prevenzione del PDPH ha identificato solo 10 RCT per la revisione. L'esito primario, una riduzione del numero di pazienti affetti da PDPH di qualsiasi gravità, era influenzato dalla somministrazione di morfina solfato o fentanil per via intratecale, caffeina orale, indometacina rettale o desametasone per via endovenosa. Sebbene sia stata osservata una riduzione dell'incidenza di PDPH con la somministrazione epidurale di morfina (rischio relativo [RR] 0.25), cosintropina per via endovenosa (RR 0.49) e aminofillina per via endovenosa (RR 0.21 a 48 ore), il beneficio di ciascuna è stato dimostrato solo in un studio unico. Indipendentemente da ciò, nonostante la scarsità di prove, le misure farmacologiche, in particolare la caffeina, continuano ad essere ampiamente utilizzate nella speranza di ridurre l'incidenza o la gravità del PDPH dopo la puntura meningea. Tuttavia, nessuna profilassi farmacologica per PDPH è stata confermata in modo indipendente e vari regimi utilizzati sono stati associati a eventi avversi.
Un recente sondaggio di anestesisti statunitensi ha riportato che il riposo a letto e l'idratazione orale ed endovenosa aggressiva continuano a essere suggeriti da una considerevole maggioranza come misure profilattiche contro il PDPH. Tuttavia, una revisione sistematica della letteratura relativa al riposo a letto rispetto alla mobilizzazione precoce dopo la puntura durale non ha mostrato alcuna evidenza di beneficio dal riposo a letto e ha suggerito che il rischio di PDPH può effettivamente essere ridotto dalla mobilizzazione precoce. È da notare che la pratica degli anestesisti statunitensi per quanto riguarda il riposo a letto è in contrasto con quella delle unità di maternità del Regno Unito, dove un sondaggio ha indicato che il 75% dei consulenti del Regno Unito incoraggia la mobilitazione il prima possibile dopo l'ADP come profilassi contro il PDPH. Allo stesso modo, in uno studio prospettico randomizzato, l'aumento dell'idratazione orale dopo LP non è riuscito a ridurre l'incidenza o la durata del PDPH. In sintesi, al momento non ci sono prove a sostegno della pratica comune di raccomandare il riposo a letto e un'idratazione aggressiva nella prevenzione del PDPH.
Consigli NYSORA
• Non ci sono prove a sostegno della pratica comune di raccomandare il riposo a letto e un'idratazione aggressiva nella prevenzione del PDPH.
Tecnica spinale
La selezione dell'ago è fondamentale per ridurre l'incidenza di PDPH. Data la forte associazione tra calibro dell'ago e PDPH, le procedure spinali dovrebbero essere eseguite con aghi aventi il calibro più piccolo ragionevolmente possibile. Tuttavia, va riconosciuto che gli aghi di calibro estremamente piccolo possono essere più difficili da posizionare, avere un lento ritorno del liquido cerebrospinale, possono essere associati a più punture non riconosciute della dura madre e possono comportare un tasso più elevato di blocco fallito. L'attenzione al design della punta dell'ago è un altro importante mezzo tecnico per ridurre il rischio di PDPH con l'anestesia spinale. Se disponibili, dovrebbero essere impiegati di routine aghi non taglienti in quanto sembrano essere associati a un minor numero di eventi avversi a un costo complessivo inferiore. Questi fattori generalmente rendono un ago non tagliente da 24 a 27 la scelta ideale per l'anestesia spinale. Se si utilizzano aghi con punta tagliente, lo smusso deve essere diretto parallelamente all'asse lungo della colonna vertebrale (Figure 7 ).
La sostituzione dello stiletto dopo il prelievo del liquido cerebrospinale ma prima del ritiro dell'ago ha dimostrato di essere un mezzo efficace per ridurre l'incidenza di PDPH dopo LP. In uno studio prospettico randomizzato su 600 pazienti con procedure che utilizzano aghi Sprotte calibro 21, la sostituzione dello stiletto ha ridotto l'incidenza di PDPH dal 16.3% al 5.0% (p <.005). Si ipotizza che questa manovra semplice e sicura riduca la possibilità che un filamento traspirante di aracnoide si estenda attraverso la dura madre. Tuttavia, in uno studio più recente su 630 pazienti sottoposti ad anestesia spinale con aghi Quincke calibro 25, la sostituzione dello stiletto non ha influenzato l'incidenza di PDPH. La disparità di questi risultati può essere correlata ai calibri dell'ago utilizzati, nonché a differenze fondamentali tra le tecniche di puntura lombare (drenaggio del liquido cerebrospinale) e anestesia spinale (iniezione di agente anestetico). Alcuni hanno riportato che l'anestesia spinale continua (CSA) è associata a incidenze sorprendentemente basse di PDPH rispetto alle tecniche spinali a dose singola che utilizzano aghi di calibro simile.
Questa osservazione è stata attribuita alla reazione al catetere, che può promuovere una migliore sigillatura di una frattura nelle meningi. CSA con aghi e cateteri di piccolo calibro ("microcateteri") è un'opzione interessante quando è desiderabile la titolazione del farmaco spinale e la durata dell'intervento chirurgico è incerta, ma i microcateteri non sono attualmente disponibili negli Stati Uniti, dove il rischio di PDPH con CSA rimane preoccupante quando si utilizzano "macrocateteri" di circa 20 gauge. Per questo motivo, sebbene la tecnica possa avere vantaggi clinici, la CSA deliberata è stata studiata quasi esclusivamente in popolazioni a basso rischio. Come accennato, in un RCT è stato dimostrato che l'aminofillina riduce l'incidenza di PDPH. I pazienti sottoposti a parto cesareo in anestesia spinale sono stati randomizzati a ricevere aminofillina per via endovenosa (1 mg/kg) o placebo dopo il clampaggio del cordone ombelicale. A 48 ore dopo l'intervento chirurgico, 3 su 60 pazienti (5%) trattati con aminofillina contro 14 su 60 pazienti (23.3%) nel gruppo di controllo hanno manifestato PDPH. Nessun paziente in nessuno dei due gruppi ha richiesto EBP.
Tecnica epidurale
Sebbene le opzioni epidurali siano limitate, specialmente con le tecniche di catetere, il rischio di PDPH dopo ADP può essere ridotto utilizzando gli aghi epidurali più piccoli possibili. È stato riportato che la semplice riduzione delle dimensioni degli aghi epidurali da 16 a 18 gauge riduce l'incidenza di PDPH dall'88% al 64%. La questione dell'aria contro il liquido per l'identificazione dello spazio epidurale con la tecnica della perdita di resistenza è stata a lungo fonte di controversia. Ciascun metodo ha riconosciuto vantaggi e svantaggi, ma nessuno dei due ha dimostrato in modo convincente un minor rischio di ADP. In questo caso, ci si aspetterebbe che la preferenza e l'esperienza dell'operatore influenzino fortemente le prestazioni e il significato prevalente di questo fattore è illustrato in un minor numero di casi di ADP rilevati quando il mezzo viene scelto a discrezione dell'anestesista. L'orientamento dello smusso per l'inserimento dell'ago epidurale rimane oggetto di dibattito.
Norris et al hanno scoperto che l'incidenza di PDPH da moderato a grave dopo ADP era solo del 24% quando lo smusso dell'ago era orientato parallelamente all'asse lungo della colonna vertebrale (rispetto al 70% con l'inserimento perpendicolare). Ciò ha comportato un minor numero di EBP terapeutici somministrati ai pazienti nel gruppo parallelo (p <.05). Tuttavia, questa tecnica richiede una controversa rotazione di 90° dell'ago per il posizionamento del catetere. Sembra che una serie di preoccupazioni relative all'inserimento parallelo dell'ago (deviazione laterale dell'ago, difficoltà nell'inserimento del catetere e trauma durale con la rotazione dell'ago) destano maggiore preoccupazione per i professionisti. La maggior parte degli intervistati (71.3%) a un'indagine di anestesisti statunitensi ha preferito inserire aghi epidurali con la smussatura perpendicolare all'asse lungo della colonna vertebrale (coerente con la direzione prevista per la corsa del catetere). È stato riportato che le tecniche combinate spinale-epidurale (CSE) sono associate a una bassa incidenza di PDPH. Pur fornendo i vantaggi di un anestetico spinale, CSE sembra non avere una maggiore incidenza di PDPH o necessità di EBP rispetto all'analgesia epidurale convenzionale. Questa osservazione può essere dovuta a diversi fattori, inclusa la capacità di utilizzare con successo aghi spinali non taglienti estremamente piccoli (p. es., calibro 27) e il tamponamento fornito dalle infusioni epidurali.
Misure per ridurre il rischio di PDPH dopo l'ADP
Il rapporto rischio-beneficio della profilassi dovrebbe essere più favorevole nelle situazioni che hanno la maggiore probabilità di sviluppare PDPH grave. Pertanto, la maggior parte degli sforzi per ridurre il rischio di PDPH dopo l'ADP sono stati nella popolazione dei pazienti ostetrici. Diverse misure profilattiche, discusse nel materiale che segue, sono degne di considerazione e sono state utilizzate da sole o in combinazione. Tuttavia, poiché non tutti i pazienti che soffrono di ADP svilupperanno PDPH e solo una parte di quelli che lo fanno richiederà un trattamento definitivo con un EBP, un approccio prudente a questo proposito è ancora generalmente giustificato. Va riconosciuto che l'efficacia di tutte le misure discusse in seguito è discutibile. Pertanto, è fondamentale che, in caso di ADP riconosciuta, questi pazienti siano almeno chiaramente informati dell'alto rischio di sviluppo di PDPH e siano seguiti quotidianamente fino alla dimissione (o chiamati a casa se dimessi entro 48 ore).
Sostituzione del mandrino
Sebbene non siano stati condotti studi a sostegno dell'uso della tecnica di sostituzione dello stiletto nell'ambito dell'ADP, la sostituzione dello stiletto è un mezzo semplice ed efficace per ridurre l'incidenza di PDPH dopo LP. Data la natura innocua di questa manovra, se non vengono prese altre misure profilattiche, sembrano esserci poche ragioni per non sostituire lo stiletto prima della rimozione dell'ago epidurale in caso di ADP.
Soluzione salina subaracnoidea
Prove limitate indicano che l'iniezione subaracnoidea di soluzione fisiologica sterile senza conservanti dopo l'ADP può essere associata a una significativa riduzione dell'incidenza di PDPH e della necessità di EBP. In un piccolo studio (n = 43), l'iniezione immediata di 10 ml di soluzione fisiologica attraverso l'ago epidurale ha ridotto sostanzialmente l'incidenza di PDPH (32%, rispetto al 62% in
un gruppo di controllo abbinato) e ha comportato una significativa riduzione della necessità di EBP (p = 0.004). L'iniezione di soluzione salina e la reiniezione di liquido cerebrospinale sono state ipotizzate come importanti nella prevenzione del PDPH mantenendo il volume del liquido cerebrospinale.
Tuttavia, data la velocità relativamente rapida di rigenerazione del liquido cerebrospinale, è possibile che il vantaggio dell'iniezione di liquido dopo l'ADP sia effettivamente nel prevenire un filamento di aracnoide traspirante (come proposto per la sostituzione dello stiletto dopo l'LP). Sono necessarie ulteriori indagini su questo problema.
Cosintropina per via endovenosa
Come accennato, non ci sono prove convincenti che le misure farmacologiche sistemiche siano utili nella prevenzione del PDPH. Tuttavia, sulla base di una serie di meccanismi teorici, la corticotropina (ormone adrenocorticotropo, ACTH) ei suoi analoghi sono stati a lungo utilizzati nel trattamento del PDPH. Hakim ha recentemente riferito di aver randomizzato 90 partorienti che soffrivano di ADP per ricevere 1 mg di cosintropina o soluzione salina per via endovenosa 30 minuti dopo il parto. L'incidenza di PDPH ed EBP era del 33% e dell'11% nel gruppo della cosintropina contro il 69% e il 30% nel gruppo della soluzione salina. Nessuna reazione grave è stata associata all'uso di cosintropina. Questi dati limitati sono incoraggianti, ma dovranno essere supportati da ulteriori studi.
Limitare/evitare la spinta
In caso di ADP, limitare la durata della seconda fase del travaglio (di solito a 30-60 minuti) ed evitare di spingere in quel momento può ridurre il rischio di PDPH. Sebbene queste misure non siano raramente raccomandate nelle unità di maternità del Regno Unito, tale gestione è rara nella pratica statunitense.
Cateteri intratecali
Dopo l'ADP in ambito ostetrico, Russell ha notato un'incidenza del 41% di almeno due tentativi aggiuntivi di posizionamento epidurale e un rischio del 9% di una seconda puntura durale. Posizionare immediatamente un catetere intratecale (ITC) dopo l'ADP ha i vantaggi di poter fornire rapidamente analgesia spinale ed eliminare la possibilità di un altro ADP in circostanze cliniche difficili. Tuttavia, i potenziali benefici dell'uso delle TIC devono essere valutati rispetto ai rischi facilmente apprezzabili coinvolti (uso accidentale, uso improprio e infezione). Sebbene le prove siano estremamente limitate, è stato anche proposto l'uso di ITC per ridurre il rischio di PDPH dopo l'ADP. Il meccanismo del beneficio degli ITC non è chiaro, ma potrebbe essere dovuto alla reazione al catetere, con infiammazione o edema che impediscono un'ulteriore perdita di liquido cerebrospinale dopo la rimozione. Ayad e colleghi hanno posizionato e mantenuto un ITC per 24 ore dopo l'ADP. Nella loro popolazione ostetrica, il posizionamento del catetere ha comportato un tasso di PDPH di solo il 6.2%, con un'incidenza prevista superiore al 50% in questo contesto. Tuttavia, questa impressionante riduzione dell'incidenza di PDPH non è stata generalmente duplicata. Una recente meta-analisi di nove studi ha concluso che l'inserimento di ITC dopo l'ADP non è riuscito a ridurre statisticamente l'incidenza di PDPH (RR = 0.82, IC 95% 0.67–1.01, p = .06), ma, tuttavia, ha ridotto significativamente la necessità di EBP (RR = 0.64, IC 95% 0.49-0.84, p = 0.001). Va notato che spesso non sono stati riportati benefici negli studi in cui i cateteri sono stati lasciati in situ per meno di 24 ore. Ci sono anche dati preliminari che suggeriscono che l'incidenza di PDPH può essere ulteriormente ridotta mediante l'iniezione di soluzione fisiologica senza conservanti attraverso un ITC immediatamente prima della rimozione. Con alcuni vantaggi accettati e altri possibili, i tassi di utilizzo delle TIC dopo l'ADP sono chiaramente aumentati nell'ultimo decennio. Recenti sondaggi di pratica negli Stati Uniti, nel Regno Unito e in Australia hanno rilevato tassi di cateterizzazione intratecale di routine dopo ADP in pazienti ostetrici rispettivamente del 18%, 28% e 35%. Sebbene l'uso dell'ITC sia diventato più comune, ritentare un'epidurale in un'intercapedine adiacente rimane l'azione preferita dopo l'ADP. A condizione che un catetere epidurale possa essere posizionato con successo, sono stati utilizzati diversi approcci epidurali nella speranza di ridurre l'incidenza e la gravità del PDPH.
Soluzione salina epidurale
Gli sforzi riguardanti la soluzione salina epidurale hanno incluso sia il bolo (di solito circa 50 ml come iniezione singola o ripetuta) sia le tecniche di infusione continua (comunemente 600-1000 ml in 24 ore). Poiché queste misure richiedono molte risorse e possono servire solo a ritardare l'inevitabile insorgenza dei sintomi, generalmente non sono state proseguite oltre le 36 ore. In un'ampia analisi (n = 241), Stride e Cooper hanno riportato una riduzione dell'incidenza di PDPH dall'86% in un gruppo di controllo trattato in modo conservativo al 70% con infusione epidurale di soluzione fisiologica. Trivedi e colleghi hanno notato una riduzione simile del PDPH (dall'87% al 67%) in 30 pazienti che hanno ricevuto un singolo "cerotto salino" profilattico (40-60 ml) dopo il completamento di una procedura ostetrica. Altri studi sulla soluzione fisiologica epidurale hanno notato questa modesta diminuzione dell'incidenza di PDPH. Stride e Cooper hanno anche riportato una minore incidenza di forte mal di testa (dal 64% al 47%), ma questo effetto è stato visto in modo incoerente da altri ricercatori e non ci sono prove convincenti che la soluzione salina epidurale riduca l'eventuale necessità di EBP.
Oppiacei epidurali
Si è ritenuto improbabile che gli oppiacei epidurali (soprattutto la morfina), sebbene utilizzati a lungo per il trattamento del PDPH, influenzino la storia naturale del disturbo. Tuttavia, recentemente rivisitando la questione degli oppiacei come profilassi dopo l'ADP, Al-metwalli ha riscontrato che due iniezioni epidurali di morfina (3 mg in 10 ml), rispetto alle iniezioni epidurali di un uguale volume di soluzione fisiologica, hanno portato a un minor numero di episodi di PDPH (p = 0.014) e ha ridotto la necessità di EBP (p = 0.022). A causa del piccolo numero di pazienti coinvolti (n = 25), è necessaria un'ulteriore indagine prospettica.
Patch di sangue epidurale profilattico
L'impressionante efficacia dell'EBP, quando usato come trattamento per PDPH, ha alimentato l'interesse per la tecnica per la profilassi. La ricerca sull'efficacia dell'EBP per la profilassi ha prodotto risultati contrastanti e un esame più attento indica che l'ottimismo dovrebbe essere preservato. L'indagine più approfondita fino ad oggi è stata quella di Scavone e colleghi, che hanno condotto uno studio prospettico, randomizzato, in doppio cieco in 64 partorienti confrontando l'EBP profilattico (PEBP) con un EBP fittizio. In questo studio, un identico 56% di pazienti in ciascun gruppo ha sviluppato PDPH. Sebbene ci fosse una tendenza verso un minor numero di EBP terapeutici raccomandati ed eseguiti nel gruppo profilattico, la differenza non era statisticamente significativa (p = 0.08). Il vantaggio principale della PEBP era una durata totale dei sintomi più breve (da una mediana di circa 5 giorni a 2 giorni) e, di conseguenza, una riduzione del carico di dolore complessivo.
Sebbene ci siano studi che hanno mostrato maggiori benefici dalla PEBP, revisioni sistematiche delle prove hanno ripetutamente notato la metodologia inferiore di questi altri studi rispetto a quella di Scavone et al. Con tale supporto inconcludente, il PEBP non è attualmente raccomandato come misura di routine sulla base delle prove disponibili. A causa della preoccupazione di esporre i pazienti a una procedura potenzialmente non necessaria e marginalmente benefica, l'applicazione profilattica dell'EBP è diminuita sostanzialmente negli ultimi anni. Se utilizzato per la profilassi, l'EBP deve essere eseguito solo dopo che qualsiasi anestetico locale spinale o epidurale si è esaurito, poiché la somministrazione prematura è stata associata a un eccessivo spostamento cefalico dell'anestetico locale. L'anestetico locale epidurale residuo può anche inibire la coagulazione del sangue, diminuendo ulteriormente l'efficacia dell'EBP.
VALUTAZIONE DIAGNOSTICA
La cefalea post-punturale rimane una diagnosi di esclusione. Sebbene il mal di testa successivo alla puntura meningea sia naturalmente sospettato di essere PDPH, rimane fondamentale escludere altre eziologie (Tabella 1). Fortunatamente, un'anamnesi attenta con una breve considerazione di altre possibili diagnosi è di solito tutto ciò che è necessario per differenziare il PDPH da altre cause di mal di testa. Sebbene siano state riportate numerose variazioni cliniche, la maggior parte dei casi di PDPH avrà (a) una storia di puntura meningea nota o possibile, (b) insorgenza ritardata dei sintomi (ma entro 48 ore) e (c) cefalea posturale bilaterale (possibilmente accompagnata da sintomi associati se moderati o gravi). È importante sottolineare che la maggior parte dei non MPH non avrà una forte natura posizionale. Gli studi di laboratorio di solito non sono necessari per la diagnosi di PDPH e, se ottenuti, sono generalmente insignificanti (più comunemente, la risonanza magnetica può mostrare un aumento delle meningi e l'LP può rivelare basse pressioni di apertura e aumento delle proteine del liquido cerebrospinale).
TABELLA 1. Diagnosi differenziale di non-PDPH dopo puntura meningea.
| Eziologie benigne |
| Cefalea aspecifica |
| Excer rimedio del mal di testa cronico (p. es., cefalea di tipo tensivo) |
| Cefalea ipertensiva |
| Pneumocefalo |
| Sinusite |
| Effetto collaterale correlato al farmaco |
| Ipotensione intracranica spontanea |
| Altro |
| Eziologie gravi |
| Meningite |
| Ematoma subdurale (SDH) |
| Emorragia subaracnoidea |
| Preeclampsia/eclampsia |
| Trombosi venosa intracranica (ICVT) |
| Altro |
L'esame fisico gioca un ruolo limitato nella diagnosi di PDPH. Devono essere documentati i segni vitali (pressione sanguigna normale e assenza di febbre) e un esame neurologico di base (funzione motoria e sensoriale più movimenti oculari e facciali). Una forte pressione venosa giugulare bilaterale, applicata brevemente (10-15 secondi), tende a peggiorare il mal di testa secondario all'ipotensione intracranica. Al contrario, il "test della pressione epigastrica da seduto" può comportare un sollievo transitorio dei sintomi di PDPH.101 Per questo test, il paziente viene posto in posizione seduta fino a quando i sintomi del mal di testa non diventano manifesti. Con una mano viene applicata una pressione addominale decisa e continua, mentre l'altra mano è fissata contro la schiena del paziente. Nei casi di PDPH, di solito si nota qualche miglioramento entro 15-30 secondi con una pronta ricomparsa dei sintomi al rilascio della pressione addominale. Va notato che le cefalee benigne si riscontrano frequentemente in ambito perioperatorio, anche in assenza di puntura meningea, ma generalmente sono state notate come meno gravi della PDPH (le eziologie comuni includono disidratazione, ipoglicemia, ansia e astinenza da caffeina). Con l'anestesia spinale, l'anestetico locale specifico utilizzato e l'aggiunta di destrosio o epinefrina possono influenzare l'insorgenza di cefalea aspecifica, ma non il tasso di vero PDPH. La maggior parte dei mal di testa successivi alla puntura meningea saranno mal di testa benigni e non specifici. In un'attenta analisi del mal di testa dopo anestesia spinale per chirurgia ambulatoriale nella popolazione generale utilizzando criteri rigorosi per PDPH, Santanen e colleghi hanno riscontrato un'incidenza di non-MPH del 18.5%, con un'incidenza di PDPH reale di solo l'1.5%. Anche il mal di testa e il dolore al collo/alla spalla sono comuni nel periodo postpartum.37 In uno studio, il 39% dei pazienti postpartum è risultato essere sintomatico, ma oltre il 75% di questi problemi è stato determinato come mal di testa primario (emicrania, tipo tensivo, cervicogenico e cluster). In questa analisi, mentre l'89% dei pazienti ha ricevuto l'anestesia neuroassiale, solo il 4.7% dei mal di testa postpartum era PDPH. Il mal di testa benigno può spesso essere differenziato dal PDPH per le sue caratteristiche. L'esacerbazione del mal di testa cronico (p. es., di tipo tensivo, a grappolo o emicrania) è di solito notevole per una storia di mal di testa simili. Nello studio citato immediatamente nel paragrafo precedente, una precedente storia di cefalea era un fattore di rischio significativo per la cefalea postpartum (odds ratio aggiustato = 2.25, se > 12 episodi all'anno). Un'ipertensione significativa può causare mal di testa e dovrebbe essere rilevata attraverso la valutazione di routine dei segni vitali. Stella et al hanno studiato le cefalee postpartum gravi e inesorabili con esordio a più di 24 ore dal parto e hanno scoperto che il 39% erano cefalee di tipo tensivo, il 24% erano dovute a preeclampsia/eclampsia e solo il 16% erano PDPH (nonostante l'anestesia neuroassiale nell'88% dei pazienti).
Sulla base di questa osservazione, hanno raccomandato il trattamento del mal di testa da tensione/emicrania prima di prendere in considerazione il PDPH. Il pneumocefalo può produrre un mal di testa posizionale che può essere difficile da distinguere dal PDPH e non risponde all'EBP, ma viene prontamente diagnosticato con la tomografia computerizzata (TC). La sinusite può essere associata a secrezione nasale purulenta e dolorabilità sul seno colpito e spesso è migliorata assumendo una posizione eretta. Va tenuto presente che il mal di testa è anche un effetto collaterale di alcuni agenti farmacologici comunemente utilizzati, come l'ondansetron.106 Sebbene certamente insoliti, i classici sintomi di PDPH possono anche plausibilmente rappresentare un caso casuale di ipotensione intracranica spontanea (SIH). Sono possibili numerose altre eziologie benigne. Le cause gravi di mal di testa saranno rare ma devono essere escluse. È importante ricordare che i segni neurologici laterali (ad eccezione delle paralisi dei nervi cranici), la febbre/brividi, le convulsioni o i cambiamenti nello stato mentale non sono coerenti con una diagnosi di PDPH. La meningite tende ad essere associata a febbre, leucocitosi, alterazioni dello stato mentale e segni meningei (come rigidità nucale). L'ematoma subdurale (SDH) è una complicanza riconosciuta della puntura durale e si ritiene che in queste circostanze sia dovuto all'ipotensione intracranica con conseguente trazione eccessiva sui vasi cerebrali, che porta alla loro rottura.
I professionisti devono mantenere un alto indice di sospetto per la SDH, che è spesso preceduta da sintomi tipici di PDPH ma progredisce fino a perdere la sua componente posturale e può evolvere fino a includere disturbi mentali e segni neurologici focali. È stato proposto che il trattamento definitivo precoce del PDPH grave possa servire a prevenire l'SDH. L'emorragia subaracnoidea, più comunemente dovuta alla rottura di un aneurisma cerebrale o a una malformazione artero-venosa, è solitamente associata all'insorgenza improvvisa di un mal di testa lancinante seguito da un ridotto livello di coscienza o coma.110 La preeclampsia/eclampsia si presenta spesso con mal di testa e può manifestarsi solo in il periodo post parto. La trombosi venosa intracranica (ICVT) si osserva più spesso nella popolazione ostetrica postpartum, dove i sintomi del mal di testa sono facilmente confusi con PDPH ma possono evolvere in convulsioni, segni neurologici focali e coma. I fattori predisponenti all'ICVT includono ipercoagulabilità, disidratazione e malattie infiammatorie e infettive. Segnalazioni di altre patologie intracraniche (tumore intracranico, emorragia intracerebrale, ecc.) diagnosticate erroneamente come PDPH sono estremamente rare e verranno rilevate con un'approfondita valutazione neurologica.
La diagnosi di PDPH può essere particolarmente difficile nei pazienti che hanno subito LP come parte di un iter diagnostico per il mal di testa. In queste situazioni, un cambiamento nella qualità del mal di testa, più comunemente una nuova natura posturale, punta verso PDPH. Occasionalmente, se non è possibile restringere con certezza le possibilità diagnostiche benigne, una risposta favorevole all'EBP può fornire prove definitive per una diagnosi di PDPH.
TRATTAMENTO
Una volta effettuata la diagnosi di PDPH, ai pazienti deve essere fornita una chiara spiegazione dell'eziologia presunta, del decorso naturale previsto (tenendo conto del tempo dalla puntura meningea) e di una valutazione realistica delle opzioni di trattamento (considerando il calibro dell'ago). Le considerazioni sul trattamento sono presentate individualmente in seguito. Sebbene i sondaggi indichino che i protocolli formali per la gestione del PDPH sono una pratica comune nel Regno Unito, tali piani rimangono l'eccezione nella pratica nordamericana. Un algoritmo di trattamento, basato principalmente sulla gravità dei sintomi, può fungere da utile guida per la gestione (Figure 8 ).
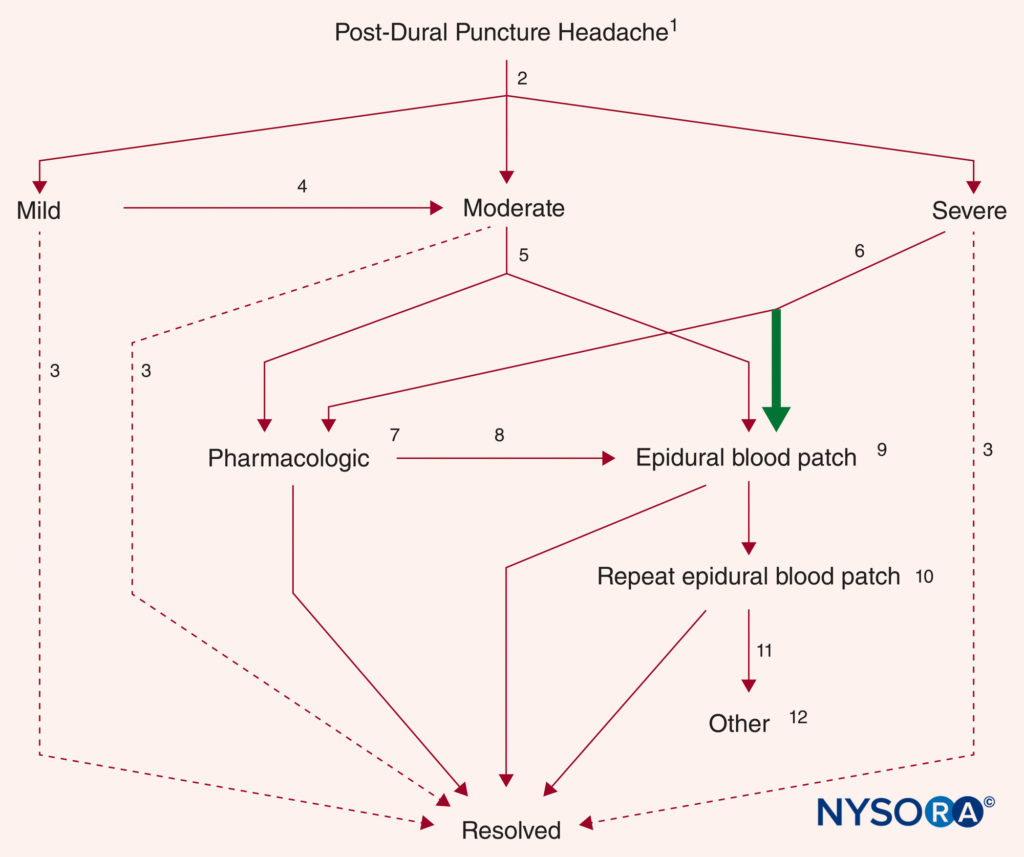
FIGURA 8. Algoritmo di trattamento per PDPH accertato (vedi testo per ulteriori dettagli). (1) Educazione, rassicurazione e misure di supporto del paziente. (2) Triage per gravità dei sintomi. (3) Risoluzione nel tempo senza ulteriore trattamento. (4) peggioramento dei sintomi o mancato miglioramento sostanziale entro 5 giorni. (5) Scelta dell'EBP o delle misure farmacologiche in base alle preferenze del paziente. (6) Si raccomanda il trattamento definitivo (EBP) (freccia in grassetto). (7) Caffeina o altri agenti. (8) Fallimento, peggioramento dei sintomi o ricorrenza. (9) I materiali dei cerotti diversi dal sangue rimangono preliminari. (10) Generalmente eseguito non prima di 24 ore dopo un primo EBP. (11) Seria riconsiderazione della diagnosi. (12) La guida radiologica è raccomandata se un altro cerotto epidurale (EBP). (Riprodotto con il permesso di Neal JM, Rathmell JP: Complications in Regional Anesthesia and Pain Medicine, 2a ed. Philadelphia: Lippincott Williams & Wilkins; 2013.)
Ora
Poiché il PDPH è una complicanza che tende a risolversi spontaneamente, il semplice passare del tempo gioca un ruolo importante nella gestione appropriata di questo disturbo. Prima dell'introduzione dell'EBP come terapia definitiva, la storia naturale del PDPH è stata documentata da Vandam e Dripps mentre seguivano 1011 episodi di PDPH dopo l'anestesia spinale utilizzando aghi taglienti di varie dimensioni. Sebbene la loro analisi fosse viziata dalla mancanza di informazioni sulla durata nel 9% dei pazienti, se si considerano i dati osservati, la risoluzione spontanea del PDPH è stata osservata nel 59% dei casi entro 4 giorni e nell'80% entro 1 settimana.
Più recentemente, Lybecker et al. hanno seguito da vicino 75 episodi di PDPH dopo anestesia spinale e, pur fornendo un EBP al 40% dei loro pazienti (generalmente a quelli che presentavano i sintomi più gravi), hanno osservato nei pazienti non trattati una durata mediana dei sintomi di 5 giorni con un intervallo di 1–12 giorni. van Kooten et al, in un piccolo ma prospettico studio randomizzato in cieco su pazienti con PDPH moderato o grave in seguito a LP utilizzando principalmente aghi calibro 20, hanno notato 18 su 21 pazienti (86%) nel gruppo di trattamento di controllo (riposo a letto di 24 ore , almeno 2 L di liquidi per via orale al giorno e analgesici se necessario) che presentano ancora sintomi di mal di testa a 7 giorni, con oltre la metà di questi sintomi ancora moderati o gravi115 (Figure 9 ).
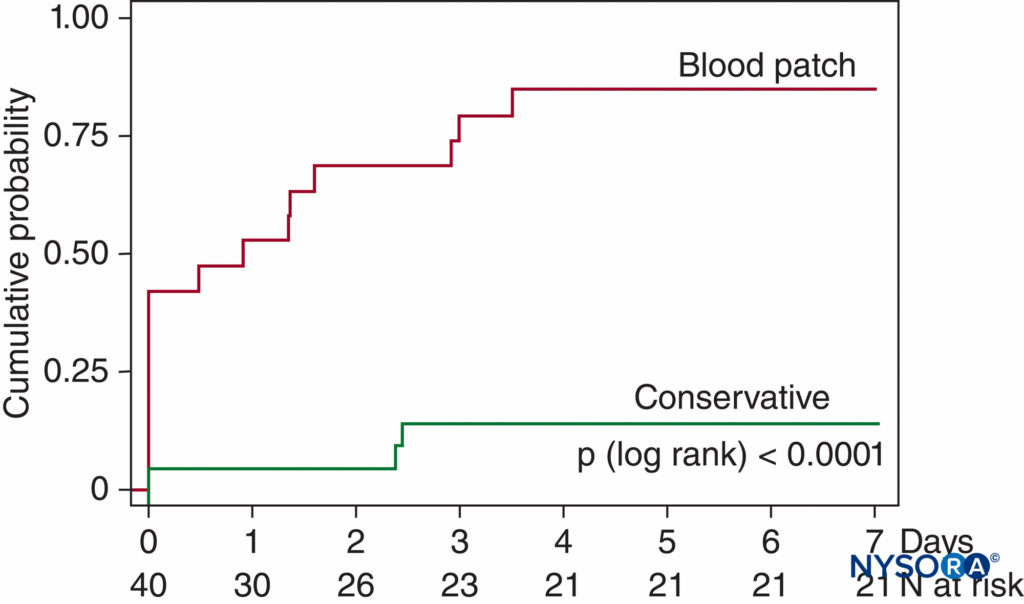
FIGURA 9. Probabilità cumulativa di recupero da PDPH. Recupero da PDPH da moderato a grave dopo LP diagnostico in 40 pazienti. A 7 giorni, solo 3 su 21 pazienti trattati in modo conservativo si erano completamente ripresi (nessun sintomo di mal di testa) rispetto a 16 su 19 pazienti trattati con EBP (p <.0001). (Riprodotto con il permesso di van Kooten F, Oedit R, Bakker SL, et al: Epidurale patch di sangue nel mal di testa post-puntura durale: uno studio clinico randomizzato, in cieco, controllato. Neurol Neurosurg Psychiatry. 2008 May;79(5) :553–558.)
Questi dati servono a illustrare la durata imprevedibile e occasionalmente prolungata del PDPH non trattato. Infatti, Vandam e Dripps hanno riferito che il 4% dei pazienti presentava ancora sintomi 7-12 mesi dopo l'anestesia spinale. Data questa realtà, non sorprende che ci siano un certo numero di casi clinici di successo nel trattamento del PDPH mesi e persino anni dopo la puntura meningea nota o occulta. In gran parte a causa della natura autolimitante del PDPH, il decorso temporale ottimale del trattamento non è stato ben definito. Clinicamente, il problema pratico è per quanto tempo la terapia definitiva (cioè l'EBP) può essere ritardata in modo appropriato. Molti professionisti attualmente sostengono un processo, più comunemente 24-48 ore, di gestione conservativa. Tuttavia, la logica alla base di questo approccio è discutibile data la natura spesso gravemente invalidante dei sintomi, in particolare nel periodo postpartum, quando l'assistenza neonatale può essere significativamente compromessa.
Misure di supporto
A tutti i pazienti sono consigliate rassicurazioni e misure volte a ridurre al minimo i sintomi, anche se non si prevede che alterino il decorso naturale del disturbo. Per definizione, la maggior parte dei pazienti con PDPH da moderato a grave cercherà naturalmente una posizione supina per alleviare i sintomi. Nonostante la mancanza di prove a sostegno, l'idratazione aggressiva continua ad essere la pratica più frequentemente raccomandata utilizzata nel trattamento del PDPH. Sebbene l'idratazione aggressiva non sembri influenzare la durata dei sintomi,74 i pazienti dovrebbero e spesso devono essere incoraggiati ad evitare la disidratazione. Gli analgesici (paracetamolo, farmaci antinfiammatori non steroidei [FANS], oppiacei, ecc.) possono essere somministrati per diverse vie e sono comunemente usati, tuttavia il sollievo ottenuto è spesso insignificante, specialmente con forti mal di testa. Quando indicato, devono essere prescritti antiemetici e emollienti delle feci. I leganti addominali sono stati consigliati ma sono scomodi e usati raramente nella pratica moderna. Misure alternative che sono state suggerite nella gestione del PDPH includono l'agopuntura e il blocco bilaterale del nervo occipitale maggiore.
Terapie farmacologiche
Molti agenti farmacologici sono stati consigliati come trattamenti per PDPH. I rapporti sull'uso riuscito di agenti farmacologici per il trattamento del PDPH sono interessanti, ma il loro ruolo nella gestione del PDPH attende ulteriori studi di efficacia e sicurezza. Sebbene allettanti, queste opzioni sono state generalmente poco studiate e hanno un valore discutibile a causa del piccolo numero di pazienti trattati, dei difetti metodologici nei rapporti pubblicati, dei pregiudizi di pubblicazione e della natura autolimitante del disturbo. Una recente revisione di RCT per valutare l'efficacia di qualsiasi farmaco farmacologico utilizzato per il trattamento del PDPH includeva solo 118 sette studi con un totale di 200 partecipanti (principalmente partorienti). Dato il ruolo iniziale ottimista ma alla fine smentito per così tanti trattamenti nel corso degli anni, si consiglia ai professionisti di aver guardato le aspettative al riguardo, specialmente quando si tratta di PDPH grave. Una revisione dettagliata delle terapie farmacologiche per PDPH va oltre lo scopo di questa sezione, ma alcune opzioni popolari o studiate di recente includono quanto segue:
1. Metilxantine. A causa dei noti effetti vasocostrittori cerebrali, questa classe di farmaci è diventata l'approccio farmacologico più comunemente usato per PDPH. Questi agenti includono aminofillina, teofillina e, la più familiare, caffeina. Sperimentalmente, la caffeina è stata utilizzata per via endovenosa (di solito 500 mg di caffeina benzoato di sodio, che contiene 250 mg di caffeina) e per via orale (p. es., 300 mg). Gli studi pubblicati sulla caffeina per PDPH hanno costantemente dimostrato un miglioramento a 1-4 ore in oltre il 70% dei pazienti trattati. Tuttavia, una singola dose orale di 300 mg
la caffeina per il trattamento del PDPH non è statisticamente migliore del placebo a 24 ore. Con un'emivita terminale solitamente inferiore a 6 ore, dosi ripetute di caffeina sembrerebbero necessarie per il trattamento del PDPH, tuttavia pochi studi hanno valutato più di 2 dosi per efficacia o sicurezza (di particolare interesse nella partoriente). Inoltre, non ci sono prove convincenti che la caffeina, o qualsiasi agente farmacologico, riduca l'eventuale necessità di EBP. Nel complesso, l'uso della caffeina per il PDPH non sembra essere supportato dalla letteratura disponibile. Tuttavia, i sondaggi hanno indicato che continua ad essere ampiamente utilizzato nel trattamento del PDPH. Clinicamente, incoraggiare l'assunzione di caffeina non monitorata ha un valore estremamente incerto, soprattutto considerando la diffusa mancanza di consapevolezza del contenuto di caffeina nelle bevande e nei farmaci prontamente disponibili. Il beneficio temporaneo spesso osservato con la caffeina indicherebbe che, se utilizzata, è forse più appropriato per il trattamento del PDPH di intensità moderata (e possibilmente lieve o grave) in attesa della risoluzione spontanea della condizione. Sebbene la familiarità della caffeina per scopi non medici argomenta per la sua sicurezza generale, i professionisti dovrebbero notare che il suo uso è controindicato in pazienti con disturbi convulsivi, ipertensione indotta dalla gravidanza o una storia di tachiaritmie sopraventricolari.
2. Agonisti del recettore della serotonina di tipo 1d. Questi agenti causano vasocostrizione cerebrale e sono comunemente usati per l'emicrania. Nonostante segnalazioni aneddotiche di successo, in un piccolo studio prospettico randomizzato sumatriptan è risultato inefficace per il trattamento del PDPH grave.
3. Alcaloidi della segale cornuta. Questi agenti vasocostrittori cerebrali sono anche comunemente usati per l'emicrania. Un piccolo studio pilota non controllato ha suggerito che la metilergonovina (0.25 mg per via orale tre volte al giorno per 24-48 ore) può accelerare la risoluzione del PDPH.
4. Corticosteroidogenici (corticotropina [ACTH] e suoi analoghi sintetici [cioè, cosintropina/tetracosactina]). Sebbene il meccanismo d'azione rimanga speculativo, è noto che l'ACTH ha molteplici effetti fisiologici che potrebbero teoricamente migliorare i sintomi del PDPH.87 Tuttavia, un analogo sintetico dell'ACTH era inefficace per il trattamento del PDPH grave in un piccolo studio randomizzato e prospettico.
5. Corticosteroidi. Simile ai corticosteroidi, i corticosteroidi hanno molteplici effetti fisiologici che potrebbero teoricamente migliorare i sintomi del PDPH. In uno studio prospettico randomizzato su 60 pazienti con PDPH grave dopo anestesia spinale utilizzando aghi Quincke calibro 25 per parto cesareo, l'aggiunta di idrocortisone (200 mg EV inizialmente, seguito da 100 mg ogni 8 ore per 6 dosi) ha determinato una cefalea significativamente più bassa intensità. Solo un paziente in questo studio (nel gruppo trattato convenzionalmente) ha richiesto EBP. Uno studio randomizzato simile su 60 pazienti sottoposti a chirurgia non ostetrica che presentavano PDPH dopo anestesia spinale ha mostrato riduzioni significative dell'intensità del mal di testa nel gruppo idrocortisone.
6. Anticonvulsivanti. Diversi agenti stabilizzanti della membrana sono ampiamente utilizzati per varie sindromi dolorose. Alcuni rapporti hanno suggerito che il gabapentin potrebbe essere utile nel contesto del PDPH. In una serie di casi non controllati di 17 pazienti postpartum con PDPH grave, 9 (53%) hanno sperimentato un sollievo "eccellente" (scala analogica visiva [VAS] < 2 su 10 più ripresa dell'attività normale) con gabapentin (200 mg inizialmente, seguito da 100 –300 mg tre volte al giorno, con dose adeguata alla tolleranza e all'efficacia).
In uno studio randomizzato, controllato con placebo, è stato dimostrato che pregabalin (75 mg due volte al giorno per 2 giorni, poi 150 mg due volte al giorno per 2 giorni) provoca punteggi del dolore più bassi e consumo di analgesici nei pazienti con PDPH in seguito ad anestesia spinale o LP .129 È interessante notare che, nonostante inizi con punteggi VAS medi superiori a 8 su 10, nessuno dei 40 pazienti in questo studio ha richiesto EBP.
Terapie epidurali
Pur non essendo una controindicazione ai trattamenti epidurali, una storia di difficoltà tecniche significative con tentativi di tecniche neuroassiali dovrebbe naturalmente incoraggiare un tentativo di misure meno invasive. Tuttavia, l'attrattiva degli approcci epidurali è evidente se l'accesso allo spazio epidurale è ritenuto ragionevole o se il paziente ha già un catetere posizionato correttamente in situ.
Soluzione salina epidurale
La soluzione salina epidurale, come bolo e infusione, ha una lunga storia di utilizzo per il trattamento del PDPH. È stato riportato che iniezioni in bolo di soluzione fisiologica epidurale (di solito 20-30 ml, ripetute se necessario se è presente un catetere) producono un sollievo immediato e praticamente universale del PDPH, tuttavia la pratica è afflitta da un tasso estremamente elevato di recidiva del mal di testa. Questo effetto transitorio non è sorprendente poiché è stato dimostrato che gli aumenti della pressione epidurale dopo la somministrazione in bolo di soluzione fisiologica ritornano ai valori basali entro 10 minuti.130 Si è ipotizzato che risultati favorevoli ottenuti con questo approccio rappresentino la riapprossimazione meccanica di un lembo durale (il -fenomeno del coperchio”). Tuttavia, è stato dimostrato in modo convincente che la somministrazione in bolo di soluzione salina per il trattamento del PDPH è inferiore all'EBP, specialmente quando il mal di testa è secondario a punture con ago di grosso calibro. Nel complesso, la soluzione fisiologica epidurale sembra avere un valore limitato per il PDPH accertato. Tuttavia, l'uso efficace della soluzione fisiologica epidurale, somministrata in bolo o infusione, continua a essere segnalato occasionalmente in circostanze eccezionali.
Patch di sangue epidurale
Negli ultimi decenni, l'EBP è emerso come il "gold standard" per il trattamento del PDPH (Figure 10
). Una revisione Cochrane (una valutazione sistematica delle prove) relativa all'EBP ha concluso che la procedura ora ha dimostrato di beneficiare di un trattamento più conservativo.
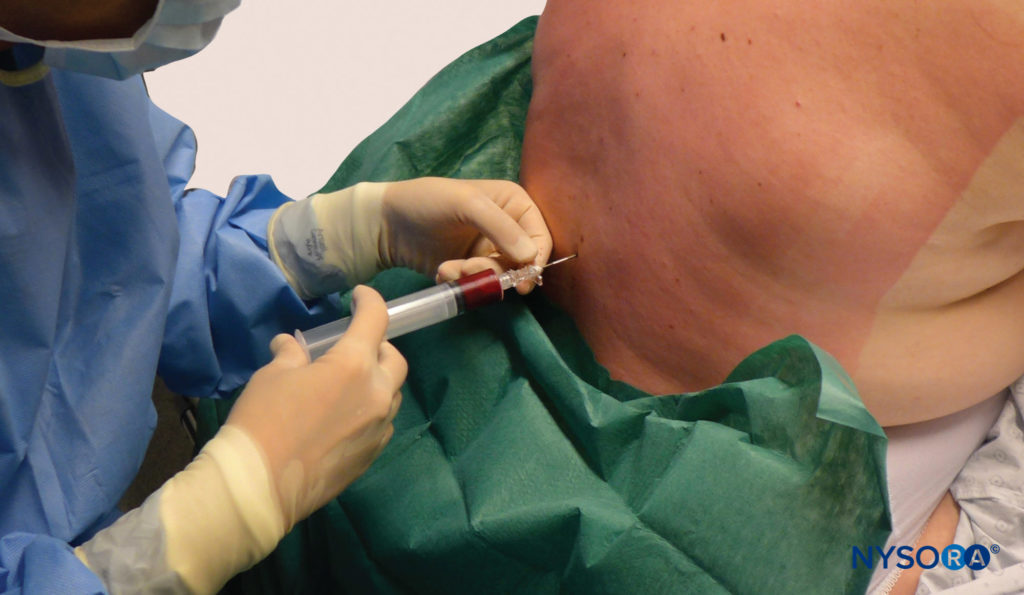
FIGURA 10. Patch di sangue. Somministrazione di un cerotto epidurale utilizzando 20 ml di sangue appena prelevato. Il sangue viene iniettato fino a raggiungere 20 ml o il paziente percepisce un dolore o una pressione significativi alla schiena, a seconda di quale evento si verifica per primo.
Il meccanismo d'azione dell'EBP, sebbene non del tutto chiarito, sembra essere correlato alla capacità di fermare un'ulteriore perdita di liquido cerebrospinale mediante la formazione di coaguli sul difetto delle meningi, nonché un effetto di tamponamento con spostamento cefalico del liquido cerebrospinale (il " cerotto pressorio epidurale”). Il ruolo appropriato dell'EBP nelle singole situazioni dipenderà da molteplici fattori, tra cui la durata e la gravità del mal di testa e i sintomi associati, il tipo e il calibro dell'ago originale utilizzato e i desideri del paziente. L'EBP dovrebbe essere incoraggiato nei pazienti che manifestano ADP con un ago epidurale e in quelli i cui sintomi sono classificati come gravi (cioè, punteggio del dolore > 6 su una scala da 1 a 10). Il consenso informato per l'EBP dovrebbe includere una discussione con il paziente in merito ai rischi comuni e gravi coinvolti, al tasso di successo reale e agli effetti collaterali previsti. Infine, i pazienti dovrebbero ricevere istruzioni chiare per la fornitura di cure mediche tempestive in caso di recidiva dei sintomi. Una serie di controversie circonda l'EBP, riflettendo la scarsità di studi randomizzati adeguatamente potenziati. La procedura stessa è stata ben descritta e consiste nell'iniezione sterile di sangue autologo fresco in prossimità della precedente puntura durale (Tabella 2). Uno studio MRI dell'EBP in 5 giovani pazienti (di età compresa tra 31 e 44 anni) utilizzando 20 ml di sangue ha rilevato una diffusione di 4.6 ± 0.9 spazi intervertebrali (media ± DS), con una media di 3.5 livelli sopra e 1 livello sotto il sito di iniezione. Questa e altre osservazioni di una diffusione cefalica preferenziale del sangue nello spazio epidurale lombare hanno portato alla raccomandazione comune di eseguire l'EBP "al livello o al di sotto" della puntura meningea. Tuttavia, l'influenza del livello di posizionamento e uso di un catetere epidurale (spesso situato notevolmente cefalica a una puntura meningea) sull'efficacia per EBP non è mai stata valutata clinicamente. La tempistica ottimale dell'EBP è oggetto di dibattito. Dopo la diagnosi, la maggior parte dei professionisti preferisce ritardare l'esecuzione dell'EBP, possibilmente per confermare ulteriormente la diagnosi e per consentire un'opportunità di risoluzione spontanea. Un'indagine del 1996 sui dipartimenti neurologici del Regno Unito ha rilevato che solo l'8% avrebbe preso in considerazione l'EBP prima che fossero trascorse 72 ore dopo l'LP. Un recente sondaggio tra le unità di maternità del Regno Unito ha riportato che il 71% eseguirebbe l'EBP solo "dopo il fallimento delle misure conservative".
TABELLA 2. Procedura del cerotto epidurale.
| Ottenere il consenso informato scritto. |
| Stabilire l'accesso endovenoso. Un calibro 18 o un blocco salino più grande è sufficiente. |
| Posizionare il paziente per il posizionamento dell'ago epidurale (memore che un decubito laterale posizione può essere più comoda rispetto a quella seduta per il paziente). |
| Utilizzando la tecnica sterile standard, posizionare un'epidurale ago nello spazio epidurale in corrispondenza o al di sotto del livello di precedente puntura meningea. |
| Raccogliere 20 ml di sangue venoso autologo fresco utilizzando rigorosa tecnica sterile (questo di solito è facilmente realizzabile utilizzando la soluzione salina precedentemente posizionata). |
| Senza indugio, iniettare costantemente sangue attraverso l'epidurale ago fino a quando il paziente non segnala pienezza o disagio nella schiena, nei glutei o nel collo. |
| Mantenere il paziente in posizione supina per un certo periodo di tempo (1–2 ore possono risultare più complete risoluzione dei sintomi). Per via endovenosa l'infusione di 1 L di cristalloide durante questo intervallo è spesso utile. |
| Istruzioni per la dimissione: |
| Incoraggiare gli analgesici da banco (p. es., paracetamolo, ibuprofene) secondo necessità lieve disagio residuo. |
| Prescrivere emollienti delle feci o sedativi della tosse se indicato. |
| Evitare di sollevare, sforzare o viaggiare in aereo per 24 ore. |
| Fornire istruzioni chiare su come contattare personale di anestesia per sollievo inadeguato o ricorrenza dei sintomi. |
Allo stesso modo, la maggior parte degli intervistati ai recenti sondaggi di pratica negli Stati Uniti e nei paesi nordici di solito ha aspettato almeno 24 ore dall'insorgenza dei sintomi prima di eseguire l'EBP. Diversi studi hanno suggerito che la procedura EBP potrebbe diventare più efficace con il passare del tempo. Safa-Tisseront et al. ha riscontrato che un ritardo inferiore a 4 giorni dalla puntura meningea prima di eseguire un EBP è un fattore di rischio indipendente per il fallimento della procedura. Tuttavia, questi autori sono stati attenti ad affermare che il fallimento dell'EBP può essere principalmente correlato alla gravità della perdita di liquido cerebrospinale (con situazioni più grandi e più difficili da trattare che richiedono un'attenzione anticipata) e che il loro studio non dovrebbe essere motivo di ritardare il EBP. Sandesc e colleghi hanno condotto uno studio prospettico, randomizzato, in doppio cieco dell'EBP rispetto alla gestione conservativa (fluidi per via endovenosa o orale fino a 3 L/d, FANS e caffeina benzoato di sodio 500 mg EV ogni 6 ore) in 32 pazienti con PDPH grave sintomi (intensità media del dolore = 8.1). Al momento dell'inizio del trattamento, nessuno di questi pazienti aveva manifestato sintomi per più di 24 ore. Mentre tutti i pazienti nel gruppo EBP hanno avuto una risoluzione soddisfacente dei sintomi al follow-up di 24 ore, il gruppo di controllo è rimasto sostanzialmente invariato (intensità media del dolore = 7.8). In particolare, 14 dei 16 pazienti nel gruppo trattato in modo conservativo hanno quindi scelto il trattamento EBP. Questi ricercatori hanno concluso che non c'era motivo di ritardare l'EBP per più di 24 ore dopo aver fatto una diagnosi di PDPH grave. Questa raccomandazione è stata ulteriormente supportata da un'analisi prospettica di 79 pazienti con PDPH che ha determinato la EBP precoce in quelli con sintomi da moderati a gravi, riducendo al minimo la sofferenza complessiva del paziente. Il volume di sangue ideale per EBP è stato un problema in evoluzione che sta diventando più chiaramente compreso. Concettualmente, il volume di sangue utilizzato dovrebbe essere sufficiente per formare un coagulo organizzato sopra il difetto meningeo e produrre un certo grado di tamponamento epidurale. Durante l'esecuzione dell'EBP, gli anestesisti comunemente iniettano tanto sangue quanto è stato prelevato (di solito circa 20 ml), fermandosi quando il paziente si lamenta di disagio o pienezza alla schiena, ai glutei o al collo. Sembra che ci siano preferenze geografiche per quanto riguarda il volume del sangue. L'analisi più ampia dell'EBP fino ad oggi (n = 504) ha utilizzato un volume di sangue di 23 ± 5 ml (media ± DS). È importante sottolineare che questo studio francese non ha riscontrato differenze significative nei volumi di sangue tra EBP riuscito e fallito. In particolare, hanno riportato "disagio" nel 78% delle iniezioni con 19 ± 5 ml e "dolore" nel 54% con 21 ± 5 ml, con l'unico fattore di rischio indipendente per il dolore durante l'EBP di età inferiore a 35 anni. Un recente sondaggio di anestesisti statunitensi ha riportato l'unanimità generale per un volume sanguigno inferiore, con due terzi (66.8%) che utilizzano più comunemente tra 16 e 20 ml. Come accennato in precedenza, potrebbe esserci un supporto sperimentale per l'utilizzo di un volume di sangue di 15-20 ml, poiché i primi studi sul drenaggio del liquido cerebrospinale nei volontari hanno riportato la produzione costante di sintomi di mal di testa posizionale con perdita del 10% del volume totale del liquido cerebrospinale (circa 15 ml).
Sono stati eseguiti due RCT per determinare il volume ottimale di sangue per EBP in pazienti ostetrici con PDPH dopo ADP. Il primo, che ha confrontato 7.5-15 ml in 33 donne taiwanesi, ha riportato un'efficacia simile con i due volumi e non è riuscito a trovare alcun vantaggio con il volume maggiore. Il secondo è stato uno studio multicentrico più ampio che ha esaminato tre volumi di sangue per EBP (15, 20 e 30 ml). Questo studio ha rilevato che i pazienti che hanno ricevuto 15 ml hanno avuto un sollievo meno completo dei sintomi rispetto a quelli che hanno ricevuto 20 o 30 ml, senza differenze di efficacia tra 20 e 30 ml. Questi ricercatori hanno anche scoperto che solo il 54% dei pazienti randomizzati al volume più alto era in grado di tollerare tutti i 30 ml (rispetto all'81% nel gruppo da 20 ml). Sebbene questi due studi non siano riusciti a determinare in modo definitivo il volume di sangue ideale per l'EBP, entrambi hanno indicato che non sembra necessario utilizzare volumi superiori a 20 ml. È da notare che, sebbene l'utilità dell'EBP nel trattamento della SIH sia incerta, per questa indicazione sono comunemente raccomandati volumi di sangue molto più grandi (fino a 100 ml). Tuttavia, case report recenti hanno evidenziato alcune potenziali complicanze, come una grave radicolopatia, da EBP di grande volume e quindi i professionisti sono generalmente incoraggiati a utilizzare il volume sanguigno effettivo più piccolo. Per consentire l'organizzazione del coagulo e la rigenerazione del liquido cerebrospinale (circa 0.35 ml/minuto), è prassi comune che i pazienti rimangano sdraiati per un periodo di tempo dopo l'EBP. Sebbene la durata ottimale del riposo a letto immediatamente dopo un EBP rimanga sconosciuta, un piccolo studio ha suggerito che il mantenimento della posizione di decubito per almeno 1 e preferibilmente 2 ore può comportare una risoluzione più completa dei sintomi. Di solito si consiglia ai pazienti anche di evitare il sollevamento, le manovre di Valsalva (p. es., sforzarsi con il movimento intestinale) e i viaggi in aereo per 24-48 ore dopo l'EBP per ridurre al minimo il rischio di interruzione del cerotto. Sono state apportate modifiche alla tecnica EBP standard in circostanze speciali. Per accogliere le credenze religiose dei pazienti Testimoni di Geova, sono state descritte tecniche che mantengono il sangue autologo all'interno di un circuito continuo. È stato ripetutamente dimostrato che l'EBP è sicuro ed efficace per il trattamento del PDPH nella popolazione pediatrica.
Un volume sanguigno di 0.2–0.3 ml/kg sembra appropriato sia per i bambini piccoli che per gli adolescenti. L'EBP viene eseguito anche con volumi ematici ridotti nei siti extralombari (p. es., rachide cervicale). Le controindicazioni all'EBP sono simili a quelle di qualsiasi posizionamento dell'ago epidurale: coagulopatia, sepsi sistemica, febbre, infezione nel sito e rifiuto del paziente. Sono state espresse preoccupazioni teoriche riguardo alla possibilità di inseminazione neoplastica del sistema nervoso centrale nei pazienti con cancro. È stato suggerito che un'attenzione speciale, sotto forma di iniezioni più lente di volumi ematici più piccoli, possa essere prudente nei pazienti il cui sistema nervoso centrale può essere vulnerabile a lesioni prodotte dall'aumento delle pressioni epidurali generate con EBP, come quelli con sclerosi multipla. Sebbene non sia esente da preoccupazioni e controversie, l'EBP è stato fornito in modo sicuro a pazienti con infezione da HIV e varicella acuta. Effetti collaterali minori sono comuni dopo l'EBP. I pazienti devono essere avvertiti di aspettarsi dolore alla schiena, ai glutei o alle gambe (osservato in circa il 25% dei pazienti). Sebbene di solito di breve durata, il mal di schiena è risultato persistente nel 16% dei pazienti dopo EBP ed è durato 3-100 giorni (con una durata media in questo sottogruppo di 27.7 giorni). Nonostante questi sintomi persistenti, la soddisfazione del paziente per l'EBP è alta. Altri effetti collaterali frequenti ma benigni dell'EBP includono dolore al collo transitorio, bradicardia e modesto aumento della temperatura. In gran parte grazie alla vasta esperienza clinica, è stato sufficientemente dimostrato che l'EBP è sicuro. I rischi sono essenzialmente gli stessi di altre procedure epidurali (infezione, sanguinamento, danno ai nervi e ADP).
Sebbene alcuni pazienti possano sviluppare dolore radicolare temporaneo alla schiena e agli arti inferiori, come menzionato, tali complicazioni sono rare. Con una tecnica adeguata, le complicanze infettive sono incredibilmente rare. In generale, un EBP precedente non sembra influenzare significativamente il successo di futuri interventi epidurali, ma i case report suggeriscono che l'EBP può occasionalmente causare cicatrici clinicamente significative. Si verificano gravi complicazioni secondarie all'EBP, ma di solito sono costituite da casi clinici isolati e sono state spesso associate a deviazioni significative dalla pratica standard.
Opzioni di trattamento alternative all'EBP
Una serie di alternative al sangue sono state promosse come materiali per cerotti. Le varie ragioni per l'uso di agenti alternativi includono situazioni per le quali l'uso del sangue è stato inefficace o è controindicato. I materiali più comunemente proposti (destrano 40, amido idrossietilico, gelatina e colla di fibrina) sono stati adattati per una capacità percepita di fornire un tamponamento epidurale prolungato o di sigillare una lacerazione meningea. In un modello di ratto, il supporto sperimentale per un effetto "simile al sangue" è stato mostrato al meglio per la colla di fibrina. Tuttavia, l'uso clinico di queste alternative è limitato a case report e piccole serie e il loro uso è raro negli Stati Uniti. Sebbene non siano necessariamente prive di merito, queste opzioni rimangono poco definite e non sono prive di potenziale rischio serio (p. es., reazioni allergiche al destrano) e le segnalazioni sul loro utilizzo dovrebbero comunque essere considerate preliminari.
PDPH PERSISTENTE O RICORRENTE
I primi rapporti sull'EBP citavano spesso percentuali di successo comprese tra il 90% e il 100%, ma spesso non includevano una definizione rigida di "successo", avevano scarso o nessun follow-up e non consideravano l'influenza di fattori confondenti come la dimensione dell'ago e design della punta, gravità dei sintomi o storia naturale di PDPH. La vera efficacia della procedura EBP è ora nota per essere significativamente inferiore a quanto si pensasse. Mal di testa persistenti o ricorrenti dopo l'EBP, sebbene non richiedano necessariamente una consultazione, giustificano un follow-up e una rivalutazione ponderata. L'EBP è associato a un sollievo sintomatico quasi immediato in oltre il 90% dei casi, ma un follow-up appropriato rivela un numero di pazienti che sperimentano un sollievo incompleto, un fallimento o una recidiva dei sintomi. In uno studio osservazionale non controllato, prospettico, su 504 pazienti consecutivi trattati con EBP in seguito a puntura meningea con aghi di varie dimensioni, Safa-Tisseront et al hanno riportato che un certo sollievo dei sintomi si verifica nel 93% dei pazienti. Ad un'analisi più approfondita, tuttavia, il completo sollievo dei sintomi è stato osservato solo nel 75% dei pazienti, con il 18% che ha riscontrato un sollievo incompleto. Hanno anche scoperto che era più probabile che l'EBP fallisse se la puntura meningea originale fosse stata eseguita con aghi più grandi di 20 gauge. Per aghi più grandi di 20 gauge, il tasso di successo non qualificato dell'EBP era solo del 62%, con il 17% dei pazienti che riportava un sollievo incompleto dei sintomi e il 21% che subiva un fallimento. Non sorprende che la maggior parte di questi grandi aghi fossero aghi epidurali Tuohy.
Le aspettative di successo con l'EBP devono essere ulteriormente mitigate nelle pazienti ostetriche (tutte giovani e femmine) che seguono l'ADP con aghi epidurali. In queste circostanze, Williams et al hanno notato un completo sollievo dei sintomi con EBP solo nel 34% dei pazienti, un sollievo parziale nel 54% e nessun sollievo nel 7% (risultati sconosciuti nel 5%).160 Se eseguito, un secondo EBP ha provocato sollievo completo nel 50%, sollievo parziale nel 36% e nessun sollievo nel 14%. In una popolazione di pazienti simile, Banks e colleghi, pur osservando inizialmente un sollievo completo o parziale con EBP nel 95% dei pazienti, hanno riportato il ritorno di sintomi da moderati a gravi nel 31%, con un tempo medio di sviluppo di cefalea ricorrente di 31.8 ore (intervallo 12–96 ore).137 I tassi di ripetizione dell'EBP per gli studi Williams e Banks erano rispettivamente del 27% e del 19%. Questi studi hanno chiaramente dimostrato la ridotta efficacia dell'EBP a seguito di punture meningee effettuate con aghi di grandi dimensioni, che non di rado rendono necessaria la possibilità di ripetere la procedura. Nel complesso, le percentuali di successo di un secondo EBP sembrano essere approssimativamente uguali a quelle di un primo. Il momento e il volume ematico ideali per ripetere l'EBP sono ancora più incerti rispetto a una procedura primaria. La maggior parte degli anestesisti statunitensi aspetterebbe almeno 24 ore dopo la ricomparsa dei sintomi di PDPH prima di eseguire un secondo EBP. Se viene eseguito più di un EBP in un breve periodo di tempo, i professionisti dovrebbero essere consapevoli della quantità cumulativa di sangue utilizzata poiché volumi eccessivi in queste circostanze sono stati implicati in esiti avversi. Esistono prove insufficienti per guidare la gestione dopo un secondo EBP fallito. Data la frequenza di PDPH e il tasso di fallimento significativo dell'EBP, non sono rari i casi di fallimento dell'EBP sequenziale, specialmente a seguito di punture meningee di grosso calibro. In un'analisi dei risultati dopo l'ADP con aghi Tuohy calibro 18 in un'unità ostetrica, Sadashivaiah ha riportato che 3 pazienti su 48 (6.25%) hanno richiesto un terzo EBP per alleviare il mal di testa. Ovviamente, ogni fallimento dell'EBP richiede una riconsiderazione ancora più critica della diagnosi.
Sebbene siano state pubblicate esperienze con la gestione di ripetuti fallimenti EBP,162 tali casi sporadici non sono sufficienti per guidare gli altri. Tuttavia, una raccomandazione logica e frequentemente citata riguardo alla ripetizione di EBP, e in particolare una terza EBP, è quella di utilizzare una qualche forma di guida radiologica per garantire un posizionamento accurato del sangue epidurale (p. es., fluoroscopia). Altre misure in queste difficili circostanze possono includere uno qualsiasi dei suddetti "trattamenti", con la riparazione chirurgica aperta che costituisce l'ultima risorsa.
QUANDO CHIEDERE ULTERIORE CONSULENZA
Poiché il PDPH tende a migliorare anche senza un trattamento specifico e l'EBP ha un tasso di successo relativamente alto, molti professionisti cercano ragionevolmente un consulto neurologico se i sintomi non si sono risolti dopo una durata arbitraria (p. es., 7-10 giorni) o un numero di EBP (di solito due o tre). La consultazione è sempre indicata se si sospetta o non si può ragionevolmente escludere una grave non PDPH. Come accennato in precedenza, i segni neurologici lateralizzanti, la febbre/brividi, le convulsioni o il cambiamento dello stato mentale non sono coerenti con una diagnosi di PDPH o mal di testa benigno. La consultazione è appropriata anche per eventuali mal di testa con caratteristiche atipiche. Procedere con misure terapeutiche dirette al PDPH in circostanze incerte può ostacolare una diagnosi corretta, causare ritardi critici nel trattamento adeguato e può rivelarsi dannoso. L'EBP, ad esempio, è stato occasionalmente segnalato per produrre aumenti dannosi della pressione intracranica. Poiché è prevedibile che la PDPH si risolva spontaneamente, i mal di testa che peggiorano nel tempo e non hanno più una natura posizionale dovrebbero essere fortemente sospettati di essere secondari all'SDH (soprattutto se ci sono segni neurologici focali o diminuzione dello stato mentale). In queste circostanze, dovrebbe essere ottenuto un consulto neurologico ed eseguiti studi radiologici diagnostici. Sebbene il mal di testa e la maggior parte dei sintomi associati, inclusi i sintomi uditivi, si risolvano rapidamente dopo l'EBP, le paralisi dei nervi cranici generalmente si risolvono lentamente (entro 6 mesi) e possono richiedere in modo appropriato un consulto neurologico per la gestione e la rassicurazione in corso. Sebbene non ci siano trattamenti accettati per la paralisi del nervo cranico associata a PDPH, sembra ragionevole trattare queste condizioni in modo simile alla paralisi idiopatica del nervo facciale (CN VII) ("paralisi di Bell"). Ci sono alcune prove, ad esempio, che suggeriscono che i corticosteroidi somministrati precocemente (entro 72 ore dall'esordio) possono accelerare la risoluzione dei sintomi della paralisi di Bell e un trattamento simile è stato suggerito per la paralisi del nervo cranico dopo la puntura della meninge.
SOMMARIO
Oltre un secolo dopo essere stato descritto per la prima volta, il PDPH rimane una preoccupazione clinica significativa per un certo numero di specialità mediche. Come per qualsiasi complicanza, la prevenzione è preferibile al trattamento. L'identificazione e la considerazione dei fattori di rischio per PDPH hanno portato a un'impressionante riduzione dell'incidenza di questo persistente problema iatrogeno. La puntura meningea accidentale con aghi epidurali continua a essere una delle principali preoccupazioni e sfide. I conseguenti sintomi di PDPH tendono ad essere più gravi, di maggiore durata e più difficili da trattare rispetto a quelli osservati con aghi di calibro più piccolo. Va notato che non ci sono prove a sostegno delle due misure profilattiche più comunemente praticate in questo contesto: idratazione aggressiva e riposo a letto incoraggiante. Sebbene alcune misure profilattiche si siano mostrate promettenti, nessuna a questo punto sembra essere una misura definitiva. Molti episodi di PDPH, in particolare quelli di gravità da lieve a moderata, si risolveranno in modo tempestivo senza un trattamento specifico. Nonostante siano comunemente consigliati, l'idratazione, il riposo a letto e la caffeina sono tutti di valore discutibile nel trattamento del PDPH accertato. Sebbene siano state proposte alternative, l'EBP rimane l'unico trattamento provato per PDPH e quindi può essere incoraggiato ed eseguito precocemente (entro 24 ore dalla diagnosi) se i sintomi sono gravi. Sfortunatamente, la letteratura pubblicata sul PDPH è stata generalmente di scarsa qualità. Rimangono molte domande riguardo ai mezzi ottimali per prevenire e curare questa fastidiosa complicanza. Anche molto di ciò che è "noto" fino a questo punto non è stato confermato negli studi di follow-up. Si prevede che questi problemi verranno risolti in futuro attraverso indagini cliniche ben progettate.
BIBLIOGRAFIA
- Van Zundert AAJ, Reina MA, Lee RA. Prevenzione della cefalea post-puntura durale (PDPH) nelle partorienti. Contributi della ricerca sperimentale. Acta anestesiolo Scand. 2013;57:947–9.
- Reina MA, Prats-Galino A, Sola RG, Puigdellívol-Sánchez A, Arriazu Navarro R, De Andrés JA. Struttura dello strato aracnoideo delle meningi spinali umane: una barriera che regola la permeabilità del sacco durale. Rev Esp Anestesiol Reanim. 2010;57:486–92. Spagnolo.
- Lesioni Reina MA, López A, Badorrey V, De Andrés JA, Martín S. Duraarachnoid prodotte da aghi spinali Quincke di calibro 22 durante una puntura lombare. J Neurol Neurochirurgia Psichiatria. 2004;75893–7.
- Reina MA, de Leon-Casasola OA, Lopez A, De Andres J, Martin S, Mora M. Uno studio in vitro di lesioni durali prodotte da aghi Quincke e Whitacre calibro 25 valutati mediante microscopia elettronica a scansione. Antidolorifico Reg Anesth. 2000;25:393–402.
- Dittmann M, Reina MA, López García A. Nuovi risultati nella visualizzazione della dura madre spinale con la microscopia elettronica a scansione. Anestesista. 1998;47:409–13. Tedesco.
- Reina MA, Dittmann M, López Garcia A, van Zundert A. Nuove prospettive nella struttura microscopica della dura madre umana nella regione dorso-lombare. Reg Anesth. 1997;22:161–6.
- Reina MA, López-García A, de Andrés-Ibáñez JA, Dittmann M, Cascales MR, del Caño MC, Daneri J, Zambrano O. Microscopia elettronica delle lesioni prodotte nella dura madre umana da Quincke smussato e aghi Whitacre. Rev Esp Anestesiol Reanim. 1997;44:56–61. Spagnolo.
- Reina MA, Lopez A, van Zundert A, De Andrés JA. Ultrastruttura delle lesioni durali prodotte nelle punture lombari. In: Reina MA. Atlante di anatomia funzionale dell'anestesia regionale e della medicina del dolore. New York: Springer; 2015. pag.767–794.
- Reina MA, Castedo J, López A. Mal di testa da puntura postdurale. Ultrastruttura delle lesioni durali e degli aghi spinali utilizzati nelle punture lombari. Rev Arg Anestesio 2008;66:6–26.
- Tourtellotte WW, Haerer AF, Heller GL, Somers JE: mal di testa da puntura lombare. Tommaso, 1964.
- Moore DC: Mal di testa. Nelle complicazioni dell'anestesia regionale. Tommaso, 1955, pp 177–196.
- Gormley JB: Trattamento del mal di testa postspinale. Anestesiologia 1960; 21:565–566.
- DiGiovanni AJ, Dunbar BS: iniezioni epidurali di sangue autologo per mal di testa da puntura postlombare. Anesth Analg 1970;49:268–271.
- Crawford JS: Esperienze con cerotto epidurale. Anestesia 1980;35:513–515.
- Harrington BE, Schmitt AM: cefalea da puntura meningea (postdurale), puntura durale non intenzionale e cerotto epidurale. Un'indagine nazionale sulla pratica degli Stati Uniti. Reg Anesth Antidolorifico 2009;34:430–437.
- Choi PT, Galinski SE, Takeuchi L, et al: PDPH è una complicanza comune del blocco neuroassiale nelle partorienti: una meta-analisi di studi ostetrici. Can J Anesth 2003;50:460–469.
- Paech M, Banks S, Gurrin L: Un audit di puntura durale accidentale durante l'inserimento epidurale di un ago Tuohy in pazienti ostetrici. Int J Obstet Anesth 2001;10:162–167.
- Webb CA, Weyker PD, Zhang L, et al: la puntura durale non intenzionale con un ago di Tuohy aumenta il rischio di mal di testa cronico. Anesth Analg 2012; 115: 124–132.
- Stendell L, Fomsgaard JS, Olsen KS: C'è spazio per miglioramenti nella prevenzione e nel trattamento del mal di testa dopo la puntura lombare. Dan Med J 2012;59:1–5.
- Vercauteren MP, Hoffmann VH, Mertens E, et al: Revisione settennale delle richieste di cerotti epidurali per il mal di testa dopo la puntura durale: modelli di riferimento ed efficacia dei cerotti ematici. Eur J Anaesth 1999; 16:298–303.
- Davies JM, Posner KL, Lee LA, et al: Responsabilità associata all'anestesia ostetrica. Un'analisi dei reclami chiusa. Anestesiologia 2009;110:131–139.
- Lee LA, Posner KL, Domino KB, et al: Lesioni associate all'anestesia regionale negli anni '1980 e '1990: un'analisi dei reclami chiusa. Anestesiologia 2004; 101: 143–152.
- Fitzgibbon DR, Posner KL, Domino KB, et al: Gestione del dolore cronico: Progetto di attestazioni chiuse dell'American Society of Anesthesiologists. Anestesiologia 2004;100:98–105.
- Brull R, McCartney CJL, Chan VWS, et al: Divulgazione dei rischi associati all'anestesia regionale: un'indagine sugli anestesisti regionali accademici. Reg Anesth Antidolorifico 2007;32:7–11.
- Levine DN, Rapalino O: La fisiopatologia del mal di testa da puntura lombare. J Neurol Sci 2001;192:1–8.
- Kunkle EC, Ray BS, Wolff HG: studi sperimentali sul mal di testa. Analisi della cefalea associata a variazioni della pressione intracranica. Psichiatria Arch Neurol 1943; 49: 323–358.
- Larrier D, Lee A: Anatomia del mal di testa e del dolore facciale. Otolaryngol Clin N Am 2003;36:1041–1053.
- Day CJE, Shutt LE: complicazioni uditive, oculari e facciali del blocco neurale centrale. Una rassegna di possibili meccanismi. Reg Anesth 1996; 21:197–201.
- Pogodzinski MS, Shallop JK, Sprung J, et al: perdita dell'udito e pressione del liquido cerebrospinale: caso clinico e revisione della letteratura. Orecchio Naso Gola J 2009;87:144–147.
- Nishio I, Williams BA, Williams JP: Diplopia. Una complicazione della puntura durale. Anestesiologia 2004; 100: 158–164.
- Yaman ME, Ayberk G, Eylen A, et al: paralisi del nervo abducente isolata dopo la puntura lombare: caso clinico e revisione del meccanismo d'azione. J Neurochirurgia Sci 2010;54:119–123.
- Fang JY, Lin JW, Li Q, et al: paralisi del nervo trigemino e del nervo facciale dopo anestesia spinale-epidurale combinata per taglio cesareo. J Clin Anesth 2010;22:56–58.
- Lybecker H, Djernes M, Schmidt JF: Cefalea da puntura postdurale (PDPH): insorgenza, durata, gravità e sintomi associati. Un'analisi di 75 pazienti consecutivi con PDPH. Acta Anaesthesiol Scand 1995;39:605–612.
- Aida S, Taga K, Yamakura T, et al: Mal di testa dopo il tentativo di blocco epidurale: il ruolo dell'aria intratecale. Anestesiologia 1998;88:76–81.
- Reamy BV: Cefalea post-epidurale: quanto tardi può verificarsi? J Am Board Fam Med 2009;22:202–205.
- Amorim JA, Gomes de Barros MV, Valenca MM: cefalea da puntura post-durale (post-lombare): fattori di rischio e caratteristiche cliniche. Cefalea 2012;32:916–923.
- Chan TM, Ahmed E, Yentis SM, et al: Mal di testa postpartum: rapporto riepilogativo del National Obstetric Anestetico Database (NOAD) 1999. Int J Obstet Anesth 2003;12:107–112.
- Sprung J, Bourke BA, Contreras MG, et al: Compromissione dell'udito perioperatoria. Anestesiologia 2003;98:241–257.
- Lybecker H, Moller JT, May O, et al: Incidenza e previsione del mal di testa da puntura postdurale: uno studio prospettico di 1021 anestesie spinali. Anesth Analg 1990;70:389–394.
- Wu CL, Rowlingson AJ, Cohen SR, et al: genere e mal di testa da puntura post-durale. Anestesiologia 2006;105:613–618.
- Angolo P, Thompson D, Halpern S, et al: La spinta del secondo stadio è correlata al mal di testa dopo la puntura durale non intenzionale nelle partorienti. Can J Anesth 1999;46:861–866.
- Vallejo MC: Gestione anestetica della partoriente patologicamente obesa. Curr Opin Anestesiolo 2007;20:175–180.
- Kuntz KM, Kokmen E, Stevens JC, et al: Mal di testa post-puntura lombare: esperienza in 501 procedure consecutive. Neurologia 1992; 42:1884–1887.
- Faure E, Moreno R, Thisted R: Incidenza di mal di testa da puntura postdurale in partorienti patologicamente obese. Reg Anesth 1994;19:361–363.
- Dodge HS, Ekhator NN, Jefferson-Wilson L, et al: I fumatori di sigarette hanno un rischio ridotto di mal di testa da puntura post-durale. Medico del dolore 2013;16:e25–e30.
- Hannerz J: Cefalea da puntura postlombare e sua relazione con la cefalea di tipo tensivo cronico. Mal di testa 1997;37:659–662.
- van Oosterhout WPJ, van der Plas AA, van Zwet EW, et al: Mal di testa da puntura postdurale in soggetti con emicrania e non mal di testa. Uno studio prospettico. Neurologia 2013;80:941–948.
- Echevarria M, Caba F, Rodriguez R: L'influenza del ciclo mestruale nel mal di testa da puntura postdurale. Reg Anesth Pain Med 1998;23: 485–490.
- Blanche R, Eisenach JC, Tuttle R, et al: Il precedente rubinetto a umido non riduce il tasso di successo dell'analgesia epidurale del travaglio. Anesth Analg 1994;79: 291–294.
- Halpern S, Preston R: mal di testa da puntura postdurale e design dell'ago spinale. Metaanalisi. Anestesiologia 1994;81:1376–1383.
- Kovanen J, Sulkava R: Durata del mal di testa posturale dopo la puntura lombare: Effetto della dimensione dell'ago. Mal di testa 1986;26:224–226.
- Lambert DH, Hurley RJ, Hertwig L, et al: ruolo del calibro dell'ago e configurazione della punta nella produzione del mal di testa da puntura lombare. Reg Anesth 1997;22:66–72.
- Reina MA, de Leon-Casasola OA, Lopez A, et al: uno studio in vitro di lesioni durali prodotte da aghi Quincke e Whitacre calibro 25 valutati mediante microscopia elettronica a scansione. Reg Anesth Antidolorifico 2000; 25:393–402.
- Richman J, Joe E, Cohen S, et al: direzione dello smusso e mal di testa da puntura postdurale. Una meta-analisi. Neurologo 2006;12:224–228.
- Reina MA, Dittmann M, Garcia AL, et al: Nuove prospettive nella struttura microscopica della dura madre umana nella regione dorso-lombare. Reg Anesth 1997;22:161–166.
- Seeberger MD, Kaufmann M, Staender S, et al: le punture durali ripetute aumentano l'incidenza del mal di testa da puntura postdurale. Anesth Analg 1996;82:302–305.
- De Almeida SM, Shumaker SD, LeBlanc SK, et al: Incidenza del mal di testa da puntura postdurale nei volontari della ricerca. Mal di testa 2011;51:1503–1510.
- Singh S, Chaudry SY, Phelps AL, et al: un audit di 5 anni di punture durali accidentali, mal di testa post-puntura e anestetici regionali falliti in un centro medico di cure terziarie. TheScientificWorldJournal 2009;9:715–722.
- Goldszmidt E, Kern R, Chaput A, et al: L'incidenza e l'eziologia del mal di testa postpartum: uno studio prospettico di coorte. Può J Anesth 2005; 52:971–977.
- Aya AGM, Manguin R, Robert C, et al: aumento del rischio di puntura durale non intenzionale nell'anestesia epidurale ostetrica notturna. Can J Anesth 1999;46:665–669.
- Paech MJ, Whybrow T: La prevenzione e il trattamento del mal di testa post-puntura durale. ASEAN J Anestesia 2007;8:86–95.
- Warwick WI, Neal JM: Oltre il mal di testa spinale: profilassi e trattamento delle sindromi di mal di testa a bassa pressione. Reg Anesth Antidolorifico 2007;32:455–461.
- Apfel CC, Saxena OS, Cakmakkaya OS, et al: Prevenzione del mal di testa da puntura postdurale dopo puntura durale accidentale: una revisione sistematica quantitativa. Fr. J Anaesth 2010;105:255–263.
- Perlas A: Evidenze per l'uso degli ultrasuoni nei blocchi neuroassiali. Reg Anesth Pain Med 2010;35 (Suppl. 1):S43–S46.
- Hamzei A, Basiri-Moghadam M, Pasban-Noghabi S: Effetto del desametasone sull'incidenza del mal di testa dopo l'anestesia spinale nel taglio cesareo. Un singolo studio controllato randomizzato cieco. Saudi Med J 2012;33:948–953.
- Doroudian MR, Norouzi M, Esmailie M, et al: Desametasone nella prevenzione del mal di testa da puntura post-durale: uno studio randomizzato, in doppio cieco, controllato con placebo. Acta Anaesth Belg 2011;62:143–146.
- Yousefshahi F, Dahmardeh AR, Khajavi M, et al: Effetto del desametasone sulla frequenza del mal di testa da puntura postdurale dopo anestesia spinale per taglio cesareo: uno studio clinico randomizzato in doppio cieco. Acta Neurol Belg 2012;112:345–350.
- Basurto Ona X, Uriona Tuma SM, Martinez Garcia L, et al: Terapia farmacologica per prevenire il mal di testa da puntura post-durale. Sistema di database Cochrane Rev 2013;(2):CD001792.
- Al-metwalli RR: iniezioni epidurali di morfina per la prevenzione del mal di testa post-puntura durale. Anestesia 2008;63:847–850.
- Hakim SM: Cosyntropin per la profilassi contro il mal di testa da puntura postdurale dopo puntura durale accidentale. Anestesiologia 2010;113:413–420.
- Sadeghi SE, Abdollahifard G, Nasabi NA, et al: Efficacia della somministrazione di una dose singola di aminopillina sulla prevenzione del mal di testa post-puntura durale nei pazienti che hanno ricevuto l'anestesia spinale per taglio cesareo elettivo. Mondo J Med Sci 2012;7:13–16.
- Jacobus CH: Il riposo a letto previene il mal di testa post-puntura lombare? Ann Emerg Med 2012;59:139–140.
- Baraz R, Collis R: La gestione della puntura durale accidentale durante l'analgesia epidurale del travaglio: un'indagine sulla pratica del Regno Unito. Anestesia 2005;60: 673–679.
- Sudlow C, Warlow C: Postura e fluidi per prevenire il mal di testa da puntura postdurale. Sistema di database Cochrane Rev 2002;(2):CD001790.
- Dakka Y, Warra N, Albadareen RJ, et al: tasso di cefalea e costo delle cure a seguito di puntura lombare in un unico ospedale di cure terziarie. Neurologia 2011;77:71–74.
- Strupp M, Brandt T, Muller A: Incidenza della sindrome da puntura post-lombare ridotta reinserindo lo stiletto: uno studio prospettico randomizzato su 600 pazienti. J Neurol 1998;245:589–592.
- Sinikoglu NS, Yeter H, Gumus F, et al: Il reinserimento dello stiletto non influisce sull'incidenza di mal di testa post-puntura durale (PDPH) dopo anestesia spinale. Rev Bras Anestesiol 2013;63:188–192.
- Moore JM: Anestesia spinale continua. Am J Ther 2009;16: 289–294.
- Sadashivaiah J, McClure H: l'ago Tuohy da 18 g può ridurre l'incidenza di un grave mal di testa post-puntura durale. Anestesia 2009;64: 1379–1380.
- Schier R, Guerra D, Aguilar J, et al: Identificazione dello spazio epidurale: una meta-analisi delle complicanze dopo l'aria rispetto al liquido come mezzo per la perdita di resistenza. Anesth Analg 2009;109:2012–2021.
- Segal S, Arendt KW: uno studio retrospettivo sull'efficacia della perdita di resistenza all'aria o alla soluzione salina per l'identificazione dello spazio epidurale. Anesth Analg 2010;110:558–563.
- Norris MC, Leighton BL, DeSimone CA: direzione dello smusso dell'ago e mal di testa dopo puntura durale involontaria. Anestesiologia 1989;70:729–731.
- Duffy B: Non girare l'ago! Terapia intensiva di Anaesth 1993;21:328–330.
- Simmons SW, Cyna AM, Dennis AT, et al: Analgesia spinale-epidurale e epidurale combinata durante il travaglio. Sistema di database Cochrane Rev 2009;(1):CD003401.
- Kuczkowski KM, Benumof JL: Diminuzione dell'incidenza del mal di testa post-puntura durale: mantenimento del volume del liquido cerebrospinale. Acta Anaesthesiol Scand 2003;47:98–100.
- Charsley MM, Abram SE: L'iniezione di soluzione fisiologica intratecale riduce la gravità del mal di testa post-puntura. Reg Anesth Antidolorifico 2001;26:301–305.
- Carter BL, Pasupuleti R: Uso della cosintropina per via endovenosa nel trattamento del mal di testa da puntura postdurale. Anestesiologia 2000;92:272–274.
- Russell IF: uno studio prospettico controllato di anestesia spinale continua
contro l'analgesia epidurale ripetuta dopo puntura durale accidentale durante il travaglio. Int J Obstet Anesth 2012;21:7–16. - Ayad S, Bemian Y, Narouze S, et al: Posizionamento del catetere subaracnoideo dopo il rubinetto bagnato per l'analgesia durante il travaglio: influenza sul rischio di mal di testa nei pazienti ostetrici. Reg Anesth Antidolorifico 2003;28:512–515.
- Heesen M, Klohr S, Rossaint R, et al: Inserimento di un catetere intratecale
a seguito di puntura durale accidentale: una meta-analisi. Int J Obstet Anesth 2013;22:26–30. - Newman M, Cyna A: Gestione immediata della puntura durale involontaria durante l'inserimento di un'epidurale del travaglio: un'indagine sugli anestesisti ostetrici australiani. Terapia intensiva di Anaesth 2008;36:96–101.
- Stride PC, Cooper GM: i rubinetti Dural rivisitati: un sondaggio di 20 anni dal Birmingham Maternity Hospital. Anestesia 1993;48:247–255.
- Trivedi NS, Eddi D, Shevde K: Prevenzione del mal di testa a seguito di puntura durale accidentale in pazienti ostetrici. J Clin Anesth 1993;5: 42–45.
- Scavone BM, Wong CA, Sullivan JT, et al: Efficacia di un cerotto profilattico di sangue epidurale nella prevenzione del mal di testa post-puntura durale nelle partorienti dopo una puntura durale involontaria. Anestesiologia 2004;101:1422–1427.
- Bradbury CL, Singh SI, Badder SR, et al: Prevenzione del mal di testa da puntura post-durale nelle partorienti: una revisione sistematica e una meta-analisi. Acta Anaesthesiol Scand 2013;57:417–430.
- Agerson AN, Scavone BM: Patch di sangue epidurale profilattico dopo puntura durale non intenzionale per la prevenzione del mal di testa da puntura postdurale nelle partorienti. Anesth Analg 2012; 115: 133–136.
- Boonmak P, Boonmak S: cerotto epidurale per prevenire e trattare il mal di testa da puntura post-durale. Sistema di database Cochrane Rev 2010;(1):CD001791.
- Baysinger CL, Pope JE, Lockhart EM, et al: La gestione della puntura durale accidentale e del mal di testa da puntura postdurale: un'indagine nordamericana. J Clin Anesth 2011;23:349–360.
- Leivers D: Anestesia spinale totale dopo cerotto epidurale profilattico precoce. Anestesiologia 1990;73:1287–1289.
- Tobias MD, Pilla MA, Rogers C, et al: La lidocaina inibisce la coagulazione del sangue: implicazioni per il cerotto epidurale. Anesth Analg 1996;82:766–769.
- Gutsche BB: analgesia epidurale lombare in ostetricia: rubinetti e cerotti. In: Reynolds F (a cura di): Blocco epidurale e spinale in ostetricia. Balliere Tindall, 1990, pp 75–106.
- Naulty JS, Hertwig L, Hunt CO, et al: Influenza della soluzione anestetica locale sul mal di testa da puntura postdurale. Anestesiologia 1990;72:450–454.
- Santanen U, Rautoma P, Luurila H, et al: confronto di aghi spinali Whitacre e Quincke calibro 27 (0.41 mm) rispetto al mal di testa da puntura postdurale e al mal di testa da puntura non durale. Acta Anaesthesiol Scand 2004; 48: 474–479.
- Stella CL, Jodicke CD, How HY, et al: Mal di testa postpartum: il tuo lavoro è completo? Am J Obstet Gynecol 2007;196:318.e1–318.e7.
- Somri M, Teszler CB, Vaida SJ, et al: Mal di testa da puntura postdurale: un protocollo di gestione guidato dall'imaging. Anesth Analg 2003;96:1809–1812.
- Sharma R, Panda A: Cefalea indotta da Ondansetron in una partoriente che imita il mal di testa da puntura postdurale. Can J Anesth 2010;57:187–188.
- Hurlburt L, Lay C, Fehlings MG, et al: Il workup postpartum del mal di testa da puntura postdurale porta alla diagnosi e al trattamento chirurgico dello pseudomeningocele toracico: un case report. Can J Anesth 2013;60:294–298.
- Istituto Nazionale di Malattie Neurologiche e Ictus. Scheda informativa su meningite ed encefalite. http://www.ninds.nih.gov/disorders/encephalitis_meningitis/detail_encephalitis_meningitis.htm. Accesso 28 giugno 2013.
- Machurot PY, Vergnion M, Fraipont V, et al: Ematoma subdurale intracranico dopo anestesia spinale: Caso clinico e revisione della letteratura. Acta Anaesth Belg 2010;61:63–66.
- Bleeker CP, Hendriks IM, Booij LHDJ: Cefalea post-partum post-puntura durale: la tua diagnosi differenziale è completa? Fr. J Anaesth 2004; 93:461–464.
- Matthys LA, Coppage KH, Lambers DS, et al: Preeclampsia postpartum ritardata: un'esperienza di 151 casi. Am J Obstet Gynecol 2004;190:1464–1466.
- Lockhart EM, Baysinger CL: Trombosi venosa intracranica nella partoriente. Anestesiologia 2007;107:652–658.
- Wittmann M, Dewald D, Urbach H, et al: Trombosi venosa sinusale: una diagnosi differenziale di cefalea postpartum. Arch Gynecol Obstet 2012;285:93–97.
- Vanden Eede H, Hoffmann VLH, Vercauteren MP: Cefalea posturale post-parto: non sempre una classica cefalea post-puntura durale. Acta Anaesthesiol Scand 2007;51:763–765.
- van Kooten F, Oedit R, Bakker SLM, et al: Patch di sangue epidurale nel mal di testa post-puntura durale: uno studio clinico randomizzato, in cieco per l'osservatore, controllato. J Neurol Neurochirurgia Psichiatria 2008;79:553–558.
- Sharma A, Cheam E: l'agopuntura nella gestione del mal di testa post-partum a seguito di analgesia neuroassiale. Int J Obstet Anesth 2009; 18: 417–419.
- Takmaz SA, Kantekin CU, Kaymak C, et al: trattamento del mal di testa post-puntura durale con blocco del nervo occipitale maggiore bilaterale. Mal di testa 2010;50:869–872.
- Cohen S, Ramos D, Grubb W, et al. Reg Anesth Antidolorifico 2014;39:563.
- Basurto Ona X, Martinez Garcia L, Sola I, et al: Terapia farmacologica per il trattamento del mal di testa da puntura post-durale. Sistema di database Cochrane Rev 2011;(8):CD007887.
- Choi A, Laurito CE, Cummingham FE: gestione farmacologica del mal di testa da puntura postdurale. Ann Pharmacother 1996;30:831–839.
- Camann WR, Murray RS, Mushlin PS, et al: Effetti della caffeina orale sul mal di testa da puntura postdurale. Uno studio in doppio cieco, controllato con placebo. Anesth Analg 1990;70:181–184.
- Halker RB, Demaerschalk BM, Wellik KE, et al: Caffeina per la prevenzione e il trattamento del mal di testa da puntura postdurale: sfatare il mito. Neurologo 2007;13:323–327.
- Connelly NR, Parker RK, Rahimi A, et al: Sumatriptan in pazienti con cefalea da puntura postdurale. Mal di testa 2000;40:316–319.
- Hakim S, Khan RM, Maroof M, et al: Methylergonovine maleate (methergine) allevia il mal di testa da puntura postdurale nei pazienti ostetrici. Acta Obstet Gynecol Scand 2005;84:100.
- Rucklidge MWM, Yentis SM, Paech MJ, et al: Synacthen Depot per il trattamento del mal di testa da puntura postdurale. Anestesia 2004;59: 138–141.
- Noyan Ashraf MA, Sadeghi A, Azarbakht Z, et al: Idrocortisone nel mal di testa da puntura post-durale. Medio Oriente J Anesthesiol 2007;19:415–422.
- Rabiul A, Aminur R, Reza E: Ruolo dell'idrocortisone per via endovenosa a brevissimo termine nella riduzione della cefalea post-puntura. J Anaesthesiol Clin Pharmacol 2012;28:190–193.
- Wagner Y, Storr F, Cope S: Gabapentin nel trattamento del mal di testa da puntura post-durale: una serie di casi. Terapia intensiva di Anaesth 2012;40:714–718.
- Huseyinoglu U, Huseyinoglu N, Hamurtekin E, et al: Effetto del pregabalin sul mal di testa post-puntura durale in seguito ad anestesia spinale e puntura lombare. JClin Neurosci 2011;18:1365–1368.
- Kroin JS, Nagalla SKS, Buvanendran, et al: I meccanismi di modulazione della pressione intracranica da sangue epidurale e altri iniettati in un modello di ratto di puntura postdurale. Anesth Analg 2002;95:423–429.
- Bart AJ, Wheeler AS: confronto tra posizionamento di soluzione salina epidurale e posizionamento di sangue epidurale nel trattamento del mal di testa post-puntura lombare. Anestesiologia 1978;48:221–223.
- Liu SK, Chen KB, Wu RSC, et al: Gestione del mal di testa da puntura postdurale mediante soluzione fisiologica epidurale somministrata con una pompa controllata dal paziente: un caso clinico. Acta Anaesthesiol Taiwan 2006;44:227–230.
- Kara I, Ciftci I, Apiliogullari S, et al: Gestione del mal di testa da puntura postdurale con cerotto salino epidurale in un bambino di 10 anni dopo la riparazione dell'ernia inguinale: un caso clinico. J Pediatr Surg 2012;47:E55–E57.
- Vakharia SB, Thomas PS, Rosenbaum AE, et al: risonanza magnetica della perdita di liquido cerebrospinale e effetto tamponamento del cerotto sanguigno nel mal di testa da puntura postdurale. Anesth Analg 1997;84:585–590.
- Serpell MG, Haldane GJ, Jamieson DR, et al: Prevenzione del mal di testa dopo la puntura lombare: questionario di neurologi e neurochirurghi nel Regno Unito. Fr Med J 1998;316:1709–1710.
- Darvish B, Gupta A, Alahuhta S, et al: Gestione della puntura durale accidentale e del mal di testa post-puntura durale dopo il travaglio: un'indagine nordica. Acta Anaesthesiol Scand 2011;55:46–53.
- Banks S, Paech M, Gurrin L: Un audit del cerotto epidurale dopo puntura durale accidentale con un ago di Tuohy in pazienti ostetrici. Int J Obstet Anesth 2001;10:172–176.
- Safa-Tisseront V, Thormann F, Malassine P, et al: Efficacia del cerotto epidurale nella gestione del mal di testa da puntura post-durale. Anestesiologia 2001;95:334–339.
- Sandesc D, Lupei MI, Sirbu C, et al: trattamento convenzionale o cerotto epidurale per il trattamento di diverse eziologie di cefalea post-puntura durale. Acta Anaesth Belg 2005;56:265–269.
- Vilming ST, Kloster R, Sandvik L: Quando dovrebbe essere eseguito un cerotto epidurale nel mal di testa da puntura postlombare? Un approccio teorico basato su una coorte di 79 pazienti. Cefalea 2005;25:523–527.
- Chen LK, Huang CH, Jean WH, et al: Volumi efficaci del cerotto epidurale per il mal di testa da puntura postdurale nelle donne taiwanesi. J Formos Med Assoc 2007;106:134–140.
- Paech MJ, Doherty DA, Christmas T, et al: Il volume di sangue per il cerotto epidurale in ostetricia: uno studio clinico randomizzato e in cieco. Anesth Analg 2011; 113: 126–133.
- Schievink WI: perdite spontanee di liquido cerebrospinale spinale e ipotensione intracranica. JAMA 2006;295:2286–2296.
- Riley CA, Spiegel JE: Complicazioni a seguito di cerotti epidurali di grande volume per mal di testa da puntura postdurale. Ematoma subdurale lombare e aracnoidite: causa iniziale o effetto finale? J Clin Anesth 2009;21:355–359.
- Desai MJ, Dave AP, Martin MB: dolore radicolare ritardato a seguito di due cerotti epidurali di grande volume per mal di testa post-puntura lombare: un caso clinico. Medico del dolore 2010;13:257–262.
- Martin R, Jourdain S, Clairoux M, et al: Durata della posizione di decubito dopo il cerotto epidurale. Can J Anaesth 1994;41:23–25.
- Jagannathan N, Tetzlaff JE: cerotto epidurale in un paziente Testimone di Geova con cefalea post-puntura durale. Can J Anaesth 2005;52:113.
- Janssens E, Aerssens P, Alliet P, et al: Mal di testa da puntura post-durale nei bambini: una revisione della letteratura. Eur J Pediatr 2003;162:117–121.
- Kokki M, Sjovall S, Kokki H: i cerotti epidurali sono efficaci per il mal di testa da puntura postdurale in pediatria: un'esperienza di 10 anni. Pediatr Anesth 2012;22:1205–1210.
- Waldman SD, Feldstein GS, Allen ML: Cerotto di sangue epidurale cervicale: un trattamento sicuro ed efficace per il mal di testa da puntura cervicale post-durale. Anesth Rev 1987;14:23–24.
- Bucklin BA, Tinker JH, Smith CV: Dilemma clinico: un paziente con mal di testa da puntura postdurale e leucemia acuta. Anesth Analg 1999;88:166–167.
- Koeva V, Bar-Or A, Gendron D, et al: Patch di sangue epidurale in un paziente con sclerosi multipla: è sicuro? Can J Anaesth 2013;60:479–483.
- Tom DJ, Gulevich SJ, Shapiro HM, et al: Patch di sangue epidurale nel paziente sieropositivo. Anestesiologia 1992;76:943–947.
- Martin DP, Bergman BD, Berger IH: cerotto epidurale e varicella acuta. Anesth Analg 2004;99:1760–1762.
- Abouleish E, de la Vega S, Blendinger I, et al: follow-up a lungo termine del cerotto epidurale. Anesth Analg 1975;54:459–463.
- Andrews PJD, Ackerman WE, Juneja M, et al: Bradicardia transitoria associata a cerotto di sangue extradurale dopo puntura durale involontaria nelle partorienti. Fr. J Anaesth 1992;69:401–403.
- Hebl JR, Horlocker TT, Chantigian RC, et al: L'anestesia epidurale e l'analgesia non sono compromesse dopo la puntura durale con o senza cerotto epidurale. Anesth Analg 1999;89:390–394.
- Collier CB: le macchie di sangue possono causare cicatrici nello spazio epidurale: due casi clinici. Int J Obstet Anesth 2011;20:347–351.
- Vassal O, Baud MC, Bolandard F, et al: iniezione epidurale di amido idrossietilico nella gestione del mal di testa da puntura postdurale. Int J Obstet Anesth 2013;22:153–155.
- Williams EJ, Beaulieu P, Fawcett WJ, et al: Efficacia del cerotto epidurale nella popolazione ostetrica. Int J Obstet Anesth 1999;8: 105–109.
- Sadashivaiah J: l'ago Tuohy 18-G può ridurre l'incidenza di un grave mal di testa post-puntura durale. Anestesia 2009;64:1379–1380.
- Ho KY, Gan TJ: Gestione del mal di testa persistente post-puntura durale dopo ripetuti cerotti epidurali. Acta Anaesthesiol Scand 2007;51:633–636.
- Sullivan FM, Swan IRC, Donnan PT, et al: trattamento precoce con prednisone o aciclovir nella paralisi di Bell. N Inglese J Med 2007;357: 1598–1607.
- Choi PTL, Galinski SE, Lucas S, et al: Esame delle prove nella letteratura sull'anestesia: un'indagine e una valutazione dei rapporti di mal di testa da puntura ostetrica post-durale. Can J Anaesth 2002;49:49–56.


