Os opioides desempenham um papel indispensável na prática da anestesiologia, cuidados intensivos e controle da dor. Uma boa compreensão da farmacologia dos opioides, incluindo ciência básica e aspectos clínicos, é fundamental para o uso seguro e eficaz desses importantes medicamentos. Este capítulo se concentrará quase exclusivamente nos agonistas dos receptores opioides intravenosos usados no perioperatório.
1. FARMACOLOGIA BÁSICA
Estrutura-Atividade
Os opioides de interesse clínico em anestesiologia compartilham muitas características estruturais. A morfina é um alcaloide benzilisoquinolínico (Fig.1). Muitos opioides semi-sintéticos comumente usados são criados pela simples modificação da molécula de morfina. A codeína, por exemplo, é o derivado 3-metil da morfina. Da mesma forma, a hidromorfona, a hidrocodona e a oxicodona também são sintetizadas por modificações relativamente simples da morfina. Alterações mais complexas do esqueleto molecular da morfina resultam em agonistas-antagonistas mistos, como a nalbufina, e até mesmo em antagonistas completos, como a naloxona.
A série de opioides do fentanil é quimicamente relacionada à meperidina. A meperidina é o primeiro opioide completamente sintético e pode ser considerada como o protótipo da fenilpiperidina clínica (ver Fig. 1). O fentanil é uma modificação simples da estrutura básica da fenilpiperidina. Outros congêneres de fentanil comumente usados, como alfentanil e sufentanil, são versões um pouco mais complexas do mesmo esqueleto de fenilpiperidina.
Os opioides compartilham muitas características físico-químicas em comum, embora algumas drogas individuais tenham características únicas. Em geral, os opioides são bases fracas altamente solúveis que são altamente ligadas a proteínas e amplamente ionizadas em pH fisiológico. As propriedades físico-químicas dos opioides influenciam seu comportamento clínico. Por exemplo, moléculas ionizadas relativamente não ligadas, como alfentanil e remifentanil, têm uma latência mais curta para o efeito máximo após a injeção em bolus.
Mecanismo
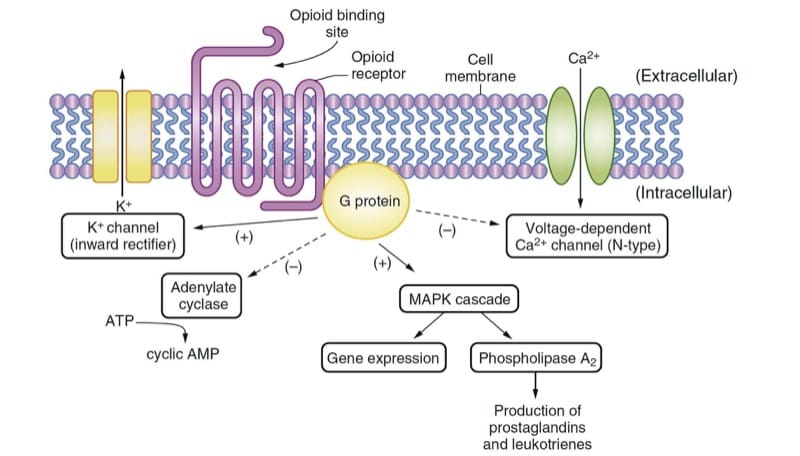
Os opioides produzem seus principais efeitos farmacológicos interagindo com os receptores opioides, que são típicos da família de receptores acoplados à proteína G amplamente encontrados na biologia (por exemplo, β-adrenérgicos, dopaminérgicos, entre outros). A expressão de receptores opioides clonados em células cultivadas facilitou a análise dos mecanismos de transdução de sinal intracelular ativados pelos receptores opioides.(1) A ligação dos agonistas opioides com os receptores leva à ativação da proteína G, produzindo efeitos principalmente inibitórios (Fig. 2); esses efeitos culminam na hiperpolarização da célula e na redução da excitabilidade neuronal.
Três receptores opióides clássicos foram identificados usando técnicas de biologia molecular: μ, κ e δ. Mais recentemente, um quarto receptor opióide, ORL1 (também conhecido como NOP), também foi identificado, embora sua função seja bastante diferente da dos receptores opióides clássicos. Cada um desses receptores opióides tem um bioensaio experimental comumente empregado, ligante(s) endógeno(s) associado(s), um conjunto de agonistas e antagonistas e um espectro de efeitos fisiológicos quando o receptor é agonizado. Embora a existência de subtipos de receptores opioides (por exemplo, μ1 μ2) tenha sido proposta, não está claro a partir de técnicas de biologia molecular que existam genes distintos para eles. A modificação pós-traducional dos receptores opióides certamente ocorre e pode ser responsável por dados conflitantes sobre os subtipos de receptores opióides.(2)
Os opioides exercem seus efeitos terapêuticos em vários locais. Eles inibem a liberação de substância P dos neurônios sensoriais primários no corno dorsal da medula espinhal, atenuando a transferência de sensações dolorosas para o cérebro. As ações dos opioides no tronco encefálico modulam a transmissão nociceptiva no corno dorsal da medula espinhal por meio de vias inibitórias descendentes. Acredita-se que os opióides alterem a resposta afetiva à dor por meio de ações no prosencéfalo; a descerebração impede a eficácia dos analgésicos opioides em ratos.(3) Além disso, a morfina induz mudanças de sinal em “estruturas de recompensa” no cérebro humano.(4)
Estudos em camundongos geneticamente modificados forneceram informações importantes sobre a função do receptor opióide. Em camundongos knockout para o receptor μ, a analgesia induzida por morfina, o efeito de recompensa e o efeito de abstinência estão ausentes.(5,6) É importante ressaltar que os camundongos knockout para o receptor μ também falham em exibir depressão respiratória em resposta à morfina.(7)

- Fig.2 Mecanismos de ação dos opioides. O ligante ou droga endógena liga-se ao receptor opioide e ativa a proteína G, resultando em múltiplos efeitos que são principalmente inibitórios. As atividades da adenilato ciclase e dos canais de Ca2+ dependentes de voltagem estão deprimidas. Os canais de K+ de retificação interna e a cascata de proteína quinase ativada por mitogênio (MAPK) são ativados. AMP, monofosfato de adenosina; ATP, trifosfato de adenosina.
Metabolismo
Os opióides administrados por via intravenosa na rotina clínica perioperatória são transformados e excretados por várias vias metabólicas. Em geral, os opioides são metabolizados pelo sistema microssomal hepático, embora a conjugação hepática e a subseqüente excreção renal sejam importantes para alguns opioides. Para certos opioides, a via metabólica específica envolvida tem implicações clínicas importantes em termos de metabólitos ativos (por exemplo, morfina, meperidina) ou uma duração de ação ultracurta (por exemplo, remifentanil). Para outros opioides, a variação genética na via metabólica pode alterar drasticamente os efeitos clínicos (por exemplo, codeína). Essas nuances são abordadas em uma seção subsequente focada em drogas individuais.
2. FARMACOLOGIA CLÍNICA
farmacocinética
As diferenças farmacocinéticas são a base primária para a seleção racional e administração de opioides na prática anestésica perioperatória. Os principais comportamentos farmacocinéticos são (1) a latência para o pico de concentração no local de efeito após a injeção em bolus (ou seja, cinética inicial do bolus), (2) o tempo para a queda clinicamente relevante da concentração após a injeção em bolus (ou seja, cinética de back-end do bolus ), (3) o tempo até a concentração no estado estacionário após o início de uma infusão contínua (ou seja, cinética inicial da infusão) e (4) o tempo para uma queda clinicamente relevante na concentração após a interrupção de uma infusão contínua (ou seja, infusão de retorno). cinética final).
A aplicação dos conceitos farmacocinéticos de opioides à anestesiologia clínica requer o reconhecimento de vários princípios fundamentais. Primeiro, uma tabela de variáveis farmacocinéticas tem valor clínico limitado. A compreensão do comportamento farmacocinético é melhor alcançada por meio de simulação de computador. Em segundo lugar, os opioides administrados por injeção em bolus ou infusão contínua devem ser considerados separadamente. (8) Em terceiro lugar, as informações farmacocinéticas devem ser integradas ao conhecimento sobre a relação concentração-efeito e interações medicamentosas (ou seja, farmacodinâmica) para serem clinicamente úteis.
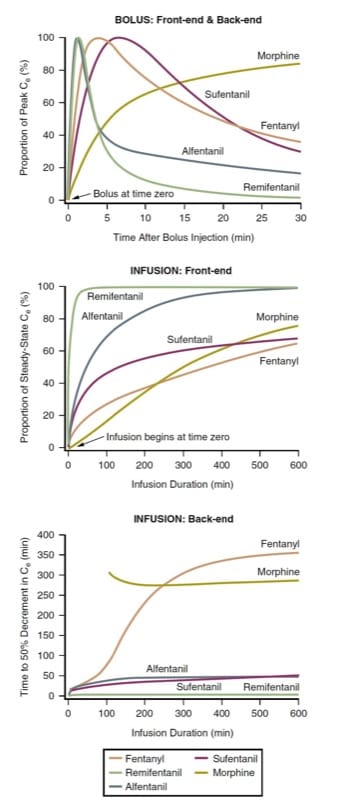
A latência para o efeito máximo e a compensação do efeito após a injeção em bolus (ou seja, cinética inicial do bolus e cinética final do bolus) de vários opioides intravenosos pode ser definida pela previsão do curso de tempo das concentrações no local do efeito após a administração de um bolus . Como os opioides diferem em termos de potência (e, portanto, das dosagens necessárias), para fins de comparação, as concentrações no local de efeito devem ser normalizadas para a porcentagem da concentração máxima de cada droga. Considerando morfina, fentanil, sufentanil, alfentanil e remifentanil entre os opioides mais comumente usados no intraoperatório, a simulação farmacocinética ilustra como os opioides diferem em termos de latência para efeito de pico após a administração de um bolus (Fig.3, painel superior). (9-12)
A simulação de uma injeção em bolus (ver Fig.3, painel superior) tem implicações clínicas. Por exemplo, quando um início rápido do efeito opioide é desejável, a morfina pode não ser uma boa escolha. Da mesma forma, quando o objetivo clínico é uma breve duração do efeito opioide seguida de rápida dissipação, o remifentanil ou o alfentanil podem ser preferidos. Observe como a concentração de remifentanil diminuiu substancialmente antes que o pico de concentração de fentanil fosse alcançado. A simulação ilustra por que a cinética inicial do fentanil o torna um medicamento adequado para analgesia controlada pelo paciente (ACP) (consulte também os capítulos Recuperação pós-anestésica e Controle da dor perioperatória). Em contraste com a morfina, o pico do efeito de um bolus de fentanil se manifesta antes que um período típico de bloqueio do PCA tenha decorrido, mitigando assim um problema de “empilhamento de dose” (consulte também o capítulo Manejo da dor perioperatória).
A latência para o pico do efeito é governada pela velocidade com que o plasma e o local do efeito chegam ao equilíbrio (ou seja, o parâmetro ke0). Fármacos com um equilíbrio mais rápido têm uma fração “difusível” mais alta (ou seja, a proporção de fármaco que é ionizada e não ligada) e alta lipossolubilidade. No entanto, uma dose muito grande, mesmo de um opióide de início lento, pode produzir um aparente início rápido (porque um nível supraterapêutico do fármaco no local de efeito é alcançado, embora o pico de concentração ocorra mais tarde).
Esta simulação de infusões simples e de taxa constante tem implicações clínicas óbvias. Primeiro, o tempo necessário para atingir uma fração substancial da concentração final no estado estacionário é muito longo no contexto do uso intraoperatório. Para atingir um estado quase estacionário mais rapidamente, é necessário administrar um bolus antes que a infusão seja iniciada (ou aumentada). O remifentanil talvez represente uma exceção parcial a essa regra geral. Além disso, as concentrações de opioides aumentarão por muitas horas após o início da infusão; em outras palavras, as concentrações normalmente aumentam, mesmo que a taxa de infusão seja a mesma por horas! O fato de o remifentanil atingir um estado quase estacionário de forma relativamente rápida é certamente parte do motivo pelo qual ele emergiu como um medicamento popular para anestesia intravenosa total (TIVA).
O tempo até o estado estacionário após o início de uma infusão contínua também é melhor examinado por simulação farmacocinética. Usando os mesmos protótipos da administração em bolus, a simulação farmacocinética (Fig. 3, painel do meio) mostra o tempo necessário para atingir as concentrações do local de efeito em estado estacionário (ou seja, cinética inicial da infusão).
O tempo para compensar o efeito após a interrupção de uma infusão em estado estacionário é melhor expresso pela simulação de meio-tempo sensível ao contexto (CSHT).(13) Definido como o tempo necessário para atingir uma diminuição de 50% na concentração após a interrupção de uma contínua, infusão de estado estacionário, o CSHT é um meio de normalizar o comportamento farmacocinético das drogas para que comparações racionais possam ser feitas em relação ao deslocamento previsto do efeito da droga. O CSHT é, portanto, focado na cinética de “back-end de infusão”.
O painel inferior da (Fig.3) é uma simulação de CSHT para opioides comumente usados. Para a maioria das drogas, o CSHT muda com o tempo. Assim, para infusões breves, a cinética final prevista para as várias drogas não difere muito (o remifentanil é uma notável exceção a essa regra geral). À medida que o tempo de infusão aumenta, os CSHTs começam a se diferenciar, fornecendo uma base racional para a seleção do medicamento. Em segundo lugar, dependendo da duração desejada do efeito opioide, drogas de ação mais curta ou mais longa podem ser escolhidas. Finalmente, as formas dessas curvas diferem dependendo do grau de declínio de concentração necessário. Em outras palavras, as curvas que representam o tempo necessário para atingir uma diminuição de concentração de 20% ou 80% (por exemplo, as simulações de tempo de diminuição de 20% ou 80%) são bastante diferentes.(8) Assim, dependendo da técnica de anestesia aplicada , as simulações de CSHT não são necessariamente as simulações clinicamente relevantes (ou seja, uma redução de 50% pode não ser a meta clínica). Além disso, a simulação de CSHT para morfina não leva em conta os metabólitos ativos (consulte a discussão posterior de medicamentos individuais em “Características exclusivas de opioides individuais”).

- Fig.3 Farmacocinética dos opioides. Simulações ilustrando o comportamento farmacocinético front-end e back-end após administração por injeção em bolus ou infusões contínuas de morfina, fentanil, alfentanil, sufentanil e remifentanil usando parâmetros farmacocinéticos da literatura (ver texto para detalhes).(9-12,45)
Farmacodinâmica
Na maioria dos aspectos, os opioides μ-agonistas podem ser considerados iguais farmacodinâmicos com importantes diferenças farmacocinéticas; ou seja, os efeitos terapêuticos e adversos são essencialmente os mesmos. Sua eficácia como analgésico e sua propensão a produzir depressão ventilatória são indistinguíveis uma da outra. Existem diferenças farmacodinâmicas com mecanismos de receptores não opioides, como a liberação de histamina.
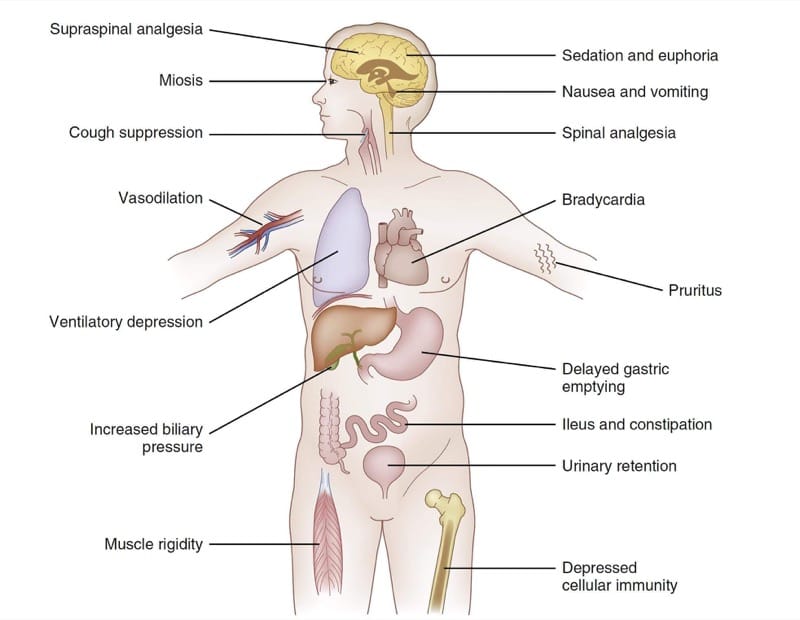
Como o sistema nervoso influencia profundamente a função de todo o corpo, os efeitos farmacodinâmicos dos μ-agonistas opióides são observados em muitos sistemas de órgãos. A Fig.4 resume os principais efeitos farmacodinâmicos dos congêneres do fentanil. Dependendo das circunstâncias clínicas e dos objetivos clínicos do tratamento, alguns desses efeitos generalizados podem ser vistos como terapêuticos ou adversos. Por exemplo, em alguns cenários clínicos, a sedação produzida por μ-agonistas pode ser vista como um objetivo da terapia. Em outros, a sonolência seria claramente considerada um efeito adverso.

- Fig. 4 Farmacodinâmica dos opioides. Um gráfico resumido dos efeitos selecionados dos congêneres do fentanil (consulte o texto para obter detalhes).
Efeitos Terapêuticos
O alívio da dor é o principal efeito terapêutico dos analgésicos opioides. Atuando nos receptores μ espinhais e cerebrais, os opióides fornecem analgesia tanto atenuando o tráfego nociceptivo da periferia quanto alterando a resposta afetiva à estimulação dolorosa centralmente.
Os μ-Agonistas são mais eficazes no tratamento de sensações de “segunda dor” transmitidas por fibras C não mielinizadas de condução lenta; eles são menos eficazes no tratamento de sensações de “primeira dor” (transportadas por pequenas fibras A-delta mielinizadas) e dor neuropática. Um aspecto único da analgesia induzida por opioides (em contraste com drogas como anestésicos locais) é que outras modalidades sensoriais não são afetadas (por exemplo, toque, temperatura, entre outras).
No perioperatório (certamente no intraoperatório), a sonolência produzida pelos μ-agonistas também é um dos efeitos direcionados. O cérebro é o substrato anatômico para a ação sedativa dos μ-agonistas. Com doses crescentes, os μ-agonistas eventualmente produzem sonolência e sono (o alívio da dor sem dúvida contribui para a promoção do sono em pacientes desconfortáveis tanto no pré quanto no pós-operatório). Com doses suficientes, os μ-agonistas produzem atividade de onda delta pronunciada no eletroencefalograma, que se assemelha ao padrão observado durante o sono natural.
É claro que os μ-Agonistas podem produzir alívio significativo da dor por meio de doses que não produzem sono. Esta é a base clínica para seu uso no tratamento da dor em pacientes ambulatoriais. No entanto, a administração de doses adicionais eventualmente produz sonolência (e, como consequência, a incapacidade de solicitar doses adicionais) e é a base científica essencial para a segurança dos dispositivos de PCA (ver também o Capítulo manejo da dor perioperatória). No entanto, mesmo grandes doses de opioides não produzem de forma confiável falta de resposta e amnésia e, portanto, os opioides não podem ser vistos como anestésicos completos quando usados sozinhos.
Os opioides também suprimem o reflexo da tosse por meio dos centros da tosse na medula. Presumivelmente, a atenuação do reflexo da tosse torna menos provável a tosse e a resistência contra o tubo endotraqueal interno.
Efeitos adversos

A depressão da ventilação é o principal efeito adverso associado aos fármacos μ-agonistas. Quando a via aérea é assegurada e a ventilação controlada no intraoperatório, a depressão da ventilação induzida por opioides tem pouca consequência. No entanto, a depressão respiratória induzida por opioides no período pós-operatório pode levar a lesão cerebral e morte.
Os μ-Agonistas alteram a resposta ventilatória às concentrações arteriais de dióxido de carbono no centro de controle ventilatório na medula. A depressão da ventilação é mediada pelo receptor μ; Camundongos μ-receptores knock-out não exibem depressão respiratória pela morfina.(14)
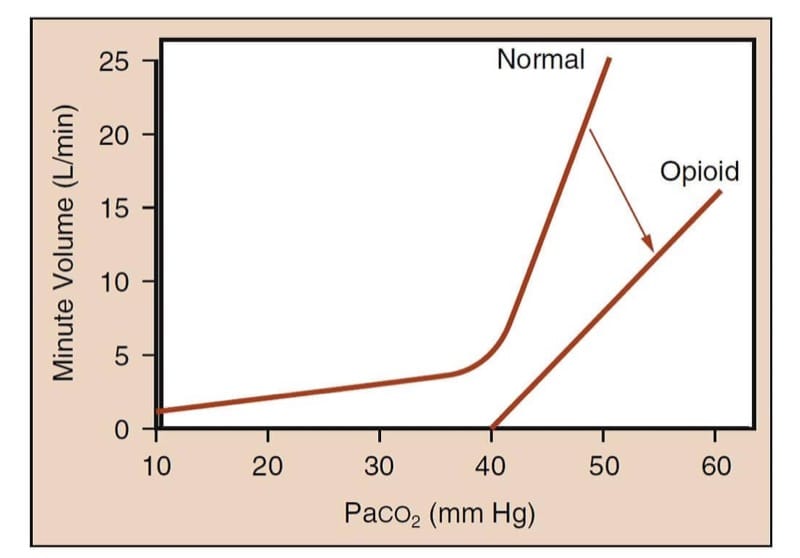
Em humanos não medicados, aumentos na pressão parcial de dióxido de carbono arterial aumentam acentuadamente o volume minuto (Fig.5). Sob a influência de analgésicos opioides, a curva é achatada e deslocada para a direita para uma determinada pressão parcial de dióxido de carbono e refletindo que o volume minuto é menor.(15) Mais importante, a forma de “taco de hóquei” da curva normal é perdida ; ou seja, pode haver uma pressão parcial de dióxido de carbono abaixo da qual o paciente não respirará (ou seja, o “limiar apneico”) na presença de opioides.

- Fig.5 Metodologia do estudo da depressão ventilatória induzida por opioides. O método caracteriza a relação entre Paco2 e volume minuto. A curva denominada “Normal” representa a resposta esperada do volume minuto aos níveis crescentes de Paco2 em um ser humano acordado. Observe o aumento dramático no volume minuto à medida que a tensão de CO2 aumenta. A curva denominada “Opioide” representa a resposta atenuada do volume minuto ao aumento dos níveis de CO2 após a administração de um opioide. Observe que a inclinação da curva diminui e a curva não tem mais o formato de um “taco de hóquei”; isso significa que, em níveis fisiológicos de Paco2, o paciente que recebe opioide suficiente pode apresentar apneia ou hipoventilação grave. (Adaptado de Gross JB. Quando você inspira, você inspira, quando NÃO respira, você... expira: novos insights sobre a depressão ventilatória induzida por opioides. Anesthesiology. 2003;99:767-770, usado com permissão .)
Os sinais clínicos de ventilação deprimida são bastante sutis com doses moderadas de opioides. Pacientes pós-operatórios recebendo terapia analgésica opióide podem estar acordados e alertas e, ainda assim, ter um volume minuto significativamente diminuído. A frequência respiratória (muitas vezes associada a um volume corrente ligeiramente aumentado) também diminui. À medida que a concentração de opioides aumenta, a frequência respiratória e o volume corrente diminuem progressivamente, culminando eventualmente em um ritmo ventilatório irregular e, então, em apnéia completa.
Muitos fatores podem aumentar o risco de depressão ventilatória induzida por opioides. Fatores de risco claros incluem grande dose de opioides, idade avançada, uso concomitante de outros depressores do sistema nervoso central (SNC) e insuficiência renal (para morfina). O sono natural também aumenta o efeito depressor ventilatório dos opioides.(16)
Os opioides podem alterar a fisiologia cardiovascular por uma variedade de mecanismos diferentes. Comparados a muitos outros fármacos anestésicos (p. ex., propofol, anestésicos voláteis), no entanto, os efeitos cardiovasculares dos opioides, particularmente os congêneres do fentanil, são relativamente mínimos (morfina e meperidina são exceções — consulte a seção a seguir sobre fármacos individuais).
Os congêneres do fentanil causam bradicardia por aumentar diretamente o tônus do nervo vago no tronco encefálico, que experimentalmente pode ser bloqueado por microinjeção de naloxona no núcleo do nervo vago ou por vagotomia periférica.(17,18)
Os opioides também produzem vasodilatação pela depressão dos centros vasomotores no tronco encefálico e, em menor extensão, por um efeito direto nos vasos. Essa ação diminui a pré-carga e a pós-carga. As reduções na pressão sanguínea arterial são mais pronunciadas em pacientes com tônus simpático aumentado, como pacientes com insuficiência cardíaca congestiva ou hipertensão. Doses clínicas de opioides não alteram apreciavelmente a contratilidade miocárdica.
Os opioides podem induzir rigidez muscular, geralmente pela administração rápida de grandes doses em bolus dos congêneres do fentanil. Essa rigidez pode até mesmo tornar a ventilação por bolsa e máscara durante a indução da anestesia quase impossível devido à rigidez e fechamento das cordas vocais.(19) O aparecimento de rigidez tende a coincidir com o início da falta de resposta.(20) Embora o mecanismo de opioide- A rigidez muscular induzida é desconhecida, não é uma ação direta no músculo porque pode ser eliminada pela administração de drogas bloqueadoras neuromusculares.
A constrição pupilar induzida por μ-agonistas pode ser um sinal diagnóstico útil indicando algum efeito opioide em andamento. Os opioides estimulam o núcleo de Edinger-Westphal do nervo oculomotor a produzir miose. Mesmo pequenas doses de opioides provocam essa resposta e muito pouca tolerância ao efeito se desenvolve. Assim, a miose é um indicador útil, embora inespecífico, de exposição a opioides, mesmo em pacientes tolerantes a opioides. A constrição pupilar induzida por opioides é reversível pela naloxona.
Os opioides têm efeitos importantes na fisiologia gastrointestinal. Os receptores opioides estão localizados em todo o plexo entérico do intestino. A estimulação desses receptores por opioides causa contração tônica do músculo liso gastrointestinal, diminuindo assim as contrações peristálticas coordenadas. Clinicamente, essa contração resulta em esvaziamento gástrico retardado e volumes gástricos presumivelmente maiores em pacientes recebendo terapia com opioides no pré-operatório. No pós-operatório, os pacientes podem desenvolver íleo induzido por opioides, o que pode potencialmente atrasar a retomada da nutrição adequada e a alta do hospital. Uma extensão desse problema agudo é a constipação crônica associada à terapia opióide de longo prazo.
Efeitos semelhantes são observados no sistema biliar, que também possui uma abundância de μ-receptores. Os μ-Agonistas podem produzir contração do músculo liso da vesícula biliar e espasmo do esfíncter de Oddi, potencialmente causando um colangiograma falsamente positivo durante a cirurgia da vesícula biliar e do ducto biliar. Esses efeitos são completamente reversíveis pela naloxona e podem ser parcialmente revertidos pelo tratamento com glucagon.
Embora os efeitos urológicos sejam mínimos, os opioides às vezes podem causar retenção urinária, diminuindo o tônus do detrusor da bexiga e aumentando o tônus do esfíncter urinário. Esses efeitos são, em parte, mediados centralmente, embora os efeitos periféricos também sejam prováveis devido à presença generalizada de receptores opioides no trato geniturinário.(21,22) Embora a retenção urinária associada à terapia com opioides não seja tipicamente pronunciada, ela pode ser problemática em homens , particularmente quando o opioide é administrado por via intratecal ou epidural.
Os opioides deprimem a imunidade celular. A morfina e o opioide endógeno β-endorfina, por exemplo, inibem a transcrição da interleucina 2 em células T ativadas, entre outros efeitos imunológicos.(23) Opioides individuais (e talvez classes de opioides) podem diferir em termos de natureza e extensão exatas de seus efeitos imunomoduladores. Embora o comprometimento da imunidade celular induzido por opioides não seja bem compreendido, a cicatrização prejudicada, as infecções perioperatórias e a recorrência do câncer são possíveis resultados adversos.
Interações medicamentosas
As interações medicamentosas podem ser baseadas em dois mecanismos: farmacocinético (isto é, quando um medicamento influencia a concentração do outro) ou farmacodinâmico (isto é, quando um medicamento influencia o efeito do outro). Na prática anestésica, embora às vezes ocorram interações farmacocinéticas não intencionais, as interações farmacodinâmicas ocorrem com praticamente todos os anestésicos e muitas vezes são produzidas intencionalmente.
A interação farmacocinética mais comum na farmacologia clínica dos opioides é observada quando os opioides intravenosos são combinados com propofol. Talvez devido às alterações hemodinâmicas induzidas pelo propofol e seu impacto nos processos farmacocinéticos, as concentrações de opioides podem ser maiores quando administrados em combinação com uma infusão contínua de propofol.(24)
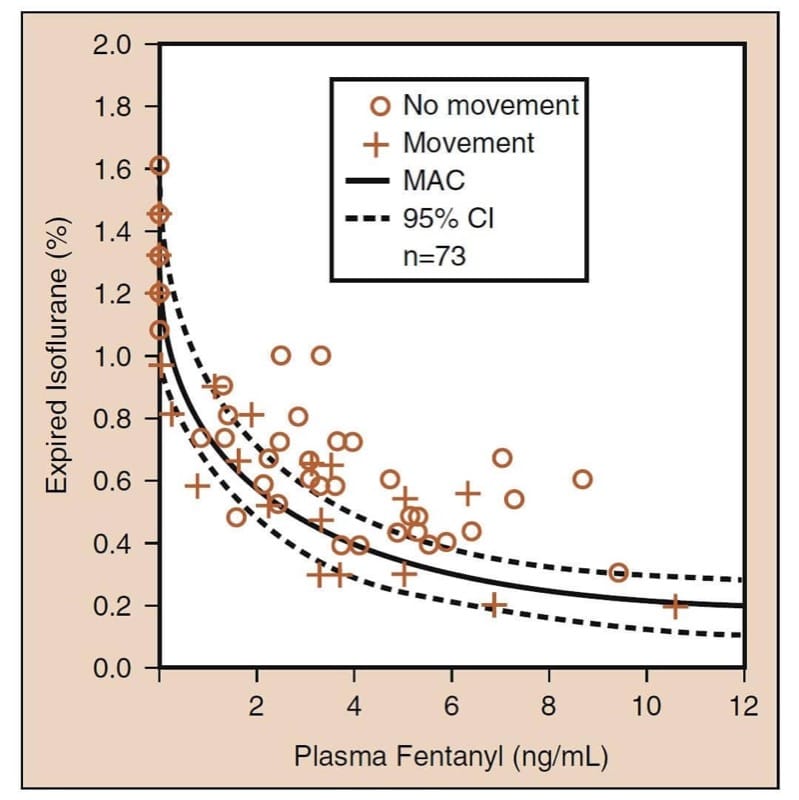
A interação medicamentosa farmacodinâmica mais importante envolvendo opioides é a interação sinérgica que ocorre quando os opioides são combinados com sedativos. (25) Quando combinados com anestésicos voláteis, os opioides reduzem a concentração alveolar mínima (CAM) de um anestésico volátil (Fig.6). O exame cuidadoso dos dados de “redução de MAC de opioide” revela vários conceitos clinicamente críticos (ver Fig.6). Primeiro, os opioides reduzem sinergicamente o MAC. Em segundo lugar, a redução do MAC é substancial (até 75% ou mais). Em terceiro lugar, a maior parte da redução da CAM ocorre em níveis moderados de opioides (ou seja, mesmo doses modestas de opioides reduzem substancialmente a CAM). Quarto, a redução da MAC não é completa (isto é, os opioides não são anestésicos completos). A adição do opioide não pode eliminar completamente a necessidade do outro anestésico. E quinto, há um número infinito de combinações de hipnóticos-opioides que atingirão a MAC (isso implica que os médicos devem escolher a combinação ideal com base nos objetivos do anestésico e da operação). Todos esses conceitos também se aplicam quando os opioides são usados em combinação com propofol para TIVA. (26)

- Fig.6 Redução da concentração alveolar mínima (CAM) do anestésico volátil por opioides: o exemplo protótipo de isoflurano e fentanil. A curva sólida é MAC; as curvas pontilhadas são os intervalos de confiança (ICs) de 95% (consulte o texto para obter detalhes). (Adaptado de McEwan AI, Smith C, Dyar O, et al. Redução da concentração alveolar mínima de isoflurano por fentanil. Anesthesiology. 1993;78:864-869, usado com permissão.)
Populações Especiais
Insuficiência Hepática
Embora o fígado seja o principal órgão metabólico responsável pela biotransformação da maioria dos opioides, a insuficiência hepática geralmente não é grave o suficiente para ter um grande impacto na farmacocinética dos opioides. Obviamente, a fase anepática do transplante ortotópico de fígado é uma exceção notável a essa regra geral (consulte também o Capítulo transplante de órgãos). Com a administração contínua do medicamento, as concentrações de opioides que dependem do metabolismo hepático aumentam quando o paciente não tem fígado. Mesmo após a ressecção parcial do fígado, ocorre um aumento na proporção de glicuronídeos de morfina para morfina, indicando uma diminuição na taxa de metabolismo da morfina.(27) Como o metabolismo do remifentanil não está relacionado aos mecanismos de depuração hepática, sua disposição não é afetada durante o transplante hepático .(28)
Considerações farmacodinâmicas podem ser importantes para a terapia com opioides em pacientes com doença hepática grave. Pacientes com encefalopatia hepática em curso são especialmente vulneráveis aos efeitos sedativos dos opioides. Como consequência, essa classe de medicamentos deve ser usada com cautela nessa população de pacientes.
Falência renal
A insuficiência renal tem implicações de grande importância clínica em relação à morfina e à meperidina (ver a discussão a seguir sobre drogas individuais). Para os congêneres do fentanil, a importância clínica da insuficiência renal é muito menor. O metabolismo do remifentanil não é afetado pela doença renal. (29)
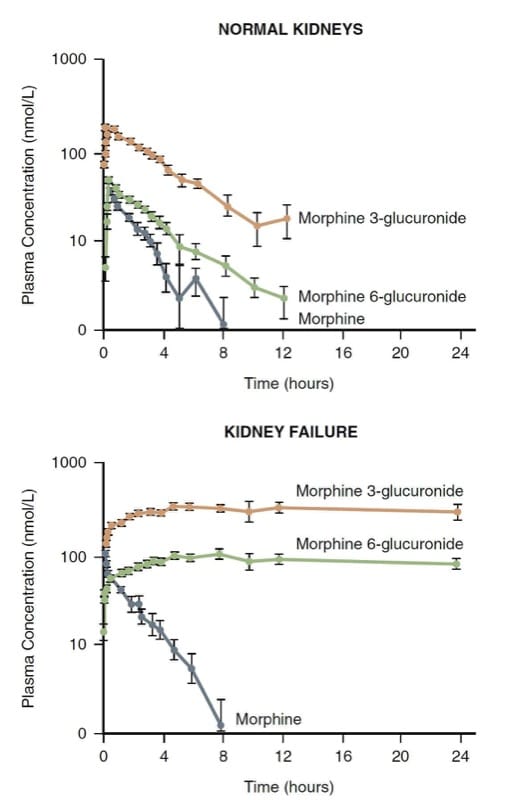
A morfina é principalmente metabolizada por conjugação no fígado; os glicuronídeos hidrossolúveis resultantes (ou seja, morfina 3-glicuronídeo e morfina 6-glicuronídeo – M3G e M6G) são excretados pelos rins. O rim também desempenha um papel na conjugação da morfina e pode ser responsável por até metade de sua conversão em M3G e M6G.
O M3G é inativo, mas o M6G é um analgésico com uma potência que rivaliza com a morfina. Níveis muito elevados de M6G e depressão respiratória com risco de vida podem se desenvolver em pacientes com insuficiência renal (Fig. 7). (30) Consequentemente, a morfina pode não ser uma boa escolha em pacientes com mecanismos de depuração renal gravemente alterados.
A farmacologia clínica da meperidina também é significativamente alterada pela insuficiência renal. Normeperidina, o principal metabólito, tem efeitos analgésicos e excitatórios do SNC que variam de ansiedade e tremores a mioclonia e convulsões francas. Como os metabólitos ativos estão sujeitos à excreção renal, a toxicidade do SNC secundária ao acúmulo de normeperidina é especialmente preocupante em pacientes com insuficiência renal. Esta deficiência da meperidina fez com que muitos formulários hospitalares restringissem seu uso ou a removessem completamente do formulário.

- Fig.7 A farmacocinética da morfina e seus metabólitos em voluntários normais versus pacientes com insuficiência renal. Observe o acúmulo significativo dos metabólitos na insuficiência renal. (Adaptado de Osborne R, Joel S, Grebenik K, et al. A farmacocinética da morfina e dos glicuronídeos da morfina na insuficiência renal. Clin Pharmacol Ther. 1993;54:158-167, usado com permissão.)
Gênero
O gênero pode ter uma influência importante na farmacologia dos opioides. A morfina é mais potente em mulheres do que em homens e tem início de ação mais lento em mulheres.(31) Algumas dessas diferenças podem estar relacionadas a hormônios gonadais cíclicos e fatores psicossociais.
Idade
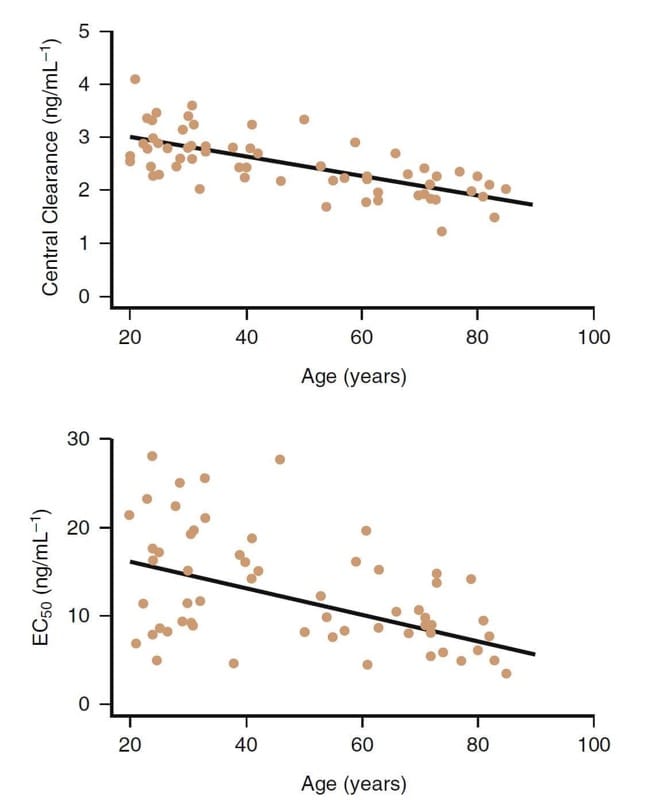
O avanço da idade é claramente um fator importante que influencia a farmacologia clínica dos opioides. Por exemplo, os congêneres do fentanil são mais potentes em pacientes idosos (Fig.8).(32,33) Diminuições na depuração e no volume de distribuição central também ocorrem em pacientes idosos.
Com a idade avançada, embora as alterações farmacocinéticas também desempenhem um papel, as diferenças farmacodinâmicas são as principais responsáveis pela diminuição da necessidade de dose em pacientes idosos (> 65 anos de idade). As doses de remifentanil devem ser reduzidas em pelo menos 50% ou mais em pacientes idosos. Reduções de dosagem semelhantes também são prudentes para os outros opioides.

- Fig.8 A influência da idade na farmacologia clínica do remifentanil. Embora haja uma variabilidade considerável, em geral, os indivíduos mais velhos têm uma depuração central mais baixa e uma potência mais alta (ou seja, menor EC50).32
Obesidade
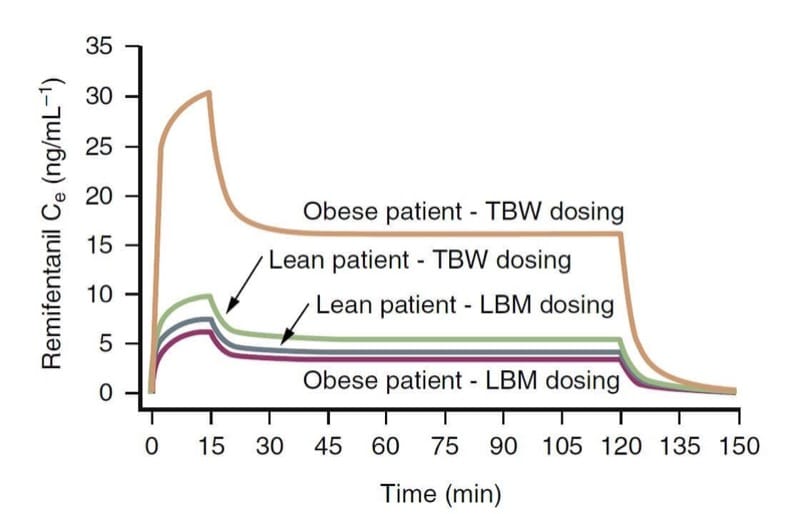
O peso corporal é provavelmente um fator importante que influencia a farmacologia clínica dos opioides. As variáveis farmacocinéticas dos opioides, especialmente a depuração, estão mais intimamente relacionadas à massa corporal magra (LBM) do que ao peso corporal total (TBW). Em termos práticos, isso significa que pacientes obesos mórbidos requerem uma dosagem maior do que pacientes magros para atingir a mesma concentração alvo, mas não tanto quanto seria sugerido por seu TBW. (34)
Por exemplo, conforme ilustrado por meio de simulação farmacocinética (Fig. 9), um esquema de dosagem baseado em TBW resulta em concentrações muito maiores no local de efeito do remifentanil do que um cálculo de dosagem baseado em LBM.(35) Em contraste, os esquemas de dosagem TBW e LBM resultam em concentrações semelhantes para pacientes magros. Esses conceitos provavelmente também se aplicam a outros opioides.

- Fig.9 Uma simulação farmacocinética ilustrando as consequências do cálculo da dosagem de remifentanil com base no peso corporal total (TBW) ou massa corporal magra (LBM) em pacientes obesos e magros (1 μg/kg de injeção em bolus seguida por uma infusão de 0.5 μg/kg /min por 15 minutos e 0.25 μg/kg/min por mais 105 minutos). Observe que a dosagem baseada em TBW em um paciente obeso resulta em concentrações dramaticamente mais altas. (Adaptado de Egan TD, Huizinga B, Gupta SK, et al. Farmacocinética do remifentanil em pacientes obesos versus magros. Anesthesiology. 1998;89:562-573, usado com permissão.)
Características únicas de opioides individuais
Codeína
A codeína, embora não seja comumente utilizada no intraoperatório, tem importância especial entre os opioides devido à nuance farmacogenômica bem caracterizada a ela associada. A codeína é na verdade uma pró-droga; a morfina é o composto ativo. A codeína é metabolizada (em parte) pela O-desmetilação em morfina, um processo metabólico mediado pela isoforma microssomal hepática CYP2D6.(36) população caucasiana) ou cujo CYP2D6 está inibido (p. (10)
Morfina
A morfina é o protótipo de opioide com o qual todos os recém-chegados são comparados. Não há evidências de que qualquer opioide sintético seja mais eficaz no controle da dor do que a morfina natural. Se não fosse pela liberação de histamina e consequente hipotensão associada à morfina, o fentanil talvez não tivesse substituído a morfina como o opioide mais comumente usado no intraoperatório.
A morfina tem um tempo de início lento. O pKa da morfina a torna quase completamente ionizada em pH fisiológico. Essa propriedade e sua baixa lipossolubilidade explicam a latência prolongada da morfina até o efeito máximo; a morfina penetra lentamente no SNC. Esse recurso tem vantagens e desvantagens associadas a ele. A latência prolongada até o efeito máximo significa que a morfina talvez tenha menos probabilidade de causar depressão respiratória aguda após a injeção em bolus de doses típicas de analgésicos em comparação com os opioides de ação mais rápida. Por outro lado, o tempo de início lento significa que os médicos talvez tenham maior probabilidade de “empilhar” inapropriadamente múltiplas doses de morfina em um paciente com dor intensa, criando assim o potencial para um “excesso” tóxico.
O metabólito ativo da morfina, M6G, tem importantes implicações clínicas. Embora a conversão para M6G represente apenas 10% do metabolismo da morfina, o M6G pode contribuir para os efeitos analgésicos da morfina mesmo em pacientes com função renal normal, particularmente com uso prolongado. Devido à alta taxa de extração hepática da morfina, a biodisponibilidade da morfina administrada por via oral é significativamente menor do que após a injeção parenteral. O efeito de primeira passagem hepática na morfina administrada por via oral resulta em altos níveis de M6G. De fato, M6G pode ser o principal composto ativo quando a morfina é administrada por via oral.(40) Conforme observado na seção anterior, “Insuficiência Renal”, o acúmulo de M6G em níveis potencialmente tóxicos em pacientes em diálise é outra implicação importante desse metabólito ativo.
Fentanil
O fentanil pode ser o opioide mais importante usado na prática anestésica moderna. Como o congênere original do fentanil, sua aplicação clínica está bem estabelecida e altamente diversificada. O fentanil pode ser fornecido de várias maneiras. Além da via intravenosa, o fentanil pode ser administrado pelas vias transdérmica, transmucosa, transnasal e transpulmonar.
A administração transmucosa oral de citrato de fentanil (OTFC) resulta na obtenção mais rápida de níveis de pico mais altos do que quando a mesma dose é ingerida. (41) Evitar o efeito de primeira passagem resulta em biodisponibilidade substancialmente maior. O fato de o OTFC ser não invasivo e de início rápido tornou-o uma terapia bem-sucedida para dor irruptiva em pacientes com câncer tolerantes a opioides, muitas vezes em combinação com um adesivo transdérmico de fentanil (consulte também o Capítulo 40).
Alfentanil
O alfentanil foi o primeiro opioide a ser administrado quase que exclusivamente por infusão contínua. Devido à sua meia-vida terminal relativamente curta, previa-se originalmente que o alfentanil teria um rápido efeito compensatório após o término de uma infusão contínua.(42) Avanços subsequentes no conhecimento farmacocinético (ou seja, o CSHT) provaram que essa afirmação era falsa.( 8) No entanto, o alfentanil é de fato um fármaco de ação curta após uma única injeção em bolus por causa de sua alta “fração difusível”; atinge rapidamente as concentrações máximas no local de efeito e depois começa a declinar (consulte a discussão anterior sobre “Farmacocinética”). O alfentanil ilustra como um medicamento pode exibir diferentes perfis farmacocinéticos, dependendo do método de administração (ou seja, bolus versus infusão contínua). O alfentanil, mais do que o fentanil ou o sufentanil, apresenta metabolismo hepático imprevisível devido à significativa variabilidade interindividual do CYP3A4 hepático, a principal enzima responsável pela biotransformação do alfentanil.
Sufentanil
A característica distintiva do sufentanil é que ele é o opioide mais potente comumente usado na prática anestésica. Por ser intrinsecamente mais eficaz no receptor opioide, as doses absolutas usadas são muito menores em comparação com outras drogas menos potentes (por exemplo, 1000 vezes menos que as doses de morfina).
Remifentanil
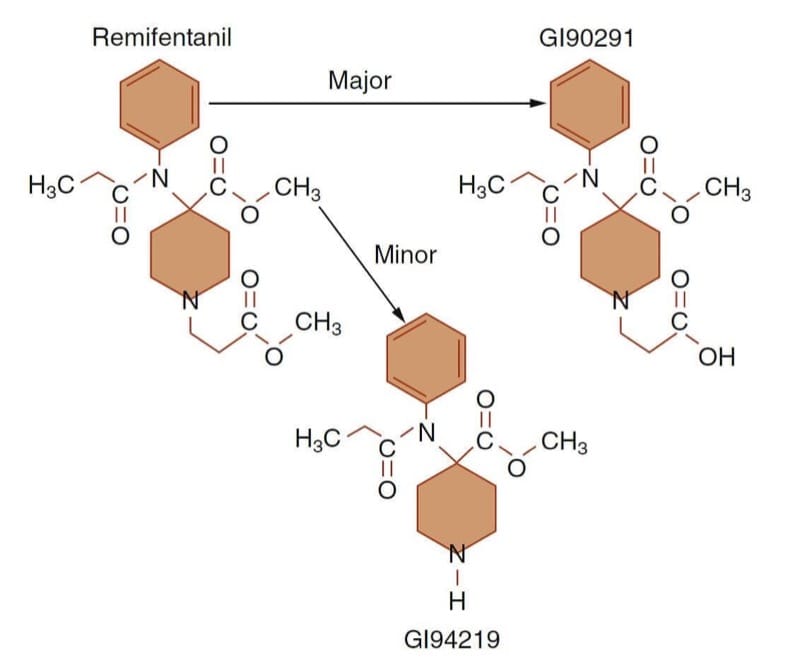
O remifentanil é um exemplo de protótipo de como objetivos clínicos específicos podem ser alcançados ao projetar moléculas com relações especializadas estrutura-atividade (ou estrutura-metabolismo). Ao perder sua atividade agonista do receptor μ após a hidrólise do éster, resulta um opioide de ação muito curta (Fig.10). (43) A percepção da necessidade não atendida que motivou o desenvolvimento do remifentanil foi ter um opioide com início e término rápidos para que o medicamento pudesse ser titulado para cima e para baixo conforme necessário para atender às necessidades dinâmicas do paciente durante as condições de rápida mudança da anestesia e da cirurgia.
Em comparação com os congêneres do fentanil atualmente comercializados, o CSHT do remifentanil é curto, da ordem de cerca de 5 minutos. (44) Farmacodinamicamente, o remifentanil exibe uma latência curta para o efeito de pico semelhante ao alfentanil e uma potência ligeiramente menor que o fentanil. (45)
O papel do remifentanil na prática anestésica moderna está relativamente bem estabelecido. O remifentanil talvez seja mais adequado para os casos em que seu perfil farmacocinético responsivo pode ser explorado com vantagem (por exemplo, quando uma recuperação rápida é desejável; quando a necessidade anestésica flutua rapidamente; quando a titulação de opióides é imprevisível ou difícil ou quando há um perigo substancial para o uso de opióides superdose ou quando uma técnica de opioide em “grande dose” é vantajosa, mas o paciente não será ventilado mecanicamente no pós-operatório).(46) A aplicação clínica mais comum do remifentanil é o fornecimento de TIVA em combinação com propofol. Também é comumente administrado por um bolus intravenoso quando apenas um pulso muito breve de efeito opioide seguido de recuperação rápida é desejado (p.

- Fig.10 Via metabólica do remifentanil. A desesterificação (ou seja, hidrólise do éster) por esterases plasmáticas e teciduais inespecíficas em um metabólito ácido inativo (GI90291) é responsável pela grande maioria do metabolismo do remifentanil. (Adaptado de Egan TD, Huizinga B, Gupta SK, et al. Farmacocinética do remifentanil em pacientes obesos versus magros. Anesthesiology. 1998;89:562-573, usado com permissão.)
Antagonistas-Agonistas Opioides e Antagonistas Puros
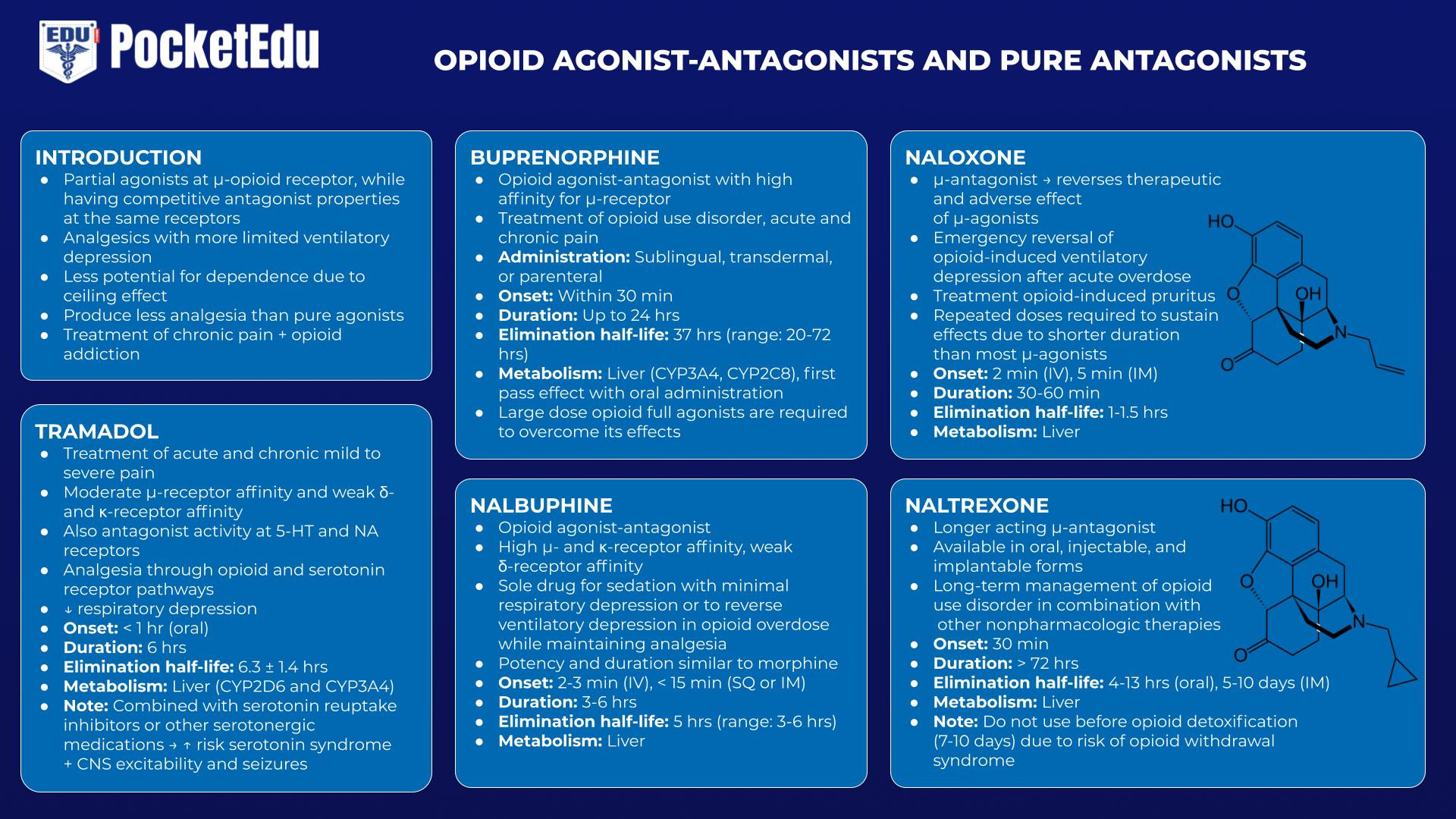
Os agonistas-antagonistas opioides agem como agonistas parciais no receptor μ, embora tenham propriedades antagonistas competitivas nos mesmos receptores. Essas drogas atuam como analgésicos com depressão ventilatória mais limitada e menor potencial de dependência, pois demonstram um “efeito teto”, produzindo menos analgesia em comparação com os agonistas puros. O menor potencial de abuso foi a principal necessidade não atendida percebida subjacente ao desenvolvimento dessas drogas. Os medicamentos desta categoria são usados para o tratamento da dor crônica, bem como para o tratamento da dependência de opioides. Esses fármacos causam algum grau de antagonismo competitivo quando administrados na presença de atividade agonista total contínua (p. ex., quando administrados após morfina e outros agonistas puros). Os antagonistas opióides puros, dos quais a naloxona é o protótipo, são antagonistas competitivos completos do receptor opióide, desprovidos de qualquer atividade agonista. Esses antagonistas puros são usados no tratamento da overdose aguda de opioides e abuso crônico.
tramadol
O tramadol é um analgésico de ação central com afinidade moderada para os receptores μ e fraca afinidade para os receptores κ e δ. Notavelmente, o tramadol também tem atividade antagonista nos receptores 5-hidroxitriptamina (5-HT) e acetilcolina nicotínica (NA). Embora forneça analgesia por meio dos receptores opioides e serotoninérgicos, o tramadol acarreta menos risco de depressão respiratória. No entanto, quando combinado com inibidores da recaptação de serotonina ou outros medicamentos serotoninérgicos, acarreta o risco de síndrome serotoninérgica e também de excitabilidade do SNC e convulsões.(47)
buprenorfina
A buprenorfina é um agonista-antagonista opioide com alta afinidade pelo receptor μ. Pode ser administrado por via sublingual, transdérmica ou parenteral, mas sofre extenso metabolismo hepático de primeira passagem com a administração oral. Embora doses moderadas possam ser usadas para tratar a dor crônica, doses mais altas usadas no tratamento da dor crônica podem antagonizar os efeitos de outros opioides, dificultando o tratamento da dor aguda sobre a crônica. Como se liga aos receptores opioides com alta afinidade e sua meia-vida de eliminação está na faixa de 20 a 72 horas, são necessários agonistas totais opioides em grandes doses para superar seus efeitos.(48)
Nalbufina
Também um agonista-antagonista opioide, a nalbufina tem uma potência e duração de ação semelhantes à morfina. Pode ser usado como medicamento único para sedação com depressão respiratória mínima, bem como medicamento para reverter a depressão ventilatória em overdose de opioides, mantendo alguma analgesia.(49)
Naloxona/Naltrexona
A naloxona é um μ-antagonista injetável que reverte os efeitos terapêuticos e adversos dos μ-agonistas.(50) A indicação mais comum da naloxona é a reversão de emergência da depressão ventilatória induzida por opioides após superdosagem aguda. Seu importante papel nesse sentido mereceu a inclusão da naloxona na “Lista de Medicamentos Essenciais” da Organização Mundial da Saúde. A naloxona às vezes é usada em doses muito menores durante a emergência da anestesia para restaurar o esforço ventilatório adequado e, assim, acelerar a extubação da traquéia. O tratamento do prurido induzido por opioides (que requer apenas pequenas doses) é outra aplicação terapêutica comum.
Embora a naloxona seja muito eficaz na reversão da depressão ventilatória associada aos opioides, ela apresenta inúmeros efeitos adversos, incluindo síndrome de abstinência aguda, náuseas, vômitos, taquicardia, hipertensão, convulsões e edema pulmonar, entre outros.(51) Reconhecendo que a duração da naloxona a ação é mais curta do que a maioria dos μ-agonistas é um ponto-chave na determinação do esquema de dosagem; doses repetidas podem ser necessárias para sustentar seus efeitos.
Em resposta à epidemia de abuso de opioides nos Estados Unidos, foram desenvolvidos novos sistemas de distribuição destinados ao uso emergencial por leigos em caso de overdose de opioides; estes incluem spray nasal e preparações de autoinjeção.(52,53)
A naltrexona, um μ-antagonista opióide de ação mais longa disponível nas formas oral, injetável e implantável, é usada no tratamento de longo prazo de viciados em opióides em combinação com outras terapias não farmacológicas. (54)
3. APLICAÇÃO CLÍNICA
Os opioides desempenham um papel vital em praticamente todas as áreas da prática anestésica. No tratamento da dor pós-operatória, os opioides são de primordial importância, enquanto na maioria dos outros cenários da medicina perioperatória, os opioides são adjuvantes terapêuticos usados em combinação com outras drogas.
Indicações clínicas comuns
A analgesia pós-operatória é a indicação mais antiga para terapia com opioides na prática anestésica. Na era moderna, a administração de opioides por meio de dispositivos PCA talvez seja o modo de administração mais comum. Nos últimos anos, os opioides são cada vez mais combinados no pós-operatório com vários outros analgésicos, como os antiinflamatórios não esteroides (AINEs), para aumentar a eficácia e a segurança.
Internacionalmente, a indicação clínica mais comum para opioides na prática anestésica é seu uso para o que se conhece como anestesia balanceada. Esse termo talvez equivocado conota o uso de múltiplas drogas (por exemplo, anestésicos voláteis, bloqueadores neuromusculares, sedativos-hipnóticos e opioides) em doses menores para produzir o estado de anestesia. Com essa técnica, os opioides são usados principalmente por sua capacidade de diminuir a CAM. Uma suposição básica subjacente a essa abordagem anestésica balanceada é que as drogas usadas em combinação atenuam as desvantagens das drogas individuais (ou seja, os anestésicos voláteis) usadas em doses maiores como terapia medicamentosa única.
A “anestesia com opioides em grandes doses”, uma técnica originalmente descrita para morfina nos primeiros dias da cirurgia de coração aberto (55) e posteriormente associada aos congêneres do fentanil, (56) é outra aplicação comum de opioides na anestesia clínica. O fundamento científico original dessa abordagem era que grandes doses de opioides permitiam ao clínico reduzir ao mínimo a concentração de anestésico volátil, evitando assim a depressão miocárdica direta e outros efeitos hemodinâmicos indesejáveis em pacientes cujos sistemas cardiovasculares já estavam comprometidos. Além disso, o fentanil frequentemente produz uma bradicardia relativa que pode ser útil em pacientes com isquemia miocárdica. Embora o conceito geral ainda seja aplicado, atualmente as doses de opioides utilizadas são menores. Os opioides também são administrados por seus possíveis efeitos benéficos em termos de cardioproteção (ou seja, pré-condicionamento).
TIVA é uma indicação mais recentemente desenvolvida e cada vez mais popular para opioides na prática anestésica. Esta técnica depende inteiramente de drogas intravenosas para a aplicação de anestesia geral. Mais comumente, infusões contínuas de remifentanil ou alfentanil são combinadas com uma infusão de propofol. Tanto o opioide quanto o sedativo são frequentemente administrados por bombas ativadas por infusão controlada por alvo (TCI). Uma clara vantagem dessa técnica, talvez entre outras, é o maior bem-estar do paciente no período pós-operatório imediato, incluindo menos náuseas e vômitos e muitas vezes uma sensação de euforia. (57)
Seleção e Administração Racionais de Medicamentos
Ao articular uma base científica para a seleção racional de opioides, as considerações farmacocinéticas são extremamente importantes. De fato, os μ-agonistas (opióides) podem ser considerados iguais farmacodinâmicos com importantes diferenças farmacocinéticas.(58) Assim, a seleção racional de um μ-agonista opióide em detrimento de outro requer que o clínico identifique o perfil temporal desejado do efeito da droga e então escolha um opioide que melhor permite ao clínico alcançá-lo (dentro de restrições óbvias, como preocupações farmacoeconômicas).
Ao selecionar o opioide apropriado, entre as principais questões a serem abordadas estão: Com que rapidez o efeito opioide desejado deve ser alcançado? Por quanto tempo o efeito opioide deve ser mantido? Quão crítico é que a depressão ventilatória ou sedação induzida por opioides se dissipe rapidamente (por exemplo, o paciente será ventilado mecanicamente no pós-operatório)? A capacidade de aumentar e diminuir o nível do efeito opioide rapidamente durante o anestésico é crítica? Haverá dor significativa no pós-operatório que exigirá tratamento com opioides? Todas essas questões estão relacionadas ao perfil temporal ideal do efeito opioide. As respostas a essas perguntas são abordadas por meio da aplicação de conceitos farmacocinéticos.
Por exemplo, quando um breve pulso de efeito opioide seguido de recuperação rápida é desejado (por exemplo, para fornecer analgesia para um bloqueio retrobulbar), um bolus de remifentanil ou alfentanil pode ser preferido. Quando se deseja um efeito opioide duradouro, como quando haverá dor pós-operatória significativa ou quando a traqueia permanecerá intubada, uma infusão de fentanil é uma escolha prudente. Se o paciente estiver acordado e alerta logo após o término do procedimento (por exemplo, uma craniotomia na qual os cirurgiões esperam realizar um exame neurológico na sala de cirurgia imediatamente após a cirurgia), uma infusão de remifentanil pode ser vantajosa.
A formulação de uma estratégia de administração racional também requer a aplicação adequada dos princípios farmacocinéticos. Um objetivo importante de qualquer esquema de dosagem é alcançar e manter um nível estável de efeito opioide. Atualmente, para atingir uma concentração estável no local de ação, os opioides são frequentemente administrados por infusão contínua. Isso é cada vez mais realizado por meio do uso da tecnologia TCI, que exige que o clínico esteja familiarizado com o modelo farmacocinético apropriado para o opioide de interesse. Quando esses sistemas não estiverem disponíveis, o clínico deve lembrar que as infusões devem ser precedidas por um bolus para chegar a um estado quase estacionário em tempo hábil.
4. DESENVOLVIMENTOS EMERGENTES
Opioides e recorrência do câncer
A influência da terapia com opioides na recorrência do câncer é controversa. Como os efeitos imunossupressores dos opioides (particularmente a morfina) e seu impacto na angiogênese foram demonstrados em estudos com animais e in vitro, surgiu a preocupação com a influência dessas drogas na recorrência e sobrevida do câncer. Alguns dados retrospectivos iniciais comparando as taxas de recorrência do câncer em pacientes que receberam analgesia opióide pós-operatória padrão com aqueles que receberam técnicas alternativas (por exemplo, controle da dor epidural) sugeriram uma taxa mais frequente de recorrência do câncer no grupo de terapia com opióides; outros estudos encontraram resultados conflitantes. Uma revisão retrospectiva de mais de 34,000 pacientes com câncer de mama de 1996 a 2008 não demonstrou nenhuma associação entre a terapia com opioides e a recorrência do câncer. (59) Da mesma forma, uma revisão retrospectiva de 819 pacientes com carcinoma hepatocelular que receberam fentanil intravenoso pós-operatório ou epidural pós-operatória com morfina não encontrou efeito na sobrevida livre de recorrência.(60)
No entanto, outros estudos sugeriram alguns resultados melhores com técnicas poupadoras de opioides. Uma revisão de 984 pacientes com câncer de pulmão de células não pequenas de 2006 a 2011 encontrou melhora na sobrevida e maior sobrevida livre de doença em estratégias de controle da dor poupadoras de opioides. (61) Portanto, o papel da terapia com opioides no perioperatório na recorrência do câncer permanece controverso; os ensaios em andamento refinarão ainda mais a tomada de decisões clínicas relacionadas à anestesia no tratamento de pacientes oncológicos.
Epidemia de abuso de opioides
As mortes relacionadas ao abuso e desvio de opioides prescritos dispararam nos Estados Unidos e em outros lugares. (62) Além das fatalidades, esse padrão generalizado de prescrição e abuso ilícito de opioides resultou em um grande aumento nas admissões em instalações de tratamento de abuso de opioides. (63) A tendência pode ser devida, pelo menos em parte, às práticas de prescrição de opioides para condições de dor crônica que podem predispor alguns pacientes ao vício. (64,65)
A epidemia atingiu um nível tão crítico que as autoridades governamentais federais e estaduais dos EUA promulgaram legislação e reservaram fundos para apoiar a pesquisa, a prevenção e o tratamento do problema. (66,67) A dispensação de naloxona baseada em farmácia aprovada pelo estado (sem receita médica) para pacientes com prescrição de opioides é um exemplo notável dos esforços apoiados por essa legislação. (68) Além disso, as sociedades profissionais e os Centros de Controle e Prevenção de Doenças (CDC) produziram novas diretrizes para a prescrição de opioides. (69) Esta é atualmente uma área de intensa discussão pública e investigação médica.
5. PERGUNTAS DO DIA
- Um paciente requer analgesia controlada pelo paciente (PCA) pós-operatória. Do ponto de vista farmacocinético, quais são as vantagens relativas do fentanil em comparação com a morfina para uso em PCA?
- Qual parâmetro farmacocinético é mais adequado para descrever o tempo de compensação de uma infusão contínua de opioides?
- Quais são os efeitos dos opioides na ventilação minuto e na resposta ventilatória ao dióxido de carbono?
- Como a insuficiência renal afeta a farmacocinética da morfina e da meperidina?
- Um paciente com depressão respiratória pós-operatória devido à morfina recebe naloxona intravenosa. Quais são os possíveis efeitos colaterais da naloxona?
- Quais questões-chave devem ser abordadas ao selecionar um opioide para uso intraoperatório?