贝伦·德·何塞·玛丽亚、吕克·蒂伦斯和史蒂夫·罗伯茨
儿童硬膜外麻醉
引言
除全身麻醉外,硬膜外镇痛通常用于处理术后疼痛。 硬膜外镇痛有效缓解术后疼痛有许多好处,包括更早的行走、促进从呼吸机脱机、减少分解代谢状态的时间以及降低循环压力激素水平。 用于单次注射技术的硬膜外针头和用于连续硬膜外麻醉的导管的精确放置可确保选择性地阻塞手术过程中涉及的皮区,从而可以使用较低剂量的局部麻醉剂,并避免在不需要的区域进行不必要的阻塞。 进入硬膜外腔可以在尾部、腰部或胸部水平。
解剖学和生理学意义
与成人相比,儿童在使用椎管内麻醉时应考虑到显着的解剖学差异。 例如,在新生儿和婴儿中,与成人相比,脊髓圆锥位于脊柱下方(大约在 L3 椎骨处),在成人中,它位于大约 L1 椎骨处。 这是婴儿脊髓和骨性脊柱之间生长速度不同的结果。 然而,在大约 1 岁时,脊髓圆锥达到与成人相似的 L1 水平。
NYSORA 小贴士
- 在新生儿和婴儿中,脊髓圆锥大约在 L3 水平结束,而在成人中,它大约位于 L1 椎骨处。
- 大约 1 岁时,脊髓圆锥达到 L1 水平,与成人相似。
与成年人相比,儿童的骶骨也更加平坦和狭窄。 出生时,由五块骶椎组成的骶骨板并未完全骨化,并继续融合到大约 8 岁(尽管可能需要到 21 岁)。 骶骨闭锁的发生率为6%。 骶椎弓的不完全融合形成骶裂孔。 婴儿和儿童可以通过骶裂孔轻松进入尾部硬膜外腔。 由于骶管顶的不断发展,骶裂孔有相当大的变异。 在幼儿中,骶裂孔比年龄较大的儿童更位于头侧,硬膜囊可能更靠尾:4岁以下的婴儿在S1,年龄较大的儿童在S2。 因此,由于意外硬脑膜穿刺的风险增加,在婴儿中放置尾部阻滞时需要谨慎。
NYSORA 小贴士
- 在幼儿中,骶裂孔的位置比年龄较大的儿童更靠近头部,并且硬脑膜囊可能更靠近尾部(小于 4 岁的婴儿在 S1 处)。
- 由于存在硬脑膜穿刺的风险,因此在婴儿中使用尾端阻滞时应谨慎。
对年幼儿童的椎管内结构进行超声 (US) 评估的挑战性较小,因为骨化较不发达。 在婴儿中,使用线性高频超声探头很容易识别脊髓纤维、脑脊液 (CSF) 和硬脑膜。 也有人提出,儿童硬膜外脂肪的密度低于成人。 松散的硬膜外脂肪可以促进局部麻醉剂的扩散并帮助实现更快的阻滞起效。 它还可以使硬膜外导管从硬膜外腔尾部畅通无阻地推进到腰椎和胸椎水平。 然而,导管尖端的最终放置最好在美国指导下直接监测,或通过识别局部麻醉剂的注射来间接监测。
与成人 (4 mL/kg) 相比,新生儿和婴儿的单位体重 CSF 量 (2 mL/kg) 更高,并且 CSF 主要位于椎管内。 此外,新生儿的脊髓仍然是无髓鞘的,这意味着可以有效使用较低浓度的局麻药。由于与成人相比,儿童的心输出量更高,因此局麻药的全身吸收发生得更快。 这可能导致有毒的血浆水平和更短的阻滞持续时间。
NYSORA 小贴士
- 与年龄较大的儿童相比,新生儿的骶骨裂孔更多位于头侧,硬膜囊末端较低,增加了意外硬膜穿刺的风险。
- 超声成像可用于评估椎管内解剖结构和硬膜外腔的方法。
儿童硬膜外麻醉的局部麻醉
由于大多数儿科患者接受硬膜外镇痛和全身麻醉,硬膜外导管的主要目的是提供足够的局部麻醉溶液,以实现有效的术中和术后镇痛。 与成人硬膜外麻醉一样,局麻药浓度和体积是决定阻滞密度和水平的重要因素。 然而,在儿科患者中,了解药物总剂量对于避免局麻药毒性也很重要。 对局部麻醉剂溶液、其特性和潜在毒性的更详细描述已在 局麻药的临床药理学.
布比卡因、罗哌卡因和左布比卡因是儿童椎管内麻醉最常用的局部麻醉剂。 利多卡因不经常使用,因为它过度的运动阻滞。 一般来说,高浓度的局部麻醉剂,例如 0.5% 布比卡因或 0.5% 罗哌卡因,很少用于儿童硬膜外阻滞。 相反,更大量更稀释的局部麻醉剂更常用于覆盖多个皮区。 在预测尾部阻滞后局麻药的扩散方面,体重通常比患者年龄具有更好的相关性。 布比卡因的最大安全剂量为 2.5 mg/kg。 对于尾部使用,布比卡因的最佳浓度为 0.125%–0.175%。 与 0.25% 制剂相比,该浓度提供了相似的术后镇痛持续时间(4-8 小时),但运动阻滞更少。 一些临床医生更喜欢按体积/重量给药。 1.0 mL/kg 稀释溶液(例如 0.125% 布比卡因)至最大体积 20 mL 的剂量有时可以提供 T10 感觉阻滞,而不会超过文献中推荐的最大水平。 在婴儿中,可以给予更高的容量,例如 1.25 mL/kg 甚至 1.5 mL/kg,以提供更多的头侧阻滞,而没有局部麻醉剂毒性的风险。 对于连续硬膜外输注,普遍接受的布比卡因剂量指南是新生儿 0.2 mg/kg/h,大龄儿童 0.4 mg/kg/h。 即使在局部麻醉溶液输注率较低的情况下,累积毒性也是一个问题。 因此,新生儿硬膜外输注的持续时间应限制在 48 小时内。
罗哌卡因的治疗指数高于较老的局部麻醉剂布比卡因。 在低浓度下,与布比卡因相比,罗哌卡因可产生较少的运动阻滞和等效的镇痛作用,同时降低心脏和中枢神经系统毒性的发生率。 由于其可能的血管收缩特性,罗哌卡因的全身吸收可能比布比卡因慢。 当肝功能受损的儿童使用长时间的局部麻醉剂输注时,这可能具有临床意义。 对于单次注射尾端阻滞,建议推注 1 mL/kg 0.2% 罗哌卡因。 婴儿输注 0.1% 罗哌卡因 0.2 mg/kg/h 和年龄较大儿童 0.4 mg/kg/h,持续时间不超过 48 小时,也被证明是有效和安全的。
左旋布比卡因是布比卡因的 S (-)-异构体,与消旋布比卡因相比,引起心肌抑制和致死性心律失常的可能性较小,对中枢神经系统的毒性也较小。 尾部注射 0.8 mL/kg 的 0.25% 左布比卡因剂量可为接受阴茎或腹股沟手术的儿童提供镇痛作用。 对于连续硬膜外输注,左布比卡因的剂量与消旋布比卡因的剂量相似。
NYSORA 小贴士
- 不建议在儿科人群中使用高浓度的局部麻醉剂,例如 0.5% 布比卡因或 0.5% 罗哌卡因。 由于髓鞘形成不完全,较低浓度的氨基酰胺局部麻醉剂是有效的(例如,0.125% 左布比卡因)。
- 相反,更大体积的更稀释的局部麻醉剂更常用于覆盖多个感兴趣的皮区。
- 在儿科患者中,体重比患者年龄在预测尾部阻滞后局麻药扩散方面提供了更好的相关性。
- 对 20 公斤以下的儿童进行尾部单次注射的简单规则是使用 0.125%–0.175% 的布比卡因或 0.2% 的罗哌卡因,并推注以下药物之一:
- 0.5 ml/kg 达到骶骨手术水平
- 1.0 ml/kg 达到高腰椎手术水平
- 1.25 ml/kg 达到低胸外科手术水平
- 对于连续硬膜外输注,通常使用 0.125% 布比卡因,新生儿 0.2 mg/kg/h,大龄儿童 0.4 mg/kg/h。 罗哌卡因 0.1%,新生儿 0.2 mg/kg/h,大龄儿童 0.4 mg/kg/h,持续 48 小时已被证明是一种有效且安全的方案。
儿童硬膜外麻醉的辅助剂
单次注射局部麻醉的尾部阻滞主要用于小手术,因为其镇痛持续时间有限。 佐剂可用于延长阻滞的持续时间,并且已经试验了几种药物。 最常用的局部麻醉剂佐剂是肾上腺素。 浓度为 1:200,000 的肾上腺素用于降低局部麻醉剂的吸收率,并具有作为无意血管内注射的可能标志物的额外好处。 最近的研究集中在使用多种佐剂。 咪达唑仑和新斯的明也进行了研究; 然而,没有证据表明这些药物在硬膜外给药时具有任何镇痛作用。 阿片类药物、可乐定和氯胺酮都值得更多考虑,因此将更详细地讨论。
阿片类药物
硬膜外阿片类药物可增强局麻药的效果并延长镇痛时间。 然而,由于可能导致呼吸抑制和其他不可接受的副作用(例如,恶心和呕吐、瘙痒、尿潴留),一些阿片类药物可能不适合在门诊使用。 因此,儿童尾部硬膜外阿片类药物的使用应仅限于门诊以外的特殊临床情况。 对于更广泛或疼痛的手术以及术后留置导尿管的患者,建议使用 2 mcg/kg 的芬太尼单次注射尾部麻醉以及标准局部麻醉溶液。 将 1-2 mcg/mL 芬太尼添加到 0.1% 布比卡因中用于连续硬膜外输注也已成功用于儿童在受良好监控的住院环境中。 然而,芬太尼不应用于新生儿硬膜外输注。硬膜外吗啡也可用于接受腹部或胸部大手术的住院患者。 当添加到单次注射尾部硬膜外阻滞时,由于其嘴部分散(因为吗啡是一种亲水分子),它将提高阻滞水平。 尾端吗啡的剂量在 30–90 mcg/kg 不等,具体取决于手术类型。 硬膜外吗啡存在呼吸抑制的潜在风险; 因此,建议使用较低剂量的尾部吗啡进行连续脉搏血氧饱和度测定,而对于中等剂量则必须进行连续脉搏血氧饱和度测定。 当使用较高剂量的尾部吗啡时,必须计划术后进入重症监护室。
可乐定
在儿童硬膜外阻滞中使用的各种非阿片类药物辅助剂中,可乐定的效果最好。 可乐定是一种 α1 激动剂,通过刺激下行的去甲肾上腺素髓质脊髓通路发挥作用,抑制脊髓背角伤害性神经递质的释放。 加用可乐定(1-5 mcg/kg)可提高单次注射尾部阻滞局麻药的镇痛效果,延长局麻药的作用时间,而不会出现硬膜外阿片类药物的不良副作用。 对于连续硬膜外输注,使用可乐定0.1 mcg/kg/h,效果良好。 应该注意的是,较高剂量与镇静和血流动力学不稳定有关,表现为低血压和心动过缓。 推注剂量为 2 mcg/kg,这些副作用是不寻常的。 此外,硬膜外可乐定会减弱对呼气末二氧化碳 (PCO2) 水平升高的通气反应。 尽管呼吸抑制似乎不是一个常见问题,但在接受由 1 mL/kg 0.2% 罗哌卡因和 2 mcg/kg 可乐定组成的尾部阻滞的足月新生儿中报告了呼吸暂停。 在非常年幼的婴儿中使用可乐定时应谨慎,因为可能会引起镇静和低血压。
氯胺酮
在单次注射尾端阻滞中加入 S-氯胺酮可延长局部麻醉剂的镇痛作用。 氯胺酮的主要缺点是其拟心理作用。 然而,在小剂量(0.25–0.5 mg/kg)下,氯胺酮是有效的,没有明显的行为副作用。 氯胺酮 1 mg/kg 也可单独用作有效的尾部镇痛剂,无需添加局部麻醉剂溶液。 S (+)-氯胺酮 (0.5–1 mg/kg) 和可乐定 (1 或 2 mcg/kg) 的组合已被证明可在儿童腹股沟疝切开术后提供有效的镇痛作用,持续时间较长(> 20 小时)没有任何不利的中枢神经系统 (CNS) 影响或运动障碍。 关于在新生儿中使用氯胺酮的一个担忧与一系列有争议的动物研究有关,这些研究表明氯胺酮可以在发育中的大脑中产生凋亡性神经变性。 其他婴儿动物研究表明,氯胺酮可能具有神经保护作用。 然而,许多麻醉师不愿将尾侧 S-氯胺酮引入其常规临床实践,而氯胺酮不太可能在无防腐剂配方的国家广泛采用。
与硬膜外麻醉相关的并发症
如果使用适当的技术,单次注射或连续硬膜外阻滞的主要并发症很少见。
神经损伤
一项大型前瞻性研究总结了超过 15,000 个儿童中央阻滞的数据,报告没有永久性神经损伤发生率,并得出结论认为并发症的发生率很低。 然而,在 1995 年发表的另一份大型回顾性报告中报告了 24,000 名婴儿死亡和另外 XNUMX 起截瘫和四肢瘫痪的发生率,其中有超过 XNUMX 例儿童硬膜外阻滞。 该研究还报告了两例一过性感觉异常。 尽管总体风险似乎很低,但脊髓直接损伤可能会发生破坏性并发症,尤其是在胸椎和高位腰椎硬膜外针放置时。 此外,低血压会影响脊髓灌注。 由于硬膜外针头和导管的放置通常是在患者处于镇静或全身麻醉状态下进行的,因此昏迷患者无法报告疼痛或感觉异常(目前公认的针头侵入脊髓的警告信号)这一事实引起了人们的关注。 建议在进行椎管内阻滞时保持患者自主呼吸作为一种安全措施。 强烈建议对可用的椎管内解剖结构进行术前超声扫描,以评估硬膜外腔的深度。
一份关于阑尾切除术全身麻醉下单次胸腔硬膜外麻醉后脊髓损伤的病例报告强调了常规评估放置胸腔硬膜外麻醉以进行较小范围手术的风险收益比的重要性。 尤其是胸腔和高位腰椎硬膜外置管应仅用于广泛的胸腔和腹部手术,并应由具有胸腔硬膜外置管经验的麻醉师执行。以尽量减少脊髓损伤的风险(以及硬脑膜的风险)穿刺),了解硬膜外腔的预期深度很重要。 作为一般规则,体重超过 10 kg 的儿童的硬膜外腔为 1 mm/kg 体重。 还有其他基于患者体重或年龄的公式来计算这个深度。 然而,最好的选择是通过对椎管解剖进行术前超声成像来测量深度(表1)
NYSORA 小贴士
作为一般规则,体重超过 10 kg 的儿童的硬膜外腔位于 1 mm/kg 体重的深度。 然而,术前超声成像有助于确定硬膜外腔的深度。
表1。 确定皮肤硬膜外腔深度的公式。
| 请注意: | 单独的术前超声评估是确定皮肤硬膜外腔深度的首选方法。 |
| 1.粗略估计:1毫米/公斤体重 | |
| 2. 深度 (cm) = 1 + (0.15 × 年龄) | |
| 3.深度(cm)=0.8+(0.05×重量公斤) |
硬膜外血肿
儿童硬膜外镇痛相关的硬膜外血肿很少见。 这可能是因为儿科患者在围手术期很少使用抗凝方案。 尽管如此,对于有临床显着凝血功能障碍或血小板减少症的患者,应避免硬膜外镇痛。 成人患者使用硬膜外麻醉的指南也应适用于接受抗血栓形成或溶栓治疗的儿科患者。
感染
尽管与尾部硬膜外导管相关的总体感染率似乎很低,但存在与儿童硬膜外导管相关的感染的孤立病例报告。 与腰椎硬膜外导管相比,由于骶骨裂孔靠近直肠,长期使用尾部放置的导管会引起导管感染。 尽管研究没有发现尾侧入路感染率更高的临床证据,但据报道细菌定植率更高。 表皮葡萄球菌是定植在腰部和尾部硬膜外的皮肤和导管上的主要微生物。 在尾导管的尖端也发现了革兰氏阴性细菌。 即使使用广泛使用的单次注射尾端阻滞,仍可能发生骶骨骨髓炎等感染。 为了降低粪便和尿液污染的风险,可以使用导管隧道和用封闭敷料沿头侧固定导管等技术。 还应使用严格的无菌技术,包括使用无菌封闭输液系统,并应注意避免局部组织损伤。 每日检查敷料和进入部位也很重要,但除非绝对必要,否则不应更换敷料。 如果孩子出现不明原因的持续发热超过 38°C,则应取出导管并送去培养。
硬膜穿刺和硬膜穿刺后头痛
如果要小心避免将针头推入骶管太远,则在尾部硬膜外镇痛期间刺穿硬膜并不常见。 使用实时超声成像来控制针头位置使这种风险极低。 硬膜穿刺后头痛 (PDPH) 的治疗包括卧床休息、口服或静脉内 (IV) 水化、镇痛(例如,常规对乙酰氨基酚、非甾体抗炎药 [NSAID])和止吐药。 卧床休息虽然减轻了头痛的严重程度,但对 PDPH 的发生率或持续时间没有影响。
在成人中,咖啡因已被用于预防和治疗 PDPH。 咖啡因通过阻断腺苷受体引起脑血管收缩,腺苷受体在被激活时会扩张血管。 减少脑血流量会减少大脑中的血量,并可能减少对疼痛敏感的颅内结构的牵引力,从而缓解 PDPH。 然而,咖啡因并不经常用于儿童缓解 PDPH,最佳剂量尚不清楚。自 1960 年以来,使用硬膜外血贴治疗 PDPH 已在成人中成功使用。现在有许多报道称其成功用于治疗孩子们也一样。 硬膜外血液贴片被认为是有效的,因为通过注入的血液在硬脑膜孔上形成凝胶状覆盖物。 在短期内,硬膜外血液补片通过 CSF 颅骨移位的占位效应和增加颅内容量和压力来封闭孔并缓解 CSF 低血压。 真正的治愈是在较长时期内发生的。 在儿童中,如果可能,建议在清醒或轻度镇静的患者中注射约 0.3 mL/kg 自体血,以检测神经根症状的出现。 关于 PDPH 的更完整的讨论见 硬膜穿刺后头痛.
血流动力学效应和全脊髓麻醉
准确实施硬膜外镇痛后,儿科患者的血压显着变化并不常见。 已发现对 T6 进行高交感神经单次注射尾部阻滞不会引起儿童心率、心脏指数或血压的显着变化。 即使当胸部硬膜外阻滞与全身麻醉相结合时,其他健康儿科患者的心血管稳定性通常也能保持。 因此,低血压应引起对全脊髓麻醉和/或血管内注射导致局麻药毒性的怀疑。 排除这些并发症后,应评估其他原因,如水合状态、血管内充盈压、正性肌力状态和麻醉深度。
如果发生全脊髓麻醉,必须提供支持性措施,直到阻滞作用消失。 然而,如果发生危及生命的全脊髓麻醉延长,如果尝试的支持性措施既无效也无选择,则可以考虑将脑脊液灌洗作为最后的操作。 一份病例报告表明,可以通过硬膜外导管抽取 20-30 mL 的 CSF 并用 30-40 mL 无防腐剂的生理盐水、乳酸林格氏液或 Plasmalyte 代替。 这种干预可以缩短恢复时间,最大限度地减少潜在的神经毒性损伤,并减少硬膜穿刺后的发生率。 然而,鉴于脑脊液灌洗的经验和信息有限,在将这种技术用于儿童之前,应根据具体情况评估潜在风险和益处。
NYSORA 小贴士
- 其他健康儿童的硬膜外麻醉和镇痛很少引起心血管不稳定。
- 低血压的发生应引起对全脊髓麻醉和/或血管内注射导致局麻药毒性的怀疑。
- 排除这些并发症后,应评估其他原因,如水合状态、血管内充盈压、正性肌力状态和麻醉深度。
局麻药全身毒性
局麻药全身毒性 (LAST) 通常源于意外的血管内注射到硬膜外血管。 这种并发症通常可以通过仔细抽吸和测试剂量来避免。 表2 总结了硬膜外阻滞试验剂量的建议。 对于单次注射尾端阻滞,使用尖头针时更容易发生血管穿刺和局麻药吸收。 对于连续硬膜外输注,新生儿和非常年幼的婴儿比年龄较大的儿童面临更大的局部麻醉毒性风险。 据报道,在接受持续输注局部麻醉剂的儿童中出现癫痫发作。 这可以通过使用局部麻醉剂的稀释溶液(≤ 0.125% 布比卡因)和遵循当前的剂量建议来避免(参见上文“用于儿童硬膜外麻醉的局部麻醉剂”)。
更重要的是,在硬膜外镇痛给药期间的警惕监测应该是一个优先事项。 LAST 治疗指南应在所有使用局部麻醉剂的医院区域易于获取。 接受硬膜外输注的患者所在病房的所有人员都应接受 LAST 症状识别和治疗方面的培训。 此外,每个病例中使用的区域技术和输液的完整记录应与患者的观察表一起提供。
表2。 测试硬膜外阻滞的剂量。
| 1. | 常规使用测试剂量,即使所有可用药物的测试剂量不是 100% 敏感。 此外,由于血管内植入的真实发生率相对较低,大多数阳性测试(即心率增加)将是假阳性。 当出现临界反应时,重复测试剂量会增加测试的特异性和敏感性。 |
| 2. | 持续监测心电图,反复循环血压袖带。 对于含有肾上腺素的溶液,如果心率不增加,血压升高应引起血管内放置的怀疑。 |
| 3. | 当儿童处于非常轻的麻醉平面或有刺激时(例如,将患者重新定位在手术台上、气道器械、切口),避免进行测试给药。 在这些条件下执行测试剂量会增加假阳性、刺激引起的心率或血压升高的可能性。 |
| 4. | 在测试剂量后,应递增施用全剂量的剩余部分。 递增剂量和持续监测有助于增加检测到血管内放置的几率,以及在给予全部心脏抑制剂剂量之前停止进一步注射的几率。 |
| 5. | 只要有可能,在硬膜外阻滞的放置和初始给药期间,让患者保持自主通气。 患者呼吸模式的任何变化都表明可能发生了不慎的血管内或鞘内注射:注射时出现呼吸急促; 如果局部麻醉剂被全身吸收,则呼吸抑制; 如果已在鞘内施用局部麻醉剂,则由全脊髓麻醉引起的呼吸急促随后呼吸缓慢。 |
其他不利影响
在一项基于来自 286 名儿科患者的前瞻性收集数据的回顾性研究中,瘙痒 (26.1%)、恶心和呕吐 (16.9%) 和尿潴留 (20.8%) 是使用布比卡因进行硬膜外麻醉时最常见的副作用和芬太尼。 镇静和过度阻滞分别发生在不到 2% 的患者中。 呼吸抑制的发生率为 4.2%,但对于严重的呼吸抑制从未需要使用纳洛酮。 如果尾针角度太陡,可能会发生直肠穿孔。 表3 总结了针对常见不良反应的推荐治疗方法。
表3。 硬膜外阻滞效果的推荐治疗总结。
| 瘙痒 | |
| 1. 排除和/或更正其他可补救的原因。 | |
| 2. 使用低剂量纳洛酮输注、部分激动剂-拮抗剂(如纳布啡)或抗组胺药。 | |
| 3. 如果瘙痒持续,从硬膜外输液中取出阿片类药物,并考虑使用可乐定。 | |
| 恶心 | |
| 1. 排除和/或更正其他可补救的原因。 | |
| 2. 使用 5-HT 拮抗剂(如昂丹司琼、多拉司琼) | |
| 3. 使用低剂量纳洛酮输液或纳布啡 | |
| 4. 避免在输液中使用阿片类药物,并考虑使用可乐定。 | |
| 肠梗阻和肠功能障碍 | |
| 1. 排除和/或更正其他可补救的原因。 | |
| 2. 如果没有其他禁忌,给予泻药。 | |
| 3. 避免在输液中使用阿片类药物,并考虑使用可乐定。 | |
| 4. 使用低剂量纳洛酮输液或纳布啡。 | |
| 5. 使用外周或肠内限制性阿片拮抗剂; 例如,甲基纳曲酮或alvimopan(目前正在研究中)。 | |
| 镇静或换气不足 | |
| 1. 排除和/或更正其他可补救的原因。 | |
| 2. 根据严重程度,减少或保持阿片类药物或可乐定的剂量。 | |
| 3. 唤醒、刺激和鼓励深呼吸。 | |
| 4. 如果严重,根据需要考虑纳洛酮或辅助通气。 | |
| 尿retention留 | |
| 1. 排除和/或更正其他可补救的原因。 | |
| 2. 如果有替代品,请避免使用抗胆碱能药或抗组胺药。 | |
| 3. 使用低剂量纳洛酮输液或纳布啡。 | |
| 4. 使用膀胱导尿术。 | |
儿科手术的硬膜外阻滞:技术
硬膜外镇痛可以通过单次注射或连续输注技术进行。 针头和导管可以插入到尾部、腰部或胸部水平。 硬膜外技术的主要目标是将针头和/或导管准确定位在硬膜外腔中。 吸入试验和试验剂量表明可能是无意的血管内或鞘内给药。 除了传统的 X 射线成像外,还开发了硬膜外刺激、硬膜外心电图 (ECG) 和超声技术,以帮助准确放置硬膜外针头或导管。
确认正确的硬膜外针或导管放置
吸入和测试剂量
在局部麻醉剂注射之前进行的抽吸测试用于避免全脊髓和血管内注射。 然而,血液或脑脊液的负向吸入不应被视为正确放置针头和导管的绝对指标。 静脉很小,抽吸时很容易塌陷; 因此,建议使用 2 mL 注射器,缓慢吸液,并考虑打开空气以寻找自由流动。
在将局部麻醉剂注入尾部空间时,应持续监测患者的心电图。 注射肾上腺素试验剂量 (25 mcg/kg) 后的 ECG 特异性变化(即 T 波增加 > 0.5%)有助于预测血管内注射。
如果可能,在硬膜外阻滞的放置和初始给药期间,应使患者保持自主通气。 患者呼吸模式的任何变化都预示着可能会意外发生某些事情:如果局部麻醉剂被全身吸收,则呼吸抑制; 如果注射疼痛,呼吸急促; 如果有局部麻醉剂的宫内给药,则呼吸急促,然后呼吸缓慢(见 表2). 表4 总结了确认硬膜外导管放置的各种方法。
表4。 确认硬膜外导管位置。
| 术中(当患者处于全身麻醉状态时) |
| 1. 强烈建议使用超声检查来评估局部麻醉剂在导管尖端或硬膜外腔内的扩散情况。 |
| 2. 确保负向愿望; 通过导管缓慢注入局部麻醉剂; 并评估对手术的反应。 如果可能,保持自主通气。 |
| 3. 造影剂。 |
| 4. 电刺激和/或心电图技术。 |
| 术后(当患者清醒时,无论他或她是否可以做出口头回应) |
| 1.超声检查是目前推荐的方法。 这是无痛的,可以在 PACU 中完成,而不会过多地打扰孩子。 |
| 2.如果没有US,可以用氯普鲁卡因试验。 这涉及增加剂量的氯普鲁卡因 3% 溶液以证明镇痛(通过自我报告或适当的行为测量)和节段效应的迹象: 一个。 腰椎导管尖端: • 双腿至少有部分感觉和运动阻滞 • 脚趾掌面变暖 湾。 下胸导管尖端: • 髋关节屈曲强度降低 • 腹部皮肤反射减弱 • 心率和血压有所降低 C。 上胸导管尖端: • 心率和血压有所降低 • 手的掌面变暖 • 单侧或双侧霍纳综合征 |
射线照相方法
X 射线成像结合造影剂可精确识别特定脊柱水平的导管尖端。
然而,没有对比的 X 光片无法区分无意的鞘内或硬膜下导管放置与正确的硬膜外放置。 此外,除非使用透视,否则标准 X 射线不允许麻醉师在插入期间调整导管的位置。 虽然透视允许实时监测和调整前进的导管,但它需要额外的设置,导致费用增加,并增加患者对电离辐射的暴露。 因此,不常规推荐透视,通常仅限于困难和/或特殊情况,例如长期硬膜外导管放置以治疗癌症疼痛。
硬膜外刺激试验(Tsui 试验)和硬膜外心电图技术
低电流电刺激试验(Tsui 试验; 图1) 建议在插入过程中监测和引导硬膜外导管的位置。 该设置要求神经刺激器的阴极引线(黑色表示阻滞)通过电极适配器连接到硬膜外导管,而阳极引线连接到患者皮肤上的电极作为接地点。 为了避免对刺激反应的误解(例如,局部肌肉收缩可能与硬膜外刺激相混淆),接地电极放置在胸硬膜外的下肢和腰部硬膜外的上肢。 硬膜外导管尖端(距神经根 1-2 cm)的正确放置由 1 mA 和 10 mA 之间的电流引起的运动反应指示。 在阈值电流显着降低 (< 1 mA) 下观察到的运动反应表明导管位于蛛网膜下腔或硬膜下腔或靠近神经根。 尽管慢性脊髓刺激是一种安全有效的疼痛管理手段,但这种硬膜外刺激试验的安全性尚不完全清楚。 然而,预计该测试造成短暂间歇性电刺激的风险很小。 表5 根据运动反应和电流总结了不同的导管位置。
表5。 电刺激试验。
| 导管位置 | 运动反应 | 电流 |
|---|---|---|
| 皮下 | 不包含 | > 10毫安 |
| 硬膜下 | 双边(多段) | <1 mA |
| 蛛网膜下腔 | 单边或双边 | <1 mA |
| 硬膜外腔 | ||
| - 对抗神经根 | 单方面 | <1 mA |
| - 非血管内 | 单边或双边 | 1–10 mA(LA 注入后阈值电流增加) |
| - 血管内 | 单边或双边 | 1–10 mA(LA 注入后阈值电流没有变化) |
硬膜外刺激技术的一个缺点是,如果存在任何显着的临床神经肌肉阻滞或在硬膜外腔内使用了局部麻醉剂,则无法可靠地进行刺激。 为了克服这一限制,有人提出了一种使用心电图监测的替代监测技术。 在手术所需的脊柱水平监测参考心电图; 然后将其与硬膜外导管尖端形成的心电图进行比较,因为它是头侧螺纹。 不幸的是,这种技术不能轻易区分导管穿入短距离的细微 QRS 波群。 它也不识别血管内或鞘内导管定位。
超声引导技术
由于硬膜外阻滞的主要目的是将针头和/或导管准确地放置在硬膜外腔中,因此了解从皮肤表面到硬膜外腔的预期深度非常重要。 表1 总结了一些计算儿童深度的公式。 在可用的情况下,US 允许实时识别解剖标志和更精确地估计硬膜外空间深度。 强烈建议在进行阻滞之前对所有儿童进行超声检查,尤其是在困难的情况下,例如脊柱侧弯或骶骨凹陷的患者。 US 还允许在新生儿的硬膜外腔内进行针头可视化。 在婴儿中,US 可以通过观察液体的注入直接或间接检测硬膜外导管的推进。
硬膜外方法
最常见的硬膜外镇痛类型是尾部镇痛(这是儿童最常用的区域技术)、腰部硬膜外镇痛和胸部硬膜外镇痛。
尾部硬膜外镇痛:单次注射技术
单次注射尾部硬膜外阻滞在儿科实践中广泛用于提供围手术期镇痛。 作为单次注射,它为接受下腹部和下肢的泌尿外科、普通外科和骨科手术的患者提供了可靠和有效的阻滞。 单次注射尾侧硬膜外麻醉可能并不适合所有病例,因为它的皮区分布有限且作用持续时间短。 新的局部麻醉剂和辅助剂,以及连续导管方法,可以克服这些限制。
尾部镇痛针的选择
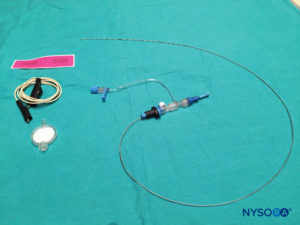
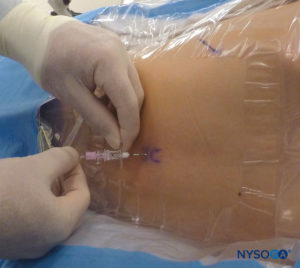
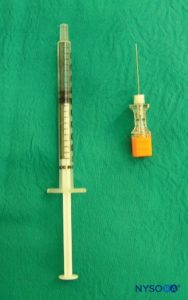
多种针头可用于单次注射尾端阻滞。 针的大小或类型似乎不会影响成功率或尾部阻滞并发症的发生率。 当刺穿骶尾韧带时,带有管心针的短斜角 Tuohy 或 Crawford 针(5 厘米长)提供更好的触感。 对于 1 岁或以上的儿童,使用 22 号针头; 对于 1 岁以下的儿童,可以使用 25 号针头。 尽管尚未报道硬膜外腔中的表皮细胞移植瘤,但使用带探针的针头可能会降低将真皮塞引入尾部空间的风险。 一些作者主张使用 22 号血管导管,这表明用这种针更容易检测血管内放置和骨内放置。 血管导管仅用于单次注射尾端阻滞,并在给药后取出(即,它不打算用作硬膜外尾端导管)。 为避免使用 angiocath 进行组织取芯,在进行任何注射之前必须移除针头。
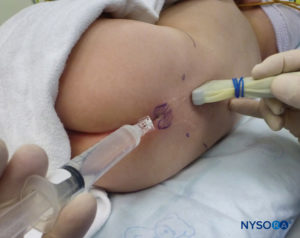
进行单次注射硬膜外阻滞的技术
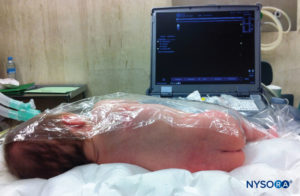
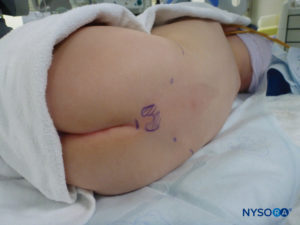
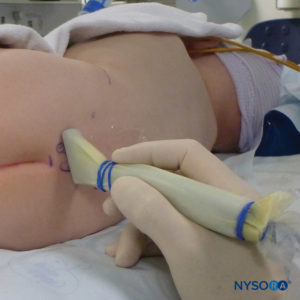
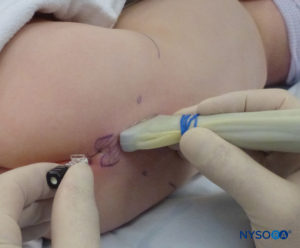
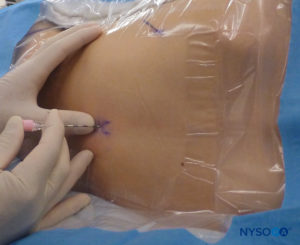
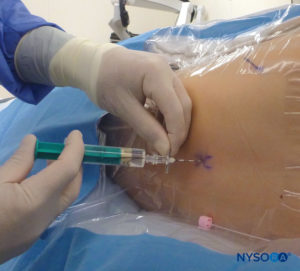
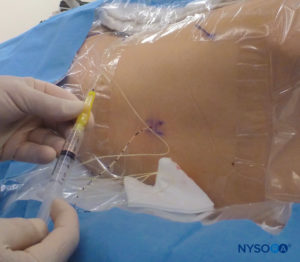
对于所有儿童,重要的是要确保在手术过程中充分防止热量散失。 对于婴儿,我们建议使用无菌透明布巾防止热量散失,因为这也可以让患者的呼吸可视化(图2)。 将患者置于侧卧位,颈部弯曲,膝盖向上拉至胸部。 正确定位后,硬膜外阻滞的标志物(图3) 在儿童中很容易识别:最初识别尾骨,然后继续以头侧方式在中线触诊,可以在中线两侧约 1 厘米处感觉到骶骨角。 骶骨裂孔感觉为骶骨角的两个骨突之间的凹陷。 在无菌条件下,将针头插入骶骨裂孔,与皮肤呈大约 70 度角,直到骶尾韧带被刺破时感觉到明显的“砰砰”声。 穿刺后,针头的角度应减小到大约 20-30 度,同时将针头推进到尾管 2-4 毫米。 不建议超过这一点的任何进展,因为意外硬膜穿刺的风险显着增加。 如果使用血管导管,塑料导管应该很容易通过针头进入硬膜外腔。
NYSORA 小贴士
应注意确保在手术过程中防止热量散失。
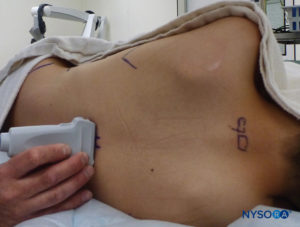
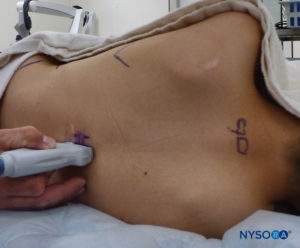
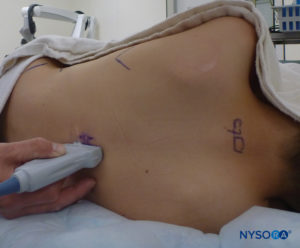
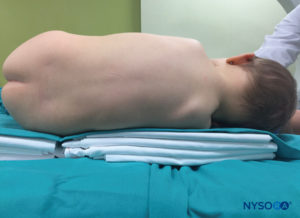
US 可用于在基于标志的技术之前评估尾部解剖结构或指导针的放置。 预评估在筛查患有脊柱裂伤皮肤耻辱的儿童时特别有用。 将患者置于侧卧位,膝盖向胸部弯曲。 美国机器放置在操作员的对面,以便他或她可以通过他或她的手向屏幕看。 患者已做好准备,US 探头已无菌覆盖。 使用高频探头:线性曲棍球棒探头用于婴儿,而具有较大足迹的探头更适合体重超过 10 公斤的儿童,因为它可以一次对更多的椎间空间进行成像。矢状面。
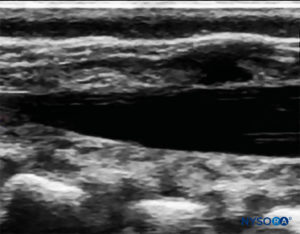
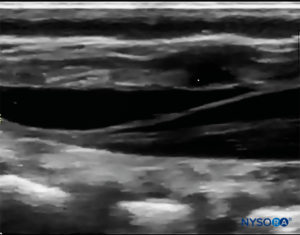
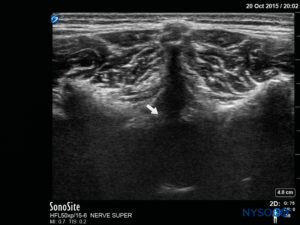
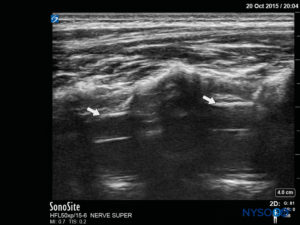
探头首先位于骶骨水平的横向平面中; 这称为短轴视图 (SAX)。 定义了角和骶尾膜(SCM)的确切位置(图4)。 图像中间有骶尾膜(图5),然后将探头旋转 90 度进入下骶骨上方的中线矢状位,这称为长轴视图 (LAX; 图6)。 SCM 以及骶骨的腹侧和背侧层,以及其间的硬膜外间隙,很容易识别。 在小孩子中,硬膜囊在这个位置可能是可见的,但对于年龄较大的孩子,您需要在更头部的方向进行更多扫描(图7)。 这些运动可以以相反的顺序进行,但建议对两个轴的空间进行完整的探索。
在对尾部解剖结构进行这种术前超声评估后,可以将针头插入骶骨裂孔,探头位于任一轴上。 如果探头保持在 SAX 中,则针插入将自动以平面外 (OOP) 方法 (图8)。 如果探头保持在 LAX 中,则针插入将采用平面内 (IP) 方法 (图9).
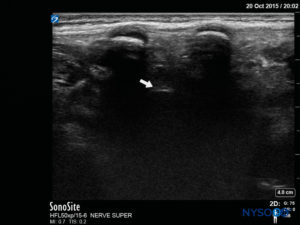
在扫描期间记录针插入角度。 可以将针头推进到尾部空间 2-4 毫米,然后移除管心针。 为确保针头的最佳位置,在超声引导下给予少量生理盐水或局部麻醉剂,探头位于中线(LAX; 图10)。 根据需要将探头定位在头侧,以便在美国屏幕上显示硬脑膜囊 (图11)。 注射开始时,您会注意到硬脑膜向腹侧移位,尤其是在年幼的儿童中。 可以通过在中线或旁正中矢状轴沿脊柱向上移动探头来监测局部麻醉剂的扩散(图12)。 使用 SAX 中的探头在更头部的位置可以看到相同的硬脑膜运动(数字13 和 14).
确认正确的局部麻醉剂分布
刺穿 SCM 时的经典“砰砰”声通常用于确认尾针位置是否正确。 没有皮下膨胀和注射时没有阻力是正确放置针头和局部麻醉剂分布的额外迹象。 针吸应清除血液和脑脊液,对肾上腺素试验剂量的阴性反应也应用于排除血管内放置。 US 已被用于提供进入尾腔的实时针头引导并评估局部麻醉剂的扩散。 美国最近的研究表明,局部麻醉剂的用量与其在婴儿和儿童尾部阻滞期间的颅内扩散无关。 最初,美国对局部麻醉剂扩散的评估被认为是到达皮区的预测因素,但事实证明并非如此,因为尽管立即监测到头侧没有扩散,但大多数尾部阻滞是成功的。 然而,已经发现局部麻醉剂在硬膜外腔中存在二次扩散。 这以两种模式发生:从背侧到腹侧硬膜外腔的水平节段内重新分布和当硬脑膜返回其原始位置时延迟的纵向颅骨扩散,从而推动硬膜外局麻药向头部。 观察到的脑脊液双向运动(称为“脑脊液反弹机制”)也有助于解释美国评估的初始扩散与皮肤测试确定的最终更多头侧效应之间差异的一个组成部分。 需要更多的超声研究来确定如何最好地预测局麻药的扩散。
尾部硬膜外镇痛:连续技术
连续尾部硬膜外镇痛克服了单次注射技术的有限持续时间和节段效应。 尾部导管可以推进到腰椎或胸椎水平。 用于持续尾部镇痛的针头插入技术与单次注射尾部方法非常相似。 可以使用 IV 导管(18 号硬膜外导管使用 20 号血管导管或 16 号硬膜外导管使用 19 号血管导管)或通过骶尾膜插入 18 号 Crawford 或 Tuohy 针头,如单次注射技术所述。 然后将硬膜外导管从尾部空间小心地推进到目标水平。 对导管通过的较小阻力通常可以通过患者脊柱的简单弯曲或伸展和/或通过同时通过导管注射生理盐水来克服。 一些作者使用专门的刺激硬膜外导管(使用 Tsui 测试的硬膜外定位系统,Arrow International Inc.,Reading,PA)。
知道导管末端的最终位置非常重要:导管末端水平过低会导致镇痛效果不佳; 过高可能会导致呼吸抑制。 然而,由于导管不会在硬膜外腔内直线移动,因此测量导管靠在患者背部的长度并不能准确地确定目标手术水平。 因此,应使用客观测试来验证导管尖端的位置,如前一节所述(即射线照相、神经刺激、心电图,或者最好是超声)。
这些技术可能被认为是繁琐或多余的,并且对于 1 岁以上的儿童,婴儿期腰椎弯曲的发展可能会妨碍导管容易向头侧推进。 因此,有人建议尾侧导管放置应仅限于 1 岁以下的患者。 作者认为,至少在 1 岁以上的儿童中,导管应放置在尽可能靠近手术皮区的位置。 因此,在所有情况下都建议进行适当的儿科和超声检查,并且在对幼儿进行腰椎或胸椎硬膜外麻醉之前是强制性的。
腰椎硬膜外麻醉
腰椎硬膜外镇痛常用于连续输注,很少用作单次注射技术。 直接腰椎入路主要用于下肢手术期间和之后的疼痛控制。 腰椎硬膜外放置,特别是在幼儿中,是在全身麻醉诱导后进行的。 然而,这种方法也可以在选定的合作儿童和青少年群体中清醒地进行。 每当在脊髓末端水平以上进行腰椎硬膜外镇痛时,应谨慎行事,以避免直接针头损伤。
腰椎硬膜外针放置的中线方法是首选。 硬膜外腔的识别通常通过对盐水的抵抗力丧失 (LOR) 来实现。 由于引入静脉空气栓塞的风险,尤其是新生儿和婴儿,应避免将 LOR 引入空气。 儿童应采用侧卧位进行直接腰椎硬膜外放置。 对于 1 岁以上的儿童,通常使用一根 18 号、5 厘米的 Tuohy 针,每 0.5 厘米标记一次,并带有一根 20 号的硬膜外导管。 对于 1 岁以下的儿童,应考虑使用 20 号、5 厘米的 Tuohy 针,每 0.5 厘米标记一次,并使用 22 号导管。 然而,这些较窄的导管会更频繁地扭结、堵塞和泄漏。 虽然大多数儿科患者的椎间隙和黄韧带很容易识别,但儿童的黄韧带张力较小; 因此,当穿透这一层时,可能不容易感觉到独特的“流行”。 此外,从皮肤到硬膜外腔的距离可能非常浅。 已经提出了用于估计从皮肤到硬膜外腔距离的公式(见 表1)。 然而,公式只是一个指导方针,并根据硬膜外针放置的角度而变化。 今天,评估硬膜外深度的最佳可用方法是超声成像。 探头在旁正中斜矢状面上,用美国机器的卡尺测量从皮肤到黄韧带的距离。 该测量提供了对 LOR 将被感觉到的深度的良好估计。 因此,强烈建议对每位患者进行术前超声评估。
有关腰椎硬膜外麻醉技术的准确描述,请参见下面的“胸腔硬膜外麻醉”(图示为胸腔硬膜外放置)。
腰胸硬膜外入路
通过腰椎入路放置的导管可能会提前到头侧至胸椎水平。 与大龄儿童在尾部空间中推进导管时遇到的问题类似,显着的阻力也阻碍了腰椎硬膜外导管轻松推进到胸椎水平。 尽管使用尾侧入路刺激取得了良好的效果,但只有一份病例报告表明,在硬膜外刺激引导下,通过腰椎路径成功放置了胸硬膜外导管。 因此,作者建议将导管放置在尽可能靠近手术部位的位置。
胸腔硬膜外镇痛
关于将胸部硬膜外麻醉置于重度镇静或全身麻醉下的安全性存在争议,因为失去知觉的患者无法报告可能警告麻醉师潜在神经系统并发症的症状 硬膜外置管过程中直接针头损伤脊髓的情况很少见,但可能会导致严重的并发症. 报告有在清醒和麻醉患者的硬膜外放置期间直接针头损伤脊髓的详细案例。 对于胸外科手术,导管应尽可能靠近皮肤切口水平。
仅在 1 岁以下的儿童中,将导管从腰部和尾部硬膜外腔推进至胸部水平是一种替代方法。 然而,由于腰椎弯曲的发展,随着年龄的增长,硬膜外腔导管的推进变得越来越困难。
在三级护理中心,直接放置胸硬膜外导管更为常见,那里训练有素的儿科麻醉师对接受大手术的儿童进行阻滞。 强烈建议进行术前超声成像。 此外,作者认为应该为愿意为儿童进行胸硬膜外麻醉的麻醉医师提供超声辅助胸硬膜外麻醉的培训。
NYSORA 小贴士
- 与成人相比,儿童需要显着更高体积(剂量)的局部麻醉剂才能达到相同的皮瘤扩散。
- 从腰椎插入部位进行预期的高位胸导管推进很少成功。
- 胸腔硬膜外导管插入只能由具有儿科胸腔硬膜外技术经验的从业者进行。
- 可以使用中线或旁正中入路在任何胸腔间隙对儿科患者进行硬膜外穿刺; 但是,通常首选中线方法。
胸腔硬膜外镇痛:中线入路
中线入路的使用提供了与腰椎入路类似的优势(针头仅在一个平面内成角度)。 使用中线入路,在下胸段 (T10–T12) 比在胸中段 (T4–T7) 更容易进针。 肩胛骨下缘与第七胸椎平齐,通常用作解剖标志。 患者取侧卧位,注意防止热量散失。 在进行阻滞之前,可以在非无菌装置中对患者的解剖结构进行评估; 这也有助于教学目的。
目标椎体水平的棘突应通过从 Tuffier 线向上计数和从最突出的 C7 颈椎向下计数来识别。图15)。 使用探头在三个平面上进行术前超声成像:横向 (SAX)、正中矢状 (median LAX) 和旁正中斜矢状 (paramedian oblique LAX)。 因此可以测量患者皮肤到硬膜外腔的距离。在 SAX (图16),必须找到两个棘突之间的窗口,图像深度中的椎体前部复合体(后纵韧带、前部硬脑膜和椎体)将是第一个被识别的结构。 后部复合体(黄韧带和后部硬脑膜)可能更难观察,但大约在椎板水平(图17).
如果患者是婴儿,并且脊柱的骨结构尚未完全骨化,则 LAX 正中(图18) 提供所涉及解剖结构的清晰、真实的成像。 使用这个探头位置,图像中的棘突几乎会到达皮肤(或美国屏幕的顶部)。 在棘突之间,硬脑膜将被视为白色双层; 它的深度比在 SAX 中发现的后复合体的水平略低(图19). 在旁正中斜线 LAX (图20),可以看到横突和/或椎板,这取决于探头的横向和倾斜程度。 前复合体再次很容易显现,大多数时候可以在幼儿中看到软脑膜。 可以在图像中找到特征性的“马头”,并且可以在更深的层次上看到硬脑膜(图21)。 硬脑膜的深度将或多或少相等,如在 SAX 和中位 LAX 位置。
在进行术前成像以测量到达硬膜外腔的深度后,准备好孩子的皮肤并进行覆盖(图22)。 然后将一根 18 厘米长、每 5 厘米标记一次的 0.5 号 Tuohy 硬膜外针以与脊柱纵轴成约 70 度的头侧角插入间隙。 一个有用的操作是以与测量硬膜外腔距离时握住超声探头的角度相似的角度插入针头(图23)。 当针穿过棘上韧带和棘间韧带时,应该感觉到持续的阻力。 当到达棘间韧带时,移除管心针并将充满盐水的 LOR 注射器连接到针头上。 随着针头进一步前进,柱塞上会持续施加压力(图24)。 在年龄较大的儿童中,当进入黄韧带时,就在感觉到 LOR 之前,最初会感觉到阻力的增加。 然而,在年幼的儿童中,黄韧带遇到的阻力可能与其他韧带的阻力没有明显不同。
针头插入深度不得大于术前超声估计的硬膜外腔深度。 胸硬膜外腔用 LOR 识别为盐水; 不建议儿童使用空气。 然后取出注射器,排除硬脑膜穿刺后,插入导管(图25)。 如果硬膜外穿刺已在适当的水平进行,则插入的导管长度应仅超出针尖约 2 cm。 如果穿刺是在下一层进行,则导管可以插入 3-4 厘米,但必须记住,对于小孩子,几厘米可能代表几个椎骨节段。
在拔出针头并确保足够长度的导管保持在适当位置后,将连接器连接到导管上。 此时,必须检查是否有下降的半月板并通过导管进行缓慢而仔细的抽吸以检查血液或脑脊液(图26)。 然后连接过滤器,并且可以在超声成像下评估扩散的情况下给予增加剂量的局部麻醉剂。
我们建议将导管穿入隧道或使用液体绷带或局部皮肤粘合剂 Histoacryl 封闭入口孔以防止泄漏。 预防儿科患者的局部麻醉剂泄漏很重要,因为泄漏的麻醉剂可能占总给药量的很大一部分。 固定装置或 Tegaderm 下方的泄漏可能会给导管固定本身带来问题。 建议使用透明硬膜外固定装置,以观察任何局部麻醉剂泄漏或感染迹象(图27).
NYSORA 小贴士
- 存在用于计算阻塞给定数量的段所需的局部麻醉剂体积的各种公式。
- 给予 1.0 mg/kg 0.25% 布比卡因或 0.2% 罗哌卡因的推注以建立阻滞。
- 在学龄前儿童,尤其是婴儿中,尽管硬膜外镇痛效果明显良好,但仍可能出现烦躁或激动。 这很可能是静脉输液管、鼻胃管、导尿管或医院环境的结果。
- 使用以下任何一种方法都可以达到令人满意的镇静效果:
– 根据需要静脉推注吗啡 25 mcg/kg,或
– 在硬膜外混合液中加入 0.5 mcg/mL 可乐定
术后硬膜外输液管理
对于有效和安全的硬膜外镇痛,建议采用系统和基于协议的患者护理方法。 由麻醉师和护士组成的专门的儿科急性疼痛团队对于确保疼痛的标准化评估、警惕的患者监测以及对不良反应的适当治疗至关重要。 硬膜外针头和导管的精确放置是硬膜外镇痛成功的关键。 这需要使用可靠的方法来确认导管尖端的位置(即,US,硬膜外刺激)。 硬膜外输注的平均时间约为 72 小时,尽管可能需要继续输注更长的时间,特别是对于有复杂病史或长期需要镇痛的儿童。 在新生儿中,由于存在全身毒性的风险,硬膜外输注的时间应限制在 48 小时。 一个专注于疼痛管理的专职人员团队应该照顾这些患者。 当计划停止硬膜外输注时,应考虑使用阿片类药物以实现充分镇痛。 最后,该过程的成功基于正确的书面命令——这是执行充分镇痛的关键部分。
NYSORA 小贴士
对于术后镇痛,使用 0.125% 布比卡因或 0.1-0.2% 罗哌卡因,联合或不联合芬太尼 1-2 mcg/mL,按以下比例给药:
- 年龄 > 3 个月:0.20–0.35 mL/kg/h(< 0.4 mg/kg/h 布比卡因)
- 年龄 < 3 个月:0.1–0.15 mL/kg/h(< 0.2 mg/kg/h 布比卡因)
儿童脊髓麻醉
引言
脊髓麻醉可能是为接受手术的患者提供疼痛缓解的最古老和研究最多的方式之一。 J. Leonard Corning 因在 1885 年使用了第一种脊髓麻醉剂而受到赞誉,他的经验随后发表在医学杂志上。 尽管在 1980 世纪初描述了在儿童中使用鞘内麻醉,但这种技术很少用于儿科人群,直到 Melman 报道了一系列在脊髓麻醉下成功接受手术的高危婴儿。 早产儿全身麻醉后呼吸暂停的报道出现在 XNUMX 年代初期的文献中,以及 Abajian 等人的一系列文章中。 为从业者提供了一种动力,以提供一种据称比全身麻醉并发症更少的替代技术。 此后,所有年龄组的各种外科手术都报道了许多系列,证明了脊髓麻醉的安全性和有效性。
表6。 成人和婴儿在椎管内的解剖学差异。
| 脊髓圆锥在婴儿的 L2-L3 和成人的 L1 结束。 |
| 婴儿的骨盆较小,骶骨比成人更靠头。 |
| 与成人相比,婴儿的硬膜囊末端更多。 |
解剖学
了解成人和婴儿之间的解剖学差异对于以技术熟练的方式安全地对儿童进行脊髓麻醉至关重要。表6)。 与成人相比,新生儿和婴儿的脊髓尾端水平要高得多。 脊髓圆锥在成人大约在 L1 水平,在新生儿和婴儿在 L2 或 L3 水平结束。 为避免对脊髓造成潜在损伤,应在脊髓水平以下进行硬脑膜穿刺; 也就是说,在新生儿和婴儿中低于 L2-L3。 在成人中,脊椎麻醉通常在最接近穿过髂嵴顶部的假想线、嵴间线或 Tuffier 线的间隙进行,对应于 L3-L4 间隙。 然而,新生儿和婴儿的骨盆比例比成人小,并且骶骨相对于髂嵴位于更靠头的位置。 因此,Tuffier 线在 L4-L5 或 L5-S1 间隙处穿过脊柱中线,远低于脊髓末端,使这一里程碑适用于所有儿科患者。 与成人相比,新生儿和婴儿的硬膜囊也终止于更靠尾的位置,与成人的 S3 水平相比,通常在 S1 水平。 如果针头进入硬膜外腔太远,硬脑膜囊的尾端末端越多,在单次注射尾端阻滞的执行过程中,硬脑膜意外穿刺的可能性就越大。
与成人 (4 mL/kg) 相比,婴儿和新生儿 (2 mL/kg) 的 CSF 体积(以毫升/千克计)更高。 此外,与成人的分布相反,婴儿的 CSF 在椎管中的分布比在头部的分布相对更多。 这可能部分解释了婴儿对局部麻醉剂剂量的要求较高和脊髓麻醉作用持续时间较短的原因。 儿科人群的高心输出量特征进一步缩短了儿童脊柱阻滞的持续时间。
局部麻醉
文献中描述了多种局部麻醉剂和剂量,包括布比卡因 86 和罗哌卡因。 布比卡因 0.5%,0.5-1 mg/kg,通常用于体重小于 10 kg 的儿童的脊髓麻醉。 对于较小的儿童,首选剂量接近该范围的上限; 只要认真进行手术,全脊髓麻醉的风险就很低(表7)。 注射器的“肾上腺素冲洗”,而不是标准剂量的肾上腺素,是首选。 含有 8% 葡萄糖的高压布比卡因溶液提供的块质量和持续时间与含有 0.9% 葡萄糖的同压布比卡因相似。
还描述了脊柱阻滞中局部麻醉剂的佐剂。 已证明,在新生儿脊髓麻醉中使用的布比卡因 (1 mg/kg) 中添加 1 mcg/kg 剂量的可乐定可将阻滞持续时间延长至几乎是不使用可乐定的脊髓麻醉持续时间的两倍。 然而,使用 2 mcg/kg 的可乐定可能会导致血压短暂下降和更大的术后镇静。 建议静脉注射 10 mg/kg 的咖啡因以预防潜在的术后呼吸暂停,尤其是在脊髓麻醉溶液中使用可乐定时。
在早产儿双侧疝修补的情况下,脊柱阻滞可以补充尾部阻滞。 进行阻滞时,将患者转至最大疝的一侧; 脊椎注射 0.8 mg/kg 布比卡因后立即尾侧注射 0.1% 布比卡因。 该技术延长了麻醉和镇痛的持续时间。 或者,可以在手术侧向上注射局部麻醉剂的低压溶液。
表7。 儿童脊髓麻醉剂量。
| 局麻药溶液:罗哌卡因或布比卡因 0.5% 0.5-1 mg/kg。 | ||
| 计算婴儿单次疝修补剂量的简单方法如下: | ||
| 年龄(月) | 体重(公斤) | 剂量布比卡因 0.5% |
| 1 | 3 | 1毫克/公斤 |
| 2 | 4 | 0.8毫克/公斤 |
| 3 | 5 | 0.6毫克/公斤 |
| > 4 | 6 | 0.4毫克/公斤 |
| 可能的添加剂: • 肾上腺素洗液 • 可乐定 1 mcg/kg • 吗啡 10 mcg/kg 仅用于心脏手术以促进早期拔管) |
||
不利影响
在成人中常见的脊髓麻醉的不良反应在儿童中不太常见。 这些包括低血压、心动过缓、PDPH 和短暂的神经根症状。
尽管需要高水平的阻滞,低血压和心动过缓在儿童中并不常见。 儿童很少需要液体负荷来增加预负荷,但如果需要,可以以 10 mL/kg 的速率进行。 尽管一些作者在实施脊柱阻滞后获得了患者下肢的静脉通路(无痛 IV 导管放置),但我们建议在实施脊柱阻滞之前获得静脉通路。 Puncuh 等人。 报告了他们使用 1132 次连续脊髓麻醉剂的经验,其中很少报告低血压:9 名 942 岁以下患者中的 10 名和 8 名 190 岁以上患者中的 10 名仅报告血压轻度下降。
儿童的 PDPH 发病率低于成人。 然而,据报道,肿瘤患者在频繁腰穿脊椎穿刺后发生率为 8%。 在该亚组患者中研究了使用不同类型的脊髓针,但在头痛的发生率方面没有发现差异(15% Quincke;9% 铅笔尖 Whitacre;p = 0.43)。 此外,不同年龄组的头痛发生率没有差异,8 例 PDPH 中有 11 例发生在 10 岁以下儿童中,最年轻的发生在 23 个月大的儿童中。 PDPHs 已在成人中接受卧床休息和咖啡因治疗,但如果头痛没有解决,则随后使用血贴。 在儿童中,咖啡因的最佳剂量尚不清楚,当头痛持续存在时,使用 0.3 mL/kg 血液进行硬膜外血贴。据报道,儿童出现短暂的神经根症状,但没有长期的不良反应。
相对禁忌症
非镇静儿童脊柱技术的主要禁忌症是手术时间超过 60 分钟。 新生儿和可能有颅内压升高的儿童应避免使用脊髓麻醉。 在患有神经肌肉疾病、心室分流(心房或腹膜)和癫痫控制不佳的儿童中,使用脊髓麻醉是有争议的。 脊髓麻醉的其他禁忌症与成人相似,包括严重的解剖畸形、全身感染或穿刺部位感染、潜在的凝血障碍和血流动力学不稳定。表8).
在考虑脊髓麻醉时,应特别考虑已知有困难气道的儿童。 尽管对这些患者而言,腰麻可能是一个合理的选择,但首先要考虑的是医师管理气道的能力。 学龄前和学龄儿童需要静脉注射镇静剂给气道困难的儿科患者带来了一系列风险。 手术部位、手术的预期长度和手术位置(即仰卧、侧卧或俯卧)也是需要考虑的重要因素。
表8。 儿童脊髓麻醉的相对禁忌症。
| 脊柱解剖异常 |
| 退行性神经肌肉疾病 |
| 患者及家属异议 |
| 凝血功能障碍 |
| 细菌感染 |
| 颅内压升高 |
| 脑室腹腔分流术 |
NYSORA 小贴士
接受脊髓麻醉的婴儿和儿童的特殊注意事项包括:
- 麻醉提供者的专业知识
- 外科医生的动机
- 预计手术时间少于 90 分钟
儿科患者的脊髓麻醉:技术
考前准备
局部麻醉剂 (EMLA) 乳膏或 LMX(4% 利多卡因乳膏)的低共熔混合物可应用于插入部位,但在非常小的早产儿中必须考虑高铁血红蛋白血症的风险。 在将患者带入手术室之前,应先加热手术室。 温暖的毯子和辐射加热灯有助于减少婴儿的热量损失。 对于年龄较大的儿童,房间应该保持安静,如果可能的话,手术器械应盖好,以尽量减少患者的焦虑。 儿科手术室可能配备立体声或视频设备,如果在没有镇静的情况下进行阻滞,可用于分散年龄较大的儿童的注意力。 在进行阻滞之前,应使用标准监测设备(脉搏血氧仪、心电图和血压袖带)。
应制定有关同时使用静脉镇静剂或吸入全身麻醉的计划。 该方法应取决于患者的医疗状况和年龄、麻醉提供者的舒适程度以及手术过程的性质和预期长度。 全身麻醉可能使早产儿易患呼吸暂停和心动过缓。 由于婴儿的生理特性,婴儿的脊髓麻醉持续时间不超过 90 分钟。 因此,对于前早产儿进行持续时间少于 90 分钟的下腹部手术,可以在没有辅助镇静剂的情况下进行脊髓麻醉。 然而,在进行阻滞时,有时可能需要短时间的吸入全身麻醉或补充 IV 镇静剂,尤其是在未使用 EMLA 乳膏的情况下。 年龄较大的儿童在进行阻滞之前可能需要补充镇静剂或轻度全身麻醉。 在某些情况下,脊髓麻醉可与尾部或硬膜外麻醉相结合以延长镇痛时间。
患者体位
儿童通常采用侧卧位或坐位进行脊髓麻醉。 如果首选侧卧位,则将患者定位在手术台的最边缘,并由助手牢牢握住。 否则,可以将患者放在手术台的中间,但要放在几条毯子上; 这些将为麻醉师的手在执行阻滞时舒适地放置提供必要的高度(图28)。 如果喜欢坐姿,婴儿必须特别注意确保颈部不弯曲,因为这可能导致气道阻塞。图29)。 在进行脊柱手术时,必须警惕地监测婴儿的氧饱和度,以确保气道的充足性和通畅性。 此外,颈部屈曲不是必需的,因为它不利于幼儿进行阻滞。 对于年龄较大的儿童,在进行阻滞时,应有一名助手在场以保持正确的姿势,并安抚和分散孩子的注意力。 在对未使用镇静剂的婴儿进行阻滞时,使用安抚奶嘴通常会有所帮助。
技术
在婴儿中,应识别 L4-L5 或 L5-S1 间隙; L3-L4 间隙可用于年龄较大的儿童。 该区域应准备好并以无菌方式覆盖。 如果术前未使用局部麻醉药膏,清醒或轻度镇静患者应在阻滞前进行局部麻醉。 在硬脑膜穿刺前,应在注射器中计算和准备所需的脊髓局麻药剂量,以确保给予正确的剂量。 由于新生儿所需的局麻药量可能很小,因此测量与针头毂对应的体积并将该体积计入局麻药的总剂量中也很重要。 胰岛素注射器有助于准确测量准确剂量。 通常使用短的 22 或 25 号脊椎针(图30)。 通常建议采用中线方法而不是旁正中方法。 儿童的黄韧带非常柔软,穿透硬脑膜时可能感觉不到明显的“砰砰”声。图31)。 一旦清除 CSF 离开针头,就可以给药,重要的是,必须缓慢注射(图32).
不推荐使用 barbotage 方法,因为它可能导致无法接受的高水平运动阻滞,并有可能导致完全脊柱阻滞。 不应抬高患者的下肢以将电烙器返回电极放置在婴儿背部,因为局部麻醉剂扩散到更高的脊髓水平可能会导致全脊髓麻醉。 在双侧疝修补的情况下,为了延长手术麻醉的持续时间,脊髓麻醉可以辅以尾部阻滞。
评估块
评估婴儿和幼儿的阻滞水平可能很困难,特别是在接受镇静剂或在全身麻醉下进行阻滞的患者中。 在婴儿中,可以使用针刺或对冷刺激(例如,酒精棉签)的反应,以及观察通气率和模式。 在 2 岁以上的儿童中,使用 Bromage 量表。 阻滞后,应注意避免将患者置于特伦德伦伯卧位或抬起下肢; 例如,在婴儿的背部放置一个电烙垫。 如果阻滞水平迅速升高,患者可能会被置于反向特伦德伦伯卧位。
NYSORA 小贴士
脊髓麻醉评估:Bromage 量表
- 无阻挡:膝盖和脚部可以自由活动
- 部分阻滞:只能弯曲膝盖,但仍然可以自由移动双脚
- 几乎完全阻滞:无法屈膝,但仍可以屈足
- 完成:无法移动腿或脚
临床用途
呼吸暂停和早产儿
儿科患者脊髓麻醉最常见的适应症是接受单侧腹股沟疝修补术的早产儿。表9)。 全身麻醉后的早产患者可能会出现呼吸暂停。 区域麻醉可能会降低(如果不能消除)术后呼吸暂停的风险,并且肯定会降低去饱和和心动过缓的风险。
表9。 儿童脊髓麻醉的适应症。
| 腹股沟疝气修复 |
| 脊髓脊膜膨出修复 |
| 下肢及下腹部手术 |
| 心脏手术后希望尽早拔管 |
然而,对于呼吸暂停的发生率和早产儿在门诊可以安全接受全身麻醉的概念年龄存在相当大的分歧。 研究设计缺乏一致性、患者群体规模小以及方法学的差异可能是造成上述差异的原因。 科特人。 对 255 项研究(包括 30 名患者)进行了荟萃分析,调查全麻后前早产儿的术后呼吸暂停。 总体而言,风险与胎龄和概念年龄独立相关。 术后呼吸暂停的其他危险因素是血细胞比容低于 5% 和在家中持续发生呼吸暂停。 该研究将婴儿分为两组:1% 风险组和 35% 风险组。 对于孕龄为 5 周的患者,术后呼吸暂停的风险在患者达到 95 周的孕后年龄之前没有低于 48%(具有 1% 的统计置信区间),并且在婴儿之前没有低于 54%达到 32 周的孕后年龄。 在更多的早产患者中,例如那些胎龄为 1 周的患者,在婴儿达到 95 周的孕后年龄之前,呼吸暂停的风险并未低于 56%(具有 XNUMX% 的统计置信区间)。
据报道,在前早产儿中同时使用氯胺酮作为镇静剂会增加术后呼吸暂停的发生率,高于对照组患者的报告。 然而,这些都是比较古老的研究。 与此同时,早产儿和婴儿的通气管理取得了重大进展,这使得呼吸暂停的风险在今天引起了争议。 此外,麻醉方面的改进,例如延长使用七氟醚代替氟烷和使用喉罩代替气管插管,进一步降低了婴儿全身麻醉的有害影响的发生率。 克雷文等人。 回顾了几项随机对照研究,发现脊髓麻醉与全身麻醉相比仅具有临界统计优势。 我们认为,在短时间自主通气时使用七氟醚有时可能有助于实施脊柱阻滞,尤其是在不使用 EMLA 乳膏的情况下。
脊髓麻醉也已用于各种其他手术,包括脊髓脊膜膨出修复和其他儿童腹部、泌尿外科和骨科手术。 Abajian 等人的早期报告。 不仅包括接受腹股沟疝修补术的婴儿,还包括作者认为面临全身麻醉风险增加的其他非婴儿患者。 这项研究包括患有各种疾病的患者,包括喉软化症、巨舌症、小颌畸形、先天性心脏病、唐氏综合症、肾上腺生殖系统综合症、发育迟缓和关节弯曲。 布莱斯等人。 报道了 30 名 7 周至 13 岁的患者,他们因各种外科手术而接受了脊髓麻醉。 科基等人。 据报道,在 92 名 93 至 1 岁的儿童中,有 17 名接受罗哌卡因腰麻进行下腹部或下肢手术的麻醉效果令人满意。区域技术已用于心脏手术,以促进早期拔管。 这个大型系列研究用于心脏手术的脊髓麻醉来自斯坦福大学的一项前瞻性随机分析。 接受脊髓麻醉以缓解术后疼痛的组在择期心脏手术和手术室早期拔管后,术后阿片类药物的需求量较少。
总之,儿科脊髓麻醉最常用于接受麻醉以修复腹股沟疝的早产儿。 脊髓麻醉也可以有效地用于儿童心脏手术的术后疼痛缓解,特别是在使用阿片类药物的情况下。
参考文献:
- Peutrell JM, Lonnqvist PA:用于儿童麻醉和镇痛的椎管内阻滞。 Curr Opin Anaesthesiol 2003;16:461–470。 2
- Suresh S、Long J、Birmingham PK 等:用于控制疼痛的尾部阻滞对儿童安全吗? 对来自儿科局部麻醉网络 (PRAN) 数据库的 18,650 个尾部阻滞的分析。 Anesth Analg 2015;120:151–156。
- Gunter JB, Eng C: 经尾侧入路对儿童进行胸部硬膜外麻醉。 麻醉学 1992;76:935–938。
- Larsson BA,Lonnqvist PA,Olsson GL:连续硬膜外输注后新生儿中布比卡因的血浆浓度。 Anesth Analg 1997;84:501–505。
- Luz G、Innerhofer P、Bachmann B 等人:婴儿和儿童连续硬膜外麻醉期间布比卡因的血浆浓度。 Anesth Analg 1996;82:231–234。
- Berde C:婴儿和儿童的局部麻醉剂:更新。 儿科麻醉 2004;14:387–393。
- Gunter JB、Dunn CM、Bennie JB 等人:布比卡因在儿童尾部全身麻醉中的最佳浓度。 麻醉学 1991;75:57-61。
- Tsui BC,Berde CB:儿童尾部镇痛和麻醉技术。 Curr Opin Anaesthesiol 2005;18:283–288。
- Lönnqvist PA:评论文章。 局部麻醉药物的毒性:儿科视角。 儿科麻醉 2012;22:39-43。
- Da Conceicao MJ, Coelho L, Khalil M:罗哌卡因 0.25% 与布比卡因 0.25% 的尾侧途径。 儿科麻醉 1999; 九:9-229。
- Eledjam JJ、Gros T、Viel E 等:罗哌卡因过量和全身毒性。 麻醉重症监护 2000;28:705–707。
- Ivani G、Lampugnani E、Torre M 等:罗哌卡因与布比卡因治疗儿科尾部阻滞的比较。 Br J Anaesth 1998;81:247–248。
- Karmakar MK、Aun CS、Wong EL 等:罗哌卡因在儿童硬膜外腔的全身吸收比布比卡因慢(表)。 Anesth Analg 2002;94:259–265。
- Kokko TI、Karinen J、Raiha E 等:0.75% 罗哌卡因和 0.5% 布比卡因在儿童髂腹股沟-髂腹下神经阻滞后的药代动力学。 Br J Anaesth 2002;89:438–441。
- Gunter JB:婴儿和儿童局部麻醉剂的益处和风险。 儿科药物 2002;4:649–672。
- Bosenberg A、Thomas J、Lopez T 等人:尾部罗哌卡因 1、2 和 3 mg × l(-1) 对儿童术后镇痛的疗效。 儿科麻醉 2002;12:53-58。
- 伊万尼·G·罗哌卡因:是时候给孩子们了吗? 儿科麻醉 2002; 十二:12—383。
- Taylor R、Eyres R、Chalkiadis GA 等人:0.25 岁以下接受腹股沟疝修补术、包皮环切术或睾丸固定术的儿童尾部注射左布比卡因 2% 的疗效和安全性。 儿科麻醉 2003;13:114-121。
- Lonnqvist PA:儿童尾部阻滞的辅助治疗——Quo vadis? Br J Anaesth 2005;95:431–433。
- Lonnqvist PA、Ivani G、Moriarty T:在儿童中使用硬膜外阿片类药物:仍然是最先进的技术还是终结的开始? 儿科麻醉 2002;12:747–749。
- Attia J、Ecoffey C、Sandouk P 等:儿童硬膜外吗啡:药代动力学和 CO2 敏感性。 麻醉学 1986;65:590–594。
- Ansermino M、Basu R、Vandebeek C 等:用于儿童尾部阻滞的局部麻醉剂中的非阿片类药物添加剂:系统评价。 儿科麻醉 2003;13:561–573。
- De Negri P、Ivani G、Visconti C 等人:在儿童术后连续硬膜外输注罗哌卡因中添加可乐定的剂量反应关系。 Anesth Analg 2001;93:71-76。
- Penon C、Ecoffey C、Cohen SE:硬膜外注射可乐定后对二氧化碳的通气反应。 Anesth Analg 1991;72:761–991。
- Fellmann C、Gerber AC、Weiss M:布比卡因尾侧布比卡因联合可乐定治疗腹股沟疝修补术后前早产儿出现呼吸暂停。 儿科麻醉 2002;12:637–640。
- Passariello M、Almenrader N、Canneti A 等:儿童尾部镇痛:S(+)-氯胺酮对比 S(+)-氯胺酮加可乐定。 儿科麻醉 2004;14:851–855。
- Hager H、Marhofer P、Sitzwohl C 等人:尾部可乐定可延长儿童尾部 S (+)-氯胺酮的镇痛作用。 麻醉分析 2002; 94:1169–1172。
- Hayashi H、Dikkes P、Soriano SG:反复使用氯胺酮可能会导致发育中的大鼠大脑神经元退化。 儿科麻醉 2002;12:770–774。
- Proescholdt M、Heimann A、Kempski O:S(+) 氯胺酮异构体在全球前脑缺血中的神经保护作用。 大脑研究 2001; 904:245–251。
- Suresh S,Wheeler M:实用的儿科区域麻醉。 Anesthesiol Clin North Am 2002;20:83–113。
- Giaufre E、Dalens B、Gombert A:儿童局部麻醉的流行病学和发病率:儿科麻醉医师法语协会的为期一年的前瞻性调查。 Anesth Analg 1996;83:904–912
- Flandin-Blety C,屏障 G:儿童硬膜外镇痛后的事故。 回顾性研究的结果。 儿科麻醉 1995;5:41-46。
- Fischer HB:在全身麻醉下进行硬膜外穿刺。 麻醉 2000;55:288–289。
- Kasai T、Yaegashi K、Hirose M 等:单次胸腔硬膜外针意外刺穿硬脑膜导致儿童脊髓损伤。 Anesth Analg 2003;96:65-67。
- Horlocker T、Wedel DJ、Rowlingson JC 等:接受抗血栓或溶栓治疗的患者的局部麻醉。 美国局部麻醉和疼痛医学协会循证指南(第三版)。 Reg Anesth Pain Med 2010;35:64–101。
- Kost-Byerly S、Tobin JR、Greenberg RS 等:儿童连续硬膜外导管的细菌定植和感染率。 Anesth Analg 1998;86:712–716。
- Wittum S、Hofer CK、Rolli U 等:一名儿童经尾侧入路单次硬膜外麻醉后的骶骨骨髓炎。 麻醉学 2003;99:503–505。
- Bubeck J、Boos K、Krause H、Thies KC:尾侧导管的皮下隧道可将细菌定植率降低到腰椎硬膜外导管的水平。 Anesth Analg 2004;99:689–693。
- Oliver A:儿童硬脑膜穿刺:我们应该怎么做? 儿科麻醉 2002;12:473–477。
- Liley A、Manoharan M、Upadhyay V:儿童硬膜穿刺后头痛的治疗。 儿科麻醉 2003;13:534–537。
- Janssens E、Aerssens P、Alliet P 等:儿童硬膜穿刺后头痛。 文献综述。 Eur J Pediatr 2003;162:117–121。
- Tsuji MH、Horigome H、Yamashita M:幼儿腰椎硬膜外麻醉后左心室功能未受损。 儿科麻醉 1996;6:405–409。
- Tsui BC、Malherbe S、Koller J 等人:通过脑脊液灌洗逆转无意的脊髓麻醉剂。 Anesth Analg 2004;98:434–436。
- Tobias JD:尾部硬膜外阻滞:儿童全身注射试验剂量和识别的回顾。 Anesth Analg 2001;93:1156–1161。
- Neal JM、Mulroy MF、Weinberg GF:美国局部麻醉和疼痛医学学会。 管理局部麻醉剂全身毒性的清单:2012 版。 Reg Anesth Pain Med 2012;37:16Y18。
- Flandin-Blety C,屏障 G:儿童硬膜外镇痛后的事故。 回顾性研究的结果。 儿科麻醉 1995; 5:41-46。
- Valairucha S、Seefelder C、Houck CS:在婴儿尾侧路径放置的胸硬膜外导管:影像学确认的重要性。 儿科麻醉 2002;12:424–428。
- Tsui BC,Gupta S,Finucane B:使用神经刺激确认硬膜外导管放置。 Can J Anaesth 1998;45:640–644。
- Tsui BC、Seal R、Koller J 等人:使用神经刺激引导进行胃底折叠术的儿科患者通过尾侧入路进行胸部硬膜外镇痛。 Anesth Analg 2001;93:1152–1155。
- Tsui BC,Gupta S,Finucane B:蛛网膜下腔和血管内硬膜外导管放置的检测。 Can J Anaesth 1999;46:675–678。
- Tsui BC,Gupta S,Emery D,Finucane B:使用神经刺激检测硬膜外导管的硬膜下放置。 Can J Anaesth 2000;47:471–473。
- Tsui BC:在心电图引导下通过尾侧入路在婴儿中放置胸硬膜外导管:原始技术的简化。 Anesth Analg 2004;98:273。
- Chen CP, Tang SF, Hsu TC, et al: 硬膜外置针的超声引导。 麻醉学 2004;101:181–184。
- Chawathe MS、Jones RM、Gildersleve CD 等:用超声检测硬膜外导管在儿童中的作用。 儿科麻醉 2003;13:681-684。
- Baris S、Guldogus F、Baris YS 等:在儿童尾部注射后,组织取芯是一个真正的问题吗? 儿科麻醉 2004;14:755–758。
- Lam DK, Corry GN, Tsui BC:超声成像在儿科区域麻醉中的应用证据:系统评价。 Reg Anesth Pain Med 2016;41:229–241。
- Rubin K、Sullivan D、Sadhasivam S:超声引导下的外周和椎管内阻滞对儿童更有效和安全吗? 儿科麻醉 2009;19:92-96。
- Perlas A:在椎管内阻滞中使用超声的证据。 Reg Anesth Pain Med 2010;35(2 增刊):S43-46。
- Triffterer L、Machata AM、Latzke D 等:儿童尾部阻滞期间颅骨扩散的超声评估:局部麻醉剂注射速度的影响。 Br J Anaesth 2012;108:670–674。
- Brenner L、Marhofer P、Kettner SC 等:儿童尾部阻滞期间颅骨扩散的超声评估:不同体积的局部麻醉剂的影响。 Br J Anaesth 2011;107:229–235。
- Lundblad M、Lönnqvist PA、Eksborg S 等:通过超声检查评估的新生儿、婴儿和学步儿童大容量尾部麻醉的分段分布。 儿科麻醉 2010;21:121-127。
- Lundblad M、Eksborg S、Lönnqvist PA:超声检查评估的尾侧阻滞的二次扩散。 Br J Anaesth 2012;108:675–681。
- Tamai H、Sawamura S、Kanamori Y 等:使用尾侧入路的胸硬膜外导管插入辅助幼儿的电神经刺激器。 Reg Anesth Pain Med 2004;29:92-95。
- Tsui BC、Wagner A、Cave D 等人:在儿科患者中使用电刺激引导的尾侧入路胸腰椎硬膜外镇痛:对 289 名患者的回顾。 麻醉学 2004;100:683–689。
- Tsui BC,Entwistle L:通过腰椎入路对患有唐氏综合症的儿科患者进行神经刺激的胸椎硬膜外镇痛。 Acta Anaesthesiol Scand 2005;49:712–714。
- Fischer HB:在全身麻醉下进行硬膜外穿刺。 麻醉 2000;55:288–289。
- Kasai T、Yaegashi K、Hirose M 等:单次胸腔硬膜外针意外刺穿硬脑膜导致儿童脊髓损伤。 Anesth Analg 2003;96:65-67。
- Bromage PR, Benumof JL:在全身麻醉下尝试硬膜外麻醉期间进行脊髓内注射后截瘫。 Reg Anesth Pain Med 1998;23:104-107。
- Chawathe MS、Jones RM、Gildersleve CD 等:用超声检测硬膜外导管在儿童中的作用。 儿科麻醉 2003;13:681-684。
- Corning JL:脊髓麻醉和脊髓局部用药。 纽约医学杂志 1885;42:483–485。
- Gray H:一项关于儿童和婴儿脊髓麻醉的研究:来自一系列 200 例病例。 柳叶刀 1909;2:913–917。
- Bainbridge W:通过脊髓注射对儿童进行镇痛,并报告了一种对注射液进行灭菌的新方法。 医学建议 1900;58:937–940。
- Melman E、Penuelas JA、Marrufo J:儿童区域麻醉。 Anesth Analg 1975;54:387–390。
- Gregory GA,管家 DJ:前“总理”中危及生命的围手术期呼吸暂停。 麻醉学 1983;59:495–498。
- 管家 DJ:早产儿术后呼吸暂停综合征。 西医杂志 1992;157:567。
- 管家 DJ:早产儿比足月儿更容易在小手术后出现并发症。 麻醉学 1982;56:304–306。
- Cote CJ、Zaslavsky A、Downes JJ 等:前早产儿腹股沟疝修补术后的术后呼吸暂停。 综合分析[见评论]。 麻醉学 1995;82:809–822。
- Liu LM、Cote CJ、Goudsouzian NG 等:从麻醉中恢复的婴儿危及生命的呼吸暂停。 麻醉学 1983;59:506–510。
- Abajian JC、Mellish RW、Browne AF 等:高危婴儿手术的脊髓麻醉。 Anesth Analg 1984;63:359–362。
- Frumiento C、Abajian JC、Vane DW:接受腹股沟疝修补术的早产儿的脊髓麻醉。 Arch Surg 2000;135:445–451。
- Blaise GA,Roy WL:小儿外科手术的脊髓麻醉。 Can Anaesth Soc J 1986;33:227-230。
- Kokki H、Tuovinen K、Hendolin H:小儿日间手术的脊髓麻醉:双盲、随机、平行组、等压和高压布比卡因的前瞻性比较。 Br J Anaesth 1998;81:502–506。
- Busoni P,Messeri A:儿童脊髓麻醉:表面解剖。 Anesth Analg 1989;68:418–419。
- Busoni P,Messeri A:婴儿脊髓麻醉:L5-S1 方法是否更安全? 麻醉学 1991;75:168–169。
- 格雷 H:人体解剖学:格雷的解剖学,第 30 版。 费城:Lippincott Williams & Wilkins,1985 年。
- Puncuh F、Lampugnani E、Kokki H:在儿科患者中使用脊髓麻醉:1132 例单中心经验。 儿科麻醉 2004;14:564–567。
- Kokki H、Ylonen P、Laisalmi M 等人:5 mg/mL 等压罗哌卡因用于儿童脊髓麻醉。 Anesth Analg 2005;100:66-70。
- Kokki H,Hendolin H:高压布比卡因用于 7-18 岁儿童的脊髓麻醉:布比卡因 5 mg mL-1 在 0.9% 和 8% 葡萄糖溶液中的比较。 Br J Anaesth 2000;84:59-62。
- Rochette A、Raux O、Troncin R 等:可乐定延长新生儿脊髓麻醉:一项前瞻性剂量范围研究。 Anesth Analg 2004;98:56-59。
- Welborn LG、de Soto H、Hannallah RS 等:使用咖啡因控制前早产儿麻醉后呼吸暂停。 麻醉学 1988;68:796–798。
- Oberlander TF、Berde CB、Lam KH 等:婴儿耐受脊髓麻醉,整体自主神经变化最小:对接受疝修补术的前早产儿的心率变异性进行分析。 Anesth Analg 1995;80:20-27。
- Ramamoorthy C、Geiduschek JM、Bratton SL 等:小儿肿瘤患者的硬膜后穿刺头痛。 临床儿科 1998;37:247–251。
- Kokki H、Salonvaara M、Herrgard E、Onen P:硬膜穿刺后头痛不是儿童的年龄相关症状:前瞻性、开放随机、平行组研究,比较 22 号 Quincke 和 22 号 Whitacre 针。 儿科麻醉 1999;9:429–434。
- Salmela L, Aromaa U:用 50 mg/mL 脑脊液稀释利多卡因或 40 mg/mL 甲哌卡因或 5 mg/mL 布比卡因的高压溶液诱导脊髓麻醉后的短暂神经根刺激。 Acta Anaesthesiol Scand 1998;42:765–769。
- Welborn LG、Rice LJ、Hannallah RS 等:前早产儿术后呼吸暂停:脊髓麻醉和全身麻醉的前瞻性比较。 麻醉学 1990;72:838–842。
- Gleason CA、Martin RJ、Anderson JV 等:早产儿脊髓穿刺的最佳位置。 儿科 1983;71:31-35。
- Krane EJ、Haberkern CM、Jacobson LE:以前早产儿的术后呼吸暂停、心动过缓和氧饱和度降低:脊髓麻醉和全身麻醉的前瞻性比较。 Anesth Analg 1995;80:7-13。
- Craven PD、Badawi M、Henderson-Smart DJ、O'Brien M:在婴儿早期接受腹股沟疝修补术的早产儿的区域(脊髓、硬膜外、尾部)与全身麻醉。 Cochrane 数据库系统修订版 2003;(3):CD003669。
- Viscomi CM、Abajian JC、Wald SL 等:脊髓麻醉修复新生儿脑膜脊髓膨出。 Anesth Analg 1995;81:492–495。
- Kokki H, Hendolin H. 脊髓麻醉与硬膜外麻醉在儿科手术中的比较。 Acta Anaesthesiol Scand 1995;39:896–900。
- Hammer GB、Ramamoorthy C、Cao H 等:接受心脏手术的婴儿和儿童脊柱阻滞后的术后镇痛。 Anesth Analg 2005;100:1283–1288。