约翰巴特沃思四世
引言
从参加专业会议的人数和研究活动的大幅增加以及科学出版物数量的增加证明,局部和区域麻醉和镇痛似乎正在经历复兴。与全身麻醉相比,全身麻醉的分子机制仍然是推测的主题,局部麻醉(LA)药物结合产生神经阻滞的位点已被克隆和突变。本章重点讨论机制 麻醉 和 毒性, 特别是因为了解这些机制将有助于临床医生进行更安全、更有效的区域麻醉。
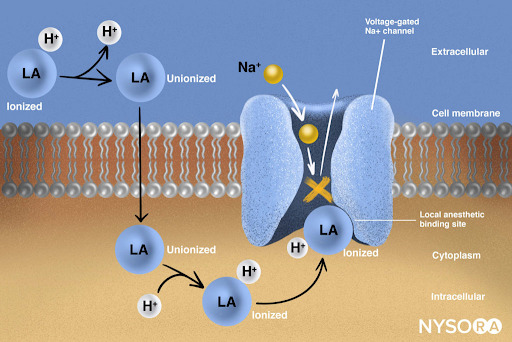
摘自《局部麻醉纲要:局部麻醉剂的作用机制》。 局部麻醉剂通过与电压门控 Na+ 通道的 α 亚基结合发挥作用,从而阻止神经冲动的产生和传导。 随后,Na+ 离子无法流入细胞,从而阻止了前进的去极化波沿神经长度的传递。 部分局部麻醉剂分子处于离子化形式。 局部麻醉剂分子在几分之一秒内从电离变为电离。
来自《局部麻醉纲要:局部麻醉剂的作用机制信息图》。
史前史和历史
印加人将古柯视为太阳神之子的礼物,并将其用于社会的“上层”。 早在可卡因被带到欧洲以使其特性被“发现”之前,他们就已经认识到并使用了可卡因的药用特性。 印加人有时会用钻孔法治疗持续性头痛,偶尔会使用古柯来促进这一过程。 局部麻醉是通过让操作员咀嚼古柯叶并将浸软的果肉涂在皮肤和伤口边缘,同时使用 tumi 刀在骨头上钻孔来完成的。 到了 XNUMX 世纪,在扰乱了印加社会之后,征服者开始向劳工支付可卡因糊状物。
工人们通常将可卡因叶卷成球(称为 cocadas),由鸟粪或玉米淀粉粘合在一起。 由于鸟粪的碱性以及与灰烬或石灰一起咀嚼可卡因的做法,这些古柯会释放出游离碱可卡因(此类碱性化合物会增加 pH 值,有利于游离碱可卡因形式而不是带正电荷的盐酸盐) . 这种做法可能标志着“游离基”可卡因的诞生,也是西方社会经常滥用的“摇滚”或“快克”可卡因的历史前身。 可卡因被一位名叫 Scherzer 的探险家/医生带回维也纳。 1860 年,化学家 Albert Niemann 在维也纳分离并结晶出纯可卡因盐酸盐。默克公司将这种药剂批量分发给医生用于研究目的。 西格蒙德弗洛伊德是这些可卡因实验者中最杰出的。 弗洛伊德在一本专门讨论可卡因的专着 Über Coca 中回顾了他的实验工作。 弗洛伊德和卡尔·科勒(一名眼科实习生)口服可卡因,并注意到这种药物使他们的舌头失去知觉。 Koller 和 Joseph Gartner 开始了一系列使用可卡因对结膜进行局部麻醉的实验。
局部和区域麻醉的诞生可以追溯到 1884 年,当时 Koller 和 Gartner 报告了他们成功地在青蛙、兔子、狗和人类的眼睛中产生局部可卡因麻醉。 局部麻醉的使用迅速在世界范围内传播开来。 纽约罗斯福医院的美国外科医生威廉·霍尔斯特德(William Halsted)报告说使用可卡因生产 下颌神经阻滞 1884年又生产出臂丛神经阻滞,不到一年后。 这些阻滞是通过手术暴露神经,然后在直视下注射来完成的。 伦纳德康宁在狗的脊椎附近注射可卡因,产生了可能是第一个 硬膜外 1885 年。 1898 年,August Bier 首次完成了可卡因的脊柱麻醉。 可卡因 脊麻 1898 年被用于治疗癌症疼痛。1902 年,Sicard 和Cathelin 引入了硬膜外麻醉。 比尔描述 静脉局部麻醉 1909 年。1911 年,赫歇尔报道了前三种经皮臂丛神经麻醉。 Fidel Pages 在 1921 年报道了在腹部手术中使用硬膜外麻醉。可卡因很快被纳入许多其他产品中,包括 Pemberton 在 1886 年设计的可口可乐的原始配方。当时的酒补品和其他“专利”药物通常含有可卡因(图1)。 当可卡因在 1900 年代初受到美国食品和药物管理局 (FDA) 的前身监管时,这种做法就结束了。

图1。 在可卡因成为受控物质之前加入可卡因的产品示例。 用可卡因强化的葡萄酒作为“滋补品”特别受欢迎。 (经布法罗大学成瘾研究组许可使用。)
药物化学
可卡因和所有其他 LA 在分子的相对末端含有一个芳环和一个胺,由烃链和酯键或酰胺键隔开(图2)。 可卡因,原型酯,是唯一天然存在的 LA。 普鲁卡因是第一种合成酯 LA,由 Einhorn 于 1904 年引入。 1948 年推出的酰胺 LA 利多卡因具有变革性。 利多卡因很快被用于所有形式的区域麻醉。 随后出现了其他基于利多卡因结构的酰胺 LA(丙胺卡因、依替卡因)。 引入了基于 2',6'-哌啶酮的相关系列酰胺 LA(甲哌卡因、布比卡因、罗哌卡因和左布比卡因)。 罗哌卡因和左布比卡因是仅有的市售单对映异构体(单旋光异构体)LA。 两者都是 S(–)-对映异构体,避免了与外消旋混合物和 R(+)-异构体相关的心脏毒性增加(这将在后续部分中讨论)。 所有其他 LA 要么作为外消旋体存在,要么没有不对称碳。
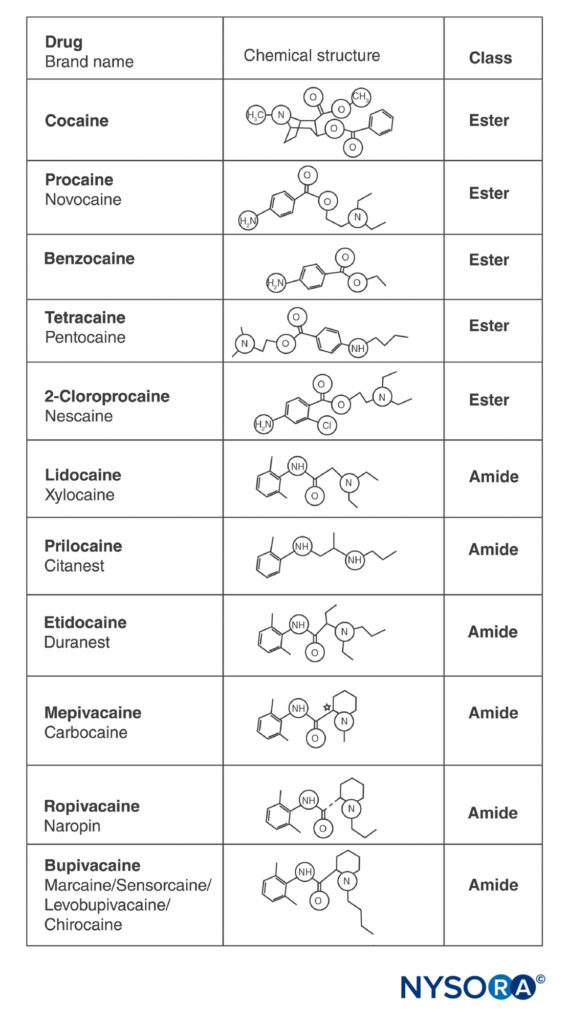
图2。 常用局部麻醉剂的结构。
NYSORA 小贴士
- 所有 LA 在分子的相对末端都包含一个芳环和一个胺,由烃链和酯键或酰胺键隔开。
电压门控钠通道的生物物理学和局部麻醉
LA 对周围神经作用机制的研究是研究 LA 与电压门控 Na 通道之间的相互作用,因为 Na 通道包含 LA 结合位点。 Na 通道是完整的膜蛋白,可在体内启动和传播动作电位 轴突、树突和肌肉组织; 在专门的心脏和脑细胞中启动和维持膜电位振荡; 以及塑造和过滤突触输入。 Na 通道与其他类似的以四聚体形式存在的电压门控离子通道具有结构特征,每个通道具有六个跨膜螺旋段(例如,电压门控 Ca 和 K 通道)。 Na 通道包含一个较大的 α 亚基和一个或两个较小的 β 亚基,具体取决于物种和起源组织。 α-亚基是离子传导和 LA 结合的位点,具有四个同源结构域,每个结构域具有六个 α-螺旋跨膜片段(图3)。 α-亚基的外表面被高度糖基化,这有助于使通道在质膜内正确定向(图4)。 无脊椎动物只有一两个钠通道α-亚基基因,这些通道的正常生理作用尚不清楚(当通道不存在时动物存活)。
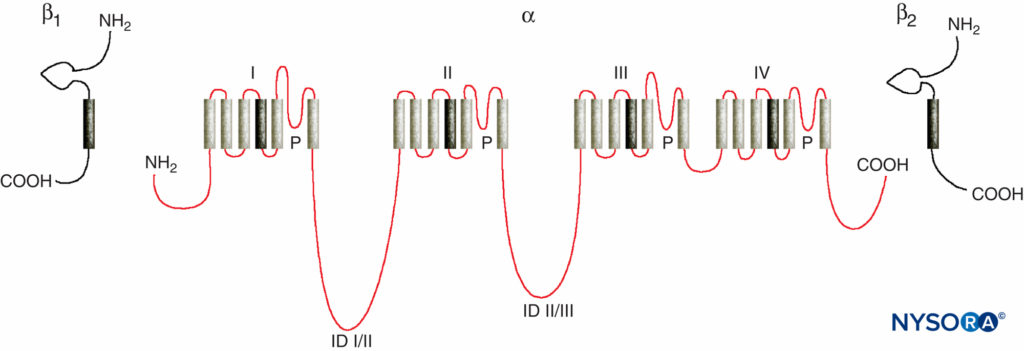
图3。 Na通道亚基的“卡通”结构。 请注意,α-亚基有四个结构域,每个结构域包含六个跨膜片段。 (经 Plummer NW 许可转载,Meisler MH:哺乳动物钠通道基因的进化和多样性。基因组学。1999 年 15 月 57 日;2(323):331-XNUMX。)
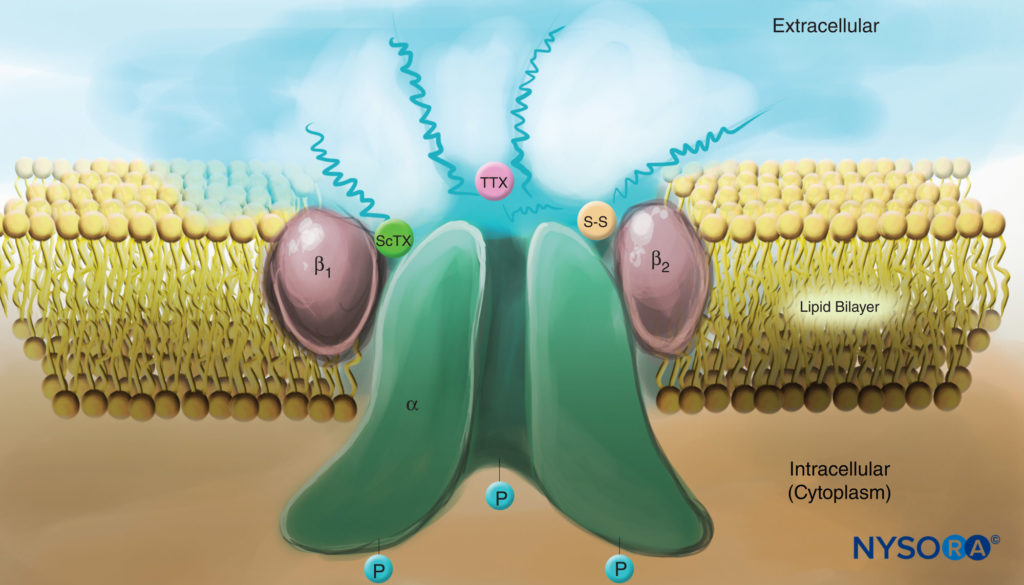
图4。 质膜中钠通道的卡通画。 请注意,所有三个亚基都在细胞外侧高度糖基化(参见“波浪线”)。 与局部麻醉剂相比,请注意蝎子毒素 (ScTX) 和河豚毒素 (TTX) 在通道外表面都有结合位点。 另请注意,通道的细胞质侧被磷酸化。 (经 Catterall WA 许可转载:电压门控钠通道的细胞和分子生物学。Physiol Rev. 1992 Oct;72(4 Suppl):S15-S48。)
表1。 电压门控钠通道——神经亚型。
| Nav 1.1 | Nav 1.2 | Nav 1.3 | Nav 1.6 | Nav 1.7 | Nav 1.8 | Nav 1.9 | |
|---|---|---|---|---|---|---|---|
| 染色体 | 2 | 2 | 2 | 12 | 2 | 3 | 3 |
| 在哪里确定 | 中枢神经系统、背根神经节 | CNS | 受伤后中枢神经系统上调 | DRG(大和小)、CNS、Ranvier | DRG(大和小) | DRG(小) | DRG(小) |
| 失活 | 快速 | 快速 | 快速 | 快速 | 快速 | 放慢 | 放慢 |
| TTX | 敏感 | 敏感 | 敏感 | 敏感 | 敏感 | 不敏感 | 不敏感 |
资料来源:经 Novakovic SD、Eglen RM、Hunter JC 许可改编:神经系统中 Na+ 通道分布的调节。 趋势神经科学。 2001 年 24 月;8(473):478-XNUMX。
相比之下,人类在 10 条染色体上有 XNUMX 个活跃的 Na 通道 α 亚基基因,具有细胞特异性表达和基因产物的定位。 XNUMX Nav 1.4 基因(按照惯例,遗传学家将电压门控 Na 通道异构体称为 Nav 1.x) 为骨骼肌提供通道,而 Nav 1.5 基因为心肌供应通道,留下七钠v 神经组织中的亚型(表1)。 确定的基因为每个无髓轴突、运动轴突中的 Ranvier 节点和小背根神经节伤害感受器贡献特定的 Na 通道形式。 尽管所有 Na 通道 α-亚基都会以类似的方式结合 LA,但它们对结合神经毒素的亲和力会有所不同。 Na 通道 α 和 β 亚基突变导致肌肉、心脏和神经疾病。 例如,Na 的遗传突变v 1.5曾与先天性长QT综合征、Bruguda综合征等传导系统疾病有关。 已经表明,某些 Nav 亚型在慢性疼痛的动物模型中增殖。 特定Na的存在v 基因 α-亚基产物提供了一种诱人的可能性,即有朝一日可能针对每种特定的 Na 开发抑制剂v α-亚基形式。 对于一些 Nav 异构体,这种发展已经在进行中,可能会彻底改变慢性疼痛的治疗。 阻断神经纤维中的冲动需要一定长度的神经变得不可兴奋(以防止冲动“跳过”被阻断的部分)。 因此,随着 LA 浓度的增加,它必须沿较短的神经长度应用以防止冲动传导,如图所示 图5. 有髓神经纤维和无髓神经纤维之间的正常传导和 LA 抑制传导的方式都不同。 有髓纤维中的传导从一个 Ranvier 结跳到下一个,这一过程称为跳跃传导。 为了阻断有髓神经纤维中的冲动,LAs 通常需要抑制三个连续 Ranvier 结中的通道。图6)。 缺乏跳跃机制的无髓纤维传导速度比有髓纤维慢得多。 无髓纤维对 LAs 具有相对抗性,尽管它们的直径较小,这是由于 Na 通道在其质膜中的分散。 当 Na 通道开始聚集在有髓轴突的 Ranvier 节点时,神经纤维之间的这些差异就会出现。 通道的节点聚集是高速信号传输所必需的,由周围神经系统中的雪旺细胞和中枢神经系统 (CNS) 中的少突胶质细胞启动。 Na 通道可能以至少三种天然构象存在:“静止”、“开放”和“失活”,首先由 Hodgkin 和 Huxley 描述。 在动作电位期间,神经元 Na 通道短暂打开,允许细胞外 Na 离子流入细胞,使质膜去极化。 仅几毫秒后,Na 通道失活(Na 电流停止时)。 Na 通道通过膜复极化返回静止构象。 通道从导电形式变为非导电形式的过程称为门控。 假设门控是由于偶极子响应电位变化而移动的结果。 电压门控通道的运行过程可能涉及到桨形电压传感器在通道外围的移动(图7)。 Na 之间的门控过程速度不同v α-亚基形式:骨骼肌和神经形式比心脏形式更快。
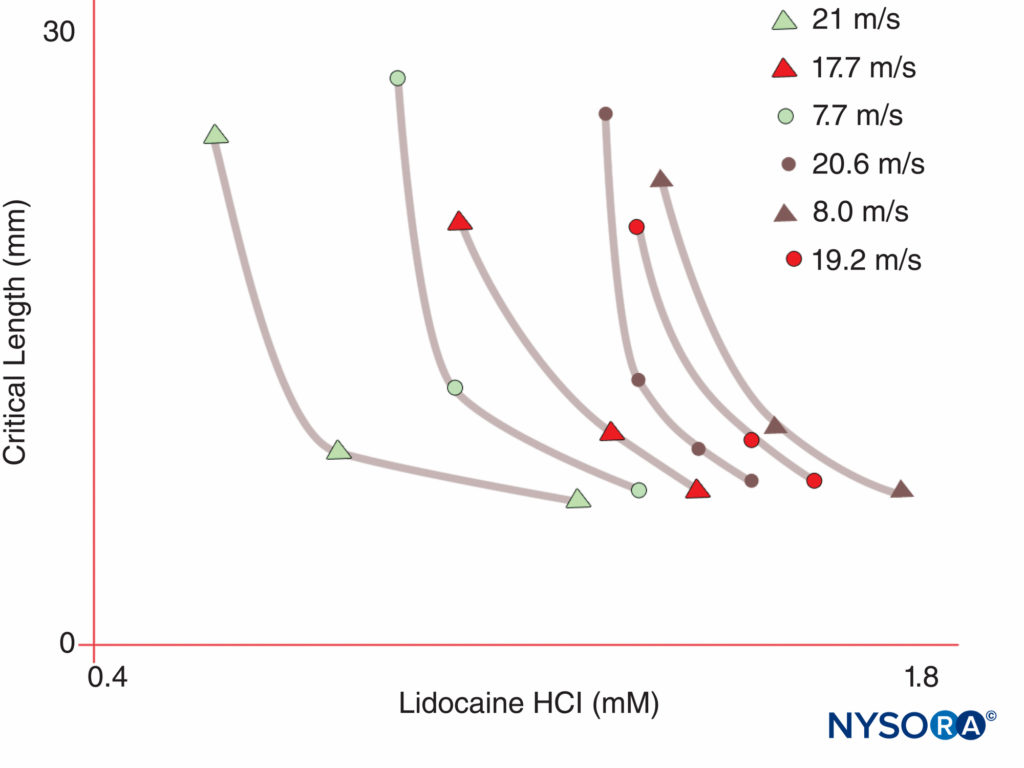
图5。 请注意,产生神经阻滞所需的局部麻醉剂浓度随着暴露于局部麻醉剂的神经长度的增加而下降。 (经 Raymond SA、Steffensen SC、Gugino LD 等人许可转载:暴露于局部麻醉剂的神经长度在脉冲阻断作用中的作用。Anesth Analg. 1989 May;68(5):563-570。)
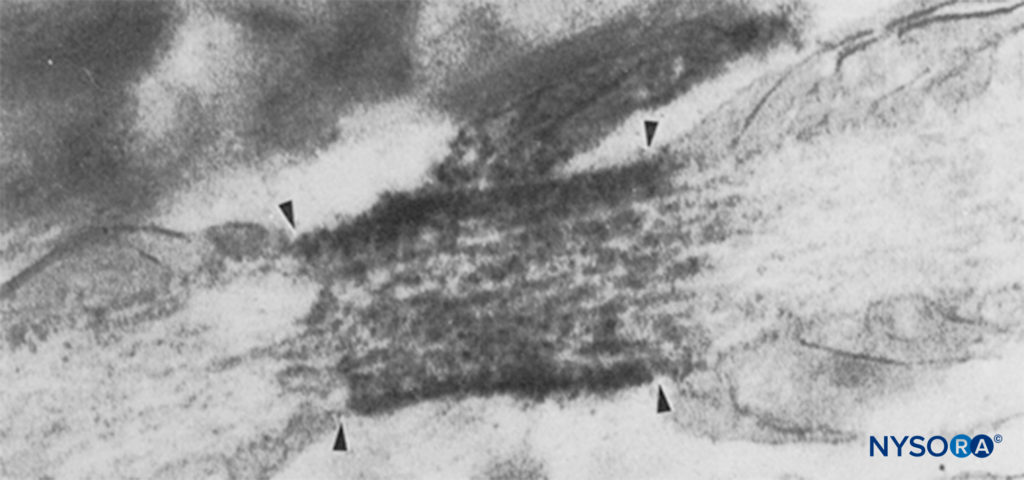
图6。 Ranvier 节点的电子显微照片。 Na 通道已被免疫标记并在四个箭头内显示为致密颗粒。 结节旁区域用“pn”表示,星形胶质细胞用“as”表示。 (经 Black JA、Friedman B、Waxman SG 等人许可转载:大鼠视神经 Ranvier 节点和节间星形胶质细胞钠通道的免疫超微结构定位。Proc R Soc Lond B Biol Sci. 1989 Oct 23;238 (1290):39-51。)
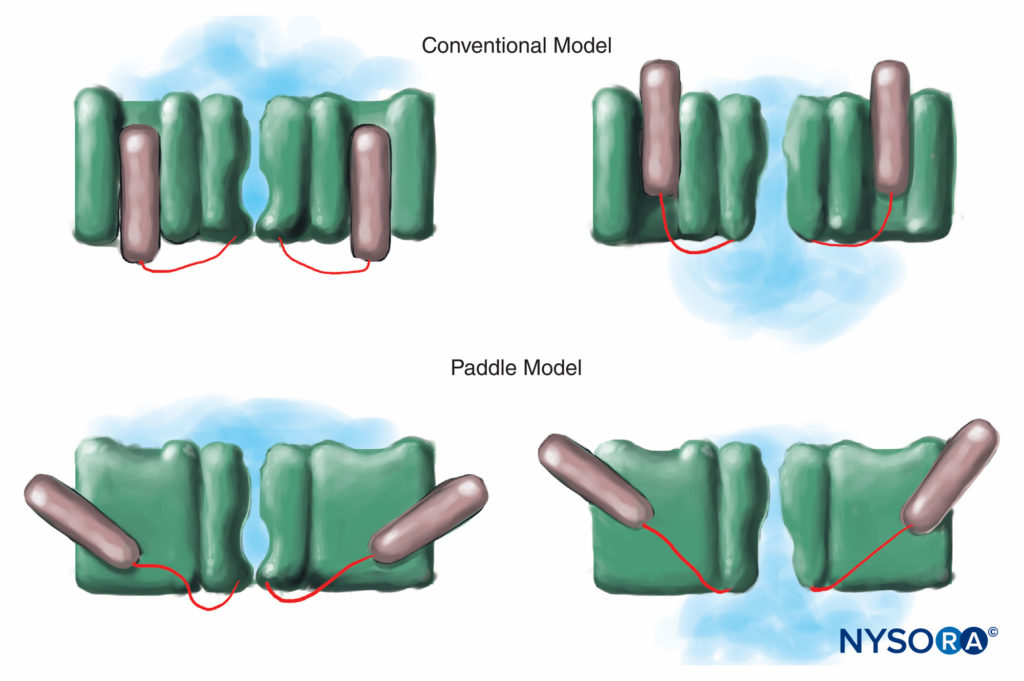
图7。 在电压门控的传统模型中,通道的电压感应部分在膜中“进出”。 最近对 K 通道的 X 射线衍射研究表明,更合适的机制是桨状结构对角滑动穿过质膜的机制。 (经 Arhem P 许可转载:离子通道中的电压传感:一个 50 年前的谜团已解开?柳叶刀。2004 年 10 月 363 日;9416(1221):1223-XNUMX。)
当 LA 结合 Na 通道并抑制作为动作电位基础的 Na 渗透性时,就会产生麻醉。 我们对 LA 机制的理解已经通过几个关键观察得到完善。 Taylor 证实 LA 选择性地抑制神经中的 Na 通道。 Strichartz 首次观察到 LA 的使用依赖性阻滞,显示了通道开放对 LA 结合的重要性。 使用(或频率)依赖性描述了 LA 对 Na 电流的抑制如何随着重复去极化(“使用”)而增加。 重复的去极化序列增加了 LA 遇到开放或失活的 Na 通道的可能性,这两种形式都比静息通道具有更高的 LA 亲和力。图8)。 因此,膜电位影响钠通道构象和钠通道对 LA 的亲和力。 使用依赖性阻滞似乎对 LA 作为抗心律失常药的功能很重要,也可能是降低 LA 浓度在控制疼痛中的有效性的基础。 最后,使用定点诱变,Ragsdale 和 Wang 将 LA 与 Na 的 D4S6 中的特定氨基酸结合v 1.2 和钠v 1.4. 一些 LA 旋光异构体比其相反的对映异构体具有更高的表观安全性。 例如,在电压钳下,R(+)-布比卡因异构体比 S(-)-布比卡因(左布比卡因)异构体更有效地抑制心脏钠电流。图9)。 许多其他类型的化学物质也会结合和抑制 Na 通道,包括全身麻醉剂、P 物质抑制剂、α2-肾上腺素能激动剂、三环类抗抑郁药和神经毒素。 神经毒素目前正在进行动物和人体测试,作为 LA 的可能替代品。
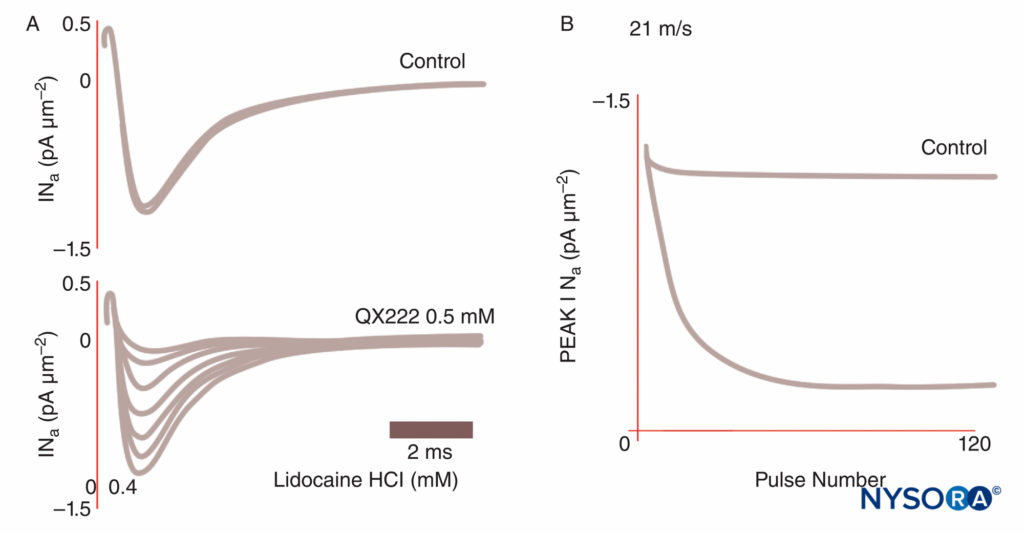
图8。 浦肯野纤维中钠电流的使用依赖性阻断。 在控制条件下,每一个脉冲序列都会产生相同的电流轨迹。 在局部麻醉剂 QX222 存在的情况下,第一次脉冲的幅度与控制条件下的幅度几乎相同。 每个后续脉冲都较小(降低的峰值 INa),反映了 Na 通道的累积块,直到达到最低点。 (经 Hanck DA、Makielski JC、Sheets MF 许可转载:四元利多卡因阻滞心脏钠通道的动力学效应:门控电流研究。J Gen Physiol. 1994 Jan;103(1):19-43。)
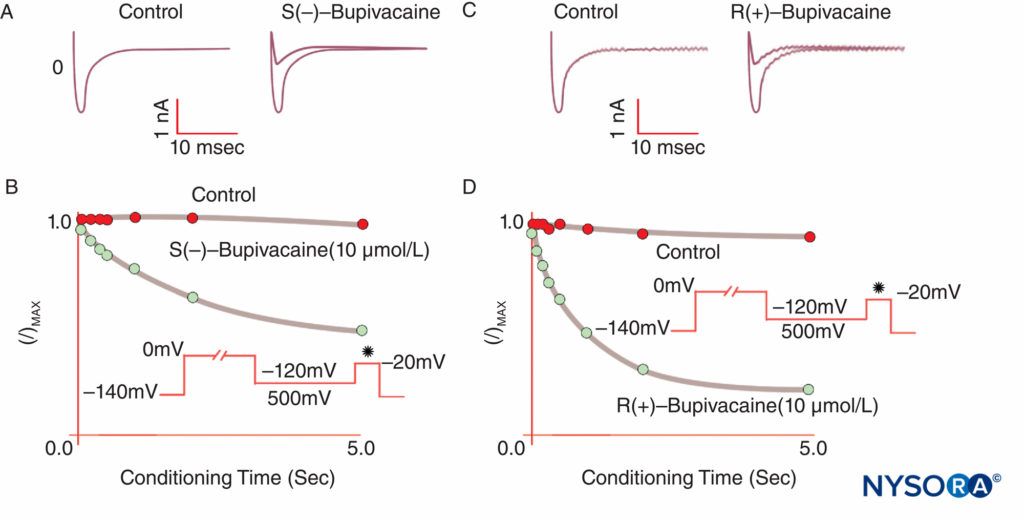
图9。 相对于 R(+)-布比卡因,S(–) 布比卡因在电压钳下抑制心脏 Na 电流的效力降低。 经过不同长度的标准“调节”去极化后,S(–) 异构体产生的 I/Imax 降低少于 R(+) 异构体。 (经 Valenzuela C、Snyders DJ、Bennett PB 等人许可转载:布比卡因在豚鼠心室肌细胞中对心脏钠通道的立体选择性阻滞。循环。1995 年 15 月 92 日;10(3014):3024-XNUMX。)
局部麻醉药效学
在临床实践中,LA 通常通过其效力、作用持续时间、起效速度和差异性感觉神经阻滞的趋势来描述。 这些属性不会独立排序。
效力和持续时间
LAs 的神经阻滞效力随着分子量的增加和脂溶性的增加而增加。 更大、更亲脂的 LA 更容易渗透神经膜并以更大的亲和力结合 Na 通道。 例如,依替卡因和布比卡因比利多卡因和甲哌卡因具有更高的脂溶性和效力,它们在化学上密切相关。
NYSORA 小贴士
- LAs 的神经阻滞效力随着分子量的增加和脂溶性的增加而增加。
更多的脂溶性 LA 是相对不溶于水的,在血液中与蛋白质高度结合,不太容易被血液从神经膜中去除,并且在体外从孤立的神经中“洗掉”的速度更慢。 因此,增加的脂溶性与增加的血液中的蛋白质结合、增加的效力和更长的作用持续时间有关。 麻醉的程度和持续时间可以与动物实验中神经的 LA 含量相关。 在动物中,与较大体积的较不集中的 LA 相比,较小体积的较集中的 LA 会产生较大深度和较长持续时间的块。
发病速度
许多教科书和评论文章断言,随着 LA 脂溶性的增加和 pKa 的增加,孤立神经的麻醉开始减慢。表2)。 在任何 pH 值下,以不带电形式存在的 LA 分子的百分比(主要负责膜通透性)随着 pKa 的增加而降低。然而,在起效最快的两种 LA 中,依替卡因是高度脂溶性的,而氯普鲁卡因的 pKa 大于其他 LA。 最后,LA 的起始速率与水扩散速率有关,随着分子量的增加而下降。
表2。 局部麻醉剂的特征倾向于归类在一起。
物理和化学
- 增加脂溶性
- 增加蛋白质结合
药理学和毒理学
- 增加效力
- 增加发病时间
- 增加作用时间
- 严重全身毒性的增加趋势
- 一般来说,所有人都倾向于一起排序
差异感觉神经阻滞
局部麻醉和疼痛管理将被 LA 所改变,该 LA 将选择性地抑制疼痛传播,同时保持其他功能完好无损。 然而,在没有运动障碍的情况下,通常无法获得足以进行皮肤切口的感觉麻醉。 正如 Gasser 和 Erlanger 在 1929 年首次证明的那样,所有 LA 将在比阻止相同类型的较大纤维所需的浓度低的情况下阻止较小(直径)的纤维。 作为一个群体,与较大的有髓 A-δ 纤维相比,无髓纤维对 LA 具有抗性。 布比卡因和罗哌卡因对感觉纤维的选择性相对较高。 布比卡因比运动阻滞产生更快的感觉起效,而密切相关的化学甲哌卡因在正中神经阻滞期间没有表现出不同的起效。图10)。 当 Nav 异构体选择性拮抗剂可用时,真正的差异麻醉是可能的。 已发现某些 Nav 同种型在背根神经节中普遍存在,并且(如前所述)各种 Nav 同种型的相对群体可以响应各种疼痛状态而改变。
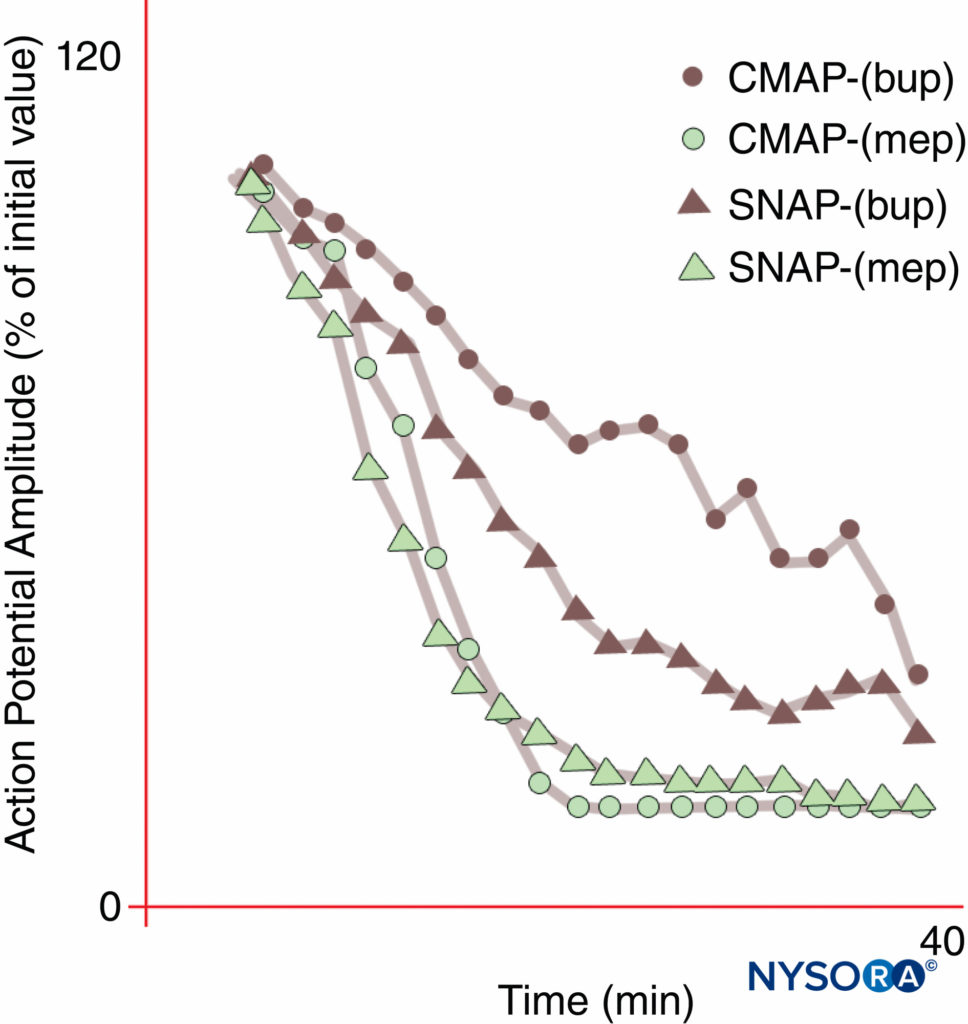
图10。 使用 0.3% 布比卡因 (bup) 时不同的正中神经阻滞起效,但使用 1% 甲哌卡因 (mep) 时则不然。 请注意,在这些正常志愿者受试者中,在布比卡因阻滞开始期间,复合运动动作电位 (CMAP) 的抑制程度低于感觉神经动作电位 (SNAP)。 在稳定状态(20 分钟),CMAP 和 SNAP 受到相当的抑制。 另一方面,甲哌卡因对 CMAP 和 SNAP 产生更快的抑制作用,并且没有不同的阻滞开始。 (经 Butterworth J、Ririe DG、Thompson RB 等人许可转载:正中神经阻滞的不同起效:健康志愿者中甲哌卡因和布比卡因的随机、双盲比较。Br J Anaesth。1998 年 81 月;4(515): 521-XNUMX。)
影响局麻药活性的其他因素
许多因素影响给定 LA 产生足够区域麻醉的能力,包括剂量、给药部位、 添加剂,温度和怀孕。 随着 LA 剂量的增加,成功的可能性和麻醉持续时间增加,而起效延迟和差异阻滞趋势减少。 一般来说,脊髓或皮下注射麻醉起效最快、持续时间最短; 使用丛阻滞可获得较慢的起效和较长的持续时间。
NYSORA 小贴士
- 如怀孕期间所见,给定 LA 的有效性受剂量、给药部位、添加剂、温度和神经易感性变化的影响。
肾上腺素经常添加到 LA 溶液中以引起血管收缩并用作血管内注射的标志物。 肾上腺素和其他 α1 激动剂主要通过延长和增加 LA 的神经内浓度来增加 LA 持续时间。 血流仅短暂减少,并且在 α1-肾上腺素能对血流的作用消散后,阻滞仍会持续很长时间。 其他流行的 LA 添加剂包括可乐定、碳酸氢钠、阿片类药物、地塞米松和透明质酸酶。 不带电荷的局部麻醉剂在碱性 pH 值下比在酸性更强的 pH 值下具有更大的表观效力,其中更多的 LA 分子不带电荷。图11)。 不带电的 LA 碱基比带电的 LA 更容易扩散穿过神经鞘和神经膜,从而加速麻醉的开始。 一些临床研究表明,在临床神经阻滞过程中,添加碳酸氢钠的作用不一致; 然而,并非所有研究都表明麻醉起效更快。 人们可能会预期,碳酸氢盐在添加到制造商添加了肾上腺素的 LA 溶液中时会产生最大的效果。 此类溶液比“普通”(不含肾上腺素)LA 溶液酸性更强,可延长保质期。 碳酸氢盐可缩短动物体内利多卡因的持续时间。 奇怪的是,一旦 LA 进入 Na 通道的细胞质侧,H+ 离子就会增强使用依赖性阻断。 局部麻醉的显着延长可以通过将 LA 掺入脂质体来实现,正如在某些制剂中使用布比卡因所做的那样。
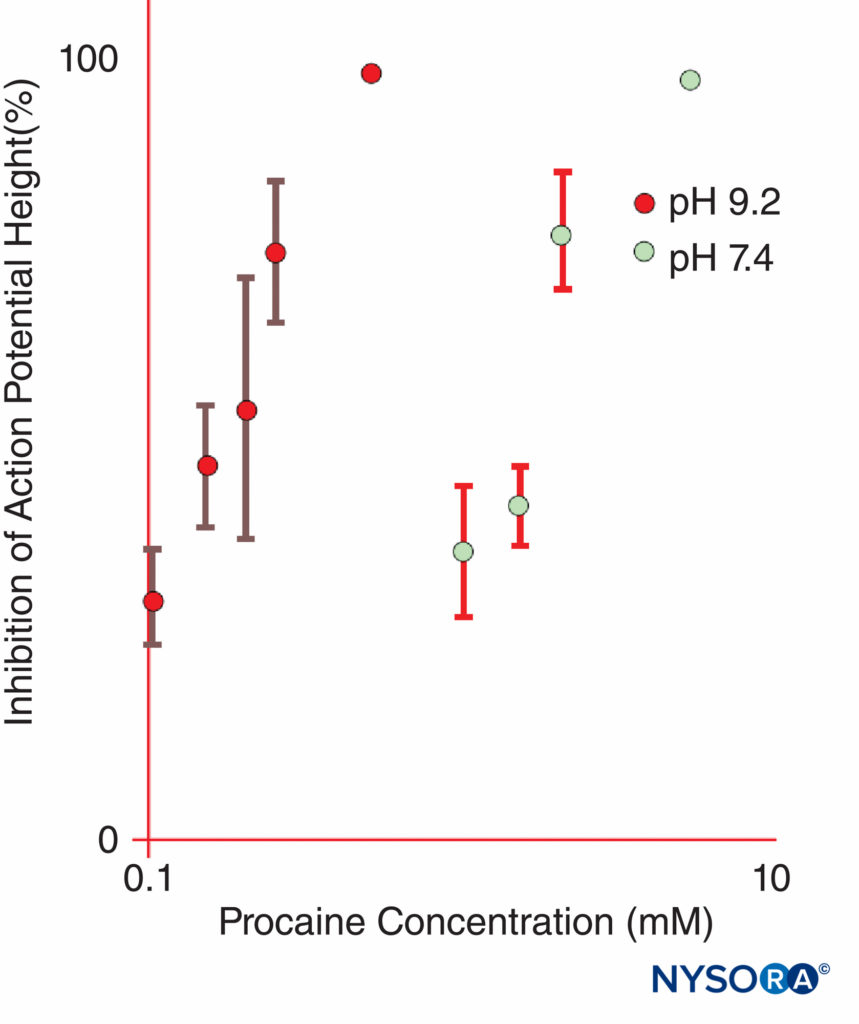
图11。 与 pH 9.2 相比,普鲁卡因抑制离体青蛙坐骨神经复合动作电位的效力在 pH 7.4 时显着增加。 (经 Butterworth JF、Lief PA、Strichartz GR 许可转载:普鲁卡因代谢物二乙氨基乙醇的 pH 依赖性局部麻醉活性。麻醉学。1988 年 68 月;4(501):506-XNUMX。)
NYSORA 小贴士
- 怀孕增加了对 LA 的神经易感性。
孕妇和怀孕动物表现出对 LA 的神经敏感性增加。 此外,由于胸腰椎脑脊液量减少,在怀孕期间椎管内麻醉的扩散可能会增加。
血液浓度和药代动力学
峰值 LA 浓度因注射部位而异(图12)。 在相同的 LA 剂量下, 肋间块 始终产生更高的峰值 LA 浓度比 硬膜外 或丛块。 正如其他人最近讨论的那样,除了参考特定的神经阻滞程序外,谈论 LA 的“最大”剂量几乎没有意义,因为峰值血液水平因阻滞部位而异。 在血液中,所有 LA 都部分与蛋白质结合,主要与 α1-酸性糖蛋白结合,其次与白蛋白结合。
对 α1-酸性糖蛋白的亲和力与 LA 疏水性相关,并随着质子化(酸度)而降低。 蛋白质结合的程度受α1-酸性糖蛋白浓度的影响。 怀孕期间蛋白质结合和蛋白质浓度都会下降。 在长期输注 LA 和 LA-阿片类药物组合期间,LA 结合蛋白的浓度逐渐增加 肺对 LA 的首过摄取量相当大,动物研究表明右向左心脏分流的患者可能预计会展示 洛杉矶毒性 在较小的静脉推注剂量后。
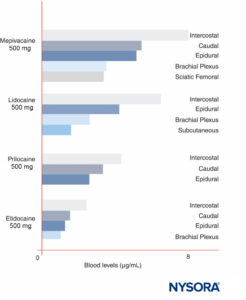
图12。 各种形式的区域麻醉后局部麻醉剂的血药浓度峰值。 请注意,肋间阻滞始终导致血液中的局部麻醉剂浓度最高,而神经丛阻滞导致血液中的局部麻醉剂浓度最低,而硬膜外/尾部技术介于两者之间。 (经 Covino BG、Vassallo HG 许可转载:局部麻醉剂:作用机制和临床使用。Grune & Stratton;1976 年。)
NYSORA 小贴士
- 药理学教科书中常见的 LA 最大剂量建议在临床区域麻醉实践中并不是非常有用。
- LAs 的血清浓度取决于注射技术、注射部位和 LA 中添加的添加剂。
- 任何关于最大安全 LA 剂量的建议仅在参考特定的神经阻滞程序时才有效。
酯在非特异性酯酶的催化下在血液中快速水解。 普鲁卡因和苯佐卡因代谢为对氨基苯甲酸 (PABA),即对这些药物产生过敏反应的物种。 较高剂量的苯佐卡因,通常用于内窥镜检查的局部麻醉,可导致危及生命的高铁血红蛋白血症。 酰胺在肝脏中进行代谢。 利多卡因经历氧化 N-脱乙酰基化(通过细胞色素 CYP 1A2 和 CYP 3A4 生成单乙基甘氨酸木糖二胺和甘氨酸木糖二胺)。 布比卡因、罗哌卡因、甲哌卡因和依替卡因也会发生 N-脱烷基化和羟基化。 丙胺卡因水解为邻甲苯胺,即导致高铁血红蛋白血症的药物。 在健康成人中,低至 400 mg 的丙胺卡因剂量可能会产生足以引起临床紫绀的高铁血红蛋白血症浓度。 Amide LA 清除率高度依赖于肝血流量、肝提取和酶功能; 因此,减少肝血流量的因素(例如 β-肾上腺素能受体或 H2-受体阻滞剂)会降低酰胺 LA 清除率,以及 心脏或肝脏衰竭. 由于心输出量、肝血流量和清除率增加,以及前面提到的蛋白质结合下降,妊娠期酰胺 LAs 的分布发生了变化。 肾功能衰竭倾向于增加酰胺 LAs 的分布容积并增加酯和酰胺 LAs 代谢副产物的积累。 理论上,胆碱酯酶缺乏症和胆碱酯酶抑制剂会增加酯类 LA 的全身毒性风险; 但是,没有确认性的临床报告。 一些药物抑制负责 LA 代谢的各种细胞色素; 然而,细胞色素抑制剂的重要性因特定的 LA 种类而异。 β-受体阻滞剂和 H2 受体阻滞剂抑制 CYP 2D6,这可能有助于减少酰胺 LA 代谢。 伊曲康唑对肝血流量没有影响,但抑制 CYP 3A4 和布比卡因消除 20%–25。 罗哌卡因被 CYP 1A2 羟基化并被 CYP 2A6 代谢为 3',4'-哌醋甲内酯。 氟伏沙明抑制 CYP 1A2 可将罗哌卡因清除率降低 70%。 另一方面,与 CYP 3A4 强抑制剂(酮康唑、伊曲康唑)合用对罗哌卡因清除率的影响很小。
直接毒副作用
这是一个常见但被误导的假设,即所有 LA 作用,包括毒副作用,都源于与电压门控 Na 通道的相互作用。 有大量证据表明 LA 会结合除 Na 通道以外的许多其他靶标,包括电压门控 K 和 Ca 通道、KATP 通道、酶、N-甲基-D-天冬氨酸受体、β-肾上腺素能受体、G-蛋白介导的调节K 和 Ca 通道以及烟碱型乙酰胆碱受体。 LA 与任何一个或所有这些其他位点的结合可能是 LA 产生 脊 or 硬膜外镇痛 并可能导致毒副作用。
中枢神经系统副作用
局部麻醉剂中枢神经系统毒性源于选择性阻断中枢神经系统中兴奋性通路的抑制,随着血液中 LA 浓度逐渐升高,产生一系列典型的体征和症状。表3)。 随着 LA 剂量的增加,杏仁核可能会出现癫痫发作。 随着进一步的 LA 给药,CNS 兴奋会进展为 CNS 抑制和最终呼吸停止。 更强效(神经阻滞)的 LA 在较低的血液浓度和较低的剂量下会比弱效的 LA 产生癫痫发作。 在动物研究中,代谢性酸中毒和呼吸性酸中毒都降低了利多卡因的惊厥剂量。
表3。 随着局部麻醉剂剂量(或浓度)逐渐增加,毒性症状和体征的进展。
- 眩晕
- 耳鸣
- 不祥的感觉
- 周围麻木
- 多嘴
- 震颤
- 肌阵挛抽搐
- 惊厥
- 昏迷
- 心血管衰竭
心血管毒性
在实验室实验中,大多数 LA 不会产生心血管 (CV) 毒性,直到血液浓度超过产生癫痫发作所需的三倍; 然而,有临床报告显示布比卡因同时出现 CNS 和 CV 毒性(表4)。 在狗中,超惊厥剂量的布比卡因比超惊厥剂量的罗哌卡因和利多卡因更常产生心律失常。 LA 产生 CNS 兴奋的 CV 征象(心率、动脉血压和心输出量增加),其浓度低于与心脏抑制相关的浓度。 低碳酸血症可减少罗哌卡因引起的 ST 段和左心室收缩力的变化。
NYSORA 小贴士
- 在实验室实验中,大多数 LA 不会产生 CV 毒性,直到血液浓度超过产生癫痫发作所需的三倍。
表4。 犬局部麻醉剂的惊厥剂量与致死剂量。
| 利多卡因 | 布比卡因 | 丁卡因 | |
|---|---|---|---|
| 所有动物的惊厥剂量 (mg/kg) | 22 | 5 | 4 |
| 所有动物的剂量产生致死率 (mg/kg) | 76 | 20 | 27 |
局麻药结合并抑制心脏钠离子通道(Nav 1.5 异构体)。 与利多卡因相比,布比卡因与心脏钠通道的结合更强烈、更持久。 如前所述,某些 R(+) 旋光异构体比 S(-) 旋光异构体更强烈地结合心脏钠通道。 这些实验室观察促成了左旋布比卡因和罗哌卡因的临床开发。 局部麻醉剂抑制心脏传导,其效力等级与神经阻滞相同。 局部麻醉剂产生剂量依赖性心肌抑制,可能是由于干扰了心肌内的 Ca 信号传导机制。 这些麻醉剂结合并抑制心脏电压门控 Ca 和 K 通道的浓度高于与 Na 通道结合最大时的浓度。 LAs 结合 β-肾上腺素能受体并抑制肾上腺素刺激的环磷酸腺苷 (AMP) 形成。 在大鼠中,心脏毒性的排序似乎是布比卡因 > 左布比卡因 > 罗哌卡因。 在狗中,利多卡因是最不有效的,而布比卡因和左布比卡因在抑制左心室功能方面比罗哌卡因更有效,超声心动图评估了这一点。表5)。 在狗中,程序性电刺激和肾上腺素复苏在布比卡因和左旋布比卡因后比在利多卡因或罗哌卡因给药后引起更多的心律失常。 产生 CV 毒性的机制可能取决于所使用的 LA。 当 LA 被给予极度低血压时,接受利多卡因的狗可以复苏,但需要持续输注肾上腺素以抵消 LA 引起的心肌抑制。 相反,许多接受布比卡因或左布比卡因治疗到极度低血压的狗无法复苏。 在布比卡因、左旋布比卡因或罗哌卡因之后,可以进行除颤的狗通常不需要额外的治疗。 同样,在猪中,比较利多卡因和布比卡因,心肌抑制的效力比为 1:4,而心律失常发生的效力比为 1:16。 LAs 在临床浓度下产生血管平滑肌扩张。 可卡因是唯一持续产生局部血管收缩的 LA。
过敏反应
NYSORA 小贴士
- 对 LA 的真正免疫反应很少见。
- 与其他 LA 相比,直接代谢为 PABA 的酯 LA 更常见真正的过敏反应。
- LAs 的意外静脉注射有时会被误诊为过敏反应。
- 一些患者可能会对 LA 中包含的防腐剂产生反应,例如对羟基苯甲酸甲酯。
对 LA 的真正免疫反应很少见。 LAs 的意外静脉注射有时会被误诊为过敏反应。 与其他 LA 相比,直接代谢为 PABA 的酯 LA 更常见真正的过敏反应。 一些患者可能会对 LA 中包含的防腐剂产生反应,例如对羟基苯甲酸甲酯。 几项研究表明,即使在表现出过敏反应的体征或症状后,转诊评估明显 LA 过敏的患者也几乎从未表现出对所施用的 LA 的真正过敏。 另一方面,LA 皮肤测试具有极好的阴性预测值。 换言之,97% 对 LA 皮肤测试无反应的患者在临床环境中也不会对 LA 产生过敏反应。
表5。 局部麻醉剂对犬心肌功能指标的影响。
| 局部麻醉药 | LVEDP(欧共体50 对于 125% 基础) (微克/毫升) | 差压/差压最大 (EC50 对于 65% 基础) (微克/毫升) | %FS (欧共体50 对于 65% 基础) (微克/毫升) |
|---|---|---|---|
| 布比卡因 | 2.2(1.2-4.4) | 2.3(1.7-3.1) | 2.1(1.47-3.08) |
| 左布比卡因 | 1.7(0.9-3.1) | 2.4(1.9-3.1) | 1.3(0.9-1.8) |
| 罗哌卡因 | 4.0(2.1-7.5)一个/支持> | 4.0(3.1-5.2)b | 3.0(2.1-4.2)一个/支持> |
| 利多卡因 | 6.8(3.0-15.4)c | 8.0(5.7-11.0)d | 5.5(3.5-8.7)d |
神经毒性作用
在 1980 年代,2-氯普鲁卡因(当时用焦亚硫酸钠在相对酸性的 pH 值下配制)在尝试硬膜外给药期间意外大剂量鞘内注射后偶尔会产生马尾综合征。 “毒素”是 2-氯普鲁卡因还是焦亚硫酸钠仍未确定:目前正在测试 2-氯普鲁卡因在人体脊髓麻醉中作为利多卡因的替代品,一系列出版物表明它可能是安全有效的。 同时,其他研究人员将动物的神经毒性反应与大剂量的 2-氯普鲁卡因联系起来,而不是与焦亚硫酸盐联系起来。 关于利多卡因脊髓麻醉后短暂的神经系统症状和持续性骶骨缺损也存在争议。 这些报道和争议已经说服许多医生放弃利多卡因脊髓麻醉。 与其他脊髓 LA 溶液不同,5% 的利多卡因在应用于孤立的神经或孤立的神经元时会永久中断传导。 这可能是利多卡因诱导的细胞内钙增加的结果,并且似乎不涉及钠通道阻滞。 虽然不可能“证明安全性”,但多项研究表明氯普鲁卡因或甲哌卡因可以替代利多卡因进行短暂的脊髓麻醉。
局麻药毒性的治疗
LA 不良反应的治疗取决于其严重程度。 可以允许轻微反应自发终止。 由 LA 引起的癫痫发作应通过保持气道通畅和提供氧气来控制。 可通过静脉注射咪达唑仑 (0.05–0.10 mg/kg) 或丙泊酚 (0.5–1.5 mg/kg) 或麻痹剂量的琥珀胆碱 (0.5–1 mg/kg) 终止癫痫发作,然后用袋子和面罩(或气管插管)。 LA CV 抑制表现为中度低血压,可通过静脉输液和血管加压剂(去氧肾上腺素 0.5-5 μg/kg/min,去甲肾上腺素 0.02-0.2 μg/kg/min,或血管加压素 40 μg IV)治疗。 如果出现心肌衰竭,可能需要肾上腺素(1-5 μg/kg 静脉推注)。 当毒性进展为心脏骤停时,由美国局部麻醉和疼痛医学协会 (ASRA) 制定的 LA 毒性治疗指南是合理的,并且肯定优于在公布之前在全国调查中确定的混乱复苏计划。指导方针。 用胺碘酮代替利多卡因是有道理的,并且基于多项动物实验,最初使用更小、增量剂量的肾上腺素而不是 1-mg 丸剂。 动物实验和临床报告证明了脂质输注对布比卡因诱导的心脏骤停复苏的显着能力。图13). 鉴于脂质输注几乎无毒的状态,人们无法提出令人信服的论据来拒绝对需要从 LA 中毒中复苏的患者进行这种治疗。 对于无反应的布比卡因心脏毒性,应考虑体外循环。 似乎来自严重局部麻醉剂全身毒性的威胁可能正在下降,无论是来自更好的治疗还是来自技术的变化。 少数人会争辩说,风险从一开始就被夸大了,至少在有经验的人手中是这样。 许多从业者认为,周围神经阻滞期间的超声引导导致了更安全的做法和更低的风险。 尽管这一观点仍有争议,但也有研究支持这一观点。
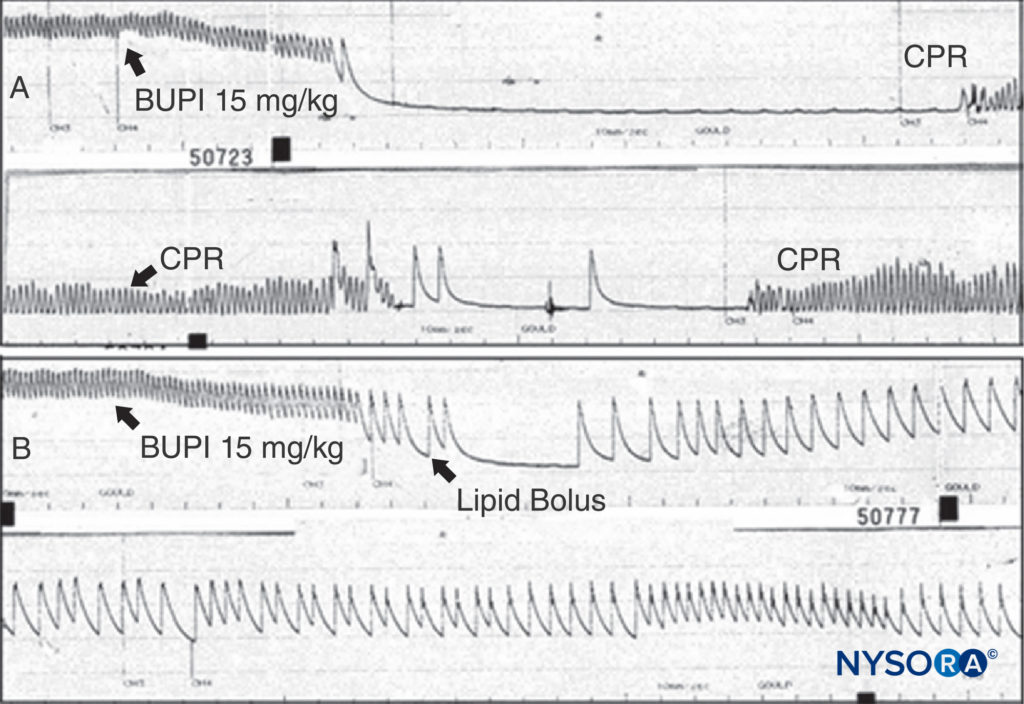
图13。 A: 麻醉大鼠按指示给予布比卡因 15 mg/kg。 动脉血压迅速下降至心脏骤停。 给予心肺复苏术 (CPR),但停止 CPR 后未观察到动脉压。 B:进行相同的实验,但给予一团脂质; 请注意,动脉压永远不会丢失(尽管使用了相同剂量的布比卡因),并且不会发生心脏骤停。 (经 Weinberg G 许可转载:局部麻醉心脏毒性患者复苏的当前概念。Reg Anesth Pain Med. 2002 Nov-Dec;27(6):568-575。)
概要
在西医使用了一个多世纪后,LA 仍然是 XNUMX 世纪医生的重要工具。 外周神经阻滞几乎肯定是 LA 抑制神经元膜中电压门控 Na 通道的结果。 脊髓和硬膜外麻醉的机制仍未完全确定。 LAs 的适当和安全剂量因具体的神经阻滞程序而异。 不同的 LA 产生 CV 毒性的机制可能不同:强效药物(例如布比卡因)可能通过钠通道作用产生心律失常,而弱效药物(例如利多卡因)可能通过其他途径产生心肌抑制。 随着更安全的 LA、更安全的区域麻醉实践和改进的治疗,对 LA 全身毒性的担忧已经减弱。 正在重新努力生产临床适用的延迟释放局部麻醉剂制剂,以延长目前可用的 LA 的持续时间。
参考文献:
- Vandam LD:局部麻醉历史的某些方面。 在 Strichartz GR(编辑)中:局部麻醉剂:实验药理学手册。 施普林格出版社,1987 年,第 1-19 页。
- Calatayud J,Gonzalez A:自古柯叶以来局部麻醉的发展和演变历史。 麻醉学 2003;98:1503–1508。
- Strichartz GR:局部麻醉剂:实验药理学手册。 施普林格出版社,1987 年。
- de Jong RH:局部麻醉剂。 莫斯比年鉴,1994 年。
- Keys TE:外科麻醉的历史。 伍德图书馆,麻醉学博物馆,1996 年。
- Butterworth JF IV,Strichartz GR:局部麻醉的分子机制:综述。 麻醉学 1990;72:711–734。
- Tetzlaff J:局部麻醉剂的临床药理学。 巴特沃斯-海涅曼,2000 年。
- Ahern CA、Payandeh J、Bosmans F、Chanda B. 电压门控钠通道星系的搭便车指南。 J Gen 生理学。 2016;147:1-24。
- 德莱拉鲁伊斯 M,克劳斯 RL。 电压门控钠通道:结构、功能、药理学和临床适应症。 J医学化学。 2015;58:7093–7118。
- Lopreato GF、Lu Y、Southwell A 等:脊椎动物钠通道基因的进化和分化。 Proc Natl Acad Sci USA 2001; 98:7588–7592。
- Savio-Galmiberti E. Gollob MH,Darbar D:电压门控钠通道:生物物理学、药理学和相关通道病。 前沿药效学 2012;3:1–19
- Chen-Izu Y、Shaw RM、Pitt GS 等。 Na+ 通道功能、调节、结构、运输和隔离。 J生理学。 2015;593:1347–1360
- Hille B:可兴奋膜的离子通道,第 3 版。 西诺尔,2001 年。
- 江 Y、Lee A、Chen J 等:电压依赖性 K+ 通道的 X 射线结构。 自然 2003;423:33-41。
- Freites JA,托拜厄斯 DJ。 膜中的电压传感:从宏观电流到分子运动。 J成员生物学。 2015;248:419–430。
- 泰勒 RE。 普鲁卡因对鱿鱼轴突膜电性能的影响。 美国生理学杂志 1959;196:1070–1078。
- 斯特里查茨 GR。 利多卡因四元衍生物对有髓神经钠电流的抑制作用。 J Gen 生理学。 1973;62:37-57。
- Ragsdale DS、McPhee JC、Scheuer T 等:局部麻醉剂对 Na+ 通道的状态依赖性阻断的分子决定因素。 科学 1994;265:1724–1728。
- Wang GK,Quan C,Wang S:电压门控 mu1 Na+ 通道中苯佐卡因和依替卡因的常见局部麻醉剂受体。 Pflugers Arch 1998;435:293–302。
- Sudoh Y、Cahoon EE、Gerner P 等:三环类抗抑郁药作为长效局部麻醉剂。 疼痛 2003;103:49-55。
- Kohane DS、Lu NT、Gokgol-Kline AC 等:用于体内大鼠坐骨神经阻滞的 saxitonin 同系物的局部麻醉特性和毒性。 Reg Anesth Pain Med 2000;25:52-59。
- Butterworth JF IV,Strichartz GR:α2-肾上腺素能激动剂可乐定和胍法辛在大鼠坐骨神经纤维中产生强直和阶段性传导阻滞。 Anesth Analg 1993;76:295–301。
- Sanchez V、Arthur GR、Strichartz GR:局部麻醉剂的基本特性。 I. 利多卡因的电离和辛醇:缓冲液分配对溶剂和温度的依赖性。 Anesth Analg 1987;66:159–165。
- Strichartz GR、Sanchez V、Arthur GR 等:局部麻醉剂的基本特性。 二、 测量临床使用药物的辛醇:缓冲分配系数和pKa值。 Anesth Analg 1990;71:158–170。
- Popitz-Bergez FA、Leeson S、Strichartz GR 等:外周神经阻滞期间功能缺陷与神经内局麻药之间的关系。 大鼠坐骨神经的一项研究。 麻醉学 1995;83:583–592。
- Sinnott CJ、Cogswell LP III、Johnson A 等人:关于肾上腺素增强利多卡因周围神经阻滞的机制。 麻醉学 2003;98:181–188。
- Nakamura T、Popitz-Bergez F、Birknes J 等人:浓度对体内周围神经的利多卡因阻滞的关键作用:大鼠功能和药物摄取的研究。 麻醉学 2003;99:1189–1197。
- Brouneus F、Karami K、Beronius P 等:适用于药物离子电渗制剂的一些局部麻醉剂的扩散传输特性。 国际药学杂志 2001;218:57-62。
- Gissen AJ、Covino BG、Gregus J:哺乳动物神经纤维对局部麻醉剂的敏感性差异。 麻醉学 1980;53:467–474。
- Raymond SA,Gissen AJ:差分神经阻滞的机制。 在 Strichartz GR(编辑):实验药理学手册:局部麻醉剂。 施普林格出版社,1987,第 95-164 页。
- Butterworth J、Ririe DG、Thompson RB 等:正中神经阻滞的不同起效:健康志愿者中甲哌卡因和布比卡因的随机双盲比较。 Br J Anaesth 1998; 81:515–521。
- Novakovic SD、Eglen RM、Hunter JC:神经系统中钠离子通道分布的调节。 趋势神经科学 2001;24:473–478。
- Covino BG,Vasallo HG:局部麻醉剂。 格鲁内和斯特拉顿,1976 年。
- Kohane DS、Lu NT、Cairns BE 等:肾上腺素能激动剂和拮抗剂对河豚毒素诱导的神经阻滞的影响。 Reg Anesth Pain Med 2001;26:239–245。
- Butterworth JF IV,Lief PA,Strichartz GR:普鲁卡因代谢物二乙氨基乙醇的 pH 依赖性局部麻醉活性。 麻醉学 1988;68:501–506。
- Fagraeus L,Urban BJ,Bromage PR:硬膜外镇痛在妊娠早期的传播。 麻醉学 1983;58:184–187。
- Butterworth JF IV、Walker FO、Lysak SZ:怀孕会增加正中神经对利多卡因的敏感性。 麻醉学 1990;72:962–965。
- Popitz-Bergez FA、Leeson S、Thalhammer JG 等人:与妊娠和非妊娠大鼠之间的镇痛剂差异相比,神经内利多卡因摄取。 Reg Anesth 1997;22:363–371。
- Scott DB、Jebson PJ、Braid DP 等:影响利多卡因和丙胺卡因血浆水平的因素。 Br J Anaesth 1972;44:1040–1049。
- Rosenberg PH、Veering BTh、Urmey WF:局麻药的最大推荐剂量:一个多因素的概念。 Reg Anesth Pain Med 2004;29:564–575。
- Taheri S、Cogswell LP III、Gent A 等人:局部麻醉剂与人类 α1-酸性糖蛋白主要变体结合中的疏水性和离子性因素。 J Pharmacol Exp Ther 2003;304:71–80。
- Fragneto RY、Bader AM、Rosinia F 等人:整个怀孕期间利多卡因蛋白质结合的测量。 Anesth Analg 1994;79:295–297。
- Thomas JM, Schug SA:局部麻醉剂药代动力学的最新进展。 长效酰胺对映体和连续输液。 临床药物动力学 1999;36:67-83。
- Rothstein P、Arthur GR、Feldman HS 等:布比卡因用于儿童肋间神经阻滞:血液浓度和药代动力学。 Anesth Analg 1986;65:625–632。
- Bokesch PM、Castaneda AR、Ziemer G 等:右向左心脏分流对利多卡因药代动力学的影响。 麻醉学 1987; 67:739–744。
- Palkama VJ, Neuvonen PJ, Olkkola KT:伊曲康唑对健康志愿者布比卡因对映体药代动力学的影响。 Br J Anaesth 1999;83:659–661。
- Oda Y、Furuichi K、Tanaka K 等:人肝细胞色素 P450 对一种新的局部麻醉剂罗哌卡因的代谢。 麻醉学 1995; 82:214-220。
- Ekstrom G,Gunnarsson UB:罗哌卡因是一种新型酰胺类局部麻醉剂,在人肝微粒体中被细胞色素 P450 1A 和 3A 代谢。 药物代谢物处置 1996;24:955–961。
- Hirota K、Browne T、Appadu BL 等:局部麻醉剂是否与神经元 L 型 Ca2+ 通道上的二氢吡啶结合位点相互作用? Br J Anaesth 1997;78:185–188。
- Olschewski A、Olschewski H、Brau ME 等:布比卡因对大鼠心肌细胞中 ATP 依赖性钾通道的影响。 Br J Anaesth 1999;82:435–438。
- Sugimoto M、Uchida I、Fukami S 等:局部麻醉剂对重组 GABA(A) 受体的 α 和 γ 亚基依赖性作用。 Eur J Pharmacol 2000;401:329–337。
- Englesson S,Grevsten S:酸碱变化对局麻药中枢神经系统毒性的影响。 二、 Acta Anaesthesiol Scand 1974;18:88-103。
- Feldman HS、Arthur GR、Covino BG:有意识的狗静脉注射罗哌卡因、布比卡因和利多卡因的惊厥和超惊厥剂量的比较全身毒性。 Anesth Analg 1989;69:794–801。
- Porter JM、Markos F、Snow HM 等:呼吸和代谢 pH 值变化和缺氧对罗哌卡因诱导的狗心脏毒性的影响。 Br J Anaesth 2000;84:92–94。
- Chernoff DM:利多卡因和布比卡因对神经元钠电流的阶段性抑制的动力学分析。 生物物理学杂志 1990;58:53-68。
- Feldman HS、Covino BM、Sage DJ:局部麻醉剂在离体豚鼠心房中的直接变时和变力作用。 Reg Anesth 1982;7:149–156。
- Reiz S, Nath S:局麻药的心脏毒性。 Br J Anaesth 1986;58:736–746。
- McCaslin PP,Butterworth J:布比卡因抑制新生大鼠心肌细胞的 [Ca(2+)](i) 振荡,细胞外 K+ 增加,细胞外 Mg(2+) 增加逆转。 Anesth Analg 2000;91:82-88。
- Butterworth JF IV、Brownlow RC、Leith JP 等人:布比卡因抑制环 3',5'-腺苷一磷酸的产生。 可能导致心血管毒性的因素。 麻醉学 1993;79:88-95。
- Butterworth J,James RL,Grimes J:β2-肾上腺素能受体的几种同源局部麻醉剂系列的结构-亲和力关系和立体特异性。 Anesth Analg 1997;85:336–342。
- Ohmura S、Kawada M、Ohta T 等人:布比卡因、左旋布比卡因或罗哌卡因输注大鼠的全身毒性和复苏。 Anesth Analg 2001;93:743–748。
- Dony P、Dewinde V、Vanderick B 等人:大鼠等效剂量下罗哌卡因和布比卡因的比较毒性。 Anesth Analg 2000;91:1489–1492。
- Chang DH、Ladd LA、Copeland S 等人:冠状动脉内布比卡因、左旋布比卡因和罗哌卡因对绵羊的直接心脏影响。 Br J Pharmacol 2001;132:649–658。
- Groban L, Deal DD, Vernon JC, et al:在利多卡因、布比卡因、左旋布比卡因和罗哌卡因过量用药后伴有或不伴有程序性电刺激的室性心律失常。 Anesth Analg 2000;91:1103–1111。
- Groban L、Deal DD、Vernon JC 等:在麻醉犬中增加过量利多卡因、布比卡因、左布比卡因和罗哌卡因后的心脏复苏。 Anesth Analg 2001;92:37-43。
- Groban L、Deal DD、Vernon JC 等:局部麻醉剂的立体选择性或结构能否预测麻醉犬的心肌抑制? Reg Anesth Pain Med 2002;27:460–468。
- Nath S、Haggmark S、Johansson G 等:局部麻醉剂的差异抑制剂和电生理心脏毒性:一项特别参考利多卡因和布比卡因的实验研究。 Anesth Analg 1986;65:1263–1270。
- Carpenter RL、Kopacz DJ、Mackey DC:激光多普勒毛细血管流量测量用于预测猪皮肤切口失血的准确性。 Anesth Analg 1989;68:308–311。
- deShazo RD, Nelson HS:对有局部麻醉过敏史的患者的治疗:90 名患者的经验。 J Allergy Clin Immunol 1979;63:387–394。
- Berkun Y、Ben-Zvi A、Levy Y 等人:局麻药不良反应的评估:236 名患者的经验。 Ann Allergy Asthma Immunol 2003;91:342–345。
- Gissen AJ、Datta S、Lambert D:氯普鲁卡因争议。 I. 解释氯普鲁卡因硬膜外麻醉神经并发症的假设。 Reg Anesth 1984;9:124–134。
- Gissen AJ、Datta S、Lambert D:氯普鲁卡因争议。 二、 氯普鲁卡因有神经毒性吗? Reg Anesth 1984;9:135–145。
- Winnie AP, Nader AM: Santayana 的预言应验了。 Reg Anesth Pain Med 2001;26:558–564。
- Kouri ME,Kopacz DJ:脊髓 2-氯普鲁卡因:志愿者与利多卡因的比较。 Anesth Analg 2004;98:75–80。
- Taniguchi M、Bollen AW、Drasner K:亚硫酸氢钠:氯普鲁卡因神经毒性的替罪羊? 麻醉学 2004;100:85–91。
- Lambert LA、Lambert DH、Strichartz GR:高浓度局部麻醉剂对孤立神经的不可逆传导阻滞。 麻醉学 1994;80:1082–1093。
- Gold MS、Reichling DB、Hampl KF 等人:利多卡因对大鼠初级传入神经元的毒性。 J Pharmacol Exp Ther 1998;285:413–421。
- Neal JM、Bernards CM、Butterworth JF 4th 等。 ASRA 对局麻药全身毒性的实践咨询。 Reg Anesth 疼痛医学。 2010;35:152–61
- Corcoran W、Butterworth J、Weller RS 等。 局麻药引起的心脏毒性:学术麻醉科的当代实践策略调查。 麻醉安乐。 2006;103:1322-6
- El-Boghdadly K,Chin KJ。 局部麻醉剂全身毒性:持续专业发展。 可以 J Anaesth。 2016;63:330–349
- Krismer AC、Hogan QH、Wenzel V 等:肾上腺素或加压素对硬膜外麻醉期间复苏的疗效。 Anesth Analg 2001;93:734–742。
- Mayr VD、Raedler C、Wenzel V 等:快速静脉注射布比卡因后心脏骤停猪模型中肾上腺素和加压素的比较。 Anesth Analg 2004;98:1426–1431。
- Weinberg GL、VadeBoncouer T、Ramaraju GA 等人:用脂质输注进行预处理或复苏会改变大鼠对布比卡因诱导的心搏停止的剂量反应。 麻醉学 1998;88:1071–1075。
- Weinberg G、Ripper R、Feinstein DL 等人:脂质乳剂输注可将狗从布比卡因引起的心脏毒性中拯救出来。 Reg Anesth Pain Med 2003;28:198-202。
- Fettiplace MR, Weinberg G. 脂质复苏疗法的过去、现在和未来。 JPEN J Parenter Enteral Nutr. 2015;39(1 增刊):72S-83S。
- Soltesz EG、van Pelt F、Byrne JG:布比卡因心脏毒性的紧急体外循环。 J 心胸血管麻醉 2003;17:357–358。
- Vasques F、Behr AU、Weinberg G 等。 自美国区域麻醉学会发布建议以来对局部麻醉全身毒性病例的回顾:可能关注的对象。 Reg Anesth 疼痛医学。 2015;40:698–705。
- Liu SS、Ortolan S、Sandoval MV、Curren J、Fields KG、Memtsoudis SG、YaDeau JT。 外周神经阻滞后局部麻醉全身毒性引起的心脏骤停和癫痫发作:我们还应该害怕死神吗? Reg Anesth 疼痛医学。 2016;4:5-21。
- Barrington MJ, Kluger R. 超声引导可降低周围神经阻滞后局部麻醉剂全身毒性的风险。 Reg Anesth 疼痛医学。 2013;38:289–299。
- 尼尔 JM、布鲁尔 R、霍恩 JL 等。 第二届美国局部麻醉和疼痛医学学会超声引导局部麻醉的循证医学评估:执行摘要。 Reg Anesth 疼痛医学。 2016;41:181–194

