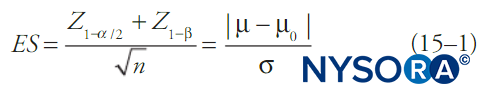Andrew Neice y Michael J. Barrington
INTRODUCCIÓN
La anestesia regional se practica mejor en el contexto de protocolos anestésicos y quirúrgicos estandarizados; estos planes se conocen generalmente como vías anestésicas. Para un paciente que se somete a una cirugía que utiliza una vía anestésica, muchas de las decisiones sobre el cuidado del paciente no se toman al lado de la cama en el período preoperatorio inmediato, sino mucho antes de la cirugía al considerar cuidadosamente los riesgos y beneficios de varios tratamientos anestésicos y perioperatorios. opciones. Cuando están bien diseñadas, las vías anestésicas pueden mejorar la atención del paciente al garantizar que los pacientes reciban una atención consistente, coordinada y basada en evidencia. También pueden reducir costos al eliminar intervenciones innecesarias y reducir complicaciones. Por supuesto, las vías no deben seguirse de manera indiscriminada, ya que algunos pacientes requerirán modificaciones para compensar las condiciones médicas específicas o las preferencias del paciente. Independientemente, las vías anestésicas permiten a los médicos centrarse en las características únicas de un paciente en lugar de las características comunes de toda una cohorte, que ya se examinaron durante el desarrollo de la vía.
En esencia, las vías anestésicas (o las vías clínicas en cualquier campo) son una serie de decisiones médicas. Como líderes del hogar quirúrgico perioperatorio, los anestesiólogos son los más adecuados para liderar su diseño. A menudo, surgen muchos problemas sutiles en el desarrollo de una vía que pueden no ser familiares para nadie más que para un médico que participa frecuente y personalmente en la atención del paciente. Además, las relaciones de trabajo de los anestesiólogos con los cirujanos, los administradores y todo el equipo de quirófano son fundamentales para el desarrollo y el éxito de las rutas de los pacientes. La coordinación entre especialidades es vital para el desarrollo exitoso de vías anestésicas. Las decisiones anestésicas afectarán con frecuencia la capacidad de los pacientes para rehabilitarse en el período posoperatorio inmediato, por lo que las vías anestésicas y quirúrgicas deben diseñarse mediante un esfuerzo de equipo.
Debido a que existe evidencia de que el uso de anestesia regional puede afectar la mortalidad y la morbilidad de las cirugías comunes, y debido a que el control del dolor en el período posoperatorio suele ser un desafío, la anestesia regional (ya sea bloqueo neuroaxial o periférico) suele ser una característica clave de las vías anestésicas. Por lo tanto, el desarrollo de vías es de particular interés para los profesionales cuya práctica clínica incluye la anestesia regional.
El diseño y la implementación de vías clínicas requieren habilidades que a menudo no se enseñan durante la formación de residencia. Los médicos adaptan sus tratamientos teniendo en cuenta las características únicas de cada paciente. Esto está relacionado con la formación de médicos diseñada para obtener y sintetizar datos para un paciente específico. Las vías clínicas, por el contrario, deben diseñarse para optimizar la experiencia promedio de una cohorte de pacientes, a menudo haciendo concesiones y compromisos en el proceso. El conocimiento de la epidemiología y las estadísticas son vitales para el diseño efectivo de vías clínicas. La estimación numérica de los resultados probables y la elección de los que califican más favorablemente es fundamental para el desarrollo de la vía.
Los beneficios de una vía de anestesia, por supuesto, dependerán de las peculiaridades de la vía en sí, la institución, las técnicas quirúrgicas y anestésicas y los otros proveedores de atención médica que utilizan la vía (como atención de enfermería, fisioterapia, etc.). Un camino diseñado para una institución puede no ser apropiado para otra institución, razón por la cual en este capítulo hemos optado por enfatizar el proceso de desarrollo de caminos en lugar de presentar caminos específicos. Además, los objetivos de una vía anestésica pueden variar: algunas vías pueden diseñarse para reducir la morbilidad o la mortalidad, mientras que otras pueden centrarse en reducir los costos y mantener un alto nivel de atención al paciente. Los objetivos comunes de una vía anestésica incluyen reducir la morbilidad y la mortalidad hospitalarias, reducir la duración de la estancia hospitalaria, reducir los costos, mejorar la satisfacción del paciente, reducir las readmisiones y mejorar los resultados funcionales a largo plazo.
A pesar de esta heterogeneidad, existe evidencia de que, en términos generales, las vías clínicas mejoran la atención al paciente. Un metanálisis reciente de las vías clínicas encontró que estaban asociadas con tasas más bajas de complicaciones del paciente (p. ej., infecciones de heridas, sangrado y neumonía), así como con una mejor documentación. La mayoría de los estudios incluidos en el metanálisis también mostraron una reducción en la duración de la estadía y los costos hospitalarios sin un mayor riesgo de tasas de reingreso y mortalidad. Sin embargo, es posible que algunas vías clínicas también puedan mejorar estos resultados. La considerable heterogeneidad de las vías clínicas exitosas no ha permitido a los investigadores identificar características comunes a las vías clínicas exitosas (o no exitosas). Sin embargo, los principios básicos de la gestión de riesgos pueden implementarse para ayudar en el diseño de vías clínicas, y parece probable que el desarrollo de un marco común reutilizable para abordar las vías clínicas aumente la probabilidad de éxito.
En este capítulo, presentamos un marco para el desarrollo de vías clínicas y revisamos algunos de los conocimientos previos necesarios para este proceso. También presentamos escenarios de casos que ilustran las sutilezas en la aplicación de la literatura médica existente a las vías clínicas. Finalmente, presentamos los componentes de una vía quirúrgica para la artroplastia total de rodilla.
MARCO PARA VÍAS ANESTÉSICAS
Un ejemplo de un solo componente de una vía clínica se muestra en Tabla 1. Este es un componente de un camino más amplio para la artroplastia articular total, que se analiza con más detalle en la sección final de este capítulo. Este componente describe los premedicamentos orales estándar para la cirugía y contiene información específica sobre la dosis, las contraindicaciones comunes y las adiciones comunes a la vía que pueden ser necesarias para algunos pacientes. Aunque el desarrollo de una vía clínica a menudo implica largos análisis con incertidumbres, los elementos finales de la vía deben ser breves y específicos. Además de los medicamentos previos recomendados, las vías pueden tener muchos elementos diferentes; por ejemplo, vea los que se muestran en Tabla 2.
Cabe señalar que, aunque las vías desarrolladas por los anestesiólogos se ocupan principalmente del manejo anestésico del paciente, están diseñadas para encajar con la vía quirúrgica correspondiente. Por ejemplo, la elección de la anestesia regional puede permitir que el paciente complete la fisioterapia en el día 1 del postoperatorio.
TABLA 1. Ejemplo de ítem de vía: premedicación oral para artroplastia total de rodilla.
| Premedicaciones orales recomendadas antes de la cirugía (solo ejemplo) | |
|---|---|
| Acetaminofén 1 g por vía oral | Evitar en personas con cirrosis, pruebas de función hepática elevadas |
| Celecoxib 400 mg por vía oral | Evitar en personas con alergia a las sulfas, disfunción renal |
| Gabapentina 600 mg por vía oral | Evitar en pacientes con disfunción renal, pacientes ambulatorios, pacientes de edad avanzada o demencia |
TABLA 2. Ejemplos de elementos de ruta.
- Enumeración de los objetivos del itinerario
- Criterios para la selección de pacientes, preparación para la cirugía y educación previa a la cirugía
- Optimización preoperatoria (p. ej., objetivos de presión arterial, objetivos de hematocrito, intervenciones farmacológicas asociadas)
- Anestesia quirúrgica recomendada
- Técnica anestésica sistémica multimodal recomendada
- Anestesia/analgesia regional recomendada para el tratamiento del dolor posoperatorio
- Tratamiento profiláctico recomendado para las náuseas y los vómitos posoperatorios
- Metas intraoperatorias recomendadas de líquido o hematocrito o criterios de transfusión
- Manejo intraoperatorio recomendado de la hemodinámica (p. ej., presiones arteriales preferidas, presores preferidos, etc.)
- Fármacos adyuvantes recomendados (p. ej., antibióticos preferidos, anticoagulantes, antifibrinolíticos)
- Monitorización adyuvante recomendada (p. ej., potenciales evocados, índice biespectral, oxigenación cerebral)
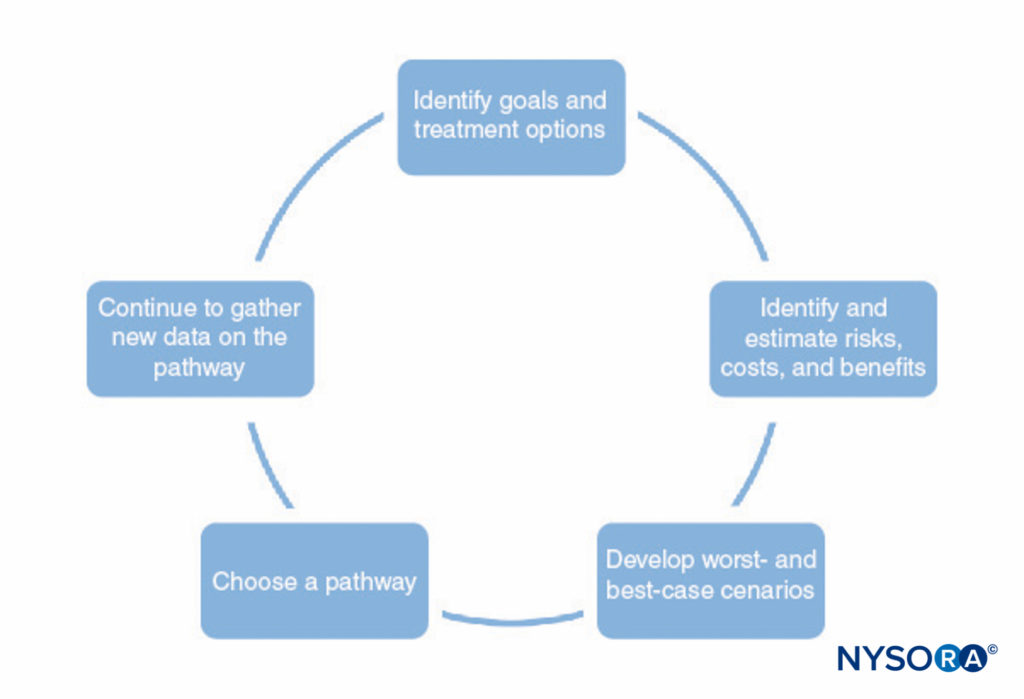
Un proceso para desarrollar vías clínicas se muestra en Figura 1 y XNUMX. Este proceso consiste en lo siguiente:
- Identificar los objetivos del camino y las diferentes opciones de tratamiento para ayudar a lograr esos objetivos. Esto debe incluir todas las etapas de la anestesia y la cirugía, incluida la recuperación posoperatoria.
- Identificar las formas en que cada tratamiento interactúa con los demás (p. ej., el tipo de anestesia regional puede afectar la capacidad del paciente para realizar fisioterapia en el posoperatorio, los premedicamentos pueden retrasar el alta debido a la sedación).
- Identificar los posibles riesgos, costos y beneficios de cada tratamiento, incluida la mortalidad, la morbilidad, la satisfacción del paciente, las capacidades institucionales, el costo financiero y otros factores.
- Hacer estimaciones numéricas de los riesgos, costos y beneficios identificados en el paso 3. Parte de esta información (p. ej., información sobre costos) se puede recopilar y tabular. Sin embargo, la mayor parte de la información no se puede conocer con certeza. En muchos casos, la literatura médica puede proporcionar estimaciones de las probabilidades involucradas, siempre que el médico comprenda las limitaciones de un estudio en particular.
- Utilice las estimaciones desarrolladas en el paso 4 para desarrollar los resultados probables y los mejores y peores escenarios para cada vía.
- Elija la vía que tenga más probabilidades de beneficiar al paciente según el paso 5.
- Perfeccione continuamente las estimaciones de los riesgos, costos y beneficios a medida que se disponga de nueva información y perfeccione las vías clínicas.
Si pudiéramos cuantificar los riesgos y beneficios de cada intervención tan fácilmente como podemos cuantificar los costos financieros de los procedimientos y el equipo, los pasos 4, 5 y 6 serían triviales. Sin embargo, esto no suele ser el caso. En muchos casos, puede que no haya datos publicados adecuados para guiar el proceso. A veces, puede haber alguna incongruencia entre los estudios disponibles y la información deseada: los únicos estudios disponibles pueden haberse realizado en poblaciones de pacientes similares, pero diferentes; han analizado procedimientos quirúrgicos similares, pero diferentes; o puede describir intervenciones que no puede replicar exactamente en su institución. No obstante, la coincidencia más cercana a las condiciones institucionales propias se puede utilizar para estimar las probabilidades utilizadas en el paso 5.
Otro riesgo a considerar incluye aquellas complicaciones que pueden no manifestarse hasta mucho después del período de tratamiento. Por ejemplo, los medicamentos, procedimientos o terapias introducidos recientemente, por definición, tendrán riesgos desconocidos a largo plazo. Reconocer las limitaciones de la evidencia existente para cada intervención en la literatura es crucial en el desarrollo del protocolo. Aunque las estadísticas inferenciales mejoran el juicio de un médico más allá de lo que se puede lograr simplemente confiando en sus observaciones personales históricas, desafortunadamente cualquier estudio dado puede tener sesgos imprevistos que pueden hacer que el estudio no sea una guía ideal para el protocolo que se está desarrollando. Como tal, al desarrollar escenarios del "peor de los casos" y del "mejor de los casos", se debe tener en cuenta la posibilidad de que un estudio haya cometido un error de tipo I o (más comúnmente) de tipo II.
REVISIÓN DE CONCEPTOS ESTADÍSTICOS RELEVANTES PARA EL DESARROLLO DE VÍAS ANESTÉSICAS
Una buena analogía del papel de las estadísticas en la mejora del juicio clínico es compararlo con el papel que desempeña una lente de aumento en la mejora de la visión. Los fármacos o intervenciones que tienen efectos grandes y constantes (p. ej., el efecto de la insulina sobre la glucosa o la epinefrina sobre la frecuencia cardíaca) pueden ser fácilmente apreciados por el médico sin ningún tipo de estudio que lo corrobore, del mismo modo que, por lo general, no es necesaria una lente de aumento para ver los resultados francos. pus en una herida. Del mismo modo, un estudio que no tiene la potencia suficiente puede ser incapaz de detectar efectos sutiles, al igual que una simple lupa no es lo suficientemente potente para obtener imágenes de bacterias individuales. Si bien pocos médicos intentarían diagnosticar una infección bacteriana con solo una lupa, los médicos con frecuencia cometen el error de suponer que un resultado negativo informado es sinónimo de ningún efecto, sin considerar el límite de detección del estudio. Las complicaciones raras pero catastróficas son de especial preocupación, ya que es posible que se requiera un número extremadamente grande de pacientes para potenciar adecuadamente un estudio.
Una prueba estadística puede informar que los datos observados son consistentes con el azar (la hipótesis nula, un resultado “negativo”) o rechazar la hipótesis nula y afirmar que existe una asociación entre un tratamiento y un resultado (un resultado “positivo”). . En realidad, puede haber o no una asociación entre un tratamiento y un resultado. Por lo tanto, hay cuatro posibilidades para cualquier prueba estadística, dos de las cuales implican sacar la conclusión correcta y dos de las cuales son errores. Estos se muestran tradicionalmente usando una tabla de 2 × 2 como se muestra en Tabla 3.
TABLA 3. Posibles resultados de una prueba estadística.
| La hipótesis es verdadera | La hipótesis es falsa | |
|---|---|---|
| Se acepta la hipótesis | decisión correcta | Error tipo I (alfa) |
| Se rechaza la hipótesis | Error tipo II (beta) | decisión correcta |
Los dos tipos de errores posibles son un error de tipo I (alfa), que consiste en concluir incorrectamente que existe una asociación cuando no existe, y un error de tipo II (beta), que consiste en concluir incorrectamente que no existe asociación cuando en realidad sí existe. . Obviamente, las probabilidades de cometer los dos tipos de errores están relacionadas. Imagine una prueba estadística que siempre afirme que existe una asociación entre el tratamiento y el resultado, independientemente de los datos. Esta técnica con frecuencia cometerá errores de tipo I, pero nunca cometerá un error de tipo II (porque nunca afirma un resultado negativo).
Por convención, las pruebas estadísticas calculan la probabilidad de que un conjunto de datos se deba al azar (el valor p) y si está por debajo de un umbral fijo (alfa), se rechaza la noción de que los datos se deban al azar. Generalmente, también se informa un intervalo de confianza. Cuando se fija alfa, más comúnmente en 0.05, beta será una función de las otras características de la prueba estadística. Una de las fórmulas más simples que relaciona alfa, beta, cambio en la media, desviación estándar de los datos y tamaño de la muestra se muestra en Ecuación 1. Ecuación 1 describe las relaciones de poder para una prueba de una muestra grande de una variable de resultado continua en una sola población con media y desviación estándar conocidas:
donde n es el tamaño de la muestra, σ es la desviación estándar de la muestra, μ es la media de la muestra, μ0 es la media de la población, ES es el tamaño del efecto y Z es la puntuación Z correspondiente al valor en el subíndice. Diferentes pruebas estadísticas (p. ej., pruebas t para variables continuas, pruebas t para proporciones, χ2 pruebas, pruebas de análisis de varianza [ANOVA], etc.) tendrán fórmulas algo diferentes para beta, pero en general beta (y por lo tanto la probabilidad de un error de tipo II) disminuirá con tamaños de muestra más grandes, opciones menos restrictivas de alfa, desviaciones estándar más pequeñas en los datos y tamaños de efecto más grandes.
El poder estadístico es simplemente 1–β y se hace referencia con más frecuencia que β. Si bien alfa se fija más comúnmente en 0.05, una potencia estadística de 0.8 generalmente se considera adecuada para la detección de asociaciones, aunque en algunos casos se aumenta a 0.9. Desafortunadamente, aunque la elección de alfa casi siempre se establece explícitamente en una publicación, a menudo se deja al médico inferir el poder del estudio, particularmente para los resultados secundarios. Afortunadamente, fórmulas como Ecuación 1 se pueden encontrar fácilmente en libros de texto comunes o en paquetes de software estadístico. Además, muchos departamentos académicos de estadística han puesto a disposición herramientas en línea para calcular el poder estadístico. Fórmulas como Ecuación 1 se puede utilizar para calcular el tamaño del efecto más pequeño que es probable que detecte un estudio en particular. Luego, corresponde al médico decidir si este tamaño del efecto es lo suficientemente pequeño como para que los tamaños del efecto más pequeños sean clínicamente irrelevantes. Si los tamaños de efecto más pequeños aún son clínicamente relevantes, entonces el médico que desarrolla una vía debe tener en cuenta la posibilidad de que haya un tamaño de efecto pequeño pero real, se cometió un error de tipo II y ajustar los mejores o peores escenarios en consecuencia. .
EJEMPLOS DE DESARROLLO DE VÍAS
Ahora proporcionamos algunos ejemplos ilustrativos del análisis discutido anteriormente. Primero, presentamos un escenario de caso que ilustra el tipo de análisis descrito. Luego, revisamos algunos ejemplos de medicamentos que se introdujeron en los protocolos quirúrgicos de rutina que causaron daño al paciente; esto ilustra las trampas en el desarrollo de vías. Por último, presentamos los componentes de una vía para el reemplazo total de rodilla.
Caso Ilustrativo: Adyuvantes a la Anestesia Espinal
Suponga que se ha desarrollado un nuevo fármaco (fármaco X) que aumenta la duración de la anestesia espinal cuando se agrega a la bupivacaína. Su grupo realiza artroplastia total de cadera y rodilla bajo anestesia espinal, pero ocasionalmente tiene que cambiar a anestesia general debido a tiempos quirúrgicos inesperadamente largos. En la vía articular total actualmente se usan espinales con bupivacaína sola, pero se está considerando agregar el fármaco X a la vía articular total para prolongar la duración de la anestesia espinal y reducir las conversiones inesperadas a la anestesia general. Un estudio inicial comparó la anestesia espinal con bupivacaína versus el fármaco X más bupivacaína, con 500 pacientes en el grupo de tratamiento y 500 en el grupo control. El estudio encontró que la anestesia espinal con bupivacaína proporcionó una anestesia quirúrgica adecuada solo durante 180 minutos, mientras que la bupivacaína con el fármaco X proporcionó una anestesia quirúrgica adecuada durante 200 minutos (IC del 95 %: 195 a 205 minutos, p < 05). Los resultados secundarios incluyeron la incidencia de vómitos en los días 1 a 3 del postoperatorio y retención urinaria que requirió cateterismo de Foley. En el brazo de control, el 3% y en el brazo de tratamiento el 4% de los pacientes vomitaron después de la operación, pero este resultado no fue estadísticamente significativo. En el brazo de control, el 2 % y en el brazo de tratamiento el 3 % de los pacientes tenían retención urinaria; sin embargo, esto tampoco fue estadísticamente significativo. El medicamento cuesta $50 por dosis.
Análisis de Costos y Beneficios
Incluso para una pregunta relativamente simple (y artificial) como esta, un análisis completo puede volverse complejo. Por lo tanto, presentamos una versión abreviada del procedimiento:
- Identificar objetivos y opciones de tratamiento. Nos limitamos al objetivo de alargar la anestesia espinal para reducir las conversiones a anestesia general. Deben explorarse alternativas a la inclusión del fármaco X. El fármaco X no debe evaluarse en el vacío, sino en competencia con otras técnicas. Por ejemplo, pueden estar disponibles otros fármacos que prolonguen la anestesia raquídea por un tiempo comparable, o simplemente aumentar la dosis raquídea puede ser factible para prolongar la anestesia quirúrgica. Alternativamente, se puede identificar la subpoblación que probablemente tendrá un tiempo operatorio más prolongado, y estos pacientes podrían recibir automáticamente anestesia general o el fármaco X podría reservarse solo para ellos. Los riesgos y beneficios de cada una de estas opciones deben considerarse individualmente y compararse con el uso habitual del fármaco X.
- Identifique las formas en que cada tratamiento interactúa con el resto de la vía. Aunque no se mencionaron restricciones, sería necesario confirmar que el uso del fármaco X no requiere un seguimiento postoperatorio especial (como la oximetría de pulso continua), una alteración en los cuidados de enfermería (como cambiar las precauciones contra caídas) o un cambio en la fisioterapia ( como retrasar la movilización) o requerir alteraciones en otras partes de la vía anestésica y quirúrgica. Si se identifican restricciones o interacciones, deben tenerse en cuenta en el paso 3.
- Identificar riesgos, costos y beneficios. Para esta ilustración, restringimos los análisis a los riesgos, beneficios y costos a los que se alude en el estudio. El beneficio principal sería una mayor duración de la anestesia quirúrgica y una menor necesidad de pasar a la anestesia general, lo que por supuesto conlleva una serie de riesgos y costos concomitantes. Los riesgos incluyen un mayor riesgo de retención urinaria y vómitos postoperatorios. Aunque el estudio inicial no vinculó ninguno de estos resultados con el fármaco X, veremos en el paso 4 que el peor de los casos debe incluir el riesgo de que este estudio cometa un error de tipo II. Los costos son más fáciles de cuantificar: esto agregará $50 en costos de medicamentos a cada cirugía.
- Haga estimaciones numéricas de los riesgos, costos y beneficios identificados en el paso 3. Los beneficios de este medicamento dependerán de las características específicas de su institución. Por ejemplo, suponga que al revisar sus registros descubre que realizó 500 artroplastias articulares totales en el último año, y 5 de ellas requirieron una conversión inesperada a anestesia general. Los tiempos quirúrgicos totales para los cinco casos fueron 195, 250, 200, 190 y 220 minutos. Utilizando el intervalo de confianza publicado, el uso del fármaco X puede haber eliminado la necesidad de convertir a anestesia general en 2 de los casos (si prolonga el tiempo a 195 minutos) a 3 de los casos (si prolonga el tiempo a 205 minutos).
Los costos de este medicamento, si se usara en todos los pacientes, serían $25,000 adicionales al año. Si se pudiera identificar una subpoblación de alto riesgo para el uso del fármaco, esto podría reducirse potencialmente. cualquier riesgo nuevo de complicaciones. Sin embargo, consideremos el poder de este estudio. Presumiblemente, los datos sobre la retención urinaria y los vómitos posoperatorios se analizaron mediante una prueba de proporciones. Mediante el uso de calculadoras de potencia en línea o paquetes estadísticos, podemos estimar el tamaño del efecto que se detectaría. Suponiendo una tasa inicial de retención urinaria del 2 % (basada en el grupo de control del estudio), el fármaco necesitaría aumentar la tasa al 5 %–6 % para lograr una potencia de aproximadamente 0.8. Los tamaños de efecto inferiores a este no se detectarán de forma fiable. Para los vómitos postoperatorios, una potencia de 0.8 corresponde al fármaco aumentando la tasa de vómitos al 7%. Si las tasas de vómitos posoperatorios y retención urinaria aumentaran más del doble, la mayoría de los médicos considerarían que se trata de un aumento clínicamente relevante, pero el estudio discutido no lo detectaría de manera confiable. Por lo tanto, debemos considerar la posibilidad de que el estudio haya cometido un error de tipo II y ajustar adecuadamente nuestro peor escenario.
Si el estudio cometió un error de tipo II, ¿qué debemos usar para nuestras estimaciones del tamaño del efecto? La estimación más razonable puede obtenerse examinando el propio estudio; a medida que se agregan sujetos, las tasas convergen hacia sus valores reales y eventualmente pueden cruzar un umbral de significación estadística. En el estudio comentado, los vómitos posoperatorios fueron del 3 % en el brazo de control y del 4 % en el brazo de tratamiento, y la retención urinaria fue del 2 % en el brazo de control y del 3 % en el brazo de tratamiento. Podemos usar estos aumentos para informar nuestras estimaciones.
Asumiendo que nuestra institución tiene tasas similares de vómitos en los días 1-3 postoperatorios (3%) y tasas similares de retención urinaria (2%), estimaríamos que aumentarían a 4% y 3%. Con un volumen quirúrgico de 500 pacientes por año, esto corresponde a 5 casos extra de retención urinaria y 5 casos extra de vómito postoperatorio por año. - Utilice las estimaciones para construir los mejores y peores escenarios. Mejor caso: eliminar tres conversiones a anestesia general por año. Agregue $25,000 a los costos de atención médica. En el peor de los casos: eliminar dos conversiones a anestesia general por año. Agregue $25,000 a los costos de atención médica. Cree cinco casos adicionales de retención urinaria y cinco casos adicionales de vómitos postoperatorios. En este caso particular, observamos que los beneficios del fármaco pueden mejorar si podemos identificar con precisión una subpoblación que probablemente se beneficie. Por ejemplo, si el fármaco se administra solo al 10% de los pacientes con mayor riesgo de tiempos quirúrgicos prolongados, tanto el costo como la morbilidad asociada con los vómitos y la retención urinaria posoperatorios se reducirían en un factor de 10. Si la subpoblación se determina con precisión identificado, el número de conversiones de anestesia general puede no verse afectado o verse afectado mínimamente.
- Elija la vía que tenga más probabilidades de beneficiar al paciente. Dependiendo de los riesgos involucrados en las conversiones a anestesia general, este fármaco puede o no valer la pena agregarlo a la vía anestésica. En última instancia, se requiere juicio clínico para tomar una decisión. Sin embargo, al usar el marco discutido, el médico está significativamente mejor informado que si simplemente tomara una decisión basándose únicamente en la intuición.
- Refinar continuamente las estimaciones de riesgos, costos y beneficios. En este escenario, el volumen quirúrgico anual de la institución (500) es igual al número de pacientes involucrados en cada brazo del estudio. Dado esto, si la institución realiza un seguimiento de sus propias tasas de complicaciones antes y después del cambio, debería poder determinar rápidamente los verdaderos riesgos, beneficios y costos de la intervención y tomar una decisión más informada que el análisis inicial.
Sorprendentemente, a menudo ocurre que la cantidad de pacientes inscritos en estudios en la literatura publicada es mucho menor que la cantidad de cirugías realizadas incluso en instituciones pequeñas. Por ejemplo, un metanálisis reciente sobre los efectos de los opioides espinales solo incluyó aproximadamente 100 a 150 sujetos y controles para el análisis de vómitos posoperatorios y retención urinaria para fentanilo intratecal, a pesar del uso prolongado y generalizado de fentanilo en la anestesia espinal. Debido a esto, el análisis de los datos internos suele ser útil para evaluar el éxito o el fracaso de la ruta. El uso de datos internos también evita el problema de los estudios publicados que usan poblaciones de pacientes, medicamentos o técnicas ligeramente diferentes a los que se usan en la institución de origen.
EJEMPLOS DE VÍAS QUE CAUSARON DAÑO AL PACIENTE
La sección anterior fue una ilustración hipotética del desarrollo de una parte de un camino. En esta sección, nos tomamos un momento para discutir casos históricos en los que el daño al paciente resultó de la introducción de un nuevo fármaco como parte de la atención perioperatoria de rutina. Aunque estos medicamentos se introdujeron antes de que la noción de vías quirúrgicas y anestésicas se hiciera común, la experiencia con estos medicamentos proporciona información sobre algunos de los peligros de aplicar nuevos tratamientos a grandes cohortes de pacientes.
Enoxaparina y profilaxis de tromboembolismo venoso
La enoxaparina fue la primera heparina de bajo peso molecular aprobada por la Administración de Drogas y Alimentos de los Estados Unidos para uso general. Poco después de la aprobación del fármaco en mayo de 1993, entró en uso generalizado y rutinario como profilaxis del tromboembolismo venoso. Debido a que muchas cirugías ortopédicas, incluida la artroplastia articular total, presentan un alto riesgo de tromboembolismo venoso, y la anestesia epidural o espinal era con frecuencia el anestésico preferido para estos casos, la enoxaparina se usaba a menudo junto con la anestesia neuroaxial.
Antes del desarrollo de la enoxaparina, la heparina subcutánea no fraccionada se había utilizado ampliamente para la profilaxis del tromboembolismo venoso. Si bien el riesgo de hematoma epidural asociado con la administración de enoxaparina se consideró comparable al de la administración subcutánea de heparina inicialmente, se subestimaron las diferencias farmacológicas entre la heparina de bajo peso molecular y la no fraccionada.
Poco después de su introducción, la Administración de Drogas y Alimentos de EE. UU. comenzó a recibir informes de hematoma epidural asociado con la administración de enoxaparina. En diciembre de 1997, la administración emitió un aviso de salud pública que indicaba que había recibido más de 30 informes de hematoma epidural posneuraxial asociado con enoxaparina y exigía que la enoxaparina llevara una advertencia de recuadro negro que indicaba un riesgo significativo de daño para el paciente. Para abril de 1998, el número de informes había aumentado a más de 40. La Administración de Drogas y Alimentos de los Estados Unidos se acercó a la Sociedad Estadounidense de Anestesia Regional y Medicina del Dolor para desarrollar nuevas pautas para el uso de enoxaparina con anestesia neuroaxial. Estas pautas se publicaron en noviembre de 1998 y recomendaban un uso mucho más conservador de enoxaparina.
Aprotinina y Reducción de Transfusiones Perioperatorias
La aprotinina es una pequeña molécula peptídica que actúa como antifibrinolítico al inhibir la tripsina y las enzimas proteolíticas relacionadas. Se usó con mayor frecuencia en cirugía cardíaca, donde se demostró que reduce significativamente los requisitos de transfusión, y se investigó su uso en otros tipos de cirugías, como los procedimientos ortopédicos. Aunque un metanálisis no mostró un mayor riesgo de mortalidad, infarto de miocardio o insuficiencia renal, grandes estudios de observación contradijeron estos hallazgos y demostraron un mayor riesgo de insuficiencia renal posoperatoria. Otros estudios observacionales se centraron en el seguimiento a largo plazo y confirmaron una mayor morbilidad y mortalidad asociadas con la aprotinina, particularmente con respecto no solo a la insuficiencia renal, sino también al accidente cerebrovascular, la muerte y el infarto de miocardio no mortal. Las ventas de aprotinina se detuvieron en 2008; la aprotinina ha sido reemplazada en gran parte por el ácido tranexámico y el ácido aminocaproico. Sigue habiendo cierta controversia con respecto a si los aumentos observados en la insuficiencia renal se debieron al efecto de la aprotinina oa algún otro factor de confusión.
Discusión
En ambos ejemplos, el daño significativo al paciente resultó de la introducción de un nuevo fármaco en una vía anestésica y quirúrgica porque no había datos suficientes para indicar el potencial de daño al paciente. Los riesgos se hicieron evidentes solo después de que se trató a un mayor número de pacientes y se produjeron complicaciones significativas en los pacientes.
En el primer caso, heparinas de bajo peso molecular y anestesia neuroaxial, la dificultad para predecir el daño al paciente se debió en gran parte a la frecuencia extremadamente baja del evento adverso. Si se supone que el riesgo inicial de hematoma espinal es de 1:150,000 XNUMX, incluso un aumento relativamente grande en el riesgo de hematoma requiere tamaños de muestra grandes para detectar un mayor riesgo. Los tamaños de muestra tan grandes a menudo no se pueden obtener de manera realista antes de la introducción de un medicamento, y solo la vigilancia posterior a la aprobación o el desarrollo de registros clínicos de alta calidad detectarán eventos adversos poco comunes, pero potencialmente catastróficos.
En el segundo caso, aprotinina e insuficiencia renal, se pueden identificar una serie de factores. Las investigaciones iniciales no se centraron en el aumento del riesgo de insuficiencia renal y no investigaron este riesgo o el estudio no tuvo suficiente poder estadístico. Además, algunos creían que las complicaciones asociadas con la aprotinina eran de naturaleza transitoria y que no había riesgos a largo plazo asociados con la aprotinina. Obviamente, esto no pudo investigarse hasta años después de que se comenzara a utilizar la aprotinina.
Estos casos resaltan los riesgos asociados con los nuevos agentes terapéuticos o los antiguos agentes terapéuticos utilizados en situaciones nuevas. Los estudios preliminares pueden investigar los riesgos erróneos o pueden tener poca potencia, o los riesgos pueden ser a largo plazo y pueden no hacerse evidentes hasta mucho después del período de estudio. Dado esto, al considerar los riesgos y beneficios para el paciente, el médico también debe considerar el riesgo desconocido o no cuantificado e incluir el agente solo si la proporción de riesgos y beneficios conocidos y cuantificables es abrumadoramente positiva. Para medicamentos con una larga historia de uso y riesgos bien definidos, se justifica menos precaución.
COMPONENTES DE UNA VÍA COMPLETA: ARTROPLASTIA TOTAL DE RODILLA
En esta sección, presentamos los componentes de una vía quirúrgica para la artroplastia total de rodilla. Esto se muestra en Tabla 4. Sin embargo, en lugar de presentar recomendaciones finales (como se haría en una ruta completa), destacamos los problemas comunes que se enfrentan al desarrollar diferentes aspectos de la ruta, así como los medicamentos y las técnicas que se emplean con frecuencia. Esto se hace para evitar implicar que existe un consenso final en torno a la vía "correcta" para la artroplastia total de la articulación; incluso si existiera tal consenso, quedaría obsoleto rápidamente a medida que se dispusiera de nuevos estudios, fármacos y técnicas. Los proveedores con diferentes poblaciones de pacientes y diferentes subespecialidades pueden desarrollar diferentes vías apropiadas para su institución.
TABLA 4
| Vía anestésica para la artroplastia articular total |
|---|
| Objetivos del camino Los objetivos de la vía deben establecerse claramente y, por lo general, incluyen la reducción de la mortalidad, la morbilidad y los costos; aumentos en la satisfacción del paciente; y mejor control del dolor. Los objetivos deben incluir criterios de valoración clínicos reales cuando sea posible y ser independientes de los medios, por ejemplo, reducir las puntuaciones de dolor posoperatorio es un objetivo más apropiado que reducir el consumo de opioides posoperatorios. |
| selección de los pacientes Los factores de riesgo modificables, como el tabaquismo, la diabetes mal controlada, la obesidad y el uso recreativo de drogas, pueden afectar las tasas de complicaciones quirúrgicas. La vía puede abordar cuándo se debe retrasar la cirugía para abordar estos factores. Además, las comorbilidades no modificables pueden crear un riesgo quirúrgico inaceptable; los criterios para la selección de pacientes pueden incluirse en una ruta. Obviamente, esto debe coordinarse con la ortopedia. |
| Educación preoperatoria y planificación previa al ingreso Con frecuencia, los pacientes son vistos de forma rutinaria en una clínica preoperatoria de anestesia. Esta parte de la ruta brinda la oportunidad de identificar las características del paciente que entran en conflicto con los elementos predeterminados en la ruta anestésica y abordarlos antes de la operación. Por ejemplo, un paciente con alergia a la penicilina puede someterse a una prueba de punción cutánea para determinar si se le pueden administrar cefalosporinas. Además, si la vía incluye catéteres nerviosos periféricos continuos, esto puede brindar una oportunidad para educar al paciente. |
| Lista de verificación previa al procedimiento Este elemento de la vía frecuentemente incluye la identificación del paciente, el marcado del sitio, la confirmación de alergias y comorbilidades, la confirmación de la disponibilidad de hemoderivados, la confirmación del estado de anticoagulación y las comprobaciones finales de los valores de laboratorio. |
| Premedicación oral/analgesia multimodal La optimización del control del dolor debe equilibrarse con los efectos secundarios indeseables, como la sedación excesiva. A continuación se enumeran los agentes comunes utilizados, junto con sus ventajas y desventajas. |
| Agente | Beneficios | Inconvenientes |
|---|---|---|
| El acetaminofeno | Reducir las puntuaciones de dolor posoperatorio, ahorrando opioides | La hepatotoxicidad |
| Gabapentina/pregabalina | Reducir las puntuaciones de dolor posoperatorio, ahorro de opioides, puede reducir la incidencia de dolor posquirúrgico crónico y tienen beneficio en pacientes con dolor crónico existente | Aumento de la sedación, particularmente en ancianos; aumento de la depresión respiratoria con dosis > 300 mg |
| Inhibidores de la ciclooxigenasa 2 | Reducir las puntuaciones de dolor posoperatorio, ahorrando opioides | Insuficiencia renal; base de evidencia debilitada por publicaciones retractadas |
| Opiáceos orales (p. ej., oxicodona SR) | Reducir las puntuaciones de dolor postoperatorio | Mayor riesgo de depresión respiratoria con dosis de oxicodona > 10 mg |
| Vía anestésica para la artroplastia articular total |
|---|
| Uso de anestesia regional para el control del dolor postoperatorio Existe un amplio espectro de técnicas anestésicas regionales asociadas con la artroplastia total de rodilla, junto con una variación significativa en costo y eficacia. La elección de la técnica afectará a otros elementos de la vía anestésica y quirúrgica. Además, los enfoques están evolucionando rápidamente a medida que se dispone de nuevas técnicas, equipos y agentes. A continuación se enumeran los sitios comunes utilizados para la anestesia regional, junto con las ventajas y desventajas. |
| Tecnologia | Beneficios | Inconvenientes |
|---|---|---|
| bloqueo epidural | Considerado el estándar de oro para la analgesia posoperatoria para una variedad de cirugías | El perfil de efectos secundarios puede interferir con la vía de atención moderna y un riesgo pequeño de resultado catastrófico (p. ej., hematoma epidural). |
| Bloqueo del nervio femoral | Alivia la mayoría del dolor postoperatorio, sin los inconvenientes de la epidural,; asociado con mejores resultados a las 6 semanas en un ensayo | La debilidad muscular puede interferir con la rehabilitación. Riesgo pequeño (2 a 4 por 10,000 XNUMX) de lesión nerviosa a largo plazo, pero la elección general del anestésico cambia el riesgo de lesión nerviosa. |
| Bloqueo del nervio ciático | Dolor de rodilla posterior reducido | Riesgo de neuropatía similar al bloqueo del nervio femoral. Los resultados de los estudios varían, desde mejorar la analgesia y la movilización temprana a agregar poca o ninguna analgesia al bloqueo femoral existente. El uso del bloqueo ciático es controvertido y es poco probable que mejore los resultados a largo plazo. |
| Bloqueo selectivo del nervio tibial | Reducción de la probabilidad de caída del pie. | Inyección más cerca del pliegue poplíteo; riesgo de lesión del nervio peroneo con abordaje de lateral a medial o lesión vascular. |
| canal aductor | Alivio del dolor similar al bloqueo del nervio femoral con debilidad muscular reducida; efectivo en el tratamiento del dolor severo existente | Más cerca del sitio quirúrgico; técnica en evolución. |
| Analgesia por infiltración local | Fácil y rápido de realizar, sin debilidad muscular. | Evidencia en evolución para la eficacia en este contexto. Sin embargo, los expertos señalan la mala calidad de algunos de los estudios existentes. El éxito de la técnica probablemente depende del operador. Asociado con parálisis transitoria del nervio peroneo. |
| Una vez que se elige un sitio o sitios para la anestesia regional, el proveedor puede utilizar diferentes técnicas para obtener analgesia posoperatoria, que se resumen a continuación. | ||
| Un solo tiro | Rápido de realizar; bajo costo; eficaz. | Duración más corta (puede ser beneficioso si se requiere una recuperación rápida de la fuerza muscular para la fisioterapia). |
| catéter nervioso | Analgesia mejorada en comparación con la técnica de inyección única. Mayor duración de la analgesia; valorable; control sobre el grado de bloqueo del motor cambiando el caudal. | Más difícil y lento de realizar; más caro; requiere vigilancia postoperatoria. |
| Formulaciones de liberación prolongada de anestésicos locales (p. ej., bupivacaína liposomal) | Tan rápido de realizar como el bloqueo de un solo disparo, con una mayor duración del bloqueo. | En comparación con la bupivacaína, actualmente hay poca evidencia de eficacia. Costoso. Limita la capacidad de rehacer el bloque. Perfil de seguridad y efectos secundarios emergente actualmente. |
| anestesia quirurgica Las opciones para la anestesia quirúrgica se resumen a continuación. |
||
| Anestesia | Beneficios | Inconvenientes |
|---|---|---|
| Espinal | Asociado con mejores resultados, disminución de los requisitos para los servicios de cuidados críticos. | Puede ser técnicamente difícil en ciertos pacientes. Resultados catastróficos ocasionales (p. ej., hematoma epidural). La duración de la anestesia espinal puede ser inadecuada para la cirugía. Los pacientes pueden ser reacios a estar "despiertos" para la cirugía |
| Epidural | Beneficios similares a los espinales, pero puede usarse para analgesia postoperatoria y cirugías de mayor duración. | Puede ser técnicamente difícil en ciertos pacientes. Resultados catastróficos ocasionales (p. ej. hematoma epidural). Los pacientes pueden ser reacios a estar "despiertos" para la cirugía. |
| General | Amnesia completa. | Asociado con malos resultados en comparación con la espinal. Resultado catastrófico ocasional (p. ej., vía aérea difícil); mayor riesgo de depresión respiratoria. |
| La anestesia neuroaxial se ha asociado con mejores resultados; sin embargo, esta modalidad no siempre es la preferida. Si se emplea anestesia neuroaxial, se deben tomar decisiones con respecto a la inclusión o exclusión de opioides de acción prolongada o corta; esta decisión puede ser compleja ya que afecta a muchos elementos de la vía posterior (seguimiento postoperatorio, rehabilitación, etc.). Incluso los pacientes que reciben anestesia neuroaxial generalmente requieren sedación, y algunas vías pueden especificar los agentes deseados o los niveles de sedación, en parte para evitar sedar excesivamente a los pacientes. Además, es probable que algunos pacientes no sean aptos para la anestesia neuroaxial, por ejemplo, debido al tiempo quirúrgico previsto para las revisiones articulares; este y otros criterios (como espina dorsal difícil) para proceder a la anestesia general se pueden describir en esta sección. | ||
| Medicamentos intraoperatorios Los medicamentos intraoperatorios pueden incluir antibióticos de primera y segunda línea, antieméticos preferidos para anestesia espinal versus anestesia general y sedantes preferidos si se elige anestesia espinal o epidural. La anticoagulación generalmente se inicia en el período posoperatorio por parte del equipo de cirugía, pero puede comentarse aquí. Cabe destacar que la dexametasona intraoperatoria parece mejorar las puntuaciones de dolor posoperatorio y proporciona un antiemético eficaz, sin aumentar el riesgo de infección u otras complicaciones perioperatorias. |
| Vía anestésica para la artroplastia articular total |
|---|
| Objetivos de transfusión intraoperatoria y opciones de conservación de sangre La transfusión de sangre tiene una serie de riesgos,53 y uno de los objetivos de la ruta puede ser minimizar la pérdida de sangre y, por lo tanto, los requisitos de transfusión. Una amplia variedad de técnicas pueden minimizar la pérdida de sangre, algunas de las cuales se resumen a continuación. |
| Tecnologia | Beneficios | Inconvenientes |
|---|---|---|
| Hipotensión intraoperatoria | Reducción de la pérdida de sangre. | Se requiere mayor vigilancia y seguimiento. Riesgo de isquemia de órgano terminal. La reanimación insuficiente puede contribuir a la intolerancia ortostática posoperatoria, lo que dificulta la movilización temprana. |
| uso de torniquete | Existen protocolos y pérdida de sangre reducida para su uso apropiado. | Riesgo de lesión isquémica o neuropatía axonal o efecto sobre la función del cuádriceps. |
| Termorregulación adecuada | Pérdida de sangre reducida a través del mantenimiento de la cascada de coagulación, recuperación mejorada. | |
| Barrido de celdas | Requisitos reducidos de productos sanguíneos alogénicos. | Costo y complejidad añadidos. |
| Drenajes de reinfusión | Requisitos reducidos de productos sanguíneos alogénicos. | Costo y complejidad añadidos. |
| Ácido tranexámico | Reducción de la pérdida de sangre debido a la antifibrinólisis. | Asociación con convulsiones. No se conoce un mayor riesgo de eventos trombóticos, pero solo recientemente se ha comenzado a utilizar en esta población quirúrgica. |
| Control del dolor posoperatorio Las vías a menudo abordan el control del dolor para pacientes con dolor crónico o uso de opioides, así como para aquellos que no lo tienen. En general, esta sección comentará sobre las tasas de infusión esperadas para cualquier catéter de nervio periférico, así como adyuvantes como la administración de opioides controlados por el paciente, ketamina u otros agentes. |
||
| Consideraciones sobre la vía quirúrgica ortopédica Las rutas a veces comentan las formas en que interactúan con la ruta del cirujano para dejar en claro por qué se hacen recomendaciones particulares. |
||
Los elementos individuales de la vía incluyen temas tan diversos como la planificación preoperatoria, la educación del paciente, el manejo anestésico intraoperatorio, el manejo del dolor posoperatorio y los objetivos hemodinámicos y de fluidos. Una vía completa, además de contener recomendaciones firmes y detalladas sobre la gestión, contendría un anexo que describa la evidencia que se utilizó para tomar decisiones sobre la vía. Sin embargo, como hemos visto, incluso después de identificar la literatura apropiada, a menudo hay una cantidad significativa de análisis y juicio que se debe usar para aplicar la literatura a la vía.
Una ruta final solo es útil si se distribuye ampliamente a todos los proveedores relevantes. Además de la distribución electrónica, las rutas se pueden mostrar en forma de póster. Esto permite que el proveedor de anestesia tenga los pasos en el camino fácilmente disponibles en diferentes fases de la atención del paciente. Los lugares comunes para mostrar información de vías incluyen áreas preoperatorias, bahías de anestesia regional, quirófanos y salas de trabajo de anestesia. Además, con la llegada de los sistemas de registros médicos electrónicos, muchas instituciones tienen la capacidad de crear conjuntos de pedidos, que automáticamente crean pedidos asociados con la vía.
CONCLUSIÓN
Las vías de anestesia y analgesia perioperatorias brindan una forma única de mejorar la atención al paciente y reducir los costos al implementar los recursos y la tecnología existentes de una manera basada en la evidencia. Por lo tanto, el desarrollo de vías debe considerarse un componente vital de la práctica del anestesiólogo.
Referencias
- Pugely AJ, Martin CT, Gao Y, Mendoza-Lattes S, Callaghan JJ: diferencias en las complicaciones a corto plazo entre la anestesia raquídea y la general para la artroplastia total de rodilla primaria. J Bone Joint Surg Am 2013;95(3):193–199.
- Memtsoudis SG, Sun X, Chiu YL, et al. Efectividad comparativa perioperatoria de la técnica anestésica en pacientes ortopédicos. Anestesiología 2013;118(5):1046–1058.
- Stundner O, Chiu YL, Sun X, et al: Resultados perioperatorios comparativos asociados con la anestesia neuroaxial versus general para la artroplastia total de rodilla bilateral simultánea. Reg Anesth Pain Med 2012;37(6):638–644.
- Memtsoudis SG, Stundner O, Rasul R, et al: Apnea del sueño y artroplastia articular total bajo varios tipos de anestesia: un estudio poblacional de resultados perioperatorios. Reg Anesth Pain Med 2013;38(4):274–281.
- Liu J, Ma C, Elkassabany N, Fleisher LA, Neuman MD: La anestesia neuroaxial reduce el riesgo de infección sistémica posoperatoria en comparación con la anestesia general en la artroplastia de rodilla. Anesth Analg 2013;117(4):1010–1016.
- Rotter T, Kinsman L, James E, et al: Vías clínicas: efectos en la práctica profesional, resultados de los pacientes, duración de la estadía y costos hospitalarios. Base de datos Cochrane Syst Rev 2010(3):CD006632.
- Shiboski S. Epidemiología y bioestadística. 2015. http://www.epibiostat.ucsf.edu/biostat/samplesize.html. Consultado el 30 de junio de 2015.
- Brant R. Cálculos del tamaño de la muestra. 2015. http://www.stat.ubc.ca/~rollin/stats/ssize/. Consultado el 30 de junio de 2015.
- Popping DM, Elia N, Marret E, Wenk M, Tramer MR: Opioides agregados a los anestésicos locales para la anestesia intratecal de inyección única en pacientes sometidos a cirugía menor: un metanálisis de ensayos aleatorios. Dolor 2012;153(4):784–793.
- Horlocker TT, Wedel DJ: Bloqueo neuroaxial y heparina de bajo peso molecular: Equilibrio de la analgesia perioperatoria y la tromboprofilaxis. Reg Anesth Pain Med 1998;23(6 Suplemento 2):164–177.
- Ruiseñor SL. De la Administración de Alimentos y Medicamentos. JAMA 1999;282(1):19.
- Wysowski DK, Talarico L, Bacsanyi J, Botstein P: hematoma espinal y epidural y heparina de bajo peso molecular. N Engl J Med 1998;338(24):1774–1775.
- Bidstrup BP, Royston D, Sapsford RN, Taylor KM: Reducción de la pérdida y el uso de sangre después de un bypass cardiopulmonar con dosis altas de aprotinina (Trasylol). J Thorac Cardiovasc Surg 1989;97(3):364–372.
- Royston D, Bidstrup BP, Taylor KM, Sapsford RN: Efecto de la aprotinina sobre la necesidad de transfusión de sangre después de repetir la cirugía a corazón abierto. Lancet 1987;2(8571):1289–1291.
- Mahdy AM, Webster NR: Agentes hemostáticos sistémicos perioperatorios. Hermano J Anaesth 2004;93(6):842–858.
- Shiga T, Wajima Z, Inoue T, Sakamoto A: Aprotinina en cirugía ortopédica mayor: una revisión sistemática de ensayos controlados aleatorios. Anesth Analg 2005;101(6):1602–1607.
- Sedrakyan A, Treasure T, Elefteriades JA: Efecto de la aprotinina en los resultados clínicos en la cirugía de injerto de derivación de la arteria coronaria: una revisión sistemática y metanálisis de ensayos clínicos aleatorios. J Thorac Cardiovasc Surg 2004;128(3):442-–448.
- Mangano DT, Tudor IC, Dietzel C, Estudio multicéntrico de investigación de isquemia perioperatoria G, Isquemia R, Educación F: El riesgo asociado con la aprotinina en la cirugía cardíaca. N Engl J Med 2006;354(4):353–365.
- Shaw AD, Stafford-Smith M, White WD, et al: El efecto de la aprotinina en el resultado después del injerto de derivación de la arteria coronaria. N Engl J Med 2008;358(8):784–793.
- Mangano DT, Miao Y, Vuylsteke A, et al: Mortalidad asociada con la aprotinina durante 5 años después de la cirugía de injerto de derivación de la arteria coronaria. JAMA 2007;297(5):471–479.
- Furnary AP, Wu Y, Hiratzka LF, Grunkemeier GL, Page US 3rd: La aprotinina no aumenta el riesgo de insuficiencia renal en pacientes de cirugía cardíaca. Circulación 2007;116(11 Suplemento):I127–I133.
- Schroeder DR: Estadísticas: Detección de una reacción adversa rara a un fármaco mediante informes espontáneos. Reg Anesth Pain Med 1998;23(6 Suplemento 2):183–189.
- Peersman G, Laskin R, Davis J, Peterson M: Infección en el reemplazo total de rodilla: una revisión retrospectiva de 6489 reemplazos totales de rodilla. Clin Orthop Relat Res 2001(392):15–23.
- Zhou TJ, Tang J, White PF: propacetamol versus ketorolaco para el tratamiento del dolor posoperatorio agudo después del reemplazo total de cadera o rodilla. Anesth Analg 2001;92(6):1569–1575.
- Mishriky BM, Waldron NH, Habib AS: Impacto de la pregabalina en el dolor posoperatorio agudo y persistente: revisión sistemática y metanálisis. Hermano J Anaesth. 2015;114(1):10–31.
- Clarke H, Bonin RP, Orser BA, Englesakis M, Wijeysundera DN, Katz J: La prevención del dolor posquirúrgico crónico con gabapentina y pregabalina: una revisión sistemática combinada y un metanálisis. Anesth Analg 2012;115(2):428–442.
- Sawan H, Chen AF, Viscusi ER, Parvizi J, Hozack WJ: La pregabalina reduce el consumo de opioides y mejora el resultado en pacientes con dolor crónico que se someten a una artroplastia total de rodilla. Phys Sportsmed 2014;42(2):10–18.
- Weingarten TN, Jacob AK, Njathi CW, Wilson GA, Sprung J: protocolo analgésico multimodal y depresión respiratoria posanestésica durante la recuperación de fase I después de una artroplastia total de articulación. Reg Anesth Pain Med 2015;40(4):330–336.
- Lin J, Zhang L, Yang H: Administración perioperatoria de inhibidores selectivos de la ciclooxigenasa-2 para el manejo del dolor posoperatorio en pacientes después de una artroplastia total de rodilla. J Artroplastia. 2013;28(2):207–213 e2.
- Rothwell MP, Pearson D, Hunter JD, et al: La oxicodona oral ofrece una analgesia equivalente a la analgesia intravenosa controlada por el paciente después del reemplazo total de cadera: un estudio aleatorizado, de un solo centro, no ciego, de no inferioridad. Hermano J Anaesth 2011;106(6):865–872.
- Pumpberger M, Memtsoudis SG, Stundner O, et al: Un análisis de la seguridad de la anestesia epidural y neuroaxial espinal en más de 100,000 2013 reemplazos articulares importantes consecutivos de las extremidades inferiores. Reg Anesth Pain Med 38;6(515):519–XNUMX.
- Bateman BT, Mhyre JM, Ehrenfeld J, et al: El riesgo y los resultados de los hematomas epidurales después del cateterismo epidural perioperatorio y obstétrico: un informe del Consorcio de investigación del grupo de resultados perioperatorios multicéntricos. Anesth Analg 2013;116(6):1380–1385.
- Paul JE, Arya A, Hurlburt L, et al: El bloqueo del nervio femoral mejora los resultados de la analgesia después de la artroplastia total de rodilla: un metanálisis de ensayos controlados aleatorios. Anestesiología 2010;113(5):1144–1162.
- Carli F, Clemente A, Asenjo JF, et al: Analgesia y resultado funcional después de la artroplastia total de rodilla: infiltración periarticular versus bloqueo continuo del nervio femoral. Br. J. Anaesth 2010;105(2):185–195.
- Neal JM, Barrington MJ, Brull R, et al: El segundo consejo de práctica de ASRA sobre complicaciones neurológicas asociadas con la anestesia regional y el resumen ejecutivo de medicamentos para el dolor 2015. Reg Anesth Pain Med 2015;40(5):401–430.
- Jacob AK, Mantilla CB, Sviggum HP, Schroeder DR, Pagnano MW, Hebl JR: lesión nerviosa perioperatoria después de una artroplastia total de rodilla: riesgo de anestesia regional durante un estudio de cohorte de 20 años. Anestesiología 2011;114(2):311–317.
- Sato K, Adachi T, Shirai N, Naoi N: Bloqueo continuo del nervio ciático versus inyección única agregado al bloqueo continuo del nervio femoral para la analgesia después de una artroplastia total de rodilla: un estudio prospectivo, aleatorizado y doble ciego. Reg Anesth Pain Med 2014;39(3):225–229.
- 38. Cappelleri G, Ghisi D, Fanelli A, Albertin A, Somalvico F, Aldegheri G: ¿El bloqueo continuo del nervio ciático mejora la analgesia posoperatoria y la rehabilitación temprana después de la artroplastia total de rodilla? Un estudio prospectivo, aleatorizado, doble ciego. Reg Anesth Pain Med 2011;36(5):489–492.
- Abdallah FW, Chan VW, Gandhi R, Koshkin A, Abbas S, Brull R: Los efectos analgésicos del bloqueo del nervio ciático proximal, distal o nulo en el dolor posterior de la rodilla después de una artroplastia total de rodilla: un ensayo aleatorizado doble ciego controlado con placebo. Anestesiología 2014;121(6):1302–1310.
- Safa B, Gollish J, Haslam L, McCartney CJ: Comparación de los efectos del bloqueo del nervio ciático de una sola inyección versus la infiltración de anestésico local de la cápsula posterior sobre la analgesia y el resultado funcional después de la artroplastia total de rodilla: un ensayo prospectivo, aleatorizado, doble ciego y controlado. J Artroplastia 2014;29(6):1149–1153.
- Wegener JT, van Ooij B, van Dijk CN, et al: Dolor a largo plazo y discapacidad funcional después de una artroplastia total de rodilla con y sin una sola inyección o bloqueo continuo del nervio ciático además del bloqueo continuo del nervio femoral: estudio prospectivo de 1 año seguimiento de un ensayo controlado aleatorizado. Reg Anesth Pain Med 2013;38(1):58–63.
- Sinha SK, Abrams JH, Arumugam S, et al: El bloqueo del nervio femoral con bloqueo selectivo del nervio tibial proporciona una analgesia eficaz sin caída del pie después de una artroplastia total de rodilla: un estudio prospectivo, aleatorizado y ciego para el observador. Anesth Analg 2012;115(1):202–206.
- Jaeger P, Zaric D, Fomsgaard JS, et al: bloqueo del canal aductor versus bloqueo del nervio femoral para la analgesia después de la artroplastia total de rodilla: un estudio aleatorizado, doble ciego. Reg Anesth Pain Med 2013;38(6):526–532.
- Jaeger P, Grevstad U, Henningsen MH, Gottschau B, Mathiesen O, Dahl JB: Efecto del bloqueo del canal de los aductores sobre el dolor posoperatorio intenso y establecido después de la artroplastia total de rodilla: un estudio aleatorizado. Acta Anaesth Scand 2012;56(8):1013–1019.
- Andersen LO, Kehlet H: Eficacia analgésica de la analgesia por infiltración local en la artroplastia de cadera y rodilla: una revisión sistemática. Hermano J Anaesth 2014;113(3):360–374.
- Tsukada S, Wakui M, Hoshino A: analgesia epidural posoperatoria en comparación con la inyección periarticular intraoperatoria para el control del dolor después de una artroplastia total de rodilla bajo anestesia espinal: un ensayo controlado aleatorizado. J Bone Joint Surg Am 2014;96(17):1433–1438.
- Bingham AE, Fu R, Horn JL, Abrahams MS: Bloqueo continuo de nervios periféricos en comparación con bloqueo de nervios periféricos con una sola inyección: una revisión sistemática y metanálisis de ensayos controlados aleatorios. Reg Anesth Pain Med 2012;37(6):583–594.
- Schroer WC, Diesfeld PG, LeMarr AR, Morton DJ, Reedy ME: ¿La bupivacaína liposomal de liberación prolongada controla mejor el dolor que la bupivacaína después de una ATR? Un ensayo clínico prospectivo y aleatorizado. J Artroplastia 2015;30(9 Suplemento):64–67.
- Ilfeld BM, Viscusi ER, Hadzic A, et al: Perfil de seguridad y efectos secundarios de la liposoma bupivacaína (Exparel) en bloqueos de nervios periféricos. Reg Anesth Pain Med 2015;40(5):572–582.
- Memtsoudis SG, Sun X, Chiu YL, et al: Utilización de los servicios de cuidados intensivos entre pacientes sometidos a artroplastia total de cadera y rodilla: epidemiología y factores de riesgo. Anestesiología 2012;117(1):107–116.
- Fleischut PM, Eskreis-Winkler JM, Gaber-Baylis LK, et al: Variabilidad en el cuidado anestésico para la artroplastia total de rodilla: un análisis del instituto de calidad de anestesia. Am J Med Qual 2015;30(2):172–179.
- Backes JR, Bentley JC, Politi JR, Chambers BT: La dexametasona reduce la duración de la hospitalización y mejora el dolor posoperatorio y las náuseas después de la artroplastia total de la articulación: un ensayo controlado aleatorio prospectivo. J Artroplastia 2013;28(8 suplemento):11–17.
- Goodnough LT: Riesgos de la transfusión de sangre. Crit Care Med 2003;31(12 suplementos):S678–S686.
- Fitzgibbons PG, Digiovanni C, Hares S, Akelman E: Uso seguro de torniquetes: una revisión de la evidencia. J Am Acad Orthop Surg 2012;20(5):310–319.
- Nitz AJ, Dobner JJ, Matulionis DH: Aplicación de torniquetes neumáticos e integridad nerviosa: función motora y electrofisiología. Exp Neurol 1986;94(2):264–279.
- Kornbluth ID, Freedman MK, Sher L, Frederick RW: Parálisis femoral del nervio safeno después del uso de torniquetes: informe de un caso. Arch Phys Med Rehab 2003;84(6):909–911.
- Weingarden SI, Louis DL, Waylonis GW: cambios electromiográficos en pacientes posmeniscectomía. Papel del torniquete neumático. JAMA 1979;241(12):1248–1250.
- Saunders KC, Louis DL, Weingarden SI, Waylonis GW: Efecto del tiempo del torniquete en la función posoperatoria del cuádriceps. Clin Orthop Relat Res 1979(143):194–199.
- Kagoma YK, Crowther MA, Douketis J, Bhandari M, Eikelboom J, Lim W: Uso de la terapia antifibrinolítica para reducir la transfusión en pacientes sometidos a cirugía ortopédica: una revisión sistemática de ensayos aleatorios. Trombosis Res 2009;123(5):687–696.
- Murkin JM, Falter F, Granton J, Young B, Burt C, Chu M: El ácido tranexámico en dosis altas se asocia con convulsiones clínicas no isquémicas en pacientes quirúrgicos cardíacos. Anesth Analg 2010;110(2):350–353.