Jeff Gadsden
INTRODUÇÃO
A incidência de complicações da anestesia geral diminuiu substancialmente nas últimas décadas, em grande parte devido aos avanços no monitoramento da função respiratória e cardiovascular durante a administração da anestesia. O uso de monitores objetivos, como oximetria de pulso, capnografia, eletrocardiografia, etc., permite aos profissionais identificar oportunamente os parâmetros fisiológicos em mudança, intervir rápida e adequadamente e orientar suas decisões terapêuticas.
A prática da anestesia regional tradicionalmente sofre com a falta de monitores objetivos que auxiliem o profissional a monitorar mais objetivamente a relação agulha-nervo e prevenir lesões neurológicas. A prática de bloqueios de nervos periféricos tradicionalmente dependia de pontos finais subjetivos para avaliar o risco potencial para o paciente. Isso está mudando, no entanto, com a introdução e adoção de métodos padronizados para realizar bloqueios de nervos periféricos com segurança com o mínimo risco possível para o paciente. Por exemplo, em vez de confiar na sensação de “cliques”, “estalos” e “arranhões” para identificar a posição da ponta da agulha, os profissionais agora podem monitorar a interação nas camadas fasciais da agulha usando ultrassonografia. Da mesma forma, a quantificação da intensidade mínima da corrente e da resistência à injeção pode ser usada para reunir dados adicionais úteis na tomada de decisão clínica para minimizar o risco de colocação da agulha em um plano de tecido indesejado, intravascularmente, ou em estruturas anatômicas vulneráveis intraneuralmente. Avanços recentes no monitoramento, portanto, podem reduzir as três complicações mais temidas do bloqueio de nervos periféricos: ferimento no nervo, toxicidade anestésica local, e danos inadvertidos a estruturas adjacentes (“desventura da agulha”).
O monitoramento objetivo e a justificativa para seu uso são discutidos na primeira parte desta seção. A última seção se concentra na documentação dos procedimentos de bloqueio do nervo, que é o registro lógico das informações objetivas obtidas pelos monitores. A documentação objetiva e robusta de como um bloqueio nervoso foi realizado tem implicações médico-legais óbvias e fornece um banco de dados útil para orientar os avanços em segurança e eficácia.
MONITORIZAÇÃO
Meios Disponíveis para Monitorar as Relações Agulha-Nervo
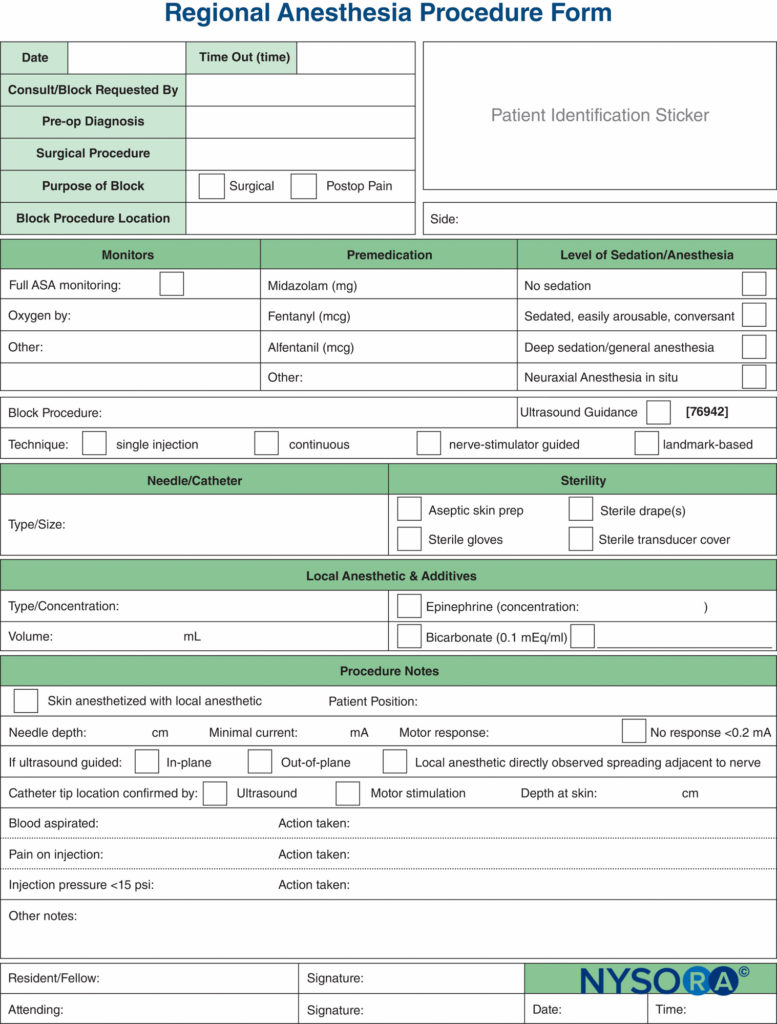
Os monitores, usados na prática médica, são dispositivos que avaliam um estado fisiológico específico e alertam o clínico sobre danos iminentes. Os monitores discutidos neste capítulo incluem aqueles para estimulação nervosa, ultrassonografia e monitoramento da pressão de injeção. Cada um deles tem seu próprio conjunto distinto de vantagens e limitações e cada um é melhor usado de forma aditiva e complementar.Figura 1) para minimizar o potencial de lesão do paciente, em vez de confiar apenas nas informações fornecidas por um monitor sozinho. Há informações baseadas em evidências suficientes de que a combinação de todos os três monitores provavelmente produzirá o processo mais seguro possível durante a prática de bloqueios de nervos periféricos.
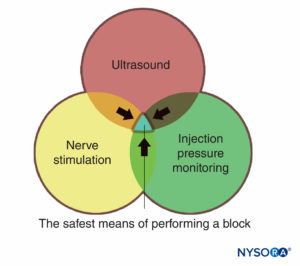
FIGURA 1. Três modos de monitoramento de bloqueios de nervos periféricos para lesão do paciente. A área de sobreposição de todos os três (área azul) representa o meio mais seguro de realizar um bloqueio.
Outro monitor farmacológico que muitos médicos utilizam regularmente é o uso de epinefrina no anestésico local. Existem algumas evidências para apoiar esta prática como meio de melhorar a segurança para a maioria dos pacientes durante bloqueios de nervos periféricos. Primeiro, atua como um marcador de absorção intravascular. A injeção intravenosa de 10 a 15 μg de epinefrina aumenta de forma confiável a pressão arterial sistólica em mais de 15 mmHg, mesmo em pacientes sedados ou tratados com β-bloqueadores. O reconhecimento deste aumento pode permitir a detecção precoce de injeção intravascular e permite ao clínico interromper prontamente a injeção e aumentar a vigilância para sinais de toxicidade sistêmica. Em segundo lugar, a epinefrina diminui o nível plasmático de pico do anestésico local, resultando em menor risco de toxicidade sistêmica. Preocupações em relação aos efeitos vasculares da epinefrina, vasoconstrição e isquemia nervosa não foram fundamentadas e, de fato, concentrações de 2.5 μg/mL (1:400,000) foram associadas a um aumento no fluxo sanguíneo nervoso, provavelmente devido à predominância da β -efeito da droga. Portanto, a epinefrina pode aumentar a segurança durante a administração de doses maiores de anestésicos locais sem risco documentado de isquemia do membro e morte neurológica.
É digno de nota que o uso de orientação por ultrassom durante bloqueios de nervos periféricos diminuiu significativamente o risco de toxicidade sistêmica grave de anestésicos locais por várias razões. Isso é mais provável porque a orientação por ultrassom permitiu a diminuição do volume e da dose de anestésico local para realizar a maioria dos procedimentos de bloqueio do nervo, monitorando sua disseminação. Além disso, a observação do trajeto da agulha no ultrassom, evitar a colocação intravascular e a confirmação da disseminação do anestésico local nos tecidos aumentam a segurança com anestesia regional guiada por ultrassom.
Estimulação do nervo
A neuroestimulação substituiu amplamente a parestesia como o principal meio de localização do nervo na década de 1980. No entanto, sua utilidade como um método de localização precisa de nervos foi recentemente contestada por dados de vários estudos que demonstraram que a resposta motora evocada (EMR) pode estar ausente apesar do contato íntimo entre agulha e nervo, conforme confirmado por ultrassonografia. De fato, em vários contatos agulha-nervo ou mesmo na colocação de agulhas intraneurais, pode ser necessária uma intensidade de corrente inesperadamente alta para induzir um EMR. Por exemplo, em alguns casos, um EMR pode ser obtido apenas com uma intensidade de corrente relativa de mais de 1 mA, mesmo com a colocação de agulha intraneural como visto no ultrassom.
Existem provavelmente vários fatores que contribuem para a explicação desse fenômeno. O fator mais importante é provavelmente o desvio da corrente elétrica ao longo do caminho de menor resistência (impedância). Em outras palavras, mesmo quando a agulha está nas imediações do nervo, a corrente elétrica pode não necessariamente se deslocar em direção ao nervo, mas sim viajar ao longo do caminho de menor resistência para sair através do eletrodo da pele. Um fator adicional pode incluir a distribuição não uniforme das fibras motoras e sensoriais no nervo composto.
Isso, no entanto, não significa que a estimulação elétrica dos nervos periféricos seja obsoleta em uma era de orientação por ultrassom. Por exemplo, dados de vários estudos em animais e humanos sugeriram que a presença de uma resposta motora em uma corrente muito baixa (ou seja, < 0.2 mA) está associada à colocação da ponta da agulha intraneural e inflamação intraneural após uma injeção nessa condição (tabela 1). Voelckel et ai. relataram que quando o anestésico local foi injetado em correntes entre 0.3 e 0.5 mA, o tecido nervoso resultante não apresentou sinais de processo inflamatório, enquanto injeções abaixo de 0.2 mA resultaram em infiltração linfocítica e granulocítica em 50% dos nervos. Tsai et ai. realizaram um estudo semelhante investigando o efeito da distância ao nervo na corrente necessária; enquanto uma faixa de correntes foi registrada para uma variedade de distâncias, os únicos casos em que a resposta motora foi obtida em menos de 0.2 mA foram quando a ponta da agulha foi colocada intraneuralmente.
TABELA 1. Resumo de estudos recentes de corrente de estimulação nervosa e posição da ponta da agulha.
| Estudo | Assunto | Forma | Descobertas |
|---|---|---|---|
| Voelckel e outros (2005)11 | Porcos (n = 10) | • Bloqueios do nervo ciático posterior realizados bilateralmente • Dois grupos - Injeção após EMR a 0.3–0.5 mA - Injeção após EMR a < 0.2 mA • 6 horas após a injeção, nervos ciáticos colhidos para análise histológica | • Aparência normal e saudável dos nervos no grupo de alta corrente • 50% dos nervos do grupo de baixa corrente mostraram evidências de linfócitos e granulócitos polimórficos sub-, peri-. e intraneural • Um espécime no grupo de baixa corrente mostrou ruptura grosseira do perineuro e múltiplas fibras nervosas |
| Tsai e outros (2008)12 | Porcos (n = 20) | • Anestesia geral • Nervos ciáticos expostos bilateralmente • Corrente aplicada com agulha em várias distâncias de 2 cm até intraneural • Dois observadores cegos concordaram com a corrente mínima necessária para obter a contração do casco • 40 tentativas em cada distância | • Contrações do nervo ciático apenas obtidas a 0.1 cm ou mais • Ampla faixa de correntes necessárias para provocar a resposta do motor • Somente quando intraneural resultou uma resposta motora de corrente < 0.2 mA |
| Bigeleisen e outros (2009)13 | Pacientes para cirurgia de mão/punho (n = 55) | • Bloqueio supraclavicular • Corrente mínima (mA) registrada - Com agulha fora do tronco nervoso (mas em contato com o nervo) - Dentro do tronco • Posição “intraneural” confirmada ultrassonograficamente com injeção de 5 mL de anestésico local | • Limiar de corrente mínima mediana fora do nervo 0.60 mA ± 0.37 mA • O limiar de corrente mínimo médio fora do nervo foi de 0.30 ± 0.19 mA • Nenhum EMR observado a qualquer momento com < 0.2 mA quando a agulha é colocada fora do nervo |
| Wiesmann et al (2014)14 | Porcos (n = 6) | • Modelo de plexo braquial aberto • Estimulação em três posições: intraneural, contato agulha-nervo e 1 mm de distância do nervo • 3 durações de pulso testadas (0.1, 0.3 e 1 ms) | • A intensidade da corrente não consegue distinguir entre o contato intraneural e o contato agulha-nervo • Resposta motora < 0.2 mA (independentemente da duração do pulso) indicou contato intraneural ou agulha-nervo |
Bigeleisen et ai. estudaram 55 pacientes programados para cirurgia de membro superior que receberam bloqueios do plexo braquial supraclavicular guiados por ultrassom. Os autores se propuseram a determinar o limite mínimo de corrente para resposta motora tanto dentro como fora do primeiro tronco encontrado. Eles relataram que a mediana do limiar mínimo de estimulação foi de 0.60 mA fora do nervo e 0.3 mA dentro do nervo. No entanto, EMR não foi observado com correntes de estimulação de 0.2 mA ou menos fora do nervo, enquanto 36% dos pacientes tiveram uma contração de EMR em correntes inferiores a 0.2 mA com a colocação da agulha intraneural. Para refinar ainda mais essa relação, Wiesmann e colegas aplicaram uma corrente elétrica ao plexo braquial de porcos em três posições diferentes (intraneural, com a agulha em contato com o epineuro e a 1 mm do nervo), variando a duração do pulso (0.1, 0.3). e 1.0 ms). A corrente mínima de limiar para eliciar uma resposta motora foi idêntica entre as posições de contato intraneural e agulha-nervo, e ambas foram significativamente menores do que a posição a 1 mm de distância. A duração do pulso não teve efeito sobre a corrente mínima de limiar. Esses autores concluíram que uma resposta motora menor que 0.2 mA (independentemente da duração do pulso) indicava contato intraneural ou agulha-nervo. Isso é importante porque foi estabelecido que, mesmo na ausência de punção do epineuro, mesmo o contato vigoroso entre agulha e nervo (epineuro) resulta em inflamação e potencial para lesão do nervo.
Em conjunto, os dados disponíveis sugerem que a sensibilidade de uma “corrente baixa” para eliciar um EMR em uma relação agulha-nervo potencialmente perigosa (colocação intraneural/epineural) é de cerca de 75%. No entanto, a especificidade do EMR quando presente em menos de 0.5 mA se aproxima de 100%. Em outras palavras, uma resposta motora é desencadeada por uma corrente estimulante de baixa intensidade (por exemplo, < 0.2 mA segundo Voelckel et al), a ponta é sempre intraneural ou intimamente relacionada ao epineuro. Portanto, a utilidade do estimulador de nervo é óbvia: o aparecimento inesperado de um EMR a 0.5 mA indica uma relação perigosa agulha-nervo (por exemplo, contato agulha-nervo) e pode permitir que o operador interrompa o avanço da agulha antes que a agulha entre no nervo .
É universalmente aceito que a injeção de anestésico local no nervo carrega um fator de risco para lesão do nervo; portanto, a deposição extraneural de anestésico local constitui uma prática mais segura. Embora inquestionavelmente útil, a ultrassonografia está longe de ser um monitor infalível da relação agulha-nervo. Como a injeção em um fascículo apresenta alto risco de lesão, a adição de monitoramento elétrico da posição da ponta da agulha é útil para segurança, principalmente em pacientes com anatomia ultrassonográfica desafiadora quando a imagem se mostra difícil ou a qualidade de uma imagem é ruim. Se um EMR for obtido em correntes abaixo de 0.5 mA, isso indica uma relação íntima agulha-nervo que deve levar a uma leve retirada da agulha e injeção cuidadosa, evitando uma pressão de injeção de abertura superior a 15 psi. Em geral, a estimulação do nervo adiciona pouco ao custo de um procedimento de bloqueio do nervo, em termos de tempo ou custo e também pode servir como uma confirmação funcional útil da imagem anatômica mostrada na tela de ultrassom (por exemplo, “É o nervo mediano ou ulnar? ?”). Por essas razões, a estimulação nervosa deve ser usada rotineiramente em conjunto com o ultrassom como um valioso monitor adicional da posição da ponta da agulha. Aprender mais sobre Estimuladores Elétricos de Nervos e Localização de Nervos Periféricos.
Ultrassonografia
O ultrassom revolucionou a prática da anestesia regional e permitiu uma evolução substancial da subespecialidade de uma arte praticada por poucos para uma ciência mais reprodutível. As vantagens são que o ultrassom permite ver a agulha em tempo real e, portanto, guiar a agulha com mais rapidez e precisão em direção ao alvo. O ultra-som também permite injeção adicional quando a primeira tentativa não é adequada e deposita com precisão o injetado nos espaços teciduais para bloqueio do nervo reprodutível. Além disso, o ultrassom permite que o bloqueio do nervo seja realizado mesmo em pacientes paralisados, amputados que não têm um membro para um EMR e assim por diante.
O ultrassom tem o potencial de melhorar a segurança dos bloqueios de nervos periféricos por vários motivos. Estruturas adjacentes de importância podem ser vistas e evitadas. O ressurgimento da popularidade do bloqueio supraclavicular é uma prova disso. Antes do ultrassom, esse bloqueio altamente eficaz era relativamente impopular como meio de anestesiar o plexo braquial por medo de causar um pneumotórax, devido à proximidade do plexo e à visão da colocação da agulha na pleura e na cavidade torácica. No entanto, como o plexo braquial e, mais importante, a costela, a pleura e a artéria subclávia podem ser identificados na ultrassonografia, o bloqueio supraclavicular tornou-se comum na prática clínica. Independentemente disso, o ultrassom não deve ser considerado à prova de falhas porque complicações, incluindo pneumotórax, ainda ocorrem com a orientação do ultrassom. Da mesma forma, há relatos de colocação de agulhas intravasculares e intraneurais testemunhadas por (e apesar do uso) de ultrassom.
Uma vantagem importante da triagem por ultrassom é a capacidade de determinar a distância da pele ao alvo. Isso, juntamente com agulhas que possuem marcações de profundidade gravadas na lateral, confere uma margem de segurança adicional ao avisar o médico sobre uma “distância de parada”, ou uma profundidade além da qual o médico deve parar de avançar a agulha para tecidos mais profundos e reavaliar. Outra vantagem importante do ultrassom é a capacidade de visualizar a distribuição do anestésico local em tempo real. (Figura 2). Se a expansão do tecido correspondente não for observada quando a injeção começar, então a ponta da agulha pode não estar onde deveria estar, e o médico pode interromper a injeção e reavaliar a localização da ponta da agulha. Isso é particularmente importante em áreas vasculares, pois a falta de dispersão do anestésico local pode sinalizar a colocação de agulhas intravasculares. Por outro lado, a monitorização ultrassonográfica pode ser utilizada para diagnosticar o posicionamento da ponta da agulha intra-arterial quando se observa um “rubor” ecogênico no lúmen da artéria, diminuindo o risco de toxicidade sistêmica.
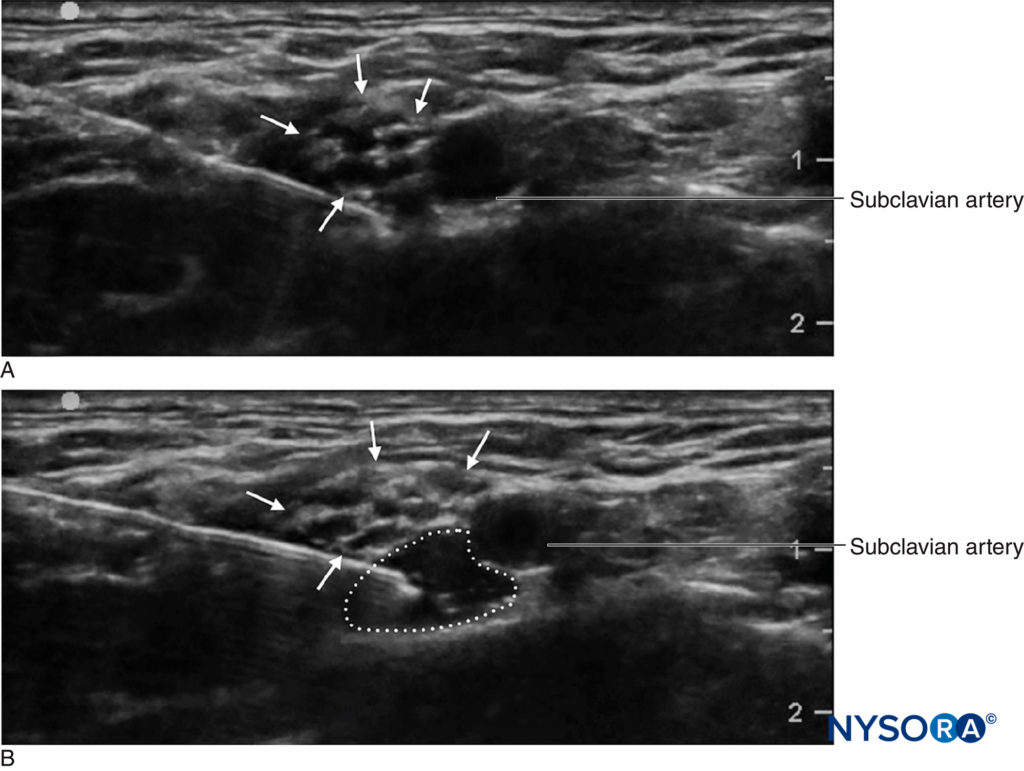
FIGURA 2. Bloqueio do plexo braquial supraclavicular mostrando plexo (setas) adjacente à artéria subclávia (SA). A Antes e B após a deposição de 10 mL de anestésico local (contorno pontilhado).
A ultrassonografia parece diminuir o risco de toxicidade sistêmica do anestésico local (LAST). Em uma análise de um grande registro multicêntrico de bloqueios de nervos periféricos (> 25,000 bloqueios de nervos periféricos), o risco de LAST foi reduzido em mais de 65% com o uso de orientação por ultrassom. O mecanismo proposto pelos autores foi a capacidade de reduzir substancialmente os volumes e doses de anestésico local necessários para realizar o bloqueio regional. De fato, diminuir a dose e o volume de anestésico local necessários para o sucesso da anestesia regional tem sido uma tendência consistente na última década. Numerosos relatórios documentaram reduções substanciais no volume necessário para efetuar um bloqueio equivalente em comparação com as técnicas de anestesia regional pré-guiada por ultrassom. Por exemplo, os bloqueios do plexo braquial podem ser realizados com menos de 10 mL de anestésico local, sem sacrificar a eficácia da anestesia ou analgesia. Mesmo que todo o volume do injetável seja administrado por via intravenosa por acidente, a LAST grave resultante, por exemplo, de um volume de 7 mL de ropivacaína a 0.5% em um adulto de tamanho médio, é improvável. bloqueios não diminuiu o risco ou a incidência de lesão nervosa.
Essa observação decepcionante foi documentada em vários relatórios e provavelmente é multifatorial. A capacidade de discernir a relação agulha-nervo depende do usuário e da anatomia. De fato, estudos demonstraram que os praticantes podem perder aproximadamente uma em cada seis injeções intraneurais. Em segundo lugar, a resolução atual da máquina de ultrassom pode não ser adequada para discernir entre uma localização extrafascicular da ponta da agulha intraversus. Essa diferença é crucial, pois uma injeção intraneural (mas extrafascicular) provavelmente não está associada a lesão, enquanto a injeção dentro dos próprios fascículos produz dano clínico e histológico. É importante ressaltar que não se pode confiar no inchaço do nervo como aviso de uma injeção intraneural, porque uma vez que isso é observado no ultrassom, pode ser tarde demais para evitar lesões. Isso ocorre porque mesmo uma quantidade minúscula de anestésico local produzirá danos se injetada no fascículo, mas quantidades tão pequenas de anestésico local (por exemplo, 0.1 a 0.5 mL) podem não ser detectadas por ultrassom. Portanto, confiar na confirmação visual da expansão do tecido pode resultar em danos antes que a expansão seja detectada na tela.
Monitoramento da pressão de injeção
Uma injeção de lidocaína enquanto a ponta da agulha estava em uma posição intrafascicular nos nervos ciáticos caninos foi associada a uma alta pressão de abertura (> 20 psi), seguida por um retorno do traçado da pressão de injeção ao normal (ou seja, < 5 psi) após a ruptura fascicular. Em contraste, as injeções extrafasciculares perineural e intraneural produziram baixas pressões de abertura e injeção. Os membros nos quais as injeções no nervo ciático foram associadas a altas pressões de injeção de abertura apresentaram sinais clínicos de neuropatia (desperdício muscular, fraqueza), bem como evidência histológica de lesão neurológica (inflamação, ruptura da arquitetura nervosa). A implicação é que a injeção em um compartimento de baixa complacência, como dentro de fascículos ligados ao perineuro, requer alta pressão de injeção de abertura antes que a injeção possa ser iniciada.
A posição da ponta da agulha intraneural também está associada a altas pressões de injeção de abertura em cadáveres humanos. Orebaugh et al colocaram agulhas em raízes cervicais de cadáveres usando ultra-som e quantificaram a pressão ao longo de uma injeção de 5 mL de ropivacaína e tinta ao longo de 15 s. Em contraste com as agulhas de controle colocadas fora das raízes (pressão de pico < 20 psi), as injeções intraneurais resultaram em uma pressão de pico média de 49 psi (intervalo de 37 a 66 psi). Da mesma forma, Krol et al realizaram injeções guiadas por ultrassom intraneural e perineural em nervos mais distais em cadáveres humanos frescos (nervos mediano, ulnar e radial) e também relataram que a pressão de injeção de abertura era superior a 15 psi intraneural, enquanto as pressões de injeção de abertura extraneural foram inferiores a 10 psi.
Em um estudo clínico de 16 pacientes submetidos à cirurgia no ombro, o contato agulha-nervo durante o bloqueio do plexo braquial interescalênico foi associado a uma injeção de abertura maior que 15 psi. De fato, no contato agulha-nervo e pouco antes da entrada da agulha nas raízes do plexo braquial, o fluxo do injetado não foi capaz de iniciar em pressões inferiores a 15 psi. A interrupção de uma injeção quando a pressão de injeção de abertura necessária para iniciar uma injeção atingiu 15 psi permitiu evitar a injeção nesta posição perigosa em 97% dos indivíduos. Em contraste, uma posição da agulha a 1 mm de distância do nervo foi associada ao início do fluxo em pressões de abertura inferiores a 15 psi. Portanto, como um monitor de contato agulha-nervo, uma pressão de injeção de abertura superior a 15 psi foi muito mais sensível do que uma corrente de limiar mínima de 0.5 ou 0.2 mA ou ocorrência de parestesia.
Esses dados sugerem que quando a pressão no sistema se aproxima de 15 psi sem a capacidade de iniciar o fluxo de injeção, essa alta pressão de injeção de abertura pode sinalizar uma relação perigosa agulha-nervo ou colocação da agulha no plano errado do tecido. Portanto, a injeção deve ser interrompida e a posição da agulha reavaliada.
Como a pressão de injeção deve ser monitorada? O uso da “sensação da mão” para evitar alta pressão de injeção infelizmente não é confiável. Estudos de profissionais experientes cegos para a pressão de injeção e solicitados a realizar uma injeção simulada usando equipamento padrão revelaram grandes variações na pressão aplicada, algumas excedendo grosseiramente os limites estabelecidos para segurança. Da mesma forma, os anestesiologistas tiveram um desempenho ruim quando solicitados a distinguir entre injeção intraneural e injeção em outros tecidos, como músculo ou tendão, em um modelo animal. Portanto, o único monitoramento significativo e reprodutível é usando um método objetivo e quantificável de monitoramento da pressão de injeção de abertura.
Embora a prática de monitoramento da pressão de injeção durante bloqueios de nervos periféricos seja relativamente nova, existem várias opções de monitoramento. Tsui et al descreveram uma “técnica de injeção de ar comprimido” pela qual 10 mL de ar são aspirados para dentro da seringa junto com o anestésico local. Segurando a seringa na posição vertical, um limite máximo de 1 atm (ou 14.7 psi) pode ser evitado permitindo que apenas a porção de gás do conteúdo da seringa seja comprimida até a metade de seu volume original, ou 5 mL (Figura 3). Isso é baseado na lei de Boyle, que afirma que a pressão x volume deve ser constante. Uma pressão de 20 psi ou menos é considerada um limiar seguro para iniciar a injeção durante bloqueios de nervos periféricos. A lei de Boyle também foi empregada em outro aparato simples usando uma torneira de quatro vias e uma seringa de 1 mL cheia de ar. Se, durante o início da injeção, o menisco do fluido atingir o ponto médio na seringa de 1 mL (ou seja, 0.5 mL), isso é indicativo de duplicação da pressão no sistema (ou seja, outra atmosfera ou 14.7 psi). Essas são maneiras baratas e disponíveis de forma onipresente para limitar a pressão de injeção durante bloqueios de nervos periféricos. As limitações práticas incluem a necessidade de manter a seringa na posição vertical ou desligar periodicamente a torneira da seringa de 1 mL ao aspirar, para que o ar não entre no tubo de injeção.
FIGURA 3. A técnica de injeção de ar comprimido. Uma bolha de ar de 10 mL é colocada na seringa de anestésico local, que é então invertida. A compressão dessa bolha em um sistema fechado para metade de seu volume original (ou seja, 5 mL) aumentará a pressão no sistema em 1 atm (14.7 psi).
Outra opção para monitorar a pressão de injeção é o uso de manômetros de pressão descartáveis em linha, fabricados especificamente para esta finalidade. Esses dispositivos conectam a seringa e o tubo da agulha e, por meio de um pistão com mola, permitem que o médico monitore continuamente a pressão no sistema seringa-tubo-agulha. No eixo do pistão há marcações delineando três diferentes limites de pressão: menos de 15 psi, 15–20 psi e mais de 20 psi (Figura 4). Uma vantagem deste método é a facilidade com que um assistente que está realizando a injeção pode ler e comunicar as pressões alcançadas. Este método também permite a documentação objetiva da pressão de injeção durante um procedimento de bloqueio de nervo periférico. É importante ressaltar que a pressão de abertura (pressão na qual o fluxo começa) é independente do tamanho da seringa, do tubo e da velocidade da agulha ou da injeção (lei de Pascal) (Figura 5). Embora uma pressão maior possa ser gerada por uma seringa menor e uma pressão de injeção mais alta possa ser alcançada por injeção rápida, a pressão de abertura na qual o fluxo começa é a mesma e independente dessas variáveis para tamanhos comuns de seringa-tubo-agulha (ou seja, 18–25). calibre 10). Quando a injeção começa, no entanto, esses fatores influenciarão a pressão de injeção alcançada. Portanto, uma velocidade de injeção lenta e constante é sugerida em todos os procedimentos de bloqueio nervoso (15–15 mL/min). A pressão de injeção de abertura torna-se relevante a cada reposição de agulha e consequente injeção. O monitoramento da pressão pode ser um monitor de segurança útil em vários outros aspectos dos bloqueios de nervos periféricos. Em um estudo de pacientes que receberam bloqueios do plexo lombar randomizados para pressões baixas (<20 psi) versus altas (>60 psi), Gadsden et al demonstraram que XNUMX% dos pacientes no grupo de alta pressão sofreram um bloqueio epidural bilateral.
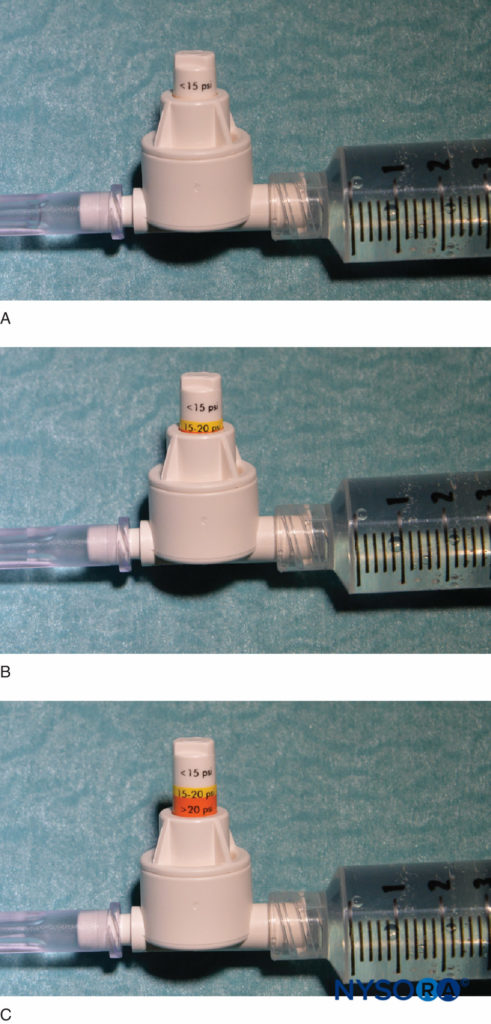
FIGURA 4. Um exemplo de um manômetro de pressão em linha comercialmente disponível (B-Smart, B. Braun Medical, Bethlehem, PA). Conforme visto em A–C, respectivamente, o monitor exibe faixas de pressão em cores no pistão móvel: 0–15 psi (branco), 15–20 psi (amarelo) e mais de 20 psi (laranja). Em uso clínico, a pressão de injeção de abertura exata (OIP) é menos importante do que a prevenção de exceder a faixa de OIP associada à lesão fascicular (>15 psi). Praticamente, isso é evitado abortando a injeção com o aparecimento de qualquer cor no pistão durante todo o ciclo de injeção (>15 psi). É importante ressaltar que a pressão de abertura (pressão na qual o fluxo começa) é independente do tamanho da seringa, do tubo e da agulha ou da velocidade de injeção (lei de Pascal).
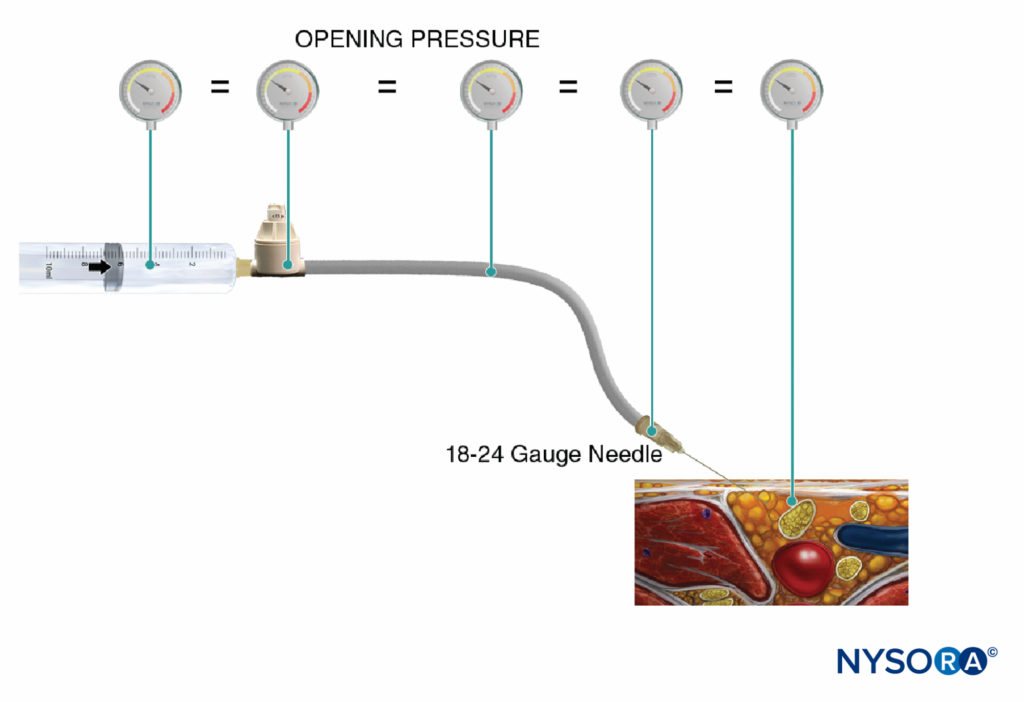
FIGURA 5. A pressão de abertura da injeção (pressão na qual o fluxo começa) é independente do tamanho da seringa, do tubo e da agulha ou velocidade de injeção, e é igual em todo o sistema de injeção (lei de Pascal).
Além disso, 50% dos pacientes do mesmo grupo desenvolveram bloqueio peridural na distribuição torácica, enquanto nenhum paciente do grupo de baixa pressão apresentou bloqueio peridural ou bilateral. Da mesma forma, Gautier et al demonstraram que quando os voluntários foram randomizados para pressões baixas (<15 psi) versus altas (>20 psi) durante o bloqueio do plexo braquial interescalênico, a disseminação peridural cervical ocorreu em 11% das injeções de alta pressão (vs 0% no grupo de baixa pressão). Além disso, todos os sujeitos solicitaram que a injeção fosse interrompida na condição de alta pressão devido ao desconforto, mas não durante a injeção de baixa pressão. Esses dados sugerem que o monitoramento da pressão de injeção de abertura é importante para diversos aspectos de segurança e conforto do paciente durante a prática de bloqueios de nervos periféricos.
Resumo
A anestesia regional vem fazendo uma transição da arte para a ciência, à medida que se desenvolvem meios mais rigorosos e precisos de localização dos nervos. O mesmo processo deve ser esperado para monitorar o bloqueio periférico. O uso de neuroestimulação, ultrassonografia e monitoramento da pressão de injeção juntos fornece um pacote complementar de dados objetivos que podem orientar os médicos a realizar os bloqueios mais seguros possíveis.
Figura 6 é um fluxograma descrevendo como esses monitores são usados em nossa prática.
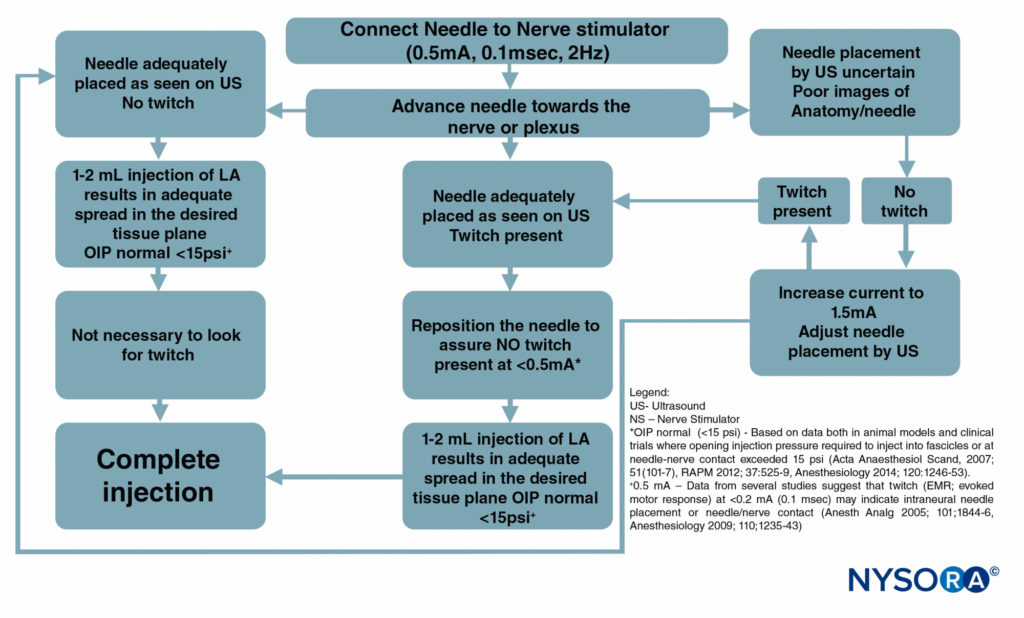
FIGURA 6. Um fluxograma que descreve a ordem de monitoramento correto dos procedimentos de bloqueio do nervo combinando ultrassom (US), estimulação do nervo (NS) e monitoramento da pressão de injeção. LA = anestésico local.
DOCUMENTAÇÃO
Notas do procedimento de bloqueio
A documentação dos procedimentos de bloqueio do nervo ficou atrás da documentação da anestesia geral, e muitas vezes é relegada a algumas linhas rabiscadas no canto do registro anestésico. A crescente pressão de fontes legais, de cobrança e regulatórias provocou um esforço para melhorar a documentação de bloqueios de nervos periféricos. Amostras de um formulário de documentação de bloqueio de nervo periférico que incorpora todos os elementos de monitoramento mencionados anteriormente neste capítulo são mostrados em Figuras 7 e 8. Estes podem ser adotados e modificados para se adequarem às práticas individuais. Os formulários possuem uma série de características que devem ser consideradas pelas instituições que tentam formular sua própria nota de procedimento. Estes incluem o seguinte:
Os registros em papel estão sendo cada vez mais substituídos por sistemas eletrônicos de manutenção de registros médicos. A documentação do bloco é simples com sistemas informatizados como esses, pois as variáveis do bloco podem ser selecionadas rapidamente de uma lista, indicando itens de documentação relevantes, enquanto quaisquer elementos narrativos podem ser digitados rapidamente usando um teclado (Figura 8). Legibilidade e capacidade de corrigir erros são vantagens para a nota de bloco eletrônico.

FIGURA 8. Captura de tela de uma página de documentação de bloco extraída de um prontuário eletrônico.
Outro aspecto útil da documentação do bloqueio de nervo periférico é a gravação de uma imagem de ultrassom ou videoclipe, a ser armazenado como uma cópia impressa no prontuário do paciente ou como uma cópia digital no prontuário eletrônico (EHR) ou em um disco rígido seguro separado. Esta não é apenas uma boa prática do ponto de vista médico-legal, mas também é uma etapa necessária que deve ser tomada se o médico desejar faturar pelo uso da orientação por ultrassom. Quaisquer cópias impressas devem ter um adesivo de identificação do paciente anexado, a data registrada e quaisquer achados pertinentes destacados com um marcador, como anestésico local se espalhando ao redor do nervo. Exemplos adicionais de documentação altamente prática de procedimentos essenciais de bloqueio nervoso e raquianestesia são mostrados em Figuras 9 e 10, Respectivamente.
| Características Úteis de uma Nota de Procedimento de Bloqueio de Nervo Periférico | Exemplo |
|---|---|
| Elementos que orientam o profissional para atender a um determinado padrão de cuidado | Um espaço para indicar o uso de epinefrina na solução anestésica local ou caso não tenha sido utilizado, por que não |
| Um compromisso entre eficiência e capacidade de individualização | Informações registradas usando caixas de seleção e espaços de linha em branco |
| Documentação para proteger contra desafios médico-legais comuns | O profissional deve indicar o nível de consciência do paciente |
| Documentação de conformidade com agências reguladoras (por exemplo, Joint Commission) | As caixas de seleção indicam lateralidade |
| Elementos para facilitar o faturamento bem-sucedido | Idioma exigido por muitas seguradoras indicando bloqueio solicitado especificamente pelo cirurgião |
| Documentação dos médicos envolvidos e em que capacidade | O atendente estava realizando o bloqueio ou estava orientando medicamente um residente? |
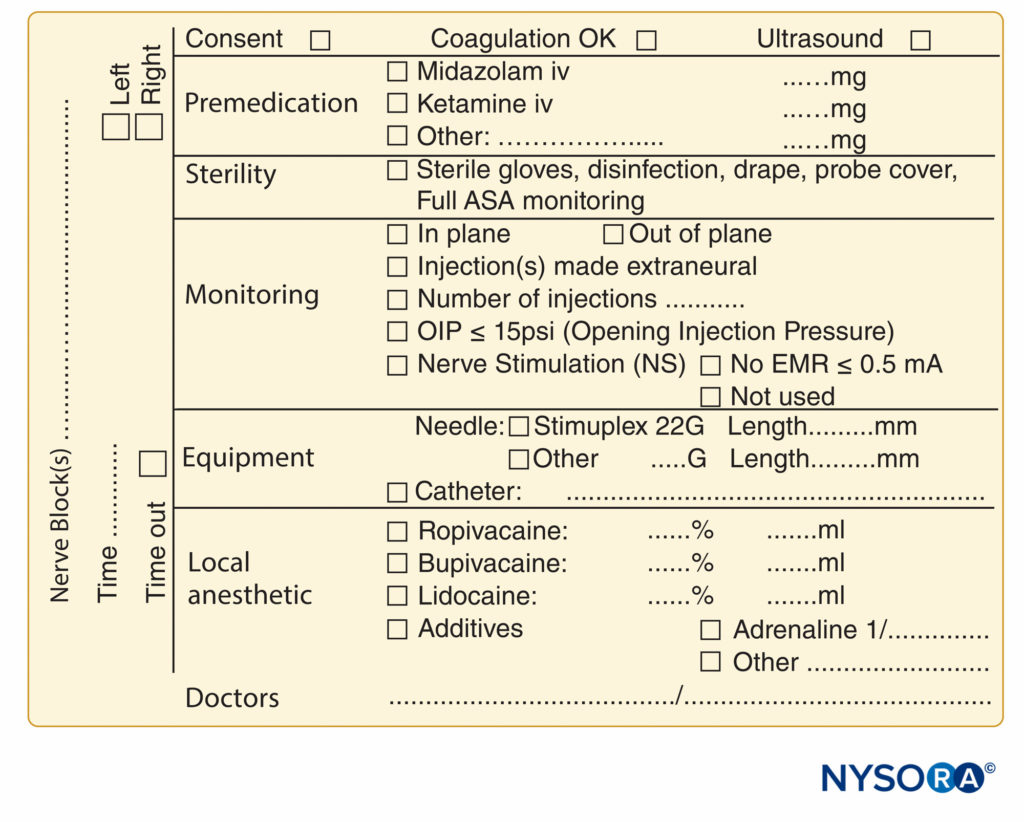
FIGURA 9. Elementos essenciais de documentação de procedimentos de bloqueio de nervos periféricos usados no NYSORA-Europe CREER (Centro de Pesquisa, Educação e Recuperação Aprimorada de Cirurgia Ortopédica) no ZOL (Ziekenhuis Oost-Limburg), Genk, Bélgica.
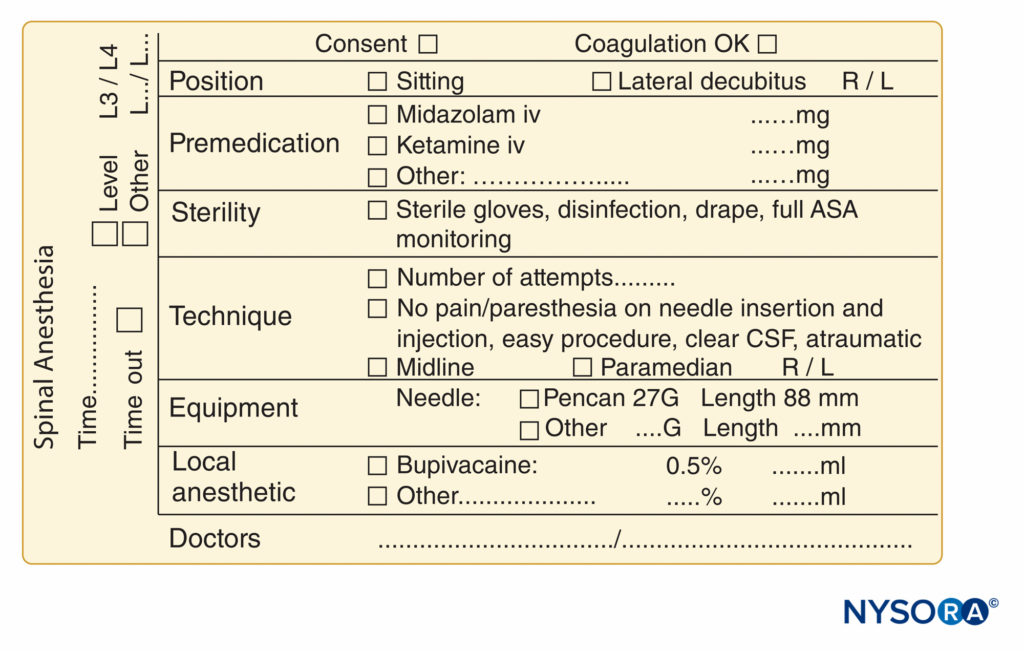
FIGURA 10. Elementos essenciais de documentação de procedimentos de raquianestesia usados no NYSORA-Europe CREER (Centro de Pesquisa, Educação e Recuperação Aprimorada de Cirurgia Ortopédica) no ZOL (Ziekenhuis Oost-Limburg), Genk, Bélgica.
Consentimento Livre e Esclarecido
A documentação do consentimento informado é um aspecto importante da prática da anestesia regional. Os padrões de prática variam muito sobre esse assunto, e o consentimento por escrito específico para procedimentos de bloqueio de nervo geralmente não é obtido. No entanto, a documentação escrita deste processo pode ser importante por vários motivos:
- Os pacientes muitas vezes ficam distraídos e ansiosos no dia da cirurgia (quando muitos consentimentos são obtidos) e podem não se lembrar dos detalhes de uma discussão com seu anestesiologista. Estudos mostraram que um registro escrito do processo de consentimento informado melhora a lembrança do paciente sobre os riscos e benefícios.
- Um consentimento por escrito estabelece que ocorreu uma discussão de riscos e benefícios entre o paciente e o médico.
- Um documento específico para anestesia regional pode ser adaptado para incluir todos os riscos comuns e graves; isso permite que o médico os explique ao paciente como uma questão de rotina e reduza a chance de omitir riscos importantes.
As dicas a seguir podem ser utilizadas para maximizar o processo de consentimento:
| Sugestões para melhorar o processo de consentimento. |
|---|
| Seja breve. Uma explicação simples e curta ajuda a lembrar dos riscos e benefícios mais do que parágrafos longos. |
| Inclua não apenas riscos graves e importantes, mas também benefícios e resultados esperados do procedimento anestésico regional proposto. É difícil para os pacientes fazer uma escolha informada se apenas os riscos forem discutidos. |
| Use o processo de consentimento como meio de educar o paciente simultaneamente. |
| Ofereça uma cópia do formulário ao paciente. Isso foi mostrado para ajudar na recuperação de informações relacionadas ao consentimento. |
REFERÊNCIAS
- Buhre W, Rossaint R: Manejo e monitoramento perioperatório em anestesia. Lancet 2003;362:1839–1846.
- Guinard JP, Mulroy MF, Carpenter RL, Knopes KD: Doses de teste: conteúdo ótimo de epinefrina com e sem bloqueio beta-adrenérgico agudo. Anestesiologia 1990;73:386–392.
- Tanaka M, Sato M, Kimura T, Nishikawa T: A eficácia da dose de teste intravascular simulada em pacientes sedados. Anesth Analg 2001;93: 1612–1617, índice.
- Karmakar MK, Ho AM-H, Law BK, Wong ASY, Shafer SL, Gin T: Farmacocinética arterial e venosa da ropivacaína com e sem epinefrina após bloqueio paravertebral torácico. Anestesiologia 2005;103:704–711.
- Van Obbergh LJ, Roelants FA, Veyckemans F, Verbeeck RK: Em crianças, a adição de epinefrina modifica a farmacocinética da ropivacaína injetada caudalmente. Can J Anaesth 2003;50:593–598.
- Neal JM: Efeitos da epinefrina em anestésicos locais no sistema nervoso central e periférico: neurotoxicidade e fluxo sanguíneo neural. Reg Anesth Pain Med 2003;28:124–134.
- Sites BD, Taenzer AH, Herrick MD, et al: Incidência de toxicidade sistêmica do anestésico local e sintomas neurológicos pós-operatórios associados a 12,668 bloqueios nervosos guiados por ultrassom: uma análise de um registro clínico prospectivo. Reg Anesth Pain Med 2012;37(5):478–482.
- Perlas A, Niazi A, McCartney C, Chan V, Xu D, Abbas S: A sensibilidade da resposta motora à estimulação nervosa e parestesia para localização do nervo avaliada por ultra-som. Reg Anesth Pain Med 2006;31:445–450.
- Chan VWS, Brull R, McCartney CJL, Xu D, Abbas S, Shannon P: Um estudo ultrassonográfico e histológico de injeção intraneural e estimulação elétrica em porcos. Anesth Analg 2007;104:1281–1284, índice.
- Robards C, Hadzic A, Somasundaram L, et al: Injeção intraneural com estimulação de baixa corrente durante o bloqueio do nervo ciático poplíteo. Anesth Analg 2009;109:673–677.
- Voelckel WG, Klima G, Krismer AC, et al: Sinais de inflamação após bloqueio do nervo ciático em porcos. Anesth Analg 2005;101:1844–1846.
- Tsai TP, Vuckovic I, Dilberovic F, et al: A intensidade da corrente estimulante pode não ser um indicador confiável da colocação da agulha intraneural. Reg Anesth Pain Med 2008;33:207–210.
- Bigeleisen PE, Moayeri N, Groen GJ: Limiares de estimulação extraneural versus intraneural durante bloqueio supraclavicular guiado por ultrassom. Anestesiologia 2009;110:1235–1243.
- Wiesmann T, Bornträger A, Vassiliou T, et al: A intensidade mínima da corrente para provocar uma resposta motora evocada não pode discernir entre o contato agulha-nervo e a inserção intraneural da agulha. Anesth Analg 2014;118:681–686.
- Steinfeldt T, Graf J, Schneider J, et al: Consequências histológicas do contato agulha-nervo após estimulação nervosa em um modelo de porco. Prática de Anestesiologia 2011;2011:591851.
- Steinfeldt T, Poeschl S, Nimphius W, et al: Avanço forçado da agulha durante o contato agulha-nervo em um modelo suíno: resultado histológico. Anesth Analg 2011;113:417–420.
- Gadsden J, Latmore M, Levine DM, Robinson A: A alta pressão de injeção de abertura está associada ao contato agulha-nervo e agulha-fáscia durante o bloqueio do nervo femoral. Reg Anesth Pain Med 2016;41(1):50–55.
- Hogan QH: Fisiopatologia da lesão do nervo periférico durante a anestesia regional. Reg Anesth Pain Med 2008;33:435–441.
- Whitlock EL, Brenner MJ, Fox IK, Moradzadeh A, Hunter DA, Mackinnon SE: lesão por injeção de nervo periférico induzida por ropivacaína no modelo de roedor. Anesth Analg 2010;111(1):214–220.
- Sala-Blanch X, Ribalta T, Rivas E, et al: Lesão estrutural do nervo ciático humano após inserção de agulha intraneural. Reg Anesth Pain Med 2009;34:201–205.
- Hadzic A, Dilberovic F, Shah S, et al: A combinação de injeção intraneural e alta pressão de injeção leva a lesão fascicular e déficits neurológicos em cães. Reg Anesth Pain Med 2004;29:417–423.
- Gauss A, Tugtekin I, Georgieff M, Dinse-Lambracht A, Keipke D, Gorsewski G: Incidência de pneumotórax clinicamente sintomático no bloqueio do plexo braquial infraclavicular e supraclavicular guiado por ultrassom. Anestesia 2014;69:327–336.
- Russon K, Blanco R: Injeção intraneural acidental no nervo musculocutâneo visualizado com ultrassom. Anesth Analg 2007;105:1504–1505, índice.
- Schafhalter-Zoppoth I, Zeitz ID, Gray AT: Empalamento inadvertido do nervo femoral e injeção intraneural visualizados por ultra-som. Anesth Analg 2004;99:627–628.
- Loubert C, Williams SR, Hélie F, Arcand G: Complicação durante bloqueio regional guiado por ultrassom: injeção intravascular acidental de anestésico local. Anestesiologia 2008;108:759–760.
- Vadeboncouer T, Weinberg G, Oswald S, Angelov F: Detecção precoce de injeção intravascular durante bloqueio do plexo braquial supraclavicular guiado por ultrassom. Reg Anesth Pain Med 2008;33:278–279.
- Martínez Navas A, DE LA Tabla González RO: A técnica guiada por ultrassom permitiu a detecção precoce de injeção intravascular durante um bloqueio do plexo braquial infraclavicular. Acta Anesthesiol Scand 2009;53:968–970.
- Barrington MJ, Kluger R: A orientação por ultrassom reduz o risco de toxicidade sistêmica do anestésico local após bloqueio de nervo periférico. Reg Anesth Pain Med 2013;38:289–297.
- Orebaugh SL, Kentor ML, Williams BA: Resultados adversos associados a bloqueios de nervos periféricos guiados por estimulador de nervos e guiados por ultrassom por estagiários supervisionados: atualização de um banco de dados de um único local. Reg Anesth Pain Med 2012;37:577–582.
- Casati A, Baciarello M, Di Cianni S, et al: Efeitos da orientação por ultrassom sobre o volume anestésico mínimo efetivo necessário para bloquear o nervo femoral. Br J Anaesth 2007;98:823–827.
- Sandhu NS, Bahniwal CS, Capan LM: Viabilidade de um bloqueio infraclavicular com volume reduzido de lidocaína com orientação ultrassonográfica. J Ultrasound Med 2006;25:51–56.
- Vandepitte C, Gautier P, Xu D, Salviz EA, Hadzic A: Volume efetivo de ropivacaína 0.75% através de um cateter necessário para bloqueio do plexo braquial interescalênico. Anestesiologia 2013;118:863–867.
- Riazi S, Carmichael N, Awad I, Holtby RM, McCartney CJL: Efeito do volume de anestésico local (20 vs 5 ml) na eficácia e consequências respiratórias do bloqueio do plexo braquial interescalênico guiado por ultrassom. Br J Anaesth 2008;101:549–556.
- O'Donnell B, Riordan J, Ahmad I, Iohom G: Relatos breves: uma avaliação clínica das características do bloqueio usando um mililitro de lidocaína a 2% no bloqueio do plexo braquial axilar guiado por ultrassom. Anesth Analg 2010;111:808–810.
- Krediet AC, Moayeri N, Bleys RLAW, Groen GJ: Intraneural ou extraneural: acurácia diagnóstica da avaliação por ultrassom para localizar injeção de baixo volume. Reg Anesth Pain Med 2014;39:409–413.
- Liu SS, YaDeau JT, Shaw PM, Wilfred S, Shetty T, Gordon M: Incidência de injeção intraneural não intencional e complicações neurológicas pós-operatórias com bloqueios dos nervos interescalênico e supraclavicular guiados por ultrassom. Anestesia 2011;66:168–174.
- Hara K, Sakura S, Yokokawa N, Tadenuma S: Incidência e efeitos da injeção intraneural não intencional durante o bloqueio do nervo ciático subglúteo guiado por ultrassom. Reg Anesth Pain Med 2012;37:289–293.
- Bigeleisen PE: A punção do nervo e a aparente injeção intraneural durante o bloqueio axilar guiado por ultrassom não resultam invariavelmente em lesão neurológica. Anestesiologia 2006;105:779–783.
- Selander D, Dhunér KG, Lundborg G: Lesão de nervo periférico devido a agulhas de injeção usadas para anestesia regional. Um estudo experimental dos efeitos agudos do trauma por agulha. Acta Anesthesiol Scand 1977;21:182–188.
- Orebaugh SL, Mukalel JJ, Krediet AC, et al: Injeção da raiz do plexo braquial em modelo de cadáver humano: distribuição do injetado e efeitos no neuroeixo. Reg Anesth Pain Med 2012;37:525–529.
- Krol A, Szarko M, Vala A, De Andres J: Monitoramento de pressão de injeções intraneurais e perineural nos nervos mediano, radial e ulnar: lições de um estudo cadavérico. Anesth Pain Med 2015;5:e22723.
- Gadsden JC, Choi JJ, Lin E, Robinson A: A pressão de injeção de abertura detecta consistentemente o contato agulha-nervo durante o bloqueio do plexo braquial interescalênico guiado por ultrassom. Anestesiologia 2014;120: 1246-1253.
- Claudio R, Hadzic A, Shih H, et al: Pressões de injeção por anestesiologistas durante bloqueio de nervo periférico simulado. Reg Anesth Pain Med 2004;29:201–205.
- Theron PS, Mackay Z, Gonzalez JG, Donaldson N, Blanco R: Um modelo animal de “sensação de seringa” durante o bloqueio do nervo periférico. Reg Anesth Pain Med 2009;34:330–332.
- Tsui BCH, Knezevich MP, Pillay JJ: Pressões de injeção reduzidas usando uma técnica de injeção de ar comprimido (CAIT): um estudo in vitro. Reg Anesth Pain Med 2008;33:168–173.
- Patil J, Ankireddy H, Wilkes A, Williams D, Lim M: Um medidor de pressão improvisado para bloqueio de nervo regional/injeções de anestesia: um estudo inicial. J Clin Monit Comput 2015. doi:10.1007/s10877-015-9701-z.
- Gadsden JC, Lindenmuth DM, Hadzic A, Xu D, Somasundarum L, Flisinski KA: O bloqueio do plexo lombar usando injeção de alta pressão leva à disseminação contralateral e epidural. Anestesiologia 2008;109: 683–688.
- Gautier P, Vandepitte C, Schaub I, et al: A disposição do radiocontraste no espaço interescalênico em voluntários saudáveis. Anesth Analg 2015;120:1138–1141.
- Gerancher JC, Grice SC, Dewan DM, Eisenach J: Uma avaliação do consentimento informado antes da analgesia epidural para trabalho de parto e parto. Int J Obstet Anesth 2000;9:168–173.