Michael J. Barrington, Richard Brull, Miguel A. Reina e Admir Hadzic
INTRODUÇÃO
Esta seção revisa vários fatores que podem contribuir para complicações neurológicas após bloqueios de nervos periféricos (BNPs) e sugere princípios de prática e implicações de modalidades de monitoramento para mitigar o risco de complicações neurológicas.
CONSIDERAÇÕES DE ANATOMIA DE LESÃO DE NERVO RELACIONADA A BLOCO DE NERVO PERIFÉRICO
Um nervo é um órgão distinto que compreende tecido neural, um estroma de tecido conjuntivo específico e um suprimento sanguíneo designado.Figura 1). As células nervosas, ou neurônios, são compostas por um corpo celular, dendritos e um axônio.
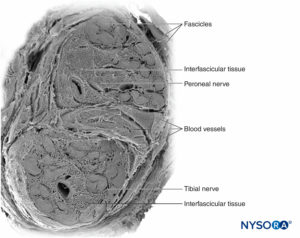
FIGURA 1. Nervo ciático humano. Microscopia eletrônica de varredura. (Reproduzido com permissão de Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
O axônio é uma extensão citoplasmática do neurônio que transmite sinais elétricos ao longo de seu comprimento do corpo celular proximalmente para qualquer lugar de apenas alguns milímetros até quase 1 m distalmente. A maioria dos nervos periféricos pode transmitir tanto sinais motores aferentes quanto sensoriais eferentes.
No sistema nervoso periférico, a grande maioria dos axônios é mielinizada, caracterizada por uma bainha de células de Schwann que envolve o axônio em uma camada de mielina.Figura 2). As células de Schwann são interrompidas em espaços interpostos, conhecidos como nódulos de Ranvier, onde ocorre o processo de despolarização e repolarização durante a propagação saltatória do potencial de ação. Juntamente com sua bainha de mielina, cada axônio é ligado por uma fina camada de tecido conjuntivo chamada endoneuro.Figura 3) e, em seguida, denominado uma fibra nervosa.
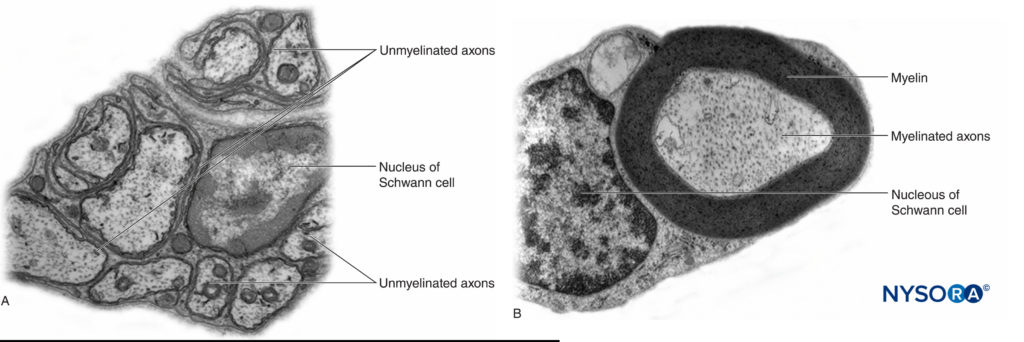
FIGURA 2. A: Axônio não mielinizado de uma radícula nervosa humana. B: Axônio mielinizado de um nervo ciático humano. Microscopia eletrônica de transmissão. (Reproduzido com permissão de Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
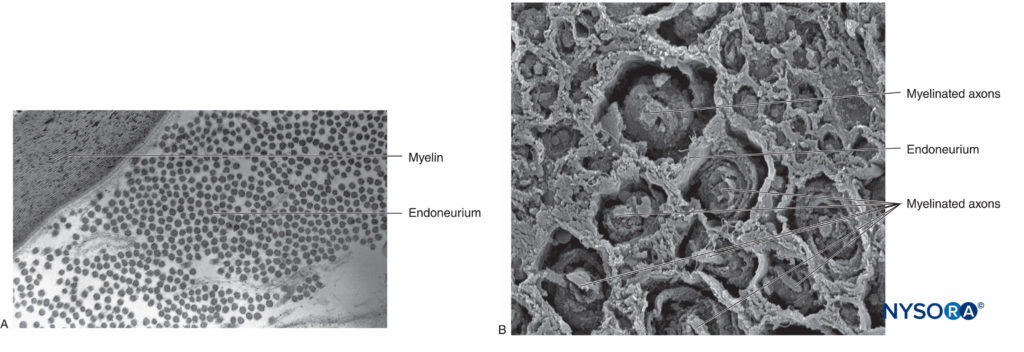
FIGURA 3. Endoneuro. Axônios mielinizados envoltos por endoneuro obtidos de um nervo ciático humano. A: Microscopia eletrônica de transmissão. (Reproduzido com permissão de Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.) B: Microscopia eletrônica de varredura. (Reproduzido com permissão de Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
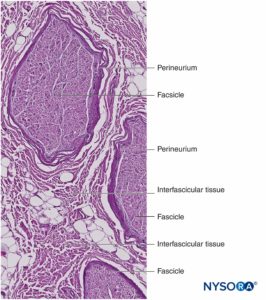
As fibras nervosas são organizadas em grupos chamados fascículos (Figura 4). Dentro de cada fascículo, as fibras nervosas formam um plexo intraneural no qual os axônios assumem diferentes posições ao longo de seu trajeto.Figura 5). Nas proximidades das articulações, os fascículos são mais finos e numerosos e tendem a ser circundados por uma maior quantidade de tecido conjuntivo, o que reduz a vulnerabilidade dos fascículos a agressões como pressão e estiramento.
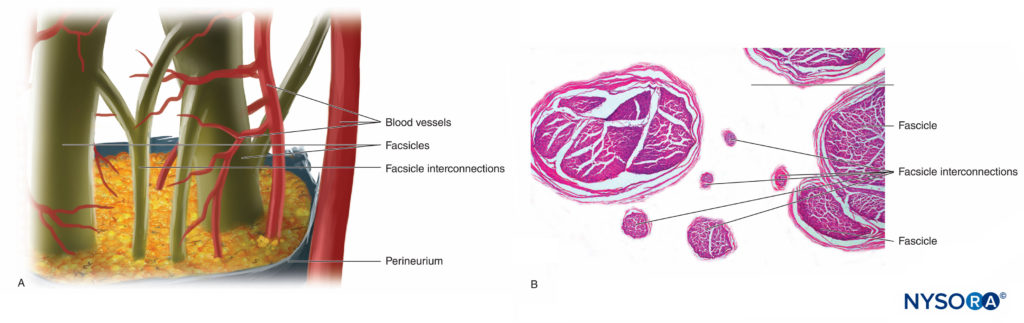
FIGURA 5. Plexo intraneural. R: Diagrama. B: Fascículos e fascículos de interligação. (B, Reproduzido com permissão de Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
Cada fascículo é circundado por perineuro constituído por camadas contínuas e concêntricas de 8 a 18 células.Figura 6). A espessura do perineuro é tipicamente de 7 a 20 μm. As camadas de células perineural fornecem uma barreira para a difusão de substâncias para dentro e para fora dos fascículos. O espaço entre as células perineural é composto por substâncias amorfas fundamentais, fibras colágenas e fibroblastos. Essas fibras colágenas podem estar alinhadas em diferentes direções, mas predominantemente ao longo do eixo longitudinal do fascículo.Figura 6). O perineuro permite algum movimento de axônios dentro de um fascículo e mantém a pressão intrafascicular enquanto serve como uma barreira física eficaz contra lesões mecânicas e químicas. Da mesma forma, o perineuro funciona como uma importante barreira de difusão, evitando a exposição dos axônios a substâncias potencialmente nocivas, como os anestésicos locais.
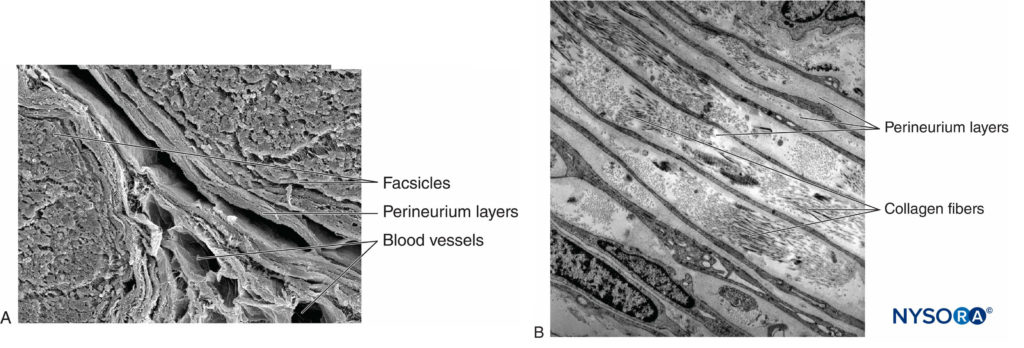
FIGURA 6. Perineuro. Camadas perineurais do nervo ciático humano. A: Microscopia eletrônica de transmissão. (Reproduzido com permissão de Reina MA, López A, Villanueva MC, et al: A barreira hemato-nervosa nos nervos periféricos. Rev Esp Anestesiol Reanim. 2003 Fev;50(2):80-86.) B: Microscopia eletrônica de varredura. (Reproduzido com permissão de Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
Grupos de fascículos são unidos por um epineuro, a mais espessa das três camadas de tecido conjuntivo que envolvem grupos de fascículos juntamente com seu tecido de suporte interfascicular e adipócitos.Figura 1). O epineuro é composto principalmente por fibras de colágeno e um pequeno número de vasos sanguíneos.Figura 7). As fibras de colágeno do epineuro são semelhantes em tamanho e aparência às fibras de colágeno da dura-máter ou mangas durais. O epineuro dá ao nervo sua aparência externa característica na imagem de ultra-som (ou seja, aparece como uma estrutura discreta).
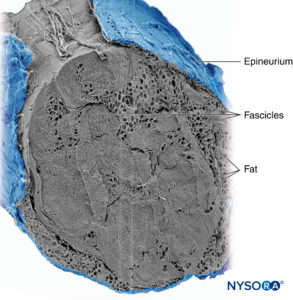
FIGURA 7. Epineuro. Nervo tibial humano: detalhe dos fascículos, tecido interfascicular e epineuro. Microscopia eletrônica de varredura. (Reproduzido com permissão de Reina
MA, Arriazu R, Collier CB, et al: Microscopia eletrônica de nervos periféricos humanos de relevância clínica para a prática do nervo
blocos. Uma revisão estrutural e ultraestrutural baseada em dados experimentais e laboratoriais originais. Rev Esp Anestesiol Reanim. 2013 dez;60(10):552–562.)
Os nervos periféricos têm dois sistemas vasculares independentes, mas interconectados. O sistema extrínseco consiste em artérias, arteríolas e veias que se encontram dentro do epineuro, enquanto o sistema vascular intrínseco compreende um grupo de capilares longitudinais que correm dentro dos fascículos e endoneuro.Figura 8). A anastomose entre os dois sistemas vasculares é formada por vasos (Figura 1) que se originam no epineuro e atravessam o perineuro. A lesão desses vasos pode levar a uma série de complicações, desde isquemia até inflamação por hematoma.
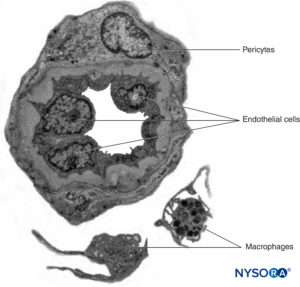
FIGURA 8. Capilares contínuos endoneurais. Microscopia eletrônica de transmissão. (Reproduzido com permissão de Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
As raízes nervosas têm menos resistência à tração e elasticidade em comparação com os axônios e seus elementos de suporte nos troncos nervosos periféricos. Os axônios incluídos nas raízes dos nervos espinhais não são circundados por um perineuro ou outra estrutura com efeito de barreira. Mais distalmente (por exemplo, nervos espinhais e troncos/divisões do plexo), os fascículos têm seu próprio perineuro protetor (Figuras 9, 10 e 11) e possuem um arranjo plexiforme que contribui para sua resistência à tração. Os troncos nervosos dentro dos leitos teciduais, os fascículos dentro dos troncos nervosos e os axônios dentro dos fascículos têm um curso levemente ondulado, resultando em um comprimento relativo excessivo. Além disso, os nervos são frequentemente ligados frouxamente por seu epineuro às estruturas adjacentes. Existe uma rede não especializada de tecido conjuntivo areolar (fáscia profunda) que preenche o espaço entre estruturas especializadas, como nervos, músculos e vasos.Figura 12). Esse tecido conecta frouxamente essas estruturas para que o movimento de uma sobre a outra seja permitido. Esse movimento é reduzido quando os nervos são amarrados entrando em vasos sanguíneos, ramos ou outros pontos de referência.
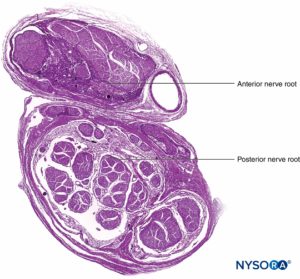
FIGURA 9. Raiz nervosa ventral e dorsal. Corte transversal no manguito da raiz do sétimo nervo entre o saco dural e o gânglio da raiz dorsal. (Usado com permissão de MA Reina.)
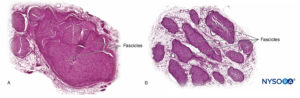
FIGURA 10. Raiz nervosa. Corte transversal no gânglio externo da raiz dorsal do manguito da raiz do sétimo nervo. A: Exterior até 2 mm. B: Exterior até 5 mm. (Usado com permissão de MA Reina.)
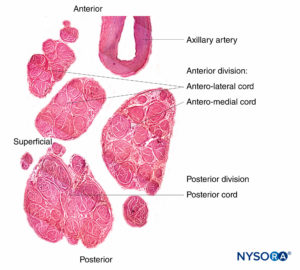
FIGURA 11. Cordões do plexo braquial. Cordão anteromedial, cordão anterolateral e cordão posterior. Detalhes de fascículos e tecido interfascicular dentro dos fascículos. (Reproduzido com permissão de Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
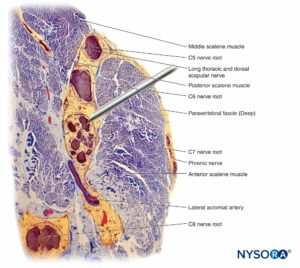
FIGURA 12. Interação da agulha de bloqueio e do plexo braquial interescalênico. A colocação da agulha em fascículos (como mostrado aqui) resulta em lesão fascicular. Lesões adicionais podem ser cometidas quando uma injeção está sendo feita através de uma agulha colocada intrafascicularmente. Observe a diferença de tamanho entre a agulha e os fascículos. (Reproduzido com permissão de Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
Para uma revisão mais abrangente, consulte Tecidos Conjuntivos dos Nervos Periféricos.
Dicas NYSORA
A perda do tônus muscular, como ocorre durante a anestesia, teoricamente expõe os elementos neurais às forças de tração. No entanto, também existem características anatômicas que protegem contra tração lateral ou lesão por estiramento. Por exemplo, no contexto de bloqueios interescalênicos do plexo braquial, a quarta, quinta e sexta raízes nervosas espinhais estão alojadas na calha dos processos transversos e, portanto, são relativamente protegidas dessas forças. As raízes dorsais e ventrais dos nervos espinhais são ainda mais protegidas da tração lateral pela cunha de um cone de dura que envolve o complexo raiz nervosa-nervo espinhal no forame intervertebral.
FISIOPATOLOGIA DA LESÃO DE NERVO PERIFÉRICO
Gravidade da lesão de nervo periférico
Os principais determinantes do prognóstico da lesão do nervo periférico (PNI) são a gravidade da lesão e a integridade residual dos axônios. A gravidade da PNI é tipicamente classificada de acordo com o grau relativo de ruptura axonal. As lesões axonais proximais (ou seja, próximas ao corpo celular) são tradicionalmente consideradas mais graves do que as lesões axonais distais (ou seja, mais próximas do alvo de inervação), pois a probabilidade de inervação e recuperação parece variar indiretamente com a distância entre a localização da a lesão axonal e o tecido-alvo.
As duas classificações anatômicas mais comumente usadas são as classificações de Seddon e Sunderland.tabela 1). A classificação mais comumente usada na prática clínica é a classificação de Seddon em três níveis, que inclui (de leve a grave) neuropraxia, axonotmese e neurotmese. Neuropraxia refere-se a danos na bainha de mielina tipicamente associados ao alongamento ou compressão do nervo, onde os axônios e elementos de suporte (endoneuro, perineuro e epineuro) permanecem intactos. O prognóstico para uma lesão neuropráxica é favorável, com recuperação completa da função ocorrendo dentro de semanas a meses.
TABELA 1. Classificação da lesão nervosa.
| Seddon3 | Sunderland4 | Processos | Prognóstico |
|---|---|---|---|
| Neuropraxia | 1 | Danos na mielina Condução desacelerando e bloqueando | Bom |
| Axonotmese | 2 | Perda de continuidade axonal; endoneuro intacto Sem condução | Feira |
| Neurotmese | 3 | Perda de continuidade axonal e endoneural; perineuro intacto Sem condução | Pobre |
| 4 | Perda de continuidade axonal, endoneural e perineural; epineuro intacto Sem condução | ||
| 5 | Transecção completa do nervo Sem condução |
Dicas NYSORA
A maioria dos sintomas neurológicos pós-operatórios associados à anestesia regional tende a seguir um padrão neuropráxico de lesão e recuperação.
A axonotmese refere-se a lesão axonal associada a empalamento fascicular, esmagamento de nervo ou lesão tóxica, com dano ao endoneuro e possivelmente ao perineuro.Figura 13). A recuperação após a perda axonal pode ser prolongada e variável, dependendo da extensão (parcial ou completa) da ruptura do perineuro e da distância do local da lesão ao músculo correspondente.
Finalmente, neurotmese refere-se à transecção completa do nervo, incluindo os axônios, endoneuro, perineuro e tecido conjuntivo epineural. Geralmente requer intervenção cirúrgica. O prognóstico é muitas vezes ruim.
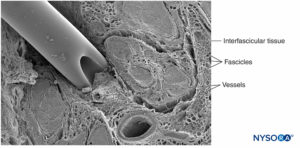
FIGURA 13. Nervo tibial humano. Punção in vitro de nervo com agulha de neuroestimulação. Microscopia eletrônica de varredura. (Reproduzido com permissão de Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
Mecanismos de Lesão
O mecanismo de PNI relacionado ao uso de BNPs se enquadra em uma das três grandes categorias: lesão mecânica e por injeção (traumática), vascular (isquêmica) e química (neurotoxicidade). A maioria das informações sobre lesão por injeção de nervo periférico é obtida a partir de pesquisas experimentais em modelos animais. Como tal pesquisa não é possível em humanos, os mecanismos de PNI não são totalmente compreendidos. Isso ocorre porque os modelos animais variam significativamente em espécies usadas, nervos injetados e protocolos de estudo, dificultando a extrapolação desses dados para a prática clínica real.
Lesão Mecânica e por Injeção
Lesões mecânicas ou traumáticas incluem compressão, estiramento, laceração ou lesão por injeção. A compressão ou aprisionamento do nervo pode produzir um bloqueio de condução e, se prolongado, uma desmielinização focal de alguns axônios. O trauma com agulha e outros insultos mecânicos aos nervos resultam em um aumento na produção de neuropeptídeos e na atividade do corno dorsal. A compressão do nervo relacionada à agulha pode resultar do contato vigoroso da agulha com o nervo de uma agulha que se aproxima ou da injeção dentro do próprio nervo. Postulou-se que uma injeção intraneural pode levar a uma pressão intraneural sustentada alta, que, ao exceder a pressão de oclusão capilar, pode levar à isquemia do nervo e potencialmente à lesão.
Injeções inadvertidas de antibióticos, esteróides, colágeno bovino, toxina botulínica e anestésicos locais em nervos periféricos têm sido associadas a déficits neurológicos deletérios. Em um modelo cadavérico de injeção intraneural deliberada do nervo ciático, a ponta da agulha rompeu 3% dos axônios. Embora algum grau de lesão axonal possa ocorrer mesmo na ausência de lesão do perineuro, o local anatômico real da lesão (por exemplo, injeção) é crítico prognosticamente. Uma das principais causas de RNP relacionada ao bloqueio é a injeção de anestésico local em um fascículo, causando trauma direto com agulha e injeção, ruptura do perineuro e perda do ambiente protetor dentro do fascículo com consequente degeneração da mielina e axonal. Lesões por estiramento nos nervos podem ocorrer quando os nervos ou plexos são colocados em uma posição fisiológica exagerada ou não fisiológica. Finalmente, a lesão mecânica por laceração ocorre quando o nervo é lesado por uma agulha, com o potencial de recuperação espontânea muito improvável após a transecção completa. tabela 2 indica as recomendações baseadas em evidências para reduzir o risco de PNIs relacionados ao bloqueio.
TABELA 2. Recomendações baseadas em evidências para reduzir o risco de PNI relacionada ao bloqueio.
| A inserção da agulha intraneural nem sempre pode levar à lesão do nervo. |
| A colocação e injeção intrafascicular da agulha devem ser evitadas. |
| Nem a presença nem a ausência de parestesia durante o avanço da agulha ou na injeção de anestésico local é totalmente preditiva de lesão nervosa. |
| A eliciação de dor intensa durante o avanço da agulha ou na injeção de anestésico local deve levar à interrupção da injeção. |
| A presença de uma resposta motora evocada em uma corrente inferior a 0.5 (0.1 ms) indica relação íntima agulha-nervo, contato agulha-nervo ou colocação de agulha intraneural. Esta informação é útil na tomada de decisão clínica. |
| O monitoramento da pressão de injeção pode detectar a injeção em um espaço de tecido pouco complacente, como um fascículo nervoso. |
| A ultrassonografia pode detectar a injeção intraneural, embora essa detecção possa ocorrer tarde demais para evitar lesões, pois uma pequena quantidade de injetado é suficiente para romper o fascículo. |
| A tecnologia de ultra-som atual não tem resolução adequada para discernir entre uma injeção interfascicular e uma intrafascicular. |
| Imagens adequadas da interface agulha-nervo não são obtidas de forma consistente por todos os operadores e em todos os pacientes. |
Lesão Vascular
Danos à vasculatura do nervo durante os bloqueios nervosos podem resultar em isquemia local ou difusa e ocorrem quando há lesão vascular direta, oclusão aguda das artérias das quais os vasa nervorum são derivados ou por hemorragia dentro de uma bainha nervosa. A circulação epineural é um componente crítico da circulação neural geral, e sua remoção reduz o suprimento sanguíneo do nervo em 50%. Na maioria das circunstâncias, nenhum vaso único domina o padrão em toda a extensão do nervo; entretanto, o nervo ciático é uma exceção a essa regra, recebendo seu maior suprimento arterial na região glútea da arteria comitans nervi ischiadici.
Dicas NYSORA
O suprimento vascular do nervo ciático é menos abundante do que o suprimento da maioria dos outros nervos periféricos. Isso pode explicar a observação clínica sobre por que a adição de epinefrina ao anestésico local parece prolongar o bloqueio ciático significativamente por mais tempo do que para a maioria dos outros BNPs.
Os nervos com abundância de tecido conjuntivo podem ser menos suscetíveis à compressão porque as forças externas não são transmitidas diretamente aos vasos epineuros. Anestésicos locais e adjuvantes reduzem potencialmente o fluxo sanguíneo neural de maneira dependente do agente e da concentração. A epinefrina tem o potencial de causar vasoconstrição local, mas seu papel em causar isquemia e lesão nervosa é controverso. O trauma da injeção pode comprometer ainda mais o fluxo sanguíneo. A isquemia neural também pode ocorrer após a ruptura da microvasculatura intrafascicular, altas pressões de injeção, torniquetes e outros insultos compressivos. Fatores relacionados à punção inadvertida do vaso, resultando na formação de um hematoma interno ou externo que pode comprimir mecanicamente os fascículos de dentro ou de fora da bainha do nervo e causar inflamação do nervo, têm sido implicados em lesão neurológica.
Lesão Química
A lesão química do nervo resulta da toxicidade tecidual de soluções injetadas (por exemplo, anestésicos locais, álcool ou fenol) ou seus aditivos. A solução tóxica pode ser injetada diretamente no nervo ou em tecidos adjacentes, causando uma reação inflamatória aguda ou fibrose crônica que envolve indiretamente o nervo. Grande parte da pesquisa sobre neurotoxicidade de anestésicos locais tem sido feita em modelos in vitro, particularmente com aplicação intratecal.
Há evidências de que quase todos os anestésicos locais podem ter efeitos miotóxicos, neurotóxicos e citotóxicos em vários tecidos sob certas condições; entretanto, os anestésicos locais variam em seu potencial neurotóxico. Vários estudos demonstraram que os anestésicos locais podem levar à fragmentação do DNA e romper o potencial de membrana nas mitocôndrias, resultando no desacoplamento da fosforilação oxidativa, o que pode resultar em apoptose. Há também uma correlação direta entre a concentração do anestésico local e o tempo de exposição do nervo, com morte das células de Schwann, infiltração de macrófagos e lesão da mielina. Alguns anestésicos locais têm um efeito vasoconstritor intrínseco que pode diminuir o fluxo sanguíneo para os nervos, resultando potencialmente em isquemia e lesão.
No entanto, a dificuldade inerente em extrapolar esses estudos laboratoriais para a prática clínica dos BNPs modernos é que há uma diminuição substancial na concentração de anestésicos locais no momento em que atinge os axônios.
O local de aplicação do anestésico local (extraneural, intraneural, interfascicular, intrafascicular) (Figuras 12, 14 e 15) pode ser o principal determinante da ocorrência de neurotoxicidade, especialmente se a concentração for alta e a duração da exposição prolongada. A maioria das substâncias químicas, incluindo todos os anestésicos locais, injetadas intrafascicularmente levam a lesão fascicular grave, enquanto as mesmas substâncias injetadas intraneuralmente, mas interfascicularmente, causam menos lesão ou nenhuma lesão detectável. De fato, a penetração da agulha em um nervo pode resultar em dano mínimo se não for combinada com injeção de anestésico local dentro do fascículo do nervo.
FIGURA 14. Sobreposição da agulha no plexo braquial supraclavicular. Se a agulha de neuroestimulação perfurar o nervo, em comparação com as imagens estáticas, a agulha lesa os fascículos. Diferentes abordagens são mostradas em A. e B. (Reproduzido com permissão de Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
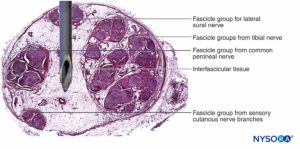
FIGURA 15. Sobreposição da agulha no nervo ciático, abordagem posterior. Se a agulha de neuroestimulação perfurar o nervo, com base nas imagens estáticas, a agulha lesa os fascículos. Observe a diferença de tamanho entre a agulha e os fascículos. Se houver uma grande quantidade de tecido interfascicular, como ocorre dentro do nervo ciático, o risco de lesão fascicular é reduzido. (Reproduzido com permissão de Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
Em um modelo de roedor, Whitlock demonstrou que a injeção intrafascicular de ropivacaína a 0.75% resultou em anormalidades histológicas graves, incluindo desmielinização, degeneração axonal e degeneração Walleriana. No entanto, a injeção extrafascicular de ropivacaína a 0.75% também resultou em lesão axonal, embora com gravidade reduzida. Farber e colegas relataram recentemente que todos os anestésicos locais comumente usados (bupivacaína, lidocaína e ropivacaína) produziram lesão nervosa quando injetados por via intrafascicular. Em seu estudo, o grau de lesão diminuiu com o aumento da distância do local da injeção. É importante notar que mesmo a administração de solução salina por via intrafascicular resultou em danos intermediários aos nervos, indicando um nível basal de lesão associado à injeção de qualquer agente em um nervo.
Dicas NYSORA
Embora a importância clínica da neurotoxicidade permaneça controversa, a localização da ponta da agulha durante a injeção do anestésico local desempenha um papel crucial na determinação da probabilidade e gravidade da lesão nervosa.
Lesão Inflamatória
Os mecanismos inflamatórios da PNI estão sendo cada vez mais reconhecidos como um mecanismo importante no déficit neurológico pós-RNPT. Respostas inflamatórias inespecíficas direcionadas aos nervos periféricos podem ocorrer distantes do local da cirurgia ou dentro do membro operatório, onde pode ser difícil distinguir de outras causas de PNI. Mecanismos inflamatórios têm sido propostos como responsáveis pela lesão persistente do nervo frênico após bloqueio interescalênico para cirurgia do ombro.Figura 12). Kaufman e colegas relataram uma série de 14 pacientes com paralisia diafragmática crônica após bloqueio interescalênico.
Durante a exploração cirúrgica, aderências, espessamento fascial, alterações vasculares e tecido cicatricial (presentes em 10 de 14 pacientes) envolvendo o nervo frênico sugeriram inflamação crônica e foram consistentes com neuropatia compressiva. Pesquisas recentes sugeriram que a injeção intratecal e intraneural de gel de ultrassom também pode levar à inflamação nos nervos subaracnóideos e periféricos, respectivamente.
ETIOLOGIA DA LESÃO DO NERVO SEGUIDO DO BLOQUEIO DO NERVO PERIFÉRICO
Fatores anestésicos
Vários estudos relataram que o tipo de anestesia (regional vs geral) não parece influenciar a incidência de PNI. A Universidade de Michigan realizou uma análise retrospectiva do PNI e não identificou o PNB como fator de risco independente para PNI em sua série. Três estudos epidemiológicos da Mayo Clinic relataram que a anestesia regional não aumenta o risco de PNI após artroplastia total do joelho (ATJ), artroplastia total do quadril (ATQ) e artroplastia total do ombro. A literatura cirúrgica recente sugeriu que o risco de lesão neurológica pós-operatória associada ao BNP pode ser maior do que o relatado na literatura de anestesia. Discutimos vários fatores técnicos relacionados ao PNB que podem aumentar o risco de PNI.
Injeção intraneural
Evitar traumas deliberados nos nervos, incluindo injeção intraneural, é provavelmente um princípio de segurança fundamental da anestesia regional. No entanto, a injeção intraneural pode ocorrer na prática clínica sem resultar em sinais evidentes de lesão nervosa. De fato, a injeção epineural não intencional intraneural (mas provavelmente extrafascicular) pode ser mais comum do que anteriormente reconhecido. Os riscos presumidos de injeção intraneural foram contestados por Bigeleisen e colegas, que relataram que a punção do nervo e a injeção intraneural aparente durante o bloqueio do plexo braquial axilar em pacientes saudáveis não levaram a lesão neurológica. Um estudo maior de Liu recrutou 257 pacientes jovens e saudáveis com bloqueio interescalênico ou supraclavicular guiado por ultrassom para cirurgia do ombro. A incidência de injeção intraneural não intencional foi de 17% sem qualquer ocorrência de PNI. No entanto, a experiência clínica é limitada e os tamanhos das amostras dos estudos atuais são inadequados para capturar eventos infrequentes, como lesão nervosa. Em contraste, em um relato de caso de Cohen, a PNI ocorreu após injeção intraneural durante bloqueio interescalênico guiado por ultrassom.
Infelizmente, os relatos de injeção intraneural não nos informam sobre os locais de injeção em relação aos fascículos. Distinguir o epineuro externo de um nervo periférico dos tecidos circundantes usando imagens de ultrassom é um desafio.
Orebaugh realizou injeções interescalênicas simuladas (embora com pequenos volumes) em um modelo de cadáver. A imagem de ultra-som não pode diferenciar os componentes neurais extrafasciculares e intrafasciculares ao longo da faixa de locais em que o BNP é realizado. Além disso, uma injeção adjacente ao epineuro externo pode gerar um halo de aparência semelhante a uma injeção intraneural, dificultando a distinção entre a colocação de agulhas perigosa e não perigosa. É importante ressaltar que apenas uma pequena quantidade de anestésico local (por exemplo, 0.1–0.5 mL) é suficiente para romper o fascículo e seu perineuro.
Dicas NYSORA
Basear-se na observação do inchaço do nervo no ultrassom durante os BNPs como método de monitoramento é inadequado para detecção de injeção intrafascicular e prevenção de lesões.
Os dados experimentais e clínicos mais recentes sugerem que a PNI da injeção de anestésico local no nervo ocorre e continua sendo um perigo clínico real. As sequelas de tal lesão podem ser de longa duração e exigir intervenção cirúrgica.
BNPs proximais versus distais e risco de lesão neurológica
As injeções de BNP em locais mais proximais (ou seja, raízes do plexo braquial vs nervos periféricos do plexo braquial) (Figuras 9, 10 e 11) podem estar em maior risco de lesão nervosa em comparação com locais distais do BNP. Isso provavelmente se deve a diferenças na arquitetura neural, principalmente a proporção de tecido neural versus não neural (conjuntivo) (Figura 16). Clinicamente, a injeção intraneural no tecido conjuntivo extrafascicular dentro do epineuro pode não resultar em lesão do nervo. Isso é consistente com o trabalho experimental que correlacionou a injeção intrafascicular à lesão por injeção do nervo periférico.
A organização estrutural do nervo periférico fornece informações sobre o risco relativo de lesão mecânica entre diferentes nervos ou mesmo em diferentes locais dentro do mesmo nervo.Figura 16). Como o epineuro é tipicamente uma camada mais resistente do que o tecido adiposo circundante, os nervos tendem a ser “empurrados” por uma agulha que avança, em vez de serem penetrados.
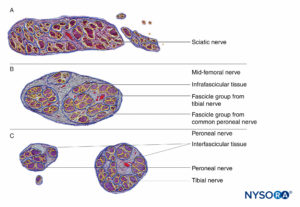
FIGURA 16. Corte transversal do nervo ciático na região subglútea (A), região médio-femoral (B) e nervos tibial e fibular na região poplítea (C). (Reproduzido com permissão de Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
Da mesma forma, quando o epineuro é penetrado por uma agulha, a ponta da agulha e a injeção são muito mais propensas a entrar no tecido adiposo interfascicular do que os fascículos.Figura 15). O tecido adiposo dentro do epineuro permite que os fascículos escapem da agulha que avança; no entanto, essa proteção pode ser prejudicada pelo avanço abrupto da agulha ou pelo contato vigoroso da agulha com o nervo. Os nervos caracterizados por fascículos compactados e alto conteúdo de tecido fascicular a conjuntivo podem estar em maior risco de lesão mecânica do nervo do que aqueles caracterizados por menor conteúdo de tecido fascicular a conjuntivo.
Incidências relativamente altas de sequelas neurológicas transitórias são relatadas após o bloqueio interescalênico, onde há uma proporção de 1:1 de tecido neural para não neural.Figura 12). Vários estudos documentaram uma incidência bastante alta de sintomas neurológicos após o bloqueio do plexo braquial, mas sem sequelas graves. Em outros estudos, houve números absolutos baixos de complicações neurológicas relacionadas ao BNP nos membros superiores, tornando problemática qualquer comparação de resultados em locais proximais com locais distais.
As taxas de lesão após BNP de extremidade inferior foram relatadas como 0.41% (intervalo de confiança de 95% [IC], 0.02–9.96) na região glútea, em comparação com 0.24% (IC 95%, 0.10–0.61) na região poplítea, indicando não diferença significante. É possível que muitos dos sintomas neurológicos relatados pelos pacientes no pós-operatório de BNP sejam inflamatórios e devido ao contato agulha-nervo ou injeção forçada, levando à inflamação intraneural, levando a sintomas, como demonstrado por Steinfeldt. Portanto, a sabedoria do ensinamento de Selander de que “os nervos devem ser manuseados com cuidado” permanece relevante.
Tipo de agulha
As características da ponta da agulha influenciam a probabilidade de penetração fascicular e lesão do nervo. Agulhas de bisel longo são mais propensas a perfurar e entrar no fascículo em comparação com agulhas de bisel curto; no entanto, as agulhas de bisel curto parecem causar mais danos em caso de penetração fascicular (Figura 17). A gravidade da lesão do nervo após a perfuração do nervo por agulha também está ligada ao diâmetro da agulha; no entanto, não existe essa diferença em relação à extensão da inflamação após trauma de nervo agulha.
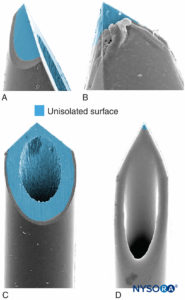
FIGURA 17. Apresenta-se a neuroestimulação de calibre 21, agulha periférica tipo A (A e B) e tipo D (C e D). Microscopia eletrônica de varredura. (Reproduzido com permissão de Reina MA: Atlas of Functional Anatomy for Regional Anesthesia and Pain Medicine. Heidelberg: Springer; 2015.)
O efeito do desenho da agulha na probabilidade e gravidade da lesão mecânica do nervo tem sido amplamente debatido. Não é de surpreender que o trauma mecânico por agulha e a injeção intraneural sejam mecanismos-chave na lesão iatrogênica do nervo, como na anestesia regional. Por exemplo, no cenário de anestesia neuraxial, as lesões durais produzidas por diferentes tipos de agulha variam muito em morfologia; uma agulha Whitacre produz uma abertura mais traumática, com rasgo e grave ruptura das fibras de colágeno, do que uma agulha estilo Quincke. Da mesma forma, a probabilidade e a extensão da lesão mecânica dos fascículos nervosos após a injeção intraneural durante o BNP também dependem do desenho da ponta da agulha. Parece intuitivo que os tipos de agulhas de bisel curto são menos propensos a penetrar nas camadas protetoras do tecido conjuntivo dos nervos periféricos (epineuro, perineuro). De fato, Selander e colegas documentaram que uma agulha com bisel de 45° tem muito menos probabilidade de penetrar no perineuro e infligir lesão fascicular do que uma agulha com bisel de 15°. No entanto, se um fascículo do nervo for acidentalmente empalado durante um procedimento de bloqueio do nervo, as lesões induzidas por agulhas de bisel curto podem ser mais graves e levar mais tempo para reparar do que aquelas induzidas por agulhas de bisel longo.
Fatores cirúrgicos
Requisitos de Posicionamento Cirúrgico
Complicações neurológicas podem ocorrer após o posicionamento para necessidades cirúrgicas. Os mecanismos de lesão nervosa relacionados à cirurgia incluem tração, transecção, compressão, contusão, isquemia e estiramento. Independentemente do mecanismo, a via final da lesão do nervo pode incluir os seguintes fatores: ruptura física dos vasos sanguíneos intraneurais causando isquemia ou hemorragia irregular; pressões venosas intraneurais elevadas; edema endoneural; comprometimento do fluxo axoplasmático; Danos nas células de Schwann; deslocamento de mielina; degeneração axonal; e degeneração Walleriana. Durante a cirurgia, os pacientes são colocados em posições que de outra forma não tolerariam, a menos que estivessem anestesiados. Além disso, as forças físicas exigidas durante a cirurgia (por exemplo, colocação de próteses) podem ser excessivas, potencialmente estressando estruturas anatômicas distantes do local da cirurgia, incluindo a coluna vertebral.
Em uma análise de reclamações fechadas, 9 de 53 lesões do plexo braquial relacionadas à anestesia foram relacionadas ao posicionamento intraoperatório (órtese de ombro na posição de cabeça para baixo [três reclamações], braço do paciente suspenso em uma barra [duas reclamações] e outras más posições [ quatro reivindicações]). Apenas duas reclamações foram relacionadas a uma técnica de anestesia regional.
Efeitos do torniquete pneumático
A insuflação do torniquete causa danos nos nervos por deformação mecânica ou isquemia. As principais características da neuropatia do torniquete incluem fraqueza ou paralisia, tato diminuído, sensação de vibração e posição e sensação preservada de calor, frio e dor. Em um modelo experimental, a compressão do torniquete resultou em aumento da permeabilidade vascular, edema intraneural e degeneração do nervo ciático.
Por exemplo, a compressão do torniquete durante a cirurgia de meniscectomia pode levar à desnervação do nervo femoral e retardar a recuperação funcional. Torniquetes mais largos, usando pressões mais baixas do manguito e limitando a duração da insuflação foram propostos como métodos para prevenir a neuropatia do torniquete.
Neuropatia Inflamatória Pós-Cirúrgica
Os pacientes com neuropatia inflamatória pós-cirúrgica geralmente apresentam uma neuropatia de início tardio e distante da cirurgia. As neuropatias são focais e multifocais com dor e fraqueza. Um mecanismo imune inflamatório é responsável, e há evidências de degeneração axonal e inflamação mediada por linfócitos.
Dicas NYSORA
Nem todos os episódios de PNI são de origem mecânica.
Fatores do Paciente
Neuropatia preexistente
Um déficit neurológico pré-operatório ou comprometimento neural, seja por aprisionamento de nervo ou razões metabólicas, isquêmicas, tóxicas, hereditárias e desmielinizantes, podem estar presentes em pacientes que se apresentam para cirurgia. Muitas dessas condições neurológicas preexistentes são subclínicas, mas podem estar associadas a um risco aumentado de PNI no pós-operatório. Por exemplo, a espondilose cervical muitas vezes negligenciada, mas comum, pode resultar em abertura áspera e irregular do forame intervertebral.
O complexo nervo-raiz nervoso espinhal fica sujeito a traumas repetidos, resultando em fibrose reduzindo sua mobilidade. O complexo nervo-raiz do nervo espinhal está, consequentemente, em risco aumentado de lesão por tração durante o movimento e o posicionamento da extremidade superior. O nervo ulnar pode ficar aprisionado no túnel cubital no cotovelo ou no punho. Os fatores de risco para neuropatia ulnar perioperatória incluem sexo masculino, extremos do habitus corporal e internação prolongada.
As neuropatias diabéticas são comuns e representam uma ampla gama de entidades clínicas comumente resultando em polineuropatia sensitiva simétrica distal. As neuropatias diabéticas assimétricas compreendem neuropatia motora proximal aguda ou subaguda (muitas vezes dolorosa), neuropatia craniana, neuropatia troncular ou toracoabdominal (muitas vezes dolorosa) e neuropatia de aprisionamento nos membros. A radiculopatia lombar diabética pode se apresentar com dor irradiando das costas para os membros inferiores e fraqueza leve.
Pode haver neuropatia difusa com eletromiografia anormal de músculos paravertebrais e músculos inervados pelos nervos do plexo sacral, glúteo, femoral e ciático. Pacientes idosos com diabetes podem ter envolvimento proximal e distal combinados, colocando esses pacientes em risco aumentado de PNI. As fibras nervosas diabéticas podem ser mais suscetíveis aos efeitos tóxicos dos anestésicos locais devido à hipóxia isquêmica crônica e porque os nervos estão expostos a maiores concentrações de anestésicos locais relacionados à diminuição do fluxo sanguíneo. A ocorrência de PNI após bloqueio neuroaxial em pacientes com neuropatia diabética foi relatada como sendo maior (0.4%; IC 95%, 0.1%–1.3%) do que na população geral; no entanto, sua verdadeira relevância clínica é controversa, pois muitos desses pacientes estão entre os maiores beneficiários dos BNPs.
Da mesma forma, o risco real de BNPs no cenário de doença vascular periférica grave, vasculite, tabagismo e hipertensão não é conhecido. Independentemente disso, pacientes com essas condições podem ser mais vulneráveis a novos insultos isquêmicos durante o período perioperatório, semelhante aos pacientes com neuropatias induzidas por álcool e cisplatina. Pacientes com esclerose múltipla e neuropatia hereditária podem ter comprometimento neural pré-operatório subclínico no sistema nervoso periférico.
Estenose do canal vertebral lombar
A estenose do canal vertebral lombar pode exagerar uma lesão periférica, afetando negativamente a recuperação física. A estenose do canal espinhal é um fator de risco para paralisia fibular comum após ATQ e pode ser significativa em casos de paraplegia ou síndrome da cauda equina após anestesia epidural. Hebl documentou déficits neurológicos novos ou progressivos após anestesia neuraxial em pacientes com estenose do canal espinhal preexistente ou doença do disco lombar. No geral, 10 (1.1%, IC 95% 0.5%–2.0%) pacientes desenvolveram novos déficits ou piora de sintomas preexistentes. A frequência de complicações foi maior em pacientes que apresentavam radiculopatia compressiva ou múltiplos diagnósticos neuroaxiais centrais. No entanto, é provável que houvesse múltiplos fatores etiológicos, pois os déficits frequentemente se correlacionavam com o lado da patologia ou procedimento cirúrgico preexistente. Um resumo dos fatores anatômicos, anestésicos, cirúrgicos e do paciente que contribuem para a PNI está listado em tabela 3.
TABELA 3. Resumo dos fatores anatômicos, anestésicos, cirúrgicos e do paciente que contribuem para a lesão nervosa perioperatória.
| Fator Potencialmente Contribuinte ou Relevante para o PNI | Comentário | |
|---|---|---|
| Anatômico | Morfologia interna do nervo, incluindo tecido conjuntivo que sustenta fascículos e axônios1,63 | O tecido epineural pode oferecer proteção contra trauma direto e compressão externa |
| Fatores anatômicos grosseiros: localização, curso, relações, anexos e mobilidade relativa dos nervos1 | - | |
| Estruturas específicas estão em risco | Exemplos: nervo ulnar no cotovelo,76,99 CPN 81,100,101 | |
| Anestésico | Tipo de anestesia | EA e GA, mas não PNB foram associados com PNI.47 PNB não associado a PNI após ATJ,48 ASSIM,49 ou TSA.50 |
| Membro insensato | Coloca os nervos em risco de compressão ou alongamento76 | |
| Local do BNP: proximal com risco aumentado versus BNP distal | Não suportado por evidências clínicas | |
| Nível de sedação durante o bloqueio nervoso | Continua polêmico. No entanto, com monitoramento objetivo da relação agulha-nervo e disposição do injetado (US, estimulação nervosa, monitoramento da pressão de injeção de abertura), esse problema provavelmente ficará mudo. Para obter a recomendação mais recente publicada, consulte o Consultivo de prática da ASRA | |
| Trauma mecânico por agulha, cateter ou injeção | - | |
| Toxicidade direta do anestésico local | Dependente do tempo e da concentração; risco com exposição intrafascicular maior do que extrafascicular6,15 | |
| Isquemia neural | Secundário à compressão,76 vasoconstritores,19,20 injeção intrafascicular,54 torniquete82,103 | |
| Surgical | Trauma: contusão, compressão, retração, tração, transecção | |
| Posicionamento perioperatório76 | ||
| Torniquete: duração da inflação e pressão81,104 Inchaço, gesso Procedimentos específicos têm perfil de risco único95 | Associado a déficits clínicos marcantes80 e alterações patológicas na EMG84 Os riscos de PNI após ATJ,48 ATQ,49 e TSA50 foram de 0.79%, 0.72% e 2.2%, respectivamente |
|
| Pacientes | Comprometimento neural pré-operatório teoricamente aumenta o risco de PNI | A etiologia inclui aprisionamento, causas metabólicas, isquêmicas, tóxicas,93 hereditárias e desmielinizantes94 |
| Estenose do canal lombar | Pode ser fator de risco significativo após bloqueio neuroaxial96,98 | |
| Outros | Mecanismo inflamatório | Causa não mecânica física e temporalmente distante do PNB43 |
MONITORAMENTO DA DISTÂNCIA AGULHA-NERVO DURANTE PNBS E PREVENÇÃO DE COMPLICAÇÕES
Embora o risco de contato agulha-nervo, colocação de agulha intraneural e injeção intraneural tenha sido recentemente questionado em pequenas séries clínicas onde não ocorreram lesões evidentes, lesões nervosas relacionadas ao BNP continuam a ser relatadas. A equipe de Susan MacKinnon recentemente alertou severamente contra a injeção intraneural intencional com base em seus resultados de neurotoxicidade após injeções intrafasciculares de anestésicos locais.
Esta publicação em um dos principais periódicos da especialidade (Anestesia e Analgesia) alertou especificamente contra as recentes recomendações de alguns provedores de que a injeção intraneural não tem risco e, de fato, pode ser benéfica para a qualidade do bloqueio.
É importante notar que o alerta da equipe de MacKinnon decorre de décadas de prática clínica de cirurgia de reparo de nervos periféricos e mais de 350 publicações científicas sobre o assunto. Embora a incidência de lesões nervosas relacionadas ao BNP seja relativamente incomum, elas estão entre as complicações incapacitantes mais comuns relacionadas à administração de anestesia e provavelmente são subnotificadas na literatura devido a implicações médico-legais e relacionadas à reputação institucional. O impacto potencialmente devastador de uma lesão nervosa grave na qualidade de vida do paciente exige uma abordagem sistemática para mitigar o risco por meio da padronização das técnicas de injeção.
Elicitação Mecânica de Parestesias
A associação entre a eliciação mecânica de parestesias e consequente PNI tem sido objeto de debate há muito tempo. Embora alguns grandes ensaios observacionais tenham de fato implicado a eliciação de parestesias como um fator de risco para PNI, tal associação não foi apoiada por outros. Além disso, a ocorrência de parestesias não é um sinal sensível de contato agulha-nervo, pois apenas 38% dos pacientes apresentaram parestesias durante a visualização em tempo real do contato agulha-nervo.
Portanto, a ausência de parestesias durante a realização de um bloqueio nervoso não exclui de forma confiável o contato agulha-nervo, e a lesão do nervo foi relatada tanto em pacientes que sofreram parestesias graves quanto naqueles que não apresentaram parestesias durante o procedimento de BNP. Independentemente disso, uma parestesia grave ou dor no avanço ou injeção da agulha pode indicar a colocação da agulha intraneural e, quando presente, deve solicitar a interrupção da injeção e o reposicionamento da agulha.
Se e como o uso de sedação profunda influencia a percepção e interpretação dos pacientes da parestesia como um sintoma não foi estudado. Da mesma forma, os BNPs guiados por ultrassom frequentemente envolviam múltiplas injeções de alíquotas de anestésico local em diversas áreas anatômicas. Não se sabe como a disseminação do anestésico local durante as técnicas de múltiplas injeções e o bloqueio sensorial incipiente que ocorre durante o procedimento podem ter impacto no valor da parestesia como monitor de segurança.
Estimulação de Nervos Periféricos
A resposta motora à estimulação do nervo periférico depende da lei de Coulomb, segundo a qual uma intensidade de corrente menor (mA; ou, mais corretamente, energia elétrica) é necessária para provocar uma resposta motora ou sensorial à medida que a ponta da agulha se aproxima do nervo.
A importância de evitar a injeção quando a resposta motora é obtida por intensidade de corrente muito baixa (<0.2 mA) e risco de lesão nervosa foi relatada pela primeira vez por Voelckel e colegas. A lesão histológica do nervo ocorreu em 50% dos porcos quando a resposta motora foi obtida em menos de 0.2 mA, em comparação com nenhuma alteração histológica em 0.3-0.5 mA. A presença de resposta motora inferior a 0.2 mA demonstrou ser um indicador específico, mas não sensível, da colocação de agulhas intraneurais em animais e humanos.
A estimulação do nervo periférico como uma técnica de localização do nervo é caracterizada por sensibilidade relativamente baixa, mas alta especificidade para prever a proximidade relativa da agulha-nervo, sugerindo que tal resposta realmente reflete a distância agulha-axônio. Tanto os dados experimentais quanto os relatórios clínicos mostraram que uma resposta motora evocada pode não ser eliciada de forma confiável quando a agulha é colocada na vizinhança imediata do nervo ou mesmo intraneuralmente. No entanto, a mesma pesquisa indicou que quando uma resposta motora é eliciada em baixa intensidade de corrente (por exemplo, < 0.5 mA, 0.1 ms), a ponta da agulha é invariavelmente posicionada no nervo ou dentro do nervo. É importante ressaltar que a estimulação do nervo periférico resistiu ao teste do tempo, como evidenciado pelos maiores conjuntos de dados publicados relacionados ao PNI, todos baseados principalmente na estimulação do nervo periférico para obter um BNP seguro e bem-sucedido.
Monitoramento da pressão de injeção de abertura
A associação entre altas pressões de injeção e injeção intrafascicular foi descrita pela primeira vez em 1979 por Selander e posteriormente estudada em vários modelos animais. Em um modelo de cão, uma injeção intrafascicular intencional foi associada à alta pressão de injeção de abertura (≥25 psi) e lesão nervosa clínica e histológica correspondente. Em contraste, as injeções extrafasciculares não foram associadas a altas pressões de injeção ou lesão nervosa. Em outro estudo em um modelo de cão, a alta pressão de injeção (≥20 psi) também foi associada à injeção intrafascicular, bem como à lesão clínica e histológica do nervo, enquanto a injeção intraneural, mas interfascicular, foi associada à baixa pressão de injeção (<10 psi) e nenhuma lesão neurológica. ou consequências histológicas. Durante a injeção intraneural nos nervos medianos de porcos, Lupu e colegas não conseguiram detectar uma correlação significativa entre a pressão máxima gerada e a lesão clínica ou histológica do nervo. Neste estudo, as pressões de injeção de pico estavam bem abaixo de 25 psi, mas 7 de 10 espécimes de nervo apresentavam evidências de dano axonal no exame histológico. Em um caso, ocorreu dano axonal após uma pressão máxima de injeção de apenas 2.2 psi. É importante ressaltar que déficits funcionais medidos até 7 dias após o insulto estavam ausentes em todos os 10 porcos estudados. Mais recentemente, no primeiro estudo desse tipo em tecido humano, Orebaugh e colegas relataram que 100% das injeções diretamente nas raízes do plexo braquial de cadáveres humanos frescos resultaram em altas pressões de injeção (> 30 psi), com uma ocorrência de disseminação do injetado no espaço peridural. É importante ressaltar que a análise das curvas de pressão de injeção alcançadas indicou que todas as injeções nas raízes do plexo braquial estavam associadas a pressões superiores a 15 psi.
Dados semelhantes sobre a relação pressão-nervo de injeção foram relatados por Krol et al nos nervos periféricos. Em um estudo sobre monitoramento da pressão durante injeções para BNPs dos nervos mediano, radial e ulnar em cadáveres humanos frescos, os autores relataram diferenças significativas entre as pressões de injeção intraneural e perineural. As pressões de injeção intraneural mostraram baixa especificidade, mas alta sensibilidade com a colocação da agulha intraneural.
Vários estudos utilizaram a pressão de injeção como ferramenta de monitoramento para injeção intraneural (intraepineural) durante o bloqueio do nervo ciático sem complicações. Robards e colegas estudaram 24 pacientes, que receberam uma injeção dentro do nervo ciático no nível da fossa poplítea. Pressões de injeção inferiores a 20 psi foram registradas em 20 pacientes, enquanto pressões de injeção superiores a 20 psi foram observadas nos 4 pacientes restantes, levando à interrupção da injeção; nenhum dos pacientes sofreu qualquer disfunção neurológica, sugerindo que as injeções que ocorreram intraneuralmente foram extrafasciculares.
Em um estudo de limiares de estimulação intraneural durante bloqueios supraclaviculares do plexo braquial guiados por ultrassom, Bigeleisen e colegas relataram uma combinação de alta resistência à injeção, estimulação de baixa corrente e dor à injeção que coincidiu em dois pacientes com a colocação de agulha intraneural que exigiu o reposicionamento da agulha antes completar a injeção sem complicações.
Além do risco de lesão neurológica, altas pressões de injeção podem levar a vários outros efeitos indesejados ou complicações graves. Por exemplo, Gadsden e colegas relataram que a alta pressão de injeção durante o bloqueio do plexo lombar traz um risco de disseminação epidural.Figuras 18 e 19). Neste estudo, pressões de injeção superiores a 20 psi durante o bloqueio do plexo lombar levaram a um risco inaceitável de bloqueio epidural de alto nível, em alguns pacientes até o nível T3, necessitando de término precoce do estudo por razões de segurança.
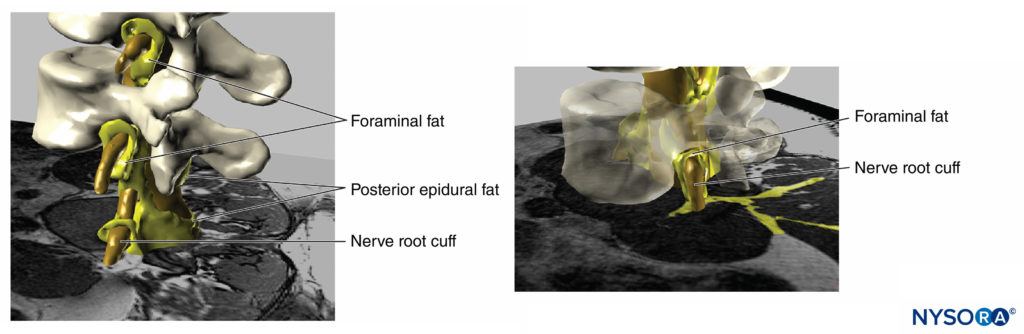
FIGURA 18. Reconstrução tridimensional de imagem de ressonância magnética de vértebras, saco dural, gordura epidural e tecido adiposo foraminal. As áreas pintadas de amarelo representam interconexões entre os tecidos adiposos que podem servir como potenciais caminhos de disseminação para soluções injetadas. (Usado com permissão de MA Reina.)
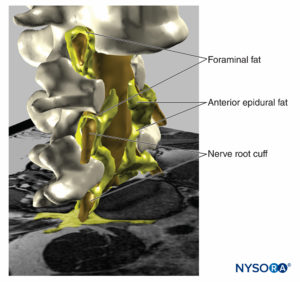
FIGURA 19. Reconstrução tridimensional de vértebras, saco dural, gordura epidural e gordura foraminal a partir de imagens de ressonância magnética de um paciente. Podemos ver o caminho potencial através da gordura da gordura epidural, gordura foraminal, para outros compartimentos de gordura, à medida que a gordura envolve as raízes nervosas externas ao canal foraminal da coluna ou a gordura encontrada entre as fáscias musculares. Dois corpos vertebrais foram removidos, permitindo a visualização da gordura peridural no espaço peridural anterior. (Usado com permissão de MA Reina.)
Mais recentemente, Gautier et al relataram que a alta pressão de injeção durante a injeção interescalênica pode levar a uma dispersão epidural substancial do injetado. O relatório de Gautier ofereceu uma explicação para a morte súbita respiratória e cardiovascular ocasionalmente relatada imediatamente após o bloqueio interescalano, bem como sugeriu que a força/pressão da injeção deve ser monitorada durante o processo de injeção. A avaliação da pressão de injeção (resistência) durante o BNP é de interesse crescente para clínicos e pesquisadores. Isso não é surpreendente, uma vez que a injeção em fascículos nervosos densamente compactados requer mais força para iniciar uma injeção (pressão de abertura) do que injeções perineural ou intraneural-interfascicular no tecido conjuntivo frouxo perineural ou perifascicular.Figuras 12, 14 e 15).
Na tentativa de padronizar o monitoramento e a documentação dos procedimentos de bloqueio nervoso, um grupo de especialistas norte-americanos sugeriu documentar a resistência à injeção como um dos elementos da ficha clínica padrão. No entanto, dois grupos independentes descobriram que a precisão do clínico em medir a pressão de injeção ou o tecido que está sendo injetado é limitada ao usar uma técnica subjetiva de sensação de seringa, questionando assim a confiabilidade das avaliações subjetivas. Enquanto isso, vários meios de monitoramento das pressões de injeção foram recomendados.
Tomados em conjunto, os dados até o momento sugerem que a alta pressão de injeção de abertura pode detectar uma injeção intrafascicular, mas não uma injeção interfascicular intraneural. No primeiro estudo em pacientes, Gadsden e colegas demonstraram que a pressão de injeção de abertura com a ponta da agulha a 1 mm de distância das raízes nervosas do plexo braquial interescalênico foi consistentemente menor que 15 psi (pressão média de pico 8.2 ± 2.4 psi). Em contraste, a pressão de abertura da injeção durante o contato agulha-nervo foi de 15 psi ou mais (pressão de pico média de 20.9 ± 3.7 psi) em 35 de 36 injeções. Neste estudo, abortar a injeção quando a pressão de injeção de abertura atingiu 15 psi impediu de forma confiável o início da injeção em 97% dos casos de contatos agulha-nervo. Além disso, a injeção de alta abertura pode se correlacionar bem com outros índices de contato agulha-nervo, como estimulação de baixa corrente e parestesia na injeção.
Em um estudo de acompanhamento, Gadsden et al usaram metodologia semelhante para determinar se a alta pressão de abertura também pode detectar o contato agulha-nervo em nervos periféricos, como o nervo femoral. Os pesquisadores relataram que a alta pressão de injeção de abertura detectou consistentemente (97%) o contato agulha-nervo e impediu uma injeção contra o nervo ou fascículos femorais. Além disso, sua pesquisa sugeriu que a alta pressão de injeção de abertura pode detectar a inserção da agulha em um plano de tecido errado. Neste relatório, a incapacidade de injetar anestésico local com pressão de injeção de abertura abaixo de 15 psi detectou 100% dos casos de colocação da agulha no aspecto errado da fáscia ilíaca.
Mais pesquisas são necessárias para determinar os benefícios clínicos do monitoramento de pressão de injeção de rotina e os valores reais de pressão de injeção de abertura “segura” para vários procedimentos de bloqueio de nervo. Independentemente disso, existem dados suficientes para sugerir que o monitoramento da pressão de injeção de abertura durante os bloqueios do nervo interescalênico e femoral adiciona informações críticas de segurança adicionais que podem influenciar a tomada de decisão clínica. A monitorização da pressão de injeção pode revelar-se mais útil por seu valor preditivo negativo para lesão nervosa funcional, pois nenhum caso de neuropatia clinicamente significativa foi relatado na literatura com baixas pressões de injeção. Com base nos dados disponíveis, evitar alta resistência e pressão de injeção de abertura superior a 15 psi parece ser uma estratégia prudente. No mínimo, isso ocorre porque durante as injeções de bloqueio nervoso, as injeções no tecido conjuntivo perineural solto nunca devem exigir mais de 15 psi; portanto, quando a pressão de abertura de 15 psi é atingida antes que a injeção realmente ocorra, o operador tem a oportunidade de reposicionar a agulha longe do nervo antes da injeção, possivelmente no espaço errado do tecido ou em partes vulneráveis do nervo (fascículos, contato agulha-nervo) .
Impedância Elétrica
O monitoramento de impedância elétrica mede a resistência ao fluxo de uma corrente alternada em um circuito elétrico e pode ser adicionado aos estimuladores nervosos existentes. A impedância elétrica é sensível a mudanças na composição do tecido, particularmente no conteúdo de água. Em um modelo de nervo ciático de porco, Tsui e colegas demonstraram que os nervos têm maior impedância elétrica do que o músculo circundante e o fluido intersticial devido ao seu baixo teor de água e alto teor de lipídios. Eles descobriram que a impedância elétrica aumentou abruptamente na entrada no compartimento intraneural em relação ao compartimento extraneural. O valor absoluto no qual ocorreu a colocação da agulha intraneural não pôde ser determinado devido à variação substancial nos dados.
Embora o monitoramento da impedância elétrica pareça promissor para detectar a colocação da ponta da agulha intraneural, isso implica necessariamente que a punção do nervo deve ocorrer antes que uma mudança na impedância seja detectada. Há também evidências razoavelmente fortes de que a medição da impedância elétrica pode diferenciar a colocação intravascular da perineural de uma agulha quando se injeta dextrose a 5% em água antes da realização do bloqueio. Com base nos dados atualmente disponíveis, o monitoramento de impedância pode diferenciar entre certos tecidos, como músculo e tecido adiposo/conjuntivo. No entanto, a variabilidade das medidas de impedância entre diferentes nervos ou mesmo os mesmos nervos em diferentes locais requer mais pesquisas antes que quaisquer recomendações sobre a potencial aplicabilidade clínica dessa modalidade possam ser feitas.
Ultrasound
Embora o ultrassom possa detectar a injeção intraneural, o uso generalizado da orientação por ultrassom não diminuiu a taxa de PNI. Em animais, o ultrassom é sensível o suficiente para detectar apenas 1 mL de injetável; entretanto, uma quantidade muito menor de injetado é suficiente para lesar os fascículos.
Independentemente disso, nenhum estudo em animais ou humanos até o momento demonstrou definitivamente uma associação entre a visualização ultrassonográfica em tempo real da injeção intraneural de anestésico local e a conseqüente lesão nervosa funcional (ou clinicamente importante). Uma razão pode ser que a resolução das atuais máquinas de ultrassom produzidas não é alta o suficiente para diferenciar a injeção intrafascicular potencialmente perigosa da injeção no compartimento extrafascicular potencialmente mais tolerante.
Além disso, a capacidade de interpretar essas imagens é altamente dependente do usuário e a capacidade de obter imagens de alta definição e qualidade varia entre os pacientes. O uso da orientação por ultrassom facilitou substancialmente o ensino e popularizou a utilização de BNPs, ao mesmo tempo em que diminuiu a incidência de toxicidade sistêmica dos anestésicos locais. No entanto, em estudos até o momento, o ultra-som não diminuiu a incidência de PNI. Mais informações sobre ultrassom e monitoramento são abordadas em Monitoramento, Documentação e Consentimento para Procedimentos Regionais de Anestesia.
Dicas NYSORA
Os principais mecanismos de lesão mediada por BNP incluem trauma mecânico, isquemia, toxicidade de anestésico local e inflamação. A principal fonte de complicações neurológicas mediadas por BNP é provavelmente lesão fascicular mecânica ou injeção de anestésico local em um fascículo, causando degeneração da mielina e axonal.
RESUMO
As complicações neurológicas associadas ao BNP são multifatoriais e associadas a uma variedade de processos perioperatórios e fatores do paciente, anestésicos e cirúrgicos. A anatomia dos nervos periféricos é variável em localização, estrutura e suscetibilidade a lesões. Os principais mecanismos de lesão mediada por BNP incluem trauma mecânico, isquemia, toxicidade de anestésico local e inflamação. A principal fonte de complicações neurológicas mediadas por BNP é provavelmente lesão fascicular mecânica ou injeção de anestésico local em um fascículo, causando degeneração da mielina e axonal. As incidências relatadas de complicações neurológicas após BNP variam significativamente, e a interpretação da literatura é difícil devido às variadas metodologias de estudo, incluindo diferenças nos resultados neurológicos capturados. Felizmente, a maioria dos déficits neurológicos pós-operatórios parecem se resolver com o tempo, e a incidência de complicações neurológicas graves a longo prazo atribuíveis ao BNP é relativamente incomum.
Evitar traumas deliberados nos nervos, incluindo injeção intraneural, é um princípio fundamental de segurança da anestesia regional. Neste momento, há evidências de que o monitoramento objetivo da colocação e injeção da agulha, como ultrassom, estimulação nervosa e pressão de injeção de abertura, podem ajudar a detectar o contato agulha-nervo e a colocação da agulha intraneural. Embora, como acontece com muitos outros monitores na prática clínica (por exemplo, oximetria de pulso), não haja evidências de que esses monitores possam reduzir a incidência de complicações neurológicas, há dados sugerindo que sua combinação deve conferir segurança adicional durante os BNPs. A seleção cuidadosa do paciente, o uso combinado de mais de uma técnica de localização de nervo ou monitor, evitando injeção com pressão de injeção de abertura e limitando o número de passagens e injeções da agulha, quando apropriado, diminuirá ainda mais o risco e tornará a prática de BNPs menos arte do que uma ciência.
REFERÊNCIAS
- Sunderland S: Lesões nervosas e seu reparo: uma avaliação crítica. Churchill Livingstone, 1991.
- Boezaart AP: Aquilo que chamamos de rosa por qualquer outro nome teria um cheiro tão doce – e seus espinhos doeriam tanto. Reg Anesth Pain Med 2009;34:3–7.
- Seddon HJ: Uma classificação de lesões nervosas. Br Med J 1942;2: 237–239.
- Sunderland S: Uma classificação de lesões de nervos periféricos que produzem perda de função. Cérebro 1951;74:491-516.
- Brull R, McCartney CJ, Chan VW, El-Beheiry H: Complicações neurológicas após anestesia regional: estimativas contemporâneas de risco. Anesth Analg 2007;104:965–974.
- Hogan QH: Fisiopatologia da lesão do nervo periférico durante a anestesia regional. Reg Anesth Pain Med 2008;33:435–441.
- Burnett MG, Zager EL: Fisiopatologia da lesão do nervo periférico: uma breve revisão. Neurocirurgia Focus 2004;16:E1.
- Steinfeldt T, Poeschl S, Nimphius W, et al: Avanço forçado da agulha durante o contato agulha-nervo em um modelo suíno: resultado histológico. Anesth Analg 2011;113:417–420.
- Kerns JM: A microestrutura dos nervos periféricos. Techn Reg Anesth Pain Manag 2008;12:127–133.
- Gentili F, Hudson AR, Kline D, Hunter D: Alterações precoces após lesão por injeção de nervos periféricos. Can J Surg 1980;23:177–182.
- Whitlock EL, Brenner MJ, Fox IK, Moradzadeh A, Hunter DA, Mackinnon SE: lesão por injeção de nervo periférico induzida por ropivacaína no modelo de roedor. Anesth Analg 2010;111:214–220.
- Mackinnon SE, Hudson AR, Gentili F, Kline DG, Hunter D: Lesão por injeção de nervo periférico com agentes esteróides. Plast Reconstr Surg 1982; 69:482-490.
- Gentili F, Hudson AR, Hunter D: Aspectos clínicos e experimentais de lesões por injeção de nervos periféricos. Can J Neurol Sci 1980;7:143-151.
- Sala-Blanch X, Ribalta T, Rivas E, et al: Lesão estrutural do nervo ciático humano após inserção de agulha intraneural. Reg Anesth Pain Med 2009;34:201–205.
- Gentili F, Hudson A, Kline DG, Hunter D: Lesão de injeção de nervo periférico: um estudo experimental. Neurocirurgia 1979;4:244-253.
- Hadzic A, Dilberovic F, Shah S, et al: A combinação de injeção intraneural e alta pressão de injeção leva a lesão fascicular e déficits neurológicos em cães. Reg Anesth Pain Med 2004;29:417–423.
- Selander D, Edshage S, Wolff T: Parestesias ou não parestesias? Lesões nervosas após bloqueios axilares. Acta Anesthesiol Scand 1979;23:27–33.
- Selander D, Sjostrand J: Disseminação longitudinal de anestésicos locais injetados intraneuralmente. Um estudo experimental da distribuição neural inicial após injeções intraneurais. Acta Anesthesiol Scand 1978;22: 622-634.
- Myers RR, Heckman HM: Efeitos da anestesia local no fluxo sanguíneo nervoso: estudos usando lidocaína com e sem epinefrina. Anestesiologia 1989;71:757-762.
- Perdiz BL: Os efeitos de anestésicos locais e epinefrina no fluxo sanguíneo do nervo ciático de rato. Anestesiologia 1991;75:243–250.
- Rodriguez J, Taboada M, Garcia F, Bermudez M, Amor M, Alvarez J: Hematoma intraneural após bloqueio femoral guiado por estimulação nervosa em paciente com deficiência de fator XI: relato de caso. J Clin Anesth 2011;23:
234-237. - Ben-David B, Stahl S: Bloqueio axilar complicado por hematoma e lesão do nervo radial. Reg Anesth Pain Med 1999;24:264–266.
- Mackinnon SE, Hudson AR, Llamas F, Dellon AL, Kline DG, Hunter DA: Lesão do nervo periférico por injeção de quimopapaína. J Neurosurg 1984;61:1-8.
- Topuz K, Kutlay M, Simsek H, Atabey C, Demircan M, Senol Guney M: Protocolo de tratamento cirúrgico precoce para lesão do nervo ciático devido a injeção - um estudo retrospectivo. Br J Neurosurg 2011;25:509–515.
- Amaniti E, Drampa F, Kouzi-Koliakos K, et al: Miotoxicidade da ropivacaína após injeção intramuscular única em ratos. Eur J Anesthesiol 2006;23: 130–135.
- Beyzadeoglu T, Torun Kose G, Ekinci ID, Bekler H, Yilmaz C: Citotoxicidade de anestésicos locais para cartilagem articular de ratos: um estudo experimental. Acta Orthop Traumatol Turc 2012;46:201–207.
- Cereda CM, Tofoli GR, Maturana LG, et al: Avaliação da neurotoxicidade local e miotoxicidade de complexos de ciclodextrina de bupivacaína e ropivacaína. Anesth Analg 2012;115:1234–1241.
- Dragoo JL, Braun HJ, Kim HJ, Phan HD, Golish SR: A condrotoxicidade in vitro de anestésicos locais de dose única. Am J Sports Med 2012;40:794–799.
- Mishra P, Stringer MD: Lesão do nervo ciático por injeção intramuscular: um problema persistente e global. Int J Clin Pract 2010;64:1573–1579.
- Nouette-Gaulain K, Dadure C, Morau D, et al: Toxicidade muscular induzida pela bupivacaína dependente da idade durante o bloqueio nervoso periférico contínuo em ratos. Anestesiologia 2009;111:1120–1127.
- Padera R, Bellas E, Tse JY, Hao D, Kohane DS: Miotoxicidade local de liberação sustentada de bupivacaína de micropartículas. Anestesiologia 2008;108:921–928.
- Small SP: Prevenindo lesão do nervo ciático por injeções intramusculares: revisão de literatura. J Adv Nurs 2004;47:287–296.
- Zink W, Sinner B, Zausig Y, Graf BM: [Miotoxicidade dos anestésicos locais: mito experimental ou verdade clínica?]. Anestesista 2007;56:118–127.
- Perez-Castro R, Patel S, Garavito-Aguilar ZV et al: Citotoxicidade de anestésicos locais em células neuronais humanas. Anesth Analg 2009;108:997–1007.
- Radwan IA, Saito S, Goto F: A neurotoxicidade dos anestésicos locais em neurônios em crescimento: um estudo comparativo de lidocaína, bupivacaína, mepivacaína e ropivacaína. Anesth Analg 2002;94:319–324, índice.
- Farber SJ, Saheb-Al-Zamani M, Zieske L, et al: Lesão de nervo periférico após injeção de anestésico local. Anesth Analg 2013;117:731–739.
- Lirk P, Haller I, Myers RR, et al: Mitigação dos efeitos neurotóxicos diretos da lidocaína e amitriptilina pela inibição da proteína quinase ativada por mitógeno p38 in vitro e in vivo. Anestesiologia 2006;104:1266–1273.
- Yang S, Abrahams MS, Hurn PD, Grafe MR, Kirsch JR: A toxicidade das células de Schwann do anestésico local é dependente do tempo e da concentração. Reg Anesth Pain Med 2011;36:444–451.
- Kalichman MW: Mecanismos fisiológicos pelos quais os anestésicos locais podem causar lesões nos nervos e na medula espinhal. Reg Anesth 1993;18:448–452.
- Gentili F, Hudson AR, Hunter D, Kline DG: Lesão por injeção de nervo com agentes anestésicos locais: um estudo microscópico de luz e eletrônico, microscópico fluorescente e peroxidase de rábano. Neurocirurgia 1980;6:263-272.
- Farber SJ, Saheb-Al-Zamani M, Zieske L, et al: Lesão de nervo periférico após injeção de anestésico local. Anesth Analg 2013;117:731–739.
- Ahn KS, Kopp SL, Watson JC, Scott KP, Trousdale RT, Hebl JR: Neuropatia inflamatória pós-cirúrgica. Reg Anesth Pain Med 2011;36: 403–405.
- Staff NP, Engelstad J, Klein CJ, et al: Neuropatia inflamatória pós-cirúrgica. Cérebro 2010;133:2866–2880.
- Kaufman MR, Elkwood AI, Rose MI, et al: Tratamento cirúrgico da paralisia permanente do diafragma após bloqueio do nervo interescalênico para cirurgia do ombro. Anestesiologia 2013;119:484–487.
- Pintaric TS, Cvetko E, Strbenc M, Mis K, Podpecan O, Mars T, Hadzic A. Alterações inflamatórias intraneurais e perineurais em leitões após injeção de gel de ultrassom, endotoxina, NaCl 0.9% ou inserção de agulha sem injeção. Anesth Analg 2014;118(4):869–873.
- Pintaric TS, Hadzic A, Strbenc M, Podpecan O, Podbregar M, Cvetko E. Resposta inflamatória após injeção de gel aquoso no espaço subaracnóideo em leitões. Reg Anesth Pain Med 2013;38(2):100–105.
- Welch MB, Brummett CM, Welch TD, et al: Lesões perioperatórias de nervos periféricos: um estudo retrospectivo de 380,680 casos durante um período de 10 anos em uma única instituição. Anestesiologia 2009;111:490–497.
- Jacob AK, Mantilla CB, Sviggum HP, Schroeder DR, Pagnano MW,
Hebl JR: Lesão nervosa perioperatória após artroplastia total do joelho: risco de anestesia regional durante um estudo de coorte de 20 anos. Anestesiologia 2011;114: 311–317. - Jacob AK, Mantilla CB, Sviggum HP, Schroeder DR, Pagnano MW,
Hebl JR: Lesão nervosa perioperatória após artroplastia total do quadril: risco de anestesia regional durante um estudo de coorte de 20 anos. Anestesiologia 2011;115: 1172–1178. - Sviggum HP, Jacob AK, Mantilla CB, Schroeder DR, Sperling JW,
Hebl JR: Lesão nervosa perioperatória após artroplastia total do ombro: avaliação do risco após anestesia regional. Reg Anesth Pain Med 2012;37:490–494. - Lenters TR, Davies J, Matsen FA 3rd: Os tipos e gravidade das complicações associadas à anestesia do bloqueio do plexo braquial interescalênico: evidências locais e nacionais. J Cirurgia de Cotovelo de Ombro 2007;
16: 379-387. - Widmer B, Lustig S, Scholes CJ, et al: Incidência e gravidade das complicações devido a bloqueios do nervo femoral realizados para cirurgia do joelho. Joelho 2013;20:181–185.
- Hogan QH: Função do nervo frênico após bloqueio interescalênico revisitado: agora, a visão de longo prazo. Anestesiologia 2013;119:250–252.
- Gadsden J, Gratenstein K, Hadzic A: Injeção intraneural e lesão do nervo periférico. Int Anesthesiol Clin 2010;48:107–115.
- Liu SS, YaDeau JT, Shaw PM, Wilfred S, Shetty T, Gordon M: Incidência de injeção intraneural não intencional e complicações neurológicas pós-operatórias com bloqueios dos nervos interescalênico e supraclavicular guiados por ultrassom. Anestesia 2011;66:168–174.
- Bigeleisen PE: A punção do nervo e a aparente injeção intraneural durante o bloqueio axilar guiado por ultrassom não resultam invariavelmente em lesão neurológica. Anestesiologia 2006;105:779–783.
- Bigeleisen PE, Moayeri N, Groen GJ: Limiares de estimulação extraneural versus intraneural durante bloqueio supraclavicular guiado por ultrassom. Anestesiologia 2009;110:1235–1243.
- Sala Blanch X, Lopez AM, Carazo J, et al: Injeção intraneural durante o bloqueio do nervo ciático guiado por estimulador de nervo na fossa poplítea. Br J Anaesth 2009;102:855–861.
- Cohen JM, Gray AT: Déficits funcionais após injeção intraneural durante o bloqueio interescalênico. Reg Anesth Pain Med 2010;35:397–399.
- Orebaugh SL, McFadden K, Skorupan H, Bigeleisen PE: Injeção subepineural na colocação da ponta da agulha interescalênica guiada por ultrassom. Reg Anesth Pain Med 2010;35:450–454.
- Altermatt FR, Cummings TJ, Auten KM, Baldwin MF, Belknap SW, Reynolds JD: Aparência ultrassonográfica de injeções intraneurais no modelo suíno. Reg Anesth Pain Med 2010;35:203–206.
- Moayeri N, Bigeleisen PE, Groen GJ: Arquitetura quantitativa do plexo braquial e compartimentos adjacentes, e seu possível significado para bloqueios de plexo. Anestesiologia 2008;108:299–304.
- Moayeri N, Groen GJ: As diferenças na arquitetura quantitativa do nervo ciático podem explicar as diferenças na vulnerabilidade potencial à lesão do nervo, tempo de início e volume anestésico mínimo efetivo. Anestesiologia 2009;111:1128–1134.
- Borgeat A, Ekatodramis G, Kalberer F, Benz C: complicações agudas e não agudas associadas ao bloqueio interescalênico e cirurgia do ombro: um estudo prospectivo. Anestesiologia 2001;95:875–880.
- Candido KD, Sukhani R, Doty R Jr, et al: Sequelas neurológicas após bloqueio interescalênico do plexo braquial para cirurgia de ombro/braço: associação de fatores do paciente, anestésicos e cirúrgicos à incidência e curso clínico. Anesth Analg 2005;100:1489–1495, índice.
- Bilbao Ares A, Sabate A, Porteiro L, Ibanez B, Koo M, Pi A: [Complicações neurológicas associadas ao bloqueio interescalênico e supraclavicular guiado por ultrassom em cirurgias eletivas de ombro e braço. Estudo prospectivo observacional em um hospital universitário.]. Rev Esp Anestesiol Reanim 2013;60:384–391.
- Auroy Y, Benhamou D, Bargues L, et al: Principais complicações da anestesia regional na França: The SOS Regional Anesthesia Hotline Service. Anestesiologia 2002;97:1274–1280.
- Barrington MJ, Watts SA, Gledhill SR, et al: Resultados preliminares da Australasian Regional Anesthesia Collaboration: uma auditoria prospectiva de mais de 7000 bloqueios de nervos e plexos periféricos para complicações neurológicas e outras. Reg Anesth Pain Med 2009;34:534–541.
- Fanelli G, Casati A, Garancini P, Torri G: Estimulador de nervo e técnica de injeção múltipla para bloqueio de membros superiores e inferiores: taxa de falha, aceitação do paciente e complicações neurológicas. Grupo de Estudos em Anestesia Regional. Anesth Analg 1999;88:847–852.
- Selander D, Dhuner KG, Lundborg G: Lesão de nervo periférico devido a agulhas de injeção usadas para anestesia regional. Um estudo experimental dos efeitos agudos do trauma por agulha. Acta Anesthesiol Scand 1977;21:182–188.
- Steinfeldt T, Nimphius W, Werner T, et al: Lesão do nervo por perfuração do nervo da agulha em anestesia regional: o tamanho importa? Br J Anaesth 2010;104:245–253.
- Steinfeldt T, Werner T, Nimphius W, et al: Análise histológica após punção de nervo periférico com ponta de lápis ou ponta de agulha Tuohy. Anesth Analg 2011;112:465–470.
- Reina MA, de Leon-Casasola OA, Lopez A, De Andres J, Martin S, Mora M: Um estudo in vitro de lesões durais produzidas por agulhas Quincke e Whitacre calibre 25 avaliadas por microscopia eletrônica de varredura. Reg Anesth Pain Med 2000;25:393–402.
- Selander D: Lesão de nervo periférico causada por agulhas de injeção. Br J Anaesth 1993;71:323–325.
- Selander DE: Palestra Labat 2006. Anestesia regional: aspectos, pensamentos e alguma ética honesta; sobre bisel de agulha e lesões nervosas e dor nas costas após raquianestesia. Reg Anesth Pain Med 2007;32:341–350.
- Winfree CJ, Kline DG: Lesões nervosas de posicionamento intraoperatório. Surg Neurol 2005;63:5–18; discussão 18.
- Kroll DA, Caplan RA, Posner K, Ward RJ, Cheney FW: Lesão no nervo
associada à anestesia. Anestesiologia 1990;73:202–207. - Jankowski CJ, Keegan MT, Bolton CF, Harrison BA: Neuropatia após bloqueio do plexo braquial axilar: é o torniquete? Anestesiologia 2003;99:1230–1232.
- Kornbluth ID, Freedman MK, Sher L, Frederick RW: Paralisia do nervo femoral e safeno após uso de torniquete: relato de caso. Arch Phys Med Rehabil 2003;84:909–911.
- Maguina P, Jean-Pierre F, Grevious MA, Malk AS: Paralisia do ramo interósseo posterior após aplicação de torniquete pneumático para cirurgia da mão. Plast Reconstr Surg 2008;122:97e–99e.
- Barner KC, Landau ME, Campbell WW: Uma revisão de lesão nervosa perioperatória para as extremidades inferiores: parte I. J Clin Neuromuscul Dis 2002;4: 95-99.
- Nitz AJ, Dobner JJ, Matulionis DH: Avaliação estrutural do nervo ciático de rato após compressão de torniquete e manipulação vascular. Anat Rec 1989;225:67–76.
- Dobner JJ, Nitz AJ: Paralisia do torniquete pós-meniscectomia e sequelas funcionais. Am J Sports Med 1982;10:211–214.
- Weingarden SI, Louis DL, Waylonis GW: Alterações eletromiográficas em pacientes pós-meniscectomia. Papel do torniquete pneumático. JAMA 1979;241:1248-1250.
- Fabre T, Piton C, Andre D, Lasseur E, Durandeau A: Encarceramento do nervo fibular. J Bone Joint Surg Am 1998;80:47–53.
- Prielipp RC, Warner MA: Lesão nervosa perioperatória: um grito silencioso? Anestesiologia 2009;111:464–466.
- Warner MA, Warner ME, Martin JT: Neuropatia ulnar. Incidência, desfecho e fatores de risco em pacientes sedados ou anestesiados. Anestesiologia 1994;81:1332–1340.
- Morales-Vidal S, Morgan C, McCoyd M, Hornik A: neuropatia periférica diabética e o manejo da dor neuropática periférica diabética. Postgrad Med 2012;124:145–153.
- Kalichman MW, Calcutt NA: Bloqueio de condução induzido por anestésico local e lesão de fibras nervosas em ratos diabéticos com estreptozotocina. Anestesiologia 1992;77:941-947.
- Hebl JR, Kopp SL, Schroeder DR, Horlocker TT: Complicações neurológicas após anestesia neuraxial ou analgesia em pacientes com neuropatia sensório-motora periférica preexistente ou polineuropatia diabética. Anesth Analg 2006;103:1294–1299.
- Neal JM, Bernards CM, Hadzic A, et al: ASRA Practice Advisory on Neurologic Complications in Regional Anesthesia and Pain Medicine. Reg Anesth Pain Med 2008;33:404–415.
- Mellion M, Gilchrist JM, de la Monte S: Neuropatia periférica relacionada ao álcool: nutricional, tóxica ou ambas? Nervo Muscular 2011;43: 309–316.
- Hebl JR, Horlocker TT, Pritchard DJ: Plexopatia braquial difusa após bloqueio interescalênico em um paciente recebendo quimioterapia com cisplatina: a síndrome farmacológica do duplo esmagamento. Anesth Analg 2001;92:249–251.
- Hebl JR: Anestesia regional guiada por ultrassom e prevenção de lesão neurológica: fato ou ficção? Anestesiologia 2008;108:186–188.
- Uskova AA, Plakseychuk A, Chelly JE: O papel da cirurgia em lesões nervosas pós-operatórias após artroplastia total do quadril. J Clin Anesth 2010;22: 285–293.
- Moen V, Dahlgren N, Irestedt L: Complicações neurológicas graves após bloqueios neuroaxiais centrais na Suécia 1990-1999. Anestesiologia 2004;101:950–959.
- Kubina P, Gupta A, Oscarsson A, Axelsson K, Bengtsson M: Dois casos de síndrome da cauda equina após anestesia raqui-peridural. Reg Anesth 1997;22:447–450.
- Hebl JR, Horlocker TT, Kopp SL, Schroeder DR: Bloqueio neuroaxial em pacientes com estenose espinhal preexistente, doença do disco lombar ou cirurgia prévia da coluna: eficácia e complicações neurológicas. Anesth Analg
2010; 111: 1511-1519. - Barner KC, Landau ME, Campbell WW: Uma revisão de lesão nervosa perioperatória nas extremidades superiores. J Clin Neuromuscul Dis 2003;4: 117–123.
- Sunderland S: A suscetibilidade relativa à lesão das divisões poplíteas medial e lateral do nervo ciático. Br J Surg 1953;41:300–302.
- Sunderland S: O nervo ciático e suas divisões tibial e fibular comum. Características anatômicas e fisiológicas. Nervos e lesões nos nervos, Churchill Livingstone, 1978, pp 924-966.
- Bernards CM, Hadzic A, Suresh S, Neal JM: Anestesia regional em pacientes anestesiados ou fortemente sedados. Reg Anesth Pain Med 2008;33: 449–460.
- Nitz AJ, Dobner JJ, Matulionis DH: Aplicação de torniquete pneumático e integridade do nervo: função motora e eletrofisiologia. Exp Neurol 1986;94:264-279.
- Horlocker TT, Cabanela ME, Wedel DJ: A analgesia epidural pós-operatória aumenta o risco de paralisia do nervo fibular após artroplastia total do joelho? Anesth Analg 1994;79:495–500.
- Sala-Blanch X, Lopez AM, Carazo J, et al: Injeção intraneural durante o bloqueio do nervo ciático guiado por estimulador de nervo na fossa poplítea. Br J Anaesth 2009;102:855–861.
- Jeng CL, Rosenblatt MA: Injeções intraneurais e anestesia regional: o conhecido e o desconhecido. Minerva Anestesiol 2011;77:54–58.
- Moore DC: “Sem parestesias, sem anestesia”, o estimulador de nervos ou nenhum dos dois? Reg Anesth 1997;22:388–390.
- Auroy Y, Narchi P, Messias A, Litt L, Rouvier B, Samii K: Complicações graves relacionadas à anestesia regional: resultados de uma pesquisa prospectiva na França. Anestesiologia 1997;87:479–486.
- Winchell SW, Wolfe R: A incidência de neuropatia após bloqueios nervosos dos membros superiores. Reg Anesth Pain Med 1985;10:12–15.
- Urban MK, Urquhart B: Avaliação da anestesia do plexo braquial para cirurgia do membro superior. Reg Anesth 1994;19:175–182.
- Liguori GA, Zayas VM, YaDeau JT, et al: Técnicas de localização do nervo para bloqueio do plexo braquial interescalênico: uma comparação prospectiva e randomizada de parestesia mecânica versus estimulação elétrica. Anesth Analg 2006;103:761–767.
- Perlas A, Niazi A, McCartney C, Chan V, Xu D, Abbas S: A sensibilidade da resposta motora à estimulação nervosa e parestesia para localização do nervo avaliada por ultra-som. Reg Anesth Pain Med
2006; 31: 445-450. - Klein SM, Melton MS, Grill WM, Nielsen KC: Estimulação nervosa periférica em anestesia regional. Reg Anesth Pain Med 2012;37: 383–392.
- Voelckel WG, Klima G, Krismer AC, et al: Sinais de inflamação após bloqueio do nervo ciático em porcos. Anesth Analg 2005;101:1844–1846.
- Chan VW, Brull R, McCartney CJ, Xu D, Abbas S, Shannon P: Um estudo ultrassonográfico e histológico de injeção intraneural e estimulação elétrica em porcos. Anesth Analg 2007;104:1281–1284, índice.
- Tsai TP, Vuckovic I, Dilberovic F, et al: A intensidade da corrente estimulante pode não ser um indicador confiável da colocação da agulha intraneural. Reg Anesth Pain Med 2008;33:207–210.
- Robards C, Hadzic A, Somasundaram L, et al: Injeção intraneural com estimulação de baixa corrente durante o bloqueio do nervo ciático poplíteo. Anesth Analg 2009;109:673–677.
- Reiss W, Kurapati S, Shariat A, Hadzic A: Lesão do nervo complicando bloqueio do plexo braquial supraclavicular guiado por ultrassom/eletroestimulação. Reg Anesth Pain Med 2010;35:400–401.
- Urmey WF, Stanton J: Incapacidade de provocar consistentemente uma resposta motora após parestesia sensorial durante a administração do bloqueio interescalênico. Anestesiologia 2002;96:552–554.
- Watts SA: Complicações neurológicas de longo prazo associadas à cirurgia e bloqueio de nervos periféricos: resultados após 1065 bloqueios consecutivos. Anaesth Intensive Care 2007;35:24–31.
- Orebaugh SL, Williams BA, Vallejo M, Kentor ML: Resultados adversos associados a bloqueios de nervos periféricos baseados em estimulador com versus sem visualização de ultrassom. Reg Anesth Pain Med 2009;34: 251–255.
- Selander D, Brattsand R, Lundborg G, Nordborg C, Olsson Y: Anestésicos locais: importância do modo de aplicação, concentração e adrenalina para o aparecimento de lesões nervosas. Um estudo experimental de degeneração axonal e dano de barreira após injeção intrafascicular ou aplicação tópica de bupivacaína (Marcain). Acta Anesthesiol Scand 1979;23:127–136.
- Kapur E, Vuckovic I, Dilberovic F, et al: Resultados neurológicos e histológicos após injeções intraneurais de lidocaína em nervos ciáticos caninos. Acta Anesthesiol Scand 2007;51:101–107.
- Lupu CM, Kiehl TR, Chan VW, El-Beheiry H, Madden M, Brull R: A expansão do nervo vista no ultrassom prediz lesão nervosa histológica, mas não funcional, após injeção intraneural em porcos. Reg Anesth Pain Med 2010;35:132–139.
- Orebaugh SL, Mukalel JJ, Krediet AC, et al: Injeção da raiz do plexo braquial em modelo de cadáver humano: distribuição do injetado e efeitos no neuroeixo. Reg Anesth Pain Med 2012;37:525–529.
- Andrzej Krol, Matthew Szarko, Arber Vala, José De Andres: Monitoramento da pressão de injeções intraneurais e perineurais nos nervos mediano, radial e ulnar; Lições de um estudo cadavérico. Anesth Pain Med. 2015 junho;5(3):e22723. DOI: 10.5812/aapm.22723.
- Sala-Blanch X, de Riva N, Carrera A, Lopez AM, Prats A, Hadzic A: O bloqueio do ciático poplíteo guiado por ultrassom com uma única injeção na divisão do ciático resulta em um início de bloqueio mais rápido do que a técnica clássica do estimulador de nervo. Anesth Analg 2012;114:1121–1127.
- Sala-Blanch X, Lopez AM, Pomes J, Valls-Sole J, Garcia AI, Hadzic A: Nenhuma evidência clínica ou eletrofisiológica de lesão nervosa após injeção intraneural durante bloqueio poplíteo ciático. Anestesiologia 2011;115:589–595.
- Gadsden JC, Lindenmuth DM, Hadzic A, Xu D, Somasundarum L, Flisinski KA: O bloqueio do plexo lombar usando injeção de alta pressão leva à disseminação contralateral e epidural. Anestesiologia 2008;109:683–688.
- Tsui BC, Li LX, Pillay JJ: Técnica de injeção de ar comprimido para padronizar as pressões de injeção de bloco. Can J Anaesth 2006;53:1098–1102.
- Siegmueller C, Ramessur S: Uma maneira simples e de baixo custo de medir a pressão de injeção durante o bloqueio do nervo periférico. Anestesia 2011;66:956.
- Gerancher JC, Viscusi ER, Liguori GA, et al: Desenvolvimento de um formulário padronizado de nota de procedimento de bloqueio de nervo periférico. Reg Anesth Pain Med 2005;30:67–71.
- Claudio R, Hadzic A, Shih H, et al: Pressões de injeção por anestesiologistas durante bloqueio de nervo periférico simulado. Reg Anesth Pain Med 2004;29: 201–205.
- Theron PS, Mackay Z, Gonzalez JG, Donaldson N, Blanco R: Um modelo animal de “sensação de seringa” durante o bloqueio do nervo periférico. Reg Anesth Pain Med 2009;34:330–332.
- Ip VH, Tsui BC: Conceitos práticos no monitoramento das pressões de injeção durante bloqueios de nervos periféricos. Int Anesthesiol Clin 2011;49: 67–80.
- Gadsden JC, Choi JJ, Lin E, Robinson A: A pressão de injeção de abertura detecta consistentemente o contato agulha-nervo durante o bloqueio do plexo braquial interescalênico guiado por ultrassom. Anestesiologia 2014;120: 1246-1253.
- Tsui BC, Pillay JJ, Chu KT, Dillane D: Impedância elétrica para distinguir a colocação de agulhas intraneurais de extraneurais em nervos suínos durante exposição direta e orientação por ultrassom. Anestesiologia 2008;109:479–483.
- Byrne K, Tsui BC: Conceitos práticos em estimulação nervosa: impedância e outros avanços recentes. Int Anesthesiol Clin 2011;49:81–90.
- Sauter AR, Dodgson MS, Kalvoy H, Grimnes S, Stubhaug A, Klaastad Ø: O limiar de corrente para estimulação do nervo depende da impedância elétrica do tecido: um estudo da estimulação elétrica do nervo mediano guiada por ultrassom. Anesth Analg 2009;108:1338–1343.
- Sites BD, Spence BC, Gallagher JD, Wiley CW, Bertrand ML, Blike GT: Caracterizando o comportamento do novato associado ao aprendizado da anestesia regional periférica guiada por ultrassom. Reg Anesth Pain Med 2007;32: 107–115.
- Sites BD, Taenzer AH, Herrick MD, et al: Incidência de toxicidade sistêmica do anestésico local e sintomas neurológicos pós-operatórios associados a 12,668 bloqueios nervosos guiados por ultrassom: uma análise de um registro clínico prospectivo. Reg Anesth Pain Med 2012;37:478–482.