ジョンバターワースIV
はじめに
専門会議への出席や研究活動の大幅な増加から判断すると、科学出版物の数が増えていることからも明らかなように、局所および領域の麻酔と鎮痛はルネサンスを迎えているようです。分子機構が依然として推測の対象である全身麻酔とは対照的に、局所麻酔薬(LA)が結合して神経ブロックを生成する部位はクローン化され、変異されている。この章では、次のメカニズムに焦点を当てます。 麻酔 & 毒性、 特にこれらのメカニズムの知識は、臨床医がより安全でより効果的な局所麻酔を実施するのに役立ちます。
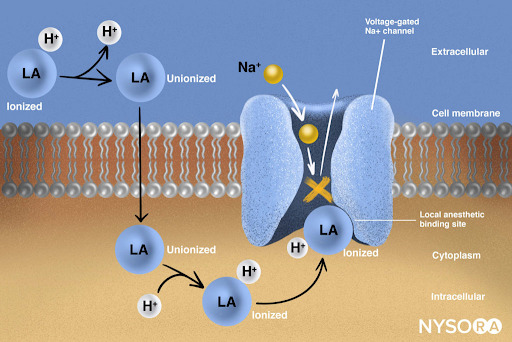
局所麻酔大要から:局所麻酔薬の作用機序。 局所麻酔薬は、電位依存性Na +チャネルのαサブユニットに結合することで機能し、神経インパルスの生成と伝導を防ぎます。 その後、Na +イオンは細胞に流れ込むことができず、それによって神経の長さを下る脱分極の進行波の伝達を停止します。 局所麻酔薬分子の一部はイオン化された形になっています。 局所麻酔薬分子は、ほんの一瞬でイオン化から非イオン化に変化します。
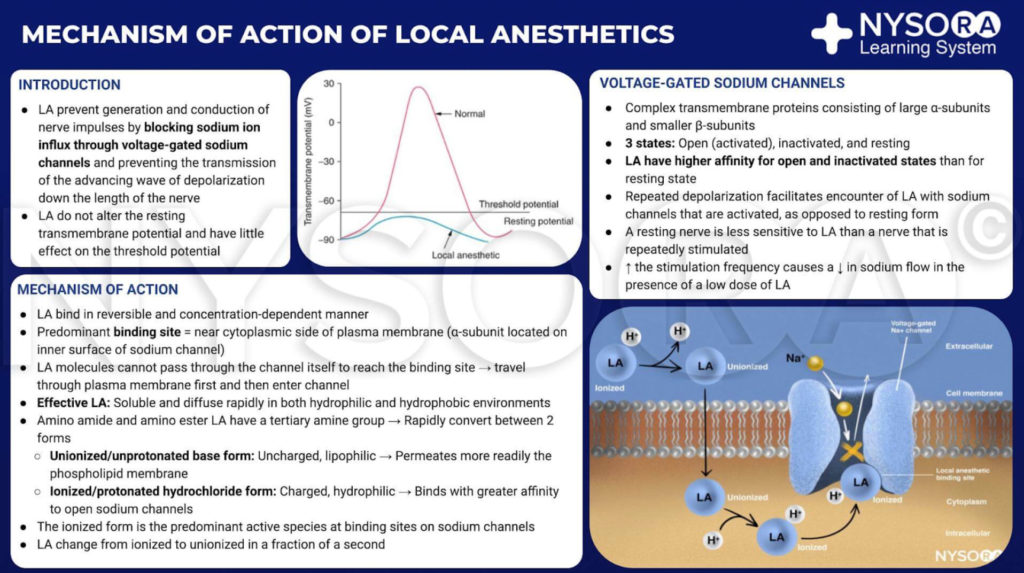
局所麻酔の大要から:局所麻酔のインフォグラフィックの作用機序。
先史時代と歴史
インカ人はコカを太陽神の息子からの贈り物と見なし、その使用を社会の「上部地殻」に限定しました。 彼らは、化合物が「発見」されるためにヨーロッパに持ち込まれるずっと前に、コカインの薬効を認識して使用していました。 インカ人は時々、持続性の頭痛を穿頭で治療し、コカはこの手順を容易にするために時々使用されました。 局所麻酔は、オペレーターにコカの葉を噛み、ツミナイフを使用して骨に穴を開けながら、浸軟した果肉を皮膚と傷口に塗布することによって達成されました。 XNUMX世紀までに、インカ社会を混乱させた征服者たちは、労働者にコカインペーストを支払い始めました。
労働者は通常、コカインの葉を丸めてボール(コカダと呼ばれる)にし、グアノまたはコーンスターチで結合しました。 これらのコカインは、グアノのアルカリ性と、灰または石灰でコカインを噛む習慣の結果として、遊離塩基コカインを放出しました(このようなアルカリ性化合物はpHを上昇させ、正に帯電した塩酸塩よりも遊離塩基コカインの形態を優先します) 。 この慣行は、おそらく「遊離塩基」コカインの誕生を示しており、西洋社会で頻繁に乱用されている「ロック」または「クラック」コカインの歴史的な前例です。 コカインは、Scherzerという名前の探検家/医師によってウィーンに戻されました。 ウィーンでは、化学者のアルベルトニーマンが、1860年に純粋な塩酸コカインを分離して結晶化しました。メルク社は、調査目的でこの薬剤のバッチを医師に配布しました。 ジークムント・フロイトは、これらのコカイン実験者の中で最も著名でした。 フロイトは、コカインに捧げられたモノグラフ、ユーバーコカで彼の実験的研究をレビューしました。 フロイトとカール・コラー(眼科研修生)はコカインを経口摂取し、その薬が彼らの舌を無感覚にすることに気づきました。 KollerとJosephGartnerは、結膜の局所麻酔を行うためにコカインを使用した一連の実験を開始しました。
局所および局所麻酔の誕生は、コラーとガートナーがカエル、ウサギ、犬、およびヒトの眼の局所コカイン麻酔の作成に成功したことを報告した1884年にさかのぼります。 局所麻酔の使用は急速に世界中に広がりました。 ニューヨークのルーズベルト病院のアメリカ人外科医ウィリアム・ハルステッドは、コカインを使用して生産したと報告しました 下顎神経ブロック 1884年にそしてXNUMX年以内に腕神経叢ブロックを生産する。 これらのブロックは、神経を外科的に露出させ、次に直視下でそれらを注入することによって達成されました。 レナード・コーニングは犬の背骨の近くにコカインを注射し、おそらく最初のものを作り出しました 硬膜外 コカインによるスピナ麻酔は、1885年にアウグストビールによって最初に達成されました。 コカイン 脊椎麻酔 1898年に癌性疼痛の治療に使用されました。尾側硬膜外麻酔は1902年にSicardとCathelinによって導入されました。 ビールの説明 静脈局所麻酔 1909年。1911年、ヒルシェルは最初の1921回の経皮的腕神経叢麻酔を報告しました。 フィデルページスは、1886年に腹部手術に硬膜外麻酔を使用したと報告しました。コカインは、XNUMX年にペンバートンによって考案されたコカコーラの元の処方を含む他の多くの製品にすぐに組み込まれました。図1)。 この慣行は、1900年代初頭に食品医薬品局(FDA)の前身によってコカインが規制されるようになったときに終了しました。

図1 規制物質になる前の時期にコカインを組み込んだ製品の例。 コカインで強化されたワインは、「トニック」として特に人気がありました。 (バッファロー大学中毒研究ユニットの許可を得て使用。)
医薬品化学
コカインと他のすべてのLAは、分子の両端に芳香環とアミンを含み、炭化水素鎖で分離されており、エステル結合またはアミド結合のいずれか(図2)。 典型的なエステルであるコカインは、天然に存在する唯一のLAです。 最初の合成エステルLAであるプロカインは、1904年にアインホーンによって導入されました。 1948年のアミドLAリドカインの導入は変革をもたらしました。 リドカインはすぐにあらゆる形態の局所麻酔に使用されるようになりました。 その後、リドカイン構造に基づく他のアミドLA(プリロカイン、エチドカイン)が出現しました。 2'、6'-ピペコロキシリジドに基づく関連シリーズのアミドLAが導入されました(メピバカイン、ブピバカイン、ロピバカイン、およびレボブピバカイン)。 ロピバカインとレボブピバカインは、市販されている唯一の単一鏡像異性体(単一光学異性体)LAです。 どちらもS(–)-エナンチオマーであり、ラセミ混合物およびR(+)-異性体に関連する心臓毒性の増加を回避します(これについては次のセクションで説明します)。 他のすべてのLAは、ラセミ体として存在するか、不斉炭素を持っていません。
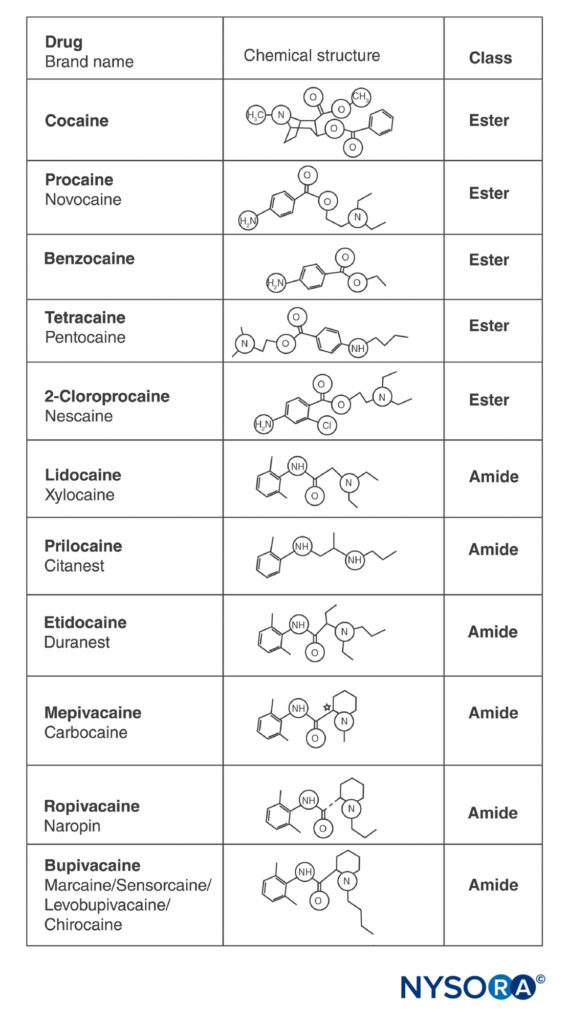
図2 一般的に使用される局所麻酔薬の構造。
NYSORAのヒント
- すべてのLAは、分子の両端に芳香環とアミンを含み、炭化水素鎖で分離されており、エステル結合またはアミド結合のいずれかが含まれています。
電位依存性ナトリウムチャネルの生物物理学および局所麻酔薬
末梢神経に対するLA作用のメカニズムの研究は、NaチャネルがLA結合部位を含むため、LAと電位依存性Naチャネルとの間の相互作用の研究です。 Naチャネルは、活動電位を開始および伝播する内在性膜タンパク質です。 軸索、樹状突起、および筋肉組織; 特殊な心臓および脳細胞の膜電位振動を開始および維持します。 シナプス入力を整形してフィルタリングします。 Naチャネルは、四量体として存在する他の同様の電位依存性イオンチャネルと構造的特徴を共有し、それぞれが6つの膜貫通ヘリカルセグメント(例えば、電位依存性CaおよびKチャネル)を有する。 Naチャネルには、種と起源の組織に応じて、XNUMXつの大きなαサブユニットとXNUMXつまたはXNUMXつの小さなβサブユニットが含まれています。 イオン伝導とLA結合の部位であるαサブユニットにはXNUMXつの相同ドメインがあり、それぞれにXNUMXつのαヘリックス膜貫通セグメントがあります(図3)。 αサブユニットの外面は高度にグリコシル化されており、原形質膜内でチャネルを適切に配向するのに役立ちます(図4)。 無脊椎動物はXNUMXつまたはXNUMXつのNaチャネルαサブユニット遺伝子しか持たず、これらのチャネルの通常の生理学的役割は不明です(チャネルが存在しない場合、動物は生き残ります)。
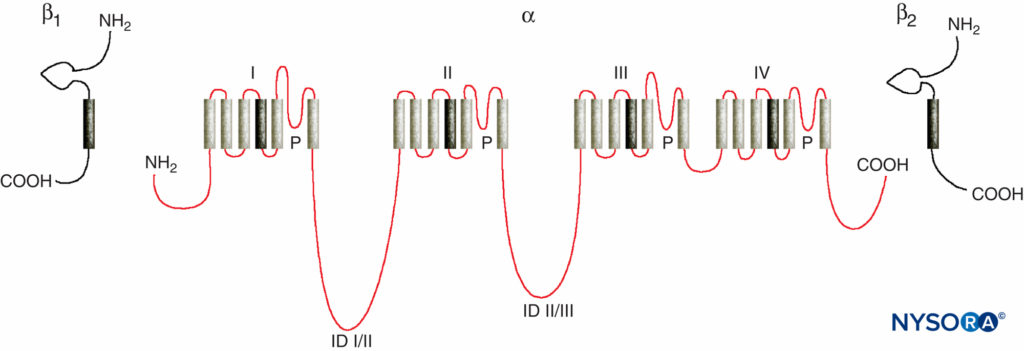
図3 Naチャネルサブユニットの「漫画」構造。 αサブユニットには1999つのドメインがあり、それぞれに15つの膜貫通セグメントが含まれていることに注意してください。 (Plummer NW、Meisler MHの許可を得て複製:哺乳類のナトリウムチャネル遺伝子の進化と多様性。Genomics.57年2月323日; 331(XNUMX):XNUMX-XNUMX。)
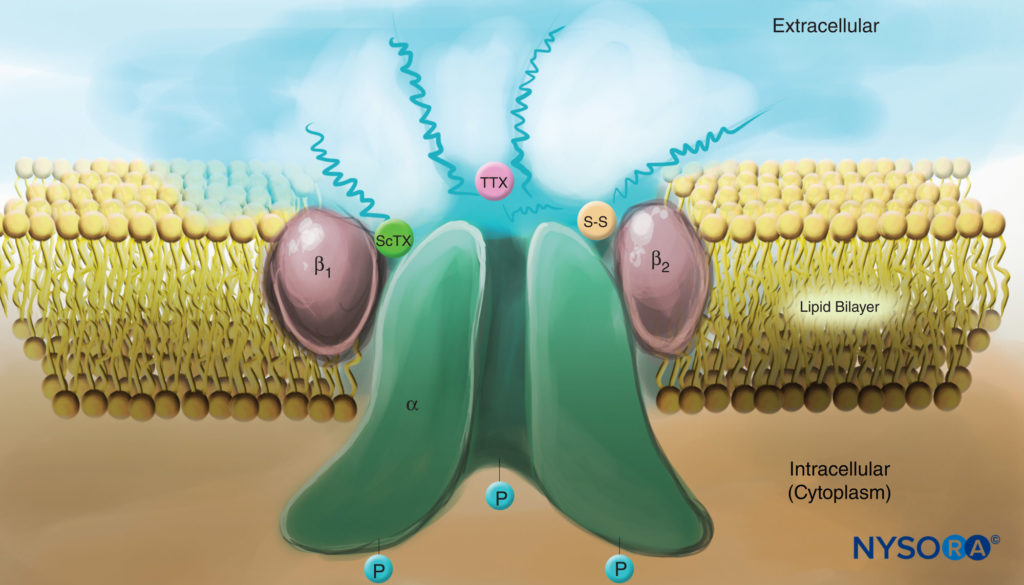
図4 原形質膜のNaチャネルの漫画。 1992つのサブユニットはすべて、細胞外側で高度にグリコシル化されていることに注意してください(「波状」の線を参照)。 局所麻酔薬とは対照的に、サソリ毒素(ScTX)とテトロドトキシン(TTX)の両方がチャネルの外面に結合部位を持っていることに注意してください。 チャネルの細胞質側がリン酸化されていることにも注意してください。 (Catterall WAの許可を得て複製:電位依存性ナトリウムチャネルの細胞および分子生物学。PhysiolRev。72 Oct; 4(15 Suppl):S48-SXNUMX。)
表1 電位依存性Naチャネル-神経アイソフォーム。
| Nav 1.1 | Nav 1.2 | Nav 1.3 | Nav 1.6 | Nav 1.7 | Nav 1.8 | Nav 1.9 | |
|---|---|---|---|---|---|---|---|
| 染色体 | 2 | 2 | 2 | 12 | 2 | 3 | 3 |
| 識別された場所 | CNS、DRG | CNS | 損傷後、CNSが上方制御される | DRG(大小)、CNS、ランヴィエ絞輪 | DRG(大小) | DRG(小) | DRG(小) |
| 不活化 | 尊大 | 尊大 | 尊大 | 尊大 | 尊大 | 遅く | 遅く |
| TTX | センシティブ | センシティブ | センシティブ | センシティブ | センシティブ | 鈍感 | 鈍感 |
出典:Novakovic SD、Eglen RM、Hunter JCの許可を得て適合:神経系におけるNa+チャネル分布の調節。 トレンド神経科学。 2001年24月;8(473):478-XNUMX。
対照的に、ヒトは10つの染色体上にXNUMXつのアクティブなNaチャネルαサブユニット遺伝子を持ち、遺伝子産物の細胞特異的な発現と局在化を示しますXNUMX。v 1.4遺伝子(慣例により、遺伝学者は電位依存性NaチャネルアイソフォームをNaと呼びますv 1.x)骨格筋、およびNaにチャネルを供給しますv 1.5遺伝子が心筋にチャネルを供給し、XNUMXつのNaを残すv 神経組織のアイソフォーム(テーブル1)。 定義された遺伝子は、無髄軸索、運動軸索のランヴィエ絞輪、および小さな後根神経節侵害受容器のそれぞれに特定のNaチャネル形態を提供します。 すべてのNaチャネルαサブユニットは同様にLAに結合しますが、神経毒に結合するための親和性は異なります。 Naチャネルのαおよびβサブユニットの変異は、筋肉、心臓、および神経の疾患を引き起こします。 たとえば、Naの遺伝性突然変異v 1.5は、先天性QT延長症候群、ブルグダ症候群、およびその他の刺激伝導系疾患に関連しています。 特定のNaが示されているv アイソフォームは慢性疼痛の動物モデルで増殖します。 特定のNaの存在v 遺伝子αサブユニット製品は、特定のNaごとに阻害剤がいつか開発される可能性があるという魅力的な可能性を提供しますv αサブユニット形式。 一部のNavアイソフォームですでに進行中のこのような開発は、慢性疼痛の治療に革命をもたらす可能性があります。 神経線維のインパルスをブロックするには、定義された長さの神経が興奮しなくなる必要があります(インパルスがブロックされたセグメントを「飛び越える」のを防ぐため)。 したがって、LA濃度が増加すると、インパルス伝導を防ぐために、より短い神経長に沿って適用する必要があります。 図5。 通常の伝導とLAが伝導を阻害する方法は、有髄神経線維と無髄神経線維で異なります。 有髄線維の伝導は、ランヴィエ絞輪から次の節へとジャンプして進行します。これは跳躍伝導と呼ばれるプロセスです。 有髄神経線維のインパルスをブロックするには、LAがXNUMXつの連続するランヴィエ絞輪(図6)。 跳躍メカニズムを欠く無髄繊維は、有髄繊維よりもはるかにゆっくりと伝導します。 無髄繊維は、それらの原形質膜全体にNaチャネルが分散しているため、直径が小さいにもかかわらず、LAに対して比較的耐性があります。 神経線維間のこれらの違いは、Naチャネルが有髄軸索のランヴィエ絞輪でクラスター化し始める発達中に生じます。 高速信号伝送に不可欠なチャネルのノードクラスタリングは、末梢神経系のシュワン細胞と中枢神経系(CNS)のオリゴデンドロサイトによって開始されます。 Naチャネルは、ホジキンとハクスリーによって最初に記述された、「休止」、「開放」、「不活化」の少なくともXNUMXつのネイティブコンフォメーションで存在する可能性があります。 活動電位の間、ニューロンのNaチャネルは短時間開き、細胞外Naイオンが細胞に流れ込み、原形質膜を脱分極させます。 わずか数ミリ秒後、Naチャネルは非アクティブになります(Na電流が停止すると)。 Naチャネルは、膜の再分極によって休止状態に戻ります。 チャネルが導電型から非導電型に移行するプロセスは、ゲーティングと呼ばれます。 ゲーティングは、電位の変化に応じた双極子の動きに起因すると想定されています。 電位依存性チャネルが動作するプロセスには、チャネルの外周内でのパドル型の電圧センサーの動きが含まれる可能性があります(図7)。 ゲーティングプロセスの速度はNaによって異なりますv αサブユニットの形態:骨格筋および神経の形態は、心臓の形態よりも速くゲートします。
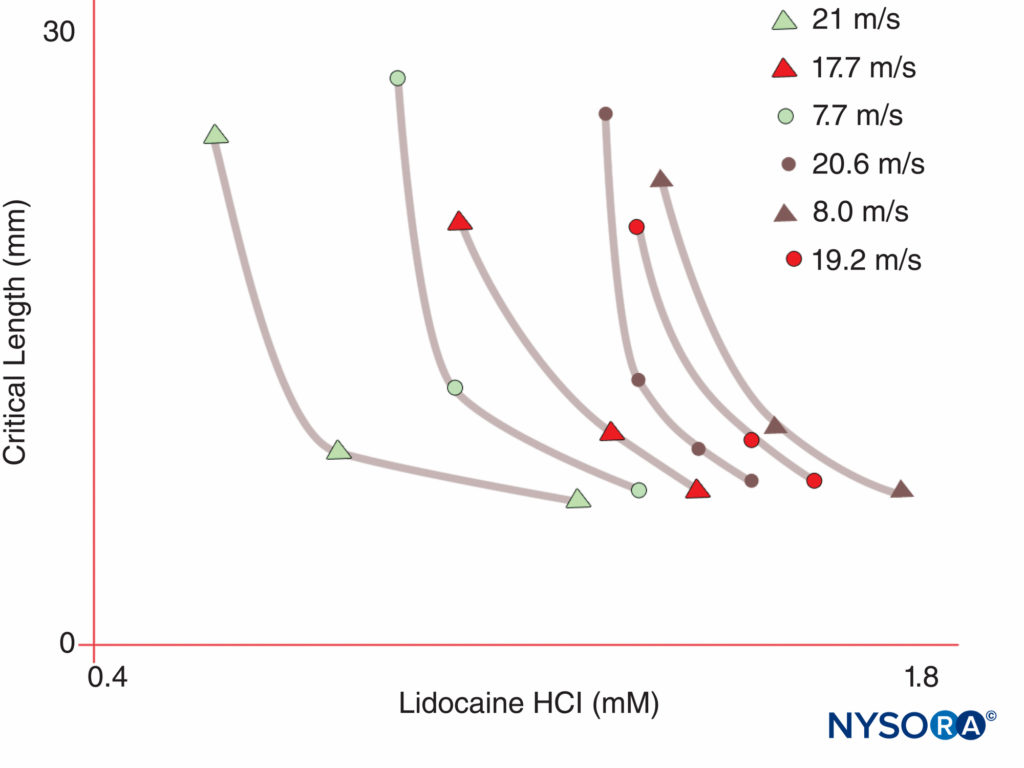
図5 局所麻酔薬にさらされる神経の長さが長くなるにつれて、神経ブロックを生成するために必要な局所麻酔薬の濃度が低下することに注意してください。 (Raymond SA、Steffensen SC、Gugino LDらの許可を得て複製:インパルス遮断作用における局所麻酔薬に曝露された神経の長さの役割。AnesthAnalg。1989年68月; 5(563):570-XNUMX。)
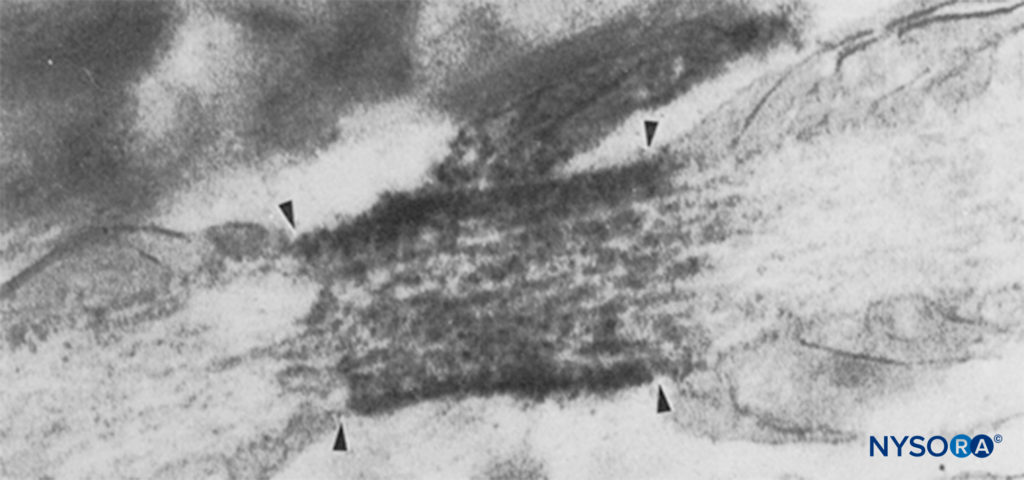
図6 ランヴィエ絞輪の電子顕微鏡写真。 Naチャネルは免疫標識されており、1989つの矢印の中に密な顆粒として表示されます。 傍結節領域は「pn」で示され、星状細胞は「as」で示されます。 (Black JA、Friedman B、Waxman SGらの許可を得て複製:ラット視神経のランヴィエ絞輪および結節周囲星状細胞におけるナトリウムチャネルの免疫超構造的局在。ProcRSoc Lond BBiolSci。23Oct238; 1290 (39):51-XNUMX。)
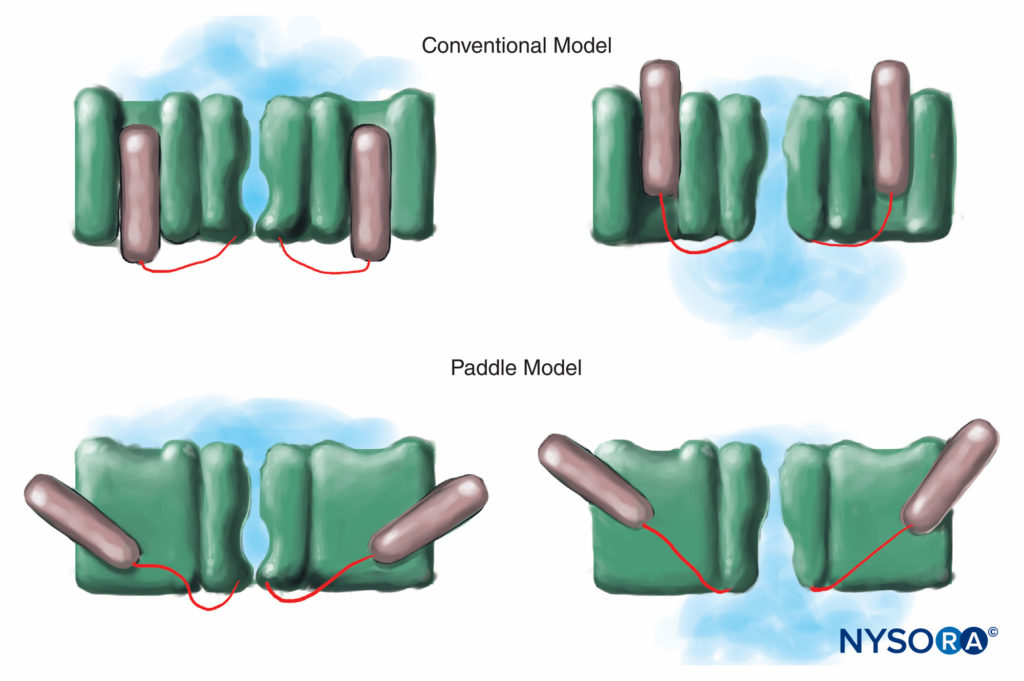
図7 電位依存性イオンチャネルの従来のモデルでは、チャネルの電圧感知部分が膜の「内外」にスライドします。 Kチャネルのより最近のX線回折研究は、より適切なメカニズムが、原形質膜を通って斜めに滑るパドル様構造のメカニズムであることを示唆している。 (Arhem Pの許可を得て複製:イオンチャネルの電圧検知:50年前の謎が解決されましたか?Lancet。2004年10月363日; 9416(1221):1223-XNUMX。)
LAがNaチャネルに結合し、活動電位の根底にあるNa透過性を阻害すると、麻酔が発生します。 LAメカニズムの理解は、いくつかの重要な観察によって洗練されています。 テイラーは、LAが神経のNaチャネルを選択的に阻害することを確認しました。 ストリチャーツは、LAでの使用依存ブロックを最初に観察し、LA結合のためのチャネル開口の重要性を示しました。 使用(または周波数)依存性は、Na電流のLA阻害が反復的な脱分極(「使用」)とともにどのように増加するかを説明します。 脱分極の反復的な列は、LAが開いているか不活性化されているNaチャネルに遭遇する可能性を高めます。どちらの形式も、休止チャネルよりもLA親和性が高くなります(図8)。 したがって、膜電位は、LAに対するNaチャネルのコンフォメーションとNaチャネルの親和性の両方に影響を与えます。 使用に依存するブロックは、抗不整脈薬としてのLAの機能にとって重要であるように思われ、痛みの管理におけるLA濃度の低下の有効性の根底にある可能性もあります。 最後に、部位特異的変異誘発を使用して、RagsdaleとWangはNaのD4S6の特定のアミノ酸に結合するLAを局在化しましたv 1.2およびNav 1.4。 一部のLA光学異性体は、反対のエナンチオマーよりも見かけ上の安全性が高くなります。 たとえば、電位固定下では、R(+)-ブピバカイン異性体はS(–)-ブピバカイン(レボブピバカイン)異性体よりも心臓のNa電流をより強力に阻害します(図9)。 全身麻酔薬、サブスタンスP阻害剤、α2-アドレナリン作動薬、三環系抗うつ薬、神経毒素など、他の多くの種類の化学物質もNaチャネルに結合して阻害します。 神経毒素は現在、LAの可能な代替品として動物と人間のテストを受けています。
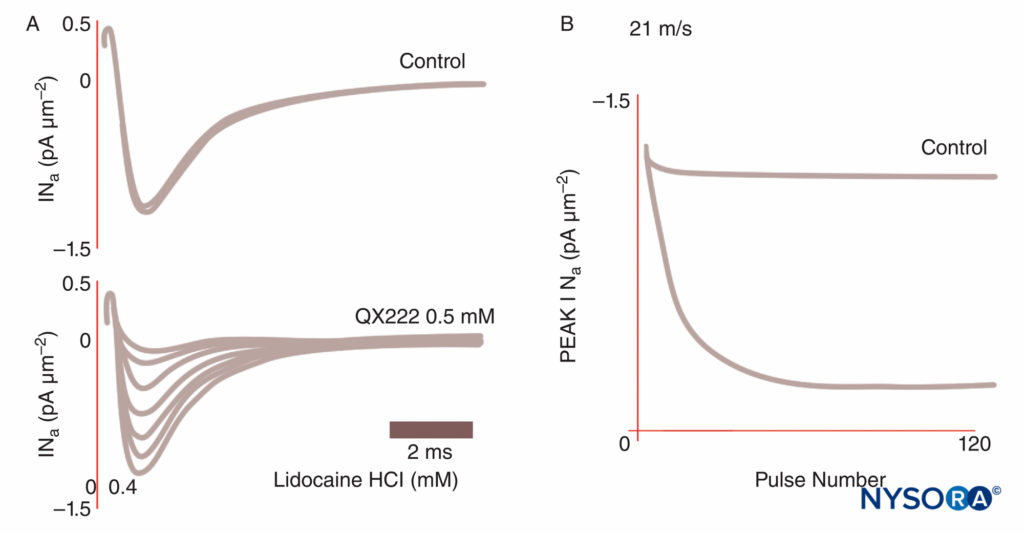
図8 プルキンエ線維におけるNa電流の使用依存ブロック。 制御条件下では、一連のインパルスのそれぞれが同一の電流トレースになります。 局所麻酔薬QX222が存在する場合、最初のインパルスは制御条件下とほぼ同じサイズの振幅になります。 後続の各インパルスは小さくなり(ピークINaが減少)、Naチャネルの蓄積ブロックを反映して、最下点に到達します。 (Hanck DA、Makielski JC、Sheets MFの許可を得て複製:心臓ナトリウムチャネルの第四リドカインブロックの速度論的効果:ゲーティング電流研究。JGenPhysiol。1994 Jan; 103(1):19-43。)
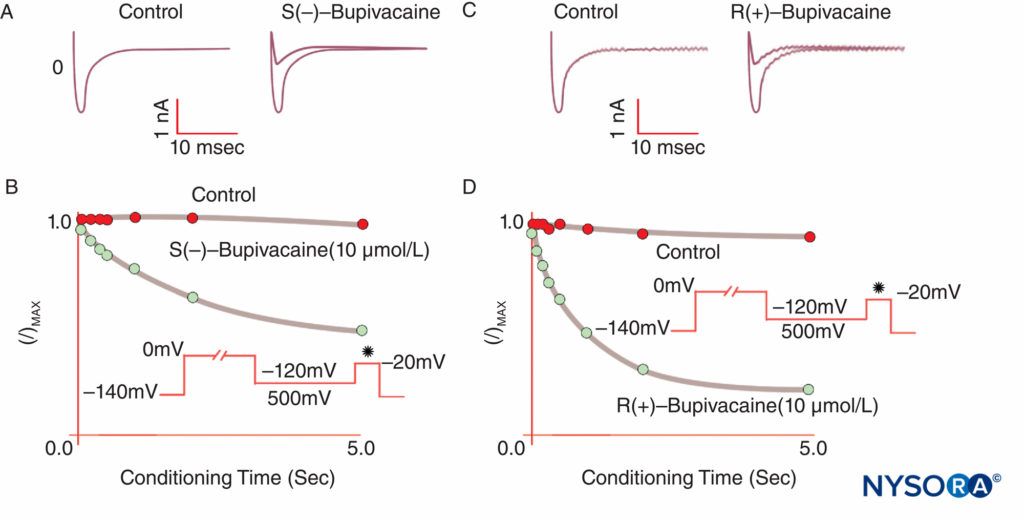
図9 電位固定下で心臓のNa電流を阻害する際のR(+)-ブピバカインと比較したS(–)ブピバカインの効力の低下。 さまざまな長さの標準的な「コンディショニング」脱分極の後、S(–)異性体は、R(+)異性体よりもI/Imaxの減少が少なくなります。 (Valenzuela C、Snyders DJ、Bennett PBらの許可を得て複製:モルモット心室筋細胞におけるブピバカインによる心臓ナトリウムチャネルの立体選択的遮断。循環。1995年15月92日; 10(3014):3024-XNUMX。)
局所麻酔薬力学
臨床診療では、LAは通常、その効力、作用の持続時間、発症の速度、および感覚神経ブロックの差異の傾向によって説明されます。 これらのプロパティは独立してソートされません。
効力と持続時間
LAの神経ブロック効力は、分子量の増加と脂質溶解度の増加とともに増加します。 より大きく、より親油性のLAは、神経膜により容易に浸透し、より高い親和性でNaチャネルに結合します。 たとえば、エチドカインとブピバカインは、化学的に密接に関連しているリドカインとメピバカインよりも脂質の溶解度と効力が高くなっています。
NYSORAのヒント
- LAの神経ブロック効力は、分子量の増加と脂質溶解度の増加とともに増加します。
より脂溶性のLAは、比較的水に不溶性で、血液中に高度にタンパク質が結合し、神経膜からの血流によって容易に除去されず、invitroで孤立した神経からよりゆっくりと「洗い流され」ます。 したがって、脂質溶解度の増加は、血液中のタンパク質結合の増加、効力の増加、および作用の持続時間の延長に関連しています。 麻酔の程度と持続時間は、動物実験における神経のLA含有量と相関させることができます。 動物では、より多くの深さとより長い期間のブロックは、より多くの濃度の低いLAと比較して、より少量のより濃縮されたLAから生じます。
発症速度
多くの教科書や総説は、孤立した神経の麻酔の開始は、LAの脂質溶解度の増加とpKaの増加とともに遅くなると主張しています(テーブル2)。 どのpHでも、膜透過性の主な原因である非荷電型で存在するLA分子の割合は、pKaの増加とともに減少しますが、開始が最も速いXNUMXつのLAのうち、エチドカインは脂溶性が高く、クロロプロカインのpKaはそれよりも大きくなります。他のLAの。 最後に、LAの開始速度は、分子量の増加とともに低下する水性拡散速度と関連しています。
表2 一緒に分類される傾向がある局所麻酔特性。
物理的および化学的
- 脂溶性の増加
- タンパク質結合の増加
薬理学的および毒物学的
- 効力の増加
- 開始時間の増加
- アクションの期間を長くする
- 重度の全身毒性の増加傾向
- 一般的に、すべてが一緒にソートされる傾向があります
差動感覚神経ブロック
局所麻酔と疼痛管理は、他の機能を損なわずに疼痛伝達を選択的に阻害するLAによって変換されます。 しかし、皮膚切開に十分な感覚麻酔は、通常、運動障害なしでは得られません。 1929年にGasserとErlangerによって最初に実証されたように、すべてのLAは、同じタイプのより大きなファイバーをブロックするために必要な濃度よりも低い濃度で、より小さな(直径)ファイバーをブロックします。 グループとして、無髄繊維は、より大きな有髄A-δ繊維と比較してLAに耐性があります。 ブピバカインとロピバカインは感覚線維に対して比較的選択的です。 ブピバカインは運動ブロックよりも感覚のより迅速な発症をもたらしますが、密接に関連する化学的メピバカインは正中神経ブロック中に異なる発症を示しません(図10)。 Navアイソフォーム選択的拮抗薬が利用可能になると、真の差動麻酔が可能になる可能性があります。 特定のNavアイソフォームは後根神経節に蔓延していることがわかっており、(前述のように)さまざまなNavアイソフォームの相対的な集団はさまざまな痛みの状態に応じて変化する可能性があります。
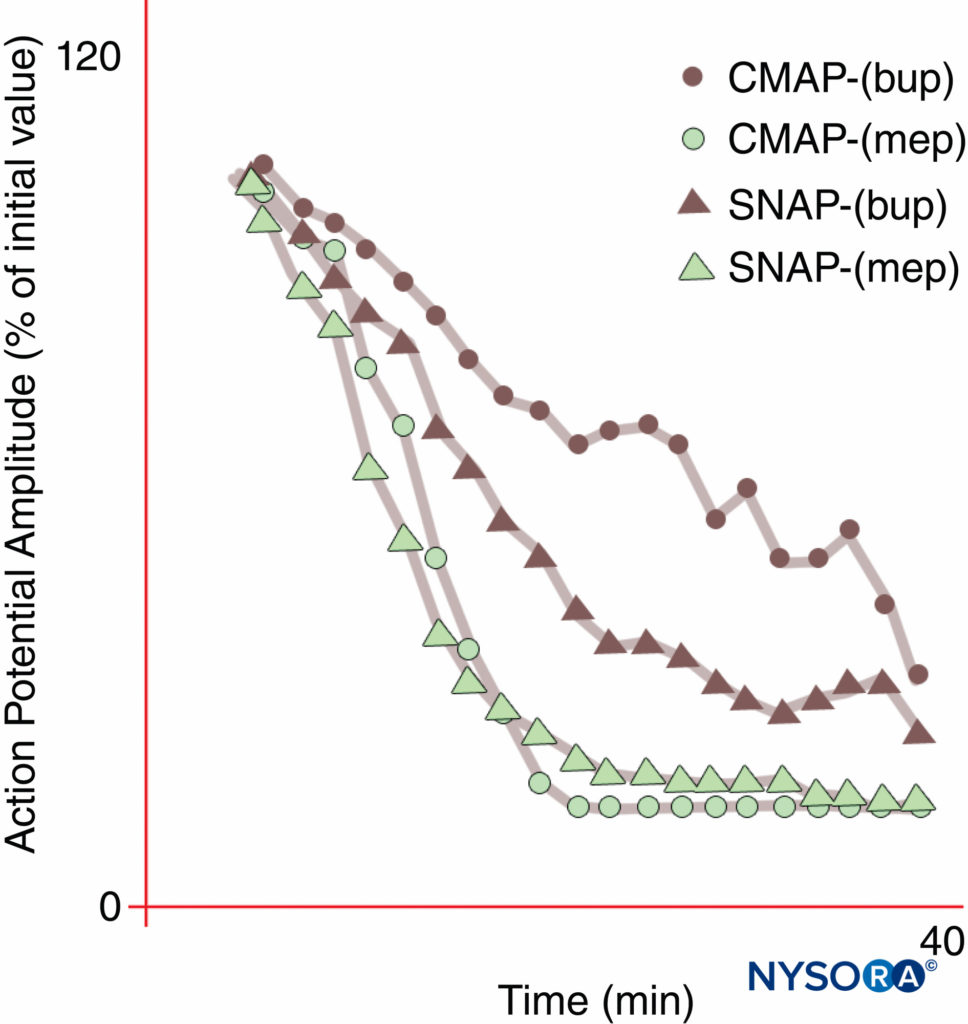
図10 ブピバカイン0.3%(bup)では正中神経ブロックの発症差がありますが、メピバカイン1%(mep)では発症しません。 複合運動活動電位(CMAP)は、これらの正常なボランティア被験者のブピバカインブロックの開始時に感覚神経活動電位(SNAP)よりも抑制されないことに注意してください。 定常状態(20分)では、CMAPとSNAPは同等に抑制されます。 一方、メピバカインはCMAPとSNAPの両方をより速く阻害し、ブロックの開始に差はありませんでした。 (Butterworth J、Ririe DG、Thompson RBらの許可を得て複製:正中神経ブロックの発症差:健康なボランティアにおけるメピバカインとブピバカインの無作為化二重盲検比較。BrJAnaesth。1998Oct; 81(4): 515-521。)
局所麻酔活性に影響を与える他の要因
投与量、投与部位、 添加剤、温度、および妊娠。 LAの投与量が増えると、成功の可能性と麻酔の持続時間が増加しますが、開始の遅延と差動ブロックの傾向は減少します。 一般に、麻酔の開始が最も速く、持続時間が最も短いのは、脊髄注射または皮下注射です。 プレクサスブロックを使用すると、発症が遅くなり、持続時間が長くなります。
NYSORAのヒント
- 特定のLAの有効性は、妊娠中に見られるように、用量、投与部位、添加剤、温度、および神経感受性の変化によって影響を受けます。
エピネフリンは、血管収縮を引き起こし、血管内注射のマーカーとして機能するために、LA溶液に頻繁に添加されます。 エピネフリンおよび他のα1アゴニストは、主にLAの神経内濃度を延長および増加させることにより、LA期間を増加させます。 血流は短時間だけ減少し、血流に対するα1アドレナリン作動性効果が消失した後もブロックは長く持続します。 その他の一般的なLA添加物には、クロニジン、NaHCO3、オピオイド、デキサメタゾン、およびヒアルロニダーゼが含まれます。 帯電していない局所麻酔薬は、より酸性のpH(図11)。 帯電していないLA塩基は、帯電したLAよりも神経鞘と膜を横切って拡散しやすく、麻酔の開始を早めます。 いくつかの臨床研究は、重曹の添加が臨床神経ブロックの間に一貫性のない作用を持っていたことを示しました。 ただし、すべての研究で麻酔の開始が早いことが示されたわけではありません。 製造業者によってエピネフリンが添加されたLA溶液に添加された場合、重炭酸塩が最大の効果を発揮すると予想されるかもしれません。 このような溶液は、「プレーン」(エピネフリンを含まない)LA溶液よりも酸性であり、貯蔵寿命を延ばします。 重炭酸塩は動物のリドカインの持続時間を短縮します。 不思議なことに、LAがNaチャネルの細胞質側にアクセスできるようになると、H+イオンが使用依存ブロックを強化します。 いくつかの製剤でブピバカインを使用して行われているように、LAをリポソームに組み込むことにより、局所麻酔の顕著な延長を達成することができます。
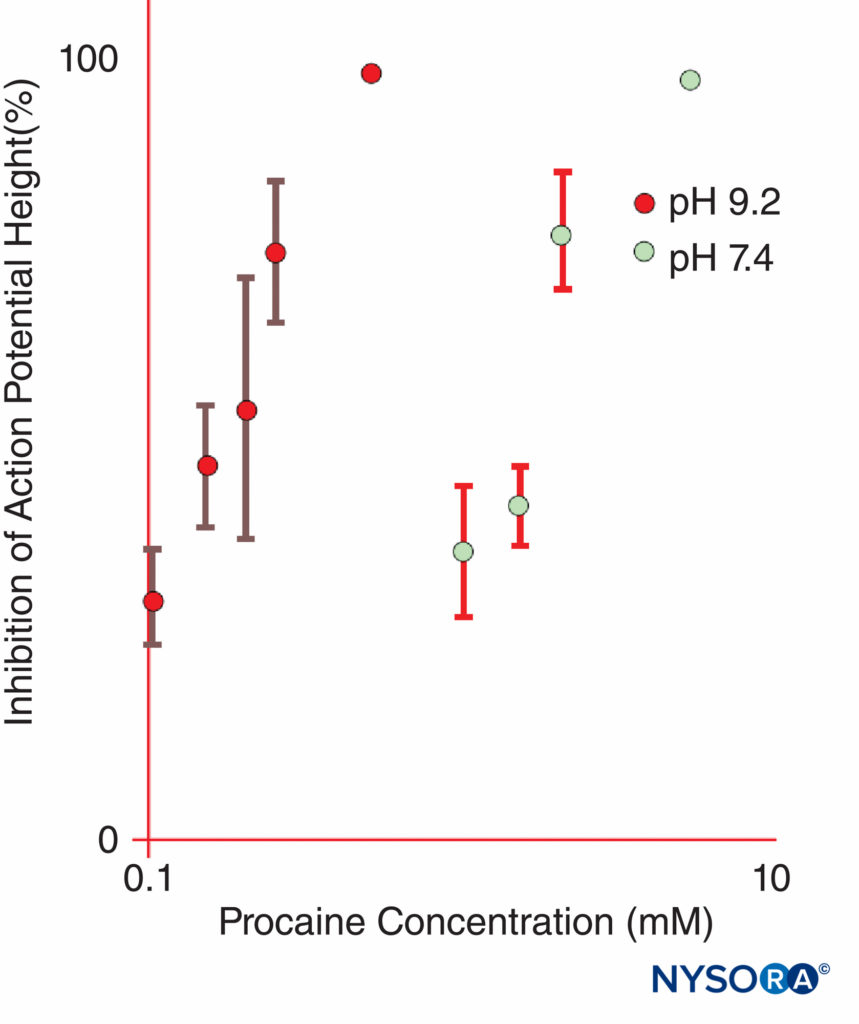
図11 孤立したカエルの坐骨神経における複合活動電位を阻害するプロカインの効力は、pH9.2と比較してpH7.4で劇的に増加します。 (Butterworth JF、Lief PA、Strichartz GRの許可を得て複製:プロカイン代謝物であるジエチルアミノエタノールのpH依存性局所麻酔活性。麻酔学。1988年68月; 4(501):506-XNUMX。)
NYSORAのヒント
- 妊娠はLAに対する神経感受性を高めます。
妊娠中の女性と妊娠中の動物は、LAに対する神経感受性の増加を示しています。 さらに、胸腰部脳脊髄液量の減少により、妊娠中に脊髄幹麻酔の広がりが増加する可能性があります。
血中濃度と薬物動態
LAのピーク濃度は、注射部位によって異なります(図12)。 同じLA用量で、 肋間ブロック 一貫してより高いピークLA濃度を生成します 硬膜外 または神経叢ブロック。 最近他の人が議論したように、ピーク血中レベルはブロック部位によって大きく異なるため、特定の神経ブロック手順を参照する場合を除いて、LAの「最大」用量について話すことはほとんど意味がありません。 血液中では、すべてのLAは部分的にタンパク質に結合しており、主にα1-酸性糖タンパク質に結合し、次にアルブミンに結合しています。
α1-酸性糖タンパク質への親和性はLAの疎水性と相関し、プロトン化(酸性度)とともに減少します。 タンパク質結合の程度は、α1-酸性糖タンパク質の濃度に影響されます。 妊娠中は、タンパク質結合とタンパク質濃度の両方が低下します。 LAとLA-オピオイドの組み合わせの長期注入中に、LA結合タンパク質の濃度は徐々に増加します肺によるLAのかなりの初回通過取り込みがあり、動物実験は、右から左への心シャントの患者が実証することが期待される LAの毒性 少量の静脈内ボーラス投与後。
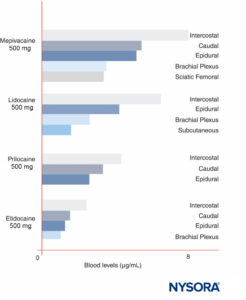
図12 さまざまな形態の局所麻酔後の局所麻酔薬のピーク血中濃度。 肋間ブロックは一貫して血液中の最大の局所麻酔薬濃度をもたらし、神経叢ブロックは血液中の最小の局所麻酔薬濃度をもたらし、硬膜外/尾側技術はその中間にあることに注意してください。 (Covino BG、Vassallo HGの許可を得て複製:局所麻酔薬:作用機序と臨床使用。Grune&Stratton; 1976.)
NYSORAのヒント
- 薬理学のテキストで一般的に見られるLAの最大投与量に関する推奨事項は、臨床局所麻酔の実践ではそれほど有用ではありません。
- LAの血清濃度は、注射技術、注射場所、およびLAへの添加剤の添加によって異なります。
- 最大安全LA用量に関する推奨事項は、特定の神経ブロック手順に関してのみ有効です。
エステルは、非特異的エステラーゼによって触媒され、血中で急速に加水分解されます。 プロカインとベンゾカインは、これらの薬剤に対するアナフィラキシーの根底にある種であるパラアミノ安息香酸(PABA)に代謝されます。 通常、内視鏡検査のための局所麻酔のための高用量のベンゾカインは、生命を脅かすレベルのメトヘモグロビン血症につながる可能性があります。 アミドは肝臓で代謝されます。 リドカインは酸化的N-deal-kylationを受けます(シトクロムCYP1A2およびCYP3A4によるモノエチルグリシンキシリジドおよびグリシンキシリジドへ)。 ブピバカイン、ロピバカイン、メピバカイン、およびエチドカインも、N-脱アルキル化およびヒドロキシル化を受けます。 プリロカインは加水分解されて、メトヘモグロビン血症を引き起こす薬剤であるo-トルイジンになります。 健康な成人にわずか400mgのプリロカインを投与すると、臨床的チアノーゼを引き起こすのに十分なメトヘモグロビン血症濃度が生じると予想される場合があります。 アミドLAクリアランスは、肝血流、肝抽出、および酵素機能に大きく依存します。 したがって、アミドLAクリアランスは、β-アドレナリン受容体またはH2受容体遮断薬など、肝血流を減少させる要因によって、および 心臓または肝不全。 アミドLAの性質は、心拍出量、肝血流、クリアランスの増加、および前述のタンパク質結合の低下により、妊娠中に変化します。 腎不全は、アミドLAの分布容積を増加させ、エステルおよびアミドLAの代謝副産物の蓄積を増加させる傾向があります。 理論的には、コリンエステラーゼ欠損症とコリンエステラーゼ阻害剤は、エステルLAによる全身毒性のリスクを高めるはずです。 ただし、確認的な臨床報告はありません。 一部の薬剤は、LA代謝に関与するさまざまなシトクロムを阻害します。 ただし、シトクロム阻害剤の重要性は、特定のLA種によって異なります。 β遮断薬とH2受容体遮断薬は、CYP 2D6を阻害します。これは、アミドLA代謝の低下に寄与する可能性があります。 イトラコナゾールは肝血流に影響を与えませんが、CYP 3A4とブピバカインの排出を20%〜25阻害します。 ロピバカインはCYP1A2によってヒドロキシル化され、CYP2A6によって3'、4'-ピペコロキシリジドに代謝されます。 CYP 1A2のフルボキサミン阻害は、ロピバ-カインクリアランスを70%減少させます。 一方、CYP 3A4の強力な阻害剤(ケトコナゾール、イトラコナゾール)との同時投与は、ロピバカインクリアランスにわずかな影響しか及ぼしません。
直接的な毒性の副作用
有毒な副作用を含むすべてのLA作用は、電位依存性Naチャネルとの相互作用から生じるというのは一般的ですが、誤った仮定です。 LAがNaチャネル以外の多くの標的に結合するという豊富な証拠があります。これには、電圧ゲート型KおよびCaチャネル、KATPチャネル、酵素、N-メチル-D-アスパラギン酸受容体、β-アドレナリン受容体、Gタンパク質媒介性調節が含まれます。 KおよびCaチャネル、およびニコチン性アセチルコリン受容体の。 これらの他のサイトのいずれかまたはすべてにLAがバインドすると、LAの生産の根底にある可能性があります。 脊髄 or 硬膜外鎮痛 有毒な副作用の原因となる可能性があります。
中枢神経系の副作用
局所麻酔薬CNS毒性は、CNSの興奮性経路の阻害を選択的にブロックすることから生じ、血中のLA濃度が徐々に増加するにつれて、兆候と症状のステレオタイプのシーケンスを生成します(テーブル3)。 LAの投与量を増やすと、扁桃体に発作が起こる可能性があります。 さらにLAを投与すると、CNS興奮はCNS抑制と最終的な呼吸停止に進行します。 より強力な(神経ブロックでの)LAは、より強力でないLAよりも低い血中濃度および低い用量で発作を引き起こします。 動物実験では、代謝性アシドーシスと呼吸性アシドーシスの両方がリドカインのけいれん性用量を減少させました。
表3 局所麻酔薬の投与量(または濃度)が徐々に増加するにつれて、毒性の兆候と症状が進行します。
- めまい
- 耳鳴り
- 不吉な気持ち
- 周囲のしびれ
- 冗長性
- トレマーズ
- ミオクローヌスのけいれん
- 痙攣
- 昏睡
- 心血管虚脱
心血管毒性
実験室での実験では、ほとんどのLAは、血中濃度が発作を引き起こすのに必要な濃度のXNUMX倍を超えるまで、心臓血管(CV)毒性を引き起こしません。 ただし、ブピバカインによる中枢神経系とCVの同時毒性の臨床報告があります(テーブル4)。 犬では、ブピバカインの超痙攣用量は、ロピバカインおよびリドカインの超痙攣用量よりも一般的に不整脈を引き起こします。 LAは、心臓のうつ病に関連する濃度よりも低い濃度で、CNS興奮のCV兆候(心拍数、動脈血圧、心拍出量の増加)を生成します。 低炭酸ガス血症は、ロピバカインによって誘発されるSTセグメントの変化と左心室収縮性を低下させます。
NYSORAのヒント
- 実験室での実験では、ほとんどのLAは、血中濃度が発作を引き起こすのに必要な濃度のXNUMX倍を超えるまでCV毒性を生じません。
表4 犬の局所麻酔薬のけいれん対致死量。
| リドカイン | ブピバカイン | テトラカイン | |
|---|---|---|---|
| すべての動物で痙攣を引き起こす用量(mg / kg) | 22 | 5 | 4 |
| すべての動物で致死性をもたらす用量(mg / kg) | 76 | 20 | 27 |
局所麻酔薬は心臓のNaチャネル(Nav 1.5アイソフォーム)。 ブピバカインは、リドカインよりも強く、より長く心臓のNaチャネルに結合します。 前述のように、特定のR(+)光学異性体は、S(–)光学異性体よりも心臓のNaチャネルに強く結合します。 これらの実験室での観察は、レボブピバカインとロピバカインの臨床開発につながりました。 局所麻酔薬は、神経ブロックと同じ効力の順位で心臓の伝導を抑制します。 局所麻酔薬は、おそらく心筋内のCaシグナル伝達メカニズムへの干渉から、用量依存的な心筋の鬱病を引き起こします。 これらの麻酔薬は、Naチャネルへの結合が最大になる濃度よりも高い濃度で、心臓電位依存性CaおよびKチャネルに結合して阻害します。 LAはβアドレナリン受容体に結合し、エピネフリン刺激によるサイクリックアデノシン一リン酸(AMP)の形成を阻害します。 ラットでは、心臓毒性の順位はブピバカイン>レボブピバカイン>ロピバカインのようです。 犬では、心エコー検査で評価したところ、リドカインは最も効力が低く、ブピバカインとレボブピバカインはロピバカインよりも左心室機能の抑制に強力でした(テーブル5)。 犬では、プログラムされた電気刺激とエピネフリン蘇生法の両方が、リドカインまたはロピバカインの投与後よりもブピバカインとレボブピバカインの後に多くの不整脈を誘発しました。 CV毒性が生じるメカニズムは、どのLAが投与されたかによって異なります。 LAが極度の低血圧になると、リドカインを投与された犬は蘇生することができましたが、LAによって誘発された心筋の鬱病に対抗するためにエピネフリンの持続注入が必要でした。 逆に、極度の低血圧になるまでブピバカインまたはレボブピバカインを投与された多くの犬は蘇生できませんでした。 ブピバカイン、レボブピバカイン、またはロピバカインの後、除細動できる犬はしばしば追加の治療を必要としませんでした。 同様に、ブタでは、リドカインとブピバカインを比較すると、心筋の鬱病の効力の比率は1:4でしたが、不整脈の発生では1:16でした。 LAは、臨床濃度で血管平滑筋の拡張を引き起こします。 コカインは、局所的な血管収縮を一貫して引き起こす唯一のLAです。
アレルギー反応
NYSORAのヒント
- LAに対する真の免疫反応はまれです。
- 真のアナフィラキシーは、他のLAよりもPABAに直接代謝されるエステルLAでより一般的に見られます。
- LAの偶発的な静脈内注射は、アレルギー反応と誤診されることがあります。
- 一部の患者は、LAに含まれるメチルパラベンなどの防腐剤に反応する可能性があります。
LAに対する真の免疫反応はまれです。 LAの偶発的な静脈内注射は、アレルギー反応と誤診されることがあります。 真のアナフィラキシーは、他のLAよりもPABAに直接代謝されるエステルLAでより一般的に見られます。 一部の患者は、LAに含まれるメチルパラベンなどの防腐剤に反応する可能性があります。 いくつかの研究は、アナフィラキシーの兆候または症状を示した後でも、明らかなLAアレルギーの評価のために紹介された患者は、投与されたLAに対して真のアレルギーを示すことはほとんどないことを示しています。 一方、LA皮膚検査は優れた陰性予測値を持っています。 言い換えれば、LA皮膚検査に反応しない患者の97%は、臨床現場でもLAに対するアレルギー反応を起こさないでしょう。
表5 犬で測定された心筋機能の指標に対する局所麻酔薬の効果。
| 局所麻酔薬 | LVEDP(EC50 125%ベースの場合) (mcg / mL) | dP / dtマックス (EC50 65%ベースの場合) (mcg / mL) | %FS(EC50 65%ベースの場合) (mcg / mL) |
|---|---|---|---|
| ブピバカイン | 2.2(1.2 - 4.4) | 2.3(1.7 - 3.1) | 2.1(1.47 - 3.08) |
| レボブピバカイン | 1.7(0.9 - 3.1) | 2.4(1.9 - 3.1) | 1.3(0.9 - 1.8) |
| ロピバカイン | 4.0(2.1 - 7.5)a / sup> | 4.0(3.1 - 5.2)b | 3.0(2.1 - 4.2)a / sup> |
| リドカイン | 6.8(3.0 - 15.4)c | 8.0(5.7 - 11.0)d | 5.5(3.5 - 8.7)d |
神経毒性作用
1980年代、2-クロロプロカイン(当時は比較的酸性のpHでメタ重亜硫酸ナトリウムを配合)は、硬膜外投与の試み中に偶発的に大量の髄腔内注射を行った後、馬尾症候群を引き起こすことがありました。 「毒素」が2-クロロプロカインであるかメタ重亜硫酸ナトリウムであるかは未解決のままです。2-クロロプロカインは現在、ヒトの脊髄くも膜下麻酔でリドカインの代替品としてテストされており、一連の出版物はそれが安全で効果的である可能性があることを示唆しています。 同時に、他の研究者は、動物の神経毒反応を、メタ重亜硫酸ナトリウムではなく、大量の2-クロロプロカインに関連付けました。 リドカイン脊髄くも膜下麻酔後の一過性の神経症状と持続的な仙骨欠損についても論争があります。 報告と論争は、多くの医師にリドカイン脊髄くも膜下麻酔を断念するように説得しました。 他の脊髄LAソリューションとは異なり、リドカイン5%は、孤立した神経または孤立したニューロンに適用すると、伝導を永続的に中断します。 これは、細胞内カルシウムのリドカイン誘発性増加の結果である可能性があり、Naチャネル遮断を伴うようには見えません。 「安全性を証明する」ことは不可能ですが、複数の研究により、短時間の脊髄くも膜下麻酔のためにリドカインの代わりにクロロプロカインまたはメピバカインを使用できることが示唆されています。
局所麻酔薬の毒性の治療
LAの有害反応の治療は、その重症度によって異なります。 マイナーな反応は自然に終了することができます。 LAによって誘発される発作は、開存気道を維持し、酸素を供給することによって管理する必要があります。 発作は、静脈内ミダゾラム(0.05–0.10 mg / kg)またはプロポフォール(0.5–1.5 mg / kg)または麻痺性用量のスクシニルコリン(0.5–1 mg / kg)で終了し、その後バッグで換気し、マスク(または気管挿管)。 中等度の低血圧によって現れるLACVうつ病は、静脈内輸液および昇圧剤(フェニレフリン0.5〜5μg / kg /分、ノルエピネフリン0.02〜0.2μg / kg /分、またはバソプレシン40μgIV)の注入によって治療できます。 心不全が存在する場合は、エピネフリン(1〜5μg / kgのIVボーラス)が必要になる場合があります。 毒性が心停止に進行する場合、米国地域麻酔疼痛医学会(ASRA)によって開発されたLA毒性の治療に関するガイドラインは合理的であり、公表前の全国調査で特定された無秩序な蘇生計画よりも確かに好ましい。ガイドライン。 リドカインの代わりにアミオダロンを使用することは理にかなっており、複数の動物実験に基づいて、最初は1 mgのボーラスではなく、少量の漸増用量のエピネフリンを使用します。 動物実験と臨床報告は、ブピバカイン誘発性心停止から蘇生する脂質注入の顕著な能力を示しています(図13脂質注入のほぼ無毒な状態を考えると、LA中毒からの蘇生を必要とする患者からこの治療を差し控える説得力のある議論をすることはできません。 ブピバカインの心臓毒性が反応しない場合は、心肺バイパスを検討する必要があります。 より良い治療によるものであれ、技術の変更によるものであれ、重度の局所麻酔薬の全身毒性による脅威は減少しているようです。 少数派は、少なくとも経験豊富な手では、リスクは最初から誇張されていると主張するでしょう。 多くの施術者は、末梢神経ブロック中の超音波ガイダンスがより安全な診療とより少ないリスクにつながったと信じています。 この見方は物議を醸すままですが、この信念を支持する研究があります。
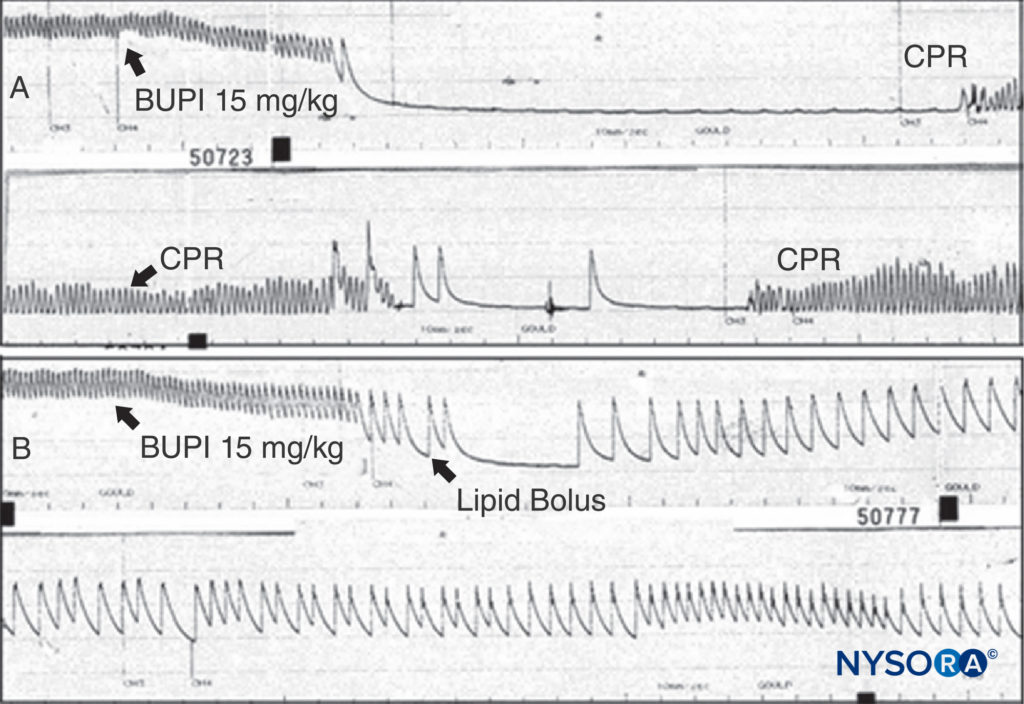
図13 A:麻酔をかけたラットには、示されているようにブピバカイン15 mg/kgを投与します。 動脈血圧は急速に低下して心停止になります。 心肺蘇生法(CPR)が行われますが、CPRを中止しても動脈圧は観察されません。 B:同じ実験が行われますが、脂質のボーラスが与えられます。 (同じ用量のブピバカインが使用されているにもかかわらず)動脈圧が失われることはなく、心停止が起こらないことに注意してください。 (Weinberg Gの許可を得て複製:局所麻酔薬による心臓毒性のある患者の蘇生における現在の概念。RegAnesthPainMed。2002Nov-27; 6(568):575-XNUMX。)
概要
西洋医学でXNUMX世紀以上使用された後も、LAはXNUMX世紀の医師にとって重要なツールであり続けています。 末梢神経ブロックは、ほぼ確実に、神経細胞膜の電位依存性NaチャネルのLA阻害の結果です。 脊髄および硬膜外麻酔のメカニズムは完全には定義されていません。 LAの適切で安全な用量は、特定の神経ブロック手順によって異なります。 LAが異なるとCV毒性が生じるメカニズムはさまざまです。より強力な薬剤(ブピバカインなど)はNaチャネル作用によって不整脈を引き起こす可能性がありますが、効力の低い薬剤(リドカインなど)は他の経路を通じて心筋の鬱病を引き起こす可能性があります。 LAの全身毒性に対する恐怖は、より安全なLA、より安全な局所麻酔の実践、および改善された治療によって軽減されました。 現在利用可能なLAの期間を延長するために、臨床的に適用可能な遅延放出局所麻酔薬製剤を製造するための新たな取り組みがあります。
参考文献
- ヴァンダムLD:局所麻酔の歴史のいくつかの側面。 Strichartz GR(ed):Local Anesthetics:Handbook ofExperimentalPharmacology。 Springer-Verlag、1987年、1〜19ページ。
- Calatayud J、Gonzalez A:コカの葉以降の局所麻酔の開発と進化の歴史。 Anesthesiology 2003; 98:1503–1508。
- ストリチャーツGR:局所麻酔薬:実験薬理学ハンドブック。 Springer-Verlag、1987年。
- de Jong RH:局所麻酔薬。 Mosby-Year Book、1994年。
- キーTE:外科麻酔の歴史。 ウッドライブラリー、麻酔学博物館、1996年。
- バターワースJFIV、ストリチャーツGR:局所麻酔の分子メカニズム:レビュー。 麻酔学1990;72:711–734。
- テッツラフJ:局所麻酔薬の臨床薬理学。 バターワースハイネマン、2000年。
- Ahern CA、Payandeh J、Bosmans F、ChandaB.電位依存性ナトリウムチャネル銀河へのヒッチハイカーのガイド。 JGenPhysiol。 2016; 147:1–24。
- de Lera Ruiz M、Kraus RL 電位依存性ナトリウムチャネル:構造、機能、薬理学、および臨床適応症。 JMedChem。 2015; 58:7093–7118。
- Lopreato GF、Lu Y、Southwell A、et al:脊椎動物におけるナトリウムチャネル遺伝子の進化と分岐。 Proc Natl Acad Sci USA 2001; 98:7588–7592。
- Savio-Galmiberti E. Gollob MH、Darbar D:電位依存性ナトリウムチャネル:生物物理学、薬理学、および関連するチャネロパチー。 Front Pharmacol 2012; 3:1–19
- Chen-Izu Y、Shaw RM、Pitt GS、他Na +チャネルの機能、規制、構造、人身売買および隔離。 J生理学。 2015; 593:1347–1360
- Hille B:興奮性膜のイオンチャネル、第3版。 シナウアー、2001年。
- Jiang Y、Lee A、Chen J、et al:電位依存性K+チャネルのX線構造。 Nature 2003; 423:33–41。
- Freites JA、TobiasDJ。 膜の電圧検知:巨視的電流から分子運動まで。 JMembrBiol。 2015; 248:419–430。
- テイラーRE。 イカ軸索膜の電気的性質に及ぼすプロカインの影響Am J Physiol 1959; 196:1070-1078。
- ストリチャーツGR。 リドカインの四級誘導体による有髄神経のナトリウム電流の抑制。 JGenPhysiol。 1973; 62:37–57。
- Ragsdale DS、McPhee JC、Scheuer T、et al:局所麻酔薬によるNa+チャネルの状態依存性遮断の分子決定因子。 Science 1994; 265:1724–1728。
- Wang GK、Quan C、Wang S:電位依存性mu1Na+チャネルにおけるベンゾカインおよびエチドカインの一般的な局所麻酔薬受容体。 Pflugers Arch 1998; 435:293–302。
- Sudoh Y、Cahoon EE、Gerner P、et al:長時間作用型局所麻酔薬としての三環系抗うつ薬。 痛み2003;103:49–55。
- Kohane DS、Lu NT、Gokgol-Kline AC、et al:invivoでのラット坐骨神経ブロックに対するサキシトキシン相同体の局所麻酔特性と毒性。 Reg Anesth Pain Med 2000; 25:52–59。
- バターワースJFIV、ストリチャーツGR:アルファ2-アドレナリン作動薬であるクロニジンとグアンファシンは、ラットの坐骨神経線維において強直性および相性の伝導遮断を引き起こします。 Anesth Analg 1993; 76:295–301。
- Sanchez V、Arthur GR、Strichartz GR:局所麻酔薬の基本的な特性。 I.リドカインのイオン化とオクタノール:バッファー分配の溶媒と温度への依存性。 Anesth Analg 1987; 66:159–165。
- Strichartz GR、Sanchez V、Arthur GR、他:局所麻酔薬の基本的な特性。 II。 測定されたオクタノール:臨床的に使用される薬物の緩衝液分配係数とpKa値。 Anesth Analg 1990; 71:158–170。
- Popitz-Bergez FA、Leeson S、Strichartz GR、et al:末梢神経ブロック中の機能障害と神経内局所麻酔薬との関係。 ラット坐骨神経の研究。 Anesthesiology 1995; 83:583–592。
- Sinnott CJ、Cogswell LP III、Johnson A、et al:エピネフリンがリドカインの末梢神経ブロックを増強するメカニズムについて。 Anesthesiology 2003; 98:181–188。
- 中村T、Popitz-Bergez F、Birknes Jら:invivoでの末梢神経のリドカインブロックの濃度の重要な役割:ラットにおける機能と薬物摂取の研究。 Anesthesiology 2003; 99:1189–1197。
- Brouneus F、Karami K、Beronius P、et al:薬物のイオントフォレーシス製剤に適用可能ないくつかの局所麻酔薬の拡散輸送特性。 Int J Pharm 2001; 218:57–62。
- Gissen AJ、Covino BG、Gregus J:局所麻酔薬に対する哺乳類の神経線維の感受性の違い。 麻酔学1980;53:467–474。
- Raymond SA、Gissen AJ:差動神経ブロックのメカニズム。 Strichartz GR(ed):実験薬理学ハンドブック:局所麻酔薬。 Springer-Verlag、1987年、95〜164ページ。
- Butterworth J、Ririe DG、Thompson RB、et al:正中神経ブロックの発症差:健康なボランティアにおけるメピバカインとブピバカインの無作為化二重盲検比較。 Br J Anaesth 1998; 81:515–521。
- Novakovic SD、Eglen RM、Hunter JC:神経系におけるNa+チャネル分布の調節。 Trends Neurosci 2001; 24:473–478。
- Covino BG、Vasallo HG:局所麻酔薬。 Grune&Stratton、1976年。
- Kohane DS、Lu NT、Cairns BE、et al:テトロドトキシン誘発神経ブロックに対するアドレナリン作動性アゴニストおよびアンタゴニストの効果。 Reg Anesth Pain Med 2001; 26:239–245。
- バターワースJFIV、ペンシルベニア州リーフ、ストリチャーツGR:プロカイン代謝物であるジエチルアミノエタノールのpH依存性局所麻酔活性。 Anesthesiology 1988; 68:501–506。
- Fagraeus L、Urban BJ、Bromage PR:妊娠初期の硬膜外鎮痛の広がり。 麻酔学1983;58:184–187。
- バターワースJFIV、ウォーカーFO、リサックSZ:妊娠はリドカインに対する正中神経感受性を増加させます。 麻酔学1990;72:962–965。
- Popitz-Bergez FA、Leeson S、Thalhammer JG、et al:妊娠中のラットと妊娠していないラットの鎮痛薬の違いと比較した神経内リドカインの取り込み。 Reg Anesth 1997; 22:363–371。
- スコットDB、ジェブソンPJ、ブレイドDPら:リグノカインとプリロカインの血漿レベルに影響を与える要因。 Br J Anaesth 1972; 44:1040-1049。
- Rosenberg PH、Veering BTh、Urmey WF:局所麻酔薬の最大推奨用量:多因子の概念。 Reg Anesth Pain Med 2004; 29:564–575。
- Taheri S、Cogswell LP III、Gent A、et al:局所麻酔薬のヒトα1-酸性糖タンパク質の主要な変異体への結合における疎水性およびイオン性因子。 J Pharmacol Exp Ther 2003; 304:71–80。
- Fragneto RY、Bader AM、Rosinia F、et al:妊娠中のリドカインのタンパク質結合の測定。 Anesth Analg 1994; 79:295–297。
- Thomas JM、Schug SA:局所麻酔薬の薬物動態における最近の進歩。 長時間作用型アミドエナンチオマーと持続注入。 Clin Pharmacokinet 1999; 36:67–83。
- Rothstein P、Arthur GR、Feldman HS、et al:小児の肋間神経ブロックに対するブピバカイン:血中濃度と薬物動態。 Anesth Analg 1986; 65:625–632。
- Bokesch PM、Castaneda AR、Ziemer G、et al:リドカインの薬物動態に対する右から左への心シャントの影響。 麻酔学1987; 67:739–744。
- Palkama VJ、Neuvonen PJ、Olkkola KT:健康なボランティアにおけるブピバカインエナンチオマーの薬物動態に対するイトラコナゾールの効果。 Br J Anaesth 1999; 83:659–661。
- Oda Y、Furuichi K、Tanaka K、et al:ヒト肝チトクロームP450による新しい局所麻酔薬ロピバカインの代謝。 麻酔学1995; 82:214–220。
- Ekstrom G、Gunnarsson UB:新しいアミド型局所麻酔薬であるロピバカインは、ヒト肝ミクロソームのチトクロームP450Aおよび1Aによって代謝されます。 Drug Metab Dispos 3; 1996:24–955。
- Hirota K、Browne T、Appadu BL、et al:局所麻酔薬はニューロンのL型Ca2 +チャネル上のジヒドロピリジン結合部位と相互作用しますか? Br J Anaesth 1997; 78:185–188。
- Olschewski A、Olschewski H、Brau ME、et al:ラット心筋細胞のATP依存性カリウムチャネルに対するブピバカインの効果。 Br J Anaesth 1999; 82:435–438。
- 杉本M、内田I、深見Sら:組換えGABA(A)受容体に対する局所麻酔薬のアルファおよびガンマサブユニット依存性効果。 Eur J Pharmacol 2000; 401:329–337。
- Englesson S、Grevsten S:局所麻酔薬の中枢神経系毒性に対する酸塩基変化の影響。 II。 Acta Anaesthesiol Scand 1974; 18:88–103。
- Feldman HS、Arthur GR、Covino BG:意識のある犬における静脈内ロピバカイン、ブピバカイン、およびリドカインの痙攣誘発薬と超痙攣薬の用量の全身毒性の比較。 Anesth Analg 1989; 69:794–801。
- Porter JM、Markos F、Snow HM、et al:犬のロピバカイン誘発性心毒性に対する呼吸および代謝pH変化と低酸素の影響。 Br J Anaesth 2000; 84:92–94。
- Chernoff DM:リドカインとブピバカインによるニューロンのナトリウム電流の相性抑制の速度論的分析。 Biophys J 1990; 58:53–68。
- Feldman HS、Covino BM、Sage DJ:孤立したモルモット心房における局所麻酔薬の直接変時作用および変力作用。 Reg Anesth 1982; 7:149–156。
- Reiz S、Nath S:局所麻酔薬の心毒性。 Br J Anaesth 1986; 58:736–746。
- McCaslin PP、Butterworth J:ブピバカインは、細胞外K +が増加すると新生児ラット心筋細胞の[Ca(2+)](i)振動を抑制し、細胞外Mg(2+)が増加すると逆転します。 Anesth Analg 2000; 91:82–88。
- Butterworth JF IV、Brownlow RC、Leith JP他:ブピバカインはサイクリック-3'、5'-アデノシン一リン酸の産生を阻害します。 心血管毒性に寄与する可能性のある要因。 麻酔学1993;79:88–95。
- Butterworth J、James RL、Grimes J:β2アドレナリン受容体に対するいくつかの同族列の局所麻酔薬の構造親和性関係と立体特異性。 Anesth Analg 1997; 85:336–342。
- Ohmura S、Kawada M、Ohta T、et al:ブピバカイン、レボブピバカイン、またはロピバカインを注入したラットにおける全身毒性と蘇生。 Anesth Analg 2001; 93:743–748。
- Dony P、Dewinde V、Vanderick B、et al:ラットにおける等効力用量でのロピバカインとブピバカインの毒性の比較。 Anesth Analg 2000; 91:1489–1492。
- Chang DH、Ladd LA、Copeland S、et al:羊における冠動脈内ブピバカイン、レボブピバカインおよびロピバカインの直接的な心臓への影響。 Br J Pharmacol 2001; 132:649–658。
- Groban L、Deal DD、Vernon JC、et al:リドカイン、ブピバカイン、レボブピバカイン、およびロピバカインの漸増的過剰投与後のプログラムされた電気刺激の有無にかかわらず心室性不整脈。 Anesth Analg 2000; 91:1103–1111。
- Groban L、Deal DD、Vernon JC、et al:麻酔をかけた犬におけるリドカイン、ブピバカイン、レボブピバカイン、およびロピバカインの漸増的過剰摂取後の心臓蘇生。 Anesth Analg 2001; 92:37–43。
- Groban L、Deal DD、Vernon JC、et al:局所麻酔薬の立体選択性または構造は、麻酔をかけた犬の心筋の鬱病を予測しますか? Reg Anesth Pain Med 2002; 27:460–468。
- Nath S、Haggmark S、Johansson G、et al:局所麻酔薬の抑制性および電気生理学的心毒性の差異:リドカインおよびブピバカインに特に関連した実験的研究。 Anesth Analg 1986; 65:1263–1270。
- Carpenter RL、Kopacz DJ、Mackey DC:ブタの皮膚切開からの失血を予測するためのレーザードップラー毛細血管血流測定の精度。 Anesth Analg 1989; 68:308–311。
- deShazo RD、Nelson HS:局所麻酔薬過敏症の病歴のある患者へのアプローチ:90人の患者の経験。 J Allergy Clin Immunol 1979; 63:387–394。
- Berkun Y、Ben-Zvi A、Levy Y、et al:局所麻酔薬に対する副作用の評価:236人の患者の経験。 Ann Allergy Asthma Immunol 2003; 91:342–345。
- Gissen AJ、Datta S、Lambert D:クロロプロカイン論争。 I.クロロプロカイン硬膜外の神経合併症を説明するための仮説。 Reg Anesth 1984; 9:124–134。
- Gissen AJ、Datta S、Lambert D:クロロプロカイン論争。 II。 クロロプロカインは神経毒ですか? Reg Anesth 1984; 9:135–145。
- ウィニーAP、ネイダーAM:サンタヤーナの予言は成就しました。 Reg Anesth Pain Med 2001; 26:558–564。
- Kouri ME、Kopacz DJ:脊髄2-クロロプロカイン:ボランティアにおけるリドカインとの比較。 Anesth Analg 2004; 98:75–80。
- Taniguchi M、Bollen AW、Drasner K:亜硫酸水素ナトリウム:クロロプロカイン神経毒性のスケープゴート? Anesthesiology 2004; 100:85–91。
- Lambert LA、Lambert DH、Strichartz GR:高濃度の局所麻酔薬による孤立した神経の不可逆的な伝導ブロック。 麻酔学1994;80:1082–1093。
- Gold MS、Reichling DB、Hampl KF、et al:ラットの一次求心性ニューロンにおけるリドカイン毒性。 J Pharmacol Exp Ther 1998; 285:413–421。
- Neal JM、Bernards CM、Butterworth JF 4th、他ASRAは、局所麻酔薬の全身毒性に関する助言を実践しています。 Reg AnesthPainMed。 2010; 35:152–61
- Corcoran W、Butterworth J、WellerRSなど。 局所麻酔薬による心臓毒性:学術麻酔科における現代の実践戦略の調査。 AnesthAnalg。 2006; 103:1322–6
- El-Boghdadly K、Chin KJ 局所麻酔薬の全身毒性:継続的な専門能力開発。 Jアナエスができます。 2016; 63:330–349
- Krismer AC、Hogan QH、Wenzel V、et al:硬膜外麻酔中の蘇生に対するエピネフリンまたはバソプレシンの有効性。 Anesth Analg 2001; 93:734–742。
- Mayr VD、Raedler C、Wenzel V、et al:ブピバカインの急速静脈内注射後の心停止のブタモデルにおけるエピネフリンとバソプレッシンの比較。 Anesth Analg 2004; 98:1426–1431。
- Weinberg GL、VadeBoncouer T、Ramaraju GA、et al:脂質注入による前処理または蘇生は、ラットのブピバカイン誘発性心静止に対する用量反応をシフトさせます。 麻酔学1998;88:1071-1075。
- Weinberg G、Ripper R、Feinstein DL、et al:脂質エマルジョン注入は、ブピバカインによって誘発された心臓毒性から犬を救います。 Reg Anesth Pain Med 2003; 28:198–202。
- Fettiplace MR、Weinberg G.脂質蘇生療法の過去、現在、そして未来。 JPENJ非経口経腸栄養剤。 2015; 39(1 Suppl):72S-83S。
- Soltesz EG、van Pelt F、Byrne JG:ブピバカインの心毒性のための緊急心肺バイパス。 J Cardiothorac Vasc Anesth 2003; 17:357–358。
- Vasques F、Behr AU、Weinberg G、他。 American Society of Regional Anesthesia Recommendationsの発行以降の局所麻酔薬の全身毒性症例のレビュー:誰に関係するか。 Reg AnesthPainMed。 2015; 40:698–705。
- Liu SS、Ortolan S、Sandoval MV、Curren J、Fields KG、Memtsoudis SG、YaDeau JT 末梢神経ブロック後の局所麻酔薬の全身毒性によって引き起こされる心停止と発作:私たちはまだ死神を恐れるべきか? Reg AnesthPainMed。 2016; 4:5–21。
- Barrington MJ、Kluger R.超音波ガイダンスは、末梢神経ブロック後の局所麻酔薬の全身毒性のリスクを軽減します。 Reg AnesthPainMed。 2013; 38:289–299。
- Neal JM、Brull R、Horn JL、他超音波ガイド下局所麻酔の第2016回米国地域麻酔および疼痛医学のエビデンスに基づく医療評価:エグゼクティブサマリー。 Reg AnesthPainMed。 41; 181:194–XNUMX

