Honorio T. Benzon、Rasha S. Jabri、Tom C. Van Zundert
はじめに
脊髄内血腫は、さまざまな原因から生じる比較的まれな状態です。 外傷性の原因には、腰椎穿刺と脊髄幹麻酔が含まれます。 抗凝固療法や血小板減少症の患者、腫瘍性疾患の患者、または肝疾患やアルコール依存症の患者に発生する可能性が高くなります。 全症例の約XNUMX分のXNUMXからXNUMX分のXNUMXが抗凝固療法に関連しています。 脊髄幹麻酔および鎮痛剤の投与後の脊髄内血腫形成のリスクは、抗凝固療法を受けた患者または凝固障害のある患者で増加します。 このため、凝固障害の存在下では、脊髄幹麻酔は禁忌となることがよくあります。 硬膜外血腫または脊髄血腫の発症のその他の危険因子には、脊椎の解剖学的異常および複数または血性の穿刺による脊髄幹麻酔の実施における技術的困難(複数回の試み)が含まれます。
脊髄硬膜外血腫の発生率は、当初、硬膜外麻酔の150,000万人に220,000人、脊髄くも膜下麻酔薬の2700万人に19,505人と報告されていました。 最近の疫学研究では、脊髄硬膜外血腫の発生率がより頻繁であり、1人に21,643人から3800人に200,000人の硬膜外麻酔に及ぶことが示されています。 最新の研究では、315回の硬膜外注射にXNUMX回の全体的なリスクが示されました。 高齢者(XNUMX人にXNUMX人)は、脊椎の変性異常、骨粗鬆症、末梢血管疾患のためにリスクが高くなります。 産科の集団は、おそらく妊娠の凝固亢進状態、若い出産者の硬膜外腔のより広い容量、およびより高い硬膜外圧に続発して、脊髄血腫の発生率が低いようです(XNUMX万人にXNUMX人)。 最近の大規模な後ろ向き研究に基づくと、異常な凝固を伴う患者の硬膜外血腫の発生率は、XNUMX人の患者にXNUMX人と低い可能性があります。
低分子量ヘパリン(LMWH)の導入は、脊髄硬膜外血腫の発生率の急上昇と関連しており、食品医薬品局(FDA)による警告と、患者の局所麻酔に関する最初のコンセンサスステートメントの導入をもたらしました。 1998年の米国地域麻酔疼痛医学会(ASRA)による抗凝固薬に関する研究。ガイドラインは、さまざまな抗凝固薬の文献と薬理学の広範なレビューに基づいていました。
脊髄幹麻酔のタイミング、硬膜外カテーテルの除去、およびその後の抗凝固剤の投与について推奨が行われました。 特に、硬膜外注入(モニタリングを容易にするために運動強度を維持するため)およびその後の神経学的モニタリングのための低濃度の局所麻酔薬の使用がASRAによって推奨されました。 1998年に公開され、2003年と2010年に更新されたコンセンサスガイドラインは、抗凝固療法の設定における脊髄幹麻酔の使用に関する意思決定において臨床医を大いに助けました。 欧州麻酔学会とスカンジナビア麻酔学会および集中治療医学によって発行された他のXNUMXつのガイドラインは、ヨーロッパで影響力があります。
この章では、一般的な抗凝固剤の重要性について説明し、臨床診療における脊髄幹麻酔と末梢神経ブロック(PNB)の使用に関する意思決定のガイドを読者に提供したいと考えています。 また、最新のASRAガイドラインでは十分にカバーされておらず、ヨーロッパおよびスカンジナビアのガイドラインでは部分的にしかカバーされていない新しい抗凝固薬についても説明します。 詳細については、リンクをたどってください 脊髄および末梢神経血腫の診断と管理。
抗血小板療法
抗血小板薬は、血小板シクロオキシゲナーゼ酵素を阻害し、トロンボキサンA2の合成を防ぎます。 トロンボキサンA2は、二次血小板凝集および放出反応を促進する強力な血管収縮剤です。 凝固および止血における血小板の役割は、 図1 & 2。 これらの薬を服用している患者の血小板は、内皮下層への正常な血小板の付着と正常な一次止血プラグの形成を示します。 潜在的に壊れやすいものの、適切な血餅が形成される可能性があります。 そのようなプラグは、より小さな血管病変に対して十分な止血バリアであるかもしれないが、それらは、適切な周術期の止血血餅形成を保証しないかもしれない。 抗血小板薬を服用している患者の血小板機能は、アスピリンで1週間、非ステロイド性抗炎症薬(NSAID)で1〜6日間低下すると想定する必要があります。 この仮定は、新しい機能的な血小板の継続的な形成を考慮していません。 すでに循環している血小板の残存機能と組み合わされた、新鮮な正常に機能している血小板の継続的な産生は、これらの患者で脊髄幹麻酔を行うことの相対的な安全性を説明するかもしれません。
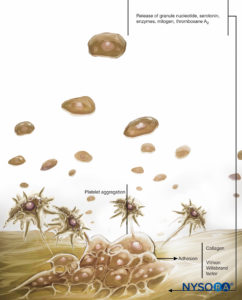
図1 凝固における血小板の役割。 血小板は、接着、活性化(および分泌)、および凝集というXNUMXつの基本的な反応を通じて止血における役割を果たします。 血管内皮が損傷すると、血小板は接着と呼ばれるプロセスによって内皮下層に急速に結合します。
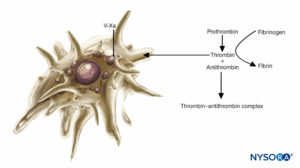
図2 凝固における血小板の役割:血小板は血漿凝固反応をサポートします。 活性化されると、血小板はいくつかの血漿タンパク質複合体に結合し、活性化された形態の第V因子(第Va因子)を分泌します。これは血小板表面に結合し、第Xa因子に結合します。 次に、血小板結合因子Xaは、プロトロンビンからトロンビンへの変換を加速します。
抗血小板療法を受けている患者の硬膜外および脊髄硬膜外血腫のリスクは、アスピリン摂取歴のある患者に脊髄または硬膜外麻酔がない場合の自発的な硬膜外血腫形成の症例報告によって高められています。 Vandermeulenらは、脊髄くも膜下麻酔後に発生した脊髄くも膜下血腫の3例のうち61例に抗血小板療法を関与させました。 他の研究では、脊髄幹麻酔を受けているアスピリンまたはNSAIDの患者の脊髄血腫のリスクが比較的低いことが示されています。 妊娠中の共同低用量アスピリン研究(CLASP)グループには、毎日1422 mgのアスピリンを投与され、神経学的後遺症なしに硬膜外麻酔を受けた60人の高リスク産科患者が含まれていました。 複数の抗血小板薬を服用していた患者の1013%を含む患者の39%が抗血小板薬を服用した11の脊髄および硬膜外麻酔薬の遡及的研究では、脊髄硬膜外血腫の兆候を示した患者はいませんでした。
しかし、抗血小板薬を服用している患者は、脊髄または硬膜外針またはカテーテルを介した血液吸引の発生率が高いことを示しました。 1000人の患者を対象としたその後の前向き研究では、その39%が術前の抗血小板療法を報告し、出血性合併症がないことを指摘しました。 したがって、術前の抗血小板療法は、血の針やカテーテルの留置の危険因子ではありませんでした。 女性の性別、年齢の増加、過度のあざや出血の病歴、継続的なカテーテル技術、大きな針ゲージ、複数回の試み、および針の配置の困難さが重大な危険因子であることが指摘されました。 ペインクリニックの患者を対象とした臨床試験は、手術を受けた患者と同様です。 硬膜外ステロイド注射を受けたアスピリンまたはNSAIDの患者は、脊髄内血腫の兆候または症状を発症しませんでした。
抗血小板薬と血小板またはカテーテル留置との間に相関関係がないことは、術前の抗血小板療法が、抗血小板療法を受けている患者の脊髄硬膜外血腫による神経機能障害の発症の重大な危険因子を表していないといういくつかの証拠を提供します。 アスピリンまたはNSAIDの患者の脊髄内血腫の症例報告がありましたが、これらの症例報告には複雑な要因があったことに注意する必要があります。 これらには、ヘパリンの併用投与、硬膜外静脈血管腫の併存、および手技の実施における技術的困難が含まれていました。 最近では、痛みの介入手順、特に脊髄刺激装置に関連して、脊髄血腫の症例報告がさらに発表されています。
入手可能なエビデンスに基づいて、ASRAは抗血小板薬に関していくつかの推奨事項を作成しました。 術前の抗血小板療法は、抗血小板療法を受けている患者の脊髄硬膜外血腫による神経学的機能障害の発症の重大な危険因子ではありません。 ただし、出血性合併症のリスクは、いくつかの抗血小板薬と、経口抗凝固薬、標準ヘパリン、LMWHなどの凝固メカニズムに影響を与える他の薬の同時使用の患者で増加する可能性があります。
NYSORAのヒント
- アスピリンとNSAIDを使用している患者では、脊髄くも膜下麻酔と局所麻酔を行うのがおそらく安全です。
- 出血と脊髄硬膜外血腫の増加の危険因子には、患者がいくつかの抗血小板薬を摂取し、複数回試行することが含まれます。
アスピリンと介入による痛みの手順
アスピリン単独、NSAID単独、またはASRAガイドラインに従った患者において、硬膜外ステロイド注射または脊髄刺激装置の配置または除去後の脊髄血腫の症例報告がいくつかあります。 これらの発生は、これらの患者に見られる頻繁な脊椎異常、脊椎手術後の線維症の存在、脊髄刺激装置の配置に使用されるより大きな針、または電極の頻繁な操作(前進および収縮)に関連している可能性があります。
痛みの管理に使用される薬も出血を引き起こします。 これらには、オクスカルバゼピンおよび選択的セロトニン再取り込み阻害薬が含まれます。 これらの理由から、ASRAは、欧州地域麻酔および疼痛治療学会、米国疼痛医学アカデミー、国際神経調節学会、北米神経調節学会、および世界疼痛研究所と連携して、介入的疼痛処置に関する特定のガイドラインを策定しました。 。 ASRAの局所麻酔ガイドラインとは対照的に、多社会ガイドラインでは、介入的疼痛処置の前にアスピリンを4〜6日間停止することを推奨しています。
NYSORAのヒント
抗血小板薬および抗凝固薬を服用している患者の介入的疼痛処置に関するガイドラインは、局所麻酔に関するガイドラインよりも制限が厳しくなります。
COX-2阻害剤およびP2Y12阻害剤
シクロオキシゲナーゼ-2(COX-2)阻害剤は、その鎮痛特性と血小板および胃腸への影響の欠如のために人気を博し、研究により、さまざまな周術期の設定での鎮痛特性が示されています。
この薬は胃腸(GI)毒性が最小限であり、重篤な上部消化管有害事象のリスクが高い患者に理想的です。 アスピリンまたはNSAIDと比較して、血小板凝集および出血時間に対するCOX-2阻害剤の効果はプラセボと異ならなかった。 COX-2阻害剤を術前に投与した場合、脊椎固定術中に失血は増加しません。 これらの薬剤の血小板特性により、脊髄幹麻酔が計画されている場合の周術期の使用に理想的です。 残念ながら、ロフェコキシブとバルデコキシブは心血管系の副作用のために市場から撤退し、セレコキシブのみが利用可能になりましたが、以前に推奨されていたよりも低い投与量でした。
チエノピリジン薬のチクロピジンとクロピドグレルは、アラキドン酸代謝に直接影響を与えません。 これらの薬剤は、アデノシン二リン酸(ADP)受容体を介した血小板の活性化を阻害することにより、血小板の凝集を防ぎます。 それらはまた血管平滑筋を調節し、血管収縮を減少させます。 チクロピジンは、好中球減少症、血小板減少性紫斑病、および高コレステロール血症を引き起こすため、めったに使用されません。
クロピドグレルは、その改善された安全性プロファイルと証明された有効性のために好まれます。 末梢血管疾患の患者では、アスピリンよりも優れていることが認められました。 クロピドグレルによるADP誘発血小板凝集の最大阻害は、標準用量(3 mg)の開始後5〜75日で発生しますが、4〜6 mgの大量負荷用量の投与後300〜600時間以内に発生します。 通常、患者が経皮的冠動脈インターベンション(PCI)を受ける前に、大量の負荷が患者に与えられます。 チクロピジンを服用している患者の脊髄血腫の症例報告があります。 クロピドグレル単独の患者で脊髄内血腫の症例はありませんでしたが、クロピドグレル、ジクロフェナク、およびアスピリンの患者で四肢麻痺の症例が報告されています。
チエノピリジン薬の場合、脊髄幹麻酔の前に、チクロピジンを10〜14日間、クロピドグレルを7日間中止することをお勧めします。 クロピドグレル中止5日後の脊髄くも膜下麻酔の安全性に関する症例報告があります。 ある研究によると、ほとんどの患者は、クロピドグレルを中止してから5日後に血小板阻害が最小限に抑えられました。 クロピドグレルの中止から5〜6日後に脊髄幹麻酔を行う必要がある場合は、血小板活性の阻害を最小限に抑えるか、まったく阻害しないように、P2Y12アッセイまたは別の適切な検査を行う必要があります。
NYSORAのヒント
- ASRAガイドラインでは、クロピドグレルの中止と脊髄幹麻酔の間に7日間の間隔を設けることを推奨しています。
- 脊髄または硬膜外麻酔を実施する必要がある場合は、血小板機能の検査を行って、残存する血小板阻害がなくなったか、無視できることを確認することをお勧めします。
脊髄刺激試験では、試験中に患者がクロピドグレルを中止するため、5日間の中止が観察される場合があります。 適切な血小板活性を確保するために、血小板機能のテスト(たとえば、VerifyNow P2Y12アッセイまたはトロンボエラストグラフ[TEG]の血小板マッピング部分)を実行する必要があります。
新しい抗血小板薬
クロピドグレルは、急性冠症候群の患者において、アスピリンがP2Y12受容体阻害剤と組み合わされる、二重抗血小板療法で一般的に使用される抗血小板薬です。 プラスグレルはクロピドグレルに似たプロドラッグですが、クロピドグレルよりも有益な特徴があり、チカグレロルは直接作用型のP2Y12受容体阻害剤です。 効果が最大になるまでの時間の中央値は、プラスグレルで1時間、クロピドグレルで4時間です。 プラスグレルで血漿中濃度がピークに達するまでの平均時間は30分で、半減期の中央値は3.7時間です。 P2Y12受容体の阻害は不可逆的であるため、これらの値は血小板阻害の期間を反映していません。 プラスグレルを止めてから血小板活性が正常化するまで7日かかります。
プラスグレルとチカグレロルは、クロピドグレルの90%〜60%と比較して、血小板機能の70%の阻害を引き起こします。 ボディマス指数(BMI)が低い患者、75歳以上の患者、および脳卒中の病歴のある患者は、出血のリスクがあります。 クロピドグレルとは異なり、プラスグレルは確実にその活性代謝物に変換され、薬物相互作用はありません。 また、遺伝子多型の影響を受けません。
チカグレロルはP2Y12受容体に可逆的に結合し、ADPを介した受容体の活性化をブロックします。 チエノピリジンとは対照的に、活性代謝物と親薬物は抗血小板活性を示し、親薬物はinvivoでの血小板阻害の大部分を担っています。 チカグレロルの抗血小板効果は急速です。 血小板阻害のピークは、クロピドグレルの2時間と比較して、摂取後4〜24時間で発生します。 チカグレロルによる平均血小板阻害は、クロピドグレルの93%と比較して58%です。 血小板の回復はチカグレロルで迅速です。 血小板活性は、最後の投与から5日後に正常です。
抗血小板薬の中止/再開から脊髄幹麻酔までの時間
抗血小板薬の中止と脊髄幹麻酔の間隔は、血小板阻害率と血小板代謝回転率に基づいています。 プラスグレルとチカグレロルは90%の抑制を引き起こします。 循環血小板プールの15〜50%が毎日形成され、薬剤の中止後75〜5日で循環血小板プールの7〜5%を占める新しい血小板が生じます。 チカグレロルには7〜7日の間隔、プラスグレルには10〜7日の間隔が推奨されています。 血小板凝集はプラスグレルを止めてから5日後とチカグレロルを止めてからXNUMX日後に正常化するため、これらの推奨事項は適切です。
スカンジナビアのガイドラインでは、カテーテルの抜去時に抗血小板薬を再開することは許容されますが、欧州麻酔学会のガイドラインでは、硬膜外カテーテルの抜去からプラスグレルまたはチカグレロルの再開までに6時間の間隔を推奨しています。 他のレビューでは、プラスグレルとチカグレロルは迅速な効果と強力な抗血小板阻害作用があるため、再起動には注意が必要です。 これらのエージェントには、24時間間隔がより適切な場合があります。
NYSORAのヒント
- プラスグレルとチカグレロルは、脊髄または硬膜外の前に、それぞれ7日と5日停止する必要があります。
- 抗血小板薬は、脊髄幹麻酔またはカテーテル除去の6〜24時間後に再開できます。
血小板機能のモニタリング
アイビーの出血時間は、抗血小板薬を投与されている患者の異常出血の信頼できる予測因子であると考えられていました。 ただし、アスピリン投与後の出血時間は、血小板機能の信頼できる指標ではありません。 試験結果には患者内および患者間の大きなばらつきがあり、アスピリン誘発性の出血時間の延長と外科的失血との相関関係を研究が示していないため、出血時間が止血機能を予測できることを示唆する証拠はありません。 。
血小板の凝集と脱顆粒を監視するための特別な血小板機能アッセイが利用可能になりました。 血小板機能分析装置(PFA)は、invitroでの血小板機能のテストです。 これはフォンウィルブランド病の優れたスクリーニングテストであり、デスモプレシン投与の効果を監視します。 PFAは、抗血小板療法後に延長されます。 残念ながら、PFA-100は、P2Y12阻害剤であるクロピドグレル、プラスグレル、およびチカグレロルの抗血小板機能を監視するための高感度テストではありません。 ただし、PFA-200の最近のアップデートであるPFA-100は、P2Y12阻害剤の効果に敏感であるようです。 ただし、この新しいPFAテストに関するポイントオブケア研究はまだ不足しています。
P2Y12受容体活性をモニターする新しいテストには、血管拡張因子刺激リン酸化タンパク質(VASP)アッセイ、VerifyNowアッセイ、複数血小板凝集測定テスト(Multiplate)、およびトロンボエラストグラフ(TEG)の血小板マッピングコンポーネントが含まれます。 VerificationNowアッセイは、アスピリンとP2Y12阻害剤の抗血小板効果を監視できます。 TEGの血小板マッピングコンポーネントは、外科および麻酔学で一般的に使用されていますが、VerifyNowは臨床心臓病学の主要なアッセイです。 血小板機能のモニタリングに関するレビューは、いくつかのレビューで議論されており、この章の範囲を超えています。
経口抗凝固薬
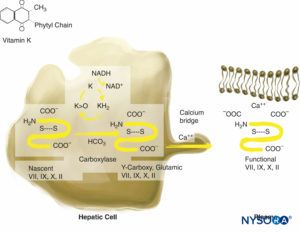
ワルファリンは、ビタミンK依存性凝固因子(VII、IX、X、およびトロンビン)の合成を妨げることによってその抗凝固効果を発揮します(図3)。 また、抗凝固タンパク質CおよびSを阻害します。第VII因子の半減期は比較的短く(6〜8時間)、プロトロンビン時間(PT)は1.5〜2以内に治療範囲(通常の24〜36倍)に延長される可能性があります。時間。 抗凝固剤プロテインCも半減期が短い(6〜7時間)。 国際感度指標(INR)の最初の延長は、第VII因子とプロテインCの減少による競合効果と、既存の凝固因子の洗い流しの結果です。 このため、ワルファリンによる治療の初期段階では、INRは予測できません。 第VII因子は外因性経路にのみ関与し、生物学的に活性な第II因子(半減期50時間)とXのレベルが十分に低下するまで、適切な抗凝固は達成されません。 これには4〜5日かかります。 治療の最初の15〜2日間は、高負荷用量のワルファリン(3 mg)が使用されることがあり、48〜72時間以内に目的の抗凝固効果が得られます。 ワルファリンの抗凝固効果は、新しい生物学的に活性なビタミンK因子が合成されている間、治療終了後4〜6日間持続します。 ワルファリン療法の欠点には、INRの連続モニタリングでその効果をモニタリングする必要性、他の薬剤との相互作用、および手術の数日前に中止する必要があることが含まれます。 ワルファリンの効果は、新鮮凍結血漿の輸血とビタミンK注射によって元に戻すことができます。 3因子または4因子プロトロンビン複合体濃縮物(PCC)は、緊急事態でワルファリンに拮抗するために使用できます。
脊髄または硬膜外カテーテルが留置され、その後ワルファリンで抗凝固療法を受けた患者の脊髄血腫のリスクに関するデータはほとんどありません。 OdoomとSihは、血管手術を受け、術前の経口抗凝固薬を投与された1000人の患者に950回の連続腰部硬膜外麻酔を実施しました。 硬膜外留置前のすべての患者で、トロンボテスト(第IX因子活性のテスト)が減少し、活性化部分トロンボプラスチン時間(aPTT)が延長されました。 ヘパリンも術中に投与された。 硬膜外カテーテルは術後48時間留置され、神経学的合併症はありませんでした。 残念ながら、カテーテル抜去時の患者の凝固状態は記載されていませんでした。 この研究の結果は心強いものですが、カテーテル除去時の患者の未知の凝固状態と組み合わされた抗凝固の尺度としてのトロンボテストの時代遅れの性質は、研究の有用性を制限します。
留置硬膜外または髄腔内カテーテルの使用と、抗凝固療法を受けた患者におけるその除去のタイミングについては議論の余地があります。 針留置の外傷は、単回投与と連続カテーテルの両方の技術で発生しますが、留置カテーテルの存在は、組織と血管構造に追加の損傷をもたらす可能性があります。
脊髄内血腫はカテーテルの抜去後に発生したため、硬膜外カテーテルの留置と抜去にも同じ検査値を適用することをお勧めします。 人工膝関節全置換術後に低用量ワルファリンと併用して術後硬膜外鎮痛を受けた192人の患者で脊髄血腫は報告されなかった。
この研究では、患者はPTを15.0〜17.3秒に延長するためにワルファリンを投与されました。 硬膜外カテーテルは37±15時間(範囲13〜96時間)留置されたままにされました。 硬膜外カテーテル抜去時の平均PTは13.4±2秒(範囲10.6〜25.8秒)でした。 この研究およびその後のいくつかの研究では、硬膜外カテーテルが留置されている患者における低用量のワルファリン抗凝固療法の相対的な安全性が実証されています。 別の研究では、ワルファリン摂取後1.9〜12時間以内に行われる限り、硬膜外カテーテルの除去にはより高いINRレベル(最大14)が許容されることが示されました。 ある研究では、INRが著しく上昇していても、ワルファリン摂取の2〜3日後に硬膜外カテーテルを抜去したときに脊髄血腫が見られなかったことが示されました。 凝固因子VII、IX、およびXのレベルが低い場合(第II因子のレベルはまだ許容できる場合があります)、ワルファリンの開始から3日後に硬膜外カテーテルを抜去する方法を研究する必要があります。 ワルファリンに対する患者の反応は大きく異なるため、これは特に当てはまります。一部の著者は、過度のPT延長を避けるために、凝固状態を綿密に監視することを推奨しています。 長期のPTおよびPTTの原因となる要因は、 図4 & 5.
ASRAは、脊髄幹神経ブロックのパフォーマンスに許容できるものとして、1.4以下のINR値を推奨しました。 この値は、INR値が1.5以下のときに優れた周術期止血を示した研究に基づいています。 さまざまなINR値での凝固因子のレベルに関する研究では、これらの因子の低下は、INR1.5では有意ではない可能性があることが示されています。 1.5〜2.0のINR値では、第II因子の濃度はベースラインの74%〜82%であるのに対し、第VII因子のレベルはベースライン値の27%〜54%でした。
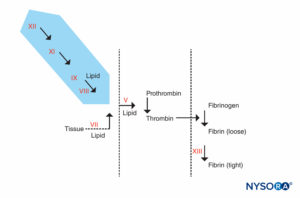
図4 凝固反応。 長期のPTTの原因となる要因は、影付きの領域にあります。 PTTが異常であるが、PTやその他の検査が正常である患者は、出血しやすい患者とそうでない患者の2つのグループに分けることができます。 出血しない患者は、PTTが極端に長くなる(90秒以上)が、出血の病歴がない場合があります。 それらは、第XII因子、プレカリクレイン、または高分子キニノゲンが不足しています。 これらの患者は、手術または硬膜外麻酔を拒否されるべきではありません。 他のグループである出血した患者は、PTTの延長と出血の病歴の両方を持っています。 それらは、第VIII因子(血友病A)、第IX因子(血友病Bまたはクリスマス病)、または第XI因子の欠乏症になります。
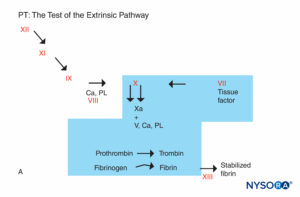
図5A。 凝固反応。 PTに関係する要因は影付きの領域にあります。 PTは、カルシウムまたはリン脂質とともに組織因子の供給源を患者の血漿に加えることによって実行されます。 組織因子は第VII因子と複合体を形成し、活性化します。 (Ca、カルシウム; PL、リン脂質。)
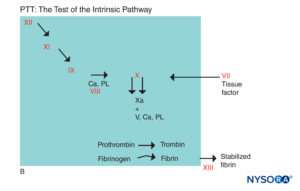
図5B。 凝固反応。 PTTに関係する要素は、影付きの領域にあります。 PTTの評価では、凝固は、ハーゲマン因子-キニノーゲン-プレカリクレイン複合体を活性化する薬剤によって開始されます。 因子VIIおよびXIII、それらを架橋することによってフィブリン血餅を安定化するタンパク質、および線維素溶解系の成分を除いて、ほとんどの凝固因子はPTTによってスクリーニングされます。 (Ca、カルシウム; PL、リン脂質。)
ワルファリン投与の初期段階でのINR値2.1±1では、因子IIおよびVIIは対照値の65±28%および25±20%でした。 40%の活動は、大手術時の正常な止血に十分であると考えられています。 別の研究では、INRが1.3〜2で、ワルファリンによる安定した抗凝固療法の下で、凝固因子VII、IX、およびXの濃度が正常範囲内にあることがわかりました。
臨床医は、凝固カスケードに対するワルファリンの効果と、この効果のモニタリングにおけるINRの役割を認識している必要があります。 合併症のリスクを最小限に抑えるために、ASRAはいくつかの予防策を推奨しています。 慢性経口ワルファリン療法を中止し、脊髄幹麻酔を行う前にINRを測定する必要があります。 凝固メカニズムに影響を与えるアスピリン、NSAID、ヘパリンなどの他の薬剤を同時に使用すると、INRに影響を与えることなく出血性合併症のリスクが高まります。 手術前にワルファリンの初回投与が行われた場合、24時間以上前に投与されたかどうかINRを確認する必要があります。 硬膜外鎮痛中に患者が低用量のワルファリン治療(平均5日量約36 mg)を受けている場合、最初の用量が3時間以上前に投与された場合は、INRを毎日チェックし、カテーテルを抜去する前にチェックする必要があります。 より高い24日の投与量は、より集中的なモニタリングを必要とするかもしれません。 硬膜外血腫および血腫を予防するために、脊髄幹麻酔を留置している患者のINRがXNUMXを超える場合は、ワルファリンの投与量を維持または減らす必要があります。 ワルファリン療法中は、硬膜外鎮痛薬の注入中、およびカテーテルを抜去してからXNUMX時間後に、患者の神経学的状態を定期的にチェックする必要があります。 感覚および運動ブロックの程度を最小限に抑えるために、局所麻酔薬の希釈濃度を利用する必要があります。 脊髄幹麻酔の注入中に治療レベルの抗凝固療法を受けている患者の脊髄幹麻酔の除去または維持について決定を下す際には、臨床的判断を下す必要があります。 ワルファリンの投与量は、薬剤に対する反応が増強される可能性が高い患者、特に高齢者には減らす必要があります。 慢性経口抗凝固療法を受けている患者の場合、ワルファリンを中止し、INRを測定する必要があります。
NYSORAのヒント
- 容易な傷つきやすさと正常な肝機能がない場合、1.4のINRは、脊髄幹神経ブロックを計画している患者の脊髄幹麻酔の前に許容されます。
- 患者が24時間以上前にワルファリンを服用した場合は、INRを確認する必要があります。
- ワルファリンが停止されてから5日後、脊髄幹麻酔の前に、INRは正常である必要があります
ヘパリン
静脈内ヘパリン
ヘパリンは、アンチトロンビンに結合することによって抗凝固効果を発揮する複雑な多糖類です。 アンチトロンビンのコンフォメーション変化は、トロンビン因子XaおよびIXaを不活性化する能力を加速します。
未分画ヘパリンは、内皮から組織因子経路阻害剤を放出し、第Xa因子に対するその活性を増強します。 皮下ヘパリンの抗凝固効果には1〜2時間かかりますが、静脈内ヘパリンの効果はすぐに現れます。 実際、凝固時間は、2単位のヘパリンの静脈内注射の4分後にベースラインレベルの5〜10,000倍延長されます。 ヘパリンの半減期は1.5〜2時間です。 ヘパリンの治療用量は、投与後4〜6時間で終了します。 aPTTは、ヘパリンの効果を監視するために使用されます。 治療的抗凝固療法は、ベースライン値の1.5倍を超えるaPTTの延長、または0.2〜0.4 U/mLのヘパリンレベルで達成されます。 aPTTは通常、低用量のヘパリンの皮下投与によって延長されず、監視されません。 プロタミンは、静脈内投与されたヘパリンの効果を中和します。
ヘパリンは分子の混合物であり、その一部だけが抗凝固活性を持っているため、理想的な抗凝固剤ではありません。 血小板第4因子とフォンウィルブランド因子に結合します。 ヘパリン-アンチトロンビン複合体は、血餅に結合したトロンビンを中和するのにもあまり効果的ではありません。 最後に、ヘパリンは免疫学的血小板減少症および免疫介在性血栓症に関連しています。 標準的なヘパリン療法を受けている患者の場合、アスピリン、NSAID、LMWH、経口抗凝固薬など、他の凝固メカニズムに影響を与える他の薬剤が存在すると、出血性合併症のリスクが高まります。 いくつかの研究は、特定の予防措置が観察された場合、脊髄または硬膜外麻酔とそれに続く全身ヘパリン化の安全性を実証しています。 RaoとEl-Etrは、継続的な脊髄または硬膜外麻酔下で下肢血管手術を受けた4000人以上の患者に脊髄血腫がないことを報告しました。 彼らの研究では、既存の凝固障害のある患者を除外し、カテーテル留置の少なくとも60分後にヘパリン化を行い、抗凝固のレベルを注意深く監視し、ヘパリン活性が低いときに留置カテーテルを取り外しました。 針に率直な血液が認められた患者の手術は中止され、翌日全身麻酔下で行われた。 同じ発見は、神経学の文献のその後の報告で指摘されました。 Ruff and Doughertyは、脳虚血の評価のために腰椎穿刺とその後のヘパリン化を受けた7人中342人(2%)の患者に脊髄硬膜外血腫を認めました。
処置中の血液の存在、併用アスピリン療法、および1時間以内のヘパリン化は、脊髄血腫の発症の危険因子として特定されました。 ASRAは、術中の抗凝固療法の存在下で脊髄幹麻酔を使用する場合について、いくつかの推奨事項を示しています。 ASRAは、他の凝固障害のある患者ではこの技術を避けるべきであるとアドバイスしています。 針の配置とヘパリン投与の間に少なくとも1時間の遅延があるはずです。 カテーテルは、最後のヘパリン投与の2〜4時間後、およびその後のヘパリン投与の1時間前に取り外す必要があります。 過度のヘパリン効果を回避するために、aPTTまたは活性化凝固時間(ACT)を監視する必要があります。 運動ブロックの再発を早期に発見するために、術後に患者を追跡する必要があります。 運動ブロックを最小限に抑えるために、局所麻酔薬の希釈濃度をお勧めします。
外傷性(血性)または困難な針の配置の場合にはリスクが高まる可能性がありますが、手術の強制的なキャンセルをサポートするデータはありません。 続行するかどうかの決定は、適切な臨床的判断と外科医および患者との完全な話し合いに基づいて行う必要があります。
NYSORAのヒント
- 脊髄幹麻酔とヘパリンの再投与の間には、少なくとも1時間の遅延が必要です。
- カテーテルは、最後のヘパリン投与の2〜4時間後に取り外すことができます。
心肺バイパスを受ける患者では、脊髄幹麻酔が行われることがあります。 これらの患者の脊髄内血腫の発症を防ぐために、以下の予防措置が推奨されています。
- 既知の凝固障害のある患者では、脊髄幹麻酔は避けるべきです。
- 外傷性タップのある患者では、手術を24時間遅らせる必要があります。
- 脊髄幹麻酔から全身ヘパリン化までの時間は1時間を超える必要があります。
- ヘパリン化と逆転は、厳重に監視および制御する必要があります。
- 正常な凝固が回復したら硬膜外カテーテルを抜去し、脊髄血腫の兆候がないか患者を注意深く監視する必要があります。
皮下ヘパリン
低用量の5000日8回皮下ヘパリン(12〜5000時間ごとに40単位)の治療の基礎は、活性化第X因子のヘパリン媒介阻害です。血栓塞栓性疾患の治療としてではなく予防として投与する場合は、より少量のヘパリンが必要です。 50単位のヘパリンの筋肉内または皮下注射後、最大の抗凝固効果が4〜6分で観察され、XNUMX〜XNUMX時間以内にベースラインに戻ります。 aPTTは正常範囲に留まる可能性があり、多くの場合監視されません。 ただし、皮下ヘパリンに対する個々の患者の反応には大きなばらつきが報告されています。 脊髄幹麻酔は皮下(少量)予防中に禁忌ではありませんが、神経ブロック後までヘパリン投与を遅らせることで出血のリスクを減らすことができます。 出血は、衰弱した患者または長期の治療後に増加する可能性があります。 XNUMX日XNUMX回の未分画ヘパリンの皮下投与による抗凝固療法の存在下での主要な脊髄幹麻酔の安全性は、いくつかの研究によって実証されています。 ほとんどの病院では、術後の静脈血栓塞栓症の発生率を減らすために、XNUMX日XNUMX回の皮下ヘパリンレジメンがXNUMX日XNUMX回のレジメンに置き換えられています。 ただし、この慣行は自然発生的な血腫に関連付けられています。 このため、最新のASRAガイドラインでは、より多くのデータが利用可能になるまで、XNUMX日XNUMX回のレジメンでの患者の脊髄幹麻酔を推奨していません。
NYSORAのヒント
- 脊髄幹麻酔は、XNUMX日XNUMX回の皮下ヘパリンを服用している患者に実施できます。
- 十分なデータがないため、ASRAは、XNUMX日XNUMX回の皮下ヘパリンを服用している患者には脊髄幹麻酔を行わないことを推奨しています。
低分子量ヘパリン
未分画ヘパリンは、さまざまな分子量の断片に分離できる多糖鎖の不均一な混合物です。 LMWHの抗凝固効果は、未分画ヘパリンの場合と同様です。 それはアンチトロンビンを活性化し、アンチトロンビンとトロンビンおよび第Xa因子との相互作用を加速します。 LMWHは第Xa因子に対してより大きな活性を示しますが、未分画ヘパリンはトロンビンおよび第Xa因子に対して同等の活性を示します。 LMWHの血漿半減期は、静脈内注射後2〜4時間、皮下注射後3〜6時間の範囲です。 LMWHの半減期は、標準的なヘパリンの2〜4倍です。 血漿タンパク質に対する親和性が低く、生物学的利用能が高くなります。 未分画ヘパリンに対するLMWHの利点には、皮下投与後のより高く、より予測可能なバイオアベイラビリティと、より長い生物学的半減期が含まれます。 また、LMWHの抗凝固反応を実験室で監視する必要はなく、体重の用量調整も必要ありません(ただし、BMIが低い患者では過剰摂取が発生する可能性があります)。 LMWHは、抗Xa活性レベルを測定することによって正確に評価される、用量依存的な抗血栓効果を示します。 LMWHの皮下注射後の抗第Xa因子活性の回復は100%に近づき、腎不全の患者または体重が50kg未満または80kgを超える患者を除いて、検査室でのモニタリングは不要になります。 トロンボエラストグラムからの反応時間は、血清抗Xa濃度と相関しているようです。
米国で市販されている12つのLMWHは、エノキサパリン(Lovenox)、ダルテパリン(Fragmin)、およびチンザパリン(Innohep)ですが、後者は使用量が少ないため中止されています。 エノキサパリンはXNUMX日XNUMX回または予防としてXNUMX時間ごとに投与され、ダルテパリンとチンザパリンはXNUMX日XNUMX回投与されます。 XNUMXつの薬は、静脈血栓塞栓症の治療と予防に同等の効果があるようです。 エノキサパリンとダルテパリンは、不安定狭心症の患者の死亡または心筋梗塞の予防に同等の効果があります。
米国で推奨される血栓予防用量は、30 mgのエノキサパリンを1.5日1回ですが、一部の臨床医は肥満の患者の用量を増やします(12日20 mg/kgまたは40時間ごとに12mg/ kg)。 ヨーロッパの投与スケジュールは、エノキサパリンXNUMX〜XNUMX mgをXNUMX日XNUMX回投与し、患者は手術のXNUMX時間前に開始用量を投与されます。これは、米国では観察されていない方法です。
脊髄幹麻酔の多数の症例が米国で発生し、FDAは1997年12月に健康勧告を発行し、抗凝固および脊髄幹麻酔に関する最初のASRAコンセンサス会議を開催しました。 ASRAガイドラインでは、LMWHの最小有効量を投与することを推奨しています。 LMWH療法の術後投与は、可能な限り長く、最低24時間、理想的には術後12時間遅らせる必要があります。 単回投与の脊髄くも膜下麻酔は、術前のLMWHを受けている患者にとって最も安全な脊髄幹麻酔法である可能性があります。 脊髄幹麻酔を行う前に、予防的LMWH投与後少なくとも1時間待つことをお勧めします。 高用量のLMWH(例えば、エノキサパリン24 mg / kgを12日4回)を受ける患者は、より長い遅延(XNUMX時間)を必要とします。 抗凝固作用が低い場合、予防的LMWH投与の少なくともXNUMX時間後、次の投与のXNUMX時間前に、カテーテルを抜去する必要があります。 留置カテーテルが注入されている間にLMWH血栓予防が実施される場合は、患者の神経学的状態の極度の警戒を観察する必要があります。 神経機能をよりよく監視できるように、局所麻酔薬を希釈することをお勧めします。 抗血小板薬、標準ヘパリン、デキストラン、経口抗凝固薬など、止血に影響を与える他の薬剤をLMWHと組み合わせて使用すると、出血性合併症のリスクが高まります。
NYSORAのヒント
- LMWHの予防的投与を受けている患者では、脊髄幹麻酔の前に12時間の間隔が推奨されます。
- 治療用量のLMWHを服用している患者には、24時間間隔が適切です。
- 硬膜外カテーテルを抜去してからLMWHを再開するまでに、4時間の遅延がFDAによって推奨されています。
血栓溶解療法
血栓溶解剤は、すでに形成されているフィブリン血餅を積極的に溶解します。 ストレプトキナーゼやウロキナーゼなどの外因性プラスミノーゲン活性化因子は、血栓を溶解するだけでなく、循環するプラスミノーゲンにも影響を及ぼし、プラスミノーゲンとフィブリンの両方のレベルを低下させます。 内因性薬剤である組換え組織型プラスミノーゲン活性化因子(r-TPA)は、フィブリン選択性が高く、循環プラスミノーゲンレベルへの影響が少ない。 血餅溶解は、血小板凝集を阻害することによって抗凝固効果を有するフィブリン分解産物の上昇をもたらします。
硬膜外または脊髄針およびカテーテルの留置とその後のヘパリン化は比較的安全であるように見えますが、血栓溶解療法を受けている患者の脊髄血腫のリスクは明確に定義されていません。 硬膜外または留置硬膜外カテーテルを使用し、血栓溶解剤を投与された患者の脊髄硬膜外血腫の症例が文献で報告されています。
ASRAガイドラインは、血栓溶解療法または線維素溶解療法後の脊髄幹麻酔に関する推奨事項を示しています。 ヘパリンを線維素溶解薬または血栓溶解薬と併用すると、脊髄くも膜下麻酔または硬膜外麻酔中に患者に有害な脊髄幹麻酔のリスクが高くなります。 非常にまれな状況を除いて、線維素溶解療法または血栓溶解療法を受けている患者は、脊髄くも膜下麻酔または硬膜外麻酔を受けないように注意する必要があります。 これらの薬剤の中止後の適切な期間と脊髄幹麻酔技術の安全な性能を明確に決定するための利用可能なデータはありません。 欧州のガイドラインでは、患者に血栓溶解薬を投与した場合は硬膜外カテーテルを留置し、薬の効果がなくなった場合にのみ硬膜外カテーテルを抜去することを推奨しています。 スカンジナビアのガイドラインでは、薬剤の中止と脊髄幹麻酔の間隔を24時間にすることを推奨しています。 線維素溶解療法または血栓溶解療法後に神経軸神経ブロックが生じた患者には、適切な期間、頻繁な神経学的モニタリングが推奨されます。 患者が継続的な硬膜外注入を受けており、線維素溶解療法または血栓溶解療法を受けている場合は、感覚および運動ブロックを最小限に抑える薬剤を使用する必要があります。 線維素溶解療法または血栓溶解療法を予期せず受けた患者の脊髄幹麻酔の除去のタイミングに関する明確な推奨事項はありませんでした。 フィブリノーゲンレベルの測定は、カテーテルの抜去または維持に関する決定を導くのに役立つ場合があります。
ハーブ療法
最も一般的に使用される漢方薬は、ニンニク、イチョウ、高麗人参です。 ニンニクは血小板凝集を抑制し、止血への影響は7日間続くようです。 イチョウは血小板活性化因子を阻害し、その効果は36時間持続します。 高麗人参にはさまざまな効果があります。invitroで血小板凝集を抑制し、実験動物のトロンビン時間(TT)とaPTTの両方を延長します。 その効果は24時間持続します。 血小板機能への影響にもかかわらず、ハーブ薬自体は、硬膜外麻酔または脊髄くも膜下麻酔をしている患者の脊髄くも膜下腫の発症に追加の重大なリスクを示さないようです。 これらの投薬の強制的な中止、またはこれらの投薬が継続された患者の手術のキャンセルは、利用可能な臨床データによってサポートされていません。 ただし、経口抗凝固薬やヘパリンなど、凝固メカニズムに影響を与える他の薬剤を同時に使用すると、これらの患者の出血性合併症のリスクが高まる可能性があります。 漢方薬を服用した患者の止血の妥当性を評価するための受け入れられたテストはありません。 現時点では、ハーブ療法の投与、術後モニタリング、または脊髄幹麻酔の抜去のタイミングに関連して、脊髄幹神経ブロックのタイミングに関して特別な懸念はないようです。
トロンビン阻害剤
デシルジンおよびビバリルジンを含む組換えヒルジン誘導体は、遊離および血餅結合トロンビンの両方を阻害します。 l-アルギニン誘導体であるアルガトロバンも同様の作用機序を持っています。 これらの薬は、主にヘパリン起因性血小板減少症の治療に使用されます。 これらの薬の効果に対する薬理学的な逆転はありません。 トロンビン阻害剤を投与された患者の脊髄くも膜下麻酔に関連した脊髄血腫の症例報告はありません。 ただし、自発的な頭蓋内出血が報告されています。 ASRAガイドラインによると、リスク評価と患者管理に関する記述はできません。
フォンダパリヌクス
フォンダパリヌクスは、第Xa因子を選択的に阻害することで抗血栓作用を発揮する合成抗凝固剤です。 化学合成されているため、抗凝固作用に一貫性があります。 それは100%生物学的に利用可能です。 急速に吸収され、投与後1.7時間以内に最大濃度に達します。 その半減期は17〜21時間です。
フォンダパリヌクスは、大規模な整形外科手術後の抗血栓剤として、および肺塞栓症の初期治療として推奨されています。 延長された半減期(約20時間)により、XNUMX日XNUMX回の投与が可能になります。 FDAは、LMWHおよびヘパリンと同様のフォンダパリヌクスに対するブラックボックス警告を発行しました。
フォンダパリヌクスによる脊髄硬膜外血腫の実際のリスクは不明です。 ある研究では、脊髄幹麻酔を受けた患者に合併症は見られませんでした。 この研究では、フォンダパリヌクスの最後の投与から36時間後にカテーテルを抜去し、カテーテルを抜去してから12時間投与を遅らせました。 脊髄幹麻酔の実施に困難が生じた場合(3回以上の試行が必要)、出血により手技が複雑になった場合、抗血小板薬が必要な場合、または手術の翌日に硬膜外カテーテルを抜去する計画であった場合、患者は研究から除外されました。 臨床診療における非現実的な要件のため、ASRAは、硬膜外カテーテルが留置されている状態でフォンダパリヌクスを使用しないことを推奨しています。 彼らの推奨事項は、フォンダパリヌクスの持続的かつ不可逆的な抗血栓効果、術後早期の投与、および薬剤の最初の臨床試験中に報告された脊髄血腫に基づいています。 外科的出血に関連する危険因子について文献を綿密に監視することは、リスク評価と患者の治療に役立つ可能性があります。 脊髄幹麻酔技術のパフォーマンスは、臨床試験で使用される条件下で発生する必要があります(単針パス、非外傷性針の配置、脊髄幹麻酔留置の回避)。 これが実行可能でない場合は、予防の代替方法を検討する必要があります。
まとめ
抗凝固剤と脊髄幹麻酔の中止の間、および硬膜外カテーテルの除去と薬物の再開の間の時間間隔は、に要約されています。 テーブル1.
表1 脊髄幹麻酔および硬膜外カテーテルの抜去の前後の推奨される時間間隔。
| 薬 | 脊髄幹麻酔までの時間 手順またはカテーテルの取り外し | 脊髄幹麻酔後の時間 手順またはカテーテルの取り外し | コメント |
|---|---|---|---|
| アスピリン | なし | なし | |
| NSAIDs | なし | なし | |
| クロピドグレル | 7日間* | カテーテル抜去後 | ヨーロッパおよびスカンジナビアのガイドラインによる |
| プラスグレル | 7-10日 | 6h | 欧州ガイドラインによる |
| ティカグレル | 5日 | 6h | (上記のように) |
| ワルファリン | 5日(通常のINR) | カテーテル除去後 | |
| ヘパリン(IV) | 4-6 | 1-2h | |
| ヘパリン | |||
| -(Sc、BID) | なし | なし | |
| -(Sc、TID) | 適用されない | 脊髄幹麻酔 | |
| LMWH | |||
| 予防的 | 12時間 | 4時間 | FDAの推奨 |
| 治療の | 24時間 | 4時間 | |
| フォンダパリヌクス | 36-42時間 | 6-12時間 | ヨーロッパのガイドラインによる。 ASRAは、この薬を服用している患者の脊髄幹麻酔を推奨していません。 *脊髄幹麻酔を5日目に行う必要がある場合は、血小板機能のテストをお勧めします(テキストを参照) |
新しい抗凝固剤
新しい抗凝固剤のダビガトラン、リバロキサバン、およびアピキサバンの議論には、特定の背景情報のレビューが含まれます。
抗凝固薬の中止と脊髄幹麻酔の間隔および脊髄幹麻酔の間隔 または硬膜外カテーテルの除去と抗凝固剤の再開
静脈血栓塞栓症(VTE)のリスクと脊髄硬膜外血腫の予防の間には、2つの半減期が適切な妥協点であることが推奨されています。 ヨーロッパとスカンジナビアのガイドラインでは、抗凝固薬の中止と脊髄幹麻酔の間にXNUMX半減期の間隔を設けることを推奨しています。
この決定は、無症状のVTEが手術直後にかなりの割合の患者に発生し、抗凝固療法が残っているとこの発生を防ぐ可能性があるため、行われたようでした。 残留抗凝固療法の存在は、脊髄幹麻酔後の完全な抗凝固療法への移行を促進します。 1、2、3、4、5、および6の半減期の後、次の割合の薬物が循環に残ります:50%、25%、12.5%、6.25%、
それぞれ3.125%、1.5625%(テーブル2ただし、これらの調査結果は、他の抗凝固剤がない場合の単回投与薬物動態研究における若い健康なボランティアの研究に基づいています。 対照的に、臨床診療では、患者は通常高齢であり、併存疾患が併発しています。
表2 新しい抗凝固剤の脊髄幹麻酔および硬膜外カテーテルの前後の推奨時間間隔。
| 薬 | 半減期 | 欧州ガイドライン | スカンジナビアのガイドライン | XNUMXつの半減期 |
|---|---|---|---|---|
| ダビガトラン | 12-17h 28時間(腎疾患) | (メーカーごとに禁忌) | データはありません | 85時間(4日) 6d(腎臓病患者) |
| リバロキサバン | 9-13h | 22-26h | 18h | 65時間(3日) |
| アピキサバン | 15.2 +/- 8.5h | 26-30h | データはありません | 75時間(3-4d) |
脳卒中の既往歴のある患者など、VTEのリスクがある患者では、適切な止血が保証されていないことを認識して、2または3半減期の間隔が適切である可能性があります。 血栓症のリスク要因がない患者の場合、抗凝固剤の最後の投与と脊髄幹麻酔の間に4〜6の半減期があるため、薬剤がより完全に排除され、出血のリスクが低くなります。 4〜6半減期と2〜3半減期という控えめな推奨値の間の妥協点は、LMWHブリッジ療法による5半減期の間隔です。
脊髄幹麻酔または硬膜外カテーテルの除去後の抗凝固剤の再開に関して、スカンジナビアのガイドラインは、Rosencherらの推奨に基づいています。 8時間から抗凝固剤がピーク効果に達するのにかかる時間を引いたものです。
血餅が安定するのに8時間で十分であると推定され、血餅形成の6時間以内に与えられた場合に血餅を溶解する血栓溶解剤の有効性によって裏付けられた推定。 Tertriらはまた、脳内出血後6〜24時間以内にエノキサパリンを投与しても血腫のサイズが拡大しなかったため、48時間間隔の方がおそらく安全であると述べました。 他の著者は、主要な手技後24時間以内に抗血栓療法を再開すると、手技周辺の出血のリスクが高まる可能性があるため、より保守的なアプローチを推奨しています。 LiewとDouketisは、ダビガトラン、リバロキサバン、またはアピキサバンを再開する前に、出血リスクが低い患者には最低24時間、出血リスクが高い患者には最低24時間を推奨しています。 したがって、オプションは48時間または8時間から薬剤のピーク効果を差し引いたものです。
VTE、脳卒中、または急性冠症候群のリスクはおそらく同じであるため、これらXNUMXつのオプションの間におそらくほとんど違いはありません。 さらに、新しい抗凝固剤の効果の発現とピークまでの時間は短いです。
ダビガトラン
ダビガトランエテキシレートは、胃の中でエステラーゼによって加水分解されて活性薬剤になるプロドラッグです。 ダビガトランエテキシレートのバイオアベイラビリティは7.2%です。 ダビガトランは、神経がトロンビンとさまざまな基質との相互作用をブロックする直接トロンビン阻害剤です。 ピーク血漿濃度は、プロドラッグの摂取後1.5〜3時間で達成されます。 半減期は14〜17時間です。 腎クリアランスは、ダビガトランの総クリアランスの80%を占めています。 末期腎疾患の場合、消失半減期は14時間から28時間に倍増します。
ダビガトランは、急性VTEの治療および再発性VTEの予防に効果的です。 心房細動の患者では、ダビガトランは脳卒中と全身性塞栓症の発生率をワルファリンと同様の程度まで低下させます。 ダビガトランは、全関節手術後のVTEの予防に一貫性があることは示されていませんでした。 研究によると、エノキサパリンよりも効果的、非劣性、または劣っています。 試験のメタアナリシスでは、分析したエンドポイントのいずれにおいても、ダビガトランとエノキサパリンの間に違いは見られませんでした。 製造業者は、ダビガトランを投与されている患者に硬膜外カテーテルを留置すべきではないと述べています。 Levyと同僚は、留置カテーテルの抜去とダビガトラン投与の間の最小間隔を2時間にすることを推奨しています。 この間隔は6時間より短いように見えます。つまり、8時間から2時間の差を引いて、薬剤の効果がピークに達するまでの時間です。 ダビガトランを服用した後の出血の増加の報告があります。 オーストラリアとニュージーランドの血液学会は、78か月間に約7000人の患者で2回の出血エピソードを特定しました。 しかし、FDAによる監査では、ワルファリンと比較してダビガトランによる出血の絶対的な増加はなかったと結論付けられました。
aPTTはダビガトランの後に延長されますが、関係は曲線です。 トロンビン凝固時間(TCT)としても知られるトロンビン時間(TT)は、ダビガトランの効果に非常に敏感であり、薬物の効果を定量化するよりも、ダビガトランの抗凝固効果の存在を検出するためにより適切に使用されます。 希薄なTTは、薬理学的に関連する血漿ダビガトラン濃度全体に初期性があります。 トロンビン生成を直接測定するエカリン凝固時間(ECT)は、ダビガトランによって用量依存的に延長されます。 これはダビガトランの最も感度の高いアッセイですが、テストを利用できる機関はほとんどありません。 プロトロンビン時間(PT)は、最も感度の低いテストです。 希薄なTTとECTは、ダビガトランに最適な検査です。
現在まで、ダビガトランまたは他の新しい経口抗凝固剤の効果を逆転させる解毒剤はありません。 活性炭は薬の吸収を防ぎますが、ダビガトランを摂取してから2時間以内に投与する必要があります。 透析は薬物除去を加速するかもしれません。 3つ(ファクターII、IX、およびX)または4つ(ファクターII、VII、IX、およびX)の凝固因子を含む血漿複合体濃縮物(PCC)が提案されていますが、その有効性は証明されていません。 遊離およびトロンビン結合ダビガトランと結合するモノクローナル抗体フラグメントであるイダルシズマブは、最近FDAによって承認されました。
NYSORAのヒント
- ダビガトランは主に腎臓に依存して排泄され、腎臓病の患者ではその半減期がXNUMX倍になります。
- これらの患者では、薬剤の中止と脊髄幹麻酔の間隔を長くすることをお勧めします。おそらく6日です。
リバロキサバン
リバロキサバンは直接第Xa因子阻害剤です。 ピーク血漿濃度は2.5〜4時間以内に観察され、第Xa因子の最大阻害(最大68%)は投与後3時間で発生し、少なくとも12時間、または高齢者に高用量を投与した場合は24〜48時間維持されます。忍耐。 リバロキサバンの終末半減期は5.7〜9.2時間ですが、腎機能の加齢に伴う低下により、高齢患者では11〜13時間にもなる可能性があります。 薬物の120分の24は腎臓によって排泄され、50分のXNUMXは糞便/胆汁経路によって排泄され、XNUMX分のXNUMXは不活性な代謝物に変化します。 最大濃度は肥満(体重XNUMXkg以上の患者)の影響を受けませんが、体重XNUMXkg以下の患者ではXNUMX%増加します。 リバロキサバンの腎クリアランスは、腎機能障害の増加とともに減少します。
リバロキサバンは、心房細動時の塞栓性脳卒中の予防において、症候性VTEおよびワルファリンに劣らない治療に効果的です。 標準的な抗血小板療法にリバロキサバンを追加すると、最近の急性冠症候群の患者の心血管系の原因、心筋梗塞、または脳卒中による死亡の複合エンドポイントが減少します。 リバロキサバンは、全関節手術後のVTEの予防において、エノキサパリンと同等またはそれより優れていると報告されています。 RECORD 1、2、3、および4の研究では、リバロキサバンはエノキサパリンよりも効果的な血栓予防薬であり、同様の安全性プロファイルを示しました。 Rosencheretal。 硬膜外カテーテルは、リバロキサバンの最後の投与後少なくとも2半減期まで除去されず、次のリバロキサバン投与はカテーテル除去の4〜6時間後に与えられたと述べた。 リバロキサバンを投与され、脊髄くも膜下麻酔を受けた1141人の患者はいずれも脊髄硬膜外血腫を発症しませんでした。 ただし、この少数の患者は、このレジメンの周術期の安全性について確固たる結論を出すには不十分です。
ヨーロッパおよびスカンジナビアのガイドラインでは、リバロキサバンの中止と硬膜外カテーテルの留置または除去の間に2半減期の間隔を推奨しています(スカンジナビアのガイドラインでは18時間、ヨーロッパのガイドラインでは22〜26時間)。 リバロキサバンは効果がピークに達するまでに4〜6時間かかるため、これらのガイドラインでは、次の投与を再開する前に2.5〜4時間の間隔を推奨しています。
リバロキサバンとPTの効果の間に線形相関が観察されました。 ただし、リバロキサバンに対するPT試薬の感度には著しいばらつきがあるため、各ラボではリバロキサバン専用にPTを校正することをお勧めします。 aPTTは、リバロキサバンの効果を決定するのに十分な感度を欠いています。 第Xa因子の阻害は、リバロキサバンの血漿中濃度の代用にもなる可能性があります。 PTおよびanti-Xaは、リバロキサバンの効果を監視するための推奨テストです。
リバロキサバンを除去するために活性炭の使用が推奨されていますが、リバロキサバンの摂取から8時間以内に投与する必要があります。 4因子PCCは、健康なボランティアにおけるリバロキサバンのinvitro抗凝固活性を逆転させることが示されています。 タンパク質結合が高いため、リバロキサバンとアピキサバンは透析できない場合があります。
アピキサバン
アピキサバンは非常に特異的な第Xa因子阻害剤です。 急速に吸収され、1〜2時間でピーク濃度に達します。 研究によると、アピキサバンの最終半減期は13.5 +/- 9.9時間、つまり15.2mgの単回投与後は8.5+/- 5時間、11.7mgの複数回投与後は3.3+/-5時間でした。 最大血漿濃度は体重の影響を受け、体重が少ない被験者ではアピキサバンの濃度が高くなります。 血漿抗第Xa因子活性は、アピキサバン血漿濃度と直接的な線形関係を示しています。
アピキサバンの経口バイオアベイラビリティは45%以上です。 経口投与後、それは複数の排泄経路ならびに直接の腎臓および腸の排泄を介して排泄されます。 投与量の29〜56%が腎臓から排泄され、投与量の5%が糞便中に回収されます。 アピキサバンの半分以上は変化せずに排泄され、代謝性の薬物と薬物の相互作用のリスクを軽減します。アピキサバンは、出血のリスクを高めることなく、脳卒中や全身性塞栓症を軽減するのに効果的です。 アピキサバンは、心房細動患者の脳卒中や全身性塞栓症の予防において、ワルファリンよりも優れています。 アピキサバンは、エノキサパリンまたはワルファリンに匹敵する、人工膝関節全置換術における効果的な血栓予防を提供します。 アピキサバンは、人工膝関節全置換術(TKR)後のVTEの予防においてエノキサパリンと同等に効果的ですが、大出血の発生率は低いか同様です。 アピキサバンは、出血を増加させることなく、人工股関節全置換術(THR)後のVTEの予防においてエノキサパリンよりも効果的です。 この試験では、「髄腔内または硬膜外麻酔に関連するデバイスは、アピキサバンの初回投与の少なくとも12時間前に取り外されました」。 アピキサバンのすべての研究において、薬剤は手術の24〜XNUMX時間後に開始されました。
リバロキサバンと比較して、アピキサバンは承認された用量で投与された場合、PTにほとんど影響を与えません。 希釈PTアッセイは、従来のPTよりも感度が向上しています。 抗Xa活性とアピキサバンの血漿濃度の間には線形相関があるようです。 抗Xaアッセイは、PTよりも感度が高く、希釈PTアッセイと同じくらい感度が高いことが認められており、アピキサバンの抗凝固効果の臨床モニタリングに最適であるように思われます。 摂取後3時間以内に与えられた活性炭は、アピキサバンの吸収を減らします。
Andexanetは、第Xa因子阻害剤に結合して隔離する、組換え型の改変ヒト第Xa因子デコイタンパク質です。 ボランティアと患者を対象とした研究では、アンデキサネットがリバロキサバンとアピキサバンの抗凝固作用を逆転させることが示されました。 2016年の時点で、andexanetはまだ米国で臨床的に利用可能ではありません。
新しい抗凝固剤に関する推奨事項の要約
VTEまたは脳卒中のリスクが高い患者では2〜3半減期の間隔が許容される場合がありますが、薬物の中止から脊髄幹麻酔までの4〜6の半減期の間隔は、低位のほとんどの患者でおそらくより安全です。血栓症のリスク。 LMWHブリッジ療法と組み合わせた5半減期の間隔は、以下に示すように、ほとんどの患者の代替手段です。 テーブル2。 脊髄幹麻酔または硬膜外カテーテルの除去後、抗凝固剤は6時間(8時間から薬剤の開始/ピーク効果を差し引いたもの、通常は2時間)後に再開できます。 抗凝固薬は通常、ほとんどの患者で24〜48時間以内に再開されますが、VTEまたは脳卒中のリスクが高い患者ではより早く再開できます。 つまり、24時間から薬の効果がピークに達するまでの時間を差し引いたものです。 他の人は24時間間隔を推奨しました(テーブル3)
表3 脊髄幹麻酔またはカテーテル抜去後の薬剤再開の推奨時間間隔。
| 薬 | 欧州ガイドライン | スカンジナビアのガイドライン | Liew&Douketis(102); コノリーとスパイロプロス(98) |
|---|---|---|---|
| ダビガトラン | 6h | 6h | 24h |
| リバロキサバン | 4-6h | 6h | 24h |
| アピキサバン | 4-6h | 6h | 24h |
抗凝固効果の実験室モニタリングは状況によっては適切であり、止血機能を迅速に回復する必要がある場合は逆転剤が提案されます。
NYSORAのヒント
- 新しい抗凝固剤については、これらの薬剤の経験が増えるまで、薬剤の中止と脊髄幹麻酔の間に5半減期の間隔を設けることをお勧めします。
- カテーテルを抜去した後、薬剤を再開する前に、薬剤の効果が最大になるまで8時間または24時間の間隔をとることをお勧めします。 24時間間隔がおそらく最も安全です。
硬膜外血腫の臨床的特徴、診断および管理
脊髄硬膜外血腫を発症する患者は、通常、神経根成分の有無にかかわらず、突然の重度の一定の腰痛を呈します。 脊椎への打診は、咳、くしゃみ、緊張などの脊椎内圧を上昇させる操作と同様に、痛みを悪化させます。 さらに、硬膜外または脊髄ブロックの明らかな解消後の運動衰弱および/または感覚障害の回復は、硬膜外または脊髄血腫の形成を強く示唆している。 運動および感覚の所見は、血腫のレベルとサイズに完全に依存しますが、脱力感、不全麻痺、腸または膀胱の機能の喪失、および事実上すべての感覚障害が含まれる場合があります。 磁気共鳴画像法(MRI)は、最適な診断研究です。 鑑別診断には、脊椎膿瘍、硬膜外腫瘍、急性椎間板ヘルニア、および脊椎くも膜下出血が含まれます。 手術なしで回復することはまれであり、脊髄硬膜外血腫が疑われるとすぐに、緊急の減圧椎弓切除術を検討するための脳神経外科の診察を受ける必要があります。 機能回復は、主に手術前に症状が現れる時間の長さに関係しています。 脊髄血腫患者の臨床的特徴、診断、鑑別診断、および治療については、 局所麻酔薬の全身毒性.
概要
開業医は、新しい抗凝固薬、抗凝固プロトコル、現在のガイドラインの推奨事項、およびFDAアラートに関する知識ベースを定期的に更新する必要があります。 脊髄硬膜外血腫は、特定可能な危険因子がない場合でも発生する可能性があるため、神経機能障害の早期評価と迅速な介入には、モニタリングの警戒が不可欠です。 抗凝固療法を受けている患者に脊髄幹麻酔を実施するかどうかの決定とカテーテル抜去のタイミングは、脊髄くも膜下腫のリスクは小さいものの、局所麻酔の利点を比較検討して、個別に行う必要があります。
抗凝固および末梢神経ブロック
必要に応じて、抗凝固薬を服用している患者に末梢神経ブロックを行うことができます。 抗凝固剤の存在下での脊髄幹麻酔とは対照的に、抗凝固剤の存在下での末梢神経ブロックに関する前向き研究はありません。 ASRAは、末梢神経ブロックについて、脊髄幹麻酔と同じガイドラインを推奨しています。 腰神経叢神経ブロックおよび大腰筋コンパートメント神経ブロックの後に、大腰筋および後腹膜血腫の症例が報告されています。 これらの患者は、エノキサパリン、チクロピジン、またはクロピドグレルのいずれかを服用していました。 場合によっては、ASRAガイドラインを順守しているにもかかわらず血腫が発生しました。
末梢神経遮断後の血腫形成の症状には、痛み(側面または傍脊椎の痛み、または乾癬出血の鼠径部の痛み)、その領域の圧痛、ヘモグロビン/ヘマトクリットの着実な低下、循環血液量減少による低血圧、および感覚運動障害が含まれます。 明確な診断はコンピューター断層撮影(CT)によって行われます。 超音波は、腰筋コンパートメント神経ブロック後の腎被膜下血腫の存在を検出するためにも使用できます。 治療には、外科的診察、抗凝固療法の逆転、必要に応じた輸血、注意深い経過観察と外科的ドレナージが含まれる場合があります。
末梢神経ブロックを受けている患者に脊髄幹神経ブロックに関するASRAガイドラインを適応させることはおそらく制限が強すぎます。 欧州麻酔学会は、脊髄幹神経ブロックのガイドラインが末梢神経ブロックに日常的に適用されないことを指摘しています。 一方、オーストリア麻酔・蘇生・集中治療学会は、抗凝固剤の存在下で表在性神経ブロックを安全に実施できることを示唆しています。 後腹膜血腫の可能性があるため、腰神経叢と傍脊椎神経ブロックは、脊髄幹麻酔の場合と同じ推奨事項に値します。 同じガイドラインが内臓交感神経ブロックにも適用されます。 したがって、ASRAガイドラインは、腹腔神経叢神経ブロック、上胃神経叢神経ブロック、腰神経叢神経ブロックなど、血管および非圧縮性領域の神経ブロックに適用できる可能性があります。 臨床医は自分たちの決定を個別化し、神経ブロックのリスクと利点について患者と外科医と話し合う必要があります。 最も重要なことは、臨床医は神経ブロックを配置した後、患者を注意深く追跡する必要があります。
NYSORAのヒント
- 脊髄幹麻酔のガイドラインは、腰神経叢神経ブロックと内臓交感神経ブロックにも適用する必要があります。
- 表在性神経ブロックの場合、超音波ガイド下局所神経ブロックは、おそらく残留抗凝固療法の存在下で実施することができます。
参考文献
- Horlocker TT、Wedel DJ:抗凝固および神経軸神経ブロック:歴史的展望、麻酔への影響、およびリスク管理。 Reg Anesth Pain Med 1998; 23:129–134。
- トリバM:[硬膜外局所麻酔と低分子ヘパリン:プロ]。 Anasthesiol Intensivmed Notfallmed Schmerzther 1993; 28:179–181。
- PöppingDM、Zahn PK、Van Aken HK、Dasch B、Boche R、Pogatzki-Zahn EM:術後疼痛管理の有効性と安全性:18年から925年までの1998人の連続患者の調査(第2006改訂):前向きのデータベース分析発生したデータ。 Br J Anaesth 2; 2008:101–832。
- Moen V、Dahlgren N、Irestedt L:1990〜1999年のスウェーデンにおける中央脊髄幹麻酔後の重度の神経学的合併症。 Anesthesiology 2004; 101:950–959。
- Volk T、Wolf A、Van Aken H、BürkleH、Wiebalck A、Steinfeldt T:硬膜外穿刺後の脊髄血腫の発生率:局所麻酔における安全性に関するドイツのネットワークからの分析。 Eur J Anaesthesiol 2012; 29:170–176。
- Ehrenfeld JM、Agarwal AK、Henneman JP、Sandberg WS:疑わしい硬膜外血腫の発生率と硬膜外カテーテル法の隠れた画像診断費用の推定:43,200例の遡及的レビュー。 Reg Anesth Pain Med 2013; 38:409–414。
- Bateman BT、Mhyre JM、Ehrenfeld J、et al:周術期および産科硬膜外カテーテル挿入後の硬膜外血腫のリスクと転帰:多施設周術期転帰グループ研究コンソーシアムからの報告。 Anesth Analg 2013:116:1380–1385。
- Horlocker T、Kopp S:米国での硬膜外ブロック後の硬膜外血腫:整形外科手術後の低分子量ヘパリンだけではありません。 Anesth Analg 2013; 116:1195–1197。
- Horlocker T:脊柱管狭窄症の患者の脊髄幹麻酔:岩と固い場所の間。 Anesth Analg 2010; 110:1305。
- Gulur P、Tsui B、Pathak R、Koury KM、Lee H:硬膜外カテーテルと異常な凝固パラメーターを持つ患者における硬膜外血腫の発生率の遡及的分析。 Br J Anaesth 2015; 114:808–811。
- Heit JA、Horlocker TT(eds):脊髄幹麻酔と抗凝固療法。 Reg Anesth Pain Med 1998; 23:S129–S193。
- Horlocker TT、Wedel DJ、Benzon HT他:抗凝固療法を受けた患者の局所麻酔:リスクの定義(脊髄幹麻酔と抗凝固療法に関する第2003回ASRAコンセンサス会議)。 Reg Anesth Pain Med 28; 171:197–XNUMX。
- Horlocker TT、Wedel DJ、Rowlingson JC他:抗血栓療法または血栓溶解療法を受けている患者の局所麻酔:米国局所麻酔および疼痛医学のエビデンスに基づくガイドライン(第2010版)。 Reg Anesth Pain Med 35; 64:101–XNUMX。
- Gogarten W、Vandermeulen E、Van Aken H、Kozek S、Llau JV、Samama CM:European SocietyofAnaesthesiology。 局所麻酔および抗血栓剤:欧州麻酔学会の推奨事項。 Eur J Anaesthesiol 2010; 27:999-1015。
- Breivik H、Bang U、Jalonen J、Vigfusson G、Alahuhta S、Lagerkranser M:スカンジナビア麻酔学会および集中治療医学による止血障害における脊髄幹麻酔の北欧ガイドライン。 Acta Anaesthesiol Scand 2010; 54:16–41。
- Cronberg S、Wallmark E、SöderbergI:ヒトへの10種類の非ステロイド性鎮痛薬の経口投与による血小板凝集への影響。 Scand J Haematol 1984; 33:155–159。
- Locke GE、Giorgio AJ、Biggers SL Jr、et al:アスピリン誘発性の長期出血に続発する急性脊髄硬膜外血腫。 Surg Neurol 1976; 5:293–296。
- Vandermeulen EP、Van Aken H、Vermylen J:抗凝固薬と脊髄くも膜下麻酔。 Anesth Analg 1994; 79:1165–1177。
- CLASP(妊娠中の共同低用量アスピリン研究)共同グループ。 CLASP:9364人の妊婦を対象とした子癇前症の予防と治療のための低用量アスピリンのランダム化試験。 Lancet 1994; 343:619–629。
- Horlocker TT、Wedel DJ、Offord KP:術前の抗血小板療法は、局所麻酔に関連する出血性合併症のリスクを高めますか? Anesth Analg 1990; 70:631–634。
- Horlocker TT、Wedel DJ、Schroeder DR他:術前の抗血小板療法は、局所麻酔に関連する脊髄血腫のリスクを増加させません。 Anesth Analg 1995; 80:303–309。
- Benzon HT、Brunner EA、Vaisrub N:アスピリン後の出血時間と神経ブロック。 Reg Anesth 1984; 9:86–90。
- Horlocker TT、Bajwa ZH、Ashraft Z、et al:硬膜外ステロイド注射を受けている外来疼痛クリニック患者における非ステロイド性抗炎症薬に関連する出血性合併症のリスク評価。 Anesth Analg 2002; 95:1691–1697。
- Benzon HT、Wong HY、Siddiqui T、et al:いくつかの抗血小板薬を患者に硬膜外注射する際の注意。 麻酔学1999;91:1558–1559。
- Benzon HT、Huntoon M:抗凝固薬を服用している患者の介入的疼痛処置のための新しいガイドラインが必要ですか? Reg Anesth Pain Med 2014; 39:1–3。
- Giberson CE、Barbosa J、Brooks ES、et al:経皮的脊髄刺激装置の試験リードの除去後の硬膜外血腫:2014つの症例報告。 Reg Anesth Pain Med 39; 73:77–XNUMX。
- Williams KN、Jackowski A、Evans PJD:慢性疼痛のために頸部硬膜外ステロイド注射を繰り返した後、外科的減圧を必要とする硬膜外血腫。 痛み1990;42:197–199。
- Ain RJ、Vance MB:ガイドラインに従ってエノキサパリンを差し控えた患者における硬膜外ステロイド注射後の硬膜外血腫。 Anesthesiology 2005; 102:701–703。
- Buvanendran A、Young A:アスピリンを服用している患者に脊髄刺激装置の試験リードを配置した後の脊髄硬膜外血腫。 Reg Anesth Pain Med 2014; 39:70–72。
- Desai MJ、Dua S:腰椎経椎間孔ステロイド注射後の神経周囲血腫は、急性-慢性腰神経根症を引き起こします:症例報告。 Pain Pract 2014; 14:271–277。
- Mahmoud J、Mathews M、Verna S、Basil B:オクスカルバゼピン誘発性血小板減少症。 Psychosomatics 2006; 47:73–74。
- Meijer WEE、Heerdink ER、Nolen WA、Herings RMC、Leufkens HGM、EgbertsACG。 異常出血のリスクと抗うつ薬によるセロトニン再取り込み阻害の程度との関連。 Arch Intern Med 2004; 164:2367–2370。
- Narouze S、Benzon HT、Provenzano DA、et al:抗血小板および抗凝固薬を服用している患者の脊椎および疼痛の介入手順:米国地域麻酔および疼痛医学学会、欧州地域麻酔および疼痛治療学会、米国アカデミーからのガイドライン疼痛医学、国際神経調節学会、北米神経調節学会、および世界疼痛研究所。 Reg Anesth Pain Med 2015; 40:182–212。
- Gajraj NM:シクロオキシゲナーゼ-2阻害剤。 Anesth Analg 2003; 96:1720–1738。
- Buvanendran A、Kroin JS、Tuman KJ、et al:膝関節置換術後の疼痛管理と機能回復に対する選択的シクロオキシゲナーゼ2阻害剤の周術期投与の効果:ランダム化比較試験。 JAMA 2003; 290:2411–2418。
- Gajraj NM、Joshi GP:術後疼痛管理におけるシクロオキシゲナーゼ-2阻害剤の役割。 Anesthesiol Clin North America 2005; 23:49–72。
- Desjardins PJ、Shu VS、Recker DPら:新しいシクロオキシゲナーゼ-2特異的阻害剤であるバルデコキシブの術前単回投与は、口腔外科手術またはバニオン切除の痛みを和らげます。 Anesthesiology 2002; 97:565–573。
- Sinatra RS、Shen QJ、Halaszynski T、et al:下腹部手術後の鎮痛補助剤としての術前ロフェコキシブ経口懸濁液:努力に依存する痛みと肺機能の影響。 Anesth Analg 2003; 98:135–140。
- Lessee PT、Hubbard RC、Karim A、et al:健康な成人の血小板機能に対する新規のシクロオキシゲナーゼ-2-阻害剤であるセレコキシブの効果:無作為化臨床試験。 J Clin Pharmacol 2000; 40:124–132。
- van Heeken H、Schwartz JI、Depre M、et al:健康なボランティアにおけるCOX-2とCOX-1に対するロフェコキシブ、メロキシカム、ジクロフェナク、イブプロフェン、ナプロキセンの阻害活性の比較。 J Clin Pharmacol 2000; 40:1109–1120。
- Greenberg H、Gottesdiener K、Huntington M、et al:新しいシクロオキシゲナーゼ-2阻害剤であるロフェコキシブ(VIOXX)は、健康なボランティアにおける低用量アスピリンの抗血小板効果を変化させませんでした。 J Clin Pharmacol 2000; 40:1509–1515。
- Psaty BM、Furberg CD:Cox-2阻害剤—医薬品の安全性に関する教訓。 N Engl J Med 2005; 352:1133–1135。
- Schror K:抗血小板薬:比較レビュー。 Drugs 1995; 50:7–28。
- Yang LH、Fareed J:クロピドグレルとチクロピジンの血管調節作用。 Thromb Res 1997; 86:479–491。
- CAPRIE運営委員会:虚血性脳卒中のリスクのある患者を対象としたクロピドグレルとアスピリンのランダム化盲検試験(CAPRIE)。 Lancet 1996; 348:1329–1339。
- Helft G、Osende JI、Worthley SG、et al:アスピリンのアテローム性動脈硬化症患者におけるクロピドグレルの前負荷レジメンの急性抗血栓効果。 Arterioscler Thromb Vasc Biol 2000; 29:2316–2321。
- Mayumi T、Dohi S:抗血小板療法を受けている患者の腰椎穿刺後の脊髄くも膜下血腫。 Anesth Analg 1983; 62:777–779。
- Benzon HT、McCarthy R、Benzon HA、et al:クロピドグレルの残留抗血小板活性の測定。 Br J Anaesth 2011; 107:966–971。
- Hall R、Mazer CD:抗血小板薬:周術期におけるそれらの薬理学と管理のレビュー。 Anesth Analg 2011; 112:292–318。
- Wallentin L:P2Y(12)阻害剤:特性と作用機序の違い、および臨床使用の潜在的な結果。 Eur Heart J 2009; 30:1964–1977。
- Capodanno D、Ferreiro JL、Angiolillo DJ:抗血小板療法:新しい薬剤と変化するパラダイム。 J Thromb Haemost 2013; 11(Suppl 1):316–329。
- Brandt JT、Payne CD、Wiviott SD、et al:血小板機能に対するプラスグレルとクロピドグレルの負荷量の比較:血小板阻害の大きさは、活性代謝物の形成に関連しています。 Am Heart J 2007; 153:66.e9–16。
- Dobesh PP:チエノピリジンP2Y12阻害剤であるプラスグレルの薬物動態と薬力学。 薬物療法2009;29:1089–1102。
- Asai F、Jacubowski JA、Nagamura H、et al:新規チエノピリジンP747Y2阻害剤であるプラスグレル(CS-12)の血小板阻害活性と薬物動態:健康なヒトにおける単回漸増用量試験。 血小板2006;17:209–217。
- Wiviott SD、Trenk D、Frelinger AL、et al:計画された経皮的冠動脈インターベンションの患者における高負荷および維持用量のクロピドグレルと比較したプラスグレル:血小板活性化および凝集の阻害のためのクロピドグレルと比較したプラスグレル-心筋梗塞における血栓溶解44トライアル。 Circulation 2007; 116:2923–2932。
- Wiviott SD、Antman EM、Winters KJら:経皮的冠動脈インターベンションにおける新規チエノピリジンP747Y640315拮抗薬であるプラスグレル(CS-2、LY12)とクロピドグレルのランダム化比較:血小板を最適に遮断するための薬剤の共同利用の結果(JUMBO )-TIMI26トライアル。 Circulation 2005; 111:3366–3373。
- Brandt JT、Close SL、Iturria SJ、et al:CYP2C19およびCYP2C9の一般的な多型は、クロピドグレルに対する薬物動態学的および薬力学的反応に影響を与えますが、プラスグレルには影響を与えません。 J Thromb Haemost 2007; 5:2429–2436。
- Mega JL、Close SL、Wiviott SD、et al:チトクロームP450遺伝子多型とプラスグレルへの反応:薬物動態、薬力学、および臨床転帰との関係。 Circulation 2009; 119:2553–2560。
- Teng R、Butler K:健康な被験者における、可逆的に結合する経口P2Y(12)受容体拮抗薬であるチカグレロルの単回漸増用量の薬物動態、薬力学、忍容性および安全性。 Eur J Clin Pharmacol 2010; 66:487–496。
- Teng R、Oliver S、Hayes MA、Butler K:健康な被験者におけるチカグレロルの吸収、分布、代謝、および排泄。 Drug Metab Dispos 2010; 38:1514–1521。
- Husted S、Emanuelsson H、Heptinstall S、Sandset PM、Wickens M、Peters G:アテローム性動脈硬化症患者における経口可逆性P2Y12拮抗薬AZD6140とアスピリンの薬力学、薬物動態、および安全性:アスピリンとクロピドグレルの二重盲検比較。 Eur Heart J 2006; 27:1038-1047。
- Gurbel PA、Bliden KP、Butler K、et al:安定した冠状動脈疾患の患者におけるチカグレロル対クロピドグレルの抗血小板効果のONSETおよびOFFSETのランダム化二重盲検評価:ONSET/OFFSET研究。 Circulation 2009; 120:2577–2585。
- ジョージJN:血小板。 Lancet 2000; 355:1531–1539。
- van Giezen J、Nilsson L、Berntsson P、et al:チカグレロルはADPとは独立してヒトP2Y(12)に結合しますが、ADPによって誘発される受容体シグナル伝達と血小板凝集に拮抗します。 J Thromb Haemost 2009; 7:1556–1565。
- Baron TH、Kamath PS、McBane RD:侵襲的処置を受けている患者における抗血栓療法の管理。 N Engl J Med 2013; 368:2113–2124。
- Rodgers RPC、Levin J:出血時間の批判的な再評価。 Semin Thromb Hemost 1990; 16:1–20。
- フェラーリVA、スワンソンE:予期しない手術を受けた患者におけるアスピリンの使用と周術期の失血。 Surg Gynecol Obstet 1983; 156:439–442。
- Mammen EF、Comp PC、Gossselin R他:PFA-100システム。 血小板機能障害を評価するための新しい方法。 Semin Thromb Hemost 1998; 24:195–202。
- Edwards A、Jakubowski JA、Rechner AR、Sugidachi A、Harrison P:INNOVANCE PFA P2Yテストカートリッジの評価:P2Y(12)ブロックに対する感受性と抗凝固剤の影響。 血小板2012;23:106–115。
- Gorog DA、Fuster V:臨床心臓病学における血小板機能検査。 J Am Coll Cardiol 2013; 61:2115–2129。
- Bouman HJ、Parlak E、van Werkum JW、et al:クロピドグレルの反応性をモニターするのに適した血小板機能検査はどれですか? クロピドグレルの活性代謝物に関する薬物動態分析。 J Thromb Haemost 2010; 8:482–488。
- van Werkum JW、Harmsze AM、Elsenberg EH、Bouman HJ、2008 Berg JM、Hackeng CM:抗血小板療法を監視するためのVerifyNowシステムの使用:現在のエビデンスのレビュー。 血小板19;479:488–XNUMX。
- Mueller T、Dieplinger B、Poelz W、Haltmayer M:心血管疾患患者の血小板機能に対するスピリンとクロピドグレルの効果を評価するためのPFA-100装置と新しいマルチプレートアナライザーの有用性。 Clin Appl Thromb Hemost 2009; 15:652–659。
- Scharbert G、Auer A、Kozek-Langenecker S:回転トロンボエラストメトリーROTEMでの血小板マッピングアッセイの評価。 血小板2009;20:125–130。
- Malinin A、Pokov A、Swaim L、Kotob M、Serebruany V:クロピドグレルによる血小板阻害をモニタリングするためのVerifyNow-P2Y12カートリッジの検証。 メソッドは、Exp Clin Pharmacol 2006; 28:315を検索します。
- Benzon HT、Avram J、Green D、Bonow RO:新しい経口抗凝固薬と局所麻酔。 Br J Anaesth 2013; 111(Suppl 1):i96–i113。
- Kearon C、Hirsh J:待機的手術前後の抗凝固療法の管理。 N Engl J Med 1997; 336:1506–1511。
- Harrison L、Johnston M、Massicote MP、et al:ワルファリン療法の開始における5mgと10mgの用量の比較。 Ann Intern Med 1997; 126:133–136。
- Benzon HT、Benzon HA、Kirby-Nolan M、Avram MJ、Nader A:ワルファリン療法の初期段階における国際感度指標の増加の第VII因子レベルと危険因子。 麻酔学2010;112:298–304。
- Schulman S、Lockner D、Bergstrom K、Blomback M:深部静脈血栓症における集中的な初期経口抗凝固療法とより短いヘパリン治療。 Thromb Haemost 10984; 52:276–280。
- Enneking FK、Benzon HT:経口抗凝固薬と局所麻酔:展望。 Reg Anesth Pain Med 1998; 23:140–145。
- Odoom JA、Sih IL:硬膜外鎮痛および抗凝固療法。 麻酔1983;38:254–259。
- Horlocker TT:抗凝固療法を受けている患者の脊髄または硬膜外カテーテルをいつ抜去するか。 Reg Anesth 1993; 18:264–265。
- Horlocker TT、Wedel DJ、Schlichting JL:術後硬膜外鎮痛および経口抗凝固療法。 Anesth Analg 1994; 79:89–93。
- Wu CL、Perkins FM:経口抗凝固薬の予防と硬膜外カテーテルの除去。 Reg Anesth 1996; 21:517–524。
- Liu SS、Buvanendran A、Viscusi ER、et al:ワルファリン療法の開始時に国際感度指標が4365を超える1.4人の患者における硬膜外カテーテルの単純な除去。 Reg Anesth Pain Med 2011; 36:231–235。
- Weinstock DM、Chang P、Aronson DL、et al:長期ワルファリン療法を受けている患者と初期段階の患者における血漿プロトロンビンと第VII因子および尿中プロトロンビンF1濃度の比較。 Am J Hematol 1998; 57:193–199。
- Jerkeman A、Astermark J、Hedner U、et al:抗ビタミンK治療の異なる強度と凝固パラメーターの間の相関。 Thromb Res 2000; 98:467–471。
- Abildgaard U、Lindahl AK、Sandset PM:ヘパリンは、ヒトの血液における抗凝固作用のために、アンチトロンビンと外因性経路阻害剤の両方を必要とします。 止血1991;21:254–257。
- Murray DJ、Brodsnahan WJ、Pennell B、et al:活性化凝固時間によるヘパリン検出:凝固検査とヘパリンアッセイの感度の比較。 J Cardiothorac Vasc Anesth 1997; 11:24–28。
- シャピロSS。 21世紀の血栓症の治療。 N Engl J Med 2003; 349:1762–1764。
- Rao TL、El-Etr AA:硬膜外およびくも膜下カテーテルの留置後の抗凝固療法:神経学的後遺症の評価。 Anesthesisology 1981; 55:618–620。
- Ruff DL、Dougherty JH:抗凝固療法とそれに続く抗凝固療法の合併症。 脳卒中1981;12:879–881。
- Liu SS、Mulroy MF:標準的なヘパリンの存在下での脊髄幹麻酔と鎮痛。 Reg Anesth Pain Med 1998; 23:157–163。
- Chaney MA:心臓手術のための髄腔内および硬膜外麻酔と鎮痛。 Anesth Analg 1997; 84:1211–1221。
- Geerts WH、Bergqvist D、Pineo GF、他:静脈血栓塞栓症の予防。 American College of Chest Physicians Evidence-Based Clinical PracticeGuidelines(第8版)。 胸部2008;133:381S–453S。
- King CS、Holley AB、Jackson JL、et al:一般集団における血栓塞栓症予防のための2007日131回対507回のヘパリン投与:メタアナリシス。 胸部516;XNUMX:XNUMX–XNUMX。
- ワイツJI。 薬物療法:低分子量ヘパリン。 N Engl J Med 1997; 337:688–698。
- Horlocker TT、Heit JA:低分子量ヘパリン:生化学、薬理学、周術期予防レジメン、および局所麻酔管理のガイドライン。 Anesth Analg 1997; 85:874–885。
- Bara L、Billaud E、Gramond G、et al:静脈内および皮下投与後の低分子量ヘパリン(PK 10 169)と未分画ヘパリンの薬物動態の比較。 Thromb Res 1985; 39:631–636。
- Klein S、Slaughter T、Vail PT、et al:低分子量ヘパリンに起因する抗凝固療法の周術期測定としてのトロンボエラストグラフィ:抗Xa濃度との比較。 Anesth Analg 2000; 91:1091-1095。
- ホワイトRH:低分子量ヘパリン:それらはすべて同じですか? Br J Haematol 2003; 121:12–20。
- Horlocker TT、Wedel DJ:脊髄幹麻酔と低分子量ヘパリン:周術期鎮痛と血栓予防のバランスを取ります。 Reg Anesth Pain Med 1998; 23:164–177。
- 米国食品医薬品局。 FDA医薬品安全性コミュニケーション:低分子量ヘパリンを服用している患者の脊柱出血と麻痺のリスクを減らすための最新の推奨事項。 http://www.fda.gov/drugs/drugsafety/ucm373595.htm。 19年2016月9日更新。2015年XNUMX月XNUMX日アクセス。
- ローゼンクイストRW、ブラウンDL:脊髄幹麻酔:線維素溶解剤/血栓溶解剤。 Reg Anesth Pain Med 1998; 23S:152–156。
- バウアーKA:フォンダパリヌクス:静脈血栓塞栓症予防における基本的な特性と有効性および安全性。 Am J Orthop 2002; 31:4–10。
- Turpie AG、Bauer KA、Eriksson BL、et al:主要な整形外科手術における静脈血栓塞栓症の予防のためのフォンダパリヌクス対エノキサパリン:4つのランダム化二重盲検試験のメタアナリシス。 Arch Intern Med 2002; 162:1833–1840。
- Matisse Investigators:肺塞栓症の初期治療における皮下フォンダパリヌクスと静脈内未分画ヘパリンの比較。 N Engl J Med 2003; 349:1695–1702。
- Singelyn FJ、Verheyen CC、Piovella F、Van Aken HK、Rosenceher N、専門家研究調査員:脊髄幹麻酔または深部末梢神経カテーテルの有無にかかわらず、下肢の大規模な整形外科手術後のフォンダパリヌクスによる長期血栓予防の安全性と有効性:専門家勉強。 Anesth Analg 2007; 105:1540–1547。
- Rosencher N、Bonnet MP、Sessler DI:主要な整形外科手術のための選択された新しい抗血栓剤と脊髄幹麻酔:管理戦略。 麻酔2007;62:1154–1160。
- Greenblatt DJ:薬物の半減期の解消:価値と限界。 Ann Rev Med 985; 36:421–427。
- Olesen JB、Lip GY、Hansen ML、et al:心房細動患者の脳卒中と血栓塞栓症を予測するためのリスク層別化スキームの検証:全国コホート研究。 BMJ 2011; 342:d124。
- Connolly G、Spyropoulos AC:NOACの実際的な問題、制限、および周術期管理。 J Thromb Thrombolysis 2013; 36:212–222。
- Garcia D、Barrett YC、Ramaciotti E、Weitz JI:次世代の経口抗凝固剤の抗凝固効果の実験室評価。 J Thromb Haemost 2013; 11:245–252。
- IST-3共同グループ:急性虚血性脳卒中から6時間以内の組換え組織プラスミノーゲン活性化因子による静脈内血栓溶解の利点と害(第3回国際脳卒中試験[IST-2012]):無作為化試験。 Lancet 379; 2352:2363–XNUMX。
- Tertri S、Hakal J、Juvela S、et al:原発性脳内出血後の静脈血栓塞栓症の予防のための低用量皮下エノキサパリンの安全性。 Thromb Res 2008; 123:206–212。
- Liew A、Douketis J:新規経口抗凝固薬を投与されている患者の周術期管理。 Intern Emerg Med 2013; 8:477–484。
- Blech S、Ebner T、Ludwig-Schwellinger E、Stangier J、Roth W:ヒトにおける経口直接トロンビン阻害剤であるダビガトランの代謝と体内動態。 Drug Metab Disposition 2008; 36:386–399。
- Di Nisio M、Middeldorp S、Buller HR 直接トロンビン阻害剤。 N Engl J Med 2005; 353:1028-1040。
- Levy JH、Faraoni D、Spring JL、Douketis JD、Samana CM:周術期および集中治療室での新しい経口抗凝固薬の管理。 麻酔学2013;118:1466–1474。
- Stangier J、Clemens A:経口直接トロンビン阻害剤であるダビガトランエテキシレートの薬理学、薬物動態、および薬力学。 Clin Appl Thromb Hemost 2009; 15(S1):9S–16S。
- Stangier J、Stahle H、Rathgen K、Fuhr R:健康な高齢者における直接経口トロンビン阻害剤ダビガトランの薬物動態および薬力学。 Clin Pharmacokinet 2008; 47:47–59。
- Eisert WG、Hauel N、Stangier J、Wienen W、Clemens A、Van Ryn J:ダビガトラン:トロンビンの経口新規強力で可逆的な非ペプチド阻害剤。 Arterioscler Thromb Vasc Biol 2010; 30:1885–1889。
- Stangier J、Rathgen K、Stahle H、Mazur D:経口ダビガトランエテキシレートの薬物動態および薬力学に対する腎機能障害の影響。 非盲検、並行群間、単一施設の研究。 Clin Pharmacokinet 2010; 49:259–268。
- Ezekowitz MD、Reilly PA、Nehmiz G、他。 非弁膜症性心房細動の患者におけるアスピリンの併用の有無にかかわらず、ダビガトランとワルファリン単独の比較(PETRO研究)。 Am J Cardiol 2007; 100:1419–1426。
- Ericksson BI、Dahl OE、BullerHRなど。 BISTRO II研究グループ:人工股関節全置換術後の血栓塞栓性イベントの予防のためのエノキサパリンと比較した、新しい経口直接トロンビン阻害剤、ダビガトランエテキシレート:BISTROIIランダム化試験。 J Thromb Haemost 2005; 3:103–111。
- Ericksson BI、Dahl OE、Rosencher N、他; RE-MODEL研究グループ:人工膝関節全置換術後の静脈血栓塞栓症の予防のための経口ダビガトランエテキシレート対皮下エノキサパリン:RE-MODELランダム化試験。 J Thromb Haemost 2007; 5:2178–2185。
- Ericksson BI、Dahl OE、Rosencher N、他; RE-NOVATE研究会。 人工股関節全置換術後の静脈血栓塞栓症の予防のためのダビガトランエテキシレート対エノキサパリン:無作為化、二重盲検、非劣性試験。 Lancet 2007; 370:949–956。
- RE-MOBILIZE執筆委員会、Ginsberg JS、Davidson BL、Comp PC他:膝関節形成術後の静脈血栓塞栓症を予防するための経口トロンビン阻害剤ダビガトランエテキシレートと北米のエノキサパリンレジメン。 J関節形成術2009;24:1–9。
- Wolowacz SE、Roskell NS、Plumb JM、Caprini JA、Ericksson BI:股関節または膝関節形成術後の静脈血栓塞栓症の予防に対するダビガトランエタキシレートの有効性と安全性。 メタアナリシス。 Thromb Haemost 2009; 101:77–85。
- Harper P、Young L、Merriman E:虚弱な高齢者におけるダビガトランによる出血リスク。 N Engl J Med 2012; 366:864–866。
- トリポーディA:実験室および直接経口抗凝固薬。 Blood 2013; 121:4032–4035。
- Siegal DM、Cuker A:大出血のある患者における新規経口抗凝固薬の逆転。 J Thromb Thrombolysis 2013; 35:391–398。
- ミヤレスMA、デイビスK:新しい経口抗凝固薬:出血性患者における検査室モニタリングオプションと逆転薬のレビュー。 Am J Health Syst Pharm 2012; 69:1473–1484。
- Baron TH、Kamath PS、McBane RD:侵襲的処置を受けている患者における抗血栓療法の管理。 N Engl J Med 2013; 368:2113–2124。
- Breuer G、Weiss DR、Ringwald J:周術期の設定における「新しい」直接経口抗凝固薬。 Curr Opin Anaesthesiol 2014; 27:409–419。
- LévyS:新しい臨床的に利用可能な抗血栓薬とその解毒剤。 J Interv Card Electrophysiol 2014; 40:269–275。
- Laux V、Perzborn E、Kubitza D、Misselwitz F:リバロキサバンの前臨床および臨床特性:新規の経口直接第Xa因子阻害剤。 Sem Thromb Hemost 2007; 33:515–523。
- Kubitza D、Becka M、Wensing G、Voith B、Zuehlsdorf M:健康な男性被験者に複数回投与した後のBAY 59-7939(経口直接第Xa因子阻害剤)の安全性、薬力学、および薬物動態。 Eur J Clin Pharmacol 2005; 61:873–880。
- Jiang J、Hu Y、Zhang J、et al:中国の高齢者におけるリバロキサバン(経口直接第Xa因子阻害剤)の単回投与の安全性、薬物動態および薬力学。 Thromb Haemost 2010; 103:234–241。
- Kubitza D、Becka M、Roth A、Mueck W:健康な高齢者におけるリバロキサバンの薬物動態および薬力学の用量漸増研究。 Curr Med Res Opin 2008; 24:2757–2765。
- Ericksson BI、Quinlan DJ、Weitz JI:開発中の経口直接トロンビンおよび第Xa因子阻害剤の薬力学と薬物動態の比較。 Clin Pharmacokinet 2009; 48:1–22。
- Weitz JI、Eikelboom JW、Samama MM:新しい抗血栓薬。 チェスト2012;141S:e120S–e151S。
- Kubitza D、Becka M、Mueck W、et al:経口直接第Xa因子阻害剤であるリバロキサバンの薬物動態、薬力学および安全性に対する腎機能障害の影響。 Br J Clin Pharmacol 2010; 70:703–712。
- Patel MR、Mahaffey KW、Garg J、他; ROCKET AF Investigators:非弁膜症性心房細動におけるリバロキサバンとワルファリンの比較。 N Engl J Med 2011; 365:883–891。
- Eriksson BI、Borris LC、Friedman RJ、他; RECORD1研究グループ:股関節形成術後の血栓予防のためのリバロキサバン対エノキサパリン。 N Engl J Med 2008; 358:2765–2775。
- Kakkar AK、Brenner B、Dahl O、他; RECORD2研究者:人工股関節全置換術後の静脈血栓塞栓症の予防のための長期リバロキサバン対短期エノキサパリン:二重盲検ランダム化比較試験。 Lancet 2008; 372:31–39。
- ラッセンMR、アゲノW、ボリスLC、他; RECORD3 Investigators:人工膝関節全置換術後の血栓予防のためのリバロキサバンとエノキサパリンの比較。 N Eng J Med 2008; 358:2776–2786。
- Turpie AG、Lassen MR、Davidson BL、他; RECORD4研究者:人工膝関節全置換術後の血栓予防のためのリバロキサバン対エノキサパリン(RECORD4):ランダム化試験。 Lancet 2009; 373:1673–1680。
- Ericksson BI、Kakkar AK、Turpie AG他:選択的股関節および膝関節置換術後の症候性静脈血栓塞栓症の予防のための経口リバロキサバン。 J Bone Joint Surg Br 2009; 91:636–644。
- Rosencher N、Liau JV、Mueck W、Loewe A、Berkowitz SD、Homering M:人工股関節全置換術後の脊髄幹麻酔の発生率:RECORDプログラム(リバロキサバンvs、エノキサパリン)。 Acta Anaesthesiol Scand 2013; 57:565–572。
- サママMM:リバロキサバンの抗凝固効果を測定するために使用するテスト:抗第Xa因子アッセイ。 J Thromb Haemost 2013; 11:579–580。
- Raghavan N、Frost CE、Yu Z、et al:ヒトへの経口投与後のアピキサバン代謝と薬物動態。 Drug Metab Dispos 2009; 37:74–81。
- Frost C、Wang J、Nepal S、et al:アピキサバン、経口直接第Xa因子阻害剤:健康な被験者における単回投与の安全性、薬物動態、薬力学および食物効果。 Br J Pharmacol 2013; 75:476–487。
- Frost C、Nepal S、Wang J、et al:健康な被験者における第Xa因子阻害剤であるアピキサバンの複数回経口投与の安全性、薬物動態および薬力学。 Br J Clin Pharmacol 2013; 76:776–786。
- Zhang D、He K、Raghavan N、et al:マウス、ラット、ウサギ、イヌ、およびヒトにおける14C標識アピキサバンの代謝の比較。 Drug Metab Dispos 2009; 37:1738–1748。
- ラッセンMR、デビッドソンBL、ガルスA、ピネオG、アンセルJ、ディッチマンD:人工膝関節全置換術後の患者の血栓予防としての経口直接第Xa因子阻害剤であるアピキサバンの有効性と安全性。 J Thromb Haemost 2007; 5:2368–2375。
- Lassen MR、Rasskob GE、Gallus A、Pineo G、Chen D、Portman RJ:膝関節置換術後の血栓予防のためのアピキサバンまたはエノキサパリン。 N Engl J Med 2009; 361:594–604。
- ラッセンMR、ラスコブGE、ガルスA、ピネオG、チェンD、ホーニックP; ADVANCE-2研究者:膝関節置換術後の血栓予防のためのアピキサバン対エノキサパリン(ADVANCE-2):無作為化二重盲検試験。 Lancet 2010; 375:807–815。
- ラッセンMR、ガルスA、ラスコブGE、ピネオG、チェンD、ラミレスLM; ADVANCE-3 Investigators:股関節置換術後の血栓予防のためのアピキサバン対エノキサパリン。 N Engl J Med 2010; 363:2487–2498。
- Barrett YC、Wang Z、Frost C、Shenker A:直接第Xa因子阻害剤の臨床検査測定:プロトロンビン時間アッセイよりも抗Xaアッセイの方が好ましい。 Thromb Haemost 2010; 104:1263–1271。
- Kozek-Langenecker SA、Fries D、Gutl M、et al:局所麻酔および凝固阻害剤。 オーストリア麻酔学会および集中治療医学の周術期凝固に関するタスクフォースの勧告。 Anaesthesist 2005; 54:476–484。
- Siegal DM、Curnutte JT、Connolly SJ、他。 第Xa因子阻害剤活性の逆転のためのアンデキサネットアルファ。 N Engl J Med 2015; 373:2413–242