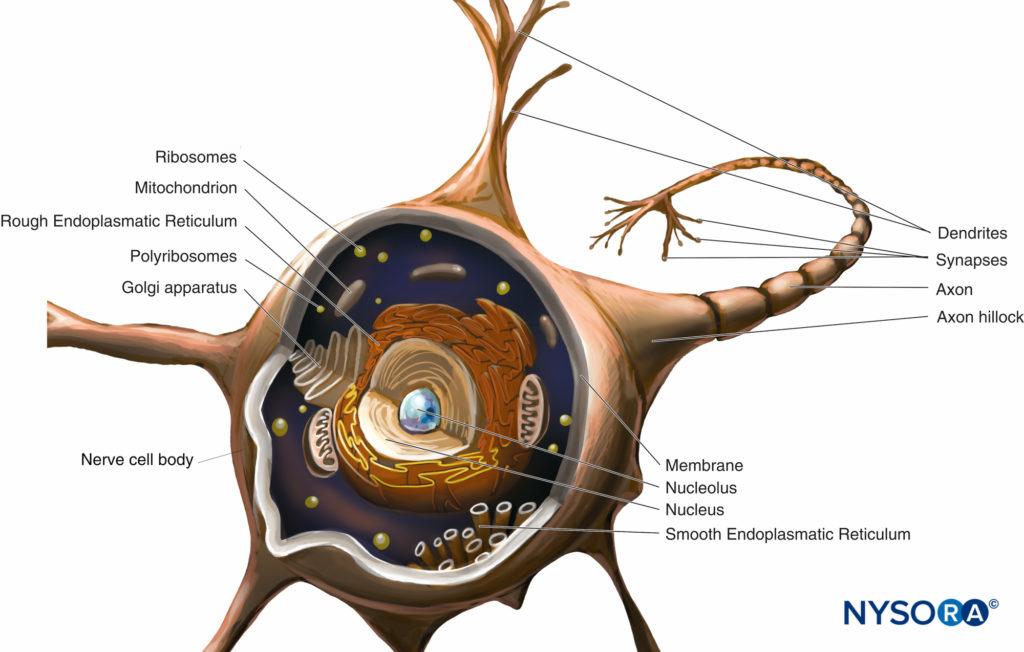
コリン・J・L・マッカートニーとスティーブン・チェ
はじめに
末梢神経ブロックは、優れた疼痛管理や全身麻酔関連の副作用の軽減など、患者に多くの利点をもたらします。 局所麻酔薬の総投与量を減らしながら痛みの緩和を最適化するには、発症を早め、感覚ブロックまたは鎮痛効果を延長する薬剤を追加すると便利です。 末梢神経系(PNS)の痛みのメカニズムに関する知識の向上により、中枢および末梢を介した副作用を軽減しながら、鎮痛を延長する方法を開発することができます。 過去20年間で、多くの薬剤がテストされ、末梢神経ブロックの局所麻酔薬に追加された場合、または局所浸潤または関節内鎮痛に使用された場合、いくつかの薬剤が臨床的に有用であることが証明されました。 これらの薬は鎮痛アジュバントとして知られています。 この章では、鎮痛補助剤の使用の理論的根拠と現在の証拠を検討し、末梢神経ブロック下での手術、局所浸潤、または関節内腔への薬物注射後の疼痛管理を最適化し、悪影響を軽減するための最良の戦略を要約します。
使用の根拠
CNSおよびPNSでの痛みの伝達には、1645つの薬剤タイプまたは技術だけでは簡単にブロックされない、複雑な一連の神経伝達物質および経路が含まれます。 損傷部位、末梢神経、脊髄の後角、および脊髄上部位でのいくつかのクラスの神経伝達物質の関与が、侵害受容の伝達に関与している。 抑制性受容体でのアゴニストと興奮性受容体でのアンタゴニストの使用は、疼痛管理の最適化と副作用の低減を伴う「マルチモーダル」アプローチを可能にします。 XNUMX年、デカルトは痛みの伝達メカニズムを提案しました。これは、末梢の痛みの衝動が、中間的な変調なしに「ハードワイヤード」システムによって末梢から脳に直接伝達されることを示唆しています(図1).
この痛みの伝達の理論は、40年前まで広く真実でした。 1965年、メルザックとウォールは、痛みの画期的なゲートコントロール理論を提案しました。これは、痛みが痛みの経路の多くのポイントで調整または「ゲート」される可能性があることを示唆しています。 その後の研究により、脊髄の後角(ラミナII)が潜在的な調節の重要な部位であることが確認され、その後の急性および慢性の痛みの治療では、この知識が有効に活用されています。 この知識に照らして、脊髄オピオイドの使用や経皮的電気神経刺激(TENS)などの治療法が開発されました。 ゲート理論はまた、多くの(しばしば失敗する)疼痛管理戦略を、化学的または外科的に疼痛経路を除去しようとした技術から、興奮性の影響を抑制し、疼痛経路内の抑制性の影響を強化しようとするより最近の調節技術に変更しました。 過去数十年の間に、痛みがどのように発生し、PNSから中枢神経系(CNS)に伝達されるかについての知識にも重要な進歩が見られました。 PNSの痛みの調節には、侵害受容経路を刺激および阻害する多数の伝達物質とメカニズムも含まれます。 PNSでは、通常の生理学的条件下で、A-αおよびC線維が熱、圧力、または組織の損傷や炎症によって生成されるいくつかの化学物質(カリウム、ヒスタミン、ブラジキニン、プロスタグランジン、アデノシン三リン酸[ATP])によって刺激されると、侵害受容信号が生成されます。 。 侵害受容信号は、脊髄の後角のラミナIIの表層に伝達され、そこでシナプス前およびシナプス後レベルの両方で、また興奮性および抑制性の下降制御経路によって脳幹を形成します(図2)。 このゲートを通過するのに成功した信号は、大脳皮質に到達して痛みの刺激を生み出す前に、脳幹と視床に伝わります。 さまざまな化学メディエーターがPNSで生成され、損傷の急性期と慢性期の両方で末梢感覚神経伝達に興奮性と抑制性の両方の影響を及ぼします(図3)。 これらは神経を直接活性化することができます(ATP、グルタミン酸、5-ヒドロキシトリプタミン[5-HT]、ヒスタミン、ブラジキニン)。 神経を他の刺激(プロスタグランジン、プロスタサイクリン、およびインターロイキンなどのサイトカイン)に感作させることにより、脱分極を促進します。 または、感覚ニューロン、炎症細胞、交感神経線維(ブラジキニン、タキキニン、神経成長因子)に調節的役割を果たします。
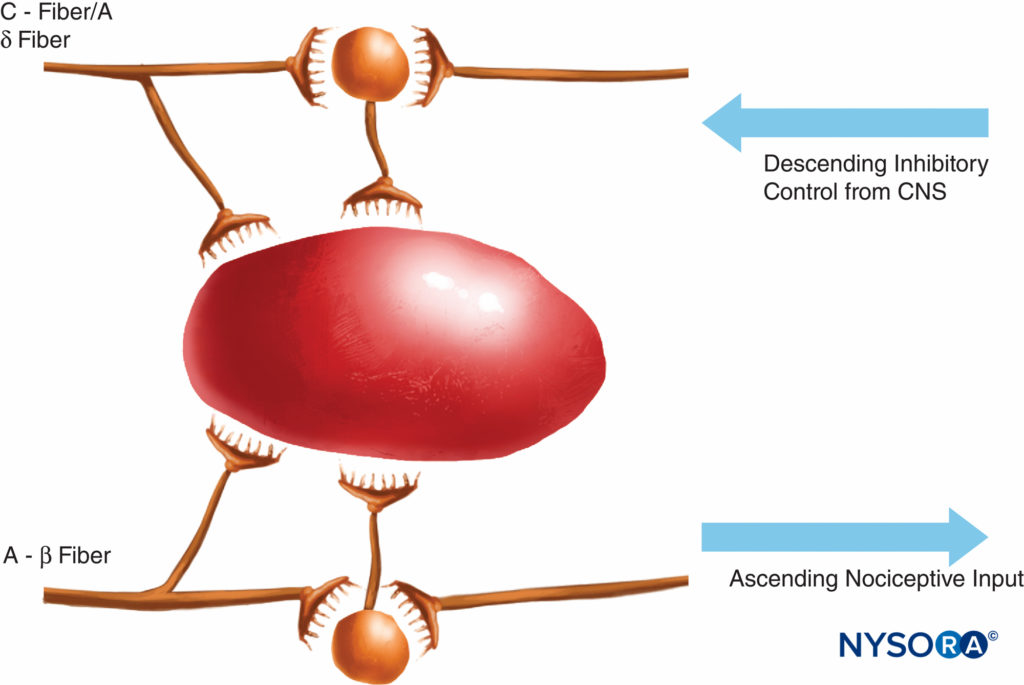
図2 ゲート理論は、小さな(C)線維が興奮性システム(黒いニューロン)を活性化し、その後出力細胞を興奮させることを提案しました。 これらの後者の細胞は、大繊維(A-β)を介した抑制(内因性オピオイドによって媒介される)のバランスによって、また中枢神経系からの下降制御システム(ノルエピネフリンとセロトニンによって媒介される)によってそれらの活性を制御しました。
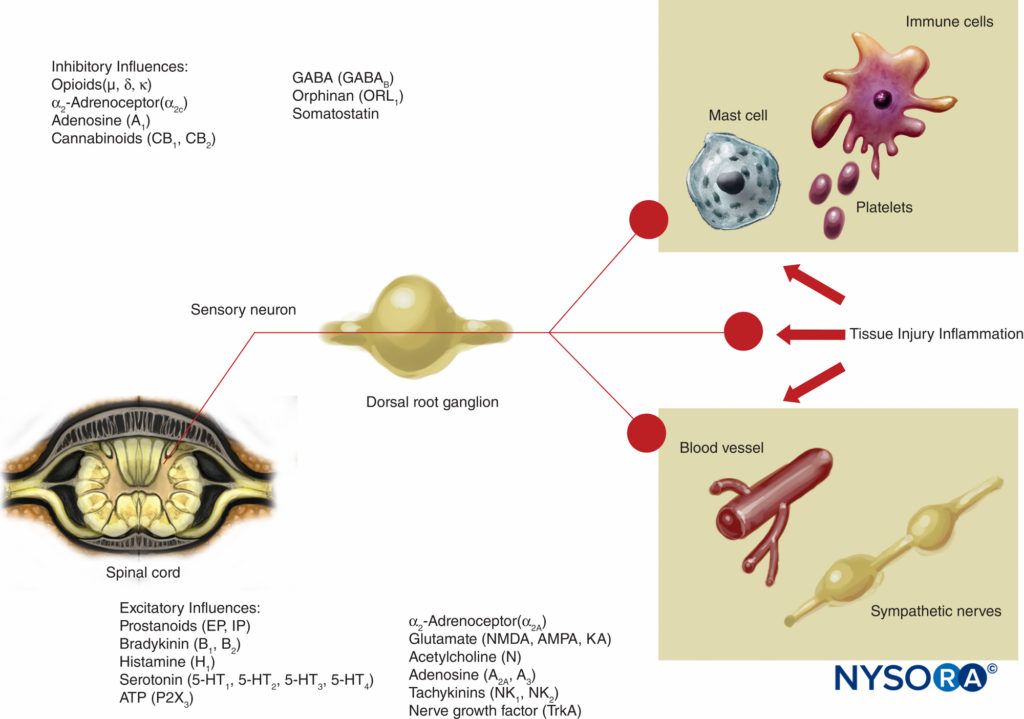
図3 組織の損傷や炎症によって放出されるメディエーターや、神経受容体に作用するさまざまな薬剤による末梢神経活動に対する興奮性および抑制性の影響。 AMPA=α-アミノ-3-ヒドロキシ-5-メチルイソキサゾール-4-プロピオン酸; KA=カイニン酸; NMDA=N-メチル-d-アスパラギン酸; NK=ニューロキニン; TrkA=トロポミオシン受容体キナーゼA。
鎮痛補助剤の使用の根拠
前に述べたように、CNSとPNSの痛みの伝達には、2つの薬の種類や技術だけでは簡単にブロックされない神経伝達物質と経路の複雑な配列が含まれます。 オピオイド、非ステロイド性抗炎症薬(NSAID)、αXNUMXアゴニスト、デキサメタゾン、N-メチルアスパラギン酸(NMDA)拮抗薬など、麻酔科医の兵器庫にある多くの薬は、これらの作用部位で活性を示し、 PNSに適用されます。 重要なことに、臨床的に適切な濃度で神経毒性を示したものはありません。
この知識は、さまざまな方法で地域の麻酔科医を支援することができます。
- 局所麻酔薬のアジュバントの選択において、発症を早め、効果を延長し、必要な総投与量を減らします。
- 局所麻酔薬の副作用を長引かせることなく術後鎮痛を強化できる薬剤を提案します。
- 中枢神経系の副作用を最小限に抑えながら鎮痛を最適化することにより、中枢神経系への影響なしに主に末梢部位で作用する薬剤を提案します。
オピオイド鎮痛薬
炎症の間、オピオイド受容体は末梢感覚線維と免疫細胞で発現します。 さらに、内因性オピオイドはこれらの細胞から放出され、炎症によって生じる侵害受容状態の増加のバランスを取ります。 増加する一連の研究は、内因性オピオイドと免疫系の間の密接な関係を示唆しています。 ベルリンのクリストフ・スタインと同僚は、免疫系が内因性オピオイドを送達する能力と、炎症がオピオイド受容体の損傷部位への移動を刺激し、それによって痛覚抑制を可能にする能力を説明した多くの先駆的な研究を行ってきました。 ただし、これらの変化は怪我の直後には発生せず、発生するまでに最大96時間かかる場合があります。 オピオイド受容体と神経ペプチド(サブスタンスPなど)は後根神経節で合成され、軸索内微小管に沿って一次求心性ニューロンの中枢および末梢突起に輸送されます(図4)。 末端では、オピオイド受容体が神経細胞膜に組み込まれ、機能的な受容体になります。 外因性または内因性オピオイド(免疫細胞によって放出される)による活性化で、オピオイド受容体は阻害性Gタンパク質に結合します。 これは、Ca2+またはNa+電流の直接的または間接的(サイクリックアデノシン一リン酸の減少による)抑制とそれに続くサブスタンスP放出の減衰につながります。
神経周膜の透過性は炎症を起こした組織内で増加し、オピオイドが標的受容体に到達する能力を高めます。 多くの研究が、PNSのオピオイドを末梢神経または関節内腔のいずれかに適用しています。 多くの研究が末梢に適用されたオピオイドの鎮痛効果を主張しましたが、比較のために全身的に適用されたオピオイドを含む対照群を組み込んだ研究はほとんどありません。 コントロールを含めないと、末梢オピオイドが真の末梢効果を示しているのか、鎮痛を誘発するために中枢神経系に運ばれているのかを解釈することは不可能です。 真の末梢介在性オピオイド鎮痛は、全身投与と比較して鎮痛の改善または副作用の軽減に関連している場合に有益である可能性があります。 効果が一元的に媒介される場合、全身投与に勝る明確な利点はありません。
神経周囲オピオイド
一次求心性線維で同定されたオピオイド受容体は、後根神経節から炎症部位に輸送されます。 しかし、それらが軸索輸送を受けている間、それらはオピオイドアゴニストによって容易に到達されないかもしれません。 これは、1997年と2000年に発表されたXNUMXつの最近の系統的レビューが、末梢神経ブロックの局所麻酔薬にオピオイドを追加することの利点についてほとんど証拠を見つけられなかった理由を説明するかもしれません。 オピオイド(ブプレノルフィンとトラマドールを除く)の神経周囲投与を調べた研究の最新の表は、鎮痛効果があいまいなままであることを示しています(テーブル1)。 さらに、PengとChoyceは、静脈内局所麻酔(IVRA)でのオピオイドの使用をレビューし、同様の残念な結論を出しました。
表1 神経周囲/神経周囲オピオイド(トラマドールとブプレノルフィンを除く)の効果を調べた研究の結果。
| 総合研究 | 全体的な結果 | 全身制御の結果 |
|---|---|---|
| 19研究 | 10協力的 | 7全身制御: 5協力的; 2ネガティブ |
| 9否定 | 12全身制御なし:5 協力的; 7ネガティブ。 |
これらの残念な結果にもかかわらず、ニューロン周囲に投与されたときに鎮痛効果を示した24つのオピオイドアゴニストは、ブプレノルフィンとトラマドールです。 ブプレノルフィンは、フェンタニル(50倍)またはモルヒネ(0.3倍)と比較して非常に高い受容体親和性を持つ部分的なμ受容体アゴニストです。 さらに、それは中程度の脂溶性を持っており、それはそれが神経膜を通過することを可能にします。 Candidoらは、100 mgのブプレノルフィン(部分的オピオイドアゴニスト)を腋窩ブロックのメピバカインとテトラカインの組み合わせに追加し、腋窩ブロックと同じ用量の筋肉内ブプレノルフィンの投与と比較して、鎮痛期間がほぼXNUMX%増加することを発見しました。悪影響の有意な増加はありません。 これは、ブプレノルフィンの末梢鎮痛効果と、全身対照群なしでブプレノルフィンを調べたXNUMXつの研究の以前の発見を裏付けています。 ブプレノルフィンを調べる研究は、 テーブル2.
表2 局所麻酔薬による鎮痛補助剤としてのブプレノルフィンを検討する研究。
| 著者/日付 | 忍耐/ グループ | ブロックタイプ | 粉量 | 局所麻酔薬 | 全身の 管理 | 結果 |
|---|---|---|---|---|---|---|
| ヴィエル 1989 | 20/2 | 鎖骨上 | 3 mcg / kg | ブピバカイン0.5%40 mL | いいえ | モルヒネ群と比較して鎮痛が長引く(35時間対18.25時間)。 感覚ブロックに違いはありません。 |
| バジン 1997 | 89/4 | 鎖骨上 | 3μg/kg | ブピバカイン0.5% リドカイン1% | いいえ | 対照群と比較した長期の鎮痛(20時間対11.5時間) |
| カンディド 2001 | 40/2 | 鎖骨上 | 0.3ミリグラム | メピバカイン1% テトラカイン0.2% | いいえ | 対照群と比較した長期の鎮痛(17.4時間対5.3時間) |
| カンディド 2002 | 60/3 | 腋窩 | 0.3ミリグラム | メピバカイン1% | 有り | 術後鎮痛の平均持続時間は、腋窩群で22.3時間、IM群で12.5時間、プラセボ群で6.6時間でした。 |
| テトラカイン0.2% | IM |
トラマドールは弱いオピオイドアゴニストであり、μ受容体に対してある程度の選択性があり、ノルエピネフリンの再取り込みを阻害し、髄腔内のセロトニン放出を刺激します。 ノルエピネフリンとセロトニンは、脊髄の下降制御経路の伝達物質であり、鎮痛を促進します。 Kapralらは、腋窩腕神経叢ブロックにおけるメピバカインの補助剤として100mgのトラマドールを使用しました。 彼らは60人の患者を1つのグループに分けました:2つのグループは1mLの生理食塩水で100%のメピバカインを受け取り、1番目のグループは2mgのトラマドールで100%のメピバカインを受け取り、01番目のグループは40mLの生理食塩水と100mgのトラマドールで200%のメピバカインを静脈内投与しました。 この研究は、腋窩トラマドール群で運動および感覚遮断の持続時間が増加し、静脈内投与群とプラセボ群の両方よりも有意に(p <.1.5)長持ちしたことを示しました。 その後、Robauxらは、プラセボと200、1.5、および0.5 mgのトラマドールを腋窩ブロックのメピバカイン0.5%の固定用量に加えて用量反応研究を行い、120mgの用量が最良の鎮痛をもたらすことを発見しました。悪影響の増加はありません。 Alemannoらは、斜角筋間ブロック用の14.5%レボブピバカイン(10.1 mL / kg)の補助剤として001 mg/kgのトラマドールを使用しました。 ここでは、XNUMX人の患者をXNUMXつのグループに分けました。XNUMXつのグループは局所麻酔薬のみを投与され、XNUMX番目のグループは全身トラマドールを使用した局所麻酔薬を投与され、XNUMX番目のグループは神経周囲トラマドールを使用した局所麻酔薬を投与されました。 トラマドールを投与された両方のグループは、プラセボと比較して長期の鎮痛を経験しましたが、神経周囲のトラマドールを投与されたグループは、全身のトラマドールと比較して長期の鎮痛を経験しました(XNUMX対XNUMX時間; p <.XNUMX)。
関節内オピオイドおよびその他の末梢投与経路
炎症を起こした組織に投与されたオピオイドアゴニストは、感覚終末のオピオイド受容体に結合し、鎮痛を誘発します。 動物実験では、これらの末梢オピオイド受容体は最初の炎症性損傷の96時間後に発現することが示されました。 したがって、オピオイドの関節内投与は、既存の炎症を有する患者にのみ鎮痛をもたらすであろう。 Kalsoらは、1997年に関節内オピオイドの役割を体系的に調査し、1〜5mgの用量で重大な副作用なしに関節内モルヒネからの長期的な利益の証拠が存在することを確立しました。 用量反応は検出されませんでした。 最近の記事はこの発見を支持し、関節内モルヒネ、トラマドール、ブプレノルフィン、およびスフェンタニルの利点を示しました。 ただし、関節内モルヒネの効果の系統的レビューでは、軽度の鎮痛効果[痛みの視覚的アナログ尺度(VAS)12〜17 mmの減少]のみが示されましたが、効果が全身吸収によって媒介されたことを排除できませんでした。
ALPHA2-アゴニストとクロニジン
クロニジンは、いくつかのα2刺激効果を持つα1アゴニストです。 それは伝統的に降圧剤として使用されており、長年にわたって鎮静および鎮痛効果があることが知られています。 最近では、α2受容体が脊髄の後角に存在することが判明し、これらの受容体の刺激は、サブスタンスPやグルタミン酸などの興奮性伝達物質のシナプス前放出を阻害することによって鎮痛効果を生み出します。 くも膜下腔内クロニジンは、アセチルコリンレベルを増加させることによって鎮痛を仲介し、それが次にムスカリン受容体を刺激します。 ムスカリン性興奮は、一次求心性線維へのγ-アミノ酪酸レベルを増加させ、興奮性神経伝達物質グルタミン酸の放出を阻害します。 局所麻酔薬の有無にかかわらず末梢神経の近くに注射されたクロニジンは、多くの方法で鎮痛を媒介するようです。 クロニジンは局所麻酔特性を持ち、ラット坐骨神経のA-α線維よりも大きいC線維の複合活動電位を強壮的に阻害し、ウサギ迷走神経のC線維を阻害する能力においてリドカインに匹敵しました。 クロニジンはまた、α1受容体での血管収縮作用によって媒介される局所麻酔薬の再分布に対して薬物動態学的作用を及ぼします。 最近の動物モデルは、クロニジンが過分極活性化カチオン電流を介して末梢神経ブロックを主に促進し、この効果が血管収縮効果とは無関係であることを実証し、支持しています。 α2アゴニストの選択に最近追加されたのはデクスメデトミジンであり、これはα2受容体に選択的であり、現在、集中治療室で鎮静剤として主に研究されています。 デクスメデトミジンは、作用の選択性のために、より深刻な鎮痛だけでなく、より大きな副作用を引き起こすと予想されるかもしれません。 α2受容体の刺激は、高用量で低血圧、徐脈、および鎮静を引き起こし、これらの効果は、これらの薬剤の使用によってもたらされる鎮痛効果を上回る可能性があります。
神経周囲アプリケーション
現在、ヒトを対象とした30以上の研究で、末梢神経ブロックの局所麻酔薬に対するクロニジンの効果が調べられています。 これらの研究から、1.5 µg / kgまでの用量のクロニジンが、末梢神経ブロックの局所麻酔薬とともに投与された場合、感覚ブロックと鎮痛を延長するという十分な証拠があります。 これは、クロニジンが末梢神経ブロックに追加されたときに有益なアジュバントであり、その効果はPNSで媒介される可能性が最も高いというマーフィーと同僚の初期の意見を支持しています。 末梢神経ブロックに添加されたクロニジンの効果を調べた研究は数多くありますが、全身効果を制御しているのはごくわずかです。 Singelynらは、30 mLの40%メピバカインと1 µg/mLのエピネフリンを含む腋窩腕神経叢ブロックを受けている5人の患者を評価しました。 患者は1つのグループにランダム化され、(2)局所麻酔薬のみ、(150)局所麻酔薬と3 µgのクロニジンを皮下投与、または(150)0.25 µgのクロニジンを腕神経叢ブロックに局所麻酔薬とともに投与しました。 腋窩腕神経叢ブロックに追加されたクロニジンは、全身コントロールと比較した場合、悪影響なしに、痛みの発症をXNUMX倍遅らせました。 Hutschalaらは最近、XNUMX%ブピバカインを含む腕神経叢ブロックに追加した場合のボランティアにおけるクロニジンの末梢鎮痛効果を実証しました。
しかし、他の最近の研究では、ブピバカインやロピバカインなどの長時間作用型局所麻酔薬にクロニジンを追加することの全体的な利点は示されていません。 最近では、Poppingと同僚によるメタアナリシスにより、クロニジンが術後鎮痛、感覚ブロック、運動ブロックをそれぞれ122分、74分、141分延長したと推定されました。 ただし、クロニジンは、低血圧(オッズ比[OR] 3.61)、失神(OR 5.07)、鎮静(OR 2.28)、および徐脈(OR 3.09)の可能性も増加させました。 30〜300 µgの範囲で用量反応は観察されず、大部分は150 µgを投与されました。 連続的な末梢神経ブロックへのクロニジンの追加は有益ではありません。 Ilfeldらは、0.1つの研究で、ロピバカイン0.2%の持続注入に0.2および284 µg / mLのクロニジンを追加しても、上肢手術後の疼痛スコアまたは経口鎮痛薬の使用を減らすことができなかったことを示しました。 デクスメデトミジンは、以前に仮定されたように、局所麻酔薬と組み合わせて神経周囲に適用された場合、実際に鎮痛に対してより深刻な効果をもたらします。 最近XNUMXつの研究がこれを調査し、メタアナリシスはデクスメデトミジンが腕神経叢ブロックの鎮痛効果をXNUMX分延長することを示唆しました。 興味深いことに、デクスメデトミジンはクロニジンよりも血行力学的効果が大きい可能性があるという最初の懸念にもかかわらず、これは当てはまらないようです。
静脈内局所麻酔
静脈内局所麻酔は、止血帯の耐性と術後鎮痛が不十分なために制限される軽度の末梢上肢手術に特に有用で単純な局所麻酔技術です。 クロニジンは、発症時間と術中の止血帯耐性を改善するために多くの研究で実証されています。 プラセボと比較して術後早期に改善された術後鎮痛を示した研究は45つだけです。 Reubenらは、40人の患者をクロニジン0.5 µg /kgを含む1%リドカイン150 mL、クロニジンを静脈内投与したリドカインのみ、生理食塩水を静脈内投与したリドカインのみにランダムに割り当てました。 リドカインとともにクロニジンを投与された患者は、他の0.5つのグループの患者よりも、痛みが大幅に少なく、鎮痛薬の要求も少なかった。 クロニジンの高用量(0.5 µg)は、有意に多くの鎮静作用と低血圧の発生率をもたらしました。 現在までに、IVRAでデクスメデトミジンを使用した研究はXNUMXつだけです。 Memisらは、XNUMX%のリドカインにXNUMX µg / kgのデクスメデトミジンを追加し、プラセボと比較して発症時間の短縮と術後鎮痛の改善を示しましたが、重大な副作用はありませんでした。
関節内技術
クロニジンの関節内効果は、局所麻酔薬の有無にかかわらず投与されたときに調べられ、術後鎮痛に有益な効果があることがわかりました。 モルヒネとクロニジンの添加は、相加効果があると期待されるかもしれません。 XNUMXつの研究がこの質問を調査しました。XNUMXつは鎮痛の改善を示し、もうXNUMXつは違いがないことを示しています。 前臨床試験では、オピオイドと同様に、クロニジンを介した鎮痛が炎症によって増強されることが示されていますが、現時点ではメカニズムは明らかではありません。
デキサメタゾン
デキサメタゾンは強力な合成コルチコステロイドであり、プレドニゾロンの約36倍の抗炎症作用があり、鉱質コルチコイド活性はほとんどありません。 周術期の設定での半減期は約54〜4時間です。 術後制吐薬(静脈内10〜60 mg)としてのデキサメタゾンの有効性は、0.31を超えるランダム化比較試験によって確認されており、最近のメタアナリシスでは、ORが3.7、治療に必要な数値が24(NNT)と推定されています。 その全身性の抗炎症特性を考慮して、デキサメタゾンの単一の術前静脈内投与の鎮痛効果は、24時間までの適度な効果で2011以上のランダム化試験で調査されました。 2751年に発表されたこのメタアナリシスには0.64人の患者が含まれ、デキサメタゾン投与後24時間までに疼痛の言語評価尺度(VRS)スコアが最大XNUMXポイントに低下したと推定されました。 これらのレビューの前に、デキサメタゾンの特定の薬理作用のin vitroおよびマウスの研究は、全身投与に加えていくつかの新しいアプリケーションをもたらしました。
神経周囲アプリケーション
神経周囲コルチコステロイドは、炎症性メディエーターの放出の減弱、異所性ニューロン放電の減少、カリウムチャネルを介した侵害受容性C線維の放電の抑制など、いくつかのメカニズムによってその効果を発揮すると考えられています。 デキサメタゾンは、局所麻酔薬と併用して投与すると、末梢神経ブロックの質と持続時間を改善すると広く信じられています。 ただし、米国食品医薬品局(FDA)(またはその他の規制機関)は、神経周囲投与用のデキサメタゾンを承認していません。 それにもかかわらず、複数の研究により、デキサメタゾン(4〜10 mg)と末梢神経ブロックの局所麻酔薬を組み合わせた効果が評価されています。 デキサメタゾンで実施された上肢および下肢の末梢神経ブロックは、局所麻酔薬のみで実施されたものを超えて約50%から75%の範囲の鎮痛または感覚/運動ブロックの延長を示した。 これまでの8つの研究だけが、末梢神経ブロックとの関連で神経周囲と全身のデキサメタゾンを比較しました。 この研究では、患者をプラセボまたは12mgの神経周囲または全身性デキサメタゾンによる斜角筋間腕神経叢ブロックにランダム化しました。 著者らは、両方のデキサメタゾン群で、全身投与と神経周囲投与でそれぞれ20時間から約22時間とXNUMX時間までのブロック延長を示し、全身投与と神経周囲デキサメタゾン投与は同等であると結論付けました。 最終的な結論を出す前に、神経周囲と全身のデキサメタゾンの効果を比較するさらなる研究が必要です。 血糖値への影響や複数回投与バイアルで使用される防腐剤による神経毒性など、デキサメタゾンに関連する合併症に対する懸念は実際には明らかではありません。 特に、デキサメタゾンの単回投与は、神経周囲または全身に投与されたかどうかにかかわらず、臨床的に有意な程度まで血糖を上昇させなかった。 亜硫酸水素ナトリウムのマウス研究は、髄腔内投与で神経毒性を示さなかった。
静脈内局所麻酔
Bigatらは、ランダム化試験でデキサメタゾンをリドカインIVRAに追加した場合の効果を調査しました。 8人の患者がプラセボを含むリドカイン、リドカインを含む8mgのデキサメタゾン、またはXNUMXmgの全身性デキサメタゾンにランダム化されました。 この研究では、全身性デキサメタゾンはIVRAの有効性に影響を及ぼさなかったが、リドカインとデキサメタゾンの併用はブロック特性の改善を示した。
N-メチル-アスパラギン酸受容体拮抗薬
脊髄の後角内では、イオノトロピック[N-メチル-アスパラギン酸(NMDA)]、α-アミノ-3-ヒドロキシ-5-メチルイソキサゾール-4-プロピオン酸(AMPA)、カイニン酸(KA)、および代謝型の両方グルタミン酸受容体は、慢性疼痛の状態における侵害受容シグナル伝達および中枢性感作に関与しています。 最近、複数のグルタミン酸受容体が末梢神経終末で発見されており、末梢痛のシグナル伝達に寄与している可能性があります。 NMDA受容体アゴニストであるグルタミン酸を咬筋に注射すると、ラットとヒトの両方に痛みが生じます。 その後のケタミンやデキストロメトルファンなどのNMDA受容体拮抗薬の注射は、痛みを和らげます。
多くの研究が、患者の末梢を介した鎮痛の生成におけるNMDA拮抗薬の効果を調べました。 Tverskoyらは、鼠径ヘルニアを患っている患者のために0.3%ケタミンまたはプラセボをブピバカインに浸透させ、ケタミンが浸潤麻酔のために投与された局所麻酔薬の麻酔および鎮痛作用を有意に増強することを発見しました。 ケタミンはIVRAの唯一の麻酔薬として使用されてきましたが、患者は止血帯の収縮に過度の悪影響を及ぼしました。 他の労働者は、IVRAのためにリドカインにケタミン(0.1 mg / mL)またはクロニジン(1 µg / kg)を追加しました。 クロニジンとケタミンの両方がリドカイン単独と比較して鎮痛薬の消費を有意に減少させたが、ケタミン群の患者は最高の疼痛管理を示し、ケタミン群では軽度の精神異常発現薬の副作用があった。 0.5つの研究が関節内ケタミンの使用を検討しました。 Dalらは、患者を関節内ケタミン(1 mg / kg)、ネオスチグミン、ブピバカイン、またはプラセボにランダム化した。 1.5つの薬すべてを投与された患者は、プラセボと比較して膝屈曲を伴う鎮痛において同様の改善が見られました。 しかし、ケタミン群は鎮痛の持続時間が最も長かった。 Brillらは、膝関節鏡検査後に最大0.5 mg / kgの関節内ケタミンを使用して用量反応研究を実施し、鎮痛効果はプラセボと比較して手術後の最初の6時間にのみ発生することを発見しました。 マグネシウムにはNMDA遮断効果があり、正常な生理状態の間にNMDA受容体のイオンチャネルを遮断します。 脊髄の後角への持続的な侵害受容入力はマグネシウムを除去し、カルシウムの流入と細胞内の変化を可能にし、持続的な痛みの状態をもたらします。 Turan et alは、IVRA用のリドカインXNUMX%にXNUMX gのマグネシウムを加えることにより、PNSのこの鎮痛の可能性を利用しました。 マグネシウムは、発症時間を短縮し、手術後XNUMX時間まで鎮痛効果を大幅に延長しましたが、副作用に違いはありませんでした。 全体として、NMDA拮抗薬は、将来、末梢を介した鎮痛を引き起こす可能性がありますが、現在利用可能な薬剤(IVRAのマグネシウムを除く)の効果は限られており、高用量では過度の副作用が生じます。
シクロオキシゲナーゼ阻害
プロスタグランジンは、組織損傷中に放出される内因性化学メディエーターの影響に対して末梢神経終末を感作します。 NSAIDは、シクロオキシゲナーゼ(COX)を阻害するというよく知られた効果により、プロスタグランジンの産生を阻害します。 したがって、PNSに直接NSAIDを適用することは、末梢メカニズムによる痛みを軽減する手段として理にかなっているように思われます。
静脈内局所麻酔
多くの著者が、ケトロラクを5〜60 mgの用量でIVRAに追加し、術中の止血帯耐性と術後鎮痛を改善しました。 Steinbergらは、プラセボ、5、10、15、20、30、および60 mgのケトロラクを使用して、IVRAでケトロラクの用量反応研究を実施しました。 20 mgが理想的な用量であり、低用量では鎮痛作用が少なく、高用量では効果がないことがわかりました。 リジンアセチルサリチル酸90mg(アセチルサリチル酸50mgに相当)がIVRAのプリロカインに追加され、術後鎮痛が延長されました。
関節内投与
局所麻酔薬または局所麻酔薬とモルヒネを併用したケトロラク単独の使用は、関節内腔に投与した場合、局所麻酔薬単独よりも効果的ではありません。 についてもっと読む 局所麻酔薬の関節内および関節周囲浸潤。
浸潤
ケトロラクは、ヘルニア修復後30〜60 mgの用量で正常に浸潤されており、ブピバカインの浸潤と同様の効果があります。 しかし、局所浸潤は全身投与よりも効果的ではないことがわかった。
コリン作動性鎮痛薬
ムスカリン受容体は脊髄の後角の鎮痛を仲介し、ネオスチグミンは髄腔内と硬膜外腔の両方に投与されたときに鎮痛を引き起こしました。 ネオスチグミンは多くの研究でPNSにも適用されており、一般的に期待外れの結果となっています。 Van Elstraeteとその同僚、およびBoneとその同僚は、腋窩腕神経叢ブロックの局所麻酔薬にネオスチグミン500 µgを追加しました。 24つの研究では違いは見られず、他の研究では500時間で痛みが大幅に軽減されただけで、他の時点では違いは見られませんでした。 IVRAの局所麻酔薬にネオスチグミンが追加されたことも残念でした。 Turanらは、0.5 µgのネオスチグミンをプリロカイン1%に追加し、最初の鎮痛薬の要求までの時間が長くなると、感覚および運動ブロックの発症と相殺が改善されることを発見しました。 ただし、McCartneyらは、ネオスチグミン0.5 mgをリドカイン500%に添加して同様の研究を実施しましたが、グループ間で違いは見られませんでした。 全体として、ネオスチグミンは末梢神経ブロックまたはIVRAの鎮痛アジュバントとして期待外れに見えます。 しかし、ネオスチグミンは、膝関節鏡検査後の関節内使用のための鎮痛アジュバントとして首尾よく使用されています。 ヤンと同僚は用量反応研究を行い、2 µgが最も効果的であることがわかりました。これは、XNUMXmgの関節内モルヒネよりも効果的でした。 関節内コリン作動性鎮痛経路の有効性は、神経周囲への適用による不十分な結果と比較して、関節内空間における炎症反応の存在に関連している可能性があり、まだ定義されていないメカニズムによってアセチルコリンの鎮痛効果を高めます。
概要
末梢神経ブロックは、私たちの患者に重要な麻酔と鎮痛の利点を提供します。 オピオイド、α2アゴニスト、NMDA受容体拮抗薬、およびその他の薬剤などの鎮痛アジュバントを局所麻酔薬に追加して、PNSに存在するメカニズムにより、発症を促進し、麻酔および鎮痛効果を延長することができます。 いくつかの薬剤は、神経周囲または関節内の空間に投与された場合、およびIVRAまたは局所浸潤で投与された場合に効果的です(テーブル3)。 それぞれの特定のアジュバントの効果量は可変であり、デキサメタゾンが最大の効果量を生み出す。 PNSの侵害受容メカニズムに関する知識の進化により、将来、疼痛管理をさらに改善するための新しい技術を開発できるようになります。
表3 投与経路による末梢神経系における最良の鎮痛アジュバント。
| ルート | エージェントと用量 |
|---|---|
| 神経周囲/神経周囲 | デキサメタゾン4〜10 mg; ブプレノルフィン0.3mg; クロニジン1〜2μg / kg; トラマドール200 mg |
| イヴラ | デクスメデトミジン0.5μg/kg; マグネシウム1.5g |
| 関節内の | クロニジン150μg; モルヒネ5mg |
| 局所浸潤 | ケタミン3mg/mL |
NB: S. Reuben博士によって執筆され、その後撤回されたいくつかの研究は、このテキストの前の版で参照されました。 これらの参照は削除されました。 撤回されていない、ルーベン博士が関与した残りのすべての参照は引き続き参照されます。
参考文献
- Kehlet H、Dahl JB:術後疼痛治療における「マルチモーダル」または「バランスの取れた鎮痛」の価値。 Anesth Analg 1993; 77:1048-1056。
- Raja SN、Meyer RA、Ringkamp M、et al:侵害受容の末梢神経メカニズム。 Wall PD、Melzack R(eds):Textbook of Pain、4thed。 Churchill-Livingstone、1999年、11〜57ページ。
- Dickenson AH:痛みのゲートコントロール理論は、時の試練に耐えます。 Br J Anaesth 2002; 88:755–757。
- Millan MJ:痛みの誘発:統合的レビュー。 Prog Neurobiol 1999; 57:1–164。
- Sawynok J:局所および末梢作用性鎮痛薬。 Pharmacol Rev 2003; 55:1–20。
- Williams BA、Hough KA、Tsui BY、Ibinson JW、Gold MS、Gebhart GF:ロピバカインと比較した神経周囲麻酔および鎮痛に使用されるアジュバントの神経毒性。 Reg Anesth Pain Med 2011; 36(3):225–230。
- Likar R、Mousa SA、Philippitsch G、et al:炎症細胞を発現するオピオイドの数の増加は、関節内モルヒネ鎮痛に影響を与えません。 Br J Anaesth 2004; 93:375–380。
- Brack A、Rittner HL、Machelska H、et al:ケモカインを介したオピオイド含有多形核細胞の動員による炎症性疼痛の制御。 痛み2004;112:229–238。
- Machelska H、Cabot PJ、Mousa SA、et al:セレクチンによって支配される炎症の疼痛管理。 Nat Med 1998; 4:1425–1428。
- Stein C、Schafer M、Machelska H:痛みの原因を攻撃する:オピオイドに関する新しい視点。 Nat Med 2003; 9:1003–1008。
- Mousa SA、Zhang Q、Sitte N、et al:ベータエンドルフィンを含む記憶細胞とミューオピオイド受容体は末梢の炎症組織に輸送されます。 J Neuroimmunol 200; 115:71–78。
- Picard PR、Tramer MR、McQuay HJら:末梢オピオイドの鎮痛効果(関節内を除くすべて):ランダム化比較試験の定性的系統的レビュー。 痛み1997;72:309–318。
- Murphy DB、McCartney CJ、Chan VW:腕神経叢ブロックのための新しい鎮痛補助剤:系統的レビュー。 Anesth Analg 2000; 90:1122–1128。
- Fanelli G、Casati A、Magistris L、et al:フェンタニルは、ロピバカインで行われる腋窩腕神経叢麻酔の神経ブロック特性を改善しません。 Acta Anaesthesiol Scand 2001; 45:590–594。
- Karakaya D、Buyukgoz F、Baris S、et al:フェンタニルをブピバカインに追加すると、腋窩腕神経叢ブロックの麻酔と鎮痛が延長されます。 Reg Anesth Pain Med 2001; 26:434–438。
- Likar R、Koppert W、Blatnig H、et al:歯科手術患者の炎症を起こした、炎症を起こしていない、神経周囲の組織における末梢モルヒネ鎮痛の有効性。 J Pain Symptom Manage 2001; 21:330–337。
- ニシカワK、カナヤN、ナカヤマMら:フェンタニルは鎮痛を改善しますが、末梢メカニズムによって腋窩腕神経叢ブロックの発症を延長します。 Anesth Analg 2000; 91:384–387。
- Choyce A、Peng P:外科的処置のための静脈内局所麻酔のための補助剤の系統的レビュー。 Can J Anaesth 2002; 49:32–45。
- Gutstein H、Akil H:オピオイド鎮痛薬。 Hardman J、Limbird L(eds):Goodman&Gilman's The Pharmacologic Basis of Therapeutics、10thed。 McGraw-Hill、2001年、601ページ。
- Lanz E、Simko G、Theiss D、et al:硬膜外ブプレノルフィン—術後鎮痛と副作用の二重盲検試験。 Anesth Analg 1984; 63:593–598。
- Candido KD、Winnie AP、Ghaleb AHら:腋窩腕神経叢ブロックの局所麻酔薬にブプレノルフィンを追加すると、術後鎮痛が延長されます。 Reg Anesth Pain Med 2002; 27:162–167。
- Candido KD、Franco CD、Khan MA、et al:外来患者に術後鎮痛を提供するために、腕神経叢ブロックの局所麻酔薬にブプレノルフィンを追加しました。 Reg Anesth Pain Med 2001; 26:352–356。
- Viel EJ、Eledjam JJ、De La Coussaye JE、et al:術後疼痛緩和のためのオピオイドによる腕神経叢ブロック:ブプレノルフィンとモルヒネの比較。 Reg Anesth 1989; 14:274–278。
- Bazin JE、Massoni C、Bruelle P、et al:腕神経叢ブロックの局所麻酔薬へのオピオイドの追加:モルヒネ、ブプレノルフィン、およびスフェンタニルの効果の比較。 麻酔1997;52:858–862。
- Alhashemi JA、Kaki AM:経尿道的前立腺切除後の術後疼痛に対する髄腔内トラマドール投与の効果。 Br J Anaesth 2003; 91:536–540。
- Kapral S、Gollmann G、Waltl B、et al:メピバカインにトラマドールを追加すると、腋窩腕神経叢ブロックの持続時間が延長されます。 Anesth Analg 1999; 88:853–856。
- Robaux S、Blunt C、Viel E、et al:腋窩腕神経叢ブロックのために1.5%メピバカインにトラマドールを追加すると、用量依存的に術後鎮痛が改善されます。 Anesth Analg 2004; 98:1172–1177。
- Alemmano F、Ghisi D、Fanelli A、et al:単発の斜角筋間ブロック用のトラモドールと0.5%レボブピバカイン。 Minerva Anestesiol 2013; 78(3):291–296。
- Kalso E、Tramer MR、Carroll D、et al:膝手術後の関節内モルヒネからの痛みの軽減:定性的系統的レビュー。 痛み1997;71:127–134。
- Brandsson S、Karlsson J、Morberg P、et al:関節鏡視下ACL再建術後の関節内モルヒネ:40人の患者を対象とした二重盲検プラセボ対照試験。 Acta Orthop Scand 2000; 71:280–285。
- Rasmussen S、Larsen AS、Thomsen ST、et al:関節内糖質コルチコイド、ブピバカイン、モルヒネは、関節鏡視下半月板切除後の痛み、炎症反応、回復期を軽減します。 痛み1998;78:131–134。
- Alagol A、Calpur OU、Kaya G、et al:関節鏡視下膝手術後の術後鎮痛のための関節内トラマドールの使用:異なる関節内および静脈内投与量の比較。 Knee Surg Sports Traumatol Arthrosc 2004; 12:184–188。
- Varrassi G、Marinangeli F、Ciccozzi A、et al:膝関節鏡検査後の関節内ブプレノルフィン。 無作為化、前向き、二重盲検試験。 Acta Anaesthesiol Scand 1999; 43:51–55。
- Vranken JH、Vissers KC、de Jongh R、et al:関節内スフェンタニル投与は、日帰り膝関節鏡検査後の回復を促進します。 Anesth Analg 2001; 92:625–628。
- Gupta A、Bodin L、Holmstrom B、Berggren:関節内モルヒネの末梢鎮痛効果の系統的レビュー。 Anesth Analg 2001; 93(3):761–770。
- Unnerstall JR、Kopajtic TA、Kuhar MJ:ラットおよびヒトの中枢神経系におけるアルファ2アゴニスト結合部位の分布:クロニジンおよび関連するアドレナリン作動薬の薬理学的効果のいくつかの機能的、解剖学的相関の分析。 Brain Res 1984; 319:69–101。
- Kuraishi Y、Hirota N、Sato Y、et al:ウサギ脊髄後角の一次求心性神経からのサブスタンスPの放出のノルアドレナリン作動性阻害。 Brain Res 1985; 359:177–182。
- Fleetwood-Walker SM、Mitchell R、Hope PJ、et al:アルファ2受容体は、同定された後角ニューロンの侵害受容反応のノルアドレナリンによる選択的阻害を仲介します。 Brain Res 1985; 334:243–254。
- 馬場H、河野T、岡本Mら:ラット脊髄後角の実質的なゼラチン質におけるGABA放出のムスカリン性促進。 J Physiol 1998; 508:83–93。
- バターワースJF5th、ストリチャーツGR:アルファ2-アドレナリン作動薬であるクロニジンとグアンファシンは、ラット坐骨神経線維の強直性および相性の伝導遮断を引き起こします。 Anesth Analg 1993; 76:295–301。
- Gaumann DM、Brunet PC、Jirounek P:クロニジンは、C線維活動電位に対するリドカインの効果を高めます。 Anesth Analg 1992; 74:719–725。
- アイゼナハJC、ゲブハートGF:髄腔内アミトリプチリン。 ラットにおける静脈内モルヒネおよび髄腔内クロニジン、ネオスチグミン、およびカルバミルコリンとの抗侵害受容性相互作用。 Anesthesiology 1995; 83:1036-1045。
- Kroin JS、Buvanendran A、Beck DR、et al:ラットの坐骨神経ブロック後のリドカイン鎮痛のクロニジン延長は、アルファアドレナリン受容体ではなく、過分極活性化カチオン電流を介して媒介されます。 Anesthesiology 2004; 101:488–494。
- Singelyn FJ、Dangoisse M、Bartholomee S、et al:クロニジンをメピバカインに追加すると、腋窩腕神経叢ブロック後の麻酔と鎮痛の期間が延長されます。 Reg Anesth 1992; 17:148–150。
- Hutschala D、Mascher H、Schmetterer L、et al:ブピバカインに追加されたクロニジンは、健康なボランティアの局所メカニズムを介して腕神経叢ブロック後の鎮痛を強化および延長します。 Eur J Anaesthesiol 2004; 21:198–204。
- Culebras X、Van Gessel E、Hoffmeyer P、et al:長時間作用型局所麻酔薬と組み合わせたクロニジンは、腕神経叢ブロック後の術後鎮痛を延長しませんが、血行力学的変化を誘発します。 Anesth Analg 2001; 92:199–204。
- ポッピングDM、エリアN、マレットE、ウェンクM、トラマーMR 末梢神経および神経叢ブロックの局所麻酔薬に対するアジュバントとしてのクロニジン:無作為化試験のメタアナリシス。 Anesthesiology 2009; 111(2):406–415。
- Ilfeld BM、Morey TE、Enneking FK:ロピバカイン単独と比較したクロニジンおよびロピバカインの鎖骨下神経周囲注入の継続:無作為化、二重盲検、対照試験。 Anesth Analg 2003; 97:706–712。
- Ilfeld BM、Morey TE、Thannikary LJら:術後鎮痛を改善するために連続的な斜角筋間ロピバカイン神経周囲注入にクロニジンを追加:無作為化、二重盲検、対照試験。 Anesth Analg 2005; 100:1172–1178。
- Abdallah FW、Brull R:神経軸および末梢神経ブロックに対する神経周囲デクスメデトミジンの促進効果:系統的レビューとメタアナリシス。 Br J Anaesth 2013; 110(6):915–925。
- Alayurt S、Memis D、Pamukcu Z:静脈内局所麻酔のためのリグノカインへのスフェンタニル、トラマドール、またはクロニジンの追加。 Anaesth Intensive Care 2004; 32:22–27。
- Gentili M、Bernard JM、Bonnet F:静脈内局所麻酔のためにリドカインにクロニジンを追加すると、止血帯の痛みを防ぎます。 Anesth Analg 1999; 88:1327–1330。
- Reuben SS、Steinberg RB、Klatt JL、et al:リドカインとクロニジンを使用した静脈内局所麻酔。 Anesthesiology 1999; 91:654–658。
- Lurie SD、Reuben SS、Gibson CS、et al:健康なボランティアの上肢止血帯の痛みに対するクロニジンの効果。 Reg Anesth Pain Med 2000; 25:502–505。
- Memis D、Turan A、Karamanlioglu B、et al:静脈内局所麻酔のためのリドカインへのデクスメデトミジンの追加。 Anesth Analg 2004; 98:835–840。
- Joshi W、Reuben SS、Kilaru PR、et al:関節内クロニジンおよび/またはモルヒネによる外来関節鏡視下膝手術のための術後鎮痛。 Anesth Analg 2000; 90:1102–1106。
- Tan PH、Buerkle H、Cheng JT、et al:関節鏡視下膝手術を受けている患者に関節内投与されたアプラクロニジン、クロニジン、およびプラセボの複数回投与の二重盲検並行比較。 Clin J Pain 2004; 20:256–260。
- Gentili M、Juhel A、Bonnet F:関節内クロニジンの末梢鎮痛効果。 痛み1996;64:593–596。
- Gentili M、Houssel P、Osman M、et al:関節内モルヒネとクロニジンは同等の鎮痛作用を示しますが、この組み合わせはより効果的ではありません。 Br J Anaesth 1997; 79:660–661。
- Buerkle H、Schapsmeier M、Bantel C、et al:ラットの炎症を起こした膝関節モデルにおける脊髄対末梢投与クロニジンの熱的および機械的抗侵害受容作用。 Br J Anaesth 1999; 83:436–441。
- 副腎皮質ステロイド。 薬物の事実と比較では、第5版。 事実と比較、1997年、122〜128ページ。
- De Oliveira GS Jr、Castro-Alves LJ、Ahmad S、Kendall MC、McCarthy RJ:術後の悪心嘔吐を防ぐためのデキサメタゾン:ランダム化比較試験の最新のメタアナリシス。 Anesth Analg 2013; 116(1):58–74。
- De Oliveira GS Jr、Almeida MD、Benzon HT、McCarthy RJ:術後疼痛に対する周術期単回投与全身デキサメタゾン:ランダム化比較試験のメタアナリシス。 麻酔学2011;115(3):575–588。
- Attardi B、Takimoto K、Gealy R、Severns C、Levitan ES:グルココルチコイドは、invitroおよびinvivoで下垂体K+チャネルmRNAのアップレギュレーションを誘導しました。 Receptors Channels 1993; 1:287–293。
- Eker HE、Cok OY、Aribogan A、Arslan G:神経損傷部位でのメチルプレドニゾロンによる神経障害性疼痛の管理。 Pain Med 2012; 13:443–451。
- Johansson A、Hao J、Sjolund B:局所的なコルチコステロイドの適用は、通常の侵害受容性C線維の伝達を遮断します。 Acta Anaesthesiol Scand 1990; 34:335–338。
- Cummings KC 3rd、Napierkowski DE、Parra-Sanchez I、et al:ロピバカインまたはブピバカインによる斜角筋間神経ブロックの持続時間に対するデキサメタゾンの効果。 Br J Anaesth 2011; 107:446–453。
- Fredrickson MJ、Danesh-Clough TK、White R:ブピバカイン坐骨神経痛および足首ブロックに対するアジュバントデキサメタゾン:2件のランダム化プラセボ対照試験の結果。 Reg Anesth Pain Med 2013; 38(4):300–307。
- Movafegh A、Razazian M、Hajimaohamadi F、Meysamie A:リドカインに追加されたデキサメタゾンは腋窩腕神経叢ブロックを延長します。 Anesth Analg 2006; 102:263–267。
- Parrington SJ、O'Donnell D、Chan VW、et al:メピバカインに追加されたデキサメタゾンは鎖骨上腕神経叢ブロック後の鎮痛の期間を延長します。 Reg Anesth Pain Med 2010; 35:422–426。
- Tandoc MN、Fan L、Kolesnikov S、Kruglov A、Nader ND:ブピバカインを含むアジュバントデキサメタゾンは、斜角筋間ブロックの期間を延長します:前向き無作為化試験。 J Anesth 2011; 25:704–709。
- ペンシルベニア州ビエイラ、ペンシルベニア州プライ、ツァオGC、マニカンタンP、ケラーB、コネリーNR ブピバカインを含むデキサメタゾンは、超音波ガイド下腕神経叢ブロックの鎮痛期間を延長します。 Eur J Anaesthesiol 2010; 27:285–288。
- Desmet M、Braems H、Reynvoet Mら:IVと神経周囲デキサメタゾンは、肩の手術のためのロピバカインによる単発の斜角筋間ブロックの鎮痛期間の延長において同等です:前向き無作為化プラセボ対照試験。 Br J Anaesth 2013; 111(3):445–452。 印刷前のEpub。
- Thangaswamy CR、Rewari V、Trikha A、Dehran M、Chandralekha:腹腔鏡下子宮全摘出術前のデキサメタゾン:無作為化対照用量反応研究。 J Anesth 2010; 24:24–30。
- Worni M、Schudel HH、Seifert E、et al:術後の悪心、疼痛、および発声機能を改善するための良性疾患に対する甲状腺切除前の単回投与ステロイドに関するランダム化比較試験。 Ann Surg 2008; 248:1060-1066。
- Taniguchi M、Bollen AW、Drasner K.亜硫酸水素ナトリウム:クロロプロカイン神経毒性のスケープゴート? Anesthesiology 2004; 100(1):85–91。
- Bigat Z、Boztug N、Hadimioglu N、Cete N、Coskunfirat N、Ertok E:デキサメタゾンは静脈内局所麻酔および鎮痛の質を改善しますか? ランダム化比較臨床試験。 Anesth Analg 2006; 102(2):605–609。
- Coderre TJ、Katz J、Vaccarino AL、et al:病理学的疼痛に対する中枢神経可塑性の寄与:臨床的および実験的証拠のレビュー。 Pain 1993; 52:259–285。
- Price DD、Mao J、Mayer DJ:正常および異常な痛みの状態の中枢神経メカニズム。 Fields HLでは、Liebskind JC(eds):Pain ResearchandManagementの進歩。 IASP Press、1994; 61–84。
- Dickenson AH、Chapman V、Green GM:脊髄の痛みの伝達と調節における興奮性および抑制性アミノ酸媒介イベントの薬理学。 Gen Pharmacol 1997; 28:633–638。
- Alfredson H、Forsgren S、Thorsen K、et al:ヒトアキレス腱の神経に局在するグルタミン酸NMDAR1受容体。 治療への影響? Knee Surg Sports Traumatol Arthrosc 2001; 9:123–126。
- Cairns BE、Hu JW、Arendt-Nielsen L、et al:咬筋へのグルタミン酸の注射によって引き起こされる人間の痛みとラットの求心性神経放電における性関連の違い。 J Neurophysiol 2001; 86:782–791。
- Svensson P、Cairns BE、Wang K、et al:人間の咬筋への神経成長因子の注射は、長期にわたる機械的異痛症と痛覚過敏を引き起こします。 Pain 2003; 104:241–247。
- Cairns BE、Svensson P、Wang K、et al:末梢NMDA受容体の活性化は、咬筋へのグルタミン酸の注射によって引き起こされる人間の痛みとラットの求心性神経放電に寄与します。 J Neurophysiol 2003; 90:2098–2105。
- Tverskoy M、Oren M、Vaskovich M、et al:ケタミンは末梢メカニズムによってブピバカインの局所麻酔および鎮痛効果を増強します:術後患者での研究。 Neurosci Lett 1996; 215:5–8。
- Amiot JF、Bouju P、Palacci JH、et al:ケタミンによる静脈内局所麻酔。 麻酔1985;40:899–901。
- Gorgias NK、Maidatsi PG、Kyriakidis AM、et al:リドカインによる静脈内局所麻酔中の止血帯の痛みを防ぐためのクロニジン対ケタミン。 Reg Anesth Pain Med 2001; 26:512–517。
- Dal D、Tetik O、Altunkaya H、et al:外来関節鏡手術における術後鎮痛のための関節内ケタミンの有効性。 関節鏡検査2004;20:300–305。
- Brill S、McCartney CJ、Sawyer R、et al:膝関節鏡検査後の関節内ケタミン鎮痛:用量設定試験。 Pain Clin 2005; 17:25–29。
- Turan A、Memis D、Karamanlioglu B、et al:リドカインとマグネシウムを使用した静脈内局所麻酔。 Anesth Analg 2005; 100:1189–1192。
- Reuben SS、Steinberg RB、Kreitzer JMら:リドカインとケトロラクを使用した静脈内局所麻酔。 Anesth Analg 1995; 81:110–113。
- Steinberg RB、Reuben SS、Gardner G:リドカインによる静脈内局所麻酔の成分としてのケトロラクの用量反応関係。 Anesth Analg 1998; 86:791–793。
- Corpataux JB、Van Gessel EF、Donald FA、et al:静脈内局所麻酔中にプリロカインに添加された少量のリジンアセチルサリチル酸塩の術後鎮痛への影響。 Anesth Analg 1997; 84:1081-1085。
- Reuben SS、Duprat KM:歩行可能な手の手術後の術後鎮痛のための、ケトロラクによる創傷浸潤とケトロラクによる静脈内局所麻酔の比較。 Reg Anesth 1996; 21:565–568。
- Ben-David B、Katz E、Gaitini L、et al:局所麻酔薬を使用した場合と使用しない場合のケトロラクのIMと局所浸潤の比較。 Br J Anaesth 1995; 75:409–412。
- Connelly NR、Reuben SS、Albert M、et al:ヘルニア患者における切開前ケトロラクの使用:静脈内投与と手術部位。 Reg Anesth 1997; 22:229–232。
- Bosek V、Cox CE:乳房切除患者における局所的および全身的に投与されたケトロラクの鎮痛効果の比較。 Ann Surg Oncol 1996; 3:62–66。
- Van Elstraete AC、Pastureau F、Lebrun T、et al:術後鎮痛のためにリドカイン腋窩神経叢ブロックにネオスチグミンを追加。 Eur J Anaesthesiol 2001; 18:257–260。
- Bone HG、Van Aken H、Booke M、et al:ネオスチグミンの同時投与による腋窩腕神経叢ブロック麻酔の強化。 Reg Anesth Pain Med 1999; 24:405–410。
- Turan A、Karamanlyoglu B、Memis D、et al:プリロカインとネオスチグミンを使用した静脈内局所麻酔。 Anesth Analg 2002; 95(5):1419–1422。
- McCartney CJ、Brill S、Rawson Rら:手の手術のためにリドカイン1%を用いた静脈内局所麻酔にネオスチグミン0.5mgを追加しても麻酔または鎮痛効果はありません。 Reg Anesth Pain Med 2003; 28:414–417。
- Yang LC、Chen LM、Wang CJ、et al:膝関節鏡検査を受けている患者における関節内ネオスチグミンによる術後鎮痛。 麻酔学1998;88:334–339。
- Gentili M、Enel D、Szymskiewicz O、et al:膝関節鏡検査を受けている患者における関節内クロニジンとネオスチグミンによる術後鎮痛。 Reg Anesth Pain Med 2001; 26:342–347。
コリン・J・L・マッカートニーとスティーブン・チェ