John-Paul J. Pozek、David Beausang、Kara G. Segna、Eugene R. Viscusi
はじめに
局所麻酔薬(LA)は、麻酔科の診療と疼痛管理において最も有用な薬剤のXNUMXつです。 それらは、オピオイドとその結果として生じる有害事象を低減または排除するためのマルチモーダル鎮痛経路内の術後疼痛管理の基礎です。 ただし、現在利用可能なLAは、浸潤、末梢ブロック、硬膜外麻酔、脊髄くも膜下麻酔など、幅広い用途でかなりの範囲の発症と持続期間、および忍容性を示します。 それらの主な制限は作用の持続時間であり、これは術後の痛みの治療において十分な持続時間の適切な治療を妨げる可能性がある。 そのため、連続カテーテル注入システムが広く使用されていますが、カテーテルの配置、カテーテルの移動とメンテナンス、外部ポンプの負担などの課題があります。 したがって、予測可能な開始、配信、およびアクションの期間を備えた長時間作用型LAは、ほぼ理想的なソリューションになります。 局所麻酔薬は、それらが配置されている体のコンパートメントに応じてかなり異なる特性を持つことができます。 徐放性LAは、さまざまな部位および適用モードでの臨床的有効性と信頼性について十分に研究する必要があります。 現時点では、XNUMXつの徐放性薬物のみが食品医薬品局(FDA)によって承認されており、市販されていますが、他にもいくつか開発中です。 この章では、現在入手可能な情報を要約します。
局所麻酔薬のキャリア
1970年代以降、LAのドラッグデリバリーシステムはかなりの研究努力の対象となってきました。 開発戦略は通常、高分子科学、薬剤学、バイオコンジュゲート化学、および分子生物学を組み合わせた学際的なアプローチに基づいています。 これらの担体の目標は、標的部位にLAデポを提供して、薬物効果を延長し、LA濃度を下げ、LAの透過性と吸収を高めることにより、局所および全身毒性を減らすことです。 これらの要因は、神経組織に対するLAの濃度と影響を決定し、潜時、広がり、ブロックの強度、および作用の持続時間に影響を与えます。 LAを全身的に送達するための製剤アプローチには、リポソームへのカプセル化、シクロデキストリンへの複合体形成、生体高分子、経皮非リポソーム担体、および他の担体システムとの結合が含まれています。 LAの局所送達システムは、粘度誘導剤、防腐剤、浸透促進剤、皮膚軟化剤など、幅広いアジュバントで構成されています。 これらの担体の物理的状態は、半固体(ゲル、クリーム、軟膏)とは異なります。 液体(エマルジョン、分散液); 固形(パッチ)剤形に。
リポソームベースの局所麻酔薬製剤
体内の特定の部位への治療薬の送達を改善するための薬物担体として広く研究されているリポソームは、非免疫原性、生分解性、非毒性であり、親水性および疎水性材料の両方をカプセル化して薬物を送達することによって機能します。 LAなどのさまざまな化合物をカプセル化する機能と組み合わされた構造の多様性は、微視的な単層または二層のリン脂質小胞によるものです。 脂肪球の極性コアにより、親水性の薬物分子がカプセル化されます。 両親媒性および親油性分子は、それらの親和性に従ってリン脂質二重層内で可溶化されます。 チャネルタンパク質は、選択的フィルターとして機能し、小胞膜の疎水性ドメイン内の活性を失うことなくリポソームに組み込むことができます。 したがって、チャネルタンパク質でカプセル化された薬物は、タンパク質分解酵素による早期分解から効果的に保護され、内部と外部の「ナノケージ」間の濃度勾配によって駆動されるチャネルを介して拡散することができます。 脂質層の数、サイズ、表面電荷、脂質組成、および小胞形成の方法に応じて、さまざまなタイプのリポソームを調製することができます。 リポソームおよびマイクロまたはナノ粒子ベースのシステムの場合、改善された薬理学的作用は、これらの脂質二重層からのカプセル化された薬物の遅い放出速度によって生成される。
福利厚生
天然に存在する物質で構成されるリポソームは、無毒で生分解性であるという利点を提供します。 水性または脂質の形で薬物を閉じ込める能力は、親水性および疎水性の両方の薬物の運搬を可能にします。 LAをリポソームにカプセル化することの利点は、麻酔効果を延長し、心臓血管および中枢神経系の毒性のリスクを低減するために、遅い薬物放出を介して制御された送達です。
NYSORAのヒント
- リポソームは、リン脂質二重層に囲まれた水性コアを含む微視的な球体です。
リスク/制限
リポソームは多くの技術で選択される担体ですが、LAへのリポソームの使用は十分に検討されていないことがよくあります。 これは、脂質が酸化しやすいため、リポソームがそのサイズのために物理的にまたは化学的に不安定なコロイド系と見なされているためである可能性があります。
デポフォーム®
デポフォーム® 微視的で球状の脂質ベースの粒子で構成されています(図1A)。 粒子は、溶液中に薬物を含む多数の多面体の非同心の水性チャンバーで構成されています。 この多小胞リポソームの各チャンバーは、脂質膜によって隣接するチャンバーから分離されています(図1B)。 DepoFoam粒子は、単層ベシクル、多層ベシクル、およびネオソームとは構造的に区別されます(図2)これらの密集した非同心の小胞によって。 粒子は直径数十マイクロメートルであり、大きなトラップ体積を持っています。 これにより、少量の製剤でカプセル化された形で比較的大量の薬剤を送達することができます。 重要なことに、薬物をカプセル化するリポソームプラットフォームは、分子構造を変えることなくそうします。 したがって、脂質および水性組成物の操作に基づく多くの方法を使用して、脂質膜の侵食または再編成を介して、1日から30日までの所望の期間にわたる持続放出の速度を制御することができる。 DepoFoamは、DepoCyt(e)を含む、これまでにFDAが承認した1つの商用製品で使用されています。® (シタラビンリポソーム注射)、およびEXPAREL® (ブピバカインリポソーム注射用懸濁液)。 DepoFoamは、皮下または筋肉内の間質腔を介して血流に放出するか、髄腔内、腹腔内、皮下、硬膜外、または眼内の方法で体のコンパートメントまたは関節に局所的に送達することができます。
NYSORAのヒント
- DepoFoamテクノロジーは、薬剤を含む多面体の非同心の水性チャンバーを備えた脂質ベースの粒子で構成されています。 この技術は、さまざまな薬で使用できます。

図1 A:ブピバカインを使用したDepoFoamの走査型電子顕微鏡画像。 B:薬剤で満たされた多面体の非同心の水性チャンバーを表す図。 (Pacira Pharmaceuticals、Inc.の許可を得て使用)
福利厚生
DepoFoamはすぐに使用できる製品であり、小さなゲージの針とペンシステムで投与できます。 柔軟な送達システムにより、即時放出用量とそれに続く持続送達を提供するように設計されています。 DepoFoamは、天然に存在する3%未満の脂質、またはリン脂質、コレステロール、トリグリセリドなどの一般的な脂質の合成類似体です。 したがって、それは生分解性で生体適合性があります。 臨床試験では、DepoFoamの副作用がないことが示されています。 製剤はFDAおよび欧州医薬品庁によって承認された製品で使用されているため、デリバリーシステムにはすでにかなりの臨床経験があります。 さらに、同様の用量で、この製剤は、薬物のピーク血清レベルを低下させることにより、全身曝露および毒性を低下させることができる。
高分子マイクロ粒子およびナノ粒子製剤
ポリマーマイクロまたはナノ粒子は、天然または人工のポリマー球またはカプセルで作られた薬物送達システムを表し、薬物送達の目的で生体適合性および生分解性でなければなりません。 ナノ粒子は、抗がん剤、降圧剤、免疫調節剤、ホルモンなどのいくつかのクラスの薬物、および核酸、タンパク質、ペプチド、抗体などの高分子の潜在的な担体として機能します。 ナノ粒子は、薬物の部位特異的送達のために設計することができます。 ナノ粒子のターゲティングおよび放出能力は、粒子サイズ、表面電荷、表面修飾、および疎水性の影響を受けます。 インビボでのナノ粒子の性能は、形態学的特徴、表面化学、および分子量に影響されます。 ポリマー(マイクロ粒子またはナノ粒子)技術は、すべての市販のLA化合物に適用可能であると主張されています。 ナノ粒子の調製のために、さまざまな天然および合成ポリマーが検討されてきました。その中のポリ(乳酸)(PLA)およびポリ(グリコール酸)(PGA)とそれらのコポリマーポリ(乳酸-co-グリコール酸)(PLGA)それらの生体適合性および生分解性について広範囲に調査されてきた。
最も成功裏に開発された生分解性ポリマーのXNUMXつであるPLGAは、FDAと欧州医薬品庁が非経口投与を承認したことにより、かなりの注目を集めました。 他の特性には、さまざまなタイプの薬物(例えば、親水性または疎水性の小分子または高分子)に適合した十分に説明された製剤および製造方法、ならびに薬物の分解からの保護が含まれる。 PLGAを使用すると、徐放性、表面特性を変更して生体物質との相互作用を向上させる可能性、さらにはナノ粒子を特定の臓器や細胞に標的化する可能性さえも可能になります。 注目すべきことに、全身投与後、PLGAベースのドラッグデリバリーシステムは、細網内皮系(RES)によって優先的に取り込まれ、炎症を起こした領域で高く選択的に取り込まれます。 担体の成功の理由のXNUMXつは、加水分解が代謝物モノマーである乳酸とグリコール酸をもたらすことです。これらは内因性であり、クレブス回路を介して体内で容易に代謝されます。 PLGAデリバリーシステムは、毒性の可能性をほとんど無視できる程度に関連付けられています。
福利厚生
生分解性ナノ粒子は、バイオアベイラビリティの向上、カプセル化の改善、放出制御により、ドラッグデリバリービヒクルとして頻繁に使用されています。 文献によると、LAのマイクロカプセル化またはナノカプセル化は、ブロックの期間を大幅に延長し、全身毒性を軽減します。
リスク/制限
高分子薬物を含む生分解性微粒子に関する既存の研究にもかかわらず、薬物のカプセル化に影響を与える重要なパラメーターの影響は、ナノスケールの担体について十分に調査されていません。 ただし、薬物をロードしたナノ粒子を調製するための多くの新しい技術が開発され、洗練されています。 問題の核心は、調製後のナノ粒子の安定性です。これは、さまざまなクラスの凍結保護剤を使用した凍結乾燥によって対処されています。 もう6つの問題は、ナノ粒子はコロイド系であるため、薬物含有量の正確な決定が容易ではないことです。 薬物のカプセル化効率は、デキサメタゾンとパクリタキセルでそれぞれ90%から60%まで変化しますが、平均カプセル化効率は、エストラジオールやキサントンなどのさまざまな薬物で約70%から1%です。 PLGAベースのナノ粒子のもう1つの大きな落とし穴は、PLGAベースのナノ粒子は高いカプセル化効率を示すことが多いものの、薬物の負荷は一般に低いことです(約100%、つまりナノ粒子はナノ粒子のポリマーXNUMXmgあたりXNUMXmgの有効成分を含むことを意味します) 。 さらに別の重要な落とし穴は、ナノ粒子からの薬物の高バースト放出の考慮です。 この現象は、ほとんどのPLGAベースのナノ粒子で説明されています。 その結果、薬が標的組織または細胞に到達できず、有効性が失われる可能性があります。 薬物放出メカニズムは、使用するポリマーとローディング効率に依存します。 一般に、急速な初期放出は、ナノ粒子の表面に吸着された薬物に起因します。 これらの問題に対処するための作業はまだ行われています。
リポソームブピバカイン
2011年72月、FDAは、手術部位への浸潤にリポソームブピバカインを単回注射することを承認しました。 現在まで、これはFDAが承認した唯一の徐放性LAです。 リポソームブピバカインは、浸潤後7時間までブピバカインの信頼できる血漿レベルを生成します。 比較すると、従来のブピバカインHClの作用持続時間は、組織浸潤後約XNUMX時間です。 リポソームブピバカインは、担体であるDepoFoam内にブピバカインHClをカプセル化します。 この開発以前は、LAの作用期間の延長は、留置カテーテルと輸液ポンプに依存していました。 留置カテーテルを使用した注入技術は、特に弾性ポンプを使用した場合、感染、薬剤充填エラー、ラベル付けエラー、および変動する注入速度のリスクを伴います。 エラストマーバッグと標的カテーテルをリポソームに封入されたLAに置き換えることは、鎮痛を提供するための新しいアプローチです。 現在まで、リポソームブピバカインは、軟部組織手術(痔核切除術、鼠径ヘルニア修復、増強乳房形成術)または整形外科手術(バニオン切除術および人工膝関節全置換術)を受けている患者で研究されてきました。 現在、組織浸潤が承認されています。
NYSORAのヒント
- リポソームブピバカインは、創傷(手術部位)浸潤についてFDAが承認した徐放性LAです。
製剤
DepoFoamは、ブピバカインHClの脂質ベースの担体として機能します。 DepoDurなどの他のキャリアと比較した場合® DepoCytの主な違いは、DepoFoamへのジルコイルホスファチジルコリンの組み込みです。 ウサギおよびイヌにおけるDepoFoamブピバカインの組織浸潤は、リポソームに対する自然な反応と考えられる肉芽腫性炎症を引き起こしたが、それは一般的な脂質の非代謝性、天然または合成類似体で構成されており、一般に忍容性が高い。
薬理学
リポソームブピバカインは現在、20%の濃度で1.3mLのバイアルにパッケージされています。 266 mg(3バイアル)を超えない単回投与が推奨されます。 リポソームブピバカイン中のLAの約XNUMX%が遊離型で存在します。 このため、この薬剤は組織浸潤後の血漿濃度TmaxにXNUMXつのピークを示します(テーブル1)。 これは、鼠径ヘルニア修復のためにリポソームブピバカインの浸潤を受けている患者の研究でLangfordらによって観察されました。 最初のTmaxは最初のXNUMX時間以内に発生し、その後にXNUMX番目のTが続きますマックス 12時間以内。 全身吸収は、投与される薬剤の総投与量、投与経路、および投与部位の血管分布に依存します。 リポソームブピバカインの作用持続時間は24時間です。 従来のブピバカインと同様に、リポソームブピバカインは、ドラッグデリバリーシステムから放出された後、肝臓で代謝されます。 重度の肝機能障害のある患者にリポソームブピバカインを使用する場合は注意が必要です。 フェーズ1では、中等度の肝機能障害のある試験患者は、最大血漿濃度Cが1.5倍に増加しました。マックス リポソームブピバカインの単一300mg浸潤後の健康な対照と比較。 ただし、これは、リポソームブピバカインの単回投与では臨床的にそれほど重要ではない可能性があります。 ブピバカインまたはその代謝物の有意な蓄積は、肝機能障害にもかかわらず期待されていません。 ブピバカインの約6%はそのまま尿中に排泄されます。
表1 徐放性局所麻酔薬の薬物動態。
| 薬 | キャリア | Tマックス (H) | Cマックス (ng / mL) |
|---|---|---|---|
| リポソームブピバカイン | デポフォーム | 1-12a | 365b |
| セイバー-ブピバカイン | サイブ | 24-48c | 625-989c |
| ブピバカイン-コラーゲンインプラント | 生分解性コラーゲンマトリックス | 0.5-20d | 200d |
SAIB=イソ酪酸酢酸スクロース。
投与と投与
最大総量300mLまでの滅菌生理食塩水で希釈することをお勧めします。 滅菌水などの低圧溶液は、リポソーム担体を破壊する可能性があり、持続的な有効性の喪失および高いシステム薬物レベルにつながる可能性があります。 リポソームブピバカインをリドカインやブピバカインHClなどの他の薬物で希釈すると、担体の破壊、結合したブピバカインの放出の加速、および毒性を引き起こす可能性があります。 リポソームブピバカイン投与後24時間は、いかなる種類の追加のLAも推奨されません。 リポソーム担体は、30ゲージの針からの注射でその完全性を維持します。
NYSORAのヒント
- リポソームブピバカインを他のLAで希釈すると、脂質担体が破壊され、ブピバカインの結合が解除される可能性があります。
臨床的証拠
第3相試験では、266 mgのリポソームブピバカインの浸潤を、痔核切除術を受けた患者を対象にプラセボと比較しました。 189人の患者を対象としたこのランダム化二重盲検試験では、リポソームブピバカインを投与された患者の痛みが大幅に軽減され、麻薬による救助が必要な患者が少なかったことがわかりました。 72時間のオピオイド消費量に関しても有意差が観察され、プラセボと比較して45%低かった。 この研究に続いて、Onelらは、同様の患者コホートでリポソームブピバカインとブピバカインHClを比較しました。 この二重盲検、ランダム化、対照試験では、100人の患者の痔核切除術を検討しました。 患者は、リポソームブピバカインを使用した最初の47時間で、痛みが有意に少なく(66%)、必要なオピオイドが有意に少なかった(72%)。
NYSORAのヒント
- リポソームブピバカインによる創傷浸潤を受けた患者は、痔核切除およびバニオン切除のためにブピバカインHClを投与された患者よりも、痛みおよびオピオイド使用量が有意に少なかった。
第193中足骨骨切り術を伴うバニオン切除術を受けた24人の患者を対象とした二重盲検ランダム化試験では、リポソームブピバカインはプラセボと比較して36時間およびXNUMX時間で有意に減少した痛みを示しました。 疼痛スコアに統計的に有意な差はありませんでしたが、片側鼠径ヘルニア修復を行った患者を対象としたリポソームブピバカイン用量設定試験では、副次的評価項目に有益性が示されました。 リポソームブピバカイングループは、155 mgのブピバカインHClと比較して、すべての用量(200、266、310、100 mg)で患者のオピオイド要件が低くなる傾向がありました。 両側豊胸手術を受けた女性を対象としたランダム化試験では、被験者は片方の乳房に133または266 mgのリポソームブピバカインを注射し、反対側の乳房に75mgのブピバカインHClを注射するようにランダム化されました。 両方のグループで、被験者はブピバカインHClを投与された乳房の痛みが増したことを訴えました。 48つのグループ間のオピオイド消費量の違いは、リポソーム担体からのブピバカインの放出の遅延に見合ったXNUMX時間後にのみ有意に達しました。 インプラントベースの乳房再建後の患者にリポソームブピバカインを使用すると、ブピバカインHClおよびプラセボと比較した場合、術後4〜24時間で視覚的アナログ尺度(VAS)の疼痛スコアが大幅に低下することが示されました。 XNUMXつの治療群間でオピオイドと制吐薬の使用法に違いはありませんでした。 人工膝関節全置換術後の創傷浸潤におけるリポソームブピバカインの鎮痛効果を調査する複数の研究が実施されました。 Bagsby et alによる研究では、関節周囲注射を2.6%のリポソームブピバカインと0.5%のロピバカインで比較しました。 患者は24時間で同様の平均疼痛スコアを報告しましたが、入院の残りの間、疼痛スコアはリポソームブピバカイン群で有意に増加しました。 ロピバカイン群の半数は、リポソームブピバカインを投与された患者のわずか17%と比較して、痛みが軽度であると報告しました。 最近の大規模なランダム化比較試験では、リポソームブピバカインとブピバカインHClの関節周囲注射を比較しました。 すべての患者が同時にマルチモーダル鎮痛を受けました。 XNUMXつのグループは、すべての時点で、最小、最悪、および平均のXNUMX日の痛みに関して有意差はありませんでした。 さらに、オピオイドの消費量に差はありませんでした。 最近の無作為化前向き研究では、リポソームブピバカインの局所浸潤をロピバカインおよびテトラカインの単回注射大腿神経ブロックと比較しました。 神経ブロック群は術後最初の24時間で有意に痛みが少なかったが、オピオイドの総消費量はXNUMXつの群間で変化しなかった。 興味深いことに、神経ブロック群は術後XNUMX日目でオピオイドが少なかったのに対し、リポソームブピバカイン群はXNUMX日目で消費量が少なかった。
安全性
リポソームブピバカインの投与量は、単一の266mgバイアルを超えないようにすることをお勧めします。 浸潤後72時間以内にLAを繰り返し投与することはお勧めしません。 リポソーム担体の完全性を確保するために、リポソームブピバカインは通常の生理食塩水でのみ希釈し、25ゲージ以上の針を通して投与する必要があります。 リドカインおよびブピバカインの毒性レベルの可能性を回避するために、リポソームブピバカイン浸潤は、リドカイン浸潤の少なくとも20分後に続く必要があります。 しかし、全体として、1万人を超える患者への曝露において、リポソームブピバカインは顕著な安全性の全身毒性プロファイルを示しました。 末梢神経ブロック(PNB)におけるリポソームブピバカインの安全性については、この章でさらに説明します。
NYSORAのヒント
- リポソームブピバカインの注射は、潜在的な毒性を避けるために、リドカインの浸潤の少なくとも20分後に行う必要があります。
実験的応用末梢神経ブロック
PNBでのリポソームブピバカインの使用は、カテーテルを留置せずに神経ブロックを延長するための可能なFDA承認の方法として大きな関心を呼んでいます。 公表の時点で、リポソームブピバカインはこの適応症についてFDAによって承認されていません。 前臨床毒物学研究からのデータは、動物モデルにおいて神経毒性の兆候を示さなかった。 同様に、健康なボランティアを対象とした第1相試験では、単回注射PNBによる神経損傷は見られませんでした。 高用量のリポソームブピバカインの有効性は、133コンパートメント膝関節形成術を受けている患者の大腿神経ブロックで見られました。 266および24mgを投与された患者は、67 mgのリポソームブピバカインまたは生理食塩水を投与された患者と比較して、0時間で安静時の痛みが有意に減少しました。 リポソームブピバカイン(80〜24 mg)の可変用量を用いたIlfeld et alによる研究は、より高用量の薬剤による長期の運動および感覚ブロックを示しました。 すべての患者は、40 mgの治療群で90時間以上、80 mgの治療群で12%以上、運動および感覚の遮断がありました。 最近の文献レビューでは、健康なボランティアとさまざまな外科的処置を受けている患者を対象としたXNUMX件の研究でリポソームブピバカインの安全性が調査されました。 神経周囲のリポソームブピバカイン注射の最も一般的な副作用は、悪心、発熱、便秘、嘔吐、および掻痒でした。 リポソームブピバカインとプラセボの副作用に差はありませんでした。 治療に関連する有害事象は、リポソームブピバカイン対ブピバカインHCL群で発生率が低く、最も一般的な有害事象は感覚鈍麻でした。 PNBでのリポソームブピバカインの広範な使用に対する潜在的な抑止力は、外科的麻酔を達成できない可能性、術後最初のXNUMX時間にわたってブピバカインHClと比較して鎮痛が劣る可能性、およびLAを滴定して効果を発揮できないことです。 感覚と運動の遮断が長引くと、早期のリハビリテーションに影響を及ぼし、転倒のリスクが高まる可能性があります。 PNBでの使用が承認された場合、単回注射のリポソームブピバカインは、連続PNBの長時間作用型代替品となる可能性があります。 神経周膜カテーテルを留置および固定することなく、処置効率が向上し、PNBがより広く使用される可能性があり、患者はカテーテル留置に関連する可能性のある有害事象を回避できます。
硬膜外麻酔
リポソームブピバカインは現在、硬膜外投与が承認されていませんが、1回の硬膜外注射後の薬理学的プロファイルが研究されています。 Viscusi、Candiotti、および同僚は、健康なボランティアにおけるブピバカインHCl 89 mgと比較して、155、266、または50mgのリポソームブピバカインの単回投与を評価する第266相ランダム化二重盲検アクティブコントロール用量漸増パイロット研究を実施しました。 彼らの研究は、89mgの硬膜外リポソームブピバカインがリポソームブピバカイン155または50mgまたはブピバカインHCl266mgよりも長い感覚遮断期間をもたらしたと結論付けました。 興味深いことに、ある程度の運動ブロックの発生率は、リポソームブピバカイン50mgとブピバカインHCl4mgの方が少なかった。 リポソームブピバカイン群は、XNUMX時間後に歩行できなかった患者が少なく、完全な運動ブロックのより迅速な解決がありました。 高い感覚運動ブロック比は、硬膜外麻酔におけるリポソームブピバカインの重要な有用性を示唆していますが、安全性と有効性を文書化するためにさらなる研究が必要です。
実験薬
セイバー-ブピバカイン
SABRE(イソ酪酸酢酸スクロース徐放性)技術(Durect Corporation)は、数日から3か月の期間にわたって薬物を送達する可能性のある、生体侵食性の注射可能なデポシステムとして開発されました。
製剤
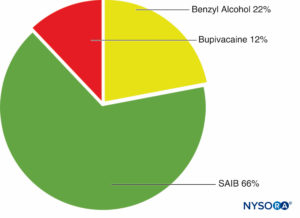
SABREデリバリーシステムは、イソ酪酸酢酸スクロース(SAIB)、添加剤、および溶媒で構成されています。 SAIBは、粘性のある液体として存在する疎水性のエステル化ショ糖誘導体です(図3)。 SABREシステムは、薬剤と混合して、最大25ゲージの針で皮下または筋肉内に注射することができます。
Durect Corporationによって開発されたSABRE-ブピバカイン(Posidur™)は、FDAの承認を待っています。
NYSORAのヒント
- SABRE-ブピバカインは、LAと混合されたSAIBデリバリーシステムで構成されています。 浸潤後、送達システムは組織内で溶解します。
薬理学
溶媒の種類と量、薬物の負荷、およびその他の添加物は、薬物送達の期間をカスタマイズするための可能な変数です。 SABRE製剤は、最大30%の薬剤ペイロードを運ぶことができます。 注射すると、薬剤は皮下組織にデポーを形成し、その放出はすぐに始まります。 デリバリーシステムはその場で溶解するため、取り外す必要がありません。 異なる用量のSABRE-ブピバカイン(12%ブピバカイン)を比較した研究では、用量濃度反応は線形の薬物動態を示しました。 健康な被験者とさまざまな外科的処置を受けている被験者の両方を対象とした11の臨床試験の大規模なレビューでは、24〜48時間でさまざまなTmaxが示されました(テーブル1)。 これは、腹部手術と比較した場合、肩の手術後の投与によるTmaxが短かったため、外科的処置によって異なるようです。 これはおそらく、より小さな手術領域に限定されたときに薬物が急速に吸収されるためです。
臨床的証拠
開放ヘルニア修復を受けた2012人の患者を対象とした124年の二重盲検ランダム化比較試験では、SABRE-ブピバカインは手術部位投与後にプラセボを上回りました。 5 mLのSABRE-ブピバカイン(12%ブピバカイン)の投与量は、プラセボと比較して、平均疼痛強度-1〜72時間の曲線下面積(AUC)が有意に低かった(2.47対3.61; p = .0036 )。 5 mLのグループは、プラセボと比較した場合、運動とオピオイドの消費による痛みの大幅な軽減と、最初のオピオイドまでの時間の増加を達成しました。 特に、SABRE-ブピバカインの2.5 mL製剤は、同じレベルの有意性に達しませんでした。 腹部手術を受けた2014人の患者を対象とした98年の多施設無作為化二重盲検試験では、SABRE-ブピバカインを投与された患者で3日間の臨床的および統計的に有意な痛みの軽減が示されました。
安全性
臨床的安全性の証拠が不完全なため、FDAは2013年にSABRE-ブピバカインの新薬承認申請を承認しませんでした。2012年、HadjらはSABRE-ブピバカインに起因する有害事象は報告しませんでした。 創傷治癒はグループ間で変化しなかった。 Gan et alは、バイタルサインの評価、身体検査、検査結果、およびホルターモニタリングを通じて、ブピバカイン毒性の証拠を特定できませんでした。
ブピバカイン-コラーゲンインプラント
現在フェーズ3のテストを待っているLAを使用したコラーゲンベースのインプラントは、ブピバカイン-コラーゲンインプラント(XaraColl®)。 この薬は、術後鎮痛を提供するために外科的外傷の部位に移植するためにInnocollPharmaceuticalsによって開発されています。
製剤
XaraCollは、ブピバカイン(図4)。 マトリックスは手術中に埋め込まれ、LAの放出をすぐに開始するとされています。
NYSORAのヒント
- ブピバカイン-コラーゲンインプラントは、LAを含浸させたコラーゲンマトリックスで構成されています。 コラーゲンマトリックスが吸収されている間、LAが放出されます。
薬理学
コラーゲンインプラントは、さまざまな濃度のブピバカインで研究されてきました。 コラーゲンマトリックスの吸収が遅いと、LAの制御放出が起こります。 全身ブピバカインレベルは、0.22μg/ mLの平均Cmaxで毒性閾値をはるかに下回ることが実証されました(テーブル1)。 リポソームブピバカインと同様に、この薬は濃度の増加の二相性ピークを示しました。 Cusackによる研究では、Tmaxは、どのピークが優勢であるかに応じて、30分から20時間の範囲でした。
臨床的証拠
片側鼠径ヘルニア修復後の男性を対象とした24つの独立した研究では、プラセボと比較した場合、ブピバカイン-コラーゲンインプラントの有意な治療効果が示されました。 ある研究では、オピオイド使用量に有意な変化がなく、48時間と72時間の両方で、インプラントとプラセボの両方で治療された患者の疼痛スコアが有意に減少しました。 XNUMX番目の研究では、疼痛スコアに差はありませんでしたが、ブピバカイン-コラーゲンインプラントを使用した患者ではオピオイドの使用量が大幅に減少しました。 これらの研究のプールされた分析は、この治療効果が術後XNUMX時間以上に及ぶことを示唆しました。
安全性
ブピバカイン-コラーゲンインプラントの埋め込み後の最も一般的な有害事象は、便秘、悪心、および頭痛でした。 ある研究では、移植後の肝酵素の上昇と異常なリンレベルが示されましたが、これらはいずれも臨床的に重要ではなく、自然に解消されました。 ブピバカインの毒性を示す可能性のある視覚障害が3人の患者で発見されましたが、血清サンプリングではブピバカインの全身濃度が低いことが示されました。 フェーズ48の試験では、プラセボと比較した場合、鼠径ヘルニアの修復において術後XNUMX時間で疼痛スコアが統計的に有意に減少することが示されています。
概要
鎮痛のより長い期間の臨床診療の必要性および時間効率が悪く、手順がより複雑な留置カテーテルの回避は、徐放性LAへの関心に拍車をかけた。 これまでのすべてのテクノロジーには、固有の妥協点があります。 これまでの証拠は、単回注射の徐放性LAの明確な有用性を示唆していますが、カテーテルと留置ポンプによるLAの送達には継続的な役割があります。 現在、FDAの承認を受けているこのクラスの唯一の薬剤は、創傷浸潤が承認されているリポソームブピバカインです。 新しい適応症の探求は、複数のモダリティの研究に影響を与えました。 局所麻酔と急性鎮痛薬で特に興味深いのは、PNBと硬膜外麻酔での使用の可能性です。 これらの分野での使用に対するFDAの承認は、局所麻酔の実施と術後疼痛管理の質にプラスの影響を与える可能性があります。 徐放性LAは、マルチモーダル鎮痛レジメンの重要な固有の部分になる可能性があります。 徐放性LAは、他の鎮痛薬とともに、現在公開されているすべての急性疼痛ガイドラインと一致する主要な術後鎮痛薬としてのオピオイドへの依存をさらに減らす可能性があります。
参考文献
- Samad A、et al:リポソームドラッグデリバリーシステム:最新のレビュー。 Curr Drug Deliv 2007; 4(4):297–305。
- Minkowitz HS、Singla NK、Evashenk MA、et al:舌下スフェンタニル錠の薬物動態および術後疼痛の管理における有効性と安全性。 Reg Anesth Pain Med 2013; 38:131–139。
- Volltexte、et al:薬物担体分子としてのシクロデキストリン:レビュー。 Sci Pharm 2008; 76:567–598。
- Kulkarni PR、et al:リポソーム:新しいドラッグデリバリーシステム。 Int J Curr Pharm Res 2011; 3(2):10–18。
- 処方集:リポソームブピバカイン:術後鎮痛のための長時間作用型局所麻酔薬。
- Lambert WJ:高分子の持続放出のためのDepoFoam多小胞リポソーム。 Rathbone MJ、Hadgraft J、Roberts MS、Lane ME(eds):Modified Release Drug Delivery Technology、第2版。 Informa Healthcare、2008:207–214。
- Angst MS、Drover DR:デポフォームを配合した薬物の薬理学:多小胞リポソーム技術を使用した非経口投与のための持続的薬物送達システム。 Clin Pharmacokinet 2006; 45(12):1153–1176。
- ハウエルSB:新規徐放性注射用ドラッグデリバリーシステムの臨床応用:デポフォーム技術。 Cancer J 2001; 7(3):219–227。
- Bala I、et al:ドラッグデリバリーにおけるPLGAナノ粒子:最先端。 Crit Rev Ther Drug Carrier Syst 2004; 21(5):387–422。
- Danhier F、et al:PLGAベースのナノ粒子:生物医学的応用の概要。 J Control Release 2012; 161(2):505–522。
- Pathak P、Nagarsenker M:皮膚送達のためのリドカイン脂質ナノシステムの処方と評価。 AAPS PharmSciTech 2009; 10(3):985–992。
- Mundargi RC、et al:ポリ(D、L-ラクチド-co-グリコリド)とその誘導体を使用して高分子治療薬を提供するためのナノ/マイクロテクノロジー。 J Control Release 2008; 125(3):193–209。
- マルカイン(ブピバカインHCl)[米国の処方情報]。 Hospira Inc.、2009年。
- ISMP:ISMPは、エラストマー鎮痛ポンプの使用における安全性の向上を求めています。 安全な投薬慣行研究所、2009年。
- Richard BM、et al:ウサギと犬に繰り返し皮下注射して投与されたEXPAREL(DepoFoam Bupivacaine)の安全性評価:種の比較。 J Drug Deliv 2011; 2011:467429。
- Richard BM、Ott、LR、et al:ウサギと犬の切開創浸潤によって投与されたDepoFoamブピバカインの安全性と忍容性の評価。 Expert Opin Investig Drugs 2011; 20(10):1327–1341。
- Langford RM、et al:術中のデポブピバカインの単回投与は、鼠径ヘルニア修復を受けている患者に長期の検出可能な血漿ブピバカインと鎮痛をもたらします。 62年12月16〜2008日、ニューヨークの第9088回麻酔科大学院会議で発表されたポスターXNUMX。
- Exparel(ブピバカインリポソーム徐放性注射用懸濁液)[処方情報]。 Pacira Pharmaceuticals Inc.、2011年。
- 臨床試験番号SKY0402-C-110。 肝機能障害のある被験者におけるSKY0402の薬物動態と安全性を評価するための非盲検第I相試験。 Pacira Pharmaceuticals Inc.(ファイルの日付)。
- 20. Hadzic A、Abikhaled JA、Harmon WJ:リポソームブピバカインの有効性と薬物動態に対する容量拡張の影響。 Local Reg Anesth 2015; 8:105–111。
- Gorfine SR、et al:痔核切除術を受けている患者の長期術後鎮痛のためのブピバカイン徐放性リポソーム注射:多施設、無作為化、二重盲検、プラセボ対照試験。 Dis Colon Rectum 2011; 54(12)1552–1559。
- Onel E、et al:リポソームブピバカイン局所鎮痛薬であるExparelは、痛みの緩和を拡大し、オピオイドの使用を減らします。 16年20月2010〜XNUMX日、カリフォルニア州サンディエゴで開催された米国麻酔科学会の年次総会で発表されました。
- Golf M、et al:バニオン切除術におけるDepoFoam®ブピバカイン(徐放性ブピバカイン局所鎮痛薬)の第3相ランダム化プラセボ対照試験。 Adv Ther 2011; 28(9):776–788。
- 臨床試験番号SKY0402-C-210。 増強乳房形成術を受けている被験者の長期の術後鎮痛に対するSKY0402の単回局所投与の安全性と有効性を評価するためのランダム化二重盲検アクティブコントロール試験。 Pacira Pharmaceuticals Inc.(ファイルの日付)
- Butz DR、Shenaq DS、Rundell VL、et al:即時のインプラントベースの乳房再建でエクスパレルを使用することにより、術後の痛みと滞在期間が短縮されました。 Plast Reconstr Surg Glob Open 2015; 3(5):e391。
- Bagsby DT、Ireland PH、Meneghini RM:人工膝関節全置換術後の疼痛管理のためのリポソームブピバカインと従来の関節周囲注射。 J関節形成術2014;29(8):1687–1690。
- Alijanipour et al:リポソームブピバカインの関節周囲注射は、人工膝関節全置換術における標準的なブピバカイン注射に勝る利点を提供しません:前向き無作為化比較試験。 2016年1月2016日、米国整形外科学会のXNUMX年年次総会で発表されました。フロリダ州オーランド。
- Surdam JW、et al:片側人工膝関節全置換術患者の術後疼痛を管理するためのExparel(リポソームブピバカイン)の使用。 J関節形成術2015;30:325–329。
- Viscusi ER:発売から2年後のリポソームブピバカインの安全性:振り返りと楽しみ。 Expert Opin Drug Saf 2015; 14(12):1801–1803。
- Ilfeld BM、Viscusi ER、Hadzic A、et al:末梢神経ブロックにおけるリポソームブピバカイン(Exparel)の安全性と副作用プロファイル。 Reg Anesth Pain Med 2015; 40(5):572–582。
- McAlvin JB、et al:坐骨神経における多小胞リポソームブピバカイン。 Biomaterials 2014; 35:4557–4564。
- Damjanovska M、Cvetko E、Hadzic A、et al:坐骨神経ブロックのブタモデルにおけるリポソームブピバカインの神経周囲注射と神経内-束外注射の神経毒性。 麻酔2015;70(12):1418–1426。
- Ilfeld BM、et al:単回注射末梢神経ブロックとしてのリポソームブピバカイン:用量反応研究。 Anesth Analg 2013; 117:1248–1256。
- Ilfeld BM、et al:末梢神経ブロックにおけるリポソームブピバカイン(Exparel)の安全性と副作用プロファイル。 Reg Anesth Pain Med 2015; 40:572–582。
- Ilfeld BM、et al:4日間の末梢神経ブロック? リポソームブピバカイン:紹介と更新。 ASAニュースレター2014;78(8)。
- Viscusi ER、Candiotti KA、Onel E、Morren M、Ludbrook GL:健康なボランティアに2012回の硬膜外注射で投与されたリポソームブピバカインの薬物動態と薬力学。 Reg Anesth Pain Med 37; 6(616):622–XNUMX。
- Hadj A、et al:開放ヘルニアにおける徐放性ブピバカイン局所麻酔薬の安全性と有効性:ランダム化比較試験。 ANZ J Surg 2012; 82:251-257。
- Sekar M、et al:生物製剤のドラッグデリバリー:徐放性戦略。 17年3月6〜2015日にカリフォルニア州サンディエゴで開催されたIBCの第XNUMX回TIDES会議で発表されました。
- Shah J、et al:外科モデル全体のヒトにおけるSABRE-ブピバカインのPKプロファイルは、72時間の持続的な薬物送達を示しています。 2014年15月2014日、ルイジアナ州ニューオーリンズで開催された米国麻酔科学会のXNUMX年年次総会で発表されました。
- Gan T、et al:SABRE-ブピバカインは、ブピバカインHClと比較して、腹部手術後72時間の痛みの強さを軽減しました。 2014年15月2014日、ルイジアナ州ニューオーリンズで開催された米国麻酔科学会のXNUMX年年次総会で発表されました。
- Cusack SL、et al:2012つの多施設、無作為化、二重盲検、プラセボ対照パイロット試験における術後鎮痛のためのブピバカイン-コラーゲンインプラントであるXaraCollの臨床評価。 J Pain Res 5; 217:225–XNUMX。
- Cusack SL、et al:腹部子宮全摘出術後の女性の術後鎮痛のための術中ブピバカイン-コラーゲンインプラント(XaraColl®)の薬物動態と安全性。 J Pain Res 2013; 6:151–159。
- Hu D、et al:手術部位での単回投与後のリポソームブピバカイン注射の薬物動態プロファイル。 Clin Drug Investig 2013; 33:109–115。
- 臨床試験NCT02523599。 開腹ヘルニア形成術後のXaracoll®ブピバカインインプラント(3mgブピバカイン塩酸塩)の有効性と安全性を調査するための第300相無作為化二重盲検プラセボ対照試験。 イノコル。 (ファイルの日付)