Jeff Gadden
INTRODUZIONE
L'incidenza delle complicanze dell'anestesia generale è diminuita sostanzialmente negli ultimi decenni, in gran parte a causa dei progressi nel monitoraggio della funzione respiratoria e cardiovascolare durante la somministrazione dell'anestesia. L'uso di monitor obiettivi come pulsossimetria, capnografia, elettrocardiografia, ecc., consentono ai professionisti di identificare tempestivamente i parametri fisiologici in cambiamento, intervenire rapidamente e in modo appropriato e guidare le loro decisioni terapeutiche.
La pratica dell'anestesia regionale ha tradizionalmente sofferto della mancanza di monitor obiettivi che aiutino il medico a monitorare in modo più obiettivo la relazione ago-nervo e prevenire lesioni neurologiche. La pratica dei blocchi nervosi periferici si basava tradizionalmente su punti finali soggettivi per valutare il potenziale rischio per il paziente. Questo sta cambiando, tuttavia, con l'introduzione e l'adozione di metodi standardizzati mediante i quali eseguire in sicurezza blocchi nervosi periferici con il minimo rischio possibile per il paziente. Ad esempio, invece di fare affidamento sulla sensazione di "clic", "scoppietti" e "graffi" per identificare la posizione della punta dell'ago, i professionisti possono ora monitorare l'interazione a livello degli strati ago-fasciali utilizzando l'ecografia. Allo stesso modo, la quantificazione dell'intensità di corrente minima e della resistenza all'iniezione può essere utilizzata per raccogliere ulteriori dati utili nel processo decisionale clinico per ridurre al minimo il rischio di posizionamento dell'ago in un piano tissutale indesiderato, per via intravascolare o in strutture anatomiche vulnerabili per via intraneurale. I recenti progressi nel monitoraggio possono quindi ridurre le tre complicanze più temute del blocco dei nervi periferici: lesioni nervose, tossicità da anestetico locale, e danni involontari alle strutture adiacenti ("disavventura dell'ago").
Il monitoraggio oggettivo e la logica del suo utilizzo sono discussi nella prima parte di questa sezione. L'ultima sezione si concentra sulla documentazione delle procedure di blocco nervoso, che è la registrazione logica delle informazioni oggettive ottenute dai monitor. La documentazione oggettiva e solida di come è stato eseguito un blocco nervoso ha ovvie implicazioni medico-legali e fornisce un utile database per guidare i progressi in termini di sicurezza ed efficacia.
MONITORAGGIO
Mezzi disponibili per il monitoraggio delle relazioni ago-nervo
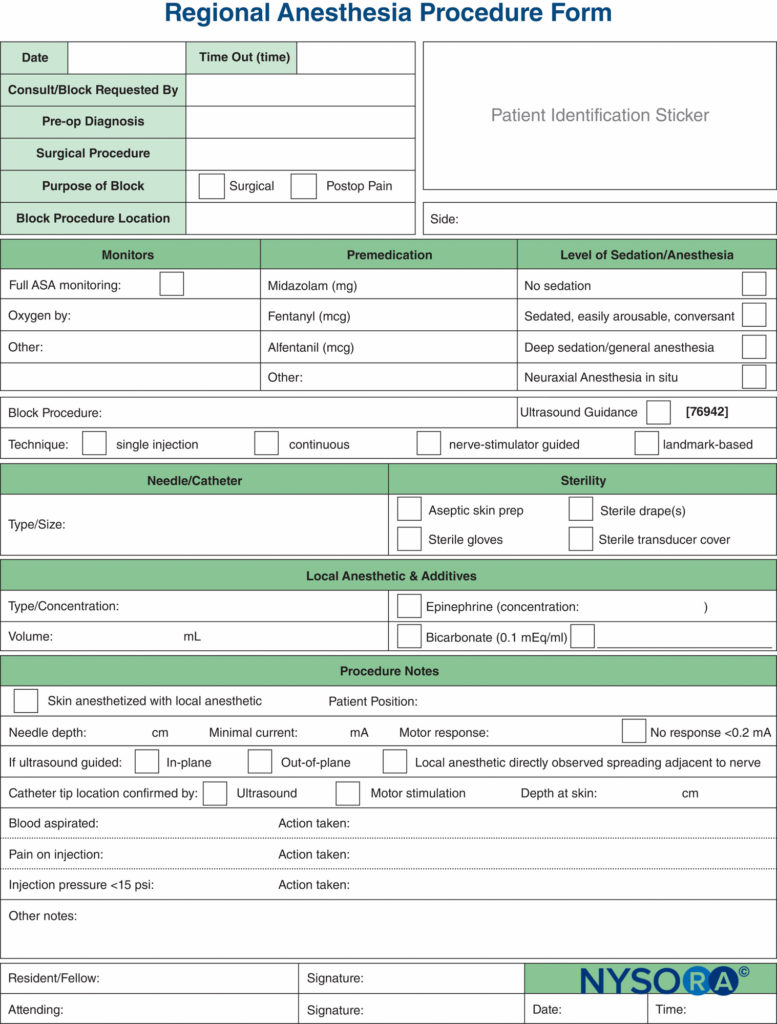
I monitor, come utilizzati nella pratica medica, sono dispositivi che valutano uno specifico stato fisiologico e avvertono il medico di danni imminenti. I monitor discussi in questo capitolo includono quelli per la stimolazione nervosa, l'ecografia e il monitoraggio della pressione di iniezione. Ognuno di questi ha il proprio insieme distinto di vantaggi e limiti e ciascuno è meglio utilizzato in modo additivo e complementare (Figure 1 ) per ridurre al minimo il rischio di lesioni al paziente, piuttosto che fare affidamento solo sulle informazioni fornite da un solo monitor. Esistono sufficienti informazioni basate sull'evidenza che è probabile che la combinazione di tutti e tre i monitor produca il processo più sicuro possibile durante la pratica dei blocchi nervosi periferici.
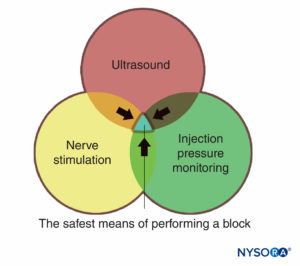
FIGURA 1. Tre modalità di monitoraggio dei blocchi nervosi periferici per lesioni al paziente. L'area di sovrapposizione di tutti e tre (area blu) rappresenta il mezzo più sicuro per eseguire un blocco.
Un altro monitoraggio farmacologico che molti medici utilizzano regolarmente è l'uso dell'adrenalina nell'anestetico locale. Ci sono alcune prove a sostegno di questa pratica come mezzo per migliorare la sicurezza per la maggior parte dei pazienti durante i blocchi nervosi periferici. In primo luogo, agisce come un marker di assorbimento intravascolare. L'iniezione endovenosa di 10-15 μg di adrenalina aumenta in modo affidabile la pressione sanguigna sistolica di oltre 15 mmHg, anche in pazienti sedati o trattati con β-bloccanti. Il riconoscimento di questo aumento può consentire la diagnosi precoce dell'iniezione intravascolare e consente al medico di interrompere prontamente l'iniezione e aumentare la vigilanza per i segni di tossicità sistemica. In secondo luogo, l'adrenalina riduce il livello plasmatico di picco dell'anestetico locale, con conseguente minor rischio di tossicità sistemica. Le preoccupazioni relative agli effetti vascolari dell'adrenalina, della vasocostrizione e dell'ischemia nervosa non sono state motivate, e infatti concentrazioni di 2.5 μg/mL (1:400,000) sono state associate ad un aumento del flusso sanguigno del nervo, probabilmente a causa della predominanza del β -effetto del farmaco. Pertanto, l'adrenalina può aumentare la sicurezza durante la somministrazione di dosi maggiori di anestetici locali senza rischio documentato di ischemia degli arti e morte neurologica.
Da notare che l'uso della guida ecografica durante i blocchi nervosi periferici ha ridotto significativamente il rischio di grave tossicità sistemica degli anestetici locali per diversi motivi. Ciò è probabilmente dovuto al fatto che la guida ecografica ha consentito di ridurre il volume e la dose di anestetico locale per eseguire la maggior parte delle procedure di blocco nervoso monitorando la sua diffusione. Inoltre, l'osservazione del percorso dell'ago sugli ultrasuoni, l'evitare il posizionamento intravascolare e la conferma della diffusione dell'anestetico locale nei tessuti si aggiungono a una maggiore sicurezza con l'anestesia regionale ecoguidata.
Stimolazione nervosa
La neurostimolazione ha in gran parte sostituito la parestesia come mezzo principale di localizzazione dei nervi negli anni '1980. Tuttavia, la sua utilità come metodo per localizzare con precisione i nervi è stata recentemente messa in discussione dai dati di diversi studi che hanno dimostrato che la risposta motoria evocata (EMR) può essere assente nonostante il contatto intimo ago-nervo, come confermato dall'ecografia. In effetti, in un certo numero di contatti ago-nervoso o persino nel posizionamento dell'ago intraneurale, potrebbe essere necessaria un'intensità di corrente inaspettatamente elevata per suscitare un EMR. Ad esempio, in alcuni casi, un EMR potrebbe essere ottenuto solo con un'intensità di corrente relativa superiore a 1 mA anche con il posizionamento dell'ago intraneurale come si vede sugli ultrasuoni.
Ci sono probabilmente molteplici fattori che contribuiscono alla spiegazione di questo fenomeno. Il fattore più importante è molto probabilmente la derivazione della corrente elettrica lungo il percorso di minor resistenza (impedenza). In altre parole, anche quando l'ago si trova nelle immediate vicinanze del nervo, la corrente elettrica potrebbe non aver scelto necessariamente di viaggiare verso il nervo, ma piuttosto viaggiare lungo il percorso di minor resistenza per uscire tramite l'elettrodo cutaneo. Un ulteriore fattore può includere la distribuzione non uniforme delle fibre motorie e sensoriali nel nervo composto.
Ciò, tuttavia, non significa che la stimolazione elettrica dei nervi periferici sia obsoleta in un'era di guida ecografica. Ad esempio, i dati di diversi studi su animali e umani hanno suggerito che la presenza di una risposta motoria a una corrente molto bassa (cioè < 0.2 mA) è associata al posizionamento della punta dell'ago intraneurale e all'infiammazione intraneurale dopo un'iniezione in questa condizione (Tabella 1). Voelckel et al. riferito che quando l'anestetico locale è stato iniettato a correnti comprese tra 0.3 e 0.5 mA, il tessuto nervoso risultante non ha mostrato segni di un processo infiammatorio, mentre le iniezioni a meno di 0.2 mA hanno provocato infiltrazione linfocitica e granulocitaria nel 50% dei nervi. Tsai et al. ha eseguito uno studio simile indagando l'effetto della distanza dal nervo sulla corrente richiesta; mentre un intervallo di correnti è stato registrato per una varietà di distanze, gli unici casi in cui la risposta motoria è stata ottenuta a meno di 0.2 mA sono stati quando la punta dell'ago è stata posizionata per via intraneurale.
TABELLA 1. Riassunto di studi recenti sulla corrente di stimolazione nervosa e sulla posizione della punta dell'ago.
| Studio | Oggetto | metodo | Giudizio |
|---|---|---|---|
| Voelckel et al (2005)11 | Suini (n = 10) | • Blocchi del nervo sciatico posteriore eseguiti bilateralmente • Due gruppi - Iniezione dopo EMR a 0.3–0.5 mA - Iniezione dopo EMR a < 0.2 mA • 6 ore dopo l'iniezione, nervi sciatici prelevati per l'analisi istologica | • Aspetto normale e sano dei nervi nel gruppo ad alta corrente • Il 50% dei nervi nel gruppo a bassa corrente ha mostrato evidenza di linfociti e granulociti polimorfi sub-, peri-. e intraneurale • Un campione nel gruppo a bassa corrente ha mostrato una grave interruzione del perineurio e di più fibre nervose |
| Sai et al (2008)12 | Suini (n = 20) | • Anestesia generale • Nervi sciatici esposti bilateralmente • Corrente applicata con ago a varie distanze da 2 cm di distanza a intraneurale • Due osservatori accecati hanno concordato sulla corrente minima richiesta per ottenere la contrazione dello zoccolo • 40 tentativi a ogni distanza | • Le contrazioni del nervo sciatico sono ottenibili solo a 0.1 cm o meno • Ampia gamma di correnti richieste per ottenere la risposta del motore • Solo quando intraneurale una risposta motoria risultava da una corrente < 0.2 mA |
| Bigeleisen et al (2009)13 | Pazienti per chirurgia della mano/polso (n = 55) | • Blocco sopraclavicolare • Corrente minima (mA) registrata- Con ago all'esterno del tronco nervoso (ma a contatto con il nervo)- All'interno del tronco • Posizione “intraneurale” confermata ecograficamente con iniezione di 5 ml di anestetico locale | • Soglia di corrente minima mediana al di fuori del nervo 0.60 mA ± 0.37 mA • La soglia di corrente minima mediana esterna al nervo era 0.30 ± 0.19 mA • Nessun EMR osservato in nessun momento con < 0.2 mA quando l'ago è posizionato all'esterno del nervo |
| Wiesmann et al (2014)14 | Suini (n = 6) | • Modello a plesso brachiale aperto • Stimolazione in tre posizioni: intraneurale, contatto ago-nervo ea 1 mm di distanza dal nervo • 3 durate di impulso testate (0.1, 0.3 e 1 ms) | • L'intensità della corrente non è in grado di distinguere tra il contatto intraneurale e il nervo dell'ago • La risposta del motore < 0.2 mA (indipendentemente dalla durata dell'impulso) indicava un contatto intraneurale o ago-nervoso |
Bigeleisen et al. ha studiato 55 pazienti in attesa di intervento chirurgico all'arto superiore che hanno ricevuto blocchi del plesso brachiale sopraclavicolare ecoguidati. Gli autori si sono proposti di determinare la soglia di corrente minima per la risposta motoria sia all'interno che all'esterno del primo tronco incontrato. Hanno riferito che la soglia di stimolazione minima mediana era di 0.60 mA all'esterno del nervo e 0.3 mA all'interno del nervo. Tuttavia, l'EMR non è stato osservato con correnti di stimolazione di 0.2 mA o meno all'esterno del nervo, mentre il 36% dei pazienti ha avuto una contrazione EMR a correnti inferiori a 0.2 mA con il posizionamento dell'ago intraneurale. Per perfezionare ulteriormente questa relazione, Wiesmann e colleghi hanno applicato una corrente elettrica al plesso brachiale dei suini in tre diverse posizioni (intraneurale, con l'ago a contatto con l'epineurio e a 1 mm dal nervo) variando la durata dell'impulso (0.1, 0.3). e 1.0 ms). La corrente di soglia minima per suscitare una risposta motoria era identica tra le posizioni di contatto intraneurale e nervo-ago, ed entrambe erano significativamente inferiori alla posizione a 1 mm di distanza. La durata dell'impulso non ha avuto alcun effetto sulla corrente di soglia minima. Questi autori hanno concluso che una risposta motoria inferiore a 0.2 mA (indipendentemente dalla durata dell'impulso) indicava un contatto intraneurale o ago-nervoso. Questo è importante perché è stato stabilito che, anche in assenza di puntura dell'epinevrio, anche un forte contatto ago-nervo (epinevrio) provoca infiammazione e potenziale danno nervoso.
Presi insieme, i dati disponibili suggeriscono che la sensibilità di una "corrente bassa" per suscitare un EMR in una relazione ago-nervoso potenzialmente pericolosa (posizionamento intraneurale/epineurale) è di circa il 75%. Tuttavia, la specificità dell'EMR quando presente a meno di 0.5 mA si avvicina al 100%. In altre parole, una risposta motoria è provocata da una corrente stimolante a bassa intensità (p. es., < 0.2 mA secondo Voelckel et al), la punta è sempre intraneurale o intimamente correlata all'epineurio. Pertanto, l'utilità dello stimolatore nervoso è ovvia: la comparsa inaspettata di un EMR a 0.5 mA indica una pericolosa relazione ago-nervo (p. es., contatto ago-nervo) e può consentire all'operatore di interrompere l'avanzamento dell'ago prima che l'ago entri nel nervo .
È universalmente accettato che l'iniezione di anestetico locale nel nervo comporti un fattore di rischio per la lesione del nervo; pertanto, la deposizione extraneurale di anestetico locale costituisce una pratica più sicura. Sebbene indiscutibilmente utile, l'ecografia è tutt'altro che un monitor infallibile della relazione ago-nervo. Poiché l'iniezione in un fascicolo comporta un rischio elevato di lesioni, l'aggiunta del monitoraggio elettrico della posizione della punta dell'ago è utile per la sicurezza, in particolare nei pazienti con un'anatomia ecografica difficile quando l'imaging si rivela difficile o la qualità di un'immagine è scarsa. Se un EMR viene suscitato a correnti inferiori a 0.5 mA, ciò indica un'intima relazione ago-nervo che dovrebbe richiedere un leggero ritiro dell'ago e un'attenta iniezione evitando una pressione di iniezione di apertura superiore a 15 psi. Nel complesso, la stimolazione nervosa aggiunge poco al costo di una procedura di blocco nervoso, in termini di tempo o di costo e può anche servire come utile conferma funzionale dell'immagine anatomica mostrata sullo schermo ecografico (ad es. "È il nervo mediano o ulnare? ?”). Per questi motivi, la stimolazione nervosa dovrebbe essere utilizzata di routine insieme agli ultrasuoni come un prezioso monitoraggio aggiuntivo della posizione della punta dell'ago. Impara di più riguardo Stimolatori nervosi elettrici e localizzazione dei nervi periferici.
ecografia
L'ecografia ha rivoluzionato la pratica dell'anestesia regionale e ha consentito una sostanziale evoluzione della sottospecialità da arte praticata da pochi a scienza più riproducibile. I vantaggi sono che gli ultrasuoni consentono di vedere l'ago in tempo reale e quindi di guidare l'ago in modo rapido e preciso verso il bersaglio. Gli ultrasuoni consentono anche un'iniezione aggiuntiva quando il primo tentativo non è adeguato e depositano accuratamente l'iniettato negli spazi dei tessuti per un blocco nervoso riproducibile. Inoltre, l'ecografia consente di eseguire il blocco nervoso anche in pazienti paralizzati, amputati che non hanno un arto per un EMR e così via.
Gli ultrasuoni hanno il potenziale per migliorare la sicurezza dei blocchi nervosi periferici per una serie di motivi. Strutture importanti adiacenti possono essere viste ed evitate. La rinascita in popolarità del blocco sopraclavicolare ne è una testimonianza. Prima dell'ecografia, questo blocco altamente efficace era relativamente impopolare come mezzo per anestetizzare il plesso brachiale per paura di provocare uno pneumotorace, a causa della vicinanza del plesso e della vista del posizionamento dell'ago alla pleura e alla cavità toracica. Tuttavia, poiché il plesso brachiale e, soprattutto, la costola, la pleura e l'arteria succlavia possono essere identificati mediante ecografia, il blocco sopraclavicolare è diventato un luogo comune nella pratica clinica. Indipendentemente da ciò, gli ultrasuoni non dovrebbero essere considerati a prova di errore perché le complicazioni, incluso il pneumotorace, si verificano ancora con la guida ecografica. Allo stesso modo, ci sono segnalazioni di posizionamento di aghi intravascolari e intraneurali testimoniato da (e nonostante l'uso di) ultrasuoni.
Un importante vantaggio dello screening ecografico è la capacità di determinare la distanza dalla pelle al bersaglio. Questo, insieme agli aghi con segni di profondità incisi sul lato, conferisce un ulteriore margine di sicurezza avvertendo il medico di una "distanza di arresto" o una profondità oltre la quale il medico dovrebbe interrompere l'avanzamento dell'ago verso il tessuto più profondo e rivalutare. Un altro importante vantaggio degli ultrasuoni è la capacità di vedere la distribuzione dell'anestetico locale in tempo reale. (Figure 2 ). Se non si vede l'espansione del tessuto corrispondente all'inizio dell'iniezione, la punta dell'ago potrebbe non essere dove si pensa che sia e il medico può interrompere l'iniezione e rivalutare la posizione della punta dell'ago. Ciò è particolarmente importante nelle aree vascolari, poiché la mancanza di diffusione dell'anestetico locale può segnalare il posizionamento dell'ago intravascolare. D'altra parte, il monitoraggio ecografico può essere utilizzato per diagnosticare il posizionamento intra-arterioso della punta dell'ago quando si nota un "rossore" ecogeno nel lume dell'arteria, diminuendo il rischio di tossicità sistemica.
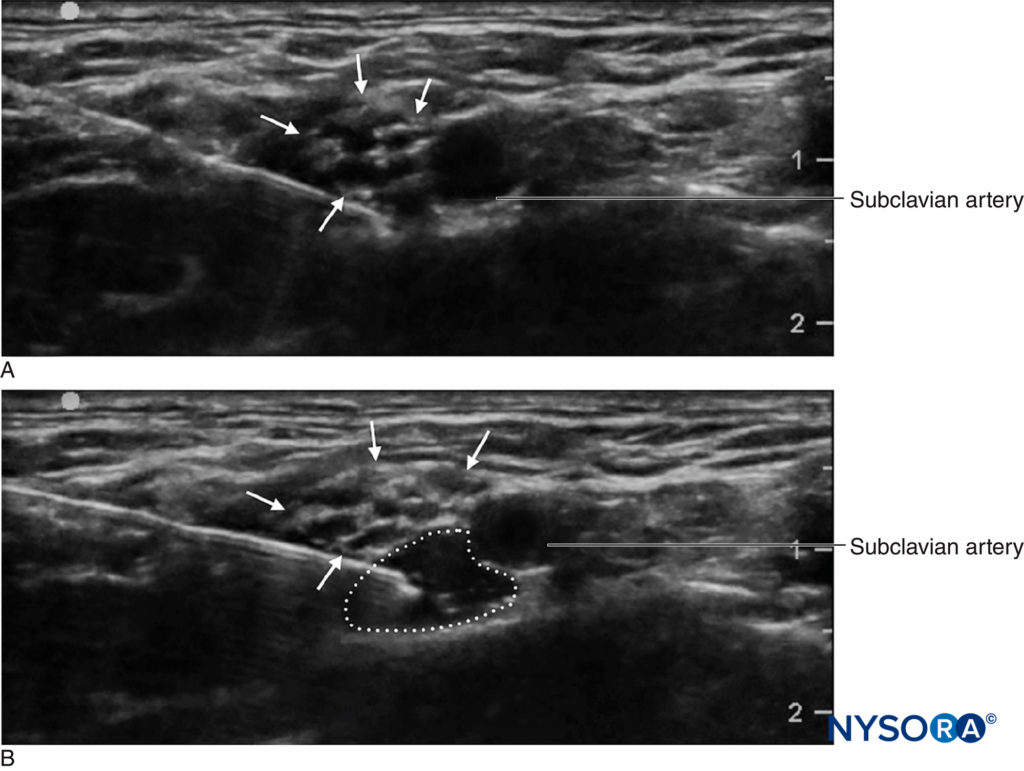
FIGURA 2. Blocco del plesso brachiale sopraclavicolare che mostra il plesso (frecce) adiacente all'arteria succlavia (SA). A Prima e B dopo la deposizione di 10 ml di anestetico locale (contorno tratteggiato).
L'ecografia sembra ridurre il rischio di tossicità sistemica dell'anestetico locale (LAST). In un'analisi di un ampio registro multicentrico di blocchi nervosi periferici (>25,000 blocchi nervosi periferici), il rischio di LAST è stato ridotto di oltre il 65% con l'uso della guida ecografica. Il meccanismo proposto dagli autori era la capacità di ridurre sostanzialmente i volumi e le dosi di anestetico locale necessarie per realizzare il blocco regionale. In effetti, la riduzione della dose e del volume di anestetico locale necessari per il successo dell'anestesia regionale è stata una tendenza coerente nell'ultimo decennio. Numerosi rapporti hanno documentato sostanziali riduzioni del volume necessario per effettuare un blocco equivalente rispetto alle tecniche di anestesia regionale pre-guidata da ultrasuoni. Ad esempio, i blocchi del plesso brachiale possono essere eseguiti con meno di 10 ml di anestetico locale, senza sacrificare l'efficacia dell'anestesia o dell'analgesia. Anche se l'intero volume di iniettato viene somministrato accidentalmente per via endovenosa, è improbabile che l'ULTIMO grave risulti, ad esempio, da un volume di 7 ml di ropivacaina allo 0.5% in un adulto di taglia media. Al contrario, l'uso della guida ecografica durante il nervo periferico blocchi non ha ridotto il rischio o l'incidenza di lesioni nervose.
Questa osservazione deludente è stata documentata in diversi rapporti ed è probabilmente multifattoriale. La capacità di discernere la relazione ago-nervo dipende dall'utente e dall'anatomia. In effetti, gli studi hanno dimostrato che i professionisti possono perdere all'incirca un'iniezione intraneurale su sei. In secondo luogo, l'attuale risoluzione della macchina ad ultrasuoni potrebbe non essere adeguata per discernere tra una posizione della punta dell'ago extrafascicolare intraversus. Questa differenza è cruciale, poiché un'iniezione intraneurale (ma extrafascicolare) probabilmente non è associata a lesioni, mentre l'iniezione all'interno dei fasci stessi produce danni clinici e istologici. È importante sottolineare che non si può fare affidamento sul gonfiore del nervo come avvertimento di un'iniezione intraneurale perché una volta notato questo sugli ultrasuoni, potrebbe essere troppo tardi per prevenire lesioni. Questo perché anche una minima quantità di anestetico locale produrrà danni se iniettata nel fascicolo, tuttavia quantità così piccole di anestetico locale (p. es., 0.1–0.5 ml) potrebbero non essere rilevate dagli ultrasuoni. Pertanto, fare affidamento sulla conferma visiva dell'espansione del tessuto può causare danni prima che l'espansione venga rilevata sullo schermo.
Monitoraggio della pressione di iniezione
Un'iniezione di lidocaina mentre la punta dell'ago era in posizione intrafascicolare nei nervi sciatici canini è stata associata a un'elevata pressione di apertura (>20 psi), seguita da un ritorno della pressione di iniezione alla normalità (cioè, < 5 psi) dopo la rottura del fascicolo. Al contrario, le iniezioni extrafascicolari perineurali e intraneurali hanno prodotto basse pressioni di apertura e di iniezione. Gli arti in cui le iniezioni del nervo sciatico erano associate a pressioni di iniezione di apertura elevate presentavano segni clinici di neuropatia (deperimento muscolare, debolezza) nonché evidenza istologica di danno neurologico (infiammazione, rottura dell'architettura del nervo). L'implicazione è che l'iniezione in un compartimento a bassa compliance, come all'interno dei fascicoli legati al perineurio, richiede un'elevata pressione di apertura dell'iniezione prima che l'iniezione possa essere avviata.
La posizione della punta dell'ago intraneurale è anche associata a pressioni di iniezione di apertura elevate nei cadaveri umani. Orebaugh et al hanno posizionato gli aghi nelle radici cervicali da cadavere usando gli ultrasuoni e hanno quantificato la pressione nel corso di un'iniezione di 5 ml di ropivacaina e inchiostro in 15 s. Contrariamente agli aghi di controllo posti all'esterno delle radici (pressione di picco < 20 psi), le iniezioni intraneurali hanno determinato una pressione di picco media di 49 psi (intervallo 37-66 psi). Allo stesso modo, Krol et al hanno eseguito iniezioni guidate da ultrasuoni per via intraneurale e perineurale in nervi più distali in cadaveri umani freschi (nervi mediano, ulnare e radiale) e hanno anche riferito che la pressione di iniezione di apertura era superiore a 15 psi a livello intraneurale, mentre le pressioni di iniezione di apertura extraneurale erano inferiori a 10 psi.
In uno studio clinico su 16 pazienti sottoposti a chirurgia della spalla, il contatto ago-nervoso durante il blocco del plesso brachiale interscalenico è stato associato a un'iniezione di apertura superiore a 15 psi. Infatti, al contatto ago-nervo e appena prima dell'ingresso dell'ago nelle radici del plesso brachiale, il flusso di iniettato non poteva iniziare a pressioni inferiori a 15 psi. Interrompere un'iniezione quando la pressione di iniezione di apertura richiesta per iniziare un'iniezione ha raggiunto 15 psi ha consentito di evitare l'iniezione in questa posizione pericolosa nel 97% dei soggetti. Al contrario, una posizione dell'ago a 1 mm di distanza dal nervo era associata all'inizio del flusso a pressioni di apertura inferiori a 15 psi. Pertanto, come monitor del contatto ago-nervo, una pressione di iniezione di apertura maggiore di 15 psi era molto più sensibile di una corrente di soglia minima di 0.5 o 0.2 mA o del verificarsi di parestesia.
Questi dati suggeriscono che quando la pressione nel sistema si avvicina a 15 psi senza la possibilità di avviare il flusso di iniettato, questa pressione di iniezione di apertura elevata può segnalare una pericolosa relazione ago-nervo o posizionamento dell'ago nel piano del tessuto errato. Pertanto, l'iniezione deve essere interrotta e la posizione dell'ago deve essere rivalutata.
Come deve essere monitorata la pressione di iniezione? Sfortunatamente, l'uso della "sensazione della mano" per evitare un'elevata pressione di iniezione non è affidabile. Gli studi su professionisti esperti, accecati dalla pressione di iniezione e ai quali è stato chiesto di eseguire una simulazione di iniezione utilizzando attrezzature standard, hanno rivelato ampie variazioni nella pressione applicata, alcune delle quali superavano grossolanamente le soglie di sicurezza stabilite. Allo stesso modo, gli anestesisti si sono comportati male quando è stato chiesto di distinguere tra iniezione intraneurale e iniezione in altri tessuti, come muscoli o tendini, in un modello animale. Pertanto, l'unico monitoraggio significativo e riproducibile consiste nell'utilizzare un metodo oggettivo e quantificabile per monitorare la pressione di iniezione di apertura.
Sebbene la pratica del monitoraggio della pressione di iniezione durante i blocchi nervosi periferici sia relativamente nuova, esistono diverse opzioni di monitoraggio. Tsui et al hanno descritto una "tecnica di iniezione di aria compressa" mediante la quale 10 ml di aria vengono aspirati nella siringa insieme all'anestetico locale. Tenendo la siringa in posizione verticale, è possibile evitare una soglia massima di 1 atm (o 14.7 psi) consentendo solo alla parte di gas del contenuto della siringa di comprimersi a metà del suo volume originale, o 5 ml (Figure 3 ). Questo si basa sulla legge di Boyle, che afferma che la pressione × volume deve essere costante. Una pressione di 20 psi o meno è considerata una soglia sicura per iniziare l'iniezione durante i blocchi nervosi periferici. La legge di Boyle è stata impiegata anche in un altro semplice apparato che utilizza un rubinetto a quattro vie e una siringa da 1 ml riempita d'aria. Se, durante l'inizio dell'iniezione, il menisco fluido raggiunge il punto intermedio nella siringa da 1 ml (cioè, 0.5 ml), ciò è indicativo del raddoppio della pressione nel sistema (cioè, un'altra atmosfera o 14.7 psi). Questi sono metodi economici e onnipresenti per limitare la pressione di iniezione durante i blocchi nervosi periferici. Le limitazioni pratiche includono la necessità di tenere la siringa in posizione verticale o di chiudere periodicamente il rubinetto della siringa da 1 ml durante l'aspirazione in modo che l'aria non possa entrare nel tubo di iniezione.
FIGURA 3. La tecnica dell'iniezione di aria compressa. Una bolla d'aria da 10 ml viene posta nella siringa dell'anestetico locale, che viene quindi capovolta. La compressione di quella bolla in un sistema chiuso alla metà del suo volume originale (cioè 5 ml) aumenterà la pressione nel sistema di 1 atm (14.7 psi).
Un'altra opzione per monitorare la pressione di iniezione è l'uso di manometri di pressione in linea monouso fabbricati appositamente per questo scopo. Questi dispositivi collegano la siringa e il tubo dell'ago e, tramite un pistone a molla, consentono al medico di monitorare continuamente la pressione nel sistema siringa-tubo-ago. Sull'albero del pistone sono presenti segni che delineano tre diverse soglie di pressione: inferiore a 15 psi, 15–20 psi e superiore a 20 psi (Figure 4 ). Un vantaggio di questo metodo è la facilità con cui un assistente che sta effettuando l'iniezione può leggere e comunicare le pressioni raggiunte. Questo metodo consente anche una documentazione oggettiva della pressione di iniezione durante una procedura di blocco del nervo periferico. È importante sottolineare che la pressione di apertura (pressione alla quale inizia il flusso) è indipendente dalle dimensioni della siringa, del tubo e dell'ago o dalla velocità di iniezione (legge di Pascal) (Figure 5 ). Mentre una pressione maggiore può essere generata da una siringa più piccola e una pressione di iniezione più alta può essere raggiunta con un'iniezione rapida, la pressione di apertura a cui inizia il flusso è la stessa e indipendente da queste variabili per le dimensioni comuni degli aghi dei tubi delle siringhe (cioè, 18– calibro 25). Quando inizia l'iniezione, tuttavia, questi fattori influenzeranno la pressione di iniezione raggiunta. Pertanto, si suggerisce una velocità di iniezione lenta e costante con tutte le procedure di blocco nervoso (10–15 ml/min). La pressione di apertura dell'iniezione diventa rilevante ad ogni riposizionamento dell'ago e conseguente iniezione. Il monitoraggio della pressione può essere un utile monitor di sicurezza in molti altri aspetti dei blocchi nervosi periferici. In uno studio su pazienti che ricevevano blocchi del plesso lombare randomizzati a pressioni basse (<15 psi) rispetto a pressioni alte (>20 psi), Gadsden et al hanno dimostrato che il 60% dei pazienti nel gruppo ad alta pressione presentava un blocco epidurale bilaterale.
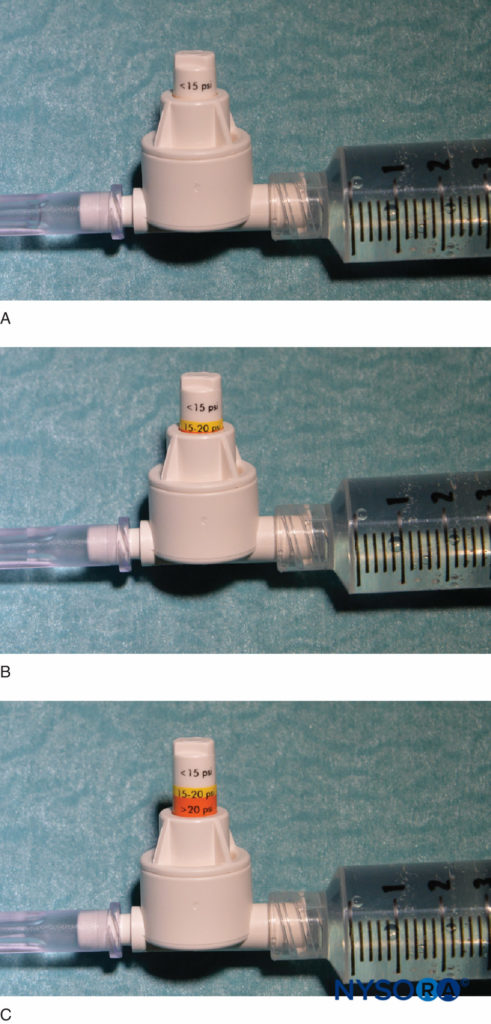
FIGURA 4. Un esempio di manometro in linea disponibile in commercio (B-Smart, B. Braun Medical, Bethlehem, PA). Come si vede rispettivamente in A–C, il monitor visualizza gli intervalli di pressione a colori sul pistone mobile: 0–15 psi (bianco), 15–20 psi (giallo) e più di 20 psi (arancione). Nell'uso clinico, l'esatta pressione di iniezione di apertura (OIP) è meno importante della prevenzione del superamento dell'intervallo di OIP associato al danno fascicolare (>15 psi). In pratica, ciò viene evitato interrompendo l'iniezione con la comparsa di qualsiasi colore sul pistone durante tutto il ciclo di iniezione (>15 psi). È importante sottolineare che la pressione di apertura (pressione alla quale inizia il flusso) è indipendente dalle dimensioni della siringa, del tubo e dell'ago o dalla velocità di iniezione (legge di Pascal).
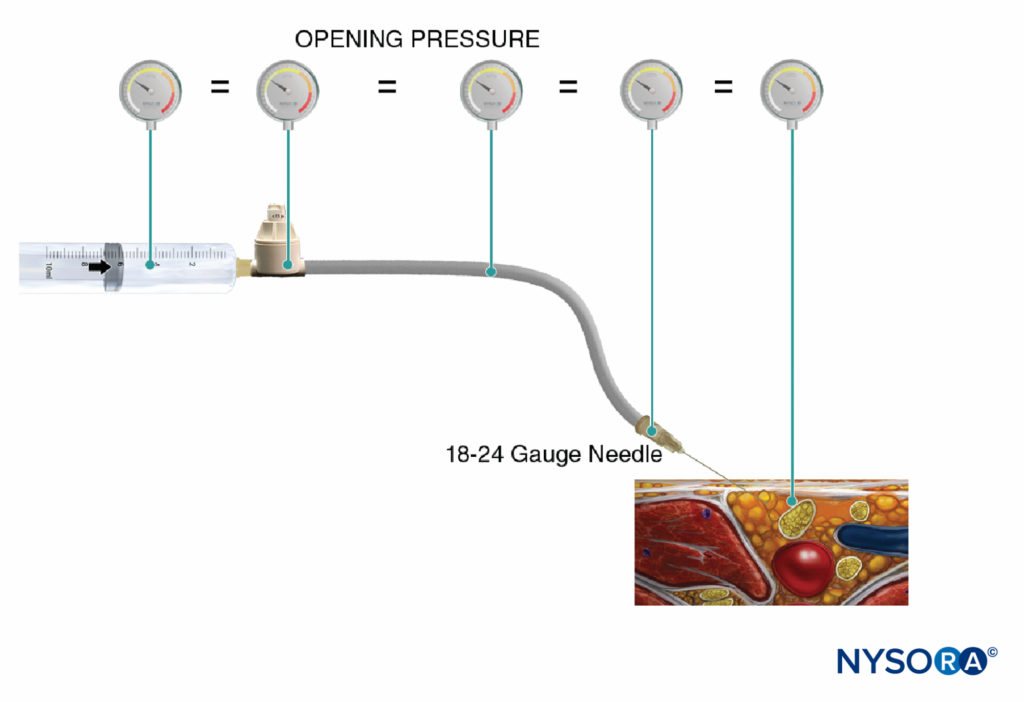
FIGURA 5. La pressione di iniezione di apertura (pressione alla quale inizia il flusso) è indipendente dalle dimensioni della siringa, del tubo e dell'ago o dalla velocità di iniezione ed è uguale in tutto il sistema di iniezione (legge di Pascal).
Inoltre, il 50% dei pazienti nello stesso gruppo ha sviluppato un blocco epidurale nella distribuzione toracica, mentre nessun paziente nel gruppo a bassa pressione ha avuto un blocco epidurale o bilaterale. Allo stesso modo, Gautier et al hanno dimostrato che quando i volontari sono stati randomizzati a pressioni basse (<15 psi) rispetto a quelle alte (>20 psi) durante il blocco del plesso brachiale interscalenico, la diffusione epidurale cervicale si verificava nell'11% delle iniezioni ad alta pressione (vs 0% nel gruppo di bassa pressione). Inoltre, tutti i soggetti hanno richiesto che l'iniezione fosse interrotta nella condizione di alta pressione a causa del disagio, ma non durante l'iniezione a bassa pressione. Questi dati suggeriscono che il monitoraggio della pressione di apertura dell'iniezione è importante per diversi aspetti della sicurezza e del comfort del paziente durante la pratica dei blocchi nervosi periferici.
Sommario
L'anestesia regionale sta effettuando una transizione dall'arte alla scienza, poiché vengono sviluppati mezzi più rigorosi e precisi per localizzare i nervi. Lo stesso processo dovrebbe essere previsto per il monitoraggio del blocco periferico. L'uso combinato di neurostimolazione, ecografia e monitoraggio della pressione di iniezione fornisce un pacchetto complementare di dati oggettivi che possono guidare i medici a eseguire i blocchi più sicuri possibili.
Figure 6 è un diagramma di flusso che illustra come questi monitor vengono utilizzati nella nostra pratica.
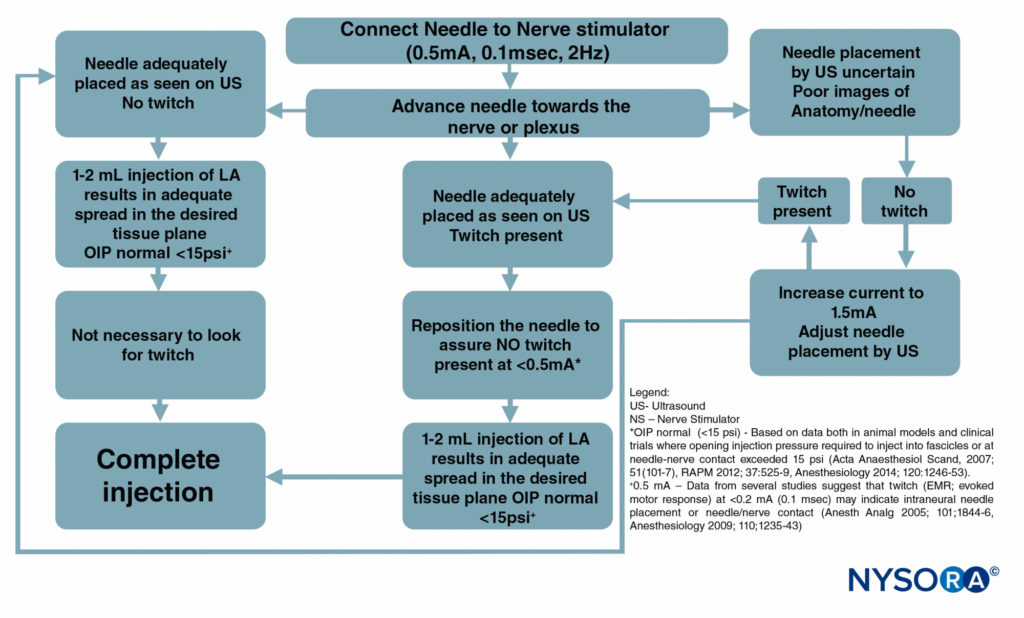
FIGURA 6. Un diagramma di flusso che illustra l'ordine di monitoraggio corretto delle procedure di blocco nervoso combinando ultrasuoni (US), stimolazione nervosa (NS) e monitoraggio della pressione di iniezione. LA = anestetico locale.
DOCUMENTAZIONE
Note sulla procedura di blocco
La documentazione delle procedure di blocco nervoso è rimasta indietro rispetto alla documentazione dell'anestesia generale ed è spesso relegata a poche righe scarabocchiate nell'angolo della cartella dell'anestetico. La crescente pressione da parte di fonti legali, di fatturazione e normative ha provocato uno sforzo per migliorare la documentazione per i blocchi nervosi periferici. Sono mostrati campioni di un modulo di documentazione del blocco nervoso periferico che incorpora tutti gli elementi di monitoraggio menzionati in precedenza in questo capitolo Figure 7 ed 8. Questi possono essere adottati e modificati per adattarsi alle pratiche individuali. I moduli hanno una serie di caratteristiche che dovrebbero essere prese in considerazione dalle istituzioni che tentano di formulare la propria nota di procedura. Questi includono quanto segue:
I registri cartacei vengono sempre più sostituiti con sistemi elettronici di conservazione dei registri medici. La documentazione del blocco è semplice con sistemi informatizzati come questi, in quanto le variabili del blocco possono essere selezionate rapidamente da un elenco indicando le voci di documentazione rilevanti, mentre eventuali elementi narrativi possono essere digitati rapidamente utilizzando una tastiera (Figure 8 ). La leggibilità e la capacità di correggere gli errori sono vantaggi per la nota e-block.

FIGURA 8. Screenshot da una pagina di documentazione del blocco presa da una cartella clinica elettronica.
Un altro aspetto utile della documentazione del blocco nervoso periferico è la registrazione di un'immagine ecografica o di un videoclip, da archiviare come copia cartacea nella cartella del paziente o come copia digitale nella cartella clinica elettronica (EHR) o in un disco rigido protetto separato. Questa non solo è una buona pratica dal punto di vista medico-legale, ma è anche un passo necessario che deve essere intrapreso se il medico desidera fatturare l'uso della guida ecografica. Qualsiasi copia cartacea dovrebbe avere un adesivo di identificazione del paziente attaccato, la data registrata e qualsiasi risultato pertinente evidenziato con un pennarello, come l'anestetico locale che si diffonde intorno al nervo. Ulteriori esempi di documentazione altamente pratica del blocco nervoso essenziale e delle procedure di anestesia spinale sono mostrati in Figure 9 ed 10, Rispettivamente.
| Caratteristiche utili di una procedura di blocco del nervo periferico Nota | Esempio |
|---|---|
| Elementi che guidano il professionista a soddisfare un determinato standard di cura | Uno spazio per indicare l'uso di epinefrina nella soluzione di anestetico locale o se non è stata utilizzata, perché no |
| Un compromesso tra efficienza e capacità di individualizzazione | Informazioni registrate utilizzando sia caselle di spunta che spazi vuoti |
| Documentazione per la tutela contro i comuni problemi medico-legali | Il medico deve indicare il livello di coscienza del paziente |
| Documentazione di conformità con le agenzie di regolamentazione (ad es. Commissione mista) | Le caselle di spunta indicano la lateralità |
| Elementi per facilitare la fatturazione di successo | Linguaggio richiesto da molte compagnie assicurative che indicano blocco espressamente richiesto dal chirurgo |
| Documentazione dei medici coinvolti e in quale veste | L'assistente era l'individuo che eseguiva il blocco o stava dirigendo medicamente un residente? |
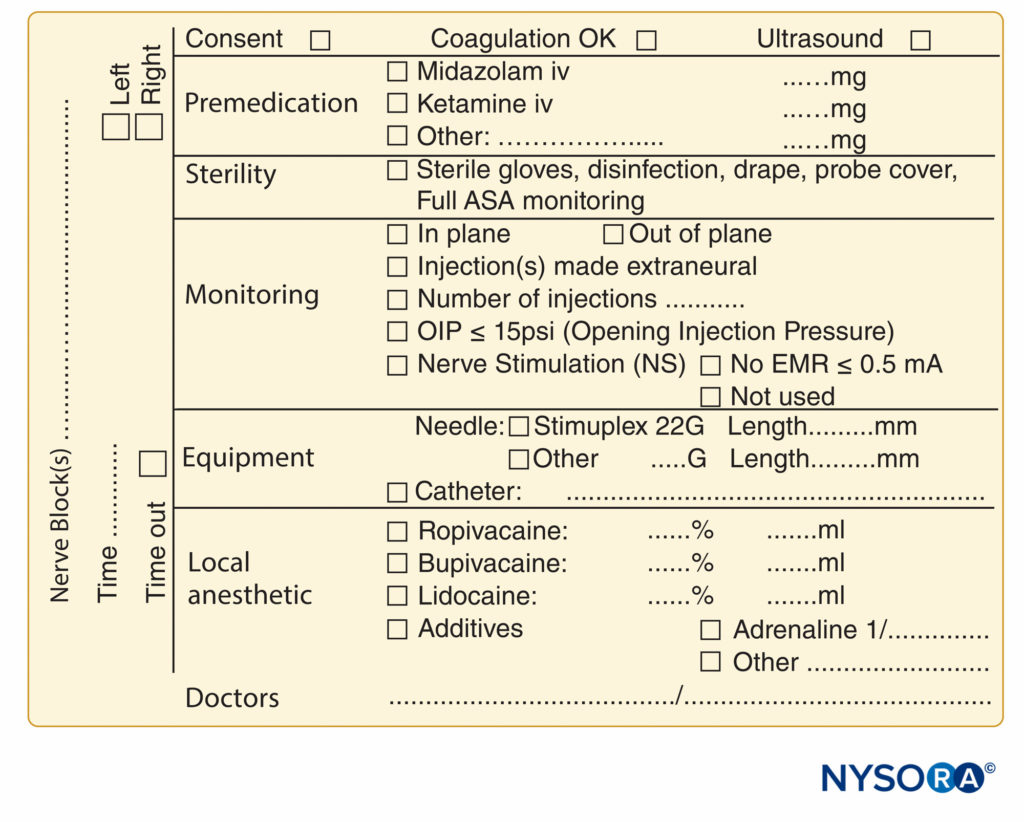
FIGURA 9. Elementi essenziali della documentazione delle procedure di blocco dei nervi periferici utilizzate presso NYSORA-Europe CREER (Centro per la ricerca, l'istruzione e il recupero avanzato dalla chirurgia ortopedica) presso ZOL (Ziekenhuis Oost-Limburg), Genk, Belgio.
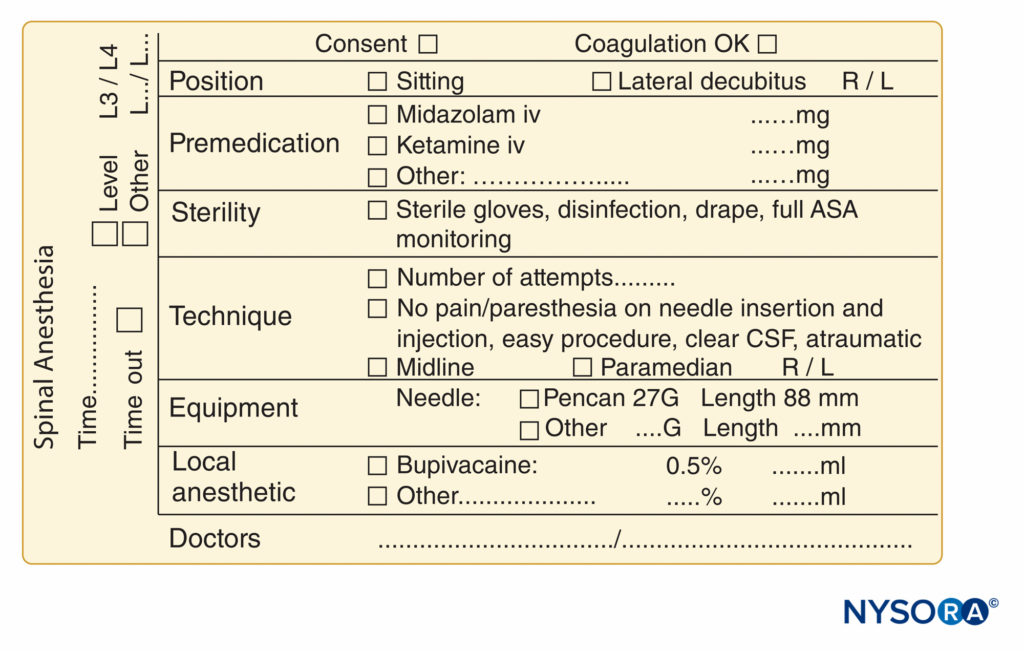
FIGURA 10. Elementi essenziali della documentazione delle procedure di anestesia spinale utilizzate presso NYSORA-Europe CREER (Center for Research, Education, and Enhanced Recovery From Orthopaedic Surgery) presso ZOL (Ziekenhuis Oost-Limburg), Genk, Belgio.
consenso informato
La documentazione del consenso informato è un aspetto importante della pratica dell'anestesia regionale. I modelli di pratica variano ampiamente su questo problema e spesso non viene ottenuto un consenso scritto specifico per le procedure di blocco nervoso. Tuttavia, la documentazione scritta di questo processo può essere importante per una serie di motivi:
- I pazienti sono spesso distratti e ansiosi il giorno dell'intervento (quando si ottengono molti consensi) e potrebbero non ricordare i dettagli di una discussione con il proprio anestesista. Gli studi hanno dimostrato che una registrazione scritta del processo di consenso informato migliora il ricordo da parte del paziente di rischi e benefici.
- Un consenso scritto stabilisce che si è verificata una discussione sui rischi e sui benefici tra il paziente e il medico.
- Un documento specifico per l'anestesia regionale può essere personalizzato per includere tutti i rischi comuni e gravi; ciò consente al medico di spiegarli al paziente come una questione di routine e di ridurre la possibilità di omettere rischi importanti.
I seguenti suggerimenti possono essere utilizzati per massimizzare il processo di consenso:
| Suggerimenti per migliorare il processo di consenso. |
|---|
| Sii breve. Una spiegazione semplice e breve aiuta a ricordare i rischi ei benefici più di lunghi paragrafi. |
| Includere non solo i rischi gravi e maggiori, ma anche i benefici e i risultati attesi della procedura di anestesia regionale proposta. È difficile per i pazienti fare una scelta informata se vengono discussi solo i rischi. |
| Utilizzare il processo di consenso come mezzo per educare il paziente contemporaneamente. |
| Offrire una copia del modulo al paziente. È stato dimostrato che ciò aiuta a ricordare le informazioni relative al consenso. |
BIBLIOGRAFIA
- Buhre W, Rossaint R: Gestione perioperatoria e monitoraggio in anestesia. Lancetta 2003;362:1839–1846.
- Guinard JP, Mulroy MF, Carpenter RL, Knopes KD: Dosi di prova: contenuto ottimale di epinefrina con e senza blocco beta-adrenergico acuto. Anestesiologia 1990;73:386–392.
- Tanaka M, Sato M, Kimura T, Nishikawa T: L'efficacia della dose di prova intravascolare simulata in pazienti sedati. Anesth Analg 2001;93: 1612–1617, sommario.
- Karmakar MK, Ho AM-H, Law BK, Wong ASY, Shafer SL, Gin T: farmacocinetica arteriosa e venosa della ropivacaina con e senza epinefrina dopo blocco paravertebrale toracico. Anestesiologia 2005;103:704–711.
- Van Obbergh LJ, Roelants FA, Veyckemans F, Verbeeck RK: Nei bambini, l'aggiunta di epinefrina modifica la farmacocinetica della ropivacaina iniettata caudalmente. Can J Anaesth 2003;50:593–598.
- Neal JM: Effetti dell'adrenalina negli anestetici locali sul sistema nervoso centrale e periferico: neurotossicità e flusso sanguigno neurale. Reg Anesth Pain Med 2003;28:124–134.
- Siti BD, Taenzer AH, Herrick MD, et al: Incidenza della tossicità sistemica dell'anestetico locale e sintomi neurologici postoperatori associati a 12,668 blocchi nervosi ecoguidati: un'analisi da un registro clinico prospettico. Reg Anesth Pain Med 2012;37(5):478–482.
- Perlas A, Niazi A, McCartney C, Chan V, Xu D, Abbas S: La sensibilità della risposta motoria alla stimolazione nervosa e parestesia per la localizzazione del nervo valutata dagli ultrasuoni. Reg Anesth Antidolorifico 2006;31:445–450.
- Chan VWS, Brull R, McCartney CJL, Xu D, Abbas S, Shannon P: uno studio ecografico e istologico dell'iniezione intraneurale e della stimolazione elettrica nei suini. Anesth Analg 2007;104:1281–1284, indice.
- Robards C, Hadzic A, Somasundaram L, et al: Iniezione intraneurale con stimolazione a bassa corrente durante il blocco del nervo sciatico popliteo. Anesth Analg 2009;109:673–677.
- Voelckel WG, Klima G, Krismer AC, et al: Segni di infiammazione dopo il blocco del nervo sciatico nei suini. Anesth Analg 2005;101:1844–1846.
- Tsai TP, Vuckovic I, Dilberovic F, et al: L'intensità della corrente stimolante potrebbe non essere un indicatore affidabile del posizionamento dell'ago intraneurale. Reg Anesth Antidolorifico 2008;33:207–210.
- Bigeleisen PE, Moayeri N, Groen GJ: soglie di stimolazione extraneurali rispetto a quelle intraneurali durante il blocco sopraclavicolare ecoguidato. Anestesiologia 2009;110:1235–1243.
- Wiesmann T, Bornträger A, Vassiliou T, et al: L'intensità di corrente minima per suscitare una risposta motoria evocata non è in grado di distinguere tra il contatto ago-nervo e l'inserimento intraneurale dell'ago. Anesth Analg 2014;118:681–686.
- Steinfeldt T, Graf J, Schneider J, et al: Conseguenze istologiche del contatto ago-nervo dopo stimolazione nervosa in un modello di maiale. Anesthesiol Res Pract 2011;2011:591851.
- Steinfeldt T, Poeschl S, Nimphius W, et al: Avanzamento forzato dell'ago durante il contatto ago-nervo in un modello suino: esito istologico. Anesth Analg 2011;113:417–420.
- Gadsden J, Latmore M, Levine DM, Robinson A: Un'elevata pressione di iniezione di apertura è associata al contatto ago-nervo e ago-fascia durante il blocco del nervo femorale. Reg Anesth Pain Med 2016;41(1):50–55.
- Hogan QH: Fisiopatologia della lesione del nervo periferico durante l'anestesia regionale. Reg Anesth Antidolorifico 2008;33:435–441.
- Whitlock EL, Brenner MJ, Fox IK, Moradzadeh A, Hunter DA, Mackinnon SE: lesione da iniezione del nervo periferico indotta da ropivacaina nel modello di roditore. Anesth Analg 2010;111(1):214–220.
- Sala-Blanch X, Ribalta T, Rivas E, et al: Lesione strutturale del nervo sciatico umano dopo l'inserimento dell'ago intraneurale. Reg Anesth Antidolorifico 2009;34:201–205.
- Hadzic A, Dilberovic F, Shah S, et al: La combinazione di iniezione intraneurale e alta pressione di iniezione porta a lesioni fascicolari e deficit neurologici nei cani. Reg Anesth Antidolorifico 2004;29:417–423.
- Gauss A, Tugtekin I, Georgieff M, Dinse-Lambracht A, Keipke D, Gorsewski G: Incidenza di pneumotorace clinicamente sintomatico nel blocco del plesso brachiale infraclavicolare e sopraclaveare ecoguidato. Anestesia 2014;69:327–336.
- Russon K, Blanco R: iniezione intraneurale accidentale nel nervo muscolocutaneo visualizzato con ultrasuoni. Anesth Analg 2007;105:1504–1505, indice.
- Schafhalter-Zoppoth I, Zeitz ID, Grey AT: Impalamento involontario del nervo femorale e iniezione intraneurale visualizzata dagli ultrasuoni. Anesth Analg 2004;99:627–628.
- Loubert C, Williams SR, Hélie F, Arcand G: Complicazione durante il blocco regionale ecoguidato: iniezione intravascolare accidentale di anestetico locale. Anestesiologia 2008;108:759–760.
- Vadeboncouer T, Weinberg G, Oswald S, Angelov F: rilevamento precoce dell'iniezione intravascolare durante il blocco del plesso brachiale sopraclavicolare ecoguidato. Reg Anesth Antidolorifico 2008;33:278–279.
- Martínez Navas A, DE LA Tabla González RO: La tecnica ecoguidata ha consentito la diagnosi precoce dell'iniezione intravascolare durante un blocco del plesso brachiale infraclavicolare. Acta Anaesthesiol Scand 2009;53:968–970.
- Barrington MJ, Kluger R: La guida ecografica riduce il rischio di tossicità sistemica dell'anestetico locale in seguito al blocco del nervo periferico. Reg Anesth Antidolorifico 2013;38:289–297.
- Orebaugh SL, Kentor ML, Williams BA: esiti avversi associati a blocchi nervosi periferici guidati da stimolatori nervosi e guidati da ultrasuoni da parte di tirocinanti supervisionati: aggiornamento di un database a sito singolo. Reg Anesth Antidolorifico 2012;37:577–582.
- Casati A, Baciarello M, Di Cianni S, et al: Effetti della guida ecografica sul volume anestetico minimo efficace richiesto per bloccare il nervo femorale. Fr. J Anaesth 2007;98:823–827.
- Sandhu NS, Bahniwal CS, Capan LM: Fattibilità di un blocco infraclavicolare con volume ridotto di lidocaina con guida ecografica. J Ultrasound Med 2006;25:51–56.
- Vandepitte C, Gautier P, Xu D, Salviz EA, Hadzic A: volume effettivo di ropivacaina 0.75% attraverso un catetere richiesto per il blocco del plesso brachiale interscalenico. Anestesiologia 2013;118:863–867.
- Riazi S, Carmichael N, Awad I, Holtby RM, McCartney CJL: Effetto del volume anestetico locale (20 vs 5 ml) sull'efficacia e sulle conseguenze respiratorie del blocco del plesso brachiale interscalenico ecoguidato. Fr. J Anaesth 2008; 101:549–556.
- O'Donnell B, Riordan J, Ahmad I, Iohom G: Brevi relazioni: una valutazione clinica delle caratteristiche del blocco utilizzando un millilitro di lidocaina al 2% nel blocco del plesso brachiale ascellare ecoguidato. Anesth Analg 2010; 111: 808–810.
- Krediet AC, Moayeri N, Bleys RLAW, Groen GJ: Intraneural or extraneural: accuratezza diagnostica della valutazione ecografica per la localizzazione dell'iniezione a basso volume. Reg Anesth Antidolorifico 2014;39:409–413.
- Liu SS, YaDeau JT, Shaw PM, Wilfred S, Shetty T, Gordon M: Incidenza di iniezione intraneurale non intenzionale e complicanze neurologiche postoperatorie con blocchi nervosi interscalenici e sopraclavicolari ecoguidati. Anestesia 2011;66:168–174.
- Hara K, Sakura S, Yokokawa N, Tadenuma S: incidenza ed effetti dell'iniezione intraneurale non intenzionale durante il blocco del nervo sciatico sottogluteale ecoguidato. Reg Anesth Antidolorifico 2012;37:289–293.
- Bigeleisen PE: la puntura del nervo e l'apparente iniezione intraneurale durante il blocco ascellare ecoguidato non provocano invariabilmente lesioni neurologiche. Anestesiologia 2006;105:779–783.
- Selander D, Dhunér KG, Lundborg G: danno del nervo periferico dovuto ad aghi per iniezione utilizzati per l'anestesia regionale. Uno studio sperimentale sugli effetti acuti del trauma da ago. Acta Anaesthesiol Scand 1977;21:182–188.
- Orebaugh SL, Mukalel JJ, Krediet AC, et al: Iniezione della radice del plesso brachiale in un modello di cadavere umano: distribuzione dell'iniezione ed effetti sulla nevassi. Reg Anesth Antidolorifico 2012;37:525–529.
- Krol A, Szarko M, Vala A, De Andres J: Monitoraggio della pressione delle iniezioni intraneurali e perineurali nei nervi mediano, radiale e ulnare: lezioni da uno studio su cadavere. Anesth Pain Med 2015;5:e22723.
- Gadsden JC, Choi JJ, Lin E, Robinson A: La pressione di iniezione di apertura rileva costantemente il contatto ago-nervo durante il blocco del plesso brachiale interscalenico guidato da ultrasuoni. Anestesiologia 2014;120: 1246–1253.
- Claudio R, Hadzic A, Shih H, et al: Pressioni di iniezione da parte degli anestesisti durante il blocco nervoso periferico simulato. Reg Anesth Antidolorifico 2004;29:201–205.
- Theron PS, Mackay Z, Gonzalez JG, Donaldson N, Blanco R: un modello animale di "sensazione di siringa" durante il blocco nervoso periferico. Reg Anesth Antidolorifico 2009;34:330–332.
- Tsui BCH, Knezevich MP, Pillay JJ: Pressioni di iniezione ridotte utilizzando una tecnica di iniezione di aria compressa (CAIT): uno studio in vitro. Reg Anesth Antidolorifico 2008;33:168–173.
- Patil J, Ankireddy H, Wilkes A, Williams D, Lim M: un manometro improvvisato per iniezioni di blocco nervoso/anestesia regionale: uno studio iniziale. J Clin Monit Comput 2015. doi:10.1007/s10877- 015-9701-z.
- Gadsden JC, Lindenmuth DM, Hadzic A, Xu D, Somasundarum L, Flisinski KA: il blocco del plesso lombare mediante iniezione ad alta pressione porta alla diffusione controlaterale ed epidurale. Anestesiologia 2008;109: 683–688.
- Gautier P, Vandepitte C, Schaub I, et al: La disposizione del radiocontrasto nello spazio interscalenico in volontari sani. Anesth Analg 2015;120:1138–1141.
- Gerancher JC, Grice SC, Dewan DM, Eisenach J: una valutazione del consenso informato prima dell'analgesia epidurale per il travaglio e il parto. Int J Obstet Anesth 2000;9:168–173.