Stavros Prinéas
INTRODUCTION
La chirurgie ophtalmique est l'une des interventions chirurgicales les plus courantes nécessitant une anesthésie dans les pays développés. L'anesthésie ophtalmique permet d'appréhender quelques principes fondamentaux de bonne pratique anesthésique, notamment dans la conduite des blocs nerveux locaux et régionaux.
ANESTHESIE LOCALE EN CHIRURGIE OCULAIRE
Les stratégies cliniques visant à minimiser les mouvements du patient pendant la chirurgie oculaire sont essentielles. Historiquement, les chirurgiens ophtalmologistes privilégiaient l'anesthésie générale (AG), qui provoquait généralement une akinésie (par bloc neuromusculaire) et une faible pression intraoculaire. Cependant, ces conditions ne sont pas toujours remplies sous GA. Une analyse des réclamations fermées par Gild et ses collègues a révélé que 30 % des réclamations pour lésions oculaires associées à l'anesthésie impliquaient le déplacement du patient pendant la chirurgie ophtalmique, la plupart des incidents se produisant sous AG. Bien que les taux de morbidité et de mortalité périopératoires associés à la chirurgie oculaire (p. ex., extraction de la cataracte) soient faibles, les patients opérés de la cataracte ont tendance à être plus âgés et à présenter des comorbidités importantes. Pour cette raison, une évaluation préopératoire systématique doit être effectuée pour déterminer si un patient est éligible à une AG et à une intervention chirurgicale.
Une gestion anesthésique appropriée contribue au succès ou à l'échec de la chirurgie ophtalmique. Une rééducation plus rapide des patients et moins de complications dans cette population de patients sont les principales raisons pour lesquelles de nombreux chirurgiens ophtalmologistes choisissent désormais l'anesthésie locale (AL) plutôt que l'AG.
Traditionnellement, l'étalon-or des blocs nerveux oculaires était l'anesthésie rétrobulbaire (RBA), le chirurgien réalisant le bloc nerveux.
Cependant, les progrès de la technologie et de la technique chirurgicale, en particulier dans la chirurgie de la cataracte, ont conduit au remplacement des anciennes techniques d'incision large (par exemple, l'extraction extra-capsulaire de la cataracte) par des techniques de phacoémulsification mini-invasive (PhE). Par conséquent, pour la nouvelle génération de chirurgiens de la cataracte, l'akinésie totale n'est plus nécessaire pour la PhE.
CONSEILS NYSORA
• Les innovations et les tendances du XXIe siècle ont révolutionné la chirurgie oculaire.
• Les techniques d'anesthésie locale et régionale ont largement remplacé l'anesthésie générale.
• La compréhension de l'anatomie fonctionnelle et des techniques chirurgicales est essentielle pour la sélection des techniques régionales.
• Le bloc nerveux sous-ténonien est l'un des choix les plus courants pour l'anesthésie car il permet généralement d'obtenir une akinésie avec un profil de sécurité favorable.
• L'anesthésie topique devient de plus en plus la plus répandue pour la chirurgie de la cataracte.
• Les complications des blocs nerveux oculaires sont rares mais peuvent menacer la vie ou la vue, d'où la nécessité d'une formation adéquate.
L'innovation a également élargi les options d'anesthésie pour la chirurgie oculaire. Comme la RBA conventionnelle comporte un plus grand risque de complications, des techniques moins invasives sont de plus en plus utilisées, avec une diversité substantielle de styles de pratique à travers le monde. Par exemple, une étude australienne de 2002 a rapporté que le bloc nerveux péribulbaire était le plus populaire parmi un échantillon international de chirurgiens ophtalmologistes. Cependant, une enquête de 2006 a révélé que 64% d'un échantillon d'anesthésistes britanniques étaient favorables à la technique du sous-Ténon et, en 2008, une enquête de la British Ophthalmic Anesthesia Society a révélé que plus de 87% des membres anesthésistes exécutaient régulièrement les blocs nerveux du sous-Ténon. .
D'autre part, une enquête annuelle de l'American Society of Cataract and Refractive Surgery a rapporté que la préférence de ses membres pour l'utilisation de l'anesthésie topique avait augmenté régulièrement, passant de 11 % en 1995 à 76 % en 2012. Dans la même enquête, l'utilisation de sous -Les blocs nerveux de Tenon semblaient être constamment faibles au fil des ans (environ 1 % à 3 %) malgré sa popularité croissante ailleurs, l'utilisation de blocs nerveux rétrobulbaires et péribulbaires semblant en déclin progressif mais soutenu.
Chaque technique d'anesthésie a ses forces et ses limites.
La connaissance de l'anatomie pertinente pour les différentes techniques d'anesthésie est essentielle pour déterminer le bloc nerveux approprié pour des situations cliniques spécifiques et pour éviter au mieux les complications potentiellement mortelles et oculaires. Dans cette section, nous passons en revue l'anatomie pertinente de l'œil, les techniques classiques de bloc nerveux avec et sans aiguille, et le choix des agents AL et adjuvants. Avec un plus large éventail d'options, l'anesthésiologiste a plus de mal à discuter des besoins anesthésiques individuels avec le chirurgien, à s'adapter et à avoir d'excellentes compétences en communication et en travail d'équipe.
ANATOMIE FONCTIONNELLE
Orbite
Les orbites (Chiffres 1 et 2) sont deux enceintes osseuses symétriques à l'avant du crâne, contenant chacune un globe oculaire (ou globe) et ses structures associées. La cavité de chaque orbite est une pyramide tronquée, avec un sommet aplati en arrière et une base trapézoïdale tournée vers l'antérolatéral. Les parois médiales (nasales) de chaque orbite sont parallèles les unes aux autres, tandis que les parois latérales (temporales) sont perpendiculaires les unes aux autres. Le volume de chaque orbite adulte est d'environ 30 mL.
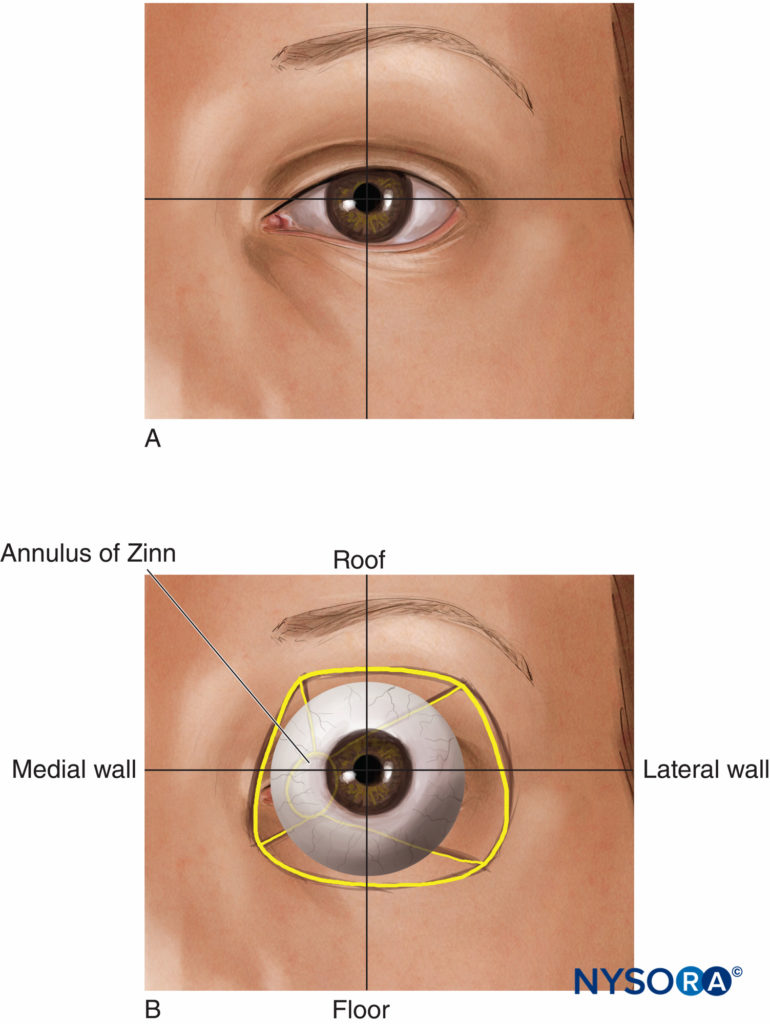
FIGURE 1. (A) L'oeil. (B) Anatomie superficielle.
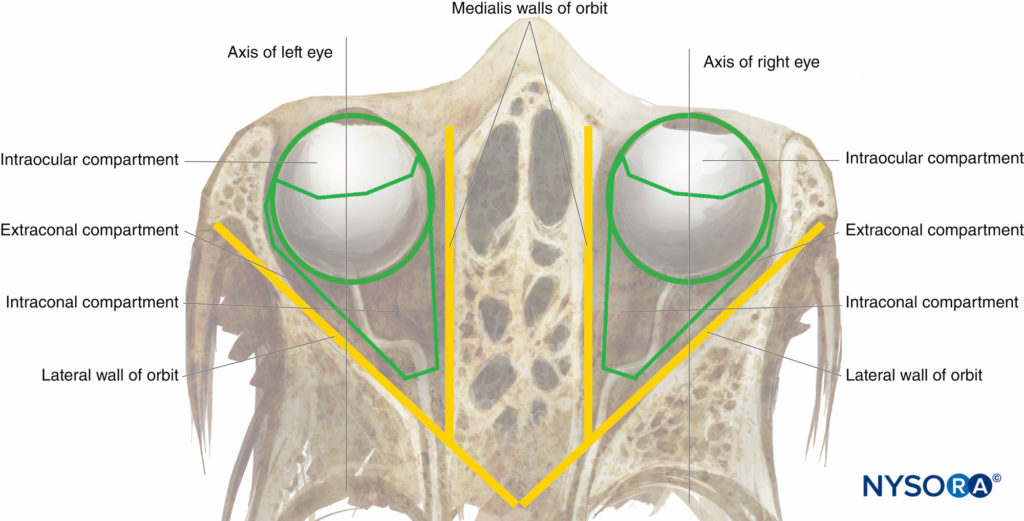
FIGURE 2. L'orbite : vue supérieure schématique.
Globe
Le globe (Figure 3) est suspendu dans la partie antéro-supérieure de l'orbite. Il est à peu près sphérique, son contenu contenu dans trois couches externes ou tuniques :
- Une tunique fibreuse comprenant la cornée translucide en avant et la sclérotique opaque en périphérie et en arrière
- Au plus profond de la tunique fibreuse, une tunique vasculaire et pigmentée comprenant l'iris et le corps ciliaire devant et la choroïde en périphérie et derrière
- Au plus profond de cela, une tunique neurale recouvrant la partie postérieure des deux autres tuniques à l'intérieur, comprenant la rétine.
Le globe a un grand segment postérieur (comprenant le humeur vitreuse, rétine, macule, et la racine du nerf optique) et un petit convexe segment antérieur comprenant deux chambres. La chambre antérieure immédiatement derrière la cornée est remplie de humeur aqueuse produit par le le corps ciliaireL’ chambre postérieure contient l' pour. Les deux chambres sont séparées par le iris et communiquer via le élève de l'oeil. Extérieurement, la jonction circonférentielle de la cornée et de la sclérotique (avec son conjonctive) s'appelle le limbe.
Le volume du globe est d'environ 7 mL. La longueur axiale (antéropostérieure) du globe adulte est en moyenne d'environ 24 mm; cependant, cela peut être considérablement plus long chez les personnes myopes (> 26 mm) et plus court en cas d'hypermétropie (jusqu'à 20 mm). En règle générale, la distance entre l'avant du globe et son équateur est d'environ 12 à 15 mm, mais, dans la mesure du possible, il est préférable de connaître la longueur axiale mesurée de l'œil avant d'essayer d'injecter derrière l'équateur (par exemple , pour les patients opérés de la cataracte, les données biométriques se retrouvent systématiquement dans les notes cliniques du chirurgien).
La sclérotique est la plus fine à l'équateur et aux points d'insertion des muscles extraoculaires. Cependant, les yeux plus myopes (avec une longueur axiale plus longue) ont une prévalence nettement accrue de staphylomes postérieurs, une faiblesse par ailleurs rare de type "éruption" dans la tunique fibreuse, qui pose un risque majeur de perforation du globe avec des techniques à l'aiguille aveugle (voir " Complications des blocs nerveux oculaires » plus loin).
Muscles de l'oeil
Les quatre muscles droits et les deux muscles obliques de l'œil s'insèrent en avant près de l'équateur du globe (voir Figure 3). En arrière, ils prennent naissance ensemble à l'apex du tendineux anneau commun de Zinn. Les quatre muscles droits, s'étendant en arrière de l'équateur à l'anneau de Zinn, délimitent le cône rétrobulbaire. Le nerf optique traverse le cône depuis la partie postérieure du globe et pénètre dans l'orbite par l'anneau de Zinn.
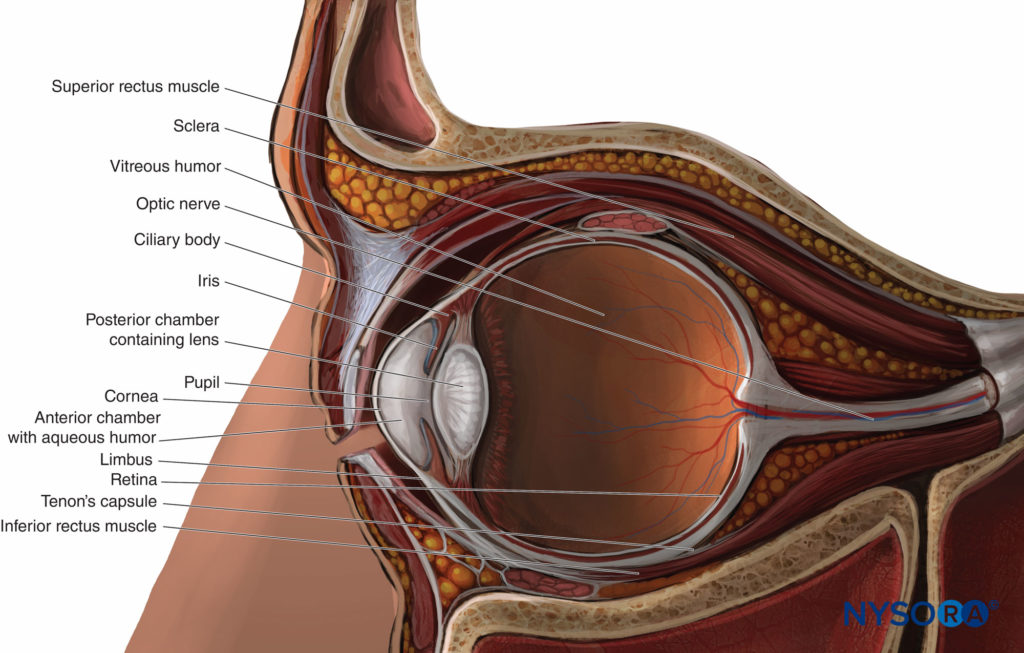
FIGURE 3. Le globe : coupe sagittale.
Trois compartiments intra-orbitaux
Le globe et le cône rétrobulbaire musculaire définissent les trois compartiments anatomiques classiques de la cavité orbitaire : l'intraoculaire, l'intraconal et l'extraconal (voir Figure 2). Cependant le cône rétrobulbaire n'est obturé par aucune membrane intermusculaire et, de fait, il y a libre communication entre les espaces intraconal et extraconal. Ainsi, un bloc nerveux péribulbaire (extraconal) de grand volume peut théoriquement fournir une anesthésie et une akinésie efficaces en tant que bloc nerveux rétrobulbaire de petit volume ciblé.
Innervation de l'orbite
L'innervation sensorielle de l'orbite et du globe est assurée principalement par les branches frontales et nasociliaires du nerf ophtalmique (première branche du nerf trijumeau, V), qui traversent le cône musculaire (Chiffres 4 et 5), tandis qu'une partie du plancher de l'orbite est alimentée par la branche infraorbitaire du nerf maxillaire (la deuxième branche du nerf trijumeau).
Le nerf trochléaire (IV) assure le contrôle moteur des muscles obliques supérieurs, le nerf abducens (VI) du muscle droit latéral et le nerf oculomoteur (III) de tous les autres muscles extraoculaires, y compris le muscle releveur. Tous sauf le nerf trochléaire traversent le cône musculaire.
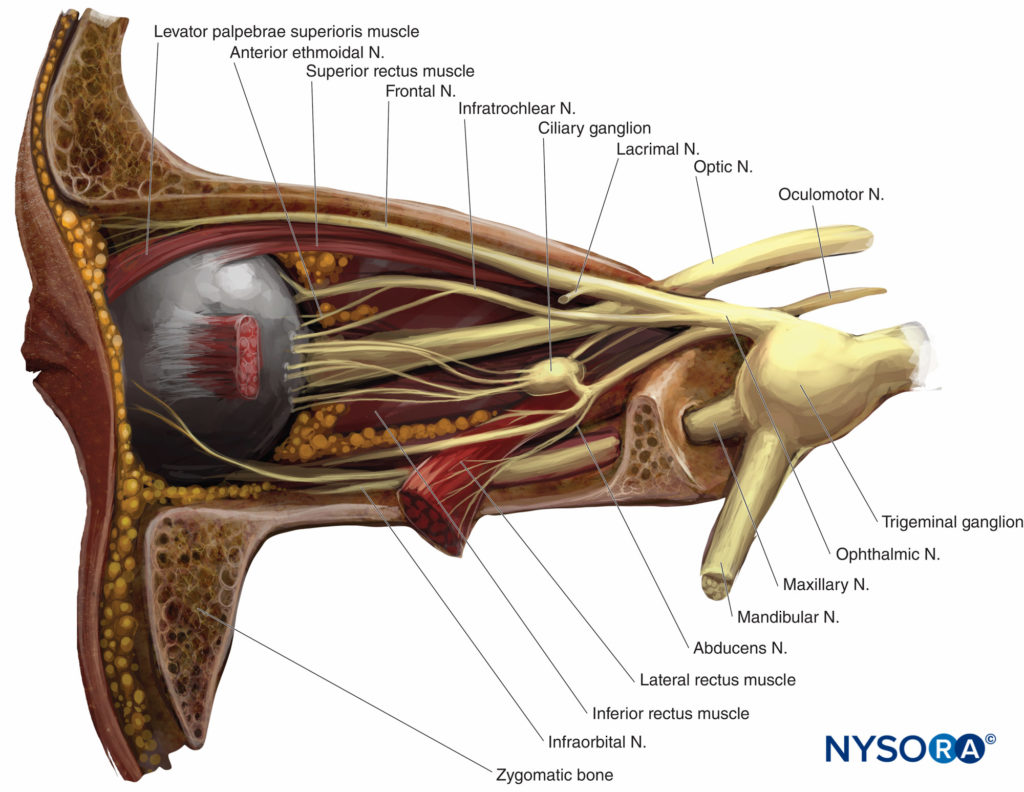
FIGURE 4. Orbite gauche : vue latérale. Paroi latérale et glande lacrymale enlevées.
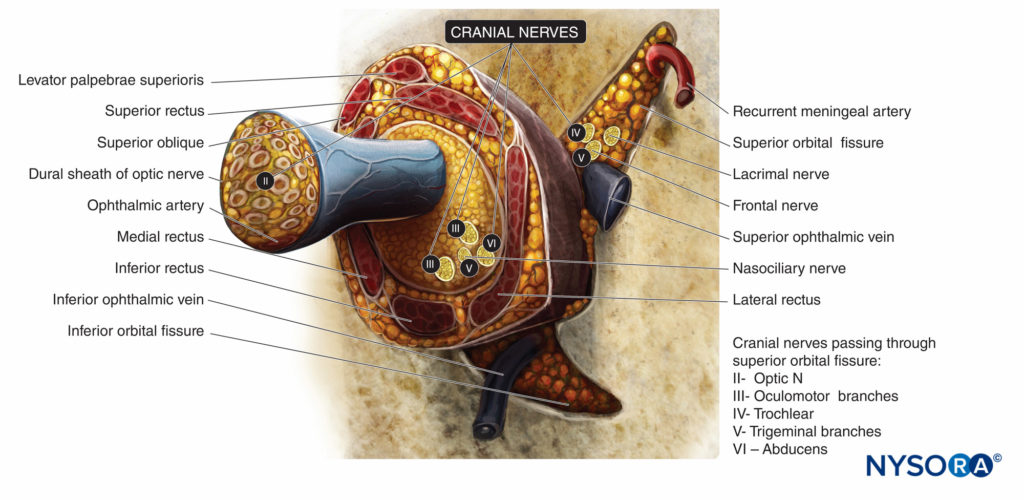
FIGURE 5. Muscles extraoculaires et innervation de l'orbite au niveau de l'anneau de Zinn. Nerfs crâniens indiqués par des chiffres romains.
Quadrants anatomiques du globe et de l'orbite
La sphère du globe peut être divisée dans les trois plans anatomiques perpendiculaires standards en huit «quadrants»: supéromédial antérieur, supéromédial postérieur, etc. En regardant de face, les quadrants extraoculaires antérieurs correspondants de l'orbite sont souvent appelés superonasal, suprotemporal, inféronasal et inférotemporal, où nasal a le même sens que médial et temporal a le même sens que latéral (Figure 6). L'espace inférotemporal (ou inférolatéral) est généralement le plus grand et le moins vasculaire et le quadrant d'approche préféré pour les blocs nerveux rétrobulbaires et péribulbaires modernes à un coup. Le quadrant inféronasal (ou inféromédial) est le plus populaire pour les blocs nerveux sous-ténoniens. Le quadrant superonasal (ou superomédial) est assez vasculaire mais contient le nerf ethmoïdal antérieur, un bloc nerf à nerf utile pour certaines procédures oculoplastiques (voir « Blocs nerveux oculoplastiques » ci-dessous).
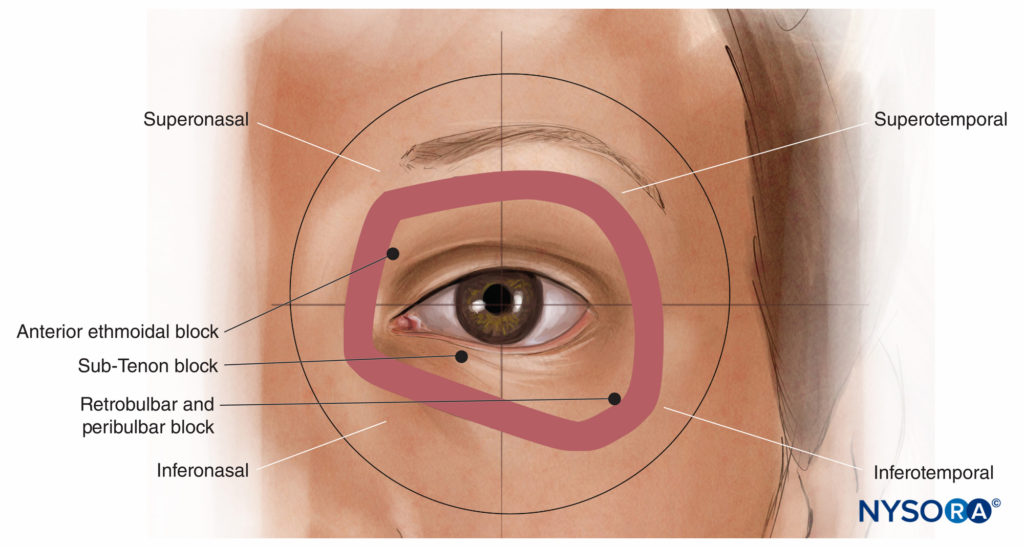
FIGURE 6. Les quadrants orbitaires antérieurs.
Capsule de Tenon et Espace Sous-Tenon
La partie sclérale du globe est entourée par la capsule de Tenon (également connue sous le nom de gaine fasciale du globe oculaire), une couche fibroélastique s'étendant du limbe cornéen vers l'avant jusqu'au nerf optique vers l'arrière. La capsule de Tenon devient généralement plus fine et moins adhérente à la sclérotique avec l'âge. Il délimite un espace potentiel appelé espace épiscléral (espace sous-ténonien), qui se dilate lorsqu'on y injecte du fluide. La conjonctive recouvre la sclère dans la partie antérieure de l'œil jusqu'à ce qu'elle se reflète au niveau des culs-de-sac de l'œil pour continuer comme la muqueuse de la face inférieure des paupières. Notez que la capsule de Tenon fusionne avec la sclérotique à environ 2 mm du limbe.
Là où la sclérotique est visible, les deux couches sont plus faciles à saisir comme une seule; plus près du fornix, le conjonctivum devient plus charnu et plus distinct de la couche sous-ténonienne. Cela permet d'identifier le point de brèche idéal pour la technique du sous-ténonien (qv)
Propagation de l'anesthésique local dans l'orbite
L'injection de solution LA à l'intérieur du cône fournira une anesthésie et une akinésie du globe et (généralement) de tous les muscles extraoculaires. Seul le nerf moteur du muscle orbiculaire des paupières a un trajet extra-orbitaire, issu de la branche supérieure du nerf facial (VII). De nombreuses structures majeures sont situées dans le cône musculaire et sont donc à risque de blessure par aiguille et injection. Ceux-ci incluent le nerf optique avec ses revêtements méningés, les vaisseaux sanguins de l'orbite et les nerfs alimentant le globe. Pour cette raison, certains auteurs conseillent d'éviter l'introduction de l'aiguille dans le cône musculaire et suggèrent de limiter l'insertion de l'aiguille à l'espace extraconal.
CONSIDÉRATIONS CHIRURGICALES CLÉS
Il est important de connaître votre chirurgien. Le choix d'une technique d'anesthésie locale appropriée nécessite une compréhension non seulement des procédures chirurgicales, mais également des préférences personnelles du chirurgien.
Akinésie
L'exigence d'akinésie varie selon la procédure (voir ci-dessous) et le chirurgien. Avec des blocs nerveux derrière l'équateur de l'œil, l'amélioration de la probabilité d'akinésie nécessite généralement plus de volume, plus de temps ou l'ajout d'hyaluronidase 30 (voir « Choix des agents anesthésiques locaux et adjuvants » ci-dessous).
Position principale par rapport à la position "sur l'axe"
La parésie complète de tous les muscles extraoculaires place l'œil dans la position « primaire » ou « neutre ». Habituellement, cela correspond au fait que le chirurgien a la pupille alignée avec l'axe du microscope chirurgical (c'est-à-dire que le chirurgien a une vue idéale « dans l'axe » du champ opératoire). Cependant, en cas de bloc nerveux moteur incomplet, ou chez les patients qui présentent une courbure vertébrale importante ou qui ne peuvent pas se coucher à plat, la position de « repos » de l'œil bloqué peut ne pas correspondre à une vue dans l'axe. Pour cette raison, de nombreux chirurgiens préfèrent en fait avoir un œil entièrement mobile pour certains patients ou certaines procédures (par exemple, trabéculectomie, ablation du ptérygion) afin de pouvoir demander au patient de regarder la lumière du microscope, amenant ainsi l'œil "sur axe », ou de détourner le regard, permettant un meilleur accès à des parties plus périphériques du globe.
L'effet volume des injections
Derrière l'oeil
Toute injection importante (> 3 ml) derrière l'équateur de l'œil (une injection péribulbaire, rétrobulbaire ou sous-ténonienne postérieure) peut augmenter considérablement la pression intraoculaire et pousser le segment postérieur vers l'avant, entraînant une chambre antérieure en forme de croissant avec une diminution du volume (Figure 7). Cela peut rendre les conditions chirurgicales plus difficiles, et bien que cela puisse principalement être compensé par une contre-pression (par une légère pression digitale ou l'application d'un poids ou d'un ballon), certains chirurgiens préfèrent les techniques qui conservent un segment antérieur "physiologique", et la plupart des chirurgiens préfèrent techniques qui évitent de grands volumes d'injectat (> 10 mL) dans l'orbite. En revanche, chez les patients présentant une énophtalmie importante, l'avancée du globe peut améliorer l'exposition chirurgicale.
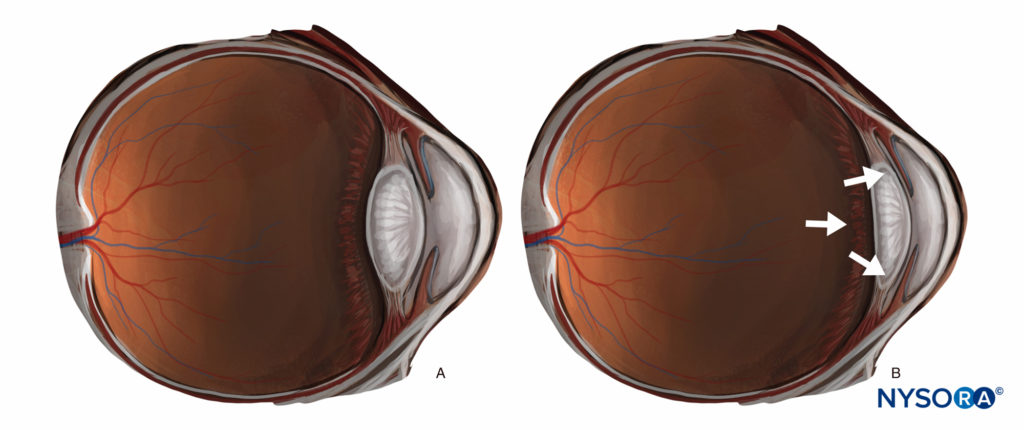
FIGURE 7. (A) Segment antérieur « physiologique ». (B) L'effet de l'augmentation du volume rétrobulbaire.
"Le seul œil"
Chez les patients qui n'ont la vision que d'un œil - l'œil opéré -, les chirurgiens et les anesthésistes ont tendance à avoir une aversion au risque et à éviter les blocages nerveux à l'aiguille pointue. Les techniques qui n'impliquent pas de perte de vision (c.-à-d. topiques, sous-conjonctivales, sous-ténoniennes « superficielles ») peuvent être préférables. Les techniques qui garantissent mieux l'akinésie entraînent généralement une perte de vision temporaire due à l'anesthésie du nerf optique. En ambulatoire, il peut être préférable d'utiliser un LA de courte durée (p. ex., lidocaïne, articaïne) plutôt que des agents à action plus longue.
Opération de la cataracte
La technique PhE mini-invasive a été popularisée dans les années 1990. La sonde PhE est insérée par une petite incision supérieure à trois plans (auto-obturante). Le contenu de la chambre postérieure est manipulé à l'aide d'une sonde de la largeur d'une aiguille insérée latéralement. Une fois la chambre postérieure vidée et nettoyée, une lentille intraoculaire artificielle pliable ou injectable est insérée par la même incision. Une anesthésie du segment antérieur suffit. Certains chirurgiens ont besoin d'akinésie; d'autres (notamment les chirurgiens à rotation élevée) ne le font pas.
Chirurgie de la cornée
Les opérations les plus courantes sur la cornée impliquent un traumatisme, l'ablation de corps étrangers, la chirurgie du lambeau conjonctival et du ptérygion, la chirurgie de greffe de cornée et, de plus en plus, la kératoprothèse. Pour ces procédures, l'anesthésie du segment antérieur est généralement tout ce qui est nécessaire. La plupart des chirurgiens ont besoin d'akinésie pour la chirurgie pénétrante de la cornée (p. ex., traumatisme, greffe, chirurgie prothétique, procédures de reprise), tandis que beaucoup ne le font pas pour la chirurgie du ptérygion, où la tunique fibreuse reste essentiellement intacte. Certains chirurgiens trouvent l'anesthésie sous-conjonctivale utile pour séparer la conjonctive de la sclérotique lors de la chirurgie du ptérygion.
Chirurgie réfractive
L'ablation de la surface cornéenne, la chirurgie réfractive incisionnelle et l'insertion d'un anneau intracornéen sont généralement réalisées sous anesthésie topique. Les procédures réfractives impliquant la chambre antérieure (par exemple, l'insertion de lentilles intraoculaires phaques) sont effectuées d'une manière similaire à la chirurgie de la cataracte.
Chirurgie du glaucome
La chirurgie de filtration du glaucome et la trabéculectomie impliquent toutes deux la création d'une fistule entre la chambre antérieure et l'espace sous-conjonctival. Encore une fois, seule l'anesthésie du segment antérieur est nécessaire. Selon le chirurgien, il peut y avoir ou non un besoin d'akinésie. Certains chirurgiens n'aiment pas la perturbation de l'intégrité de la conjonctive qui accompagne souvent la technique chirurgicale sous-ténonienne (ou « snip »), en particulier dans des mains inexpérimentées. De plus, l'hématome conjonctival peut introduire des cellules réticulo-endothéliales qui interfèrent avec les lambeaux de trabéculectomie ; par conséquent, certains chirurgiens du glaucome préfèrent l'anesthésie péribulbaire pour ces procédures. L'anesthésie topique (avec ou sans lidocaïne intracamérulaire) et l'anesthésie sous-conjonctivale évitent toutes deux l'effet potentiel des injections de volume derrière ou autour de l'orbite sur le flux sanguin oculaire pulsatile chez les patients atteints de glaucome avancé. Paradoxalement, la chirurgie non perforante du glaucome (par exemple, sclérotomie profonde), étant une procédure plus longue et plus difficile, nécessite généralement une technique qui garantit un bloc nerveux plus long avec akinésie. Les procédures impliquant des shunts de tube aqueux peuvent être effectuées sous anesthésie topique mais ont tendance à être plus inconfortables pour le patient.
La cyclophotocoagulation est l'ablation circonférentielle du corps ciliaire jusqu'au limbe. L'akinésie n'est pas essentielle pour cette procédure mais peut être préférée par certains chirurgiens ; cependant, une bonne analgésie est essentielle, car la procédure peut être très douloureuse. L'anesthésie sous-conjonctivale fonctionne mais demande du temps; Les blocs nerveux sous-ténoniens ou à l'aiguille fournissent généralement une anesthésie acceptable plus rapidement.
Chirurgie oculoplastique
Les procédures des tissus mous de l'œil comprennent la correction des malpositions des paupières telles que l'entropion et l'ectropion, les malpositions des cils (districhiasis), la chirurgie du ptosis, la chirurgie des tumeurs des paupières, la reconstruction des paupières, la blépharoplastie, la chirurgie des canaux lacrymaux, la décompression orbitaire (par exemple, pour la maladie de Grave) , et l'énucléation et l'éviscération. Bien que bon nombre de ces procédures puissent être réalisées sous infiltration locale, des techniques anesthésiques spécifiques sont décrites plus loin dans ce chapitre.
Chirurgie musculaire extraoculaire
La chirurgie du strabisme est le plus souvent pratiquée chez les enfants sous anesthésie générale. Chez les adultes, la chirurgie du strabisme est généralement pratiquée chez les personnes de moins de 30 ans, un groupe qui peut souvent être moins que stoïque, donc encore une fois, l'AG est généralement préféré. Cependant, cette chirurgie peut être réalisée sous anesthésie régionale. Bien que l'akinésie soit utile, la principale exigence est une anesthésie profonde du cône musculaire, car tirer sur les muscles extraoculaires est généralement assez douloureux et peut induire un réflexe oculocardique. De simples ajustements de suture peuvent être effectués sous anesthésie topique.
Chirurgie vitréorétinienne
Les réparations de vitrectomie et de décollement de la rétine (y compris le flambage scléral) nécessitent à la fois une anesthésie du segment postérieur et une akinésie de l'œil ; les techniques topiques et sous-conjonctivales sont inadéquates pour cela. Ainsi, un bloc nerveux sous-ténonien, rétrobulbaire ou péribulbaire est plus approprié. Une chirurgie de flambage antérieure est une contre-indication relative à toute technique régionale, car la boucle et le tissu cicatriciel qui l'entourent entraveront la propagation de l'anesthésique local. Cependant, si la position de la boucle est connue, un bloc nerveux sous-ténonien profond peut être possible via l'un des quadrants non affectés. Le traitement « tap-and-inject » de l'endophtalmie est généralement réalisé à l'aide d'un bloc nerveux rétrobulbaire ou péribulbaire.
Blessures à globe ouvert
Les patients présentant une lésion à globe ouvert connue ou suspectée sont le plus souvent traités sous anesthésie générale pour éviter les risques d'infection, d'hémorragie rétrobulbaire et d'augmentation de la pression intraoculaire, qui peuvent aggraver les dommages. Certains auteurs préconisent la réparation sous anesthésie locale et sédation, affirmant que cette méthode évite le dilemme de l'utilisation de la succinylcholine, qui peut augmenter considérablement la pression intraoculaire, chez les patients présentant à la fois une lésion oculaire pénétrante et un estomac plein. Les relaxants musculaires non dépolarisants à action rapide (NDMR), tels que le rocuronium, et la plus grande disponibilité de l'agent d'inversion du NDMR, le sugammadex, ont largement atténué ce problème. Néanmoins, la littérature récente semble suggérer que le risque d'extrusion vitréenne reste très réel et, peut-être dans des situations soigneusement sélectionnées, l'anesthésie locale ne doit pas être écartée comme alternative en cas de traumatisme oculaire.
Oncologie ophtalmique
La plupart des procédures d'ablation des tumeurs oculaires peuvent être réalisées sous anesthésie locale ou générale, selon les préférences du chirurgien et/ou du patient. Cependant, les procédures nécessitant une immobilisation stéréotaxique ou une hypotension délibérée doivent être réalisées sous anesthésie générale.
TECHNIQUES ANESTHÉSIQUES
Principes communs du bloc nerveux sous-ténonien (épiscléral)
L'anesthésie de Sub-Tenon, décrite pour la première fois en 1884, place l'anesthésique local dans l'espace potentiel entre la capsule de Tenon et la sclère (Figure 8). Bien que cet espace soit théoriquement accessible depuis n'importe quel quadrant du globe, le fornix conjonctival inféronasal est le plus populaire, à environ 4h30 (œil droit) ou 7h30 (œil gauche) pour éviter de rencontrer les insertions du droit médial. et les muscles obliques inférieurs à l'équateur.
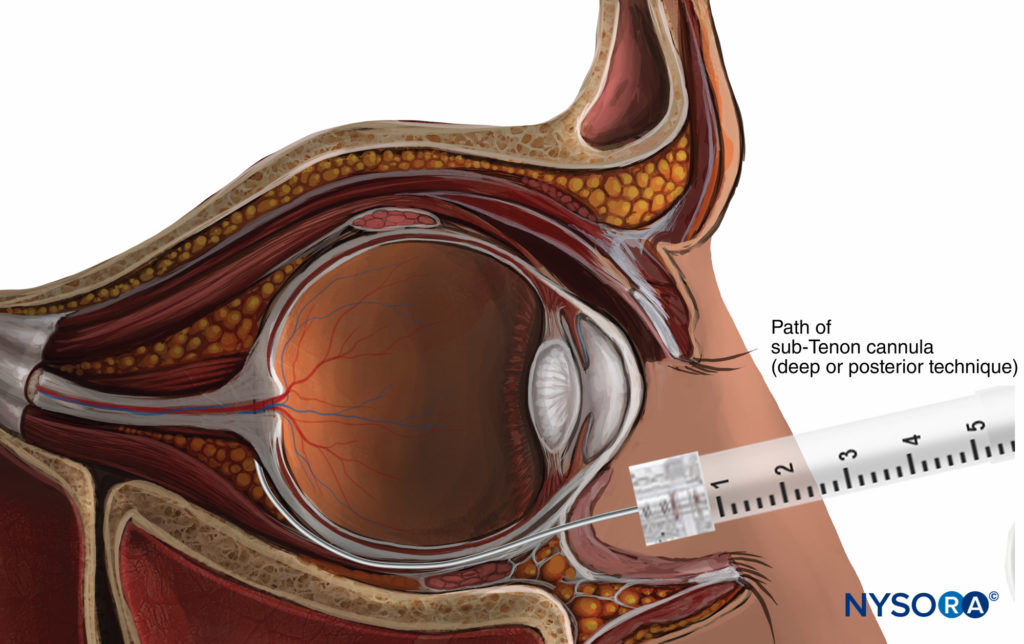
FIGURE 8. Bloc nerveux sous-ténonien.
En utilisant une approche chirurgicale ou non chirurgicale (voir ci-dessous), une aiguille ou une canule spécifique est dirigée vers l'arrière en suivant la courbe du globe. Une injection superficielle ou profonde de solution d'AL peut alors être réalisée. Des injections "superficielles" ou plus antérieures (immédiatement au-delà de l'équateur) permettent à l'AL de se propager de manière circulaire autour de la partie sclérale du globe, assurant une analgésie de haute qualité de l'ensemble du globe avec des volumes d'injection relativement faibles (généralement 3 à 5 ml). L'injection d'un volume plus important (jusqu'à 8 à 11 ml) provoque la propagation de l'AL dans les gaines musculaires extraoculaires, assurant une akinésie reproductible.
Cependant, des volumes plus importants provoquent souvent une chémosis (une propagation sous-conjonctivale de LA), qui nécessite une compression pour se résoudre, ainsi qu'une augmentation significative de la pression intraoculaire.
D'autre part, les injections «profondes» ou postérieures dirigent plus d'injectat dans les espaces intra- et extraconiques postérieurs et sont plus susceptibles d'obtenir une anesthésie à des volumes inférieurs et sans chémosis, sans akinésie (2-3 mL) ou avec akinésie complète (3 –5 mL). Si la technique d'injection profonde « chirurgicale » est actuellement la plus populaire, plusieurs approches ont été décrites.
Technique chirurgicale ("Snip") avec une canule émoussée
Cette technique, d'abord proposée en complément (ou en sauvetage d'un bloc nerveux) de l'anesthésie rétrobulbaire, est probablement la variante la plus populaire de l'approche sous-ténonienne. Après anesthésie topique, la conjonctive bulbaire est saisie avec de petites pinces dans le quadrant inféronasal près du fornix. De petits ciseaux sont utilisés pour créer une petite ouverture dans la conjonctive et la capsule de Tenon pour accéder à l'espace épiscléral. Les mêmes ciseaux sont utilisés pour disséquer un passage vers l'espace sous-ténonien postérieur. Une canule émoussée en métal (par exemple, Stevens) ou en plastique (par exemple, Helica) est ensuite insérée dans cet espace pour permettre l'injection.
Certains praticiens optent pour un passage superficiel puis « hydro-disséquent » à l'aide de l'injectat d'anesthésique local ; d'autres (en particulier pour la chirurgie du segment postérieur) préfèrent sonder-disséquer au plus près de l'espace intraconal en utilisant des ciseaux fermés. Il est également possible, en particulier chez les personnes âgées, de pousser doucement la canule vers l'arrière sans dissection. Le volume d'injection LA habituel est de 3 à 5 ml. L'augmentation du volume d'injection (jusqu'à 11 ml) entraîne une probabilité accrue d'akinésie, mais est rarement nécessaire. Le principal avantage de cette technique est sa sécurité, car elle évite l'introduction aveugle d'une aiguille pointue dans l'orbite. Dans 6000 7 cas, aucune complication grave n'a été rapportée, avec seulement 6 % d'hématome sous-conjonctival et 6000 % d'œdème sous-conjonctival. La chirurgie a été annulée en raison d'un hématome sous-conjonctival chez un seul patient sur les XNUMX.
Technique non chirurgicale avec une canule émoussée
Couper la conjonctive peut entraîner des cicatrices à long terme et crée une porte d'entrée pour les bactéries et parfois d'autres corps étrangers. Avec de la pratique, une canule émoussée à bout rond (telle qu'une canule sous-ténonienne « Tri-Port » de calibre 21 Eagle Laboratories ou même une canule de Stevens) peut être introduite à travers la conjonctive et les couches de Tenon sans incision préalable.
Cela provoque moins de traumatismes, réduit les saignements et est particulièrement recommandé lorsque les lésions conjonctivales doivent être minimisées (par exemple, chirurgie du glaucome).
Technique non chirurgicale avec une aiguille pointue
Une aiguille pointue de calibre 25, 25 mm, à biseau court est introduite dans le fornix entre le pli semi-lunaire de la conjonctive et le globe, tangentiellement au globe. L'aiguille est légèrement décalée vers l'intérieur et avancée vers l'arrière. Après une petite perte de résistance (clic) à 10–15 mm, LA est injectée. L'utilisation d'un grand volume avec cette technique (6 à 11 ml) permet d'obtenir une bonne akinésie du globe et des paupières, plus reproductible que l'anesthésie péribulbaire classique ; cependant, notez qu'il s'agit de volumes importants par rapport aux autres techniques et, comme pour toutes les techniques à l'aiguille pointue, il faut toujours garder à l'esprit le risque de mauvais placement de l'aiguille et ses complications ultérieures. Néanmoins, cette technique est associée à un faible risque de complications, et elle est simple à apprendre et à utiliser. Dans une série de 2000 cas, aucune complication grave n'est survenue.
Technique de canule improvisée
Cette technique historique a été brièvement populaire avant que les canules spécialisées ne deviennent largement disponibles. Une courte canule intraveineuse (IV) (calibre 18 ou 20) était généralement utilisée pour injecter de faibles volumes d'AL (3 à 5 ml). Il procure une bonne analgésie du globe mais seulement une akinésie partielle du globe et des paupières. L'injection ne provoque qu'une légère augmentation de la pression intraoculaire et la compression préopératoire du globe est généralement inutile. Cependant, étant donné qu'elle nécessite l'introduction de la canule en perçant la capsule de Tenon, un peu comme la technique de canulation IV, le risque de mauvais placement de l'aiguille a réduit la popularité de cette technique.
Limites de la technique du sous-ténon
La technique sous-ténonienne peut ne pas être possible là où les culs-de-sac conjonctivaux ont été oblitérés, comme dans le cas du pemphigus oculaire chronique. Il doit également être évité lorsque la sclère est connue pour être fine ou fragile (par exemple, la « sclérotique bleue » de l'ostéogenèse imparfaite ou un staphylome antérieur).
L'accès peut être difficile chez les patients dont l'espace inféronasal est déjà marqué par plusieurs blocs nerveux antérieurs ou chez ceux qui ont une boucle sclérale en place, en particulier une qui est circonférentielle. Dans la plupart de ces situations, l'accès est possible via un quadrant alternatif (le plus souvent l'inférotemporal). L'inflammation oculaire chronique peut rendre la conjonctive charnue et douloureuse au toucher et saigner facilement. L'accès par un ptérygion doit être évité pour les mêmes raisons.
CONSEILS NYSORA
La technique chirurgicale « Snip » du bloc nerveux du sous-ténon selon Guise
• Utiliser de l'iode à demi-concentration : Un ensemble substantiel de preuves suggère que cela réduit le risque d'endophtalmie bactérienne.
• Restez dans la « ligne de longitude » d'un pôle à l'autre : Restez à égalité entre la droite médiale et la droite inférieure.
• Gardez les ciseaux Westcott fermés : Une seule coupe au début est nécessaire.
• Maintenez le bout de la canule bien serré contre la sclérotique : il est facile de dépasser.
• Injecter dans des directions différentes : Une légère rotation de la seringue facilitera la diffusion derrière l'œil.
• Evitez les ptérygions : Ils rendent plus difficile l'accès à l'espace sous-ténonien, et ils saignent.
• Gardez l'anesthésique local en arrière de l'équateur : Gardez le canal créé par les ciseaux de Westcott aussi étroit que possible pour minimiser le reflux.
• Réduisez le débit et la force d'injection : trop rapide et trop fort est douloureux pour le patient et plus susceptible de provoquer un chémosis.
• Utilisez moins de 5 ml pour minimiser la chémosis et l'augmentation de la pression intraoculaire.
• Évitez les massages oculaires, qui peuvent provoquer des pics dramatiques de pression intraoculaire et peuvent même provoquer des saignements de la chambre antérieure. Une pression douce et régulière, le cas échéant, est préférable.
• Faites attention avec les boucles sclérales : Le quadrant inférotemporal est généralement dégagé, mais demandez conseil à votre chirurgien. Si ce n'est pas clair et que vous n'êtes pas à l'aise d'essayer un autre quadrant, ou si vous vous attendez ou rencontrez des cicatrices importantes, essayez une technique différente.
ANESTHÉSIE RÉTROBULBAIRE
Historiquement, l'anesthésie rétrobulbaire (RBA) était l'étalon-or pour l'anesthésie de l'œil et de l'orbite. Cette technique consiste généralement à injecter un petit volume de solution d'AL (3 à 5 mL) à l'intérieur du cône musculaire (voir Figure 3). Un bloc nerveux facial est parfois nécessaire pour empêcher le clignement des yeux (voir « Blocs nerveux oculoplasiques » ci-dessous). Du fait de son contrôle moteur extraconal, le muscle oblique supérieur peut fréquemment rester fonctionnel, excluant une akinésie totale du globe. Le principal danger de la RBA est le risque de blessure au globe ou à l'une des structures anatomiques du cône musculaire. Près de l'apex, ces structures s'entassent dans un espace très réduit et sont fixées par le tendon de Zinn, ce qui les empêche de s'éloigner d'une aiguille.
Technique classique (désormais obsolète)
Dans la description classique d'Atkinson de 1936, on demande au patient de regarder dans la direction « vers le haut et vers l'intérieur ». L'aiguille est introduite à travers la peau sous la paupière inférieure à la jonction entre le tiers latéral et les deux tiers médiaux du bord orbitaire inférieur. L'aiguille est dirigée vers le sommet de l'orbite (légèrement médialement et céphalique) et avancée à une profondeur de 25 à 35 mm. Un volume de 2 à 4 ml de solution LA est ensuite injecté. Un bloc nerveux facial supplémentaire peut être nécessaire pour empêcher le clignement des yeux ; la technique la plus fréquemment utilisée est le bloc de Van Lint (voir « Blocs nerveux oculoplasiques »).
Techniques modernes
Les blocs nerveux rétrobulbaires modernes sont réalisés avec l'œil en position neutre (Figure 9). La position du regard "vers le haut" d'Atkinson a été abandonnée lorsque Liu et al. et Unsöld et al. a averti qu'il augmentait le risque de lésion du nerf optique puisque cette position place le nerf optique près du trajet de l'aiguille. De plus, le nerf optique est étiré et peut être facilement blessé par l'aiguille, plutôt que d'être écarté. Des sites de ponction alternatifs et des aiguilles pliées ou incurvées spécialement conçues ont été proposés mais n'ont pas gagné en popularité.
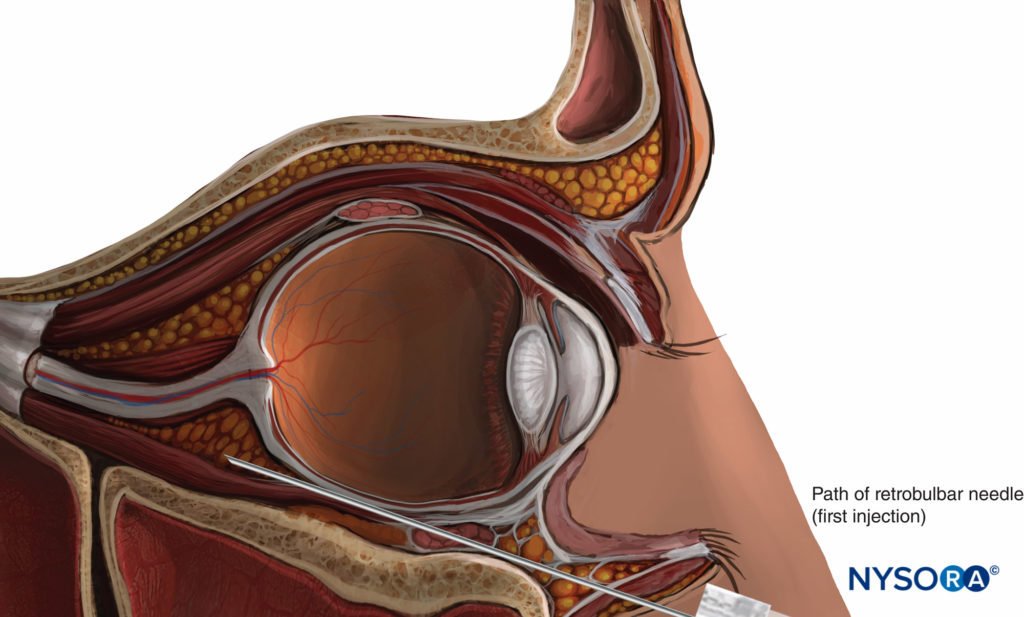
FIGURE 9. Bloc nerveux rétrobulbaire.
RBA : Y a-t-il un avenir ?
Compte tenu de la polyvalence et de la popularité croissante des blocs nerveux sous-ténoniens, et étant donné qu'il n'existe aucune situation dans laquelle un bloc nerveux rétrobulbaire serait préféré à un bloc nerveux péribulbaire, il semble peu probable que les blocs nerveux rétrobulbaires continuent de faire partie du répertoire de la anesthésiste moderne.
ANESTHÉSIE PÉRIBULBAIRE
Avec l'anesthésie péribulbaire (PBA), l'aiguille est introduite dans l'espace extraconal (Figure 10). La technique classique comporte deux injections. La première injection est inférieure et temporale, l'aiguille étant introduite au même endroit que pour une injection RBA, mais avec un angle de va-et-vient moindre.
La deuxième injection est supérieure et nasale, entre le tiers médial et les deux tiers latéraux du bord du toit orbitaire (voir Figure 10).
Le volume injecté d'AL (6 à 12 ml) est supérieur à celui d'une injection rétrobulbaire. Ce volume plus important permet à l'AL de se répandre dans tout le corps adipeux de l'orbite, y compris l'espace intraconal, où se trouvent les nerfs à bloquer. De plus, un volume aussi important permet à la propagation antérieure de LA aux paupières de fournir un bloc nerveux du muscle orbiculaire et d'éviter le besoin d'un bloc nerveux supplémentaire de la paupière.
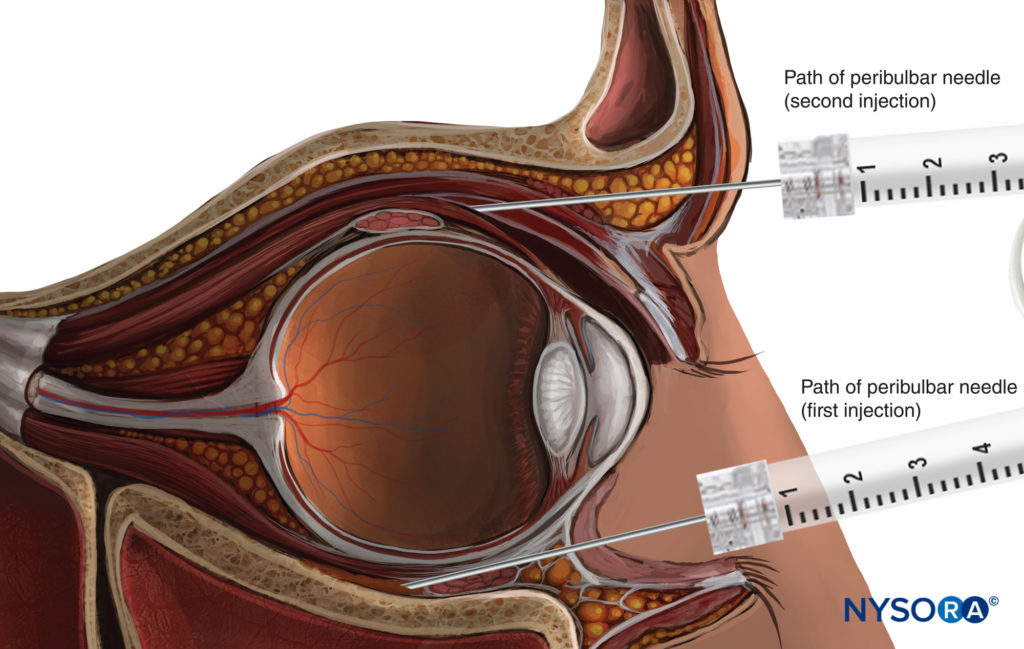
FIGURE 10. Bloc nerveux péribulbaire : technique de deuxième injection supérieure.
Plusieurs variantes du PBA ont été décrites (Figure 11). Les plus courantes sont (1) l'injection du canthus médial, (2) l'injection du caroncule lacrymal et (3) les injections inférieure et temporale.
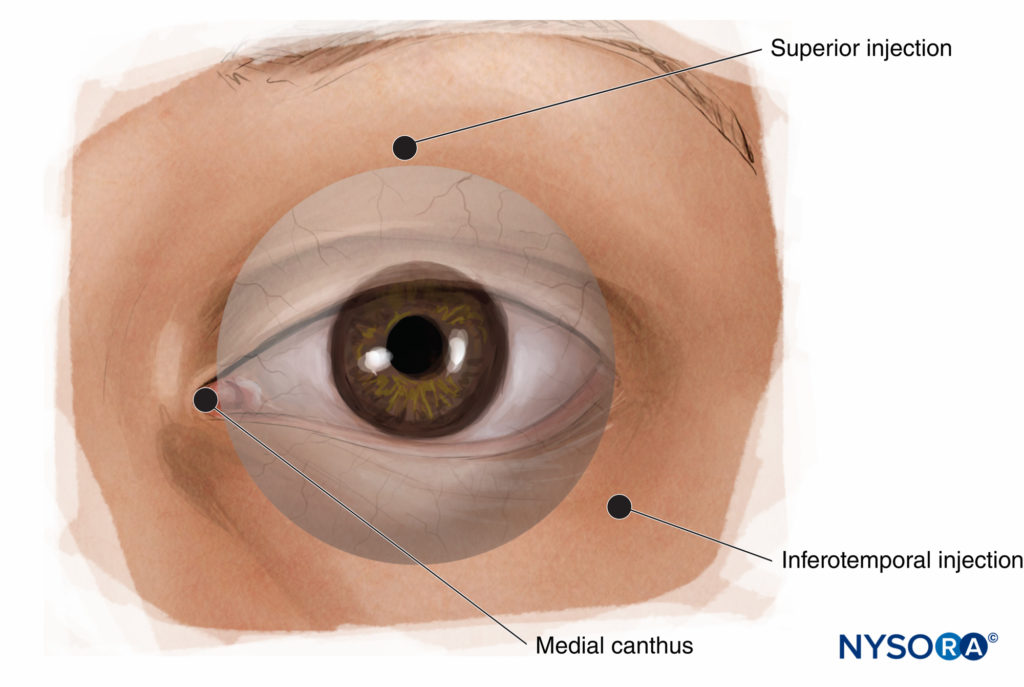
FIGURE 11. Bloc nerveux péribulbaire : sites d'injection alternatifs.
Principes de l'anesthésie péribulbaire
• Technique à injection unique versus à injections multiples: L'augmentation du volume d'AL injecté permet une anesthésie suffisante. Des injections supplémentaires ne sont pas nécessaires. De plus, une distorsion anatomique après la première injection peut augmenter le risque de complications associées aux injections consécutives. En règle générale, une deuxième injection ne doit être effectuée qu'en complément lorsque la première injection n'a pas réussi à fournir une anesthésie efficace.
• Sites d'insertion de l'aiguille: L'insertion de l'aiguille dans le site nasal supérieur doit être évitée. A ce niveau, la distance entre le toit orbital et le globe est réduite, augmentant théoriquement le risque de perforation du globe.
De plus, l'aiguille peut blesser le muscle oblique supérieur. L'approche inféronasale ou une approche par le canthus médial doit être utilisée à la place. L'aiguille est introduite à la jonction médiale des paupières, nasale à la caroncule lacrymale, dans une direction strictement postérieure à une profondeur de 15 mm ou moins. A ce niveau, l'espace entre la paroi orbitaire et le globe est de taille similaire à celui de l'abord inférieur et temporal et est exempt de vaisseaux sanguins. Par ailleurs, le staphylome myopique, anomalie anatomique qui représente un facteur de risque de perforation, est peu fréquent sur la face nasale du globe.
• Profondeur d'insertion de l'aiguille: Limitez la profondeur d'insertion de l'aiguille à 25 mm. En arrière du globe, les muscles droits sont en contact avec les parois orbitaires, de sorte que l'espace extraconal disparaît entièrement et devient virtuel. L'augmentation de la profondeur d'insertion de l'aiguille devrait faire en sorte qu'une injection péribulbaire devienne une injection rétrobulbaire. Certains blocs nerveux péribulbaires postérieurs sont en fait des injections rétrobulbaires involontaires. Ceci est une explication plausible d'une lésion du nerf optique après une tentative d'injection péribulbaire. De plus, une longue aiguille complètement introduite dans l'orbite peut atteindre le sommet de l'orbite, une autre zone dangereuse. L'insertion de l'aiguille à une profondeur de 40 mm a conduit à réaliser l'injection directement par le foramen optique dans 11 % des cas.
• Des aiguilles fines (calibre 25) sont suggérées pour réduire la douleur lors de l'insertion de l'aiguille: L'utilisation d'aiguilles à biseau court peut être plus sûre car elles peuvent améliorer la perception tactile de la résistance lors de l'insertion de l'aiguille (placement intraneural ou intramusculaire). En effet, sur des cadavres, il faut plus de pression avec des aiguilles à biseau court pour perforer la sclérotique. Néanmoins, il ne s'agit là que de considérations théoriques, car le taux de complication des blocs nerveux péribulbaires est faible.
• Utiliser la compression pour abaisser la pression intraoculaire, qui augmente après l'injection: Il n'a pas été démontré que la compression améliore la qualité du bloc nerveux. L'application d'une pression de 30 mm Hg pendant 5 à 10 minutes est généralement suffisante.
• Dans tous les cas, la propagation de LA dans le corps adipeux de l'orbite reste quelque peu imprévisible, ce qui nécessite plus d'anesthésique pour prévenir un bloc nerveux imparfait.: Selon la demande du chirurgien pour l'akinésie, une anesthésie supplémentaire est nécessaire dans jusqu'à la moitié des cas. La faible reproductibilité de l'efficacité du bloc nerveux est le principal inconvénient de l'anesthésie péribulbaire.
Blocs nerveux rétrobulbaires versus péribulbaires versus sous-ténoniens
La RBA est traditionnellement considérée comme plus efficace que la PBA. Cependant, lorsqu'un volume suffisant d'AL est injecté, les deux blocs nerveux semblent avoir des taux de réussite similaires. Cela s'explique par l'absence d'une membrane intermusculaire pour séparer les compartiments extra- et intraconaux, entraînant une propagation favorable de l'AL (voir « Anatomie fonctionnelle »). Par conséquent, si l'efficacité est similaire, il faut préférer utiliser la technique avec un moindre risque de complications. Étant donné que la RBA comporte théoriquement un risque plus élevé de complications (p.
Cependant, toutes autres exigences étant égales par ailleurs, le bloc nerveux sous-ténonien offre le meilleur profil de sécurité des trois blocs nerveux et peut délivrer de manière fiable à la fois une anesthésie chirurgicale et une akinésie s'il est effectué par un praticien expérimenté avec un volume approprié (avec ou sans adjuvants). Cependant, lorsque le chémosis, l'hématome conjonctival ou la rupture de la conjonctive ne sont pas souhaitables, ou lorsque l'anatomie postérieure est gravement anormale, cette technique peut ne pas être appropriée.
La diversité des opinions et des données suggère, du moins pour cet auteur, que l'efficacité individuelle de chacun de ces blocs nerveux dépend fortement de l'opérateur. Dans une large mesure, il en va de même en ce qui concerne leurs profils de sécurité.
COMPLICATIONS DES BLOCS NERVEUX OCULAIRES
La principale cause de complications graves est le mauvais placement de l'aiguille. Bien que certaines caractéristiques anatomiques puissent augmenter le risque de complications, le principal facteur de risque est une connaissance insuffisante et une expérience limitée de la part de l'opérateur. Cependant, il convient de noter que des complications telles que l'hémorragie rétrobulbaire et le réflexe oculocardique peuvent survenir même chez les praticiens les plus expérimentés. Les signes, les symptômes et les mécanismes des complications courantes sont résumés dans Tables 1 et 2.
TABLE 1. Signes, symptômes et mécanismes des complications de l'anesthésie rétrobulbaire.
| complication | Signes et symptômes | Mécanisme de complication |
|---|---|---|
| Oculaire | ||
| Perforation du globe | Douleur oculaire, hémorragie intraoculaire, agitation | Traumatisme direct : œil myope, staphylome postérieur, à répétition injections |
| Rétrobulbaire hémorragie | Ecchymose sous-conjonctivale ou palpébrale, augmentation de la douleur de la proptose et/ou augmentation de la pression intraoculaire | Traumatisme direct (artère ou veine) |
| Lésions du nerf optique | Perte de vision, possible gonflement précoce du disque optique, pâleur tardive du disque optique | Lésion directe des nerfs ou des vaisseaux sanguins, occlusion vasculaire |
| Systémique | ||
| Intra-artériel injection | Arrêt cardiorespiratoire, convulsions | Flux rétrograde vers la carotide interne et accès aux structures du mésencéphale |
| Gaine du nerf optique injection | Anesthésie du tronc cérébral : agitation, ptosis, mydriase, dysphagie, étourdissements, confusion, ophtalmoplégie controlatérale, perte de conscience, dépression/arrêt respiratoire, troubles cardiaques arrêter | Injection sous-durale ou sous-arachnoïdienne |
| Réflexe oculocardiaque | Bradycardie, autres arythmies, asystole | Nerf trijumeau (afférent, arc) au plancher du quatrième ventricule avec arc efférent via le nerf vague |
TABLE 2. Autres complications de l'anesthésie rétrobulbaire.
| complication | Commentaires |
|---|---|
| Chémosis (œdème sous-conjonctival) | Habituellement peu préoccupant; disparaît avec la pression. |
| Hémorragie veineuse | Habituellement bénigne et, bien que disgracieuse, elle est facilement maîtrisée. |
| Hémorragie artérielle | Peut être dramatique, provoquant une exophtalmie, un hématome sous-conjonctival et palpébral étendu et une augmentation spectaculaire de la pression intraoculaire. Il s'agit d'une complication menaçant la vue : informez immédiatement le chirurgien, car une décompression orbitaire (p. ex., canthotomie latérale/cantholyse) peut être nécessaire pour prévenir la cécité. Entraîne généralement le report de la chirurgie. |
| Perforation du globe | Probablement plus fréquent dans les yeux longs et myopes. Un œil long a une sclérotique plus fine et peut avoir un contour irrégulier (staphylomes). L'aiguille doit être insérée tangentiellement au globe et se déplacer librement dans la graisse orbitaire sans faire tourner le globe. |
| Dommages au nerf optique | Conséquence d'un traumatisme direct, d'une injection dans la gaine nerveuse ou des conséquences ischémiques de la pression lors de l'injection. |
| Diminution de l'acuité visuelle | Résout généralement avec la résolution du bloc, mais méfiez-vous du « effacement », en particulier chez les patients atteints de glaucome avancé (voir « Choix des anesthésiques locaux et des agents adjuvants »). |
| Myotoxicité | Peut suivre une injection directe dans un muscle ou l'utilisation de fortes concentrations d'AL (probablement plus fréquent qu'actuellement reconnu ; se résout généralement pendant la convalescence chirurgicale). |
| Complications systémiques | L'injection sous-arachnoïdienne lors d'un bloc rétrobulbaire est une cause possible d'arrêt respiratoire. |
| Convulsions de grand mal, perte de conscience et dépression respiratoire ou arrêt cardiaque | Ces complications peuvent résulter de la toxicité systémique de l'AL, de l'injection d'AL dans la gaine du nerf optique (et de là dans le tronc cérébral) ou du flux artériel rétrograde. |
| Œdème pulmonaire | Rare; mécanisme est mal compris. |
| Réaction à l'épinéphrine | Souvent appelé de manière inappropriée « toxicité de l'épinéphrine » ; chez les patients souffrant d'hypertension, d'angine de poitrine ou d'arythmie, la quantité d'épinéphrine injectée avec l'AL doit être réduite. |
| Réflexe oculocardiaque, réaction vasovagale | Voir le texte pour la présentation et la gestion. |
| Réactions allérgiques | Extrêmement rare avec les LA de type amide ; plus fréquent avec l'hyaluronidase d'origine animale. |
Complications du système nerveux central
Les complications du bloc nerveux oculaire du système nerveux central peuvent survenir à la suite d'un bloc nerveux à l'aiguille par deux mécanismes différents :
1. Un accident injection intra-artérielle peut inverser le flux sanguin dans l'artère ophtalmique jusqu'à l'artère cérébrale antérieure ou l'artère carotide interne,70 de sorte qu'un volume injecté aussi petit que 4 mL peut provoquer des convulsions. Traitement symptomatique en maintenant une voie aérienne brevetée ; fournir une oxygénation; et l'abolition de l'activité épileptique avec de petites doses de benzodiazépam, de propofol ou d'un barbiturique est généralement adéquate et entraîne une récupération rapide sans séquelles.
2. Un accident injection sous-arachnoïdienne via la ponction de la gaine dure-mère du nerf optique ou directement à travers le foramen optique entraîne une anesthésie partielle ou totale du tronc cérébral. Katsev et al. ont montré que le sommet de l'orbite peut être atteint avec une aiguille de 40 mm chez jusqu'à 11 % des patients. Selon la dose et le volume d'AL se propageant vers le tronc cérébral, injection sous-arachnoïdienne peut entraîner un bloc nerveux bilatéral ; paralysie des nerfs crâniens avec activation sympathique, confusion et agitation ; ou rachianesthésie totale avec tétraparésie, hypotension artérielle, bradycardie et éventuellement arrêt respiratoire. Un traitement symptomatique (oxygène, vasopresseurs et, si nécessaire, intubation trachéale et ventilation) doit permettre une récupération complète après la disparition du bloc nerveux spinal
(quelques heures).
Involontaire perforation globe et la rupture est la complication la plus dévastatrice des blocs nerveux oculaires. Elle est de mauvais pronostic, surtout lorsque le diagnostic est tardif. L'incidence est comprise entre 1 sur 350 et 7 sur 50,000 50,000 cas. Les principaux facteurs de risque comprennent une expérience insuffisante de l'opérateur et un œil très myope (c'est-à-dire un long globe oculaire). Dans une étude de XNUMX XNUMX cas, Edge et Navon ont observé que staphylome myopique était un facteur de risque important. Cela suggère qu'une forte myopie isolée n'est peut-être pas un facteur de risque en soi, mais agit comme un facteur de confusion, car le staphylome ne semble se produire que dans les yeux myopes. Vohra et Good ont observé avec l'échographie en mode B que la probabilité de staphylome est plus grande chez les yeux fortement myopes que chez les yeux légèrement myopes. De plus, le staphylome était plus fréquemment retrouvé au pôle postérieur du globe (expliquant les perforations après RBA) ou dans la région inférieure du globe (expliquant les perforations après ponctions inférieures et temporales, péri et rétrobulbaires). En conséquence, au moins chez les patients myopes, et au mieux chez tous les patients, la mesure échographique de la longueur axiale du globe (biométrie) devrait être disponible. En cas d'œil très myope (longueur axiale supérieure à 26 mm), un bloc nerveux à l'aiguille peut entraîner un risque accru de perforation du globe, et un bloc nerveux sous-ténonien ou topique est préférable. Les causes inhabituelles de perforation du globe comprennent des blocs nerveux sous-orbitaires mal placés (voir « Blocs nerveux oculoplasiques ») et des patients éternuant sous sédation au propofol (voir « Sédation »).
Lésion musculaire extraoculaire
Une blessure à un muscle extraoculaire peut provoquer une diplopie et une ptose. Plusieurs mécanismes peuvent être impliqués, notamment une blessure directe par l'aiguille entraînant un hématome intramusculaire, une pression élevée à la suite d'une injection dans la gaine musculaire ou une myotoxicité directe des LA.
Myotoxicité extraoculaire directe
On sait depuis un certain temps que des concentrations élevées d'anesthésiques locaux de type amide, en particulier la bupivacaïne, provoquent des modifications myotoxiques du muscle squelettique. Les muscles extraoculaires semblent particulièrement sensibles, et de nombreux rapports de cas de diplopie persistante après chirurgie de la cataracte y ont été attribués. Cependant, à ce jour, aucune évaluation clinique formelle de la fonction musculaire squelettique après bloc nerveux oculaire n'a été réalisée. Chez les singes, un bloc nerveux rétrobulbaire à la bupivacaïne à 0.75 % provoque généralement une réponse myopathique qui culmine à 14 jours et est largement résolue à 27 jours. Chez les lapins, la myotoxicité de la bupivacaïne semble dépendre de la concentration, les solutions à 0.75 % produisant des dommages étendus et de plus longue durée, tandis que les solutions à 0.19 % produisent peu de signes de dommages à court ou à long terme. Les solutions de lidocaïne contenant de l'épinéphrine causent beaucoup plus de dommages aux muscles squelettiques que la lidocaïne ordinaire, tant chez les rats que chez les humains. En effet chez l'homme, la toxicité de la bupivacaïne des muscles oculaires est délibérément induite pour traiter le strabisme. La blessure progresse en trois étapes : premièrement, le muscle est paralysé ; deuxièmement, le muscle semble récupérer ; et troisièmement, une hyperplasie rétractile se développe.
Compte tenu des rapports de cas et des preuves pathologiques impressionnantes et cohérentes d’une espèce à l’autre, et des milliers de blocs nerveux oculaires effectués chaque année, il est surprenant que le phénomène ne soit pas plus apparent sur le plan clinique. Il a été proposé que la douleur postopératoire puisse masquer les modifications myopathiques et que tout inconfort ou dysfonctionnement oculaire soit facilement attribué à l'opération plutôt qu'à d'autres causes. Par ailleurs, le animal les preuves suggèrent que dans la plupart des cas, il y aura probablement une récupération rapide avec une régénération complète des tissus. Dans une autre étude animale, les lésions musculaires squelettiques induites par le bloc du nerf fémoral étaient plus graves chez les rats plus jeunes que chez les rats plus âgés, donc peut-être que les humains plus âgés sont également moins sensibles.
Sur la base des preuves disponibles limitées, il semblerait que la myotoxicité extraoculaire soit probablement un élément concomitant plus fréquent des blocs nerveux de volume derrière l'équateur de l'œil qui est généralement reconnu et qu'elle dépend de la concentration et qu'elle se produise plus probablement avec la bupivacaïne, mais que tout les effets indésirables cliniquement significatifs dans la population de patients concernée disparaissent généralement (mais pas toujours) complètement dans le délai de cicatrisation de l'opération.
CONSEILS NYSORA
Hémorragie rétrobulbaire
• L'hémorragie rétrobulbaire est généralement causée par une ponction artérielle accidentelle. Elle peut entraîner un hématome compressif, qui peut menacer la perfusion rétinienne.
• Au moment de l'hémorragie, il est impératif d'avoir un ophtalmologiste présent qui peut surveiller la pression intraoculaire et prendre les mesures appropriées pour préserver la perfusion de l'artère centrale de la rétine. Le manque de perfusion, même pendant de courtes périodes, peut entraîner une perte de vision permanente et dévastatrice.
• Une décompression chirurgicale peut être nécessaire, mais dans la plupart des cas, l'intervention chirurgicale n'a qu'à être reportée.
• Une ponction veineuse peut survenir après une injection rétrobulbaire et péribulbaire. Elle conduit à un hématome non compressif dont les conséquences sont beaucoup moins graves si bien que dans la plupart des cas la chirurgie peut être poursuivie.
• Pour les patients prenant des anticoagulants (y compris même de l'aspirine et des médicaments similaires), envisagez une anesthésie sous-ténonienne ou topique pour minimiser le risque d'hémorragie.
Traumatisme du nerf optique
Le traumatisme direct du nerf optique par l'aiguille est rare mais grave, car il provoque la cécité. L'imagerie par tomodensitométrie montre généralement une hypertrophie du nerf optique causée par un hématome intraneural.
Résumé
Dans l'ensemble, il y a 1 à 3 % de risque de complications, nécessitant souvent le report de l'intervention chirurgicale prévue. Étant donné que certaines complications peuvent mettre la vie en danger si les patients ne sont pas immédiatement réanimés, il est recommandé qu'un anesthésiste soit présent pour surveiller le patient en périopératoire.
CONSEILS NYSORA
Réflexe oculocardiaque
• Bradycardie due à une série de stimuli dans ou autour de l'orbite, tels qu'une traction sur les muscles extraoculaires, une pression sur le globe, un bloc nerveux rétrobulbaire, un traumatisme oculaire ou une pression sur les tissus résiduels après l'énucléation.
• Provoque également d'autres arythmies, dont la tachycardie ventriculaire et (rarement) l'asystolie.
• Les voies neuronales concernées sont les branches du nerf trijumeau (afférent) et du nerf vague (efférent). Bien qu'il soit principalement associé à la stimulation du nerf ophtalmique, il peut survenir avec n'importe quelle branche du nerf trijumeau.
• L'incidence est la plus élevée chez les enfants (jusqu'à 90 % sans prétraitement à l'atropine).
• Pour la prophylaxie chez les enfants, l'atropine 0.02 mg/kg ou le glycopyrrolate 0.01 mg/kg avant la chirurgie est indiqué.
• L'atropine intramusculaire n'est pas utile en raison de son apparition retardée.
• La prophylaxie chez l'adulte n'est pas indiquée.
• Le traitement de la bradycardie comprend la suppression du stimulus ou la demande au chirurgien d'arrêter la stimulation, l'initiation d'anticholinergiques intraveineux (par exemple, l'atropine 5-10 mcg/kg ou le glycopyrrolate 2.5-5 mcg/kg) et la vérification de la profondeur de l'anesthésie (lorsque l'AG est utilisé ).
ANESTHESIE TOPIQUE
L'instillation de collyre LA permet une anesthésie cornéenne, permettant ainsi une chirurgie de la cataracte par PhE (Figure 12). Cette technique est rapide et simple à réaliser et évite les dangers potentiels des techniques à l'aiguille. Il a été suggéré que le manque d'akinésie et de contrôle de la pression intraoculaire, associé à la courte durée de cette technique, peut rendre la chirurgie dangereuse 90 ; cependant, cette observation ne semble pas avoir ébranlé la popularité croissante de la technique. De nombreux chirurgiens américains semblent préférer l'anesthésie topique à la PhE de routine dans plus de 90 % des cas.
Néanmoins, l'utilisation de l'anesthésie topique doit être limitée aux procédures simples réalisées par des chirurgiens expérimentés chez des patients coopératifs. Dans les régions du monde où la PhE n'est pas techniquement disponible, et dans certaines indications spécifiques où la PhE n'est pas réalisable, une akinésie totale est toujours nécessaire et l'utilisation d'une anesthésie topique peut être discutable.
Quant à ce que les patients préfèrent réellement, il existe des rapports contradictoires. Boezaart a rapporté que l'anesthésie pouvant être incomplète dans les approches topiques, les patients soumis au hasard à l'une de ces techniques pour un œil et à une autre technique pour l'autre œil préféraient la technique rétrobulbaire à la technique topique (71 % contre 10 %).
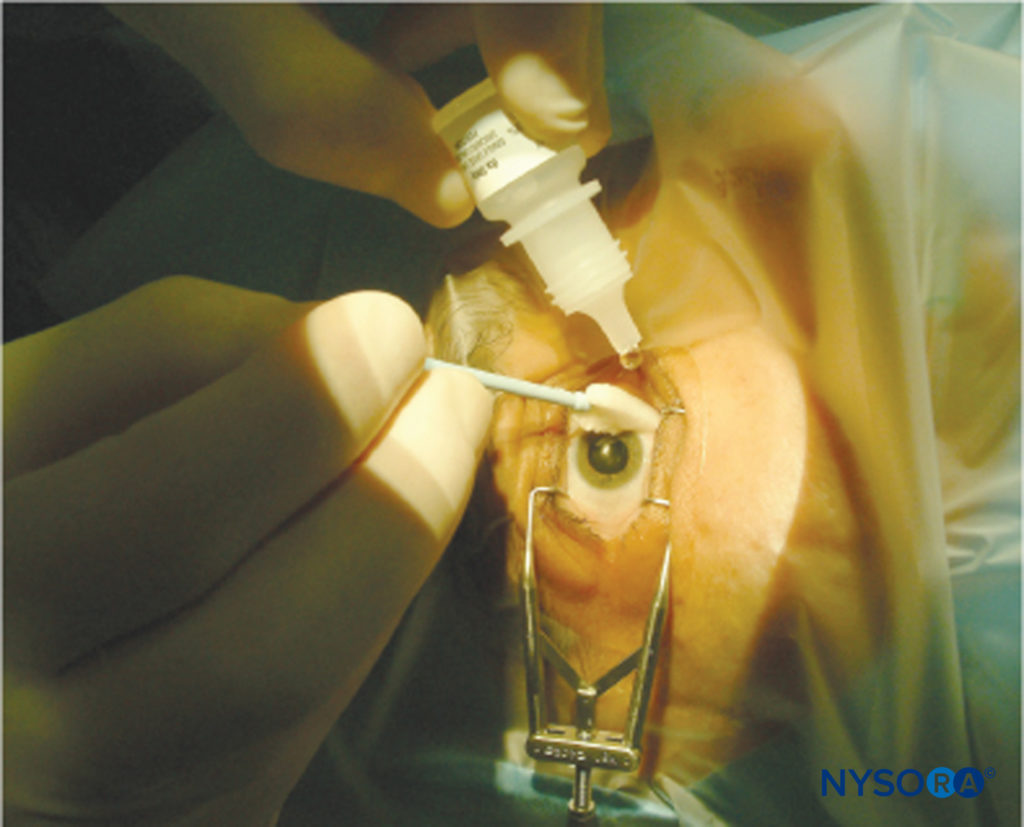
FIGURE 12.Anesthésie topique.
Les patients rapportent systématiquement moins d'inconfort peropératoire sous anesthésie rétrobulbaire ou sous-ténonienne par rapport à l'anesthésie topique. D'autre part, une méta-analyse de Zhao et al. ont rapporté que les patients préféraient massivement l'anesthésie topique aux blocs nerveux à l'aiguille, citant la « peur des aiguilles » comme raison principale, malgré le fait que la même population de patients signalait plus d'inconfort peropératoire sous anesthésie topique par rapport aux blocs nerveux à l'aiguille. Dans certaines mains expérimentées, aucune anesthésie ne semble être aussi efficace que l'anesthésie topique dans certains cas.
Une injection intracamérulaire d'AL semble améliorer considérablement l'analgésie avec une approche topique. Cela consiste à injecter de petites quantités (0.1 ml) d'AL dans la chambre antérieure au début ou pendant la chirurgie. Les agents anesthésiques intracamérulaires doivent être sans conservateur. Certaines inquiétudes ont été exprimées concernant les effets toxiques de l'AL sur l'endothélium cornéen, qui est incapable de se régénérer ; cependant, la sécurité de l'injection intracamérulaire semble maintenant bien établie. Certains auteurs ont remis en question son bénéfice analgésique par rapport à une simple anesthésie topique, et en effet le degré d'analgésie ne semble pas corrélé à la concentration intracamérulaire d'AL. Néanmoins, la combinaison de l'anesthésie topique et intracamérulaire est actuellement la technique la plus préférée par les chirurgiens ophtalmologistes américains.
L'insertion d'éponges imbibées d'AL dans les culs-de-sac conjonctivaux a été proposée. L'utilisation de la gelée de lidocaïne à la place du collyre semble améliorer la qualité de l'analgésie du segment antérieur et devient très populaire pour améliorer le confort du patient sous anesthésie topique.
Toxicité épithéliale cornéenne directe des anesthésiques topiques
D'après des études sur des animaux, on sait depuis un certain temps que des applications répétées de pratiquement tous les agents anesthésiques topiques provoquent un certain degré de toxicité épithéliale cornéenne transitoire qui est macroscopiquement apparente, y compris un épaississement et une opacification cornéens réversibles. Les changements peuvent être évidents avec même une seule application topique, et ceux-ci peuvent prendre plus d'une heure ou plus pour récupérer. Chez l'homme, l'abus d'anesthésique topique est une cause connue de kératopathie sévère chez les soudeurs à l'arc et les métallurgistes, et même chez les patients qui abusent de leurs «gouttes de confort» après une kératectomie réfractive.
Un œdème cornéen transitoire a été observé chez des patients subissant une chirurgie de la cataracte sous ropivacaïne ou lidocaïne topique. Fernandez et al. ont examiné l'état de l'épithélium cornéen par examen à la lampe à fente le lendemain de la chirurgie de la cataracte sous lévobupivacaïne ou lidocaïne topique. Ils ont trouvé de légers changements épithéliaux chez 17 à 22 % des patients et des signes de lésions épithéliales importantes (ponctués) chez 2.4 à 5.8 %, respectivement ; cependant, aucune donnée n'a été fournie sur comment, quand ou si ces changements ont été résolus.
Néanmoins, à ce jour, aucun cas de kératopathie sévère associée à l'administration systématique d'une anesthésie topique pour chirurgie oculaire n'a été rapporté. La rareté relative actuelle des données cliniques concrètes peut en partie expliquer la diversité des pratiques à travers les continents, car les praticiens peuvent interpréter les données disponibles pour affirmer leurs propres préférences. Compte tenu de la popularité croissante de la technique (en particulier aux États-Unis), on pourrait supposer que, comme pour la myotoxicité extraoculaire, tout effet cliniquement significatif est transitoire et peut être masqué et/ou attribué aux effets de la chirurgie pendant la convalescence.
ANESTHESIE SOUS-CONJONCTIVAL
L'injection sous-conjonctivale d'AL, technique peu connue de nombreux anesthésistes, permet une anesthésie du segment antérieur sans akinésie. Également connue sous le nom d'anesthésie «périlimbique», il s'agit en fait d'une forme d'injection épisclérale et peut également être considérée comme un bloc nerveux sous-tenon «très antérieur» ou «très superficiel». Ce bloc nerveux est utile pour la chirurgie de la cataracte, du ptérygion et du glaucome superficiel. Après un prétraitement avec une goutte d'anesthésique topique, une aiguille de calibre 27 à 30 est utilisée pour soulever la conjonctive supérotemporale ou inférotemporale à au moins 5 à 8 mm du limbe (Figure 13). Un microscope chirurgical ou des loupes peuvent être utilisés pour éviter les vaisseaux conjonctivaux et les hématomes. Une fois l'aiguille sous la conjonctive, 0.5 à 0.8 ml de solution anesthésique locale provoquera une chémosis, qui est dispersée avec une pression douce et constante, soit à l'aide des doigts, soit d'un poids ou d'un ballon à usage spécifique. L'hyaluronidase peut être ajoutée pour faciliter la propagation de la solution et la dispersion de la chémosis. Par rapport à l'injection rétrobulbaire, cette technique est moins douloureuse et réduit le besoin d'anesthésie supplémentaire lors de la chirurgie de la cataracte. L'injection au niveau de la conjonctive supérotemporale semble être moins douloureuse que l'injection au niveau de la conjonctive inférotemporale. L'injection sous-conjonctivale permet d'obtenir des concentrations fiables et substantielles d'anesthésique local dans l'humeur aqueuse.
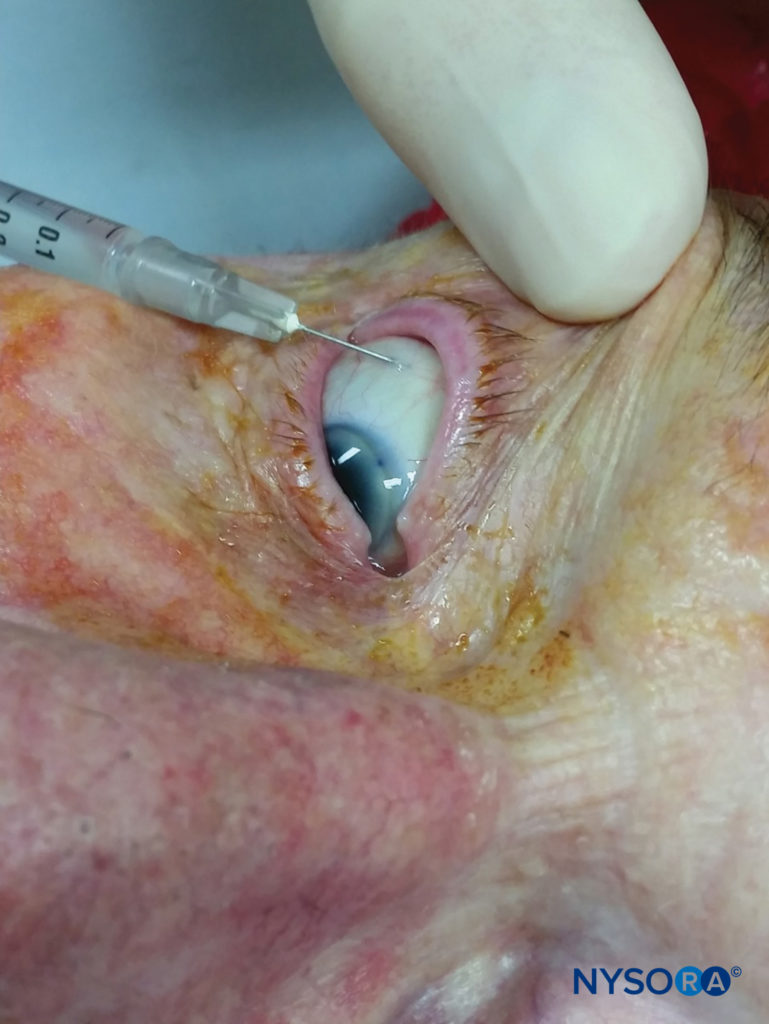
FIGURE 13. Bloc sous-conjonctival.
BLOCS NERVEUX OCULOPLASTIQUES
De nombreuses procédures oculoplastiques (Figure 14) peut être réalisée sous anesthésie locale. Cependant, étant donné l'innervation sensible du visage, ces blocs nerveux sont mieux réalisés sous une certaine forme de sédation profonde transitoire (par exemple, une petite dose IV de propofol), sauf chez le patient très stoïque. Notez également que, bien que le blocage ciblé de nerfs individuels soit utile, il existe souvent un chevauchement important de l'apport sensoriel. Selon le site et l'étendue de la plaie opératoire proposée, plus d'un type de bloc nerveux peut être nécessaire et une infiltration locale supplémentaire peut être nécessaire. La plupart des chirurgiens oculoplastiques y sont habitués.
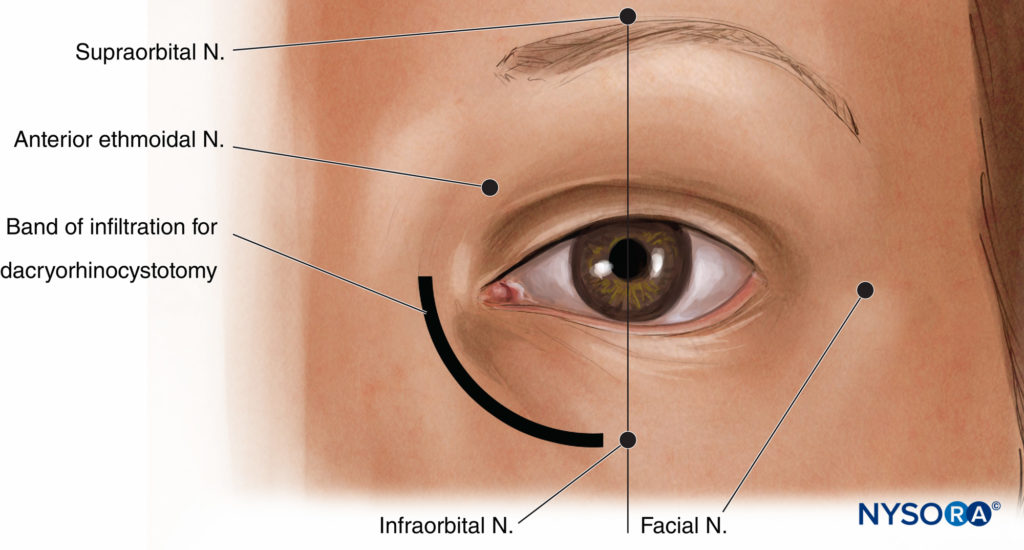
FIGURE 14. Repères pour les blocs nerveux oculoplastiques.
Blocs nerveux des paupières supérieures et inférieures
Des procédures telles que la blépharoplastie supérieure et inférieure et la réparation d'ectropion peuvent être réalisées sous une légère infiltration locale sous-cutanée de la base de la paupière opératoire. Certaines procédures nécessitent que le chirurgien retourne la paupière sous sédation profonde et s'infiltre en aval du pli semi-lunaire.
Bloc nerveux facial
Parfois, un bloc nerveux des branches périoculaires du nerf facial est nécessaire pour empêcher un clignement excessif pendant la chirurgie oculaire. Les approches classiques incluent les techniques Van Lint et O'Brien ; Atkinson a décrit une technique modifiée, dont les variantes sont probablement les plus populaires aujourd'hui. Une bulle d'anesthésique local est soulevée d'environ 2 à 3 cm latéralement au bord latéral de l'orbite au niveau du canthus latéral, qui se situe quelque part entre les emplacements des approches plus distales de Van Lint et plus proximales d'O'Brien. Deux rayons d'infiltration locale sont alors injectés en haut et en bas à partir de ce point formant un « V » qui attrape les fibres du nerf facial. Un total de 5 ml est généralement plus que suffisant.
Bloc nerveux supratrochléaire/supraorbitaire
Les blocs nerveux des nerfs supraorbitaire et supratrochléaire, branches du nerf ophtalmique, sont utiles pour les procédures impliquant la zone de la paupière supérieure immédiatement au niveau ou au-dessus du sourcil. L'encoche supraorbitaire peut généralement être ressentie à environ 2 à 3 cm de la ligne médiane le long de la partie médiale du bord supérieur de l'orbite, généralement alignée avec la pupille du patient. La paresthésie peut souvent être déclenchée en appuyant sur cette encoche. Un volume de 2 ml d'anesthésique local ici devrait fournir une certaine anesthésie à la zone immédiatement autour du sourcil, de la paupière supérieure et du front inférieur ; cependant, il est généralement également nécessaire de bloquer le nerf supratrochléaire en exécutant une bande médiale d'infiltration (2 à 3 ml supplémentaires) de l'encoche à la ligne médiane et environ 1 à 2 cm latéralement pour attraper les fibres supraorbitales latérales qui peuvent survenir à travers un foramen séparé.
Bloc nerveux infraorbitaire
Le nerf infraorbitaire, une branche majeure du nerf maxillaire, fournit la sensation à la paupière inférieure et au plancher de l'orbite. Il émerge sur le visage par le foramen sous-orbitaire, qui se trouve de manière fiable juste en dessous du rebord orbitaire inférieur, en ligne avec la pupille et l'encoche supraorbitaire. Un volume de 2 à 3 ml d'anesthésique local à ce stade est généralement plus que suffisant. Dans l'approche traditionnelle de ce bloc nerveux, l'aiguille est dirigée légèrement vers le haut pour s'aligner sur l'orientation du canal sous-orbitaire ; cependant, notez qu'au moins deux cas de pénétration de globe par inadvertance ont été signalés avec cette technique.
Bloc nerveux nasocilaire/infratrochléaire/ethmoïdal antérieur
Le nerf nasocilaire est une branche du nerf ophtalmique et fournit, via ses branches intratrochléaire et ethmoïdale antérieure, des sensations à la paroi médiale de l'orbite, au sac lacrymal proximal, au canal lacrymo-nasal proximal, à la muqueuse de la cavité nasale et à une grande partie de la peau du nez. Ce nerf est bloqué via une injection de 2 à 3 ml d'anesthésique local par une insertion verticale d'une aiguille de calibre fin parallèle à la paroi médiale de l'orbite approximativement au droit de l'arête du nez à une profondeur d'environ 25 mm. Cela correspond au foramen par lequel le nerf ethmoïdal antérieur sort de l'orbite. Il est important que l'aiguille descende librement jusqu'au point d'injection car la paroi orbitaire est fine à ce niveau et la perforation des sinus ethmoïdaux voire sphénoïdaux est tout à fait possible.
Anesthésie locale pour la chirurgie des canaux lacrymaux
L'anesthésie locale pour la dacryorhinocystostomie et d'autres procédures impliquant l'appareil lacrymal est possible en utilisant une combinaison d'anesthésie topique de la cavité nasale (pour les branches nasales des nerfs ethmoïde antérieur et postérieur, sphénopalatin et nasopalatin), un bloc nerveux nasociliaire, un nerf infraorbitaire bloc, et une courte bande d'infiltration sous-cutanée le long de la base du nez depuis le niveau du canthus médial jusqu'au niveau du foramen sous-orbitaire.
UTILISATION DU BLOC NERVEUX OCULAIRE POUR L'ANALGÉSIE POSTOPÉRATOIRE
L'anesthésie régionale, en particulier le bloc nerveux sous-ténonien, a été proposée comme traitement de la douleur postopératoire.122 Cependant, cela n'est pas nécessaire pour la chirurgie du segment antérieur, qui entraîne généralement peu ou pas d'inconfort postopératoire.
CONSEILS NYSORA
Douleur postopératoire
• Une douleur importante survenant après une chirurgie de la cataracte est inhabituelle et doit faire suspecter une augmentation de la pression intraoculaire, une inflammation sévère ou une infection ; l'œil doit être examiné par un ophtalmologiste.
• La douleur postopératoire est plus probable après une chirurgie du segment postérieur. L'utilisation d'un cathéter à demeure rétrobulbaire, péribulbaire ou sous-ténonien a été proposée pour améliorer l'anesthésie peropératoire, prolonger l'analgésie régionale postopératoire et traiter les douleurs oculaires réfractaires.
CHOIX DES AGENTS ANESTHÉSIQUES ET ADJUVANTS LOCAUX
Tous les AL disponibles ont été utilisés pour le bloc nerveux oculaire, seuls ou en combinaison de deux agents. Les AL injectés les plus utilisés sont la lidocaïne, la bupivacaïne, la ropivacaïne, la mépivacaïne ou une combinaison de deux d'entre elles. Le choix des LA doit être basé sur les propriétés pharmacologiques et la disponibilité des médicaments, la principale considération étant la nécessité d'un effet rapide (lidocaïne, mépivacaïne), d'un effet prolongé ou d'un bloc nerveux résiduel postopératoire pour l'analgésie (ropivacaïne, bupivacaïne) ou l'akinésie (concentration plus élevée). Étant donné que la quantité d'AL injectée est généralement faible (3 à 11 ml), la toxicité systémique n'est pas une préoccupation majeure.
Septocaïne (articaïne) est un AL de type amide relativement nouveau, couramment utilisé en dentisterie, avec une utilisation émergente dans les blocs nerveux oculaires. Il a un début plus rapide que les préparations de bupivacaïne/lidocaïne dans les blocs nerveux péribulbaires et sous-ténoniens et, parce qu'il semble se diffuser à travers les tissus plus facilement que les autres LA, entraîne souvent un bloc nerveux plus dense. Il ne semble pas y avoir d'avantage clinique à 4 % par rapport à 2 % d'articaïne, du moins en anesthésie dentaire. Malgré les inquiétudes concernant son potentiel neurotoxique dans les études animales, il ne semble pas y avoir de preuve concluante qu'il soit plus toxique que d'autres AL à haute concentration.
Hyaluronidase est une enzyme qui a été largement utilisée pour faciliter la propagation de l'anesthésique local à travers le tissu conjonctif, améliorant ainsi à la fois le début et le taux de réussite de l'anesthésie régionale pour l'œil. Un autre avantage est une incidence réduite de strabisme postopératoire lié à son utilisation, éventuellement en limitant la myotoxicité LA en raison de sa propagation plus rapide.
Certains auteurs sont moins confiants quant au bénéfice réel de la hyaluronidase dans l'amélioration de l'akinésie. Il existe également des inquiétudes importantes quant à son potentiel allergène; cependant, ceux-ci peuvent être dus aux impuretés intrinsèques à la hyaluronidase traditionnelle d'origine animale ; les nouveaux produits recombinants humains se sont avérés non seulement plus puissants, mais également plus purs enzymatiquement et pratiquement exempts de réactions d'hypersensibilité. Il semblerait que, à mesure que l'exigence d'akinésie se relâche, les adjuvants tels que la hyaluronidase deviennent moins populaires. Néanmoins, dans les situations où l'akinésie est requise, l'hyaluronidase peut encore avoir un rôle important.
Les agonistes α2-adrénergiques sont bien connus des ophtalmologistes en tant qu'agents topiques qui réduisent la pression intraoculaire dans le glaucome.
Clonidine Il a été démontré qu'il améliore l'anesthésie peropératoire et l'analgésie postopératoire lorsqu'il est ajouté à l'AL dans une gamme de blocs nerveux oculaires. À une dose de 1 mcg/kg, la clonidine n'augmente pas l'incidence des événements indésirables systémiques tels que l'hypotension ou la sédation excessive. De plus, cela peut aider à prévenir l'hypertension artérielle peropératoire et à réduire la pression intraoculaire. Dexmedetomidine, un agoniste α2 plus sélectif, est de plus en plus utilisé comme adjuvant efficace dans les blocs nerveux périphériques, y compris le bloc nerveux sous-ténonien. Il a été proposé que l'ajout d'agonistes α2 puisse permettre une anesthésie chirurgicale à des concentrations plus faibles d'AL, limitant ainsi
Myotoxicité induite par LA. Il convient de noter que toutes les études sur les adjuvants α2 à ce jour ont été de puissance relativement faible et, bien qu'il s'agisse d'un domaine d'étude prometteur, des tailles d'échantillons considérablement plus élevées sont nécessaires. L'épinéphrine est parfois utilisé pour augmenter la durée du bloc nerveux oculaire. Cependant, la disponibilité des AL à longue durée d'action et la crainte d'un vasospasme avec une ischémie rétinienne ultérieure ont réduit son utilisation. Le « wipe-out » (perte totale et soudaine de la vue non manifestement liée à une pathologie oculaire) est un risque rare mais grave, en particulier chez les patients atteints de glaucome. Les solutions LA contenant de l'épinéphrine ont été impliquées comme facteur contributif.
Alcalinisation de solutions anesthésiques locales ont été proposées pour diminuer la douleur lors de l'injection et accélérer l'apparition du bloc nerveux ; cependant, son efficacité reste non prouvée. D'autres agents adjuvants ont été proposés mais n'ont pas gagné en popularité. De petites doses d'un relaxant musculaire peuvent augmenter l'akinésie, mais des inquiétudes ont été exprimées quant à leur risque potentiel d'effets systémiques.
Les opioïdes ne semblent pas plus efficaces par voie ophtalmique régionale que par voie systémique.
Le réchauffement de l'AL peut diminuer la douleur lors de l'injection et améliorer l'efficacité du bloc nerveux, bien que ces avantages ne semblent pas cliniquement pertinents.
QUI DEVRAIT EFFECTUER DES BLOCAGES NERVEUX OCULAIRES ?
Depuis les années 1980, les anesthésistes sont de plus en plus impliqués dans les blocs nerveux oculaires qui étaient auparavant pratiqués par des chirurgiens. Cependant, dans certains pays, les anesthésistes ne sont pas disponibles et les chirurgiens doivent gérer eux-mêmes le bloc nerveux. Dans d'autres pays, les anesthésistes ne surveillent que les soins d'anesthésie, car le chirurgien effectue le bloc nerveux. Dans de nombreux pays développés (par exemple, la France et l'Australie), les anesthésistes sont souvent responsables de l'administration de blocs nerveux oculaires. La même chose était vraie au Royaume-Uni; cependant, les récentes contraintes de coût ont obligé les gestionnaires à reconsidérer le rôle de l'anesthésiste dans les procédures ophtalmiques électives qui ne nécessitent pas d'anesthésie générale. Il n'existe actuellement aucune donnée concrète pour étayer ou réfuter l'idée selon laquelle il est plus sûr pour cette population de patients que l'anesthésiste effectue des blocs nerveux oculaires, plutôt que le chirurgien, ou même que l'anesthésiste soit présent. Cependant, la littérature disponible suggère qu'avec une formation appropriée, les anesthésiologistes peuvent effectuer des blocs nerveux oculaires avec le même degré de sécurité que dans d'autres techniques d'anesthésie régionale. Avoir une personne expérimentée effectuant des blocs nerveux pendant qu'une autre opère est plus rapide, et il y a un avantage théorique à avoir une personne qualifiée en réanimation présente dans le cas peu probable d'une complication potentiellement mortelle (qui, sans surprise, se matérialise en un avantage réel chaque fois que une telle complication se produit).
PRISE EN CHARGE PÉRIOPÉRATOIRE DES PATIENTS SUBISSANT UN BLOC NERVEUX OCULAIRE
Sélection et évaluation des patients
Les patients âgés subissant une chirurgie oculaire ont fréquemment des maladies coexistantes telles que le diabète sucré, l'hypertension, la maladie coronarienne ou l'insuffisance cardiaque. Une évaluation préopératoire doit être effectuée systématiquement pour s'assurer que les conditions médicales coexistantes sont raisonnablement bien contrôlées. Malgré la faible morbidité et mortalité associées à l'anesthésie ophtalmique locale, les patients doivent être soigneusement sélectionnés pour leur éligibilité à la chirurgie. Les patients atteints de cyphose ou de scoliose sévère posent des problèmes pratiques évidents pour la chirurgie microscopique. Les patients qui peuvent ne pas être en mesure de rester allongés pendant la période requise, en raison d'une insuffisance cardiaque ou respiratoire, d'une maladie neurologique ou de démence, sont également difficiles. Une fois drapés, les patients atteints de surdité profonde peuvent être incapables de répondre aux commandes peropératoires à moins d'être soigneusement informés avant l'opération.
Informer les patients
Compte tenu des problèmes potentiels d'une sédation excessive (voir ci-dessous), un briefing préopératoire empathique et interactif est un outil utile à la fois pour réduire l'anxiété et optimiser la coopération pendant la chirurgie oculaire. Les patients doivent recevoir une explication claire de ce qui leur sera fait, de ce qu'ils sont susceptibles de vivre et de ce qu'on peut leur demander de faire pendant l'opération, dans un langage adapté à leur niveau de compréhension.
Le Monitoring
La surveillance peropératoire doit inclure une surveillance de base (c.-à-d. électrocardiogramme, oxymétrie de pouls et mesure automatisée non invasive de la pression artérielle). L'accès intravasculaire est nécessaire pour toute technique d'anesthésie invasive.
Sédation
La chirurgie oculaire (p. ex., chirurgie de la cataracte) comporte un faible risque de morbidité et de mortalité périopératoires. Le bloc nerveux oculaire est associé à une morbidité périopératoire plus faible que l'anesthésie générale utilisée pour la chirurgie ophtalmique, à condition d'éviter une sédation lourde. L'anxiété et la douleur résiduelle surviennent fréquemment lors d'une chirurgie oculaire sous AL. Une immobilité parfaite est requise, et la présence de champs sur la tête augmente l'anxiété du patient et gêne l'accès aux voies respiratoires. Le patient doit être installé aussi confortablement que possible, avec un espace suffisant pour permettre une respiration libre. Une sédation peropératoire avec des doses judicieuses de sédatifs peut être utilisée pour limiter l'anxiété et la douleur. Cependant, un excès de sédation peut entraîner une agitation, un sommeil, des ronflements ou une dépression respiratoire, qui, en l'absence de tout accès aux voies respiratoires, posent un défi peropératoire important. Le maintien d'un contact significatif avec le patient est d'une importance primordiale pour éviter les catastrophes qui peuvent survenir avec des patients désorientés ou combatifs pendant la chirurgie.
Un autre phénomène intéressant et dangereux associé aux blocs nerveux à l'aiguille ophtalmique réalisés sous sédation au propofol est l'éternuement involontaire, qui peut survenir chez jusqu'à un cinquième des patients pendant l'injection ; cette réaction menace la vue, car elle peut entraîner une perforation accidentelle du globe. Il est plus susceptible de survenir chez les patients de sexe masculin qui ont des antécédents d'éternuements photiques (éternuements avec exposition soudaine à une lumière vive ou au soleil), qui sont sous sédation plus profonde ou qui reçoivent simultanément du midazolam. Il ne semble pas se produire chez les patients subissant des blocs nerveux avec sédation au rémifentanil ou sans sédation du tout. La sensibilisation à ce phénomène devrait mieux préparer les opérateurs à retirer immédiatement l'aiguille du bloc nerveux si un éternuement est imminent et éventuellement à reconsidérer leur pratique actuelle de sédation. La dexmédétomidine, un α-agoniste hautement sélectif, gagne en popularité en tant qu'agent sédatif dans divers contextes cliniques, y compris la chirurgie oculaire.
Les patients subissant un bloc nerveux oculaire doivent-ils jeûner ?
Les pratiques de jeûne pour les patients ayant des procédures sous bloc nerveux topique, local ou régional ont connu une évolution ces dernières années. Dans la machine complexe de la pratique médicale du secteur public, la doctrine bien intentionnée et traditionnelle « NPO à partir de minuit » conduit souvent les patients à jeûner bien au-delà de 12 heures. En plus d'une probabilité accrue de nausées et de vomissements postopératoires, un jeûne prolongé de manière inappropriée peut causer de l'inconfort et de la détresse, ainsi qu'une déshydratation et des troubles métaboliques, qui peuvent tous rendre les patients (en particulier les enfants et les personnes âgées) agités et peu coopératifs. De plus, s'il existe un cas théorique évident de jeûne avant toute intervention chirurgicale, aucun cas d'aspiration sous anesthésie locale n'a été rapporté lors d'opérations de la cataracte. L'opinion commune des collèges savants du Royaume-Uni est que le jeûne n'est généralement pas requis pour les patients subissant une chirurgie oculaire sans sédation. De plus, au moins un centre d'ophtalmologie expérimenté a réalisé des blocs nerveux sous des «doses judicieuses» (0.5 à 2 mg) de midazolam IV chez plus de 5000 XNUMX patients non jeûnés sans incident fâcheux. Néanmoins, lorsqu'il est prévu qu'une sédation profonde ou une anesthésie générale, même brève, sera nécessaire soit pour effectuer le bloc nerveux, soit pendant l'opération, le jeûne préopératoire standard reste une condition préalable raisonnable et, le cas échéant, des mesures systémiques doivent être explorées pour minimiser les jeûnes prolongés de manière inappropriée. Là où le jeûne n'est pas systématiquement requis, une petite proportion de patients problématiques se présenteront pour une intervention chirurgicale sans jeûner mais pour lesquels le besoin d'une sédation profonde devient évident une fois qu'ils sont dans la salle d'opération. Les institutions individuelles doivent vérifier la prévalence de ce phénomène et prendre en conséquence des décisions en matière de coûts et de risques-avantages. Un briefing préopératoire complet et compatissant pour le patient peut jouer un rôle important dans la minimisation de ce problème.
L'accès intraveineux est-il nécessaire chez les patients subissant un bloc nerveux oculaire ?
Au cours des dernières années, de nombreux centres, en particulier ceux qui effectuent des interventions oculaires en cabinet, ont abandonné l'exigence traditionnelle de sécuriser l'accès intraveineux pour toutes les interventions chirurgicales, à condition que les interventions soient effectuées sous anesthésie « sans aiguille » (c.-à-d. anesthésie topique ou nerf sous-ténonien bloquer). Selon une déclaration conjointe du Royal College of Anesthetists et du Royal College of Ophthalmologists au Royaume-Uni, "l'accès intraveineux ... est essentiel avec les blocs nerveux péribulbaires et rétrobulbaires et lorsqu'une sédation peropératoire est utilisée" et "recommandé pour les cas longs / complexes, sous - Blocs nerveux de Tenon et patients en mauvaise santé générale. À cet égard, l'auteur est d'accord avec Guise pour faire les observations suivantes : (1) la sédation peut parfois être requise à très court terme par les patients, même sous anesthésie topique, et l'accès IV préalable rend la sédation opportune plus facile et moins stressante ; (2) des réactions vasovagales et d'autres réactions dysrythmiques, bien que rares, peuvent également survenir, auquel cas l'accès intraveineux déjà in situ est bénéfique à la fois pour le patient et le réanimateur ; et (3) c'est une précaution clinique prudente, et aucun problème réel, si une personne expérimentée dans la canulation IV (comme un anesthésiste) est présente.
Blocs nerveux oculaires et patient anticoagulé
Traditionnellement, les anesthésiologistes prenaient souvent une décision fondée sur une formule quant à l'opportunité d'effectuer un bloc nerveux régional ophtalmique (qui était généralement un bloc nerveux rétrobulbaire ou péribulbaire) sur la base des résultats d'un profil de coagulation sanguine et en nommant un seuil arbitraire (p. ex., un rapport international normalisé [INR] de 1.5 à 2.0 ou une numération plaquettaire de 50 à 100). De nos jours, cependant, il existe non seulement une diversité de thérapies anticoagulantes (dont plusieurs défient une évaluation facile), mais aussi une gamme d'options de gestion anesthésique. De plus, les risques d'arrêt du traitement anticoagulant chez certains patients peuvent l'emporter sur les risques de saignement périopératoire en cas d'anticoagulation complète. Par conséquent, il n'y a pas d'algorithme clair pour gérer les « patients subissant une chirurgie oculaire qui sont sous anticoagulants ». Il est préférable de prendre une décision équilibrée entre les avantages et les risques dans chaque cas en fonction d'un certain nombre de questions fondamentales :
• Quel(s) anticogulant(s) le patient prend-il ? Une variété d'agents sont maintenant disponibles. Bien qu'il existe des stratégies de gestion établies pour des médicaments tels que la warfarine et l'héparine, les stratégies pour d'autres sont moins simples.
Le dabigatran, par exemple, est un nouvel anticoagulant oral à action prolongée sans antidote direct. La prise en charge périopératoire des saignements potentiels chez les patients prenant ce médicament est actuellement un sujet de grande préoccupation, y compris ceux qui subissent une chirurgie oculaire. Puisqu'il n'existe actuellement aucune donnée sur les patients sous dabigatran subissant un bloc nerveux oculaire, y compris le bloc nerveux sous-ténonien, les recommandations actuelles sont de suspendre le médicament pendant deux à cinq jours avant d'effectuer le bloc nerveux et la chirurgie.
• Pourquoi le patient est-il sous anticoagulation ? Parfois, les patients prennent eux-mêmes de l'aspirine (par exemple, parce qu'ils en ont lu dans un magazine). Il est courant que les patients soient traités par warfarine pour une fibrillation auriculaire aiguë qui régresse spontanément. De telles situations permettent d'envisager plus facilement de suspendre le médicament plutôt que de choisir de ne pas effectuer le bloc nerveux.
• Le patient fait-il partie d'un groupe à haut risque (p. ex., avec des antécédents documentés de thromboembolie) ? Souvent, il n'y a pas seulement une indication clinique claire d'anticoagulation, mais aussi une nette augmentation du risque si l'anticoagulation périopératoire n'est pas correctement gérée, et donc un impératif plus important d'utiliser une technique qui ne nécessite pas de modifier le traitement anticoagulant du patient. En cas de doute, consultez l'équipe médicale qui a mis le patient sous traitement anticoagulant.
• Quels sont les risques hémorragiques relatifs de l'intervention proposée ? Ici, l'équipe doit tenir compte à la fois des procédures chirurgicales et anesthésiques. Les chirurgies oculoplastiques et du glaucome ont tendance à comporter un risque de saignement plus élevé, alors que la plupart des procédures de PhE et vitréorétiniennes peuvent être effectuées sous anticoagulation complète (toutefois, discutez des cas individuels avec le chirurgien, car la décision lui appartient en dernier ressort).
Généralement, les blocs nerveux topiques, sous-conjonctivaux et sous-ténoniens sont considérés comme à faible risque, et les preuves limitées à ce jour soutiennent l'utilisation de ces techniques sans modifier le traitement anticoagulant de routine du patient. Des études de faible puissance suggèrent que, si les complications hémorragiques mineures telles que l'hématome sous-conjonctival sont plus fréquentes avec les blocs nerveux sous-ténoniens pratiqués chez les patients sous aspirine, warfarine ou clopidogrel, les complications majeures telles que les saignements menaçant la vue ne le sont pas. Les blocs nerveux rétrobulbaires et péribulbaires sont considérés comme à haut risque.
• Quelles sont les exigences chirurgicales pour l'anesthésie? Lorsque l'akinésie n'est pas nécessaire pour la chirurgie du segment antérieur, les techniques topiques ou sous-conjonctivales sont plus attrayantes. Si une anesthésie et/ou une akinésie du segment postérieur sont nécessaires et qu'il n'y a pas d'autres contre-indications, le bloc nerveux sous-ténonien est désormais considéré comme l'option la plus sûre.
• S'agit-il d'un cas électif ou d'une véritable urgence ? Lorsqu'il est temps d'adopter une approche plus progressive qui évite l'utilisation d'antidotes et d'agents prothrombotiques, cette opportunité doit être saisie.
Travailler avec des chirurgiens à haut volume
La gestion sûre et efficace d'une liste de cataractes à rotation élevée (20 patients ou plus par jour) est à la fois une science et une forme d'art nécessitant non seulement des compétences techniques individuelles consommées, mais également de bonnes compétences en matière de travail d'équipe et de communication, ainsi qu'une attention aux détails ergonomiques. Un bon chirurgien inclura tous les membres de son équipe opératoire dans la planification et l'exécution de la liste. Le rôle de l'anesthésiste est de soutenir l'équipe à la fois techniquement et avec tact, en surveillant l'ensemble de l'équipe et en signalant quand l'équipe devrait ralentir ou même s'arrêter. La standardisation dans la mesure du possible - de l'attribution des rôles et du positionnement du chariot patient au vocabulaire utilisé pour décrire l'équipement et les procédures - aide à rationaliser les activités et à rendre les écarts par rapport à la routine plus saillants. L'utilisation d'une liste de contrôle de sécurité chirurgicale modifiée de l'Organisation mondiale de la santé (OMS) dans un théâtre oculaire à rythme rapide peut également aider à détecter les anomalies et à réduire les erreurs. Des commentaires et des discussions réguliers sur les performances individuelles et d'équipe contribuent à promouvoir le kaizen : l'approximation de la perfection par de petites améliorations continues et progressives au fil du temps.
RÉSUMÉ
Dans les pays développés, la chirurgie oculaire fait partie des actes chirurgicaux nécessitant une anesthésie les plus pratiqués.
Au cours des 20 dernières années, les anesthésistes ont assumé un rôle croissant dans la réalisation de blocs nerveux oculaires. La nécessité d'un bloc nerveux anesthésique profond avec akinésie totale a été considérablement réduite grâce à l'utilisation de la PhE pour la chirurgie de la cataracte, donnant un rôle plus important à l'anesthésie topique.
Aiguille Les blocs nerveux comportent un risque faible mais réel de complications graves, principalement dues au mauvais placement de l'aiguille. La formation et la pratique sont nécessaires pour minimiser ces problèmes. L'utilisation du bloc nerveux sous-ténonien réduit les risques de blocs nerveux à l'aiguille et est maintenant une technique établie et populaire, bien qu'elle ne prévienne pas complètement les complications. La bonne technique d'anesthésie dépend des compétences, de l'expérience et de la compréhension de l'intervention chirurgicale de l'anesthésiste et des préférences de chaque chirurgien.
Conseils du Compendium d'anesthésie régionale
- Une immobilité parfaite est requise. Par conséquent, le patient doit être installé aussi confortablement que possible, avec un espace suffisant pour permettre une respiration libre.
- Une sédation peropératoire avec des doses judicieuses de sédatifs peut être utilisée pour limiter l'anxiété et la douleur. Cependant, un excès de sédation peut entraîner une agitation, un sommeil, des ronflements ou une dépression respiratoire, qui, en l'absence de tout accès aux voies respiratoires, posent un défi peropératoire important.
- Le maintien d'un contact significatif avec le patient est de la plus haute importance pour éviter les catastrophes qui peuvent survenir avec des patients désorientés ou combatifs.
- Le jeûne n'est généralement pas requis pour les patients subissant une chirurgie oculaire sans sédation. Néanmoins, le jeûne préopératoire standard reste un pré-requis lorsqu'il est prévu qu'une sédation profonde ou une anesthésie générale, même brève, sera nécessaire (soit pour réaliser le bloc, soit au cours de l'intervention).
- Les chirurgies oculoplastiques et du glaucome ont tendance à comporter un risque hémorragique plus élevé, alors que la plupart des procédures de phacoémulsification et vitréorétiniennes peuvent être réalisées sous anticoagulation complète (toutefois, discutez des cas individuels avec le chirurgien).
- Les blocs topiques, sous-conjonctivaux et sous-ténoniens ont un faible risque hémorragique, tandis que les blocs rétrobulbaires et péribulbaires sont considérés comme à haut risque.
ANNEXE : LE RÉFLEXE OCULOCARDIAQUE
Le réflexe oculocardiaque, décrit pour la première fois en 1908 ; est une diminution de la fréquence cardiaque de plus de 20 % en dessous des valeurs de base souvent observée lors de la traction sur les muscles extrinsèques de l'œil, en particulier lors d'une chirurgie du strabisme. Cependant, il peut également survenir lors de l'administration de blocs nerveux oculaires, en particulier de bloc nerveux rétrobulbaire.
D'autres déclencheurs comprennent un traumatisme oculaire, un hématome intraorbitaire, un glaucome aigu, une augmentation soudaine de la pression intraoculaire, un étirement des muscles des paupières et de la conjonctive. Chez les sujets non préparés, la bradycardie peut être assez dramatique, et parfois entraîner une asystole chez le patient (et une tachycardie chez l'anesthésiste), qui dure aussi longtemps que la stimulation déclenchante est appliquée. Bien que le ralentissement sinusal du cœur soit classique, toute arythmie, y compris la fibrillation ventriculaire, peut survenir.
Le réflexe est exagéré chez les enfants (jusqu'à 90 % sans prétraitement) et en présence d'hypoventilation, d'hypoxémie et d'acidose.
L'arc réflexe a été bien décrit (Figure 15), le membre afférent composé des branches longues et courtes des nerfs ciliaires, du nerf ophtalmique, du ganglion géniculé et du noyau sensoriel principal du nerf trijumeau. De courtes fibres internonciales transmettent ensuite le réflexe au membre efférent, constitué du noyau moteur du nerf vague, du nerf vague et du nerf dépresseur cardiaque. Le réflexe oculocardiaque est une variante spécifique du réflexe trigéminocardiaque, une constellation plus large de réactions médiées par le tronc cérébral - bradycardie, transpiration, apnée, bâillement, éternuements, etc. - déclenchées par la stimulation de l'une des branches sensorielles du nerf trijumeau ( principalement le nerf ophtalmique).
Le meilleur traitement chez l'enfant est la prophylaxie : atropine IV 10–20 mcg/kg ou glycopyrrolate 5–10 mcg/kg à l'induction. Les agents intramusculaires sont moins utiles en raison de leur apparition tardive. La prophylaxie chez les adultes n'est généralement pas indiquée; cependant, il est prudent d'avoir un anticholinergique IV pré-tiré et disponible.
Le traitement aigu consiste à supprimer le stimulus : demander au chirurgien d'arrêter ce qu'il est en train de faire. Si le pouls ne s'améliore pas, donner un anticholinergique (p. ex., atropine IV 5–10 mcg/kg ou glycopyrrolate 2.5–5 mcg/kg). Vérifier la profondeur de l'anesthésie en cas d'AG.
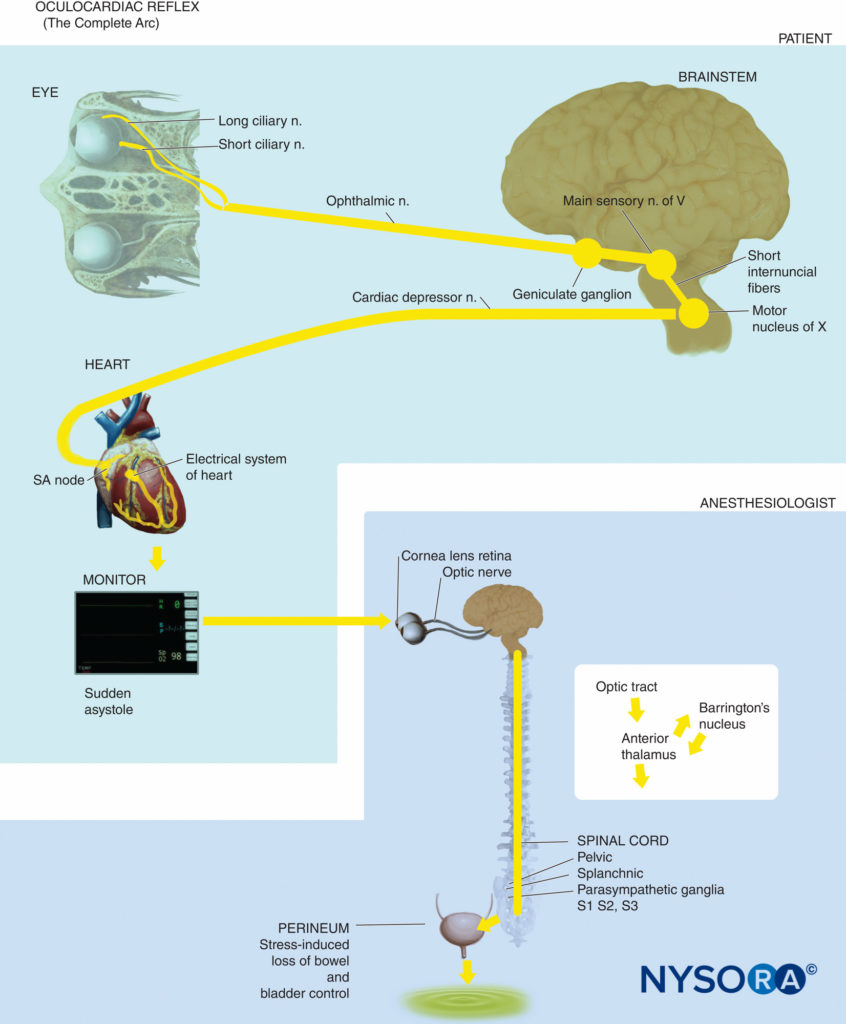
FIGURE 15. Arc réflexe oculocardiaque.
Remerciements
L'auteur tient à remercier Jacques Ripart, Kenneth Mehbridge et Robert Della Rocca pour leur première édition de ce chapitre et sans qui cette révision n'aurait pas été possible. Merci avec une profonde gratitude également à Keith Allman, Tom Eke, Phil Guise et Chandra Kumar, qui ont tous consacré beaucoup de temps et d'efforts pour offrir des suggestions inestimables et des références supplémentaires.
*Sources : Aschner B. Ueber einen bisher noch nicht beschrieben Reflex vom Auge auf kreislauf et Atmung. Verschwinden des Radialpulsen bei Druck aut des auge. Wiener Klinische Wochenschrift 1908;21:1529–1530; Dagnini G. Intemo ad un riflesso provocato in alcuni emiplegici collo stimolo della come e colla pressione sul bulbo oculare. Bull Sci Med 1908;8:380–381.
Lire la suite Blocs nerveux du visage
Références
- Apprentissage DV : Styles de pratique et préférences des membres de l'ASCRS — enquête 2003. J Cataract Refract Surg 2004;30:892–900.
- Gild WM, Posner KL, Caplan RA, et al : lésions oculaires associées à l'anesthésie. Une analyse des réclamations fermées. Anesthésiologie 1992 ; 76 : 204–208.
- Quigley HA : Mortalité associée à la chirurgie ophtalmique : Une expérience de 20 ans à l'Institut Wilmer. Am J Ophthalmol 1974;77:517–524.
- Breslin PP : Mortalité en chirurgie ophtalmique. Int Ophthalmol Clin 1973; 13:215–226.
- McKibbin M: L'évaluation préopératoire et l'investigation des patients ophtalmiques. Oeil 1996;10:138–140.
- Bass EB, Steinberg EP, Luthra R : Les ophtalmologistes, les anesthésiologistes et les internistes sont-ils d'accord sur les tests préopératoires chez les patients en bonne santé subissant une chirurgie de la cataracte ? Arch Ophthalmol 1995;113:1248–1256.
- Maltzman BA, Cinotti AA, Calderone JP Jr : Évaluation préadmission et chirurgie élective de la cataracte. J Med Soc NJ 1981;78:519–520.
- Gilvarry A, Eustace P : Le profil médical des patients atteints de cataracte. Trans Ophthalmol Soc UK 1982;102:502–504.
- Fisher SJ, Cunningham RD : Le profil médical des patients atteints de cataracte. Clin Geriatr Med 1985;1:339–344.
- Hardesty DC : Le patient en chirurgie ophtalmique. Dans Wolfsthal S (éd.): Gestion périopératoire médicale. Norwalk, Connecticut : Appleton & Lange,
1989, p. 417–426. - Hodgkins P, Luff A, Morrell A : Pratique actuelle de l'extraction de la cataracte et de l'anesthésie. Br J Ophthalmol 1992;76:323–326.
- Hamilton R, Gimble H, Strunin L : Anesthésie régionale pour 12,000 1988 procédures d'extraction de la cataracte et d'implantation de lentilles intraoculaires. J Can Anaesth 35;615:623–XNUMX.
- Eke T, Thompson J : L'enquête nationale sur l'anesthésie locale pour la chirurgie oculaire. II. Méthodologie d'enquête et pratique actuelle. Oeil 1999;13 : 196–204.
- Eichel R, Goldberg I: Techniques d'anesthésie pour la chirurgie de la cataracte: une enquête auprès des délégués au Congrès du Conseil international d'ophtalmologie, 2002. Clin Exp Ophth 2005;33:469–472
- Thampy R, Hariprasad M, Saha B : Anesthésie locale pour la chirurgie ophtalmique : une enquête multicentrique sur la pratique actuelle parmi les anesthésistes du Nord-Ouest. Anesthésie 2007 ; 62 : 101–103.
- Vohra SB, Murray PI : bloc du sous-tenon. une enquête nationale au Royaume-Uni. Ophth Surg Lasers Imag 2008;39:379–385.
- Leaming DV, Duffey R : Faits saillants de l'enquête 2008 sur le style de pratique des membres de l'ASCRS. http://ascrs2009.abstractsnet.com/handouts/000101_Highlights_of_the_2008_ASCRS_member_practice_style.ppt. Consulté le 29 juin 2013.
- Leaming DV: Enquêtes auprès des membres de l'American Society of Cataract and Refractive Surgery 1999–2012. www.analeyz.com. Consulté le 29 juin 2013.
- Williams PL (éd.) : Gray's Anatomy, 38e éd. Londres : Churchill Livingstone, 1995 ; passim mais esp. pp 1225–1241, 1321–1366.
- Ropo A, Nikki P, Ruusuvaara P, et al : comparaison des injections rétrobulbaires et périoculaires de lidocaïne par tomographie informatisée. Br J Ophthalmol 1991;75:417–420.
- Koornneef L : L'architecture de l'appareil musculo-fibreux dans l'orbite humaine. Acta Morphol Neerl Scand 1977;15:35–64.
- Koornneef L : Détails du système de tissu conjonctif orbitaire chez l'adulte. Acta Morphol Neerl Scand 1977;15:1–34.
- Ripart J, Lefrant J, de La Coussaye J, et al : Anesthésie péribulbaire versus rétrobulbaire pour la chirurgie ophtalmique. Une comparaison anatomique des injections extraconales et intraconales. Anesthésiologie 2001 ; 94 : 56–62.
- Edward DP, Kaufmann LM : Anatomie, développement et pathologie du système visuel. Pedatr Clin North Am 2003 ; 50 : 1–23.
- Bloomberg L : Administration de l'anesthésie périoculaire. J Cataract Refract Surg 1986;12:677–679.
- Davis D, Mandel M : Anesthésie péribulbaire postérieure : une alternative à l'anesthésie rétrobulbaire. J Cataract Refract Surg 1986;12:182–184.
- Spaeth GL, Danesh-Meyer H, Goldberg I, Kampik, A (éd.) : Chirurgie ophtalmique : Principes et pratique, 4e éd. Amsterdam, Pays-Bas : Elsevier, 2012.
- Ortiz M, Blanco D, Serra J, Vidal F : Anesthésie péribulbaire : le rôle des volumes d'anesthésie locale et de la thiomucase dans le bloc moteur et la pression intraoculaire. Eur J Anaesthesiol 1995;12:603–607.
- Wong DH : Anesthésie régionale pour chirurgie intraoculaire. Can J Anaesth 1993;40:635–657.
- Rowley SA, Hale JE, Finlay RD : Anesthésie locale sous-ténonienne : l'effet de la hyaluronidase. Br J Ophthmalmol 2000;84:435–436.
- Aziz ES, Rageh M: Bloc nerveux topique profond du fornix par rapport au bloc péribulbaire dans la chirurgie du strabisme horizontal à suture ajustable en une étape. Br J Anaesth 2002;88:129–132.
- Scott IU, McCabe CM, Flynn HW : Anesthésie locale avec sédation intraveineuse pour la réparation chirurgicale de certaines blessures à globe ouvert. Am J Ophthalmol 2002;134:707–711.
- Amadasun FE, Isele TO : Extrusion de l'humeur vitrée après induction d'une anesthésie au suxaméthonium chez un patient polytraumatisé : à propos d'un cas. Case Rep Med 2010;2010:913763.
- Ripart J, Prat-Pradal D, Charavel P, et al : Imagerie anatomique de l'anesthésie épisclérale (sous-Tenon) à injection unique du canthus médial. Clin Anat 1998;11:390–395.
- Ripart J, Metge L, Prat-Pradal D, et coll. Anesth Analg 1998;87:43–45.
- Ripart J, Lefrant JY, Vivien B, et al : Anesthésie régionale ophtalmique : l'anesthésie épisclérale (sous-tenon) du canthus médial est plus efficace que l'anesthésie péribulbaire : une étude randomisée en double aveugle. Anesthésiologie
2000; 92: 1278-1285. - Li H, Abouleish A, Grady J, et al : injection sous-ténonienne pour l'anesthésie locale dans la chirurgie du segment postérieur. Ophtalmologie 2000 ;107 : 41–47.
- Mein C, Flynn HW : Augmentation de l'anesthésie locale pendant la chirurgie du décollement de la rétine [lettre]. Arch Ophthalmol 1989;107:1084.
- Stevens JD : Une nouvelle technique d'anesthésie locale pour l'extraction de la cataracte par infiltration d'un quadrant sous-ténonien. Br J Ophthalmol 1992;76 : 670–674.
- MacNeela BJ, Kumar CM : bloc sous-ténonien à l'aide d'une canule ultracourte. J Cataract Refract Surg 2004;30:858–862.
- Kumar CM, Mac Neela BJ : Localisation par ultrasons des fluides anesthésiques à l'aide de canules sous-ténoniennes de trois longueurs différentes. Oeil 2003 ; 17 : 1–5.
- Guise P : Anesthésie sous-ténonienne : une étude prospective de 6000 blocs. Anesthésiologie 2003;98:964–968.
- Heatley CJ, Marshall J, Toma M : « Une victime de thrips aux yeux », une complication inhabituelle de l'anesthésie sous-ténonienne. Oeil 2006;20:738–739.
- Costen MT, Bolton K, Boase DL : Lash corps étranger compliquant l'anesthésie sous-ténonienne. Oeil 2004;18:192–193.
- Allman KG, Theron AD, Bayles DB : Une nouvelle technique d'anesthésie sous-ténonienne mini-invasive sans incision. Anesthésie 2008 ;63 : 782–783.
- Nouvellon E, L'Hermite J, Chaumeron A, et al: Anesthésie sous-ténonienne à injection unique du canthus médial: une expérience de 2000 cas. Anesthésiologie 2004 ; 100 : 370–374.
- Guise P : Anesthésie sous-ténonienne : mise à jour. Local Reg Anesth 2012;5 : 35–46.
- Ciulla TA, Starr MB, Masket S : Prophylaxie de l'endophtalmie bactérienne pour la chirurgie de la cataracte : une mise à jour fondée sur des données probantes. Ophtalmologie 2002;109:13–24.
- Atkinson W : injection rétrobulbaire d'anesthésique dans le cône musculaire (injection de cône). Arch Ophthalmol 1936;16:495–503.
- Liu C, Youl B, Moseley I : Imagerie par résonance magnétique du nerf optique dans les extrêmes du regard. Implications pour le positionnement du globe pour l'anesthésie rétrobulbaire. Br J Ophthalmol 1992;76:728–733.
- Unsöld R, Stanley J, Degroot J : La tomodensitométrie de l'anesthésie rétrobulbaire. Corrélation anatomo-clinique des implications et suggestion d'une technique modifiée. Albrecht Von Graefes Arch Klin Exp Ophthalmol 1981;217:125–136.
- Hamilton R, Loken R : Bloc rétrobulbaire modifié. Can J Anaesth 1993;40:1219–1220.
- Galindo A, Keilson L, Mondshine R, et al : Anesthésie rétro-péribulbaire : technique spéciale et conception de l'aiguille. Ophthalmol Clin North Am 1990;3:71–81.
- Chang WM, Stetten GD, Lobes LA Jr, Shelton DM, Tamburo RJ : Guidage de l'injection rétrobulbaire avec réflexion tomographique en temps réel. J Ultrasound Med 2002;21:1131–1135.
- Luyet C, Eichenberger U, Moriggl B, Remonda L, Greif R : Visualisation en temps réel du bloc rétrobulbaire guidé par échographie : une étude d'imagerie. Br J Anaesth 2008;101:855–859.
- Guyer S, Shaw ES : Anesthésie guidée par échographie oculaire. Dans Singh AD (ed): Échographie ophtalmique. Amsterdam, Pays-Bas : Elsevier, 2012.
- Kumar C, communication personnelle, 23 juin 2013.
- Bloomberg L : Anesthésie périoculaire antérieure : cinq ans d'expérience.
J Cataract Refract Surg 1991 ; 17 : 508-511. - Davis D, Mandel M : Efficacité et taux de complications de 16224 1994 blocs péribulbaires consécutifs. Une étude prospective multicentrique. J Cataract Refract Surg 20;327:337–XNUMX.
- Hustead R, Hamilton R, Loken R : Anesthésie locale périoculaire : orbitale médiale comme alternative à l'injection nasale supérieure. J Cataract Refract Surg 1994;20:197–201.
- Wang BC, Bogart B, Hillman DE, et al : injection sous-arachnoïdienne - une complication potentielle du bloc rétrobulbaire. Anesthésiologie 1989;71 : 845–857.
- Kumar CM, Lawler PG : Œdème pulmonaire après bloc péribulbaire. Br J Anaesth 1999;82:777–779.
- Demirok A, Simsek S, Cinal A, et al : Anesthésie péribulbaire : une contre deux injections. Lasers chirurgicaux ophtalmiques 1997;28:998–1001.
- Ball JL, Woon WH, Smith S : Perforation du globe par la deuxième injection péribulbaire. Oeil 2002;16:663–665.
- Sarvela J, Nikki P : Comparaison de deux longueurs d'aiguilles en anesthésie ophtalmique régionale avec l'étidocaïne et l'hyaluronidase. Ophthalmic Surg 1992;23:742–745.
- Karampatakis V, Natsis K, Gisgis P, Stangos N : Le risque de lésion du nerf optique dans l'anesthésie rétrobulbaire : une étude comparative sur les aiguilles rétrobulbaires de 35 et 40 mm sur 12 cadavres. Eur J Ophthalmol 1998;8:184–187.
- Katsev D, Drews RC, Rose BT : étude anatomique de la longueur du trajet de l'aiguille rétrobulbaire. Ophtalmologie 1989;96:1221–1224.
- Waller S, Taboada J, O'Connor P : Risque d'anesthésie rétrobulbaire : les aiguilles pointues perforent-elles vraiment plus facilement l'œil que les aiguilles émoussées ? Ophtalmologie 1993;100:506–510.
- Demediuk O, Dhaliwal R, Papworth D, et al : une comparaison de l'anesthésie péribulbaire et rétrobulbaire pour les interventions chirurgicales vitréo-rétiniennes. Arch Ophthalmol 1995;113:908–913.
- Aldrete J, Romo-Salas F, Arora S, et al : flux sanguin artériel inverse comme voie des réponses toxiques du système nerveux central après l'injection d'anesthésiques locaux. Anesth Analg 1978;57:428–433.
- Singer SB, Preston R, Hodge WG : Arrêt respiratoire après anesthésie péribulbaire pour chirurgie de la cataracte : rapport de cas et revue de la littérature. Can J Ophthalmol 1997;32:450–454.
- Loken R, Mervyn Kirker GE, Hamilton RC : Arrêt respiratoire après anesthésie péribulbaire pour chirurgie de la cataracte : rapport de cas et revue de la littérature. Can J Ophthalmol 1998;33:225–226.
- Nicoll J, Acharya P, Ahlen K, et al Complication du système nerveux central après 6000 blocs rétrobulbaires. Anesth Analg 1987;66:1298–1302.
- Duker J, Belmont J, Benson W, et al : Perforation du globe par inadvertance pendant l'anesthésie rétrobulbaire et péribulbaire. Ophtalmologie 1991 ; 98:519–526.
- Bord R, Navon S. Perforation sclérale pendant l'anesthésie rétrobulbaire et péribulbaire. Facteur de risque et résultat sur 50,000 1999 injections consécutives. J Cataract Refract Surg 25;1237:1244–XNUMX.
- Vohra S, Good P : Modification des dimensions du globe de la myopie axiale en tant que facteurs de risque de lésion oculaire pénétrante pendant l'anesthésie péribulbaire. Br J Anaesth 2000;85:242–245.
- Carlson B, Rainin E : Régénération des muscles extraoculaires du rat. Réparation des dommages induits par l'anesthésie locale. Arch Ophthalmol 1985;103:1373–1377.
- Porter JD, Edner DP, et al Myotocxicité extraoculaire du chlorhydrate de bupivacaïne anesthésique rétrobulbaire. Inv Ophth Vis Sci 1988;29 : 163–174.
- Gomez-Arnau JI, Yanguela J, Gonzalez A, et al : Diplopie liée à l'anesthésie après chirurgie de la cataracte. Br J Anaesth 2003;90:189–193.
- Han SK, Kim JH, Hwang JM : Diplopie persistante après anesthésie rétrobulbaire. J Cataract Refract Surg 2004;30:1248–1253.
- Taylor G, Devys JM, et al : exploration précoce de la diplopie avec imagerie par résonance magnétique après anesthésie péribulbaire. Br J Anaesth 2004;92 : 899–901.
- Zhang C, Phamonvaechavan P, et al : myotoxicité de la bupivacaïne dépendante de la concentration dans le muscle extraoculaire du lapin. JAAPOS 2010;14:323–327.
- Yagiela JA, Benoit PW, et al. Comparaison des effets myotoxiques de la lidocaïne avec l'épinéphrine chez le rat et l'homme. Anesth Analg 1981;60:471–480.
- Scott AB, Alexander DE, Miller JM : injection de bupivacaïne dans les muscles oculaires pour traiter le strabisme. Br J Ophthalmol 2007;91:146–148.
- Zink W, Graf BM : myotoxicité anesthésique locale. Reg Anesth Pain Med 2004;29:333–340.
- Nouette-Gaulain K, Dadure C, et al. Toxicité musculaire induite par la bupivacaïne en fonction de l'âge pendant un bloc nerveux périphérique continu chez le rat. Anesthésiologie 2009 ; 111 : 1120–1127.
- Edge K, Nicoll M : Hémorragie rétrobulbaire après 12,500 1993 blocs rétrobulbaires. Anesth Analg 76;1019:1022–XNUMX.
- Hersch M, Baer G, Diecker JP, et al. Hypertrophie du nerf optique et occlusion de l'artère centrale de la rétine secondaires à une anesthésie rétrobulbaire. Ann Ophthalmol 1989;21:195–197.
- Rubin AP : Complications de l'anesthésie locale pour la chirurgie ophtalmique. Br J Anaesth 1995;75:93–96.
- Rebolleda G, Munoz-Negrete FJ, Gutierrez-Ortiz C : anesthésie topique plus lidocaïne intracamérulaire versus anesthésie rétrobulbaire dans la phacotrabéculectomie : étude prospective randomisée. J Cataract Refract Surg 2001;27:1214–1220.
- Waddell KM, Reeves BC, Johnson GJ : Une comparaison des lentilles de chambre antérieure et postérieure après extraction de la cataracte en Afrique rurale : un essai randomisé intra-patient. Br J Ophthalmol 2004;88:734–739.
- Bourne R, Minassian D, et al : Effet de la chirurgie de la cataracte sur l'endothélium cornéen : phacoémulsification moderne par rapport à la chirurgie extracapsulaire. Ophtalmologie 2004;11:679–685.
- Boezaart A, Berry R, Nell M : Anesthésie topique versus bloc rétrobulbaire pour la chirurgie de la cataracte : le point de vue du patient. J Clin Anesth 2000;12 : 58–60.
- Sekundo W, Dick HB, Schmidt JC : Anesthésie à la gelée de xylocaïne assistée par la lidocaïne par rapport à une infiltration sous-ténonienne d'un quadrant pour la phacoémulsification de routine par incision scléro-cornéenne auto-obturante. Eur J Ophthalmol 2004;14:111–116.
- Davison M, Padroni S, Bunce C, Rüschen H : anesthésie sous-ténonienne par rapport à l'anesthésie topique pour la chirurgie de la cataracte. Cochrane Database Syst Rev 2007;3:CD006291.
- Zhao LQ, Zhu H, et al : Anesthésie topique versus anesthésie régionale pour la chirurgie de la cataracte : une méta-analyse d'essais contrôlés randomisés. Ophtalmologie 2012 ;119 : 659–667.
- Pandey S, Werner L, et al : phacoémulsification cornéenne claire sans anesthésie par rapport à l'anesthésie topique et topique plus intracamérulaire. Essai clinique randomisé. J Cataract Refract Surg 2001;27:1643–1650.
- Karp CL, Cox TA, et al : anesthésie intracamérulaire. Un rapport de l'American Academy of Ophthalmology. Ophtalmologie 2001;108 : 1704–1710.
- Heuerman T, Hartman C, Anders N : Perte de cellules endothéliales à long terme après phacoémulsification : anesthésie péribulbaire versus lidocaïne intracamérulaire 1 %. Etude prospective randomisée. J Cataract Refract Surg 2002;28:638–643.
- Pang MP, Fujimoto DK, Wilkens LR : Douleur, photophobie et fonction nerveuse rétinienne et optique après phacoémulsification avec de la lidocaïne intracamérulaire. Ophtalmologie 2001;108:2018–2025.
- Roberts T, Boytell K : Une comparaison de la chirurgie de la cataracte sous anesthésie topique avec et sans lignocaïne intracamérulaire. Clin Experiment Ophthalmol 2002;30:19–22.
- Boulton J, Lopatazidis A, Luck J, et al : Un essai contrôlé randomisé de lidocaïne intracamérulaire pendant la phacoémulsification sous anesthésie topique. Ophtalmologie 2000;107:68–71.
- Bardocci A, Lofoco G, Perdicaro S, et al : gel de lidocaïne à 2 % contre gouttes sans conservateur de lidocaïne à 4 % pour l'anesthésie topique dans la chirurgie de la cataracte. Un essai contrôlé randomisé. Ophtalmologie 2003;110:144–149.
- Barequet IS, Soriano ES, Green WR, et al : Fourniture d'une anesthésie avec une seule application de gel de lidocaïne. J Cataract Refract Surg 1999;25 : 626–631.
- Juge AJ, Najafi K, et al : Toxicité endothéliale cornéenne de l'anesthésie topique. Ophtalmologie 1997;104:1373–1379.
- Guzey M, Satici A, Dogan Z, Karadede S : les effets de la bupivacaïne et de la lidocaïne sur l'endothélium cornéen lorsqu'elles sont appliquées dans la chambre antérieure aux concentrations fournies dans le commerce. Ophtalmologique
2002; 216: 113-117. - Carney LG, O'Leary DJ, Millodot M : Effet de l'anesthésie topique sur la fragilité de l'épithélium cornéen. Int Ophthalmol 1984;7:71–73.
- Yagci A, Bozkurt B, Egrilmez S, Palamar M, Ozturk BT, Pekel H : kératopathie par abus d'anesthésique topique : un problème de santé souvent négligé. Cornée 2011;30:571–575.
- Rao SK, Wong VW, Cheng AC, Lam PT, Lam DS : Kératopathie induite par anesthésie topique après kératectomie sous-épithéliale assistée par laser. J Cataract Refract Surg 2007;33:1482–1484.
- Lee JK, Stark WJ : Kératopathie anesthésique après kératectomie photoréfractive. J Cataract Refract Surg 2008;34:1803–1805.
- Martini E, Cavallini GM, Campi L, Lugli N, Neri G, Molinari P : Lidocaïne versus ropivacaïne pour l'anesthésie topique dans la chirurgie de la cataracte(1). J Cataract Refract Surg 2002;28:1018–1022.
- Fernandez SA, Dios E, Diz JC : étude comparative de l'anesthésie topique avec la lidocaïne 2 % contre la lévobupivacaïne 0.75 % dans la chirurgie de la cataracte. Br J Anaesth 2009;102:216–220.
- Wood CC, Menon G, Ayliffe W : Bloc sous-conjonctival pour l'extraction de la cataracte et la kératoplastie. Br J Anaesth 1999;83:969.
- Kongsap P : anesthésie sous-conjonctivale supérieure par rapport à l'anesthésie rétrobulbaire pour la chirurgie manuelle de la cataracte à petite incision dans un programme de formation en résidence : un essai contrôlé randomisé. Clin Ophtalmol 2012 ;
6: 1981-1986. - Yuen JS, Prineas S, Pham T, Liu H : Efficacité de l'anesthésie sous-conjonctivale supérieure par rapport à inférieure pour la chirurgie de la cataracte. Anaesth Intensive Care 2007;35:945–948.
- Prineas SN : données non publiées. Disponible en contactant directement l'auteur.
- Van Lint M: Paralysie palpébrale transitoire provoquée dans l'opération de la cataracte. Ann Ocul 1914;151:420–424.
- O'Brien, CS : Akinésie lors de l'extraction de la cataracte. Arch Ophthal 1929; 1 : 447–449.
- Atkinson WS : Akinésie de l'orbiculaire. Am J Ophthalmol 1953;36 : 1255–1258.
- Saeedi OJ, Wang H, Blomquist PH : lésion du globe pénétrant lors d'un bloc nerveux sous-orbitaire. Arch Otolaryngol Head Neck Surg 2011; 137: 396–397.
- Chan BJ, Koushan K, Liszauer A, Martin J : Pénétration du globe iatrogène dans un cas de bloc nerveux sous-orbitaire. Can J Ophthalmol 2011;46 : 290–291.
- Duker J, Nielsen J, Vander JF, Rosenstein RB, Benson WE : Irrigation rétrobulbaire à la bupivacaïne pour la douleur postopératoire après une chirurgie de flambage scléral. Ophtalmologie 1991;98:514–518.
- Jonas JB, Jäger M, Hemmerling T : Anesthésie rétrobulbaire continue pour la chirurgie de flambage scléral à l'aide d'un cathéter d'anesthésie rachidienne ultra-fin. Can J Anesth 2002;49:487–489.
- Allman KG, Barker LL, Werrett GC, Gouws P, Sturrock GD, Wilson IH :
Comparaison de l'articaïne et de la bupivacaïne/lidocaïne pour l'anesthésie péribulbaire par injection inférotemporale. Frère J Anaesth 2002;88 :
676-678. - Gouws P, Galloway P, Jacob J, English W, Allman KG : Comparaison de l'articaïne et de la bupivacaïne/lidocaïne pour l'anesthésie sous-ténonienne dans l'extraction de la cataracte. Br J Anaesth 2004;92:228–230.
- Hintze A, Paessler L : Enquêtes comparatives sur l'efficacité de l'articaïne 4 % (épinéphrine 1 : 200,000 2) et de l'articaïne 1 % (épinéphrine 200,000 : XNUMX XNUMX) dans l'anesthésie par infiltration locale en dentisterie - étude randomisée
étude en double aveugle. Clin Oral Investig 2006;10:145–150. - Hillerup S, Bakke M, Larsen JO, Thomsen CE, Gerds TA : Neurotoxicité dépendante de la concentration de l'articaïne : une étude électrophysiologique et stéréologique du nerf sciatique du rat. Anesth Analg 2011;112 :
133-138. - Snoeck M : Articaine : un examen de son utilisation pour l'anesthésie locale et régionale. Loc Reg Anesth 2012;5:23–33.
- Guise P, Laurent S : Bloc de Sous-Tenon. L'effet de l'hyaluronidase sur la vitesse d'apparition et la qualité du bloc. Anaesth Soins Intensifs 1999:27 :
179-181. - Brown SM, Coats DK, Collins ML, Underdahl JP : deuxième groupe de cas de strabisme après anesthésie périoculaire sans hyaluronidase. J Cataract Refract Surg 2001;27:1872–1875.
- Struthidis NG, Sobha S, Lanigan L, Hammond CJ : Diplopie verticale après anesthésie péribulbaire : le rôle de l'hyaluronidase. J Pediatr Ophthalmol Starbismus 2004;41:25–30.
- Alwitryy A, Chaudhary S, Gopee K, Butler TK, Holden R : Effet de l'hyaluronidase sur la motilité oculaire dans l'anesthésie sous-ténonienne : essai contrôlé randomisé. J Cataract Refract Surg 2002;28:1420–1423.
- Dempsey GA, Barrett PJ, Kirby IJ : Hyaluronidase et bloc péribulbaire. Br J Anaesth 1997;78:671–674.
- Quhill F, Bowling B, Packard RB : Allergie à la hyaluronidase après anesthésie péribulbaire avec inflammation orbitaire. J Cataract Refract Surg 2004;30:916.
- Eberhart AH, Weiler CR, Erie JC : Angiœdème lié à l'utilisation de l'hyaluronidase dans la chirurgie de la cataracte. Am J Ophthalmol 2004;138:142.
- Escolano F, Parés N, Gonzalez I, Castillo J, Valero A, Bartolomé B : Réaction allergique à l'hyaluronidase dans la chirurgie de la cataracte. Eur J Anaesth 2005;22:729–730.
- Silverstein SM, Greenbaum S, Stern R : Hyaluronidase en ophtalmologie. J App Res 2012;12:1–13.
- Mjahed K, el Harrar N, Hamdani M, Amraoui M, Benaguida M : Bloc rétrobulbaire lidocaïne-clonidine pour la chirurgie de la cataracte chez les personnes âgées. Reg Anesth 1996;21:569–575.
- Baroni MF, Lauretti GR, Lauretti-Fo A, Pereira NL : Clonidine en tant que co-adjuvant en chirurgie oculaire : comparaison entre l'administration péribulbaire et l'administration orale. J Clin Anesth 2002;14:140–145.
- Madan R, Bharti N, Shende D, Khokhar SK, Kaul HL : Une étude dose-réponse de la clonidine avec un mélange anesthésique local pour le bloc péribulbaire : une comparaison de trois doses. Anesth Analg 2001;93:1593–1597.
- Khan B, Bajwa SJ, Vohra R, et al : évaluation comparative de la ropivacaïne et de la lignocaïne avec la combinaison de ropivacaïne, de lignocaïne et de clonidine pendant l'anesthésie péribulbaire pour la chirurgie de la cataracte par phacoémulsification. Ind J Anaes 2012;56:21–26.
- Cabral SA, Carraretto AR, Brocco MC, Abreu Baptista JF, Gomez RS : Effet de la clonidine ajoutée à la lidocaïne pour l'anesthésie sous-ténonienne (épisclérale) dans la chirurgie de la cataracte. J Anesth 2014;28:70–75.
- Bharti N, Madan R, Kaul HL, et al : effet de l'ajout de clonidine au mélange anesthésique local pour le bloc péribulbaire. Anaesth Intensive Care 2002;30:438–441.
- Eskandr AM, Elbakry AE, Elmorsy OA : La dexmédétomidine est un adjuvant efficace pour le bloc sous-ténon dans la chirurgie de la cataracte par phacoémulsification. Égypte J Anaes 2014;30:261–266.
- Moster MR, Azura-Blanco A : Effacement après une chirurgie de filtration du glaucome. J Curr Glauc Prac 2007;1:45–47.
- Kücükyavuz Z, Arici MK : Effets de l'atracurium ajouté aux anesthésiques locaux sur l'akinésie dans le bloc péribulbaire. Reg Anesth Pain Med 2002; 27:487–490.
- Hemmerling TM, Budde WM, Koppert W, Jonas JB : application rétrobulbaire versus systémique de morphine pendant une anesthésie régionale titrable via un cathéter rétrobulbaire en chirurgie intraoculaire. Anesth Analg 2000;
91: 585-588. - Krause M, Weindler J, Ruprecht KW : Le réchauffement des solutions anesthésiques améliore-t-il l'analgésie et l'akinésie lors d'une anesthésie rétrobulbaire ? Ophtalmologie 1997;104:429–432.
- Hansen TE : Styles de pratique et préférences des chirurgiens danois de la cataracte - Enquête de 1995. Acta Ophthalmol Scand 1996;74:56–59.
- Eke T, Thompson JR : Oeil : l'enquête nationale sur l'anesthésie locale pour la chirurgie oculaire II. Profil de sécurité des techniques d'anesthésie locale. Oeil 1999;13:196–204.
- Glantz L, Drenger B, Gozal Y : Ischémie myocardique périopératoire chez les patients opérés de la cataracte : anesthésie générale ou locale. Anesth Analg 2000;91:1415–1419.
- Katz J, Feldman MA, Bass EB, et al. Événements médicaux peropératoires indésirables et leur association avec les stratégies de gestion de l'anesthésie dans la chirurgie de la cataracte. Ophtalmologie 2001;108:1721–1726.
- Abramson DC. Éternuements soudains et inattendus lors de l'insertion d'un bloc péribulbaire sous sédation au propofol. Can J Anaesth1995;42(8): 740–3.
- Ahn ES, Mills DM, Meyer DR, Stasior GO : Réflexe d'éternuement associé à une sédation intraveineuse et à une injection anesthésique périoculaire. Am J Ophthal 2008;146:31–35.
- Boezaart AP, Berry RA, Nell MA, van Dyk AL : une comparaison du propofol et du rémifentanil pour la sédation et la limitation des mouvements pendant le bloc périrétrobulbaire. J Clin Anesth 2001;13:422–426.
- Morley AM, Jazayeri F, Ali S, Malhotra R : Facteurs provoquant des éternuements chez les patients sous sédation intraveineuse recevant des injections d'anesthésique local dans les paupières. Ophtalmologie 2010 ;117 :1032–1036.
- Schaack E, Diallo B et al. Perforation du globe par inadvertance au cours d'une anesthésie péribulbaire et d'une sédation au propofol. Ann Fr Anesth Reanim 2006;25(1):43-5.
- Steeds C, Mather SJ. Schémas de jeûne pour l'anesthésie ophtalmique régionale : une enquête auprès des membres de la British Ophthalmic Anesthesia Society. Anesthésie 2001;56:638
- Crenshaw JT, Winslow EH : Jeûne préopératoire : les vieilles habitudes ont la vie dure. Am J Nurs 2002;102:36–44.
- Le Collège royal des anesthésistes. Lignes directrices pour la prestation de services d'anesthésie. Chapitre 13 : Conseils sur la prestation de services d'anesthésie ophtalmique. Londres, 2015 lien Internet http://www.rcoa.ac.uk/system/files/GPAS-2015-13-OPHTHAL.pdf consulté le 31 août 2016
- Collège royal des anesthésistes, Collège royal des ophtalmologistes : Anesthésie locale pour la chirurgie ophtalmique. Directives conjointes du Royal College of Anesthetists et du Royal College of Ophthalmologists. Londres, 2012. http://www.rcoa.ac.uk/system/files/LA- Ophthalmicsurgery-2012.pdf consulté le 31 août 2016
- Guise P, communication personnelle, 16 juillet 2013.

