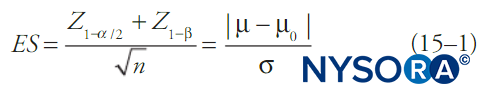Andrew Neice et Michael J. Barrington
INTRODUCTION
L'anesthésie locorégionale est mieux pratiquée dans le cadre de protocoles anesthésiques et chirurgicaux standardisés ; ces plans sont généralement appelés voies anesthésiques. Pour un patient subissant une intervention chirurgicale qui utilise une voie anesthésique, de nombreuses décisions concernant les soins du patient ne sont pas prises au chevet du patient dans la période préopératoire immédiate, mais plutôt bien avant l'intervention chirurgicale en examinant attentivement les risques et les avantages des diverses anesthésies et traitements périopératoires. Lorsqu'elles sont bien conçues, les voies d'anesthésie peuvent améliorer les soins aux patients en garantissant que les patients reçoivent des soins cohérents, coordonnés et fondés sur des preuves. Ils peuvent également réduire les coûts en éliminant les interventions inutiles et en réduisant les complications. Bien sûr, les voies ne doivent pas être respectées sans discernement car certains patients nécessiteront une modification pour expier des conditions médicales spécifiques ou des préférences du patient. Quoi qu'il en soit, les voies anesthésiques permettent aux cliniciens de se concentrer sur les caractéristiques uniques d'un patient plutôt que sur les caractéristiques communes d'une cohorte entière, qui ont déjà été examinées lors du développement de la voie.
À leur base, les voies anesthésiques (ou les voies cliniques dans n'importe quel domaine) sont une série de décisions médicales. En tant que leaders du foyer de chirurgie périopératoire, les anesthésiologistes sont les mieux placés pour diriger leur conception. Il y a souvent de nombreux problèmes subtils qui surviennent dans le développement d'un cheminement qui peuvent ne pas être familiers à quiconque autre qu'un clinicien qui est fréquemment et personnellement impliqué dans les soins aux patients. De plus, les relations de travail des anesthésistes avec les chirurgiens, les administrateurs et toute l'équipe du bloc opératoire sont primordiales dans l'élaboration et la réussite des parcours patients. La coordination interspécialisée est essentielle au développement réussi des voies anesthésiques. Les décisions anesthésiques affecteront fréquemment la capacité des patients à se réadapter dans la période postopératoire immédiate, de sorte que les voies anesthésiques et chirurgicales doivent être conçues par un effort d'équipe.
Parce qu'il existe des preuves que l'utilisation de l'anesthésie régionale peut affecter la mortalité et la morbidité des chirurgies courantes, et parce que le contrôle de la douleur dans la période postopératoire est souvent difficile, l'anesthésie régionale (bloc neuraxial ou périphérique) est souvent une caractéristique clé des voies anesthésiques. Par conséquent, le développement de parcours présente un intérêt particulier pour les praticiens dont la pratique clinique comprend l'anesthésie régionale.
La conception et la mise en œuvre de cheminements cliniques nécessitent des compétences souvent non enseignées pendant la formation en résidence. Les médecins adaptent leurs traitements en tenant compte des caractéristiques uniques de chaque patient. Ceci est lié à la formation des médecins conçue pour obtenir et synthétiser des données pour un patient spécifique. Les parcours cliniques, en revanche, doivent être conçus pour optimiser l'expérience moyenne d'une cohorte de patients, en faisant souvent des compromis et des compromis au cours du processus. La connaissance de l'épidémiologie et des statistiques est essentielle à la conception efficace d'un cheminement clinique. L'estimation numérique des résultats probables et le choix de ceux qui obtiennent le score le plus favorable sont au cœur du développement de la voie.
Les avantages d'un parcours d'anesthésie dépendront bien sûr des particularités du parcours lui-même, de l'établissement, des techniques chirurgicales et anesthésiques et des autres prestataires de soins de santé utilisant le parcours (tels que les soins infirmiers, la kinésithérapie, etc.). Un parcours conçu pour un établissement peut ne pas convenir à un autre établissement, c'est pourquoi nous avons choisi dans ce chapitre de mettre l'accent sur le processus de développement du parcours plutôt que de présenter des parcours spécifiques. De plus, les objectifs d'une voie anesthésique peuvent varier - certaines voies peuvent être conçues pour réduire la morbidité ou la mortalité, tandis que d'autres peuvent être axées sur la réduction des coûts tout en maintenant un niveau élevé de soins aux patients. Les objectifs communs d'une voie anesthésique comprennent la réduction de la morbidité et de la mortalité hospitalières, la réduction de la durée du séjour à l'hôpital, la réduction des coûts, l'amélioration de la satisfaction des patients, la réduction des réadmissions et l'amélioration des résultats fonctionnels à long terme.
Malgré cette hétérogénéité, il est prouvé que, de manière générale, les parcours cliniques améliorent la prise en charge des patients. Une méta-analyse récente des voies cliniques a révélé qu'elles étaient associées à des taux plus faibles de complications chez les patients (p. ex., infections de plaies, saignements et pneumonies), ainsi qu'à une meilleure documentation. La plupart des études incluses dans la méta-analyse ont également montré une réduction de la durée de séjour et des coûts hospitaliers sans augmentation du risque de taux de réadmission et de mortalité. Cependant, il est possible que certaines voies cliniques puissent également améliorer ces résultats. L'hétérogénéité considérable des parcours cliniques réussis n'a pas permis aux chercheurs d'identifier les caractéristiques communes aux parcours cliniques réussis (ou non). Néanmoins, les principes de base de la gestion des risques peuvent être déployés pour aider à la conception des parcours cliniques, et le développement d'un cadre commun réutilisable pour aborder les parcours cliniques semble susceptible d'augmenter la probabilité de succès.
Dans ce chapitre, nous présentons un cadre pour l'élaboration de cheminements cliniques et passons en revue certaines des connaissances préalables requises pour ce processus. Nous présentons également des scénarios de cas qui illustrent les subtilités de l'application de la littérature médicale existante aux cheminements cliniques. Enfin, nous présentons les éléments d'un parcours chirurgical d'arthroplastie totale du genou.
CADRE POUR LES VOIES ANESTHÉSIQUES
Un exemple d'un seul composant d'un cheminement clinique est présenté dans Tableau 1. Il s'agit d'une composante d'une voie plus large pour l'arthroplastie totale de l'articulation, qui est discutée plus en détail dans la dernière section de ce chapitre. Ce composant décrit les prémédications orales standard pour la chirurgie et contient des informations spécifiques sur la dose, les contre-indications courantes et les ajouts courants à la voie qui peuvent être nécessaires pour certains patients. Bien que l'élaboration d'un cheminement clinique implique souvent de longues analyses avec des incertitudes, les éléments finaux du cheminement doivent être brefs et précis. Outre les prémédications recommandées, les parcours peuvent comporter de nombreux éléments différents ; par exemple, voir ceux montrés dans Tableau 2.
Il est à noter que si les voies développées par les anesthésistes concernent avant tout la prise en charge anesthésique du patient, elles sont conçues pour s'articuler avec la voie chirurgicale correspondante. Par exemple, le choix de l'anesthésie régionale peut permettre au patient de terminer la kinésithérapie le jour 1 postopératoire.
TABLE 1. Exemple d'item de cheminement : prémédication orale pour arthroplastie totale du genou.
| Prémédications orales recommandées avant la chirurgie (exemple seulement) | |
|---|---|
| Acétaminophène 1g par voie orale | Éviter chez les personnes atteintes de cirrhose, les tests de la fonction hépatique élevés |
| Célécoxib 400 mg par voie orale | À éviter chez les personnes allergiques aux sulfamides, dysfonction rénale |
| Gabapentine 600 mg par voie orale | Éviter chez les patients présentant un dysfonctionnement rénal, les patients ambulatoires, les patients âgés ou atteints de démence |
TABLE 2. Exemples d'éléments de voie.
- Enumération des objectifs du parcours
- Critères de sélection des patients, de préparation à la chirurgie et d'éducation avant la chirurgie
- Optimisation préopératoire (p. ex., objectifs de pression artérielle, objectifs d'hématocrite, interventions pharmacologiques associées)
- Anesthésie chirurgicale recommandée
- Technique d'anesthésie systémique multimodale recommandée
- Anesthésie/analgésie régionale recommandée pour le traitement de la douleur postopératoire
- Traitement prophylactique recommandé pour les nausées et vomissements postopératoires
- Objectifs peropératoires recommandés en matière de liquide ou d'hématocrite ou critères de transfusion
- Gestion peropératoire recommandée de l'hémodynamique (p. ex., pressions artérielles préférées, vasopresseurs préférés, etc.)
- Médicaments adjuvants recommandés (p. ex., antibiotiques préférés, anticoagulation, antifibrinolytiques)
- Surveillance adjuvante recommandée (p. ex., potentiels évoqués, indice bispectral, oxygénation cérébrale)
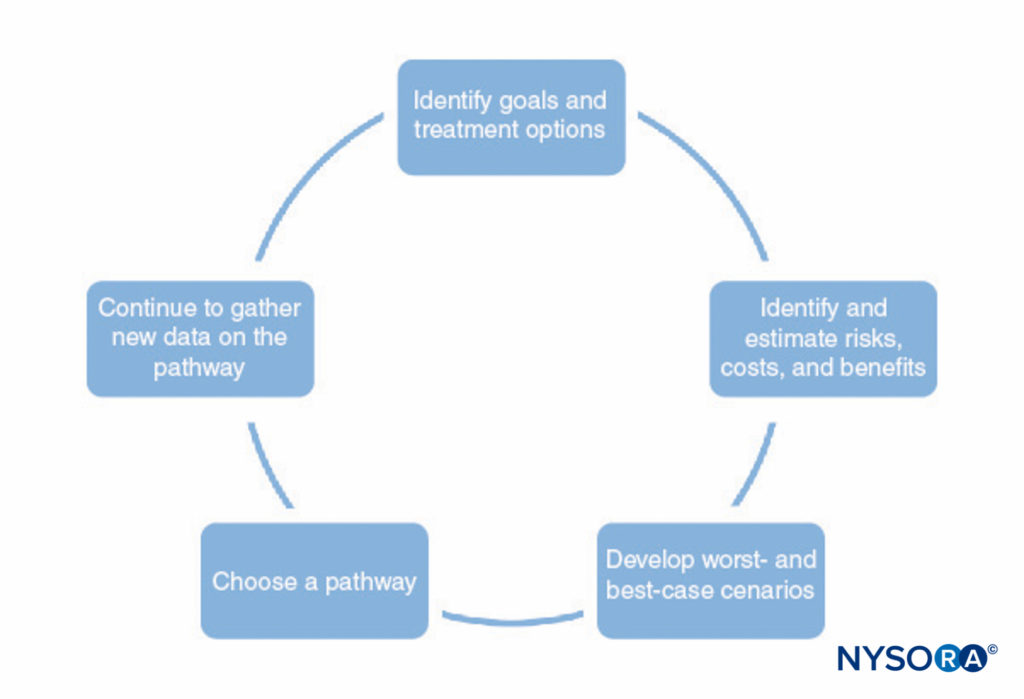
Un processus de développement de voies cliniques est présenté dans Figure 1. Ce processus comprend les éléments suivants :
- Identifier les objectifs du parcours et les différentes options de traitement pour aider à atteindre ces objectifs. Cela devrait inclure toutes les étapes de l'anesthésie et de la chirurgie, y compris la récupération postopératoire.
- Identifier les façons dont chaque traitement interagit avec les autres (par exemple, le type d'anesthésie régionale peut affecter la capacité du patient à effectuer une thérapie physique postopératoire, les prémédications peuvent retarder la sortie en raison de la sédation).
- Identifier les risques, les coûts et les avantages possibles de chaque traitement, y compris la mortalité, la morbidité, la satisfaction des patients, les capacités institutionnelles, le coût financier et d'autres facteurs.
- Faire des estimations numériques des risques, des coûts et des avantages identifiés à l'étape 3. Certaines de ces informations (par exemple, les informations sur les coûts) peuvent être rassemblées et tabulées. Cependant, la plupart des informations ne peuvent pas être connues avec certitude. Dans de nombreux cas, la littérature médicale peut fournir des estimations des probabilités impliquées, tant que le médecin comprend les limites d'une étude particulière.
- Utilisez les estimations développées à l'étape 4 pour développer les résultats probables et les scénarios les plus défavorables et les plus optimistes pour chaque voie.
- Choisissez la voie la plus susceptible de bénéficier au patient en fonction de l'étape 5.
- Affinez continuellement les estimations des risques, des coûts et des avantages à mesure que de nouvelles informations deviennent disponibles et affinez les cheminements cliniques.
Si nous pouvions quantifier les risques et les avantages de chaque intervention aussi facilement que nous pourrions quantifier les coûts financiers des procédures et de l'équipement, les étapes 4, 5 et 6 seraient triviales. Néanmoins, c'est très rarement le cas. Dans de nombreux cas, il se peut qu'il n'y ait pas de données publiées adéquates pour guider le processus. Parfois, il peut y avoir une certaine incongruité entre les études disponibles et les informations souhaitées - les seules études disponibles peuvent avoir été réalisées sur des populations de patients similaires, mais différentes ; ont analysé des procédures chirurgicales similaires, mais différentes ; ou peuvent décrire des interventions que vous ne pouvez pas reproduire exactement dans votre établissement. Néanmoins, la correspondance la plus proche de ses conditions institutionnelles peut être utilisée pour estimer les probabilités utilisées à l'étape 5.
Un autre risque à prendre en compte comprend les complications qui peuvent ne se manifester que bien après la période de traitement. Par exemple, les médicaments, les procédures ou les thérapies récemment introduits auront par définition des risques à long terme inconnus. Reconnaître les limites des preuves existantes pour chaque intervention dans la littérature est crucial dans l'élaboration du protocole. Bien que les statistiques inférentielles améliorent le jugement d'un médecin au-delà de ce qui peut être réalisé simplement en s'appuyant sur ses observations personnelles historiques, malheureusement, toute étude donnée peut avoir des biais imprévus qui peuvent rendre l'étude moins qu'un guide idéal pour le protocole en cours d'élaboration. En tant que tel, lors de l'élaboration de scénarios «pire cas» et «meilleur cas», il faut tenir compte de la possibilité qu'une étude ait commis une erreur de type I ou (plus communément) de type II.
REVUE DES CONCEPTS STATISTIQUES PERTINENTS AU DEVELOPPEMENT DES VOIES ANESTHETIQUES
Une bonne analogie pour le rôle des statistiques dans l'amélioration du jugement du clinicien est de le comparer au rôle que joue une loupe dans l'amélioration de la vision. Les médicaments ou les interventions qui ont des effets importants et constants (par exemple, l'effet de l'insuline sur le glucose ou l'épinéphrine sur la fréquence cardiaque) peuvent être facilement appréciés par le clinicien sans aucune sorte d'étude corroborante, tout comme une loupe n'est généralement pas nécessaire pour voir franchement pus dans une plaie. De même, une étude qui manque de puissance peut être incapable de détecter des effets subtils, tout comme une simple loupe n'est pas assez puissante pour imager des bactéries individuelles. Alors que peu de cliniciens tenteraient de diagnostiquer une infection bactérienne avec seulement une loupe, les cliniciens commettent fréquemment l'erreur de supposer qu'un résultat négatif rapporté est synonyme d'absence d'effet, sans tenir compte de la limite de détection de l'étude. Des complications rares mais catastrophiques sont particulièrement préoccupantes car un très grand nombre de patients peut être nécessaire pour alimenter correctement une étude.
Un test statistique peut rapporter soit que les données observées sont cohérentes avec le hasard (l'hypothèse nulle, un résultat "négatif"), soit rejeter l'hypothèse nulle et affirmer qu'il existe une association entre un traitement et un résultat (un résultat "positif"). . En réalité, il peut y avoir ou non une association entre un traitement et un résultat. Il y a donc quatre possibilités pour tout test statistique, dont deux consistent à tirer la bonne conclusion et deux sont des erreurs. Celles-ci sont traditionnellement affichées à l'aide d'un tableau 2 × 2, comme indiqué dans Tableau 3.
TABLE 3. Résultats possibles d'un test statistique.
| L'hypothèse est vraie | L'hypothèse est fausse | |
|---|---|---|
| L'hypothèse est acceptée | Décision correcte | Erreur de type I (alpha) |
| L'hypothèse est rejetée | Erreur de type II (bêta) | Décision correcte |
Les deux types d'erreurs possibles sont une erreur de type I (alpha), qui consiste à conclure à tort qu'une association existe alors qu'il n'y en a pas, et une erreur de type II (bêta), qui consiste à conclure à tort qu'aucune association n'existe alors qu'en fait il en existe une. . Évidemment, les probabilités de commettre les deux types d'erreurs sont liées. Imaginez un test statistique qui affirme toujours qu'il existe une association entre le traitement et le résultat, quelles que soient les données. Cette technique fera fréquemment des erreurs de type I mais ne fera jamais d'erreur de type II (car elle n'affirme jamais un résultat négatif).
Par convention, les tests statistiques calculent la probabilité qu'un ensemble de données soit dû au hasard (la valeur p) et si celle-ci est inférieure à un seuil fixe (alpha), la notion que les données sont dues au hasard est rejetée. Généralement, un intervalle de confiance est également indiqué. Lorsque alpha est fixé, le plus souvent à 0.05, le bêta sera fonction des autres caractéristiques du test statistique. L'une des formules les plus simples reliant alpha, bêta, changement de moyenne, écart type des données et taille de l'échantillon est illustrée dans Équation 1. Équation 1 décrit les relations de pouvoir pour un test d'un grand échantillon d'une variable de résultat continue dans une seule population avec une moyenne et un écart type connus :
où n est la taille de l'échantillon, σ est l'écart type de l'échantillon, μ est la moyenne de l'échantillon, μ0 est la moyenne de la population, ES est la taille de l'effet et Z est le score Z correspondant à la valeur en indice. Différents tests statistiques (par exemple, tests t pour les variables continues, tests t pour les proportions, χ2 tests, tests d'analyse de variance [ANOVA], etc.) auront des formules quelque peu différentes pour le bêta, mais en général, le bêta (et donc la probabilité d'une erreur de type II) diminuera avec des échantillons plus grands, des choix moins restrictifs de alpha, des écarts-types plus petits dans les données et des tailles d'effet plus importantes.
La puissance statistique est simplement 1–β et est plus fréquemment référencée que β. Alors que alpha est le plus souvent fixé à 0.05, une puissance statistique de 0.8 est généralement considérée comme adéquate pour la détection d'associations, bien que dans certains cas, elle soit portée à 0.9. Malheureusement, alors que le choix de l'alpha est presque toujours explicitement énoncé dans une publication, il revient souvent au clinicien d'en déduire la puissance de l'étude, en particulier pour les résultats secondaires. Heureusement, des formules telles que Équation 1 se trouvent facilement dans les manuels courants ou dans les progiciels statistiques. En outre, de nombreux départements universitaires de statistiques ont mis à disposition des outils en ligne pour calculer la puissance statistique. Des formules telles que Équation 1 peut être utilisé pour calculer la plus petite taille d'effet qu'une étude particulière est susceptible de détecter. Il incombe ensuite au clinicien de décider si cette taille d'effet est suffisamment petite pour que des tailles d'effet plus petites soient cliniquement non pertinentes. Si des tailles d'effet plus petites sont toujours cliniquement pertinentes, le clinicien développant une voie doit prendre en compte la possibilité qu'il y ait une taille d'effet petite mais réelle, qu'une erreur de type II ait été commise, et ajuster les meilleurs ou les pires scénarios en conséquence. .
EXEMPLES DE DÉVELOPPEMENT DE PARCOURS
Nous donnons maintenant quelques exemples illustratifs de l'analyse discutée précédemment. Premièrement, nous présentons un scénario de cas qui illustre le type d'analyse décrit. Ensuite, nous passons en revue quelques exemples de médicaments qui ont été introduits dans les protocoles chirurgicaux de routine et qui ont causé des dommages aux patients ; cela illustre les écueils du développement de la voie. Enfin, nous présentons les éléments d'un parcours de prothèse totale de genou.
Cas illustratif : Adjuvants à la rachianesthésie
Supposons qu'un nouveau médicament (médicament X) a été développé qui augmente la durée de la rachianesthésie lorsqu'il est ajouté à la bupivacaïne. Votre groupe pratique une arthroplastie totale de la hanche et du genou sous rachianesthésie, mais doit parfois passer à une anesthésie générale en raison de temps chirurgicaux étonnamment longs. La voie articulaire totale utilise actuellement des rachidiens à la bupivacaïne seule, mais envisage d'ajouter le médicament X à la voie articulaire totale pour prolonger la durée de la rachianesthésie et réduire les conversions inattendues en anesthésie générale. Une première étude a comparé la rachianesthésie à la bupivacaïne au médicament X plus bupivacaïne, avec 500 patients dans le groupe de traitement et 500 dans le groupe témoin. L'étude a révélé que la rachianesthésie avec de la bupivacaïne fournissait une anesthésie chirurgicale adéquate pendant seulement 180 minutes, tandis que la bupivacaïne avec le médicament X fournissait une anesthésie chirurgicale adéquate pendant 200 minutes (IC à 95 % 195-205 minutes, p < 05). Les critères de jugement secondaires comprenaient l'incidence des vomissements les jours 1 à 3 postopératoires et la rétention urinaire nécessitant une sonde de Foley. Dans le bras contrôle, 3% et dans le bras traitement 4% des patients ont vomi après l'opération, mais ce résultat n'était pas statistiquement significatif. Dans le bras contrôle, 2% et dans le bras traitement 3% des patients avaient une rétention urinaire ; cependant, cela n'était pas non plus statistiquement significatif. Le médicament coûte 50 $ par dose.
Analyse des coûts et des avantages
Même pour une question relativement simple (et artificielle) comme celle-ci, une analyse complète peut devenir complexe. Nous présentons donc une version abrégée de la procédure :
- Identifier les objectifs et les options de traitement. Nous nous limitons à l'objectif d'allonger la rachianesthésie pour réduire les conversions en anesthésie générale. Des alternatives à l'inclusion du médicament X doivent être explorées. Le médicament X doit être évalué non pas dans le vide, mais plutôt en concurrence avec d'autres techniques. Par exemple, d'autres médicaments peuvent être disponibles qui allongent l'anesthésie rachidienne pendant un temps comparable, ou simplement augmenter la dose rachidienne peut être faisable pour allonger l'anesthésie chirurgicale. Alternativement, la sous-population susceptible d'avoir un temps opératoire plus long peut être identifiée, et ces patients pourraient recevoir automatiquement une anesthésie générale ou le médicament X pourrait leur être réservé. Les risques et les avantages de chacune de ces options doivent être considérés individuellement et comparés à l'utilisation courante du médicament X.
- Identifier les façons dont chaque traitement interagit avec le reste de la voie. Bien qu'aucune restriction n'ait été mentionnée, nous aurions besoin de confirmer que l'utilisation du médicament X ne nécessite pas de surveillance postopératoire particulière (comme l'oxymétrie de pouls continue), une modification des soins infirmiers (comme la modification des précautions contre les chutes) ou un changement de physiothérapie ( tels que retarder la mobilisation) ou nécessitent des modifications à d'autres parties de la voie anesthésique et chirurgicale. Si des restrictions ou des interactions sont identifiées, elles doivent être prises en compte à l'étape 3.
- Identifier les risques, les coûts et les avantages. Pour cette illustration, nous limitons les analyses aux risques, avantages et coûts auxquels il est fait allusion dans l'étude. Le principal avantage serait une augmentation de la durée de l'anesthésie chirurgicale et une réduction du besoin de passer à l'anesthésie générale, qui comporte bien sûr un certain nombre de risques et de coûts associés. Les risques comprennent un risque accru de rétention urinaire et de vomissements postopératoires. Bien que l'étude initiale n'ait lié aucun de ces résultats au médicament X, nous verrons à l'étape 4 que le pire scénario doit inclure le risque que cette étude ait commis une erreur de type II. Les coûts sont plus faciles à quantifier : cela ajoutera 50 $ en frais de médicaments pour chaque chirurgie.
- Faites des estimations numériques des risques, des coûts et des avantages identifiés à l'étape 3. Les bénéfices de ce médicament dépendront des spécificités de votre établissement. Par exemple, supposons qu'en examinant vos dossiers, vous constatiez que vous avez effectué 500 arthroplasties totales au cours de l'année écoulée, et que 5 d'entre elles ont nécessité une conversion inattendue en anesthésie générale. Les temps chirurgicaux totaux pour les cinq cas étaient de 195, 250, 200, 190 et 220 minutes. En utilisant l'intervalle de confiance publié, l'utilisation du médicament X peut avoir éliminé le besoin de passer à l'anesthésie générale dans 2 des cas (si cela allonge le temps à 195 minutes) à 3 des cas (si cela allonge le temps à 205 minutes).
Les coûts de ce médicament, s'il est utilisé sur tous les patients, seraient de 25,000 2 $ de plus par année. Si une sous-population à haut risque pouvait être identifiée pour l'utilisation du médicament, celle-ci pourrait potentiellement être réduite. L'étude n'a trouvé aucun lien entre la rétention urinaire ou les vomissements postopératoires avec le médicament X, donc dans le meilleur des cas, l'ajout du médicament X n'introduit pas tout nouveau risque de complication. Cependant, considérons la puissance de cette étude. Vraisemblablement, les données sur la rétention urinaire et les vomissements postopératoires ont été analysées à l'aide d'un test de proportions. En utilisant des calculateurs de puissance en ligne ou des packages de statistiques, nous pouvons estimer l'ampleur de l'effet qui serait détecté. En supposant un taux de base de rétention urinaire de 5 % (basé sur le bras témoin de l'étude), le médicament devrait augmenter le taux à 6 %-0.8 % pour atteindre une puissance d'environ 0.8. Des tailles d'effet inférieures à cela ne seront pas détectées de manière fiable. Pour les vomissements postopératoires, une puissance de 7 correspond au médicament augmentant le taux de vomissements à XNUMX %. Si les taux de vomissements postopératoires et de rétention urinaire faisaient plus que doubler, la plupart des cliniciens considéreraient qu'il s'agit d'une augmentation cliniquement pertinente, mais elle ne serait pas détectée de manière fiable par l'étude discutée. Par conséquent, nous devons considérer la possibilité que l'étude ait commis une erreur de type II et ajuster notre pire scénario de manière appropriée.
Si l'étude a commis une erreur de type II, que devrions-nous utiliser pour nos estimations de la taille de l'effet ? L'estimation la plus raisonnable peut être obtenue en examinant l'étude elle-même; au fur et à mesure que les sujets sont ajoutés, les taux convergent vers leurs vraies valeurs et peuvent éventuellement franchir un seuil de signification statistique. Dans l'étude discutée, les vomissements postopératoires étaient de 3 % dans le bras contrôle et de 4 % dans le bras traitement, et la rétention urinaire était de 2 % dans le bras contrôle et de 3 % dans le bras traitement. Nous pouvons utiliser ces augmentations pour éclairer nos estimations.
En supposant que notre établissement ait des taux similaires de vomissements les jours 1 à 3 postopératoires (3 %) et des taux similaires de rétention urinaire (2 %), nous estimons qu'ils augmenteraient à 4 % et 3 %. Avec un volume chirurgical de 500 patients par an, cela correspond à 5 cas supplémentaires de rétention urinaire et 5 cas supplémentaires de vomissements postopératoires par an. - Utilisez les estimations pour construire les meilleurs et les pires scénarios. Meilleur cas : éliminer trois conversions en anesthésie générale par an. Ajoutez 25,000 25,000 $ aux coûts des soins de santé. Pire cas : Éliminer deux conversions en anesthésie générale par an. Ajoutez 10 10 $ aux coûts des soins de santé. Créer cinq cas supplémentaires de rétention urinaire et cinq cas supplémentaires de vomissements postopératoires. Dans ce cas particulier, nous notons que les bénéfices du médicament peuvent être améliorés si nous pouvons identifier avec précision une sous-population susceptible d'en bénéficier. Par exemple, si le médicament n'est administré qu'aux XNUMX % de patients présentant le risque le plus élevé de longues durées d'intervention, le coût et la morbidité associés aux vomissements postopératoires et à la rétention urinaire diminueraient d'un facteur XNUMX. Si la sous-population est précisément identifié, le nombre de conversions en anesthésie générale peut être inchangé ou peu affecté.
- Choisissez la voie la plus susceptible de bénéficier au patient. Selon les risques liés aux conversions en anesthésie générale, ce médicament peut ou non valoir la peine d'être ajouté à la voie anesthésique. En fin de compte, le jugement clinique est nécessaire pour prendre une décision. Cependant, en utilisant le cadre discuté, le clinicien est nettement mieux informé que s'il prenait simplement une décision basée sur l'intuition seule.
- Affiner continuellement les estimations des risques, des coûts et des avantages. Dans ce scénario, le volume chirurgical annuel de l'établissement (500) est égal au nombre de patients impliqués dans chaque bras de l'étude. Compte tenu de cela, si l'établissement suit ses propres taux de complications avant et après le changement, il devrait être en mesure de déterminer rapidement les véritables risques, avantages et coûts de l'intervention et de prendre une décision plus éclairée que l'analyse initiale.
Étonnamment, il arrive souvent que le nombre de patients inscrits à des études dans la littérature publiée soit beaucoup plus petit que le nombre de chirurgies pratiquées même dans de petites institutions. Par exemple, une méta-analyse récente sur les effets des opioïdes rachidiens n'incluait qu'environ 100 à 150 sujets et témoins pour l'analyse des vomissements postopératoires et de la rétention urinaire pour le fentanyl intrathécal, malgré l'utilisation longue et généralisée du fentanyl dans la rachianesthésie. Pour cette raison, l'analyse des données internes est souvent utile pour évaluer le succès ou l'échec du parcours. L'utilisation de données internes évite également le problème des études publiées utilisant des populations de patients, des médicaments ou des techniques légèrement différents de ceux utilisés dans l'établissement d'origine.
EXEMPLES DE VOIES AYANT CAUSÉ DES DOMMAGES AUX PATIENTS
La section précédente était une illustration hypothétique du développement d'une partie d'un parcours. Dans cette section, nous prenons un moment pour discuter des cas historiques dans lesquels un préjudice pour le patient a résulté de l'introduction d'un nouveau médicament dans le cadre des soins périopératoires de routine. Bien que ces médicaments aient été introduits avant que la notion de voies chirurgicales et anesthésiques ne devienne courante, l'expérience avec ces médicaments donne un aperçu de certains des risques liés à l'application de nouveaux traitements à de grandes cohortes de patients.
Énoxaparine et prophylaxie de la thromboembolie veineuse
L'énoxaparine a été la première héparine de bas poids moléculaire approuvée par la Food and Drug Administration des États-Unis pour un usage général. Peu de temps après l'approbation du médicament en mai 1993, il est entré dans une utilisation courante et généralisée comme prophylaxie de la thromboembolie veineuse. Étant donné que de nombreuses chirurgies orthopédiques, y compris l'arthroplastie totale des articulations, présentent un risque élevé de thromboembolie veineuse et que l'anesthésie péridurale ou rachidienne était souvent l'anesthésique préféré dans ces cas, l'énoxaparine était souvent utilisée en conjonction avec l'anesthésie neuraxiale.
Avant le développement de l'énoxaparine, l'héparine sous-cutanée non fractionnée était largement utilisée pour la prophylaxie de la thromboembolie veineuse. Alors que le risque d'hématome épidural associé à l'administration d'énoxaparine était initialement jugé comparable à celui de l'administration d'héparine sous-cutanée, les différences pharmacologiques entre l'héparine de bas poids moléculaire et l'héparine non fractionnée avaient été sous-estimées.
Peu de temps après l'introduction, la Food and Drug Administration des États-Unis a commencé à recevoir des rapports d'hématome épidural associés à l'administration d'énoxaparine. En décembre 1997, l'administration a émis un avis de santé publique indiquant qu'elle avait reçu plus de 30 rapports d'hématome épidural postneuraxial associé à l'énoxaparine et exigeait que l'énoxaparine porte un avertissement de boîte noire indiquant un risque important de préjudice pour le patient. En avril 1998, le nombre de rapports était passé à plus de 40. La Food and Drug Administration des États-Unis a approché l'American Society of Regional Anesthesia and Pain Medicine pour élaborer de nouvelles directives sur l'utilisation de l'énoxaparine avec une anesthésie neuraxiale. Ces lignes directrices ont été publiées en novembre 1998 et recommandaient une utilisation beaucoup plus prudente de l'énoxaparine.
Aprotinine et réduction des transfusions périopératoires
L'aprotinine est une petite molécule peptidique qui agit comme antifibrinolytique en inhibant la trypsine et les enzymes protéolytiques apparentées. Il a été utilisé le plus souvent en chirurgie cardiaque, où il a été démontré qu'il réduisait considérablement les besoins en transfusion, et son utilisation a été étudiée dans d'autres types de chirurgies, telles que les procédures orthopédiques. Bien qu'une méta-analyse n'ait montré aucun risque accru de mortalité, d'infarctus du myocarde ou d'insuffisance rénale, de vastes études observationnelles ont contredit ces résultats et ont démontré un risque accru d'insuffisance rénale postopératoire. D'autres études observationnelles se sont concentrées sur le suivi à long terme et ont confirmé l'augmentation de la morbidité et de la mortalité associées à l'aprotinine, en particulier en ce qui concerne non seulement l'insuffisance rénale, mais aussi les accidents vasculaires cérébraux, les décès et les infarctus du myocarde non mortels. Les ventes d'aprotinine ont été arrêtées en 2008; l'aprotinine a été largement remplacée par l'acide tranexamique et l'acide aminocaproïque. Il reste une certaine controverse quant à savoir si les augmentations observées de l'insuffisance rénale étaient dues à l'effet de l'aprotinine ou à un autre facteur de confusion.
a lieu
Dans ces deux exemples, un préjudice important pour le patient a résulté de l'introduction d'un nouveau médicament dans une voie anesthésique et chirurgicale parce qu'il n'y avait pas suffisamment de données pour indiquer le potentiel de préjudice pour le patient. Les risques ne sont devenus apparents qu'après qu'un plus grand nombre de patients aient été traités et que des complications importantes se soient produites chez les patients.
Dans le premier cas, les héparines de bas poids moléculaire et l'anesthésie neuraxiale, la difficulté à prédire le préjudice subi par le patient était due en grande partie à la fréquence extrêmement faible de l'événement indésirable. Si l'on suppose que le risque de base d'hématome spinal est de 1:150,000 XNUMX, même une augmentation relativement importante du risque d'hématome nécessite des échantillons de grande taille pour détecter un risque accru. Des tailles d'échantillons aussi importantes ne peuvent souvent pas être obtenues de manière réaliste avant l'introduction d'un médicament, et seule la surveillance post-approbation ou le développement de registres cliniques de haute qualité détectera ces événements indésirables rares, mais potentiellement catastrophiques.
Dans le second cas, aprotinine et insuffisance rénale, plusieurs facteurs peuvent être identifiés. Les investigations initiales n'étaient pas axées sur le risque accru d'insuffisance rénale et soit elles n'ont pas étudié ce risque, soit l'étude était de faible puissance. De plus, certains pensaient que les complications associées à l'aprotinine étaient de nature transitoire et qu'il n'y avait aucun risque à long terme associé à l'aprotinine. De toute évidence, cela n'a pu être étudié que des années après l'utilisation de l'aprotinine.
Ces cas mettent en évidence les risques associés aux nouveaux agents thérapeutiques ou aux anciens agents thérapeutiques utilisés dans des situations nouvelles. Les études préliminaires peuvent enquêter sur les mauvais risques ou être sous-alimentées, ou les risques peuvent être à long terme et ne devenir évidents que bien après la période d'étude. Compte tenu de cela, lors de l'examen des risques et des avantages pour le patient, le clinicien doit également prendre en compte les risques inconnus ou non quantifiés et inclure l'agent uniquement si le rapport entre les risques et les avantages connus et quantifiables est extrêmement positif. Pour les médicaments avec une longue histoire d'utilisation et des risques bien définis, moins de prudence est justifiée.
COMPOSANTES D'UN PARCOURS COMPLET : ARTHROPLASTIE TOTALE DU GENOU
Dans cette section, nous présentons les éléments d'un cheminement chirurgical pour l'arthroplastie totale du genou. Ceci est montré dans Tableau 4. Cependant, au lieu de présenter des recommandations finales (comme ce serait le cas dans un parcours complet), nous soulignons les problèmes communs rencontrés lors de l'élaboration de différents aspects du parcours, ainsi que les médicaments et les techniques fréquemment utilisés. Ceci est fait pour éviter d'impliquer qu'il existe un consensus final autour de la voie "correcte" pour l'arthroplastie totale de l'articulation - même si un tel consensus existait, il deviendrait rapidement obsolète à mesure que de nouvelles études, médicaments et techniques deviendraient disponibles. Les prestataires ayant différentes populations de patients et différentes surspécialités peuvent développer différentes voies adaptées à leur établissement.
TABLEAU 4
| Voie anesthésique pour l'arthroplastie totale de l'articulation |
|---|
| Objectifs du parcours Les objectifs de la voie doivent être clairement énoncés et comprennent généralement la réduction de la mortalité, de la morbidité et des coûts ; augmentation de la satisfaction des patients ; et un meilleur contrôle de la douleur. Les objectifs doivent impliquer de véritables paramètres cliniques lorsque cela est possible et être indépendants des moyens, par exemple, réduire les scores de douleur postopératoire est un objectif plus approprié que réduire la consommation postopératoire d'opioïdes. |
| Sélection des patients Des facteurs de risque modifiables, tels que le tabagisme, un diabète mal contrôlé, l'obésité et la consommation de drogues à des fins récréatives, peuvent influer sur les taux de complications chirurgicales. La voie peut indiquer quand la chirurgie doit être retardée pour répondre à ces facteurs. De plus, les comorbidités non modifiables peuvent créer un risque chirurgical inacceptable ; des critères de sélection des patients peuvent être inclus dans un cheminement. Évidemment, cela doit être coordonné avec l'orthopédie. |
| Éducation préopératoire et planification préadmission Souvent, les patients sont vus systématiquement dans une clinique préopératoire d'anesthésie. Cette partie du cheminement offre la possibilité d'identifier les caractéristiques du patient qui entrent en conflit avec les éléments par défaut du cheminement anesthésique et de les traiter avant l'opération. Par exemple, un patient allergique à la pénicilline peut subir un test cutané pour déterminer si le patient peut recevoir des céphalosporines. De plus, si la voie comprend des cathéters nerveux périphériques continus, cela peut fournir une opportunité pour l'éducation du patient. |
| Liste de contrôle avant la procédure Cet élément de la voie comprend fréquemment l'identification du patient, le marquage du site, la confirmation des allergies et des comorbidités, la confirmation de la disponibilité des produits sanguins, la confirmation du statut d'anticoagulation et les vérifications finales des valeurs de laboratoire. |
| Prémédication orale/analgésie multimodale L'optimisation du contrôle de la douleur doit être contrebalancée par des effets secondaires indésirables tels qu'une sédation excessive. La liste suivante répertorie les agents couramment utilisés, ainsi que leurs avantages et leurs inconvénients. |
| Agent | Avantages | Inconvénients |
|---|---|---|
| L'acétaminophène | Réduire les scores de douleur postopératoire, épargner les opioïdes | Hépatotoxicité |
| Gabapentine/prégabaline | Réduire les scores de douleur postopératoire, épargner les opioïdes, peut réduire l'incidence de la douleur post-chirurgicale chronique et avoir des avantages chez les patients souffrant de douleur chronique existante | Augmentation de la sédation, en particulier chez les personnes âgées ; augmentation de la dépression respiratoire avec des doses > 300 mg |
| Inhibiteurs de la cyclooxygénase 2 | Réduire les scores de douleur postopératoire, épargner les opioïdes | Insuffisance rénale; base de preuves affaiblie par des publications retirées |
| Opioïdes oraux (p. ex., oxycodone SR) | Réduire les scores de douleur postopératoire | Risque accru de dépression respiratoire avec une dose d'oxycodone > 10 mg |
| Voie anesthésique pour l'arthroplastie totale de l'articulation |
|---|
| Utilisation de l'anesthésie régionale pour le contrôle de la douleur postopératoire Il existe un large éventail de techniques d'anesthésie régionale associées à l'arthroplastie totale du genou, ainsi que des variations importantes en termes de coût et d'efficacité. Le choix de la technique affectera d'autres éléments du parcours anesthésique et chirurgical. De plus, les approches évoluent rapidement à mesure que de nouvelles techniques, équipements et agents deviennent disponibles. La liste suivante répertorie les sites couramment utilisés pour l'anesthésie régionale, ainsi que les avantages et les inconvénients. |
| Technique | Avantages | Inconvénients |
|---|---|---|
| Bloc péridural | Considéré comme l'étalon-or pour l'analgésie postopératoire pour une gamme de chirurgies | Le profil des effets secondaires peut interférer avec le parcours de soins moderne et un faible risque de résultat catastrophique (par exemple, hématome épidural). |
| Bloc nerveux fémoral | Soulage la majorité des douleurs postopératoires, sans les inconvénients de la péridurale,; associé à de meilleurs résultats à 6 semaines dans un essai | La faiblesse musculaire peut interférer avec la rééducation. Faible risque (2 à 4 pour 10,000 XNUMX) de lésion nerveuse à long terme, mais le choix global de l'anesthésique modifie le risque de lésion nerveuse. |
| Blocage du nerf sciatique | Réduction de la douleur postérieure au genou | Risque de neuropathie similaire au bloc du nerf fémoral. Les résultats des études varient, allant de l'amélioration de l'analgésie à la mobilisation précoce à ajouter peu ou pas d'analgésie au bloc fémoral existant. L'utilisation du bloc sciatique est controversée et peu susceptible d'améliorer les résultats à long terme. |
| Bloc sélectif du nerf tibial | Réduction de la probabilité de pied tombant | Injection plus proche du pli poplité ; risque de lésion du nerf péronier avec abord latéral-médial ou lésion vasculaire. |
| Canal de l'adducteur | Soulagement de la douleur similaire au blocage du nerf fémoral avec réduction de la faiblesse musculaire; efficace dans le traitement de la douleur intense existante | Plus près du site chirurgical ; technique évolutive. |
| Analgésie par infiltration locale | Facile et rapide à réaliser, pas de faiblesse musculaire | Évolution des preuves d'efficacité dans ce contexte. Cependant, les experts soulignent la mauvaise qualité de certaines des études existantes. Le succès de la technique dépend probablement de l'opérateur. Associée à une paralysie transitoire du nerf péronier. |
| Une fois qu'un ou plusieurs sites sont choisis pour l'anesthésie régionale, le prestataire peut utiliser différentes techniques pour obtenir une analgésie postopératoire, résumées ci-après. | ||
| Coup unique | Rapide à exécuter; faible coût; efficace. | Durée la plus courte (peut être bénéfique si une récupération rapide de la force musculaire est nécessaire pour la thérapie physique). |
| Cathéter nerveux | Analgésie améliorée par rapport à la technique à injection unique. Durée d'analgésie la plus longue ; titrable; contrôle du degré de blocage du moteur en modifiant le débit. | Plus difficile et plus long à réaliser ; plus cher; nécessite une surveillance postopératoire. |
| Formulations à libération prolongée d'anesthésiques locaux (p. ex., bupivacaïne liposomale) | Aussi rapide à exécuter qu'un bloc à un seul coup, avec une durée de bloc plus longue. | Par rapport à la bupivacaïne, actuellement peu de preuves d'efficacité. Cher. Limite la possibilité de refaire un bloc. Profil d'innocuité et d'effets secondaires en cours d'élaboration. |
| Anesthésie chirurgicale Les options d'anesthésie chirurgicale sont résumées ci-après. |
||
| Anesthésie | Avantages | Inconvénients |
|---|---|---|
| Spinal | Associé à de meilleurs résultats, diminution des besoins en services de soins intensifs. | Peut être techniquement difficile sur certains patients. Résultats catastrophiques occasionnels (p. ex., hématome épidural). La durée de la rachianesthésie peut être insuffisante pour une intervention chirurgicale. Les patients peuvent être réticents à être « éveillés » pour la chirurgie |
| Épidurale | Avantages similaires à ceux de la colonne vertébrale, mais peuvent être utilisés pour l'analgésie postopératoire et les chirurgies de plus longue durée. | Peut être techniquement difficile sur certains patients. Résultats catastrophiques occasionnels (par ex. hématome épidural). Les patients peuvent être réticents à être « éveillés » pour la chirurgie. |
| Général | Amnésie complète. | Associé à de mauvais résultats par rapport à la colonne vertébrale. Résultat catastrophique occasionnel (p. ex. voies respiratoires difficiles); risque accru de dépression respiratoire. |
| L'anesthésie neuraxiale a été associée à de meilleurs résultats; cependant, cette modalité n'est pas toujours la modalité préférée. Si une anesthésie neuraxiale est utilisée, des décisions concernant l'inclusion ou l'exclusion d'opioïdes à action longue ou courte doivent être prises ; cette décision peut être complexe car elle affecte de nombreux éléments du cheminement ultérieur (suivi postopératoire, rééducation, etc.). Même les patients qui reçoivent une anesthésie neuraxiale ont généralement besoin d'une sédation, et certaines voies peuvent spécifier les agents ou les niveaux de sédation souhaités, en partie pour éviter une sédation excessive des patients. De plus, certains patients ne sont probablement pas adaptés à l'anesthésie neuraxiale, par exemple, en raison du temps chirurgical prévu pour les révisions articulaires ; ce critère et d'autres (tels que la colonne vertébrale difficile) pour procéder à une anesthésie générale peuvent être décrits dans cette section. | ||
| Médicaments peropératoires Les médicaments peropératoires peuvent inclure des antibiotiques de première et de deuxième intention, des antiémétiques préférés pour la rachianesthésie par rapport à l'anesthésie générale, et des sédatifs préférés si l'anesthésie rachidienne ou péridurale est choisie. L'anticoagulation est généralement débutée en période postopératoire par l'équipe chirurgicale mais peut être commentée ici. Il convient de noter que la dexaméthasone peropératoire semble améliorer les scores de douleur postopératoire et fournir un antiémétique efficace, sans augmenter le risque d'infection ou d'autres complications périopératoires. |
| Voie anesthésique pour l'arthroplastie totale de l'articulation |
|---|
| Objectifs de transfusion peropératoire et options de conservation du sang La transfusion sanguine comporte un certain nombre de risques,53 et l'un des objectifs de la voie peut être de minimiser la perte de sang et donc les besoins en transfusion. Une grande variété de techniques peuvent minimiser la perte de sang, dont certaines sont résumées ci-dessous. |
| Technique | Avantages | Inconvénients |
|---|---|---|
| Hypotension peropératoire | Perte de sang réduite. | Vigilance et surveillance accrues requises. Risque d'ischémie des organes cibles. La sous-réanimation peut contribuer à l'intolérance orthostatique postopératoire, altérant la mobilisation précoce. |
| Utilisation du garrot | Une perte de sang réduite et des protocoles existent pour une utilisation appropriée. | Risque de lésion ischémique ou de neuropathie axonale ou effet sur la fonction du quadriceps. |
| Thermorégulation appropriée | Réduction de la perte de sang grâce au maintien de la cascade de coagulation, amélioration de la récupération. | |
| Balayage cellulaire | Réduction des besoins en produits sanguins allogéniques. | Coût et complexité supplémentaires. |
| Drains de réinfusion | Réduction des besoins en produits sanguins allogéniques. | Coût et complexité supplémentaires. |
| L'acide tranexamique | Réduction de la perte de sang due à l'antifibrinolyse. | Association avec des convulsions. Aucun risque accru connu d'événements thrombotiques, mais n'a été utilisé que récemment dans cette population chirurgicale. |
| Contrôle de la douleur postopératoire Les voies traitent souvent du contrôle de la douleur pour les patients souffrant de douleur chronique ou utilisant des opioïdes, ainsi que pour ceux qui n'en ont pas. En règle générale, cette section commentera à la fois les débits de perfusion attendus pour tout cathéter nerveux périphérique, ainsi que les adjuvants tels que l'administration d'opioïdes contrôlée par le patient, la kétamine ou d'autres agents. |
||
| Considérations relatives au parcours chirurgical orthopédique Les parcours commentent parfois la manière dont ils interagissent avec le parcours du chirurgien pour expliquer clairement pourquoi des recommandations particulières sont faites. |
||
Les éléments individuels de la voie comprennent des sujets aussi divers que la planification préopératoire, l'éducation du patient, la gestion de l'anesthésie peropératoire, la gestion de la douleur postopératoire et les objectifs liquidiens et hémodynamiques. Un cheminement terminé, en plus de contenir des recommandations fermes et détaillées sur la gestion, contiendrait un addenda décrivant les preuves qui ont été utilisées pour prendre des décisions sur le cheminement. Comme nous l'avons vu, cependant, même après avoir identifié la littérature appropriée, il y a souvent une quantité importante d'analyse et de jugement qui doit être utilisée pour appliquer la littérature à la voie.
Un parcours final n'est utile que s'il est largement distribué à tous les prestataires concernés. En plus de la diffusion électronique, les parcours peuvent être affichés sous forme d'affiche. Cela permet au fournisseur d'anesthésie d'avoir facilement accès aux étapes du parcours à différentes phases des soins du patient. Les emplacements communs pour afficher les informations sur les voies comprennent les zones préopératoires, les baies d'anesthésie régionale, les salles d'opération et les salles de travail d'anesthésie. De plus, avec l'avènement des systèmes de dossiers de santé électroniques, de nombreux établissements ont la capacité de créer des ensembles d'ordonnances, qui créent automatiquement des ordonnances associées au cheminement.
CONCLUSION
Les voies d'anesthésie et d'analgésie périopératoires offrent un moyen unique d'améliorer les soins aux patients et de réduire les coûts en déployant les ressources et la technologie existantes d'une manière fondée sur des preuves. Le développement de voies doit donc être considéré comme un élément essentiel de la pratique de l'anesthésiste.
Références
- Pugely AJ, Martin CT, Gao Y, Mendoza-Lattes S, Callaghan JJ : Différences dans les complications à court terme entre l'anesthésie rachidienne et générale pour l'arthroplastie totale primaire du genou. J Bone Joint Surg Am 2013;95(3):193–199.
- Memtsoudis SG, Sun X, Chiu YL, et al. Efficacité comparative périopératoire de la technique anesthésique chez les patients orthopédiques. Anesthésiologie 2013;118(5):1046–1058.
- Stundner O, Chiu YL, Sun X, et al : résultats périopératoires comparatifs associés à l'anesthésie neuraxiale par rapport à l'anesthésie générale pour l'arthroplastie totale bilatérale simultanée du genou. Reg Anesth Pain Med 2012;37(6):638–644.
- Memtsoudis SG, Stundner O, Rasul R, et al : Apnée du sommeil et arthroplastie articulaire totale sous divers types d'anesthésie : Une étude basée sur la population des résultats périopératoires. Reg Anesth Pain Med 2013;38(4):274–281.
- Liu J, Ma C, Elkassabany N, Fleisher LA, Neuman MD : L'anesthésie neuraxiale diminue le risque d'infection systémique postopératoire par rapport à l'anesthésie générale dans l'arthroplastie du genou. Anesth Analg 2013;117(4):1010–1016.
- Rotter T, Kinsman L, James E, et al : Cheminements cliniques : effets sur la pratique professionnelle, les résultats pour les patients, la durée du séjour et les coûts hospitaliers. Cochrane Database Syst Rev 2010(3):CD006632.
- Shiboski S. Épidémiologie et biostatistique. 2015. http://www.epibiostat.ucsf.edu/biostat/samplesize.html. Consulté le 30 juin 2015.
- Brant R. Calculs de la taille de l'échantillon. 2015. http://www.stat.ubc.ca/~rollin/stats/ssize/. Consulté le 30 juin 2015.
- Popping DM, Elia N, Marret E, Wenk M, Tramer MR : Opioïdes ajoutés aux anesthésiques locaux pour l'anesthésie intrathécale à injection unique chez les patients subissant une chirurgie mineure : une méta-analyse d'essais randomisés. Douleur 2012;153(4):784–793.
- Horlocker TT, Wedel DJ : Bloc neuraxial et héparine de bas poids moléculaire : Équilibrer l'analgésie périopératoire et la thromboprophylaxie. Reg Anesth Pain Med 1998;23(6 Suppl 2):164–177.
- Rossignol SL. De la Food and Drug Administration. JAMA 1999;282(1):19.
- Wysowski DK, Talarico L, Bacsanyi J, Botstein P : hématome spinal et épidural et héparine de bas poids moléculaire. N Engl J Med 1998;338(24):1774–1775.
- Bidstrup BP, Royston D, Sapsford RN, Taylor KM : Réduction de la perte de sang et de l'utilisation du sang après un pontage cardio-pulmonaire avec une dose élevée d'aprotinine (Trasylol). J Thorac Cardiovasc Surg 1989;97(3):364–372.
- Royston D, Bidstrup BP, Taylor KM, Sapsford RN : Effet de l'aprotinine sur le besoin de transfusion sanguine après une chirurgie à cœur ouvert répétée. Lancet 1987;2(8571):1289–1291.
- Mahdy AM, Webster NR : Agents hémostatiques systémiques périopératoires. Br J Anaesth 2004;93(6):842–858.
- Shiga T, Wajima Z, Inoue T, Sakamoto A : Aprotinine en chirurgie orthopédique majeure : une revue systématique des essais contrôlés randomisés. Anesth Analg 2005;101(6):1602–1607.
- Sedrakyan A, Treasure T, Elefteriades JA : Effet de l'aprotinine sur les résultats cliniques du pontage aortocoronarien : une revue systématique et une méta-analyse d'essais cliniques randomisés. J Thorac Cardiovasc Surg 2004;128(3):442-–448.
- Mangano DT, Tudor IC, Dietzel C, Étude multicentrique de recherche sur l'ischémie périopératoire G, Ischémie R, Éducation F : Le risque associé à l'aprotinine en chirurgie cardiaque. N Engl J Med 2006;354(4):353–365.
- Shaw AD, Stafford-Smith M, White WD, et al : L'effet de l'aprotinine sur les résultats après un pontage coronarien. N Engl J Med 2008;358(8):784–793.
- Mangano DT, Miao Y, Vuylsteke A, et al : Mortalité associée à l'aprotinine pendant 5 ans après un pontage coronarien. JAMA 2007;297(5):471–479.
- Furnary AP, Wu Y, Hiratzka LF, Grunkemeier GL, Page US 3rd : L'aprotinine n'augmente pas le risque d'insuffisance rénale chez les patients en chirurgie cardiaque. Diffusion 2007;116(11 Suppl):I127–I133.
- Schroeder DR : Statistiques : Détecter une réaction indésirable rare à un médicament à l'aide de déclarations spontanées. Reg Anesth Pain Med 1998;23(6 Suppl 2):183–189.
- Peersman G, Laskin R, Davis J, Peterson M : Infection dans les arthroplasties totales du genou : une revue rétrospective de 6489 2001 arthroplasties totales du genou. Clin Orthop Relat Res 392(15):23–XNUMX.
- Zhou TJ, Tang J, White PF : Propacétamol versus kétorolac pour le traitement de la douleur postopératoire aiguë après une arthroplastie totale de la hanche ou du genou. Anesth Analg 2001;92(6):1569–1575.
- Mishriky BM, Waldron NH, Habib AS : Impact de la prégabaline sur la douleur postopératoire aiguë et persistante : une revue systématique et une méta-analyse. Frère J Anaesth. 2015;114(1):10–31.
- Clarke H, Bonin RP, Orser BA, Englesakis M, Wijeysundera DN, Katz J : La prévention de la douleur post-chirurgicale chronique à l'aide de gabapentine et de prégabaline : une revue systématique et une méta-analyse combinées. Anesth Analg 2012;115(2):428–442.
- Sawan H, Chen AF, Viscusi ER, Parvizi J, Hozack WJ : La prégabaline réduit la consommation d'opioïdes et améliore les résultats chez les patients souffrant de douleur chronique subissant une arthroplastie totale du genou. Phys Sportsmed 2014;42(2):10–18.
- Weingarten TN, Jacob AK, Njathi CW, Wilson GA, Sprung J : Protocole analgésique multimodal et dépression respiratoire post-anesthésie pendant la phase I de récupération après arthroplastie totale. Reg Anesth Pain Med 2015;40(4):330–336.
- Lin J, Zhang L, Yang H : administration périopératoire d'inhibiteurs sélectifs de la cyclooxygénase-2 pour la gestion de la douleur postopératoire chez les patients après une arthroplastie totale du genou. J Arthroplastie. 2013;28(2):207–213 e2.
- Rothwell MP, Pearson D, Hunter JD, et al : L'oxycodone orale offre une analgésie équivalente à l'analgésie intraveineuse contrôlée par le patient après une arthroplastie totale de la hanche : une étude de non-infériorité randomisée, monocentrique, non aveugle. Br J Anaesth 2011;106(6):865–872.
- Pumberger M, Memtsoudis SG, Stundner O, et al : Une analyse de la sécurité de l'anesthésie neuraxiale péridurale et rachidienne dans plus de 100,000 2013 prothèses articulaires majeures consécutives des membres inférieurs. Reg Anesth Pain Med 38;6(515):519–XNUMX.
- Bateman BT, Mhyre JM, Ehrenfeld J, et al : Le risque et les résultats des hématomes épiduraux après un cathétérisme épidural périopératoire et obstétrical : un rapport du Consortium de recherche du Groupe multicentrique sur les résultats périopératoires. Anesth Analg 2013;116(6):1380–1385.
- Paul JE, Arya A, Hurlburt L, et al : Le blocage du nerf fémoral améliore les résultats de l'analgésie après une arthroplastie totale du genou : une méta-analyse d'essais contrôlés randomisés. Anesthésiologie 2010;113(5):1144–1162.
- Carli F, Clemente A, Asenjo JF, et al : Analgésie et résultat fonctionnel après arthroplastie totale du genou : infiltration périarticulaire vs bloc nerveux fémoral continu. Br J Anaesth 2010;105(2):185–195.
- Neal JM, Barrington MJ, Brull R, et al : Le deuxième avis de pratique de l'ASRA sur les complications neurologiques associées à l'anesthésie régionale et à la médecine de la douleur résumé 2015. Reg Anesth Pain Med 2015;40(5):401–430.
- Jacob AK, Mantilla CB, Sviggum HP, Schroeder DR, Pagnano MW, Hebl JR : Lésion nerveuse périopératoire après arthroplastie totale du genou : risque d'anesthésie régionale au cours d'une étude de cohorte de 20 ans. Anesthésiologie 2011;114(2):311–317.
- Sato K, Adachi T, Shirai N, Naoi N : bloc du nerf sciatique continu versus à injection unique ajouté au bloc du nerf fémoral continu pour l'analgésie après une arthroplastie totale du genou : une étude prospective, randomisée, en double aveugle. Reg Anesth Pain Med 2014;39(3):225–229.
- 38. Cappelleri G, Ghisi D, Fanelli A, Albertin A, Somalvico F, Aldegheri G : Le blocage continu du nerf sciatique améliore-t-il l'analgésie postopératoire et la rééducation précoce après une arthroplastie totale du genou ? Une étude prospective, randomisée, en double aveugle. Reg Anesth Pain Med 2011;36(5):489–492.
- Abdallah FW, Chan VW, Gandhi R, Koshkin A, Abbas S, Brull R : Les effets analgésiques du bloc proximal, distal ou non sciatique sur la douleur postérieure au genou après une arthroplastie totale du genou : un essai randomisé en double aveugle contrôlé par placebo. Anesthésiologie 2014;121(6):1302–1310.
- Safa B, Gollish J, Haslam L, McCartney CJ : Comparaison des effets du bloc du nerf sciatique à un seul coup par rapport à l'infiltration anesthésique locale de la capsule postérieure sur l'analgésie et les résultats fonctionnels après une arthroplastie totale du genou : un essai prospectif, randomisé, en double aveugle et contrôlé. J Arthroplasty 2014;29(6):1149–1153.
- Wegener JT, van Ooij B, van Dijk CN, et al : douleur à long terme et incapacité fonctionnelle après une arthroplastie totale du genou avec et sans injection unique ou bloc du nerf sciatique continu en plus du bloc du nerf fémoral continu : une étude prospective d'un an suivi d'un essai contrôlé randomisé. Reg Anesth Pain Med 1;2013(38):1–58.
- Sinha SK, Abrams JH, Arumugam S, et al : Le bloc du nerf fémoral avec bloc du nerf tibial sélectif fournit une analgésie efficace sans pied tombant après une arthroplastie totale du genou : une étude prospective, randomisée et à l'insu des observateurs. Anesth Analg 2012;115(1):202–206.
- Jaeger P, Zaric D, Fomsgaard JS, et al : bloc du canal adducteur par rapport au bloc du nerf fémoral pour l'analgésie après une arthroplastie totale du genou : une étude randomisée en double aveugle. Reg Anesth Pain Med 2013;38(6):526–532.
- Jaeger P, Grevstad U, Henningsen MH, Gottschau B, Mathiesen O, Dahl JB : Effet du bloc du canal adducteur sur la douleur postopératoire sévère établie après une arthroplastie totale du genou : une étude randomisée. Acta Anaesth Scand 2012;56(8):1013–1019.
- Andersen LO, Kehlet H : Efficacité analgésique de l'analgésie par infiltration locale dans l'arthroplastie de la hanche et du genou : Une revue systématique. Br J Anaesth 2014;113(3):360–374.
- Tsukada S, Wakui M, Hoshino A : Analgésie épidurale postopératoire par rapport à l'injection périarticulaire peropératoire pour le contrôle de la douleur après une arthroplastie totale du genou sous rachianesthésie : un essai contrôlé randomisé. J Bone Joint Surg Am 2014;96(17):1433–1438.
- Bingham AE, Fu R, Horn JL, Abrahams MS : bloc nerveux périphérique continu par rapport au bloc nerveux périphérique à injection unique : une revue systématique et une méta-analyse d'essais contrôlés randomisés. Reg Anesth Pain Med 2012;37(6):583–594.
- Schroer WC, Diesfeld PG, LeMarr AR, Morton DJ, Reedy ME : La bupivacaïne liposomale à libération prolongée contrôle-t-elle mieux la douleur que la bupivacaïne après une PTG ? Un essai clinique prospectif randomisé. J Arthroplastie 2015;30(9 Suppl):64–67.
- Ilfeld BM, Viscusi ER, Hadzic A, et al : profil d'innocuité et d'effets secondaires de la bupivacaïne liposomale (Exparel) dans les blocs nerveux périphériques. Reg Anesth Pain Med 2015;40(5):572–582.
- Memtsoudis SG, Sun X, Chiu YL, et al : Utilisation des services de soins intensifs chez les patients subissant une arthroplastie totale de la hanche et du genou : épidémiologie et facteurs de risque. Anesthésiologie 2012;117(1):107–116.
- Fleischut PM, Eskreis-Winkler JM, Gaber-Baylis LK, et al : Variabilité des soins anesthésiques pour l'arthroplastie totale du genou : une analyse de l'Institut de la qualité de l'anesthésie. Am J Med Qual 2015;30(2):172–179.
- Backes JR, Bentley JC, Politi JR, Chambers BT : La dexaméthasone réduit la durée d'hospitalisation et améliore la douleur et les nausées postopératoires après une arthroplastie totale de l'articulation : un essai prospectif contrôlé randomisé. J Arthroplastie 2013;28(8 Suppl):11–17.
- Goodnough LT : Risques de transfusion sanguine. Crit Care Med 2003;31(12 Suppl):S678–S686.
- Fitzgibbons PG, Digiovanni C, Hares S, Akelman E : Utilisation sûre du garrot : Un examen des preuves. J Am Acad Orthop Surg 2012;20(5):310–319.
- Nitz AJ, Dobner JJ, Matulionis DH : application de garrot pneumatique et intégrité nerveuse : fonction motrice et électrophysiologie. Exp Neurol 1986;94(2):264–279.
- Kornbluth ID, Freedman MK, Sher L, Frederick RW : paralysie du nerf fémoral et saphène après utilisation d'un garrot : à propos d'un cas. Arch Phys Med Rehab 2003;84(6):909–911.
- Weingarden SI, Louis DL, Waylonis GW : Changements électromyographiques chez les patients postméniscectomie. Rôle du garrot pneumatique. JAMA 1979;241(12):1248–1250.
- Saunders KC, Louis DL, Weingarden SI, Waylonis GW : Effet du temps de garrot sur la fonction postopératoire du quadriceps. Clin Orthop Relat Res 1979(143):194–199.
- Kagoma YK, Crowther MA, Douketis J, Bhandari M, Eikelboom J, Lim W : Utilisation de la thérapie antifibrinolytique pour réduire la transfusion chez les patients subissant une chirurgie orthopédique : Une revue systématique des essais randomisés. Thrombosis Res 2009;123(5):687–696.
- Murkin JM, Falter F, Granton J, Young B, Burt C, Chu M : L'acide tranexamique à haute dose est associé à des crises cliniques non ischémiques chez les patients en chirurgie cardiaque. Anesth Analg 2010;110(2):350–353.