Steven L.Orebaugh
INTRODUCTION
La lésion du nerf périphérique est une complication relativement rare mais potentiellement grave de l'anesthésie régionale. La peur des lésions neurologiques avec des blocs nerveux peut inciter certains praticiens ainsi que des patients à éviter les blocs nerveux périphériques. Les mécanismes par lesquels les blocs nerveux peuvent causer des lésions neurales, ainsi que l'évaluation et la prise en charge, sont abordés dans des chapitres distincts. Au lieu de cela, ce chapitre traite d'autres causes potentielles de lésions nerveuses car un certain nombre de facteurs possibles peuvent entraîner des symptômes neurologiques dans la période périopératoire.
Pour comprendre comment la période périopératoire peut influencer négativement les nerfs des extrémités, même de manière subtile, les lésions du nerf ulnaire rapportées dans la littérature anesthésiologique il y a plus de dix ans sont discutées. Les lésions du nerf cubital peuvent être les lésions nerveuses les plus courantes associées à l'anesthésie générale et une source importante de litiges. Ces blessures semblent se produire en l'absence de traumatisme évident à l'extrémité concernée et sont souvent retardées dans leur présentation clinique. La compression, la pression et l'étirement au niveau du coude jouent tous probablement un rôle dans la physiopathologie, et un compromis neural préexistant peut également être pris en compte. Les effets délétères de l'étirement ou de la pression sur le nerf cubital chez un patient anesthésié peuvent être prévenus par de simples manœuvres ; par exemple, placer l'avant-bras étendu en supination, plutôt qu'en pronation, s'est avéré protéger un patient inconscient contre une lésion du nerf ulnaire.
Cependant, lorsqu'une extrémité est elle-même le site d'une intervention chirurgicale, de nombreux autres facteurs supplémentaires peuvent conspirer pour entraîner une lésion nerveuse. Initialement, la peau est soumise à des solutions antimicrobiennes dures après la tonte ou le rasage. Un garrot pneumatique est souvent placé pour ces chirurgies, avec une ischémie distale résultante et des pressions élevées sur les nerfs de l'extrémité proximale. La chirurgie elle-même offre un potentiel de traumatisme tranchant, contondant ou thermique, qui pourrait affecter négativement les nerfs, à la fois au niveau des petites branches cutanées locales près des incisions et au niveau des troncs nerveux périphériques. Une position corporelle non physiologique peut survenir et être maintenue pendant de longues périodes, impliquant généralement l'extrémité chirurgicale, mais parfois aussi les membres non chirurgicaux. Dans la phase postopératoire, de longues périodes d'immobilisation dans des positions non physiologiques peuvent provoquer un étirement ou une compression des nerfs, tout comme les dispositifs d'immobilisation, en particulier en présence d'un œdème post-traumatique dépendant inévitable. Combiné au manque de perception dû à l'anesthésie générale ou aux analgésiques opioïdes postopératoires, ainsi qu'à toute perte de sensation causée par les anesthésiques locaux, il existe un risque de dysfonctionnement neuronal ou de blessure ou d'altération de la fonction sensorielle (Tables 1 et 2).
GARROTS CHIRURGICAUX
L'utilisation du garrot pneumatique pour la chirurgie des extrémités présente plusieurs avantages, notamment le contrôle des pertes sanguines et l'amélioration des conditions opératoires pour les chirurgiens (Figure 1). Cependant, la pression créée par ces appareils peut entraîner des lésions musculaires ou nerveuses, et les recommandations pour une utilisation sûre (et une technologie sûre) continuent d'évoluer. L'incidence signalée de complications liées à l'utilisation d'un garrot dans un rapport était aussi élevée que 0.15 %. Cependant, d'autres grandes bases de données ont signalé un risque de blessure plus faible. Si les anomalies électrophysiologiques subcliniques sont utilisées comme critère d'incidence des troubles neurologiques, l'incidence pourrait être beaucoup plus élevée, en particulier avec des pressions de garrot élevées. Par exemple, Saunders et al ont noté des modifications électromyographiques (EMG), d'une durée moyenne de 51 jours, chez 62.5 % des patients ayant subi une arthrotomie du genou soumis à des pressions de garrot fixées entre 350 et 450 mm Hg. Dans une étude randomisée et contrôlée de 48 patients subissant une arthroscopie du genou, Dobner et al ont noté une dénervation à l'EMG dans 71 % des cas avec des garrots, qui avaient une pression moyenne du brassard de 393 mm Hg, contre aucun changement de ce type dans le groupe témoin, qui avait pas de garrot pour la chirurgie. Ces anomalies électrophysiologiques étaient corrélées à un retour retardé de la fonction et duraient plusieurs mois.
TABLE 1. Causes peropératoires potentielles de lésions nerveuses.
| Garrot chirurgical (pression, durée, taille/ajustement du brassard) |
| Positionnement du membre opératoire |
| Positionnement des extrémités |
| Incision/dissection pointue |
| Rétraction/étirement/pression sur les nerfs |
| Blessure thermique par électrocoagulation |
| Insertion de fixateurs ou d'autres instruments pointus |
| Surextension ou malposition des membres/articulations |
Bien que l'ischémie puisse contribuer aux lésions nerveuses avec les garrots, la compression physique réelle des tissus sous le brassard peut être l'insulte dominante. Dans les études sur les primates, la lésion du nerf a été principalement trouvée en profondeur et sur les bords de la manchette. Ces lésions nerveuses sont caractérisées par des lésions microvasculaires, la formation d'œdèmes, une perturbation de la myéline et une dégénérescence axonale.
La pression de gonflage, la durée de gonflage du brassard, ainsi que la forme et la taille du brassard sont toutes des variables importantes liées au traumatisme tissulaire avec des garrots pneumatiques. Les preuves existantes sont insuffisantes pour établir des recommandations exactes sur la durée de l'inflation afin de garantir qu'aucune lésion nerveuse ne se produira. En général, des durées d'inflation plus longues semblent prédisposer à une fréquence plus élevée de lésions nerveuses ; la plupart des études animales ont suggéré que 2 heures est un seuil au-delà duquel la lésion cellulaire peut devenir irréversible. Au-delà de cette période, une déflation et un regonflage périodiques sont recommandés, bien qu'il n'y ait aucune preuve clinique liant cela à de meilleurs résultats.
Les pressions du brassard de garrot sont fréquemment fixées à 150 mm Hg au-dessus de la pression systolique pour le membre inférieur et à 100 au-dessus de la pression systolique pour le membre supérieur. Cependant, les niveaux de sécurité absolus sont difficiles à déterminer. De simples prescriptions de gonflage à 250 mm Hg pour le membre inférieur, avec un niveau légèrement inférieur pour le membre supérieur, jusqu'à 2 heures ne tiennent pas compte de tous les dangers potentiels de ces dispositifs. En cas d'application incorrecte, de taille inappropriée ou d'utilisation prolongée, les garrots peuvent entraîner une neuropraxie.
TABLE 2. Causes postopératoires potentielles de lésions nerveuses.
| Modifications inflammatoires/neuropathie inflammatoire post-chirurgicale |
| Dispositifs d'immobilisation, tels que plâtres/attelles, avec compression directe |
| Positionnement des extrémités |
| Immobilisation prolongée en position non physiologique des extrémités |
| Œdème des extrémités, dans un dispositif d'immobilisation |
| Absence de perception de la douleur ou de la pression due aux opioïdes ou à un membre engourdi |
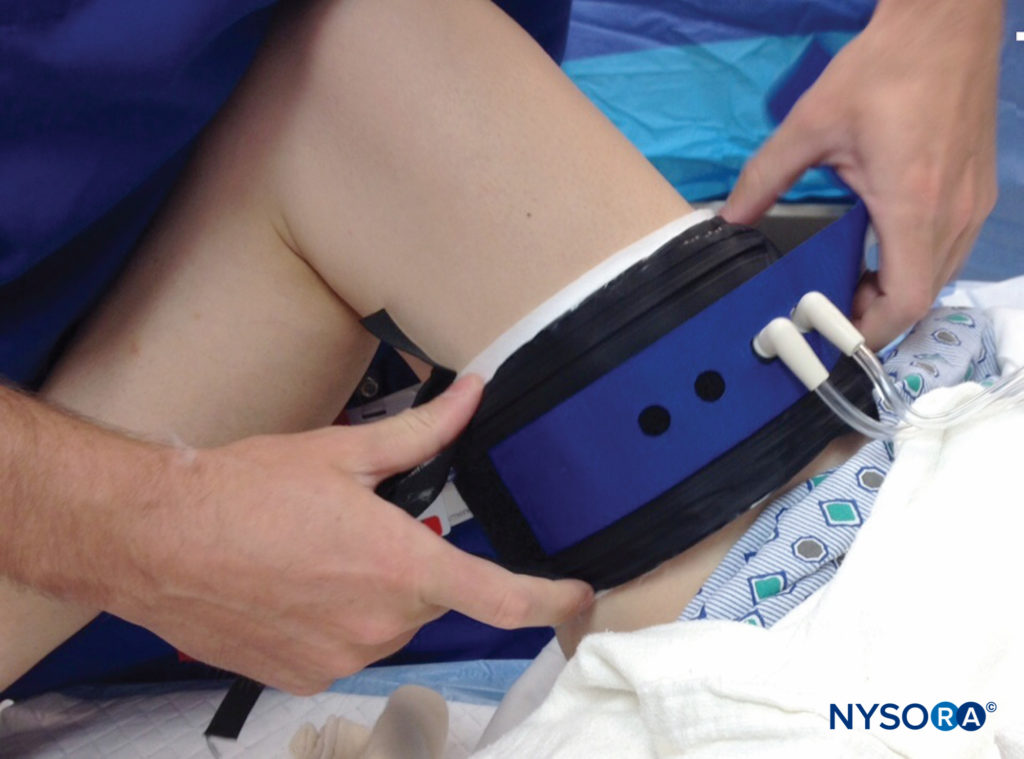
FIGURE 1. L'application et l'utilisation d'un garrot chirurgical doivent tenir compte de la taille des membres, de la taille et de la forme du brassard et de la pression artérielle. Si possible, une pression d'occlusion du membre doit être obtenue, ce qui permet de réduire les pressions peropératoires du brassard tout en maintenant un champ exsangue.
La reconnaissance que des pressions plus élevées causent plus de lésions tissulaires et augmentent le risque de lésion nerveuse a conduit à recommander l'utilisation de pressions de garrot plus faibles au cours des deux dernières décennies, ainsi qu'un intérêt à trouver des moyens de diminuer le flux sanguin vers le site chirurgical tout en maintenir les pressions du brassard à un niveau bas. L'arrêt du flux sanguin vers une extrémité est en fait une fonction de la pression d'occlusion des membres (LOP), plutôt que simplement de la pression artérielle systolique ; la LOP est déterminée par la forme et la taille de l'extrémité et le site et la conformation du garrot, ainsi que la pression artérielle d'entrée. Fait intéressant, la LOP ne varie pas directement avec la pression artérielle. En tant que tel, il est unique pour chaque patient et chaque extrémité, ce qui suggère qu'il est difficile de prescrire des recommandations universelles pour régler la pression du brassard en fonction de la pression artérielle systolique.
Les garrots pneumatiques existants peuvent être modifiés pour déterminer la LOP. Certains systèmes de garrot plus récents disposent également d'un moyen intégré de détermination de la LOP, ainsi que de recommandations, basées sur ce paramètre, pour régler la pression optimale du brassard de garrot. Des brassards plus larges et profilés permettent également des pressions plus faibles, ce qui peut contribuer à la sécurité du patient.
Bien qu'il n'y ait pas de directives spécifiques suggérées par les sociétés spécialisées en orthopédie pour la gestion des garrots, d'autres sociétés spécialisées ont émis des recommandations pour une utilisation sûre de ces dispositifs. Tableau 3 résume les lignes directrices et les recommandations existantes de la littérature. L'Association of Surgical Technicians recommande que les garrots sur le membre inférieur ne soient pas gonflés à plus de 100 mm Hg au-dessus de la pression artérielle systolique pour le membre inférieur et 50 mm Hg au-dessus de la pression systolique pour le membre supérieur, ce qui est nettement inférieur à ce que la sagesse dominante pourrait suggérer.
TABLE 3. Recommandations pour les pressions de gonflage du garrot.
| AST25 UE : 50 mm Hg au-dessus de la pression systolique |
| LE : 100 mm Hg au-dessus de la pression systolique |
| AORN27 Déterminer LOP ; 40 mm Hg au-dessus de la LOP pour une LOP inférieure à 130 mm Hg, 60 mm Hg au-dessus de la LOP pour une LOP entre 130 et 190 mm Hg, 80 mm Hg au-dessus de la LOP si LOP supérieure à 190 mm Hg |
| Crenshaw57 50-75 mm Hg au-dessus de la pression systolique pour UE 100-150 mm Hg au-dessus de la pression systolique pour LE |
| Noordin22 Déterminer LOP ; baser la pression du brassard sur le niveau de LOP |
| Estersohn58 90-100 mm Hg au-dessus de la pression systolique pour LE |
Certaines directives pour la gestion du garrot reposent spécifiquement sur la détermination de la LOP. Le réglage du garrot à ce niveau de pression, avec l'ajout d'un facteur de sécurité (en cas d'élévation de la pression artérielle pendant le cas), permet une pression globale inférieure du brassard pour contrôler le flux sanguin, avec un effet potentiellement bénéfique sur la sécurité du patient. Dans une série, lorsque la LOP a été utilisée chez des patients subissant une reconstruction du ligament croisé antérieur, les pressions du brassard du garrot ont été réduites de plus de moitié par rapport à l'utilisation de pressions de gonflage standard basées uniquement sur les pressions artérielles systoliques. L'American Society of Operating Room Nurses (AORN) recommande la détermination de la LOP, avec l'ajout d'un degré de pression variable, en fonction de la pression artérielle systolique du patient (des pressions plus élevées sont ajoutées pour des pressions artérielles plus élevées du patient). Certains auteurs de la littérature orthopédique ont également suggéré l'utilisation de LOP pour influer favorablement sur les résultats des patients (Tableau 3).
Comme la transmission de la pression aux tissus profonds est liée à la quantité de tissu située directement sous la manchette, l'effet de pression/cisaillement du garrot est atténué par une plus grande épaisseur de tissu entre la manchette et le nerf. Cela explique la nécessité de pressions de brassard plus élevées dans les membres les plus larges pour contrôler le flux sanguin dans le champ opératoire et la recommandation d'utiliser des pressions de brassard plus faibles dans le bras des adultes (par rapport à la jambe) et chez les patients pédiatriques. En général, les pressions les plus basses efficaces pour contrôler le flux sanguin, associées à la durée la plus courte possible, sont susceptibles d'être les plus sûres pour le patient. L'utilisation des LOP, qui tiennent compte de la taille et de la forme des membres, ainsi que des pressions d'afflux artérielles dominantes, le permet.
Les lésions nerveuses liées au garrot dues à la pression exercée directement par le brassard sur le nerf sous-jacent (par opposition à l'insulte ischémique distale) entraînent fréquemment un degré plus élevé de perte motrice que de perte sensorielle, d'où le terme historique de paralysie du garrot. Dans le membre inférieur, la blessure par garrot affecte le plus souvent le nerf sciatique, tandis que dans le bras, le nerf radial semble être le plus vulnérable.
Heureusement, bon nombre de ces blessures disparaissent avec le temps et les blessures permanentes sont rares. Il convient également de noter que, bien que l'utilisation du garrot pneumatique ait fait l'objet de nombreuses recherches, la combinaison de la contrainte de cisaillement et de l'ischémie du garrot, associée à une perturbation temporaire de la physiologie nerveuse normale par l'administration d'un anesthésique local, n'a pas été suffisamment étudiée.
NEUROPATHIE INFLAMMATOIRE POST-CHIRURGICALE
Une autre cause potentielle de lésion nerveuse pouvant survenir à la suite d'une intervention chirurgicale, sans relation apparente avec le bloc nerveux périphérique, est la neuropathie inflammatoire post-chirurgicale (PSIN). Dans cette entité pathologique, un traumatisme chirurgical avec lésion tissulaire entraîne une stimulation immunitaire, qui se traduit principalement par une inflammation du tissu neural. Ce dysfonctionnement nerveux inflammatoire peut survenir dans la région de la chirurgie, sur un site distant du même membre ou sur un site complètement distant du corps.
Le PSIN peut même se développer de manière diffuse sur plusieurs sites. Les nerfs affectés présentent des signes d'œdème, de troubles microvasculaires, de lésion et de perte de myéline et de lésion axonale, avec afflux de cellules inflammatoires aiguës. Une biopsie est nécessaire pour un diagnostic définitif de PSIN ; cependant, l'imagerie par résonance magnétique appuie le diagnostic et, associée aux preuves cliniques, peut permettre un diagnostic et un traitement présomptifs (Chiffres 2 et 3). Le traitement par corticostéroïdes est utile dans de nombreux cas, et bien que la plupart des épisodes de PSIN s'améliorent progressivement avec le temps, des séquelles permanentes ont été signalées. En 2011, Staff et al. résume la base de données la plus complète de cas de PSIN à ce jour. Une variété de différents types de chirurgies étaient impliqués, y compris les procédures orthopédiques, la chirurgie générale et même les cas dentaires. Aucun des 33 patients n'avait reçu de bloc nerveux périphérique. La présentation typique était une douleur et une faiblesse dans le territoire des nerfs affectés ; les changements sensoriels étaient également fréquents. Vingt et un des cas ont été confirmés par biopsie.
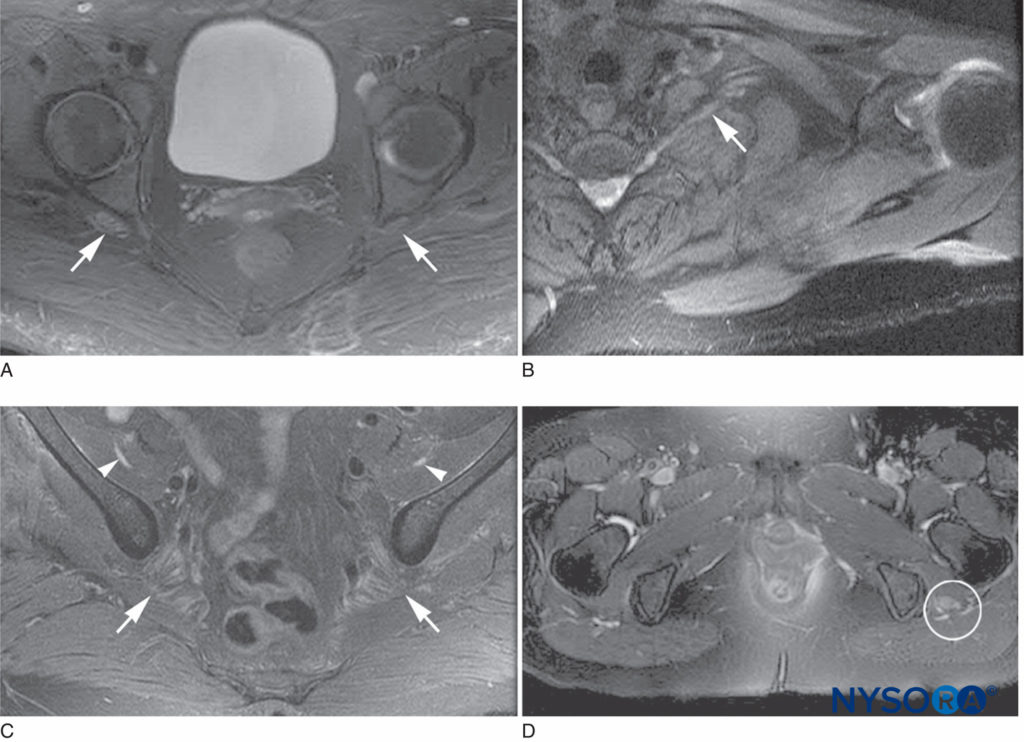
FIGURE 2. Caractéristiques d'imagerie par résonance magnétique de la neuropathie inflammatoire post-chirurgicale. A : hypersignal T2 et légère hypertrophie des nerfs sciatiques bilatéraux, plus à droite qu'à gauche (flèches). B : hypersignal T2 et légère hypertrophie de la racine C8 gauche et du tronc inférieur (flèche). C : hypersignal T2 et hypertrophie modérée des nerfs fémoraux bilatéraux (têtes de flèches) et hypertrophie légère des nerfs sciatiques (flèches). D : hypersignal T2 et hypertrophie sévère du nerf sciatique gauche (cerclé).
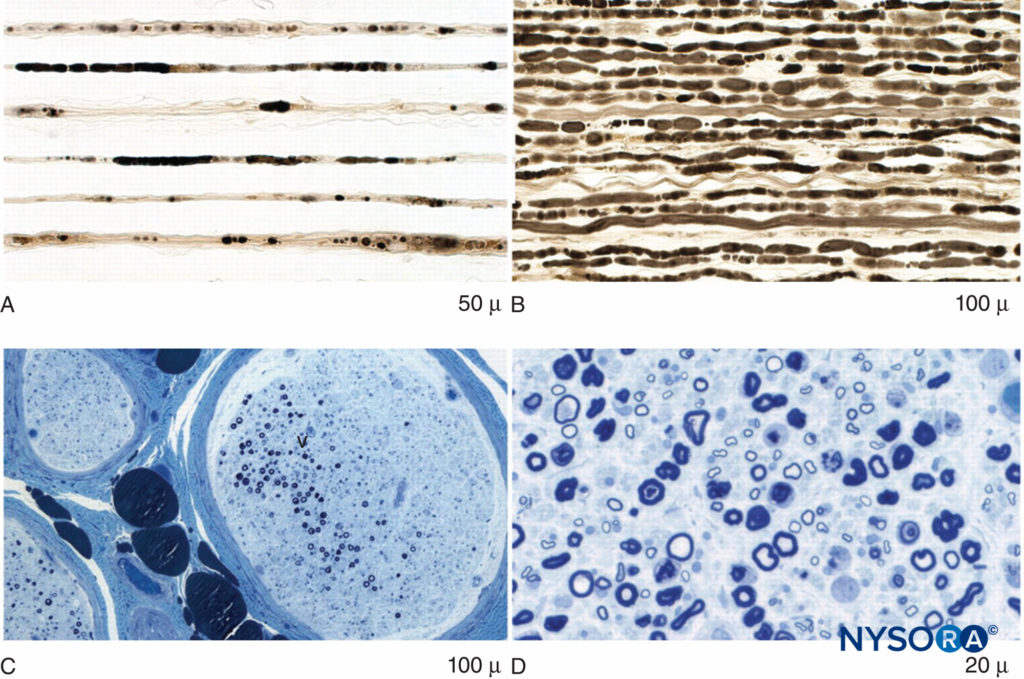
FIGURE 3. Dégénérescence axonale et perte de fibres focales dans la neuropathie inflammatoire post-chirurgicale. A: Préparation de fibres taquinées montrant de multiples brins avec une dégénérescence axonale tardive fulminante. B: Préparation de fibres taquinées montrant plusieurs brins étroitement alignés de dégénérescence axonale précoce fulminante. C: Coupe d'époxy au bleu de méthylène à faible grossissement d'un nerf illustrant la perte de fibres multifocales. D: Coupes époxy au bleu de méthylène de haute puissance montrant une dégénérescence axonale proéminente de grosses fibres myélinisées.
Les auteurs ont noté que les lésions nerveuses peuvent parfois être attribuées de manière inappropriée à des causes mécaniques pendant la chirurgie, lorsque les mécanismes immunitaires sont en fait la cause insoupçonnée, et que les PSIN peuvent sous-tendre ces symptômes de compromis neuronal beaucoup plus souvent qu'on ne le reconnaît. Compte tenu de ce potentiel, les lésions nerveuses graves devraient probablement être évaluées, non seulement avec des études EMG et de conduction nerveuse, qui sont relativement non spécifiques à moins qu'un niveau de lésion puisse être clairement établi, mais aussi avec la neurographie par résonance magnétique, qui peut fournir des informations supplémentaires sur la gravité. , l'étendue et l'emplacement de la ou des agressions neurales. Si un diagnostic ne peut être établi, une biopsie nerveuse doit être envisagée.
CAUSES CHIRURGICALES DE LÉSIONS NERVEUSES
Compte tenu de la nature invasive des interventions chirurgicales, les lésions involontaires des structures anatomiques ne sont pas surprenantes. Les lésions nerveuses causées par un traumatisme chirurgical, que ce soit par une dissection tranchante ou l'insertion de dispositifs chirurgicaux ou de fixation, constituent un risque potentiel de nombreux types de procédures. Par exemple, dans la chirurgie de l'épaule, des lésions peuvent survenir aux nerfs accessoires suprascapulaires, axillaires, musculo-cutanés, sous-scapulaires ou rachidiens lors de procédures ouvertes ou arthroscopiques. Les lésions du nerf fémoral dans la période périopératoire sont généralement liées à une ischémie due à l'étirement ou à la rétraction survenant lors d'interventions abdominales ou pelviennes. Au cours d'une arthroscopie de la hanche, une lésion du nerf sciatique peut survenir et est plus étroitement liée à la force de distraction sur la jambe opérée40 (Figure 4). Au cours du prélèvement du tendon des ischio-jambiers pour la reconstruction du ligament croisé antérieur par autogreffe, une lésion de la branche infrapatellaire ou vestimentaire du nerf saphène, avec des déficits sensoriels conséquents, survient chez pas moins de 74 % des patients. Les dispositifs de fixation, tels que les fils K, peuvent également causer par inadvertance un traumatisme aux nerfs. Une anatomie aberrante peut entraîner des positions imprévisibles des nerfs, les mettant en danger lors de procédures autrement courantes.
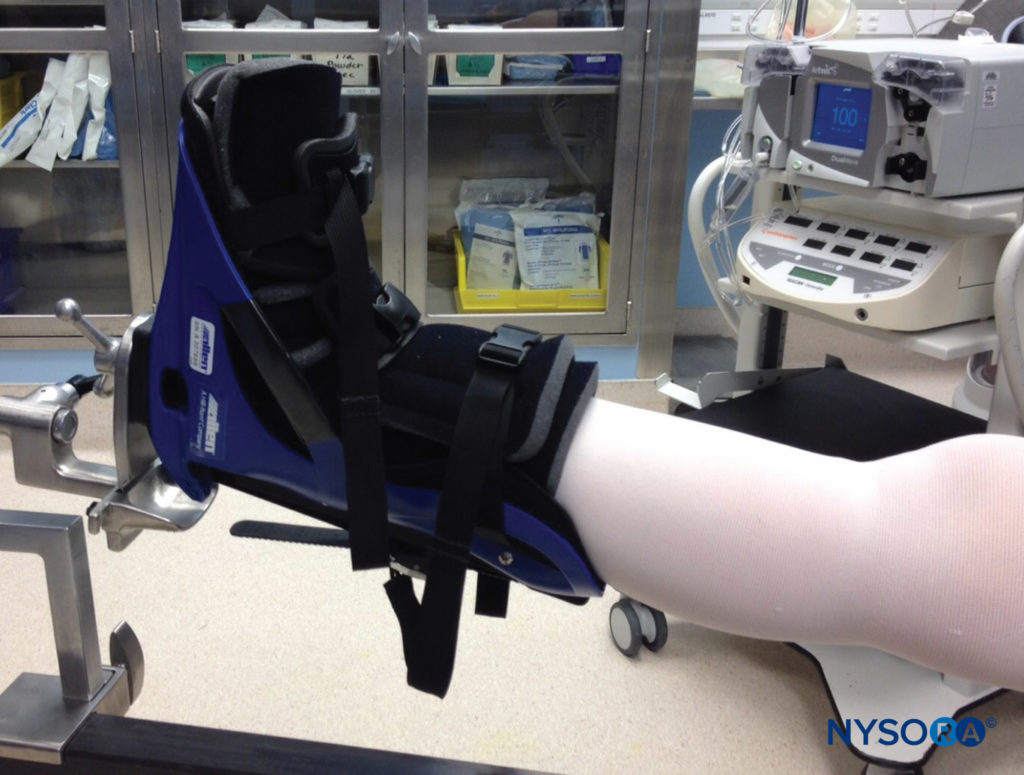
FIGURE 4. L'arthroscopie de la hanche nécessite une distraction énergique de la jambe opérée, ce qui présente un risque de lésion du nerf sciatique.
Positionnement pour la chirurgie
Le positionnement chirurgical dans la salle d'opération peut jouer un rôle crucial dans les lésions nerveuses et doit être pris en compte lorsque de nouveaux symptômes nerveux sont signalés, en particulier lorsque des positions autres que le décubitus dorsal sont utilisées. La position ventrale, la lithotomie et les degrés sévères de Trendelenburg sont tous connus pour prédisposer aux lésions nerveuses. De plus, la position latérale est plus susceptible d'entraîner une lésion du nerf du plexus brachial que la position en chaise longue pour les interventions à l'épaule (Figure 5). En position assise, des cas prolongés ont entraîné une neuropraxie de l'un ou des deux nerfs sciatiques, y compris une perte sensorielle et une faiblesse motrice invalidante (Figure 6). L'inclinaison latérale de la tête en position assise peut entraîner un étirement du plexus brachial, avec un potentiel de compromis nerveux également.
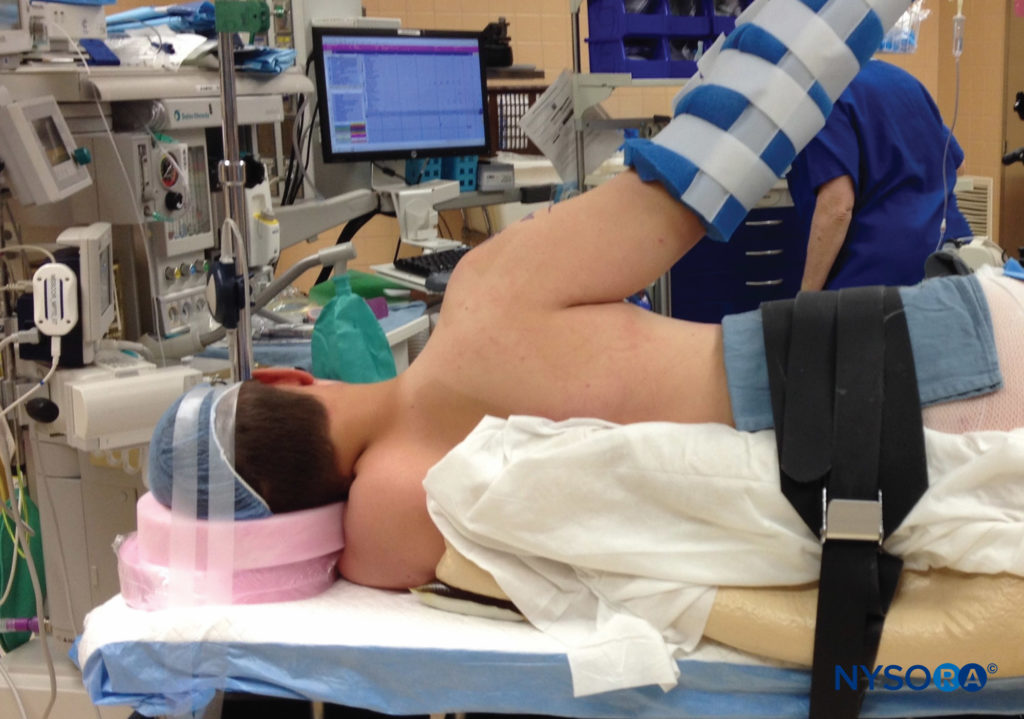
FIGURE 5. La position latérale pour la chirurgie de l'épaule est associée à une incidence plus élevée de lésions nerveuses.
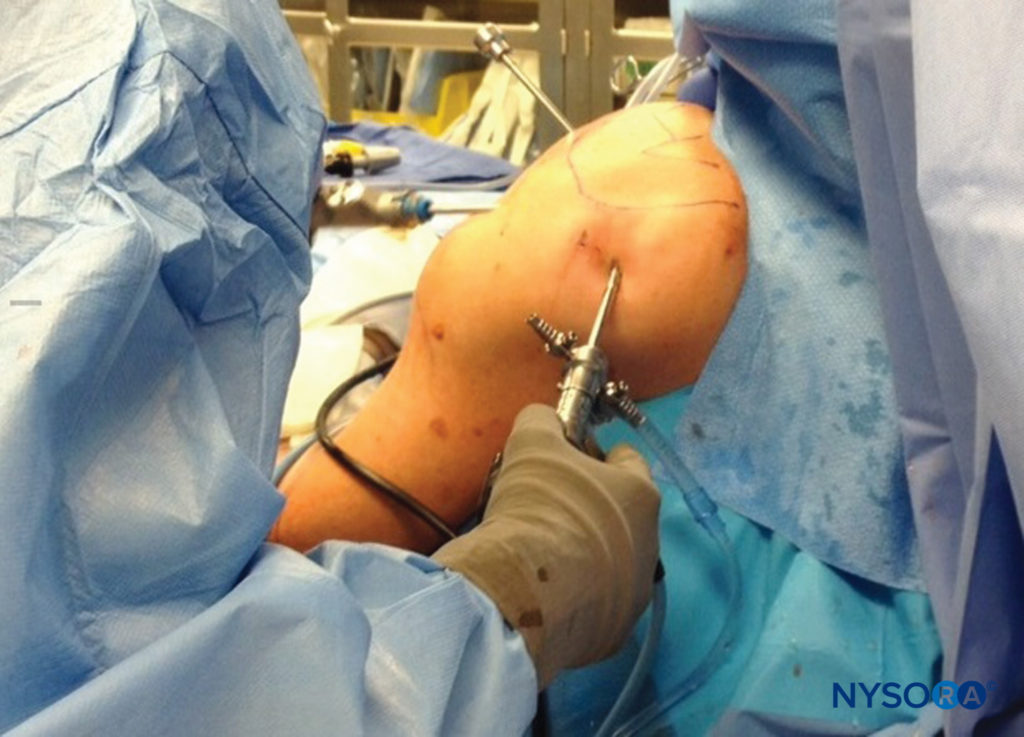
FIGURE 6. La position de chaise de plage, lorsqu'elle est adoptée pendant des périodes prolongées, peut entraîner une lésion par compression du nerf sciatique.
Immobilisation postopératoire
Le positionnement de l'extrémité après une opération peut également contribuer à l'atteinte nerveuse. Alors que l'immobilisation dans une position relativement neutre au niveau de la hanche, du genou et de la cheville est habituelle pour les interventions des membres inférieurs, ce n'est pas le cas pour les membres supérieurs. Dans les procédures orthopédiques pour la main, le poignet, l'épaule et certaines affections du coude, maintenir l'extrémité en flexion au niveau du coude pendant de longues périodes, dans une écharpe ou un dispositif d'immobilisation de l'épaule, aide à protéger l'extrémité blessée et à réduire la gravité de l'œdème postopératoire. Cependant, une immobilisation prolongée en flexion, parfois pendant des semaines, peut être délétère pour le nerf cubital, qui est placé dans un degré d'étirement (Figure 7).
La combinaison de cette position avec une immobilité relative et l'œdème postopératoire inévitable qui se produit peut prédisposer au piégeage ulnaire, à la compression et au syndrome du sulcus ulnaris Une autre préoccupation dans la période postopératoire est le dispositif d'immobilisation lui-même. Les attelles, plâtres et appareils orthodontiques, s'ils sont appliqués sans tenir compte des nerfs sous-jacents, peuvent présenter un danger. Même lorsqu'il est placé avec soin pour une pression ou une constriction potentielle, l'œdème inévitable qui survient à la suite d'un traumatisme chirurgical, en particulier avec une dépendance, peut servir à rendre un appareil confortable assez serré (Figure 8). Le syndrome de loge peut survenir lorsque de tels appareils éteignent complètement le flux sanguin vers les tissus sous-jacents, et cela est discuté plus en détail dans Acute Compartment Syndome of the Limb: Implications for Regional Anesthesia.
Cependant, même en l'absence d'une telle gêne circulatoire grave, une pression sur un nerf, avec une paralysie résultante, peut se produire. Un exemple est le potentiel d'une attelle de genou, placée après la reconstruction du ligament croisé antérieur, pour empiéter sur le nerf péronier sur le col du péroné, avec un engourdissement résultant sur le dessus du pied et une faiblesse de la dorsiflexion (Figure 9). Les dispositifs d'immobilisation de l'épaule, avec des sangles bien ajustées sur l'extrémité distale ou des découpes circulaires qui se trouvent à la base du pouce, peuvent entraîner des changements sensoriels au bout d'un doigt, qui disparaissent généralement rapidement lorsque cette constriction est résolue, comme je l'ai vécu moi-même. pratique
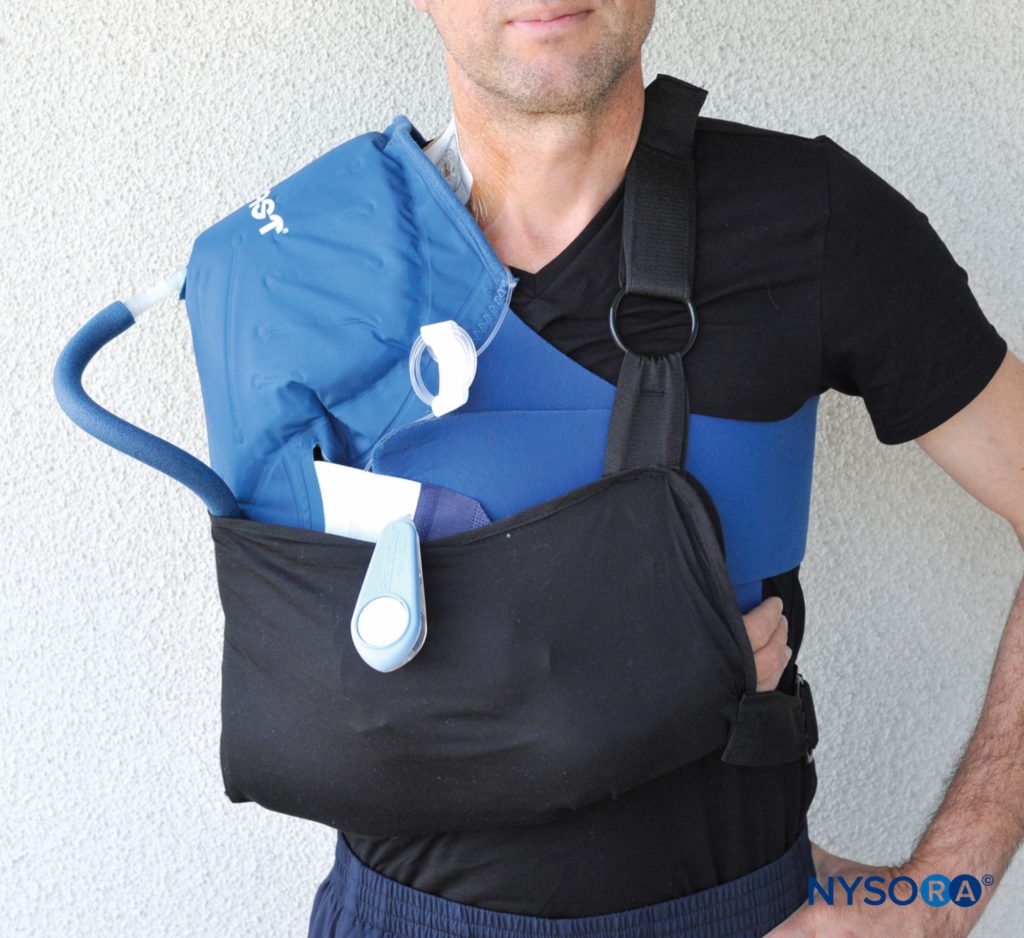
FIGURE 7. Les chirurgies de l'épaule et autres interventions des membres supérieurs nécessitent généralement une période prolongée d'immobilisation en flexion au niveau du coude, dans des écharpes ou d'autres dispositifs. Cela peut entraîner un dysfonctionnement ou une blessure du nerf cubital.
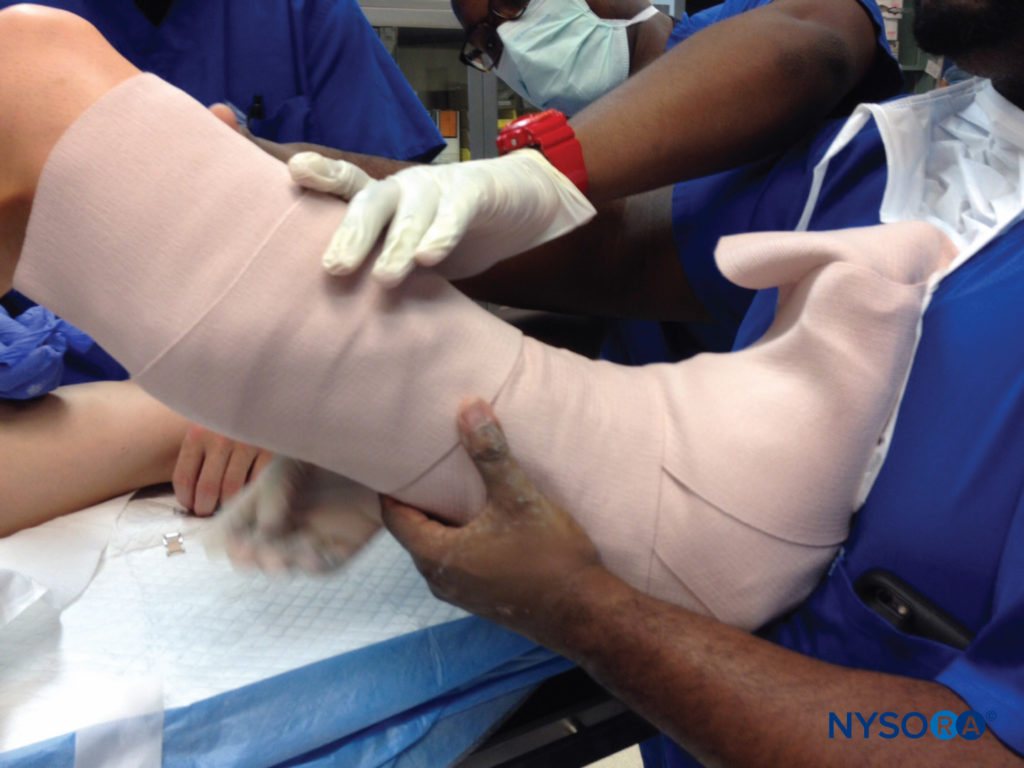
FIGURE 8. Les plâtres ou attelles postopératoires doivent être placés avec soin pour éviter une apposition ferme contre la peau ou une pression sur les proéminences osseuses ou les nerfs superficiels, en tenant compte d'un œdème probable de l'extrémité affectée.
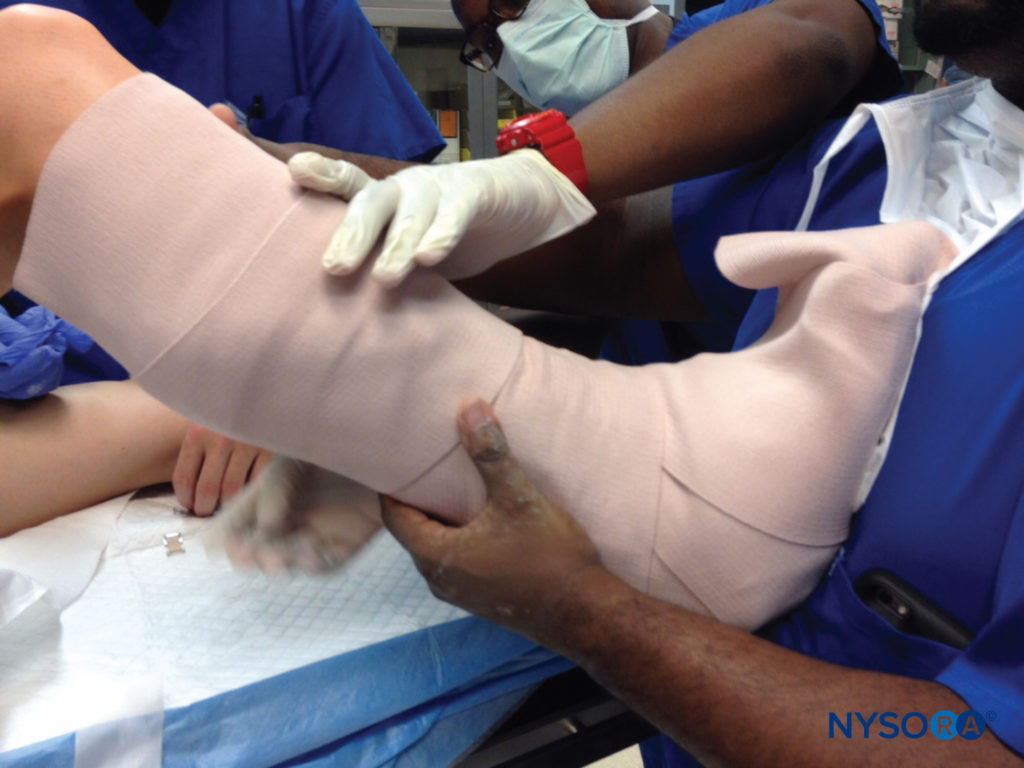
FIGURE 9. Lors de la mise en place d'une attelle de genou après la chirurgie, il faut veiller à éviter un ajustement serré ou une pression directement sur le nerf péronier commun, ce qui peut entraîner une perte sensorielle ou motrice du pied.
Pression cutanée prolongée
La pression sur un nerf digital ou plus substantiel peut entraîner des déficits sensoriels ou moteurs dans le territoire de ce nerf. Cependant, un contact prolongé avec une parcelle de peau sous-jacente causée par une attelle, un corset ou un plâtre immobilisant peut entraîner des déficits sensoriels dans cette région, simplement en raison de la compression à long terme des récepteurs sensoriels de la peau. On ne s'attendrait pas à ce que de telles anomalies de la sensation provoquent des changements dans les études EMG ou de conduction nerveuse. Bien que ces effets sur la fonction nerveuse ne soient pas, en eux-mêmes, liés aux interventions d'anesthésie, la simple présence d'une période prolongée d'altération sensorielle due au bloc nerveux périphérique (qu'il soit appliqué par l'anesthésiste ou le chirurgien) peut rendre difficile pour le patient de perçoivent la pression exercée sur la peau ou un nerf sous-cutané, contribuant au risque de blessure ou de dysfonctionnement temporaire de ces petits nerfs. L'ischémie et l'ulcération du talon après un repos prolongé du talon chez les patients qui ont reçu un bloc du nerf sciatique sont particulièrement préoccupantes. Ainsi, des instructions précises de retour à domicile et un suivi de ces patients sont essentiels.
Syndrome douloureux régional complexe
Le syndrome douloureux régional complexe (SDRC) après une intervention chirurgicale est généralement le résultat de l'événement traumatique lui-même, bien qu'il puisse également survenir à la suite d'une lésion nerveuse, appelée SDRC de type 2. Bien que cette entité se manifeste généralement par des douleurs et un dysfonctionnement des membres, des troubles sensoriels peuvent être des symptômes primaires au début de son évolution. Les cas graves peuvent également entraîner une atrophie et une faiblesse. Distinguer le CRPS précoce d'une lésion nerveuse peut être accompli avec un examen neurologique minutieux, des tests sensoriels quantitatifs, le test quantitatif de réflexe axonal sudomoteur (QSART) et l'appréciation d'autres changements qui accompagnent cette maladie. Les perturbations sensorielles dans le SDRC ne seront probablement pas limitées au territoire d'un seul nerf périphérique, comme on s'y attend avec une lésion nerveuse périphérique.
ÉVALUATION POSTOPÉRATOIRE
La détermination de l'étiologie d'une lésion nerveuse nécessite l'intégration de l'examen physique, de l'électrophysiologie ou de l'imagerie. Lorsque toutes les modalités diagnostiques sont soigneusement examinées, la majorité des lésions nerveuses postopératoires sont en fait causées par des facteurs autres que la technique régionale. L'utilité de l'EMG en tant que test dépend à la fois de la tolérance du patient à la procédure et de la compétence et de l'expérience de l'examinateur. Les résultats physiques peuvent ajouter des informations spécifiques supplémentaires sur le niveau de la lésion nerveuse réelle.
Par exemple, dans les lésions du nerf fémoral, le niveau de la lésion peut être déterminé de manière fiable comme étant au-dessus ou en dessous du ligament inguinal en évaluant si les muscles fléchisseurs de la hanche (muscles iliaque et psoas), qui sont innervés haut dans le bassin, sont affectés, ainsi que les extenseurs du genou, qui sont innervés dans la cuisse elle-même, en dessous du niveau d'arborisation du nerf. Une lésion qui survient de manière proximale, dans le bassin - telle qu'une plexopathie lombaire inflammatoire - avec une faiblesse de la flexion de la hanche ainsi que de l'extension du genou ne peut pas être liée à une atteinte structurelle du nerf fémoral causée par un bloc périphérique au niveau du pli fémoral. De même, une lésion du nerf sciatique avec perte d'innervation des ischio-jambiers ne pourrait pas être attribuable à un traumatisme d'un bloc poplité/sciatique, qui se produit à une distance significative en dessous de la libération des branches vers ces muscles.
RÉSUMÉ
Il existe de nombreuses causes potentielles de lésions ou de dysfonctionnements neurologiques dans la période périopératoire. Les anesthésistes devraient assumer le rôle principal dans l'établissement de la cause des lésions neurologiques postopératoires pour guider le traitement ainsi que pour des raisons médico-légales. Cela nécessite une approche multidisciplinaire avec un examen moteur et sensoriel détaillé, une référence en neurologie ou en médecine physique, des tests électrophysiologiques appropriés, ainsi que l'imagerie, comme détaillé dans Évaluation des complications neurologiques de l'anesthésie régionale.
Références
- Warner MA, Warner ME, Martin JT : Neuropathie ulnaire : incidence, résultat, facteurs de risque chez les patients sous sédation ou anesthésiés. Anesthésiologie 1994 ; 81 : 1332–1340.
- Warner MA, Warner DO, Matsumoto JY, et al : Neuropathie ulnaire chez
patients chirurgicaux. Anesthésiologie 1999;90:54. - Cheney FW, Domino KB, Caplan RA, et al : lésion nerveuse associée à l'anesthésie. Anesthésiologie 1999;90:1062.
- O'Driscoll SW, Horii E, Carmichael SW, et al : Le tunnel cubital et la neuropathie ulnaire. J Bone Joint Surg Am 1991;73:613.
- Macnicol MF. Pressions extraneurales affectant le nerf cubital au niveau du coude. J Hand Surg Eur 1982;14:5.
- Alvine FG, Schurrer ME. Paralysie postopératoire du nerf ulnaire : existe-t-il des facteurs prédisposants ? J Bone Joint Surg Am 1987;69:255.
- Prielipp RC, Morell RC, Walker FO, et al : Pression du nerf cubital : influence de la position du bras et relation avec les potentiels évoqués somatosensoriels. Anesthésiologie 1999;91:345.
- McEwen JA : Complications et améliorations de la pneumatique garrot utilisé en chirurgie. Med Instrument 1981;15:253.
- Odinsson A, Finson V : Utilisation du garrot et ses complications en Norvège. J Bone Joint Surg Br 2006;88:1090.
- Middleton RWD, Varian JPW : Paralysie du garrot. Aust NZJ Surg 1974;44:124.
- Saunders KC, Louis DL, Weingarden SI, et al : Effet du temps de garrot sur la fonction postopératoire du quadriceps. Clin Orthoped Relat Res 1979;143:194.
- Dobner JJ, Nitz AJ: Paralysie tourniquent post-méniscectomie et séquelles fonctionnelles. Am J Sports Med 1982;10:211.
- Ochoa J, Danta G, Fowler TJ, et al : Nature de la lésion nerveuse causée par un garrot pneumatique. Nature 1971;233:265.
- Ochoa J, Fowler TJ, Rudge P, et al : Modifications anatomiques des nerfs périphériques comprimés par un garrot pneumatique. J Anat 1972;113 (partie 3):433.
- Rydevik B, Lundborg G, Bagge U : Effets de la compression graduée sur le flux sanguin intraneural. J Hand Surg Am 1981;6:3.
- Wakai A, Winter DC, Street JT, et al : garrots pneumatiques dans la chirurgie des extrémités. J Am Acad Orthop Surg 2001;9:345.
- Heppenstall RB, Balderston R, Goodwin C : effets physiopathologiques distaux à un garrot chez le chien. J Trauma 1979;19:234.
- Klenerman L, Biswas M, Hulands GH, et al : Effets systémiques et locaux de l'application d'un garrot. J Bone Joint Surg Br 1980;62:385.
- Nitz AJ, Dobner JJ, Matulionis DH. Application du garrot pneumatique et intégrité nerveuse : fonction motrice et électrophysiologie. Exp Neurol 1986;94:264.
- Rorabeck CH : Ischémie nerveuse induite par le garrot. Une expérience enquête. J Trauma 1980;20:280.
- Pedowitz RA. Blessure neuromusculaire induite par le garrot : revue des expériences cliniques et chez le lapin. Acta Orthoped Scand 1991;Suppl 245:1.
- Noordin S, McEwen JA, Kragh JF Jr, et al : garrots chirurgicaux en orthopédie. J Bone Joint Surg Am 2009;91:2958.
- Kam PCA, Kavanaugh R, Yoong FFY : Le garrot : conséquences physiopathologiques et implications anesthésiques. Anesthésie 2001;56:534.
- Ishii Y, Noguchi H, Matsuda Y, et al : Un nouveau système de garrot qui détermine la pression en synchronisation avec la pression artérielle systolique. Arch Orthop Traum Surg 2008;128:297.
- Association of Surgical Technologists : Normes de pratique recommandées pour une utilisation sécuritaire des garrots pneumatiques. 2007. http://www.ast.org//pdf/Standards_of_Practice/RSOP_Pneumatic_Tourniquets.pdf. Consulté le 28 juin 2015.
- Reilly CW, McEwen JA, Leveille L, et al : Minimiser la pression du garrot dans la chirurgie reconstructive pédiatrique du ligament croisé antérieur. J Pediatr Orthop 2009;29:275.
- Conner R, Blanchard J, Burlingame B, Chard R, Denholm B, Downing D : AORN. Pratiques recommandées pour l'utilisation du pneumatique tourniquet. Dans Normes périopératoires et pratiques recommandées. AORN, 2009, p. 373.
- Shaw JA, Murray DG : La relation entre la pression du garrot et la pression sous-jacente des tissus mous dans la cuisse. J Bone Joint Surg Am 1982;64:1148.
- Lieberman JR, Staneli CT, Dales MC : Pressions du garrot sur les patients pédiatriques : une étude clinique. Orthopédie 1997;20:1143.
- Horlocker TT, Hebl JR, Gali B, et al : Facteurs de risque anesthésiques, patients et chirurgicaux pour les complications neurologiques après un temps de garrot total prolongé pendant une arthroplastie totale du genou. Anesth Analg 2006;102:950.
- Personnel NP, Engelstad J, Klein CJ, et al : Neuropathie inflammatoire post-chirurgicale. Cerveau 2010;133:2866.
- Malamut RI, Marques W, England JD, et al : Névrite brachiale idiopathique post-chirurgicale. Nerf musculaire 1994;17:320.
- Ahn KS, Kopp SL, Watson JC, et al : Inflammation post-chirurgicale neuropathie. Reg Anesth Pain Med 2011;36:403.
- Barrington MJ, Morrison W, Sutherland T, et al : Scénario de cas : plexopathie brachiale postopératoire associée à un bloc sous-claviculaire du plexus brachial. Anesthésiologie 2014;121:383.
- Sully WF, Wilson DJ, Parada SA, et al : Lésions nerveuses iatrogènes dans la chirurgie de l'épaule. J Am Acad Orthop Surg 2013;21:717.
- Rhee PC, Spinner RJ, Bishop AT, et al. Lésions iatrogènes du plexus brachial associées à une ténodèse ouverte sous-pectorale du biceps. Am J Sports Med 2013;41:2048.
- Carofino BC, Brogan DM, Kircher MF, et al : Lésions nerveuses iatrogènes lors d'une chirurgie de l'épaule. J Bone Joint Surg 2013;95:1667.
- Yoo JC, Lee YS, Ahn JH, et al : lésion isolée du nerf suprascapulaire sous l'encoche spinoglénoïde après réparation SLAP. J Épaule Elbow Surg 2009;18:e27.
- Moore AE, Stringer MD : Lésion iatrogène du nerf fémoral. Surg Radiol Anat 2011;33:649.
- Telleria JJ, Safran MR, Harris AH, et al : Risque de lésion par traction du nerf sciatique lors d'une arthroscopie de la hanche : est-ce la quantité ou la durée ? J Bone Joint Surg Am 2012;94:2025.
- Sanders B, Rolf R, McClelland W, et al : Prévalence des lésions du nerf saphène après prélèvement autogène des ischio-jambiers. Arthroscopie 2007;23:956.
- Glanvill R, Boon JM, Birkholtz F, et al : Lésion superficielle du nerf radial lors de la fixation standard du fil de Kirschner d'une fracture du radius distal non compliquée. Orthopédie 2006;29:639.
- Jou IM, Lai KA. Lésion aiguë du nerf médian par migration d'une broche de Kirschner. J Hand Surg Br 1998;23:112.
- Jeon IH, Kim PT, Park IH, et al : bifurcation élevée du nerf médian au niveau du poignet provoquant une lésion du nerf numérique commun lors de la libération endoscopique du canal carpien. J Hand Surg Br 2002;27:580.
- Warner ME : Positionnement du patient. Dans Barash PG, Cullen BF, Stoelting RK (éd.) : Clinical Anesthesia, 7e éd. Lipincott, Williams et Wilkins, 2013, p 803.
- Rains DD, Rooke GA, Wahl CJ : Pathomécanismes et complications liés au positionnement du patient et à l'anesthésie pendant l'arthroscopie de l'épaule. Arthroscopie 2011;27:532.
- Wang JC, Wong TT, Chen HH, et al : neuropathie sciatique bilatérale en tant que complication de la craniotomie en position assise. Childs Nerv Syst 2012;28:159.
- Lowdon IMR : Troubles neurocirculatoires des extrémités. Dans Duthie RB, Bentley G (eds): Chirurgie orthopédique de Mercer. Oxford University Press, 1996, page 881.
- Coppieters MW, Van De Velde M, Stappaerts KH : Positionnement en anesthésiologie. Anesthésiologie 2002;97:75.
- Borgeat A, Ekatodramis G, Kalberer F, et al : Complications aiguës et non aiguës associées au bloc interscalène et à la chirurgie de l'épaule. Anesthésiologie 2001;97:1274.
- Arnold WD, Elsheikh BH : Neuropathies de piégeage. Neurol Clin 2013;31:405.
- Mauser N, Gissel H, Henderson C, et al : Syndrome aigu du compartiment inférieur de la jambe. Orthopédie 2013;36:619.
- Flanigan RM, DiGiovanni BF : compressions nerveuses périphériques de la partie inférieure de la jambe, de la cheville et du pied. Foot Cheville Clin N Am 2011;16:255.
- Guzelkucuk U, Skempes D, Kumnerddee W : paralysie du nerf péronier commun causée par des bas de compression après une intervention chirurgicale. Am J Phys Med Rehab 2014;93:609.
- Todkar M : bloc du nerf sciatique provoquant un ulcère du talon après arthroplastie totale du genou chez 36 patients. Acta Orthop Belg 2005;71(6):724–725.
- Rockett M : Diagnostic, mécanismes et traitement du syndrome douloureux régional complexe. Curr Opin Anesthesiol 2014;27:494–500.
- Gierthmuhlen J, Maier C, Baron R, et al : signes sensoriels dans le syndrome douloureux régional complexe et les lésions nerveuses périphériques. Douleur 2012 ; 153:765.
- Barrington MJ, Watts SA, Gledhill SR, et al : rapport préliminaire de la collaboration sur l'anesthésie régionale australasienne. Reg Anesth Pain Med 2009;34:534.
- Preston DC, Shapiro BE : Électromyographie et troubles neuromusculaires, 2e éd. Elsevier, 2005, p 3.
- Preston DC, Shapiro BE : Électromyographie et troubles neuromusculaires, 2e éd. Elsevier, 2005, p 355.
- Laughlin RS, Dyck P: Tests électrodiagnostiques dans les plexopathies lombo-sacrées. Phys Med Rehab Clin N Am 2013;24:93, 2013.

