J. Sudharma Ranasinghe, Elyad Davidson et David J. Birnbach
INTRODUCTION
Ces dernières années, les techniques d'anesthésie régionale pour la chirurgie, obstétrique, et la gestion de la douleur postopératoire ont été utilisées avec une fréquence croissante. La technique rachidienne-péridurale combinée (CSE), un choix anesthésique relativement nouveau, comprend une injection sous-arachnoïdienne initiale suivie de la mise en place d'un cathéter péridural et de l'administration ultérieure de médicaments périduraux. Cela permet un soulagement rapide de la douleur ou l'induction d'une anesthésie régionale par l'apparition rapide des médicaments rachidiens et l'administration ultérieure de médicaments pour une anesthésie prolongée. De plus, l'analgésie postopératoire via le cathéter épidural peut être administrée pendant de longues périodes. Des études cliniques ont démontré que la technique CSE offre d'excellentes conditions chirurgicales aussi rapidement que le bloc sous-arachnoïdien en un seul coup et avec des avantages par rapport au bloc épidural conventionnel. L'avantage réside dans le fait que l'anesthésie CSE offre des avantages à la fois spinal et anesthésie péridurale.
Bien que la technique CSE soit devenue de plus en plus populaire au cours des deux dernières décennies, il s'agit d'une technique plus complexe qui nécessite une compréhension globale de la péridurale et physiologie de la colonne vertébrale et pharmacologie. Ce chapitre traite des aspects techniques, des avantages, des complications potentielles et des limites de la technique CSE pour la chirurgie, la gestion de la douleur postopératoire et analgésie du travail.
APPLICATIONS CLINIQUES DU CSE
Les résultats d'une enquête menée par Blanshard et Cook ont démontré une grande variation dans l'utilisation et la pratique de l'anesthésie CSE parmi les anesthésiologistes expérimentés, reflétant les inquiétudes concernant la fréquence des complications liées à la CSE, la controverse sur la technique et le potentiel de taux d'échec plus élevés avec la technique CSE. par rapport à une colonne vertébrale individuelle ou autre anesthésique Techniques.
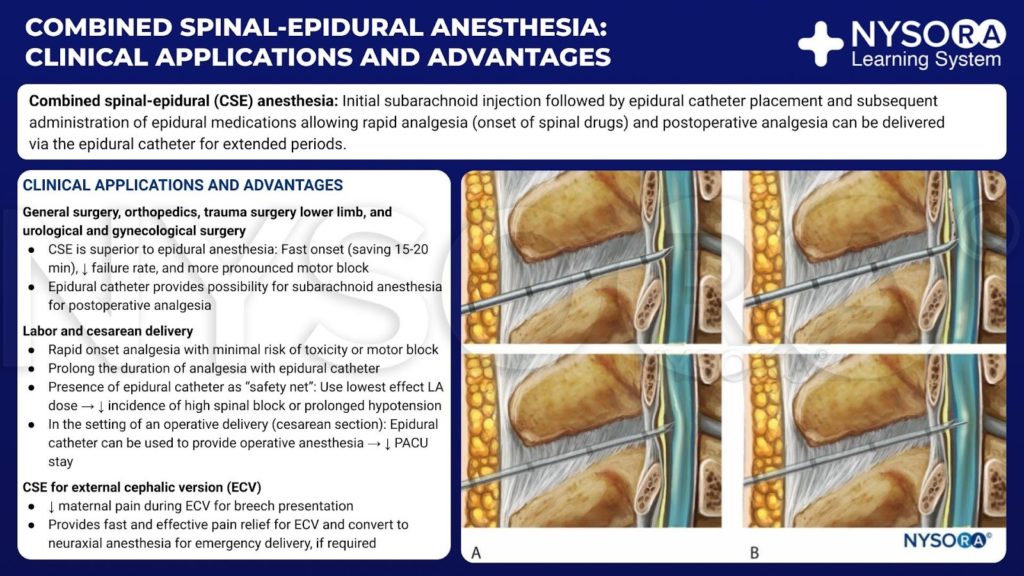
Extrait du Compendium of Regional Anesthesia : applications cliniques et avantages de l'infographie sur l'anesthésie rachidienne-péridurale combinée.
Chirurgie générale
La technique CSE a été décrite dans la littérature médicale pour une utilisation en chirurgie générale, en orthopédie, en chirurgie traumatologique du membre inférieur et en chirurgie urologique et gynécologique. Des études cliniques ont démontré que la technique CSE permet d'obtenir d'excellentes conditions chirurgicales aussi rapidement qu'avec un bloc sous-arachnoïdien en un seul coup, meilleures qu'avec le bloc péridural seul. Avec la technique CSE, l'anesthésie chirurgicale est établie rapidement, économisant 15 à 20 minutes par rapport à l'anesthésie péridurale. De plus, le cathétérisme péridural offre la possibilité de compléter l'anesthésie sous-arachnoïdienne, qui peut être insuffisante lorsqu'elle est utilisée seule. Ceci a été récemment illustré par Mane et al, qui ont présenté une série de cas d'appendicectomie laparoscopique réalisée avec succès sous anesthésie CSE. L'anesthésie CSE dans leur série a été réalisée à l'aide d'aiguilles séparées à deux espaces différents. Anesthésie rachidienne a été réalisée à l'espace intermédiaire L2-L3 en utilisant 2 ml de bupivacaïne hyperbare à 0.5% (10 mg) mélangée à 25 μg de fentanyl. Le cathéter péridural a été inséré au niveau de l'espace intermédiaire T10-T11 pour compléter l'anesthésie rachidienne et pour soulager la douleur postopératoire. Dans un article lié à l'obstétrique, il a également été observé que diverses aiguilles peuvent être utilisées dans différentes combinaisons lors de l'exécution de la technique CSE et peuvent avoir différents avantages et inconvénients pour différents patients et situations. Ceci est discuté plus loin dans le chapitre.
Analgésie du travail
La technique CSE est largement utilisée en pratique obstétricale pour fournir une analgésie optimale aux parturientes. Il offre une analgésie efficace et rapide avec un risque minimal de toxicité ou de blocage moteur. De plus, cette technique offre la possibilité de prolonger la durée de l'analgésie, comme cela est souvent nécessaire pendant le travail, grâce à l'utilisation d'un cathéter épidural. En outre, si une délivrance opératoire devient nécessaire, ce même cathéter épidural peut être utilisé pour fournir une anesthésie opératoire. Le début de l'analgésie rachidienne est quasi immédiat, et la durée est comprise entre 2 et 3 heures, selon le ou les agents choisis. La durée de l'analgésie rachidienne, cependant, s'est avérée réduite lorsqu'elle est administrée à une femme en travail avancé par rapport à une femme en début de travail. Les patients en travail peuvent être plus satisfaits de l'anesthésie CSE que des péridurales standard, peut-être en raison d'un plus grand sentiment de maîtrise de soi. Les descriptions originales de l'analgésie du travail rachidien utilisaient du sufentanil ou du fentanyl, mais l'ajout de bupivacaïne isobare à l'opioïde produit une plus grande densité de bloc sensoriel tout en minimisant le bloc moteur. À l'origine, 25 μg de fentanyl ou 10 μg de sufentanil étaient préconisés, mais des études ultérieures ont suggéré l'utilisation de doses plus faibles d'opioïdes associées à un anesthésique local.
Par exemple, de nombreux cliniciens utilisent désormais systématiquement 10 à 15 μg de fentanyl intrathécal. Plusieurs études ont suggéré que la ropivacaïne et la lévobupivacaïne peuvent remplacer la bupivacaïne intrathécale, en particulier lorsqu'elles sont ajoutées à un opioïde, pour fournir une analgésie pendant le travail. La technique CSE a également rendu la marche possible pour de nombreuses femmes recevant une analgésie neuraxiale, bien que la marche puisse également être possible avec d'autres techniques. Wilson et al ont montré que beaucoup plus de femmes maintenaient une puissance de jambe supérieure pendant une période plus longue avec l'anesthésie CSE qu'avec une perfusion à faible dose de péridurale standard. En plus de l'avantage d'un soulagement rapide de la douleur, la technique CSE peut réduire l'incidence de plusieurs problèmes potentiels associés à la technique péridurale conventionnelle, y compris le bloc incomplet (inégal), le bloc moteur et une mauvaise propagation sacrée. Un autre avantage potentiel de la technique CSE est qu'elle peut être associée à une réduction significative de la durée de la première phase du travail chez les parturientes primipares. Cependant, selon une étude plus récente de Pascual-Ramirez et al, par rapport à l'analgésie péridurale conventionnelle, la technique CSE n'a pas raccourci la durée totale du travail, mais a réduit les besoins en anesthésie locale et la faiblesse motrice. La réduction du bloc moteur est avantageuse pour les parturientes, même celles qui ne marcheront pas.
Technique combinée rachi-péridurale pour l'accouchement par césarienne
La technique CSE, signalée pour la première fois comme une option pour l'accouchement par césarienne en 1984, a récemment gagné en popularité de façon spectaculaire. L'avantage de cette technique est qu'elle fournit un début rapide d'anesthésie chirurgicale dense tout en permettant de prolonger le bloc avec un cathéter péridural. De plus, comme le bloc peut être complété à tout moment, la technique CSE permet l'utilisation initiale de doses plus faibles d'anesthésiques locaux rachidiens, ce qui peut, à son tour, réduire l'incidence d'un bloc rachidien élevé ou d'une hypotension prolongée. Cela peut également réduire la durée du séjour en unité de soins post-anesthésiques (USPA). Les problèmes potentiels de la technique CSE pour l'accouchement par césarienne comprennent une incapacité à tester le cathéter, la possibilité d'un cathéter péridural défaillant après l'injection spinale et le risque de propagation accrue du médicament spinal précédemment injecté après l'utilisation du cathéter péridural.
Technique combinée spino-épidurale pour la version céphalique externe de la présentation par le siège
L'analgésie neuraxiale a été utilisée pour réduire la douleur maternelle lors de la version céphalique externe (VCE) pour la présentation du siège. Un avantage potentiel de la technique CSE est la capacité de fournir un soulagement rapide et efficace de la douleur pour l'ECV et de convertir en anesthésie neuraxiale pour un accouchement d'urgence si nécessaire. Kawase et al ont rapporté un cas réussi de VCE sous la technique CSE suivi d'un accouchement vaginal. Sullivan et ses collègues ont étudié l'effet de la technique CSE sur le succès de la VCE par rapport à l'analgésie opioïde systémique et n'ont trouvé aucune différence ; cependant, les scores de douleur étaient plus faibles et la satisfaction était plus élevée avec l'analgésie CSE. En savoir plus sur Anesthésie Régionale Obstétricale.
AVANTAGES DE LA TECHNIQUE COMBINÉE RACHIDE-PÉRIDURALE
Début du bloc
Lorsque le bloc CSE a été comparé au bloc péridural ou sous-arachnoïdien pour l'arthroplastie de la hanche ou du genou, l'anesthésie CSE s'est avérée supérieure à l'anesthésie péridurale. Avec la technique CSE, l'anesthésie chirurgicale a été rapidement mise en place, économisant 15 à 20 minutes par rapport à anesthésie péridurale. De plus, le cathéter péridural offrait la possibilité de compléter une anesthésie sous-arachnoïdienne insuffisante. Les patients qui ont reçu la technique CSE ont eu un bloc moteur plus intense que ceux qui ont reçu une anesthésie péridurale seule.
Taux d'échec
Il a été rapporté que la technique CSE diminue le taux d'échec et l'incidence de plusieurs autres événements indésirables associés à l'analgésie neuraxiale. Dans une analyse rétrospective de près de 20,000 75 accouchements (12 % de taux d'analgésie neuraxiale pendant le travail), le taux d'échec global avec cette technique était de 6.8 %. Les patientes avaient une analgésie adéquate dès le placement initial, mais 98.8 % des patientes avaient une analgésie inadéquate par la suite pendant le travail et ont nécessité le remplacement du cathéter péridural. En fin de compte, 1.5 % de tous les patients du rapport de Pan ont reçu une analgésie adéquate, même si XNUMX % des patients ont eu un ou plusieurs remplacements de cathéter péridural. Cependant, par rapport à l'analgésie péridurale seule pour le travail, les incidents d'échec global, de cathéters périduraux intravasculaires accidentels, de ponctions durales accidentelles, d'analgésie péridurale inadéquate et de remplacements de cathéter se sont révélés à plusieurs reprises significativement plus faibles chez les patients recevant une analgésie CSE. En outre, Eappen et al ont rapporté que le CSE avait un taux de réussite plus élevé par rapport à la technique épidurale conventionnelle. Cette différence peut être due à la capacité de confirmer l'emplacement épidural douteux par un placement rachidien réussi et l'observation du liquide céphalo-rachidien (LCR).
Exigence d'anesthésie locale
Pendant la chirurgie Le CSE permet une rachianesthésie à faible dose pour l'accouchement par césarienne. Lors de l'utilisation de l'anesthésie rachidienne à un seul coup (SSS) pour la chirurgie ambulatoire, de nombreux anesthésistes ont tendance à administrer plus de médicaments que nécessaire car il n'y a qu'une seule chance d'assurer un bloc rachidien efficace. La présence d'un cathéter péridural comme « filet de sécurité » permet à l'anesthésiste d'utiliser la plus faible dose efficace d'anesthésique local. Urmey et al ont utilisé la technique CSE pour étudier la dose appropriée de lidocaïne isobare intrathécale à 2 % pour l'arthroscopie en ambulatoire. La technique CSE a fourni une excellente anesthésie pour les 90 patients de son étude. Les patients recevant la plus petite dose (40 mg) ont eu une durée d'anesthésie significativement plus courte, ce qui a permis une sortie plus rapide que pour les patients recevant 60 ou 80 mg de lidocaïne intrathécale.
Norris et al ont suggéré l'utilisation d'une technique CSE avec du sufentanil intrathécal seul pour la lithotripsie par ondes de choc en ambulatoire, réservant l'utilisation d'un cathéter péridural aux patients qui n'ont pas obtenu une analgésie adéquate.
Pendant le travail Analgésie Patel et al ont étudié l'impact des médicaments rachidiens administrés dans le cadre d'une technique CSE sur les besoins ultérieurs en bupivacaïne épidurale. Dans une étude prospective, randomisée et en double aveugle, la MLAC (concentration minimale d'analgésique local) de la bupivacaïne péridurale pour l'analgésie du travail a été évaluée après une médication initiale intrathécale (CSE) ou péridurale (péridurale standard). Ils ont rapporté que le MLAC de la bupivacaïne épidurale n'était pas réduit par l'utilisation de médicaments intrathécaux, mais en fait augmenté d'un facteur de 1.45. (MLAC dans le groupe épidural standard était de 0.032 % poids/vol et pour le groupe CSE était de 0.047 % poids/vol.)
Cela suggère que l'analgésie CSE peut ne pas offrir un avantage analgésique quantitatif par rapport à l'analgésie épidurale standard au-delà de la dose initiale.
Extension du volume péridural : une modification du CSE
Au cours de l'anesthésie CSE, il a été démontré que la supplémentation de l'espace péridural avec une solution saline péridurale (« extension du volume épidural », EVE) peut influencer le niveau d'anesthésie et la qualité de la rachianesthésie. Le mécanisme proposé pour cette augmentation est un effet compressif sur l'espace sous-arachnoïdien qui favorise la diffusion céphalique de l'anesthésique local. Takiguschi et al, dans une étude utilisant la myélographie sur des volontaires humains, ont démontré que le produit de contraste dans l'espace sous-arachnoïdien était déplacé crânialement après une injection saline péridurale lombaire et que le diamètre de l'espace sous-arachnoïdien était rétréci en raison de l'effet de volume. Il s'agit d'un phénomène dépendant du temps avec un maximum d'avantages s'il est effectué tôt. De même, Blumgart et al ont montré qu'EVE avec 10 ml de solution saline normale entraînait une augmentation de la hauteur du bloc sensoriel de quatre segments après l'administration de 8 à 9 mg de bupivacaïne hyperbare sous-arachnoïdienne chez les femmes subissant une césarienne.
Cependant, une étude plus récente de Loubert et al n'a pas réussi à montrer une différence de hauteur de bloc sensoriel après EVE avec 5 ml de solution saline normale. Il est possible que le volume de 5 ml ait été insuffisant dans cette population de patients, bien que le volume de solution saline normale qui s'est déjà avéré efficace pour l'EVE soit d'environ 5 à 10 ml. Les résultats peuvent également être dus à un effet de position ; dans les deux études, la technique CSE a été réalisée en position assise. Cependant, Blumgart a injecté 10 ml de solution saline par voie épidurale à travers le cathéter dans les 5 minutes suivant le traitement hyperbare de la colonne vertébrale uniquement après que le patient a été mis en décubitus dorsal avec une inclinaison latérale gauche de 15 °. Dans l'étude de Loubert, 5 ml de solution saline normale ont été injectés par l'aiguille de Tuohy immédiatement après le médicament hyperbare rachidien alors que les patients étaient toujours en position assise. Enfin, le cathéter péridural a été enfilé et les patients ont été aidés dans l'inclinaison latérale gauche de 15° en décubitus dorsal.
La baricité de l'anesthésique local est-elle un facteur ? Une étude de Tyagi et al a démontré (chez des patientes non obstétriques) que l'EVE était plus efficace avec la bupivacaïne ordinaire par rapport à la bupivacaïne hyperbare, nécessitant une dose plus faible tout en produisant un bloc sensoriel plus élevé avec un début plus précoce. Ils ont attribué cette différence à la diffusion restreinte des anesthésiques locaux hyperbares dans l'espace sous-arachnoïdien par rapport à la solution ordinaire.
Une autre étude de Tyagi et al a révélé que le niveau de bloc intrathécal était similaire en durée et en étendue avec la bupivacaïne hyperbare, qu'elle soit administrée sous forme de SSS ou d'administration CSE avec ou sans EVE sur des parturientes subissant une césarienne élective. De nombreux facteurs semblent affecter EVE. Il s'agit notamment du moment, du volume de solution saline, des caractéristiques de l'anesthésique local (hyperbare ou hypobare), de la position pendant ou après la rachianesthésie et des patients obstétriques par rapport aux patients non obstétricaux. Bien qu'il ait été proposé qu'EVE puisse permettre une dose sous-arachnoïdienne réduite d'anesthésique local pour la chirurgie et par conséquent réduire l'incidence des effets hémodynamiques associés au bloc rachidien, il existe un manque d'uniformité entre les protocoles et les résultats des études. Par conséquent, l'influence de l'injection péridurale de solution saline sur la qualité de la rachianesthésie reste incertaine.
CSE séquentiel
Dans une étude menée par Fan et al, quatre doses intrathécales différentes de bupivacaïne hyperbare (2.5, 5, 7.5 et 10 mg) ont été comparées chez des patientes subissant un accouchement par césarienne sous bloc CSE séquentiel, une technique qui implique l'administration d'un bloc sous-arachnoïdien relativement petit qui peut être complétée au besoin par des anesthésiques locaux périduraux. Les auteurs ont démontré que 5 mg de bupivacaïne intrathécale associée à une dose appropriée de lidocaïne péridurale procuraient une analgésie chirurgicale adéquate tout en maintenant une stabilité hémodynamique optimale. Des doses plus élevées de bupivacaïne intrathécale ont été associées à des effets indésirables typiques du bloc sous-arachnoïdien haut, tels que nausées, vomissements et dyspnée. Macfarlane et al ont démontré que l'anesthésie CSE ne semble offrir aucun avantage hémodynamique par rapport à l'anesthésie SSS pendant l'accouchement par césarienne lorsque la même dose d'anesthésique local est administrée. La stabilité hémodynamique a été étudiée directement en mesurant la pression artérielle non invasive et indirectement par les besoins en éphédrine, l'indice de résistance vasculaire systémique et l'indice cardiaque à l'aide de la cardiographie par impédance thoracique.
Combiné rachi-péridurale pour les patients à haut risque
La technique CSE séquentielle peut être particulièrement avantageuse chez les patients à haut risque, tels que ceux maladie cardiaque, lorsqu'une apparition plus lente du bloc sympathique est souhaitable. La plupart des anesthésiques rachidiens sont administrés en une seule injection, et l'apparition rapide d'un bloc sympathique peut entraîner une hypotension brutale et sévère. Traditionnellement, les patients à haut risque sont pris en charge avec le début lent de l'anesthésie péridurale contrôlée, qui nécessite des doses totales d'anesthésique local beaucoup plus élevées que ce n'est le cas avec l'ECS séquentielle. Avec un positionnement soigneux du patient avant l'induction du bloc sous-arachnoïdien et en permettant une titration avec de petites doses péridurales incrémentielles jusqu'au niveau précis d'anesthésie souhaité, la technique séquentielle CSE peut améliorer la sécurité du bloc neuraxial. Agarwal et al ont rapporté une prise en charge réussie de l'hystérectomie chez une patiente présentant une communication interventriculaire et une atrésie pulmonaire (VSD-PA) en utilisant le CSE avec la technique EVE. Dans le même ordre d'idées à haut risque, Month et al ont présenté deux parturientes atteintes d'hypertension intracrânienne idiopathique qui ont obtenu à la fois une analgésie du travail et un soulagement symptomatique en utilisant la technique CSE avec un retrait de petit volume de LCR.
En résumé, le CSE peut réduire ou éliminer bon nombre des inconvénients de l'anesthésie sous-arachnoïdienne ou péridurale seule tout en préservant leurs avantages respectifs. Le bloc CSE offre la rapidité d'apparition, l'efficacité et la toxicité minimale d'un bloc sous-arachnoïdien combiné avec le potentiel d'améliorer un bloc inadéquat ou de prolonger la durée de l'anesthésie avec des suppléments épiduraux ; avec la péridurale, on peut prolonger l'analgésie jusque dans la période postopératoire. Bien que la technique CSE séquentielle prenne un peu plus de temps que la technique CSE standard, il a été démontré que l'utilisation de doses minimales d'anesthésiques locaux réduit la fréquence et la gravité de l'hypotension par rapport aux techniques épidurales ou rachidiennes. Malgré de nombreuses études prônant la CSE, une revue Cochrane de 2007 de 19 essais randomisés impliquant 2658 femmes en travail a conclu que la CSE offre peu d'avantages par rapport à l'analgésie péridurale conventionnelle, et il n'y avait aucune différence dans la satisfaction globale des femmes entre les deux techniques. Cependant, les auteurs ont reconnu que le CSE a produit un début légèrement plus rapide de soulagement efficace de la douleur et moins de besoin d'analgésie de secours et a été associé à moins de rétention urinaire. Plus tard, Van de Velde a critiqué cette revue Cochrane, déclarant qu'un certain nombre d'études bien réalisées avaient été exclues de l'analyse. Il a écrit : « Avec l'analgésie péridurale conventionnelle, il existe une plus grande variabilité inter-patients en ce qui concerne le moment d'apparition de l'analgésie. Avec le CST, le délai d'apparition est court chez tous les patients, quels que soient les autres facteurs.
ANATOMIE FONCTIONNELLE LIÉE AU CSE
Lors de la réalisation d'un bloc péridural, la distance entre la peau et l'espace épidural (SED) et la distance entre l'espace épidural postérieur (PED) sont des mesures qui peuvent aider à réduire la pénétration accidentelle de la dure-mère et les lésions des structures neurales. La connaissance de ces distances est également importante dans le taux de réussite des blocs épiduraux. Le PED, une mesure de la profondeur de l'espace épidural, est particulièrement important avec la technique CSE aiguille à travers l'aiguille (NTN). La sous-estimation de cette distance (courte saillie de l'aiguille rachidienne à travers l'aiguille péridurale) entraînera une incidence plus élevée d'échec du bloc rachidien.
Toute approche non médiane augmenterait également le risque de ne pas atteindre l'espace sous-arachnoïdien car le sac dural a une forme triangulaire avec le sommet pointant vers le dos. La surestimation de la PED entraînera une protrusion excessive de l'aiguille spinale, ce qui peut augmenter le risque de lésions neurales. Ces distances ont été mesurées à l'aide de diverses méthodes, notamment l'imagerie par résonance magnétique (IRM), la tomodensitométrie (TDM), l'échographie et la mesure de la distance pointe à pointe CSE ou de la quantité de saillie de l'aiguille vertébrale au-delà de l'aiguille de Tuohy. La distance du SED est le plus souvent de 4 cm (50 %) et de 4 à 6 cm chez 80 % de la population selon les dossiers détaillés de 3200 5 cas. La largeur du PED varie avec le niveau vertébral, étant la plus large dans la région médio-lombaire (6 à 3 mm) et diminuant vers la colonne vertébrale cervicale. Dans la région médiothoracique, il mesure 5 à 1.5 mm sur la ligne médiane et se rétrécit latéralement. Dans la région cervicale inférieure, il n'est que de 2 à 10 mm sur la ligne médiane. Ces espaces sont également en corrélation avec le rapport poids/taille et l'indice de masse corporelle (IMC). Sur la base de ces mesures, la conception actuelle de la saillie de l'aiguille spinale varie entre 15 et XNUMX mm au-delà de l'aiguille péridurale. En savoir plus sur Anatomie neuraxiale fonctionnelle.
Espace péridural et Flavum ligamentaire
L'épaisseur du ligament jaune, la distance à la dure-mère et la distance peau-dure varient en fonction de la surface du canal vertébral (voir Tableau 1).
Les deux ligaments flava sont joints (fusionnés) de manière variable sur la ligne médiane, et cette fusion ou absence de fusion du ligament flavum se produit à différents niveaux vertébraux chez des patients individuels. Lirk et al ont étudié l'incidence des lacunes de la ligne médiane du ligament jaune lombaire dans les cadavres embaumés. Des échantillons de colonne vertébrale ont été obtenus à partir de 45 cadavres humains. Les lacunes du ligament jaune lombaire sont les plus fréquentes entre L1 et L2 (22.2 %) mais sont rares en dessous de ce niveau (L2–L3 = 11.4 %, L3–L4 = 11.1 %, L4–L5 = 9.3 %, L5–S1 = 0). Par conséquent, lors de l'utilisation d'une approche médiane, on ne peut pas compter sur le ligament jaune pour empêcher l'entrée dans l'espace épidural chez tous les patients.
TABLE 1. Caractéristiques du ligament jaune à différents niveaux vertébraux.
| site | Peau à Ligament (cm) | Épaisseur du ligament (mm) |
|---|---|---|
| Cervical | - | 1.5-3.0 |
| Thoracique | - | 3.0-5.0 |
| Lombaire | 3.0-8.0 | 5.0-6.0 |
| Débit | Variable | 2.0-6.0 |
Pour une revue plus complète, voir Anatomie neuraxiale
TECHNIQUE
Un certain nombre d'examens ont examiné les facteurs techniques liés à la performance et au succès du CST. Bien que le CSE soit considéré comme une technique relativement nouvelle, en 1937, Soresi a en fait décrit l'injection intentionnelle d'agents anesthésiques à l'extérieur et à l'intérieur de l'espace sous-arachnoïdien. Quelque peu différent de la pratique actuelle, Soresi a intentionnellement utilisé une seule aiguille. Il a d'abord injecté un anesthésique local dans l'espace péridural, puis a avancé l'aiguille et injecté le reste du médicament pour provoquer un bloc sous-arachnoïdien. Bien que cette technique comprenne à la fois une anesthésie rachidienne et péridurale, aucun cathéter n'a été utilisé. En 1979, Curelaru a signalé le premier CSE avec l'introduction d'un cathéter épidural à travers une aiguille de Tuohy. L'insertion du cathéter a été suivie d'une dose test, puis d'une ponction durale traditionnelle, qui a été réalisée à un espacement différent à l'aide d'une aiguille spinale de calibre 26. Cette même année, Brownridge a suggéré l'utilisation du CSE pour l'obstétrique. Il a décrit l'utilisation réussie du CSE pour la césarienne élective en 1981. En 1982, la technique NTN CSE a été décrite pour la première fois indépendamment par Coates et Mumtaz, et son utilisation active dans la pratique obstétricale a été publiée pour la première fois en 1984 par Carrie. La popularité de la technique a commencé à la fin des années 1990. Plusieurs approches pour l'initiation du CSE ont été décrites dans la littérature récente.

Extrait du Compendium d'anesthésie régionale : Infographie sur les techniques d'anesthésie rachidienne-épidurale combinée.
Technique de l'aiguille dans l'aiguille
Contrairement à la description initiale de Soresi du CSE, dans laquelle une seule aiguille était introduite dans l'espace épidural puis avancée dans l'espace sous-arachnoïdien, la technique NTN actuellement préférée comprend l'utilisation d'aiguilles épidurales et rachidiennes séparées. En règle générale, l'espace épidural est localisé avec une aiguille et une technique épidurales conventionnelles, puis une longue aiguille rachidienne est passée à travers l'aiguille épidurale jusqu'à ce que le LCR apparaisse dans le moyeu de l'aiguille rachidienne. Le médicament est administré via l'aiguille rachidienne dans l'espace sous-arachnoïdien, l'aiguille rachidienne est retirée et enfin un cathéter épidural est inséré dans l'espace épidural. Bien que plusieurs techniques CSE différentes soient utilisées dans la pratique clinique (y compris la technique à deux aiguilles, deux espaces), NTN est la technique CSE la plus largement utilisée aux États-Unis.
Technique de l'aiguille séparée
La technique CSE peut être réalisée à l'aide de deux aiguilles séparées avec la technique de l'aiguille séparée (SNT), avec placement d'un bloc rachidien et d'un cathéter épidural à un ou deux espaces différents. Si le cathéter péridural est placé en premier, le placement correct peut être testé avant l'administration de médicaments pour la colonne vertébrale, ce qui réduit potentiellement le risque de migration accidentelle du cathéter intravasculaire ou intrathécal. Placer le cathéter épidural en premier peut également réduire le risque de lésions neurales, qui peuvent survenir lorsque le cathéter est inséré après un bloc sous-arachnoïdien, car la paresthésie et d'autres signes avant-coureurs d'un mauvais placement de l'aiguille peuvent être absents après l'administration de médicaments pour la colonne vertébrale.
Cependant, il existe également le risque de heurter le cathéter péridural avec l'aiguille spinale. Certains auteurs considèrent qu'il s'agit d'un risque purement hypothétique et ont démontré qu'il n'est pas possible de perforer un cathéter péridural avec des aiguilles rachidiennes couramment utilisées.
Cook et al ont rapporté une série de 201 CSE consécutives réalisées avec un nouveau SNT. L'étude a été conçue pour éviter les problèmes potentiels et réels associés à la technique CSE.
Cook et al ont placé l'aiguille rachidienne dans l'espace sous-arachnoïdien, puis ont remplacé le stylet de l'aiguille rachidienne pour arrêter la fuite de LCR. Ensuite, le cathéter épidural a été placé à travers un espace intermédiaire différent, puis renvoyé à l'aiguille spinale pour injecter le médicament sous-arachnoïdien, évitant ainsi l'insertion du cathéter épidural chez un patient anesthésié. Cette méthode d'anesthésie CSE, bien que beaucoup plus laborieuse, peut être associée à un taux de succès élevé et à de faibles taux de complications. Quel que soit le composant réalisé en premier, l'inconvénient majeur de la technique à deux aiguilles et deux espaces intermédiaires est qu'elle prend plus de temps à réaliser et nécessite deux injections séparées.
Comparaison des techniques
La technique SNT présente quelques avantages théoriques par rapport à la technique NTN. Il permet la mise en place du cathéter péridural avant l'initiation du bloc rachidien. Le SNT peut donc théoriquement réduire le risque de lésion neurologique car les paresthésies et autres symptômes ne sont pas masqués. Étant donné que le cathéter péridural est placé tôt, les problèmes pouvant survenir en raison d'un placement retardé du cathéter (problèmes techniques) après l'injection d'une solution rachidienne hyperbare (telle qu'un bloc neuraxial régional unilatéral, sacré ou lombaire bas) sont évités. Plusieurs études ont comparé les techniques NTN et SNT. Certains ont signalé un meilleur succès et des taux d'échec inférieurs avec le SNT. Cependant, ces études ont également rapporté une plus grande acceptation par les patients et moins d'inconfort avec la technique NTN.
Backe et al, dans une étude prospective randomisée, ont comparé les résultats et les techniques de CSE NTN et SNT (double espace) chez 200 patientes ayant accouché par césarienne élective. Les blocs réussis à T5 avec les techniques à double espace et NTN étaient de 80 contre 54, respectivement, rapport de cotes de 0.29. La SNT a eu un taux de réussite supérieur à la technique NTN ; le dermatome T5 a été atteint avec moins de manipulations correctives (augmentation épidurale ou blocs répétés). L'impossibilité d'entrer dans l'espace intrathécal une fois l'espace épidural repéré est survenue chez 29 patients du groupe NTN. Le temps de préparation à la chirurgie, cependant, a été légèrement augmenté avec le SNT (15 minutes avec le SNT contre 12.9 minutes avec le NTN). Sadashivaiah et al ont analysé rétrospectivement les données de 3519 accouchements par césarienne élective réalisés selon la technique SNT. Ils ont signalé un taux de conversion en anesthésie générale inférieur à celui rapporté précédemment (0.23 % à 0.8 %). L'un des problèmes avec la technique NTN est que de nombreux patients se plaignent de paresthésie/dysesthésie ou réagissent (mouvement, grimace, vocalisation) à la ponction durale lors de l'insertion d'une aiguille à pointe de crayon. Van den Berg et al ont comparé les effets de la solution saline par rapport à l'air pour la perte de résistance (LOR) sur l'apparition de cet inconfort et ont rapporté que l'utilisation de la solution saline est associée à moins de réponses des patients (1.3 % contre 18 %) au moment de la thecal pénétration. Bien que le mécanisme de cette réponse réduite avec une solution saline pour LOR ne soit pas clair, les auteurs ont postulé que peut-être le placement de solution saline dans l'espace péridural modulait la sensibilité durale.
Techniques pour améliorer le succès et la sécurité de la rachi-péridurale combinée
Le succès d'un bloc CSE dépend fortement de la canulation précise de l'espace épidural. L'identification de l'espace épidural est traditionnellement réalisée par une technique LOR en aveugle. Avec cette manipulation des aiguilles, où la rétroaction vers l'opérateur est simplement tactile, une déviation de l'axe de la trajectoire de l'aiguille peut se produire. En raison de la forme triangulaire du sac dural, la déviation de l'aiguille rachidienne par rapport à la ligne médiane entraînera le manque du sac dural, entraînant une défaillance du composant rachidien ou une ponction durale infructueuse. Grau et al ont effectué une échographie en temps réel de la colonne lombaire pour fournir une lecture précise de l'emplacement de la pointe de l'aiguille et pour faciliter la réalisation de l'anesthésie CSE. Leur objectif était d'établir une méthode moins invasive pour surveiller l'avancement de l'aiguille en temps réel. Trente parturientes devant accoucher par césarienne ont été randomisées en trois groupes égaux. Dix patients témoins ont reçu une anesthésie CSE réalisée de manière conventionnelle. Dix ont reçu des échographies par une technique hors ligne. Les 10 autres ont reçu une imagerie en ligne de la région lombaire pendant la ponction. L'aiguille de Tuohy a été insérée en utilisant l'approche de la ligne médiane dans les trois groupes. Dans le groupe témoin, le CSE a été réalisé à l'aide d'une technique NTN à espace unique avec la méthode LOR standard à solution saline. Dans le groupe hors ligne, des images échographiques ont été prises juste avant la ponction pour améliorer la trajectoire de l'aiguille. Dans le groupe en ligne, des images ultrasonores ont été prises pour surveiller et identifier la trajectoire de l'aiguille en temps réel.
Les auteurs ont rapporté que dans les deux groupes d'échographie, une réduction significative du nombre de tentatives de ponction nécessaires a été constatée (p < 036) ; le nombre d'espaces nécessaires à la ponction a été réduit (p < 036) ; et le nombre de manipulations à l'aiguille vertébrale a été significativement réduit (p < 036). Le tenting dural a été observé chez 9 des 10 membres du groupe en ligne (longueur du tenting 2.4 mm). Un bloc asymétrique a été observé chez 10 % des patients du groupe témoin, mais chez aucun de ceux des groupes d'échographie. Les auteurs ont conclu que l'utilisation de l'imagerie par ultrasons était évidemment utile pour trouver la trajectoire idéale de l'aiguille et pour améliorer les conditions de ponction en démontrant l'anatomie pertinente. Dans la technique CSE NTN, il n'y a pas de test pratique pour confirmer le placement correct du cathéter épidural. Tsui et ses collègues ont proposé l'utilisation de stimulateurs nerveux pour confirmer le placement correct du cathéter épidural. Ils ont étudié 39 patientes obstétricales en travail, recevant des cathéters périduraux (pas de CSE) pour l'analgésie. Une stimulation électrique à faible courant (1 à 10 mA) a été utilisée pour confirmer la mise en place correcte du cathéter épidural (19-gauge Arrow Flextip plus). Une réponse motrice positive (tronc ou membre) indiquait que le cathéter se trouvait dans l'espace épidural. Ils ont rapporté que la sensibilité et la spécificité de ce test étaient respectivement de 100% et 100%, avec 38 vrais tests positifs et 1 vrai test négatif. Un cas de migration intravasculaire du cathéter péridural a été détecté à l'aide de ce nouveau test et a ensuite été confirmé par un test d'adrénaline positif. Si la réponse motrice ne se produit qu'avec des courants plus importants (> 10 mA) ou ne répond pas du tout (avant de recevoir des anesthésiques locaux), le cathéter est très probablement en dehors de l'espace épidural. Si une réponse positive se produit à un milliampérage anormalement bas (<1 mA), un placement intrathécal est probable.
Le test de stimulation électrique peut ne pas être applicable lorsque la technique CSE est utilisée pour la chirurgie, où des doses anesthésiques d'anesthésiques locaux sont administrées par voie intrathécale avant la mise en place du cathéter épidural. Lors de l'utilisation de la technique CSE pour l'analgésie du travail, ce test peut être utilisé comme une méthode simple et pratique pour déterminer le placement du cathéter épidural. La dose test standard utilisée aux États-Unis (3 mL de lidocaïne à 1.5 % avec épinéphrine à 1:200,000 XNUMX) peut aider à identifier le placement intravasculaire et intrathécal, mais elle ne vérifie pas le placement ou la fonction épidurale appropriée.
MÉDICAMENTS POUR COMBINAISON RACHIDE-PÉRIDURALE
Le sufentanil et le fentanyl, avec ou sans anesthésiques locaux, sont le plus souvent administrés par voie intrathécale pour fournir une analgésie à la femme en travail recevant une CSE. Les doses habituelles de sufentanil sont de 2.5 à 10 μg ; cependant, la plupart des praticiens utilisent maintenant 2.5 ou 5 μg. La DE50 et la DE95 pour les patientes en travail étaient respectivement de 2.6 et 8.9 μg. Les doses de fentanyl utilisées sont généralement de 10 à 25 μg. La dose efficace médiane (DE50) et la dose efficace chez 95 % de la population (DE95) pour les patientes en travail ont été respectivement de 5.5 et 17.4 μg. Bien que les études initiales aient utilisé des doses beaucoup plus élevées d'opioïdes intrathécaux (10 μg de sufentanil et 25 à 50 μg de fentanyl), des études ultérieures ont suggéré l'utilisation de doses plus faibles, avec des effets secondaires réduits et un effet analgésique similaire.
La morphine, un opioïde hautement ionisé et soluble dans l'eau, produit une analgésie de longue durée mais d'apparition lente (environ 60 minutes entre l'injection neuraxiale et l'apparition). De plus, il peut être associé à une incidence inacceptablement élevée d'effets secondaires, tels que nausées, vomissements, prurit, ainsi qu'au potentiel de dépression respiratoire retardée. Ces effets secondaires, associés à l'apparition lente du soulagement de la douleur, limitent l'utilité de la morphine intrathécale pour l'analgésie du travail. La mépéridine intrathécale (10 mg) peut fournir une analgésie fiable lors d'un travail avancé, mais a été associée à une incidence élevée de nausées, de vomissements, d'hypotension et à la nécessité d'une prise en charge de l'hypotension artérielle. De plus, c'est le seul opioïde qui possède des propriétés anesthésiques locales intrinsèques à des doses cliniquement appropriées en bloquant la conduction nerveuse à l'extrémité proximale de la racine dorsale via un mécanisme autre que le blocage des canaux sodiques. Ce bloc de conduction nerveuse n'est pas réversible avec la naloxone.
Chez de nombreux patients, une seule injection intrathécale d'un opioïde liposoluble est insuffisante pour produire une analgésie pendant toute la durée du travail. Si la deuxième étape du travail est imminente, pour obtenir un soulagement plus profond de la douleur, l'administration sous-arachnoïdienne d'un anesthésique local plus un opioïde doit être envisagée. La combinaison de 2.5 à 5 μg de sufentanil plus 2.5 mg de bupivacaïne procure une analgésie rapide sans bloc moteur, soulage la douleur de la deuxième étape du travail et dure plus longtemps que le sufentanil seul. Bien que les rapports originaux recommandaient l'utilisation de 10 μg de sufentanil, Sia et ses collègues ont montré qu'un soulagement adéquat de la douleur du travail pouvait être assuré en toute sécurité en administrant la moitié de cette dose de sufentanil intrathécal plus de la bupivacaïne.
Des études antérieures ont tenté de déterminer la DE50 de la bupivacaïne intrathécale, définie comme la dose minimale d'anesthésique local (MLAD) ou DE50, puis de l'utiliser pour évaluer l'effet de différentes doses de fentanyl. La MLAD de la bupivacaïne intrathécale s'est avérée être de 1.99 mg, et l'ajout de 5 μg de fentanyl intrathécal a offert un effet d'épargne significatif similaire à 15 ou 25 μg de fentanyl, entraînant moins de prurit mais avec une durée d'action raccourcie. La DE95 a été estimée à partir de ces études.
Whitty et al ont réalisé une étude de recherche de dose ascendante pour déterminer la DE95 de la bupivacaïne intrathécale (plus pertinente sur le plan clinique que celle calculée à partir de la DE50) lorsqu'elle est associée à une quantité fixe de fentanyl. Ils ont recommandé 1.75 mg de bupivacaïne avec 15 μg de fentanyl pour soulager de manière fiable et rapide la douleur des parturientes dans la phase active du travail. Au Jackson Memorial Hospital (Miami, FL), nous utilisons actuellement 1.25 mg de bupivacaïne plus 15 μg de fentanyl comme médicament pour la colonne vertébrale. Levin et al ont comparé une dose standard de bupivacaïne intrathécale avec du sufentanil pour l'analgésie CSE en utilisant deux doses de ropivacaïne (2 et 4 mg) avec du sufentanil. Ils ont conclu que les deux anesthésiques locaux fournissaient une durée d'analgésie du travail similaire avec des effets secondaires équivalents. En savoir plus sur Anesthésiques locaux.
COMPLICATIONS ET PRÉOCCUPATIONS DE LA TECHNIQUE CSE
Échec de la composante vertébrale
La méthode la plus courante pour effectuer un CSE est la technique NTN à espacement unique. L'échec de l'obtention d'un bloc rachidien avec cette technique a été signalé dans 10 à 15 % des cas dans le passé,111,112 bien que dans des mains expérimentées, ce risque puisse être aussi faible que 2 à 5 %.
Les causes possibles d'échec du CSE sont les suivantes :
1. Aiguille spinale trop courte. L'aiguille ne s'étend pas assez loin au-delà de la pointe de la péridurale ou tente la dure-mère. Holloway et Telford ont observé la distance entre l'identification de l'espace péridural et la pénétration de la dure-mère chez 31 patients lors de l'utilisation d'une aiguille de Tuohy pour effectuer une ponction durale délibérée pour l'insertion de drains lombaires. Bien que de nombreux manuels de référence indiquent des distances moindres entre l'emplacement des espaces épiduraux et la ponction durale, ces auteurs ont trouvé une distance étonnamment grande allant jusqu'à 2.25 cm et ont postulé que la formation de tentes de la dure-mère par l'aiguille spinale atraumatique émoussée pourrait être la cause de cette découverte.
2. Défaut d'entrer dans la dure-mère. Cela peut se produire avec des aiguilles de très petit calibre qui manquent de rigidité pour perforer la dure-mère. Comme postulé par Holloway et Telford, l'absence de pression négative dans l'espace épidural limite le gradient de pression transdural et minimise les forces réactives à travers la dure-mère. Par conséquent, la pénétration de la dure-mère (une membrane relativement dure) nécessite une force réactive substantielle.
3. Divergence de la ligne médiane. Cela peut faire passer l'aiguille vertébrale par la dure-mère, malgré le fait que l'espace épidural ait été identifié.
4. Utilisation d'une longue aiguille spinale de petit calibre. Une longue aiguille rachidienne de petit calibre peut pénétrer dans la dure-mère puis être avancée trop loin (vers l'espace épidural antérieur) en raison du retard du reflux du LCR.
5. Utilisation d'une longue aiguille spinale à pointe de crayon. Un autre problème potentiel peut survenir avec les longues aiguilles spinales à pointe de crayon actuellement utilisées. L'aiguille spinale peut être mal ancrée car elle est située dans l'aiguille péridurale et n'est pas maintenue fermement dans les tissus. Par conséquent, l'aiguille spinale étant susceptible de bouger pendant l'injection, le médicament peut n'être que partiellement administré dans l'espace sous-arachnoïdien. La capacité de tenir l'aiguille spinale régulièrement demande de la pratique mais s'apprend facilement.
6. Retarder la mise en place du cathéter épidural. Une fois que le médicament sous-arachnoïdien a été administré, il peut y avoir un délai lors de la mise en place du cathéter péridural. Celle-ci est généralement brève et sans conséquences, mais selon certains auteurs,
cela peut altérer les caractéristiques finales du bloc. Cette complication est d'une plus grande importance clinique lors de la réalisation d'ECS pour une césarienne. Cependant, si un retard se produit et que le bloc n'atteint pas la hauteur optimale, le cathéter péridural peut être utilisé pour compléter le bloc.
La plupart des conceptions d'aiguilles actuelles permettent l'extension de l'aiguille spinale de 12 à 15 mm au-delà de la pointe de l'aiguille de Tuohy. Des aiguilles trop longues posent cependant des problèmes de manipulation et de profondeur de pose. Une déviation par rapport à la ligne médiane allongera la distance péridurale-durale et peut également faire en sorte que l'aiguille vertébrale manque l'espace rachidien latéralement (Les figures 1 et 2). De plus, une solution saline normale sans conservateur utilisée pour identifier l'espace péridural peut être interprétée à tort comme du LCR.
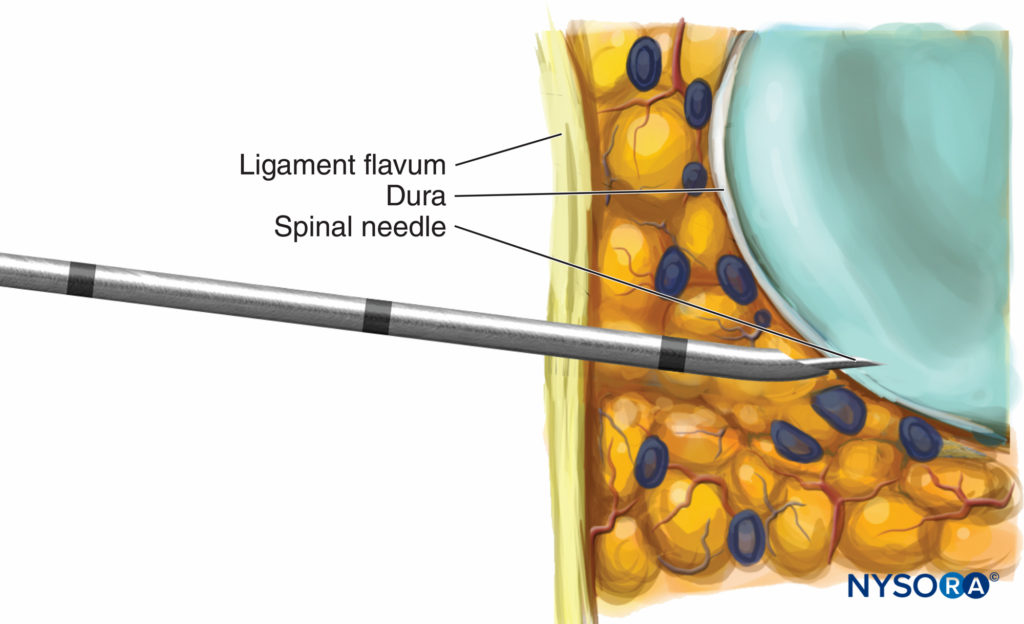
FIGURE 1. Déviation de l'aiguille épidurale latéralement.
Complications associées à la migration rachidienne du cathéter péridural
ou administration intrathécale de médicaments périduraux
Placement sous-arachnoïdien de l'intention
Cathéter péridural
L'une des préoccupations avec la technique CSE est que le cathéter épidural peut passer involontairement à travers le trou de ponction durale dans l'espace sous-arachnoïdien pendant la technique CSE. Cela semble plus probable avec la technique NTN CSE qu'avec la SNT ou avec des aiguilles péridurales à trous arrière (Figure 3). Bien que cela puisse sembler un problème théorique rare, plusieurs publications ont signalé son apparition. Angle et al ont étudié les facteurs contribuant au passage accidentel du cathéter sous-arachnoïdien après la mise en place de la péridurale avec un modèle in vitro utilisant du tissu dural humain. Dans cette étude, la dure-mère a été perforée avec du Whitacre de calibre 25® aiguilles spinales. La probabilité que le cathéter pénètre dans l'espace sous-arachnoïdien a été comparée entre la dure-mère intacte, par rapport à la dure-mère avec des ponctions évidentes à l'aiguille péridurale, et des ponctions uniques à l'aiguille spinale Whitacre de calibre 25 après une technique CSE.

FIGURE 3. Aiguille péridurale avec trou arrière.
Ils ont conclu qu'il est peu probable que le passage du cathéter se produise en présence d'une dure-mère intacte ou après une technique CSE non compliquée. Par conséquent, le passage sous-arachnoïdien involontaire du cathéter péridural suggère des dommages duraux avec l'aiguille péridurale.
Holtz et al ont étudié le passage possible du cathéter péridural dans l'espace sous-arachnoïdien dans une préparation anatomique. Dans 10 séries d'expériences, le compartiment épidural a été pénétré avec une aiguille Tuohy de calibre 18. La ponction rachidienne (aiguille de Quincke calibre 27 ou 29) a été réalisée selon la technique NTN. Par la suite, le côté interne du compartiment intrathécal a été examiné par endoscopie pour la pénétration du cathéter péridural. De même, l'endoscope a été inséré par voie épidurale pour visualiser les mouvements du cathéter épidural dans le compartiment épidural. Dans ce modèle de conditions intrathécales physiologiques simulées, en utilisant une technique NTN spatiale, ils ne pouvaient pas détecter le passage intrathécal du cathéter épidural.
Holmstrom et ses collègues, dans une étude d'épiduroscopie percutanée utilisant des cadavres frais, ont également rapporté qu'il était impossible de forcer un cathéter épidural dans l'espace sous-arachnoïdien après une seule perforation de la dure-mère avec une aiguille spinale de petit calibre. Cependant, ils ont constaté que le risque de migration intrathécale du cathéter augmentait d'environ 5 % après plusieurs ponctions durales avec l'aiguille spinale. La pénétration durale du cathéter péridural après une ponction durale avec une aiguille de Tuohy a été clairement démontrée dans la même étude.
La question de savoir si l'incidence d'un passage involontaire du cathéter péridural dans l'espace sous-arachnoïdien est augmentée avec le CSE par rapport à la technique péridurale standard seule est controversée. Par conséquent, quelle que soit la technique utilisée, tous les médicaments périduraux doivent être administrés en doses incrémentielles.
Propagation sous-arachnoïdienne de la péridurale
Médicaments administrés
Leighton et ses collègues ont rapporté qu'à la suite d'un CST, une dose d'anesthésique local épidural produira un niveau dermatomique plus élevé que prévu, probablement en raison du flux sous-arachnoïdien du médicament. Cependant, lorsqu'il est utilisé pour l'analgésie du travail, à moins que la dure-mère ne soit percée avec l'aiguille péridurale ou que de grands volumes de bolus soient administrés, le flux ne devrait pas être cliniquement significatif. Suzuki et al ont découvert, chez des patientes non enceintes, que la ponction durale à l'aide d'une aiguille spinale Whitacre de calibre 26 avant l'injection péridurale augmentait la propagation caudale de l'analgésie induite par les anesthésiques locaux périduraux sans modification de la propagation céphalique.
Holtz et al ont étudié par voie endoscopique le passage possible de l'anesthésique péridural à travers le trou de ponction durale dans le compartiment du LCR dans une préparation anatomique. Même 1 heure après l'administration péridurale de 20 mL d'anesthésique local coloré au bleu de méthylène (bupivacaïne 0.5 %, isobare), aucun passage d'anesthésique local dans le compartiment intrathécal n'a pu être détecté sous surveillance endoscopique continue.
Une étude de Kamiya et al a mesuré la concentration de lidocaïne dans le LCR après administration péridurale à différents espaces intermédiaires avec ou sans rachianesthésie précédente. Ils ont conclu qu'il n'y avait pas de différence dans les concentrations de lidocaïne dans le LCR avec ou sans trou méningé. Les auteurs ont expliqué la raison possible de l'absence de différence de concentration de lidocaïne comme suit : la lidocaïne pénètre facilement à travers le tissu méningé, et cette efficacité de transfert n'a probablement pas été affectée par la présence d'un petit trou méningé. L'équilibre de la concentration de lidocaïne dans le LCR, à proximité du site d'administration, serait atteint en quelques minutes grâce à cette pénétration rapide.
En d'autres termes, la quantité d'anesthésique local qui traverse le petit trou de la dure-mère est insignifiante par rapport à la quantité qui traverse les méninges. Cette étude a confirmé que le CSE est sûr et que les trous duraux n'ont aucune influence cliniquement significative sur la durée ou l'étendue des blocs rachidiens chez les patientes subissant une césarienne. Les données de plusieurs études cliniques de la technique CSE n'ont pas indiqué une augmentation de la propagation du bloc sensoriel due à une fuite sous-arachnoïdienne de médicaments administrés par voie épidurale.
Cependant, l'amplitude du flux est fonction du diamètre de l'aiguille spinale, et le risque peut être augmenté en utilisant une aiguille spinale plus grande ou en présence d'un trou fait avec une aiguille de Tuohy. La possibilité de ce risque est étayée par des rapports de bloc rachidien élevé ou total au cours d'une anesthésie péridurale administrée à la suite d'une perforation durale accidentelle avec l'aiguille péridurale. L'administration d'une dose test pour le placement rachidien d'un cathéter péridural peut être problématique et l'aspiration peut échouer, mais il a été constaté que les doses test détectent plus de cathéters intrathécaux que l'aspiration seule pendant l'analgésie du travail.
Malgré des études qui ont rapporté que la migration intrathécale est très rare et que le flux ne devrait pas produire de complications cliniquement pertinentes, le lecteur est averti que les médicaments périduraux ou les cathéters peuvent migrer dans l'espace rachidien après un CST. Par conséquent, toutes les doses péridurales doivent être incrémentielles et les patients recevant des perfusions péridurales continues pour l'analgésie doivent être contrôlés environ toutes les heures pour exclure un bloc moteur ou sensoriel excessif pouvant indiquer une administration intrathécale involontaire de médicaments.
Hypotension
Le bloc sous-arachnoïdien induit par le CSE (utilisant le LOR à l'air) rend-il un niveau d'anesthésie sensorielle plus élevé que le SSS lorsqu'une masse identique d'anesthésique intrathécal a été injectée ? Goy et al ont réalisé une étude prospective randomisée comparant le CSE (en utilisant LOR à l'air) au SSS sur 60 patientes subissant des procédures gynécologiques mineures et ont conclu que le bloc sous-arachnoïdien induit par le CSE produit une plus grande anesthésie sensorimotrice (p < 01) et une récupération prolongée (p < .05) que SSS. Ils ont également trouvé une incidence plus fréquente d'hypotension et d'utilisation de vasopresseurs dans le groupe CSE (p < 05), malgré l'utilisation de doses identiques de médicaments intrathécaux. Une autre étude a rapporté des résultats similaires lorsque seulement 4 ml d'air ont été utilisés dans le cadre de la technique LOR. L'objectif de cette étude était de déterminer la DE50 de la bupivacaïne hyperbare intrathécale pour le CSE et le SSS en utilisant la technique d'allocation séquentielle de haut en bas. Soixante participants ont été répartis en deux groupes dans une étude prospective randomisée en double aveugle. Ils ont conclu que, dans des conditions cliniques similaires, la DE50 de la bupivacaïne hyperbare intrathécale dans le CSE était inférieure de 20 % à celle du SSS. Bien que le mécanisme qui explique cette découverte n'ait pas été déterminé, une explication possible est que la technique LOR à air dans le CSE pourrait introduire des poches d'air dans l'espace épidural. L'IRM a démontré que les poches d'air résiduelles s'étendent jusqu'à trois segments vertébraux lombaires et compriment le sac thécal lombaire dorsalement et latéralement. Cela pourrait potentiellement entraîner une réduction du volume du LCR lombo-sacré et améliorer l'étendue de l'anesthésie sensorielle.
L'administration péridurale de médicaments semble affecter le contenu thécal et donc influencer la propagation du bloc sous-arachnoïdien induit plus tôt. L'ampleur de cet effet dépend de l'intervalle de temps entre les injections et du volume de l'injectat épidural. Initialement, le mécanisme proposé pour cet effet était la fuite sous-arachnoïdienne de médicaments administrés par voie épidurale. Une hypotension peut survenir après l'administration intrathécale de fentanyl ou de sufentanil, même en l'absence de bloc sympathique. Cependant, les effets hémodynamiques du fentanyl intrathécal sont généralement de nature bénigne et peuvent en fait être dus à une diminution des catécholamines secondaire au soulagement de la douleur. Cependant, la vasodilatation due à la sympathectomie entraîne une diminution de la précharge, de l'indice télédiastolique et de l'indice d'AVC et une augmentation de la fréquence cardiaque. Étant donné que l'indice de fin de diastole et l'indice d'AVC sont restés relativement stables et que la fréquence cardiaque a diminué dans une étude de Mandell et ses collègues, ces auteurs ont conclu que l'hypotension observée n'était pas due à une vasodilatation. Les épisodes d'hypotension qui suivent l'administration d'opioïdes neuraxiaux pendant le travail sont transitoires, faciles à traiter et pas nécessairement associés à des modifications indésirables du rythme cardiaque fœtal.
Blessure neurologique
Les complications neurologiques directement liées à la rachianesthésie peuvent être causées par un traumatisme, une ischémie médullaire, une infection et une neurotoxicité.
Traumatisme à l'aiguille
Un traumatisme induit par une aiguille ou un cathéter entraîne rarement une lésion neurologique permanente. Cependant, Horlocker et al, dans une revue rétrospective de 4767 rachianesthésies consécutives pour des complications du système nerveux central, ont conclu que la présence de paresthésie lors du placement de l'aiguille augmentait significativement le risque de paresthésie persistante (p < 001). Dans cette revue, une paresthésie a été provoquée lors du placement de l'aiguille dans 298 (6.3 %) cas. Six patients ont signalé des douleurs (paresthésies persistantes) lors de la résolution de la rachianesthésie ; quatre de ces personnes ont eu une douleur qui a disparu en 1 semaine, et la douleur des deux autres a disparu en 18 à 24 mois. Selon une étude plus récente de Bigeleisen sur le bloc nerveux périphérique, la ponction nerveuse et l'injection intraneurale n'entraînent pas invariablement de lésions neurologiques. Plusieurs raisons expliquent une éventuelle augmentation du risque de séquelles neurologiques suite à la technique CSE. Dans la technique NTN à espace unique du CSE, l'insertion de l'aiguille péridurale et du cathéter après l'administration d'anesthésiques locaux rachidiens peut empêcher l'identification des paresthésies qui peuvent avertir l'anesthésiste du mauvais placement de l'aiguille. L'incidence plus élevée de paresthésie pendant le CST est un facteur reconnu. En fait, il a été rapporté que des paresthésies surviennent chez jusqu'à 11 % des patients subissant une CST.
Browne et al ont rapporté une incidence de 14 % de paresthésies avec l'aiguille Espocan (aiguille péridurale Tuohy de calibre 18 avec une lumière supplémentaire dans le biseau de l'aiguille) et une incidence de 42 % avec une aiguille péridurale Tuohy conventionnelle. Dans une étude prospective randomisée, McAndrew et al ont rapporté de la même manière que 37 % (17 sur 46) des femmes du groupe NTN CSE et seulement 9 % (4 sur 43) du groupe SSS avaient une paresthésie lors de l'insertion de l'aiguille spinale (p < 0.05) . L'équipement utilisé était un kit CSE de calibre 16/26 et une aiguille spinale à pointe de crayon de calibre 26 avec introducteur (tous deux Sims Portex, Australie). Ils ont postulé que l'incidence plus élevée de paresthésies peut être liée à une pénétration plus profonde de l'espace sous-arachnoïdien avec la technique CSE. Fait intéressant, dans cette étude, aucun des patients ne présentait de symptômes neurologiques persistants lors de l'examen au premier jour postopératoire. Holloway et al ont mené une enquête pilote sur les expériences des anesthésistes en matière de séquelles neurologiques suite à une anesthésie rachidienne et CSE dans les unités d'obstétrique au Royaume-Uni. En raison de la nature rétrospective de l'enquête, de nombreux problèmes neurologiques signalés manquaient de détails. Cependant, il n'y avait pas de différences évidentes dans l'incidence des problèmes associés aux techniques CSE par rapport aux techniques SSS.
Turner et Shaw ont suggéré la possibilité que l'insertion douloureuse et les dommages subséquents aux racines puissent être augmentés par l'utilisation d'aiguilles spinales à pointe de crayon atraumatiques. Dans cette enquête, des problèmes ont été signalés avec les aiguilles Whitacre et Sprotte, mais aucun avec les aiguilles Quincke. Cependant, les nombres utilisant des aiguilles de Quincke étaient trop petits pour permettre une analyse statistique. Plus dangereux que les dommages aux racines sont les dommages à la moelle épinière elle-même, et dans cette enquête, il y avait deux cas de dommages aux cônes, un avec CSE et un avec SSS. Cette complication n'est pas un défaut des aiguilles atraumatiques, mais plutôt de la technique. Il est important de rappeler que chez 19 % des patients, la moelle épinière se termine en dessous de L1. Plus inquiétant encore, dans plus de 50% des cas, l'espace choisi est mal identifié. Par conséquent, un espace L3/L4 ou inférieur doit être sélectionné pour CSE ou SSS.
Risque de toxicité des métaux dans le CST
Il a été allégué que pendant la technique NTN CSE, de minuscules particules métalliques abrasées par l'aiguille spinale à partir du bord intérieur de l'aiguille Tuohy peuvent être introduites dans le compartiment péridural ou spinal. Pour examiner cette préoccupation, Holst et ses collègues ont simulé la technique NTN dans un modèle in vitro. Ils ont utilisé la spectrographie d'absorption atomique (AAS) pour identifier les particules métalliques abrasées. Les aiguilles ont ensuite été examinées au microscope électronique. Ils n'ont signalé aucune augmentation des composants d'alliage détectés dans la solution de rinçage après une ponction double ou quintuple par rapport aux mesures de contrôle. Après cinq piqûres et une manipulation de l'aiguille comme dans la pratique normale, aucune trace d'utilisation n'a pu être détectée par microscopie électronique sur le bord intérieur meulé de l'aiguille de Tuohy.
Carottage des tissus
Le carottage tissulaire est un phénomène qui peut se produire lors d'une ponction lombaire, au cours de laquelle des morceaux de tissu sont retirés par l'aiguille lorsqu'elle traverse le tissu et dépose les morceaux dans l'espace sous-arachnoïdien. Bien que rares, des effets indésirables tels que des tumeurs épidermoïdes iatrogènes intrarachidiennes peuvent être associés à ce phénomène. Sharma et al ont postulé que la technique CSE introduit moins de cellules épithéliales dans l'espace sous-arachnoïdien par rapport au SSS sans l'utilisation d'un introducteur. Cependant, cette étude n'a pas confirmé l'hypothèse. Un carottage significatif des tissus s'est produit avec les deux techniques (CSE 88 % et SSS 96 %).
Complications neurologiques infectieuses
Bien que l'incidence globale des infections et de leurs séquelles après la mise en place d'un CST soit perçue comme extrêmement faible, le risque relatif par rapport à une technique rachidienne ou péridurale seule n'est pas connu. Dans une étude classique, Dripps et Vandam n'ont signalé de manière prospective aucun cas de méningite après 10,098 10,440 rachianesthésies. Phillips et al n'ont également signalé aucun cas après un examen prospectif de 1990 XNUMX cas de ce type. Ces études ont inclus des patients subissant des opérations obstétricales et urologiques, qui sont connues pour être associées à une bactériémie périopératoire. Cependant, des rapports de cas de méningite suite à des CSE sont apparus dans les revues à partir du milieu des années XNUMX.
Théoriquement, on pense que le CSE est associé à un risque accru de méningite par rapport à la péridurale seule car la dure-mère (barrière protectrice du système nerveux central) est percée délibérément pendant le CSE, puis un corps étranger, un cathéter péridural, est placé à proximité. Le cathéter péridural peut se trouver à proximité du trou dural et est un foyer potentiel d'infection, en particulier après une bactériémie. La contamination de l'espace sous-arachnoïdien peut résulter d'un saignement dû à un traumatisme par aiguille chez un patient bactériémique ou d'un échec de la technique aseptique.
Plusieurs études ont montré que les masques faciaux empêchent la dispersion vers l'avant des organismes des voies respiratoires supérieures et la dispersion vers le bas pendant la conversation et la rotation de la tête. Malgré cela, en 1996, une enquête postale auprès des membres de l' Obstetric Anesthetists Association au Royaume-Uni a révélé que plus de la moitié des personnes interrogées ne portaient pas systématiquement de masque facial lors de l'anesthésie neuraxiale. En 2007, pour la première fois, le Comité consultatif sur les pratiques de contrôle des infections dans les soins de santé (HICPAC) a recommandé le port de masques chirurgicaux lors des interventions sur la colonne vertébrale afin de prévenir les infections. Cette recommandation a été formulée en réponse à plusieurs rapports de méningite suite à des procédures de myélographie.
En 2008, trois cas de méningite bactérienne chez des femmes en post-partum ont été signalés au Département de la santé de l'État de New York. Les trois femmes ont reçu une CSE pour le travail. Streptococcus salivarius (un commensal normal de la flore buccale) a été cultivé à partir du LCR de deux patients. L'anesthésiste responsable des trois cas a signalé l'utilisation systématique de masques pendant les procédures neuraxiales. Cependant, le personnel a signalé qu'il était courant d'avoir des visiteurs non masqués présents dans la salle pendant ces procédures. L'hôpital a institué de nouvelles politiques pour minimiser les visiteurs et exiger des masques pour toutes les personnes dans la chambre pendant les procédures d'analgésie neuraxiale du travail. En 2009, deux cas similaires ont été signalés au ministère de la Santé de l'Ohio. L'anesthésiste responsable de ces deux cas ne portait pas de masque. Les cultures de LCR des deux patients ont révélé S. salivarius et l'un d'eux est décédé d'une méningo-encéphalite suppurée. En 2009, Sankovsky et al ont également signalé un cas de méningite à S. salivarius suite à un CST pour le travail chez une patiente primigeste en bonne santé. L'anesthésiste portait des gants stériles et un masque, mais le masque avait été porté lors d'interventions antérieures. Ces cas soulignent l'importance de respecter les recommandations établies de contrôle des infections pendant les procédures neuraxiales, qui comprennent l'utilisation de masques, le lavage des mains et le respect d'une technique aseptique. Il est important que le masque facial soit bien fixé pour couvrir la bouche et le nez et qu'il ne soit pas réutilisé.
Les maux de tête et les douleurs au cou ou la raideur de la nuque chez un patient qui a récemment reçu une rachianesthésie sont souvent attribués à une céphalée post-ponction durale (PDPH). Un rapport de cas a mis en évidence les dangers associés à un diagnostic manqué de méningite. La patiente a été diagnostiquée à tort comme ayant une endométrite lorsqu'elle s'est présentée avec des maux de tête, des vomissements et de la fièvre pendant 2 jours après une analgésie péridurale non compliquée pendant le travail. Son état s'est rapidement détérioré et la méningite n'a été considérée comme un diagnostic que trop tard. Elle est ensuite décédée en soins intensifs.
Syndrome de Cauda Equina
La bupivacaïne hyperbare est fréquemment administrée par voie intrathécale pendant l'anesthésie CSE. Bien que des problèmes neurologiques soient principalement rapportés suite à l'administration de lidocaïne ou de mépivacaïne, quelques cas de syndrome de la queue de cheval suite à des doses ordinaires de bupivacaïne intrathécale dans une technique CSE ont été rapportés. Tariq a rapporté le cas d'un homme de 83 ans qui a développé le syndrome de la queue de cheval après une anesthésie CSE sans incident pour une arthroplastie élective du genou.
Takasu et al ont rapporté une parturiente de 29 ans qui a développé un syndrome de la queue de cheval suite à une CSE sans incident avec de la bupivacaïne hyperbare pour un accouchement par césarienne. Kubina et al ont également décrit deux cas de queue de cheval suite à une CSE sans incident avec de la bupivacaïne hyperbare. Un des patients souffrait cependant d'une sténose rachidienne, ce qui pourrait expliquer cette complication. Kato et al ont décrit un cas de syndrome de la queue de cheval suite à un CST avec une dose ordinaire de bupivacaïne hyperbare chez un patient âgé sans sténose spinale. On pense que l'absence d'une gaine protectrice dans la queue de cheval lorsque les nerfs rachidiens et les racines traversent la dure-mère les rend particulièrement sujets aux blessures causées par une concentration élevée d'anesthésiques locaux.
Céphalée de ponction postdurale
L'incidence de PDPH après la technique CSE est controversée ; certains auteurs ont rapporté une diminution de l'incidence par rapport à la technique péridurale seule, tandis que d'autres rapportent une augmentation de l'incidence. Balestrieri a rapporté que les patients qui recevaient une analgésie péridurale conventionnelle étaient plus susceptibles de subir une ponction durale accidentelle (doublement ; péridurale vs CSE = 4.2 % vs 1.7 %). Ils ont proposé deux explications possibles à ce résultat. La première raison était qu'ils choisissaient généralement le CSE pour les femmes qui étaient le plus souvent en début de travail et réservaient l'analgésie péridurale aux patientes dans la phase active la plus douloureuse du travail. Par conséquent, les patients du groupe péridurale étaient plus susceptibles de bouger pendant la procédure et donc de provoquer un « tapotement humide ». Deuxièmement, pendant le CSE, si l'emplacement de l'aiguille épidurale est incertain, l'aiguille rachidienne peut être insérée pour rechercher le LCR et l'aiguille épidurale n'avance plus après avoir vu le LCR dans l'aiguille rachidienne.
D'autres facteurs peuvent également diminuer l'incidence de PDPH suite à la technique CSE. Il a été démontré que l'administration intrathécale d'opioïdes diminue l'incidence de la PDPH. Une perfusion ultérieure d'anesthésique local péridural augmente la pression sous-arachnoïdienne et peut aider à réduire l'incidence de la PDPH après un CST. Dunn et al. ont fait valoir que la ponction durale intentionnelle impliquée dans la technique CSE augmenterait le risque de PDPH chez les patientes obstétriques par rapport à l'analgésie péridurale seule. L'utilisation d'aiguilles spinales à pointe de crayon atraumatique de petit calibre (telles que Whitacre, Pencan, Sprotte et Gertie Marx) réduira considérablement l'incidence de PDPH chez les patients recevant une CSE.
Chan et Paech ont rapporté trois cas de fuite persistante de LCR suite à une analgésie sans incident du CSE pendant le travail. Il a été confirmé que le fluide qui fuyait était du LCR dans deux cas par un test d'immunofixation de la β2-trasferrine. Aucun des patients n'a développé de PDPH ou d'autres complications. Howes et Lenz ont également signalé une fistule cutanée du LCR chez deux patients après une anesthésie péridurale (pas de CSE) pour le soulagement de la douleur postopératoire. Les deux patients ont développé une PDPH seulement après le retrait des cathéters et ont été traités avec succès avec un patch sanguin autologue.
Pour plus d'informations, voir Céphalée de ponction postdurale.
Complications liées à l'analgésie du travail
Bradycardie fœtale
Des rapports dans la littérature ont suggéré une fréquence accrue de tracés de fréquence cardiaque fœtale (FHR) non rassurants et de bradycardie fœtale associée au CST. L'étiologie de la bradycardie fœtale après CSE reste insaisissable mais peut être liée à une réduction aiguë des taux circulants de catécholamines maternelles après le début presque immédiat de l'analgésie. En outre, il a été postulé qu'un déséquilibre entre les niveaux d'épinéphrine et de noradrénaline (diminution des niveaux d'épinéphrine en présence continue de niveaux élevés de noradrénaline) provoque des effets α-adrénergiques sans opposition sur le tonus utérin avec une augmentation de la résistance vasculaire utérine entraînant une diminution du flux sanguin utérin.
Une méta-analyse réalisée par Mardirosoff et ses collègues a révélé un risque relatif de 1.81 d'avoir des anomalies du RCF lorsque des opioïdes intrathécaux étaient utilisés. Cependant, le risque d'accouchement ultérieur par césarienne n'a pas été augmenté. Il existe des preuves d'une relation dose et d'une plus grande fréquence d'anomalies préoccupantes du RCF avec des doses plus élevées d'opioïdes. Nicolet et al ont réalisé une étude prospective pour identifier les facteurs maternels impliqués dans la bradycardie fœtale après CSE pour douleur de travail. Ils ont constaté que le niveau des scores de douleur maternelle au moment de la demande d'analgésie pendant le travail et l'âge de la mère étaient des prédicteurs indépendants de la bradycardie fœtale après une analgésie neuraxiale pendant le travail.
La bradycardie fœtale qui en résultait était généralement de courte durée et se résolvait généralement en 5 à 8 minutes. Une étude rétrospective portant sur 1240 1140 patientes ayant reçu une analgésie régionale pendant le travail (principalement des CSE) et 1.3 1.4 patientes ayant reçu des médicaments systémiques ou aucune analgésie n'a démontré aucune différence significative dans le taux d'accouchement par césarienne, avec des taux de 90 % et 3.2 %, respectivement. Cette étude a également indiqué qu'aucune césarienne d'urgence pour « détresse » fœtale aiguë n'était nécessaire en l'absence d'indications obstétricales jusqu'à 6.2 minutes après l'administration intrathécale de sufentanil. Une étude prospective randomisée de Skupski et al n'a également trouvé aucune différence dans le taux de décélération prolongée entre la péridurale du travail et l'ECS pendant le travail (0.43 % contre XNUMX %, respectivement ; p = XNUMX).
LES MEILLEURS ÉQUIPEMENTS
La technique CSE a gagné en popularité et en acceptation, en particulier en obstétrique. Des kits spéciaux ont été produits pour le CSE (par exemple, B Braun Medical Ltd. comprenant l'aiguille Tuohy standard de calibre 16, 8 cm avec une aiguille spinale Quincke de calibre 26). Diverses préoccupations de la technique CSE ont conduit à certaines modifications des aiguilles utilisées.
Pour éloigner le cathéter péridural du site de ponction durale, Rawal et al ont recommandé une rotation de l'aiguille péridurale de 180° après la ponction durale. Cette manœuvre dirige le cathéter péridural à 2–2.5 mm du site de ponction durale. Cependant, Meikljohn, en utilisant la dure-mère post-mortem, a démontré que la rotation de l'aiguille épidurale diminuait considérablement la force nécessaire pour percer la dure-mère et pouvait donc entraîner un robinet humide.
Récemment, des kits CSE conçus avec un orifice dans la courbe arrière (trou arrière) de l'aiguille péridurale pour un passage séparé de l'aiguille spinale ont été mis à disposition (Figure 4). Cette aiguille et d'autres similaires peuvent réduire la probabilité d'un passage dural du cathéter épidural en éloignant le cathéter du site de ponction durale. Cependant, l'aiguille rachidienne peut ne pas toujours passer par l'orifice de l'aiguille rachidienne et peut sortir par la pointe Huber, perdant ainsi l'avantage du trou arrière (Figure 5).
FIGURE 4. Kit combiné rachi-péridurale avec un orifice dans la courbe arrière pour le passage séparé de l'aiguille rachidienne.
FIGURE 5. Kit combiné rachi-péridurale avec aiguille rachidienne sortant du trou arrière et embout Huber.
Joshi et McCarroll ont suggéré une technique pour améliorer la sortie de l'aiguille spinale à travers l'orifice de l'aiguille spinale. La technique modifiée consistait à aligner d'abord l'orifice biseauté de l'aiguille spinale dans la même direction que le biseau de Tuohy, puis à plier l'aiguille spinale de 10° vers le biseau de Tuohy tout en avançant à travers l'aiguille de Tuohy. Cette technique guide la pointe de l'aiguille vertébrale pour sortir par le trou arrière. Pan, dans une étude prospective randomisée, a évalué le taux de réussite de l'aiguille rachidienne sortant par l'orifice de l'aiguille rachidienne dans deux kits d'aiguille CSE à lumière unique et à double orifice couramment disponibles. Les études sur les kits CSE ont d'abord été le kit Espocan CSE (Braun Medical Ltd.) qui se compose d'une aiguille Tuohy standard de calibre 18 avec une aiguille vertébrale Quincke à manchon de calibre 26 qui s'étend de 12 mm au-delà de la pointe de l'aiguille Tuohy à travers le trou arrière. . Le manchon de l'aiguille spinale a été conçu pour guider l'aiguille spinale pour qu'elle sorte par le trou arrière. Le second était le kit Espocan CSE (Braun Medical Ltd.), qui se compose de la même aiguille péridurale avec une aiguille spinale Sprotte sans manchon de calibre 27 qui s'étend de 13 mm au-delà de la pointe de l'aiguille Tuohy à travers le trou arrière. Ils ont effectué 1600 tentatives, dont la technique modifiée décrite par Joshi et McCarroll. La technique modifiée a amélioré le taux de réussite de l'aiguille spinale sortant par le trou arrière de 67 % à 94 % pour le premier kit et de 50 % à 81 % pour le deuxième kit ; l'orientation céphalique du biseau de l'aiguille de Tuohy a encore amélioré le taux de réussite à 96 % et 91 %, respectivement. Dans l'ensemble, l'aiguille rachidienne à manchon a eu un meilleur taux de réussite que l'aiguille rachidienne sans manchon.
L'échec de l'aiguille spinale à sortir par le trou arrière peut également entraîner une flexion de l'aiguille spinale et moins de saillie au-delà de la pointe de l'aiguille Tuohy. Cela peut contribuer à l'augmentation du taux d'échec de la ponction durale. La longueur idéale de la saillie de l'aiguille vertébrale serait d'au moins 12 à 13 mm. Dans une étude prospective randomisée de 40 patients, Joshi et McCarroll ont rapporté un taux d'échec de 15 % du retour du LCR lorsque l'aiguille vertébrale ne dépassait que de 10 mm au-delà de la pointe de l'aiguille de Tuohy et de 0 % avec une protrusion de 13 mm. Riley et al ont rapporté des résultats similaires en comparant Sprotte de calibre 24 (protrusion de 9 mm au-delà de la pointe du Tuhoy et 17% d'échec pour obtenir le CSF) et Gertie Marx (protrusion de 17 mm et taux d'échec de 0%). Le nombre de patients développant une PDPH et nécessitant un patch sanguin était plus élevé avec Gertie Marx qu'avec l'aiguille Sprotte. Cependant, cette différence n'était pas statistiquement significative. Il est possible que l'aiguille rachidienne plus longue ait également percé la face antérieure de la dure-mère et ait ainsi provoqué une plus grande fuite de LCR. Des taux de paresthésie plus importants ont également été notés (anecdotique) avec l'aiguille de 127 mm, et l'aiguille Gertie Marx de 124 mm a été suggérée comme un excellent compromis.
Herbstman et al ont comparé quatre aiguilles rachidiennes à pointe de crayon couramment utilisées dans la technique CSE et ont rapporté que des aiguilles rachidiennes plus longues étaient associées à beaucoup plus de paresthésies transitoires (protrusion de Gertie Marx de 15 mm avec une incidence de 29 % ; protrusion de Whitacre de 10 mm avec une incidence de 17 % ). Le succès dans l'obtention de CSF et l'incidence de PDPH ne différaient pas entre les quatre aiguilles.
L'aiguille rachidienne conventionnelle du kit CSE, qui ne se verrouille pas dans l'aiguille épidurale, peut être difficile à manipuler et à stabiliser pendant l'injection de médicaments rachidiens. Le déplacement de l'aiguille rachidienne pendant l'aspiration du LCR et l'injection peut entraîner un échec de l'anesthésie ou peut pousser l'aiguille rachidienne plus profondément, entraînant des lésions nerveuses ou une perforation durale antérieure. Pour pallier ce problème, Simsa a proposé un dispositif de fixation externe. Cet appareil est cependant quelque peu compliqué à manipuler.
Récemment, des aiguilles rachidiennes avec un dispositif de verrouillage réglable ont été introduites (aiguille CSEcure et Ajustable Durasafe CSE). Des études sur les extensions verrouillables ont montré qu'elles offraient des conditions sûres et stables lors du placement de la seringue et de l'injection. Cependant, les deux études ont rapporté une incapacité fréquente à sentir la perforation dure-mère avec les aiguilles de verrouillage (15.3 % avec CSFcure et 25 % avec Adjustable Durasafe). Il n'y avait pas d'explication claire à cela.
Dans une technique CSE, parfois le cathéter péridural ne peut pas être fileté ou fileté de manière intravasculaire après que les médicaments intrathécaux ont été injectés. Pour surmonter ce problème, un kit CSE à double lumière et double orifice a été développé dans lequel un cathéter péridural peut être inséré en place avant d'insérer l'aiguille spinale et le médicament. Ceci est possible car il y a deux lumières séparées pour le cathéter et l'aiguille spinale (Figure 6). Récemment, une aiguille CSE à double lumière a été commercialisée en Europe (Epistar ; Medimex, Allemagne).

FIGURE 6. Kit CSE à double lumière et double orifice.
SUJETS CONTROVERSÉS DANS LA TECHNIQUE DU CST
Dose d'essai
La question de savoir si une dose test est nécessaire lors de l'administration d'une analgésie péridurale pendant le travail est controversée. Étant donné que des solutions très diluées d'AL sont couramment utilisées et que l'aspiration est souvent diagnostique, certains auteurs pensent qu'une dose test conventionnelle n'est pas nécessaire. Cependant, étant donné que l'aspiration par cathéter n'est pas toujours prédictive (en particulier lors de l'utilisation d'un cathéter péridural à orifice unique), d'autres maintiennent l'importance d'une dose test pour améliorer la détection du placement intrathécal ou intravasculaire d'un cathéter péridural.
Une partie de la controverse entourant le test des cathéters périduraux implique l'utilisation de l'épinéphrine. Il a été démontré que l'épinéphrine produit une augmentation fiable de la fréquence cardiaque chez les volontaires et les patients chirurgicaux lorsque la péridurale a été placée dans un vaisseau sanguin. Cependant, chez les femmes en travail, la variabilité de la fréquence cardiaque maternelle due à la douleur des contractions utérines peut confondre l'interprétation de la réponse de la fréquence cardiaque, et l'épinéphrine intraveineuse peut avoir des effets délétères sur le débit sanguin utérin.
Les moyens d'améliorer la fiabilité d'une dose test d'épinéphrine comprennent l'injection de la dose entre les contractions utérines et la répétition de la dose test lorsque la réponse est équivoque. Cependant, le manque de sensibilité et de spécificité de la dose test remet en cause son utilité comme outil de diagnostic.
Leighton et ses collègues ont décrit un autre moyen de tester un cathéter épidural pour le placement intravasculaire. Ils ont préconisé l'injection de 1 à 2 ml d'air dans le cathéter péridural tout en écoutant le précordium avec le moniteur Doppler externe maternel pour détecter la présence d'air.
Avec des rapports d'administration sous-arachnoïdienne de chloroprocaïne, il est possible qu'à l'avenir cet agent soit utilisé pour tester les cathéters épiduraux. La prudence s'impose cependant car la chloroprocaïne contenant un conservateur est également disponible dans le commerce. Si une perfusion continue d'anesthésique local dilué est administrée et que le patient reste confortable sans bloc moteur, le placement correct du cathéter péridural est très probable. C'est-à-dire que si le cathéter épidural était intravasculaire, le patient devrait avoir un soulagement inadéquat de la douleur, et si le cathéter était sous-arachnoïdien, un bloc moteur solide se développerait. Bien que les perfusions d'anesthésiques locaux ultradilués ne constituent pas une menace sérieuse, ce n'est pas le cas des anesthésiques locaux concentrés utilisés pour l'administration chirurgicale. Certains auteurs ont suggéré qu'une dose test est essentielle pour toute parturiente recevant une anesthésie péridurale. Quelle que soit la technique utilisée, la pratique sûre d'administrer une analgésie péridurale pendant le travail dicte l'aspiration initiale du cathéter, les injections incrémentielles et la surveillance continue des signes de toxicité de l'anesthésique local.
Positionnement pour le CSE
Les blocs neuraxiaux sont souvent réalisés avec les patients en position assise, en particulier les personnes obèses car la ligne médiane est facilement reconnaissable. Il a été démontré que la position assise permet une meilleure flexion de la colonne vertébrale chez les parturientes. De plus, la distance entre la peau et l'espace péridural s'est avérée significativement plus grande lorsque la ponction péridurale était effectuée en position latérale par rapport à la position assise. Ce changement de distance peut provoquer un délogement du cathéter lorsque le patient est tourné de la position assise à la position latérale, avec pour conséquence une analgésie inadéquate.
Yun et al ont comparé les effets de l'induction de l'anesthésie CSE en position assise par rapport à la position latérale chez des femmes en bonne santé subissant une césarienne élective. La sévérité de l'hypotension, mesurée par le pourcentage maximal de diminution de la pression artérielle systolique par rapport au contrôle, ainsi que sa durée étaient significativement plus importantes dans le groupe assis (p < 0.05). Les patients du groupe assis avaient besoin de deux fois plus d'éphédrine pour traiter l'hypotension que ceux du groupe couché sur le côté. La raison de la différence dans la sévérité de l'hypotension n'était pas claire. Ils ont postulé qu'il était lié à une récupération plus lente de l'accumulation veineuse dans les membres inférieurs lors de la prise d'une position couchée à partir de la position assise initiale. Ces auteurs ont conclu que la position utilisée pour l'induction du CSE devrait être envisagée dans les cas associés à un risque maternel ou fœtal plus élevé d'hypotension.
L'enseignement traditionnel est que la propagation des solutions intrathécales hyperbares suit la gravité. Lewis et al ont comparé le développement de blocs rachidiens en position latérale gauche par rapport à une position en décubitus dorsal après avoir effectué le CSE en position assise. Les médicaments intrathécaux consistaient en 2 mL de bupivacaïne hyperbare à 0.5 % avec 15 μg de fentanyl. La position latérale gauche n'a pas produit de bloc unilatéral. La position latérale gauche était associée à un début de bloc plus lent (p = 004) mais produisait finalement un bloc rachidien similaire en termes de caractéristiques à celui obtenu dans la position en décubitus dorsal. La position latérale gauche est connue pour améliorer le débit cardiaque maternel, et le bénéfice possible pour le fœtus peut l'emporter sur un début plus lent.
RÉSUMÉ
La technique CSE est une méthode bien établie pour divers types de chirurgie, en particulier en obstétrique. Dans notre établissement, la technique CSE est la technique régionale la plus pratiquée pour l'analgésie du travail (97%) ainsi que la césarienne (54%). Le CSE offre de nombreux avantages ; il fournit un procédé pour administrer une anesthésie et une analgésie neuraxiales dans de nombreuses situations cliniques.
La technique CSE offre les avantages des techniques rachidiennes et péridurales et a donc un taux de réussite élevé dans la fourniture d'une anesthésie régionale. Le CSE fournit un début rapide et la capacité de titrer à un niveau sensoriel souhaité, de contrôler la durée du bloc et de fournir une analgésie postopératoire. Un autre avantage du CSE est la facilitation de l'entrée de l'aiguille vertébrale dans l'espace sous-arachnoïdien. L'aiguille Tuohy sert de guide pour l'aiguille spinale presque jusqu'à l'espace sous-arachnoïdien. Cela permet d'utiliser les aiguilles rachidiennes atraumatiques de plus petit calibre, avec lesquelles le PDPH est absent ou rare.
Les inconvénients du CSE sont que la technique combinée introduit des effets secondaires potentiels tels que PDPH, le risque accru de migration du cathéter dans l'espace sous-arachnoïdien et des paresthésies transitoires de l'aiguille spinale. Bien que le risque soit faible, un certain nombre de modifications de l'équipement ont été suggérées et développées pour éviter la pénétration du cathéter péridural à travers le trou dural fait par l'aiguille spinale.
La longueur idéale de la saillie de l'aiguille rachidienne au-delà de la pointe de l'aiguille péridurale serait d'au moins 12 à 13 mm. Des aiguilles rachidiennes plus longues se sont avérées associées à une incidence significativement plus élevée de paresthésies transitoires. L'incapacité d'obtenir du LCR à travers l'aiguille rachidienne peut survenir avec des aiguilles plus courtes (<10 mm de saillie) et entraîner une défaillance de la composante rachidienne de la technique. L'échec du CSE est également lié à un site de ponction défectueux ou à une déviation de l'axe lors de l'avancement de l'aiguille. Le risque d'infection, d'hématome et de dommages neurologiques augmente avec de multiples tentatives et de multiples manipulations des aiguilles, mais il n'est pas clair si la technique CSE augmente ces risques.
Lire la suite Anesthésie péridurale et analgésie
Références
- Rodgers A, Walker N, Schug S, et al. Réduction de la mortalité et de la morbidité postopératoires avec une anesthésie péridurale ou rachidienne : résultats d'un aperçu d'essais randomisés. BMJ 2000;321:1493–1504.
- Buhre W, Rossaint R : Prise en charge et surveillance périopératoires en anesthésie. Lancet 2003;362:1839–1846.
- Kehlet H, Wilmore DW : Stratégies multimodales pour améliorer les résultats chirurgicaux. Am J Surg 2002;183:630–641.
- Holmström B, Laugaland K, Rawal N, et al : Bloc péridural spinal combiné versus bloc spinal et péridural pour la chirurgie orthopédique. Can J Anesth 1993;40:601–606.
- Stienstra R, Dahan A, Alhadi ZRB, et al : mécanisme d'action d'un complément péridural dans l'anesthésie péridurale rachidienne combinée. Anesth Analg 1996;83:382–386.
- Stienstra R, Dilrosun-Alhadi BZR, Dahan A, et al : Le complément épidural dans l'anesthésie rachidienne-épidurale combinée : l'effet du volume par rapport à la dose. Anesth Analg 1999;88:810–814.
- Blanshard HJ, Cook TM : Utilisation de la péridurale-rachidienne combinée par les anesthésistes obstétricaux. Anesthésie 2004;59(9):922–923.
- Norris MC. Les cathéters périduraux rachidiens combinés sont-ils fiables ? Int J Obsted Anesth 2000;9:3–6.
- Reynolds F : Dommages au cône médullaire suite à une rachianesthésie. Anesthésie 2001 ; 56 : 238–247.
- Cook TM : Techniques combinées rachi-péridurale. Anesthésie 2000 ; 55:42–64.
- Hughes D, Simmons SW, Brown J, Cyna AM : Analgésie spinalepidurale versus péridurale combinée pendant le travail. Cochrane Database Syst Rev 2003;(4):CD003401.
- Poulakka R, Pitkanen MT, Rosenberg PH : Comparaison des caractéristiques techniques et de bloc de différentes techniques combinées d'anesthésie rachidienne et péridurale. Reg Anesth Pain Med 2001;26:17–23.
- Cherng YG, Wang YP, Liu CC, Shi JJ, Huang CC : anesthésie rachidienne et péridurale combinée pour l'hystérectomie abdominale chez une patiente atteinte de dystrophie myotonique. Rapport de cas. Reg Anesth 1994;19(1):69–72.
- Mane RS, Patil MC, Kedareshvara KS, Sanikop CS : anesthésie péridurale rachidienne combinée pour l'appendicectomie laparoscopique chez l'adulte : une série de cas. Saudi J Anaesth 2012;6:27–30.
- Browne IM, Birnbach DJ, Stein DJ, O'Gorman DA : Une comparaison des aiguilles Espocan et Tuohy pour la technique combinée spino-épidurale pour l'analgésie du travail. Anesth Analg 2005;101:535–540.
- Hermanides J, Hollmann MW, Stevens MF, Lirk P : Échec de la péridurale : causes et prise en charge. Br J Anaesth 2012;109:144–154.
- Viscomi CM, Rathmell JP, Pace NL : Durée de l'analgésie intrathécale du travail. Travail précoce ou avancé. Anesth Analg 1997;84:1108–1112.
- Collis RE, Davies DW, Aveling W : Comparaison randomisée de l'analgésie épidurale épidurale combinée et de l'épidurale standard pendant le travail. Lancet 1995;345:1413–1416.
- Palmer CM, Randall CC, Hays R, et al : La relation dose-réponse du fentanyl intrathécal pour l'analgésie du travail. Anesthésiologie 1998 ;88 : 355–361.
- Campbell DC, Camann WR, Datta S, et al : L'ajout de bupivacaïne au sufentanil intrathécal pour l'analgésie du travail. Anesth Analg 1995;81:305–309.
- Sia AT, Chong JL, Chiu JW : Combinaison de sufentanil intrathécal 10 mcg plus bupivacaïne 2.5 mg pour l'analgésie du travail. Est-ce que la moitié de la dose suffit ? Anesth Analg 1999;88:362–366.
- Hughes D, Hill D, Fee JP : Ropivacaïne intrathécale ou bupivacaïne avec fentanyl pour le travail. Br J Anaesth 2001;87:733–737.
- Vercauteren MP, Haus G, De Decker K, et al : Lévobupivacaïne associée au sufentanil pour l'analgésie intrathécale du travail : une comparaison avec la bupivacaïne racémique. Anesth Analg 2001;93:996–1000.
- Van de Velde M, Dreelinck R, Dubois J, et al. Détermination de la relation dose-réponse complète de la bupivacaïne intrathécale, de la lévobupivacaïne et de la ropivacaïne, associées au sufentanil, pour l'analgésie du travail. Anesthésiologie 2007 ; 106 : 149–156.
- Wilson MJ, MacArthur C, Cooper GM, Shennan A; COMET Study Group UK : Déambulation pendant le travail et l'accouchement : un essai contrôlé randomisé comparant l'analgésie épidurale mobile à forte dose. Anesthésie 2009 ; 64 : 266–272.
- Tsen L, Thue B, Datta S, et al : L'analgésie péridurale-rachidienne combinée est-elle associée à une dilatation cervicale plus rapide chez les patientes nullipares par rapport à l'analgésie péridurale conventionnelle ? Anesthésiologie 1999 ;91 :920–925.
- Wong CA, Scavon BM, Peaceman AM, et al : Le risque d'accouchement par césarienne avec analgésie neuraxiale administrée tôt ou tard dans le travail. N Engl J Med 2005;352(7):655–665.
- Pascual-Ramirez J, Haya J, Pérez-López FR, et al : effet de l'analgésie épidurale rachidienne combinée par rapport à l'analgésie épidurale sur la durée du travail et de l'accouchement. Int J Gynaecol Obstet 2011;114:246–250.
- Carrie LES, O'Sullivan GM : bupivacaïne sous-arachnoïdienne à 0.5 % pour la césarienne. Eur J Anaesthesiol 1984;1:275–283.
- Crowhurst J, Birnbach DJ : Bloc neuraxial à faible dose. En route vers le nouveau millénaire. Anesth Analg 2000;90:241–242.
- Blumgart CH, Ryall D, Dennison B, et al : Mécanisme d'extension de la rachianesthésie par injection extradurale d'anesthésique local. Br J Anaesth 1992;169:457.
32. Kawasw H, Sumikura H, Kamada T, et al : Cas de version céphalique externe sous anesthésie spino-péridurale combinée suivie d'un accouchement vaginal. Masui 2009;58:637–640. - Sullivan JT, Grobman WA, Bauchat JR, et al : Un essai contrôlé randomisé de l'effet de l'analgésie rachidienne-péridurale combinée sur le succès de la version céphalique externe pour la présentation du siège. Int J Obstet Anesth 2009;18:328–334.
- Pan PH, Bogard TD, Owen MD : Incidence et caractéristiques des échecs de l'analgésie et de l'anesthésie neuraxiales obstétricales : Une analyse rétrospective de 19,259 2004 accouchements. Int J Obstet Anesth 13;4(227):233–XNUMX.
- Eappen S, Blinn A, Segal S : Incidence du remplacement du cathéter épidural chez les parturientes : examen rétrospectif des dossiers. Int J Obstet Anesth 1998;7:220–225.
- Choi DH, Park YD : Comparaison de l'anesthésie rachidienne-péridurale combinée et de la rachianesthésie pour la césarienne. IMRAPT 2002;14:A129.
- Reyes M, Pan PH :. Rachianesthésie à très faible dose pour césarienne chez une patiente prééclamptique obèse morbide et ses implications potentielles. Int J Obstet Anesth 2004;13:99–102.
- Ranasinghe JS, Steadman J, Toyama T, Lai M : L'anesthésie péridurale rachidienne combinée est meilleure que la rachianesthésie ou la péridurale seule pour l'accouchement par césarienne. Br J Anaesth 2003;91:299–300.
- Lim Y, Loo CC, Goh E : rachianesthésie et péridurale combinées à très faible dose pour la césarienne. Int J Obstet Anesth 2004;13:198–200.
- Peng PW, Chan VW, Perks A : Concentration anesthésique efficace minimale de lidocaïne hyperbare pour la rachianesthésie. Can J Anesth 1998;45:122–129.
- Urmey WF, Stanton J, Peterson M, et al : anesthésie rachidienne-péridurale combinée pour la chirurgie ambulatoire. Caractéristiques dose-réponse de la lidocaïne isobare intrathécale à l'aide d'une aiguille Whitacre de calibre 27. Anesthésiologie 1995;83 :528–534.
- Norris MC, anesthésie rachidienne-péridurale combinée pour les procédures vasculaires urologiques et des membres inférieurs. Tech Reg Anaesth Pain Manag 1997;1:131–136.
- Patel NP, Armstrong SL, Fernando R, et al : Péridurale rachidienne combinée vs péridurale pendant le travail : l'analgésie intrathécale initiale réduit-elle la concentration analgésique locale minimale ultérieure de bupivacaïne péridurale ? Anesthésie 2012 ; 67 : 584–593.
- Takiguchi T, Okano T, Egawa H, et al : L'effet de l'injection péridurale de solution saline sur le niveau analgésique pendant l'anesthésie rachidienne et péridurale combinée a été évalué cliniquement et myélographiquement. Anesth Analg 1997;85:1097–1100.
- Blumgart CH, Ryall D, Dennison B, et al : Mécanisme d'extension de la rachianesthésie par injection extradurale d'anesthésique local. Br J Anaesth 1992;69:457–460.
- Loubert C, Hallworth S, Fernando R, et al : extension du volume péridural dans l'anesthésie péridurale rachidienne combinée pour la césarienne élective : un essai contrôlé randomisé. Anesth Analg 2011;113:811–817.
- Doganci N, Apan A, Tekin O, Kaymak C : Expansion du volume péridural : y a-t-il un effet plafond ? Minerva Anestesiol 2010;76:334–339.
- Tyagi A, Kumar A, Sethi AK, Mohta M : Extension du volume péridural et exigence de dose intrathécale : bupivacaïne ordinaire ou hyperbare. Anesth Analg 2008;107:333–338.
- Tyagi A, Girotra G, Kumar A, et al : rachianesthésie à un seul coup, extension de volume rachidienne-péridurale et péridurale combinée pour une césarienne élective : une comparaison randomisée. Int J Obstet Anesth 2009; 18:231–236.
- Fan SZ, Suseti L, Wang YP, et al : Faible dose de bupivacaïne hyperbare intrathécale associée à de la lidocaïne péridurale pour la césarienne - une technique de bloc d'équilibre. Anesth Analg 1994;78:474–477.
- Macfarlane A, Pryn A, Litchfield K, et al : Essai contrôlé randomisé de péridurale rachidienne combinée vs rachianesthésie pour la césarienne élective : besoins en vasopresseurs et changements cardiovasculaires. Eur J Anaesth 2009;26:47–51.
- Landau R, Giraud R, Morales M, Kern C, Trindade P : anesthésie spino-péridurale combinée séquentielle pour césarienne chez une femme avec un ventricule droit à double sortie. Acta Anesthésiol Scand 2004 ; 48:922–926.
- Parneix M, Fanou L, Morau E, Colson P : Spinalepidural vombiné à faible dose anesthésie pour césarienne chez une patiente atteinte du syndrome d'Eisenmenger. Int J. Obstet Anesth 2009;18:81–84.
- Agarwal A, Garg R, Joshi A, Verma S : rachianesthésie péridurale combinée avec technique d'extension de volume épidural pour l'hystérectomie chez une patiente atteinte d'une cardiopathie cyanotique non palliée - Un rapport de cas. Acta Anaesthesiol Belg 2010;61:159–161.
- Month RC, Vaida SJ : Une technique rachidienne-épidurale combinée pour l'analgésie du travail et le soulagement symptomatique chez deux parturientes atteintes d'hypertension intracrânienne idiopathique. Int J Obstet Anesth 2012;21:192–194.
- Thorén T, Holmström B, Rawal N, et al : bloc épidural spinal combiné séquentiel versus bloc spinal pour la césarienne : effets sur l'hypotension maternelle et la fonction neurocomportementale du nouveau-né. Anesth Analg 1994;78:1087–1092.
- Simmons SW, Cyna AM, Dennis AT, Hughes D : Analgésie spino-péridurale combinée versus péridurale pendant le travail. Cochrane Database Syst Rev 2007;(3):CD003401.
- Van De Velde M : Analgésie épidurale combinée pour le travail et l'accouchement : Une vision équilibrée basée sur l'expérience et la littérature. Acta Anaesth Belg 2009;60:109–122.
- Hoffmann VL, Vercauteren MP, Vreugde JP, Hans GH, Coppejans HC, Adriaensen HA : Profondeur de l'espace épidural postérieur : Sécurité de la perte de résistance et des techniques de chute suspendue. Br J Anaesth 1999;83 : 807–809.
- Han KR, Kim C, Park SK, Kim JS : Distance à l'espace épidural cervical adulte. Reg Anesth Pain Med 2003;28:95–97.
- McAndrew CR, Harms P : Paresthésies pendant la péridurale rachidienne combinée aiguille à aiguille par rapport à la colonne vertébrale à injection unique pour la césarienne élective. Anaesth Intensive Care 2003;31:514–517
- Hoffmann VL, Vercauteren MP, Buczkowski PW, Vanspringel GL : Un nouvel appareil spino-épidural combiné : Mesure de la distance aux espaces épidural et sous-arachnoïdien. Anesthésie 1997 ; 52 : 350–355.
- Cousins MJ, Bridenbaugh PO: Neural block in Clinical Anesthesia and Management of Pain, 3e éd. Lippincott-Raven, 1998, pp 252–255.
- Watts RW : L'influence de l'obésité sur la relation entre l'indice de masse corporelle et la distance entre l'espace péridural et la peau. Anesth Intensive Care 1993;21;309–310.
- Lirk P, Moriggl B, Colvin J, et al : L'incidence des lacunes de la ligne médiane du Ligamentum flavum lombaire. Anesth Analg 2004;98:1178–1180.
- Cook TM : Techniques combinées rachi-péridurale. Anesthésie 2000 ; 55 : 42–64.
- Landau R : Analgésie rachi-péridurale combinée pour le travail : percée ou invasion injustifiée ? Semin Perinatol 2002;26:109–121.
- Rawal N, Holmstrom B : La technique combinée spino-épidurale. Best Pract Res Clin Anaesthesiol 2003;17:347–364.
- Soresi AL : Anesthésie épisous-durale. Anesth Analg 1937;16:306–310.
- Curelaru I : Anesthésie sous-arachnoïdienne de longue durée avec bloc péridural continu. Prak Anesth 1979;14:71–78.
- Brownridge P : bloc neural central et césarienne, partie 1. Revue et série de cas. Anaesth Intensive Care 1979 ; 7 : 33–41.
- Brownridge P : Analgésie péridurale et sous-arachnoïdienne pour césarienne élective. Anesthésie 1981;36:70.
- Coates MB : techniques combinées sous-arachnoïdiennes et épidurales. Anesthésie. 982;37:89–90.
- Mumtaz MH, Daz M, Kuz M : Une autre technique à espace unique pour la chirurgie orthopédique. Anesthésie 1982;37:90.
- Carrie LES, O'Sullivan GM : bupivacaïne sous-arachnoïdienne à 0.5 % pour la césarienne. Eur J Anaesth 1984;1:275–283.
- Turner MA, Reifenberg NA. L'analgésie péridurale rachidienne combinée. La technique du double canon à espace unique. Int J Obstet Anesth 1995;55 : 158–160.
- Cook TM : Une nouvelle technique combinée rachi-péridurale. Int J Obstet Anesth 1999;55:3–6.
- Brownridge P : Analgésie péridurale et sous-arachnoïdienne pour césarienne élective. Anesthésie 1981;55:70.
- Carrie LES : péridurale versus bloc épidural rachidien combiné pour la césarienne. Acta Anaesth Scand 1988;55:5956.
- Morris GN, Kinsella M, Thomas TA : aiguilles à pointe de crayon et bloc péridural rachidien combiné. Pourquoi aiguille dans l'aiguille ? Anesthésie 1998;55 : 1132.
- Kestin IG : La rachianesthésie en obstétrique. Br J Anaesth 1991;55:663.
- Eldor J : anesthésie rachidienne-péridurale combinée avec l'ensemble Portex. Anesthésie 1993;55:836.
- Soni AK, Sarna MC. L'analgésie péridurale rachidienne combinée. La technique du double canon à espace unique. Int J Obstet Anesth 1996;55:206–207.
- Sakuma N, Hori M, Suzuki H, et al : Un cathéter épidural cisaillé et séquestré : Un rapport de cas. Masui 2004;53(2):198–200.
- Roberts E, Brighouse D : anesthésie rachidienne-péridurale combinée pour la césarienne. Anesthésie 1992;55:1006.
- Cook TM : 201 rachi-péridurales combinées pour l'anesthésie utilisant une technique d'aiguille séparée. Eur J Anaesthesiol 2004;21:679–683.
- Levin A, Segal S, Datta S : L'analgésie rachidienne combinée modifie-t-elle l'incidence des paresthésies lors de l'insertion d'un cathéter péridural ? Anesth Analg 1998;55:44551.
- Familton MJG, Morgan BM : Technique « aiguille dans aiguille » pour l'anesthésie rachidienne-extradurale combinée en obstétrique. Br J Anaesth 1992; 55:327.
- Patel M, Samsoon G, Swami A, Morgan B : Posture et propagation de la bupivacaïne hyperbare chez les parturientes en utilisant la technique épidurale rachidienne combinée. Can J Anaesth 1993;55:943–946.
- McAndrew CR, Harms P : Paresthésies pendant la péridurale rachidienne combinée aiguille à aiguille par rapport à la colonne vertébrale à injection unique pour la césarienne élective. Anaesth Intensive Care 2003;31:514–517.
- Lyons G, Macdonald R, Mikl B : anesthésie épidurale spinale combinée pour la césarienne. À travers l'aiguille ou dans des espaces séparés ? Anesthésie 1992 ; 55 : 199–201.
- Casati A, D'ambrosio A, De Negri P, Fanelli G, Tageriello V, Tarantino F : une comparaison clinique entre les techniques d'aiguille à travers l'aiguille et à double segment pour l'anesthésie rachidienne et péridurale combinée. Reg Anesth Pain Med 1998;55:3904.
- Rawal N, Van Zundert A, Holmström B, Crowhurst JA : Technique spinalepidurale combinée. Reg Anesth 1997;55:40623.
- Backe SK, Sheikh Z, Wilson R, Lyons GR : Anesthésie péridurale/rachidienne combinée : aiguille dans l'aiguille ou espaces séparés ? Eur J Anaesthesiol 2004;21:854–857.
- Sadashivaiah J, Wilson R, McLure H, Lyons G : technique spino-épidurale combinée à double espace pour la césarienne élective : un examen de 10 ans d'expérience dans une unité de maternité d'enseignement au Royaume-Uni. Int J Obstet Anesth 2010;19:183–187.
- Van den Berg AA, Ghatge S, Wang S : La perte de résistance à la solution saline réduit les réponses accompagnant l'insertion de l'aiguille spinale lors de l'institution de l'analgésie spino-épidurale combinée « aiguille dans l'aiguille ». Anaesth Intensive Care 2010;38:1013–1017.
- Grau T, Leipold RW, Fatehi s, Martin E, Motsch J : Observation ultrasonore en temps réel de l'anesthésie spino-épidurale combinée. Eur J Anaesthesiol 2004;21:25–31.
- Tsui BC, Gupta S, Finucane B : Détermination du placement du cathéter péridural à l'aide de la stimulation nerveuse chez les patientes obstétricales. Reg Anesth 1999;24:17–23.
- Herman NL, Calicott R, Van Decar TK, et al : Détermination de la relation dose-réponse pour le sufentanil intrathécal chez les patients en travail. Anesth Analg 1997;84:1256–1261.
- Herman NL, Choi KC, Affleck PJ, et al : analgésie, prurit et ventilation chez les parturientes recevant du fentanyl intrathécal pendant le travail. Anesth Analg 1999;89:378–383.
- Palmer CM, Randall CC, Hays R, et al : La relation dose-réponse du fentanyl intrathécal pour l'analgésie du travail. Anesthésiologie 1998 ;88 : 355–361.
- Honet JE, Arkoosh VA, Norris MC, et al : Comparaison entre le fentanyl intrathécal, la mépéridine et le sufentanil pour l'analgésie du travail. Anesth Analg 1992;75:734–739.
- Jaffe RA, Rowe MA : Comparaison des effets anesthésiques locaux de la mépéridine, du fentanyl et du sufentanil sur les axones de la racine dorsale. Anesth Analg 1996;83:776–781.
- Flanagan MT, Walker FO, Butterworth J : Échec de la mépéridine pour anesthésier le nerf médian humain. Une comparaison en aveugle avec la lidocaïne et la solution saline. Reg Anesth 1997;22:73–79.
- Abouleish A, Abouleish E, Camann W : Analgésie rachidienne-péridurale combinée en travail avancé. Can J Anaesth 1994;41:575–578.
- Campbell DC, Camann WR, Datta S : L'ajout de bupivacaïne au sufentanil intrathécal pour l'analgésie du travail. Anesth Analg 1995;81 : 305–309.
- Sia ATH, Chong JL, Chiu JW : Combinaison de sufentanil intrathécal 10 μg et de bupivacaïne 2.5 mg pour l'analgésie du travail : la moitié de la dose est-elle suffisante ? Anesth Analg 1999;88:362–366.
- Stocks GM, Hallworth SP, Fernando R, et al : Dose analgésique locale minimale de bupivacaïne intrathécale pendant le travail et effet du fentanyl intrathécal. Anesthésiologie 2001, 94 : 593–598.
- Whitty R, Goldszmidt E, Parkes RK, Carvalho JC : Détermination de la DE95 pour la bupivacaïne ordinaire intrathécale associée au fentanyl pendant le travail actif. Int J Obstet Anesth 2007;16:341–345.
- Levin A, Datta S, Camann W : Ropivacaïne intrathécale pour l'analgésie du travail : une comparaison avec la bupivacaïne. Anesth Analg 1998;87:624–627.
- Joshi GP, McCarroll SM : Évaluation de l'anesthésie rachidienne-péridurale combinée à l'aide de deux techniques différentes. Reg Anesth 1994;55:16974.
- Collis RE, Baxandall ML, Srikantharajah ID, Edge G, Kadim MY, Morgan BM : Analgésie épidurale rachidienne combinée avec capacité de marcher tout au long du travail. Lancet 1993;55:7678.
- Hoffmann VLH, Vercauteran MP, Buczkowski PW, Vanspringel GLJ : Un nouvel appareil épidural spinal combiné : mesure de la distance aux espaces épidural et sous-arachnoïdien. Anesthésie 1997 ; 55 : 350–355.
- Holloway TE, Telford RJ : Observations sur la ponction durale volontaire avec une aiguille de Touhy : Mesure de la profondeur. Anesthésie 1991;46:722–724.
- Cousins MJ, Bridenbaugh PO: Neural block in Clinical Anesthesia and Management of Pain, 3e éd. Lippincott-Raven, 1998, pp 255.
Brighouse D, Wilkins A : Échec des aiguilles spinales à pointe de crayon pour pénétrer dans l'espace sous-arachnoïdien. Anesthésie 1994;55:176. - Meiklejohn BH : L'effet de la rotation d'une aiguille épidurale : une étude in vitro. Anesthésie 1987 ; 42 : 1180–1182.
- Husemeyer RP, White DC : Topographie de l'espace épidural lombaire. Anesthésie 1980 ; 55 : 7–11.
- Waldman SA, Liguori GA : Comparaison des débits des aiguilles Whitacre et Sprotte de calibre 27 pour l'anesthésie rachidienne et péridurale combinée. Reg Anesth 1996;55:378–379.
- Vandermeersch E : rachianesthésie-péridurale combinée. Balliere's Clin Anaesth 1993;7:691–708.
- Fukishige T, Sano T, Kano T : Déformation du sac dural lombaire après injection péridurale. Anesthésiologie 1998;55:A870.
- Norris MC, Grieco WM, Borkowski M, et al : Complications de l'analgésie du travail : péridurale versus techniques épidurales rachidiennes combinées. Anesth Analg 1994;55:529–537.
- Lesser P, Bembridge M, Lyons G, Macdonald R : Une évaluation d'une aiguille de calibre 30 pour la rachianesthésie pour la césarienne. Anesthésie 1990 ; 55 : 76–78.
- Dennison B : Bloc combiné sous-arachnoïdien et péridural pour la césarienne. Can J Anaesth 1987;55:105.
- Patel M, Swami M : anesthésie rachidienne-extradurale combinée pour la césarienne. Anesthésie 1992 ; 55 : 1005–1006.
- Robbins PM, Fernando R, Lim GH : Insertion intrathécale accidentelle d'un cathéter extradural pendant une anesthésie rachidienne-extradurale combinée pour une césarienne. Br J Anaesth 1995;75:355–357.
- Vucevic M, Russell IF : Rachianesthésie pour césarienne : 0.125 % de bupivacaïne ordinaire 12 mL par rapport à 0.5 % de bupivacaïne ordinaire 3 ml. Br J Anaesth 1992;55:590–595.
- Ferguson DJM : Ponction durale et cathéters périduraux. Anesthésie 1992;55:272.
- Muranaka K, Tsutsui T : Comparaison de l'utilité clinique des deux types d'aiguilles péridurales combinées. Masui 1994;55:1714–1717.
- Angle P, Kronberg JE, Thompson DE, Duffin J, et al : Cathéter péridural
pénétration du tissu de la dure-mère humaine : enquête in vitro. Anesthésiologie
2004;100(6);141–146. - Holtz D, Mollman M, Schymroszcyk B, Ebel C, Wendt M : Aucun risque de toxicité des métaux dans l'anesthésie rachidienne-épidurale combinée. Anesth Analg 1999;88(2):393–397.
- Holmstrom B, Rawal N, Axelsson K, et al : Risque de migration du cathéter lors d'une étude combinée épidurale épidurale percutanée et épiduroscopie. Anesth Analg 1995;80:747–753.
- Leighton BL, Arkoosh VA, Huffnagle S, et al : La propagation dermatomique de la bupivacaïne épidurale avec et sans sufentanil intrathécal antérieur. Anesth Analg 1996;83:526–529.
- Stienstra R, Dilrosun-Alhadi BZ, Dahan A, van Kleef JW, Veering BT, Burm AG : Le « complément » épidural dans l'anesthésie spino-épidurale combinée : L'effet du volume par rapport à la dose. Anesth Analg 1999;88:810–814.
- Suzuki N, Koganemaru M, Onizuka S, Takasaki M : La ponction durale avec une aiguille spinale 26G affecte la propagation de l'anesthésie péridurale. Anesth Analg 1996;82:1040–1042.
- Kamiya Y, Kikuchi T, Inagawa G, et al : concentration de lidocaïne dans le liquide céphalo-rachidien après administration péridurale : une comparaison entre l'anesthésie épidurale et l'anesthésie spino-épidurale combinée. Anesthésiologie 2009 ;110 :1127–1132.
- Leach A, Smith GB : Propagation sous-arachnoïdienne d'un anesthésique local péridural après ponction durale. Anesthésie 1988 ; 43 : 671–674.
- Gaiser RR, Lewin SB, Cheek TG, Gutsche BB : Effets de l'initiation immédiate d'une perfusion péridurale dans la technique combinée rachidienne et péridurale chez les parturientes nullipares. Reg Anesth Pain Med 2000;25:223–227.
- Beaubien G, Drolet P, Girard M, Grenier Y : péridurale contrôlée par le patient
analgésie par fentanyl-bupivacaïne : influence d'une ponction dure-mérienne antérieure. Reg Anesth Pain Med 2000;25:254–258. - Hodgkinson R : Bloc rachidien total après injection épidurale dans un espace intermédiaire adjacent à une perforation durale accidentelle. Anesthésiologie 1981;55 :593–595.
- Eldor J, Guedj P, Levine S. Arrêt respiratoire retardé dans l'anesthésie rachidienne-péridurale combinée. Rapport de cas. Reg Anesth 1994;19;418–422.
- Kuczkowski KM, Birnbach DJ, O'Gorman DA, Stein DJ, Santos AC : Une dose test augmente-t-elle la probabilité d'identifier le placement intrathécal de cathéters épiduraux pendant l'analgésie du travail ? Résumé des articles scientifiques SOAP. Anesthésiologie 2000;A26.
- Goy RW, Sia AT. Anesthésie sensorimotrice et hypotension après bloc sous-arachnoïdien : technique combinée rachi-péridurale versus rachidienne à un seul coup. Anesth Analg 2004;98(2):491–496.
- Goy RWL, Chee-Seng Y : La dose efficace médiane de bupivacaïne hyperbare intrathécale est plus élevée dans la rachidienne à injection unique par rapport à la technique rachidienne-péridurale combinée. Anesth Analg 2005; 100:1499–1502.
- Gaur V, Gupta RK, Agarwal A, et al : Air ou protoxyde d'azote pour la perte de résistance
technique péridurale ? Can J Anaesth 2000;47:503–505. - Carpenter RL, Hogan QH, Liu SS, et al : le volume de liquide céphalo-rachidien lombo-sacré est le principal déterminant de l'étendue et de la durée du bloc sensoriel pendant la rachianesthésie. Anesthésiologie 1998;89:24–29.
- Rawal N, Schollin J, Wesström G : bloc péridural péridural versus bloc péridural spinal combiné pour la césarienne. Acta Anaesth Scand 1988;32 : 61–66.
- Kumar C : Bloc combiné sous-arachnoïdien et péridural pour la césarienne. Can J Anesth 1987;34:329–330.
- Mandell GL, Jamnback L, Ramanathan S : Effets hémodynamiques du fentanyl sous-arachnoïdien chez les parturientes en travail. Reg Anesth 1995;21(2):103–111.
- Horlocker TT, McGregor DG, Matsushige DK, Schroeder DR, Besse JA : Une revue rétrospective de 4767 anesthésiques rachidiens consécutifs : complications du système nerveux central. Anesth Analg 1997;55:578–584.
- Bigeleisen PE : La ponction nerveuse et l'injection intraneurale apparente pendant le bloc axillaire guidé par échographie n'entraînent pas invariablement de lésions neurologiques. Anesthésiologie 2006 ; 105 : 779–783.
- Simsa J : Utilisation d'aiguilles rachidiennes 29-G et d'un dispositif de fixation avec technique péridurale rachidienne combinée. Acta Anaesth Scand 1994;38:439–441.
- McAndrew CR, Harms P : Paresthésies pendant la péridurale rachidienne combinée aiguille à aiguille par rapport à la colonne vertébrale à injection unique pour la césarienne élective. Anaesth Intensive Care 2003;31(5):514–517.
- Holloway J, Seed PT, O'Sullivan G, Reynolds F : Paresthésies et lésions nerveuses après péridurale rachidienne et anesthésie rachidienne combinées : une enquête pilote. Int J Obstet Anesth 2000;9(3):151–155.
- Turner MA, Shaw M: Aiguille spinale atraumatiquea [lettre]. Anesthésie 1993;48:452.
- Broadbent CR, Maxwell WB, Ferrie R, et al : capacité des anesthésistes à identifier un espace lombaire marqué. Anesthésie 2000 ; 55 : 1106–1126.
- Eldor J : Fragments métalliques et technique combinée rachidienne-extradurale. Br J Anaesth 1992;69:663.
- Sharma B, Gupta S, Jain N, Handoo A, Sood J : cytologie du liquide céphalo-rachidien chez les patients subissant une péridurale rachidienne combinée par rapport à une anesthésie rachidienne sans introducteur. Anaesth Soins Intensifs 2011 ; 39:914–918.
- Dripps Rd, Vandem LD : Suivi à long terme de patients ayant reçu 10,098 1954 rachianesthésies. JAMA 156;1486:1491–XNUMX.
- Phillips OC, Ebner H, Melson AT, Black MH : Complications neurologiques suite à une rachianesthésie avec lidocaïne : Une revue prospective de 10,440 1969 cas. Anesthésiologie 30 ; 284 : 289–XNUMX.
- Harding SA, Collis RE, Morgan BM : Méningite après rachianesthésie extradurale combinée en obstétrique. Br J Anaesth 1994;73:545–547.
- Cascio M : Méningite suite à une technique rachi-péridurale combinée chez une parturiente en travail. Can J Anaesth 1996;43:399–402.
- Pinder AJ, Dresner M : Méningite méningococcique après spinalepidurale combinée
analgésie. Int J Obstet Anesth 2003;12:183–187. - McLure HA, Talboys CA, Yentis SM, Azadian BS : Facemesks chirurgicaux et dispersion vers le bas des bactéries. Anesthésie 1998 ; 53 : 624–626.
- Phillips BJ, Fergusson S, Armstrong P, Anderson FM, Wildsmith JAW : Les masques chirurgicaux sont efficaces pour réduire la contamination bactérienne causée par la dispersion à partir des voies respiratoires supérieures. Br J Anaesth 1992;69:407–408.
- Burnstein R, Buckland R, Pickett JA : Une enquête sur l'analgésie péridurale pour le travail au Royaume-Uni. Anesthésie 1999 ; 54 : 634–650.
- Siegel J, Rhinehart E, Jackson M, Chiarello L; et le Comité consultatif sur les pratiques de contrôle des infections dans les soins de santé. Lignes directrices sur les précautions d'isolement : Prévention de la transmission des agents infectieux dans les établissements de santé, juin 2007. http://www.premierinc.com/safety/topics/ guidelines/downloads/cdc-isolation-2007.pdf.
- Centres pour le Contrôle et la Prévention des catastrophes. Méningite bactérienne après rachianesthésie pendant le travail—Ohio et New York, 2008–2009. MMWR Morb Mortal Wkly Rep 2010;59:65–69.
- Sandkovsky U, Mihu MR, Adeyeye A, et al : méningite iatrogène chez une patiente obstétricale après analgésie spino-épidurale combinée : rapport de cas et revue de la littérature. South Med J 2009;102:287–290.
- Choy JC : Mortalité par méningite péripartum. Anaesth Intensive Care 2000;28:328–330.
- Tariq A : Déficit neurologique après rachianesthésie-péridurale combinée pour arthroplastie du genou. Moyen-Orient J Anesthesiol 2010;20:759–762.
- Takasu, M, Okita M, Araki m, et al : Rehaussement au gadolinium de la queue de cheval après une anesthésie spino-épidurale combinée. Br J Radiol 2010;83:192–194.
- Kubina P, Gupta A Oscarsson A, et al : Deux cas de syndrome de la queue de cheval suite à une anesthésie spino-épidurale. Reg Anesth 1997;22 : 447–450.
- Kato J, Konishi J, Yoshida H, et al : syndrome de la queue de cheval après anesthésie rachidienne et épidurale combinée : rapport de cas. Can J Anaesth 2011;58:638–641.
- Rawal N, Holmstrom B, Croehurst JA, Van Zundert A : La technique spino-épidurale combinée. Anaesthsiol Clin Amérique du Nord 2000;18 : 267–295.
- Dunn SM, Connelly NR, Parker RK : Céphalée post-ponction durale (PDPH) et rachianesthésie combinée (CSE). Anesth Analg 2000;90 : 1249–1250.
- Balestrieri PJ : L'incidence des céphalées de ponction post-durale et combinée rachi-péridurale : quelques réflexions. Int J Obstet Anesth 2003; 12(4):305–306.
- Brownridge P. L'anesthésie rachidienne en obstétrique. Br J Anaesth 1991;67 : 663–667.
- Geurts JW, Haanschoten MC, Van Wijk RM, Kraak H, Besse TC : Céphalée post-ponction durale chez les jeunes patients. Une étude comparative entre l'utilisation d'aiguilles spinales de 0.52 mm (calibre 25) et de 0.33 mm (calibre 29). Acta Anaesthesiol Scand 1990;34:350–353.
- Chan BO, Paech MJ : fuite persistante de liquide céphalo-rachidien : une complication de la technique combinée spino-épidurale. Anesth Analg 2004;98(3): 828–830.
- Reisinger PWM, Hochstrasser K : Le diagnostic des fistules du LCR sur la base de la détection de la bêta2-transferrine par électrophorèse sur gel de polyacrylamide et immunotransfert. J Clin Chem Clin Biochem 1989; 27:169–172.
- Howes J, Lenz R : Fistule cutanée du liquide céphalo-rachidien - Une complication inhabituelle de l'anesthésie péridurale. Anesthésie 1994;49:221–222.
- Pan PH, Moore CH, Ross VH : bradycardie et asystole maternelles sévères après analgésie rachidienne-péridurale combinée chez une parturiente obèse morbide. J Clin Anesth 2004;16(6):461–464.
- Kuczkowski KM : Bradycardie fœtale persistante sévère après administration sous-arachnoïdienne de fentanyl et de bupivacaïne pour l'induction d'une analgésie spino-épidurale combinée pour la douleur du travail. J Clin Anesth 2004;16(1):78–79.
- D'Angelo R, Eisenach JC : hypotension maternelle sévère et bradycardie fœtale après un CSE. Anesthésiologie 1997 ; 81 : 116–118.
- Mardirosoff C, Dumont L, Boulvain M, Tramèr MR : Bradycardie fœtale due aux opioïdes intrathécaux pour l'analgésie du travail : une revue systématique. BJOG 2002;109:274–281.
- Van de Velde M : Analgésie neuraxiale et bradycardie fœtale. Curr Opin Anaesthesiol 2005;18:253–256.
- Nocolet J, Miller A, Kaufman I, et al : Facteurs maternels impliqués dans la bradycardie fœtale après épidurale rachidienne combinée pour la douleur du travail. Eur J Anaesth 2008;25:721–725.
- Clarke VT, Smiley RM, Finster M : Hyperactivité utérine après injection intrathécale de fentanyl pour l'analgésie pendant le travail : une cause de bradycardie fœtale ? Anesthésiologie 1994;81:1083.
- Albright GA, Forster RM : L'analgésie spino-épidurale combinée avec le sufentanil sous-arachnoïdien augmente-t-elle l'incidence de l'accouchement par césarienne d'urgence ? Reg Anesth Pain Med 1997;22:400–405.
- Skupski DW, Abramovitz S, Samuels J, et al : Effets indésirables de l'analgésie péridurale combinée par rapport à l'analgésie péridurale traditionnelle pendant le travail. Int J. Gynecol Obstet 2009;106:242–245.
- Rawal N, Schollin J, Wesstrom G : péridurale versus bloc épidural rachidien combiné pour la césarienne. Acta Anaesthesiol Scand 1988;32 : 61–66.
- Joshi GP, MaCarroll SM : anesthésie rachidienne-péridurale combinée utilisant la technique de l'aiguille dans l'aiguille [Lettre]. Anesthésiologie 1993 ; 78 : 406–407.
- Pan PH : Évaluation en laboratoire des aiguilles rachidiennes-épidurales combinées à lumière unique et à double orifice : effets de l'orientation du biseau et de la technique modifiée. J Clin Anesth 1998;10(4):286–290.
- Riley ET, Hamilton CL, Ratner EF, Cohen S : Une comparaison des aiguilles spinales Sprotte et Gertie Marx de calibre 24 pour l'analgésie spino-épidurale combinée pendant le travail. Anesthésiologie 2002;97 :574–577.
- Herbstman CH, Jaffe JB, Tuman KJ, et al : une évaluation in vivo de quatre aiguilles rachidiennes utilisées pour la technique rachidienne-épidurale combinée. Anesth Analg 1998;86(3):520–522.
- Simsa J: Fixation à l'aiguille avec anesthésie rachidienne combinée. Acta Anaesth Scand 1995;55:275.
- Stocks GM, Hallworth SP, Fernando R : Évaluation d'un dispositif de verrouillage de l'aiguille spinale à utiliser avec la technique épidurale spinale combinée. Anesthésie 2000;55(12):1185–1188.
- Eldor J, Chaimsky G : L'aiguille épidurale spinale combinée Eldor. Anesthésie 1993;48:173.
- Torrieri A, Aldrete JA : Aiguille combinée rachi-péridurale. Actes Anaesth Belg 1998;39:65–66.
- Birnbach DJ, Chestnut DH : La dose test péridurale en pratique obstétricale : a-t-elle perdu son utilité ? Anesth Analg 1999;88:971.
- Steffek M, Owczuk R, Szlyk-Augustyn M, Lasinska-Kowara M, Wujtewicz M : La rachianesthésie totale en tant que complication de l'administration d'une dose test d'anesthésique local via un cathéter péridural. Acta Anesthesiol Scand 2004;48(9):1211–1213.
- Norris MC, Ferrenbach D, Dalman H, et al : L'épinéphrine améliore-t-elle la précision diagnostique de l'aspiration pendant l'analgésie péridurale du travail ? Anesth Analg 1999;88;1073.
- Moore DC, Batra MS : les composants d'une dose test efficace avant le bloc épidural. Anesthésiologie 1981;55:693.
- Hood DD, Dewan DM, James FM III : effet maternel et fœtal de l'épinéphrine chez les brebis gravides. Anesthésiologie 1986;64:610.
- Leighton BL, Norris MC, DeSimone CA, et al : Le test de l'air comme indicateur cliniquement utile des cathéters épiduraux placés par voie intraveineuse. Anesthésiologie 1990;73:610.
- Kopacz DJ : Spinal 2-chloroprocaïne : Dose minimale efficace. Reg Anesth Pain Med 2005;30(1):36–42.
- Hamza J, Smida M, Benhamou D, Cohen SE : La poture de la parturiente pendant la ponction épidurale affecte la distance entre la peau et l'espace épidural. J Clin Anesth 1995;7:1–4.
- Yun EM, Marx GF, Santos AC : Les effets de la position maternelle lors de l'induction de l'anesthésie rachidienne-péridurale combinée pour l'accouchement par césarienne. Anesth Analg 1998;87:614–618.
- Lewis NL, Ritchie EL, Downer JP, Nel MR : latéral gauche vs décubitus dorsal, position coincée pour le développement d'un bloc après une anesthésie rachidienne-péridurale combinée pour une césarienne. Anesthésie 2004;59 : 894–898.


