Steve Robert
INTRODUCTION
L'anesthésie régionale est un élément essentiel de la pratique moderne de l'anesthésie pédiatrique, apportant de nombreux avantages significatifs au patient et à l'hôpital (Tableau 1). Cependant, malgré un ensemble de preuves solides mettant en évidence les avantages de l'anesthésie régionale, ce n'est que relativement récemment que l'anesthésie régionale a commencé à devenir plus courante dans la pratique anesthésique. De vastes études prospectives de la Société francophone des anesthésistes pédiatres (ADARPEF) n'ont démontré aucun risque accru chez les enfants ayant des blocs réalisés sous anesthésie générale. Cependant, les complications étaient quatre fois plus importantes chez les enfants de moins de 6 mois que chez ceux de plus de 6 mois.
Historiquement, on pensait que les nouveau-nés nécessitaient peu ou pas d'analgésie. Cependant, une analgésie inadéquate chez le nouveau-né peut provoquer des changements biocomportementaux susceptibles de moduler les réponses futures à la douleur pendant l'enfance. En conséquence, les techniques avancées d'anesthésie régionale (par exemple, l'analgésie péridurale) sont de plus en plus utilisées chez les enfants de tous âges. Fait intéressant, les études ADARPEF ont identifié qu'il y a maintenant une tendance à s'éloigner des blocs neuraxiaux centraux vers les techniques de cathéter nerveux périphérique. Ce changement peut avoir été influencé par les progrès de la chirurgie mini-invasive et l'administration plus prévisible des techniques de cathéter périphérique dans la pratique moderne de l'anesthésie régionale.
Toutes les techniques d'anesthésie régionale peuvent être réalisées en toute sécurité dans la population pédiatrique avec une formation adéquate et un équipement moderne.
TABLE 1. Avantages de l'anesthésie régionale chez l'enfant.
| Avantages pour les patients | Analgésie supérieure : rend le patient et les parents/soignants plus calmes. |
| MAC réduit : risque réduit d'AG plus profond, émergence plus douce, retour plus rapide de l'appétit. | |
| Neurotoxicité : ce problème potentiel dépend de la dose de GA ; par conséquent, une exposition réduite au MAC peut être bénéfique. | |
| Stabilité hémodynamique : jusqu'à l'âge de 8 ans, les CNB provoquent rarement une hypotension importante. | |
| Besoin réduit d'assistance respiratoire postopératoire : en particulier chez les nouveau-nés et les nourrissons subissant une chirurgie abdominale haute et thoracique. | |
| Obtient la réponse hormonale au stress. | |
| Réduction de la perte de sang peropératoire : démontrée lors de la réparation de l'hypospadias, de la réparation de la fente et de l'amygdalectomie. | |
| Fonction gastro-intestinale améliorée : Péristaltisme mieux maintenu ; amélioration de la perfusion splanchnique en cas de NEC et de gastroschisis | |
| Évite le besoin d'AG : les prématurés qui subissent une AG sont à risque d'apnée postopératoire. | |
| Prestations hospitalières | Plus facile à allaiter : Les enfants sans douleur demandent moins de travail pour s'occuper. |
| MAC réduit : décharge rapide de la récupération de la première étape. | |
| Nécessité réduite d'assistance ventilatoire postopératoire : Ceci est particulièrement avantageux lorsque l'assistance à l'USIP est limitée. | |
| Durée de séjour réduite. |
DIFFÉRENCES ANATOMIQUES ENTRE ENFANTS & ADULTES
En ce qui concerne l'anatomie, la physiologie et la pharmacologie, les adolescents peuvent être considérés comme de « petits adultes » ; cependant, les nouveau-nés et les nourrissons nécessitent une attention particulière. Anatomiquement, la différence majeure réside dans la colonne vertébrale et son contenu ; ce sujet est décrit plus en détail dans Péridurale pédiatrique et rachianesthésie et analgésie. Physiologiquement, il existe un certain nombre de différences dans le développement du système nerveux pédiatrique par rapport aux adultes. La myélinisation est incomplète à la naissance et le processus peut prendre 12 ans pour se terminer; par conséquent, des concentrations plus faibles d'anesthésique local peuvent être utilisées efficacement dans la population pédiatrique, réduisant ainsi également le risque de toxicité. Bien que les voies nociceptives soient fondamentalement les mêmes chez les enfants que chez les adultes, il existe des différences qui peuvent faire en sorte que les enfants ressentent plus de douleur que les adultes. Chez l'enfant, le champ récepteur d'un neurone peut être plus important, entraînant une mauvaise localisation de la douleur. Les voies inhibitrices descendantes sont immatures, ce qui peut permettre des apports nociceptifs non modulés aux voies ascendantes de la douleur rachidienne. Les immaturités physiologiques du foie néonatal associées à un débit cardiaque relativement élevé produisent des différences pharmacologiques qui se combinent pour augmenter le risque de toxicité anesthésique locale chez les nouveau-nés.
PHARMACOLOGIE DES ANESTHÉSIQUES LOCAUX CHEZ LES PATIENTS PÉDIATRIQUES
Il existe deux groupes principaux de médicaments anesthésiques locaux utilisés en anesthésie régionale pédiatrique : les esters aminés et les amides aminés. (Une discussion détaillée de ces médicaments peut être trouvée dans Pharmacologie clinique des anesthésiques locaux.) Il existe relativement peu d'anesthésiques locaux dont la pharmaco-cinétique chez l'enfant, et surtout chez le nouveau-né, est limitée ; malheureusement, c'est ce groupe d'âge qui est le plus à risque de toxicité des anesthésiques locaux.
Anesthésiques locaux de type aminoamide
Le groupe d'anesthésiques locaux le plus couramment utilisé en pratique pédiatrique est celui des amides aminés : lidocaïne, bupivacaïne, ropivacaïne et lévobupivacaïne. Les anesthésiques locaux aminoamides subissent un métabolisme hépatique. Cependant, le foie néonatal est immature, les systèmes de cytochromes mûrissant à des rythmes variables : le CYP3A4 dans les 9 premiers mois de la vie par rapport au CYP1A2, qui peut prendre jusqu'à 8 ans pour arriver à maturité. Le volume de distribution à l'état d'équilibre chez les nourrissons est plus important que chez les adultes. Les compartiments liquidiens changent radicalement avec l'âge, 80 % du poids corporel étant constitué d'eau chez un nouveau-né prématuré, 75 % chez un nouveau-né à terme, 65 % chez un nourrisson et 60 % chez les enfants plus âgés. À mesure que l'âge augmente, le liquide intracellulaire augmente de 20 % du poids corporel chez les nouveau-nés prématurés à 30 % chez les adultes ; dans ce laps de temps, les fluides extracellulaires sont réduits de moitié. Les anesthésiques locaux sont solubles dans l'eau; par conséquent, les changements liés à l'âge dans la composition du compartiment liquidien sont importants. Les nourrissons ont des niveaux inférieurs de protéines de liaison à l'anesthésique local (p. ex., glycoprotéine acide alpha-1 et albumine), ce qui entraîne une augmentation de la fraction d'anesthésique local non lié et donc un risque accru de toxicité. Cependant, dans les 48 premières heures postopératoires, il y a une augmentation de la glycoprotéine alpha-1-acide qui peut agir pour protéger le nouveau-né. La clairance de ces médicaments est diminuée chez les moins de 3 mois, atteignant progressivement les niveaux adultes à l'âge de 8 mois. Par conséquent, les demi-vies d'élimination des anesthésiques locaux sont plus longues chez les nouveau-nés et les nourrissons que chez les adultes.
Bupivacaïne
La bupivacaïne est un isomère avec à la fois des énantiomères l et d, l'énantiomère d causant la plupart des effets indésirables observés chez l'homme. Étant donné que la bupivacaïne est le plus toxique des anesthésiques locaux à base d'amide aminé, il convient d'envisager l'utilisation d'une alternative plus sûre, en particulier pour les nouveau-nés et lorsque des techniques de perfusion continue par cathéter à demeure sont administrées. La pharmacocinétique et la pharmacodynamique de la bupivacaïne ont été bien documentées dans la littérature. La concentration préférée pour les enfants est de 0.25 % pour les blocs nerveux périphériques et de 0.1 % pour les perfusions continues. Les enfants plus âgés peuvent tolérer une dose plus élevée de solution anesthésique locale (0.4 mg/kg/h) que les nouveau-nés et les nourrissons (0.2 mg/kg/h). La posologie de la bupivacaïne est limitée à 2–4 mg/kg pour une injection monodose et à 0.2–0.4 mg/kg pour une perfusion continue.
Ropivacaïne
La ropivacaïne est un nouvel anesthésique local de type amide qui est utilisé plus fréquemment en chirurgie pédiatrique. C'est un énantiomère L avec moins d'effets secondaires cardiovasculaires et sur le système nerveux central que la bupivacaïne. La ropivacaïne a de légères propriétés vasoconstrictrices qui peuvent expliquer le Tmax plus long lorsqu'il est administré par voie caudale par rapport à la bupivacaïne. Des données pharmacocinétiques sont disponibles chez l'enfant sur l'utilisation de la ropivacaïne en perfusion continue ainsi qu'en injection unique. Des essais pédiatriques ont démontré une durée d'action plus longue avec la ropivacaïne qu'avec la mépivacaïne lorsqu'elle est utilisée pour le bloc nerveux périphérique. La prudence s'impose lors de l'utilisation de la ropivacaïne chez les enfants également, car des cas de toxicité cardiovasculaire ont été signalés.
Lévobupivacaïne
La lévobupivacaïne est un énantiomère L plus récent avec un risque potentiellement moindre de toxicité cardiovasculaire sévère. Des données pharmacocinétiques sont disponibles chez l'enfant et l'intervalle posologique est similaire à celui de la bupivacaïne. Des expérimentations animales ont montré que la lévobupivacaïne provoque moins de dépression myocardique et une diminution de l'incidence des arythmies mortelles par rapport à la bupivacaïne. Bien que ce médicament offre au praticien l'option d'un médicament moins cardiotoxique, la prudence s'impose tout de même.
Anesthésiques locaux de type ester
En raison de leur courte durée d'action et de leur propension à provoquer des réactions allergiques, les esters aminés (p. ex., procaïne, 2-chloroprocaïne, tétracaïne) constituent le groupe d'anesthésiques locaux le moins couramment utilisé. Contrairement aux anesthésiques locaux à base d'amides aminés, les esters aminés sont métabolisés par les cholinestérases plasmatiques. Par conséquent, le métabolisme des anesthésiques locaux à base d'ester dépend des taux plasmatiques de cholinestérase. Par conséquent, dans les populations présentant des taux plasmatiques de cholinestérase réduits, comme les nouveau-nés et les nourrissons, le taux plasmatique de ces médicaments peut être augmenté, entraînant potentiellement des taux de médicaments toxiques. La présence de cholinestérase plasmatique limite également la durée d'action de ces médicaments, conduisant à une activité raccourcie. Les anesthésiques locaux à base d'ester les plus couramment utilisés chez les nourrissons et les enfants sont la chloroprocaïne et la tétracaïne. Ces médicaments sont parfois utilisés chez les enfants comme adjuvant à la rachianesthésie chez les anciens prématurés subissant une rachianesthésie ou comme seule solution anesthésique pour l'analgésie caudale. La tétracaïne a été rapportée dans la rachianesthésie, en particulier chez les prématurés, comme seul anesthésique pour la réparation des hernies inguinales. La 2-chloroprocaïne a été largement utilisée chez les enfants pour l'analgésie dans l'espace neuraxial central.
DOSAGE DES ANESTHÉSIQUES LOCAUX CHEZ LES PATIENTS PÉDIATRIQUES
La plupart des doses de médicaments chez les patients pédiatriques sont basées sur le poids du patient (Tableau 2), bien qu'il soit souvent débattu de savoir si le poids corporel total ou la masse corporelle maigre est plus approprié pour les calculs de médicaments. Cependant, cela peut ne pas s'appliquer aux considérations anesthésiques locales ; des études réalisées sur des nourrissons subissant une rachianesthésie ont révélé un besoin plus important de solution anesthésique locale (en fonction du poids) par rapport à leurs homologues adultes utilisant de la bupivacaïne ou de la tétracaïne.
TABLE 2. Doses maximales recommandées et durée d'action approximative des agents anesthésiques locaux couramment utilisés.
| Anesthésie locale | Classe | Dose maximale (mg/kg)a | Durée d'action (min) | Perfusion (mg/kg/h) |
|---|---|---|---|---|
| Procaine | Ester | 10 | 60-90 | - |
| 2-chloroprocaïne | Ester | 20 | 30-60 | - |
| Tétracaïne | Ester | 1.5 | 180-600 | - |
| Lidocaïne | amides | 5 | 90-200 | - |
| Bupivacaïne | amides | 2.5 | 180-600 | 0.2-0.4 |
| Ropivacaïne | amides | 2.5 | 180-600 | 0.2-0.5 |
| Lévobupivacaïne | amides | 2.5 | 180-600 | 0.2-0.5 |
La concentration de l'anesthésique local administré doit également être soigneusement prise en compte. Une concentration plus faible d'anesthésique local à action prolongée (p. ex., 0.25 % de lévobupivacaïne) est souvent utilisée car l'enfant reçoit également une anesthésie générale ; par conséquent, le bloc est utilisé uniquement pour l'analgésie. Cependant, dans certains scénarios, des concentrations plus faibles ou plus élevées d'anesthésique local doivent être administrées. Des concentrations plus faibles (p. ex., 0.125 % de lévobupivacaïne) sont utiles pour diminuer le risque de toxicité chez les nouveau-nés et sont moins susceptibles de masquer le syndrome des loges ou de retarder la marche. Des concentrations plus élevées d'anesthésique local (p. ex., 0.5 % de lévobupivacaïne) doivent être envisagées lorsqu'un bloc moteur profond est souhaitable (p. ex., chirurgie de transfert des tendons des membres inférieurs chez les enfants atteints de paralysie cérébrale).
TOXICITÉ DES MÉDICAMENTS ANESTHÉSIQUES LOCAUX
La toxicité des anesthésiques locaux chez les enfants comprend une toxicité cardiovasculaire et du système nerveux central (Tableau 3) et réactions allergiques aux solutions anesthésiques locales à base d'esters. Les différences pharmacocinétiques déjà discutées, ainsi que l'immaturité de la barrière hémato-encéphalique, peuvent rendre la toxicité du système nerveux central plus probable chez les nouveau-nés. Cependant, la co-administration d'une anesthésie générale peut masquer les premiers signes et symptômes de toxicité systémique. La dose d'anesthésique local pour les enfants est toujours calculée sur la base d'un milligramme par kilogramme, plutôt que sur les volumes prévus comme dans l'anesthésie régionale pour adultes. Bien qu'il soit reconnu que, parmi les patients pédiatriques, les nourrissons présentent un risque plus élevé de toxicité systémique, la prudence doit être la norme pour les enfants de tous âges, car des concentrations plus élevées de certains anesthésiques locaux ont été enregistrées chez les adolescents par rapport aux adultes. Des concentrations plasmatiques toxiques ont également été signalées après des doses sûres d'anesthésique local utilisées pour les blocs caudaux et ilio-inguinaux, de sorte que la dose minimale efficace est recommandée.
TABLE 3. Toxicité systémique de la solution anesthésique locale.
| Système nerveux centrala |
| Étourdissements et vertiges |
| Troubles visuels et auditifs |
| Contractions musculaires et tremblements |
| Convulsions généralisées |
| Cardiovasculaire |
| Effets cardiaques directs |
| Phase rapide déprimée de repolarisation des fibres de Purkinje |
| Déclenchement spontané déprimé du nœud sino-auriculaire |
| Effet inotrope négatif sur le muscle cardiaque |
| Influx de calcium altéré, entraînant une diminution de la contractilité myocardique |
| Effets sur le tonus vasculaire |
| Faibles concentrations : vasoconstriction |
| Hautes concentrations : vasodilatation |
| Augmentation de la résistance vasculaire pulmonaire |
Fait intéressant, Weintraud et al. ont constaté que les blocs ilioin-guinal guidés par échographie entraînaient des concentrations plasmatiques plus élevées par rapport aux techniques basées sur les points de repère. Cela peut être dû à une plus grande surface d'absorption créée en plaçant l'anesthésique local précisément dans un plan fascial par rapport aux multiples dépôts dans le muscle qui se produisent souvent avec une méthode basée sur les points de repère.
Conseils NYSORA
Prévention de la toxicité systémique dans la population pédiatrique
- Choisissez un médicament moins toxique (p. ex., lévobupivacaïne ou ropivacaïne).
- Ne pas dépasser la dose maximale (chez les nouveau-nés, il peut être prudent de réduire de moitié la dose maximale).
- Injecter de petites aliquotes et aspirer à plusieurs reprises.
- L'échographie permet d'utiliser des doses plus faibles de médicaments et de visualiser l'injection.
- Attention aux doses répétées et limiter les perfusions chez le nouveau-né à 48 heures.
- Une dose test contenant de l'épinéphrine peut être utilisée pour identifier l'injection intravasculaire, mais elle est limitée par l'anesthésique général administré.
- Quelle que soit la technique utilisée, tous les enfants, recevant une solution anesthésique locale, en particulier lorsqu'ils sont administrés en perfusion continue, doivent être surveillés en permanence pour détecter les effets indésirables.
Conseils NYSORA
Gestion de la toxicité des anesthésiques locaux
En pratique pédiatrique, les signes avant-coureurs et les symptômes de toxicité peuvent être masqués par l'administration concomitante d'une anesthésie générale. Cela signifie que le premier signe peut être une arythmie ou un collapsus cardiovasculaire. Tenez compte des éléments suivants lors de la prise en charge de la toxicité des anesthésiques locaux :
- Arrêtez l'injection d'anesthésique local.
- Instituez une assistance vitale de base et appelez à l'aide.
- Sécurisez les voies respiratoires, ventilez avec 100 % d'oxygène et obtenez un accès intraveineux.
- Les convulsions peuvent être gérées avec une benzodiazépine ou un agent d'induction anesthésique.
- Si un arrêt cardiaque s'est produit, commencer le maintien en vie avancé.
- A noter que les arythmies sont souvent réfractaires, et la réanimation doit donc être prolongée.
- Administration des lipides. L'Association of Anesthetists of Great Britain and Ireland a publié un protocole simple à suivre (Figure 1).
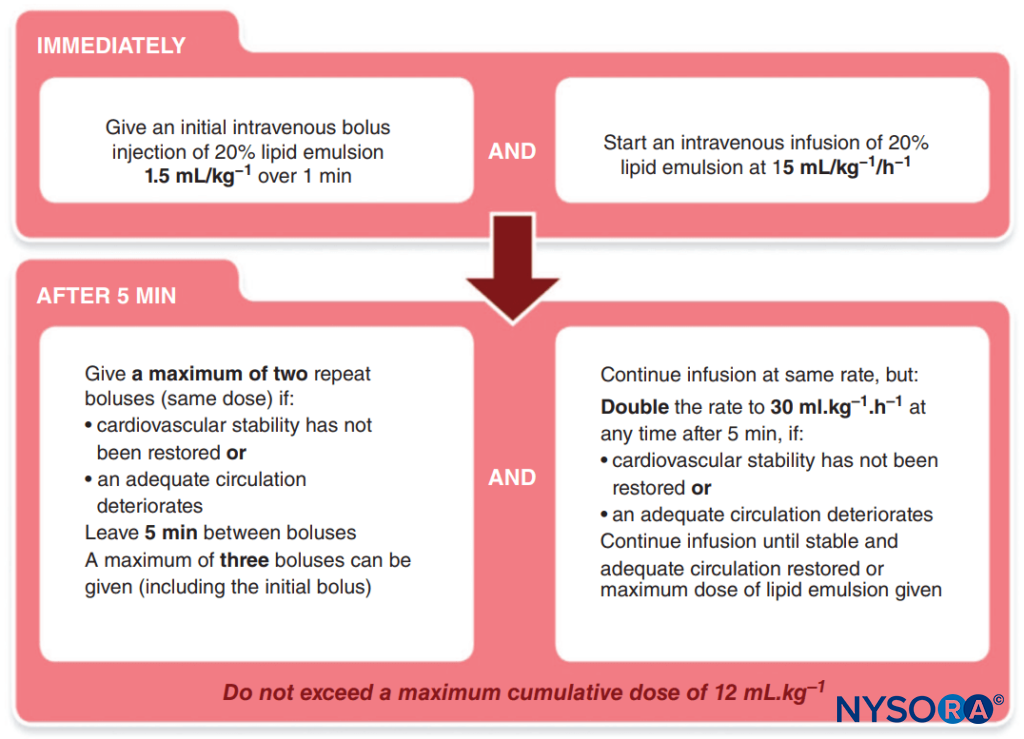
FIGURE 1. Protocole de l'Association des anesthésistes de Grande-Bretagne et d'Irlande (AAGBI) pour la toxicité des anesthésiques locaux.
ANESTHESIE TOPIQUE
Il est important de discuter de l'utilisation de l'anesthésie topique chez les enfants car elle est couramment utilisée dans la pratique clinique pour fournir une analgésie lors de la mise en place d'un cathéter intraveineux, d'une ponction lombaire et d'autres procédures invasives (par exemple, la circoncision chez les nouveau-nés). Les préparations les plus courantes comprennent la lidocaïne, la tétracaïne, la benzocaïne et la prilocaïne. La solution anesthésique topique pénètre à travers la peau pour fournir une analgésie. Les trois préparations les plus courantes disponibles comprennent le mélange eutectique d'anesthésiques locaux et locaux (EMLA), le LMX-4 (solution de lidocaïne liposomale à 4 %) et l'Ametop (gel d'améthocaïne à 4 %). EMLA contient de la lidocaïne et de la prilocaïne et doit être appliqué au moins une heure avant la canulation. Sa durée d'action n'est que de 30 à 60 minutes, bien qu'il puisse être laissé en place pendant 4 à 5 heures. Le LMX-4 ne nécessite que 30 minutes pour faire effet et peut également être laissé en place pendant 4 à 5 heures. Ametop nécessite 45 minutes pour faire effet et doit être retiré dans l'heure suivant l'application ; sa durée d'effet peut aller jusqu'à 3 heures, car il se lie aux protéines de la couche cornée. Ametop est vasodilatateur, ce qui peut faciliter la canulation. Cependant, Ametop peut provoquer un érythème et un œdème, qui peuvent obscurcir les veines.
Conseils NYSORA
Voici quelques considérations pour les enfants subissant une anesthésie régionale :
- L'anesthésie régionale est le plus souvent réalisée avec le patient sous anesthésie générale.
- La dose d'anesthésique local utilisée est beaucoup plus faible que pour les adultes et est calculée en milligrammes par kilogramme).
- Utilisez un anesthésique local à la concentration efficace la plus faible.
- Si une douleur modérée ou sévère est attendue, une physiothérapie intense requise après l'opération ou s'il existe des antécédents de douleur chronique, envisagez d'utiliser une technique de cathéter.
- Beaucoup moins de complications d'anesthésie régionale sont signalées chez les enfants que chez les adultes.
- Obtenez toujours l'assentiment ou le consentement du patient si l'enfant est plus âgé.
- Toujours expliquer la paresthésie postopératoire aux patients.
ÉVALUATION PRÉOPÉRATOIRE
La visite préopératoire est l'occasion d'évaluer et de préparer le patient et sa famille à la chirurgie proposée et à la technique d'anesthésie. Il est important que l'anesthésiste comprenne l'intervention chirurgicale envisagée afin de pouvoir prendre la décision d'effectuer une technique d'anesthésie régionale à injection unique ou continue. Généralement, le bloc le plus périphérique doit être choisi, car il présente généralement le risque le plus faible et le moins d'effets secondaires et sera donc plus acceptable pour le patient et les parents ou les soignants. Une technique de cathéter est recommandée pour les interventions chirurgicales modérées à majeures, les interventions nécessitant une physiothérapie postopératoire prolongée et pour les enfants souffrant de douleur chronique. Il est également important de s'assurer qu'il y aura du personnel infirmier formé pour gérer les techniques d'anesthésie régionale continue.
L'anesthésiste doit rechercher les contre-indications potentielles (p. ex. comorbidités) à une technique d'anesthésie régionale donnée. Une anamnèse complète de la douleur doit être prise, en recherchant spécifiquement des antécédents de douleur chronique ou de spasticité musculaire. Les enfants ayant des besoins spéciaux peuvent être particulièrement difficiles, et l'anesthésiste doit savoir comment l'enfant gère et exprime la douleur. L'examen anesthésique préopératoire standard doit inclure un examen du site d'insertion du bloc proposé pour identifier des éléments tels que des difficultés anatomiques (par exemple, une scoliose) et une infection locale. Chez les enfants atteints d'une maladie neurologique, leur déficit neurologique préopératoire doit être documenté. L'anesthésiste doit expliquer les avantages, les effets secondaires et les complications potentielles du plan d'anesthésie proposé à l'enfant et aux parents/tuteurs ; il est également prudent de discuter d'un « plan B » en cas d'échec de la technique proposée. Des stratégies analgésiques alternatives doivent être discutées afin qu'un consentement éclairé puisse être donné. En particulier, les paresthésies postopératoires de la technique régionale doivent être expliquées aux enfants dans des termes compréhensibles, car il s'agit souvent d'une expérience qu'ils ont du mal à vivre. Si une technique d'anesthésie régionale continue est utilisée, rassurez l'enfant que le retrait du cathéter ne sera pas douloureux. Les parents ou les soignants donnent généralement leur consentement pour une procédure pour leur enfant. Cependant, si l'enfant a la capacité cognitive de discerner le bien du mal, il est suggéré d'obtenir également l'assentiment de l'enfant pour une technique régionale. Il y a un débat quant à savoir quand ou quel peut être cet âge. Si un enfant refuse d'avoir une procédure régionale malgré l'insistance des parents ou des soignants, il est important que l'anesthésiste propose une modalité alternative de soulagement de la douleur.
Une prémédication analgésique avec du paracétamol (acétaminophène) et un anti-inflammatoire non stéroïdien (AINS) doit être envisagée, en particulier lorsque l'on sait que le bloc ne fournira pas une analgésie totale (p. ex., un bloc du plan transversal de l'abdomen [TAP] pour une appendicectomie). Les instructions postopératoires doivent être données en préopératoire et renforcées en postopératoire à la sortie.
ANESTHÉSIE RÉGIONALE : ÉVEILLÉ OU ENDORMI ?
La question de savoir s'il est préférable pour le patient d'être éveillé ou endormi pendant l'anesthésie régionale a été une question controversée chez les adultes, et ce débat a déjà imprégné le domaine de la pratique de l'anesthésie régionale pédiatrique. Placer un bloc régional chez un enfant éveillé est difficile en raison de l'incapacité de l'enfant à coopérer ainsi que de l'incapacité cognitive de l'enfant à se rapporter à des symptômes tels que la paresthésie ou la douleur. Par conséquent, il est préférable de fournir à l'enfant une technique régionale sous sédation profonde ou après l'induction d'une anesthésie générale ; cette pratique a été le consensus des anesthésiologistes pédiatriques aux États-Unis ainsi qu'à l'étranger pendant un certain temps.
Cependant, il existe deux scénarios dans lesquels des techniques régionales éveillées sont utilisées chez les enfants. Premièrement, on pensait qu'en évitant l'anesthésie générale chez les prématurés subissant une chirurgie mineure, l'incidence de l'apnée postopératoire pourrait être réduite. C'est probablement moins un problème maintenant que les poumons des nouveau-nés prématurés sont mieux protégés et avec la disponibilité de nouveaux agents d'inhalation qui permettent une émergence plus rapide.
Deuxièmement, l'enfant plus mature peut être considéré comme apte à une technique régionale éveillée lorsqu'il subit une chirurgie mineure s'il le préfère ou lorsqu'une anesthésie générale est considérée comme trop risquée (p. ex., biopsie ganglionnaire chez un adolescent avec une masse médiastinale). Pour les patients plus âgés, il est essentiel de préparer l'enfant et les parents ou soignants à l'ensemble de la visite en salle d'opération, et pas seulement à l'insertion du bloc. L'insertion du bloc peut être rendue plus confortable en appliquant une crème anesthésiante topique (EMLA a la meilleure pénétration) sur le site d'injection proposé. Pendant la visite au bloc opératoire, l'enfant doit être soutenu et distrait par une infirmière ou un spécialiste du jeu. L'enfant peut également trouver l'utilisation d'un lecteur DVD ou MP3 une distraction utile. Il peut être nécessaire d'utiliser du protoxyde d'azote (Entonox) ou des doses anxiolytiques de propofol ou de rémifentanil pour faciliter la procédure. Marhofer et al. ont montré que dans le scénario de traumatisme pédiatrique, les blocs du plexus brachial sont insérés plus confortablement avec l'échographie qu'avec la stimulation nerveuse. Dans les hôpitaux pédiatriques, il faut rappeler au personnel de la salle d'opération et au chirurgien que le patient sera éveillé et que les médicaments et l'équipement nécessaires pour passer à l'anesthésie générale doivent être prêts.
GESTION DU BLOC PÉRIOPÉRATOIRE
Certaines règles simples doivent être suivies lors de l'exécution de toute technique d'anesthésie régionale chez les enfants. Un assistant qualifié doit être présent à tout moment, et cette personne doit comprendre les principes de base de l'anesthésie régionale, en particulier la nécessité d'aspirer régulièrement avant l'injection, la nécessité d'avertir l'anesthésiste de la résistance à l'injection. De plus, l'assistant doit être capable d'effectuer des ajustements de base sur le stimulateur nerveux périphérique (PNS) et les machines US.
L'enfant doit avoir des voies respiratoires sécurisées, un accès intraveineux et une surveillance complète avant de commencer le bloc. Dans le cadre de la liste de contrôle de sécurité chirurgicale de l'Organisation mondiale de la santé (OMS), le consentement et le côté de la chirurgie sont vérifiés, et juste avant l'insertion du bloc, le site doit à nouveau être confirmé avec l'assistant de l'anesthésiste.
L'enfant, l'échographe (lorsqu'il est utilisé), l'équipement et l'anesthésiste doivent être positionnés de manière ergonomique.
Il y a un débat sur les normes minimales d'asepsie pour l'anesthésie régionale. Pour les techniques à injection unique, il suffit de se frotter les mains, de porter des gants stériles, d'appliquer une solution alcoolique sur la peau du patient et de recouvrir la sonde US. Pour les techniques de cathéter, une technique aseptique plus rigoureuse est conseillée. Lors de l'exécution de toute technique de cathéter, il est utile lors du drapage de l'enfant d'avoir une grande zone d'anatomie visible ; cela permet à l'anesthésiologiste d'avoir suffisamment d'espace pour effectuer une cartographie/un balayage de reconnaissance et également une meilleure vue, et donc une meilleure appréciation, de l'anatomie du patient (particulièrement important lors de la mise en place de péridurales chez les enfants atteints de scoliose). Il peut être avantageux de tunneliser le cathéter, car cela facilite la fixation et, dans certains cas, peut réduire le risque d'infection (p. ex., avec un cathéter caudal, le cathéter peut être tunnelisé loin de la zone de la couche).
Il n'y a pas de dose test idéale ; par conséquent, une aspiration fréquente et répétée pendant l'injection est suggérée. Lorsqu'il n'est pas prévu que le bloc couvre tous les aspects de la douleur chirurgicale (p. per rectum pour faciliter l'analgésie. D'autres adjuvants peuvent s'avérer bénéfiques (p. ex., le sulfate de magnésium peropératoire à 50 mg/kg peut diminuer les spasmes musculaires postopératoires chez les patients atteints de paralysie cérébrale subissant une chirurgie des membres inférieurs).
L'auteur est d'avis que, dans la mesure du possible, l'efficacité de la technique d'anesthésie régionale ne doit pas être obscurcie par l'administration d'opioïdes ou de protoxyde d'azote. Il est important lors de l'évaluation peropératoire du bloc que toute modification de la fréquence cardiaque et de la pression artérielle soit notée et liée à la procédure chirurgicale spécifique à ce moment-là. Cela permet de planifier des blocs de secours en fin de procédure. Même avec des blocs réussis, des réponses cardiovasculaires occasionnelles à des stimuli chirurgicaux peuvent se produire, car les blocs sont généralement effectués en utilisant une concentration plus faible d'anesthésique local (par exemple, 0.25 % de lévobupivacaïne) et, si un garrot est utilisé, une augmentation progressive de la fréquence cardiaque et la pression artérielle se produira après les 30 à 40 premières minutes.
Le degré de stabilité cardiovasculaire peropératoire aide l'anesthésiste à décider si la détresse du patient au cours de la première étape de la convalescence est due à la douleur ou à une autre cause (p. ex., délire d'émergence). bouleversé, il faut supposer que le patient souffre, et cela doit être rapidement traité en administrant un opiacé à action rapide (par exemple, le fentanyl).
SOINS POSTOPÉRATOIRES
Les conseils postopératoires relatifs à la protection de la zone anesthésiée doivent être donnés verbalement en préopératoire et répétés en postopératoire, et des instructions écrites doivent également être données à la famille. La famille et l'enfant doivent être avertis de la faiblesse musculaire et de la diminution des sensations. Des harnais doivent être fournis aux patients pédiatriques présentant des blocs des membres supérieurs. Les enfants ambulatoires avec des blocs des membres inférieurs devraient avoir les moyens de se mobiliser et de rentrer chez eux organisés. Chaque établissement doit avoir des lignes directrices pour les soins infirmiers aux patients hospitalisés et le suivi des techniques d'anesthésie régionale, et le personnel doit recevoir une formation régulière sur la gestion des blocs régionaux postopératoires et les soins du membre anesthésié. Il est généralement plus économique et plus sûr de placer les patients sous anesthésie régionale et analgésie dans des services spécifiques. (Pour plus d'informations sur ce sujet, voir Gestion de la douleur aiguë et chronique chez les enfants.)
ENTRAÎNEMENT
La formation des anesthésistes en anesthésie régionale pédiatrique et en anatomie est essentielle pour sa mise en œuvre réussie et sécuritaire. Dans la mesure du possible, chaque département doit proposer une approche structurée de l'enseignement des blocs simples communs : caudal, pénien, fémoral, axillaire, ilio-inguinal et droit. La formation devrait inclure les techniques d'échographie et d'aiguilletage. Une fois que les compétences de base en aiguilletage aux États-Unis ont été acquises sur des fantômes et que les compétences de numérisation ont été développées sur des volontaires adultes, ces compétences peuvent ensuite être transférées en milieu clinique. En règle générale, ces techniques sont d'abord plus faciles et plus sûres pour les patients plus âgés.
Conseils NYSORA
Dans la mesure du possible, chaque département doit proposer une approche structurée de l'enseignement des blocs communs : caudal, pénien, fémoral, axillaire, ilio-inguinal et droit.
RÉSUMÉ
L'anesthésie régionale améliore l'expérience postopératoire des enfants et des parents ou des soignants et facilite l'utilisation efficace des installations hospitalières et on s'attend à ce que l'utilisation de l'anesthésie régionale chez les enfants continue de gagner en popularité. Les techniques d'anesthésie régionale doivent fournir le juste équilibre entre les risques et les avantages pour les enfants et la chirurgie d'aujourd'hui. Les États-Unis permettent à un plus grand nombre de blocs périphériques d'être utilisés de manière plus sûre et fiable chez les enfants. La technologie est importante, mais ne remplace pas une solide compréhension de l'anatomie et un niveau élevé de pratique générale sécuritaire.
Références
- Giaufre E, Dalens B, Gombert A : Epidémiologie et morbidité de l'anesthésie locorégionale chez l'enfant : enquête prospective sur un an de la Société francophone des anesthésistes pédiatres. Anesth Analg 1996;83:904–912.
- Ecoffey C, Lacroix F, Giaufre E et al : Épidémiologie et morbidité de l'anesthésie locorégionale chez l'enfant : enquête prospective de suivi sur un an de la Société francophone des anesthésistes pédiatres (ADARPEF). Pediatr Anesth 2010;20:1061–1069.
- Taddio A, Katz J, Ilersich AL, Koren G : Effet de la circoncision néonatale sur la réponse à la douleur lors de la vaccination de routine ultérieure [voir les commentaires]. Lancet 1997;349:599–503.
- Peutrell JM, Mather SJ : Anesthésie régionale chez les bébés et les enfants. Oxford : presse universitaire d'Oxford, 1997.
- Suresh S, Wheeler M : Anesthésie régionale pédiatrique pratique. Anesthesiol Clin North Am 2002;20:83–113.
- Fitzgerald M, Walker SM : Gestion de la douleur infantile : une approche développementale neurobiologique. Nat Clin Pract Neurol 2009;5:35–50.
- Mazoit JX, Dalens BJ : Pharmacocinétique des anesthésiques locaux chez le nourrisson et l'enfant. Clin Pharmacokinet 2004;43:17–32.
- Besunder JB, Reed MD, Blumer JL : Principes de la biodisposition des médicaments chez le nouveau-né. Une évaluation critique de l'interface pharmacocinétique-pharmacodynamique (Partie I). Clin Pharmacokinet 1988;14 : 189–216.
- Besunder JB, Reed MD, Blumer JL : Principes de la biodisposition des médicaments chez le nouveau-né. Une évaluation critique de l'interface pharmacocinétique-pharmacodynamique (Partie II). Clin Pharmacokinet 1988;14 : 261–286.
- Mazoit JX, Denson DD, Samii K : Pharmacocinétique de la bupivacaïne après anesthésie caudale chez le nourrisson. Anesthésiologie 1988 ; 68 : 387–391.
- Ecoffey C, Desparmet J, Maury M, et al : Bupivacaïne chez l'enfant : pharmacocinétique après anesthésie caudale. Anesthésiologie 1985;63 : 447–448.
- Murat I, Montay G, Delleur MM, et al : pharmacocinétique de la bupivacaïne pendant l'anesthésie péridurale chez l'enfant. Eur J Anaesthesiol 1988;5 : 113–120.
- Berde CB : Toxicité des anesthésiques locaux chez le nourrisson et l'enfant. [Examen]. J Pediatr 1993;122(Pt 2):S14–S20.
- Petitjeans F, Mion G, Puidupin M, et al : Tachycardie et convulsions induites par une injection intravasculaire accidentelle de ropivacaïne lors d'un bloc sciatique. Acta Anesthesiol Scand 2002;46:616–617.
- Ivani G, Mereto N, Lampugnani E, et al : Ropivacaïne en chirurgie pédiatrique : résultats préliminaires. Paediatr Anaesth 1998;8:127–129.
- Ivani G, Mazzarello G, Lampugnani E, DeNegri P, Torre M, Lonnqvist PA : Ropivacaïne pour les blocs centraux chez les enfants. Anesthésie 1998;53(Suppl 2): 74–76.
- Ala-Kokko TI, Partanen A, Karinen J, et al : Pharmacocinétique de 0.2 % de ropivacaïne et de 0.2 % de bupivacaïne après des blocs caudaux chez les enfants. Acta Anaesthesiol Scand 2000;44:1099–1102.
- Dalens B, Ecoffey C, Joly A, et al : pharmacocinétique et effet analgésique de la ropivacaïne après un bloc nerveux ilio-inguinal/iliohypogastrique chez les enfants. Paediatr Anaesth 2001;11:415–420.
- Fernandez-Guisasola J, Andueza A, Burgos E, et al : une comparaison de 0.5 % de ropivacaïne et de 1 % de mépivacaïne pour le bloc du nerf sciatique dans la fosse poplitée. Acta Anaesthesiol Scand 2001;45:967–970.
- Ivani G, DeNegri P, Lonnqvist PA, et al : une comparaison de trois concentrations différentes de lévobupivacaïne pour le bloc caudal chez les enfants (tableau). Anesth Analg 2003;97:368–371.
- Lerman J, Nolan J, Eyres R, et al : Efficacité, innocuité et pharmacocinétique de la lévobupivacaïne avec et sans fentanyl après une perfusion épidurale continue chez les enfants : un essai multicentrique. Anesthésiologie 2003;99 : 1166–1174.
- Ala-Kokko TI, Raiha E, Karinen J, et al : Pharmacocinétique de la lévobupivacaïne à 0.5 % après un bloc nerveux ilio-inguinal-iliohypogastrique chez les enfants. Acta Anaesthesiol Scand 2005;49:397–400.
- Foster RH, Markham A : Lévobupivacaïne : un examen de sa pharmacologie et de son utilisation comme anesthésique local. Drogues 2000;59:551–579.
- Mather LE, Huang YF, Veering B, Pryor ME : Pharmacocinétique systémique et régionale des énantiomères de la lévobupivacaïne et de la bupivacaïne chez le mouton. Anesth Analg 1998;86:805–811.
- Tobias JD, O'Dell N : Chloroprocaïne pour l'anesthésie péridurale chez les nourrissons et les enfants. AANA J 1995;63:131–135.
- Raj PP, Ohlweiler D, Hitt BA, Denson DD : Cinétique des esters anesthésiques locaux et effets des médicaments adjuvants sur l'hydrolyse de la 2-chloroprocaïne. Anesthésiologie 1980 ; 53 : 307–314.
- Tobias JD, Rasmussen GE, Holcomb GW III, et al : Anesthésie caudale continue avec de la chloroprocaïne en complément de l'anesthésie générale chez les nouveau-nés. Can J Anaesth 1996;43:69–72.
- Crowhust JA : Déficit en cholinestérase. Anaesth Intensive Care 1983;11:7–9.
- Kuhnert BR, Philipson EH, Pimental R, Kuhnert PM : Un bloc épidural prolongé de chloroprocaïne chez une patiente en post-partum avec une pseudocholinestérase anormale. Anesthésiologie 1982 ; 56 : 477–478.
- Monedero P, Hess P : bloc péridural élevé avec chloroprocaïne chez une parturiente à faible activité pseudocholinestérase. Can J Anaesth 2001;48:318–319.
- Kuhnert BR, Kuhnert PM, Prochaska AL, Gross TL : taux plasmatiques de 2-chloroprocaïne chez les patientes obstétricales et leurs nouveau-nés après une anesthésie péridurale. Anesthésiologie 1980 ; 53 : 21–25.
- Henderson K, Sethna NF, Berde CB : Anesthésie caudale continue pour la réparation de la hernie inguinale chez les anciens prématurés. J Clin Anesth 1993;5 : 129–133.
- Krane EJ, Haberkern CM, Jacobson LE : Apnée postopératoire, bradycardie et désaturation en oxygène chez les nourrissons autrefois prématurés : comparaison prospective de l'anesthésie rachidienne et générale. Anesth Analg 1995;80 : 7–13.
- Henderson K, Sethna NF, Berde CB : Anesthésie caudale continue pour la réparation de la hernie inguinale chez les anciens prématurés. J Clin Anesth 1993;5:129–133.
- Suresh S, Cote CJ : Anesthésiques locaux pour nourrissons et enfants. Dans Yaffe SJ, Aranda JV (eds): Pharmacologie néonatale et pédiatrique, Principes thérapeutiques en pratique, 3e éd. Philadelphie : Lippincott Williams & Wilkins, 2004.
- Frumiento C, Abajian JC, Vane DW : Anesthésie rachidienne pour les prématurés subissant une réparation de hernie inguinale. Arch Surg 2000;135:445–451.
- Kasten GW, Martin ST : Toxicité cardiovasculaire de la bupivacaïne : comparaison du traitement au brétylium et à la lidocaïne. Anesth Analg 1985;64:911–916.
- Murat I, Esteve C, Montay G, et al : pharmacocinétique et effets cardiovasculaires de la bupivacaïne pendant l'anesthésie péridurale chez les enfants atteints de dystrophie musculaire de Duchenne. Anesthésiologie 1987 ; 67 : 249–252.
- Graf BM : La cardiotoxicité des anesthésiques locaux : la place de la ropivacaïne. Curr Top Med Chem 2001;1:207–214.
- Bergman BD, Hebl JR, Kent J, Horlocker TT : Complications neurologiques de 405 cathéters axillaires continus consécutifs (tableau). Anesth Analg 2003;96:247–252.
- Berde CB : Convulsions associées à l'anesthésie régionale pédiatrique [commentaire éditorial] [voir commentaires]. Anesth Analg 1992;75:164–166.
- Weintraud M, Lundblad M, Kettner SC et al : Échographie versus technique basée sur les points de repère pour le bloc nerveux ilio-inguinal-iliohypogastrique chez les enfants : les implications sur les taux plasmatiques de ropivacaïne. Anesth Analg 2009;108:1488–1492.
- Ludot H, Tharin JY, Belouadah M, et al : Réanimation réussie après une arythmie vebtriculaire induite par la ropivacaïne et la lidocaïne suite à un bloc du plexus lombaire postérieur chez un enfant. Anesth Analg 2008;106 : 1572–1574.
- Acharya AB, Bustani PC, Phillips JD, et al : essai contrôlé randomisé d'un mélange eutectique de crème anesthésique locale pour la ponction veineuse chez les prématurés en bonne santé. Arch Dis Child Fetal Neonatal Ed 1998;78:F138–F142.
- Benini F, Johnston CC, Faucher D, Aranda JV : Anesthésie topique pendant la circoncision chez les nouveau-nés. JAMA 1993;270:850–853.
- Gourrier E, Karoubi P, el Hanache A, et al : Utilisation de la crème EMLA dans un service de néonatologie. Douleur 1996 ; 68 : 431–434.
- Eichenfield LF, Funk A, Fallon-Friedlander S, Cunningham BB : Une étude clinique pour évaluer l'efficacité d'ELA-Max (lidocaïne liposomale à 4 %) par rapport à un mélange eutectique de crème anesthésique locale pour la réduction de la douleur de la ponction veineuse chez les enfants. Pédiatrie 2002;109:1093–1099.
- Jain A, Rutter N : Gel topique d'améthocaïne chez le nouveau-né : combien de temps agit-il et combien de temps dure-t-il ? Arch Dis Child Fetal Neonatal Ed 2000:83:F211–214.
- Tait AR, Voepel-Lewis T, Malviya S : Comprennent-ils ? (Partie II) : consentement des enfants participant à la recherche clinique en anesthésie et chirurgie. Anesthésiologie 2003;98:609–614.
- Krane EJ, Dalens BJ, Murat I, Murrell D : La sécurité des péridurales placées pendant l'anesthésie générale. Reg Anesth Pain Med 1998;23:433–438.
- Marhofer P, Sitzwohl C, GreherM, Kapral S : guidage échographique pour l'anesthésie du plexus brachial sous-claviculaire chez les enfants. Anesthésie 2004 ; 59 : 642–646.

