Holly Evans, Karen C. Nielsen, M. Steve Melton, Roy A. Greengrass, et Susan M. Steele
INTRODUCTION
Les blocs nerveux périphériques continus (CPNB) offrent un certain nombre d'avantages dans la période périopératoire. Ces techniques offrent la souplesse nécessaire pour prolonger l'anesthésie peropératoire tout en évitant les risques et les effets secondaires de l'anesthésie générale. Après la chirurgie, les CPNB offrent une analgésie postopératoire prolongée. Par rapport à l'analgésie opioïde parentérale, les CPNB sont associés à une analgésie supérieure, à une consommation réduite d'opioïdes et à une diminution des effets secondaires liés aux opioïdes tels que les nausées et vomissements postopératoires, la sédation et la dépression respiratoire. Une analgésie de qualité similaire à l'anesthésie péridurale en est le résultat ; cependant, moins d'hypotension, de rétention urinaire, de prurit et de restrictions de mobilité se produisent avec les CPNB.
Il existe également des preuves soutenant l'effet bénéfique des CPNB sur les habitudes de sommeil postopératoires et la fonction cognitive ainsi que sur la réadaptation précoce. La sympathectomie concomitante est idéale après une chirurgie microvasculaire, de réimplantation et à lambeau libre, ainsi que pour le traitement d'une injection intra-artérielle accidentelle de médicament. Une analgésie prolongée peut également être fournie aux patients souffrant de douleur chronique et à ceux nécessitant des soins palliatifs pour une maladie en phase terminale. Enfin, l'utilisation préopératoire peut réduire la sensation de membre fantôme chez les patients subissant une amputation.
Malgré ces avantages, les CPNB ont toujours été relativement sous-utilisés. Ce manque de popularité précoce était multifactoriel; cependant, l'équipement inadéquat du CPNB y a probablement contribué. Le développement des aiguilles CPNB, des cathéters et de la technologie de localisation nerveuse a été essentiel pour l'utilisation sûre et l'avancement de ces techniques d'anesthésie régionale. Ce chapitre résume l'équipement requis pour l'anesthésie continue du plexus et passera en revue la chronologie du développement de l'équipement PCNB moderne.
CONSIDÉRATIONS PRÉ-BLOCAGE
Salle de bloc
Un cathéter périneural peut être placé dans une salle de bloc juste au moment où la procédure du patient précédent se termine. Cela améliore l'efficacité et le flux de la salle d'opération. Une salle de bloc permet aux fournitures et aux moniteurs discutés ci-après d'être stockés et stockés en un seul endroit. La salle de bloc doit être une pièce propre et semi-stérile située à proximité de la salle d'opération.
Bloquer le panier
Tableau 1 décrit les fournitures de chariots blocs nécessaires à la performance des CPNB. Les fournitures sont stériles le cas échéant.
TABLEAU 1 Chariot à blocs fournitures nécessaires pour les blocs nerveux périphériques continus.
- Gants stériles ± blouse pour anesthésiste
- Solution désinfectante (gluconate de chlorhexidine à 2 % et alcool isopropylique à 70 %)
- Rideaux transparents
- Aiguilles pour l'infiltration anesthésique locale sous-cutanée (c.-à-d. calibre 25 1½ pouce)
- Seringues pour infiltration sous-cutanée d'anesthésique local (c'est-à-dire 3 ml)
- Gaze 2 × 2 po
- Sélection d'aiguilles de bloc et d'ensembles de cathéters de diamètre et de longueur appropriés
- Stimulateur nerveux et électrodes
- Machine à ultrasons
- Sélection de sondes à ultrasons de fréquence, de forme et de taille appropriées
- Housses stériles pour sondes à ultrasons
- Gel stérile pour échographie
- Dextrose 5 % dans l'eauAnesthésiques locaux et adjuvants (voir ci-dessous)
- Pansement occlusif, Epi-Guard, tape, Mastisol, Dermabond®
- Connecteurs pour l'extrémité proximale du cathéter
- Source d'oxygène
- Masques à oxygène
- Succion
Le Monitoring
Les patients recevant un cathéter périneural reçoivent souvent une sédation et de fortes doses d'anesthésique local. Ils devraient avoir des moniteurs standard de l'American Society of Anesthesiologists (ASA). De plus, ces patients doivent être surveillés par une personne ayant des connaissances et des compétences en réanimation cardiaque avancée (ACLS).
Médicaments et équipement de réanimation
Un certain nombre de complications potentiellement mortelles peuvent survenir lors de la mise en place d'un CPNB. Tableau 2 répertorie les médicaments et l'équipement de réanimation qui doivent être facilement disponibles.
TABLE 2. Médicaments et équipements de réanimation nécessaires.
- Médicaments ACLS (c.-à-d. épinéphrine, vasopressine, atropine)
- Cardioverter/défibrillateur
- Intralipid® 20 % (bolus de 1.5 mL/kg sur 1 minute et toutes les 3 à 5 minutes jusqu'à 3 mL/kg, perfusion de 0.25 mL/kg/min, dose totale maximale de 8 mL/kg)
Prémédication et sédation
Tableau 3 énumère divers agents qui peuvent être utilisés pour procurer une sédation et une analgésie lors de la mise en place d'un cathéter périneural. La plupart préconisent l'utilisation d'une sédation légère, permettant ainsi la communication avec le patient concernant les effets secondaires potentiels.
TABLE 3. Agents de sédation et d'analgésie pour la mise en place d'un cathéter périneural.
- Benzodiazépines (c'est-à-dire midazolam)
- Opiacés (c.-à-d. Fentanyl)
- Antagonistes du N-méthyl-aspartate (c.-à-d. kétamine)
- Antagonistes alpha-2 (c.-à-d. clonidine, dexmédétomidine)
- Anesthésiques (c'est-à-dire propofol, étomidate)
Les solutions anesthésiques locales et les adjuvants bloquent l'initiation
Une variété d'anesthésiques locaux doit être disponible sur le chariot de bloc pour initier le bloc nerveux. Les agents à courte durée d'action tels que la lidocaïne ou la mépivacaïne permettent une apparition rapide mais une récupération précoce du bloc sensorimoteur. Cela facilite l'évaluation rapide de la fonction neurologique après la chirurgie et avant de commencer une perfusion périneurale continue. L'initiation du bloc avec des agents à action prolongée tels que la bupivacaïne ou la ropivacaïne prolonge la durée de l'anesthésie et de l'analgésie denses. La ropivacaïne est souvent choisie à la place de la bupivacaïne pour son profil de sécurité plus favorable. Les solutions concentrées assurent une anesthésie et une analgésie peropératoire efficaces. Les solutions anesthésiques locales diluées peuvent fournir une anesthésie sensorielle sélective tout en minimisant le bloc moteur après la chirurgie.
Le cas échéant, de l'épinéphrine 1:200,000 1 ou 400,000:XNUMX XNUMX est ajoutée à la solution anesthésique locale. L'épinéphrine sert de marqueur d'injection intravasculaire et peut limiter l'absorption systémique de l'anesthésique local administré par voie périneurale.
D'autres adjuvants tels que la clonidine et la dexaméthasone ont été utilisés pour améliorer la durée et la qualité de l'analgésie.
Infusion continue
Le bloc nerveux est généralement maintenu avec une perfusion continue d'anesthésique local dilué à action prolongée. Des bolus contrôlés par le patient sont souvent ajoutés à la perfusion continue pour améliorer l'analgésie. La solution anesthésique locale doit être préparée dans un environnement propre, comme dans une pharmacie à l'aide d'une paillasse à flux laminaire. Minimiser la contamination bactérienne est essentiel pour réduire la probabilité de complications neurologiques infectieuses.
Conseils NYSORA
- La pratique sécuritaire de l'anesthésie régionale nécessite la disponibilité immédiate de moniteurs, de médicaments de réanimation et d'équipement ainsi que d'un professionnel de la santé connaissant les protocoles de l'ACLS.
SYSTÈMES D'AIGUILLE ET DE CATHÉTER
Perspective historique
Le premier rapport du CPNB est attribué aux travaux d'Ansbro de 1946 (Figure 1). Il a attaché une aiguille émoussée malléable au tube d'injection et à une seringue. L'aiguille a été placée à l'aveugle dans la zone supraclaviculaire latérale aux pulsations de l'artère sous-clavière et à environ 1 cm céphalique du point médian de la clavicule. Un bouchon de liège provenant d'une boîte d'éther a été utilisé pour maintenir l'aiguille en place. Des injections intermittentes de procaïne ont été administrées à 27 patients pour prolonger la durée de l'anesthésie peropératoire jusqu'à 4 heures et 20 minutes.
Près d'un quart de siècle plus tard, des blocs continus sous-claviers périvasculaires, interscalènes et axillaires du plexus brachial ont été rapportés par DeKrey et al, Winnie et Selander (Figure 2), respectivement. Dans tous les rapports, les auteurs ont utilisé un ensemble aiguille et canule de type intraveineux. Le plexus brachial a été identifié avec une paresthésie ou une technique de pop fasciale, l'aiguille interne a été retirée et la canule en plastique externe a été avancée dans un emplacement périneural.
Alors que ces premiers récits impliquaient principalement des dispositifs «canule sur aiguille», les descriptions ultérieures incluaient également des équipements «cathéter à travers l'aiguille». Dans le premier rapport d'un bloc continu des membres inférieurs, Brands et Callahan ont effectué des blocs continus du plexus lombaire qui ont duré de 72 à 96 heures pour les patients qui ont subi des fractures du col du fémur. Les auteurs ont utilisé une aiguille de calibre 18, de 15 cm de long et la méthode de perte de résistance pour identifier le compartiment psoas du plexus lombaire et ont ensuite enfilé un cathéter péridural à travers l'aiguille.
L'identification des caractéristiques neuroanatomiques importantes s'est produite en même temps que la description de ces premiers CPNB. Ces connaissances ont contribué à une meilleure compréhension de l'anatomie du plexus et au développement de techniques d'anesthésie régionale continue. Des articles marquants ont été publiés par Winnie ainsi que Thompson et Rorie décrivant l'existence d'une gaine du plexus brachial et suggérant le potentiel d'une anesthésie continue du plexus. Tuominen et al ont fourni des preuves précoces de l'innocuité des perfusions continues d'anesthésique local dans le plexus lorsqu'ils ont étudié les taux sanguins de bupivacaïne pendant la perfusion continue du plexus brachial axillaire.
Reflétant la popularité des techniques de paresthésie, de fascia pop et de perte de résistance des années 1970 au début des années 1990, la majorité des rapports ultérieurs de CPNB impliquaient également l'utilisation d'aiguilles et de canules de type intraveineux (dispositifs canule sur aiguille ) ainsi que des aiguilles et cathéters de type péridural (équipement cathéter traversant l'aiguille).
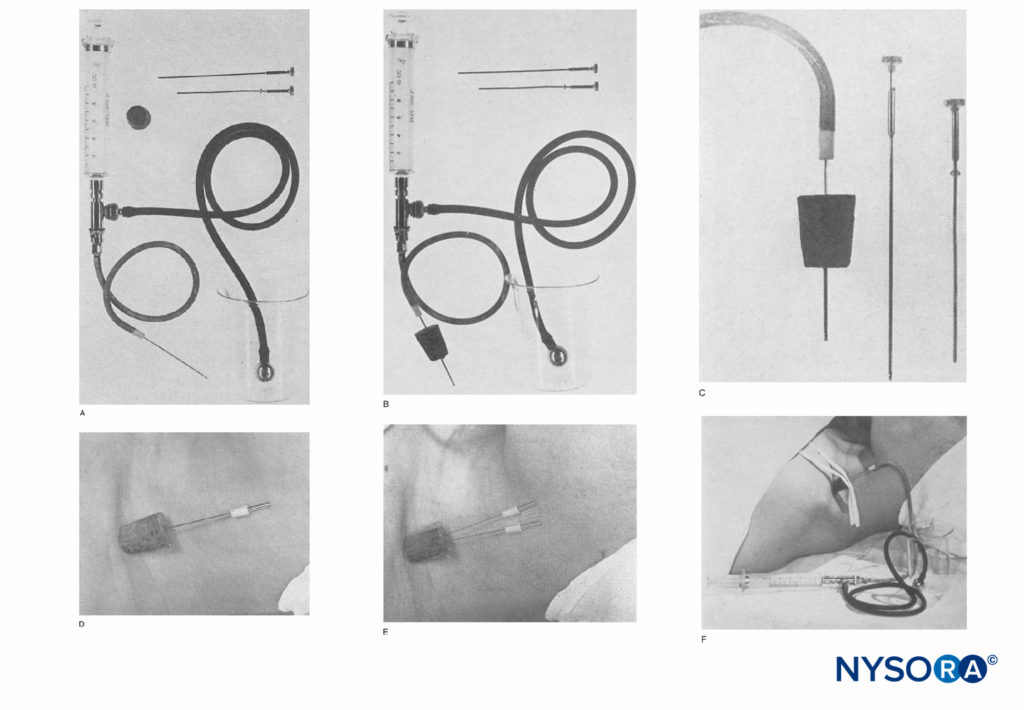
FIGURE 1. R : L'appareil se compose d'une seringue Luer Lock de 10 mL et de la valve à deux voies utilisée dans la méthode caudale continue Hingson-Edwards. Le tube peut être de n'importe quelle longueur désirée (18 pouces est suffisant). Une aiguille malléable (Becton-Dickinson & Company) qui a été limée jusqu'à une extrémité émoussée pour empêcher la perforation des vaisseaux sanguins est utilisée. Un bouchon de liège d'un bidon d'éther complète l'appareil. B : Appareil avec aiguille à travers le bouchon, généralement de 4 à 6 cm. C : Vue rapprochée de l'aiguille émoussée à travers le protège-bouchon. Le bouchon, lorsqu'il est placé au ras de la peau dans la zone sus-claviculaire, empêche l'aiguille de pénétrer plus profondément. D : Aiguille en place dans la région sus-claviculaire. Le liège empêche le déplacement vers l'intérieur et le maintient droit.

FIGURE 2. A, B : la canule de Venflon. (Reproduit avec la permission de Selander D: Catheter technique in axillary plexus block. Presentation of a new method. Acta Anaesthesiol Scand. 1977;21(4):324-329.)
Développement de systèmes isolés
À la fin des années 1970, des inquiétudes sont apparues dans la littérature sur l'anesthésie régionale concernant le potentiel des aiguilles à long biseau et de la technique de paresthésie à provoquer des complications neurologiques. L'introduction des techniques de stimulation nerveuse a entraîné une baisse de la popularité des méthodes de paresthésie, de fascia pop et de perte ou de résistance au profit de l'identification des structures neurales par électrolocalisation. Des aiguilles non isolées à biseau court pourraient être utilisées avec des stimulateurs nerveux; cependant, les aiguilles isolées se sont avérées fournir une sortie de courant plus focalisée et, par conséquent, une localisation plus précise des structures neuronales. Au fur et à mesure que les techniques de stimulation nerveuse se sont répandues dans les années 1990, des aiguilles à injection unique isolées dans le commerce sont devenues disponibles, mais la conception des aiguilles et des cathéters CPNB n'a initialement pas suivi le rythme. Pendant de nombreuses années, les anesthésistes régionaux ont assemblé des équipements d'accès intraveineux, rachidien et épidural pour créer leur propre appareil CPNB isolé.
De nombreux rapports ont décrit la connexion d'une aiguille intraveineuse et d'une canule à une source de courant pour permettre la stimulation nerveuse. Par exemple, Anker-Moller et al ont adapté un ensemble d'aiguilles et de canules intraveineuses de calibre 14 (Viggo, Suède) pour fournir un bloc nerveux fémoral continu. Le stimulateur nerveux était fixé à l'intérieur du moyeu de l'aiguille métallique. Le nerf fémoral a été identifié à l'aide d'un stimulateur nerveux, l'aiguille interne a été retirée et un cathéter épidural de calibre 16 (Portex, Royaume-Uni) a été inséré dans la canule intraveineuse (Figure 3).
Ben-David et al ont inséré l'aiguille métallique d'un cathéter intraveineux de calibre 20 (Venflon, Viggo, Suède) à l'intérieur de l'extrémité proximale d'une aiguille de pression veineuse centrale de calibre 16 (Secalon, Viggo, Suède). Ils ont attaché l'électrode négative du stimulateur nerveux à l'aiguille métallique exposée du cathéter intraveineux de calibre 20 et ont obtenu une stimulation appropriée pendant le bloc du plexus lombaire. La canule veineuse centrale au-dessus de l'aiguille a ensuite été avancée au-delà de la pointe de l'aiguille et utilisée pour le bloc continu du plexus lombaire (Figure 4).
Concepcion a enroulé le stylet d'une aiguille spinale de calibre 26 autour de l'introducteur métallique d'une canule intraveineuse typique sur l'aiguille. Une pince crocodile a ensuite été attachée au stylet pour permettre une stimulation électrique à l'aide d'un stimulateur nerveux.
Prosser a conçu une autre méthode pour fournir une stimulation nerveuse pendant les CPNB pour les patients pédiatriques. Cet auteur a connecté une électrode jackplug dans le moyeu d'une canule intraveineuse (Abbocath-T Venisystems, Abbott, Irlande) pour établir un contact électrique entre le stimulateur nerveux et l'aiguille métallique centrale de l'ensemble intraveineux (Figure 5). Le téflon environnant®-gaine enduite isolée tout sauf la pointe de la canule. Cette adaptation a réussi avec les cathéters intraveineux de calibre 20, 22 et 24 et était donc idéale pour la population pédiatrique.
Pour faire progresser l'anesthésie régionale pédiatrique, Tan et al ont utilisé un ensemble de cathétérisme de l'artère radiale (#RA-04120 ; Arrow, Reading, PA) avec une canule de calibre 20 sur une aiguille de calibre 22, à paroi mince et à biseau court pour l'axillaire continue bloc du plexus brachial. L'ensemble avait un fil à ressort intégré de 0.018 pouce que ce groupe connectait via une pince crocodile au pôle négatif d'un stimulateur nerveux pour permettre l'électrolocalisation du plexus brachial. En utilisant une technique de Seldinger, le fil de guidage a ensuite été avancé et utilisé pour diriger la canule dans la gaine du plexus brachial.
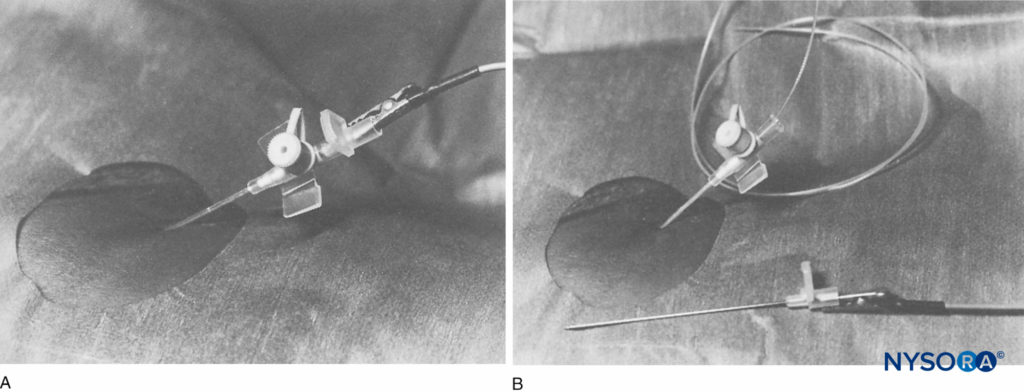
FIGURE 3. A : Mise en place de la canule de perfusion. Stimulateur nerveux fixé au trocart (vue latérale). B : Le cathéter est inséré à travers la canule de perfusion (vue latérale). (Reproduit avec la permission de Anker-Møller E1, Spangsberg N, Dahl JB, et al : Bloc continu du plexus lombaire après une chirurgie du genou : une comparaison des concentrations plasmatiques et de l'effet analgésique de la bupivacaïne 0.250 % et 0.125 %. Acta Anaesthesiol Scand. août 1990;34(6):468-472.)
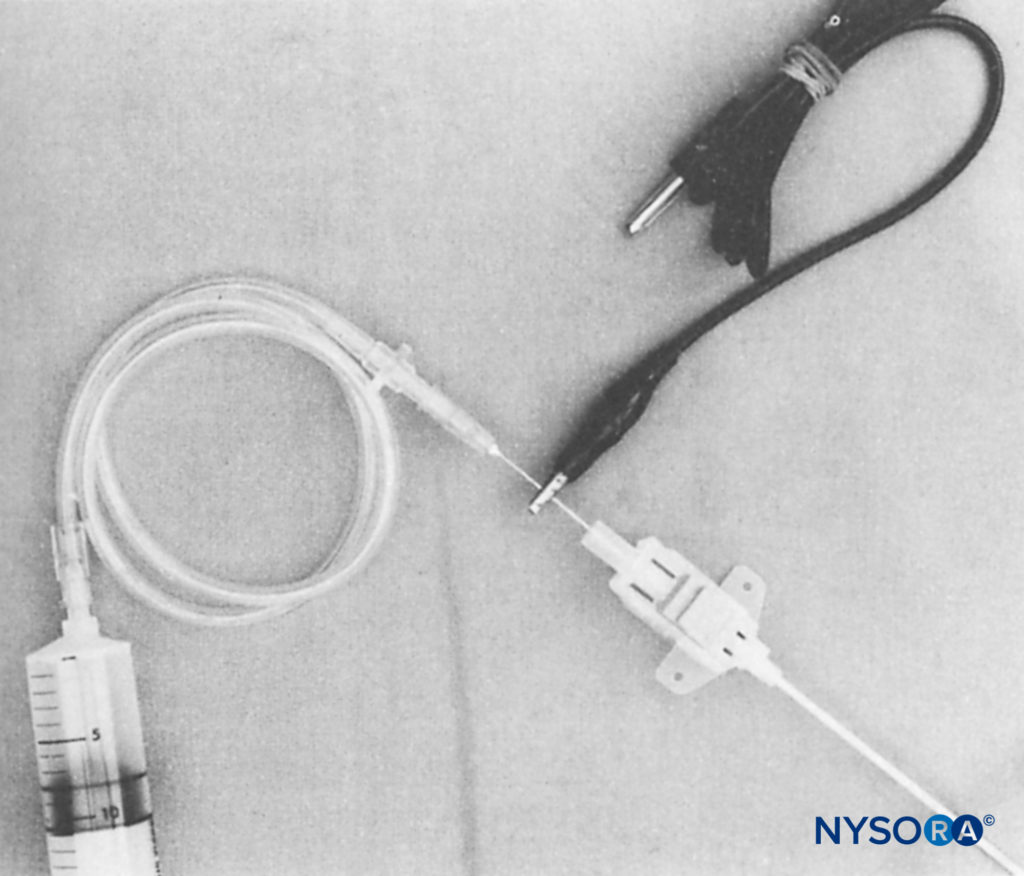
FIGURE 4. L'assemblage montre une aiguille de calibre 21 insérée dans l'extrémité proximale du cathéter de pression veineuse centrale Secalon de calibre 16 (Viggo, Suède). Le contact métallique de la plus petite aiguille à l'intérieur de la plus grande aiguille permet de transmettre une impulsion électrique à la pointe de l'aiguille Secalon. Une pince crocodile du stimulateur électrique est attachée à la tige de l'aiguille de calibre 21. La tubulure d'extension intraveineuse s'insère dans le moyeu de l'aiguille de calibre 21. (Reproduit avec la permission de Ben-David B1, Lee E, Croitoru M : Bloc du psoas pour la réparation chirurgicale d'une fracture de la hanche : rapport de cas et description d'une technique de cathéter. Anesth Analg. 1990 Sep ; 71 (3): 298-301. )
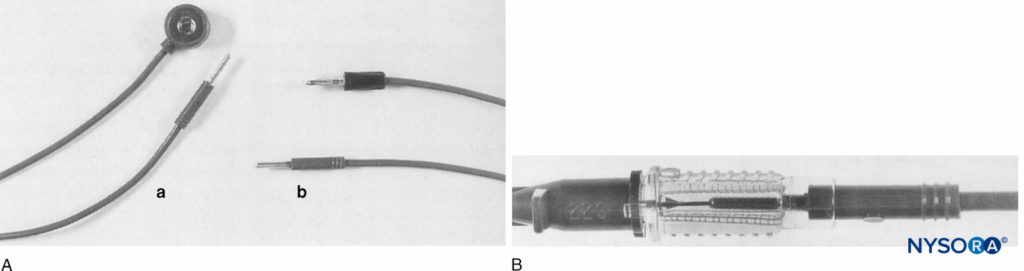
FIGURE 5. A : Sonde de stimulateur nerveux périphérique équipée (a) de connecteurs standard à bouton-pression et jack plug ; (b) connecteurs modifiés, bouton-pression remplacé par une deuxième prise jack. B : Contact électrique entre la canule métallique centrale d'Abbocath et la prise jack d'origine du câble. (Reproduit avec la permission de Prosser DP : Adaptation of an intravenous cannula for pédiatric regional anesthesia. Anesthesia. 1996 May ;51(5):510.)
L'équipement rachidien et péridural a également été adapté pour les CPNB effectués avec des stimulateurs nerveux. Plusieurs groupes ont placé une canule intraveineuse de calibre 18 sur une aiguille spinale de calibre 22 pour isoler la partie distale de l'aiguille. Une source de courant a ensuite été attachée à l'aiguille métallique proximale nue et un anesthésique local a été injecté lors de l'identification des structures neurales. La canule a ensuite été retirée de l'aiguille rachidienne dans l'espace périneural et utilisée pour une perfusion continue d'anesthésique local pendant jusqu'à 2 jours.
Alternativement, des aiguilles rachidiennes et des microcathéters ont été utilisés. Les microcathéters rachidiens, cependant, étaient d'une taille si petite que l'injection était difficile, et ils étaient enclins à se tordre. Cet équipement a finalement été retiré du marché en raison de la neurotoxicité associée à la rachianesthésie continue.
Alors que ces conceptions permettaient la stimulation nerveuse à travers une aiguille isolée, un certain nombre d'inconvénients existaient toujours. De nombreuses étapes ont été nécessaires entre l'identification du nerf et l'enfilage du cathéter. Cela augmentait le risque d'égarement du cathéter et la probabilité de commettre une brèche dans la stérilité. Malgré l'isolation fournie par une canule de type intraveineuse sur une aiguille métallique, la zone non isolée de la pointe distale de l'aiguille était de taille importante et pouvait nuire à la précision de la localisation du nerf. Malheureusement, dans ces systèmes auto-assemblés, la canule fournissait rarement un ajustement serré sur l'aiguille. De plus, le risque de complications neurologiques des aiguilles à long biseau de type intraveineux continuait de susciter des inquiétudes. Enfin, la forme de la pointe de l'aiguille ne facilitait pas l'enfilage du cathéter dans des directions autres que parallèles au parcours de l'aiguille.
Des efforts accrus dans le développement de l'équipement CPNB et l'introduction de l'anesthésique local à action prolongée plus sûr, la ropivacaïne (Astra, Westborough, MA) dans les années 1990, ont encore stimulé l'expansion des techniques CPNB.
Des systèmes de canule sur aiguille disponibles dans le commerce ont été développés et commercialisés par diverses sociétés. B. Braun a présenté un ensemble composé d'une canule sur une aiguille à biseau court avec un cathéter d'accompagnement. L'avantage était que les composants étaient conçus pour s'emboîter parfaitement (Figure 6). Pajunk (Geisengen, Allemagne) et B. Braun ont par la suite développé des systèmes qui impliquaient une aiguille à biseau court avec un fil intégré pour la stimulation nerveuse et avec un tube de connexion pour l'aspiration et l'injection simultanées (Figure 7). Il y avait un cathéter d'accompagnement qui pouvait être enfilé à travers la canule. Certains fabricants ont proposé l'option d'une pointe d'aiguille Sprotte ou Facet et une variété de tailles, certaines adaptées aux patients pédiatriques. Les premiers équipements Arrow impliquaient une aiguille à pointe ogive pour une meilleure sensation de pénétration fasciale et une réduction théorique des lésions neurologiques (Figure 8).
Conseils NYSORA
- Des aiguilles à biseau court ont été utilisées avec la technique de paresthésie pour minimiser les lésions nerveuses.
- Les aiguilles isolées sont utilisées avec la stimulation nerveuse pour localiser le nerf ou le plexus.
- La conception des aiguilles et des cathéters CPNB était initialement en retard sur le développement de l'équipement PNB à injection unique.
Systèmes isolés modernes
La prochaine avancée dans le développement de l'équipement CPNB isolé impliquait des systèmes de cathéter à travers l'aiguille (c'est-à-dire Contiplex® Tuohy, B. Braun Medical, Bethléem, Pennsylvanie et Plexolong®, Pajunk). Une aiguille de Tuohy a été isolée sur toute sa longueur à l'exception d'une zone ponctuelle à son extrémité la plus distale. Un fil stimulant était attaché à l'aiguille. Les premiers prototypes impliquaient un fil détachable avec une pince crocodile à une extrémité et une prise pour un stimulateur nerveux à l'autre extrémité (Figure 9). Dans les modèles suivants, le fil stimulant était fixé en permanence à l'aiguille métallique (Chiffres 10 et 11). Ce fil a également servi de marqueur pour la face ouverte du biseau de l'aiguille distalement. Un cathéter péridural multiorifice de calibre 20 et un connecteur ont été inclus. La pointe distale incurvée de l'aiguille de Tuohy a facilité l'avancement du cathéter parallèlement au(x) nerf(s) en question. Différentes longueurs d'aiguilles ont été fabriquées, permettant la CPNB de nerfs de profondeurs variables. Des pointes d'aiguille Sprotte et Facet ont également été fabriquées pour permettre l'enfilage du cathéter à différentes approches d'angle d'aiguille.
Certains équipements CPNB (Contiplex Tuohy) intègrent un adaptateur avec une tête de verrouillage Luer et une valve hémostatique qui peut être fixée à l'extrémité proximale de l'aiguille (Figure 10). L'adaptateur a un diaphragme central qui permet le passage d'un cathéter à travers un orifice séparé de l'endroit où se produisent l'aspiration et l'injection. Cela élimine le besoin de débrancher l'équipement et minimise la probabilité de mouvement de l'aiguille, de mauvais placement du cathéter et de défaillance du bloc secondaire. Cet adaptateur a également un bras latéral connecté à une tubulure d'extension qui permet une aspiration continue du sang et l'injection de solution par un assistant.
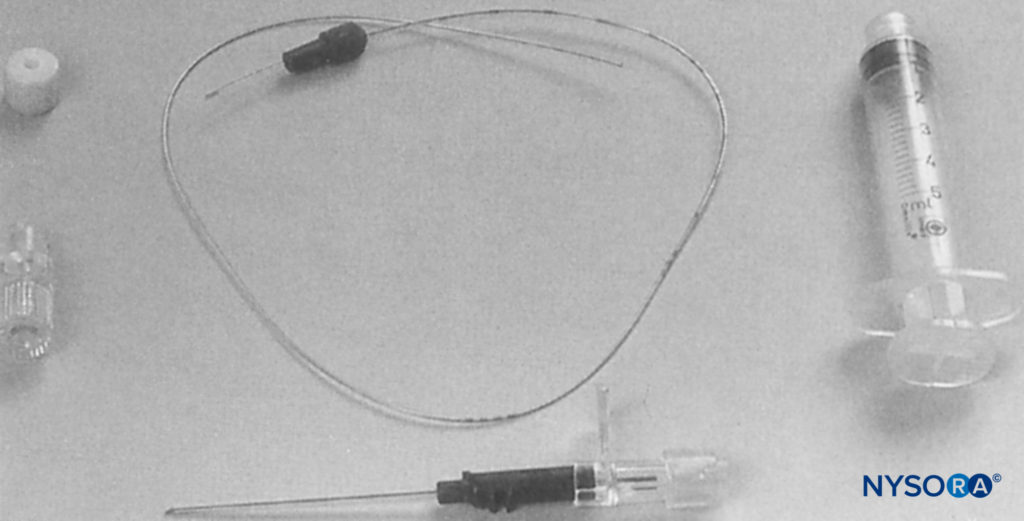
FIGURE 6. Kit de perfusion du plexus brachial tel qu'utilisé dans cette étude (Contiplex®, B. Braun Australia Pty. Ltd.). La canule d'introduction est de calibre 18, avec un cathéter de 0.85 mm de diamètre, qui est vissé dans la gaine du plexus brachial axillaire. L'aiguille à l'intérieur de la canule est de type à biseau court (30°). (Reproduit avec la permission de Mezzatesta JP, Scott DA, Schweitzer SA, et al : bloc continu du plexus brachial axillaire pour le soulagement de la douleur postopératoire. Bolus intermittent versus perfusion continue. Reg Anesth. 1997 juillet-août ;22(4):357-362. )
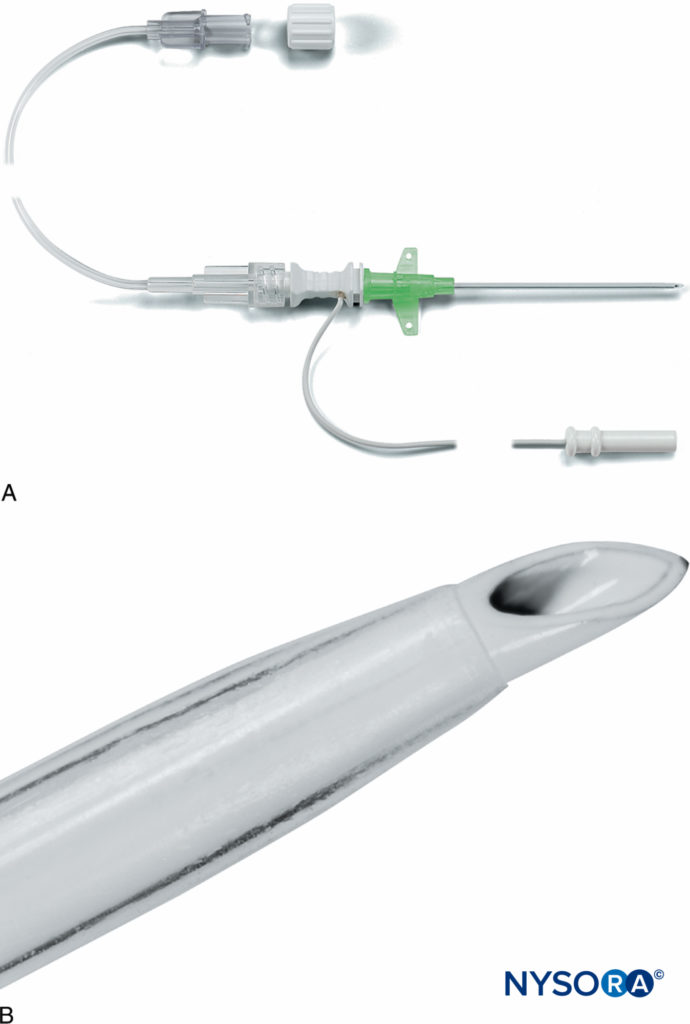
FIGURE 7. A: Pajunk MiniSet® composé d'une conception canule sur aiguille et d'un câble de stimulation intégré et d'un tube d'extension. B : Pointe d'aiguille distale à biseau court Pajunk MiniSet et canule. (Utilisé avec la permission de Pajunk, Geisengen, Allemagne.)

FIGURE 8. Cathéter Arrow monocoup ou continu pour le plexus brachial. (Reproduit avec la permission de Longo SR, Williams DP : Bilateral fascia iliaca cathéters pour le contrôle de la douleur postopératoire après arthroplastie totale bilatérale du genou : rapport de cas et description d'une technique de cathéter. Reg Anesth. 1997 juillet-août ;22(4):372- 377.)
Les cathéters initialement fabriqués pour une utilisation péridurale ont été adaptés pour les CPNB. Ils sont bien adaptés à cette application car ils sont non irritants et flexibles et génèrent une friction minimale lors du passage à travers les aiguilles. Les marquages gradués fournissent un indicateur de la profondeur d'insertion et la radio-opacité fournit une méthode supplémentaire pour confirmer l'emplacement du placement. Certains préconisent l'utilisation de cathéters à stylet, estimant qu'ils sont plus faciles à faire avancer ; cependant, ceux-ci peuvent entraîner un traumatisme plus important des tissus ou des vaisseaux sanguins. Les cathéters multiorifices ont une pointe distale fermée et trois ouvertures distales (0.5, 1.0 et 1.5 cm de la pointe). Les cathéters à orifice unique ont une seule ouverture à l'extrémité distale du cathéter (Figure 12). Les cathéters multi-orifices permettent une meilleure diffusion de la solution anesthésique locale administrée par bolus ; par conséquent, ils sont associés à une analgésie améliorée par rapport aux cathéters à orifice unique.
Conseils NYSORA
L'équipement de bloc nerveux périphérique continu comprend généralement les éléments suivants :
- Une aiguille isolée de gros calibre (c'est-à-dire une pointe Tuohy) avec un fil intégré pour permettre la stimulation nerveuse
- Un cathéter flexible et atraumatique qui est enfilé à travers l'aiguille dans un emplacement périneural
- Tube transparent et flexible qui peut être attaché à une aiguille ou à un cathéter pour l'injection et l'aspiration

FIGURE 9. Un système Tuohy isolé de calibre 18 (Braun, Contiplex®, B. Braun Medical, Bethlehem, PA). L'encart montre une tête de verrouillage Luer avec un diaphragme central à l'extrémité proximale de l'aiguille. (Reproduit avec la permission de Klein SM, Grant SA, Greengrass RA, et al. Bloc du plexus brachial interscalénique avec un système d'insertion de cathéter continu et une pompe à perfusion jetable. Anesthésie et analgésie. Déc 2000;91(6):1473-1478.)
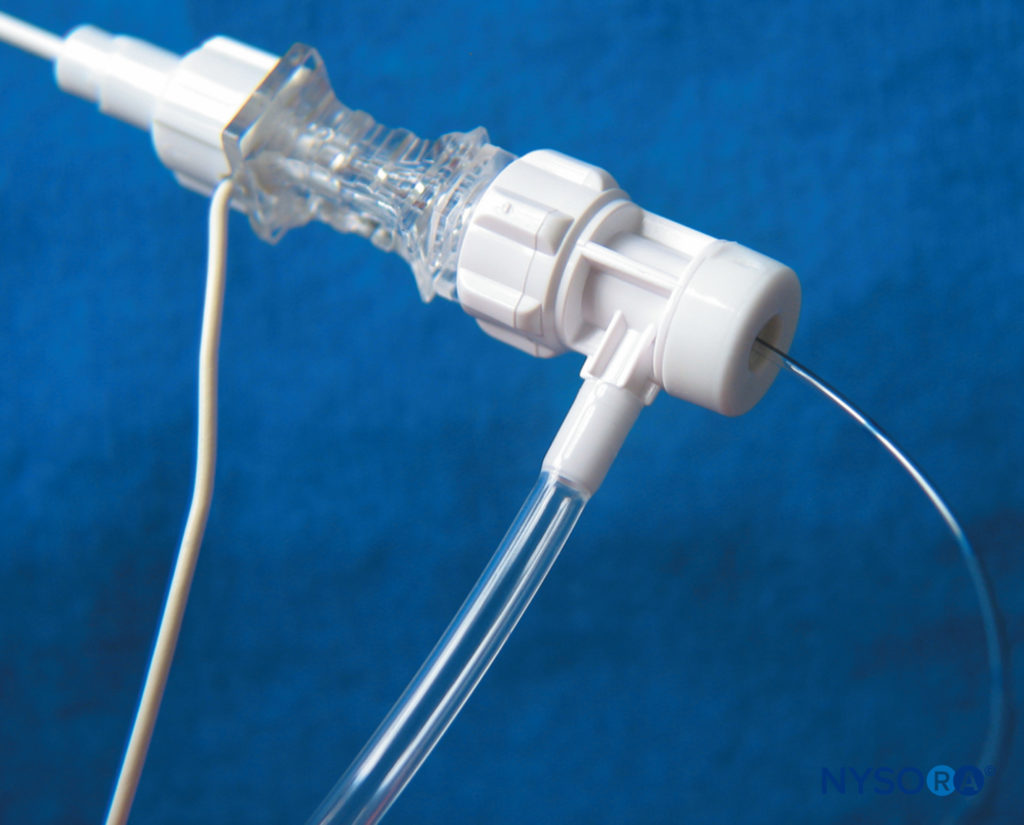
FIGURE 10. Le Contiplex® Tuohy (B. Braun, Melsungen AG, Allemagne) se compose d'une aiguille Tuohy isolée avec une pointe pointue non isolée, un fil de stimulation intégré, un tube d'extension et un connecteur avec une valve hémostatique permettant l'insertion d'un cathéter. Cette conception permet une stimulation nerveuse, une aspiration et une injection simultanées et permet une aiguille immobile pendant l'insertion du cathéter. (Utilisé avec la permission de Holly Evans, MD.)
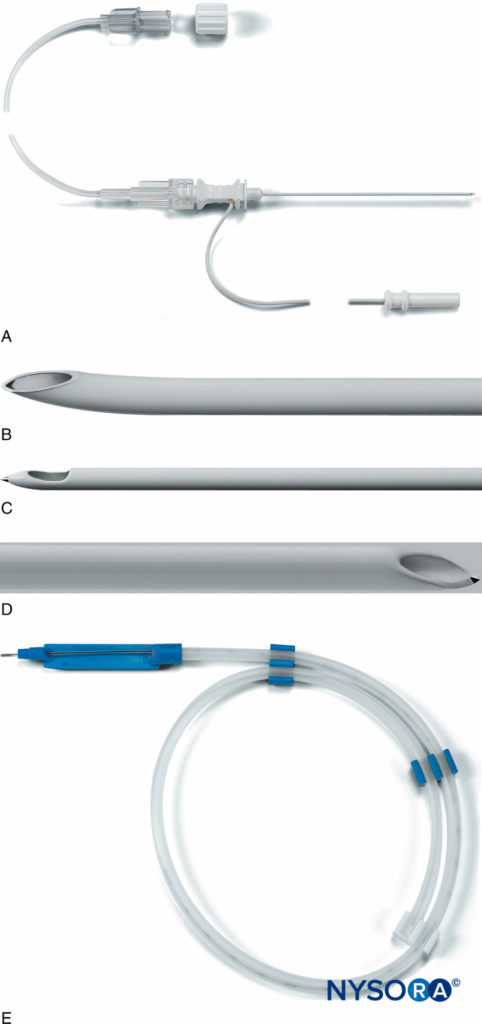
FIGURE 11. R : Le système Plexolong® (Pajunk, Geisengen, Allemagne) comprend une aiguille isolée, un fil de stimulation intégré et un tube d'extension. B : La pointe Plexolong Tuohy. C : La pointe Plexolong Sprotte. D : La pointe Plexolong Facet (ou biseau court). E : Le cathéter Plexolong avec dispositif d'aide au filetage. (Utilisé avec la permission de Pajunk, Geisengen, Allemagne.)
Cathéters stimulants
Les cathéters de stimulation permettent de conduire le courant jusqu'à leur extrémité distale. Ils ont été développés comme un outil pour évaluer la proximité de l'extrémité distale du cathéter aux structures neurales et pour tenter de réduire la probabilité d'échec du bloc secondaire. Dans l'un des premiers rapports publiés, Sutherland a utilisé un cathéter urétéral de 1.0 mm de diamètre extérieur (Portex-Boots, Kent, Royaume-Uni) avec un stylet en métal. Cet auteur a adapté le cathéter en retirant 50 mm de son extrémité distale et en réenfilant le stylet métallique de manière à ce qu'il dépasse à peine de l'extrémité distale (Figure 12). La partie proximale du stylet a été repliée sur l'extrémité proximale du cathéter pour maintenir la longueur correcte et pour faciliter une connexion électrique au stimulateur nerveux. Cet équipement a été utilisé avec succès pour le bloc du nerf sciatique continu après une chirurgie du pied.
Boezaart et al ont ensuite décrit leur adaptation d'un cathéter épidural renforcé de fil pour une utilisation comme cathéter de stimulation. Ils ont utilisé un polyuréthane (Tecothane®) cathéter thermoplastique avec un renfort interne à ressort en acier et un stylet en acier inoxydable non ferromagnétique (Arrow Theracath®) et a retiré une partie du cathéter externe pour fournir une pointe métallique non gainée de 5 mm. Ces auteurs ont décrit le retrait du stylet interne d'une aiguille Tuohy de calibre 17 non isolée et l'avancement du cathéter péridural à travers l'aiguille de sorte que la pointe métallique du cathéter n'entre pas en contact avec l'aiguille métallique. Cela a effectivement permis l'électrolocalisation pendant le placement de l'aiguille et du cathéter pour le bloc continu du plexus brachial interscalénique. Une modification ultérieure impliquait l'ajout d'une aiguille isolée avec un stylet métallique interne à l'ensemble (StimuCath®, Arrow International). D'autres révisions ont abouti à l'ajout d'une pince crocodile pour permettre une connexion directe à un stimulateur nerveux (Figure 13) et, plus récemment, l'ajout d'un fil stimulant intégré fixé à l'aiguille.
Alors que ce cathéter stimulant était une avancée significative, plusieurs limitations existaient. Le biseau de l'aiguille était plus tranchant que celui des équipements d'autres fabricants et était associé à des inquiétudes concernant les lésions neurales. L'opacité des cathéters bleus de calibre 20 et blancs de calibre 19 a rendu difficile l'identification du sang aspiré. Le segment non isolé relativement grand à l'extrémité distale de l'aiguille pourrait diminuer la précision de l'identification des nerfs. Et, il y avait un risque que la zone du fil exposé à l'extrémité distale du cathéter puisse se dérouler in vivo si elle était coupée ou traumatisée.
Pour tenter de remédier à certaines de ces lacunes, Kick et al ont développé un autre cathéter stimulant (Stimulong® Catheter Set, Pajunk) et a rapporté sa fiabilité dans une série de 10 blocs supraclaviculaires du plexus brachial (Figures 14A et 14M). Il consistait en un cathéter en polyamide de calibre 20, à trou unique, de 400 mm avec un stylet conducteur amovible à demeure de 405 mm. Le stylet en fil métallique a été isolé avec un revêtement en téflon sur toute sa longueur à l'exception de la partie distale de 0.3 mm. L'extrémité proximale avait un bouchon pour permettre la connexion à un stimulateur nerveux. La modification ultérieure impliquait l'incorporation d'un fil intégré dans le cathéter (Stimulong Plus®, Pajunk) (Figure 15).

FIGURE 12. Un cathéter multiorifice à extrémité fermée (en haut) et un cathéter à orifice unique à extrémité ouverte (en bas). (Utilisé avec la permission de Holly Evans, MD.)
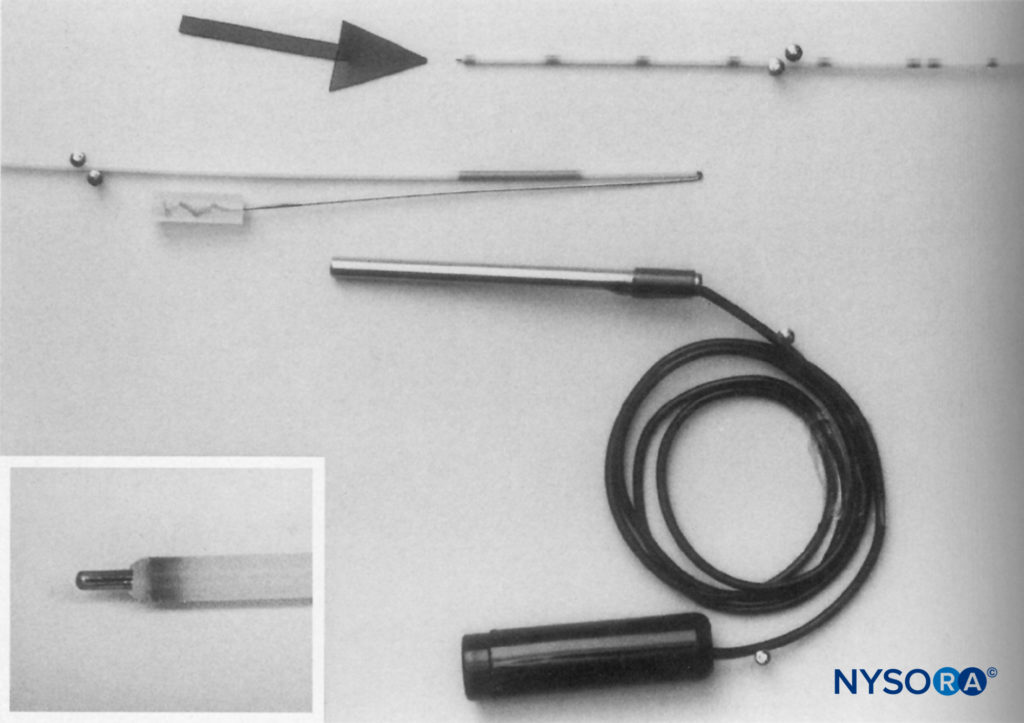
FIGURE 13. Cathéter raccourci avec stylet dépassant juste de l'extrémité distale (encart) et replié pour maintenir la position à l'extrémité proximale. La connexion électrique est réalisée en glissant un tube métallique bien ajusté sur l'extrémité proximale du cathéter. (Reproduit avec la permission de Sutherland ID : Perfusion continue du nerf sciatique : rapport de cas élargi décrivant une nouvelle approche. Reg Anesth Pain Med. 1998 sept.-oct. ;23(5):496-501.)
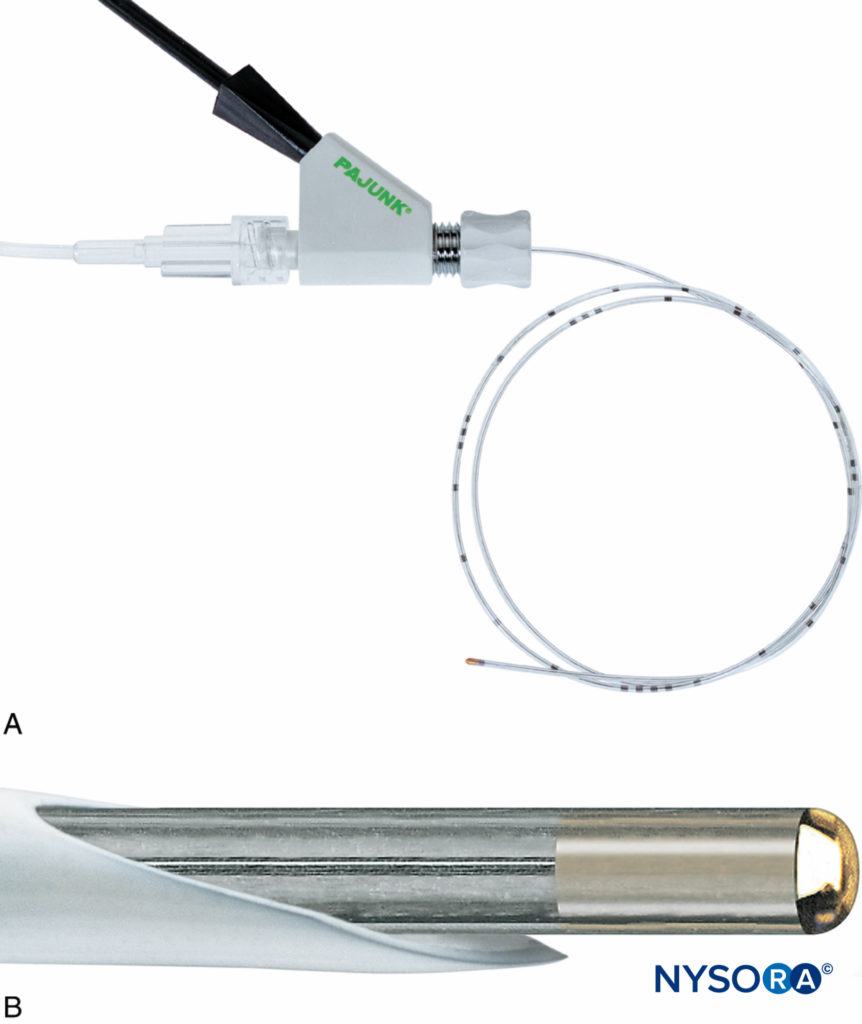
FIGURE 14. A : Le cathéter de stimulation avec fil intégré, Stimulong Plus® (Pajunk, Geisengen, Allemagne), est présenté avec son connecteur à vis. Le connecteur accepte un câble électrique et un tube d'extension. B : La pointe du cathéter de stimulation Stimulong Plus est représentée avec sa pointe dorée conductrice. (Utilisé avec la permission de Pajunk, Geisengen, Allemagne.)
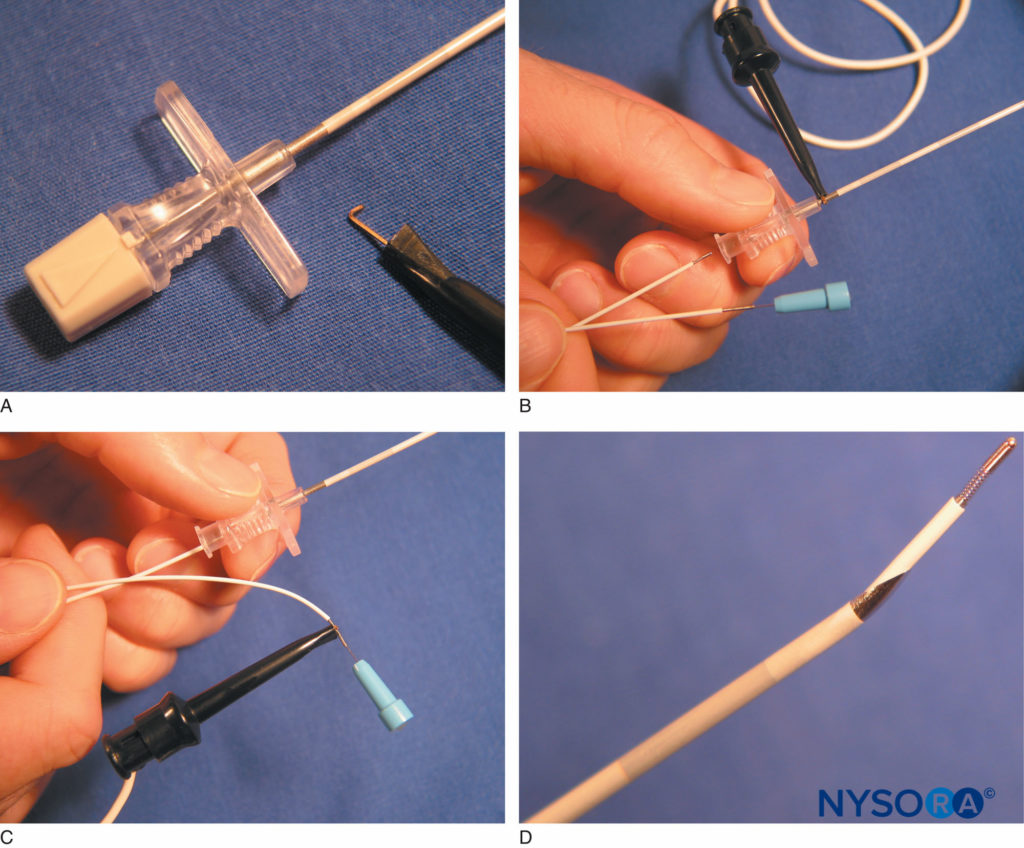
FIGURE 15. R : Une pince crocodile se connecte à un segment non isolé sur la tige proximale de l'aiguille du système StimuCath® (Arrow International, Reading, PA). B : Le système StimuCath se compose d'une aiguille à pointe Tuohy isolée, d'un cathéter de stimulation et d'un connecteur à pince crocodile. C : La pince crocodile est retirée de l'aiguille et attachée à l'extrémité proximale du cathéter. Cela fournit une sortie de courant à la pointe distale du cathéter. D : La pointe de l'aiguille Tuohy avec un segment non isolé de 5 mm de long est vue avec la pointe distale du cathéter de stimulation StimuCath. (Utilisé avec la permission de Holly Evans, MD.)
Les cathéters stimulants ont été comparés aux cathéters non stimulants pour le CPNB. Un cathéter stimulant est associé à une consommation d'anesthésique local plus faible et à un besoin réduit d'analgésie opioïde supplémentaire ; cependant, il peut être techniquement plus difficile de le placer sous guidage échographique.
Conseils NYSORA
- Un cathéter stimulant peut confirmer la localisation périneurale et peut réduire le besoin d'analgésie supplémentaire.
Systèmes échogènes
L'utilisation de l'échographie pour aider à la mise en place des CPNB est maintenant courante. Par conséquent, de nombreux fabricants ont intégré des caractéristiques échogènes dans leur équipement CPNB. B. Braun intègre des réflecteurs laser dans l'aiguille de sa série Contiplex Ultra. Les cathéters Pajunk sont renforcés par des fils et contiennent des bandes de radiocontraste à leur extrémité distale.
Conseils NYSORA
- Les aiguilles et cathéters échogènes améliorent la visualisation de l'équipement inséré sous guidage échographique.
SYSTÈMES DE LOCALISATION NERVEUSE
Stimulateur nerveux
Les stimulateurs nerveux génèrent un courant électrique qui traverse la pointe d'une aiguille isolée ou d'un cathéter stimulant pour stimuler un nerf/plexus. Une secousse motrice appropriée au nerf en question est recherchée. Les limites de cette technique doivent être appréciées. Des études de blocs nerveux réalisées à la fois par stimulation nerveuse et guidage par ultrasons ont montré qu'une pointe d'aiguille peut entrer en contact avec un nerf sans entraîner de contraction motrice. De plus, une pointe d'aiguille peut se trouver dans un nerf même lorsqu'il n'y a pas de secousse motrice à un courant relativement faible.
Ultrason
L'anatomie neurale et périneurale peut être visualisée par échographie. Des variantes anatomiques peuvent être observées. L'emplacement précis et la profondeur des structures neuronales peuvent être estimés. Les structures environnantes et la vascularisation peuvent être identifiées et évitées. Une image de l'aiguille du bloc nerveux, du cathéter et de l'injection d'anesthésique local peut être vue par rapport au nerf/plexus en temps réel. Bien qu'associés à la nécessité d'une formation supplémentaire de l'opérateur et à des dépenses d'équipement plus importantes, les avantages potentiels de l'échographie comprennent un meilleur succès du bloc et une réduction des complications. De plus amples détails sont fournis dans les chapitres correspondants.
Système de positionnement global (Ultrasonix)
L'une des techniques de localisation nerveuse les plus récentes implique l'utilisation d'un système de positionnement global (c.-à-d. SonixGPS, Ultrasonix, Richmond, BC, Canada). L'aiguille et la sonde à ultrasons contiennent toutes deux des capteurs. En conséquence, l'écran à ultrasons affiche la trajectoire prévue de l'aiguille et l'emplacement où l'aiguille croisera le faisceau d'ultrasons.
Autre : fluoroscopie, paresthésie, clic fascial
Il existe d'autres techniques de localisation nerveuse. La fluoroscopie utilise l'imagerie par rayons X en continu pour localiser une structure osseuse à proximité. Le cas échéant, l'injection de colorant de contraste peut être utilisée pour définir l'emplacement des structures périneurales.
La technique de paresthésie consiste à faire avancer l'aiguille du bloc nerveux pour entrer en contact avec un nerf/plexus. Bien qu'une paresthésie sensorielle puisse en résulter, elle n'est pas garantie. Par conséquent, la technique de paresthésie peut être imprécise et potentiellement dangereuse.
La technique du clic fascial implique une sensation tactile de "pop" lorsqu'une aiguille de bloc nerveux pénètre dans les couches fasciales. Bien que cette technique puisse être utilisée pour les blocs de champ (c'est-à-dire fascia iliaca), sa précision pour la localisation nerveuse est limitée.
Conseils NYSORA
- La stimulation nerveuse peut aider à l'identification des structures neurales ; cependant, des limites existent.
- Le guidage échographique permet d'identifier les structures neurales et périneurales importantes et permet de confirmer l'injection périneurale appropriée de soluté.
CONSIDÉRATIONS POST-BLOCAGE
Systèmes de fixation de cathéter
L'une des étiologies les plus courantes d'échec CPNB secondaire implique le déplacement du cathéter. Diverses techniques peuvent être utilisées pour réduire le risque de délogement du cathéter. La tunnelisation sous-cutanée du cathéter peut être utilisée dans des endroits appropriés. Un adhésif liquide peut être appliqué là où le cathéter sort de la peau et sous le pansement occlusif transparent. Il existe des pansements adhésifs spécialement conçus pour fixer un cathéter à la peau (c.-à-d. Epi-Guard, Copenhagen MedLab, Glostrup, Danemark).
pompes à perfusion
La pompe à perfusion choisie doit être fiable et précise. Il doit contenir un volume approprié de solution anesthésique locale pour la durée prévue de la perfusion. La pompe doit être réglable et avoir la capacité de fournir une perfusion continue ainsi que des bolus contrôlés par le patient à des intervalles précis. Ces caractéristiques permettent au CPNB d'être adapté aux besoins changeants des patients.
Les pompes à perfusion périneurale ambulatoire doivent être fiables, précises et compactes. Des pompes électroniques ou en élastomère sont disponibles pour une utilisation ambulatoire. Certains sont jetables, tandis que d'autres sont réutilisables et doivent être retournés par le patient à l'hôpital.
Suivi des patients
Les patients porteurs de cathéters périneuraux doivent être suivis quotidiennement. Le site du cathéter est inspecté pour la propreté, l'intégrité et le délogement possible. Le site du cathéter est évalué à la recherche de signes d'infection, tels que rougeur, chaleur ou écoulement purulent. L'adéquation de l'analgésie est évaluée et des modifications sont apportées au plan de gestion de la douleur. Le patient est éduqué sur les soins du membre engourdi et les stratégies de prévention des chutes, le cas échéant. Des symptômes de toxicité anesthésique locale sont recherchés. Le fonctionnement de la pompe est revu.
Cathéters périneuraux ambulatoires
Les patients externes sont contactés quotidiennement par téléphone, moment auquel le suivi décrit précédemment est effectué. La procédure de retrait du cathéter est discutée et effectuée par le patient et son soignant à domicile. Les pompes jetables sont jetées à la poubelle, tandis que les pompes non jetables sont retournées en personne ou envoyées par la poste à l'hôpital.
Conseils NYSORA
- La sécurité et l'efficacité des CPNB reposent sur une fixation correcte du cathéter pour éviter le délogement, un suivi approprié par un professionnel de la santé compétent et une éducation adéquate du patient concernant les soins de l'extrémité engourdie, les complications potentielles et le fonctionnement de la pompe d'anesthésie locale.
CONCLUSION
Ce chapitre met en évidence l'équipement requis pour une perfusion périneurale sûre et efficace de solutions anesthésiques locales. Le développement de systèmes spécialisés d'aiguille et de cathéter à cette fin a été initialement lent; cependant, les systèmes actuellement disponibles sont fiables et applicables à la plupart des situations cliniques. Lors de l'examen des moyens de dissuasion à l'adoption plus répandue des CPNB, le manque de formation des opérateurs a souvent été cité dans le passé. Actuellement, il existe de nombreuses opportunités d'apprentissage disponibles, y compris des cours pratiques, des préceptorats, la réalité virtuelle et une formation par simulation. Il y a également eu une amélioration de l'éducation des patients et des chirurgiens concernant les avantages potentiels des CPNB. Néanmoins, certaines inquiétudes persistent quant aux effets secondaires potentiels, notamment les lésions nerveuses et les chutes. Bien que les recherches en cours aient amélioré notre compréhension du mécanisme des lésions nerveuses liées à l'anesthésie régionale, des informations supplémentaires sont nécessaires. D'autres facteurs limitant l'application clinique des CPNB peuvent être institutionnels et doivent être traités au niveau local. Ceux-ci incluent la pression du temps dans les salles d'opération très fréquentées, le manque d'assistants qualifiés pour les performances en bloc, le manque de fonds pour l'équipement ou le manque de soutien pour les soins postopératoires.
Références
- Serpell MG, Millar FA, Thomson MF : Comparaison entre le bloc du plexus lombaire et l'analgésie opioïde conventionnelle après une arthroplastie totale du genou. Anesthésie 1991;46(4):275–277.
- Edwards ND, Wright EM : Bloc nerveux continu 3 en 1 à faible dose pour le soulagement de la douleur postopératoire après une arthroplastie totale du genou. Anesth Analg 1992;75(2):265–267.
- Matheny JM, Hanks GA, Rung GW, Blanda JB, Kalenak A : Une comparaison de l'analgésie contrôlée par le patient et du bloc continu du plexus lombaire après reconstruction du ligament croisé antérieur. Arthroscopie 1993;9(1):87–90.
- Borgeat A, Schappi B, Biasca N, Gerber C : Analgésie contrôlée par le patient après une chirurgie majeure de l'épaule : Analgésie interscalène contrôlée par le patient versus analgésie contrôlée par le patient. Anesthésiologie 1997;87(6):1343–1347.
- Singelyn FJ, Aye F, Gouverneur JM : Bloc continu du nerf sciatique poplité : Une technique originale pour procurer une analgésie postopératoire après chirurgie du pied. Anesth Analg 1997;84(2):383–386.
- Borgeat A, Tewes E, Biasca N, Gerber C : Analgésie interscalénique contrôlée par le patient avec de la ropivacaïne après une chirurgie majeure de l'épaule : PCIA vs PCA. Br J Anaesth 1998;81(4):603–605.
- Singelyn FJ, Deyaert M, Joris D, Pendeville E, Gouverneur JM. Effets de l'analgésie intraveineuse contrôlée par le patient avec de la morphine, de l'analgésie péridurale continue et du bloc trois en un continu sur la douleur postopératoire et la rééducation du genou après une arthroplastie totale unilatérale du genou. Anesth Analg 1998;87(1):88–92.
- Capdevila X, Barthelet Y, Biboulet P, Ryckwaert Y, Rubenovitch J, d'Athis F. Effets de la technique analgésique périopératoire sur le résultat chirurgical et la durée de la rééducation après une chirurgie majeure du genou. Anesthésiologie 1999;91(1):8–15.
- Lehtipalo S, Koskinen LO, Johansson G, Kolmodin J, Biber B. Bloc continu du plexus brachial interscalène pour l'analgésie postopératoire après une chirurgie de l'épaule. Acta Anaesthesiol Scand 1999;43(3):258–264.
- Chelly JE, Greger J, Gebhard R, et al. Les blocs fémoraux continus améliorent la récupération et les résultats des patients subissant une arthroplastie totale du genou. J Arthroplasty 2001;16(4):436–445.
- White PF, Issioui T, Skrivanek GD, Early JS, Wakefield C : L'utilisation d'un bloc sciatique poplité continu après une chirurgie impliquant le pied et la cheville : améliore-t-elle la qualité de la récupération ? Anesth Analg 2003;97(5):1303–1309.
- Matthews PJ, Govenden V : Comparaison des perfusions paravertébrales et extradurales continues de bupivacaïne pour le soulagement de la douleur après une thoracotomie. Br J Anaesth 1989;62(2):204–205.
- Schultz P, Anker-Moller E, Dahl JB, Christensen EF, Spangsberg N, Fauno P : Traitement de la douleur postopératoire après une chirurgie du genou ouverte : bloc continu du plexus lombaire avec bupivacaïne versus morphine péridurale. Reg Anesth 1991;16(1):34–37.
- Turker G, Uckunkaya N, Yavascaoglu B, Yilmazlar A, Ozcelik S : comparaison du bloc de compartiment du psoas en technique de cathéter et du bloc péridural pour l'analgésie dans la chirurgie de remplacement partiel de la hanche. Acta Anaesthesiol Scand 2003;47(1):30–36.
- Nielsen KC, Greengrass RA, Pietrobon R, Klein SM, Steele SM : Le bloc continu interscalénique du plexus brachial fournit une bonne analgésie à domicile après une chirurgie majeure de l'épaule - rapport de quatre cas. Can J Anaesth 2003;50(1):57–61.
- Zaric D, Boysen K, Christiansen J, Haastrup U, Kofoed H, Rawal N:. Bloc continu du nerf sciatique poplité pour la chirurgie ambulatoire du pied - Un essai randomisé et contrôlé. Acta Anaesthesiol Scand 2004;48(3):337–341.
- Buettner J, Klose R, Hoppe U, Wresch P : taux sériques de mépivacaïne-HCl pendant le bloc continu du plexus brachial axillaire. Reg Anesth 1989;14(3):124–127.
- van den Berg B, Berger A, van den Berg E, Zenz M, Brehmeier G, Tizian C : Anesthésie continue du plexus pour améliorer la circulation dans les interventions microvasculaires périphériques. Handchir Mikrochir Plast Chir 1983;15(2):101–104.
- Camprubi Sociats I, Garcia Huete L, Sabate Pes A, Bartolome Sarvise C, Cochs Cristia J. Utilisation du blocage périvasculaire axillaire du plexus brachial avec un cathéter comme traitement dans l'injection intra-artérielle accidentelle de médicaments. Rev Esp Anestesiol Reanim 1989;36(3):167–170.
- Haynsworth RF, Heavner JE, Racz GB : bloc continu du plexus brachial à l'aide d'un cathéter axillaire pour le traitement des injections intra-artérielles accidentelles. Reg Anesth 1985;10:187.
- Berger JL, Nimier M, Desmonts JM : Bloc continu du plexus axillaire dans le traitement des injections intra-artérielles accidentelles de cocaïne. N Engl J Med 1988;318(14):930.
- Aguilar JL, Domingo V, Samper D, Roca G, Vidal F : Anesthésie du plexus brachial à long terme à l'aide d'un système d'injection implantable sous-cutané. Rapport de cas. Reg Anesth 1995;20(3):242–245.
- Fischer HB, Peters TM, Fleming IM, Else TA : Cathétérisme nerveux périphérique dans la prise en charge de la douleur cancéreuse en phase terminale. Reg Anesth 1996;21(5):482–485.
- Smith BE, Fischer HB, Scott PV. Blocage continu du nerf sciatique. Anesthésie 1984;39(2):155–157.
- Ansbro FP : Une méthode de bloc continu du plexus brachial. Am J Surg 1946;71:716–722.
- DeKrey JA, Schroeder CF, Buechel DR : bloc continu du plexus brachial. Anesthésiologie 1969;30(3):332.
- Winnie AP : bloc interscalénique du plexus brachial. Anesth Analg 1970;49(3):455–466.
- Selander D : Technique du cathéter dans le bloc du plexus axillaire. Présentation d'une nouvelle méthode. Acta Anaesthesiol Scand 1977;21(4):324–329.
- Brands E, Callanan VI : Bloc continu du plexus lombaire - analgésie pour les fractures du col du fémur. Anaesth Intensive Care 1978;6(3):256–258.
- Thompson GE, Rorie DK : Anatomie fonctionnelle des gaines du plexus brachial. Anesthésiologie 1983;59(2):117–122.
- Tuominen M, Rosenberg PH, Kalso E : Niveaux sanguins de bupivacaïne après une dose unique, une dose supplémentaire et pendant une perfusion continue dans un bloc du plexus axillaire. Acta Anaesthesiol Scand 1983;27(4):303–306.
- Manriquez RG, Pallares V : Bloc continu du plexus brachial pour sympathectomie prolongée et contrôle de la douleur. Anesth Analg 1978;57(1):128–130.
- Economacos G, Skountzos V : blocage nerveux des nerfs sciatique et fémoral. Bloc continu avec cathéter veineux chez 44 patients. Acta Anaesthesiol Belg 1980;31 Suppl:223–228.
- Vatashsky E, Aronson HB : Bloc interscalénique continu du plexus brachial pour les interventions chirurgicales de la main. Anesthésiologie 1980;53(4):356.
- Sada T, Kobayashi T, Murakami S : bloc continu du plexus brachial axillaire. Can Anaesth Soc J 1983;30(2):201–205.
- Neimkin RJ, May JW Jr, Roberts J, Sunder N : bloc axillaire continu à travers un cathéter à demeure en téflon. J Hand Surg Am 1984;9(6):830–833.
- Conacher ID, Kokri M. Blocs paravertébraux postopératoires pour la chirurgie thoracique. Un bilan radiologique. Br J Anaesth 1987;59(2):155–161.
- Lonnqvist PA : Bloc paravertébral continu chez l'enfant. Première expérience. Anesthésie 1992;47(7):607–609.
- Vaghadia H, Kapnoudhis P, Jenkins LC, Taylor D : Bloc lombo-sacré continu utilisant une aiguille de Tuohy et une technique de cathéter. Can J Anaesth 1992;39(1):75–78.
- Chan V, Ferrante FM : Bloc paravertébral thoracique continu. Dans Ferrante FM, VadeBoncoeur TR (eds) : Gestion de la douleur postopératoire. Churchill Livingstone, 1993 : 403-414.
- Selander D, Dhuner KG, Lundborg G : lésion nerveuse périphérique due aux aiguilles d'injection utilisées pour l'anesthésie régionale. Une étude expérimentale des effets aigus du traumatisme causé par la pointe d'une aiguille. Acta Anaesthesiol Scand 1977;21(3):182–188.
- Selander D, Edshage S, Wolff T : Paresthésies ou pas de paresthésies ? Lésions nerveuses après blocs axillaires. Acta Anaesthesiol Scand 1979;23(1):27–33.
- Montgomery SJ, Raj PP, Nettles D, Jenkins MT : L'utilisation du stimulateur nerveux avec des aiguilles non gainées standard dans le bloc nerveux. Anesth Analg 1973;52(5):827–831.
- Ford DJ, Pither C, Raj PP : Comparaison des aiguilles isolées et non isolées pour localiser les nerfs périphériques avec un stimulateur nerveux périphérique. Anesth Analg 1984;63(10):925–928.
- Anker-Moller E, Spangsberg N, Dahl JB, Christensen EF, Schultz P, Carlsson P : Bloc continu du plexus lombaire après chirurgie du genou : Une comparaison des concentrations plasmatiques et de l'effet analgésique de la bupivacaïne 0.25 % et 0.125 %. Acta Anaesthesiol Scand 1990;34(6):468–472.
- Ben-David B, Lee E, Croitoru M : Bloc du psoas pour la réparation chirurgicale d'une fracture de la hanche : rapport de cas et description d'une technique de cathéter. Anesth Analg 1990;71(3):298–301.
- Conception M : Techniques continues du plexus brachial. Dans Ferrante FM, VadeBoncoeur TR (eds) : Gestion de la douleur postopératoire. Churchill Livingstone, 1993 : 359–402.
- Prosser DP : Adaptation d'une canule intraveineuse pour l'anesthésie régionale pédiatrique. Anesthésie 1996;51(5):510.
- Tan TS, Watcha MF, Safavi F, McCulloch D, Payne CT, Tuefel A : Canulation de la gaine brachiale axillaire chez les enfants. Anesth Analg 1995;80(3):640–641.
- Rosenblatt R, Pepitone-Rockwell F, McKillop MJ : Analgésie axillaire continue pour blessure traumatique à la main. Anesthésiologie 1979;51(6):565–566.
- Steele SM, Klein SM, D'Ercole FJ, Greengrass RA, Gleason D : Un nouveau système d'administration continue par cathéter. Anesth Analg 1998;87(1):228.
- Fredrickson MJ, Ball CM, Dalgleish AJ : La configuration de l'orifice du cathéter influence l'efficacité du bloc nerveux périphérique continu. Reg Anesth Pain Med 2011;36(5):470–475.
- Sutherland ID : Perfusion continue du nerf sciatique : rapport de cas détaillé décrivant une nouvelle approche. Reg Anesth Pain Med 1998;23(5):496–501.
- Boezaart AP, de Beer JF, du Toit C, van Rooyen K : Une nouvelle technique de bloc nerveux interscalène continu. Can J Anaesth 1999;46(3):275–281.
- Boezaart AP, De Beer JF, Nell ML : Expérience précoce du bloc paravertébral cervical continu à l'aide d'un cathéter stimulant. Reg Anesth Pain Med 2003;28(5):406–413.
- Borene SC, Rosenquist RW, Koorn R, Haider N, Boezaart AP : Une indication pour le bloc paravertébral cervical continu (approche postérieure de l'espace interscalénique). Anesth Analg 2003;97(3):898–900.
- Kick O, Blanche E, Pham-Dang C, Pinaud M, Estebe JP : Un nouveau stylet stimulant pour un contrôle immédiat de la position de la pointe du cathéter dans les blocs nerveux périphériques continus. Anesth Analg 1999;89(2):533–534.
- Pham-Dang C, Kick O, Collet T, Gouin F, Pinaud M : Blocs nerveux périphériques continus avec cathéters stimulants. Reg Anesth Pain Med 2003;28(2):83–88.
- Casati A, Fanelli G, Koscielniak-Nielsen Z, et al : L'utilisation de cathéters stimulants pour le bloc du nerf sciatique continu raccourcit le temps d'apparition du bloc chirurgical et minimise la consommation postopératoire d'analgésiques après la réparation de l'halux valgus par rapport aux cathéters non stimulants conventionnels. Anesth Analg 2005;101(4):1192–1197.
- de Tran QH, Munoz L, Russo G, Finlayson RJ : Échographie et cathéters périneuraux stimulants pour les blocs nerveux : un examen des preuves. Can J Anaesth 2008;55(7):447–457.
- Morin AM, Kranke P, Wulf H, Stienstra R, Eberhart LH : L'effet des techniques de cathéter stimulantes et non stimulantes pour l'anesthésie régionale continue : une revue systématique semi-quantitative. Reg Anesth Pain Med 2010;35(2):194–199.
- Mariano ER, Loland VJ, Sandhu NS, et al : Efficacité comparative des cathéters périneuraux poplités-sciatiques guidés par ultrasons et stimulants pour l'analgésie postopératoire. Can J Anaesth 2010;57(10):919–926.
- Gandhi K, Lindenmuth DM, Hadzic A, et al : l'effet de la stimulation par rapport aux cathéters périneuraux conventionnels sur l'analgésie postopératoire après la localisation du nerf fémoral guidée par échographie. J Clin Anesth 2011;23(8):626–631.
- Robards C, Hadzic A, Somasundaram L, et al : injection intraneurale avec stimulation à faible courant pendant le bloc du nerf sciatique poplité. Anesth Analg 2009;109(2):673–677.

