Juan Butterworth IV
INTRODUCCIÓN
La anestesia y analgesia local y regional parecen estar atravesando un renacimiento, a juzgar por la asistencia a reuniones de especialidades y el aumento sustancial de la actividad investigadora, como lo demuestra el creciente número de publicaciones científicas. A diferencia de la anestesia general, en la que el mecanismo molecular sigue siendo objeto de especulaciones, el sitio en el que los anestésicos locales (AL) se unen para producir bloqueos nerviosos ha sido clonado y mutado. Este capítulo se centra en los mecanismos de anestesia y toxicidad, especialmente porque el conocimiento de estos mecanismos ayudará al médico a realizar una anestesia regional más segura y eficaz.
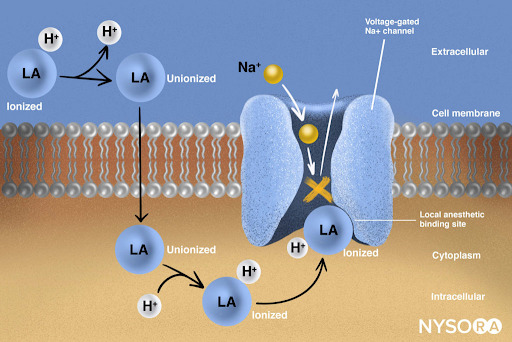
Del Compendio de Anestesia Regional: Mecanismo de acción de los anestésicos locales. Los anestésicos locales funcionan uniéndose a la subunidad α de los canales de Na+ dependientes de voltaje, lo que impide la generación y conducción de impulsos nerviosos. Posteriormente, los iones de Na+ no pueden fluir hacia la célula, deteniendo así la transmisión de la onda de despolarización que avanza a lo largo del nervio. La fracción de moléculas anestésicas locales se encuentra en forma ionizada. Las moléculas del anestésico local cambian de ionizadas a unionizadas en una fracción de segundo.
Del Compendio de Anestesia Regional: Mecanismo de acción de los anestésicos locales infografía.
PREHISTORIA E HISTORIA
Los incas consideraban a la coca como un regalo del hijo del dios sol y limitaban su uso a la “corteza superior” de la sociedad. Ellos reconocieron y usaron las propiedades medicinales de la cocaína mucho antes de que el compuesto fuera traído a Europa para “descubrir” sus propiedades. Los incas a veces trataban los dolores de cabeza persistentes con trepanación y ocasionalmente se usaba coca para facilitar este procedimiento. La anestesia local se logró haciendo que el operador masticara hojas de coca y aplicara la pulpa macerada en la piel y los bordes de la herida mientras usaba un cuchillo tumi para perforar el hueso. En el siglo XVI, después de haber perturbado la sociedad inca, los conquistadores comenzaron a pagar a los trabajadores con pasta base de cocaína.
Los trabajadores generalmente enrollaban las hojas de cocaína en bolas (llamadas cocadas), unidas con guano o almidón de maíz. Estas cocadas liberaban la base libre de cocaína como consecuencia de la alcalinidad del guano y de la práctica de masticar las cocadas con ceniza o cal (dichos compuestos alcalinos aumentan el pH, favoreciendo la base libre de cocaína sobre la sal clorhidrato cargada positivamente) . Esta práctica probablemente marque el nacimiento de la cocaína “de base libre” y sea el antecedente histórico de la cocaína “rock” o “crack” de la que tanto se abusa en las sociedades occidentales. La cocaína fue traída a Viena por un explorador/médico llamado Scherzer. En Viena, el químico Albert Niemann aisló y cristalizó clorhidrato de cocaína pura en 1860. Merck Company distribuyó lotes de este agente a los médicos con fines de investigación. Sigmund Freud fue el más destacado de estos experimentadores de cocaína. Freud revisó su trabajo experimental en una monografía dedicada a la cocaína, Über Coca. Freud y Carl Koller (un aprendiz de oftalmólogo) tomaron cocaína por vía oral y notaron que la droga les dejaba la lengua insensible. Koller y Joseph Gartner comenzaron una serie de experimentos usando cocaína para producir anestesia tópica de la conjuntiva.
El nacimiento de la anestesia local y regional data de 1884, cuando Koller y Gartner reportaron su éxito al producir anestesia tópica con cocaína en el ojo de ranas, conejos, perros y humanos. El uso de anestesia local se extendió rápidamente por todo el mundo. El cirujano estadounidense William Halsted del Hospital Roosevelt de Nueva York informó que usaba cocaína para producir bloqueo del nervio mandibular en 1884 y producir bloqueo del plexo braquial menos de un año después. Estos bloqueos se lograron exponiendo quirúrgicamente los nervios y luego inyectándolos bajo visión directa. Leonard Corning inyectó cocaína cerca de la columna vertebral de los perros, produciendo lo que probablemente fue la primera epidural en 1885. La anestesia espinal con cocaína fue realizada por primera vez en 1898 por August Bier. Cocaína anestesia espinal se usó para tratar el dolor del cáncer en 1898. La anestesia epidural caudal fue introducida en 1902 por Sicard y Cathelin. féretro descrito anestesia regional intravenosa en 1909. En 1911, Hirschel informó sobre las tres primeras anestesias percutáneas del plexo braquial. Fidel Pages informó que usó anestesia epidural para cirugía abdominal en 1921. La cocaína pronto se incorporó a muchos otros productos, incluida la formulación original de Coca-Cola ideada por Pemberton en 1886. Los tónicos de vino y otras medicinas "patentes" de la época comúnmente contenían cocaína (Figura 1 y XNUMX). Esta práctica terminó cuando la cocaína fue regulada por el precursor de la Administración de Drogas y Alimentos (FDA) a principios del siglo XX.

FIGURA 1. Ejemplos de productos que incorporaron cocaína durante el tiempo antes de que se convirtiera en una sustancia controlada. Los vinos fortificados con cocaína eran particularmente populares como "tónicos". (Usado con permiso de la Unidad de Investigación de Adicciones, Universidad de Buffalo.)
QUÍMICA MEDICINAL
La cocaína y todos los demás LA contienen un anillo aromático y una amina en los extremos opuestos de la molécula, separados por una cadena hidrocarbonada y un enlace éster o amida (Figura 2 y XNUMX). La cocaína, el éster arquetípico, es el único LA natural. La procaína, el primer éster sintético de LA, fue introducido en 1904 por Einhorn. La introducción de la amida LA lidocaína en 1948 fue transformadora. La lidocaína se utilizó rápidamente para todas las formas de anestesia regional. Posteriormente aparecieron otros LA de amida basados en la estructura de la lidocaína (prilocaína, etidocaína). Se introdujo una serie relacionada de LA de amida basada en 2',6'-pipecoloxilidida (mepivacaína, bupivacaína, ropivacaína y levobupivacaína). La ropivacaína y la levobupivacaína son los únicos LA de enantiómero único (isómero óptico único) comercialmente disponibles. Ambos son enantiómeros S(–), lo que evita el aumento de la toxicidad cardiaca asociada con las mezclas racémicas y los isómeros R(+) (esto se analiza en una sección posterior). Todos los demás LA existen como racematos o no tienen carbonos asimétricos.
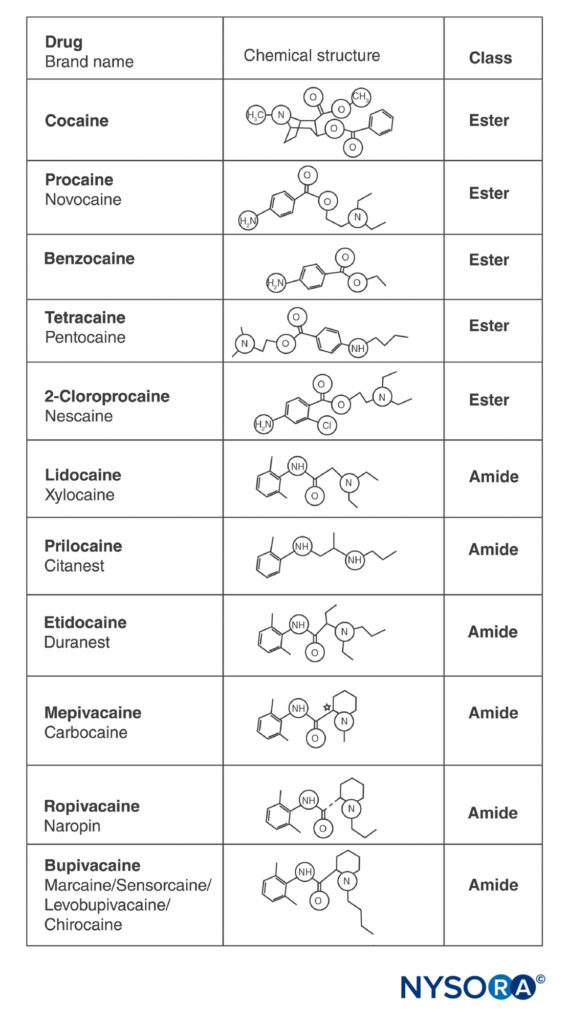
FIGURA 2. Estructuras de los anestésicos locales de uso común.
Consejos NYSORA
- Todos los LA contienen un anillo aromático y una amina en los extremos opuestos de la molécula, separados por una cadena hidrocarbonada, y un enlace éster o amida.
BIOFÍSICA DE LOS CANALES DE SODIO ACTIVADOS POR VOLTAJE Y ANESTÉSICOS LOCALES
Los estudios de los mecanismos de acción del LA sobre los nervios periféricos son estudios de las interacciones entre los LA y los canales de Na dependientes de voltaje porque los canales de Na contienen el sitio de unión de LA. Los canales de Na son proteínas integrales de membrana que inician y propagan potenciales de acción en axones, dendritas y tejido muscular; iniciar y mantener oscilaciones de potencial de membrana en células especializadas del corazón y el cerebro; y dar forma y filtrar entradas sinápticas. Los canales de Na comparten características estructurales con otros canales iónicos activados por voltaje similares que existen como tetrámeros, cada uno con seis segmentos helicoidales transmembrana (p. ej., canales de Ca y K activados por voltaje). Los canales de Na contienen una subunidad α más grande y una o dos subunidades β más pequeñas, según la especie y el tejido de origen. La subunidad α, el sitio de conducción de iones y unión de LA, tiene cuatro dominios homólogos, cada uno con seis segmentos que abarcan la membrana helicoidal α (Figura 3 y XNUMX). La superficie externa de la subunidad α está fuertemente glicosilada, lo que sirve para orientar correctamente el canal dentro de la membrana plasmática.Figura 4 y XNUMX). Los invertebrados tienen sólo uno o dos genes de la subunidad α de los canales de Na, y la función fisiológica normal de estos canales no está clara (los animales sobreviven cuando los canales no están presentes).
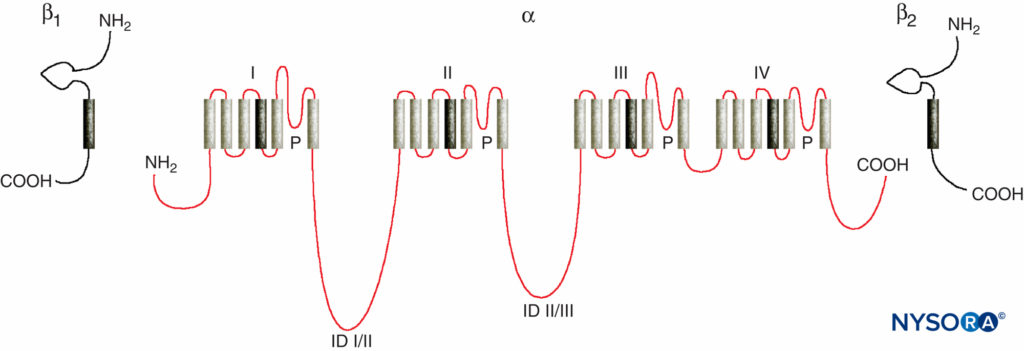
FIGURA 3. Estructura de "dibujos animados" de las subunidades del canal de Na. Tenga en cuenta que la subunidad α tiene cuatro dominios, cada uno de los cuales contiene seis segmentos que atraviesan la membrana. (Reproducido con autorización de Plummer NW, Meisler MH: Evolution and diversity of mamiferous sodium channel genes. Genomics. 1999 de abril de 15; 57(2):323-331.)
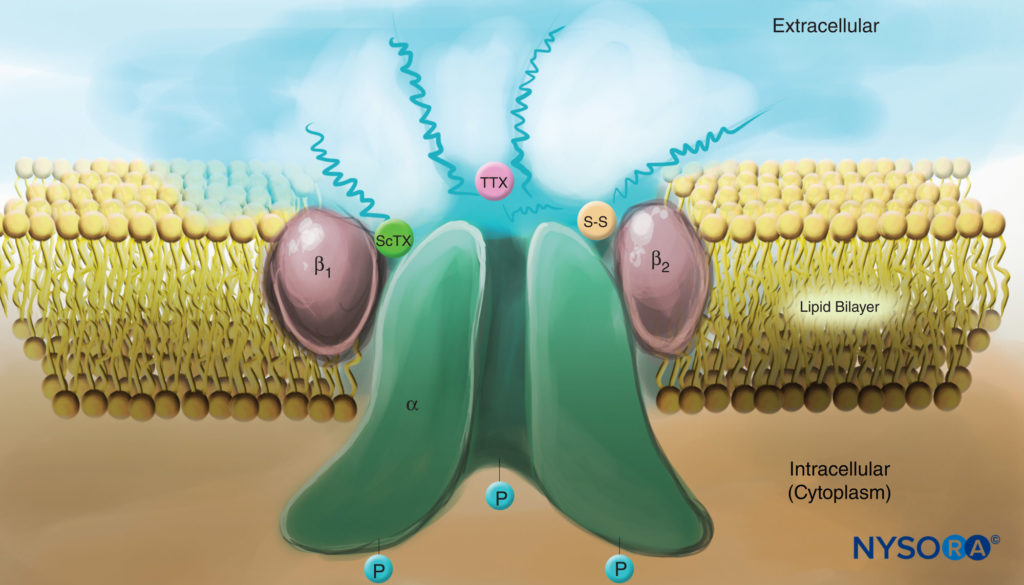
FIGURA 4. Caricatura de un canal de Na en la membrana plasmática. Tenga en cuenta que las tres subunidades están muy glicosiladas en el lado extracelular (véanse las líneas onduladas). En contraste con los anestésicos locales, tenga en cuenta que tanto las toxinas de escorpión (ScTX) como la tetrodotoxina (TTX) tienen sitios de unión en la superficie externa del canal. Tenga en cuenta también que el lado citoplásmico del canal está fosforilado. (Reproducido con permiso de Catterall WA: Cellular and molecular biology of voltage-gated sodio channel. Physiol Rev. 1992 Oct;72(4 Suppl):S15-S48.)
TABLA 1. Canal de Na dependiente de voltaje: isoformas neurales.
| Nav 1.1 | Nav 1.2 | Nav 1.3 | Nav 1.6 | Nav 1.7 | Nav 1.8 | Nav 1.9 | |
|---|---|---|---|---|---|---|---|
| Cromosoma | 2 | 2 | 2 | 12 | 2 | 3 | 3 |
| Donde identificado | SNC, GRD | SNC | SNC regulado positivamente, después de una lesión | DRG (grande y pequeño), SNC, Ranvier | DRG (grandes y pequeños) | GRD (pequeño) | GRD (pequeño) |
| Inactivacion | Rápido | Rápido | Rápido | Rápido | Rápido | Lenta | Lenta |
| TTX | Sensible | Sensible | Sensible | Sensible | Sensible | Insensible | Insensible |
Fuente: Adaptado con permiso de Novakovic SD, Eglen RM, Hunter JC: Regulación de la distribución de canales de Na+ en el sistema nervioso. Tendencias Neurosci. 2001 agosto; 24 (8): 473-478.
Los seres humanos, por el contrario, tienen nueve genes activos de la subunidad α del canal de Na en cuatro cromosomas, con expresión específica de células y localización de productos génicos.10 El Nav gen 1.4 (por convención, los genetistas se refieren a las isoformas del canal de Na dependientes de voltaje como Nav 1.x) suministra canales al músculo esquelético y el Nav El gen 1.5 suministra canales al músculo cardíaco, dejando siete Nav isoformas en el tejido neural (Tabla 1). Los genes definidos aportan formas específicas de canales de Na a cada uno de los axones no mielinizados, nódulos de Ranvier en axones motores y pequeños nociceptores de los ganglios de la raíz dorsal. Mientras que todas las subunidades α de los canales de Na se unirán a los LA de manera similar, su afinidad para unirse a las neurotoxinas varía. Las mutaciones de las subunidades α y β del canal de Na conducen a enfermedades musculares, cardíacas y neurales. Por ejemplo, mutaciones heredadas en Nav 1.5 se han asociado con el síndrome de QT prolongado congénito, el síndrome de Bruguda y otras enfermedades del sistema de conducción. Se ha demostrado que ciertos Nav las isoformas proliferan en modelos animales de dolor crónico. La existencia de Na específicov Los productos de la subunidad α del gen ofrecen la tentadora posibilidad de que algún día se desarrollen inhibidores para cada Na específico.v forma de subunidad α. Tales desarrollos, que ya están en marcha para algunas isoformas de Nav, podrían revolucionar el tratamiento del dolor crónico. El bloqueo de impulsos en una fibra nerviosa requiere que una longitud definida de nervio se vuelva inexcitable (para evitar que el impulso "salte" sobre el segmento bloqueado). Por lo tanto, a medida que aumenta la concentración de LA, debe aplicarse a lo largo de un nervio más corto para evitar la conducción del impulso, como se muestra en la figura. Figura 5 y XNUMX. Tanto la conducción normal como la forma en que los AL inhiben la conducción difieren entre las fibras nerviosas mielinizadas y amielínicas. La conducción en las fibras mielinizadas procede en saltos de un nódulo de Ranvier al siguiente, un proceso denominado conducción saltatoria. Para bloquear los impulsos en las fibras nerviosas mielinizadas, generalmente es necesario que las LA inhiban los canales en tres nódulos de Ranvier sucesivos.Figura 6 y XNUMX). Las fibras amielínicas, que carecen del mecanismo saltatorio, conducen mucho más lentamente que las fibras mielínicas. Las fibras amielínicas son relativamente resistentes a los LA, a pesar de su diámetro más pequeño, debido a la dispersión de los canales de Na a lo largo de sus membranas plasmáticas. Estas diferencias entre las fibras nerviosas surgen durante el desarrollo cuando los canales de Na comienzan a agruparse en los nódulos de Ranvier en los axones mielinizados. La agrupación nodal de canales, esencial para la transmisión de señales de alta velocidad, es iniciada por las células de Schwann en el sistema nervioso periférico y por los oligodendrocitos en el sistema nervioso central (SNC). Los canales de Na pueden existir en al menos tres conformaciones nativas: "reposo", "abierto" e "inactivo", descritas por primera vez por Hodgkin y Huxley. Durante un potencial de acción, los canales neuronales de Na se abren brevemente, lo que permite que los iones de Na extracelulares fluyan hacia la célula y despolaricen la membrana plasmática. Después de solo unos pocos milisegundos, los canales de Na se desactivan (donde cesa la corriente de Na). Los canales de Na vuelven a la conformación de reposo con la repolarización de la membrana. El proceso por el cual los canales pasan de formas conductoras a no conductoras se denomina activación. Se supone que la activación resulta de los movimientos de los dipolos en respuesta a los cambios de potencial. El proceso por el cual operan los canales controlados por voltaje probablemente involucra movimientos de sensores de voltaje en forma de paleta dentro del perímetro exterior del canal (Figura 7 y XNUMX). La velocidad de los procesos de activación difiere entre Nav Formas de la subunidad α: las formas nerviosas y del músculo esquelético se activan más rápido que las formas cardíacas.
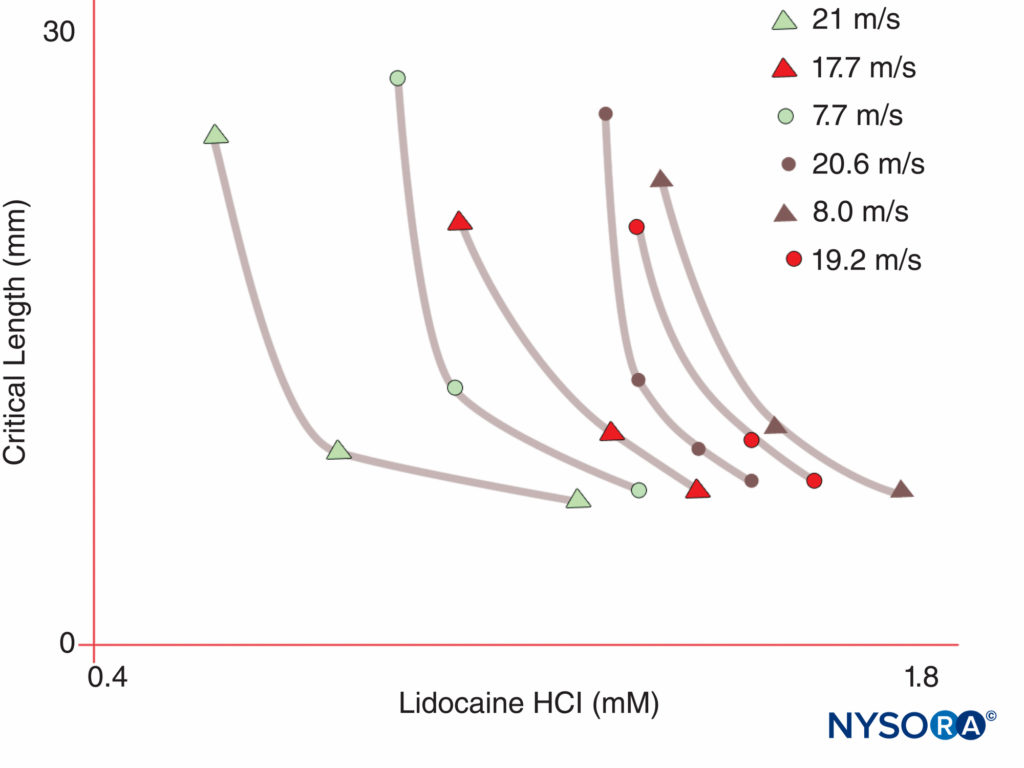
FIGURA 5. Tenga en cuenta que la concentración de anestésico local necesaria para producir un bloqueo nervioso disminuye a medida que aumenta la longitud del nervio expuesto al anestésico local. (Reproducido con permiso de Raymond SA, Steffensen SC, Gugino LD, et al: The role of length of nervioexposed to local anesthetics in impulse blocking action. Anesth Analg. 1989 May;68(5):563-570.)
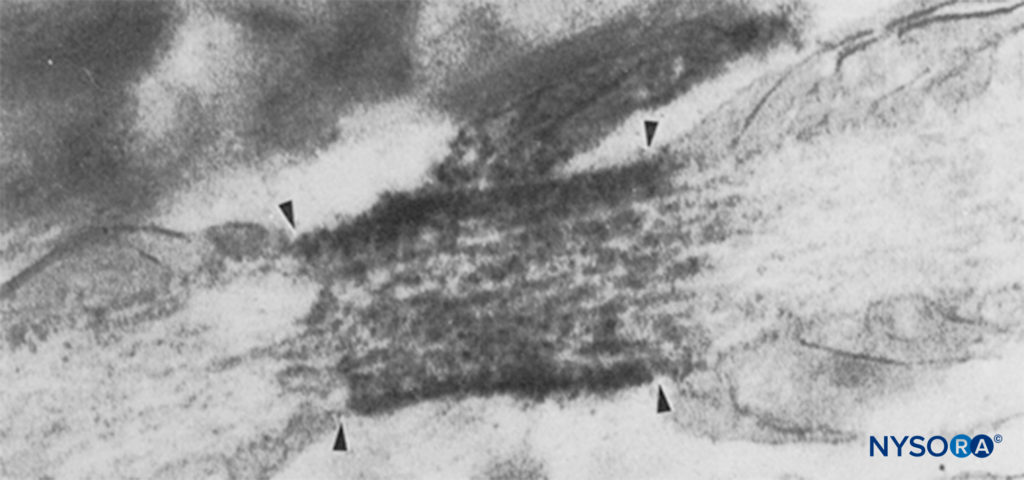
FIGURA 6. Micrografía electrónica de un nodo de Ranvier. Los canales de Na han sido inmunomarcados y aparecen como gránulos densos dentro de las cuatro flechas. La región paranodal se indica con "pn" y un astrocito se indica con "as". (Reproducido con permiso de Black JA, Friedman B, Waxman SG, et al: Immunoultrastructural localization of sodio channel at nodes of Ranvier and perinodal astro-cytes in rat optic neural. Proc R Soc Lond B Biol Sci. 1989 Oct 23;238 (1290):39-51.)
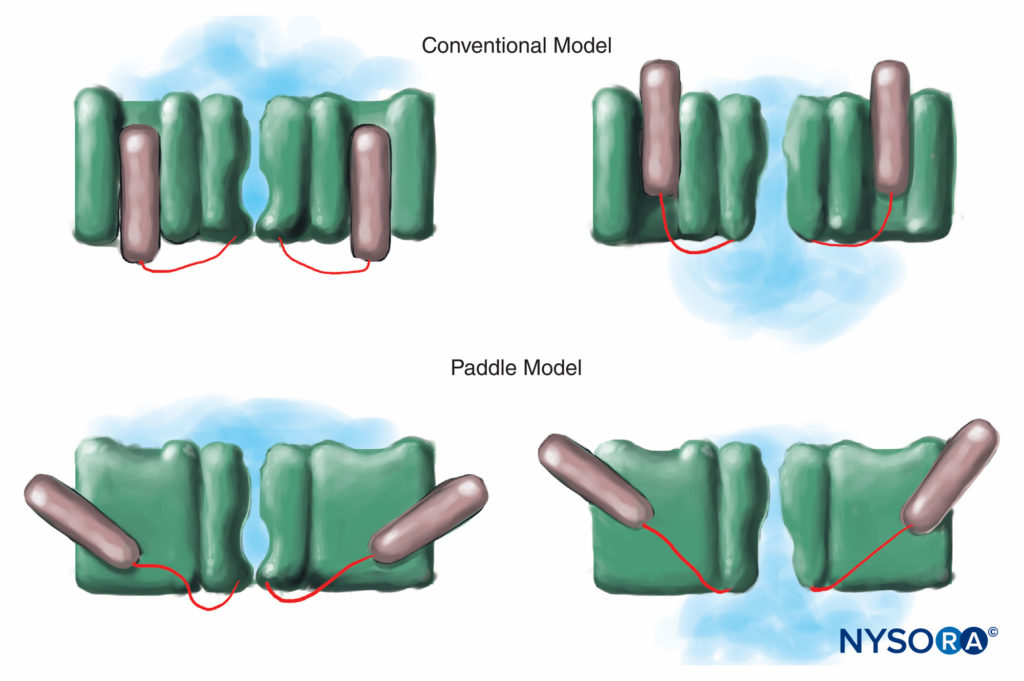
FIGURA 7. En el modelo convencional para control de voltaje, la parte del canal que detecta el voltaje se desliza "hacia adentro y hacia afuera" de la membrana. Estudios de difracción de rayos X más recientes del canal de K sugieren que un mecanismo más apropiado es el de estructuras en forma de paletas que se deslizan diagonalmente a través de la membrana plasmática. (Reproducido con permiso de Arhem P: Detección de voltaje en canales iónicos: ¿resuelto un misterio de 50 años? Lancet. 2004 de abril de 10; 363 (9416): 1221-1223).
La anestesia se produce cuando los LA se unen a los canales de Na e inhiben la permeabilidad al Na que subyace a los potenciales de acción. Nuestra comprensión de los mecanismos de LA ha sido refinada por varias observaciones clave. Taylor confirmó que los LA inhiben selectivamente los canales de Na en los nervios. Strichartz observó por primera vez el bloqueo dependiente del uso con LA, lo que demuestra la importancia de la apertura del canal para la unión de LA. La dependencia del uso (o frecuencia) describe cómo la inhibición de LA de las corrientes de Na aumenta con las despolarizaciones repetitivas ("uso"). Los trenes repetitivos de despolarizaciones aumentan la probabilidad de que un LA encuentre un canal de Na abierto o inactivo, y ambas formas tienen mayor afinidad por el LA que los canales en reposo.Figura 8 y XNUMX). Por lo tanto, el potencial de membrana influye tanto en la conformación del canal de Na como en la afinidad del canal de Na por los LA. El bloqueo dependiente del uso parece importante para el funcionamiento de los LA como antiarrítmicos y también puede ser la base de la eficacia de las concentraciones reducidas de LA para controlar el dolor. Finalmente, usando mutagénesis dirigida al sitio, Ragsdale y Wang localizaron la unión de LA a aminoácidos específicos en D4S6 de Nav 1.2 y Nav 1.4. Algunos isómeros ópticos de LA confieren mayor seguridad aparente que su enantiómero opuesto. Por ejemplo, bajo tensión de sujeción, el isómero R(+)-bupivacaína inhibe más potentemente las corrientes cardíacas de Na que el isómero S(–)-bupivacaína (levobupivacaína) (Figura 9 y XNUMX). Muchos otros tipos de sustancias químicas también se unirán e inhibirán los canales de Na, incluidos los anestésicos generales, los inhibidores de la sustancia P, los agonistas adrenérgicos α2, los antidepresivos tricíclicos y las toxinas nerviosas. Las toxinas nerviosas se están sometiendo actualmente a pruebas en animales y humanos como posibles reemplazos de los LA.
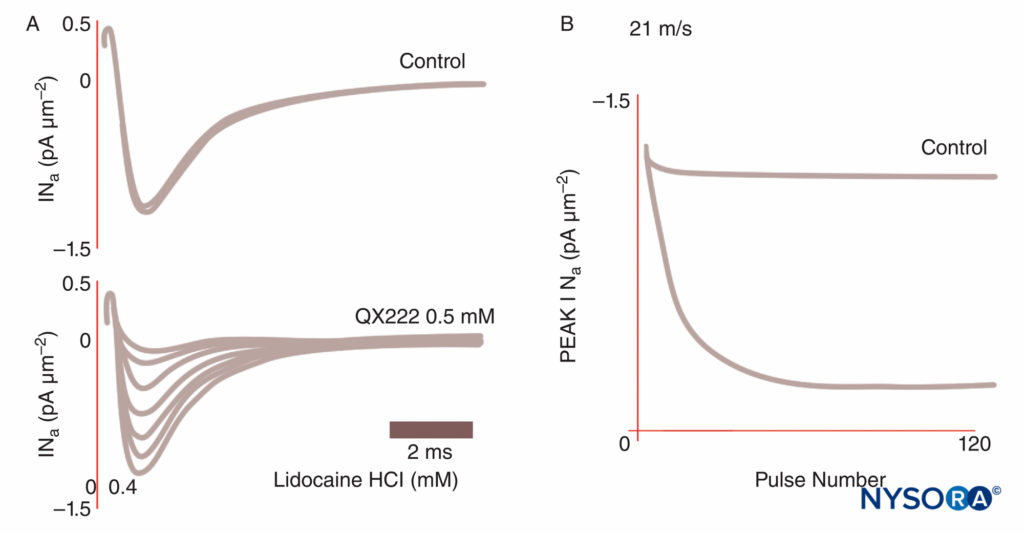
FIGURA 8. Bloqueo dependiente del uso de las corrientes de Na en las fibras de Purkinje. Bajo condiciones de control, cada tren de impulsos da como resultado trazados de corriente idénticos. En presencia del anestésico local QX222, el primer impulso tiene una amplitud de casi el mismo tamaño que en condiciones de control. Cada impulso sucesivo es más pequeño (Ina pico reducido), lo que refleja un bloque acumulado de canales de Na, hasta que se alcanza un nadir. (Reproducido con permiso de Hanck DA, Makielski JC, Sheets MF: Kinetic effects of quaternary lidocaine block of cardiac sodium channel: a gating current study. J Gen Physiol. 1994 Jan;103(1):19-43.)
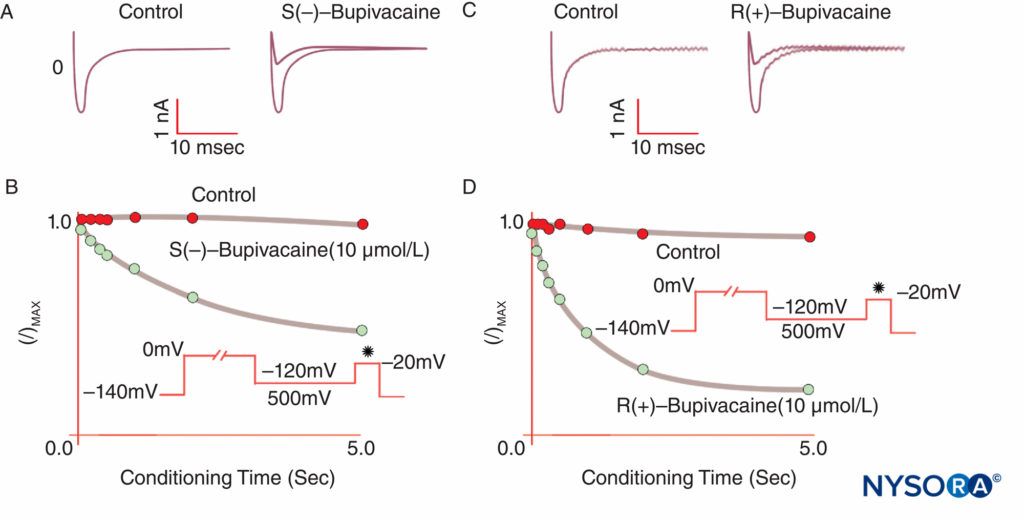
FIGURA 9. Potencia reducida de S(–) bupivacaína en relación con R(+)-bupivacaína en la inhibición de las corrientes cardíacas de Na bajo tensión de sujeción. Después de una despolarización de "condicionamiento" estándar de longitud variable, el isómero S(–) produce una reducción menor de I/Imax que el isómero R(+). (Reproducido con permiso de Valenzuela C, Snyders DJ, Bennett PB, et al: Stereoselective block of cardiac sodium channel by bupivacaine in guinea pig ventricular myocytes. Circulation. 1995 de noviembre de 15; 92(10):3014-3024.)
FARMACODINÁMICA DE LOS ANESTÉSICOS LOCALES
En la práctica clínica, los AL se describen típicamente por su potencia, duración de la acción, velocidad de aparición y tendencia al bloqueo diferencial de los nervios sensoriales. Estas propiedades no se clasifican de forma independiente.
Potencia y Duración
La potencia bloqueadora de los nervios de los LA aumenta con el aumento del peso molecular y el aumento de la solubilidad en lípidos. Los LA más grandes y lipófilos penetran las membranas nerviosas más fácilmente y se unen a los canales de Na con mayor afinidad. Por ejemplo, la etidocaína y la bupivacaína tienen mayor solubilidad en lípidos y potencia que la lidocaína y la mepivacaína, con las cuales están estrechamente relacionadas químicamente.
Consejos NYSORA
- La potencia bloqueadora de los nervios de los LA aumenta con el aumento del peso molecular y el aumento de la solubilidad en lípidos.
Los LA más solubles en lípidos son relativamente insolubles en agua, altamente ligados a proteínas en la sangre, el torrente sanguíneo los elimina con menos facilidad de las membranas nerviosas y se "lavan" más lentamente de los nervios aislados in vitro. Por lo tanto, el aumento de la solubilidad en lípidos se asocia con una mayor unión a proteínas en la sangre, mayor potencia y mayor duración de la acción. La extensión y la duración de la anestesia se pueden correlacionar con el contenido de LA de los nervios en experimentos con animales. En los animales, los bloques de mayor profundidad y mayor duración surgen de volúmenes más pequeños de LA más concentrados, en comparación con volúmenes más grandes de LA menos concentrados.
Velocidad de inicio
Muchos libros de texto y artículos de revisión afirman que el inicio de la anestesia en nervios aislados se ralentiza con el aumento de la solubilidad en lípidos de LA y el aumento de pKa.Tabla 2). A cualquier pH, el porcentaje de moléculas de LA presentes en forma no cargada, en gran parte responsables de la permeabilidad de la membrana, disminuye al aumentar el pKa. Sin embargo, de los dos LA con el inicio de acción más rápido, la etidocaína es altamente soluble en lípidos y la cloroprocaína tiene un pKa mayor que ese. de otras LA. Finalmente, la tasa de inicio de LA está asociada con la tasa de difusión acuosa, que disminuye con el aumento del peso molecular.
TABLA 2. Características anestésicas locales que tienden a clasificarse juntas.
Físico y químico
- Aumento de la solubilidad en lípidos
- Aumento de la unión a proteínas
Farmacológico y Toxicológico
- Potencia creciente
- Aumento del tiempo de inicio
- Aumento de la duración de la acción.
- Tendencia creciente a la toxicidad sistémica grave
- En general, todos tienden a ordenar juntos
Bloqueo del nervio sensorial diferencial
La anestesia regional y el manejo del dolor se verían transformados por un LA que inhibiría selectivamente la transmisión del dolor mientras dejaba intactas otras funciones. Sin embargo, la anestesia sensorial suficiente para la incisión de la piel por lo general no se puede obtener sin deterioro motor. Como fue demostrado por primera vez por Gasser y Erlanger en 1929, todos los LA bloquearán fibras más pequeñas (diámetro) en concentraciones más bajas que las requeridas para bloquear fibras más grandes del mismo tipo. Como grupo, las fibras no mielinizadas son resistentes a los LA en comparación con las fibras A-δ mielinizadas más grandes. La bupivacaína y la ropivacaína son relativamente selectivas para las fibras sensoriales. La bupivacaína produce un inicio más rápido del bloqueo sensorial que del motor, mientras que la mepivacaína, un químico estrechamente relacionado, no muestra un inicio diferencial durante los bloqueos del nervio mediano.Figura 10 y XNUMX). La verdadera anestesia diferencial puede ser posible cuando los antagonistas selectivos de las isoformas de Nav estén disponibles. Se ha encontrado que ciertas isoformas de Nav prevalecen en los ganglios de la raíz dorsal y (como se señaló anteriormente) las poblaciones relativas de varias isoformas de Nav pueden cambiar en respuesta a varios estados de dolor.
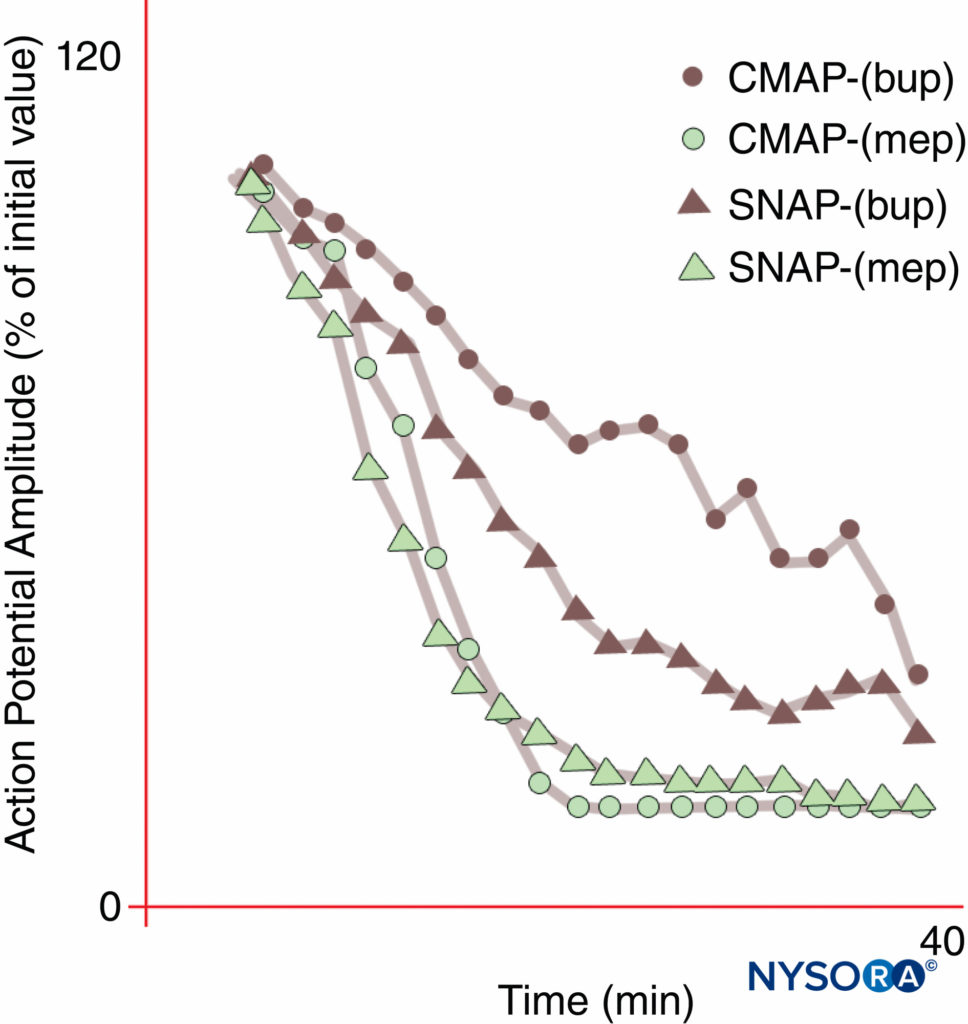
FIGURA 10. Inicio diferencial del bloqueo del nervio mediano con bupivacaína al 0.3% (bup), pero no con mepivacaína al 1% (mep). Tenga en cuenta que el potencial de acción motor compuesto (CMAP) se inhibe menos que el potencial de acción del nervio sensorial (SNAP) durante el inicio del bloqueo de bupivacaína en estos sujetos voluntarios normales. En estado estacionario (20 min), CMAP y SNAP se inhiben de forma comparable. Por otro lado, la mepivacaína produjo una inhibición más rápida tanto de CMAP como de SNAP y no hubo un inicio diferencial del bloqueo. (Reproducido con autorización de Butterworth J, Ririe DG, Thompson RB, et al: Differential onset of mediananeer block: randomized, double-blind compare of mepivacaine and bupivacaine in healthy Volunteers. Br J Anaesth. 1998 Oct;81(4): 515-521.)
Otros factores que influyen en la actividad anestésica local
Muchos factores influyen en la capacidad de un AL dado para producir una anestesia regional adecuada, incluida la dosis, el lugar de administración, aditivos, temperatura y embarazo. A medida que aumenta la dosis de LA, aumentan la probabilidad de éxito y la duración de la anestesia, mientras que disminuye el retraso del inicio y la tendencia al bloqueo diferencial. En general, el inicio más rápido y la duración más corta de la anestesia ocurren con inyecciones espinales o subcutáneas; se obtiene un inicio más lento y una duración más prolongada con bloqueos de plexo.
Consejos NYSORA
- La eficacia de un LA determinado está influenciada por la dosis, el sitio de administración, los aditivos, la temperatura y los cambios en la susceptibilidad neural, como se observa durante el embarazo.
La epinefrina se agrega con frecuencia a las soluciones de LA para causar vasoconstricción y servir como marcador para la inyección intravascular. La epinefrina y otros agonistas α1 aumentan la duración de LA en gran medida al prolongar y aumentar las concentraciones intraneurales de LA. El flujo sanguíneo disminuye solo brevemente y el bloqueo persistirá mucho después de que se haya disipado el efecto adrenérgico α1 sobre el flujo sanguíneo. Otras adiciones populares de LA incluyen clonidina, NaHCO3, opioides, dexametasona y hialuronidasa. Los anestésicos locales sin carga tienen una potencia aparente mayor a pH básico, donde se descarga una mayor fracción de moléculas de LA, que a pH más ácido.Figura 11 y XNUMX). Las bases de LA sin carga se difunden a través de las vainas y membranas nerviosas más fácilmente que las bases de LA cargadas, lo que acelera el inicio de la anestesia. Algunos estudios clínicos mostraron que la adición de bicarbonato de sodio tuvo una acción inconsistente durante el bloqueo nervioso clínico; sin embargo, no todos los estudios demostraron un inicio más rápido de la anestesia. Uno podría anticipar que el bicarbonato tendría su mayor efecto cuando se agregara a las soluciones de LA a las que el fabricante agregó epinefrina. Tales soluciones son más ácidas que las soluciones de LA “simples” (sin epinefrina) para aumentar la vida útil. El bicarbonato acorta la duración de la lidocaína en animales. Curiosamente, una vez que los LA obtienen acceso al lado citoplásmico del canal de Na, los iones H+ potencian el bloqueo dependiente del uso. Se puede lograr una marcada prolongación de la anestesia local mediante la incorporación de LA en los liposomas, como se ha hecho con la bupivacaína en algunas formulaciones.
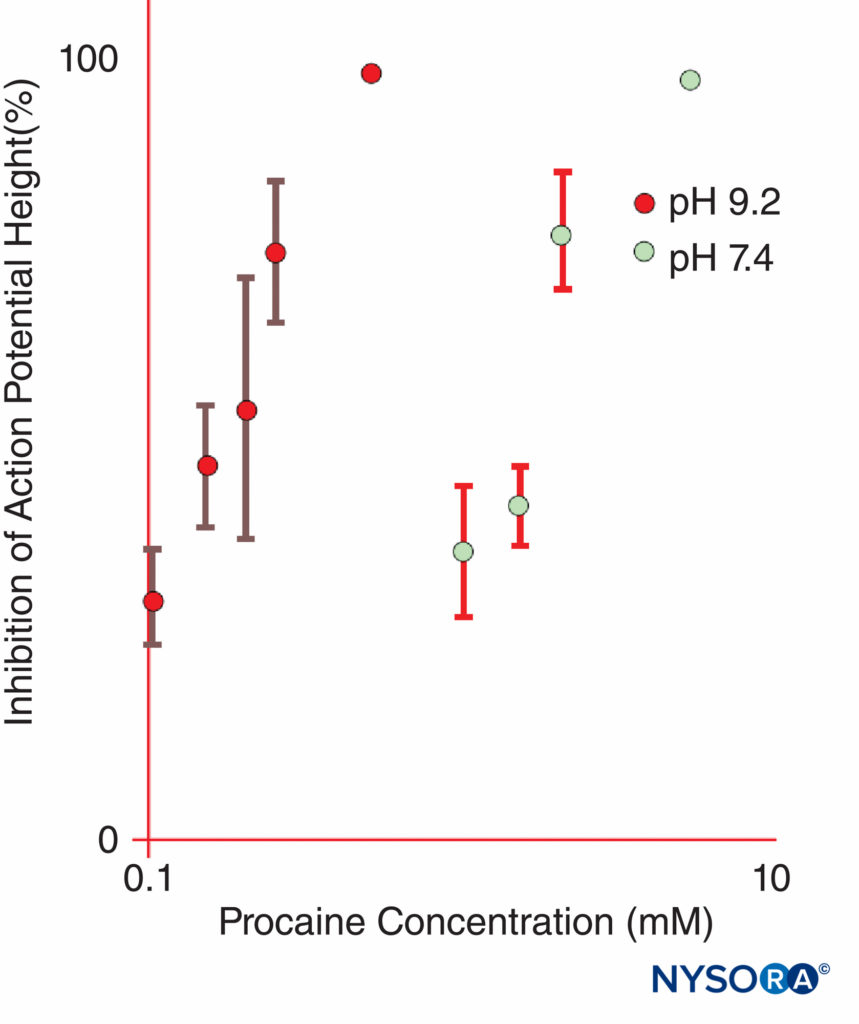
FIGURA 11. La potencia de la procaína para inhibir los potenciales de acción del compuesto en los nervios ciáticos de ranas aisladas aumenta drásticamente a un pH de 9.2 en comparación con un pH de 7.4. (Reproducido con autorización de Butterworth JF, Lief PA, Strichartz GR: The pH-dependent local anesthetic activity of dietilaminoetanol, un metabolito de la procaína. Anesthesiology. 1988 April;68(4):501-506.)
Consejos NYSORA
- El embarazo aumenta la susceptibilidad neural a los AL.
Las mujeres embarazadas y los animales preñados muestran una mayor susceptibilidad neural a los LA. Además, es probable que la propagación de la anestesia neuroaxial aumente durante el embarazo debido a la disminución del volumen del líquido cefalorraquídeo toracolumbar.
CONCENTRACIONES EN SANGRE Y FARMACOCINÉTICA
Las concentraciones máximas de LA varían según el sitio de inyección (Figura 12 y XNUMX). Con la misma dosis de LA, bloqueos intercostales consistentemente producen mayores concentraciones máximas de LA que epidural o bloqueos del plexo. Como han discutido recientemente otros, tiene poco sentido hablar de dosis "máximas" de LA excepto en referencia a un procedimiento de bloqueo nervioso específico, ya que los niveles sanguíneos máximos varían ampliamente según el sitio de bloqueo. En la sangre, todos los LA se unen parcialmente a proteínas, principalmente a la glicoproteína ácida α1 y, en segundo lugar, a la albúmina.
La afinidad por la glicoproteína ácida α1 se correlaciona con la hidrofobicidad de LA y disminuye con la protonación (acidez). El grado de unión a proteínas está influenciado por la concentración de glicoproteína ácida α1. Tanto la unión a proteínas como la concentración de proteínas disminuyen durante el embarazo. Durante la infusión a largo plazo de LA y combinaciones de opiáceos de LA, las concentraciones de proteínas de unión de LA aumentan progresivamente. se espera que demuestre Toxicidad LA después de dosis más pequeñas en bolo intravenoso.
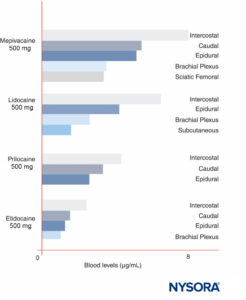
FIGURA 12. Concentraciones máximas en sangre de anestésicos locales después de varias formas de anestesia regional. Tenga en cuenta que los bloqueos intercostales dan como resultado consistentemente las mayores concentraciones de anestésico local en la sangre, que los bloqueos del plexo dan como resultado las menores concentraciones de anestésico local en la sangre y que las técnicas epidurales/caudales se encuentran en el medio. (Reproducido con permiso de Covino BG, Vassallo HG: Local Anesthetics: Mechanisms of Action and Clinical Use. Grune & Stratton; 1976.)
Consejos NYSORA
- Las recomendaciones sobre las dosis máximas de AL que se encuentran comúnmente en los textos de farmacología no son muy útiles en la práctica de la anestesia regional clínica.
- Las concentraciones séricas de LA dependen de la técnica de inyección, el lugar de inyección y la adición de aditivos al LA.
- Cualquier recomendación sobre la dosis máxima segura de LA puede ser válida solo en referencia a un procedimiento de bloqueo nervioso específico.
Los ésteres experimentan una rápida hidrólisis en la sangre, catalizada por esterasas no específicas. La procaína y la benzocaína se metabolizan a ácido para-aminobenzoico (PABA), las especies subyacentes a la anafilaxia a estos agentes. Dosis más altas de benzocaína, generalmente para anestesia tópica para endoscopia, pueden conducir a niveles de metahemoglobinemia potencialmente mortales. Las amidas se metabolizan en el hígado. La lidocaína se somete a N-deal-kylation oxidativa (por los citocromos CYP 1A2 y CYP 3A4 a monoetil glicina xilidida y glicina xilidida). La bupivacaína, la ropivacaína, la mepivacaína y la etidocaína también sufren N-desalquilación e hidroxilación. La prilocaína se hidroliza a o-toluidina, el agente que causa la metahemoglobinemia. Se puede esperar que dosis de prilocaína de tan solo 400 mg en adultos aptos produzcan concentraciones de metahemoglobinemia lo suficientemente altas como para causar cianosis clínica. El aclaramiento de la amida LA depende en gran medida del flujo sanguíneo hepático, la extracción hepática y la función enzimática; por lo tanto, la depuración de la amida LA se reduce por factores que disminuyen el flujo sanguíneo hepático, como los bloqueadores del receptor β-adrenérgico o del receptor H2, y por insuficiencia cardíaca o hepática. La disposición de los LA de amida se altera durante el embarazo debido al aumento del gasto cardíaco, el flujo sanguíneo hepático y la depuración, así como la disminución mencionada anteriormente en la unión a proteínas. La insuficiencia renal tiende a aumentar el volumen de distribución de los LA de amida ya aumentar la acumulación de subproductos metabólicos de los LA de éster y amida. En teoría, la deficiencia de colinesterasa y los inhibidores de la colinesterasa deberían aumentar el riesgo de toxicidad sistémica por los ésteres LA; sin embargo, no hay informes clínicos confirmatorios. Algunos fármacos inhiben varios citocromos responsables del metabolismo del LA; sin embargo, la importancia de los inhibidores del citocromo varía según la especie específica de LA. Los bloqueadores β y los bloqueadores de los receptores H2 inhiben el CYP 2D6, lo que puede contribuir a reducir el metabolismo de la amida LA. El itraconazol no tiene efecto sobre el flujo sanguíneo hepático, pero inhibe la eliminación de CYP 3A4 y bupivacaína en un 20-25%. La ropivacaína es hidroxilada por CYP 1A2 y metabolizada a 2′,6′-pipecoloxilidida por CYP 3A4. La inhibición de fluvoxamina de CYP 1A2 reduce el aclaramiento de ropivacaína en un 70%. Por otro lado, la coadministración con inhibidores potentes de CYP 3A4 (ketoconazol, itraconazol) tiene solo un pequeño efecto sobre el aclaramiento de ropivacaína.
EFECTOS SECUNDARIOS TÓXICOS DIRECTOS
Es una suposición común, pero equivocada, que todas las acciones del LA, incluidos los efectos secundarios tóxicos, surgen de la interacción con los canales de Na activados por voltaje. Existe abundante evidencia de que los LA se unirán a muchos otros objetivos además de los canales de Na, incluidos los canales de K y Ca dependientes de voltaje, canales KATP, enzimas, receptores de N-metil-D-aspartato, receptores β-adrenérgicos, modulación mediada por proteína G de canales de K y Ca, y receptores nicotínicos de acetilcolina. La unión de LA a cualquiera o a todos estos otros sitios podría ser la base de la producción de LA de espinal or analgesia epidural y podría contribuir a los efectos secundarios tóxicos.
Efectos secundarios del sistema nervioso central
La toxicidad de los anestésicos locales en el SNC surge del bloqueo selectivo de la inhibición de las vías excitatorias en el SNC, lo que produce una secuencia estereotipada de signos y síntomas a medida que aumenta gradualmente la concentración de LA en la sangre.Tabla 3). Con dosis aumentadas de LA, pueden surgir convulsiones en la amígdala. Con dosis adicionales de LA, la excitación del SNC progresa a la depresión del SNC y al paro respiratorio eventual. Los LA más potentes (en el bloqueo nervioso) producen convulsiones a concentraciones sanguíneas más bajas y en dosis más bajas que los LA menos potentes. En estudios con animales, tanto la acidosis metabólica como la respiratoria disminuyeron la dosis convulsiva de lidocaína.
TABLA 3. Progresión de los signos y síntomas de toxicidad a medida que aumenta gradualmente la dosis (o concentración) del anestésico local.
- Vértigo
- Tinnitus
- sentimientos siniestros
- entumecimiento circumoral
- locuacidad
- Temblores
- Sacudidas mioclónicas
- Convulsiones
- Coma
- Colapso cardiovascular
Toxicidad cardiovascular
En experimentos de laboratorio, la mayoría de los LA no producirán toxicidad cardiovascular (CV) hasta que la concentración en sangre exceda tres veces la necesaria para producir convulsiones; sin embargo, existen informes clínicos de toxicidad simultánea del SNC y CV con bupivacaína (Tabla 4). En perros, las dosis supraconvulsivas de bupivacaína producen arritmias con más frecuencia que las dosis supraconvulsivas de ropivacaína y lidocaína. Los LA producen signos CV de excitación del SNC (aumento de la frecuencia cardíaca, presión arterial y gasto cardíaco) en concentraciones más bajas que las asociadas con la depresión cardíaca. La hipocapnia reduce los cambios inducidos por la ropivacaína en los segmentos ST y la contractilidad del ventrículo izquierdo.
Consejos NYSORA
- En experimentos de laboratorio, la mayoría de los LA no producirán toxicidad CV hasta que la concentración en sangre exceda tres veces la necesaria para producir convulsiones.
TABLA 4. Dosis convulsivas versus letales de anestésicos locales en perros.
| Lidocaína | Bupivacaína | Tetracaína | |
|---|---|---|---|
| Dosis que produce convulsiones en todos los animales (mg/kg) | 22 | 5 | 4 |
| Dosis que produce letalidad en todos los animales (mg/kg) | 76 | 20 | 27 |
Los anestésicos locales se unen e inhiben los canales cardíacos de Na (Nav 1.5 isoforma). La bupivacaína se une con más avidez y durante más tiempo que la lidocaína a los conductos cardíacos de Na. Como se señaló anteriormente, ciertos isómeros ópticos R(+) se unen a los canales cardíacos de Na con más avidez que los isómeros ópticos S(–). Estas observaciones de laboratorio condujeron al desarrollo clínico de levobupivacaína y ropivacaína. Los anestésicos locales inhiben la conducción en el corazón con el mismo orden de potencia que el bloqueo nervioso. Los anestésicos locales producen depresión miocárdica dependiente de la dosis, posiblemente por interferencia con los mecanismos de señalización de Ca dentro del músculo cardíaco. Estos anestésicos se unen e inhiben los canales de Ca y K dependientes de voltaje cardiacos en concentraciones mayores que aquellas en las que la unión a los canales de Na es máxima. Los LA se unen a los receptores adrenérgicos β e inhiben la formación de monofosfato de adenosina cíclico (AMP) estimulado por epinefrina. En ratas, el orden de clasificación de la toxicidad cardíaca parece ser bupivacaína > levobupivacaína > ropivacaína. En perros, la lidocaína fue la menos potente, y la bupivacaína y la levobupivacaína fueron más potentes que la ropivacaína en la inhibición de la función ventricular izquierda evaluada por ecocardiografía.Tabla 5). En perros, tanto la estimulación eléctrica programada como la reanimación con epinefrina provocaron más arritmias después de la administración de bupivacaína y levobupivacaína que después de la administración de lidocaína o ropivacaína. El mecanismo por el que se produce la toxicidad CV puede depender del LA que se haya administrado. Cuando los LA se administraron hasta el punto de la hipotensión extrema, los perros que recibieron lidocaína pudieron reanimarse, pero requirieron una infusión continua de epinefrina para contrarrestar la depresión miocárdica inducida por LA. Por el contrario, muchos perros que recibieron bupivacaína o levobupivacaína hasta el punto de hipotensión extrema no pudieron ser reanimados. Después de la bupivacaína, la levobupivacaína o la ropivacaína, los perros que podían desfibrilarse a menudo no requerían terapia adicional. De manera similar, en cerdos, al comparar la lidocaína con la bupivacaína, la relación de potencia para la depresión miocárdica fue de 1:4, mientras que para la arritmogénesis fue de 1:16. Los AL producen dilatación del músculo liso vascular en concentraciones clínicas. La cocaína es el único AL que produce constantemente vasoconstricción local.
Reacciones alérgicas
Consejos NYSORA
- Las verdaderas reacciones inmunológicas a los LA son raras.
- La verdadera anafilaxia parece más común con los ésteres LA que se metabolizan directamente a PABA que con otros LA.
- Las inyecciones intravenosas accidentales de AL a veces se diagnostican erróneamente como reacciones alérgicas.
- Algunos pacientes pueden reaccionar a los conservantes, como el metilparabeno, incluido con los LA.
Las verdaderas reacciones inmunológicas a los LA son raras. Las inyecciones intravenosas accidentales de AL a veces se diagnostican erróneamente como reacciones alérgicas. La verdadera anafilaxia parece más común con los ésteres LA que se metabolizan directamente a PABA que con otros LA. Algunos pacientes pueden reaccionar a los conservantes, como el metilparabeno, incluido con los LA. Varios estudios han demostrado que los pacientes remitidos para evaluación de alergia aparente al LA, incluso después de mostrar signos o síntomas de anafilaxia, casi nunca demuestran alergia verdadera al LA que se administró. Por otro lado, las pruebas cutáneas de LA tienen un excelente valor predictivo negativo. En otras palabras, el 97 % de los pacientes que no responden a las pruebas cutáneas de LA tampoco tendrán una reacción alérgica a LA en un entorno clínico.
TABLA 5. Efectos de los anestésicos locales sobre los índices de función miocárdica medidos en perros.
| Anestesia local | LVEDP (CE50 para 125% base) (mcg/mL) | dp/dtmax (CE50 para 65% base) (mcg/mL) | %FS (CE50 para 65% base) (mcg/mL) |
|---|---|---|---|
| Bupivacaína | 2.2 (1.2 – 4.4) | 2.3 (1.7 – 3.1) | 2.1 (1.47 – 3.08) |
| Levobupivacaína | 1.7 (0.9 – 3.1) | 2.4 (1.9 – 3.1) | 1.3 (0.9 – 1.8) |
| Ropivacaína | 4.0 (2.1 – 7.5)un/sup> | 4.0 (3.1 – 5.2)b | 3.0 (2.1 – 4.2)un/sup> |
| Lidocaína | 6.8 (3.0 – 15.4)c | 8.0 (5.7 – 11.0)d | 5.5 (3.5 – 8.7)d |
Efectos neurotóxicos
Durante la década de 1980, la 2-cloroprocaína (en ese momento formulada con metabisulfito de sodio a un pH relativamente ácido) ocasionalmente produjo el síndrome de cauda equina después de una inyección intratecal accidental de grandes dosis durante un intento de administración epidural. Si la "toxina" es la 2-cloroprocaína o el metabisulfito de sodio sigue sin determinarse: la 2-cloroprocaína ahora se está probando como un sustituto de la lidocaína en la anestesia espinal humana, y una serie de publicaciones sugieren que puede ser segura y eficaz. Al mismo tiempo, otros investigadores han relacionado las reacciones neurotóxicas en animales con grandes dosis de 2-cloroprocaína en lugar de metabisulfito. También existe controversia acerca de los síntomas neurológicos transitorios y los déficits sacros persistentes después de la anestesia espinal con lidocaína. Los informes y la controversia han persuadido a muchos médicos a abandonar la anestesia espinal con lidocaína. A diferencia de otras soluciones espinales de AL, la lidocaína al 5 % interrumpe permanentemente la conducción cuando se aplica a nervios aislados oa neuronas aisladas. Esto puede ser el resultado de aumentos inducidos por la lidocaína en el calcio intracelular y no parece involucrar el bloqueo de los canales de Na. Si bien es imposible "probar la seguridad", varios estudios sugieren que la cloroprocaína o la mepivacaína pueden sustituir a la lidocaína para anestesias espinales breves.
Tratamiento de la toxicidad por anestésicos locales
El tratamiento de las reacciones adversas de LA depende de su gravedad. Se puede permitir que las reacciones menores terminen espontáneamente. Las convulsiones inducidas por AL deben manejarse manteniendo una vía aérea permeable y proporcionando oxígeno. Las convulsiones pueden terminar con midazolam intravenoso (0.05 a 0.10 mg/kg) o propofol (0.5 a 1.5 mg/kg) o una dosis paralizante de succinilcolina (0.5 a 1 mg/kg), seguido de ventilación con bolsa y máscara (o intubación traqueal). La depresión del LA CV que se manifiesta por hipotensión moderada puede tratarse mediante la infusión de líquidos intravenosos y vasopresores (0.5 a 5 μg/kg/min de fenilefrina, 0.02 a 0.2 μg/kg/min de norepinefrina o 40 μg de vasopresina IV). Si hay insuficiencia miocárdica, es posible que se requiera epinefrina (1 a 5 μg/kg en bolo IV). Cuando la toxicidad progresa a un paro cardíaco, las pautas para el tratamiento de la toxicidad de LA desarrolladas por la Sociedad Estadounidense de Anestesia Regional y Medicina del Dolor (ASRA) son razonables y ciertamente preferibles a los caóticos esquemas de reanimación identificados en una encuesta nacional anterior a la publicación del guía. Tiene sentido que la amiodarona se sustituya por lidocaína y, en base a múltiples experimentos con animales, que se usen inicialmente dosis incrementales más pequeñas de epinefrina en lugar de bolos de 1 mg. Los experimentos con animales y los informes clínicos demuestran la notable capacidad de la infusión de lípidos para resucitar de un paro cardíaco inducido por bupivacaína.Figura 13 y XNUMX).Dado el estado casi no tóxico de la infusión de lípidos, no se puede presentar un argumento convincente para negar esta terapia a un paciente que requiere reanimación por intoxicación por LA. Si la toxicidad cardíaca por bupivacaína no responde, se debe considerar la derivación cardiopulmonar. Parece que la amenaza de toxicidad sistémica grave por anestésicos locales puede estar disminuyendo, ya sea por un mejor tratamiento o por cambios en las técnicas. Una minoría argumentaría que el riesgo fue exagerado desde el principio, al menos en manos experimentadas. Muchos médicos creen que la guía por ultrasonido durante los bloqueos de nervios periféricos ha dado lugar a prácticas más seguras y con menos riesgos. Si bien este punto de vista sigue siendo controvertido, hay estudios que respaldan esta creencia.
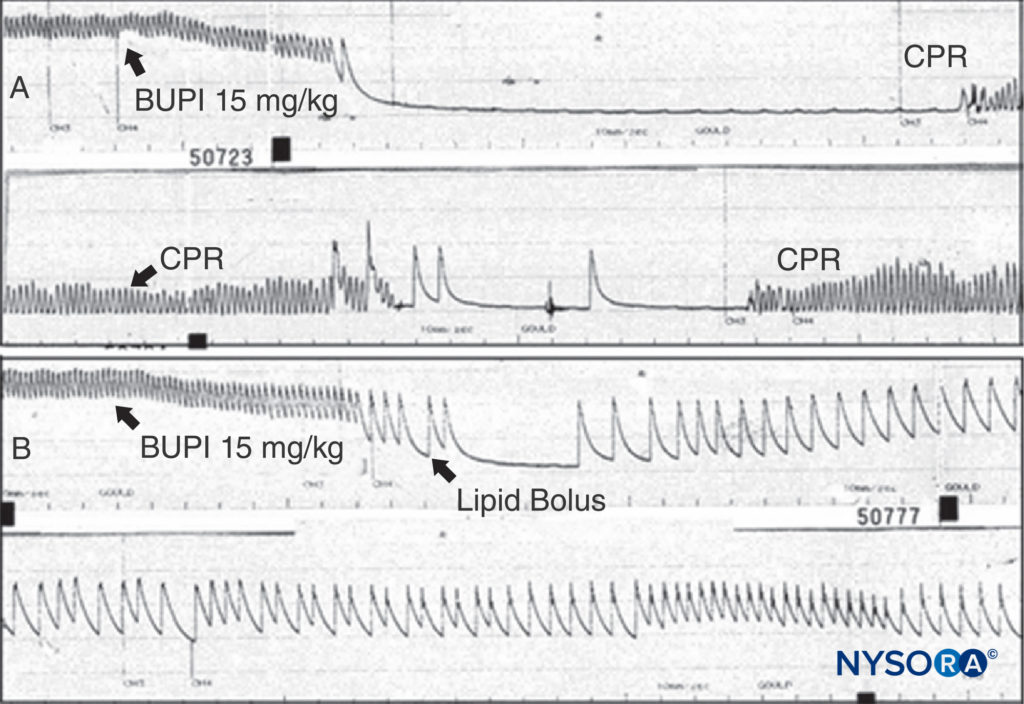
FIGURA 13. R: A una rata anestesiada se le administra bupivacaína 15 mg/kg como se indica. La presión sanguínea arterial desciende rápidamente hasta un paro cardíaco. Se administra reanimación cardiopulmonar (RCP), pero no se observa presión arterial cuando se interrumpe la RCP. B: Se realiza el mismo experimento, pero se administra un bolo de lípido; tenga en cuenta que la presión arterial nunca se pierde (a pesar de que se use la misma dosis de bupivacaína), y que no se produce un paro cardíaco. (Reproducido con permiso de Weinberg G: Conceptos actuales en resucitación de pacientes con toxicidad cardíaca por anestesia local. Reg Anesth Pain Med. 2002 Nov-Dec;27(6):568-575.)
RESUMEN
Después de más de un siglo de uso en la medicina occidental, los AL siguen siendo herramientas importantes para el médico del siglo XXI. Es casi seguro que los bloqueos de nervios periféricos son el resultado de la inhibición por LA de los canales de Na dependientes de voltaje en las membranas neuronales. Los mecanismos de la anestesia raquídea y epidural siguen estando incompletamente definidos. La dosis adecuada y segura de AL varía según el procedimiento de bloqueo nervioso específico. Es probable que varíen los mecanismos por los cuales los diferentes LA producen toxicidad CV: los agentes más potentes (p. ej., bupivacaína) pueden producir arritmias a través de la acción de un canal de Na, mientras que los agentes menos potentes (p. ej., lidocaína) pueden producir depresión miocárdica a través de otras vías. Los temores sobre la toxicidad sistémica de LA han disminuido con LA más seguros, prácticas de anestesia regional más seguras y tratamientos mejorados. Hay un esfuerzo renovado para producir formulaciones de anestésicos locales de liberación retardada clínicamente aplicables para extender la duración de los AL actualmente disponibles.
Referencias
- Vandam LD: Algunos aspectos de la historia de la anestesia local. En Strichartz GR (ed): Anestésicos locales: Manual de farmacología experimental. Springer-Verlag, 1987, págs. 1–19.
- Calatayud J, Gonzalez A: Historia del desarrollo y evolución de la anestesia local desde la hoja de coca. Anestesiología 2003;98:1503–1508.
- Strichartz GR: Anestésicos locales: Manual de Farmacología Experimental. Springer-Verlag, 1987.
- de Jong RH: Anestésicos locales. Anuario de Mosby, 1994.
- Claves TE: Historia de la Anestesia Quirúrgica. Biblioteca de Madera, Museo de Anestesiología, 1996.
- Butterworth JF IV, Strichartz GR: Mecanismos moleculares de la anestesia local: una revisión. Anestesiología 1990;72:711–734.
- Tetzlaff J: Farmacología clínica de los anestésicos locales. Butterworth-Heinemann, 2000.
- Ahern CA, Payandeh J, Bosmans F, Chanda B. La guía del autoestopista a la galaxia del canal de sodio dependiente de voltaje. J Gen Physiol. 2016;147:1–24.
- de Lera Ruiz M, Kraus RL. Canales de sodio activados por voltaje: estructura, función, farmacología e indicaciones clínicas. J Med Chem. 2015;58:7093–7118.
- Lopreato GF, Lu Y, Southwell A, et al: Evolución y divergencia de los genes del canal de sodio en vertebrados. Proc Natl Acad Sci USA 2001; 98:7588–7592.
- Savio-Galmiberti E. Gollob MH, Darbar D: Canales de sodio activados por voltaje: biofísica, farmacología y canalopatías relacionadas. Front Pharmacol 2012;3:1–19
- Chen-Izu Y, Shaw RM, Pitt GS, et al. Función, regulación, estructura, tráfico y secuestro de los canales de Na+. J Physiol. 2015;593:1347–1360
- Hille B: Canales iónicos de membranas excitables, 3.ª ed. Sinauer, 2001.
- Jiang Y, Lee A, Chen J, et al: Estructura de rayos X de un canal de K+ dependiente de voltaje. Naturaleza 2003; 423: 33–41.
- Freites JA, Tobías DJ. Detección de voltaje en membranas: desde corrientes macroscópicas hasta movimientos moleculares. J Membra Biol. 2015;248:419–430.
- Taylor RE. Efecto de la procaína sobre las propiedades eléctricas de la membrana del axón del calamar. Am J Physiol 1959; 196: 1070–1078.
- Strichartz GR. La inhibición de las corrientes de sodio en el nervio mielinizado por derivados cuaternarios de la lidocaína. J Gen Physiol. 1973;62:37–57.
- Ragsdale DS, McPhee JC, Scheuer T, et al: Determinantes moleculares del bloqueo dependiente del estado de los canales de Na+ por anestésicos locales. Ciencia 1994; 265: 1724–1728.
- Wang GK, Quan C, Wang S: Un receptor anestésico local común para la benzocaína y la etidocaína en los canales mu1 Na+ dependientes de voltaje. Arco de Pflugers 1998;435:293–302.
- Sudoh Y, Cahoon EE, Gerner P, et al: Antidepresivos tricíclicos como anestésicos locales de acción prolongada. Dolor 2003;103:49–55.
- Kohane DS, Lu NT, Gokgol-Kline AC, et al: Las propiedades anestésicas locales y la toxicidad de los homólogos de saxitonina para el bloqueo del nervio ciático en ratas in vivo. Reg Anesth Pain Med 2000;25:52–59.
- Butterworth JF IV, Strichartz GR: Los agonistas alfa 2-adrenérgicos clonidina y guanfacina producen un bloqueo tónico y fásico de la conducción en las fibras del nervio ciático de rata. Anesth Analg 1993;76:295–301.
- Sanchez V, Arthur GR, Strichartz GR: Propiedades fundamentales de los anestésicos locales. I. La dependencia de la ionización de la lidocaína y la partición octanol:tampón del solvente y la temperatura. Anesth Analg 1987;66: 159–165.
- Strichartz GR, Sanchez V, Arthur GR, et al: Propiedades fundamentales de los anestésicos locales. II. Coeficientes de reparto octanol:tampón medidos y valores de pKa de fármacos utilizados clínicamente. Anesth Analg 1990;71:158–170.
- Popitz-Bergez FA, Leeson S, Strichartz GR, et al: Relación entre el déficit funcional y la anestesia local intraneural durante el bloqueo de los nervios periféricos. Un estudio en el nervio ciático de rata. Anestesiología 1995;83:583–592.
- Sinnott CJ, Cogswell LP III, Johnson A, et al: Sobre el mecanismo por el cual la epinefrina potencia el bloqueo nervioso periférico de la lidocaína. Anestesiología 2003;98:181–188.
- Nakamura T, Popitz-Bergez F, Birknes J, et al: El papel crítico de la concentración para el bloqueo de lidocaína del nervio periférico in vivo: Estudios de función y absorción de fármacos en la rata. Anestesiología 2003;99: 1189–1197.
- Brouneus F, Karami K, Beronius P, et al: Propiedades de transporte difusivo de algunos anestésicos locales aplicables para la formulación iontoforética de los fármacos. Int J Pharm 2001;218:57–62.
- Gissen AJ, Covino BG, Gregus J: sensibilidades diferenciales de las fibras nerviosas de mamíferos a los agentes anestésicos locales. Anestesiología 1980;53:467–474.
- Raymond SA, Gissen AJ: Mecanismos de bloqueo nervioso diferencial. En Strichartz GR (ed): Manual de farmacología experimental: anestésicos locales. Springer-Verlag, 1987, págs. 95–164.
- Butterworth J, Ririe DG, Thompson RB, et al: Inicio diferencial del bloqueo del nervio mediano: comparación aleatorizada, doble ciego de mepivacaína y bupivacaína en voluntarios sanos. Br. J. Anaesth 1998; 81:515–521.
- Novakovic SD, Eglen RM, Hunter JC: Regulación de la distribución de canales de Na+ en el sistema nervioso. Tendencias Neurosci 2001;24:473–478.
- Covino BG, Vasallo HG: Anestésicos locales. Grune y Stratton, 1976.
- Kohane DS, Lu NT, Cairns BE, et al: Efectos de los agonistas y antagonistas adrenérgicos en el bloqueo nervioso inducido por tetrodotoxina. Reg Anesth Pain Med 2001;26:239–245.
- Butterworth JF IV, Lief PA, Strichartz GR: La actividad anestésica local dependiente del pH del dietilaminoetanol, un metabolito de la procaína. Anestesiología 1988;68:501–506.
- Fagraeus L, Urban BJ, Bromage PR: Propagación de la analgesia epidural en el embarazo temprano. Anestesiología 1983;58:184–187.
- Butterworth JF IV, Walker FO, Lysak SZ: El embarazo aumenta la susceptibilidad del nervio mediano a la lidocaína. Anestesiología 1990;72:962–965.
- Popitz-Bergez FA, Leeson S, Thalhammer JG, et al: captación de lidocaína intraneural en comparación con las diferencias analgésicas entre ratas preñadas y no preñadas. Reg Anesth 1997;22:363–371.
- Scott DB, Jebson PJ, Braid DP, et al: Factores que afectan los niveles plasmáticos de lignocaína y prilocaína. Hermano J Anaesth 1972;44:1040–1049.
- Rosenberg PH, Veering BTh, Urmey WF: Dosis máximas recomendadas de anestésicos locales: un concepto multifactorial. Reg Anesth Pain Med 2004;29:564–575.
- Taheri S, Cogswell LP III, Gent A, et al: Factores hidrofóbicos e iónicos en la unión de los anestésicos locales a la variante principal de la glicoproteína ácida alfa1 humana. J Pharmacol Exp Ther 2003;304:71–80.
- Fragneto RY, Bader AM, Rosinia F, et al: Mediciones de la unión a proteínas de la lidocaína durante el embarazo. Anesth Analg 1994;79: 295–297.
- Thomas JM, Schug SA: Avances recientes en la farmacocinética de los anestésicos locales. Enantiómeros de amida de acción prolongada e infusiones continuas. Clin Pharmacokinet 1999;36:67–83.
- Rothstein P, Arthur GR, Feldman HS, et al: Bupivacaína para bloqueos nerviosos intercostales en niños: Concentraciones en sangre y farmacocinética. Anesth Analg 1986;65:625–632.
- Bokesch PM, Castaneda AR, Ziemer G, et al: La influencia de un cortocircuito cardíaco de derecha a izquierda en la farmacocinética de la lidocaína. Anestesiología 1987; 67:739–744.
- Palkama VJ, Neuvonen PJ, Olkkola KT: Efecto del itraconazol sobre la farmacocinética de los enantiómeros de bupivacaína en voluntarios sanos. Hermano J Anaesth 1999;83:659–661.
- Oda Y, Furuichi K, Tanaka K, et al: Metabolismo de un nuevo anestésico local, ropivacaína, por el citocromo P450 hepático humano. Anestesiología 1995; 82:214–220.
- Ekstrom G, Gunnarsson UB: La ropivacaína, un nuevo agente anestésico local de tipo amida, es metabolizado por los citocromos P450 1A y 3A en microsomas hepáticos humanos. Drug Metab Dispos 1996;24:955–961.
- Hirota K, Browne T, Appadu BL, et al: ¿Los anestésicos locales interactúan con los sitios de unión de dihidropiridina en los canales neuronales de Ca2+ tipo L? Hermano J Anaesth 1997;78:185–188.
- Olschewski A, Olschewski H, Brau ME, et al: Efecto de la bupivacaína en los canales de potasio dependientes de ATP en cardiomiocitos de rata. Hermano J Anaesth 1999;82:435–438.
- Sugimoto M, Uchida I, Fukami S, et al: Los efectos dependientes de las subunidades alfa y gamma de los anestésicos locales en los receptores GABA(A) recombinantes. Eur J Pharmacol 2000;401:329–337.
- Englesson S, Grevsten S: La influencia de los cambios ácido-base en la toxicidad del sistema nervioso central de los agentes anestésicos locales. II. Acta Anaesthesiol Scand 1974;18:88–103.
- Feldman HS, Arthur GR, Covino BG: Toxicidad sistémica comparativa de dosis convulsivas y supraconvulsivas de ropivacaína, bupivacaína y lidocaína intravenosas en perros conscientes. Anesth Analg 1989;69: 794–801.
- Porter JM, Markos F, Snow HM, et al: Efectos de los cambios de pH respiratorios y metabólicos y la hipoxia en la cardiotoxicidad inducida por ropivacaína en perros. Hermano J Anaesth 2000;84:92–94.
- Chernoff DM: Análisis cinético de la inhibición fásica de las corrientes neuronales de sodio por lidocaína y bupivacaína. Biophys J 1990;58:53–68.
- Feldman HS, Covino BM, Sage DJ: Efectos cronotrópicos e inotrópicos directos de los agentes anestésicos locales en aurículas aisladas de conejillo de Indias. Reg Anesth 1982;7:149–156.
- Reiz S, Nath S: Cardiotoxicidad de los agentes anestésicos locales. Hermano J Anaesth 1986;58:736–746.
- McCaslin PP, Butterworth J: La bupivacaína suprime las oscilaciones de [Ca(2+)](i) en cardiomiocitos de rata neonatal con un aumento de K+ extracelular y se invierte con un aumento de Mg(2+) extracelular. Anesth Analg 2000;91:82–88.
- Butterworth JF IV, Brownlow RC, Leith JP, et al: La bupivacaína inhibe la producción de monofosfato de 3',5'-adenosina cíclica. Un posible factor que contribuye a la toxicidad cardiovascular. Anestesiología 1993;79:88–95.
- Butterworth J, James RL, Grimes J: relaciones de estructura-afinidad y estereoespecificidad de varias series homólogas de anestésicos locales para el receptor beta2-adrenérgico. Anesth Analg 1997;85:336–342.
- Ohmura S, Kawada M, Ohta T, et al: Toxicidad sistémica y resucitación en ratas infundidas con bupivacaína, levobupivacaína o ropivacaína. Anesth Analg 2001;93:743–748.
- Dony P, Dewinde V, Vanderick B, et al: La toxicidad comparativa de ropivacaína y bupivacaína en dosis equipotentes en ratas. Anesth Analg 2000;91:1489–1492.
- Chang DH, Ladd LA, Copeland S, et al: Efectos cardíacos directos de la bupivacaína intracoronaria, la levobupivacaína y la ropivacaína en las ovejas. BrJ Pharmacol 2001;132:649–658.
- Groban L, Deal DD, Vernon JC, et al: arritmias ventriculares con o sin estimulación eléctrica programada después de una sobredosis incremental con lidocaína, bupivacaína, levobupivacaína y ropivacaína. Anesth Analg 2000;91:1103–1111.
- Groban L, Deal DD, Vernon JC, et al: Reanimación cardíaca después de una sobredosis incremental con lidocaína, bupivacaína, levobupivacaína y ropivacaína en perros anestesiados. Anesth Analg 2001;92:37–43.
- Groban L, Deal DD, Vernon JC, et al: ¿La estereoselectividad o la estructura del anestésico local predicen la depresión miocárdica en caninos anestesiados? Reg Anesth Pain Med 2002;27:460–468.
- Nath S, Haggmark S, Johansson G, et al: Depresor diferencial y cardiotoxicidad electrofisiológica de los anestésicos locales: un estudio experimental con especial referencia a la lidocaína y la bupivacaína. Anesth Analg 1986;65:1263–1270.
- Carpenter RL, Kopacz DJ, Mackey DC: Precisión de las mediciones de flujo capilar con láser Doppler para predecir la pérdida de sangre por incisiones en la piel en cerdos. Anesth Analg 1989;68:308–311.
- deShazo RD, Nelson HS: Un abordaje del paciente con antecedentes de hipersensibilidad a los anestésicos locales: Experiencia con 90 pacientes. J Allergy Clin Immunol 1979;63:387–394.
- Berkun Y, Ben-Zvi A, Levy Y, et al: Evaluación de las reacciones adversas a los anestésicos locales: experiencia con 236 pacientes. Ann Allergy Asthma Immunol 2003;91:342–345.
- Gissen AJ, Datta S, Lambert D: La controversia de la cloroprocaína. I. Una hipótesis para explicar las complicaciones neurales de la cloroprocaína epidural. Reg Anesth 1984;9:124–134.
- Gissen AJ, Datta S, Lambert D: La controversia de la cloroprocaína. II. ¿La cloroprocaína es neurotóxica? Reg Anesth 1984;9:135–145.
- Winnie AP, Nader AM: La profecía de Santayana cumplida. Reg Anesth Pain Med 2001;26:558–564.
- Kouri ME, Kopacz DJ: 2-cloroprocaína espinal: una comparación con la lidocaína en voluntarios. Anesth Analg 2004;98:75–80.
- Taniguchi M, Bollen AW, Drasner K: bisulfito de sodio: ¿chivo expiatorio de la neurotoxicidad de la cloroprocaína? Anestesiología 2004;100:85–91.
- Lambert LA, Lambert DH, Strichartz GR: bloqueo de conducción irreversible en nervio aislado por altas concentraciones de anestésicos locales. Anestesiología 1994;80:1082–1093.
- Gold MS, Reichling DB, Hampl KF, et al: Toxicidad de la lidocaína en las neuronas aferentes primarias de la rata. J Pharmacol Exp Ther 1998;285:413–421.
- Neal JM, Bernards CM, Butterworth JF 4th, et al. Asesoramiento práctico de la ASRA sobre la toxicidad sistémica de los anestésicos locales. Reg Anesth Dolor Med. 2010;35: 152–61
- Corcoran W, Butterworth J, Weller RS, et al. Toxicidad cardíaca inducida por anestésicos locales: una encuesta de estrategias de práctica contemporánea entre los departamentos académicos de anestesiología. Analgésico Anesth. 2006;103:1322–6
- El-Boghdadly K, Chin KJ. Toxicidad sistémica de los anestésicos locales: desarrollo profesional continuo. Can J Anaesth. 2016;63:330–349
- Krismer AC, Hogan QH, Wenzel V, et al: La eficacia de la epinefrina o la vasopresina para la reanimación durante la anestesia epidural. Anesth Analg 2001;93:734–742.
- Mayr VD, Raedler C, Wenzel V, et al: Una comparación de epinefrina y vasopresina en un modelo porcino de paro cardíaco después de una inyección intravenosa rápida de bupivacaína. Anesth Analg 2004;98:1426–1431.
- Weinberg GL, VadeBoncouer T, Ramaraju GA, et al: El tratamiento previo o la reanimación con una infusión de lípidos cambia la dosis-respuesta a la asistolia inducida por bupivacaína en ratas. Anestesiología 1998;88:1071–1075.
- Weinberg G, Ripper R, Feinstein DL, et al: La infusión de emulsión de lípidos rescata a los perros de la toxicidad cardíaca inducida por la bupivacaína. Reg Anesth Pain Med 2003;28:198–202.
- Fettiplace MR, Weinberg G. Pasado, presente y futuro de la terapia de reanimación con lípidos. JPEN J Parenter Nutrición enteral. 2015;39(1 suplemento): 72S-83S.
- Soltesz EG, van Pelt F, Byrne JG: derivación cardiopulmonar emergente para la cardiotoxicidad por bupivacaína. J Cardiothorac Vasc Anesth 2003;17: 357–358.
- Vasques F, Behr AU, Weinberg G, et al. Una revisión de los casos de toxicidad sistémica de los anestésicos locales desde la publicación de las recomendaciones de la Sociedad Estadounidense de Anestesia Regional: A quien corresponda. Reg Anesth Dolor Med. 2015;40:698–705.
- Liu SS, Ortolan S, Sandoval MV, Curren J, Fields KG, Memtsoudis SG, YaDeau JT. Paro cardíaco y convulsiones causados por toxicidad sistémica por anestésicos locales después de bloqueos de nervios periféricos: ¿debemos seguir temiendo al segador? Reg Anesth Dolor Med. 2016;4:5–21.
- Barrington MJ, Kluger R. La guía por ultrasonido reduce el riesgo de toxicidad sistémica del anestésico local después del bloqueo de los nervios periféricos. Reg Anesth Dolor Med. 2013;38:289–299.
- Neal JM, Brull R, Horn JL, et al. La Segunda Sociedad Estadounidense de Anestesia Regional y Medicina del Dolor Evaluación de Medicina Basada en Evidencia de Anestesia Regional Guiada por Ultrasonido: Resumen Ejecutivo. Reg Anesth Dolor Med. 2016;41:181–194

