Belén de José María, Luc Tielens y Steve Roberts
ANESTESIA EPIDURAL EN NIÑOS
INTRODUCCIÓN
La analgesia epidural se usa comúnmente además de la anestesia general y para controlar el dolor posoperatorio. El alivio efectivo del dolor posoperatorio con la analgesia epidural tiene numerosos beneficios, entre ellos, una deambulación más temprana, facilitando el destete de los ventiladores, reduciendo el tiempo que se pasa en un estado catabólico y disminuyendo los niveles circulantes de la hormona del estrés. La colocación precisa de agujas epidurales para técnicas de inyección única y catéteres para anestesia epidural continua asegura que los dermatomas involucrados en el procedimiento quirúrgico se bloqueen selectivamente, lo que permite usar dosis más bajas de anestésicos locales y evitar bloqueos innecesarios en regiones no deseadas. El abordaje del espacio epidural puede ser a nivel caudal, lumbar o torácico.
IMPLICACIONES ANATÓMICAS Y FISIOLÓGICAS
Existen diferencias anatómicas significativas en los niños en comparación con los adultos que deben tenerse en cuenta al usar anestesia neuroaxial. Por ejemplo, en los recién nacidos y los lactantes, el cono medular está situado más abajo en la columna vertebral (aproximadamente en la vértebra L3) en comparación con el de los adultos, en quienes está situado aproximadamente en la vértebra L1. Este es el resultado de diferentes tasas de crecimiento entre la médula espinal y la columna vertebral ósea en los bebés. Sin embargo, aproximadamente al año de edad, el cono medular alcanza el nivel L1 similar al de un adulto.
Consejos NYSORA
- En recién nacidos y lactantes, el cono medular termina aproximadamente en el nivel de L3, a diferencia de los adultos, donde se ubica aproximadamente en la vértebra L1.
- Aproximadamente al año de edad, el cono medular alcanza el nivel L1, similar al de un adulto.
El sacro de los niños también es más plano y estrecho en comparación con la población adulta. Al nacer, la placa sacra, que está formada por cinco vértebras sacras, no está completamente osificada y continúa fusionándose hasta aproximadamente los 8 años (aunque puede tardar hasta los 21 años). Hay una incidencia del 6% de atresia sacra. La fusión incompleta del arco vertebral sacro forma el hiato sacro. Se puede acceder fácilmente al espacio epidural caudal en lactantes y niños a través del hiato sacro. Debido al desarrollo continuo del techo del canal sacro, existe una variación considerable en el hiato sacro. En los niños pequeños, el hiato sacro se localiza más cefálicamente que en los niños mayores, y el saco dural puede terminar más caudalmente: en S4 en lactantes menores de 1 año y en S2 en niños mayores. Por lo tanto, debido al mayor riesgo de punción dural accidental, se recomienda precaución al colocar bloqueos caudales en lactantes.
Consejos NYSORA
- En los niños pequeños, el hiato sacro se localiza más cefálicamente que en los niños mayores, y el saco dural puede terminar más caudalmente (en S4 en lactantes menores de 1 año).
- Se recomienda precaución con el uso de bloqueos caudales en lactantes debido al riesgo de punción dural.
La evaluación por ultrasonido (US) de las estructuras neuroaxiales es menos desafiante en los niños más pequeños porque la osificación está menos desarrollada. En los lactantes, las fibras de la médula espinal, el líquido cefalorraquídeo (LCR) y la duramadre se identifican fácilmente mediante sondas de ecografía lineales de alta frecuencia. También se ha sugerido que la grasa epidural está menos densamente empaquetada en niños que en adultos. La grasa epidural suelta puede facilitar la difusión del anestésico local y ayudar a lograr un inicio más rápido del bloqueo. También puede permitir el avance sin obstáculos de los catéteres epidurales desde el espacio epidural caudal hasta los niveles lumbar y torácico. Sin embargo, la colocación final de la punta de un catéter se controla mejor directamente bajo la guía de ecografía o indirectamente mediante la identificación de la inyección de anestésico local.
La cantidad de LCR por peso corporal es mayor en recién nacidos y lactantes (4 ml/kg) en comparación con los adultos (2 ml/kg), y el LCR se localiza principalmente en el conducto raquídeo. Además, la médula espinal de los recién nacidos todavía no está mielinizada, lo que significa que se pueden usar de manera efectiva concentraciones más bajas de anestésico local. Debido a que los niños tienen un gasto cardíaco más alto en comparación con los adultos, la absorción sistémica del anestésico local ocurre más rápido. Esto puede conducir a niveles plasmáticos tóxicos y una duración más corta del bloqueo.
Consejos NYSORA
- En comparación con los niños mayores, el hiato sacro en los recién nacidos se encuentra más cefálico y el saco dural termina más abajo, lo que aumenta el riesgo de punción dural accidental.
- La ecografía se puede utilizar para evaluar la anatomía neuroaxial y el abordaje del espacio epidural.
ANESTÉSICOS LOCALES PARA LA ANESTESIA EPIDURAL EN NIÑOS
Dado que la mayoría de los pacientes pediátricos reciben analgesia epidural junto con un anestésico general, el objetivo principal del catéter epidural es administrar suficiente solución de anestésico local para una analgesia intraoperatoria y posoperatoria eficaz. Al igual que con la anestesia epidural en adultos, la concentración y el volumen del anestésico local son factores importantes para determinar la densidad y el nivel de bloqueo. Sin embargo, en pacientes pediátricos, el conocimiento de la dosis total del fármaco también es importante para evitar la toxicidad del anestésico local. Una descripción más detallada de las soluciones anestésicas locales, sus características y potencial de toxicidad se ha descrito en Farmacología Clínica de los Anestésicos Locales.
La bupivacaína, la ropivacaína y la levobupivacaína son los anestésicos locales más utilizados para la anestesia neuroaxial en niños. La lidocaína no se usa con frecuencia debido a su bloqueo motor excesivo. Como regla general, las concentraciones altas de anestésicos locales, como bupivacaína al 0.5% o ropivacaína al 0.5%, rara vez se usan en bloqueos epidurales en niños. En cambio, se utilizan con más frecuencia volúmenes más grandes de anestésico local más diluido para cubrir múltiples dermatomas. El peso corporal suele tener una mejor correlación que la edad del paciente para predecir la propagación del anestésico local después de un bloqueo caudal. La dosis máxima segura de bupivacaína es de 2.5 mg/kg. Para uso caudal, la concentración óptima de bupivacaína es 0.125%–0.175%. En comparación con la preparación al 0.25%, esta concentración proporciona una duración similar de la analgesia posoperatoria (4 a 8 horas) pero con menos bloqueo motor. Algunos médicos prefieren administrar dosis en base al volumen por peso. Una dosis de 1.0 ml/kg de una solución diluida, como bupivacaína al 0.125 %, hasta un volumen máximo de 20 ml, a veces puede proporcionar un bloqueo sensorial T10 sin exceder los niveles máximos recomendados en la literatura. En lactantes, se pueden administrar volúmenes más altos, como 1.25 ml/kg o incluso 1.5 ml/kg, para proporcionar un bloqueo más cefálico sin el riesgo de toxicidad del anestésico local. Para la infusión epidural continua, una pauta posológica comúnmente aceptada para la bupivacaína es de 0.2 mg/kg/h para recién nacidos y de 0.4 mg/kg/h para niños mayores. La toxicidad acumulativa es una preocupación incluso a tasas más bajas de infusiones de solución de anestésico local. Por lo tanto, la duración de las infusiones epidurales neonatales debe limitarse a 48 horas.
La ropivacaína tiene un índice terapéutico más alto que el antiguo anestésico local bupivacaína. En bajas concentraciones, la ropivacaína puede producir menos bloqueo motor y analgesia equivalente en comparación con la bupivacaína con una menor incidencia de toxicidad cardíaca y del sistema nervioso central. Debido a sus posibles propiedades vasoconstrictoras, la ropivacaína puede sufrir una absorción sistémica más lenta que la bupivacaína. Esto puede tener implicaciones clínicas cuando se utiliza una infusión prolongada de anestésico local en niños con insuficiencia hepática. Para un bloqueo caudal de una sola inyección, se recomienda un bolo de 1 ml/kg de ropivacaína al 0.2 %. Una infusión de ropivacaína al 0.1% a razón de 0.2 mg/kg/h en lactantes y 0.4 mg/kg/h en niños mayores, con una duración no superior a 48 horas, también ha demostrado ser eficaz y segura.
La levobupivacaína, el isómero S (-) de la bupivacaína, es menos probable que cause depresión miocárdica y arritmias letales y también es menos tóxica para el sistema nervioso central que la bupivacaína racémica. Una dosis de 0.8 ml/kg de levobupivacaína al 0.25 % inyectada caudalmente proporciona analgesia en niños sometidos a cirugía de pene o ingle. Para la infusión epidural continua, la dosis de levobupivacaína es similar a la de la bupivacaína racémica.
Consejos NYSORA
- Las concentraciones altas de anestésico local, como bupivacaína al 0.5% o ropivacaína al 0.5%, no se recomiendan en la población pediátrica. Como la mielinización no es completa, son eficaces concentraciones más bajas de anestésicos locales de aminoamida (p. ej., 0.125% de levobupivacaína).
- En cambio, se utilizan con más frecuencia volúmenes más grandes de anestésicos locales más diluidos para cubrir varios dermatomas de interés.
- En los pacientes pediátricos, el peso corporal proporciona una mejor correlación que la edad del paciente para predecir la propagación del anestésico local después de un bloqueo caudal.
- Una regla sencilla para una única inyección caudal en niños de menos de 20 kg es usar bupivacaína al 0.125 %–0.175 % o ropivacaína al 0.2 % y administrar un bolo de uno de los siguientes:
- 0.5 ml/kg para lograr un nivel quirúrgico sacro
- 1.0 ml/kg para conseguir un alto nivel quirúrgico lumbar
- 1.25 ml/kg para conseguir un nivel quirúrgico torácico bajo
- Para la infusión epidural continua, a menudo se usa bupivacaína al 0.125% a razón de 0.2 mg/kg/h para recién nacidos y 0.4 mg/kg/h para niños mayores. La ropivacaína al 0.1% a razón de 0.2 mg/kg/h para recién nacidos y 0.4 mg/kg/h para niños mayores durante 48 horas ha demostrado ser un régimen eficaz y seguro.
ADYUVANTES PARA LA ANESTESIA EPIDURAL EN NIÑOS
El bloqueo caudal de una sola inyección con anestésico local se usa principalmente para cirugía menor debido a la duración limitada de la analgesia. Se pueden usar adyuvantes para prolongar la duración del bloqueo y se han probado varios fármacos. El adyuvante más utilizado para los anestésicos locales ha sido la epinefrina. La epinefrina en una concentración de 1:200,000 XNUMX se usa para disminuir la tasa de absorción del anestésico local y tiene el beneficio adicional de servir como un posible marcador para una inyección intravascular inadvertida. Investigaciones recientes se han centrado en el uso de una multitud de adyuvantes. También se han estudiado midazolam y neostigmina; sin embargo, no hay evidencia de que estos fármacos proporcionen algún beneficio analgésico cuando se administran por vía epidural. Los opioides, la clonidina y la ketamina merecen más consideración y, por lo tanto, se analizarán con mayor detalle.
Opioides
Los opioides epidurales pueden potenciar el efecto de los anestésicos locales y prolongar la analgesia. Sin embargo, algunos opioides pueden no ser recomendables en un entorno ambulatorio debido al potencial de depresión respiratoria y otros efectos secundarios inaceptables (p. ej., náuseas y vómitos, picazón, retención urinaria). Como resultado, el uso de opioides epidurales caudales en niños debe restringirse a situaciones clínicas especiales fuera del entorno ambulatorio. Se ha recomendado una dosis de 2 mcg/kg de fentanilo para anestesia caudal de inyección única junto con la solución estándar de anestésico local para procedimientos más extensos o dolorosos y en pacientes que tienen un catéter urinario en el postoperatorio. La adición de 1 a 2 mcg/ml de fentanilo a la bupivacaína al 0.1 % para infusiones epidurales continuas también se ha utilizado con éxito en niños en un entorno hospitalario bien supervisado. Sin embargo, el fentanilo no debe usarse en infusiones epidurales neonatales. La morfina epidural también puede usarse en pacientes hospitalizados que se someten a una cirugía mayor abdominal o torácica. Cuando se agrega a bloqueos epidurales caudales de inyección única, mejorará el nivel de bloqueo debido a su dispersión rostral (ya que la morfina es una molécula hidrófila). Las dosis de morfina caudal varían de 30 a 90 mcg/kg según el tipo de cirugía. La morfina epidural conlleva un riesgo potencial de depresión respiratoria; por lo tanto, se recomienda la oximetría de pulso continua con dosis más bajas de morfina caudal y es obligatoria con dosis medias. Cuando se utilizan dosis más altas de morfina caudal, se debe planificar el ingreso postoperatorio a cuidados intensivos.
La clonidina
De los diversos complementos no opiáceos utilizados en los bloqueos epidurales en niños, la clonidina ofrece el mejor perfil. La clonidina es un agonista α1 y actúa estimulando las vías meduloespinales noradrenérgicas descendentes, lo que inhibe la liberación de neurotransmisores nociceptivos en el asta dorsal de la médula espinal. La adición de clonidina (1 a 5 mcg/kg) puede mejorar el efecto analgésico de los anestésicos locales para el bloqueo caudal de una sola inyección y prolongar la duración de la acción del anestésico local sin los efectos secundarios no deseados de los opioides epidurales. Para infusiones epidurales continuas, se ha utilizado clonidina 0.1 mcg/kg/h con buenos resultados. Debe advertirse que las dosis más altas se han asociado con sedación e inestabilidad hemodinámica en forma de hipotensión y bradicardia. Con dosis en bolo de 2 mcg/kg, estos efectos secundarios son inusuales. Además, la clonidina epidural atenúa la respuesta ventilatoria a niveles crecientes de dióxido de carbono (PCO2) al final de la espiración. Aunque la depresión respiratoria no parece ser un problema común, se informó apnea en un recién nacido a término que recibió un bloqueo caudal que constaba de 1 ml/kg de ropivacaína al 0.2 % con clonidina 2 mcg/kg. Se debe tener precaución cuando se usa clonidina en bebés muy pequeños debido a la sedación e hipotensión que pueden producirse.
Ketamina
La adición de S-ketamina a un bloqueo caudal de una sola inyección prolonga el efecto analgésico de los anestésicos locales. Las principales desventajas de la ketamina son sus efectos psicomiméticos. Sin embargo, en dosis pequeñas (0.25 a 0.5 mg/kg), la ketamina es eficaz sin efectos secundarios perceptibles en el comportamiento. La ketamina 1 mg/kg también se puede utilizar como un analgésico caudal efectivo únicamente sin la adición de una solución anestésica local. Se ha demostrado que la combinación de S (+)-ketamina (0.5-1 mg/kg) y clonidina (1 o 2 mcg/kg) proporciona una analgesia eficaz después de una herniotomía inguinal en niños con una duración prolongada del efecto (> 20 horas) sin ningún efecto adverso sobre el sistema nervioso central (SNC) o deterioro motor. Una preocupación con respecto al uso de ketamina en recién nacidos se relaciona con una controvertida serie de estudios en animales que sugieren que la ketamina puede producir neurodegeneración apoptótica en el cerebro en desarrollo. Otros estudios en animales lactantes han demostrado que la ketamina puede tener un efecto neuroprotector. Sin embargo, muchos anestesiólogos dudan en introducir la S-ketamina caudal en su práctica clínica de rutina, y es poco probable que la ketamina sea ampliamente adoptada en países donde las fórmulas sin conservantes no están disponibles.
COMPLICACIONES ASOCIADAS A LA ANESTESIA EPIDURAL
Las complicaciones mayores de los bloqueos epidurales continuos o de una sola inyección son raras si se utiliza la técnica adecuada.
Lesión neurológica
Un gran estudio prospectivo, que resumió datos de más de 15,000 1995 bloqueos centrales en niños, no informó incidencia de lesiones neurológicas permanentes y concluyó que la incidencia de complicaciones es rara. Sin embargo, se informaron tres muertes infantiles y otras dos incidencias de paraplejía y tetraplejía en otro gran informe retrospectivo publicado en 24,000 con más de XNUMX XNUMX bloqueos epidurales en niños. Este estudio también informó dos casos de parestesia transitoria. Aunque el riesgo general parece bajo, pueden ocurrir complicaciones devastadoras por daño directo a la médula espinal, particularmente con la colocación de agujas epidurales torácicas y lumbares altas. Además, la hipotensión puede comprometer la perfusión espinal. Debido a que la colocación de agujas y catéteres epidurales generalmente se realiza con el paciente bajo sedación o anestesia general, el hecho de que los pacientes inconscientes no puedan reportar dolor o parestesia (la señal de advertencia actualmente aceptada de la invasión de la aguja en la médula espinal) genera preocupación. Se ha sugerido como medida de seguridad mantener al paciente respirando espontáneamente mientras se realiza el bloqueo neuroaxial. Se recomienda encarecidamente la ecografía previa al procedimiento de la anatomía neuroaxial, cuando esté disponible, para evaluar la profundidad del espacio epidural.
Un informe de caso de lesión de la médula espinal después de colocar una inyección epidural torácica única bajo anestesia general para una apendicectomía destaca la importancia de la evaluación de rutina de la relación riesgo-beneficio de colocar una epidural torácica directa para una cirugía menos extensa. En particular, el uso de la colocación de catéteres epidurales torácicos y lumbares altos debe reservarse solo para procedimientos torácicos y abdominales extensos y debe ser realizado por anestesiólogos con experiencia en la colocación epidural torácica. Para minimizar el riesgo de lesión de la médula espinal (y el riesgo de punción), es importante conocer la profundidad esperada del espacio epidural. Como regla general, el espacio epidural en niños de más de 10 kg se encuentra en 1 mm/kg de peso corporal. Existen otras fórmulas basadas en el peso corporal o la edad del paciente para calcular esta profundidad. Sin embargo, la mejor opción es medir la profundidad mediante ecografía previa al procedimiento de la anatomía neuroaxial (Tabla 1)
Consejos NYSORA
Como regla general, el espacio epidural en niños de más de 10 kg se encuentra a una profundidad de 1 mm/kg de peso corporal. Sin embargo, la ecografía previa al procedimiento es útil para determinar la profundidad del espacio epidural.
TABLA 1. Fórmulas para determinar la profundidad del espacio epidural a partir de la piel.
| Nota: | Una evaluación de ultrasonido previa al procedimiento individual es el método preferido para determinar la profundidad del espacio epidural desde la piel. |
| 1. Estimación aproximada: 1 mm/kg de peso corporal | |
| 2. Profundidad (cm) = 1 + (0.15 × edad en años) | |
| 3. Profundidad (cm) = 0.8 + (0.05 × peso en kilogramos) |
Hematoma epidural
El hematoma epidural asociado con analgesia epidural en niños es raro. Esto puede deberse a que los protocolos de anticoagulación rara vez están indicados durante el período perioperatorio en pacientes pediátricos. No obstante, la analgesia epidural debe evitarse en pacientes con coagulopatía o trombocitopenia clínicamente significativa. Las pautas para el uso de anestesia epidural en pacientes adultos también deben aplicarse en pacientes pediátricos que reciben terapia antitrombótica o trombolítica.
Infección
Aunque la tasa general de infección asociada con los catéteres epidurales caudales parece ser baja, existen informes de casos aislados de infección relacionada con catéteres epidurales en niños. En comparación con los catéteres epidurales lumbares, existe cierta preocupación con respecto a la infección del catéter con el uso prolongado de catéteres colocados caudalmente debido a la proximidad del hiato sacro al recto. Aunque los estudios no han encontrado evidencia clínica de mayores tasas de infección con el abordaje caudal, se ha informado que la colonización bacteriana es mayor. Staphylococcus epidermidis es el microorganismo predominante colonizado en la piel y los catéteres de las epidurales lumbares y caudales. También se han encontrado bacterias gramnegativas en las puntas de los catéteres caudales. Incluso con los bloqueos caudales de inyección única ampliamente utilizados, aún pueden ocurrir infecciones como la osteomielitis sacra. Para reducir el riesgo de contaminación por heces y orina, se pueden utilizar técnicas como la tunelización del catéter y la fijación del catéter con un vendaje oclusivo en dirección cefálica. También se debe utilizar una técnica aséptica estricta que incluya el uso de un sistema de infusión cerrado estéril, y se debe tener cuidado para evitar traumatismos tisulares locales. También es importante la inspección diaria del vendaje y del sitio de entrada, aunque no se debe cambiar el vendaje a menos que sea estrictamente necesario. Si el niño presenta fiebre persistente superior a 38°C de origen desconocido, se debe retirar el catéter y enviarlo para cultivo.
Punción dural y cefalea pospunción dural
La punción de la duramadre durante la analgesia epidural caudal es poco común si se tiene cuidado de no introducir demasiado la aguja en el canal sacro. El uso de ecografías en tiempo real para controlar la posición de la aguja hace que este riesgo sea extremadamente bajo. El tratamiento para la cefalea posterior a la punción dural (CPPD) incluye reposo en cama, hidratación oral o intravenosa (IV), analgesia (p. ej., paracetamol regular, medicamentos antiinflamatorios no esteroideos [AINE]) y antieméticos. El reposo en cama, aunque alivia la severidad del dolor de cabeza, no tiene efecto sobre la incidencia o duración de la CPPD.
En adultos, la cafeína se ha utilizado tanto para la profilaxis como para el tratamiento de la CPPD. La cafeína provoca vasoconstricción cerebral al bloquear los receptores de adenosina, que dilatan los vasos cuando se activan. La reducción del flujo sanguíneo cerebral disminuye la cantidad de sangre en el cerebro y puede disminuir la tracción sobre las estructuras intracraneales sensibles al dolor, aliviando así la CPPD. Sin embargo, la cafeína no se usa con frecuencia en niños para aliviar la CPPD, y se desconoce la dosis óptima. El uso de parches hemáticos epidurales para tratar la CPPD se ha usado con éxito en adultos desde 1960. Ahora hay muchos informes de su uso exitoso en los niños también Se cree que un parche de sangre epidural es efectivo a través de la formación de una cubierta gelatinosa sobre el orificio de la duramadre por la sangre inyectada. A corto plazo, el parche de sangre epidural sella el orificio y alivia la hipotensión del LCR tanto por el efecto de masa del desplazamiento craneal del LCR como por el aumento del volumen y la presión intracraneales. La curación real tiene lugar a largo plazo. En niños, se recomienda inyectar aproximadamente 0.3 mL/kg de sangre autóloga en el paciente despierto o levemente sedado, si es posible, para detectar la aparición de síntomas radiculares. Una discusión más completa sobre CPPD se presenta en Dolor de cabeza por punción dural.
Efectos hemodinámicos y anestesia espinal total
Los cambios significativos en la presión arterial son poco comunes en pacientes pediátricos después de la administración precisa de analgesia epidural. Se ha encontrado que un bloqueo caudal simpático alto con inyección única a T6 no provoca cambios significativos en la frecuencia cardíaca, el índice cardíaco o la presión arterial en los niños. Incluso cuando el bloqueo epidural torácico se combina con anestesia general, la estabilidad cardiovascular generalmente se mantiene en pacientes pediátricos sanos. Por lo tanto, la hipotensión debe hacer sospechar una anestesia espinal total y/o una inyección intravascular que lleve a la toxicidad del anestésico local. Después de descartar estas complicaciones, se deben evaluar otras causas, como el estado de hidratación, la presión de llenado intravascular y el estado inotrópico, y la profundidad de la anestesia.
Si se ha producido anestesia espinal total, se deben proporcionar medidas de apoyo hasta que el efecto del bloqueo se haya disipado. Sin embargo, en el caso de una extensión potencialmente mortal de una anestesia espinal total, si las medidas de apoyo intentadas no son efectivas ni una opción, se puede considerar el lavado cerebroespinal como última maniobra. Un informe de caso sugirió que se pueden extraer 20 a 30 ml de LCR y reemplazarlos con 30 a 40 ml de solución salina normal sin conservantes, lactato de Ringer o Plasmalyte a través del catéter epidural. Esta intervención puede acortar el tiempo de recuperación, minimizar el daño neurotóxico potencial y reducir la incidencia de punción posterior a la duramadre. Sin embargo, a la luz de la experiencia e información limitadas sobre el lavado cerebroespinal, los riesgos y beneficios potenciales deben evaluarse caso por caso antes de usar esta técnica en niños.
Consejos NYSORA
- La anestesia epidural y la analgesia en niños por lo demás sanos rara vez provocan inestabilidad cardiovascular.
- La aparición de hipotensión debe hacer sospechar la anestesia espinal total y/o una inyección intravascular que conduce a la toxicidad del anestésico local.
- Después de descartar estas complicaciones, se deben evaluar otras causas, como el estado de hidratación, la presión de llenado intravascular y el estado inotrópico, y la profundidad de la anestesia.
Toxicidad Sistémica de Anestésicos Locales
Toxicidad sistémica del anestésico local (LAST) a menudo proviene de una inyección intravascular accidental en los vasos sanguíneos epidurales. Esta complicación a menudo se puede evitar mediante una aspiración cuidadosa y una dosificación de prueba. Tabla 2 resume las recomendaciones para la dosificación de prueba en el bloqueo epidural. Para un bloqueo caudal de una sola inyección, la punción vascular y la absorción del anestésico local son más probables cuando se utilizan agujas de punta afilada. Para la infusión epidural continua, los recién nacidos y los bebés muy pequeños tienen un mayor riesgo de toxicidad por anestésicos locales que los niños mayores. Se han informado convulsiones en niños que reciben infusiones continuas de anestésicos locales. Esto se puede evitar usando soluciones diluidas de anestésicos locales (≤ 0.125 % de bupivacaína) y siguiendo las recomendaciones de dosificación actuales (consulte “Anestésicos locales para la anestesia epidural en niños”, más arriba).
Lo que es más importante, la vigilancia atenta durante la administración de la analgesia epidural debe ser una prioridad. Las pautas para el tratamiento LAST deben estar fácilmente accesibles en todas las áreas del hospital donde se usan anestésicos locales. Todo el personal de las salas donde se atienden pacientes sometidos a infusión epidural debe estar capacitado en el reconocimiento de los síntomas y el tratamiento de LAST. Además, junto con el cuadro de observaciones del paciente, debe presentarse un registro completo de la técnica regional y la infusión utilizada en cada caso.
TABLA 2. Dosificación de prueba para bloqueo epidural.
| 1. | Use la dosificación de prueba de forma rutinaria, aunque la dosificación de prueba para todos los agentes disponibles no es 100% sensible. Además, debido a que la verdadera incidencia de la colocación intravascular es relativamente baja, la mayoría de las pruebas positivas (es decir, aumentos de la frecuencia cardíaca) serán falsos positivos. Cuando hay una respuesta dudosa, la repetición de la dosis de prueba aumenta la especificidad y la sensibilidad de la prueba. |
| 2. | Monitoree continuamente el ECG y cicle el manguito de presión arterial repetidamente. Con soluciones que contienen epinefrina, si la frecuencia cardíaca no aumenta, un aumento en la presión arterial debe hacer sospechar la colocación intravascular. |
| 3. | Evite realizar la dosificación de prueba cuando el niño se encuentre en un plano de anestesia muy leve o cuando haya estimulación (p. ej., cambio de posición del paciente en la mesa de operaciones, instrumentación de las vías respiratorias, incisión). Realizar la dosis de prueba en estas condiciones aumenta la probabilidad de falsos positivos, aumentos inducidos por la estimulación en la frecuencia cardíaca o la presión arterial. |
| 4. | Después de la dosis de prueba, el resto de la dosis completa debe administrarse de forma incremental. La dosificación incremental y el monitoreo continuo ayudan a aumentar las probabilidades de que se detecte una colocación intravascular y que se detenga la inyección adicional antes de que se administren las dosis completas de cardiodepresores. |
| 5. | Siempre que sea posible, mantenga al paciente bajo ventilación espontánea durante la colocación y la dosificación inicial del bloqueo epidural. Cualquier cambio en el patrón de respiración del paciente es una alerta de que puede haber tenido lugar una inyección intravascular o intratecal inadvertida: taquipnea si hay dolor en la inyección; depresión respiratoria si ha habido absorción sistémica del anestésico local; o taquipnea seguida de bradipnea causada por anestesia espinal total si se ha administrado anestesia local por vía intratecal. |
Otros efectos adversos
En una revisión retrospectiva basada en datos prospectivos recopilados de 286 pacientes pediátricos, el prurito (26.1 %), las náuseas y los vómitos (16.9 %) y la retención urinaria (20.8 %) fueron los efectos secundarios más comunes encontrados durante la anestesia epidural con una infusión de bupivacaína y fentanilo. La sedación y el bloqueo excesivo ocurrieron cada uno en menos del 2% de los pacientes. La incidencia de depresión respiratoria fue del 4.2%, pero nunca fue necesaria la administración de naloxona para la depresión respiratoria grave. La perforación del recto puede ocurrir si la aguja caudal tiene un ángulo demasiado pronunciado. Tabla 3 resume los tratamientos recomendados para los efectos adversos comunes.
TABLA 3. Resumen de tratamientos recomendados de efectos en bloqueos epidurales.
| Picor | |
| 1. Excluir y/o corregir otras causas subsanables. | |
| 2. Use infusiones de naloxona en dosis bajas, agonistas-antagonistas parciales (p. ej., nalbufina) o antihistamínicos. | |
| 3. Si persiste la picazón, retire el opioide de la infusión epidural y considere clonidina. | |
| Náuseas | |
| 1. Excluir y/o corregir otras causas subsanables. | |
| 2. Utilizar antagonistas de 5-HT (p. ej., ondansetrón, dolasetrón) | |
| 3. Use infusiones de naloxona en dosis bajas o nalbufina | |
| 4. Evitar los opioides en infusiones y considerar la clonidina. | |
| Íleo y disfunción intestinal | |
| 1. Excluir y/o corregir otras causas subsanables. | |
| 2. Administre laxantes si no está contraindicado. | |
| 3. Evitar los opioides en infusiones y considerar la clonidina. | |
| 4. Use infusiones de naloxona o nalbufina en dosis bajas. | |
| 5. Usar antagonistas opioides restringidos por vía periférica o enteral; por ejemplo, metilnaltrexona o alvimopan (actualmente en fase de investigación). | |
| Sedación o hipoventilación | |
| 1. Excluir y/o corregir otras causas subsanables. | |
| 2. Según la gravedad, reduzca o suspenda la dosificación de opioides o clonidina. | |
| 3. Despertar, estimular y fomentar la respiración profunda. | |
| 4. Si es grave, considere naloxona o ventilación asistida según sea necesario. | |
| Retención urinaria | |
| 1. Excluir y/o corregir otras causas subsanables. | |
| 2. Evite el uso de anticolinérgicos o antihistamínicos si hay alternativas disponibles. | |
| 3. Use infusiones de naloxona o nalbufina en dosis bajas. | |
| 4. Utilizar cateterismo vesical. | |
Bloque EPIDURAL PARA CIRUGÍA PEDIÁTRICA: TÉCNICAS
La analgesia epidural se puede administrar a través de una técnica de inyección única o de infusión continua. Las agujas y los catéteres se pueden insertar a nivel caudal, lumbar o torácico. El objetivo principal de la técnica epidural es colocar con precisión la aguja y/o el catéter en el espacio epidural. Las pruebas de aspiración y las dosis de prueba indican una posible administración intravascular o intratecal inadvertida del fármaco. Se han desarrollado técnicas de estimulación epidural, electrocardiograma epidural (ECG) y US además de las imágenes de rayos X convencionales para ayudar con la colocación precisa de la aguja o el catéter epidural.
Confirmación de la colocación adecuada de la aguja epidural o del catéter
Aspiración y dosis de prueba
Se utiliza una prueba de aspiración realizada antes de la inyección de anestésico local para evitar inyecciones espinales e intravasculares totales. Sin embargo, una aspiración negativa de sangre o LCR no debe considerarse un indicador absoluto de la colocación adecuada de la aguja y el catéter. Las venas son tan pequeñas que pueden colapsar fácilmente con la aspiración; por lo tanto, se recomienda usar una jeringa de 2 ml, aspirar lentamente y considerar la apertura al aire para buscar un flujo libre.
El ECG del paciente debe monitorearse continuamente mientras se inyecta el anestésico local en el espacio caudal. Los cambios en la especificidad del ECG (es decir, > 25 % de aumento en la onda T) después de la inyección de una dosis de prueba de epinefrina (0.5 mcg/kg) pueden ayudar a predecir la inyección intravascular.
Si es posible, el paciente debe mantenerse bajo ventilación espontánea durante la colocación y la dosificación inicial del bloqueo epidural. Cualquier cambio en el patrón respiratorio del paciente es una alerta de que algo puede estar pasando accidentalmente: depresión respiratoria si hay absorción sistémica del anestésico local; taquipnea si hay dolor en la inyección; o taquipnea seguida de bradipnea si ha habido una administración intratecal de anestésico local (ver Tabla 2). Tabla 4 resume varios métodos para confirmar la colocación del catéter epidural.
TABLA 4. Confirmación de la posición del catéter epidural.
| Intraoperatoriamente (mientras el paciente está bajo anestesia general) |
| 1. Se recomienda encarecidamente la ecografía para evaluar la propagación del anestésico local en la punta del catéter o dentro del espacio epidural. |
| 2. Asegurar la aspiración negativa; inyecte el anestésico local lentamente en pequeños incrementos a través del catéter; y evaluar la respuesta a la cirugía. Si es posible, mantenga la ventilación espontánea. |
| 3. Radiografía con contraste. |
| 4. Estimulación eléctrica y/o técnica de ECG. |
| Postoperatoriamente (mientras el paciente está despierto, ya sea que él o ella pueda dar respuestas verbales o no) |
| 1. La ecografía es el método actualmente recomendado. Esto es indoloro y se puede hacer en la PACU sin molestar demasiado al niño. |
| 2. Si no se dispone de ecografía, se puede utilizar la prueba de cloroprocaína. Esto implica la dosificación incremental de una solución de cloroprocaína al 3 % para demostrar analgesia (por autoinforme o medidas conductuales, según corresponda) y signos de efecto segmentario: una. Punta del catéter lumbar: • Bloqueo sensorial y motor al menos parcial en ambas piernas • Calentamiento de la superficie volar de los dedos de los pies b. Punta del catéter torácico inferior: • Fuerza reducida en la flexión de la cadera • Reflejos cutáneos abdominales reducidos • Cierta reducción en la frecuencia cardíaca y la presión arterial C. Punta del catéter torácico superior: • Cierta reducción en la frecuencia cardíaca y la presión arterial • Calentamiento de la superficie volar de las manos • Síndrome de Horner unilateral o bilateral |
Métodos radiográficos
Las imágenes de rayos X junto con un agente de contraste identifican con precisión la punta del catéter en un nivel espinal específico.
Sin embargo, una radiografía sin contraste no puede distinguir la colocación inadvertida del catéter intratecal o subdural de la colocación epidural correcta. Además, la radiografía estándar no permite que el anestesiólogo ajuste la posición del catéter durante la inserción a menos que se use fluoroscopia. Aunque la fluoroscopia permite la monitorización y el ajuste en tiempo real de los catéteres que avanzan, requiere una configuración adicional, incurre en mayores gastos y aumenta la exposición del paciente a la radiación ionizante. Como resultado, la fluoroscopia no se recomienda de manera rutinaria y generalmente se limita a circunstancias difíciles y/o especiales, como la colocación de un catéter epidural a largo plazo para el dolor del cáncer.
Prueba de estimulación epidural (prueba de Tsui) y técnica de ECG epidural
Una prueba de estimulación eléctrica de baja corriente (la prueba de Tsui; Figura 1 y XNUMX) se ha sugerido para monitorear y guiar la posición del catéter epidural durante la inserción. La configuración requiere que el cable de cátodo (negro para bloque) del estimulador de nervios esté conectado al catéter epidural a través de un adaptador de electrodo, mientras que el cable de ánodo está conectado a un electrodo en la piel del paciente como sitio de conexión a tierra. Para evitar una mala interpretación de la respuesta a la estimulación (p. ej., una contracción muscular local puede confundirse con una estimulación epidural), el electrodo conectado a tierra se coloca en la extremidad inferior para las epidurales torácicas y en la extremidad superior para las epidurales lumbares. La colocación correcta de la punta del catéter epidural (1 a 2 cm de las raíces nerviosas) está indicada por una respuesta motora provocada con una corriente entre 1 mA y 10 mA. Una respuesta motora observada con un umbral de corriente significativamente más bajo (< 1 mA) sugiere que el catéter está en el espacio subaracnoideo o subdural o está muy cerca de una raíz nerviosa. Aunque la estimulación crónica de la médula espinal es un medio seguro y eficaz para controlar el dolor, la seguridad de esta prueba de estimulación epidural no se conoce por completo. Sin embargo, se anticipa que el riesgo de una breve estimulación eléctrica intermitente de esta prueba es mínimo. Tabla 5 resume las diferentes ubicaciones del catéter según la respuesta motora y la corriente eléctrica.
TABLA 5. Prueba de estimulación eléctrica.
| Ubicación del catéter | Respuesta motora | Current |
|---|---|---|
| Subcutáneo | Ninguna | > 10 mA |
| subdural | Bilateral (muchos segmentos) | <1 mA |
| Subaracnoideo | Unilateral o bilateral | <1 mA |
| Espacio epidural | ||
| - Contra la raíz nerviosa | Unilateral | <1 mA |
| - No intravascular | Unilateral o bilateral | 1–10 mA (aumento de corriente de umbral después de la inyección de LA) |
| - Intravascular | Unilateral o bilateral | 1–10 mA (sin cambios en el umbral de corriente después de la inyección de LA) |
Una desventaja de la técnica de estimulación epidural es que no se puede realizar de forma fiable si existe algún bloqueo neuromuscular clínico importante o si se han administrado anestésicos locales en el espacio epidural. Para superar esta limitación, se ha sugerido una técnica de monitorización alternativa mediante la monitorización de ECG. Se monitorea un ECG de referencia en el nivel espinal requerido para la cirugía; esto luego se compara con el ECG formado a partir de la punta del catéter epidural a medida que se enrosca cefálicamente. Desafortunadamente, esta técnica no puede diferenciar fácilmente los complejos QRS sutiles donde el catéter se enrosca una distancia corta; tampoco reconoce el posicionamiento del catéter intravascular o intratecal.
Técnicas Guiadas por Ultrasonido
Dado que el objetivo principal de un bloqueo epidural es colocar con precisión la aguja y/o el catéter en el espacio epidural, es extremadamente importante conocer la profundidad esperada desde la superficie de la piel hasta el espacio epidural. Tabla 1 resume algunas fórmulas para calcular esta profundidad en niños. Donde esté disponible, la ecografía permite la identificación en tiempo real de puntos de referencia anatómicos y una estimación mucho más precisa de la profundidad del espacio epidural. Es muy recomendable escanear la anatomía con ultrasonografía en todos los niños antes de realizar el bloqueo y especialmente en casos difíciles, como pacientes con escoliosis o hoyuelos sacros. La ecografía también permite la visualización de la aguja dentro del espacio epidural en los recién nacidos. En los lactantes, la ecografía puede detectar el avance del catéter epidural, ya sea directa o indirectamente al observar la inyección de líquido.
Abordajes epidurales
Los tipos más comunes de analgesia epidural son la analgesia caudal (que constituye la técnica regional más utilizada en niños), la analgesia epidural lumbar y la analgesia epidural torácica.
Analgesia epidural caudal: técnica de inyección única
El bloqueo epidural caudal de inyección única se usa ampliamente para proporcionar analgesia perioperatoria en la práctica pediátrica. Como inyección única, ofrece un bloqueo confiable y efectivo para pacientes que se someten a cirugía urológica, general y ortopédica que involucra la parte inferior del abdomen y las extremidades inferiores. Una epidural caudal de inyección única puede no ser adecuada para todos los casos porque tiene una distribución dermatómica limitada y una acción de corta duración. Los nuevos anestésicos locales y adyuvantes, así como los abordajes con catéter continuo, pueden superar estas limitaciones.
Elección de aguja para analgesia caudal
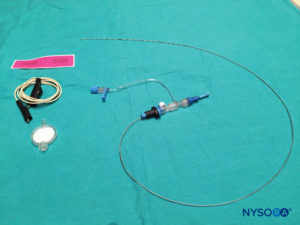
Hay una variedad de agujas disponibles para el bloqueo caudal de una sola inyección. El tamaño o tipo de aguja no parece afectar la tasa de éxito o la incidencia de complicaciones del bloqueo caudal. Las agujas Tuohy o Crawford de bisel corto (5 cm de longitud) con estiletes ofrecen una mejor sensación táctil cuando se perfora el ligamento sacrococcígeo. Para niños de 1 año o más, se usa una aguja de calibre 22; para niños menores de 1 año de edad, se puede usar una aguja de calibre 25. El uso de una aguja con estilete puede reducir el riesgo de introducir un tapón dérmico en el espacio caudal, aunque aún no se ha notificado un tumor de injerto de células epidérmicas en el espacio epidural. Algunos autores abogan por el uso de un angiocatéter de calibre 22, sugiriendo que es más fácil detectar la colocación intravascular y la colocación intraósea con esta aguja. El angiocath se usa solo para el bloqueo caudal de una sola inyección y se retira después de administrar la dosis (es decir, no está diseñado para ser un catéter caudal epidural). Para evitar la formación de núcleos de tejido con el angiocatéter, se debe retirar la aguja antes de realizar cualquier inyección.
Técnica para realizar un bloqueo epidural caudal de inyección única
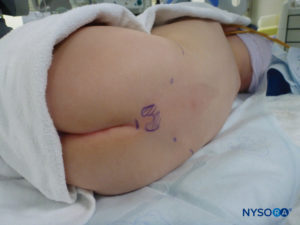
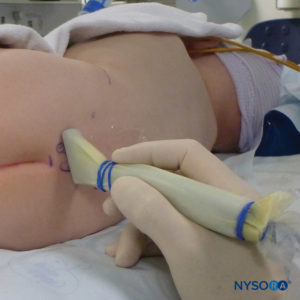
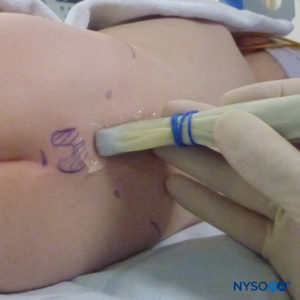
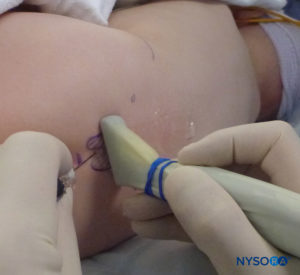
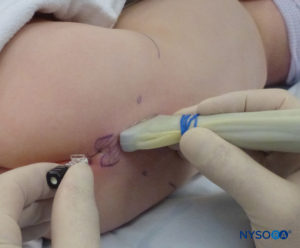
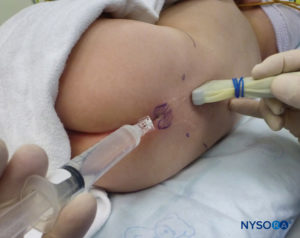
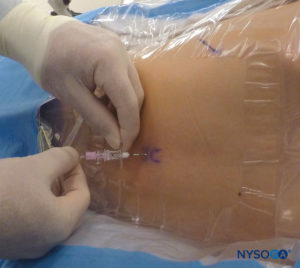
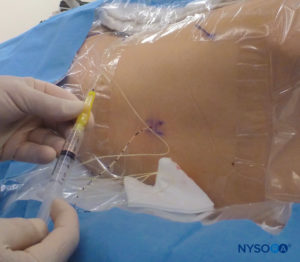
En todos los niños, es importante garantizar una prevención adecuada de la pérdida de calor durante el procedimiento. En lactantes, recomendamos evitar la pérdida de calor con un paño transparente estéril, ya que esto también permitirá la visualización de la respiración del paciente (Figura 2 y XNUMX). El paciente se coloca en decúbito lateral con el cuello flexionado y las rodillas pegadas al tórax. Después del posicionamiento adecuado, los puntos de referencia para el bloqueo epidural caudal (Figura 3 y XNUMX) se identifican fácilmente en los niños: inicialmente se identifica el cóccix y, continuando con la palpación en la línea media de manera cefálica, se pueden sentir los cuernos sacros a ambos lados de la línea media con una separación de aproximadamente 1 cm. El hiato sacro se siente como una depresión entre dos prominencias óseas de los cuernos sacros. En condiciones estériles, la aguja se inserta y avanza en el hiato sacro en un ángulo de aproximadamente 70 grados con respecto a la piel hasta que se siente un "chasquido" característico cuando se punza el ligamento sacrococcígeo. Después de esta punción, el ángulo de la aguja debe reducirse a aproximadamente 20 a 30 grados mientras se avanza la aguja 2 a 4 mm en el canal caudal. No se recomienda ningún avance más allá de este punto porque el riesgo de punción dural inadvertida aumenta significativamente. Si se utiliza un angiocatéter, el catéter de plástico debe avanzar fácilmente sobre la aguja hacia el espacio epidural caudal.
FIGURA 2. Cobertura transparente utilizada en neonatos y lactantes para permitir la visualización del paciente y evitar la pérdida de calor. La máquina estadounidense se coloca en el lado opuesto.
Consejos NYSORA
Se debe tener cuidado para garantizar la prevención de la pérdida de calor durante el procedimiento.
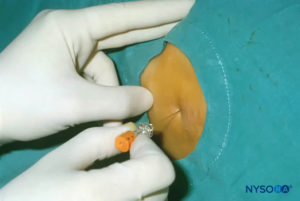
La ecografía se puede utilizar para evaluar la anatomía caudal antes de la técnica basada en puntos de referencia o para guiar la colocación de la aguja. La evaluación previa es particularmente útil en la detección de niños con estigmas cutáneos de disrafismo espinal. El paciente se coloca en decúbito lateral con las rodillas flexionadas hacia el tórax. La máquina de EE. UU. se coloca frente al operador para que él o ella pueda mirar por encima de sus manos hacia la pantalla. El paciente está preparado y la sonda ecográfica se cubre de forma estéril. Se utiliza una sonda de alta frecuencia: en los lactantes se utiliza una sonda de palo de hockey lineal, mientras que en los niños que pesan más de 10 kg es preferible una sonda con una huella grande, ya que permite obtener imágenes de más espacios intervertebrales a la vez en el plano sagital.
La sonda se coloca primero en un plano transversal al nivel del sacro; esto se denomina vista de eje corto (SAX). La posición exacta de los cuernos y la membrana sacrococcígea (SCM) están definidas (Figura 4 y XNUMX). Con la membrana sacrococcígea en el centro de la imagen (Figura 5 y XNUMX), la sonda luego se gira 90 grados en una posición sagital en la línea media sobre el sacro inferior, lo que se denomina vista de eje largo (LAX; Figura 6 y XNUMX). El SCM y la capa ventral y dorsal del hueso sacro, con el espacio epidural caudal en el medio, se identifican fácilmente. En niños pequeños, el saco dural puede ser visible en esta posición, aunque en niños mayores es necesario escanear más en una dirección más cefálica (Figura 7 y XNUMX). Estos movimientos se pueden realizar en el orden inverso, pero se recomienda una exploración completa del espacio en ambos ejes.
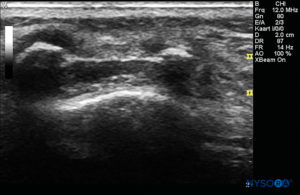
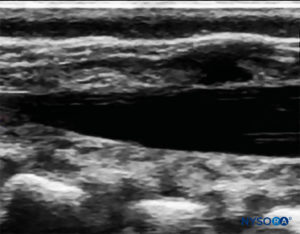
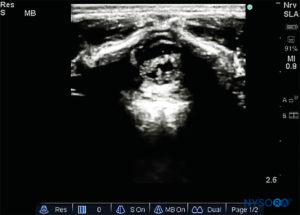
FIGURA 5. Imagen de EE. UU. en la vista de eje corto que muestra la córnea sacra y la membrana sacrococcígea.
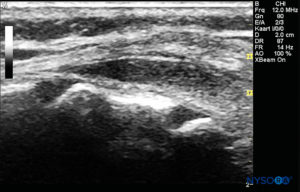
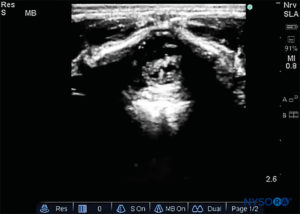
FIGURA 7. Imagen de EE. UU. en la vista de eje largo que muestra la membrana sacrococcígea y el espacio epidural caudal en el os sacrum
Después de esta evaluación ecográfica previa al procedimiento de la anatomía caudal, la aguja se puede introducir en el hiato sacro con la sonda en cualquier eje. Si la sonda se mantiene en el SAX, la inserción de la aguja se realizará automáticamente en el enfoque fuera del plano (OOP) (Figura 8 y XNUMX). Si la sonda se mantiene en LAX, la inserción de la aguja se realizará en el enfoque en el plano (IP) (Figura 9 y XNUMX).
El ángulo de inserción de la aguja se anota durante la exploración. La aguja puede avanzarse 2 a 4 mm en el espacio caudal y se retira el estilete. Para garantizar una colocación caudal óptima de la aguja, se administra un pequeño bolo de solución salina o anestésico local bajo guía ecográfica con la sonda en la línea media (LAX; Figura 10 y XNUMX). La sonda se coloca tan cefálica como sea necesario para visualizar el saco dural en la pantalla de ecografía (Figura 11 y XNUMX). Cuando comience la inyección, notará que la duramadre se desplaza ventralmente, especialmente en los niños más pequeños. La propagación del anestésico local se puede monitorear moviendo la sonda cefálicamente hacia arriba de la columna vertebral en la línea media o en un eje sagital paramediano (Figura 12 y XNUMX). El mismo movimiento de la duramadre se puede visualizar con la sonda en el SAX en las posiciones más cefálicas (Figuras 13 y 14).
Confirmación de la distribución correcta del anestésico local
Por lo general, se busca el clásico "chasquido" que se siente cuando se perfora el SCM para confirmar la colocación adecuada de la aguja caudal. La ausencia de protuberancias subcutáneas y la falta de resistencia a la inyección son signos adicionales de la colocación correcta de la aguja y la distribución del anestésico local. La aspiración de la aguja debe estar libre de sangre y líquido cefalorraquídeo, y también debe utilizarse una respuesta negativa a una dosis de prueba de epinefrina para descartar la colocación intravascular. La ecografía se ha utilizado para proporcionar guía de aguja en tiempo real hacia el espacio caudal y para evaluar la propagación del anestésico local. Estudios estadounidenses recientes han demostrado que el volumen de anestésico local no se correlaciona con su diseminación craneal durante el bloqueo caudal en lactantes y niños. Inicialmente, se pensó que la evaluación ecográfica de la extensión del anestésico local era un predictor del dermatoma alcanzado, pero resultó que no fue así, ya que la mayoría de los bloqueos caudales tienen éxito a pesar de una falta de extensión cefálica monitoreada inmediatamente. Sin embargo, se ha encontrado que existe una diseminación secundaria del anestésico local en el espacio epidural. Esto ocurre en dos patrones: una redistribución intrasegmentaria horizontal desde el espacio epidural dorsal al ventral y una extensión craneal longitudinal retardada a medida que la duramadre regresa a su posición original, empujando así el anestésico local epidural en dirección cefálica. El movimiento bidireccional observado del LCR (denominado "mecanismo de rebote del LCR") también ayuda a explicar un componente de la diferencia entre la propagación inicial evaluada por ecografía y el efecto final más cefálico determinado por pruebas cutáneas. Se necesitan más estudios con ultrasonografía para determinar la mejor manera de predecir la propagación del anestésico local.
Analgesia Caudal Epidural: Técnica Continua
La analgesia epidural caudal continua supera la duración limitada y el efecto segmentario de una técnica de inyección única. Los catéteres caudales se pueden avanzar hasta el nivel lumbar o torácico. La técnica de inserción de la aguja para la analgesia caudal continua es muy similar al abordaje caudal de inyección única. Se puede hacer con un catéter intravenoso (un angiocatéter calibre 18 para un catéter epidural calibre 20 o un angiocatéter calibre 16 para un catéter epidural calibre 19) o con una aguja Crawford o Tuohy calibre 18 insertada a través de la membrana sacrococcígea , como se describe para la técnica de inyección única. A continuación, el catéter epidural se hace avanzar con cuidado desde el espacio caudal hasta el nivel objetivo. La resistencia menor al paso del catéter normalmente se puede superar mediante la simple flexión o extensión de la columna vertebral del paciente y/o inyectando simultáneamente solución salina normal a través del catéter. Algunos autores utilizan un catéter epidural de estimulación especializado (el sistema de posicionamiento epidural mediante la prueba de Tsui, Arrow International Inc., Reading, PA).
Es extremadamente importante saber dónde se encuentra finalmente la punta del catéter: un nivel demasiado bajo de la punta del catéter provocará una analgesia deficiente; demasiado alto puede causar depresión respiratoria. Sin embargo, debido a que los catéteres no se desplazan linealmente en el espacio epidural, medir la longitud del catéter contra la espalda del paciente no determina con precisión el nivel quirúrgico objetivo. Por lo tanto, la ubicación de la punta del catéter debe verificarse mediante una prueba objetiva, como se describe en la sección anterior (es decir, radiografía, estimulación nerviosa, electrocardiografía o, preferiblemente, ecografía).
Estas técnicas pueden considerarse engorrosas o redundantes, y en niños mayores de 1 año, el desarrollo de una curva lumbar durante la infancia podría impedir el fácil avance cefálico del catéter. Por lo tanto, algunos han sugerido que la colocación del catéter caudal debe limitarse a pacientes menores de 1 año de edad. Es opinión de los autores que, al menos en niños mayores de 1 año, los catéteres deben colocarse lo más cerca posible del dermatoma quirúrgico. Por lo tanto, se recomienda una formación pediátrica y ultrasonográfica adecuada en todos los casos y es obligatoria antes de realizar epidurales lumbares o torácicas en niños pequeños.
Anestesia epidural lumbar
La analgesia epidural lumbar se usa comúnmente para infusiones continuas y rara vez se usa como una técnica de inyección única. Un abordaje lumbar directo está indicado principalmente para el control del dolor durante y después de la cirugía de las extremidades inferiores. La colocación de la epidural lumbar, particularmente en niños pequeños, se realiza después de la inducción de la anestesia general. Sin embargo, este abordaje también puede realizarse despierto en un grupo selecto de niños y adolescentes cooperativos. Se debe tener precaución siempre que se realice analgesia epidural lumbar por encima del nivel del extremo de la médula espinal para evitar traumatismos directos con la aguja.
Se prefiere un abordaje de línea media para la colocación de la aguja epidural lumbar. La identificación del espacio epidural se logra comúnmente mediante la pérdida de resistencia (LOR) a la solución salina. Debe evitarse la LOR al aire debido al riesgo de introducir una embolia gaseosa venosa, especialmente en recién nacidos y lactantes. Los niños deben colocarse en decúbito lateral para la colocación epidural lumbar directa. En niños mayores de 1 año se suele utilizar una aguja Tuohy calibre 18 de 5 cm, marcada cada 0.5 cm, con catéter epidural calibre 20. En niños menores de 1 año, se debe considerar una aguja Tuohy de 20 cm, calibre 5, marcada cada 0.5 cm, con un catéter de calibre 22. Sin embargo, estos catéteres más angostos se doblan, ocluyen y pierden con más frecuencia. Aunque la identificación del espacio intervertebral y el ligamento amarillo en la mayoría de los pacientes pediátricos es fácil, el ligamento amarillo puede ser menos resistente a la tensión en los niños; por lo tanto, es posible que no se sienta fácilmente un "estallido" distintivo al penetrar en esta capa. Además, la distancia de la piel al espacio epidural puede ser muy superficial. Se han propuesto fórmulas para estimar la distancia de la piel al espacio epidural (ver Tabla 1). Sin embargo, las fórmulas son solo una guía y cambian según el ángulo de colocación de la aguja epidural. Hoy en día, el mejor método disponible para evaluar la profundidad epidural es la ecografía. Con la sonda en un plano sagital oblicuo paramediano, la distancia desde la piel hasta el ligamento amarillo se mide con el calibrador de la máquina de EE. UU. Esta medida proporciona una buena estimación de la profundidad a la que se sentirá el LOR. Por lo tanto, se recomienda encarecidamente una evaluación ecográfica previa al procedimiento de cada paciente individual.
Para obtener una descripción exacta de la técnica epidural lumbar, consulte "Anestesia epidural torácica" a continuación (las figuras ilustran una colocación epidural torácica).
Abordaje epidural lumbar a torácico
Los catéteres colocados a través de la ruta lumbar pueden avanzar cefálicamente hasta los niveles de las vértebras torácicas. Similar a los problemas encontrados al hacer avanzar los catéteres en el espacio caudal en niños mayores, una resistencia significativa también impide el fácil avance de los catéteres epidurales lumbares a los niveles torácicos. A pesar de los resultados favorables con la estimulación a través de un abordaje caudal, solo un informe de caso ha demostrado la colocación exitosa de un catéter epidural torácico a través de la ruta lumbar con guía de estimulación epidural. Por lo tanto, los autores recomiendan colocar el catéter lo más cerca posible del sitio quirúrgico.
Analgesia epidural torácica
Existe controversia con respecto a la seguridad de colocar epidurales torácicos bajo sedación intensa o anestesia general, porque los pacientes inconscientes no pueden informar síntomas que puedan advertir al anestesiólogo de posibles complicaciones neurológicas El trauma directo de la aguja en la médula espinal durante la inserción epidural es raro pero puede causar complicaciones devastadoras . Los informes han detallado casos de traumatismo directo por aguja en la médula espinal durante la colocación epidural en pacientes tanto despiertos como anestesiados. Para la cirugía torácica, el catéter debe introducirse lo más cerca posible del nivel del dermatoma de la incisión.
El avance de catéteres desde los espacios epidurales lumbares y caudales hasta el nivel torácico es una alternativa solo en niños hasta 1 año de edad. Sin embargo, el avance de los catéteres en el espacio epidural se vuelve cada vez más difícil con la edad debido al desarrollo de la curvatura lumbar.
La colocación directa de catéteres epidurales torácicos es más común en los centros de atención terciaria, donde anestesiólogos pediátricos bien capacitados realizan los bloqueos en niños que se someten a una cirugía mayor. Se recomienda encarecidamente la obtención de imágenes por ultrasonografía antes del procedimiento. Además, los autores creen que se debe proporcionar capacitación en anestesia epidural torácica asistida por ecografía a los anestesiólogos que deseen realizar epidurales torácicas en niños.
Consejos NYSORA
- Los niños requieren un volumen (dosis) significativamente mayor de anestésico local en comparación con los adultos para lograr la misma diseminación dermatomal.
- El avance previsto del catéter torácico alto desde un sitio de inserción lumbar rara vez tiene éxito.
- La inserción del catéter epidural torácico debe ser realizada únicamente por profesionales con experiencia en la técnica epidural torácica pediátrica.
- La inserción de la aguja epidural en pacientes pediátricos se puede realizar en cualquier espacio torácico utilizando un abordaje de línea media o paramediano; sin embargo, a menudo se prefiere un enfoque de línea media.
Analgesia epidural torácica: abordaje de línea media
El uso del abordaje de línea media ofrece la ventaja de ser similar al abordaje lumbar (con la aguja angulada en un solo plano). Utilizando el abordaje de línea media, la inserción de la aguja es más fácil en el nivel torácico inferior (T10–T12) que en el nivel torácico medio (T4–T7). El borde inferior del omóplato, que está a la altura de la séptima vértebra torácica, suele utilizarse como referencia anatómica. El paciente se coloca en decúbito lateral y se tiene cuidado de evitar la pérdida de calor. Se puede realizar una evaluación de la anatomía del paciente en un entorno no estéril antes de realizar el bloqueo; esto también es útil para fines de enseñanza.
La apófisis espinosa del nivel vertebral objetivo debe identificarse contando desde la línea de Tuffier y contando hacia atrás desde la vértebra cervical C7 más prominente (Figura 15 y XNUMX). La ecografía previa al procedimiento se realiza con la sonda en tres planos: transversal (SAX), sagital medio (LAX medio) y sagital oblicuo paramediano (LAX oblicuo paramediano). Así se puede medir la distancia desde la piel del paciente hasta el espacio epidural. En el SAX (Figura 16 y XNUMX), se debe encontrar la ventana entre dos apófisis espinosas, y el complejo anterior de la columna vertebral (ligamento longitudinal posterior, duramadre anterior y cuerpo vertebral) en la profundidad de la imagen serán las primeras estructuras a identificar. El complejo posterior (ligamento amarillo y duramadre posterior) puede ser más difícil de visualizar pero estará aproximadamente al nivel de la lámina (Figura 17 y XNUMX).
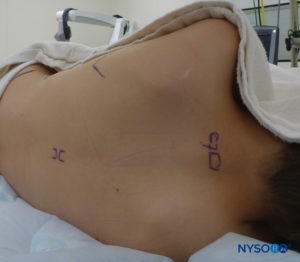
FIGURA 15. Analgesia epidural torácica: posicionamiento del paciente y puntos de referencia para un enfoque de línea media.
FIGURA 16. Exploración previa al procedimiento con configuración no estéril con fines didácticos; la sonda estadounidense está en la vista de eje corto.
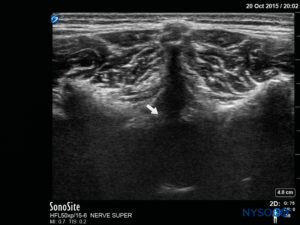
FIGURA 17. Imagen de US en la vista de eje corto, que muestra el complejo posterior con la duramadre (flecha blanca).
Si el paciente es un bebé y las estructuras óseas de la columna vertebral aún no están completamente osificadas, un LAX medio (Figura 18 y XNUMX) proporciona imágenes claras y reales de la anatomía involucrada. Con esta posición de la sonda, la apófisis espinosa de la imagen casi alcanzará la piel (o la parte superior de la pantalla de ecografía). Entre el proceso espinoso, la duramadre se verá como una doble capa blanca; se encuentra un poco menos profundo que el nivel en el que se encuentra el complejo posterior en el SAX (Figura 19 y XNUMX).En el LAX oblicuo paramediano (Figura 20 y XNUMX), se puede visualizar el proceso transverso y/o la lámina, dependiendo de qué tan lateral u oblicuamente se coloque la sonda. De nuevo, el complejo anterior se visualiza fácilmente, y la mayoría de las veces la piamadre se puede ver en niños pequeños. En la imagen se pueden encontrar las características “cabezas de caballo”, y en medio se verá la duramadre, a un nivel más profundo (Figura 21 y XNUMX). La profundidad de la duramadre será más o menos igual, como en las posiciones SAX y LAX mediana.
FIGURA 18. Exploración previa al procedimiento con configuración no estéril con fines didácticos; la sonda de EE. UU. está en la vista de eje largo medio. La sonda debe estar exactamente en la línea media, pero en esta foto se ha colocado en la vista del eje largo paramediano para ver la dirección.
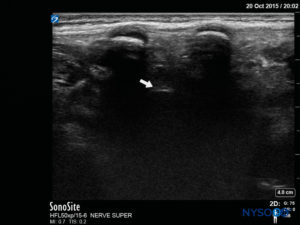
FIGURA 19. Imagen de EE. UU. en la vista de eje largo medio, que muestra la duramadre (flecha blanca).
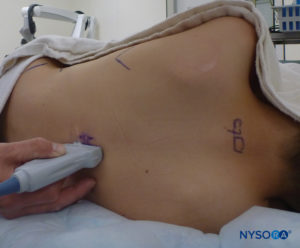
FIGURA 20. Exploración previa al procedimiento con configuración no estéril con fines didácticos; la sonda de EE. UU. está en la vista de eje largo oblicua paramediana. La inclinación de la sonda se puede comparar con la que se muestra en Figura 16 y XNUMX.
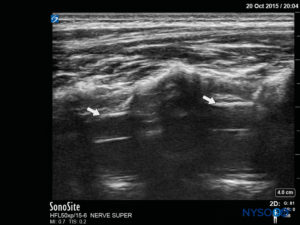
FIGURA 21. Imagen de US en la vista de eje largo oblicua paramediana, que muestra el complejo posterior con la duramadre (flechas blancas).
Después de las imágenes previas al procedimiento para medir la profundidad a la que se alcanzará el espacio epidural, se prepara y cubre la piel del niño (Figura 22 y XNUMX). Luego se inserta una aguja epidural Tuohy de calibre 18, de 5 cm de largo, con marcas cada 0.5 cm, en el espacio intermedio en un ángulo cefálico de aproximadamente 70 grados con respecto al eje longitudinal de la columna. Una maniobra útil es insertar la aguja en un ángulo similar al que se sostuvo la sonda ecográfica cuando se midió la distancia hacia el espacio epidural (Figura 23 y XNUMX). Se debe sentir una resistencia continua a medida que se inserta la aguja a través de los ligamentos supraespinoso e interespinoso. Cuando se alcanza el ligamento interespinoso, se retira el estilete y se conecta a la aguja una jeringa de LOR llena de solución salina. Se ejerce presión continua sobre el émbolo a medida que la aguja avanza más (Figura 24 y XNUMX). En niños mayores, inicialmente se siente un aumento en la resistencia cuando se ingresa al ligamento amarillo, justo antes de que se sienta el LOR. Sin embargo, en los niños más pequeños, la resistencia encontrada en el ligamento amarillo puede no ser notablemente diferente de la de los otros ligamentos.
FIGURA 23. Inserción de aguja. Tenga en cuenta la dirección en comparación con la sonda en Figura 14 y XNUMX.
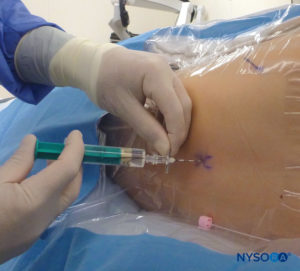
FIGURA 24. Avance de la aguja con presión continua sobre el émbolo con la mano derecha mientras la mano izquierda avanza la aguja.
La aguja no debe insertarse a una profundidad mayor que la profundidad del espacio epidural estimada por ecografía antes del procedimiento. El espacio epidural torácico se identifica con LOR a solución salina; No se recomienda el aire en niños. A continuación se retira la jeringa y, tras descartar punción dural, se introduce el catéter (Figura 25 y XNUMX). La longitud del catéter insertado debe ser de solo unos 2 cm más allá de la punta de la aguja si la punción epidural se ha realizado en el nivel adecuado. Si la punción se ha realizado un nivel por debajo, el catéter puede introducirse hasta 3-4 cm, pero hay que tener en cuenta que en niños pequeños unos pocos centímetros pueden representar varios segmentos vertebrales.
Después de retirar la aguja y asegurarse de que se mantiene una longitud adecuada de catéter, se conecta el conector al catéter. En este punto, es imperativo comprobar si hay un menisco caído y realizar una aspiración lenta y cuidadosa a través del catéter para comprobar si hay sangre o LCR (Figura 26 y XNUMX). Luego se conecta el filtro y se pueden administrar dosis incrementales de anestésico local con la extensión evaluada mediante ecografía.
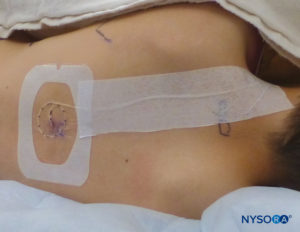
Recomendamos tunelizar el catéter o usar un vendaje líquido o el adhesivo cutáneo tópico Histoacryl para cerrar el orificio de entrada y evitar fugas. Es importante prevenir la fuga de anestésico local en pacientes pediátricos, ya que la fuga de anestésico puede consistir en un porcentaje significativo del fármaco total administrado. La fuga debajo del dispositivo de fijación o Tegaderm puede presentar un problema para la fijación del catéter en sí. Se recomienda un dispositivo de fijación epidural transparente para permitir la observación de cualquier fuga de anestésico local o signos de infección (Figura 27 y XNUMX).
Consejos NYSORA
- Existen varias fórmulas para calcular el volumen de anestésico local necesario para bloquear un número determinado de segmentos.
- Se administra un bolo de 1.0 mg/kg de bupivacaína al 0.25% o ropivacaína al 0.2% para establecer el bloqueo.
- En niños en edad preescolar y especialmente en bebés, puede presentarse irritabilidad o agitación a pesar de una analgesia epidural que aparentemente funciona bien. Lo más probable es que esto sea el resultado de la vía intravenosa, la sonda nasogástrica, el catéter urinario o el entorno hospitalario.
- Se puede lograr una sedación satisfactoria con cualquiera de los siguientes:
– Bolos IV de morfina de 25 mcg/kg según se requiera, o
– Adición de clonidina 0.5 mcg/mL a la mezcla epidural
MANEJO DE LA INFUSIÓN EPIDURAL POSTOPERATORIA
Para una analgesia epidural eficaz y segura, se recomienda un enfoque sistemático y basado en protocolos para la atención del paciente. Un equipo dedicado al dolor agudo pediátrico, formado por anestesiólogos y enfermeros, es fundamental para garantizar evaluaciones estandarizadas del dolor, un control atento del paciente y el tratamiento adecuado de los efectos adversos. La colocación precisa de agujas y catéteres epidurales es la clave para una analgesia epidural exitosa. Esto requiere el uso de un método fiable para confirmar la ubicación de la punta del catéter (es decir, ecografía, estimulación epidural). La duración promedio de la infusión epidural es de aproximadamente 72 horas, aunque puede ser necesario continuar la infusión por períodos más largos, especialmente en niños con antecedentes médicos complicados o una necesidad prolongada de analgesia. En neonatos, la duración de la perfusión epidural debe limitarse a 48 horas debido al riesgo de toxicidad sistémica. Un equipo de personal dedicado con un enfoque en el manejo del dolor debe atender a estos pacientes. Cuando existan planes para descontinuar la infusión epidural, se debe considerar un opioide para permitir una analgesia adecuada. Finalmente, el éxito del proceso se basa en órdenes debidamente escritas, una parte crucial de la ejecución de la analgesia adecuada.
Consejos NYSORA
Para la analgesia posoperatoria, se administra bupivacaína al 0.125 % o ropivacaína al 0.1–0.2 %, con o sin fentanilo, 1–2 mcg/mL, a las siguientes velocidades:
- Edad > 3 meses: 0.20-0.35 mL/kg/h (< 0.4 mg/kg/h bupivacaína)
- Edad < 3 meses: 0.1-0.15 ml/kg/h (< 0.2 mg/kg/h bupivacaína)
ANESTESIA ESPINAL EN NIÑOS
INTRODUCCIÓN
La anestesia espinal es quizás una de las modalidades más antiguas y estudiadas para aliviar el dolor en pacientes que se someten a cirugía. A J. Leonard Corning se le atribuye la administración del primer anestésico espinal en 1885 y su experiencia se publicó posteriormente en una revista médica. Aunque el uso de la administración de anestesia intratecal en niños se describió a principios del siglo XX, esta técnica rara vez se usaba en la población pediátrica hasta que Melman informó una serie de bebés de alto riesgo que se sometieron a una cirugía exitosa bajo anestesia espinal. Los informes de apnea después de la anestesia general en bebés prematuros aparecieron en la literatura a principios de la década de 1980, y una serie de Abajian et al. ofreció a los profesionales un ímpetu para ofrecer una técnica alternativa con menos complicaciones que la anestesia general. Desde entonces, se han informado varias series en todos los grupos de edad para una variedad de procedimientos quirúrgicos que atestiguan la seguridad y eficacia de la anestesia espinal.
TABLA 6. Diferencias anatómicas entre adultos y bebés en el canal espinal.
| Conus medullaris termina en L2-L3 en bebés versus L1 en adultos. |
| Los bebés tienen una pelvis pequeña y el sacro comienza más cefálico que en los adultos. |
| El saco dural termina más caudalmente en bebés que en adultos. |
ANATOMÍA
Comprender las diferencias anatómicas entre adultos y bebés es crucial para administrar anestesia espinal en niños de manera segura y técnicamente competente (Tabla 6). La médula espinal termina a un nivel mucho más caudal en los recién nacidos y los lactantes que en los adultos. El conus medullaris termina aproximadamente en L1 en adultos y en el nivel L2 o L3 en recién nacidos y lactantes. Para evitar posibles lesiones en la médula espinal, la punción dural debe realizarse por debajo del nivel de la médula espinal; es decir, por debajo de L2-L3 en recién nacidos y lactantes. En adultos, la anestesia espinal a menudo se realiza en el espacio intermedio más cercano a una línea imaginaria que se extiende a lo largo de la parte superior de las crestas ilíacas, la línea intercristalina o de Tuffier, correspondiente al espacio intermedio L3-L4. Sin embargo, los recién nacidos y los lactantes tienen una pelvis proporcionalmente más pequeña que los adultos, y el sacro se ubica más cefálico en relación con las crestas ilíacas. Por lo tanto, la línea de Tuffier cruza la línea media de la columna vertebral en el espacio intermedio L4-L5 o L5-S1, muy por debajo de la terminación de la médula espinal, lo que hace que este punto de referencia sea aplicable en todos los pacientes pediátricos. El saco dural en recién nacidos y lactantes también termina en una ubicación más caudal en comparación con la de los adultos, por lo general aproximadamente al nivel de S3 en comparación con el nivel adulto de S1. La terminación más caudal del saco dural hace que sea más probable una punción dural involuntaria durante la realización de un bloqueo caudal de una sola inyección si la aguja se introduce demasiado en el espacio epidural.
El volumen de LCR es mayor en mililitros por kilogramo en lactantes y recién nacidos (4 ml/kg) en comparación con los adultos (2 ml/kg). Además, el LCR en lactantes se distribuye relativamente más en el conducto raquídeo que en la cabeza, a diferencia de la distribución en adultos. Esto puede explicar, en parte, los requisitos de dosis más altas de anestésico local y la duración más corta de la acción de la anestesia espinal en los bebés. El alto gasto cardíaco característico de la población pediátrica acorta aún más la duración de los bloqueos espinales en niños.
ANESTÉSICOS LOCALES
En la literatura se han descrito una variedad de anestésicos locales y dosis, incluyendo bupivacaína86 y ropivacaína. La bupivacaína al 0.5%, 0.5 a 1 mg/kg, generalmente se usa para la anestesia espinal en niños que pesan menos de 10 kg. Se prefiere una dosis hacia el extremo superior del rango para niños más pequeños; el riesgo de la raquianestesia total es bajo siempre que el procedimiento se lleve a cabo con diligencia (Tabla 7). Se prefiere un “lavado de epinefrina” de la jeringa, en lugar de una dosis estándar de epinefrina. Una solución hiperbárica de bupivacaína con glucosa al 8% proporciona un bloqueo de calidad y duración similar a la de la bupivacaína isobárica con glucosa al 0.9%.
También se han descrito adyuvantes de los anestésicos locales en bloqueos espinales. Se ha demostrado que la clonidina en una dosis de 1 mcg/kg agregada a la bupivacaína (1 mg/kg) utilizada en la anestesia espinal para recién nacidos prolonga la duración del bloqueo a casi el doble de la duración de la anestesia espinal sin clonidina. Sin embargo, el uso de 2 mcg/kg de clonidina puede provocar una disminución transitoria de la presión arterial y una mayor sedación postoperatoria. Puede ser recomendable el uso de una dosis de cafeína de 10 mg/kg por vía intravenosa para prevenir una posible apnea postoperatoria, especialmente si se usa clonidina en la solución de anestesia espinal.
En casos de reparación de hernia bilateral en ex prematuros, el bloqueo espinal puede complementarse con un bloqueo caudal. El paciente se gira sobre el lado de la hernia más grande mientras se realiza el bloqueo; una inyección espinal de 0.8 mg/kg de bupivacaína es seguida inmediatamente por una inyección caudal de bupivacaína al 0.1%. Esta técnica prolonga la duración de la anestesia y la analgesia. Como alternativa, se puede inyectar una solución hipobárica de anestésico local con el lado operatorio hacia arriba.
TABLA 7. Dosis de anestesia espinal en niños.
| Solución anestésica local: ropivacaína o bupivacaína al 0.5% 0.5-1 mg/kg. | ||
| Una manera fácil de calcular la dosis para una sola reparación de hernia en bebés es la siguiente: | ||
| Edad (meses) | Peso (kg) | Dosis bupivacaína 0.5% |
| 1 | 3 | 1 mg / kg |
| 2 | 4 | 0.8 mg / kg |
| 3 | 5 | 0.6 mg / kg |
| > 4 | 6 | 0.4 mg / kg |
| Posibles aditivos: • Lavado con epinefrina • Clonidina 1 mcg/kg • Morfina 10 mcg/kg solo para cirugía cardiaca para facilitar una extubación más temprana) |
||
EFECTOS ADVERSOS
Los efectos adversos de la anestesia espinal que se observan comúnmente en adultos son menos comunes en los niños. Estos incluyen hipotensión, bradicardia, CPPD y síntomas radiculares transitorios.
La hipotensión y la bradicardia son poco comunes en los niños a pesar de los altos niveles de bloqueo requeridos. La carga de líquidos para aumentar la precarga rara vez se necesita en niños pero, si es necesario, se puede realizar a razón de 10 ml/kg. Aunque algunos autores obtienen un acceso venoso en las extremidades inferiores del paciente después de haber realizado la raquianestesia (colocación de un catéter intravenoso sin dolor), nosotros recomendamos obtener un acceso venoso antes de realizar la raquianestesia. Puncuh et al. informaron su experiencia con 1132 anestésicos espinales consecutivos en los que rara vez se informó hipotensión: solo se informó una leve disminución de la presión arterial en 9 de 942 pacientes menores de 10 años y en 8 de 190 pacientes mayores de 10 años.
La incidencia de CPPD es menor en niños que en adultos. Sin embargo, se ha informado una incidencia del 8% en pacientes oncológicos después de frecuentes punciones lumbares para punciones lumbares. Se estudió el uso de diferentes tipos de aguja espinal en este subgrupo de pacientes, pero no se encontró diferencia en la incidencia de dolor de cabeza (15% Quincke; 9% punta de lápiz Whitacre; p = 0.43). Además, la incidencia de dolor de cabeza no fue diferente por grupo de edad, con 8 de 11 CPPD ocurriendo en niños menores de 10 años y el más joven informado en un niño de 23 meses. Las CPPD se han tratado con reposo en cama y cafeína en adultos, pero se siguen con un parche de sangre si el dolor de cabeza no se resuelve. En niños no se conoce la dosis óptima de cafeína, y se realiza parche hemático epidural con 0.3 mL/kg de sangre cuando persiste la cefalea. Se han reportado síntomas radiculares transitorios en niños pero sin efectos adversos a largo plazo.
CONTRAINDICACIONES RELATIVAS
La principal contraindicación para una técnica espinal en un niño no sedado es una cirugía de más de 60 minutos. Se debe evitar la anestesia espinal en recién nacidos y niños que pueden tener presión intracraneal elevada. En niños con enfermedades neuromusculares, derivaciones ventriculares (auriculares o peritoneales) y convulsiones mal controladas, el uso de anestesia espinal es controvertido. Otras contraindicaciones de la raquianestesia son similares a las de la población adulta e incluyen deformidades anatómicas graves, infección sistémica o en el sitio de punción, coagulopatía subyacente e inestabilidad hemodinámica.Tabla 8).
Al considerar la anestesia espinal, se debe prestar especial atención a los niños con vías respiratorias difíciles conocidas. Aunque la anestesia raquídea puede ser una opción razonable en estos pacientes, la primera consideración debe ser la capacidad del médico para controlar las vías respiratorias. La necesidad de sedación intravenosa en niños en edad preescolar y escolar plantea su propio conjunto de riesgos en pacientes pediátricos con vías respiratorias difíciles. El sitio quirúrgico, la duración anticipada del procedimiento y la posición quirúrgica (es decir, supino, lateral o prono) también son factores importantes a considerar.
TABLA 8. Contraindicaciones relativas a la anestesia espinal en niños.
| Anomalías anatómicas de la columna vertebral. |
| Enfermedad neuromuscular degenerativa |
| Disidencia del paciente y la familia |
| Coagulopatía |
| Infección bacteriana |
| Aumento de la presión intracraneal |
| Derivaciones ventriculoperitoneales |
Consejos NYSORA
Las consideraciones especiales para bebés y niños que se someten a anestesia espinal incluyen lo siguiente:
- La experiencia del anestesista
- La motivación del cirujano.
- La duración estimada de la cirugía es inferior a 90 minutos.
ANESTESIA ESPINAL PARA PACIENTES PEDIÁTRICOS: TÉCNICA
PREPARACIÓN
Se puede aplicar una mezcla eutéctica de crema anestésica local (EMLA) o LMX (crema de lidocaína al 4%) en el sitio de inserción, aunque se debe tener en cuenta el riesgo de metahemoglobinemia en bebés prematuros muy pequeños. El quirófano debe calentarse antes de llevar al paciente a la habitación. Las mantas calientes y las lámparas de calefacción radiante ayudan a disminuir la pérdida de calor en los bebés. Con niños mayores, la habitación debe estar tranquila y, si es posible, los instrumentos quirúrgicos cubiertos para minimizar la ansiedad del paciente. Los quirófanos pediátricos pueden estar equipados con equipos estéreo o de video, que pueden usarse para distraer a los niños mayores si el bloqueo se realiza sin sedación. Los dispositivos de monitoreo estándar (pulsioxímetro, electrocardiograma y manguito de presión arterial) deben aplicarse antes de realizar el bloqueo.
Se debe hacer un plan con respecto al uso concomitante de sedación intravenosa o anestesia general por inhalación. El enfoque debe estar dictado por la condición médica y la edad del paciente, el nivel de comodidad del anestesista y la naturaleza y duración prevista del procedimiento quirúrgico. La anestesia general puede predisponer a los recién nacidos muy prematuros a la apnea y la bradicardia. La raquianestesia en lactantes no dura más de 90 minutos debido a sus características fisiológicas. Por lo tanto, en los recién nacidos prematuros que se someten a procedimientos abdominales inferiores de menos de 90 minutos de duración, se puede realizar anestesia espinal sin sedación adyuvante. Sin embargo, a veces puede ser necesario un breve período de anestesia general por inhalación o sedación intravenosa suplementaria mientras se realiza el bloqueo, especialmente si no se ha utilizado la crema EMLA. Los niños mayores pueden requerir sedación adicional o anestesia general ligera antes de realizar el bloqueo. En algunos casos, la anestesia espinal puede combinarse con anestesia caudal o epidural para prolongar la analgesia.
Posición del paciente
La anestesia espinal se administra habitualmente en posición lateral o sentada en los niños. Si se prefiere la posición lateral, el paciente se coloca en el borde mismo de la mesa quirúrgica y un ayudante lo sujeta firmemente. De lo contrario, se puede colocar al paciente en medio de la mesa de operaciones pero encima de varias mantas; estos darán la altura necesaria para que las manos del anestesiólogo se coloquen cómodamente mientras realiza el bloqueo (Figura 28 y XNUMX). Si se prefiere la posición sentada, se debe prestar especial atención en los bebés para asegurarse de que el cuello no esté flexionado, ya que esto podría provocar la obstrucción de las vías respiratorias (Figura 29 y XNUMX). Es esencial monitorear atentamente la saturación de oxígeno en los bebés mientras se realiza la columna vertebral para garantizar la adecuación y la permeabilidad de las vías respiratorias. Además, la flexión del cuello no es necesaria porque no facilita la realización del bloqueo en niños pequeños. En niños mayores, debe estar presente un asistente para mantener la posición adecuada y para tranquilizar y distraer al niño mientras se realiza el bloqueo. El uso de un chupete, mientras se realiza el bloqueo en un lactante no sedado, suele ser útil.
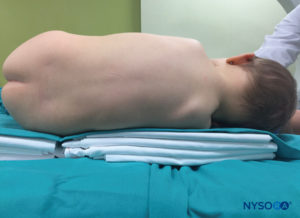
FIGURA 28. Anestesia espinal en posición lateral. El niño se coloca encima de varias mantas para ganar altura para las manos del anestesiólogo mientras realiza el bloqueo.
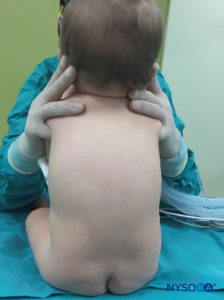
FIGURA 29. Anestesia espinal en posición sentada. Debe evitarse la flexión de la cabeza para evitar la obstrucción de las vías respiratorias.
Tecnologia
En los lactantes, debe identificarse el espacio intermedio L4-L5 o L5-S1; el espacio intermedio L3-L4 puede usarse en niños mayores. El área debe prepararse y cubrirse de manera estéril. Si no se aplicó crema anestésica tópica antes de la operación, se debe administrar anestesia local antes del bloqueo en pacientes despiertos o ligeramente sedados. La dosis deseada de anestésico local espinal debe calcularse y prepararse en una jeringa antes de la punción dural para garantizar que se administre la dosis correcta. Debido a que el volumen de anestésico local necesario puede ser pequeño en los recién nacidos, es importante medir el volumen correspondiente al centro de la aguja y contar este volumen también en la dosis total de anestésico local. Una jeringa de insulina es útil para medir la dosis exacta con precisión. A menudo se usa una aguja espinal corta de calibre 22 o 25 (Figura 30 y XNUMX). Por lo general, se recomienda un abordaje de línea media sobre un abordaje paramediano. El ligamento amarillo es muy blando en los niños y es posible que no se perciba un "chasquido" distintivo cuando se penetra la duramadre (Figura 31 y XNUMX). Una vez que sale líquido cefalorraquídeo claro por la aguja, se pueden administrar los fármacos y, lo que es más importante, se deben inyectar lentamente (Figura 32 y XNUMX).
FIGURA 30. Equipo utilizado para anestesia espinal en neonatos: aguja espinal y jeringa con anestésico local.
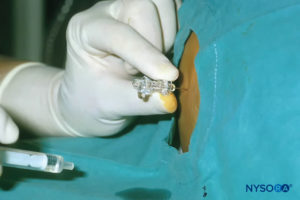
FIGURA 32. Anestesia espinal: el líquido cefalorraquídeo sale por la aguja y se inyecta anestesia local.
No se recomienda el método de barbotaje, ya que puede dar lugar a niveles inaceptablemente altos de bloqueo motor y tiene potencial para un bloqueo espinal total. Las extremidades inferiores del paciente no deben elevarse para colocar el electrodo de retorno del electrocauterio en la espalda del bebé, ya que la anestesia espinal total puede resultar de la propagación del anestésico local a un nivel espinal más alto. Para prolongar la duración de la anestesia quirúrgica en el caso de reparación de hernia bilateral, la anestesia espinal se puede complementar con un bloqueo caudal.
Evaluación del bloque
La evaluación del nivel de bloqueo puede resultar difícil en bebés y niños pequeños, particularmente en pacientes que han recibido sedación o en aquellos en quienes el bloqueo se realiza bajo anestesia general. En los lactantes, se puede utilizar el pinchazo o la respuesta a estímulos fríos (p. ej., una torunda con alcohol), así como la observación de la frecuencia y el patrón de ventilación. En niños mayores de 2 años se utiliza la escala de Bromage. Después del bloqueo, se debe tener cuidado de no colocar al paciente en posición de Trendelenburg o levantar las extremidades inferiores; por ejemplo, para colocar una almohadilla de electrocauterización en la espalda del bebé. En caso de que el nivel de bloqueo aumente rápidamente, se puede colocar al paciente en la posición de Trendelenburg inversa.
Consejos NYSORA
Evaluación de la anestesia espinal: la escala de Bromage
- Sin bloqueo: es posible el libre movimiento de rodillas y pies.
- Bloqueo parcial: solo es capaz de flexionar las rodillas, pero aún es posible el movimiento libre de los pies
- Bloqueo casi completo: incapaz de flexionar las rodillas pero todavía es posible flexionar los pies
- Completo: incapaz de mover las piernas o los pies
USOS CLÍNICOS
Apnea y ex-bebés prematuros
La indicación más común para la anestesia espinal en pacientes pediátricos es en recién nacidos prematuros sometidos a reparación de hernia inguinal unilateral.Tabla 9). La apnea puede ocurrir en ex pacientes prematuros después de una anestesia general. La anestesia regional puede disminuir, si no eliminar, el riesgo de apnea posoperatoria y ciertamente disminuye el riesgo de desaturación y bradicardia.
TABLA 9. Indicaciones de anestesia espinal en niños.
| Reparación de hernia inguinal |
| Reparación de mielomeningocele |
| Cirugía de miembros inferiores y abdomen inferior |
| Extubación precoz deseada tras cirugía cardiaca |
Sin embargo, existe un desacuerdo considerable con respecto a la incidencia de apnea y la edad conceptual en la que un recién nacido prematuro puede someterse con seguridad a anestesia general de forma ambulatoria. La falta de uniformidad en el diseño del estudio, el pequeño tamaño de la población de pacientes y las variaciones en la metodología probablemente explican las diferencias observadas. Cote en al. realizó un metanálisis de ocho estudios, con 255 pacientes, que investigaba la apnea posoperatoria en recién nacidos prematuros después de la anestesia general. En general, el riesgo se relacionó de forma independiente tanto con la edad gestacional como con la edad conceptual. Los factores de riesgo adicionales para la apnea posoperatoria fueron un hematocrito inferior al 30 % y episodios continuos de apnea en el hogar. El estudio estratificó a los bebés en dos grupos: un grupo de riesgo del 5 % y un grupo de riesgo del 1 %. Para pacientes con una edad gestacional de 35 semanas, el riesgo de apnea posoperatoria no cayó por debajo del 5 % (con un intervalo de confianza estadística del 95 %) hasta que las pacientes alcanzaron una edad posconcepcional de 48 semanas y no disminuyó por debajo del 1 % hasta los bebés. alcanzó una edad posconcepcional de 54 semanas. En pacientes más prematuros, como aquellos con una edad gestacional de 32 semanas, el riesgo de apnea no cayó por debajo del 1 % (con un intervalo de confianza estadística del 95 %) hasta que los bebés alcanzaron una edad posconcepcional de 56 semanas.
También se informó que el uso concomitante de ketamina como sedante en bebés prematuros aumentó la incidencia de apnea posoperatoria por encima de la informada en pacientes de control. Sin embargo, todos estos son estudios algo más antiguos. Mientras tanto, ha habido avances sustanciales en el manejo ventilatorio de los recién nacidos prematuros y los bebés, lo que hace que el riesgo de apnea sea controvertido en la actualidad. Además, las mejoras en la anestesia, como el uso prolongado de sevoflurano en lugar de halotano y máscaras laríngeas en lugar de la intubación traqueal, han disminuido aún más la incidencia de los efectos nocivos de la anestesia general en los lactantes. Craven et al. revisó varios estudios controlados aleatorios y encontró solo una ventaja estadística límite de la anestesia espinal sobre la anestesia general. En nuestra opinión, la administración de sevoflurano en ventilación espontánea durante un período corto de tiempo puede ser útil en ocasiones para ayudar a realizar el bloqueo espinal, especialmente si no se utiliza la crema EMLA.
La anestesia espinal también se ha utilizado para una variedad de otros procedimientos, incluida la reparación de mielomeningocele y otros procedimientos abdominales, urológicos y ortopédicos en niños. El informe inicial de Abajian et al. incluyeron no solo a bebés sometidos a herniorrafia inguinal, sino también a otros pacientes que no eran bebés y que, según los autores, corrían un mayor riesgo de anestesia general. Este estudio incluyó pacientes con una variedad de condiciones médicas, incluyendo laringomalacia, macroglosia, micrognatia, cardiopatía congénita, síndrome de Down, síndrome adrenogenital, retraso en el crecimiento y artrogriposis. Blaise et al. informaron 30 pacientes de 7 semanas a 13 años que se sometieron a anestesia espinal para una variedad de procedimientos quirúrgicos. Kokki et al. informaron anestesia satisfactoria en 92 de 93 niños de 1 a 17 años de edad sometidos a anestesia espinal con ropivacaína para procedimientos en el abdomen inferior o en las extremidades inferiores. Se han utilizado técnicas regionales en cirugía cardíaca para facilitar la extubación temprana. Esta gran serie que investiga la anestesia espinal para la cirugía cardíaca proviene de un análisis prospectivo aleatorizado de la Universidad de Stanford. El grupo que recibió raquianestesia para el alivio del dolor postoperatorio tuvo menor requerimiento de opioides en el postoperatorio de cirugía cardiaca electiva con extubación temprana en quirófano.
En resumen, la anestesia raquídea en pediatría se utiliza con mayor frecuencia en los recién nacidos prematuros que se someten a anestesia para la reparación de una hernia inguinal. La anestesia espinal también se puede usar de manera efectiva en niños para aliviar el dolor posoperatorio en cirugía cardíaca, especialmente si se usan opioides.
Referencias
- Peutrell JM, Lonnqvist PA: Bloqueos neuroaxiales para anestesia y analgesia en niños. Curr Opin Anaesthesiol 2003;16:461–470. 2
- Suresh S, Long J, Birmingham PK, et al: ¿Son seguros los bloqueos caudales para el control del dolor en niños? Un análisis de 18,650 bloques caudales de la base de datos de la Red de Anestesia Regional Pediátrica (PRAN). Anesth Analg 2015;120:151–156.
- Gunter JB, Eng C: Anestesia epidural torácica a través del abordaje caudal en niños. Anestesiología 1992;76:935–938.
- Larsson BA, Lonnqvist PA, Olsson GL: concentraciones plasmáticas de bupivacaína en recién nacidos después de una infusión epidural continua. Anesth Analg 1997;84:501–505.
- Luz G, Innerhofer P, Bachmann B, et al: concentraciones plasmáticas de bupivacaína durante la anestesia epidural continua en bebés y niños. Anesth Analg 1996;82:231–234.
- Berde C: Anestésicos locales en bebés y niños: una actualización. Pediatr Anaesth 2004;14:387–393.
- Gunter JB, Dunn CM, Bennie JB, et al: Concentración óptima de bupivacaína para anestesia caudal-general combinada en niños. Anestesiología 1991;75:57–61.
- Tsui BC, Berde CB: Técnicas de anestesia y analgesia caudal en niños. Curr Opin Anaesthesiol 2005;18:283–288.
- Lönnqvist PA: Artículo de revisión. Toxicidad de los fármacos anestésicos locales: una perspectiva pediátrica. Pediatr Anaesth 2012;22:39–43.
- Da Conceicao MJ, Coelho L, Khalil M: Ropivacaína al 0.25 % en comparación con bupivacaína al 0.25 % por vía caudal. Pediatr Anaesth 1999; 9:229–233.
- Eledjam JJ, Gros T, Viel E, et al: Sobredosis de ropivacaína y toxicidad sistémica. Anaesth Cuidados Intensivos 2000;28:705–707.
- Ivani G, Lampugnani E, Torre M, et al: Comparación de ropivacaína con bupivacaína para bloqueo caudal pediátrico. Hermano J Anaesth 1998;81: 247–248.
- Karmakar MK, Aun CS, Wong EL, et al: La ropivacaína sufre una absorción sistémica más lenta desde el espacio epidural caudal en niños que la bupivacaína (tabla). Anesth Analg 2002;94:259–265.
- Kokko TI, Karinen J, Raiha E, et al: Farmacocinética de ropivacaína al 0.75 % y bupivacaína al 0.5 % después del bloqueo del nervio ilioinguinal-iliohipogástrico en niños. Hermano J Anaesth 2002;89:438–441.
- Gunter JB: Beneficios y riesgos de los anestésicos locales en bebés y niños. Pediatr Drugs 2002;4:649–672.
- Bosenberg A, Thomas J, Lopez T, et al: La eficacia de la ropivacaína caudal 1, 2 y 3 mg × l(-1) para la analgesia posoperatoria en niños. Pediatr Anaesth 2002;12:53–58.
- Ivani G. Ropivacaína: ¿es hora de los niños? Pediatr Anaesth 2002; 12:383–387.
- Taylor R, Eyres R, Chalkiadis GA, et al: Eficacia y seguridad de la inyección caudal de levobupivacaína, 0.25%, en niños menores de 2 años sometidos a reparación de hernia inguinal, circuncisión u orquidopexia. Paediatr Anaesth 2003;13:114–121.
- Lonnqvist PA: complementos del bloqueo caudal en niños: ¿Quo vadis? Hermano J Anaesth 2005;95:431–433.
- Lonnqvist PA, Ivani G, Moriarty T: Uso de opioides caudales-epidurales en niños: ¿todavía de vanguardia o el principio del fin? Pediatr Anaesth 2002;12:747–749.
- Attia J, Ecoffey C, Sandouk P, et al: Morfina epidural en niños: farmacocinética y sensibilidad al CO2. Anestesiología 1986;65:590–594.
- Ansermino M, Basu R, Vandebeek C, et al: Aditivos no opioides a los anestésicos locales para el bloqueo caudal en niños: una revisión sistemática. Pediatr Anaesth 2003;13:561–573.
- De Negri P, Ivani G, Visconti C, et al: La relación dosis-respuesta para la clonidina añadida a una infusión epidural continua posoperatoria de ropivacaína en niños. Anesth Analg 2001;93:71–76.
- Penon C, Ecoffey C, Cohen SE: Respuesta ventilatoria al dióxido de carbono después de la inyección epidural de clonidina. Anesth Analg 1991;72:761–991.
- Fellmann C, Gerber AC, Weiss M: Apnea en un bebé prematuro anterior después de la bupivacaína caudal con clonidina para la herniorrafia inguinal. Paediatr Anaesth 2002;12:637–640.
- Passariello M, Almenrader N, Canneti A, et al: Analgesia caudal en niños: S(+)-ketamina vs S(+)-ketamina más clonidina. Pediatr Anaesth 2004;14:851–855.
- Hager H, Marhofer P, Sitzwohl C, et al: La clonidina caudal prolonga la analgesia de la S (+)-ketamina caudal en niños. Anesth Analg 2002; 94:1169–1172.
- Hayashi H, Dikkes P, Soriano SG: La administración repetida de ketamina puede conducir a la degeneración neuronal en el cerebro de rata en desarrollo. Pediatr Anaesth 2002;12:770–774.
- Proescholdt M, Heimann A, Kempski O: Neuroprotección del isómero de ketamina S (+) en la isquemia del cerebro anterior global. Cerebro Res 2001; 904: 245–251.
- Suresh S, Wheeler M: Anestesia regional pediátrica práctica. Anesthesiol Clin North Am 2002;20:83–113.
- Giaufre E, Dalens B, Gombert A: Epidemiología y morbilidad de la anestesia regional en niños: una encuesta prospectiva de un año de la Sociedad de Anestesiólogos Pediátricos de Lengua Francesa. Anesth Analg 1996;83:904–912
- Flandin-Blety C, Barrera G: Accidentes después de la analgesia extradural en niños. Los resultados de un estudio retrospectivo. Pediatr Anaesth 1995;5:41–46.
- Fischer HB: Realización de inserción epidural bajo anestesia general. Anestesia 2000;55:288–289.
- Kasai T, Yaegashi K, Hirose M, et al: Lesión de la médula espinal en un niño causada por una punción dural accidental con una aguja epidural torácica de un solo disparo. Anesth Analg 2003;96:65–67.
- Horlocker T, Wedel DJ, Rowlingson JC, et al: Anestesia regional en el paciente que recibe terapia antitrombótica o trombolítica. Directrices basadas en la evidencia de la Sociedad Estadounidense de Anestesia Regional y Medicina del Dolor (tercera edición). Reg Anesth Pain Med 2010;35:64–101.
- Kost-Byerly S, Tobin JR, Greenberg RS, et al: Colonización bacteriana y tasa de infección de catéteres epidurales continuos en niños. Anesth Analg 1998;86:712–716.
- Wittum S, Hofer CK, Rolli U, et al: Osteomielitis sacra después de anestesia epidural de inyección única a través del abordaje caudal en un niño. Anestesiología 2003;99:503–505.
- Bubeck J, Boos K, Krause H, Thies KC: La tunelización subcutánea de catéteres caudales reduce la tasa de colonización bacteriana a la de los catéteres epidurales lumbares. Anesth Analg 2004;99:689–693.
- Oliver A: Punciones durales en niños: ¿qué debemos hacer? Pediatr Anaesth 2002;12:473–477.
- Liley A, Manoharan M, Upadhyay V: El tratamiento de un dolor de cabeza posterior a la punción dural en un niño. Pediatr Anaesth 2003;13:534–537.
- Janssens E, Aerssens P, Alliet P, et al: Dolores de cabeza posteriores a la punción dural en niños. Una revisión de la literatura. Eur J Pediatr 2003;162:117–121.
- Tsuji MH, Horigome H, Yamashita M: Las funciones del ventrículo izquierdo no se ven afectadas después de la anestesia epidural lumbar en niños pequeños. Paediatr Anaesth 1996;6:405–409.
- Tsui BC, Malherbe S, Koller J, et al: Reversión de un anestésico espinal no intencional por lavado cerebroespinal. Anesth Analg 2004;98:434–436.
- Tobias JD: Bloqueo epidural caudal: una revisión de la dosificación de prueba y el reconocimiento de la inyección sistémica en niños. Anesth Analg 2001;93:1156–1161.
- Neal JM, Mulroy MF, Weinberg GF: Sociedad Estadounidense de Anestesia Regional y Medicina del Dolor. Lista de verificación para el manejo de la toxicidad sistémica por anestésicos locales: versión 2012. Reg Anesth Pain Med 2012;37:16Y18.
- Flandin-Blety C, Barrera G: Accidentes después de la analgesia extradural en niños. Los resultados de un estudio retrospectivo. Pediatr Anaesth 1995; 5:41–46.
- Valairucha S, Seefelder C, Houck CS: Catéteres epidurales torácicos colocados por vía caudal en lactantes: la importancia de la confirmación radiográfica. Paediatr Anaesth 2002;12:424–428.
- Tsui BC, Gupta S, Finucane B: Confirmación de la colocación del catéter epidural mediante estimulación nerviosa. Can J Anaesth 1998;45:640–644.
- Tsui BC, Seal R, Koller J, et al: analgesia epidural torácica a través del abordaje caudal en pacientes pediátricos sometidos a fundoplicatura utilizando guía de estimulación nerviosa. Anesth Analg 2001;93:1152–1155.
- Tsui BC, Gupta S, Finucane B: Detección de la colocación de catéteres subaracnoideos y epidurales intravasculares. Can J Anaesth 1999;46: 675–678.
- Tsui BC, Gupta S, Emery D, Finucane B: Detección de la colocación subdural de un catéter epidural mediante estimulación nerviosa. Can J Anaesth 2000;47:471–473.
- Tsui BC: colocación de catéter epidural torácico en lactantes a través del abordaje caudal bajo guía electrocardiográfica: simplificación de la técnica original. Anesth Analg 2004;98:273.
- Chen CP, Tang SF, Hsu TC, et al: guía de ultrasonido en la colocación de la aguja epidural caudal. Anestesiología 2004;101:181–184.
- Chawathe MS, Jones RM, Gildersleve CD, et al: Detección de catéteres epidurales con ultrasonido en niños. Pediatr Anaesth 2003;13: 681–684.
- Baris S, Guldogus F, Baris YS, et al: ¿La extracción de muestras de tejido es un problema real después de la inyección caudal en niños? Pediatr Anaesth 2004;14:755–758.
- Lam DK, Corry GN, Tsui BC: Evidencia para el uso de imágenes de ultrasonido en anestesia regional pediátrica: una revisión sistemática. Reg Anesth Pain Med 2016;41:229–241.
- Rubin K, Sullivan D, Sadhasivam S: ¿Son los bloqueos periféricos y neuroaxiales guiados por ecografía más efectivos y seguros en niños? Pediatr Anaesth 2009;19:92–96.
- Perlas A: Evidencia del uso de ultrasonido en bloqueos neuroaxiales. Reg Anesth Pain Med 2010;35(2 suplementos):S43–46.
- Triffterer L, Machata AM, Latzke D, et al: Evaluación por ultrasonido de la extensión craneal durante el bloqueo caudal en niños: efecto de la velocidad de inyección de anestésicos locales. Hermano J Anaesth 2012;108:670–674.
- Brenner L, Marhofer P, Kettner SC, et al: Evaluación por ultrasonido de la extensión craneal durante el bloqueo caudal en niños: el efecto de diferentes volúmenes de anestésicos locales. Hermano J Anaesth 2011;107:229–235.
- Lundblad M, Lönnqvist PA, Eksborg S, et al: Distribución segmentaria de anestesia caudal de alto volumen en recién nacidos, bebés y niños pequeños evaluada por ultrasonografía. Pediatr Anaesth 2010;21:121–127.
- Lundblad M, Eksborg S, Lönnqvist PA: Propagación secundaria del bloqueo caudal evaluada por ultrasonografía. Hermano J Anaesth 2012;108:675–681.
- Tamai H, Sawamura S, Kanamori Y, et al: Inserción de catéter epidural torácico utilizando el enfoque caudal asistido con un estimulador nervioso eléctrico en niños pequeños. Reg Anesth Pain Med 2004;29:92–95.
- Tsui BC, Wagner A, Cave D, et al: analgesia epidural torácica y lumbar a través del enfoque caudal utilizando guía de estimulación eléctrica en pacientes pediátricos: una revisión de 289 pacientes. Anestesiología 2004;100:683–689.
- Tsui BC, Entwistle L: Analgesia epidural torácica a través del abordaje lumbar mediante estimulación nerviosa en un paciente pediátrico con síndrome de Down. Acta Anaesthesiol Scand 2005;49:712–714.
- Fischer HB: Realización de inserción epidural bajo anestesia general. Anestesia 2000;55:288–289.
- Kasai T, Yaegashi K, Hirose M, et al: Lesión de la médula espinal en un niño causada por una punción dural accidental con una aguja epidural torácica de un solo disparo. Anesth Analg 2003;96:65–67.
- Bromage PR, Benumof JL: Paraplejía después de una inyección intramedular durante un intento de anestesia epidural bajo anestesia general. Reg Anesth Pain Med 1998;23:104–107.
- Chawathe MS, Jones RM, Gildersleve CD, et al: Detección de catéteres epidurales con ultrasonido en niños. Pediatr Anaesth 2003;13: 681–684.
- Corning JL: Anestesia espinal y medicación local de la médula. NYJ Med 1885;42:483–485.
- Gray H: Un estudio de la anestesia espinal en niños y bebés: de una serie de 200 casos. Lancet 1909; 2: 913–917.
- Bainbridge W: Analgesia en niños por inyección espinal con un informe de un nuevo método de esterilización del líquido de inyección. Med Rec 1900;58:937–940.
- Melman E, Peñuelas JA, Marrufo J: Anestesia regional en niños. Anesth Analg 1975;54:387–390.
- Gregory GA, Steward DJ: apnea perioperatoria potencialmente mortal en el ex "premie". Anestesiología 1983;59:495–498.
- Steward DJ: Síndrome de apnea postoperatoria en bebés prematuros. West J Med 1992; 157:567.
- Steward DJ: Los bebés prematuros son más propensos a sufrir complicaciones después de una cirugía menor que los bebés a término. Anestesiología 1982;56:304–306.
- Cote CJ, Zaslavsky A, Downes JJ, et al: Apnea postoperatoria en bebés prematuros después de una herniorrafia inguinal. Un análisis combinado [ver comentarios]. Anestesiología 1995;82:809–822.
- Liu LM, Cote CJ, Goudsouzian NG, et al: Apnea potencialmente mortal en bebés que se recuperan de la anestesia. Anestesiología 1983;59:506–510.
- Abajian JC, Mellish RW, Browne AF, et al: Anestesia espinal para cirugía en bebés de alto riesgo. Anesth Analg 1984;63:359–362.
- Frumiento C, Abajian JC, Vane DW: anestesia espinal para bebés prematuros sometidos a reparación de hernia inguinal. Arch Surg 2000; 135: 445–451.
- Blaise GA, Roy WL: Anestesia espinal para cirugía pediátrica menor. Can Anaesth Soc J 1986;33:227–230.
- Kokki H, Tuovinen K, Hendolin H: Anestesia espinal para cirugía pediátrica ambulatoria: una comparación prospectiva, doble ciego, aleatorizada, de grupos paralelos, de bupivacaína isobárica e hiperbárica. Hermano J Anaesth 1998;81:502–506.
- Busoni P, Messeri A: Anestesia espinal en niños: anatomía de superficie. Anesth Analg 1989;68:418–419.
- Busoni P, Messeri A: Anestesia espinal en lactantes: ¿podría ser más seguro un abordaje L5-S1? Anestesiología 1991;75:168–169.
- Gray H: Anatomía del cuerpo humano: Anatomía de Gray, 30ª ed. Filadelfia: Lippincott Williams & Wilkins, 1985.
- Puncuh F, Lampugnani E, Kokki H: Uso de anestesia espinal en pacientes pediátricos: experiencia de un solo centro con 1132 casos. Paediatr Anaesth 2004;14:564–567.
- Kokki H, Ylonen P, Laisalmi M, et al: Isobárica ropivacaína 5 mg/mL para anestesia espinal en niños. Anesth Analg 2005;100:66–70.
- Kokki H, Hendolin H: Bupivacaína hiperbárica para anestesia espinal en niños de 7 a 18 años: comparación de bupivacaína 5 mg mL-1 en soluciones de glucosa al 0.9 % y al 8 %. Hermano J Anaesth 2000;84:59–62.
- Rochette A, Raux O, Troncin R, et al: La clonidina prolonga la anestesia espinal en recién nacidos: un estudio prospectivo de rango de dosis. Anesth Analg 2004;98:56–59.
- Welborn LG, de Soto H, Hannallah RS, et al: El uso de la cafeína en el control de la apnea postanestésica en ex bebés prematuros. Anestesiología 1988;68:796–798.
- Oberlander TF, Berde CB, Lam KH, et al: Los bebés toleran la anestesia espinal con cambios autónomos generales mínimos: análisis de la variabilidad de la frecuencia cardíaca en bebés prematuros sometidos a reparación de hernia. Anesth Analg 1995;80:20–27.
- Ramamoorthy C, Geiduschek JM, Bratton SL, et al: Dolor de cabeza pospunción dural en pacientes oncológicos pediátricos. Clin Pediatr 1998;37:247–251.
- Kokki H, Salonvaara M, Herrgard E, Onen P: El dolor de cabeza pospunción dural no es un síntoma relacionado con la edad en niños: estudio prospectivo, aleatorizado abierto, de grupos paralelos que compara una aguja Quincke de calibre 22 con una aguja Whitacre de calibre 22. Pediatr Anaesth 1999;9:429–434.
- Salmela L, Aromaa U: Irritación radicular transitoria tras raquianestesia inducida con soluciones hiperbáricas de líquido cefalorraquídeo lidocaína diluida 50 mg/mL o mepivacaína 40 mg/mL o bupivacaína 5 mg/mL. Acta Anaesthesiol Scand 1998;42:765–769.
- Welborn LG, Rice LJ, Hannallah RS, et al: Apnea posoperatoria en bebés prematuros anteriores: comparación prospectiva de anestesia espinal y general. Anestesiología 1990;72:838–842.
- Gleason CA, Martin RJ, Anderson JV, et al: Posición óptima para una punción lumbar en bebés prematuros. Pediatría 1983;71:31–35.
- Krane EJ, Haberkern CM, Jacobson LE: Apnea posoperatoria, bradicardia y desaturación de oxígeno en bebés anteriormente prematuros: comparación prospectiva de anestesia espinal y general. Anesth Analg 1995;80:7–13.
- Craven PD, Badawi M, Henderson-Smart DJ, O'Brien M: Anestesia regional (espinal, epidural, caudal) versus anestesia general en bebés prematuros sometidos a herniorrafia inguinal en la primera infancia. Base de datos Cochrane Syst Rev 2003;(3):CD003669.
- Viscomi CM, Abajian JC, Wald SL, et al: anestesia espinal para la reparación de meningomielocele en recién nacidos. Anesth Analg 1995;81:492–495.
- Kokki H, Hendolin H. Comparación de anestesia espinal con anestesia epidural en cirugía pediátrica. Acta Anaesthesiol Scand 1995;39: 896–900.
- Hammer GB, Ramamoorthy C, Cao H, et al: analgesia posoperatoria después del bloqueo espinal en bebés y niños sometidos a cirugía cardíaca. Anesth Analg 2005;100:1283–1288.