John-Paul J. Pozek, David Beausang, Kara G. Segna y Eugene R. Viscusi
INTRODUCCIÓN
Los anestésicos locales (AL) se encuentran entre los fármacos más útiles en la práctica de la anestesiología y el manejo del dolor. Son piedras angulares en el manejo del dolor posoperatorio dentro de una vía analgésica multimodal para reducir o eliminar los opioides y sus efectos adversos resultantes. Sin embargo, los AL actualmente disponibles muestran un rango considerable de inicio y duración, así como tolerabilidad en una amplia gama de usos, que incluyen infiltración, bloqueos periféricos y anestesia epidural y espinal. Su principal limitación es la duración de la acción, que en el tratamiento del dolor postoperatorio puede impedir una terapia adecuada de duración suficiente. Por esa razón, los sistemas de infusión de catéter continuo se usan ampliamente, pero presentan desafíos, como la colocación del catéter, la migración y el mantenimiento del catéter, y la carga de la bomba externa. Por lo tanto, los LA de acción prolongada con inicio, administración y duración de la acción predecibles serían una solución casi ideal. Los anestésicos locales pueden tener propiedades considerablemente diferentes según el compartimento del cuerpo donde se coloquen. Los LA de liberación controlada deben estudiarse bien en cuanto a eficacia clínica y confiabilidad en los diversos sitios y modos de aplicación. En este momento, solo un medicamento de liberación controlada está aprobado por la Administración de Alimentos y Medicamentos (FDA) y está disponible comercialmente, aunque hay varios otros en desarrollo. En este capítulo, resumimos la información actualmente disponible.
PORTADORES DE ANESTÉSICOS LOCALES
Desde la década de 1970, los sistemas de administración de fármacos para AL han sido objeto de considerables esfuerzos de investigación. Las estrategias de desarrollo suelen basarse en enfoques interdisciplinarios que combinan ciencia de polímeros, productos farmacéuticos, química de bioconjugados y biología molecular. Los objetivos de estos vehículos son proporcionar un depósito de LA en el sitio objetivo para prolongar el efecto del fármaco y disminuir la toxicidad local y sistémica al reducir la concentración de LA y aumentar la permeabilidad y absorción de LA. Estos factores determinan la concentración y el efecto del LA sobre el tejido nervioso, influyendo en la latencia, la propagación, la intensidad del bloqueo y la duración de la acción. Los enfoques de formulación para administrar LA sistémicamente han incluido la encapsulación en liposomas, la formación de complejos en ciclodextrinas, la asociación con biopolímeros, vehículos transdérmicos no liposomales y otros sistemas de transporte. Los sistemas de administración tópica para LA comprenden un amplio espectro de adyuvantes, incluidos agentes inductores de viscosidad, conservantes, potenciadores de la permeación y emolientes. El estado físico de estos portadores varía desde semisólido (gel, crema, pomada); líquido (emulsión, dispersión); a formas farmacéuticas sólidas (parches).
Formulaciones anestésicas locales basadas en liposomas
Los liposomas, ampliamente investigados como transportadores de fármacos para mejorar la entrega de agentes terapéuticos a sitios específicos del cuerpo, no son inmunogénicos, biodegradables, no tóxicos y funcionan encapsulando materiales hidrofílicos e hidrofóbicos para administrar fármacos. La versatilidad estructural combinada con la capacidad de encapsular diferentes compuestos, como los LA, se debe a las vesículas microscópicas de fosfolípidos de una o dos capas. El núcleo polar de la lipoesfera permite que las moléculas hidrofílicas del fármaco se encapsulen. Las moléculas anfifílicas y lipofílicas se solubilizan dentro de la bicapa de fosfolípidos según su afinidad. Las proteínas del canal se pueden incorporar al liposoma sin pérdida de actividad dentro del dominio hidrofóbico de las membranas de las vesículas, actuando como un filtro selectivo. Por lo tanto, los fármacos que están encapsulados con proteínas del canal están protegidos de manera efectiva contra la degradación prematura por las enzimas proteolíticas y pueden difundirse a través del canal impulsado por gradientes de concentración entre el "nanoenvoltorio" interior y exterior. Se pueden preparar varios tipos de liposomas, según el número de capas lipídicas, el tamaño, la carga superficial, la composición lipídica y los métodos de formación de vesículas. En el caso de los liposomas y los sistemas basados en micro o nanopartículas, la acción farmacológica mejorada se genera por la lenta velocidad de liberación del fármaco encapsulado desde estas bicapas lipídicas.
Beneficios
Los liposomas, compuestos de sustancias naturales, ofrecen la ventaja de ser no tóxicos y biodegradables. La capacidad de atrapar fármacos en forma acuosa o lipídica permite transportar tanto fármacos hidrofílicos como hidrofóbicos. Las ventajas de encapsular LA en liposomas es la administración controlada a través de la liberación lenta del fármaco para prolongar el efecto anestésico y reducir el riesgo de toxicidad cardiovascular y del sistema nervioso central.
Consejos NYSORA
- Los liposomas son esferas microscópicas que contienen un núcleo acuoso rodeado por una bicapa de fosfolípidos.
Riesgos / Limitaciones
Aunque los liposomas son el vehículo de elección en muchas tecnologías, su uso para los LA no se ha explorado adecuadamente a menudo. Esto podría deberse a que los liposomas se consideran sistemas coloidales inestables, ya sea físicamente debido a su tamaño o químicamente, ya que los lípidos son propensos a la oxidación.
espuma depo®
espuma depo® consiste en partículas microscópicas, esféricas, a base de lípidos (Figura 1A). Las partículas están compuestas por numerosas cámaras acuosas poliédricas, no concéntricas, que contienen el fármaco en solución. Cada cámara de este liposoma multivesicular está separada de las cámaras adyacentes por membranas lipídicas (Figura 1B). Las partículas de DepoFoam se distinguen estructuralmente de las vesículas unilamelares, las vesículas multilamelares y los neosomas.Figura 2 y XNUMX) por estas vesículas no concéntricas estrechamente empaquetadas. Las partículas tienen decenas de micrómetros de diámetro y tienen un gran volumen atrapado. Esto permite la entrega de cantidades relativamente grandes de medicamentos en forma encapsulada con solo un pequeño volumen de la formulación. Es importante destacar que la plataforma liposomal que encapsula el fármaco lo hace sin alterar la estructura molecular. Por lo tanto, se pueden usar varios métodos basados en la manipulación del lípido y la composición acuosa para controlar la tasa de liberación sostenida durante un período deseado de 1 a 30 días a través de la erosión o reorganización de las membranas lipídicas. DepoFoam se ha utilizado hasta la fecha en dos productos comerciales aprobados por la FDA, incluido DepoCyt(e)® (inyección de liposomas de citarabina), así como EXPAREL® (suspensión inyectable de liposomas de bupivacaína). DepoFoam se puede liberar en el torrente sanguíneo a través del espacio intersticial por vía subcutánea o intramuscular o se puede administrar localmente en un compartimento del cuerpo o en una articulación a través de métodos intratecales, intraperitoneales, subcutáneos, epidurales o intraoculares.
Consejos NYSORA
- La tecnología DepoFoam consiste en partículas a base de lípidos con cámaras acuosas poliédricas, no concéntricas que contienen el medicamento. Esta tecnología se puede utilizar con varios medicamentos diferentes.

FIGURA 1. A: imagen de micrografía electrónica de barrido de DepoFoam con bupivacaína. B: Diagrama que representa las cámaras acuosas poliédricas no concéntricas llenas de medicación. (Usado con permiso de Pacira Pharmaceuticals, Inc.)
Beneficios
DepoFoam es un producto listo para usar y se puede administrar con agujas de calibre pequeño y sistemas de pluma. Con un sistema de administración flexible, está diseñado para ofrecer una dosis de liberación inmediata, seguida de una administración sostenida. DepoFoam contiene menos del 3 % de lípidos naturales o un análogo sintético de los lípidos comunes, incluidos los fosfolípidos, el colesterol y los triglicéridos; por lo tanto, es biodegradable y biocompatible. Los ensayos clínicos han demostrado efectos adversos limitados o nulos de DepoFoam. Ya existe una experiencia clínica considerable con el sistema de administración, ya que la formulación se ha utilizado en productos aprobados por la FDA y la Agencia Europea de Medicamentos. Además, a dosis similares, esta formulación puede reducir la exposición sistémica y la toxicidad al reducir los niveles séricos máximos de un fármaco.
Formulaciones poliméricas de micropartículas y nanopartículas
Las micropartículas o nanopartículas poliméricas representan sistemas de administración de fármacos hechos de esferas o cápsulas de polímeros naturales o artificiales, que deben ser biocompatibles y biodegradables para fines de administración de fármacos. Las nanopartículas actúan como portadores potenciales de varias clases de fármacos, como agentes contra el cáncer, agentes antihipertensivos, inmunomoduladores y hormonas, y de macromoléculas como ácidos nucleicos, proteínas, péptidos y anticuerpos. Las nanopartículas se pueden diseñar para la administración de fármacos en sitios específicos. La capacidad de direccionamiento y liberación de las nanopartículas está influenciada por el tamaño de las partículas, la carga de la superficie, la modificación de la superficie y la hidrofobicidad. El rendimiento de las nanopartículas in vivo está influenciado por las características morfológicas, la química de la superficie y el peso molecular. Se afirma que las tecnologías de polímeros (micropartículas o nanopartículas) son aplicables a todos los compuestos LA disponibles comercialmente. Se ha explorado una variedad de polímeros naturales y sintéticos para la preparación de nanopartículas, de las cuales poli(ácido láctico) (PLA) y poli(ácido glicólico) (PGA) y su copolímero poli(ácido láctico-co-glicólico) (PLGA) han sido ampliamente investigados por su biocompatibilidad y biodegradabilidad.
El PLGA, uno de los polímeros biodegradables desarrollados con más éxito, atrajo una atención considerable debido a que la FDA y la Agencia Europea de Medicamentos aprobaron la administración parenteral. Otras propiedades incluyen formulaciones bien descritas y métodos de producción adaptados a varios tipos de fármacos (p. ej., moléculas pequeñas o macromoléculas hidrófilas o hidrófobas) y la protección del fármaco frente a la degradación. El uso de PLGA permite la posibilidad de liberación sostenida, la posibilidad de modificar las propiedades de la superficie para proporcionar una mejor interacción con los materiales biológicos e incluso la posibilidad de dirigir las nanopartículas a órganos o células específicos. Es de destacar que, después de la administración sistémica, los sistemas de administración de fármacos basados en PLGA son absorbidos preferentemente por el sistema reticuloendotelial (RES) y presentan una captación alta y selectiva en áreas inflamadas. Una de las razones del éxito del transportador es que la hidrólisis conduce a los metabolitos monómeros ácido láctico y ácido glicólico, que son endógenos y fácilmente metabolizados por el cuerpo a través del ciclo de Krebs. El sistema de administración de PLGA está asociado con un potencial casi insignificante de toxicidad.
Beneficios
Las nanopartículas biodegradables se han utilizado con frecuencia como vehículos de administración de fármacos debido a su biodisponibilidad mejorada, mejor encapsulación y liberación controlada. La literatura describe que la micro o nanoencapsulación de LA prolonga en gran medida la duración del bloqueo y reduce la toxicidad sistémica.
Riesgos / Limitaciones
A pesar de la investigación existente sobre micropartículas biodegradables que contienen fármacos macromoleculares, los efectos de los parámetros críticos que influyen en la encapsulación de fármacos no están suficientemente investigados para los transportadores a nanoescala. Sin embargo, se están desarrollando y refinando muchas técnicas novedosas para la preparación de nanopartículas cargadas de fármacos. El quid del problema es la estabilidad de las nanopartículas después de la preparación, que se está abordando mediante la liofilización utilizando diferentes clases de lioprotectores. Otro problema es que la determinación precisa del contenido de fármaco no es fácil porque las nanopartículas son sistemas coloidales. La eficiencia de encapsulación de los fármacos varía del 6% al 90% para la dexametasona y el paclitaxel, respectivamente, mientras que la eficiencia media de encapsulación es de alrededor del 60% al 70% para varios fármacos, como el estradiol o las xantonas. Otro escollo importante de las nanopartículas basadas en PLGA es que, aunque las nanopartículas basadas en PLGA a menudo pueden presentar una alta eficiencia de encapsulación, la carga de fármaco es generalmente deficiente (alrededor del 1 %, lo que significa que las nanopartículas contienen 1 mg de ingrediente activo por cada 100 mg de polímeros de nanopartículas) . Otro escollo importante es la consideración de la liberación de fármaco a partir de nanopartículas. Este fenómeno se describe para la mayoría de las nanopartículas basadas en PLGA. En consecuencia, es posible que el fármaco no pueda llegar al tejido o las células diana, lo que provoca una pérdida de eficacia. Los mecanismos de liberación del fármaco dependen del polímero utilizado y de la eficiencia de carga. En general, la rápida liberación inicial se atribuye al fármaco adsorbido en la superficie de las nanopartículas. Todavía se está trabajando para abordar estos problemas.
BUPIVACAÍNA LIPOSOMAL
En octubre de 2011, la FDA aprobó el uso de bupivacaína liposomal de inyección única para la infiltración del sitio quirúrgico. Hasta la fecha, este es el único LA de liberación controlada aprobado por la FDA. La bupivacaína liposomal produce niveles plasmáticos confiables de bupivacaína hasta 72 horas después de la infiltración. En comparación, la bupivacaína HCl tradicional tiene una duración de acción de aproximadamente 7 horas después de la infiltración del tejido. La bupivacaína liposomal encapsula bupivacaína HCl dentro del vehículo, DepoFoam. Antes de este desarrollo, extender la duración de la acción de un LA dependía de catéteres permanentes y bombas de infusión. La tecnología de infusión con un catéter permanente conlleva un riesgo de infección, errores de llenado de medicamentos, errores de etiquetado y tasas de infusión variables, particularmente con bombas elastométricas. El reemplazo de bolsas elastoméricas y catéteres dirigidos con LA encapsulado en un liposoma es un enfoque novedoso para proporcionar analgesia. Hasta la fecha, la bupivacaína liposomal se ha estudiado en pacientes sometidos a cirugía de tejidos blandos (hemorroidectomía, reparación de hernia inguinal, mamoplastia de aumento) o cirugía ortopédica (juanetetomía y artroplastia total de rodilla). Actualmente, está aprobado para la infiltración de tejidos.
Consejos NYSORA
- La bupivacaína liposomal es un LA de liberación controlada que está aprobado por la FDA para la infiltración de heridas (sitio quirúrgico).
Formulación
DepoFoam sirve como vehículo basado en lípidos de bupivacaína HCl. En comparación con otros operadores, como DepoDur® y DepoCyt, la principal diferencia es la incorporación de dierucoilfosfatidilcolina en DepoFoam. Se compone de análogos no metógenos, naturales o sintéticos de lípidos comunes, lo que lo hace generalmente bien tolerado, aunque una infiltración tisular con bupivacaína DepoFoam en conejos y perros resultó en una inflamación granulomatosa, considerada una reacción natural contra los liposomas.
Farmacología
La bupivacaína liposomal se presenta actualmente en un vial de 20 ml a una concentración del 1.3 %. Se recomienda la administración en dosis única, que no supere los 266 mg (un vial). Aproximadamente el 3% del LA en la bupivacaína liposomal está presente en forma libre. Debido a esto, el fármaco exhibe dos picos en la concentración plasmática Tmax luego de la infiltración tisular (Tabla 1). Esto fue observado por Langford et al en su estudio de pacientes que recibieron infiltración de bupivacaína liposomal para reparación de hernia inguinal. El primer Tmax ocurre dentro de la primera hora, seguido de un segundo Tmax dentro de las 12 horas. La absorción sistémica depende de la dosis total del fármaco administrado, la vía de administración y la vascularización del sitio de administración. La bupivacaína liposomal tiene una duración de acción de 24 horas. Al igual que con la bupivacaína tradicional, la bupivacaína liposomal se metaboliza en el hígado luego de su liberación del sistema de administración del fármaco. Se recomienda precaución al usar bupivacaína liposomal en pacientes con disfunción hepática grave. En la fase 1, los pacientes del ensayo con insuficiencia hepática moderada tuvieron un aumento de 1.5 veces en la concentración plasmática máxima Cmax en comparación con controles sanos después de una sola infiltración de 300 mg de bupivacaína liposomal. Sin embargo, es probable que esto no tenga una gran importancia clínica con la administración única de bupivacaína liposomal. No se espera una acumulación significativa de bupivacaína o sus metabolitos a pesar de la función hepática alterada. Aproximadamente el 6% de la bupivacaína se excreta sin cambios en la orina.
TABLA 1. Farmacocinética de los anestésicos locales de liberación controlada.
| Droga | Portador | Tmax (H) | Cmax (ng/mL) |
|---|---|---|---|
| Bupivacaína liposomal | espuma depo | 1-12a | 365b |
| SABRE-bupivacaína | SAIB | 24-48c | 625-989c |
| Implante de bupivacaína-colágeno | Matriz de colágeno biodegradable | 0.5-20d | 200d |
SAIB = isobutirato de acetato de sacarosa.
Dosificación y Administración
Se recomienda la dilución con solución salina estéril hasta un volumen total máximo de 300 ml. Las soluciones hipobáricas, como el agua esterilizada, pueden alterar el soporte liposomal, lo que podría provocar la pérdida de la eficacia sostenida y niveles elevados del fármaco en el sistema. La dilución de la bupivacaína liposomal con otros fármacos, como la lidocaína o el clorhidrato de bupivacaína, puede provocar la interrupción del transportador, la liberación acelerada de la bupivacaína unida y la toxicidad. No se recomienda LA adicional, de ningún tipo, durante las 24 horas posteriores a la administración de bupivacaína liposomal. El portador liposomal mantendrá su integridad con la inyección a través de agujas tan pequeñas como de calibre 30.
Consejos NYSORA
- La dilución de la bupivacaína liposomal con otro LA puede causar la interrupción del transportador de lípidos, posiblemente desatando la bupivacaína.
Evidencia clínica
En un ensayo de fase 3, se comparó una infiltración de 266 mg de bupivacaína liposomal con placebo en pacientes sometidos a hemorroidectomía. Este estudio aleatorizado, doble ciego de 189 pacientes encontró que los pacientes que recibieron bupivacaína liposomal tenían significativamente menos dolor y menos pacientes requirieron rescate con opiáceos. También se observó una diferencia significativa con respecto al consumo de opioides de 72 horas, que fue un 45% menor en comparación con el placebo. Después de este estudio, Onel y sus colegas compararon la bupivacaína liposomal con el clorhidrato de bupivacaína en una cohorte similar de pacientes. Este estudio doble ciego, aleatorizado y controlado examinó a 100 pacientes para hemorroidectomía. Los pacientes tuvieron significativamente menos dolor (47 %) y requirieron significativamente menos opioides (66 %) durante las primeras 72 horas con bupivacaína liposomal.
Consejos NYSORA
- Los pacientes que recibieron infiltración de heridas con bupivacaína liposomal tuvieron significativamente menos dolor y uso de opiáceos que aquellos que recibieron clorhidrato de bupivacaína para hemorroidectomía y bunionectomía.
En un ensayo aleatorio doble ciego de 193 pacientes que recibieron bunionectomía con osteotomía del primer metatarsiano, la bupivacaína liposomal mostró una reducción significativa del dolor a las 24 y 36 horas en comparación con el placebo. Aunque no hubo diferencias estadísticamente significativas en las puntuaciones de dolor, un estudio de búsqueda de dosis de bupivacaína liposomal de pacientes sometidos a reparación de hernia inguinal unilateral demostró beneficios para los criterios de valoración secundarios. El grupo de bupivacaína liposomal tendió a requerimientos más bajos de opioides en pacientes en todas las dosis (155, 200, 266, 310 mg) en comparación con 100 mg de clorhidrato de bupivacaína. En un ensayo aleatorizado de mujeres que se sometieron a una cirugía de aumento mamario bilateral, los sujetos se aleatorizaron para recibir una inyección de 133 o 266 mg de bupivacaína liposomal en un seno y 75 mg de bupivacaína clorhidrato en el seno contralateral. En ambos grupos, los sujetos se quejaron de más dolor en el seno que recibieron bupivacaína HCl. La diferencia en el consumo de opiáceos entre los dos grupos solo alcanzó significación después de 48 horas, lo que es proporcional a la liberación retardada de bupivacaína de los liposomas portadores. El uso de bupivacaína liposomal en pacientes después de una reconstrucción mamaria basada en implantes demostró una disminución significativa de las puntuaciones de dolor en la escala analógica visual (EVA) a las 4-24 horas después de la operación en comparación con el clorhidrato de bupivacaína y el placebo. No hubo diferencia en el uso de opiáceos y antieméticos entre los tres grupos de tratamiento. Se han realizado múltiples estudios que investigan la eficacia analgésica de la bupivacaína liposomal en la infiltración de heridas después de una artroplastia total de rodilla. Un estudio de Bagsby et al comparó la inyección periarticular con bupivacaína liposomal al 2.6 % versus ropivacaína al 0.5 %. Los pacientes informaron puntuaciones medias de dolor similares a las 24 horas, pero durante el resto de la hospitalización, las puntuaciones de dolor aumentaron significativamente en el grupo de bupivacaína liposomal. La mitad del grupo de ropivacaína informó que su dolor era leve, en comparación con solo el 17 % de los pacientes que recibieron bupivacaína liposomal. Un reciente ensayo controlado, aleatorizado y de gran tamaño comparó la inyección periarticular de bupivacaína liposomal versus bupivacaína HCl. Todos los pacientes recibieron simultáneamente analgesia multimodal. Los dos grupos no tuvieron diferencias significativas en términos de dolor diario mínimo, peor y promedio en todos los puntos temporales. Además, no hubo diferencia en el consumo de opioides. Un estudio prospectivo aleatorizado reciente comparó la infiltración local de bupivacaína liposomal con una inyección única de bloqueo del nervio femoral de ropivacaína y tetracaína. El grupo de bloqueo nervioso tuvo significativamente menos dolor en las primeras 24 horas posteriores a la operación, pero el consumo total de opioides no cambió entre los dos grupos. Curiosamente, el grupo de bloqueo nervioso tuvo menos opioides durante el primer día después de la operación, mientras que el grupo de bupivacaína liposomal consumió menos el segundo día.
Safety
Se recomienda que la dosis de bupivacaína liposomal no exceda el vial único de 266 mg. No se recomienda repetir la administración de LA dentro de las 72 horas posteriores a la infiltración. Para garantizar la integridad del portador liposomal, la bupivacaína liposomal debe diluirse solo con solución salina normal y administrarse a través de una aguja de calibre 25 o más grande. Para evitar posibles niveles tóxicos de lidocaína y bupivacaína, la infiltración de bupivacaína liposomal debe seguir a la infiltración de lidocaína durante al menos 20 minutos. Sin embargo, en general, en más de 1 millón de pacientes expuestos, la bupivacaína liposomal demostró un perfil de toxicidad sistémica de seguridad notable. La seguridad de la bupivacaína liposomal en los bloqueos de nervios periféricos (PNB) se analiza más adelante en el capítulo.
Consejos NYSORA
- La inyección de bupivacaína liposomal debe realizarse al menos 20 minutos después de la infiltración de lidocaína para evitar una posible toxicidad.
Aplicaciones experimentales Bloques de nervios periféricos
El uso de bupivacaína liposomal en BNP ha generado un interés significativo como posible método aprobado por la FDA para prolongar el bloqueo nervioso sin catéteres permanentes. En el momento de la publicación, la bupivacaína liposomal no había sido aprobada por la FDA para esta indicación. Los datos de los estudios toxicológicos preclínicos no demostraron signos de neurotoxicidad en modelos animales. De manera similar, un estudio de fase 1 en voluntarios sanos no demostró lesión nerviosa con PNB de una sola inyección. Se observó la eficacia de dosis más altas de bupivacaína liposomal en los bloqueos del nervio femoral en pacientes que se sometieron a una artroplastia de rodilla tricompartimental. Los pacientes que recibieron 133 y 266 mg tuvieron una disminución significativa del dolor en reposo a las 24 horas en comparación con los pacientes que recibieron 67 mg de bupivacaína liposomal o solución salina. Un estudio realizado por Ilfeld et al con dosis variables de bupivacaína liposomal (0 a 80 mg) demostró un bloqueo motor y sensorial prolongado con dosis más altas del medicamento. Todos los pacientes tuvieron bloqueo motor y sensorial durante más de 24 horas en el grupo de tratamiento de 40 mg y más del 90 % en el grupo de tratamiento de 80 mg. Una revisión reciente de la literatura examinó la seguridad de la bupivacaína liposomal en seis estudios con voluntarios sanos y pacientes que se sometieron a diversos procedimientos quirúrgicos. Los efectos secundarios más comunes de la inyección de bupivacaína liposomal perineural fueron náuseas, pirexia, estreñimiento, vómitos y prurito. No hubo diferencia en los efectos adversos entre la bupivacaína liposomal y el placebo. Los eventos adversos relacionados con el tratamiento tuvieron menor incidencia en los grupos de bupivacaína liposomal versus bupivacaína HCL, siendo el evento adverso más común la hipoestesia. Los posibles factores disuasorios para el uso generalizado de bupivacaína liposomal en los BNP son la posible incapacidad para lograr la anestesia quirúrgica, la analgesia inferior en comparación con el clorhidrato de bupivacaína durante las primeras 12 horas posoperatorias y la incapacidad para titular la LA para lograr el efecto. El bloqueo sensorial y motor prolongado puede afectar la rehabilitación temprana y aumentar los riesgos de caídas. Si se aprueba su uso en BNP, la bupivacaína liposomal de inyección única puede presentar una alternativa de acción prolongada a la BNP continua. Existe la posibilidad de una mayor eficiencia del procedimiento y un uso más generalizado de BNP sin la colocación y fijación de un catéter perineural, y el paciente evitaría posibles eventos adversos relacionados con la colocación del catéter.
Anestesia epidural
La bupivacaína liposomal actualmente no está aprobada para administración epidural, aunque se ha estudiado su perfil farmacológico después de una única inyección epidural. Viscusi, Candiotti y sus colegas realizaron un estudio piloto de fase 1 aleatorizado, doble ciego, de control activo y de aumento de dosis que evaluó una dosis única de bupivacaína liposomal de 89, 155 o 266 mg en comparación con bupivacaína HCl 50 mg en voluntarios sanos. Su estudio concluyó que la bupivacaína liposomal epidural a 266 mg resultó en una duración más prolongada del bloqueo sensorial que la bupivacaína liposomal 89 o 155 mg o la bupivacaína HCl 50 mg. Curiosamente, la incidencia de algún grado de bloqueo motor fue menor con bupivacaína liposomal 266 mg versus bupivacaína HCl 50 mg. El grupo de bupivacaína liposomal tuvo menos pacientes que no podían deambular después de 4 horas y una resolución más rápida del bloqueo motor completo. El alto índice de bloqueo sensoriomotor sugiere una utilidad significativa de la bupivacaína liposomal en la anestesia epidural, pero se necesitan más estudios para documentar la seguridad y la eficacia.
MEDICAMENTOS EXPERIMENTALES
SABRE-Bupivacaína
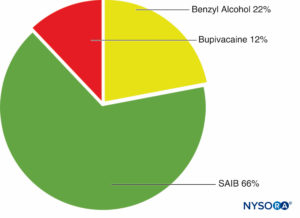
La tecnología SABRE (liberación prolongada de isobutirato de acetato de sacarosa) (Durect Corporation) se ha desarrollado como un sistema de depósito inyectable bioerosionable con el potencial de administrar un fármaco durante un período de días a 3 meses.
Formulación
El sistema de administración SABRE consta de isobutirato de acetato de sacarosa (SAIB), aditivos y un solvente. SAIB es un derivado de sacarosa esterificado hidrofóbico que existe como un líquido viscoso (Figura 3 y XNUMX). El sistema SABRE puede mezclarse con un fármaco e inyectarse por vía subcutánea o intramuscular con una aguja de calibre 25 como máximo.
SABER-bupivacaine (Posidur™), desarrollado por Durect Corporation, espera la aprobación de la FDA.
Consejos NYSORA
- SABER-bupivacaína consiste en un sistema de administración de SAIB que se mezcla con LA. Después de la infiltración, el sistema de administración se disuelve dentro de los tejidos.
Farmacología
El tipo y la cantidad de disolvente, la carga de fármaco y otros aditivos son posibles variables para personalizar la duración de la administración del fármaco. Las formulaciones de SABRE pueden transportar una carga útil de medicamentos de hasta el 30 %. Al inyectarse, el fármaco forma un depósito en el tejido subcutáneo y su liberación comienza de inmediato. El sistema de entrega se disuelve in situ, eliminando la necesidad de remoción. En un estudio que comparó diferentes dosis de SABER-bupivacaína (12 % de bupivacaína), la respuesta a la concentración de la dosis exhibió una farmacocinética lineal. Una amplia revisión de 11 ensayos clínicos con sujetos sanos y sujetos a diversos procedimientos quirúrgicos demostró una Tmax variada a las 24-48 horas (Tabla 1). Esto parece diferir con el procedimiento quirúrgico, ya que la Tmax con la administración después de la cirugía de hombro fue más corta en comparación con la cirugía abdominal. Esto posiblemente se deba a la rápida absorción del fármaco cuando se limita a un área quirúrgica más pequeña.
Evidencia clínica
En un ensayo controlado, aleatorizado, doble ciego de 2012 de 124 pacientes que recibieron reparación abierta de hernia, SABER-bupivacaína superó al placebo después de la administración en el sitio quirúrgico. Una dosis de 5 ml de SABER-bupivacaína (bupivacaína al 12 %) tuvo un área bajo la curva (AUC) significativamente más baja para la intensidad media del dolor de 1 a 72 horas, en comparación con el placebo (2.47 frente a 3.61; p = 0036). ). El grupo de 5 ml logró una reducción significativa del dolor con el movimiento y el consumo de opioides y aumentó el tiempo hasta el primer opioide en comparación con el placebo. En particular, la formulación de 2.5 ml de SABER-bupivacaína no alcanzó los mismos niveles de significación. Un estudio multicéntrico, aleatorizado, doble ciego de 2014 de 98 pacientes sometidos a cirugía abdominal mostró una disminución del dolor clínica y estadísticamente significativa durante 3 días en pacientes que recibieron SABER-bupivacaína.
Safety
Debido a evidencia incompleta de seguridad clínica, la FDA no aprobó la nueva solicitud de fármaco de SABER-bupivacaína en 2013. En 2012, Hadj et al. no informaron eventos adversos derivados de SABER-bupivacaína. La cicatrización de heridas se mantuvo sin cambios entre los grupos. Gan et al no pudieron identificar ninguna evidencia de toxicidad de bupivacaína a través de la evaluación de signos vitales, examen físico, resultados de laboratorio y monitoreo Holter.
Implante de bupivacaína-colágeno
Un implante a base de colágeno con LA que actualmente está a la espera de la prueba de fase 3 es un implante de bupivacaína-colágeno (XaraColl®). Este medicamento está siendo desarrollado por Innocoll Pharmaceuticals para su implantación en sitios de trauma quirúrgico para proporcionar analgesia posquirúrgica.
Formulación
XaraColl está compuesto por una matriz de colágeno biodegradable y totalmente reabsorbible que está impregnada de bupivacaína (Figura 4 y XNUMX). La matriz se implanta durante la cirugía y se supone que comienza a liberar LA inmediatamente.
Consejos NYSORA
- Un implante de bupivacaína-colágeno está compuesto por una matriz de colágeno que está impregnada con LA. Mientras se reabsorbe la matriz de colágeno, se libera LA.

FIGURA 4. Sistema de entrega del implante de bupivacaína-colágeno. (Usado con permiso del sitio web de Innocoll Inc.. Consultado en noviembre de 2015).
Farmacología
Los implantes de colágeno se han estudiado con concentraciones variables de bupivacaína. Con la reabsorción lenta de la matriz de colágeno, se produce la liberación controlada de LA. Se demostró que los niveles sistémicos de bupivacaína estaban muy por debajo del umbral de toxicidad con una Cmax media de 0.22 μg/mL (Tabla 1). Similar a la bupivacaína liposomal, este medicamento demostró un pico bifásico de mayor concentración. En un estudio realizado por Cusack, Tmax varió de 30 minutos a 20 horas, según el pico que predominara.
Evidencia clínica
Dos estudios independientes en hombres después de la reparación de una hernia inguinal unilateral indicaron un efecto significativo del tratamiento con implantes de bupivacaína y colágeno en comparación con el placebo. En un estudio, las puntuaciones de dolor se redujeron significativamente en pacientes tratados con implantes versus placebo a las 24 y 48 horas sin cambios significativos en el uso de opioides. En el segundo estudio, las puntuaciones de dolor no difirieron, pero el uso de opioides disminuyó significativamente en pacientes con implantes de bupivacaína y colágeno. El análisis combinado de estos estudios sugirió que el efecto de este tratamiento se prolongó durante las 72 horas posteriores a la operación.
Safety
Los eventos adversos más comunes después de la implantación de implantes de bupivacaína-colágeno fueron estreñimiento, náuseas y dolor de cabeza. Un estudio demostró enzimas hepáticas elevadas y niveles anormales de fósforo después de la implantación, aunque ninguno de estos fue clínicamente significativo y se resolvió espontáneamente. Se encontraron alteraciones visuales que posiblemente indicaban toxicidad por bupivacaína en un paciente, pero el muestreo de suero mostró una baja concentración sistémica de bupivacaína. Los ensayos de fase 3 muestran una disminución estadísticamente significativa en las puntuaciones de dolor 48 horas después de la operación en la reparación de hernia inguinal en comparación con el placebo.
RESUMEN
La práctica clínica necesita una mayor duración de la analgesia y evitar los catéteres permanentes ineficientes en el tiempo y más complejos desde el punto de vista del procedimiento ha estimulado el interés en los AL de liberación controlada. Cada tecnología hasta la fecha tiene compromisos inherentes. La evidencia hasta la fecha sugiere una clara utilidad para los LA de liberación prolongada de inyección única, pero un papel continuo para la administración de LA por catéter y bomba permanente. Actualmente, el único medicamento de esta clase con aprobación de la FDA es la bupivacaína liposomal, que está aprobada para la infiltración de heridas. La búsqueda de nuevas indicaciones ha inspirado la investigación en múltiples modalidades. De particular interés para la anestesia regional y la medicina del dolor agudo es su uso potencial en BNP y anestesia epidural. La aprobación de la FDA para su uso en estas áreas tiene el potencial de afectar positivamente la práctica de la anestesia regional y la calidad del manejo del dolor posoperatorio. Es probable que los AL de liberación controlada se conviertan en una parte inherente importante de un régimen de analgesia multimodal. Los LA de liberación controlada, junto con otros analgésicos, pueden reducir aún más la dependencia de los opiáceos como analgesia posoperatoria principal, de acuerdo con todas las guías publicadas actuales sobre el dolor agudo.
Referencias
- Samad A, et al: Sistemas de administración de fármacos liposomales: una revisión actualizada. Curr Drug Deliv 2007;4(4):297–305.
- Minkowitz HS, Singla NK, Evashenko MA, et al: Farmacocinética de tabletas sublinguales de sufentanilo y eficacia y seguridad en el manejo del dolor posoperatorio. Reg Anesth Pain Med 2013;38:131–139.
- Volltexte, et al: Ciclodextrinas como molécula transportadora de fármacos: una revisión. Sci Pharm 2008;76:567–598.
- Kulkarni PR, et al: liposomas: un nuevo sistema de administración de fármacos. Int J Curr Pharm Res 2011;3(2):10–18.
- Formulario: Bupivacaína liposomal: anestésico local de acción prolongada para la analgesia posquirúrgica.
- Lambert WJ: Liposomas multivesiculares DepoFoam para la liberación sostenida de macromoléculas. En Rathbone MJ, Hadgraft J, Roberts MS, Lane ME (eds): Modified Release Drug Delivery Technology, 2.ª ed. Informa Healthcare, 2008:207–214.
- Angst MS, Drover DR: Farmacología de fármacos formulados con Depo-foam: un sistema de administración sostenida de fármacos para administración parenteral utilizando tecnología de liposomas multivesiculares. Clin Pharmacokinet 2006;45(12):1153–1176.
- Howell SB: aplicaciones clínicas de un nuevo sistema de administración de fármacos inyectables de liberación sostenida: tecnología Depofoam. Cáncer J 2001;7 (3): 219–227.
- Bala I, et al: Nanopartículas de PLGA en la administración de fármacos: el estado del arte. Crit Rev Ther Drug Carrier Syst 2004;21(5):387–422.
- Danhier F, et al: Nanopartículas basadas en PLGA: una descripción general de las aplicaciones biomédicas. J Control Release 2012;161(2):505–522.
- Pathak P, Nagarsenker M: Formulación y evaluación de nanosistemas de lípidos de lidocaína para administración dérmica. AAPS PharmSciTech 2009;10(3): 985–992.
- Mundargi RC, et al: Tecnologías nano/micro para administrar terapias macromoleculares utilizando poli (D, L-lactida-co-glicolida) y sus derivados. J Control Release 2008;125(3):193–209.
- Marcaine (Bupivacaine HCl) [información de prescripción de EE. UU.]. Hospira Inc., 2009.
- ISMP: ISMP pide mejoras de seguridad en el uso de bombas elastoméricas para el alivio del dolor. Instituto para Prácticas de Medicamentos Seguros, 2009.
- Richard BM, et al: Evaluación de seguridad de EXPAREL (DepoFoam Bupivacaine) administrado por inyección subcutánea repetida en conejos y perros: Comparación de especies. J Drug Deliv 2011;2011:467429.
- Richard BM, Ott, LR, et al: Evaluación de seguridad y tolerabilidad de la bupivacaína DepoFoam administrada mediante infiltración de heridas por incisión en conejos y perros. Expert Opin Investig Drugs 2011;20(10):1327–1341.
- Langford RM, et al: Una sola administración intraoperatoria de depobupivacaína produce bupivacaína plasmática detectable prolongada y analgesia en pacientes sometidos a reparación de hernia inguinal. Presentado en la 62ª Asamblea de Postgrado en Anestesiología, 12 al 16 de diciembre de 2008, Nueva York, Afiche 9088.
- Exparel (suspensión inyectable de liberación prolongada de liposomas de bupivacaína) [información de prescripción]. Pacira Pharmaceuticals Inc., 2011.
- Ensayo clínico n.º SKY0402-C-110. Un estudio abierto de fase I para evaluar la farmacocinética y la seguridad de SKY0402 en sujetos con insuficiencia hepática. Pacira Pharmaceuticals Inc. (fecha en archivo).
- 20. Hadzic A, Abikhaled JA, Harmon WJ: Impacto de la expansión de volumen en la eficacia y farmacocinética de la bupivacaína liposómica. Registro local Anesth 2015;8:105–111.
- Gorfine SR, et al: Inyección de liposomas de liberación prolongada de bupivacaína para la analgesia posquirúrgica prolongada en pacientes sometidos a hemorroidectomía: un ensayo multicéntrico, aleatorizado, doble ciego, controlado con placebo. Dis Colon Rectum 2011;54(12)1552–1559.
- Onel E, et al: Exparel, un analgésico local de bupivacaína liposomal, prolonga el alivio del dolor y disminuye el uso de opioides. Presentado en la Reunión Anual de la Sociedad Estadounidense de Anestesiólogos, del 16 al 20 de octubre de 2010, San Diego, CA.
- Golf M, et al: Un ensayo de fase 3, aleatorizado, controlado con placebo de bupivacaína DepoFoam® (analgésico local de bupivacaína de liberación prolongada) en bunionectomía. Adv Ther 2011;28(9):776–788.
- Ensayo clínico n. CIELO0402-C-210. Un estudio aleatorizado, doble ciego, de control activo para evaluar la seguridad y la eficacia de una sola administración local de SKY0402 para la analgesia posoperatoria prolongada en pacientes que se someten a una mamoplastia de aumento. Pacira Pharmaceuticals Inc. (fecha en archivo)
- Butz DR, Shenaq DS, Rundell VL, et al: El dolor posoperatorio y la duración de la estancia se redujeron mediante el uso de Exparel en la reconstrucción mamaria inmediata basada en implantes. Plast Reconstr Surg Glob Open 2015;3(5):e391.
- Bagsby DT, Ireland PH, Meneghini RM: bupivacaína liposomal versus inyección periarticular tradicional para el control del dolor después de una artroplastia total de rodilla. J Artroplastia 2014;29(8):1687–1690.
- Alijanipour et al: La inyección periarticular de bupivacaína liposomal no ofrece ningún beneficio sobre la inyección estándar de bupivacaína en la artroplastia total de rodilla: un ensayo prospectivo, aleatorizado y controlado. Presentado en la Reunión Anual 2016 de la Academia Estadounidense de Cirujanos Ortopédicos, 1 de marzo de 2016. Orlando, FL.
- Surdam JW, et al: El uso de Exparel (bupivacaína liposomal) para controlar el dolor posoperatorio en pacientes con artroplastia total de rodilla unilateral. J Artroplastia 2015;30:325–329.
- Viscusi ER: La seguridad de la bupivacaína liposomada 2 años después del lanzamiento: una mirada hacia atrás y hacia adelante. Expert Opin Drug Saf 2015;14(12): 1801–1803.
- Ilfeld BM, Viscusi ER, Hadzic A, et al: Perfil de seguridad y efectos secundarios de la liposoma bupivacaína (Exparel) en bloqueos de nervios periféricos. Reg Anesth Pain Med 2015;40(5):572–582.
- McAlvin JB, et al: Bupivacaína liposomal multivesicular en el nervio ciático. Biomateriales 2014;35:4557–4564.
- Damjanovska M, Cvetko E, Hadzic A, et al: Neurotoxicidad de la inyección perineural vs intraneural-extrafascicular de bupivacaína liposomal en el modelo porcino de bloqueo del nervio ciático. Anestesia 2015;70(12): 1418–1426.
- Ilfeld BM, et al: bupivacaína liposomal como bloqueo nervioso periférico de una sola inyección: un estudio de dosis-respuesta. Anesth Analg 2013;117:1248–1256.
- Ilfeld BM, et al: Perfil de seguridad y efectos secundarios de la bupivacaína liposómica (Exparel) en bloqueos de nervios periféricos. Reg Anesth Pain Med 2015;40: 572–582.
- Ilfeld BM, et al: ¿Un bloqueo de nervio periférico de 4 días? Liposoma bupivacaína: una introducción y actualización. Boletín ASA 2014;78(8).
- Viscusi ER, Candiotti KA, Onel E, Morren M, Ludbrook GL: Farmacocinética y farmacodinámica de la liposoma bupivacaína administrada mediante una única inyección epidural a voluntarios sanos. Reg Anesth Pain Med 2012;37(6):616–622.
- Hadj A, et al: Seguridad y eficacia del anestésico local de bupivacaína de liberación prolongada en la hernia abierta: un ensayo controlado aleatorio. ANZ J Surg 2012;82:251-257.
- Sekar M, et al: Administración de fármacos de productos biológicos: una estrategia de liberación controlada. Presentado en la 17.ª Conferencia Anual TIDES de IBC, del 3 al 6 de mayo de 2015, San Diego, CA.
- Shah J, et al: El perfil farmacocinético de SABER-bupivacaína en humanos a través de modelos quirúrgicos demuestra una administración sostenida del fármaco durante 72 horas. Presentado en la Reunión Anual 2014 de la Sociedad Estadounidense de Anestesiólogos, 15 de octubre de 2014, Nueva Orleans, LA.
- Gan T, et al: SABER-bupivacaína redujo la intensidad del dolor durante 72 horas después de la cirugía abdominal en relación con el clorhidrato de bupivacaína. Presentado en la Reunión Anual 2014 de la Sociedad Estadounidense de Anestesiólogos, 15 de octubre de 2014, Nueva Orleans, LA.
- Cusack SL, et al: Evaluación clínica de XaraColl, un implante de bupivacaína y colágeno, para la analgesia posoperatoria en dos estudios piloto multicéntricos, aleatorizados, doble ciego, controlados con placebo. J Pain Res 2012;5: 217–225.
- Cusack SL, et al: Farmacocinética y seguridad de un implante intraoperatorio de bupivacaína y colágeno (XaraColl®) para la analgesia posoperatoria en mujeres después de una histerectomía abdominal total. J Pain Res 2013;6: 151–159.
- Hu D, et al: perfil farmacocinético de la inyección de bupivacaína en liposomas después de una sola administración en el sitio quirúrgico. Clin Drug Investig 2013;33:109–115.
- Ensayo clínico NCT02523599. Estudio de fase 3, aleatorizado, doble ciego, controlado con placebo para investigar la eficacia y la seguridad del implante de bupivacaína Xaracoll® (300 mg de clorhidrato de bupivacaína) después de una hernioplastia por laparotomía abierta. Inocoll. (fecha en archivo)