Johan Raeder y Ulrich J. Spreng
INTRODUCCIÓN
La infiltración o instilación de anestésicos locales alrededor y dentro de la articulación como complemento analgésico para el dolor postoperatorio de la cirugía articular se ha utilizado durante décadas. Sin embargo, ha habido un interés renovado en la analgesia por infiltración local (LIA), en parte debido al trabajo de Kerr y Kohan en 2008, quienes demostraron una analgesia superior después de la artroplastia total de rodilla o cadera con infiltración extendida y diluida de anestesia local con epinefrina y ketorolaco. inyecciones añadidas y repetidas a través de catéteres intraarticulares. El interés en usar LIA en la cirugía de rodilla y cadera también puede deberse a la falta de alternativas de anestesia regional más simples que existen para otras articulaciones. Por ejemplo, la analgesia después de una cirugía de hombro y extremidades superiores se puede lograr con un simple bloqueo de una sola inyección del plexo braquial, mientras que la analgesia para las articulaciones de la cadera y la rodilla requiere bloqueos nerviosos múltiples y técnicamente más desafiantes. Además, mientras que la debilidad motora es común con los bloqueos nerviosos, la analgesia por infiltración generalmente respeta la función motora.
EL CONCEPTO DE INFILTRACIÓN LOCAL
ANALGESIA
Hay tres componentes básicos del concepto LIA: alto volumen de anestésico local diluido de acción prolongada; adyuvantes anestésicos no locales; e inyecciones en bolo del catéter (recargas) durante 1 a 3 días.
Alto volumen de acción prolongada diluida
Fármaco anestésico
Un problema con la infiltración de anestésicos locales para cirugía mayor es que se deben infiltrar muchas estructuras y capas diferentes. Al hacerlo, se requiere un cierto volumen mínimo de anestésico local para una infiltración local efectiva para cubrir todas las estructuras relevantes. Con concentraciones convencionales de soluciones anestésicas locales, tales volúmenes elevados conllevan un riesgo inaceptable de toxicidad sistémica (ver Toxicidad Sistémica de Anestésicos Locales). Sin embargo, la anestesia de las pequeñas terminaciones nerviosas dentro y alrededor de las articulaciones no requiere anestesia local de alta concentración. Por lo tanto, la concentración de anestésico local puede reducirse y aumentarse el volumen, manteniendo la dosis total dentro de límites seguros. Además, como las articulaciones principales están desprovistas de vasos sanguíneos principales, el riesgo de inyección involuntaria de un bolo grande directamente en la circulación es pequeño.
Adyuvantes anestésicos no locales
Dado que las inyecciones cuidadosas de anestésico local se realizan cerca del sitio de la lesión quirúrgica, existe la posibilidad de apuntar a la fuente del dolor causado por la inflamación local y el dolor para proporcionar un tratamiento eficaz cerca del origen del dolor. Esta es una alternativa al enfoque sistémico de la analgesia mediante el cual se necesita una dosis total potencialmente más alta de fármaco y conlleva un mayor potencial de efectos secundarios generales. Se han utilizado adyuvantes anestésicos no locales, como agentes antiinflamatorios, fármacos antiinflamatorios no esteroideos (AINE, inhibidores tradicionales o de la ciclooxigenasa [COX] 2) y esteroides, así como opioides y ketamina. Sin embargo, no se ha estudiado bien el papel de la epinefrina o la clonidina en la mezcla de LIA. Si bien ambos fármacos tienen un efecto analgésico sobre los receptores espinales α2 cuando se administran por vía epidural o espinal, no hay documentación sobre ningún efecto analgésico específico o mecanismo objetivo de estos fármacos cuando se usan por vía periférica. La epinefrina a menudo se incluye empíricamente "por si acaso" debido al potencial de prolongar el efecto de otras drogas localmente activas ya que su eliminación del sitio local se retrasa debido a la vasoconstricción inducida por la epinefrina.
Recargas de catéteres de 1 a 3 días
Los anestésicos locales de acción prolongada utilizados para la infiltración, las inyecciones perioperatorias y la infiltración tienen una duración limitada y desaparecen unas pocas horas después de la inyección. Debido a que la inyección repetida del anestésico local es dolorosa o inconveniente, un enfoque es dejar uno o más catéteres en la herida o articulación para proporcionar el vehículo para bolos o infusión continua de anestésicos locales. Sin embargo, el uso de catéteres en un entorno de reemplazo articular importante es controvertido debido al potencial de infección. El uso rutinario del catéter también se ve desafiado en los Estados Unidos por el desarrollo reciente y la aprobación de la FDA de la bupivacaína de depósito de acción prolongada (bupivacaína liposomal), aunque el papel y el potencial de este fármaco en el concepto de LIA requieren un mayor escrutinio.
INFORMACIÓN BASADA EN EVIDENCIA SOBRE LA EFICACIA Y LA SEGURIDAD DE LA ANALGESIA POR INFILTRACIÓN LOCAL
Como suele ser el caso con los nuevos métodos y técnicas, el entusiasmo inicial por LIA expresado en prácticas clínicas, reuniones profesionales e informes de casos,1 espera un escrutinio basado en evidencia antes de que se puedan hacer recomendaciones para el uso clínico diario. Las siguientes son preguntas importantes que necesitan escrutinio:
1. ¿Es el método suficientemente eficaz?
2.¿Qué componentes del nuevo método son eficientes?
3.¿Cómo se compara LIA con otros métodos comunes en términos de seguridad, calidad y costo?
Si se prueba un nuevo método como componente de un régimen multimodal y muestra superioridad frente a los controles, es posible que tengamos la respuesta a la primera pregunta, pero las preguntas 2 y 3 siguen sin respuesta. Los siguientes pasos lógicos son poner a prueba cada componente individualmente (manteniendo el resto sin cambios y estandarizados) en condiciones controladas y estandarizadas para dilucidar qué componentes del protocolo multimodal son realmente beneficiosos. La LIA debe compararse con las mejores alternativas potenciales utilizadas en condiciones óptimas: opioide intratecal, analgesia epidural, bloqueo del nervio femoral, otros bloqueos nerviosos o simplemente analgesia multimodal óptima, incluida la infiltración de la herida con anestesia local. Sabemos que la infiltración de anestésicos locales confiere analgesia después de la cirugía de reemplazo de rodilla, suponiendo que el anestésico local se infiltre hábilmente en todos los tejidos relevantes. En un estudio de reparación de hernias con analgesia por infiltración de bupivacaína, Aasboe et al. mostraron un mejor alivio del dolor hasta 1 semana después del procedimiento. Aún así, tales resultados son, hasta cierto punto, específicos del procedimiento y no son reproducidos con LIA por otros. En el estudio de Andersen et al sobre artroplastia de rodilla, la infiltración preoperatoria de ropivacaína fue superior al placebo a las 6 horas pero no a las 24 horas. El éxito de la LIA puede depender de cuán extensa se realice la técnica de infiltración local en términos de incluir todas las estructuras relevantes, no solo las capas superficiales de la herida. Con todos los conceptos nuevos, se debe encontrar un equilibrio entre incorporar rápidamente los beneficios en la práctica diaria y esperar la documentación objetiva de estudios de calidad. Los estudios realizados hasta ahora sobre la eficacia de LIA no tienen el poder, la estandarización o la calidad para proporcionar una respuesta clara o incluso proporcionar datos agrupados de calidad para metanálisis.
Una de las razones de la escasez de pruebas es que los estudios aleatorizados y ciegos que incorporan LIA son algo difíciles de diseñar porque todas las inyecciones, los catéteres y la recarga también deben realizarse en el grupo de placebo. Incluso entonces, dicho grupo de placebo no sería relevante porque en la práctica clínica no se producirían inyecciones de solución salina en las estructuras de la herida y los catéteres y, sin embargo, las inyecciones de solución salina solas pueden tener beneficios analgésicos. Esto se debe a que la infiltración de solución salina en la articulación de la rodilla tiene un efecto analgésico, posiblemente por enfriamiento y dilución de proteínas locales inflamatorias, o por placebo. Como hay muchos factores de confusión, los estudios ideales sobre la eficacia de LIA deberían abordar solo uno o unos pocos elementos específicos a la vez, controlando o estandarizando los demás. Dichos elementos específicos incluyen un tipo específico de cirugía, controles sistémicos para todos los fármacos activos en la mezcla de LIA e infusiones simuladas o de placebo o complementos cuando se prueba la LIA posoperatoria. Los efectos analgésicos de ketorolaco y ropivacaína cuando se administran sistémicamente son bien conocidos. Asimismo, la administración intraarticular también dará como resultado absorción sistémica y efectos sistémicos. Debe recordarse que es posible que la LIA nunca esté bien estandarizada como una dosis definida de un solo fármaco intravenoso o un bloqueo nervioso específico por varias razones.
Primero, los diferentes tipos de cirugía y articulaciones varían en composición anatómica, aceptabilidad y diseminación de LIA y grado de dolor posoperatorio. En segundo lugar, las diferencias en las técnicas de infiltración pueden influir en los beneficios analgésicos. La impresión clínica sugiere que la inyección matutina del día después de la cirugía parece tener un efecto analgésico en pacientes con dolor, aunque esto no se demostró de manera convincente en estudios controlados. Esto puede deberse a que los pacientes de control en los estudios generalmente reciben una inyección de placebo y, a menudo, tienen un dolor de bajo a moderado y, por lo tanto, no tienen mucho potencial o poder estadístico para mostrar mejoras para todo el grupo. Dos aspectos adicionales de la interpretación clínica de los estudios son importantes: si el grupo de control recibe un régimen analgésico multimodal efectivo que resulta en puntuaciones de dolor bajas, se hace difícil demostrar los beneficios adicionales de un nuevo método. Sin embargo, si un nuevo método es igualmente efectivo pero no mejor, no significa que el nuevo método no tenga valor. Por el contrario, esto simplemente proporciona una opción de dos métodos diferentes con diferencias en el perfil de efectos secundarios, riesgos y aspectos prácticos y económicos. Los beneficios de LIA pueden estar en varios aspectos de la atención de enfermería, menor necesidad de cumplimiento por parte del paciente, menor dosis total de AINE, menor necesidad de opioides, menor necesidad de gabapentinoides y sus posibles efectos secundarios, etc. Aún así, el número de pacientes en muchos estudios es demasiado bajo para abordar las cuestiones de seguridad y efectos secundarios menos frecuentes. Los estudios deben examinar cuidadosamente los efectos secundarios graves, pero raros, así como también cómo utilizar LIA como una herramienta para mejorar la rehabilitación, acortar la estancia hospitalaria y lograr un mejor resultado funcional.
¿Cuáles son las alternativas a la LIA para la artroplastia de rodilla o cadera? En términos del alivio del dolor "más efectivo", es difícil mejorar la analgesia epidural. Sin embargo, la analgesia epidural no proporciona ningún beneficio analgésico más allá del período de uso activo. Además, durante el tratamiento analgésico, la técnica demanda recursos y perjudica la movilización y la fisioterapia. También existen riesgos de retención urinaria, hipotensión y hematoma epidural. El bloqueo del nervio femoral para la artroplastia de rodilla brinda un tratamiento más específico, pero no cubre todos los nervios involucrados en la inervación de la rodilla y produce debilidad del músculo cuádriceps.
Al igual que con el bloqueo epidural, esta técnica puede estar asociada con daño nervioso muy raro pero grave. En un estudio reciente que comparó la LIA y el bloqueo femoral para la artroplastia de rodilla, Affas et al mostraron menos dolor con la actividad con LIA a las 24 horas y una ventaja en términos de facilidad de ejecución y menores costos. Otros bloqueos nerviosos pueden proporcionar un alivio del dolor de una sola rodilla más enfocado sin bloqueo motor, como un bloqueo del canal aductor de los nervios safeno y obturador. El opioide intratecal, como se usa en el estudio de Essving et al., también puede ser beneficioso. La morfina parece ser la mejor droga en términos de efecto prolongado después de una sola inyección. Sin embargo, una dosis superior a 0.1 mg puede en algunos casos prolongar el efecto, pero con un mayor riesgo de efectos secundarios. La recomendación experta, basada en evidencia y específica del procedimiento para la artroplastia de rodilla (ver http://www.postoppain.org/image.aspx?imgid=654) es la combinación de anestesia espinal sin opioides o anestesia general con bloqueo femoral como la primera opción para la anestesia. Cualquiera de los dos debe complementarse con paracetamol más AINE más un opioide para el dolor irruptivo. La recomendación de evitar la morfina intratecal se basó en las náuseas en un estudio con una dosis de morfina de 0.25 mg y puede no ser relevante con la dosis de 0.1 mg utilizada por Essving et al. Aunque algunos lo usan, no hay datos convincentes de que los esteroides o el gabapentinoide confieran beneficios analgésicos adicionales.
PROS Y CONTRAS POTENCIALES Y DOCUMENTADOS DE LA ANALGÉSICA POR INFILTRACIÓN LOCAL Y ALTERNATIVAS
Para Agencias y Operadores
Un beneficio importante de LIA es la falta de deterioro motor que a menudo se observa con técnicas alternativas de bloqueos nerviosos, como bloqueos de nervios femorales o ciáticos, o analgesia epidural. Con LIA, también existe un riesgo menor de formación de hematoma, que es una complicación temida de los bloqueos profundos, como el bloqueo lumbar o la analgesia epidural. Además, LIA no está contraindicado en casos de aumento del riesgo de sangrado por otras causas, como la anticoagulación terapéutica, la inhibición plaquetaria o incluso el uso de AINE tradicionales o ácido acetilsalicílico en dosis bajas. Otro argumento a favor de LIA es su simplicidad; la infiltración la puede realizar el cirujano intraoperatoriamente o los anestesistas mediante ecografía. Una enfermera en la sala puede realizar fácilmente las recargas postoperatorias de uno o más catéteres.
Desventajas
Algunas de las desventajas específicas de LIA tienen que ver con los peligros potenciales de suministrar una droga potente cerca de estructuras articulares delicadas. El anestésico local puede ser neurotóxico para los nervios pequeños cuando se administra repetidamente, aunque se ha demostrado que la ropivacaína diluida es segura durante 2 a 3 días de infusión continua. Una preocupación más seria puede ser el efecto condrotóxico, especialmente con bupivacaína. Debido a que en la mayoría de las cirugías de reemplazo de cadera y rodilla, el cartílago se extrae como parte del procedimiento, esta consideración puede no ser una preocupación práctica. La adición de AINE, inhibidores de la COX-2 o glucocorticoides puede retrasar o afectar la cicatrización o el crecimiento de los tejidos, aunque aún no se ha demostrado un impacto práctico en estudios clínicos en humanos en pacientes que se sometieron a un reemplazo de cadera o rodilla. Se ha expresado una preocupación con respecto a la posibilidad de un mayor riesgo de infección con LIA. Esta preocupación surge principalmente del uso posoperatorio de un catéter con el riesgo de contaminación por múltiples inyecciones, así como la migración de bacterias a lo largo del catéter permanente, más que por la infiltración estéril realizada durante la cirugía. También se teoriza que la epinefrina puede impedir la circulación, la oxigenación y la función de los macrófagos. Para minimizar el riesgo de infección, es importante utilizar procedimientos asépticos estrictos para todas las recargas y recargas de infusiones.
ANALGESIA POR INFILTRACIÓN LOCAL PARA ARTROPLASTIA DE CADERA
Kehlet et al revisaron seis estudios disponibles en 2011, mientras que McCarthy e Iohom ampliaron la revisión al incluir estudios adicionales adicionales. Desde entonces, también se han publicado los dos estudios de Rikalainen-Salimi y Murphy et al. Los primeros estudios de Kerr y Kohan et al y Otte et al informaron analgesia favorable y movilización rápida con LIA; sin embargo, no hubo grupos de control. En los estudios de Parvataneni et al y Busch et al, se comparó la LIA con la analgesia con opiáceos intravenosos. Ambos estudios informaron puntuaciones de dolor más bajas con LIA; el estudio de Parvataneni et al redujo la estancia hospitalaria en 1 día con LIA. Cuatro estudios compararon LIA versus placebo.
El primer ensayo controlado con placebo de Bianconi et al de 2003 usó solo 40 ml de 5 mg/ml de ropivacaína para la infiltración, pero la infusión de 10 mg/h continuó durante 35 horas. El grupo LIA tuvo puntajes de dolor más bajos en reposo y durante la movilización hasta 72 horas después de la operación y una menor necesidad de opioides. El estudio de Andersson et al usó infiltración, seguida de bolo al día siguiente, y demostró menos dolor y consumo de opiáceos desde las 4 horas posteriores a la operación hasta las 2 semanas, mientras que la función articular mejoró en 1 semana. Murphy et al compararon la infiltración con 60 mL de levobupivacaína 2.5 mg/mL versus placebo. El consumo de morfina se redujo en un 4% en el grupo LIA durante las primeras 12 horas, pero la calidad de la analgesia y los efectos secundarios fueron similares. En el estudio controlado con placebo de Lunn et al, el grupo de placebo recibió un régimen analgésico multimodal óptimo de paracetamol, elecoxib y gabapentina con los mismos resultados que en el grupo de LIA. Andersen et al compararon LIA con inyecciones complementarias con analgesia epidural y encontraron menos consumo de opioides, mejor movilización y estancia hospitalaria más corta con LIA. Specht et al encontraron que un bolo de refuerzo a las 10 y 22 horas no fue mejor que el placebo en pacientes que recibieron LIA perioperatoria. Rikalainen-Salmi et al. compararon la LIA con un complemento por la mañana después de la cirugía con 0.1 mg de morfina administrados como parte del anestésico espinal. La técnica LIA resultó en un menor consumo de opioides el día de la cirugía y una mejor movilización temprana, sin diferencias en las puntuaciones de dolor y satisfacción del paciente; sin embargo, la recarga del LIA no confería ningún beneficio. En conjunto, LIA parece ser mejor que el placebo para la cirugía de reemplazo de cadera, mientras que en comparación con otros métodos optimizados, los resultados son mixtos. No se ha estudiado adecuadamente en la cirugía de cadera si los adjuntos en las soluciones LIA tienen un efecto local específico en comparación con la administración sistémica.
ANALGESIA POR INFILTRACIÓN LOCAL PARA ARTROPLASTIA DE RODILLA
En la literatura reciente se ha descrito una amplia gama de técnicas LIA para la artroplastia total de rodilla. En estudios anteriores, el volumen de la mezcla de anestésicos locales y adyuvantes utilizados fue inferior a 50 mL. En el estudio de Kerr y Kohan, una mezcla de ropivacaína (2 mg/mL, máximo 300 mg), ketorolaco (30 mg) y epinefrina (10 μg/mL) se diluyó con solución salina hasta un volumen de 150 a 170 mL. La mezcla se inyectó en las diferentes estructuras de la rodilla durante la artroplastia de rodilla en tres etapas: después de la preparación de las superficies óseas (30–50 mL), después de la inserción de los componentes de la prótesis (35–50 mL) y en el tejido subcutáneo (25–50 mL). ml). Al final de la cirugía, se insertó un catéter epidural de calibre 18 con la punta del catéter colocada anterior a la cápsula posterior y se inyectaron 10-15 ml de la mezcla. Este catéter se usó para una inyección adicional 15 a 20 horas después de la operación, cuando se inyectaron otros 50 ml de la mezcla a través del catéter.
Hasta donde sabemos, los primeros estudios aleatorizados sobre la inyección de fármacos multimodal intra o periarticular de gran volumen en la artroplastia total de rodilla fueron publicados por Busch et al y Vendittoli et al. Recientemente se han publicado varias revisiones sobre la LIA después de la artroplastia total de rodilla. La revisión más reciente de Gibbs et al. incluyó un total de 29 estudios aleatorizados. Sin embargo, este número en la revisión de Gibbs y colegas también incluyó algunos estudios de infiltración local en los que se usaron volúmenes bajos de LIA (<100 ml). La mayoría de los estudios individuales carecían de un cegamiento adecuado. Sin embargo, al comparar diferentes modalidades de tratamiento (p. ej., LIA versus analgesia epidural), un ensayo adecuado requeriría procedimientos invasivos en el grupo de placebo, lo que puede ser poco ético y, por lo tanto, difícil de ejecutar. Andersen y sus colegas realizaron un estudio doble ciego controlado con placebo en pacientes que se sometieron a una artroplastia total de rodilla bilateral y demostraron la eficacia de la técnica LIA. Sin embargo, según la información actual, la eficacia de una dosis posoperatoria de refuerzo es cuestionable y puede conllevar un riesgo de infección. Independientemente, varios autores informaron que las inyecciones de refuerzo posoperatorio se asocian con un menor consumo de opioides y puntuaciones de dolor más bajas. Hasta la fecha, ningún estudio informó una mayor incidencia de infecciones posoperatorias con catéteres LIA.
Consejos NYSORA
¿El LIA tiene un beneficio clínico suficiente para justificar el uso clínico de rutina?
A. Cirugía de reemplazo de cadera
La LIA no es mejor que la anestesia raquídea preoperatoria seguida de analgesia multimodal con paracetamol + AINE/inhibidor de la COX-2 + glucocorticoide o gabapentinoide.
En pacientes en los que está contraindicada la terapia multimodal, la LIA puede ser un método analgésico valioso, reduciendo la necesidad de opiáceos de rescate.
B. Cirugía de reemplazo de rodilla
Sí, incluso con un bloqueo espinal preoperatorio óptimo (u otros bloqueos nerviosos) y analgesia multimodal sistémica de tres componentes, el LIA preoperatorio aún proporciona analgesia adicional durante 24 a 48 horas.
En comparación con la ausencia de inyecciones o las inyecciones de solución salina, todos los estudios demostraron que LIA tenía un efecto analgésico beneficioso. Sin embargo, los dos estudios que compararon la LIA con el bloqueo del nervio femoral mostraron resultados contradictorios. Si bien Toftdahl y sus colegas concluyeron que la LIA fue superior a un bloqueo continuo del nervio femoral con respecto al consumo de opiáceos y las puntuaciones de dolor durante el primer día posoperatorio, Carli y colaboradores sugirieron que el nervio femoral es mejor. Es de destacar que los pacientes del estudio de Carli et al recibieron una infiltración con ropivacaína, ketorolaco y epinefrina en la cápsula posterior de la articulación de la rodilla durante la cirugía (además de LIA o bloqueo del nervio femoral). Ambos estudios compararon LIA con analgesia epidural (Tabla 1) demostraron que LIA puede reducir tanto el consumo de opioides postoperatorios como las puntuaciones de dolor postoperatorio.
TABLA 1. Comparación de la analgesia por infiltración local con otras técnicas.
| Autor (Referencia Número) | Pacientes (norte) | Grupos Intraoperatorio | Tratamiento Intraoperatorio | Grupos Postoperatorio | Tratamiento Postoperatorio | Hallazgos de LIA |
|---|---|---|---|---|---|---|
| 1. Estudios que comparan LIA con no inyecciones o inyecciones de solución salina | ||||||
| Busch y otros (2006) 37 | 64 | LIA (100 ml) Ninguna inyección | 400 mg de ropivacaína 30 mg de ketorolaco 5 mg de epimorfina 0.6 mg de epinefrina | Todos los pacientes | Sin inyecciones en la rodilla. Morfina PCA | Consumo de opioides ↓ (0–24 horas) Dolor ↓ (0-4 h) |
| Vendittoli et al. (2006) 38 | 42 | LIA (160 ml) Ninguna inyección | 275 mg de ropivacaína 30 mg de ketorolaco 0.5 mg de epinefrina | LIA (15 ml) Ninguna inyección | 150 mg de ropivacaína a las 16-24 h | Consumo de opioides ↓ (0–48 horas) Dolor ↓ (0-48 h) |
| Andersen et al. (2008) 8 | 12 (24 rodillas) | LIA (170 ml) Control | 340 mg de ropivacaína 1.7 mg de epinefrina Solución salina (170 ml) | LIA Control | 8 h: ropivacaína 40 mg + 0.2 mg epinefrina (20 ml) 24 h: ropivacaína 100 mg + 0.5 mg epinefrina (50 ml) 8 h + 24 h: solución salina (20 + 50 mL) | Dolor ↓ (0-24 h) |
| kazak y otros (2010) 45 | 60 | LIA (150 ml) LIA (150 ml) Control | 200 mg bupivacaína 0.5 mg epinefrina 200 mg de levobupivacaína 0.5 mg de epinefrina Solución salina (150 ml) | LIA (25 ml) LIA (25 ml) Control | 10 h + 22 h: 120 mg bupivacaína 10 h + 22 h: 120 mg de levobupivacaína + 0.5 mg de epinefrina 10 h + 22 h: solución salina (25 mL + 25 mL) | Consumo de opioides ↓ (0–48 horas) Dolor ↓ (0-48 h) |
| Essving et al. (2010) 43 | 48 | LIA (166 ml) Ninguna inyección | 400 mg de ropivacaína 30 mg de ketorolaco 0.5 mg de epinefrina | LIA (22 ml) Control | 21 h: ropivacaína 200 mg + 30 mg ketorolaco + 0.1 mg de epinefrina 21 h: solución salina (22 mL) | Consumo de opioides ↓ (0–48 horas) Dolor ↓ (0-27 h) |
| 2. Estudios que comparan LIA con bloqueo del nervio femoral | ||||||
| Carli y otros (2010)46 | 40 | LIA (102 ml) → peri y intraarticularmente FNB (8 ml) Todos los pacientes: → Infiltración postoperatorio cápsula (51 ml) | 200 mg de ropivacaína 30 mg de ketorolaco 0.5 mg de epinefrina + 8 ml de solución salina en catéter femoral 16 mg de ropivacaína + 100 mL solución salina en periarticular catéter 100 mg de ropivacaína 15 mg de ketorolaco 0.25 mg de epinefrina | LIA (50) ml FNB | 24 h: ropivacaína 250 mg + 30 mg ketorolaco + 0.25 mg de epinefrina + 8 ml/h de solución salina a través de la femoral catéter durante 48 h Ropivacaína 2 mg/mL 8mL/h para 48 h + 50 mL de solución salina en periarticular catéter 24 h después de la cirugía | Consumo de opioides ↑ (0–48 h) para LIA grupo (peri y intra-articular infiltraciones) |
| Toftdahl y otros (2007)44 | 77 | LIA (152 ml) FNB (20 ml) | 300 mg de ropivacaína 30 mg de ketorolaco 0.5 mg de epinefrina 200 mg de ropivacaína 4 mg de morfina + 50 mg de bupivacaína por drenaje (intraarticular) | LIA (22 ml) FNB | 12 h + 24 h: 200 mg ropivacaína + 30 mg ketorolaco + 0.5 mg epinefrina Ropivacaína 2 mg/mL a 10 mL/h por 48 h | Consumo de opioides ↓ (0-24 h) Dolor ↓ (0-24 h) |
| 3. Estudios que comparan LIA con analgesia epidural | ||||||
| Andersen et al. (2010)47 | 40 | LIA (152 ml) EDA | 300 mg de ropivacaína 30 mg de ketorolaco 0.5 mg de epinefrina Dosis de prueba 3 mL: lidocaína + epinefrina | LIA EDA | Infusión continua a 4 mL/h durante 48 h (380 mg de ropivacaína, 60 mg de ketorolaco) Infusión continua a 4 mL/h durante 48 h (ropivacaína 2 mg/mL) Ketorolaco 15 mg IV × 6 | Consumo de opioides ↓ (0-48 h) Dolor ↓ (0-72 h) |
| Spreng et al. (2010)14 | 99 | LIA (150 ml) LIA IV (150 ml) EDA | 150 mg de ropivacaína 30 mg de ketorolaco 5 mg de morfina 0.5 mg de epinefrina 6 ml de solución salina IV 150 mg de ropivacaína 0.5 mg de epinefrina 6 ml de solución salina (LIA) 30 mg de ketorolaco IV 5 mg de morfina IV Dosis de prueba 3 mL: lidocaína + epinefrina | LIA (20 ml) LIA IV (20 ml) EDA | 22-24 h: ropivacaína 142.5 mg + ketorolaco 30 mg 1 ml de solución salina IV 22-24 h: 142.5 mg de ropivacaína + 1 mL de solución salina (LIA) 1 ml de ketorolaco IV 6-10 mL/h durante 48h: fentanilo 2 μg/mL + bupivacaína 1 mg/mL + epinefrina 1 μg/mL | Consumo de opioides ↓ (0-72 h) Dolor ↓ (24-72 h) |
| 4. Estudios que comparan diferentes técnicas de LIA | ||||||
| Andersen et al. (2008)49 | 48 | LIA ± vendaje de compresión | 340 mg de ropivacaína 1 mg de epinefrina (170 mL) | LIA ± vendaje de compresión | 6 h + 12 h: 40 mg ropivacaína + 0.2 mg epinefrina (20 mL) 24 h: 100 mg epinefrina (50 mL) | Dolor ↓ (0-8h) con vendaje compresivo |
| Andersen y otros (2010; p984) | 43 | Todos los pacientes: LIA (150 ml) | 300 mg de ropivacaína 1 mg de epinefrina | LIA (20 ml) LIA (10 ml) | 6 h + 24 h: ropivacaína 5 mg/mL 6 h + 24 h: ropivacaína 10 mg/mL | Sin diferencias entre los grupos |
| Andersen et al (2010; p543) 42 | 16 (32 rodillas) | LIA (150 ml) LIA (100 ml) | 200 mg de ropivacaína 1 mg de epinefrina 100 mg de ropivacaína a capas superficiales 200 mg de ropivacaína 1 mg de epinefrina 50 ml de solución salina a capas superficiales | LIA (20 ml) Control (20 ml) | 24 h: 100 mg de ropivacaína por vía subcutánea 24 h: solución salina por vía subcutánea | Dolor ↓ (0-6 h) con infiltración de capas superficiales, pero sin diferencia a las 24 h |
| Andersen et al. (2010; pág. 904) | 60 | Todos los pacientes: LIA (150 ml) | 300 mg ropivacaína 1 mg epinefrina | LIA (20 ml) intracapsular LIA (20 ml) intra-articular | 6 h + 24 h: 100 mg de ropivacaína | Sin diferencias entre los grupos |
| Andersen et al. (2008;p800)49 | 32 | Todos los pacientes: LIA (170 ml) | 340 mg ropivacaína 1.2 mg epinefrina | LIA LIA | 6 h + 12 h + 24 h: 40 mg de ropivacaína + 0.2 mg de epinefrina (20 mL). 60 mg adicionales de ropivacaína + 0.3 mg de epinefrina (30 ml) durante retracción del catéter 6 h + 12 h + 24 h: 40 mg de ropivacaína + 0.2 mg de epinefrina (20 mL). 30 ml adicionales de solución salina durante retracción del catéter | Sin diferencias entre los grupos |
| Spreng et al. (2010) 14 | 99 | LIA (150 ml) LIA IV (150 ml) EDA | 150 mg de ropivacaína 30 mg de ketorolaco 5 mg de morfina 0.5 mg de epinefrina 6 ml de solución salina IV 150 mg de ropivacaína 0.5 mg de epinefrina 6 ml de solución salina (LIA) 30 mg de ketorolaco IV 5 mg de morfina IV Dosis de prueba 3 mL: lidocaína + epinefrina | LIA (20 ml) LIA IV (20 ml) EDA | 22-24 h: ropivacaína 142.5 mg + 30 mg ketorolaco 1 ml de solución salina IV 22-24 h: 142.5 mg ropivacaína + 1 mL solución salina (LIA) 1 ml de ketorolaco IV 6–10 mL/h durante 48 h (fentanilo 2 μg/mL + bupivacaína 1 mg/mL + epinefrina 1 µg/mL) | Consumo de opioides ↓ (0–72 h) cuando ketorolaco y la morfina eran infiltrado en el rodilla Dolor ↓ (0-72 h) cuando ketorolaco y la morfina eran infiltrado en el rodilla |
| Andersen et al. (2013) 48 | 60 | LIA (151 ml) LIA (151 ml) | 300 mg de ropivacaína 30 mg de ketorolaco 300 mg de ropivacaína 1 ml de solución salina | LIA (10 ml) LIA (10 ml) | Cada 6 h durante 48 h: 100 mg de ropivacaína + 15 mg de ketorolaco Cada 6 h durante 48 h: 100 mg de ropivacaína + 1 ml | Consumo de opioides ↓ (0–48 h) en el grupo ketorolaco Dolor ↓ (0-48 h) en el grupo ketorolaco |
EDA = analgesia epidural; IV = intravenoso; LIA = analgesia por infiltración local; FNB = bloqueo del nervio femoral; PCA = analgesia controlada por el paciente.
Además, LIA se asoció con una movilización más rápida y una preparación más temprana para el alta hospitalaria. La receta de LIA (es decir, volumen, contenido, así como el uso de adyuvantes) no está bien definida. Dos estudios publicados recientemente han demostrado que el ketorolaco es un factor importante en la mezcla LIA. Además, Spreng y sus colegas demostraron que la administración local de ketorolaco y morfina también puede tener un efecto local. La aplicación de un vendaje de compresión durante 24 horas después de la operación y la infiltración de capas superficiales en la articulación de la rodilla con anestésicos locales también son importantes para la efectividad de la LIA. Se han publicado varios estudios recientes sobre la infusión continua de anestésicos locales con o sin adyuvantes. Gomez-Cardero y Rodriguez-Merchán50 compararon LIA continuo durante 60 horas (ropivacaína) con placebo y encontraron una reducción del consumo de opioides y de las puntuaciones de dolor durante los primeros 3 días después de la cirugía. Ong y sus colegas examinaron el uso de infusión intraarticular continua o dosis en bolo y demostraron un consumo reducido de opioides y puntuaciones de dolor más bajas en comparación con el tratamiento del dolor intravenoso solo.
RECETAS DE ANALGESIA POR INFILTRACIÓN LOCAL
LIA en Artroplastia Total de Rodilla
La receta de LIA
La solución, que se infiltra en la rodilla, debe prepararse en condiciones asépticas (Figura 1 y XNUMX). El volumen total de la solución es de 150 ml y contiene lo siguiente:
•200 mg de ropivacaína (2 mg/mL) (la cantidad de ropivacaína infiltrada en los estudios publicados varió: 150 mg, 200 mg, 300 mg, 1 400 mg)
•30 mg de ketorolaco (30 mg/mL)
•0.5 mg de epinefrina (1 mg/mL)
• Solución salina isotónica (dilución a 150 ml en total)

FIGURA 1. En quirófano, una bolsa estéril con ropivacaína de la farmacia recibe la adición de 30 mg (1 mL) de ketorolaco y 0.5 mg (0.5 mL) de epinefrina.
Consejos NYSORA
Aunque existen numerosas recetas, la siguiente fórmula es eficaz tanto para la cirugía de reemplazo de rodilla como de cadera:
• Volumen total 150 mL (agregar solución salina normal de acuerdo a la cantidad de mililitros utilizados por los otros medicamentos)
• 200 mg de ropivacaína (utilice cualquier preparación práctica: 2, 5, 7.7 mg/ml, diluida)
• 30 mg de ketorolaco
La adición de epinefrina (p. ej., 0.5 mg en 150 ml) puede tener un efecto beneficioso sobre la hemostasia.
La solución, que se infiltra en el catéter de rodilla en el postoperatorio (dosis de refuerzo), también debe prepararse en condiciones asépticas. El volumen total de la solución debe ser de 15 a 20 ml para cada inyección y contiene lo siguiente:
•150 mg de ropivacaína (5–7.5 mg/mL)
•30 mg de ketorolaco (30 mg/mL)
• Solución salina isotónica (dilución de 15 a 20 ml en total)
Técnica de inyección
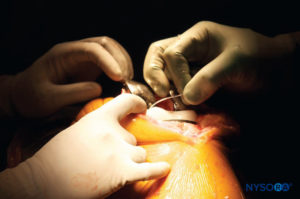
• Después de la preparación quirúrgica de la articulación de la rodilla, el cirujano ortopédico infiltra 40 ml de la solución LIA en las estructuras de la cápsula posterior. Es preferible una “técnica de aguja móvil” (Figura 2 y XNUMX, área marcada I).
• Después del reemplazo articular, se infiltran circularmente alrededor de la prótesis 50–60 mL de la solución (Figura 2 y XNUMX, área marcada IIa y IIb).
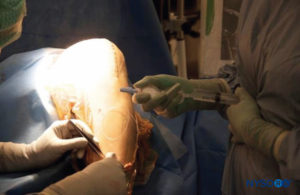
• Se puede colocar un catéter epidural de calibre 18 con un filtro bacteriano desde el lado lateral hasta la articulación de la rodilla (opcional) (Figura 2, línea sinusoidal, marcada III;Figura 3 y XNUMX).
• Después del cierre de la cápsula, se infiltran otros 50 ml de la solución en la fascia y el tejido subcutáneo (Figura 4 y XNUMX).
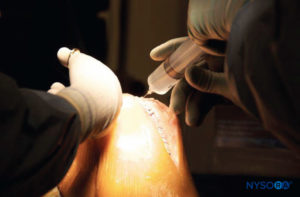
• Si se utiliza un catéter, se inyectan 10 ml de la solución a través del catéter de la rodilla al final de la cirugía para verificar el flujo de líquido (Figura 5 y XNUMX).
• Inyecciones asépticas de relleno en el catéter de la rodilla (15-20 ml, según el tamaño real de la rodilla) después de 8, 16 y 24 horas (Figura 6 y XNUMX).
• El catéter de la rodilla se retira durante la última inyección y luego se extiende hacia la fascia y el tejido subcutáneo.
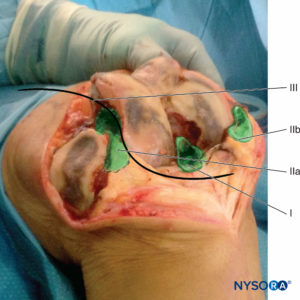
FIGURA 2. Técnica de inyección de LIA en cuatro pasos en pacientes sometidos a reemplazo de rodilla.
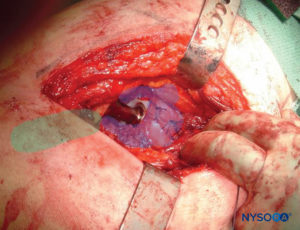
FIGURA 6. Sitios de infiltración de LIA en artroplastia de cadera: área azul transparente para la primera inyección (ver texto) y área verde transparente para la segunda inyección.
LIA en Artroplastia Total de Cadera
El Cóctel LIA
La solución cóctel LIA, que se infiltra en la cadera, debe prepararse en condiciones asépticas (Figura 1 y XNUMX). El volumen total de la solución es de 100 ml y contiene lo siguiente:
• 200 mg de ropivacaína (2 mg/mL)
• 30 mg de ketorolaco (30 mg/mL)
• 0.5 mg de epinefrina (1 mg/mL)
• Solución salina isotónica (dilución a 100 ml en total)
Técnica de inyección
Según el tamaño de la incisión quirúrgica y la elección del abordaje quirúrgico, se inyectan 100 ml de la solución LIA en dos etapas:
• Después de la preparación quirúrgica del acetábulo, se infiltran 50 mL de la solución en las estructuras de la cápsula (si quedan), en los músculos aductores y en el músculo glúteo medio.
Consejos NYSORA
¿Deberíamos incluir catéteres para infusión/relleno peri o intraarticular cuando usamos LIA?
• No, hay pruebas sólidas de que el catéter no tiene ningún beneficio después de la prótesis de cadera.
• Después de la prótesis de rodilla, la evidencia es más contradictoria y en su mayoría no indica ningún efecto adicional en comparación con la analgesia sistémica multimodal óptima, pero sí algún efecto si no se utilizan todos los componentes de los regímenes multimodales.
• Un informe reciente de un aumento en la tasa de infecciones con catéteres, sumado a informes anecdóticos de resultados similares, sumado a la evidencia en contra del uso de catéteres.
• Después de la inserción del componente femoral, se infiltran otros 50 ml en los rotadores externos (músculo cuadrado femoral, músculo obturador y tendón del músculo glúteo mayor) (Figura 6 y XNUMX).
Referencias
- Kerr DR, Kohan L: Analgesia por infiltración local: una técnica para el control del dolor posoperatorio agudo después de una cirugía de rodilla y cadera: un estudio de caso de 325 pacientes. Acta Orthop 2008;79:174–183.
- Goodwin RC, Amjadi F, Parker RD: efectos analgésicos a corto plazo de las inyecciones intraarticulares después de la artroscopia de rodilla. Artroscopia 2005;21: 307–312.
- Brummett CM, Williams BA: Aditivos a los anestésicos locales para el bloqueo de nervios periféricos. Int Anesthesiol Clin 2011;49:104–116.
- Ilfeld BM: Bloqueos nerviosos periféricos continuos: una revisión de la evidencia publicada. Anesth Analg 2011;113:904–925.
- Smoot JD, Bergese SD, Onel E, et al: La eficacia y la seguridad de la bupivacaína DepoFoam en pacientes que se someten a una mamoplastia de aumento submuscular cosmética bilateral: un estudio aleatorizado, doble ciego y de control activo. Aesthet Surg J 2012;32:69–76.
- Kehlet H, Andersen LO: Analgesia por infiltración local en reemplazo articular: evidencia y recomendaciones para la práctica clínica. Acta Anaesthesiol Scand 2011;55:778–784.
- Raeder J, Spreng UJ: Anestesia de infiltración local (LIA): ¿Manejo del dolor posoperatorio revisado y evaluado por los cirujanos? Acta Anaesthesiol Scand 2011;55:772–774.
- Andersen LO, Husted H, Otte KS, et al: analgesia de infiltración de alto volumen en la artroplastia total de rodilla: un ensayo aleatorizado, doble ciego, controlado con placebo. Acta Anaesthesiol Scand 2008;52:1331–1335.
- Aasbo V, Thuen A, Raeder J: Mejora de la analgesia postoperatoria de larga duración, la función de recuperación y la satisfacción del paciente después de la reparación de una hernia inguinal con bloqueo del campo inguinal en comparación con la anestesia general. Acta Anaesthesiol Scand 2002;46:674–678.
- Parker RD, Streem K, Schmitz L, Martineau PA: Eficacia de la infusión continua de bupivacaína intraarticular para la analgesia posoperatoria después de la reconstrucción del ligamento cruzado anterior: un estudio doble ciego, controlado con placebo, prospectivo y aleatorizado. Am J Sports Med 2007; 35:531–536.
- Rosseland LA, Helgesen KG, Breivik H, Stubhaug A: El dolor de moderado a intenso después de la artroscopia de rodilla se alivia con solución salina intraarticular: un ensayo controlado aleatorizado. Anesth Analg 2004;98:1546–1551, tabla.
- Lenz H, Raeder, Heyerdahl F, et al: Modulación de la hiperalgesia posterior a la infusión inducida por remifentanilo por parecoxib o ketorolaco en humanos. Dolor 2011;100–110.
- Dye SF: La fisiopatología del dolor patelofemoral: Una perspectiva de la homeostasis tisular. Clin Orthop Relat Res 2005;100–110.
- Spreng UJ, Dahl V, Hjall A, et al: analgesia de infiltración local de alto volumen combinada con ketorolaco intravenoso o local + morfina en comparación con analgesia epidural después de la artroplastia total de rodilla. Hermano J Anaesth 2010;105: 675–682.
- Affas F, Nygards EB, Stiller CO, et al: Control del dolor después de la artroplastia total de rodilla: un ensayo aleatorio que compara la anestesia por infiltración local y el bloqueo femoral continuo. Acta Orthop 2011;82(4):441–447.
- Lund J, Jenstrup MT, Jaeger P, et al: Bloqueo continuo del canal de los aductores para la analgesia postoperatoria adyuvante después de una cirugía mayor de rodilla: resultados preliminares. Acta Anaesthesiol Scand 2011;55:14–19.
- Essving P, Axelsson K, Åberg E, et al: analgesia por infiltración local (LIA) frente a morfina intratecal para el tratamiento del dolor posoperatorio después de una artroplastia total de rodilla. Un ensayo aleatorizado y controlado. Anesth Analg 2011;113: 926–933.
- Sitios BD, Beach M, Gallagher JD, et al: Un bloqueo del nervio femoral asistido por ultrasonido con una sola inyección proporciona una analgesia que evita los efectos secundarios en comparación con la morfina intratecal en pacientes sometidos a una artroplastia total de rodilla. Anesth Analg 2004;99:1539–1543.
- Hval K, Thagaard KS, Schlichting E, Raeder J: El efecto analgésico posoperatorio prolongado cuando se agrega dexametasona a un fármaco antiinflamatorio no esteroideo (rofecoxib) antes de la cirugía de mama. Anesth Analg 2007;105:481–486.
- Zhang J, Ho KY, Wang Y: Eficacia de la pregabalina en el dolor posoperatorio agudo: un metanálisis. Hermano J Anaesth 2011;106:454–462.
- Banks A: Innovaciones en el manejo del dolor postoperatorio: infusión continua de anestésicos locales. AORN J 2007;85:904–914.
- Piper SL, Kramer JD, Kim HT, Feeley BT: Efectos de los anestésicos locales sobre el cartílago articular. Am J Sports Med 2011;39:2245–2253.
- McCarthy D, Iohom G: Analgesia por infiltración local para el control del dolor posoperatorio después de una artroplastia total de cadera: una revisión sistemática. Anesthesiol Res Pract 2012;2012:709531.
- Rikalainen-Salmi R, Forster JG, Makela K, et al: Analgesia de infiltración local con levobupivacaína en comparación con morfina intratecal en pacientes con artroplastia total de cadera. Acta Anaesthesiol Scand 2012;56: 695–705.
- Murphy TP, Byrne DP, Curtin P, et al: ¿Puede una inyección periarticular de levobupivacaína reducir el consumo de opiáceos posoperatorio durante la artroplastia primaria de cadera? Clin Orthop Relat Res 2012;470:1151–1157.
- Otte K, Husted H, Andersen L, et al: Analgesia por infiltración local en la artroplastia total de rodilla y el revestimiento de cadera: un estudio metodológico. Dolor agudo 2008;10:111–116.
- Parvataneni HK, Shah VP, Howard H, et al: Control del dolor después de una artroplastia total de cadera y rodilla mediante un protocolo multimodal con inyecciones periarticulares locales: un estudio prospectivo aleatorizado. J Artroplastia 2007;22:33–38.
28. Busch CA, Whitehouse MR, Shore BJ, et al: La eficacia de la infiltración de fármacos multimodal periarticular en la artroplastia total de cadera. Clin Orthop Relat Res 2010;468:2152–2159. - Bianconi M, Ferraro L, Traina GC, et al: Farmacocinética y eficacia de la instilación continua de ropivacaína en heridas después de una cirugía de reemplazo articular. Hermano J Anaesth 2003;91:830–835.
- Andersen LJ, Poulsen T, Krogh B, Nielsen T: Analgesia posoperatoria en la artroplastia total de cadera: un estudio aleatorizado, doble ciego, controlado con placebo sobre la infiltración de la herida con ropivacaína, ketorolaco y adrenalina en el período preoperatorio y posoperatorio. Acta Orthop 2007;78:187–192.
- Lunn TH, Husted H, Solgaard S, et al: analgesia de infiltración local intraoperatoria para la analgesia temprana después de la artroplastia total de cadera: un ensayo aleatorizado, doble ciego, controlado con placebo. Reg Anesth Pain Med 2011;36: 424–429.
- Andersen KV, Pfeiffer-Jensen M, Haraldsted V, Soballe K: Reducción de la estancia hospitalaria y el consumo de narcóticos, y mejora de la movilización con infiltración local e intraarticular después de la artroplastia de cadera: ensayo clínico aleatorizado de una técnica intraarticular versus infusión epidural en 80 pacientes. Acta Orthop 2007;78:180–186.
- Specht K, Leonhardt JS, Revald P, et al: No hay evidencia de un efecto clínicamente importante de agregar analgesia de infusión local administrada a través de un catéter en el tratamiento del dolor después de la artroplastia total de cadera. Acta Orthop 2011;82:315–320.
- Badner NH, Bourne RB, Rorabeck CH, et al: Inyección intraarticular de bupivacaína en operaciones de reemplazo de rodilla. Resultados de uso para analgesia y para bloqueo preventivo. J Bone Joint Surg Am 1996;78:734–738.
- Mauerhan DR, Campbell M, Miller JS, et al: Morfina intraarticular y/o bupivacaína en el tratamiento del dolor después de una artroplastia total de rodilla. J Artroplastia 1997;12:546–552.
- Ritter MA, Koehler M, Keating EM, et al: Morfina intraarticular y/o bupivacaína después del reemplazo total de rodilla. J Bone Joint Surg Br 1999; 81:301–303.
- Busch CA, Shore BJ, Bhandari R, et al: Eficacia de la inyección de fármacos multimodal periarticular en la artroplastia total de rodilla. Un ensayo aleatorio. J Bone Joint Surg Am 2006;88:959–963.
- Vendittoli PA, Makinen P, Drolet P, et al: Un protocolo de analgesia multimodal para la artroplastia total de rodilla. Un estudio aleatorizado y controlado. J Bone Joint Surg Am 2006;88:282–289.
- Morin AM, Wulf H: Analgesia por infiltración local (LIA) de alto volumen para la artroplastia total de cadera y rodilla: una breve revisión del estado actual [en alemán]. Anasthesiol Intensivmed Notfallmed Schmerzther 2011;46: 84–86.
40. Ganapathy S, Brookes J, Bourne R: Analgesia por infiltración local. Anesthesiol Clin 2011;29:329–342. - Gibbs DM, Green TP, Esler CN: La infiltración local de la analgesia después del reemplazo total de rodilla: una revisión de la literatura actual. J Bone Joint Surg Br 2012;94:1154–1159.
- Andersen LO, Husted H, Kristensen BB, et al: Eficacia analgésica de la infiltración de la herida con anestésico local subcutáneo en la artroplastia de rodilla bilateral: un ensayo aleatorizado, controlado con placebo, doble ciego. Acta Anaesthesiol Scand 2010;54:543–548.
- Essving P, Axelsson K, Kjellberg J, et al: Reducción del consumo de morfina y la intensidad del dolor con analgesia por infiltración local (LIA) después de la artroplastia total de rodilla. Acta Orthop 2010;81:354–360.
- Toftdahl K, Nikolajsen L, Haraldsted V, et al: Comparación de la analgesia periarticular e intraarticular con el bloqueo del nervio femoral después de la artroplastia total de rodilla: un ensayo clínico aleatorizado. Acta Orthop 2007;78: 172–179.
- Kazak BZ, Aysu SE, Darcin K, et al: La administración intraarticular de levobupivacaína o bupivacaína disminuye las puntuaciones de dolor y proporciona una mejor recuperación después de la artroplastia total de rodilla. J. Anesth 2010; 24:694–699.
- Carli F, Clemente A, Asenjo JF, et al: Analgesia y resultado funcional después de la artroplastia total de rodilla: infiltración periarticular versus bloqueo continuo del nervio femoral. Hermano J Anaesth 2010;105:185–195.
- Andersen KV, Bak M, Christensen BV, et al: Un ensayo aleatorizado y controlado que comparó la analgesia por infiltración local con la infusión epidural para la artroplastia total de rodilla. Acta Orthop 2010;81:606–610.
- Andersen KV, Nikolajsen L, Haraldsted V, et al: Infiltración local
analgesia para artroplastia total de rodilla: ¿se debe agregar ketorolaco? Hermano J Anaesth 2013;111:242–248. - Andersen LO, Husted H, Otte KS, et al: Un vendaje de compresión mejora
Analgesia por infiltración local en artroplastia total de rodilla. Acta Orthop 2008;79:806–811. - Gomez-Cardero P, Rodriguez-Merchan EC: Analgesia postoperatoria en
TKA: infusión intraarticular continua de ropivacaína. Clin Orthop Relat Res 2010;468:1242–1247. - Ong JC, Chin PL, Fook-Chong SM, et al: Infiltración continua de anestésico local después de la artroplastia total de rodilla. J Orthop Surg (Hong Kong)
2010; 18: 203207. - Essving P, Axelsson K, Kjellberg J, et al: Reducción de la estancia hospitalaria, el consumo de morfina y la intensidad del dolor con analgesia por infiltración local después
Artroplastia unicompartimental de rodilla. Acta Orthop 2009;80:213–219. - Ali A, Sundberg M, Hansson U, Malmvik J, Flivik G: Dudoso efecto de
analgesia intraarticular continua después de la artroplastia total de rodilla. Acta Orthop 2015;86:373–377.