Imran Ahmad
INTRODUCCIÓN
La intubación endotraqueal despierto se puede lograr utilizando una variedad de equipos, como videolaringoscopios, estiletes ópticos y endoscopios de fibra óptica. La anestesia tópica adecuada de las vías respiratorias y la sedación pueden permitir el uso exitoso de cualquiera de estas técnicas. El método más común utilizado para realizar la intubación endotraqueal despierto es con un fibroscopio flexible, y la intubación con fibra óptica despierto se considera el estándar de oro para la intubación endotraqueal de pacientes con una vía aérea difícil anticipada. Este procedimiento requiere habilidades y conocimientos que deben ser familiares para todos los anestesiólogos.
Recientemente, ha habido muchos avances en la anestesia regional, lo que permite realizar procedimientos más complicados e innovadores bajo técnicas de bloqueo regional; sin embargo, no todos estos casos pueden realizarse únicamente bajo anestesia regional. A menudo, se requiere una combinación de anestesia regional y general; por lo tanto, todos los anestesiólogos deben estar familiarizados con las técnicas de intubación despierto, especialmente si el paciente tiene una vía aérea difícil anticipada. Anestesiar a los pacientes con una vía aérea difícil anticipada es a menudo una fuente de ansiedad y temor, pero las técnicas adecuadas de topicalización y sedación de las vías respiratorias pueden crear las condiciones apropiadas para un procedimiento seguro y sin estrés tanto para el paciente como para el anestesiólogo.
Es difícil dar cifras precisas sobre la incidencia de las vías respiratorias difíciles debido a una variedad de razones, incluidas las diferencias de población, la variación de las habilidades del operador, los informes del operador y la inconsistencia en la definición de vía aérea difícil. En la población general, las cifras aproximadas de incidencia de laringoscopia grados 3 y 4 de Cormack y Lehane es del 10 %, la intubación difícil es del 1 % y la ventilación con bolsa mascarilla difícil es del 0.08 % al 5 %.
La intubación endotraqueal generalmente se realiza bajo anestesia general, pero si se anticipa una vía aérea difícil, lo ideal es que se realice bajo anestesia regional (con o sin sedación), ya que esto permite que el paciente respire espontáneamente, mantenga la vía aérea abierta y coopere con el operador. . Si se experimentan dificultades adversas, entonces el procedimiento puede abandonarse con un riesgo mínimo para el paciente. Hay excepciones obvias para realizar la intubación despierto, como la negativa del paciente, los niños pequeños y los pacientes que no cooperan (debido a confusión o problemas de aprendizaje).
Para realizar con éxito la intubación endotraqueal despierto, uno debe estar familiarizado con lo siguiente:
- Sensorial inervación de la vía aérea superior
- Agentes disponibles para la topicalización
- Técnicas de aplicación disponibles para topicalizar la vía aérea
- Técnicas de anestesia regional, por puntos de referencia o guiadas por ecografía
- Técnicas de sedación seguras
INERVACIÓN SENSORIAL DE LAS VÍAS AÉREAS
La vía aérea superior se divide en las cavidades nasal y oral, la faringe y la laringe. La inervación sensitiva de las vías respiratorias superiores proviene de los nervios trigémino, glosofaríngeo y vago.Figura 1 y XNUMX).
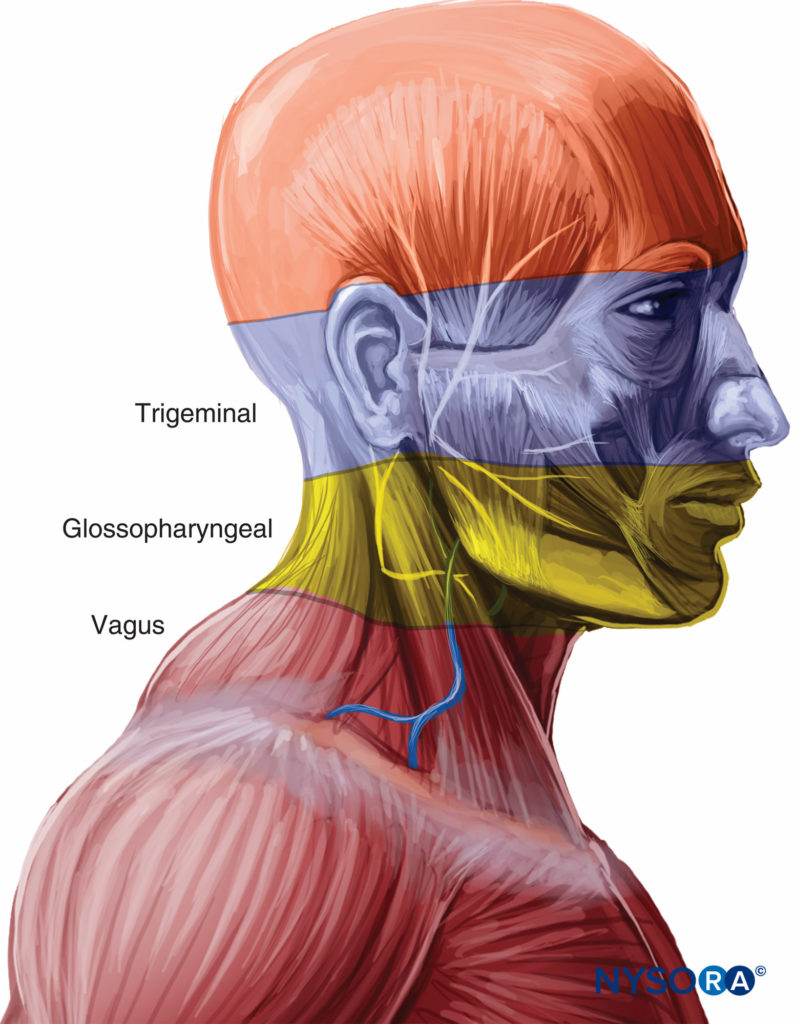
FIGURA 1. Inervación de la vía aérea superior.
Cirugía de Nariz
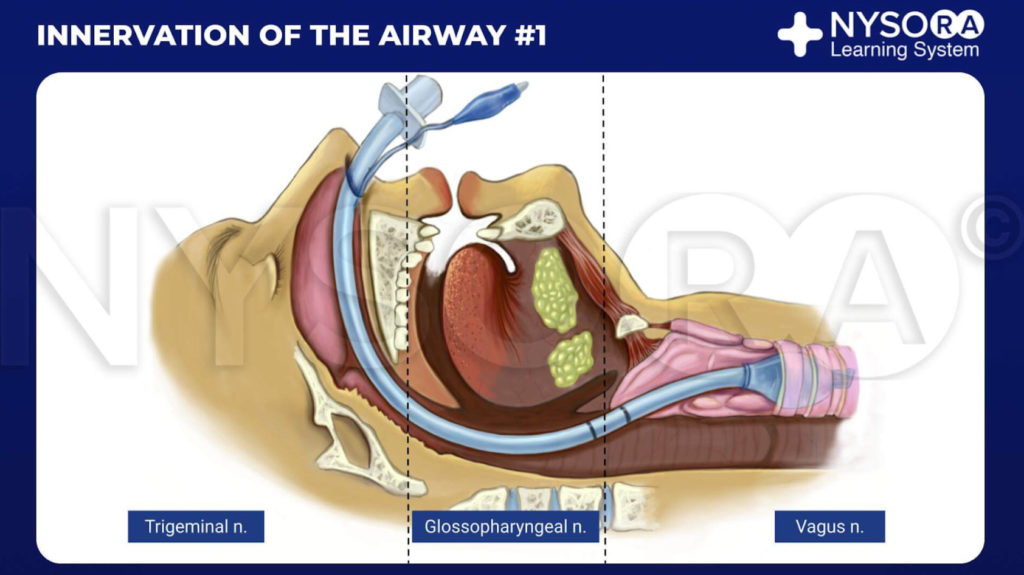
Del Compendio de Anestesia Regional: Inervación de las vías respiratorias infografía #1.
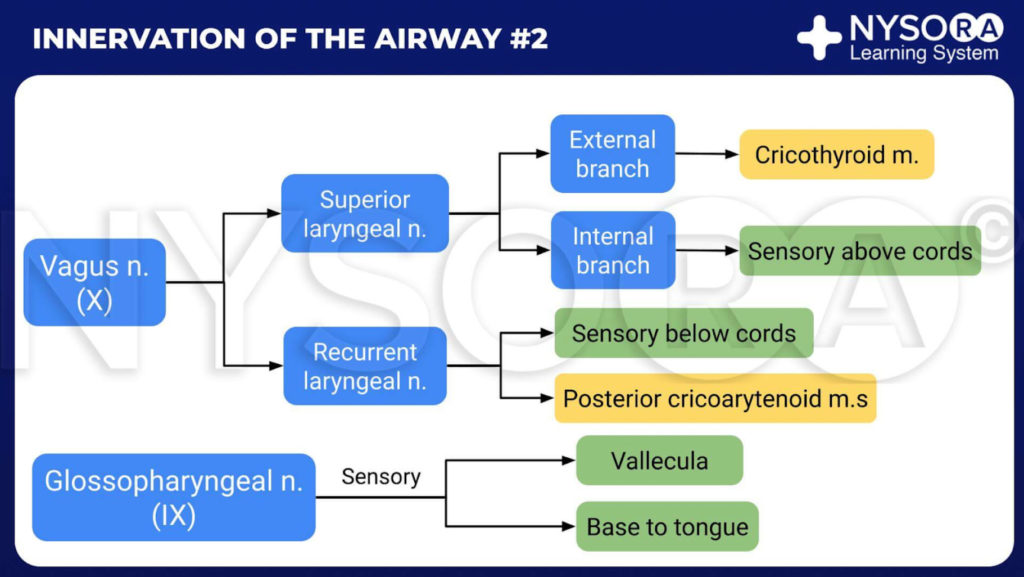
Del Compendio de Anestesia Regional: Inervación de las vías respiratorias infografía #2.
La nariz está completamente inervada por ramas del nervio trigémino. El tabique y las partes anteriores de la cavidad nasal se ven afectados por el nervio etmoidal anterior (una rama del nervio oftálmico). El resto de la cavidad nasal está inervado por los nervios palatinos mayor y menor (ramas del nervio maxilar).
Los nervios palatinos se transmiten a través del ganglio pterigopalatino, que se encuentra en la fosa pterigopalatina, que está situada cerca de la fosa esfenopalatina, ubicada justo por detrás del cornete medio.
Faringe
La faringe está inervada en gran medida por el nervio glosofaríngeo. La inervación de toda la faringe, tercio posterior de la lengua, fauces, amígdalas y epiglotis proviene del nervio glosofaríngeo.
Orofaringe
La orofaringe está inervada por ramas de los nervios vago, trigémino y glosofaríngeo. El tercio posterior de la lengua, la vallécula y la superficie anterior de la epiglotis están inervados por el nervio amigdalino (una rama del nervio glosofaríngeo). Las paredes posterior y lateral de la faringe están inervadas por el nervio faríngeo (una rama del nervio vago). El nervio amigdalino afecta a las amígdalas. Los dos tercios anteriores de la lengua están inervados por el nervio lingual (rama de la división mandibular del nervio trigémino).
Laringe
La laringe está inervada por el nervio vago (Figura 2 y XNUMX). Por encima de las cuerdas vocales (base de la lengua, epiglotis posterior, pliegues ariepiglóticos y aritenoides), la rama interna del nervio laríngeo superior (una rama del nervio vago) proporciona inervación. Para las cuerdas vocales y debajo de las cuerdas vocales, el nervio laríngeo recurrente (una rama del nervio vago) es el proveedor.
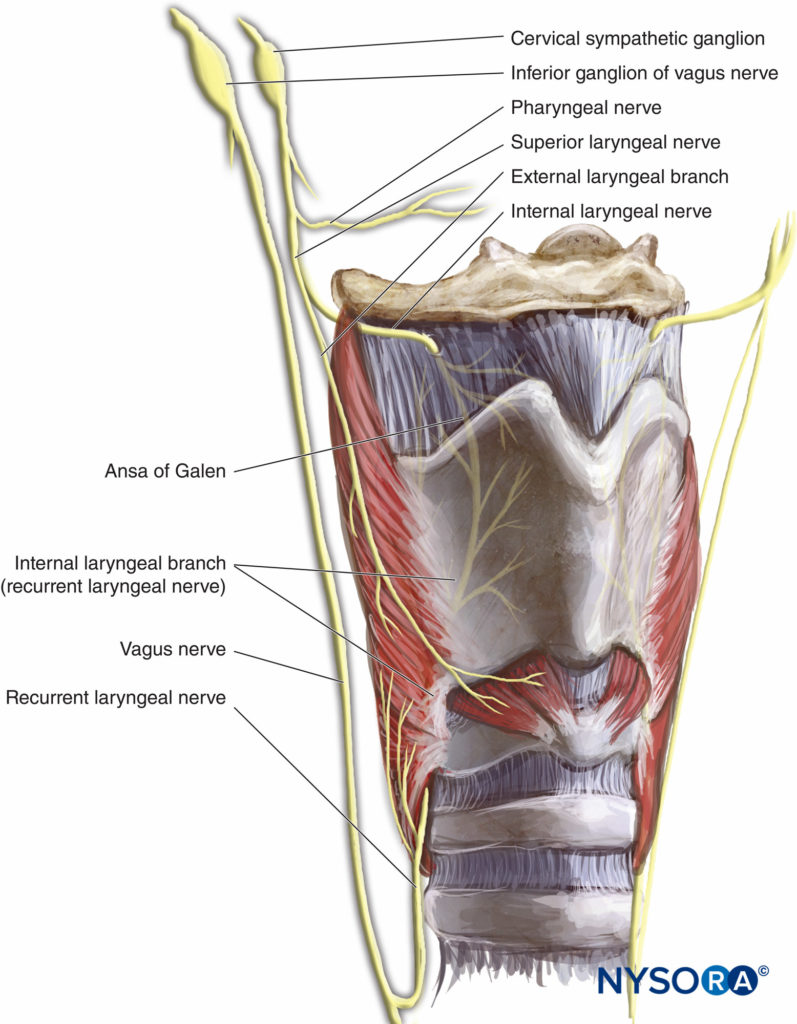
FIGURA 2.Inervación de la laringe.
Consejos NYSORA
• Los nervios palatinos mayor y menor proporcionan sensibilidad a los cornetes nasales ya los dos tercios posteriores del tabique nasal.
• El nervio etmoidal anterior inerva el resto de las fosas nasales.
• El nervio glosofaríngeo proporciona inervación sensitiva al tercio posterior de la lengua, la vallécula, la superficie anterior de la epiglotis (rama lingual), las paredes de la faringe (rama faríngea) y las amígdalas (rama amigdalina).
• El nervio laríngeo superior inerva la base de la lengua, la superficie posterior de la epiglotis, el pliegue ariepiglótico y los aritenoides.
• El nervio laríngeo recurrente proporciona inervación sensorial a la tráquea y las cuerdas vocales.
ANESTESIA TÓPICA
Cocaína
La cocaína es el único anestésico local con propiedades vasoconstrictoras; por lo tanto, es particularmente útil para la anestesia tópica de la nasofaringe, que es muy vascular. La cocaína está disponible como solución al 5% o al 10% y en forma de pasta; la dosis máxima recomendada es de 1.5 mg/kg. Debe usarse con precaución en pacientes con enfermedad arterial coronaria, hipertensión y deficiencia de pseudocolinesterasa.
La mezcla de 2 mL de cocaína al 10%, 1 mL de adrenalina 1:1000, 2 mL de bicarbonato de sodio y 5 mL de cloruro de sodio da como resultado 10 mL de solución de Moffett. Esto se usa comúnmente en procedimientos rinológicos para proporcionar anestesia local, vasoconstricción y descongestión. También se utiliza para topicalizar la mucosa nasal para proporcionar las condiciones óptimas para las intubaciones nasales.
Lidocaína
La lidocaína es el anestésico local más utilizado para la topicalización de las vías respiratorias. La solución al 4% y el spray al 10% son los más utilizados (Figura 3 y XNUMX). La absorción sistémica de la aplicación tópica en las vías respiratorias superiores es inferior a la esperada, por lo que en la práctica se pueden utilizar dosis superiores a los 2 mg/kg recomendados.
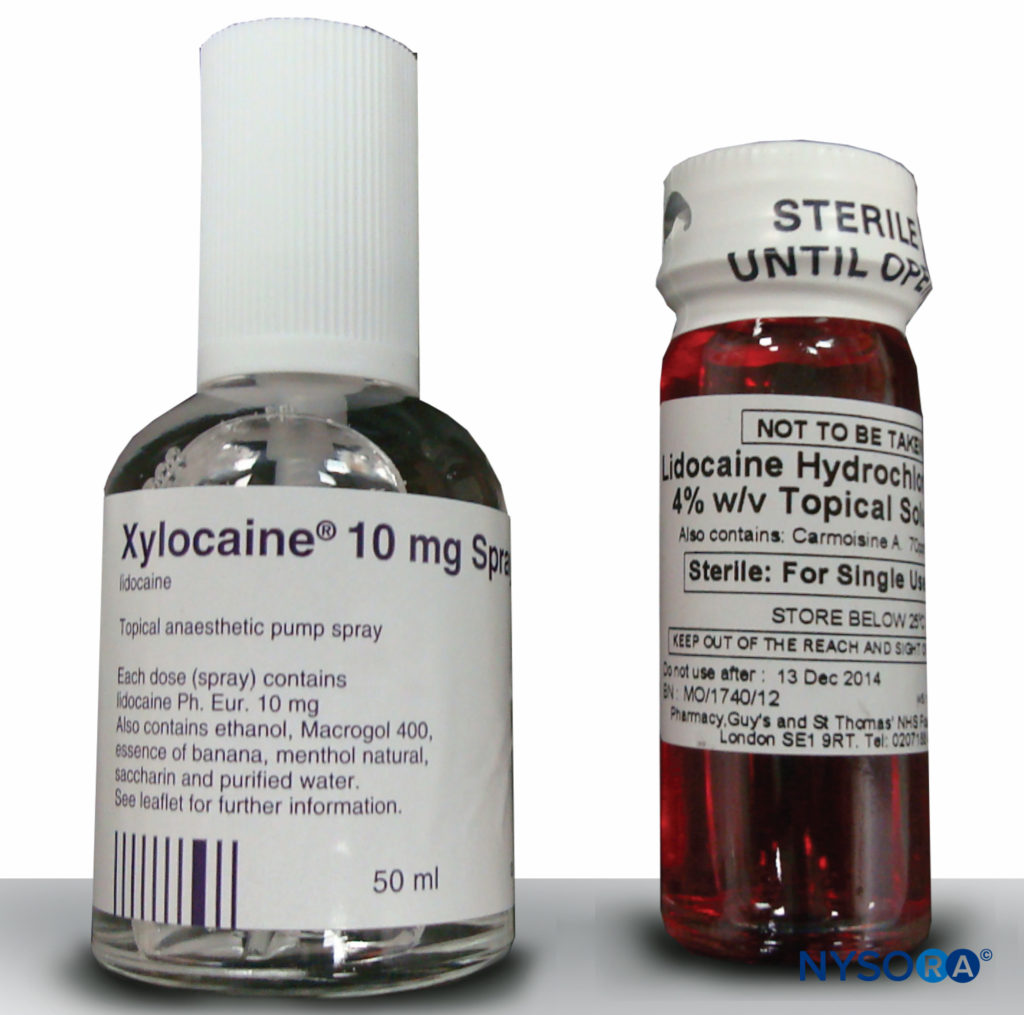
FIGURA 3.Lidocaína, 10% y 4%.
Vasoconstrictores
Los vasoconstrictores deben usarse cuando se anestesia la mucosa nasal; esto se debe a que la mucosa está muy vascularizada y puede producirse sangrado con facilidad en la instrumentación, lo que puede oscurecer la vista que se ve en el fibroscopio.
Como se mencionó, la cocaína tiene propiedades vasoconstrictoras inherentes, por lo que es un agente adecuado para usar en la mucosa nasal. Los agentes vasoconstrictores como la xilometazolina y la fenilefrina se preparan con lidocaína para producir anestesia local y vasoconstricción.
Estas mezclas también son agentes adecuados para la preparación de la mucosa nasal.
Consejos NYSORA
• El uso de vasoconstrictores reduce el sangrado “encoge” la mucosa nasal dando como resultado una mejor exposición quirúrgica.
• La contracción de la mucosa nasal aumenta el tamaño de las vías respiratorias nasales, creando más espacio para el fibroscopio y el tubo endotraqueal.
• Debe dejarse un tiempo adecuado para que el vasoconstrictor haga efecto antes de comenzar la fibroscopia.
TÉCNICAS DE APLICACIÓN
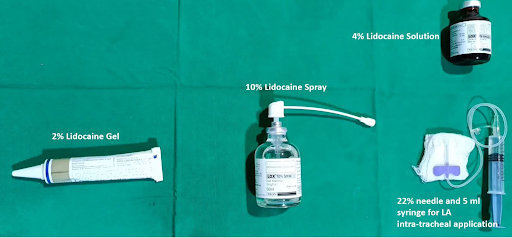
Del Compendio de Anestesia Regional: Equipos y preparados anestésicos locales para la anestesia de las vías respiratorias.
Hay varias técnicas disponibles para topicalizar la vía aérea superior en preparación para la intubación despierto. La nasofaringe y la orofaringe se pueden rociar directamente desde el recipiente de las preparaciones anestésicas locales, rociar usando la técnica de McKenzie o rociar mediante un dispositivo de atomización de la mucosa (MAD).
La técnica de McKenzie utiliza una cánula de calibre 20 unida a un tubo de burbujas de oxígeno a través de un grifo de tres vías.
Luego, el otro extremo del tubo de burbujas se conecta a una fuente de oxígeno, que se enciende para administrar un flujo de 2 a 4 L/min. A medida que el anestésico local se administra lentamente a través de una jeringa de 5 ml conectada al puerto superior de la cánula, se observa un efecto de rociado similar a un chorro, que aumenta en gran medida el área de superficie del anestésico local y permite la topicalización dirigida de la mucosa nasal y oral (Figura 4 y XNUMX).
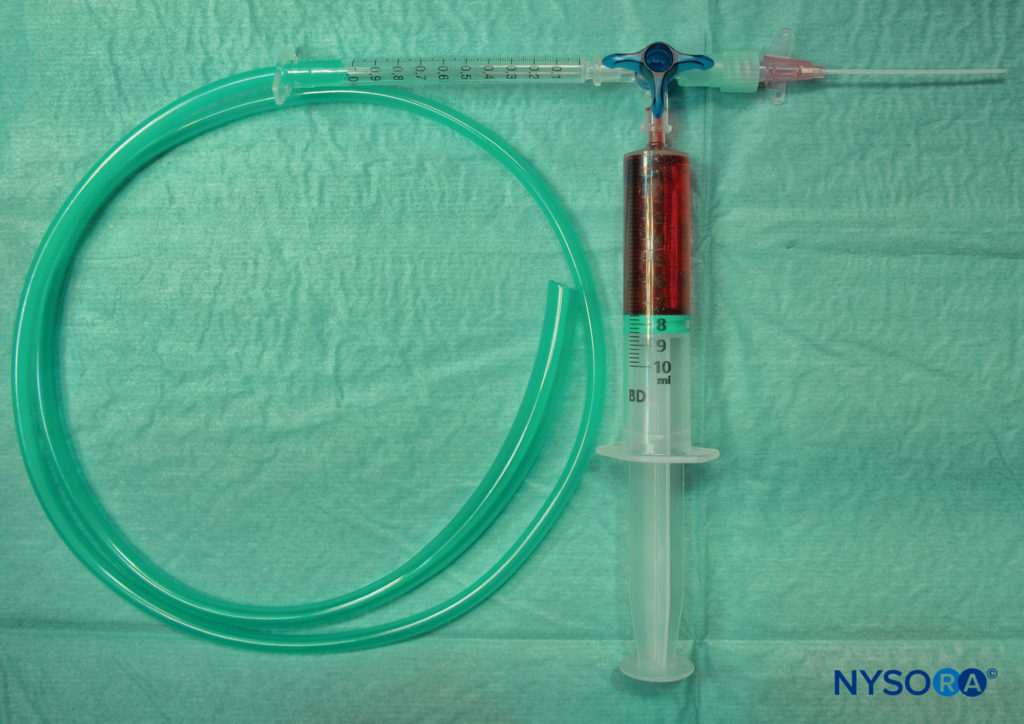
FIGURA 4. Configuración para la técnica de McKenzie.
Consejos NYSORA
• Mantenga un sello hermético entre el tubo y la cánula para evitar la fuga de anestésico local de estas áreas.
• La presión lenta y continua sobre la jeringa de 5 ml que contiene anestesia local dará como resultado un sonido de "silbido" a medida que se rocía una fina niebla de la cánula.
Los atomizadores para mucosas disponibles en el mercado permiten un efecto de niebla similar al que se observa con la técnica de McKenzie simplemente conectándolos al extremo de una jeringa (Figura 5 y XNUMX). Estos dispositivos están disponibles para aplicaciones nasales y orales.

FIGURA 5. Dispositivo de atomización de mucosas (MAD).
Agregar aproximadamente 5 ml de lidocaína al 4 % a un nebulizador y luego administrarlo con oxígeno durante un máximo de 30 minutos es una forma segura y no invasiva de aplicar un tópico en las vías respiratorias hasta la tráquea (Figura 6 y XNUMX). Es bien tolerado y es una técnica útil para topicalizar toda la vía aérea. También permite la topicalización de pacientes con apertura bucal limitada, donde no se pueden pasar atomizadores a la boca para topicalizar la orofaringe.
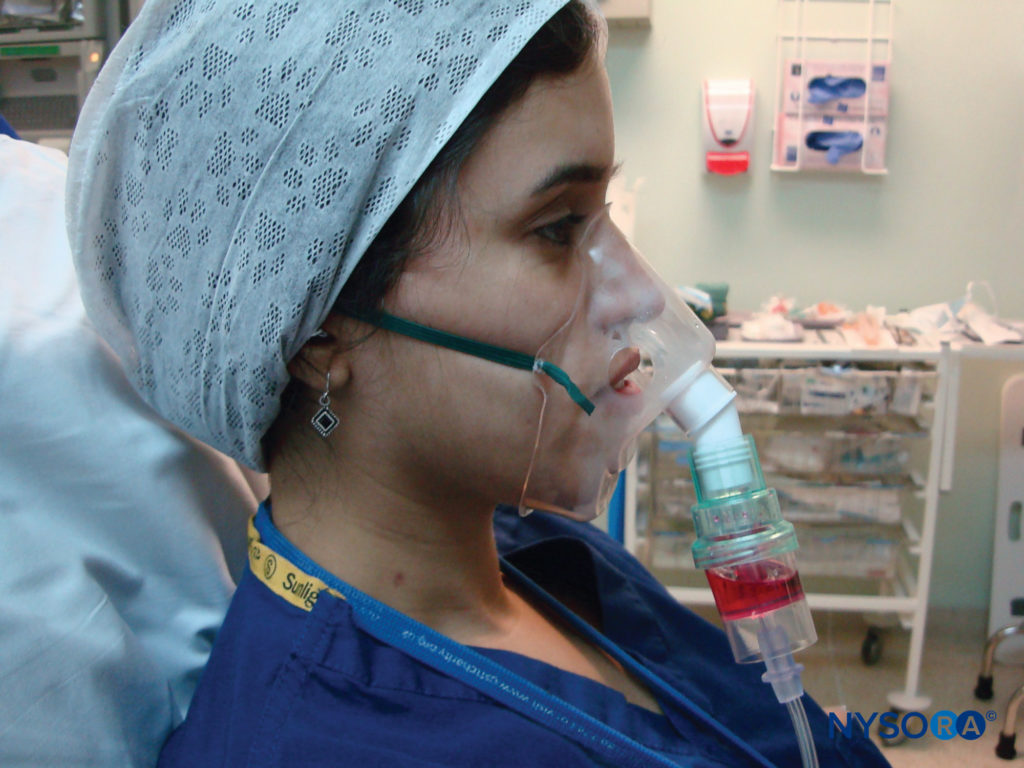
FIGURA 6. Administración de lidocaína nebulizada.
Las cuerdas vocales también se pueden rociar directamente con anestesia local usando la técnica de rociar sobre la marcha (SAYGO). Aquí, el extremo distal de un catéter epidural de calibre 16 se corta a 3 cm del extremo y luego se introduce a través del canal de trabajo de un fibroscopio.
El conector Luer lock se conecta al extremo proximal del catéter y luego se conecta a una jeringa de 5 ml preparada con lidocaína al 4%. El extremo distal debe sobresalir del fibroscopio, de modo que la punta sea apenas visible. Luego, el anestésico local se gotea sobre las cuerdas vocales antes de introducir el fibroscopio en la tráquea. Esto reduce la incomodidad y la tos del paciente cuando el fibroscopio y el tubo endotraqueal se introducen en la tráquea.
Por lo general, una combinación de técnicas (Tabla 1) se utiliza para administrar anestesia local a la mucosa de las vías respiratorias en preparación para la intubación despierto. Por ejemplo, para preparar la nasofaringe, la solución anestésica local preparada previamente se puede rociar en la mucosa nasal utilizando la boquilla del recipiente. La orofaringe podría prepararse con anestesia local pulverizada mediante la técnica de McKenzie, y las cuerdas vocales podrían pulverizarse mediante el método SAYGO. Alternativamente, los MAD se pueden usar para rociar la mucosa nasal y oral. Cualquiera que sea la técnica o combinación de técnicas que se utilice, el objetivo debe ser tener una vía aérea adecuadamente anestesiada en preparación para la instrumentación.
TABLA 1. Técnicas de aplicación.
| Pulverizar desde el recipiente Anestésico local empapado en cinta de gasa Aplicadores de algodón Técnica de McKenzie Dispositivo de atomización de mucosas Inhalación de lidocaína nebulizada “Rocíe sobre la marcha” a través de un catéter epidural |
Consejos NYSORA
• Sentar al paciente en posición vertical ayudará con la oxigenación y la topicalización.
• Administre siempre oxígeno suplementario.
• Iniciar y establecer la sedación antes de iniciar el proceso de topicalización, que puede resultar incómodo.
• Pedirle al paciente que “olfatea” mientras rocía la nasofaringe puede ayudar en la distribución del anestésico local.
TÉCNICAS DE ANESTESIA REGIONAL
Bloques nerviosos Puede proporcionar anestesia para la intubación despierto, pero puede ser técnicamente más difícil de realizar que la anestesia tópica de las vías respiratorias. Conlleven un mayor riesgo de complicaciones, como inyección intravascular y daño en el nervio, y es necesario bloquear más de un nervio. Estos son los nervios glosofaríngeo, laríngeo superior y laríngeo recurrente, ya que inervan la orofaringe y la laringe. Por lo tanto, los bloqueos nerviosos necesarios para anestesiar las vías respiratorias son los bloqueos glosofaríngeo, laríngeo superior y translaríngeo.
Las fosas nasales están inervadas por los nervios palatinos y el nervio etmoidal anterior. Estos nervios deben bloquearse para permitir la intubación nasal con fibra óptica despierto. Estos nervios generalmente se bloquean mediante la aplicación tópica de anestésico local en las fosas nasales, generalmente por inhalación, aplicación de tópicos en aerosol o aplicación de aplicadores de algodón empapados en anestésico.
Técnica de referencia
Bloqueo del nervio glosofaríngeo
El nervio glosofaríngeo proporciona sensibilidad al tercio posterior de la lengua y la vallécula y proporciona la rama sensorial para el reflejo nauseoso; por lo tanto, este bloqueo es particularmente útil para abolir este reflejo. Hay dos abordajes descritos para este bloque: intraoral y peristiloideo.
Para el abordaje intraoral, el paciente requiere suficiente apertura de la boca para permitir una adecuada visualización y acceso a la base de los pilares amigdalinos posteriores (arco palatofaríngeo) (Figura 7 y XNUMX). Después de aplicar la anestesia tópica adecuada (spray de lidocaína), la lengua se retrae medialmente con un
hoja de laringoscopio o un bajalenguas, que permite el acceso al pilar amigdalino posterior. Luego, con una aguja de calibre 22 o 25, se inyectan de 2 a 5 ml de lidocaína al 2% por vía submucosa, después de la aspiración negativa. El punto de inyección está en la cara caudal del pilar amigdalino posterior (aproximadamente 0.5 cm lateral al borde lateral de la lengua donde se une al piso de la boca; Figura 8 y XNUMX). Esto luego se repite en el otro lado.
Alternativamente, se puede aplicar firmemente una gasa empapada en anestésico local en esta región durante unos minutos. Este método evita el riesgo de inyección intravascular pero no es tan exitoso como cuando se inyecta el anestésico local.
El abordaje peristiloide tiene como objetivo infiltrar el anestésico local justo por detrás de la apófisis estiloides donde se encuentra el nervio glosofaríngeo. Muy cerca de esto se encuentra la arteria carótida interna, por lo que se debe tener cuidado al utilizar este enfoque.
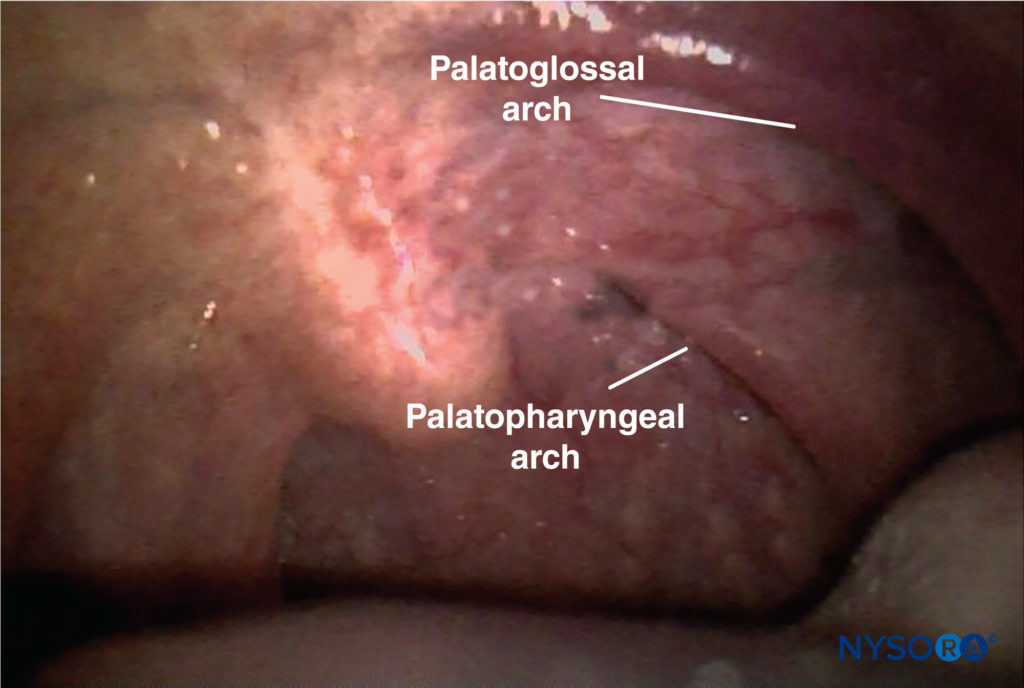
FIGURA 7. Arco palatofaríngeo.
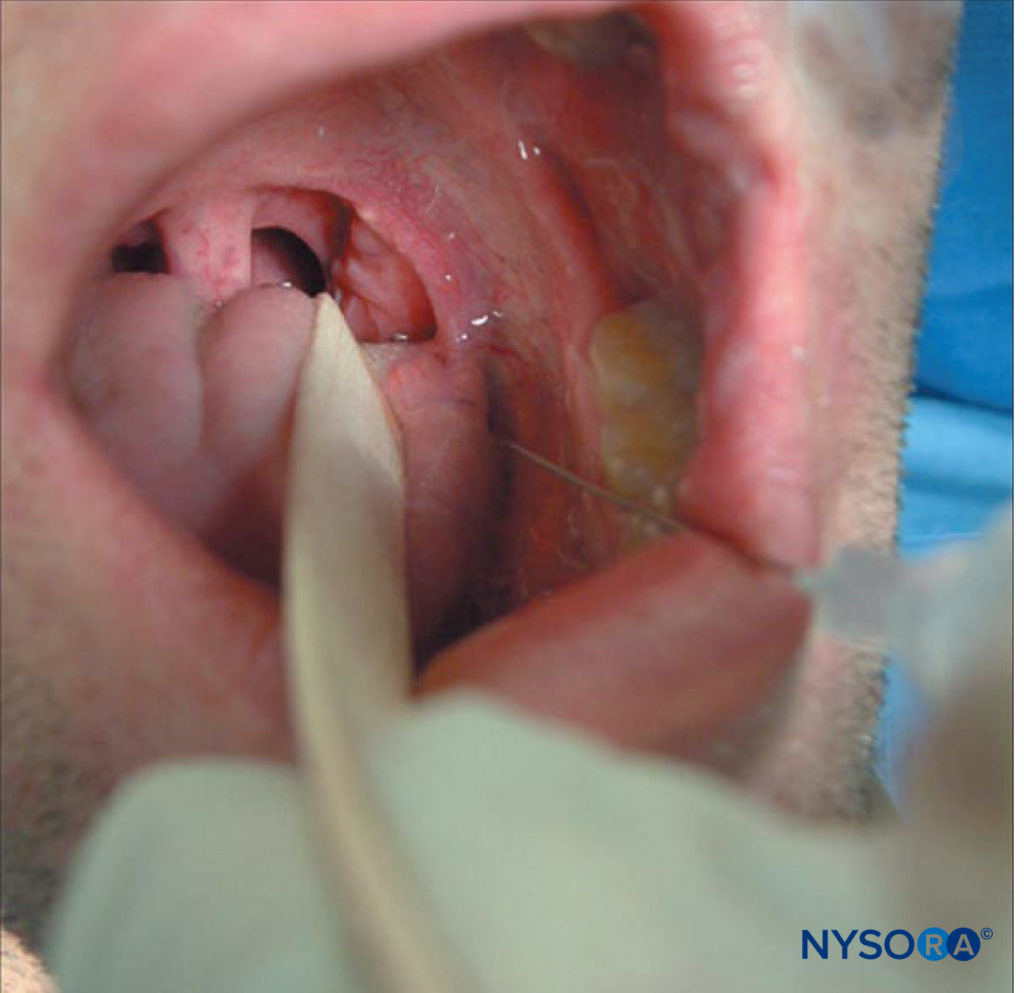
FIGURA 8. Bloqueo del nervio glosofaríngeo.
El paciente debe colocarse en posición supina con la cabeza en posición neutra. La apófisis estiloides se encuentra en el punto medio de una línea trazada desde el ángulo de la mandíbula hasta la punta de la apófisis mastoides. Se puede palpar con presión profunda, pero esto puede resultar incómodo para el paciente; se inserta una aguja perpendicular a la piel, con el objetivo de golpear el proceso estiloides. Una vez que se ha hecho contacto (generalmente de 1 a 2 cm de profundidad), la aguja debe reorientarse hacia atrás y alejarse de la apófisis estiloides hasta que se pierda el contacto, luego se pueden inyectar 5 a 7 ml de lidocaína al 2% después de la aspiración negativa. Esto luego se repite en el otro lado.
Consejos NYSORA
• El nervio glosofaríngeo se bloquea más fácilmente donde cruza el arco palatogloso.
• Puede bloquearse rociando anestésico local, aplicando gasas o compresas empapadas en anestésico local directamente sobre el nervio, o mediante inyección directa de anestésico local alrededor del nervio.
• Esto ayuda a abolir el reflejo nauseoso, pero este bloqueo por sí solo no proporcionará las condiciones adecuadas para la intubación con fibra óptica despierto.
Bloqueo del nervio laríngeo superior
El nervio laríngeo superior proporciona sensibilidad a las estructuras laríngeas por encima de las cuerdas vocales y se encuentra por debajo del asta mayor del hueso hioides; aquí, se divide en las ramas interna y externa. La rama interna luego penetra en la membrana tirohioidea alrededor de 2 a 4 mm por debajo del cuerno mayor, continuando submucosamente en el receso piriforme.Figura 9 y XNUMX y Figura 10 y XNUMX). La rama externa no penetra la membrana tirohioidea; desciende sobre la laringe en profundidad hasta el músculo esternotiroideo. El nervio laríngeo superior se puede bloquear utilizando el abordaje externo o interno.
Para realizar el bloqueo mediante el abordaje externo, el paciente se coloca en decúbito supino y necesitará cierto grado de extensión del cuello para facilitar la identificación del hueso hioides.
Una vez identificado, el hueso hioides se desplaza suavemente hacia el lado donde se realizará el bloqueo y se inserta una aguja de calibre 25 desde el lado lateral del cuello, apuntando hacia el cuerno mayor.
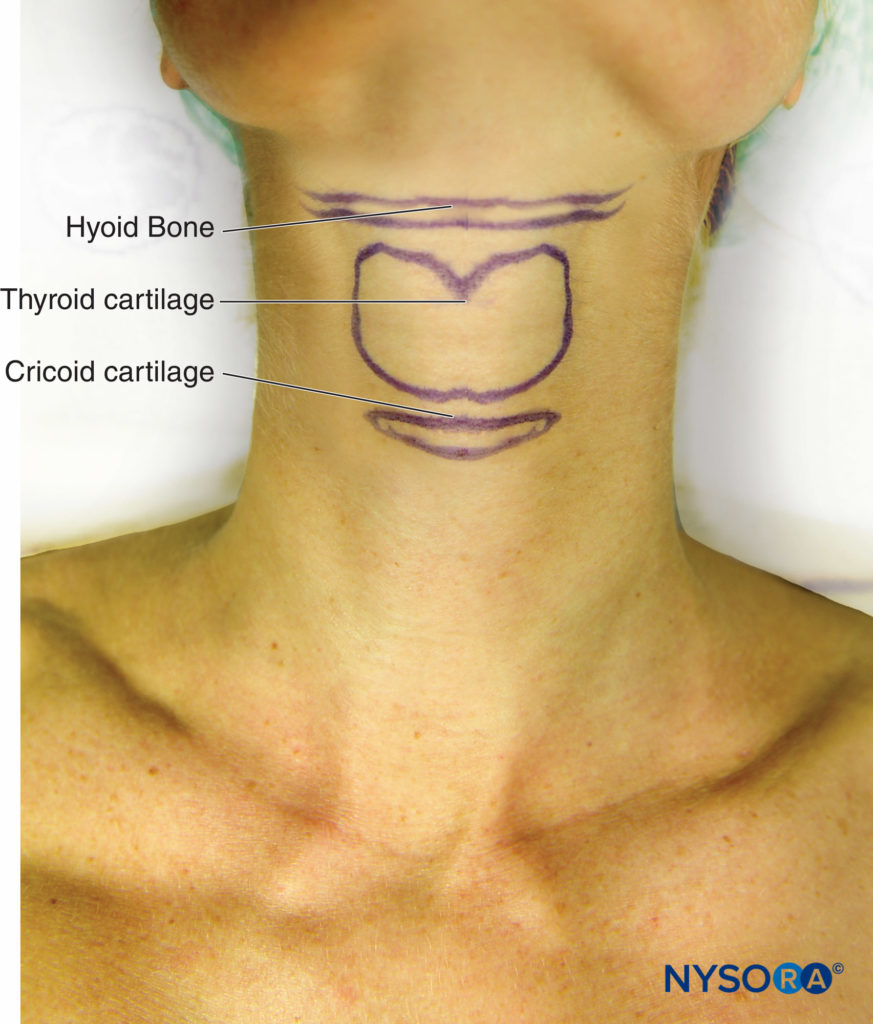
FIGURA 9. Anatomía superficial del hueso hioides, tiroides y cartílagos cricoides.
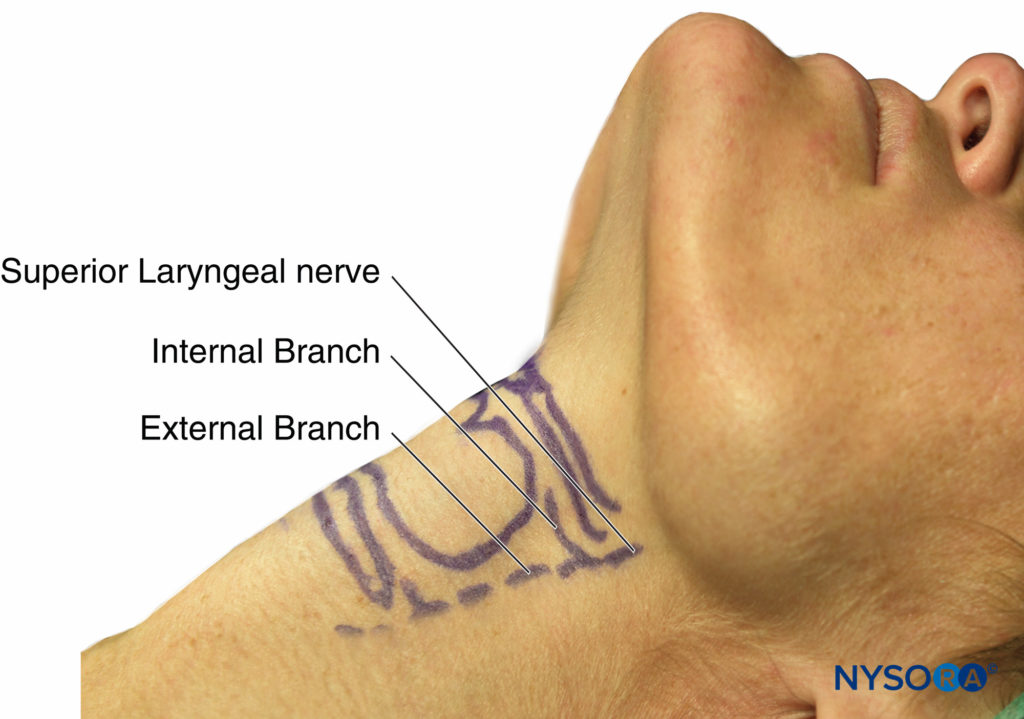
FIGURA 10. Anatomía de superficie del nervio laríngeo superior y ramas.
Una vez que se ha hecho contacto, la aguja se retira del hueso hacia abajo, y la inyección de 2 ml de lidocaína al 2% aquí bloqueará las ramas interna y externa del nervio laríngeo superior (Figura 11 y XNUMX). Si la aguja se avanza unos pocos milímetros, perforará la membrana tirohioidea y se sentirá un "cedimiento". Inyectar anestésico local aquí dará como resultado que solo se bloquee la rama interna del nervio laríngeo superior. Como con todos los bloqueos, se debe realizar una aspiración cuidadosa antes de la inyección, especialmente porque la arteria carótida está muy cerca.
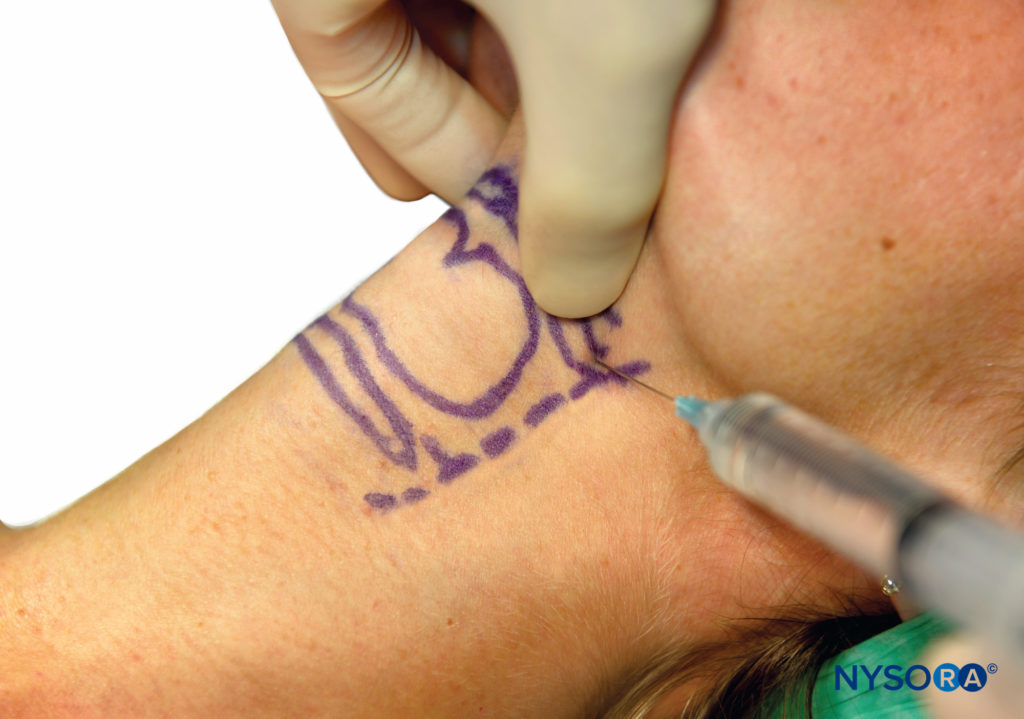
FIGURA 11. Bloqueo del nervio laríngeo superior.
Si es difícil identificar el hueso hioides, se puede identificar el asta superior del cartílago tiroides. Este se localiza identificando la escotadura tiroidea, trazando el borde superior hacia atrás hasta que se puede palpar el cuerno superior como una pequeña estructura redonda. Esto se encuentra justo por debajo del cuerno mayor del hueso hioides. La aguja puede ser insertada, apuntando al asta superior del cartílago tiroides, luego se camina cefálicamente, luego se inyecta anestesia local una vez que la aguja pierde contacto con el asta superior. Si se perfora la membrana tirohioidea, inyecte 2 ml de anestésico local aquí y otros 2 ml a medida que se retira la aguja; esto aumentará las posibilidades de que se bloqueen las ramas interna y externa del nervio laríngeo superior.
El abordaje interno utiliza gasas o compresas empapadas en anestésico local y se colocan en las fosas piriformes con unas pinzas de Krause. Estos deben mantenerse en su lugar durante 5 a 10 minutos para permitir suficiente tiempo para que el anestésico local haga efecto.
Bloqueo del nervio laríngeo recurrente
La inervación sensorial de las cuerdas vocales y la tráquea es suministrada por los nervios laríngeos recurrentes. Estos ascienden a lo largo del surco traqueoesofágico y también proporcionan el suministro motor a todos los músculos intrínsecos de la laringe excepto al músculo cricotiroideo. No se realizan bloqueos directos del nervio laríngeo recurrente, ya que pueden provocar parálisis bilateral de las cuerdas vocales y obstrucción de las vías respiratorias, ya que tanto las fibras motoras como las sensoriales corren juntas. Por lo tanto, este nervio se bloquea mediante el bloqueo translaríngeo.
Para realizar esto, el paciente debe estar en decúbito supino, con el cuello extendido identificarse en la línea media, luego se debe mover el dedo palpador en dirección caudal hasta palpar el cartílago cricoides. La membrana cricotiroidea se encuentra entre estas dos estructuras, inmediatamente por encima del cartílago cricoides. El pulgar y el tercer dígito de una mano deben estabilizar la tráquea al nivel del cartílago tiroides, luego se debe insertar una aguja de calibre 22 o 20 perpendicular a la piel con el objetivo de penetrar la membrana cricotiroidea (por encima del cartílago cricoides) (Figura 12 y XNUMX). Esto debe hacerse con aspiración continua de la jeringa, ya que la aparición de burbujas indicará que la punta de la aguja está ahora en la tráquea. En este punto, deje de avanzar inmediatamente la aguja; de lo contrario, se puede perforar la pared laríngea posterior. La inyección rápida (y luego la extracción de la aguja) de 5 ml de lidocaína al 4% provocará tos, lo que ayudará a dispersar el anestésico local y bloquear el nervio laríngeo recurrente.
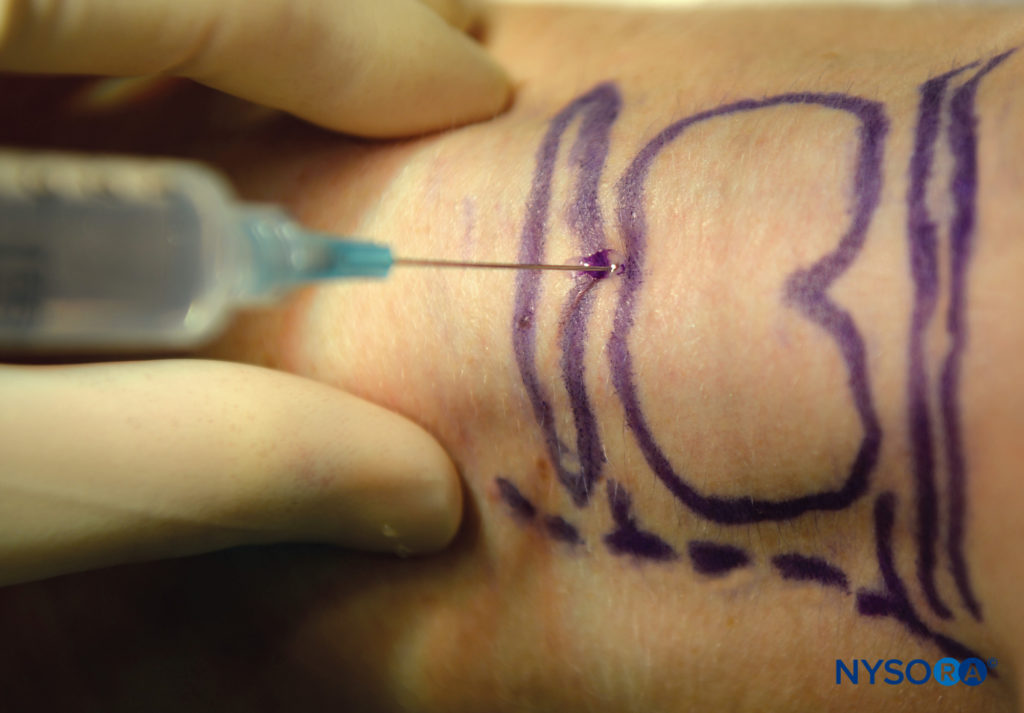
FIGURA 12. Bloqueo translaríngeo.
Consejos NYSORA
• La posición adecuada del paciente ayudará a identificar correctamente los cartílagos cricoides y tiroides y la membrana cricotiroidea.
• El cuello debe estar extendido, lo que hace que estas estructuras sean más prominentes.
• Colocar una bolsa de un litro de líquidos de infusión entre los omoplatos puede ayudar a lograr esta posición.
Técnicas Guiadas por Ultrasonido
Ultrasonido se puede utilizar para ayudar a aumentar la tasa de éxito de realizar algunos de los bloques descritos (Tabla 2). La ecografía puede aumentar la precisión del depósito del anestésico local alrededor del cuerno mayor del hueso hioides para el bloqueo del nervio laríngeo superior y puede utilizarse para identificar la membrana cricotiroidea para los bloqueos translaríngeos.
TABLA 2. Estructuras que se pueden identificar en la ecografía.
| Hueso hioides Cartílago tiroideo Membrana tirohioidea Arteria laríngea superior Nervio laríngeo superior |
Bloqueo del nervio laríngeo superior
A veces, puede ser difícil identificar los puntos de referencia (p. ej., en pacientes obesos) al intentar realizar este bloqueo. Por lo tanto, se puede utilizar el ultrasonido para facilitar el depósito del anestésico local en el lugar correcto. El hueso hioides se puede visualizar en la ecografía (Figura 13 y XNUMX), y se puede utilizar una técnica en el plano para depositar anestésico local alrededor de la superficie del cuerno mayor del hueso hioides para lograr el bloqueo.
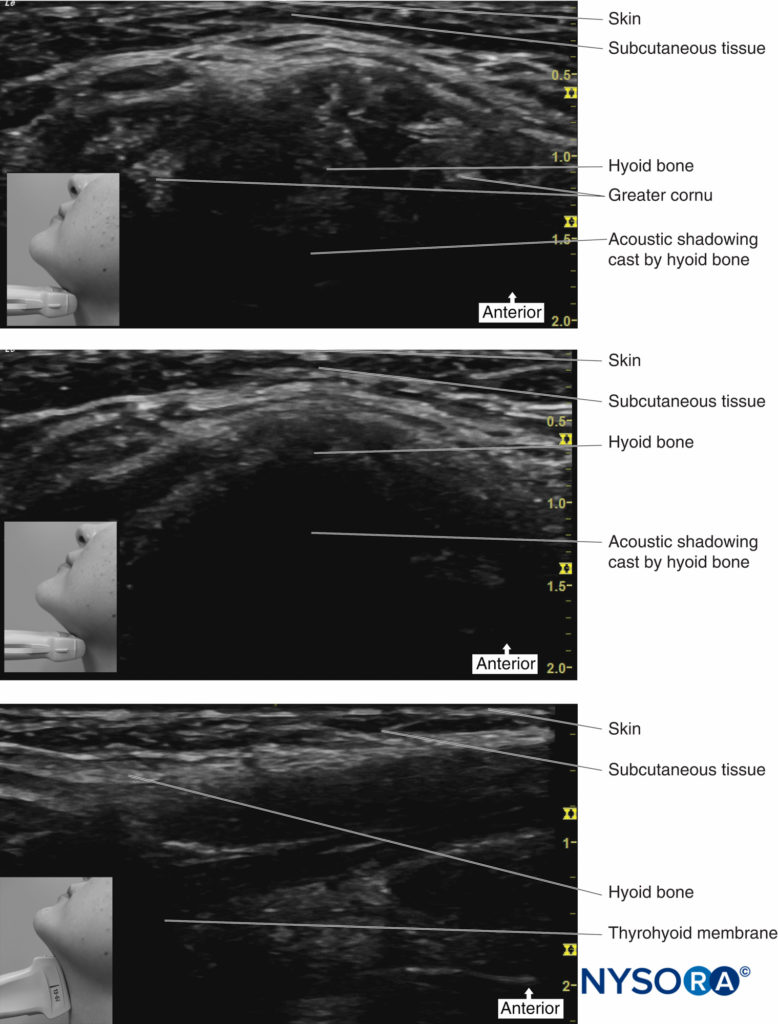
FIGURA 13. Imágenes de ultrasonido del hueso hioides.
Coloque la sonda del transductor en el plano sagital para identificar el cuerno mayor del hueso hioides; luego se gira el transductor transversalmente para identificar la cara lateral superior de la membrana tirohioidea. El nervio laríngeo superior puede verse superficial a la membrana tirohioidea cuando la cara medial de la sonda está girada cefálico. La rama interna del nervio laríngeo superior discurre junto con la arteria laríngea superior, justo por debajo del cuerno mayor del hueso hioides.
Un enfoque alternativo es identificar el hueso hioides, que aparece como una estructura brillante curvada hiperecogénica en la ecografía en la línea media. Si la sonda se mueve lateralmente, el asta mayor del hueso hioides puede verse como una estructura brillante medial a la arteria laríngea superior. La rama interna del nervio laríngeo superior discurre con la arteria laríngea superior justo por debajo del nivel del asta mayor del hueso hioides. Usando una técnica en el plano, se pasa una aguja perpendicular a la piel, apuntando justo debajo del cuerno mayor del hueso hioides.
Luego, se pueden inyectar 1-2 ml de anestésico local aquí después de la aspiración negativa (Figura 14 y XNUMX).
Se ha demostrado que esta técnica tiene una tasa de éxito de más del 90%. Se cree que el fracaso se debe a variaciones en la posición anatómica del nervio laríngeo superior en relación con el hueso hioides.
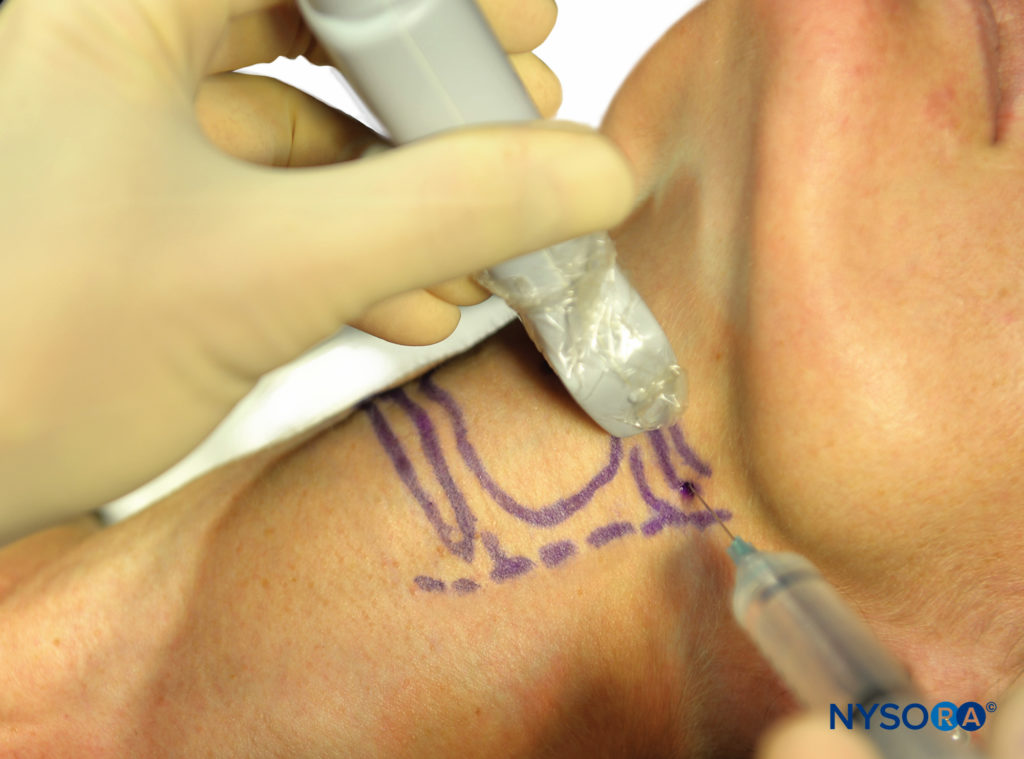
FIGURA 14. Bloqueo del nervio laríngeo superior guiado por ecografía.
Bloque translaríngeo
A veces, la ubicación correcta de la membrana cricotiroidea es difícil de identificar solo por palpación. La ecografía se puede utilizar para identificar los cartílagos tiroides y cricoides y la membrana cricotiroidea (Tabla 3), asegurando que el anestésico local se deposite correctamente y se logre un bloqueo translaríngeo exitoso19 (Figura 15 y XNUMX).
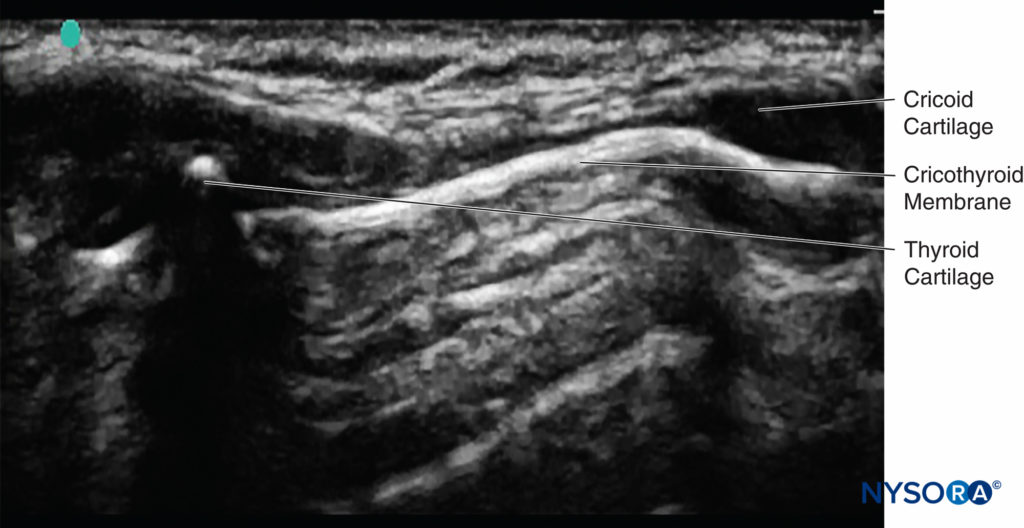
FIGURA 15. Imagen ecográfica de cartílago cricoides, cartílago tiroides, plano sagital y membrana cricotiroidea.
TABLA 3. Estructuras fácilmente identificables.
| anillos traqueales Cartílago cricoides Cartílago tiroideo Membrana cricotiroidea |
Si la sonda se coloca longitudinalmente en la línea media del cuello, se pueden ver los anillos traqueales. Si la sonda se hace avanzar cranealmente, el cartílago cricoides se puede ver a continuación; esta es una estructura ligeramente alargada que es más grande y más superficial que los anillos traqueales. Si la sonda avanza cranealmente, se puede ver el cartílago tiroides. La membrana cricotiroidea se encuentra entre el borde caudal del cartílago tiroides y el borde cefálico del cartílago cricoides. Mantenga la sonda en la línea media con la membrana cricotiroidea en el medio de la imagen que se ve en el monitor; luego, se puede marcar la ubicación exacta en el cuello del paciente con un rotulador. Ahora que se ha localizado la posición de la membrana cricotiroidea, se puede realizar el bloqueo translaríngeo.
El bloqueo también se puede realizar bajo ecografía en tiempo real simplemente inclinación la sonda desde la línea media hasta una posición parasagital, manteniendo el cartílago cricoides a la vista. El punto de entrada de la aguja debe estar justo craneal al cartílago cricoides y se puede ver en el monitor de ultrasonido (Figura 16 y XNUMX). Una vez que se aspira el aire, esto confirma que la aguja está a través de la membrana y en la tráquea.
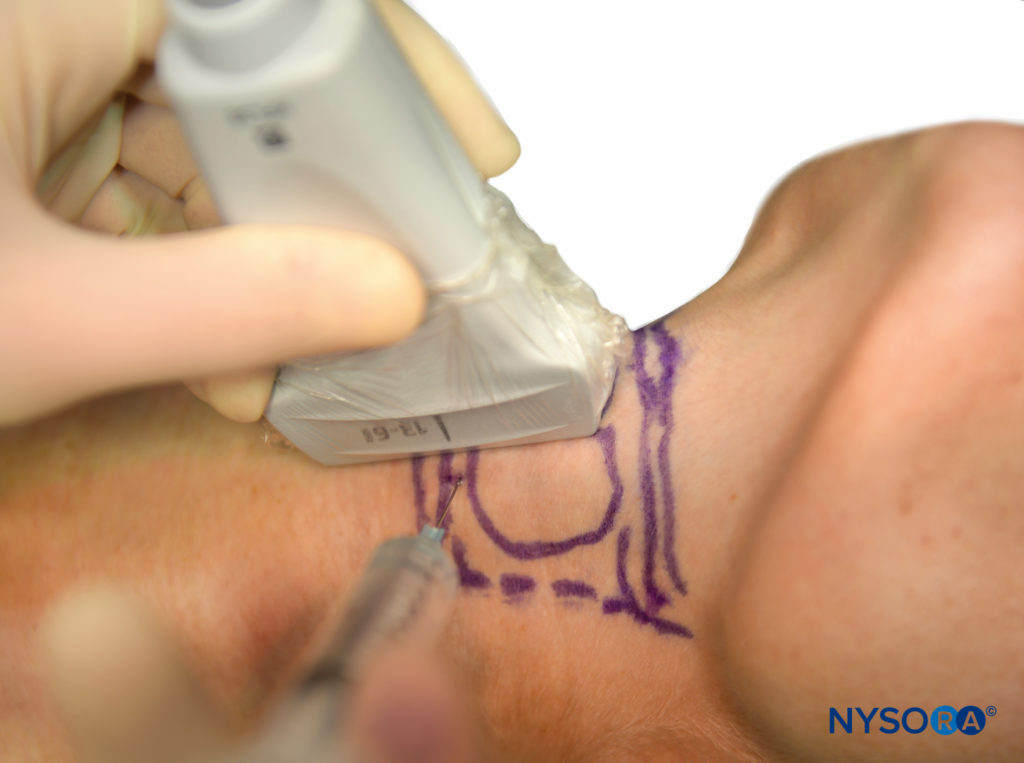
FIGURA 16. Bloqueo translaríngeo guiado por ultrasonido.
TÉCNICAS DE SEDACIÓN
La intubación endotraqueal despierto puede ser una experiencia desagradable para el paciente, incluso si se ha realizado una topicalización completa de las vías respiratorias. El objetivo de la sedación consciente no es solo permitir que el paciente tolere el procedimiento, sino también proporcionar condiciones óptimas de intubación.
Hay varias técnicas disponibles para lograr el nivel deseado de sedación; cualquiera que sea el uso, la prioridad es evitar la sobresedación del paciente. La sedación excesiva podría provocar que un paciente no responda con pérdida de las vías respiratorias, lo que podría tener consecuencias graves.
Las condiciones ideales de sedación implicarían un paciente cómodo que responda a los comandos con una vía aérea mantenida, respiración espontánea y cierto grado de amnesia.Tabla 4).
Dos fármacos se están volviendo cada vez más populares y cada vez hay más pruebas que respaldan su uso para la sedación consciente: el remifentanilo y la dexmedetomidina.20 El remifentanilo es un opioide de acción ultracorta y la dexmedetomidina es un agonista α2 altamente selectivo (Tabla 5).
Se ha encontrado que el remifentanilo brinda buenas condiciones de intubación, se tolera bien y tiene puntajes altos de satisfacción del paciente, aunque hay una alta incidencia de retiro cuando se usa como agente solo. Los mejores resultados se observan cuando se utiliza una técnica de infusión controlada por objetivo (TCI).
TABLA 4. Condiciones ideales de sedación.
| Ansiólisis Amnesia Analgesia Supresión de los reflejos nauseoso y tusígeno Fácilmente valorable Efectos secundarios respiratorios mínimos Rápidamente reversible |
TABLA 5. Ejemplos de técnicas de sedación.
| Bolos de benzodiacepinas (p. ej., diazepam, midazolam) Bolos de opioides (p. ej., fentanilo, alfentanilo, morfina) Bolos de agonistas α2 (p. ej., clonidina, dexmedetomidina) Bolos de agentes anestésicos (propofol, ketamina) Combinación de agentes (p. ej., benzodiazepinas y opioides) Infusión intravenosa (propofol, remifentanilo, dexmedetomidina) Combinación de infusiones intravenosas (propofol y remifentanilo) |
La ventaja de la dexmedetomidina es que se logra un estado de sedación cooperativa; también tiene efectos antisialagogos. Existe evidencia de nivel 1 para respaldar su uso en buenas condiciones de intubación, tolerancia y satisfacción del paciente. Por lo general, se administra como un bolo lento durante 120 minutos, seguido de una infusión. Las benzodiacepinas generalmente se administran en combinación con un opioide en bolos intermitentes y se han usado como sedantes para la intubación con fibra óptica despierto. La desventaja de usar bolos de benzodiazepinas es que los bolos intermitentes se asocian con exceso; por lo tanto, existe el riesgo de sobresedación y apnea.
El propofol se puede administrar en bolos intermitentes o en infusión. Ambas técnicas han demostrado ser seguras y bien toleradas por los pacientes. En la actualidad, existe una creciente popularidad de la administración de propofol como TCI, ya sea como agente único o en combinación con remifentanilo. Cualquiera que sea la técnica que se utilice, es importante mantener un equilibrio entre un nivel adecuado de sedación y evitar la infradosificación o la sobredosis.
La combinación de propofol y remifentanilo TCI ha demostrado ser una técnica segura para la intubación con fibra óptica con efectos farmacodinámicos consistentes y permite un nivel de sedación más predecible.
Consejos NYSORA
• Se puede lograr una sedación segura administrando lentamente los medicamentos sedantes y comunicándose continuamente con el paciente.
• La monitorización del índice biespectral (BIS) también se puede utilizar para ayudar y guiar el nivel de sedación.
TÉCNICA PREFERIDA POR EL AUTOR PARA REALIZAR UNA INTUBACIÓN CON FIBRA ÓPTICA DESPIERTO
Existen numerosas técnicas disponibles para realizar la intubación con fibra óptica despierto. A continuación se describe una técnica bien aceptada y exitosa que utilizo regularmente:
- Siéntese al paciente tan erguido como sea tolerable.
- Administre oxígeno suplementario (a través de una máscara de Hudson o cánulas nasales).
- Adjuntar seguimiento completo.
- Iniciar infusión de TCI de remifentanilo (1-3 ng/mL) y propofol (0.5-1 μg/mL). No administre una dosis en bolo. Titular la dosis de acuerdo con el nivel de sedación del paciente.
- Comience a topicalizar la nasofaringe con solución de Moffett rociada a través de MAD.
- Topicalizar la orofaringe con lidocaína al 4% usando un MAD.
- Después de la topicalización, aspire las secreciones con un catéter de succión suave; esto también prueba la efectividad del anestésico local.
- Si el paciente no tolera el catéter de succión, rocíe la orofaringe con 2 a 4 aplicaciones de lidocaína al 10 %.
- Precargue el fibroscopio con un tubo endotraqueal nasal (ETT) (diámetro exterior de tamaño 6/6.5 [OD]).
- Inicie la fibroscopia a través de la nasofaringe y visualice las cuerdas vocales.
- Pase el fibroscopio en la tráquea.
- “Deslice” el ETT lubricado sobre el endoscopio suavemente hacia la tráquea, tratando de no tocar la carina con el fibroscopio.
- Confirme la colocación correcta del ETT visualizando la carina y el ETT.
- Conecte el TET al circuito anestésico y capnografía.
- Infle suavemente el manguito del TET.
- Sujete el TET hasta que esté asegurado de forma segura.
- Ahora es seguro anestesiar al paciente.
RESUMEN
Para realizar con éxito la intubación despierto en un paciente con una vía aérea difícil anticipada, es importante que comprenda y sea competente en todo lo siguiente:
- Inervación de la vía aérea superior
- Conocimiento de técnicas apropiadas de anestesia local y drogas vasoconstrictoras
- Técnicas disponibles para topicalizar/anestesiar la vía aérea superior
- Técnicas prudentes de sedación
- Técnicas de oxigenación durante el procedimiento
- Técnicas utilizadas para la correcta colocación del tubo endotraqueal
Esto permitirá una intubación despierto segura, sin estrés y exitosa con altos niveles de satisfacción del paciente.
Referencias
- Cheney FW, Posner KL, Caplan RA: eventos respiratorios adversos que con poca frecuencia conducen a demandas por mala praxis. Un análisis de siniestros cerrados. Anestesiología 1991;75:932–939.
- Cheney FW, Posner KL, Lee LA, Caplan RA, Domino KB: Tendencias en la muerte y el daño cerebral relacionados con la anestesia: un análisis de reclamos cerrados. Anestesiología 2006;105:1081–1086.
- Popat M (editor). Manejo de la Vía Aérea Difícil. Prensa de la Universidad de Oxford, 2009.
- Rose DK, Cohen MM: La vía aérea: Problemas y predicciones en 18,500 pacientes. Can J Anaesth 1994;41:372–383.
- Benjamin E, Wong DK, Choa D: Solución de "Moffett": una revisión de la evidencia y la base científica para la preparación tópica de la nariz. Clin Otolaryngol Allied Sci 2004;29(6):582–587.
- Simmons ST, Schleich AR: Anestesia regional de las vías respiratorias para la intubación con fibra óptica despierto. Reg Anesth Pain Med 2002;27:180–192.
- Curran J, Hamilton C, Taylor T: Analgesia tópica antes de la intubación traqueal. Anestesia 1975;30:765–768.
- Morris IR: intubación de fibra óptica. Can J Anaesth 1994;41:996–1008.
- Vloka JD, Hadzic A, Kitain E: Una adaptación simple a los broncoscopios de fibra óptica Olympus LF1 y LF2 para la instilación de anestésico local.
Anestesiología 1995;82:792. - Furlan JC: Estudio anatómico aplicado a la técnica de bloqueo anestésico del nervio laríngeo superior. Acta Anaesthesiol Scand 2002;46:199–202.
- Wheatley JR, Brancatisano A, Engel LA: Actividad relacionada con la respiración del músculo cricotiroideo en humanos normales despiertos. J Appl Physiol 1991;70:2226–2232.
- Curran J, Hamilton C, Taylor T: Analgesia tópica antes de la intubación traqueal. Anestesia 1975;30:765–768.
- Tsui BC, Dillane D: Finucane. Bloqueo neural para cirugía de cuello y cabeza: aplicaciones clínicas. En: Primos MJ, Bridenbaugh PO, Carr D,
et al (editores). Bloqueo neural de Cousin y Bridenbaugh en anestesia clínica y manejo del dolor, 4ª ed. Lippincott Williams y Wilkins; 2008:479-491. - Green JS, Tsui BCH: Aplicaciones de la ultrasonografía en ENT: evaluación de las vías respiratorias y bloqueo nervioso. Anestesiología Clin 2010;28:541–553.
- Singh M, Chin KJ, Chan VWS, Wong DT, Prasad GA, Yu E: Uso de la ecografía para la evaluación de las vías respiratorias. Un estudio observacional. J Ultrasonido Med 2010;29:79–85.
- Kristensen MS: Ultrasonografía en el manejo de la vía aérea. Acta Anaesthesiol Scand 2011;55:1155–1173.
- Manikandan S, Neema PK, Rathod RC: Bloqueo del nervio laríngeo superior bilateral guiado por ultrasonido para ayudar a la intubación endotraqueal despierto en un paciente con enfermedad de la columna cervical para cirugía de emergencia. Anaesth Cuidados Intensivos 2010;38:946–948.
- Kaur B, Tang R, Sawka A, Krebs C, Vaghadia H: un método para la visualización ultrasonográfica y la inyección del nervio laríngeo superior: estudio de voluntarios y simulación de cadáveres. Anaesth Analg 2012;115(5):1242–1245.
- De Oliveira GS Jr, Fitzgerald P, Kendall M: bloqueo translaríngeo asistido por ultrasonido para la intubación con fibra óptica despierto. Can J Anesth/J Can Anesth 2011;58:664–665.
- Johnson KD, Rai MR; Sedación consciente para la intubación con fibra óptica despierto: una revisión de la literatura. Can J Anaesth 2013;60(6):584–599.
- Rai MR, Parry TM, Dombrovskis A, Warner OJ: Infusión controlada por objetivo de remifentanilo frente a infusión controlada por objetivo de propofol para la sedación consciente para la intubación con fibra óptica despierto: un ensayo controlado aleatorio doble rubio. Hermano J Anaesth 2008;100:125–130.
- Puchner W, Egger P, Punringer F, Lockinger A, Obwegeser J, Gombotz H: Evaluación del remifentanilo como fármaco único para la intubación con fibra óptica despierto. Acta Anaesthesiol Scand 2002;46:350–354.
- Mingo OH, Ashpole KJ, Irving CJ, Rucklidge MW: Sedación con remifentanilo para la intubación con fibra óptica despierto con aplicación limitada de anestésico local en pacientes para cirugía electiva de cabeza y cuello. Anestesia 2008;63:1065–1069.
- Maroof M, Khan RM, Jain D, Ashraf M: La dexmedetomidina es un complemento útil para la intubación despierto. Can J. Anesth 2005;52:776–777.
- Unger RJ, Gallagher CJ: Sedación con dexmedetomidina para la intubación con fibra óptica despierto. Semin Anesth Perioper Med Pain 2006;25:65–70.
- Bergese SD, Khabiri B, Roberts WD, Howie MB, McSweeney TD, Gerhardt MA: Dexmedetomidina para la sedación consciente en casos difíciles de intubación con fibra óptica despierto. J Clin Anesth 2007;19:141–144.
- Sidhu VS, Whitehead EM, Ainsworth QP, Smith M, Calder I: Una técnica para la intubación con fibra óptica despierto. Experiencia en pacientes con patología de columna cervical. Anestesia 1993;48:910–913.
- JooHS, Kapoor S, Rose DK, Naik VN: Intubación de las vías respiratorias con mascarilla laríngea después de la inducción de la anestesia versus intubación con fibra óptica despierto en pacientes con vías respiratorias difíciles. Anesth Analg 2001;92:1342–1346.
- Lallo A, Billard V, Bourgain JL: Una comparación de infusiones controladas por objetivo de propofol y remifentanilo para facilitar la intubación nasotraqueal con fibra óptica. Anesth Analg 2009;108:852–857.

