Kenneth D. Candido, Anthony R. Tharian y Alon P. Winnie
INTRODUCCIÓN
La técnica de anestesia regional intravenosa (IVRA), o “bloque de Bier”, fue introducida por primera vez en 1908 por el cirujano alemán August Bier. Un bloqueo de Bier consiste esencialmente en inyectar soluciones anestésicas locales en el sistema venoso de una extremidad superior o inferior que ha sido desangrado por compresión o gravedad y que ha sido aislado mediante un torniquete de la circulación central. En la técnica original de Bier, el anestésico local procaína en concentraciones de 0.25% a 0.5% se inyectaba a través de una cánula intravenosa, que se había colocado entre dos vendajes de Esmarch utilizados como torniquetes para dividir el brazo en componentes proximal y distal. Después de inyectar el anestésico local, Bier notó dos tipos distintos de anestesia: un inicio casi inmediato de anestesia "directa" entre los dos torniquetes y luego, después de un retraso de 5 a 7 minutos, una anestesia "indirecta" distal al colocado distalmente. torniquete. Al realizar disecciones del sistema venoso de la extremidad superior en cadáveres después de inyectar azul de metileno, Bier pudo determinar que la anestesia directa era el resultado de la anestesia local que bañaba las terminaciones nerviosas desnudas en los tejidos, mientras que la anestesia indirecta probablemente se debía a la anestesia local se transporta a la sustancia de los nervios a través de los vasa nervorum, donde se produce un bloqueo de conducción típico. La conclusión de Bier fue que dos mecanismos de anestesia estaban asociados con esta técnica: bloqueo de infiltración periférica y bloqueo de conducción. La técnica, como la describió originalmente Bier, permanece esencialmente sin cambios en la práctica moderna durante los últimos 106 años, excepto por la introducción de la preparación de doble torniquete de tipo neumático que se usa en la práctica clínica actual (Figura 1 y XNUMX).
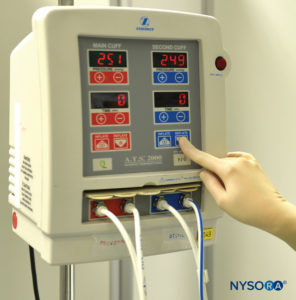
FIGURA 1.Sistema de torniquete neumático doble para uso en anestesia regional intravenosa de la extremidad superior o inferior.
Un bloque de Bier se puede utilizar para procedimientos quirúrgicos breves o manipulaciones de la extremidad superior o inferior. Sin embargo, la técnica ha encontrado su mayor aceptación para su uso en las extremidades superiores debido a que los problemas con los torniquetes y otros problemas de seguridad parecen surgir con mayor frecuencia cuando se utiliza la IVRA en las extremidades inferiores. El bloqueo de Bier también es un procedimiento que ha encontrado utilidad como complemento del tratamiento para pacientes que padecen síndromes de dolor regional complejo (SDRC) (anteriormente conocido como distrofia simpática refleja, con dolor simpático mantenido) como una alternativa a los bloqueos repetidos de ganglios simpáticos. En este sentido, se ha demostrado que la IVRA disminuye la inflamación neurogénica, un fenómeno posiblemente asociado con el SDRC, con poco deterioro de la función sensorial, al menos cuando la mepivacaína es el anestésico local elegido para el bloqueo. La sensibilidad al frío disminuye significativamente de 10 a 30 minutos después del bloqueo, incluso con una reducción de la temperatura de la piel en el lado bloqueado.
La simpatectomía química con IVRA con agentes como guanetidina o bretilio puede durar hasta 5 días, en comparación con los bloqueos anestésicos locales, que generalmente brindan analgesia que dura solo varias horas. Las pruebas sensoriales cuantitativas (QSART, prueba cuantitativa del reflejo del axón sudomotor) antes y después de tales bloqueos demostraron que es posible predecir qué pacientes tendrán un alivio duradero del dolor usando bloqueos IVRA con guanetidina después de una lesión traumática o cirugía.
Aunque la IVRA es un método seguro y eficaz para administrar anestésicos locales para el bloqueo de las extremidades, tanto para la cirugía como para el control del dolor, una gran encuesta publicada señaló que la mayoría de los residentes de anestesia de tercer año (CA-3) habían realizado menos de 10 bloqueos de este tipo durante todo el curso de su formación.
ANATOMÍA
La única anatomía relevante es la ubicación y distribución de las venas de la mano, de la fosa antecubital y de la región del pie y el tobillo.
INDICACIONES
La extremidad superior
La anestesia regional intravenosa con anestésico local, más comúnmente lidocaína al 0.5%–1% (prilocaína al 1% en Europa), es apropiada para cirugía y manipulación de las extremidades que requieren anestesia de hasta 1 hora de duración. Es más adecuado para operaciones periféricas de tejidos blandos, como ganglionectomía, liberación del túnel carpiano, cirugía de contractura de Dupuytren o reducción de fracturas. Sin embargo, la necesidad de desangrar la extremidad con un vendaje de Esmarch, una maniobra potencialmente dolorosa, puede impedir que se realicen ciertos procedimientos con esta técnica (Figura 2 y XNUMX y Figura 3 y XNUMX).
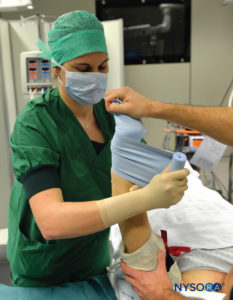
FIGURA 2.Inicio del proceso de exanguinación de la extremidad superior izquierda elevada utilizando un vendaje Esmarch bien envuelto desde la mano distal hasta la extremidad superior proximal en la base del torniquete distal.
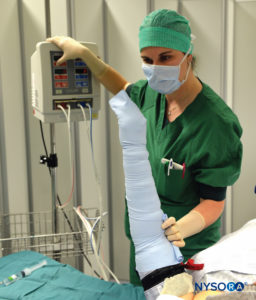
FIGURA 3. Manteniendo el vendaje de Esmarch bien envuelto, primero los torniquetes distales y luego proximales están a 50-100 mm Hg por encima de la presión arterial sistólica.
Asimismo, las manipulaciones de los nervios cubital, mediano o radial pueden causar parestesias, lo que puede requerir el uso de analgésicos o sedantes parenterales adyuvantes. Un uso novedoso de IVRA es para anestesiar la mano antes de inyectar la toxina botulínica A (BTX-A) para el tratamiento de la hiperhidrosis. BTX-A reduce significativamente la producción de sudor, medida por la prueba de Minor y cuantificada por el análisis del corneómetro, pero la inyección es dolorosa a menos que la mano esté anestesiada de antemano; Se ha encontrado que IVRA es adecuado para este propósito. Según un estudio reciente, no hubo diferencia en el grado y la duración de la analgesia entre ARIV y bloqueo del ganglio estrellado (SGB) usando una combinación de 70 mg de lidocaína y 30 μg de clonidina en pacientes con SDRC tipo 1 que afecta a las extremidades superiores. El estudio concluyó que IVRA era preferible a SGB en este entorno debido a su menor riesgo de efectos secundarios indeseables y su ejecución más fácil que SGB.
La IVRA de la extremidad superior se ha utilizado ocasionalmente para analgesia/anestesia prolongada (es decir, cirugías que se espera que duren más de 1 hora), con un período obligatorio de desinflado del torniquete de al menos 1 minuto antes de restablecer el estado anestesiado.
Extremidad baja
La anestesia regional intravenosa se puede usar para intervenciones quirúrgicas breves de la extremidad inferior de manera análoga a la descrita para la cirugía de la extremidad superior. Los procedimientos quirúrgicos que se pueden completar con este enfoque incluyen la escisión de una masa; reparación de nervios digitales; cirugía de fractura/dislocación de falange; y escisión del navicular accesorio. Cualquier procedimiento ortopédico de pie, tobillo o extremidad inferior distal que requiera aproximadamente 45 minutos o menos para completarse puede ser apto para esta modalidad.
Aunque la IVRA se ha asociado con una mayor incidencia de síndrome compartimental en el tratamiento de fracturas de la diáfisis tibial y, por lo tanto, se ha considerado contraindicado en tales casos, un estudio en voluntarios no mostró diferencias significativas en las presiones tisulares antes y después de inflar el torniquete, independientemente del volumen de solución salina utilizada (≤1.5 ml/kg) o en función de tiempo después de la inyección de solución salina durante el inflado del torniquete. Los autores concluyeron que, en la extremidad atraumática normal, la IVRA simulada con solución salina normal (NS) no aumenta la presión tisular dentro del compartimento anterior de la pierna.
Pediatría
La anestesia regional intravenosa ha sido una opción aceptable en pacientes pediátricos seleccionados para la reducción de fracturas de la extremidad superior. Un estudio retrospectivo que comparó la IVRA y la sedación consciente para la reducción de las fracturas pediátricas del antebrazo encontró que la IVRA es un método seguro, eficiente y rentable para reducir las fracturas pediátricas del antebrazo. Hubo 600 pacientes en el grupo IVRA y 645 pacientes en el grupo de sedación consciente. Ningún paciente experimentó síndrome compartimental o necesidad de reingreso secundario a la aplicación de yeso. 28 pacientes (4.34 %) en el grupo de sedación para procedimientos y 13 pacientes (2.16 %) en el grupo de IVRA necesitaron alguna intervención en el yeso debido a la tensión.
CONTRAINDICACIONES
La única contraindicación absoluta para la IVRA es la negativa del paciente. Las contraindicaciones relativas incluyen las siguientes:
• Lesiones por aplastamiento de una extremidad
• Incapacidad para localizar venas periféricas
• Infecciones cutáneas locales
• Celulitis
• Fracturas compuestas
• Pacientes con antecedentes convincentes de alergia a los anestésicos locales
• Pacientes con lesiones vasculares graves en la extremidad
• Derivaciones arteriovenosas vasculares preexistentes y pacientes en los que un torniquete no es adecuado (es decir, pacientes con enfermedad vascular periférica grave)
• Enfermedad de célula falciforme
• La cirugía planificada para más de 1 hora no suele ser una buena indicación para la anestesia regional IV debido a la aparición de dolor por torniquete.

Del Compendio de Anestesia Regional: Anestesia regional intravenosa (IVRA, Bier block): mecanismo de acción, indicaciones y contraindicaciones infografía.
EQUIPO
Figura 1 y XNUMX a Figura 8 y XNUMX mostrar el equipo utilizado en IVRA
1. Agentes anestésicos locales: lidocaína HCl, 0.25%–0.1% (la alternativa es prilocaína, 0.5%)
2. Un torniquete de goma (drenaje Penrose) de 12 a 18 pulg. de largo (30 a 45 cm) y 7/8 pulg. de ancho (2.3 cm) para usar antes de colocar la cánula intravenosa
3. Un extracatéter intravenoso de calibre 20 o 22 (catéter sobre aguja) (Figura 5 y XNUMX)
4. Una bolsa de 500 ml o 1 l de solución intravenosa conectada a un equipo de infusión (en lugar de un dispositivo hep lock) que se conectará a la cánula intravenosa para mantener su permeabilidad hasta que se inyecte la solución anestésica en la extremidad aislada (puede sustituir un puerto intravenoso lavado con solución salina en su lugar)
5. Monitores estándar de la Sociedad Estadounidense de Anestesiólogos (ASA) (electrocardiógrafo, presión arterial, oxímetro de pulso)
6. Equipo de reanimación (catéter intravenoso, solución cristaloide y equipo de infusión para la extremidad superior contralateral) (para IVRA de la extremidad superior)
7. Dos torniquetes neumáticos de tamaño apropiado para la extremidad seleccionada (Figuras 6 y 9)
8. Un vendaje Esmarch de 60 pulgadas de largo (152 cm) y 4 pulgadas de ancho (10 cm) para desangrar el brazo (Figuras 2, 3, y 7)
9. Set preparatorio de piel estéril
10. Una jeringa Luer lock de 30 o 50 ml
11. Una taza de medir graduada para mezclar la solución, preferiblemente con una capacidad de 100 ml.
12. Cinta adhesiva, varios tamaños
Aprenda más sobre Equipos para Anestesia Regional.
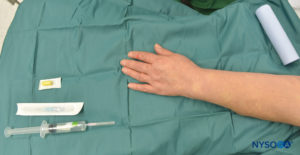
FIGURA 4. El equipo para IVRA consta de vendaje Esmarch, ampollas de anestésico local, torniquete de goma, extracatéter intravenoso (IV) (catéter sobre aguja), hisopos con alcohol y una jeringa para extraer el anestésico local.
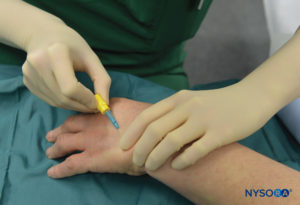
FIGURA 5.Cánula intravenosa y Hep-Lock colocados en una vena distal de la mano en preparación para IVRA.
PREPARACIÓN DEL PACIENTE
El paciente se acuesta en decúbito dorsal siempre que la vena seleccionada para la colocación sea fácilmente accesible. Se revisa el equipo de reanimación y se prueban y preparan los torniquetes neumáticos para su uso. Para la cirugía del codo, la aguja se colocará en el antebrazo o en la fosa antecubital. Para procedimientos en la mano o el antebrazo, lo mejor es seleccionar una vena en el dorso de la mano (Figura 5 y XNUMX).
Para los procedimientos de las extremidades inferiores, se elige una vena en el pie, el tobillo o la parte inferior de la pierna. Después de obtener un acceso intravenoso en una extremidad no operada (alternativamente, se puede asegurar un acceso venoso central), un complemento completo de monitores ASA se aplica y se evalúan los signos vitales basales. Si el paciente tiene dolor intenso, ahora se pueden administrar pequeñas alícuotas de analgésicos intravenosos (es decir, 1 a 2 μg/kg de fentanilo) para facilitar el proceso de exanguinación. Debido a que la cooperación total del paciente no es esencial para tener éxito, se pueden administrar como alternativa pequeñas dosis de benzodiacepinas solubles en agua (es decir, midazolam, 15 a 25 μg/kg) para la ansiolisis. Un beneficio importante de elegir una benzodiazepina es la supresión de la respuesta convulsiva asociada con la toxicidad del anestésico local, una preocupación válida en el paciente sometido a IVRA debido al gran volumen del agente que se administra directamente en el sistema vascular.
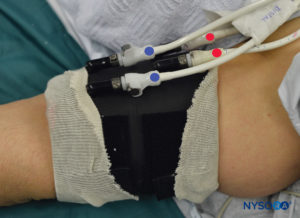
FIGURA 6. Torniquete proximal (ROJO) y distal (AZUL) claramente etiquetado del sistema de doble torniquete. El torniquete siempre se infla en el siguiente orden: Distal, Proximal. Una vez comprobada la funcionalidad, se desinfla el torniquete distal (AZUL).
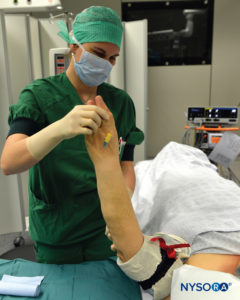
FIGURA 7. Elevación de la extremidad para permitir la exanguinación pasiva.
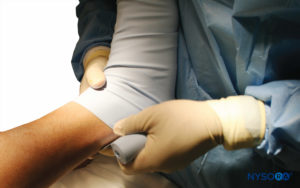
FIGURA 8. La extremidad inferior derecha elevada se envuelve con un vendaje de Esmarch apretado al torniquete.
TÉCNICA

Del Compendio de Anestesia Regional: Anestesia regional intravenosa (IVRA, Bier block): Técnica infográfica.
Extremidad Superior IVRA
La siguiente es la técnica para IVRA para procedimientos de extremidades superiores:
1. Se inserta un catéter de plástico permanente en una vena periférica tan lejos como sea posible bajo estrictas precauciones asépticas (Figura 5 y XNUMX).
2. Se coloca un torniquete neumático doble en el manguito proximal en la parte superior del brazo. (Figuras 6 y 7). Si bien, por convención, los torniquetes se colocan en el área del bíceps, un estudio encontró que la dosis de lidocaína se podía reducir casi a la mitad cuando el torniquete se colocaba en el antebrazo en lugar de en la parte superior del brazo. Veinte pacientes sometidos a cirugías de antebrazo y mano recibieron IVRA con una combinación de lidocaína 1.5 mg/kg y ketorolaco 0.15 mg/kg con un torniquete colocado en el antebrazo. Otros 20 pacientes sometidos a procedimientos similares recibieron IVRA con el doble de la dosis de los mismos medicamentos y con el torniquete colocado en la parte superior del brazo. La anestesia quirúrgica se evaluó como excelente en los 20 pacientes en el grupo de torniquete de brazo superior, mientras que se calificó como excelente en 19/20 pacientes en el grupo de torniquete de antebrazo. El inicio y la regresión del bloqueo sensorial fueron similares en ambos grupos. Un estudio reciente que comparó la colocación de torniquetes en el antebrazo (n = 28) con 8 ml de lidocaína al 2 % y 10 mg de ketorolaco y la colocación de torniquetes en la parte superior del brazo (n = 28) con 15 ml de lidocaína al 2 % y 20 mg de ketorolaco encontró que los pacientes en el antebrazo El grupo del torniquete experimentó menos molestias, menos intervenciones de sedación y una mayor probabilidad de pasar por alto la unidad de cuidados postanestésicos (PACU) en comparación con el grupo con el torniquete en la parte superior del brazo.
3. Se eleva todo el brazo para permitir la exanguinación pasiva. (Figura 7 y XNUMX), y se enrolla un vendaje de goma Esmarch alrededor del brazo en espiral desde las yemas de los dedos de la mano hasta el manguito distal del torniquete doble para desangrar el brazo (Figuras 2 y 3).
4. La arteria axilar se ocluye digitalmente, y mientras se mantiene la presión sobre él, el manguito neumático proximal se infla a 50-100 mm Hg por encima de la presión arterial sistólica, después de lo cual se retira el vendaje de Esmarch.
5. Después de inflar el manguito proximal y retirar el vendaje de Esmarch, se inyectan 30 a 50 ml de lidocaína HCl al 0.5 %. a través del catéter de plástico permanente, dependiendo el volumen del tamaño del brazo que se anestesia.
6. Hasta el nivel de la mesa de procedimientos, se retira la cánula intravenosa en la extremidad quirúrgica y se aplica presión rápidamente sobre el sitio con una gasa estéril.
7. Alrededor de 25 a 30 minutos después del inicio de la anestesia o cuando un paciente se queja de dolor con el torniquete, se infla el manguito distal y se desinfla el proximal. para minimizar el desarrollo del dolor del torniquete.
IVRA de extremidades inferiores
La única diferencia significativa en la IVRA para las extremidades superiores e inferiores es que la técnica IVRA para la extremidad inferior requiere volúmenes relativamente mayores de soluciones anestésicas locales en virtud de la evidente disparidad de tamaño entre las extremidades superiores e inferiores. Esto es necesario para llenar más completamente el compartimento vascular más grande de la extremidad inferior desde la cánula intravenosa colocada distalmente hasta el torniquete proximal (100 ml frente a 50 ml).
CONSIDERACIONES FARMACOLÓGICAS
Consideraciones anestésicas locales
La lidocaína es el anestésico local prototípico utilizado para IVRA en los Estados Unidos. En Europa, sin embargo, la prilocaína puede usarse con mayor frecuencia y, de hecho, ha sido objeto de la mayoría de los ensayos clínicos. Se han hecho intentos para maximizar la eficacia de la lidocaína mientras se minimizan los efectos secundarios o toxicidad del agente La alcalinización de lidocaína al 0.5 % (usando bicarbonato de sodio al 1.4 %) para IVRA se estudió en 31 pacientes. Los autores no encontraron ninguna ventaja clínica en la práctica de la alcalinización de la lidocaína con respecto al bloqueo sensorial, bloqueo motor o aparición de dolor posoperatorio. Cuando se comparó la lidocaína con la 2-cloroprocaína alcalinizada y no alcalinizada, ambas utilizadas en concentraciones del 0.5 % y utilizadas exclusivamente para cirugía de la mano, la cloroprocaína alcalinizada se comportó de manera similar a la lidocaína, pero la cloroprocaína simple no ofreció ningún beneficio y produjo más efectos secundarios que los observados con la lidocaína.
Otro estudio comparó la IVRA con lidocaína de baja concentración/alto volumen (0.5 % de concentración de 30–50 ml de lidocaína) y lidocaína de mayor concentración/bajo volumen (2 % de concentración de 12–15 ml de lidocaína) en pacientes sometidos a cirugía de las extremidades superiores mostró un inicio más rápido y una regresión tardía del bloqueo sensorial en el grupo de mayor concentración/bajo volumen. No hubo diferencias significativas en los datos hemodinámicos como la presión arterial sistólica y diastólica, la presión arterial media y la frecuencia cardíaca entre los dos grupos.
La lidocaína se comparó con la ropivacaína para la IVRA de las extremidades superiores en dos estudios separados. Se compararon dos dosis de ropivacaína (1.2 y 1.8 mg/kg) con una dosis de lidocaína (3.0 mg/kg) en 15 voluntarios. La recuperación del bloqueo sensorial y motor después de la liberación del torniquete fue más lenta con el grupo de ropivacaína en dosis altas. Más pacientes en el grupo de lidocaína (5 de 5) experimentaron mareos después de la liberación del torniquete, en comparación con solo 1 en el grupo de ropivacaína en dosis alta. En el segundo estudio, 51 pacientes fueron aleatorizados para recibir ropivacaína al 0.375 % o lidocaína al 0.5 % en un volumen de 0.4 ml/kg hasta 25 ml. La analgesia postoperatoria medida por la primera solicitud de analgésicos fue superior en el grupo de ropivacaína.
Se estudió la progresión del bloqueo sensorial en la mano después de ARIV con 20 ml de ropivacaína al 0.3% y un doble torniquete colocado en el antebrazo en 10 voluntarios sanos. El anestésico local se inyectó a través de un catéter intravenoso de calibre 22 colocado en una vena prominente en el dorso de la mano después de la exanguinación de la mano usando un vendaje Esmarch e inflando secuencialmente el torniquete distal a 150 mm Hg o 20 mm Hg por encima de la sangre sistólica. presión (la que fuera mayor) y el torniquete proximal a 250 mm Hg. Luego se desinfló el torniquete distal y se retiró el vendaje de Esmarch. Los valores de referencia para la sensación de frío y tacto se determinaron antes del bloqueo, y los valores actualizados se obtuvieron repetida y continuamente, comenzando 5 minutos después de la inyección del anestésico local y continuando hasta que se obtuvo la pérdida de sensibilidad en todas las áreas. Hubo una pérdida casi inmediata de la percepción del frío seguida de una extensión tardía y desigual de la pérdida de la sensación del tacto. La extensión inicial de la anestesia se notó tanto proximal como distalmente en el dorso de la mano y luego avanzó hacia las yemas de los dedos, con una extensión proximal tardía sobre la superficie palmar de la mano hasta la muñeca.
La prilocaína se ha comparado con la lidocaína, así como con otros anestésicos locales utilizados para IVRA. Al evaluar el inicio del bloqueo sensorial y motor, se compararon 40 ml de prilocaína al 0.5 % (100 mg) con el mismo volumen y la misma concentración de cloroprocaína en 10 voluntarios sometidos a IVRA. El inicio del bloqueo motor no difirió entre los grupos y la sensación se recuperó casi igualmente bien. Sin embargo, la recuperación de la función motora fue más breve en el grupo de prilocaína y más pacientes con cloroprocaína mostraron signos de irritación venosa o urticaria antecubital durante 30 a 45 minutos después de desinflar el torniquete. Los cambios en la frecuencia cardíaca también fueron más notables en el grupo de cloroprocaína. El mismo grupo de investigadores amplió su estudio para incluir 60 pacientes, 30 en cada uno de los grupos respectivos detallados anteriormente. Ahora, los investigadores encontraron que la recuperación completa del bloqueo sensorial fue más rápida en el grupo de prilocaína (7.1 frente a 9.8 minutos). De lo contrario, la incidencia de efectos secundarios siguió siendo mayor en el grupo de cloroprocaína.
A continuación, estos investigadores compararon prilocaína al 0.5 % con la misma concentración de articaína (un nuevo anestésico local de tipo aminoamida que contiene tiofeno y es farmacológicamente similar a la mepivacaína) para la IVRA de las extremidades superiores. Se consideró que la articaína, un potente anestésico local con un bajo grado de toxicidad en virtud de su rápido metabolismo con las esterasas, era una alternativa adecuada a la prilocaína. Diez voluntarios participaron en esta comparación cruzada doble ciego de los dos agentes.
No encontraron diferencias significativas entre los dos con respecto al inicio de la anestesia o el bloqueo motor o en la recuperación de la función sensorial o motora. Sin embargo, el 80 % de los sujetos experimentaron erupciones cutáneas después de recibir articaína, frente al 20 % en el grupo de prilocaína.
Cuando se comparó la prilocaína al 0.5% con las mismas concentraciones de articaína o lidocaína en tres grupos de 10 pacientes cada uno para IVRA, se encontró que el inicio del bloqueo sensorial fue significativamente más corto en el grupo de articaína, que también tuvo las concentraciones plasmáticas máximas más bajas de anestesia local después de la liberación del torniquete. La prilocaína simple al 1 % se comparó con el mismo anestésico local combinado con cuatro aditivos diferentes para IVRA: bupivacaína al 0.25 %, clonidina 150 μg, sufentanilo 25 μg o tenoxicam 20 mg. El grupo al que se añadió sufentanilo demostró el inicio más rápido del bloqueo sensorial; Las puntuaciones de dolor posoperatorio mejoraron al agregar clonidina o tenoxicam. De lo contrario, no hubo diferencias significativas entre los cinco grupos con respecto al inicio y la duración del bloqueo sensorial. A diferencia de la situación observada para la lidocaína con la adición de bicarbonato como adyuvante, la adición de bicarbonato a la prilocaína parece acortar el tiempo de inicio y prolongar la duración de la anestesia durante la IVRA.
Se ha estudiado el uso de mepivacaína para IVRA. Dieciséis pacientes fueron evaluados usando 1.4 mg/kg en 40 ml en total para IVRA versus bloqueos de solución salina realizados en los mismos individuos en el brazo contralateral. Se mantuvo la oclusión arterial durante 20 minutos. La hiperemia reactiva se atenuó en el brazo tratado con mepivacaína durante el período de evaluación de 60 minutos, lo que indica que la mepivacaína es un potente vasoconstrictor con una acción de larga duración. Este hallazgo tiene implicaciones para el uso de mepivacaína en personas con flujo sanguíneo comprometido en las extremidades superiores o con SDRC, para quienes probablemente no debería considerarse el anestésico local de elección.
El mismo grupo de estudio evaluó los efectos de la mepivacaína IVRA sobre el dolor quemante inducido por capsaicina intracutánea y sobre el flujo sanguíneo microvascular de la piel medido por Doppler imágenes de perfusión. La hiperemia reactiva fue menor en el brazo tratado con mepivacaína 10 minutos después de soltar el torniquete, y el área de la erupción fue menor después de la capsaicina en los brazos tratados con mepivacaína. Los autores concluyeron que la mepivacaína IVRA no tuvo efectos sobre la función sensorial posterior a la IVRA de las fibras aferentes delgadas, pero disminuyó diferencialmente la propagación de la llamarada inducida por capsaicina.
Consejos NYSORA
• La lidocaína es el fármaco prototípico utilizado para IVRA en los Estados Unidos; la prilocaína es la preferida en Europa.
• La alcalinización de la lidocaína confiere una ventaja mínima, si es que alguna, a la lidocaína comercial para IVRA.
• Las potentes propiedades vasoconstrictoras de la mepivacaína restan valor a su atractivo general como agente primario para la IVRA.
Adyuvantes a los anestésicos locales para IVRA
Se realizó una revisión sistemática de la literatura para evaluar el uso de complementos de los anestésicos locales para IVRA. Veintinueve estudios cumplieron los criterios de ser aleatorios, doble ciego y controlados. Se revisaron los datos de 1217 sujetos del estudio y los agentes estudiados incluyeron opioides (fentanilo, sufentanilo, meperidina y morfina); clonidina; relajantes musculares (atracurio, pancuronio, mivacurio); tramadol; agentes antiinflamatorios no esteroideos (AINE) (ketorolaco, tenoxicam, acetilsalicilato); alcalinización con bicarbonato de sodio; la adición de potasio; y alteraciones de temperatura. Los autores encontraron pruebas sólidas que respaldan el uso de AINE en general y de ketorolaco en particular para mejorar la analgesia posoperatoria y prolongar la tolerancia al torniquete durante la IVRA. Los opiáceos tuvieron malos resultados cuando se usaron para IVRA, y solo la meperidina en dosis de 30 mg o más mostró beneficios posoperatorios sustanciales a expensas de las náuseas, los vómitos y los mareos posteriores a la deflación. Los relajantes musculares mejoraron el bloqueo motor posoperatorio y fueron beneficiosos en la reducción de fracturas en las que la relajación muscular es imprescindible para obtener buenos resultados.
Agonistas alfa2 (clonidina y dexmedetomidina)
Se ha agregado clonidina tanto a la prilocaína como a la lidocaína como complemento de la IVRA para la cirugía de las extremidades. Cuando se agregaron 2 μg/kg a la prilocaína al 0.5 % de forma aleatoria y doble ciego en 56 pacientes sometidos a cirugía de las extremidades superiores, no hubo diferencias entre los grupos con respecto al inicio o la duración del bloqueo sensorial o motor. Los pacientes que recibieron clonidina tuvieron una reducción significativa en la presión arterial después de la liberación del torniquete (24%–48%), mientras que la frecuencia cardíaca permaneció sin cambios.
Los autores concluyeron que la clonidina tenía un beneficio limitado como complemento de los anestésicos locales.35 La adición de clonidina a la prilocaína suprimió drásticamente el dolor del torniquete, pero no alteró el dolor posoperatorio después de desinflarlo.
Se encontró que la clonidina no proporciona beneficios mensurables cuando se agrega a la lidocaína para IVRA en pacientes sometidos a liberación del túnel carpiano.
La dexmedetomidina es apropiadamente ocho veces más selectiva hacia los receptores adrenérgicos α que la clonidina. Como tal, se ha utilizado en IVRA para determinar si podría promover algunos de los hallazgos beneficiosos observados con este último agente. Treinta pacientes sometidos a cirugía de mano bajo IVRA recibieron lidocaína al 0.5% sola o lidocaína más dexmedetomidina 0.5 μg/kg.
El grupo de dexmedetomidina mostró un inicio más rápido del bloqueo sensorial y motor; recuperación prolongada del bloqueo sensorial y motor; tolerancia prolongada al torniquete; y mejoró la calidad de la analgesia en comparación con el grupo que recibió anestesia local solamente.
Un tiempo de inicio de bloqueo sensorial más corto; tiempos prolongados de recuperación del bloqueo sensorial y motor; duración prolongada de la analgesia para el torniquete; y analgesia posoperatoria prolongada en pacientes sometidos a IVRA con dexmedetomidina en otro estudio aleatorizado, doble ciego, que comparó los efectos de lornoxicam o dexmedetomidina en IVRA con prilocaína en pacientes sometidos a cirugía de mano o antebrazo. En este estudio, la IVRA se logró con 2 mg/kg de prilocaína al 3 % en el grupo de control (n = 25), 2 mg/kg de prilocaína al 3 % más 0.5 μg/kg de dexmedetomidina en el grupo de dexmedetomidina (n = 25), y prilocaína al 2% a 3 mg/kg más lornoxicam 8 mg en el grupo de lornoxicam (n = 25). En cada grupo, los fármacos se diluyeron con solución salina normal al 0.9 % hasta un volumen total de 40 ml.
Un estudio más reciente que comparó los efectos de la dexmedetomidina cuando se agregó a la lidocaína para IVRA y cuando se administró por vía parenteral como premedicación antes de IVRA encontró que ambos grupos habían mejorado de manera similar la calidad de la anestesia y la analgesia perioperatoria. Este estudio se realizó en pacientes sometidos a liberación del túnel carpiano distribuidos aleatoriamente en tres grupos.
La ARIV se realizó con 40 ml de lidocaína al 0.5 %. Se administró una dosis única de dexmedetomidina 0.5 μg/kg y placebo (solución salina) en un volumen total de 20 ml al grupo P (n = 15) y al grupo S (n = 15), respectivamente, antes de la ARIV. Se añadió dexmedetomidina a 0.5 μg/kg de lidocaína en el grupo A (n = 15) durante la IVRA. Se anotó el tiempo de aparición y recuperación del bloqueo sensitivo y motor, la escala analógica visual (EVA) intraoperatoria-postoperatoria, el puntaje de sedación de Ramsay (RSS), los requerimientos de analgésicos, las variables hemodinámicas y los efectos secundarios. Se encontró un tiempo de inicio y recuperación del bloqueo sensorial significativamente más corto en los grupos P y A, un tiempo de inicio de bloqueo motor más corto en el grupo P y puntuaciones VAS intraoperatorias y requisitos de analgésicos disminuidos en los grupos P y A. La RSS intraoperatoria en el grupo P y la RSS posoperatoria en los grupos P y A fueron más altas que en el grupo S. La frecuencia cardíaca intraoperatoria y posoperatoria y la presión arterial media (PAM) posoperatoria del grupo P fueron significativamente más bajas que en los grupos A y S, respectivamente.
Opioides
Debido a que se descubrió que existen receptores de opiáceos en el sistema nervioso periférico y con la demostración de que los opiáceos pueden producir una analgesia eficaz y duradera cuando se inyectan junto con anestésicos locales para el bloqueo del plexo braquial, varios investigadores han intentado disminuir el potencial de toxicidad de los fármacos locales. IVRA solo anestésico agregando opioides para reducir la concentración de lidocaína. Aunque no se ha demostrado que la adición de fentanilo a la lidocaína para la IVRA mejore la analgesia y reduzca los riesgos, la adición de fentanilo en dosis de 200 μg a la prilocaína al 0.5 % resultó en una analgesia más completa que en los pacientes que recibieron 100 μg. agregado, o cuando se usó prilocaína simple para IVRA. Las náuseas posoperatorias y los efectos secundarios en el sistema nervioso central fueron mayores en los grupos que recibieron fentanilo en comparación con los que recibieron anestesia local sola. Sin embargo, otros dos estudios encontraron que la adición de opioides a la prilocaína no mejoró el éxito de la técnica. Más investigación sobre los efectos de la adición de opiáceos a la prilocaína para IVRA puede resolver esta discrepancia en última instancia.
Algunos investigadores han descubierto que agregar opioides y relajantes musculares a la lidocaína al 0.25 % proporciona la misma analgesia y relajación muscular que proporciona la lidocaína al 0.5 % sola, al tiempo que reduce la probabilidad de toxicidad sistémica. Los adyuvantes agregados a la lidocaína incluyen 50 μg de fentanilo más 0.5 mg de pancuronio, fentanilo más rocuronio, fentanilo más D-tubocurarina y fentanilo más vecuronio. En cada caso, los autores informaron condiciones operativas sobresalientes y debido a que la concentración de lidocaína pudo reducirse al 0.20 % (es decir, más de la mitad de la normal utilizada), el potencial de toxicidad sistémica se redujo al menos a la mitad.
Cuando se utilizó meperidina al 0.25%, 40 ml (100 mg), como agente único para ARIV, se produjo un bloqueo motor completo, tan efectivo como el producido por la lidocaína. El inicio del bloqueo motor fue tan rápido o más rápido que el inicio del bloqueo sensorial en cada uno de los 15 pacientes de este grupo de estudio. Sin embargo, en comparación con la lidocaína simple en este estudio, hubo una mayor incidencia de mareos, náuseas y dolor en el lugar de la inyección.
tramadol
Tramadol ha sido evaluado para su uso en IVRA de la extremidad superior. Sesenta voluntarios divididos en cuatro grupos de 15 pacientes cada uno recibieron IVRA con 40 ml de tramadol al 0.25 % (100 mg), solución salina normal al 0.9 %, lidocaína al 0.5 % o lidocaína más tramadol al 0.25 %. El inicio y la recuperación del bloqueo sensorial y motor fueron similares entre el tramadol y la solución salina normal sola. Sin embargo, la adición de tramadol a la lidocaína resultó en un inicio más rápido del bloqueo sensorial a expensas de un aumento de la erupción cutánea y de la sensación dolorosa de ardor en la inyección. sitio. La conclusión de los autores fue que el tramadol por sí solo no posee efectos anestésicos locales, pero podría modificar los efectos si se agrega a un anestésico local como la lidocaína.
En otro estudio que comparó la lidocaína al 0.5 % con y sin 50 mg de tramadol para la IVRA de las extremidades superiores, el grupo al que se añadió tramadol experimentó menos dolor por el torniquete que el grupo solo local, pero como en el estudio mencionado anteriormente, hubo varios casos de urticaria cutánea en el grupo de tramadol pero no en el grupo de lidocaína sola. El tramadol (100 mg) agregado a la lidocaína para IVRA para la anestesia de las extremidades superiores actuó de manera similar al sufentanilo (25 μg) o la clonidina (1 μg/kg) agregados a la anestesia local con respecto a los datos hemodinámicos intraoperatorios, tiempo hasta la recuperación del bloqueo sensorial, inicio y la recuperación del bloqueo motor, las puntuaciones de sedación y el dolor posoperatorio.61 En resumen, el tramadol es ineficaz como agente único para la IVRA, pero puede otorgar alguna ventaja cuando se agrega a la lidocaína. Esta ventaja, sin embargo, puede verse contrarrestada por la incidencia significativa de efectos secundarios dermatológicos del tramadol administrado por vía intravenosa en una extremidad exanguinada.
Relajantes musculares
Se puede elegir una pequeña dosis de relajante muscular no despolarizante como complemento del anestésico local administrado para IVRA; sin embargo, debido a que la D-tubocurarina libera histamina incluso en dosis juiciosas, probablemente sea mejor evitar este agente por completo. Se ha agregado atracurio a la lidocaína en un esfuerzo por mejorar la relajación muscular durante la IVRA, particularmente durante la reducción de fracturas y dislocaciones de las extremidades superiores. La adición de 3 mg de atracurio a la lidocaína para IVRA dio como resultado una disminución en el tiempo de inicio de la analgesia en la mano, pero no en el sitio del torniquete. No hubo beneficio adicional al agregar este agente o alfentanilo a la lidocaína en el mismo estudio. Un estudio que usó 2 mg de atracurio agregados a 40 ml de lidocaína al 0.5 % para IVRA para cirugía de la mano en 40 pacientes asignados al azar a uno de dos grupos encontró que la adición de atracurio proporcionó un mayor grado de relajación muscular, una reducción más fácil de las fracturas y mejores condiciones de operación, así como menos dolor después de la cirugía.
La neostigmina
Se ha sugerido la neostigmina como coanalgésico cuando se usa para epidural y intratecal analgesia y anestesia, pero falta evidencia de su beneficio en el sistema nervioso periférico. En dos estudios, uno que utilizó neostigmina agregada a la lidocaína y el otro que utilizó el adyuvante agregado a la prilocaína, hubo resultados contradictorios. Cuando se agregó neostigmina (1 mg) a la lidocaína al 0.5 % para IVRA en un estudio de 54 voluntarios asignados al azar a uno de los tres grupos de estudio, se encontró que la adición del adyuvante no proporcionó ningún beneficio en términos de analgesia o anestesia en comparación con los controles. Cuando se añadió la mitad de la dosis de neostigmina (0.5 mg) a la prilocaína (3 mg/kg) para IVRA en 30 pacientes asignados al azar a uno de dos grupos de tratamiento, se encontró que el grupo adyuvante mostró un inicio más corto del bloqueo motor y sensorial. tiempos prolongados de recuperación del bloqueo sensorial y motor, mejor calidad de la anestesia y tiempo prolongado hasta el primer requerimiento analgésico en comparación con el grupo de prilocaína sola.
Un estudio más reciente que analizó el efecto de agregar 0.5 mg de neostigmina a 40 ml de lidocaína al 0.5 % para IVRA en pacientes que se sometieron a cirugías electivas o de emergencia de antebrazo y mano aleatoriamente en dos grupos, con 1 ml de solución salina isotónica agregada a 40 ml de solución salina al 0.5 %. lidocaína en el grupo de control, observó tiempos de inicio del bloqueo sensorial y motor significativamente más cortos y tiempos de recuperación más largos en el grupo de neostigmina en comparación con el grupo de control. La calidad de la anestesia intraoperatoria y la frecuencia del dolor del torniquete fueron similares en ambos grupos. Parece que los hallazgos contradictorios con dos dosis diferentes de neostigmina agregada a la lidocaína para la ARIV deberán confirmarse mediante un trabajo adicional que incorpore tamaños de muestra de pacientes más grandes para resolver la discrepancia en los dos estudios pequeños mencionados anteriormente.
Agentes antiinflamatorios no esteroideos
Otros intentos de mejorar la IVRA con lidocaína incluyeron el uso de AINE para suprimir el dolor del torniquete y mejorar la analgesia posoperatoria. Aunque el ketorolaco ha demostrado cierta eficacia, a otros AINE no les ha ido tan favorablemente. El ketorolaco se estudió como adyuvante de la lidocaína utilizando un torniquete en el antebrazo o en la parte superior del brazo en pacientes sometidos a cirugía de mano o antebrazo. En este estudio, los pacientes fueron aleatorizados en dos grupos: grupo UA, que consta de 20 pacientes sometidos a IVRA con un torniquete en la parte superior del brazo; y el grupo FA, formado por 20 pacientes sometidos a ARIV con torniquete en el antebrazo. Los pacientes del grupo de torniquete en la parte superior del brazo recibieron ARIV con lidocaína al 0.5 % en una dosis de 3 mg/kg más ketorolaco 0.3 mg/kg. IVRA en el grupo de torniquete de antebrazo se estableció con 0.5% de lidocaína a 0.15 mg/kg más ketorolaco 0.15 mg/kg. No hubo diferencias estadísticamente significativas en el inicio y la duración del bloqueo sensorial y la necesidad de suplementos analgésicos entre los dos grupos. Las puntuaciones de dolor posoperatorio también fueron similares entre los dos grupos. Los autores concluyeron que el torniquete del antebrazo IVRA con lidocaína al 0.5 % a una dosis de 1.5 mg/kg más ketorolaco 0.15 mg/kg es una opción segura y clínicamente viable que proporciona una anestesia y analgesia perioperatoria similar a la proporcionada por el torniquete del antebrazo IVRA con 0.5 % de lidocaína. lidocaína a dosis de 3 mg/kg más ketorolaco 0.3 mg/kg, reduciendo a la mitad la dosis de lidocaína y ketorolaco.
Otro AINE, tenoxicam, se agregó a la prilocaína en un estudio de 45 pacientes en total. Se utilizó una dosis de 20 mg del AINE en pacientes sometidos a IVRA para la reducción de fracturas de Colles, con pacientes divididos en tres grupos. Un grupo recibió anestesia local solamente; uno recibió local más tenoxicam; y un grupo recibió IVRA con anestesia local solamente más un AINE intravenoso. En este último grupo, el tenoxicam (20 mg) se inyectó en el brazo contralateral, opuesto al brazo del procedimiento IVRA. El grupo que recibió el AINE agregado al anestésico local tuvo analgesia superior y puntajes de dolor más bajos que cualquiera de los otros dos grupos de pacientes.
Un estudio más reciente que comparó los efectos analgésicos intraoperatorios y posoperatorios de lornoxicam y fentanilo cuando se agregaron a la lidocaína para IVRA en pacientes sometidos a cirugía de la mano mostró un aumento del tiempo de recuperación del bloqueo sensorial y del primer requerimiento de analgésicos en el grupo de lornoxicam, sin aumento de la incidencia de efectos secundarios. en comparación con el grupo de lidocaína sola y el grupo de lidocaína con fentanilo. En este estudio, un total de 45 pacientes fueron aleatorizados en tres grupos. Los pacientes del grupo 1 recibieron 3 mg/kg de lidocaína al 2% (40 mL); el grupo 2 recibió lidocaína 3 mg/kg, 38 mL más lornoxicam 2 mL (4 mg/mL); y el grupo 3 recibió 3 mg/kg de lidocaína, 38 mL más 2 mL de fentanilo (0.05 mg/mL). Este estudio también concluyó que la adición de fentanilo a la lidocaína IVRA (grupo 3) parecía ser superior a la lidocaína IVRA (grupo 1) y el lornoxicam agregado a la lidocaína IVRA (grupo 2) en la disminución del dolor causado por el torniquete; sin embargo, esto fue a expensas de aumentar los efectos secundarios como la picazón.
El dexketoprofeno es otro AINE que se ha estudiado como complemento de la lidocaína para IVRA. En este estudio prospectivo, aleatorizado y controlado con placebo, los pacientes programados para cirugía electiva de tejidos blandos de la mano o el antebrazo se dividieron aleatoriamente en tres grupos. Los 45 pacientes recibieron lidocaína al 0.5% como IVRA. Se administró dexketoprofeno 50 mg por vía intravenosa o se agregó a la solución IVRA, y el grupo de control recibió un volumen igual de solución salina por vía intravenosa y como parte de la IVRA. Se registraron los tiempos de inicio del bloqueo sensitivo y motor, el tiempo de recuperación y el consumo de analgésicos postoperatorios. En comparación con los controles, la adición de dexketoprofeno a la solución de IVRA resultó en un inicio más rápido del bloqueo sensorial y motor, un tiempo de recuperación más prolongado, menores puntajes de dolor intra y posoperatorio y menores requisitos de analgésicos posoperatorios. La formulación farmacológica de dexketoprofeno utilizada en este estudio contenía etanol como excipiente. Los autores afirmaron que el efecto neurolítico del etanol puede haber contribuido al desarrollo más rápido del bloqueo sensorial y motor y tiempos de recuperación más prolongados en el grupo IVRA en este estudio.
Otros agentes específicos: corticosteroides
Las propiedades antiinflamatorias de los esteroides de tipo glucocorticoide se han evaluado cuando estos agentes se han agregado a los anestésicos locales para IVRA en pacientes con artritis reumatoide (AR). En un estudio aleatorizado, doble ciego, cruzado, controlado con placebo, 20 pacientes con AR recibieron 50 mg de metilprednisolona en mepivacaína al 0.25 % o mepivacaína simple para ARIV de las extremidades superiores. La otra extremidad recibió el tratamiento opuesto. Una semana después, se inyectaron los mismos medicamentos en las extremidades contralaterales, respectivamente. El cincuenta por ciento de los pacientes informó una mejoría subjetiva a las 1 y 6 semanas; los parámetros objetivos como la fuerza de prensión no cambiaron hasta la evaluación de 6 semanas, momento en el que se observó un aumento significativo, al igual que la reducción de la diástasis de prensión y el dolor invocado por el movimiento. Este informe sugirió que los corticosteroides administrados por IVRA pueden proporcionar una analgesia sostenida en ciertos pacientes con AR.
El esteroide IVRA también se ha utilizado como tratamiento complementario del SDRC tipo 1. Se agregó metilprednisolona (40 mg) a la lidocaína para IVRA de forma aleatoria, doble ciego y controlada con placebo en 22 pacientes. Los tratamientos se aplicaron una vez por semana, hasta por tres sesiones de bloques. Los investigadores no encontraron ningún beneficio al agregar el esteroide al local con respecto a la mejora en la intensidad del dolor o el acortamiento del curso de la enfermedad. Curiosamente, una serie de casos que involucró a 168 pacientes con SDRC tipo 1 de la extremidad superior tratados con ARIV usando 25 ml de lidocaína al 0.5 % y 125 mg de metilprednisolona diluidos en 10 ml de solución salina normal y seguidos durante un período de 5 años informaron ausencia completa de dolor en el 92% de los pacientes al final del período de seguimiento. IVRA se realizó con el torniquete inflado durante 20 minutos, tiempo durante el cual se manipuló la extremidad afectada en un intento de aumentar el rango de movimiento. Luego, el torniquete se desinflaba gradualmente para evitar la entrada rápida de los agentes inyectados a la circulación.
El mismo proceso se repetía una o dos veces por semana dependiendo de la intensidad y persistencia de los síntomas del paciente, y entre sesiones se mantenía a los pacientes en fisioterapia suave, que no era prolongada ni estresante. Se necesitó un promedio de 4.8 sesiones para aliviar los síntomas y proporcionar una extremidad funcional. Los autores atribuyeron los resultados clínicos a la etapa temprana del SDRC tipo 1 al iniciar el tratamiento y al aumento de la dosis de metilprednisolona en comparación con estudios previos.
El acetaminofeno
Debido a sus conocidos efectos analgésicos, el acetaminofén (APAP) (paracetamol) se ha estudiado como adyuvante de los anestésicos locales en pacientes sometidos a cirugía de mano bajo IVRA. Sesenta pacientes sometidos a cirugía de la mano fueron asignados al azar en tres grupos. Todos los grupos recibieron lidocaína IVRA (3 mg/kg) diluida con solución salina normal hasta un volumen total de 40 ml. El grupo 1 recibió lidocaína IVRA más solución salina intravenosa. el grupo 2 recibió lidocaína IVRA y una mezcla de APAP (300 mg) más solución salina intravenosa; y el grupo 3 recibió lidocaína IVRA más APAP intravenoso (300 mg). Durante la cirugía se evaluó el tiempo de inicio del bloqueo sensorial y motor, el dolor del torniquete y el uso de analgésicos. Después de desinflar el torniquete, la EVA puntúa a las 1, 2, 4, 6, 12 y 24 horas; el tiempo hasta el primer requerimiento de analgésicos; consumo total de analgésicos en las primeras 24 horas; y se observaron efectos secundarios. No hubo diferencia significativa en la aparición de bloqueos sensoriales entre los tres grupos; sin embargo, la duración del bloqueo sensorial fue significativamente más larga en el grupo 2. El tiempo de inicio del bloqueo motor fue más corto y la duración del bloqueo motor fue más larga en el grupo 2. El dolor del torniquete se redujo y la calidad de las puntuaciones de la anestesia según lo informado por el anestesiólogo, que estaba cegado al fármaco del estudio, también fue significativamente mayor en el grupo 2. No hubo una disminución demostrable en las puntuaciones de dolor posoperatorio entre los tres grupos. Los autores señalaron la dosificación arbitraria de APAP (300 mg) como una deficiencia del estudio. Se requieren más estudios de rango de dosis para optimizar la dosificación de paracetamol cuando se usa como adyuvante de la lidocaína para IVRA.
Otro estudio que evaluó el efecto de APAP, cuando se agrega a la lidocaína en IVRA, sobre el tiempo de inicio del bloqueo sensorial y motor, el dolor del torniquete y la analgesia posoperatoria encontró un tiempo de inicio del bloqueo sensorial más corto; tiempo de aparición tardía del dolor del torniquete; y redujo las puntuaciones de dolor posoperatorio y el consumo de analgésicos. La dosis de paracetamol fue idéntica a la del estudio anterior (lidocaína al 0.5 % diluida con 300 mg de APAP intravenoso hasta un volumen total de 40 ml). El grupo de control recibió lidocaína al 0.5 % diluida con solución salina normal al 0.9 % hasta un volumen total de 40 ml. En este estudio no se evaluaron el tiempo de inicio y la duración del bloqueo motor. En un intento de explicar el tiempo de aparición más rápido del bloqueo sensorial en el grupo de lidocaína y acetaminofén, los autores investigaron el pH de la mezcla de lidocaína y acetaminofén y encontraron que el valor de pH de esta mezcla era de 5.88, que era más bajo que el pH de la lidocaína. –Mezcla salina normal, que fue 6.16. Esto contradice el hecho de que cuanto mayor sea el pH del anestésico local, mayor será la penetración del nervio y, por tanto, más rápido el inicio del bloqueo neural. En este estudio, los autores atribuyeron el inicio más rápido del bloqueo sensorial a los posibles efectos antinociceptivos de APAP en sitios periféricos.
Nitroglicerina
El efecto de la nitroglicerina (NTG), cuando se agrega a la lidocaína para IVRA, se estudió en un estudio prospectivo, aleatorizado, doble ciego.76 Treinta pacientes que se sometieron a cirugía de la mano se asignaron al azar a dos grupos. El grupo control (grupo C, n = 15) recibió una dosis total de 40 mL con 3 mg/kg de lidocaína diluida con solución salina normal, y el grupo NTG (grupo NTG, n = 15) recibió 200 μg adicionales de NTG. Acortamiento de los tiempos de inicio del bloqueo sensorial y motor; tiempos prolongados de recuperación del bloqueo motor y sensorial; disminución del dolor del torniquete; y se observó una mejor calidad de la anestesia en el grupo NTG. Los requisitos de analgésicos postoperatorios también se redujeron significativamente en el grupo NTG. Los autores atribuyeron el tiempo de inicio más corto del bloqueo sensorial y motor a los efectos vasodilatadores de la NTG que promueve la distribución del anestésico local a los nervios. Algunos de los otros mecanismos que pueden contribuir a mejorar la analgesia con NTG pueden incluir el metabolismo de NTG a óxido nítrico, que a su vez causa un aumento en la concentración intracelular de monofosfato de guanosina cíclico, que produce
modulación del dolor en el sistema nervioso central y periférico. También se ha demostrado que los generadores de óxido nítrico inducen efectos antiinflamatorios y analgésicos al bloquear la hiperalgesia y el componente neurogénico del edema inflamatorio por aplicación tópica.
Midazolam
Se ha demostrado que el midazolam acelera la aparición del bloqueo sensorial y motor y mejora la analgesia posoperatoria cuando se agrega a la bupivacaína para el bloqueo del plexo braquial. Se demostró que el midazolam tiene efectos analgésicos mediados por los receptores GABA (ácido γ-aminobutírico) en la médula espinal en estudios con animales. También se han encontrado receptores GABA en nervios periféricos. También se demostró que el midazolam reduce la actividad de las fibras A-delta y C.
En un estudio diseñado para evaluar el efecto del midazolam cuando se agrega a la lidocaína para IVRA, 40 pacientes sometidos a cirugía de mano fueron asignados aleatoriamente a dos grupos. El grupo de control recibió 3 mg/kg de lidocaína al 2 % diluida con solución salina hasta un volumen total de 40 ml, y el grupo de midazolam recibió 50 μg/kg adicionales de midazolam. No hubo diferencias estadísticamente significativas en los tiempos de inicio y recuperación del bloqueo sensorial y motor entre los dos grupos. Sin embargo, una puntuación de evaluación del dolor subjetivo utilizando la escala de calificación numérica (NRS) para el dolor del torniquete se redujo significativamente en el grupo de midazolam. La calidad de la anestesia evaluada por el paciente y el cirujano también fue significativamente mejor en el grupo de midazolam.
Las puntuaciones de dolor NRS postoperatorias también fueron significativamente más bajas en el grupo de midazolam durante las primeras 2 horas después de la operación.
Sin embargo, las puntuaciones de sedación posoperatoria también fueron más altas en el grupo de midazolam. Los autores indicaron que la analgesia postoperatoria mejorada después de desinflar el torniquete puede explicarse por el efecto sistémico del midazolam además del efecto analgésico periférico.
Otro estudio involucró a 60 pacientes sometidos a cirugía de mano aleatorizados en dos grupos, con el grupo de control y el grupo de midazolam recibiendo IVRA con una dosificación exactamente idéntica de lidocaína y midazolam como en el estudio anterior. Este estudio mostró tiempos de inicio de bloqueo motor y sensorial reducidos y tiempos de recuperación de bloqueo motor y sensorial prolongados, además de puntuaciones de dolor de torniquete y puntuaciones de dolor postoperatorio disminuidas. Los hallazgos contradictorios con respecto a los tiempos de inicio del bloqueo sensorial y motor pueden justificar más estudios con muestras de mayor tamaño para resolver la discrepancia. En la actualidad, todo lo que se puede afirmar es que el midazolam parece ser prometedor como complemento del anestésico local cuando se utiliza para la IVRA de las extremidades superiores.
Ketamina
La ketamina es un potente agente analgésico cuyo principal mecanismo de acción es el antagonismo de los receptores de glutamato N-metil-D-aspartato (NMDA) que juegan un papel crucial en el mecanismo de procesamiento del dolor a nivel de la médula espinal. Los estudios en animales han indicado la presencia de receptores NMDA en los nervios periféricos. También se ha demostrado que la ketamina produce un bloqueo transitorio de los canales de sodio y potasio de los nervios periféricos. La posible presencia de receptores NMDA en los nervios periféricos, así como la capacidad de la ketamina para bloquear los canales de sodio localmente, apunta a un posible sitio de acción periférico para la ketamina, además de sus sitios de acción centrales bien establecidos.
La ketamina se estudió como adyuvante de la lidocaína IVRA en pacientes sometidos a cirugía de la mano y se comparó su eficacia para controlar el dolor del torniquete intraoperatorio, la analgesia posoperatoria y los efectos secundarios con la misma dosis de ketamina administrada sistémicamente. En este estudio de control sistémico, aleatorizado, doble ciego, 40 pacientes que se sometieron a cirugía ambulatoria de la mano se aleatorizaron en dos grupos. En el grupo “IVRA”, se agregó 0.1 mg/kg de ketamina en 1 ml de solución salina normal a la lidocaína de IVRA y se administró 1 ml de solución salina normal a través de una vía intravenosa periférica. En el grupo "sistémico", se agregó 1 ml de solución salina normal a la jeringa de IVRA y se administró 0.1 mg/kg de ketamina en 1 ml de solución salina normal a través de una vía intravenosa periférica. Ambos grupos recibieron 40 mL de lidocaína al 0.5% para IVRA.
El estudio no encontró diferencias entre los grupos en los parámetros de estudio mencionados, y los autores concluyeron que la ketamina IVRA y la ketamina intravenosa sistémica eran indistinguibles en términos de dolor de torniquete intraoperatorio y consumo de analgésicos posoperatorios. En este estudio no se midió la velocidad de inicio y la duración del bloqueo sensorial y motor. Otro estudio que comparó la eficacia de la ketamina y la clonidina cuando se agregaron por separado a 40 ml de lidocaína al 0.5 % para IVRA en pacientes sometidos a cirugía de la mano o el antebrazo encontró una aparición tardía del dolor del torniquete y una disminución del consumo de analgésicos en ambos grupos en comparación con el grupo de control. recibiendo 40 mL de lidocaína al 0.5% con solución salina añadida. La ketamina tuvo un efecto más potente sobre los parámetros del estudio en comparación con la clonidina. En este estudio en el que participaron 45 pacientes aleatorizados en tres grupos, la IVRA se realizó con 40 ml de lidocaína al 0.5 % y solución salina, 1 μg/kg de clonidina o 0.1 mg/kg de ketamina.
Tratamientos IVRA específicos para CRPS
Los bloqueadores o antagonistas adrenérgicos, en particular los que son efectivos en el receptor α, se han mostrado prometedores en el tratamiento del SDRC, en particular cuando estos agentes se usan para IVRA. Otros adyuvantes adrenérgicos liberan y luego previenen la recaptación de norepinefrina en la unión neurovascular. Su uso en el SDRC es intuitivo porque se sospecha que la fisiopatología de la enfermedad incluye el receptor α y está mediada por la norepinefrina. Sin embargo, existe una gran controversia con respecto a este tema, particularmente cuando se compara la investigación actual con los hallazgos de estudios realizados hace casi 40 años. La guanetidina, la reserpina y el bretilio se han evaluado para IVRA para CRPS. Cuando se agregaron 15 mg de guanetidina a la prilocaína al 0.5 % en un grupo de 57 pacientes con SDRC de la extremidad superior y la mano, no se encontró que la guanetidina fuera más eficaz que la solución salina normal en el tratamiento de la alodinia y el dolor quemante del SDRC después de fracturas del radio distal.
Estos hallazgos corroboraron el trabajo realizado en un estudio multicéntrico, aleatorizado y doble ciego 7 años antes. Sesenta pacientes con distrofia simpática refleja (RSD)/causalgia recibieron cuatro bloqueos de IVRA a intervalos de 4 días con guanetidina o placebo en lidocaína al 0.5%. A largo plazo, no se observaron diferencias entre el grupo de placebo y el grupo de guanetidina, y solo el 35 % de los pacientes en general en todos los grupos lograron una resolución de su problema.
El bretilio también se ha utilizado en CRPS. En un ensayo aleatorizado y controlado, se comparó la lidocaína al 0.5 % con el mismo anestésico local al que se añadió 1.5 mg/kg de bretilio. Se consideró significativa una disminución del dolor del 30% o más. El grupo de bretilio local tuvo alivio del dolor durante 20 ± 17.5 días, a diferencia del grupo de lidocaína sola, en el que la analgesia persistió solo durante 2.7 ± 3.7 días. El bretilio fue muy superior al anestésico local solo en el tratamiento del SDRC en este estudio.
Se utilizó anestesia regional intravenosa con bretilio para demostrar que una reducción en el tono simpático de los músculos del antebrazo en ejercicio aumentaría el flujo sanguíneo, reduciría la acidosis muscular y atenuaría las respuestas reflejas. La IVRA con bretilio aumentó el flujo sanguíneo y el consumo de oxígeno en el antebrazo en ejercicio, aunque tanto el potasio venoso como el contenido de iones de hidrógeno aumentaron durante la fase de ejercicio, lo que implica que los efectos reflejos no se vieron afectados por el bloqueo con bretilio.
COMPLICACIONES
Las complicaciones debidas a IVRA pueden clasificarse como relacionadas con medicamentos o equipos (es decir, torniquete). Las complicaciones relacionadas con los medicamentos dependen de los agentes, incluidos los anestésicos locales y los adyuvantes, que se administran directamente en el sistema vascular. Las complicaciones relacionadas con el equipo incluyen todos los dispositivos y técnicas utilizadas para aislar el espacio vascular de la circulación sistémica. El desinflado accidental o involuntario del manguito, la falla del manguito, un aumento repentino de la presión venosa dentro del tejido ocluido a un nivel superior a la presión del manguito y una circulación interósea intacta pueden contribuir a las complicaciones de la IVRA.
La lidocaína es el anestésico local más comúnmente utilizado para IVRA y, por lo tanto, es el agente sobre el cual se han informado la mayoría de las complicaciones. Afortunadamente, la lidocaína no se acumula en gran medida en los canales de sodio a concentraciones plasmáticas terapéuticas, y debido a que se une y se disocia rápidamente del canal, las acumulaciones tóxicas del fármaco en el canal son atípicas. Concentraciones plasmáticas excesivas de lidocaína , como se asocian con bolos intravenosos de grandes dosis con un sistema de torniquete defectuoso, dan como resultado vasodilatación periférica y disminución de la contractilidad cardíaca, que generalmente se observa clínicamente como hipotensión. El inicio habitual de ARIV con lidocaína en concentraciones al 97,98% es rápido (alrededor de 0.5 ± 4.5 minutos), y la finalización de la anestesia una vez que se ha desinflado el torniquete también es rápida (0.3 ± 5.8 minutos)0.5. Por lo general, no hay signos o síntomas de toxicidad cardiovascular o del sistema nervioso central si el torniquete se desinfla al menos 99 minutos después de inyectar el fármaco en el sistema venoso, aunque se ha observado tinnitus en los períodos posteriores al desinflado de 30 y 20 segundos después de los tiempos de inflado estándar.
Sin embargo, una búsqueda bibliográfica en PubMed®, Embase® y MEDLINE® de la Biblioteca Nacional Estadounidense de Medicina, que abarcó el período de 1950 a 2007, reveló 24 casos de convulsiones, y se informó que las convulsiones ocurrieron en 12 casos mientras el manguito aún estaba inflado. y en 9 casos después de que se desinflara el manguito. La información no estaba disponible en tres casos. Se informaron convulsiones que ocurrieron durante el inflado del torniquete con una presión del torniquete que superó la presión arterial sistólica inicial en 150 mm Hg. Las convulsiones que ocurrieron después de desinflar el torniquete se informaron con tiempos de torniquete de hasta 60 minutos y con un retraso de hasta 10 minutos después del desinflado del torniquete. La dosis más baja de anestésico local asociada con una convulsión fue de 1.4 mg/kg de lidocaína, 4 mg/kg de prilocaína y 1.3 mg/kg de bupivacaína.
Aunque alrededor del 70 % de la dosis de lidocaína administrada permanece dentro de los tejidos de la extremidad aislada después de desinflar el torniquete, el 30 % restante ingresa a la circulación sistémica durante los siguientes 45 minutos. Se libera mucho más fármaco de los tejidos de la extremidad aislada a la circulación después de desinflar el torniquete si la extremidad se ejercita inadvertidamente, lo que enfatiza la importancia de mantener inactiva la extremidad previamente anestesiada durante algún tiempo inmediatamente después de desinflar el torniquete.
El otro anestésico local comúnmente utilizado para IVRA, la prilocaína, está asociado con la formación de metahemoglobina (MetHb), que ocurre alrededor de 4 a 8 horas después de su administración. Afortunadamente, no se informó metahemoglobinemia significativa cuando se usó prilocaína para IVRA. La prilocaína (0.5 %) administrada para IVRA tiene un inicio de analgesia de aproximadamente 11 minutos (±6.8 minutos), y la terminación de la analgesia después de desinflar el torniquete tiene un promedio de 7.2 minutos (±4.6 minutos).25 El uso de este agente para IVRA parece ser extraordinariamente seguro. De hecho, en una encuesta de 45,000 102 bloques de prilocaína IVRA, no hubo efectos secundarios graves ni muertes al usar este fármaco a través de esta técnica.XNUMX En términos de eficacia, la prilocaína parece ser equivalente a la lidocaína cuando se usa para IVRA.
Cuando los opioides se administran en combinación con anestésicos locales para IVRA en un intento de prolongar la analgesia después de desinflar el manguito, se pueden notar efectos secundarios ocasionales típicamente atribuidos a los opiáceos administrados sistémicamente después de desinflar el manguito. Estos incluyen náuseas, vómitos y sedación leve.
Cuando se administran bloqueadores neurovasculares junto con anestésicos locales para mejorar las condiciones quirúrgicas en pacientes que se someten a reducción de fracturas, no ha habido informes de complicaciones por estos adyuvantes.
Consejos NYSORA
• Un sistema de torniquete intacto es esencial para la realización exitosa y segura de IVRA.
• El desinflado accidental del torniquete o la presencia de una comunicación vascular, incluso con un torniquete intacto y en funcionamiento, puede provocar una toxicidad sistémica grave.
• Cuando los procedimientos quirúrgicos duran menos de 30 minutos, el desinflado y el inflado intermitentes del manguito pueden prolongar efectivamente el tiempo para alcanzar las concentraciones arteriales máximas del anestésico local, pero pueden no ser completamente confiables para minimizar la toxicidad debida a la liberación del anestésico local en la circulación.
• El torniquete no debe desinflarse hasta que hayan transcurrido al menos 30 minutos desde el momento en que se inyectó el anestésico local (y los adyuvantes, si se usaron) en el sistema venoso aislado.
Además, el propio torniquete puede ser fuente de complicaciones porque puede causar dolor y molestias isquémicas.
La hipertensión sistémica puede resultar de la insuflación sostenida o prolongada del torniquete. El mal uso o mal funcionamiento del equipo es una fuente importante y evitable de complicaciones debido a esta técnica. Incluso un torniquete intacto y completamente funcional puede estar asociado con la fuga de fármacos administrados desde una extremidad supuestamente aislada hacia la circulación sistémica.
La IVRA de la extremidad inferior tiene una incidencia de casi el 100 % de fuga de anestésico local por debajo del torniquete, frente a una incidencia de alrededor del 25 % para el bloqueo de la extremidad superior. Como corolario de este fenómeno de fuga, el uso de IVRA para la analgesia de las extremidades inferiores tiene una alta incidencia asociada de bloqueo de mala calidad (casi el 40% en un estudio prospectivo). El fármaco puede filtrarse a través de un manguito aparentemente en pleno funcionamiento y acceder a la circulación sistémica a través de la circulación interósea, que no se ve afectada por la oclusión de los músculos, los tejidos blandos y los canales vasculares acompañantes incluidos en ella. Este factor se reconoce desde hace casi 50 años, pero no parece ser significativo en la producción de complicaciones por ARIV.
El desinflado del torniquete después de la IVRA se asocia con signos y síntomas de toxicidad de anestésicos locales sistémicos, que van desde eventos leves relacionados con el sistema nervioso central, como tinnitus y entumecimiento perioral, hasta convulsiones y, finalmente, colapso cardiovascular devastador. Estos se correlacionan con las concentraciones de anestésico local en la sangre arterial y no con las concentraciones venosas.
Otra complicación debida a la IVRA es el dolor del torniquete, que no es raro que ocurra si no se utiliza un dispositivo neumático doble (Figura 1 y XNUMX y Figura 9 y XNUMX). Recomendamos el uso de un torniquete de este tipo para cualquier procedimiento realizado con IVRA que se espera que dure más de 30 minutos. Sin embargo, incluso cuando se siguen dichas pautas, se producen eventos adversos después de desinflar el torniquete después de un intervalo de tiempo "seguro". Informes muy raros y aislados de complicaciones neurológicas, incluido el daño a los nervios mediano, cubital y musculocutáneo, están asociados con ARIV. La causa de tales complicaciones parece ser la presión directa del torniquete aplicado a estos nervios, que posteriormente muestran cambios histológicos que se asemejan a lesiones por aplastamiento. Se recomienda que el tiempo de torniquete no supere las 2 horas para reducir la probabilidad de daño capilar y muscular secundario a la acidosis tisular.
Síndrome compartimental puede ocurrir raramente después de la IVRA, especialmente cuando la IVRA se utiliza para la reducción de fracturas de extremidades inferiores de huesos largos, y puede deberse tanto al gran volumen de anestésico local inyectado para efectuar la analgesia como a la exanguinación inadecuada o incompleta de la extremidad antes de realizar la bloquear. Existe un informe de caso de esta complicación después de la inyección inadvertida de solución salina hipertónica cuando se pretendía inyectar anestésico local.
Una paciente embarazada de 33 años que se sometió a ARIV para la liberación endoscópica del túnel carpiano experimentó un episodio grave de sensación de miembro fantasma después de la inyección del anestésico local.
Los síntomas se resolvieron con la disipación del IVRA. Hay un informe de la devastadora necesidad de amputar el brazo en un paciente de 28 años cuyas arterias radial y cubital se trombosaron después de una IVRA después de un breve tiempo de oclusión con torniquete. Si esto se debió a una inyección intraarterial no sospechada del fármaco, un error en la administración del fármaco , o tal vez una reacción idiosincrásica a un fármaco es puramente especulativa. En el Proyecto de Reclamos Cerrados de ASA para los años 1980 a 1999 se informaron tres casos que incluían muerte o daño cerebral permanente asociado con IVRA. Se desconocen los detalles de estos casos.
FIGURA 9.El sistema de doble torniquete se coloca en la parte proximal del muslo derecho, como preparación para la IVRA de la extremidad inferior derecha.
Toxicidad de los anestésicos locales
Aunque la lidocaína es el agente anestésico local más comúnmente utilizado para IVRA en los Estados Unidos, en Europa se elige de manera más rutinaria la prilocaína al 0.5%. La prilocaína, sin embargo, se metaboliza a ortotoluidina, un compuesto oxidante capaz de convertir la hemoglobina en MetHb. Por lo general, esto solo es motivo de preocupación cuando la dosis de prilocaína supera los 600 mg, lo cual, incluso para la IVRA de las extremidades inferiores en las que se utilizan volúmenes de hasta 100 ml, no debe alcanzarse (es decir, 100 ml × 0.5 % de prilocaína = 500 mg) .
Consejos NYSORA
• La metahemoglobinemia grave es una emergencia médica que requiere reconocimiento inmediato y tratamiento adecuado.
• Se requiere una buena anamnesis y un alto nivel de sospecha para realizar el diagnóstico.
• Para la metahemoglobinemia debida a la exposición a fármacos, el tratamiento tradicional de primera línea consiste en la infusión de azul de metileno (MB).
• Se debe administrar dextrosa porque la principal fuente de NADH (nicotinamida adenina dinucleótido reducida [hidrogenada]) en los glóbulos rojos es el catabolismo del azúcar a través de la glucólisis. La dextrosa también es necesaria para formar NADPH (fosfato de NAD [hidrogenado] reducido) a través de la derivación de monofosfato de hexosa, que es necesaria para que MB sea eficaz.
• La dosis de MB es de 1 a 2 mg/kg IV durante 5 minutos (la dosis total no debe exceder los 7–8 mg/kg).
• MB puede causar disnea, dolor torácico o hemólisis.
• MB proporciona un transportador de electrones artificial para la reducción de MetHb a través de la vía dependiente de NADPH. La respuesta es rápida; la dosis puede repetirse en
1 hora si el nivel de MetHb sigue siendo alto 1 hora después de la perfusión inicial.
• La metahemoglobinemia de rebote puede ocurrir hasta 18 horas después de la administración de MB debido a la absorción prolongada de agentes lipofílicos (benzocaína) del tejido adiposo. Es razonable realizar mediciones en serie de los niveles de MetHb después del tratamiento con MB. MB no debe administrarse a pacientes con deficiencia de glucosa-6-fosfato deshidrogenasa (G6PD) porque la reducción de MetHb por MB depende del NADPH generado por G6PD (hemólisis). Un tratamiento alternativo para estos pacientes es el ácido ascórbico (2 mg/kg).
• La transfusión de sangre o la exanguinotransfusión pueden ser útiles en pacientes que están en estado de shock. El oxígeno hiperbárico se ha utilizado con éxito anecdótico en casos graves.
El desinflado del torniquete después de la cirugía es un paso crítico para minimizar la posibilidad de toxicidad asociado con IVRA. En primer lugar, es absolutamente obligatorio que el torniquete no se desinfle hasta que hayan transcurrido al menos 30 minutos desde la inyección del anestésico local, aunque la duración de la cirugía o de la manipulación haya sido breve. Si la cirugía es breve y el paciente necesita recuperarse en la PACU, es aceptable sujetar el torniquete distal mientras está inflado, retirar al paciente del área de operación (con el torniquete inflado) y transferir al paciente a una entorno de atención supervisado. Sin embargo, nadie debe retirar el torniquete sujeto en ningún momento hasta que haya transcurrido el período de 30 minutos que comienza con la inyección de la solución anestésica local. En ese momento, el paciente debe ser monitoreado continuamente durante al menos 15 minutos después de quitar el torniquete en la PACU. Se ha informado al menos un caso de paro cardíaco cuando se soltó el torniquete poco después de la inyección de anestésico local, donde la duración de la cirugía fue extremadamente corta.
En segundo lugar, es absolutamente esencial que el desinflado del torniquete se realice de manera “cíclica” de la siguiente manera: El manguito se desinfla (después de un mínimo de 30 minutos) y se vuelve a inflar inmediatamente. El paciente es observado o interrogado atentamente por la aparición de síntomas asociados con la toxicidad del anestésico local, como tinnitus, mareos, sabor metálico en la boca, etc. Obviamente, los signos de estimulación del sistema nervioso central también pueden representar toxicidad del anestésico local y también deben buscarse. Si no hay tales signos o síntomas después de aproximadamente 1 minuto, el manguito se desinfla una vez más y se vuelve a inflar inmediatamente durante un período de aproximadamente 1 a 2 minutos, mientras se observa al paciente y se le pregunta por la toxicidad del anestésico local sistémico. Si no aparece ninguno en ese momento, el torniquete puede desinflarse y retirarse de la extremidad de manera segura. La seguridad de dicho desinflado/reinflado cíclico es que, con cada desinflado, solo una pequeña fracción del anestésico local administrado (y no unido) puede ingresar a la circulación sistémica, lo que minimiza la posibilidad de un aumento repentino y sostenido en el nivel sanguíneo de el anestésico local.
RESUMEN
La anestesia regional intravenosa es un complemento valioso para el arsenal de los médicos en cualquier especialidad que trate al paciente con lesiones agudas. La sencillez de la técnica y la relativa seguridad (si se mantiene un estricto cumplimiento del protocolo indicado anteriormente) la convierten en una atractiva alternativa a bloqueo del plexo braquial (para cirugía o manipulación de las extremidades superiores) y espinal or bloqueo epidural (para cirugía o manipulación de extremidades inferiores). El simple hecho de poder identificar y acceder a una vena periférica y aplicar un torniquete neumático hace de esta una de las modalidades de bloqueo regional más "fáciles de usar" en la práctica clínica. No hay ningún requisito para ser fácil con un estimulador de nervios periféricos o interpretar imágenes obtenidas de una máquina de ultrasonido. Una de las únicas desventajas potenciales asociadas con IVRA es la duración finita de la anestesia/analgesia asociada con su uso. Una relativa incapacidad para prolongar la analgesia durante mucho tiempo en el período posterior al procedimiento resta valor a su utilidad. Para esas ocasiones, la inserción y mantenimiento continuo del catéter mediante anestesia del plexo asegura ofrecer una alternativa atractiva.
Referencias
- Bier A: Uber einen neun weg anestesia local an den gliedmassen zuerzeugen. Arco Klin Chir 1908; 86: 1007–1016.
- Bier A: Sobre un nuevo método de anestesia local. Muench Med Wschir 1909; 56:589.
- Bier A: Sobre la anestesia venosa. Berlin Klin Wschr 1909; 46: 477–489.
- Bier A: Sobre la anestesia local con especial referencia a la anestesia venosa. Edimburgo Med J 19105: 103–123.
- Morrison J: Anestesia local intravenosa. Br J Surg 1930–1931; 18: 641–647.
- Herreros L: Anestesia regional por vía intravenosa. Anestesiología 1946;7:558–560.
- Holmes CMcK: Analgesia regional intravenosa. Lancet 1963; 1: 245–247.
- Kalman S, Svenson H, Lisander B, et al: Cambios sensoriales cuantitativos en humanos después del bloqueo regional intravenoso con mepivacaína. Reg Anesth Pain Med 1999;24:236–241.
- Wahren L, Torebjork E, Nystorm B: Pruebas sensoriales cuantitativas antes y después del bloqueo regional con guanetidina en pacientes con neuralgia en la mano. Dolor 1991;46:23–30.
- Smith M, Sprung J, Zura A, et al: Una encuesta sobre la exposición a las técnicas de anestesia regional en los programas de capacitación de residencia en anestesia estadounidenses. Reg Anesth Pain Med 1999;24:11–16.
- Blaheta H, Vollert B, Zuder D, et al: La anestesia regional intravenosa (bloqueo de Bier) para el tratamiento con toxina botulínica de la hiperhidrosis palmar es segura y eficaz. Dermatol Surg 2002;28:666–671.
- Bosdotter Enroth S, Rystedt A, Covaciu L, et al: Anestesia regional intravenosa del antebrazo bilateral con prilocaína para el tratamiento con toxina botulínica de la hiperhidrosis palmar. J Am Acad Dermatol 2010;63(3): 466–474.
- Nascimento MSA, Klamt JG y Prado WA: El bloqueo regional intravenoso es similar al bloqueo del ganglio simpático para el tratamiento del dolor en pacientes con síndrome de dolor regional complejo tipo 1. Braz J Med Biol Res 2010; 43(12):1239–1244.
- Glickman L, Mackinnon S, Rao T, et al: Anestesia regional intravenosa continua. J Hand Surg 1992;17:82–86.
- Mabee J, Shean C, Orlinsky M, et al: Los efectos del bloque de Bier simulado IVRA en la presión del tejido intracompartimental. Acta Anaesthesiol Scand 1997;41:208–213.
- Aarons CE, Fernandez MD, Willsey M, Peterson B, Key C, Fabregas J: anestesia regional con bloqueo de Bier y yeso para fracturas de antebrazo: seguridad en el entorno del departamento de emergencias pediátricas. J Pediatr Orthop 2014;34:45–49.
- Singh R, Bhagawat A, Bhadoria P, Kohli A: Forearm IVRA, usando lidocaína al 0.5 % en una dosis de 1.5 mg/kg con ketorolaco 0.15 mg/kg para cirugías de mano y muñeca. Minerva Anestesiol 2010;76:109–114.
- Chiao FB, Chen J, Lesser JB, Resta-Flarer F, Bennett H: El torniquete de antebrazo con manguito único en la anestesia regional intravenosa produce menos dolor y requiere menos sedación que el torniquete de la parte superior del brazo. Hermano J Anaesth 2013;111(2):271–275.
- Benlabed M, Jullien P, Guelmi K, et al: Alcanización de lidocaína al 0.5 % para anestesia regional intravenosa. Reg Anesth 1990; 15:59–60.
- Lavin P, Henderson C, Vaghadia H: 2-clorprocaína alcalinizada y no alcalinizada versus lidocaína para la anestesia regional intravenosa durante la cirugía ambulatoria de la mano. Can J Anaesth 1999;46:939–945.
- Ulus A, Gurses E, Oztrurk I, Serin S: evaluación comparativa de dos volúmenes diferentes de lidocaína en anestesia regional intravenosa. Med Sci Monit 2013;19:978–983.
- Chan V, Weisbrod M, Kaszas Z, et al: Comparación de ropivacaína y lidocaína para anestesia regional intravenosa en voluntarios: un estudio preliminar sobre la eficacia anestésica y el nivel sanguíneo. Anestesiología 1999;90: 1602–1608.
- Peng P, Coleman M, McCartney C, et al: Comparación del efecto anestésico entre ropivacaína al 0.375 % versus lidocaína al 0.5 % en la anestesia regional intravenosa del antebrazo. Reg Anesth Pain Med 2002;27;595–599.
- Horn JL, Cordo P, Kunster D, et al: Progresión de la anestesia regional intravenosa del antebrazo con ropivacaína. Reg Anesth Pain Med 2011;36(2): 177-180.
- Pitkanen M, Suzuki N, Rosenberg P: Anestesia regional intravenosa con prilocaína al 0.5 % o clorprocaína al 0.5 %. Una comparación doble ciego en voluntarios. Anestesia 1992;47:618–619.
- Pitkanen M, Kytta J, Rosenberg P: Comparación de 2-cloroprocaína y prilocaína para la anestesia regional intravenosa del brazo: un estudio clínico. Anestesia 1993;48:1091–1093.
- Pitkanen M, Xu M, Haasio J, et al: Comparación de articaína al 0.5 % con prilocaína al 0.5 % en anestesia regional intravenosa del brazo: un estudio cruzado en voluntarios. Reg Anesth Pain Med 1999;24:131–135.
- Simon M, Gielen M, Albernik N, et al: Anestesia regional intravenosa con articaína al 0.5 %, lidocaína al 0.5 % o prilocaína al 0.5 %. Un estudio clínico aleatorizado doble ciego. Reg Anesth 1997;22:29–34.
- Hoffman V, Vercauteren M, Van Steenberge A, et al: Anestesia regional intravenosa. Evaluación de cuatro aditivos diferentes a la prilocaína. Acta Anaesthesiol Belg 1997;48:71–76.
- Armstrong P, Brockway M, Wildsmith J: Alcalinización de prilocaína para anestesia regional intravenosa. Anestesia 1990;45:11–13.
- Solak M, Akturk G, Erciyes N, et al: La adición de bicarbonato de sodio a la solución de prilocaína durante la anestesia regional IV. Acta Anaesthesiol Scand 1991;35:572–574.
- Kalman S, Bjorn K, Tholen E, et al: La mepivacaína como bloqueo regional intravenoso interfiere con la hiperemia reactiva y disminuye el flujo sanguíneo en estado estacionario. Reg Anesth 1997;22:552–556.
- Kalman S, Liderfalk C, Wardell K, et al: Efecto diferencial sobre la vasodilatación y el dolor después de la capsaicina intradérmica en humanos durante el deterioro de la anestesia regional intravenosa con mepivacaína. Reg Anesth Pain Med 1998;23:402–408.
- Choyce A, Peng P: Una revisión sistemática de complementos para anestesia regional intravenosa para procedimientos quirúrgicos. Can J Anaesth 2002;49: 32–45.
- Kleinschmidt S, Stockl W, Wilhelm W, et al: La adición de clonidina a la prilocaína para la anestesia regional intravenosa. Eur J Anaesthesiol 1997;14:40–46.
- Cucchia G, Chasot-Di Dio V, et al: Efecto de la adición de clonidina al anestésico local durante el bloqueo de Bier en la analgesia pre y postoperatoria. Br J Anaesth 1997;78(Suplemento 1):78–79.
- Ivie CS, Viscomi CM, Adams DC, Friend AF, Murphy TR, Parker CJ: La clonidina como complemento de la anestesia regional intravenosa: un estudio aleatorizado, doble ciego, de rango de dosis controlado con placebo. Anaesthesiol Clin Pharmacol 2011;27(3):323–327.
- Memis D, Turan A, Karamanlioglu B, et al: Agregar dexmedetomidina a la lidocaína para la anestesia regional intravenosa. Anesth Analg 2004;98: 835–840.
- Kol IO, Ozturk H, Kaygusuz K, Gursoy S, Comert B, Mimaroglu C: Adición de dexmedetomidina o lornoxicam a prilocaína en anestesia regional intravenosa para cirugía de mano o antebrazo: un estudio controlado aleatorio. Clin Drug Investig 2009;29(2):121–129.
- Mirzak A, Gul R, Erkutlu I, Alptekin M, Oner U: premedicación con dexmedetomidina sola o junto con lidocaína al 0.5 % para IVRA. J Surg Res 2010;164(2):242–247.
- Fields H, Emson P, Leigh B, et al: Múltiples sitios receptores de opiáceos en fibras aferentes primarias. Naturaleza 1980; 284: 351–353.
- Young W, Wamsley J, Zarbin M, et al: Los receptores opioides experimentan flujo axonal. Ciencia 1980; 210: 76–78.
- Boogaerts J, Balatoni E, Lafont N, et al: Utilization des morphiniques dans les blocs neuralux peripheriques. Congreso Ser Ars Medicina 1985;3:143–150.
- Gobeaux D, Landais A: Utilization de deux morphiniques dans les blocs du plexus brachial. J Can Anesth 1988;36:437–440.
- Gobeaux D, Landais A, Bexon G, et al: Adjunción de fentanilo la lidocaína adrenalina para el bloqueo del plexo braquial. J Can Anesth 1987;35:195–199.
- Viel E, Eledjam J, de la Coussaye J, et al: Bloqueo del plexo braquial con opioides para el alivio del dolor posoperatorio: Comparación entre buprenorfina y morfina. Reg Anesth 1989; 14:274–278.
- Candido K, Khan M, Raja D, et al: Bloqueo del plexo braquial para el alivio del dolor posoperatorio. Reg Anesth 2000; 25:23.
- Arhtur J, Mian T, Heavner J, et al: Fentanilo y lidocaína versus lidocaína para el bloqueo de Bier. Reg Anesth 1992; 17: 223–227.
- Bobart V, Hartmannsgruber M, Atanassoff P, et al: analgesia/anestesia después de fentanilo más lidocaína frente a lidocaína simple para anestesia regional intravenosa. Anesth Analg 1998:86:S-3.
- Pitkanen M, Rosenberg P, Pere P, et al: mezcla de fentanilo y prilocaína para anestesia regional intravenosa en pacientes sometidos a cirugía. Anestesia 1992;47:395–398.
- Armstrong P, Power I, Wildsmith J: Adición de fentanilo a prilocaína para anestesia regional intravenosa. Anestesia 1991;46:278–280.
- Gupta A, Begntsson M, Bjornsson A, et al: Falta de efecto analgésico periférico de morfina en dosis bajas durante la anestesia regional intravenosa. Reg Anesth 1993; 18:250–253.
- Abdulla W, Fadhil N: Un nuevo enfoque para la anestesia regional intravenosa. Anesth Analg 1992;75:597–601.
- Sztark F, Thicoipe M, Favarel-Garriques J, et al: El uso de lidocaína al 0.25 % con fentanilo y pancuronio para la anestesia regional intravenosa. Anesth Analg 1997;84:777–779.
- Subxedar D, Gevirtz C, Malik V, et al: anestesia regional intravenosa: evaluación prospectiva de lidocaína al 0.25 % con fentanilo y rocuronio. Reg Anesth 1997; 22:41.
- Thapar P, Skerman J: Evaluación de lidocaína al 0.2 % con fentanilo y D-tubocurarina para anestesia regional intravenosa. Reg Anesth 1997; 84: S342.
- Santhosh MC, Rohini BP, Roopa S, Raghavendra PR: Estudio de lidocaína al 0.5 % sola y combinación de lidocaína al 0.25 % con fentanilo y vecuronio en anestesia regional intravenosa para cirugías de miembros superiores. Rev Bras Anestesiol 2013;63(3):254–257.
- Acalovschi I, Cristea T: Anestesia regional intravenosa con meperidina. Anesth Analg 1995;81:539–543.
- Acalovschi I, Cristea T, Margarit S, et al: Tramadol agregado a lidocaína para anestesia regional intravenosa. Anesth Analg 2001;92:209–214.
- Tan S, Pay L, Chan S: anestesia regional intravenosa con lignocaína y tramadol. Ann Acad Med Singapur 2001;30:516–519.
- Alayurt S, Memis D, Pamucku Z: La adición de sufentanilo, tramadol o clonidina a la lignocaína para la anestesia regional intravenosa. Anaesth Cuidados Intensivos 2004;32:22–27.
- Kurt N, Kurt I, Aygunes B, et al: Efectos de agregar alfentanilo o atracurio a la solución de lidocaína para la anestesia regional intravenosa. Eur J Anaesthesiol 2002;19:522–525.
- Elhakim M, Sadek R: Adición de atracurio a la lidocaína para la anestesia regional intravenosa. Acta Anaesthesiol Scand 1994;38:542–544.
- McCartney C, Brill S, Rawson R, et al: Ningún beneficio anestésico o analgésico de neostigmina 1 mg agregado a la anestesia regional intravenosa con lidocaína al 0.5% para cirugía de la mano. Reg Anesth Pain Med 2003;28:414–417.
- Turan A, Karamanlyoglu B, Memis D, et al: Anestesia regional intravenosa con prilocaína y neostigmina. Anesth Analg 2002;95: 1419–1422.
- Sethi D, Wason R: Anestesia regional intravenosa con lidocaína y neostigmina para cirugía de miembros superiores. J Clin Anesth 2010;22(5): 324–328.
- Singh R, Bhagwat A, Bhadoria P, Kohli A: Forearm IVRA, usando lidocaína al 0.5 % en una dosis de 1.5 mg/kg con ketorolaco 0.15 mg/kg para cirugías de mano y muñeca. Minerva Anestesiol 2010;76(2):109–114.
- Jones N, Pugh S: La adición de tenoxicam a la prilocaína para la anestesia regional intravenosa. Anestesia 1996;51:446–448.
- Sertoz N, Kocaoglu N, Ayanoglu HO: Comparación de lornoxicam y fentanilo cuando se agrega a la lidocaína en anestesia regional intravenosa. Rev Bras Anestesiol 2013;63(4):311–316.
- Yurtlu S, Hanci V, Kargi E, Erdogan G, et al: El efecto analgésico del dexketoprofeno cuando se agrega a la lidocaína para la anestesia regional intravenosa: un estudio prospectivo, aleatorizado y controlado con placebo. J Int Med Res 2011;39(5):1923–1931.
- Bengtsson A, Bengtsson M, Nilsson I, et al: Efectos de la administración intravenosa regional de metilprednisolona más mepivacaína en la artritis reumatoide. Scand J Rheumatol 1998;27:277–280.
- Taskaynatan M, Ozgul A, Tan A, et al: Bloque Bier con metilprednisolona y lidocaína en SDRC tipo 1: un estudio aleatorizado, doble ciego, controlado con placebo. Reg Anesth Pain Med 2004;29:408–412.
- Varitimidis SE, Papatheodorou LK, Dailiana ZH, Poultsides L, Malizos KN: Síndrome de dolor regional complejo tipo I como consecuencia de trauma o cirugía en la extremidad superior: manejo con anestesia regional intravenosa, utilizando lidocaína y metilprednisolona. J Hand Surg Eur 2011;36(9):771–777.
- Sen H, Kulachi Y, Bicerer E, Ozkan S, Dagli G, Turan A: El efecto analgésico del paracetamol cuando se agrega a la lidocaína para la anestesia regional intravenosa. Anesth Analg 2009;109(4):1327–1330.
- Ko MJ, Lee JH, Cheong SH, et al: Comparación de los efectos del paracetamol con el ketorolaco cuando se agrega a la lidocaína para la anestesia regional intravenosa. Korean J Anesthesiol 2010;58(4):357–361.
- Sen S, Ugur B, Aydin ON, et al: El efecto analgésico de la nitroglicerina añadida a la lidocaína en la anestesia regional intravenosa. Anesth Analg 2006;102(3):916–920.
- Lauretti GR, Perez MV, Reis MP, Pereira NL: Evaluación doble ciego de la nitroglicerina transdérmica como adyuvante de la morfina oral para el tratamiento del dolor por cáncer. J Clin Anesth 2002:14:83–86).
- Lauretti GR, de Olivera R, Reis MP, et al: La nitroglicerina transdérmica mejora la analgesia postoperatoria de sufentanilo espinal después de una cirugía ortopédica. Anestesiología 1999;90:734–739.
- Ferreira SH, Lorenzette BB, Faccioli LH: bloqueo de hiperalgesia y edema neurogénico por aplicación tópica de NTG. Eur J Pharmacol 1992;217:207–209.
- Jaro K, Batra YK, Panda NB: El bloqueo del plexo braquial con midazolam y bupivacaína mejora la analgesia. Can J Anaesth 2005;52:822–826.
- Laig N, Khan MN, Arif M, Khan S: Midazolam con bupivacaína para mejorar la calidad de la analgesia en el bloqueo del plexo braquial para cirugías de miembros superiores. J Coll Médicos Surg Pak 2008;18:674–678.
- Nishiyama T, Tamai H, Hanaoka K: Concentraciones de midazolam en suero y líquido cefalorraquídeo después de la administración epidural en perros. Anesth Analg 2003;96:159–162.
- Bhisitkul RB, Villa JE, Kocsis JD: Los receptores axonales GABA están presentes selectivamente en fibras sensoriales normales y regeneradas en nervios periféricos de rata. Exp Brain Res 1987: 66: 659–663.
- Brown DA, Marsh S: Receptores axonales GABA en troncos nerviosos periféricos de mamíferos. Cerebro Res 1978; 156: 187–191.
- Cairns BE, Sessle BJ, Hu JW: La activación de los receptores GABA-A periféricos inhibe la actividad muscular mandibular provocada por la articulación temporomandibular. J Neurofisiol 1999;81:1966–1969.
- Kontinen VK, Dickenson AH: Efectos del midazolam en el modelo de ligadura del nervio espinal del dolor neuropático en ratas. Dolor 2000;85:425–431.
- Farouk S, Aly AJ: Calidad de la analgesia con lidocaína con y sin midazolam para la anestesia regional intravenosa. J Anesth 2010;24(6): 864–868.
- Kashefi P, Montazeri K, Honarmand A, Safavi M, Hosseini HM: El efecto analgésico del midazolam cuando se agrega a la lidocaína para la anestesia regional intravenosa. J Res Med Sci 2011;16(9):1139–1148.
- Carlton SM, Hargett GL, Coggeshall RE: Localización y activación de receptores de glutamato en axones mumelinados de piel glabra de rata. Neurosci Lett 1995;197:25–28.
- Brau ME, Sander F, Vogel W, Hempelmann G: Mecanismos de bloqueo de la ketamina y sus enantiómeros en el nervio periférico desmielinizado enzimáticamente según lo revelado por experimentos de un solo canal. Anestesiología 1997;86:394–404.
- Viscomi CM, Friend C, Parker C, Murphy T, Yarnell M: Ketamina como adyuvante en la anestesia regional intravenosa con lidocaína: un ensayo de control sistémico, aleatorizado, doble ciego. Reg Anesth Pain Med 2009;34(2): 130–133.
- Georgias NK, Maidatsi PG, Kyriakidis AM, et al: Clonidina versus ketamina para prevenir el dolor del torniquete durante la anestesia regional intravenosa con lidocaína. Reg Anesth Pain Med 2001;26(6):512–517.
- Livingstone J, Atkins R: Bloqueo intravenoso de guanetidina regional en el tratamiento del síndrome de dolor regional complejo postraumático 1 (algodistrofia) de la mano. J Bone Joint Surg Br 2002;84:380–386.
- Ramamurthy S, Hoffman J: Guanetidina regional intravenosa en el tratamiento de la distrofia/causalgia simpática refleja. Un estudio aleatorizado, doble ciego. Grupo de estudio de guanetidina. Anesth Analg 1995;81: 718–723.
- Hord A, Rooks M, Stephens B, et al: Bretilio regional intravenoso y lidocaína para el tratamiento de la distrofia simpática refleja: un estudio aleatorizado, doble ciego. Anesth Analg 1992;74:818–821.
- Lee F, Shoemaker J, McQuillan P, et al: Efectos del bloqueo de Bier en el antebrazo con bretilio en las respuestas hemodinámicas y metabólicas al agarre manual. Am J Physiol Heart Circ 2000;279:H586–H593.
- Bader A, Concepcion M, Hurley R, et al: Comparación de lidocaína y prilocaína para anestesia regional intravenosa. Anestesiología 1988;69: 409–412.
- Tucker G, Boas R: aspectos farmacocinéticos de la anestesia intravenosa. Anestesiología 1971;34:538–549.
- Ware R: Anestesia regional intravenosa con bupivacaína. Una comparación doble ciego con lidocaína. Anestesia 1979;34:231–235.
- Smith C, Steinhaus J, Haynes C: La seguridad y eficacia de la anestesia regional intravenosa. South Med J 1968;61:1057–1060.
- Guay J: Eventos adversos asociados a la anestesia regional intravenosa (Bier Block): Una revisión sistemática de las complicaciones. J Clin Anesth 2009;21: 585–594.
- Bartholomew K, Sloan J: Prilocaína para el bloqueo de Bier: ¿Qué tan seguro es seguro? Arch Emerg Med 1990;7:189–195.
- Sukhani R, Garcia C, Munhall R, et al: Disposición de lidocaína después de anestesia regional intravenosa con diferentes técnicas de desinflado Anesth Analg 1989;68:633–637.
- Mazze R, Dunbar R: Concentraciones plasmáticas de lidocaína después de bloqueo epidural lumbar, caudal, axilar y anestesia regional intravenosa. Anestesiología 1966;27:574–579.
- Dunbar R, Mazze R: Anestesia regional intravenosa: experiencia con 779 casos. Anesth Analg 1967;46:806–813.
- Davies J, Walford A: Anestesia regional intravenosa para cirugía de pie. Acta Anaesthesiol Scand 1986;30:145–147.
- Kim D, Shuman C, Sadr B: Anestesia regional intravenosa para cirugía ambulatoria de pie y tobillo. Un estudio prospectivo. Ortopedia 1993:16; 1109–1113.
- Cotev S, Robin G: Estudios experimentales sobre anestesia regional intravenosa con lignocaína radiactiva. Hermano J Anaesth 1966;38:936–940.
- Hargrove R, Hoyle J, Parker J: niveles de lidocaína en sangre después de la analgesia regional intravenosa. Anestesia 1996;21:37–41.
- Larsen U, Hommelgaard P: Parálisis por torniquete neumático después de anestesia regional intravenosa. Anestesia 1987;42:526–528.
- Shaw-Wilgis E: Observaciones sobre los efectos de la isquemia del torniquete. J Bone Joint Surg 1971;1104:190.
- Mabee J, Bostwick T, Burke M: Síndrome compartimental iatrogénico por inyección de solución salina hipertónica en el bloque Bier. J Emerg Med 1994;12: 473-476.
- Quigley J, Popich G, Lanz U: síndrome compartimental del antebrazo y la mano: reporte de un caso. Clin Orthop 1981; 161:247–251.
- Hastings H 2nd, Misamore G: Síndrome compartimental resultante de anestesia regional intravenosa. J Hand Surg 1987;12:559–562.
- Domínguez E: Angustiosa sensación de miembro fantasma en las extremidades superiores durante la anestesia regional intravenosa. Reg Anesth Pain Med 2001;26:72–74.
- Luce E, Mangubat E: Pérdida de la mano y el antebrazo tras el bloqueo de Bier: informe de un caso. J Hand Surg 1983;8:280–283.
- Lee LA, Posner K, Domino KB, et al: Lesiones asociadas con la anestesia regional en los años 1980 y 1990. Un análisis de siniestros cerrados. Anestesiología 2004;101:143–152.
- Kennedy B, Duthie A, Parbrook G, Carr T: Anestesia regional intravenosa: una evaluación. Br Med J 1965;5440:954–957.

