Honorio T. Benzon, Rasha S. Jabri und Tom C. Van Zundert
EINFÜHRUNG
Das intraspinale Hämatom ist eine relativ seltene Erkrankung, die auf eine Vielzahl von Ursachen zurückzuführen ist. Traumatische Ursachen sind Lumbalpunktion und Neuraxialanästhesie. Es tritt eher bei antikoagulierten oder thrombozytopenischen Patienten, Patienten mit neoplastischen Erkrankungen oder bei Patienten mit Lebererkrankungen oder Alkoholismus auf. Etwa ein Viertel bis ein Drittel aller Fälle sind mit einer Antikoagulationstherapie verbunden. Das Risiko einer intraspinalen Hämatombildung nach Verabreichung einer neuraxialen Anästhesie und Analgesie ist bei Patienten erhöht, die eine Antikoagulanzientherapie erhalten haben oder an einer Gerinnungsstörung leiden. Aus diesem Grund ist eine neuroaxiale Anästhesie bei Vorliegen einer Koagulopathie oft kontraindiziert. Andere Risikofaktoren für die Entwicklung eines epiduralen oder spinalen Hämatoms umfassen technische Schwierigkeiten (mehrere Versuche) bei der Durchführung der neuraxialen Verfahren aufgrund anatomischer Anomalien der Wirbelsäule und mehrfacher oder blutiger Punktionen.
Die Inzidenz von spinalen Hämatomen wurde ursprünglich mit einer von 150,000 Epiduralanästhetika und einer von 220,000 Spinalanästhetika angegeben. Jüngste epidemiologische Studien haben gezeigt, dass spinale Hämatome häufiger auftreten und von einem von 2700 bis zu einem von 19,505 Epiduralanästhesien reichen. Die jüngste Studie zeigte ein Gesamtrisiko von 1 zu 21,643 epiduralen Injektionen. Ältere Menschen (einer von 3800) sind aufgrund von degenerativen Wirbelsäulenanomalien, Osteoporose und peripheren Gefäßerkrankungen einem erhöhten Risiko ausgesetzt. Geburtshelfer scheinen eine geringere Inzidenz von spinalen Hämatomen zu haben (eins von 200,000), wahrscheinlich sekundär zu dem hyperkoagulierbaren Zustand der Schwangerschaft, der größeren Kapazität des Epiduralraums bei jüngeren Gebärenden und einem höheren intraepiduralen Druck. Basierend auf einer kürzlich durchgeführten großen retrospektiven Studie kann die Inzidenz epiduraler Hämatome bei Patienten mit abnormaler Gerinnung nur bei einem von 315 Patienten liegen.
Die Einführung von niedermolekularem Heparin (LMWH) war mit einem Anstieg der Inzidenz von spinalen Hämatomen verbunden, was zu einer Warnung der Food and Drug Administration (FDA) und der Einführung der ersten Konsenserklärung zur Regionalanästhesie bei Patienten führte zu Antikoagulanzien von der American Society of Regional Anästhesie und Schmerzmedizin (ASRA) im Jahr 1998. Die Richtlinien basierten auf einer umfassenden Literaturrecherche und der Pharmakologie der verschiedenen Antikoagulanzien.
Es wurden Empfehlungen zum Zeitpunkt der neuraxialen Nervenblockade, der Entfernung des Epiduralkatheters und der anschließenden Verabreichung von Antikoagulanzien gegeben. Insbesondere die Verwendung niedriger Konzentrationen von Lokalanästhetika zur epiduralen Infusion (um die motorische Kraft für eine einfachere Überwachung zu erhalten) und die anschließende neurologische Überwachung wurden von der ASRA empfohlen. Die 1998 veröffentlichten und 2003 und 2010 aktualisierten Konsensleitlinien haben Ärzten bei der Entscheidungsfindung im Hinblick auf den Einsatz neuraxialer Verfahren im Rahmen einer Antikoagulationstherapie eine große Hilfestellung geleistet. Zwei weitere Richtlinien, die von der European Society of Anaesthesiology und der Scandinavian Society of Anaesthesiology and Intensive Care Medicine herausgegeben wurden, haben in Europa Einfluss.
In diesem Kapitel erörtern wir die Bedeutung gängiger Antikoagulanzien und hoffen, dem Leser einen Leitfaden für die Entscheidungsfindung über den Einsatz von neuroaxialer Anästhesie und peripheren Nervenblockaden (PNB) in der klinischen Praxis zu bieten. Wir werden auch die neuen Antikoagulanzien besprechen, Medikamente, die in den neuesten ASRA-Richtlinien nicht ausreichend und nur teilweise von den europäischen und skandinavischen Richtlinien abgedeckt wurden. Folgen Sie dem Link, um mehr darüber zu erfahren Diagnose und Behandlung von spinalen und peripheren Nervenhämatomen.
Thrombozytenaggregationshemmung
Thrombozytenaggregationshemmer hemmen das Thrombozytenenzym Cyclooxygenase und verhindern die Synthese von Thromboxan A2. Thromboxan A2 ist ein starker Vasokonstriktor, der die sekundäre Thrombozytenaggregation und Freisetzungsreaktionen erleichtert. Die Rolle der Blutplättchen bei der Blutgerinnung und Hämostase ist in dargestellt Figuren 1 und 2. Blutplättchen von Patienten, die diese Medikamente einnehmen, haben eine normale Blutplättchenadhärenz am Subendothelium und eine normale primäre hämostatische Pfropfenbildung. Es kann sich ein adäquates, wenn auch potenziell zerbrechliches Gerinnsel bilden. Obwohl solche Pfropfen zufriedenstellende hämostatische Barrieren für kleinere vaskuläre Läsionen sein können, stellen sie möglicherweise keine angemessene perioperative hämostatische Gerinnselbildung sicher. Bei Patienten, die Thrombozytenaggregationshemmer erhalten, sollte davon ausgegangen werden, dass die Thrombozytenfunktion für 1 Woche mit Aspirin und für 1–6 Tage mit nichtsteroidalen Antirheumatika (NSAIDs) verringert ist. Diese Annahme berücksichtigt nicht die kontinuierliche Bildung neuer, funktionsfähiger Blutplättchen. Die kontinuierliche Produktion frischer, normal funktionierender Blutplättchen, kombiniert mit der Restfunktion bereits zirkulierender Blutplättchen, könnte die relative Sicherheit der Durchführung von neuraxialen Verfahren bei diesen Patienten erklären.
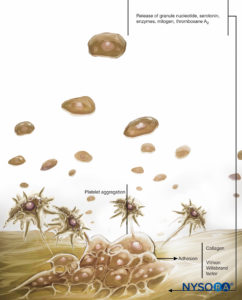
ABBILDUNG 1. Rolle der Blutplättchen bei der Blutgerinnung. Blutplättchen üben ihre Rolle bei der Hämostase durch drei grundlegende Reaktionen aus: Adhäsion, Aktivierung (und Sekretion) und Aggregation. Wenn das vaskuläre Endothel beschädigt ist, binden Blutplättchen durch einen Prozess, der als Adhäsion bezeichnet wird, schnell an das Subendothel.
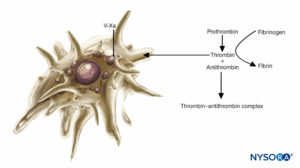
ABBILDUNG 2. Rolle der Blutplättchen bei der Blutgerinnung: Blutplättchen unterstützen Plasmagerinnungsreaktionen. Bei Aktivierung binden Blutplättchen mehrere Plasmaproteinkomplexe und sezernieren eine aktivierte Form von Faktor V (Faktor Va), die an die Blutplättchenoberfläche bindet und Faktor Xa bindet. Plättchengebundener Faktor Xa beschleunigt dann die Umwandlung von Prothrombin zu Thrombin.
Das Risiko epiduraler und spinaler Hämatome bei Patienten unter Thrombozytenaggregationshemmern wurde durch einen Fallbericht über eine spontane epidurale Hämatombildung ohne Spinal- oder Epiduralanästhesie bei einem Patienten mit Aspirin-Einnahme in der Anamnese erhöht. Vandermeulen und Kollegen implizierten eine Thrombozytenaggregationshemmung in 3 der 61 Fälle von spinalen Hämatomen, die nach Spinal- oder Epiduralanästhesie auftraten. Andere Studien haben ein relativ geringes Risiko für spinale Hämatome bei Patienten unter Aspirin oder NSAIDs gezeigt, die sich einem neuraxialen Eingriff unterziehen. Die Collaborative Low-dose Aspirin Study in Pregnancy (CLASP)-Gruppe umfasste 1422 geburtshilfliche Hochrisikopatientinnen, die täglich 60 mg Aspirin erhielten und sich einer Epiduralanästhesie ohne neurologische Folgen unterzogen. In einer retrospektiven Studie mit 1013 Spinal- und Epiduralanästhetika, bei denen 39 % der Patienten Thrombozytenaggregationshemmer einnahmen, einschließlich 11 % der Patienten, die mehrere Thrombozytenaggregationshemmer erhielten, entwickelte kein Patient Anzeichen eines spinalen Hämatoms.
Die Patienten unter Thrombozytenaggregationshemmern zeigten jedoch eine höhere Inzidenz von Blutaspiration durch die Spinal- oder Epiduralnadel oder den Katheter. Eine anschließende prospektive Studie mit 1000 Patienten, von denen 39 % über eine präoperative Thrombozytenaggregationshemmung berichteten, stellte fest, dass keine hämorrhagischen Komplikationen auftraten. Daher war die präoperative Thrombozytenaggregationshemmung kein Risikofaktor für eine blutige Nadel- oder Katheterplatzierung. Weibliches Geschlecht, höheres Alter, übermäßige Blutergüsse oder Blutungen in der Vorgeschichte, kontinuierliche Kathetertechnik, große Nadelstärke, mehrere Versuche und schwierige Nadelplatzierung wurden als signifikante Risikofaktoren festgestellt. Klinische Studien mit Patienten in Schmerzkliniken ähneln denen, die sich einer Operation unterziehen. Patienten unter Aspirin oder NSAIDs, die epiduralen Steroidinjektionen unterzogen wurden, entwickelten keine Anzeichen oder Symptome eines intraspinalen Hämatoms.
Die fehlende Korrelation zwischen Thrombozytenaggregationshemmern und blutiger Nadel- oder Katheterplatzierung liefert einige Hinweise darauf, dass die präoperative Thrombozytenaggregationshemmung keinen signifikanten Risikofaktor für die Entwicklung einer neurologischen Dysfunktion aufgrund eines spinalen Hämatoms bei Patienten unter Thrombozytenaggregationshemmern darstellt. Es sollte beachtet werden, dass es Fallberichte über intraspinale Hämatome bei Patienten gab, die Aspirin oder NSAIDs erhielten, obwohl es in diesen Fallberichten erschwerende Faktoren gab. Dazu gehörten die gleichzeitige Verabreichung von Heparin, gleichzeitig bestehende epidurale venöse Angiome und technische Schwierigkeiten bei der Durchführung des Verfahrens. In jüngerer Zeit wurden weitere Fallberichte über spinale Hämatome im Zusammenhang mit schmerzinterventionellen Verfahren veröffentlicht, insbesondere mit Platzierungen zur Rückenmarkstimulation.
Basierend auf der verfügbaren Evidenz hat die ASRA mehrere Empfehlungen zu Thrombozytenaggregationshemmern abgegeben. Die präoperative Thrombozytenaggregationshemmung stellt keinen signifikanten Risikofaktor für die Entwicklung einer neurologischen Dysfunktion aufgrund eines spinalen Hämatoms bei Patienten unter Thrombozytenaggregationshemmern dar. Das Risiko von Blutungskomplikationen kann jedoch bei Patienten erhöht sein, die mehrere Thrombozytenaggregationshemmer einnehmen und gleichzeitig andere Medikamente einnehmen, die die Gerinnungsmechanismen beeinflussen, wie z. B. orale Antikoagulanzien, Standardheparin und LMWH.
NYSORA-Tipps
- Es ist wahrscheinlich sicher, neuroaxiale und regionale Anästhesieverfahren bei Patienten unter Aspirin und NSAIDs durchzuführen.
- Zu den Risikofaktoren für vermehrte Blutungen und spinale Hämatome gehören die Einnahme mehrerer Thrombozytenaggregationshemmer und mehrere Versuche des Patienten.
Aspirin und interventionelle Schmerzverfahren
Es gab mehrere Fallberichte über spinale Hämatome nach epiduraler Steroidinjektion oder Platzierung oder Entfernung eines Rückenmarkstimulators bei Patienten, die nur Aspirin oder NSAIDs erhielten oder wenn die ASRA-Richtlinien befolgt wurden. Diese Vorkommnisse können mit den bei diesen Patienten häufig festgestellten Wirbelsäulenanomalien, dem Vorhandensein einer Fibrose nach einer Wirbelsäulenoperation, größeren Nadeln, die bei der Platzierung von Rückenmarksstimulatoren verwendet werden, oder den häufigen Manipulationen (Vorschieben und Zurückziehen) der Elektroden zusammenhängen.
Medikamente, die zur Schmerzbehandlung eingesetzt werden, verursachen ebenfalls Blutungen; Dazu gehören Oxcarbazepin und die selektiven Serotonin-Wiederaufnahmehemmer. Aus diesen Gründen arbeitete die ASRA mit der European Society of Regional Anasthetic and Pain Therapy, der American Academy of Pain Medicine, der International Neuromodulation Society, der North American Neuromodulation Society und dem World Institute of Pain zusammen, um spezifische Richtlinien für interventionelle Schmerzverfahren zu formulieren . Im Gegensatz zu den ASRA-Leitlinien für Regionalanästhesie empfahlen die gesellschaftsübergreifenden Leitlinien, Aspirin für 4–6 Tage vor interventionellen Schmerzeingriffen abzusetzen.
NYSORA-Tipps
Die Richtlinien zu interventionellen Schmerzverfahren bei Patienten mit Thrombozytenaggregationshemmern und gerinnungshemmenden Medikamenten sind restriktiver als die zur Regionalanästhesie.
COX-2-Hemmer und P2Y12-Hemmer
Cyclooxygenase-2 (COX-2)-Inhibitoren gewannen aufgrund ihrer analgetischen Eigenschaften und des Fehlens von Blutplättchen- und gastrointestinalen Wirkungen an Popularität, und Studien haben ihre analgetische Eigenschaft in einer Vielzahl von perioperativen Situationen gezeigt.
Die Medikamente haben eine minimale gastrointestinale (GI) Toxizität und sind ideal für Patienten, die einem erhöhten Risiko für schwerwiegende unerwünschte Ereignisse im oberen GI-Trakt ausgesetzt sind. Im Vergleich zu Aspirin oder NSAIDs war die Wirkung von COX-2-Hemmern auf die Thrombozytenaggregation und die Blutungszeiten nicht anders als bei Placebo. Der Blutverlust steigt während einer Spondylodese-Operation nicht an, wenn präoperativ COX-2-Hemmer verabreicht werden. Die Thrombozyteneigenschaften dieser Medikamente machen sie ideal für den perioperativen Einsatz, wenn eine neuraxiale Anästhesie geplant ist. Leider wurden Rofecoxib und Valdecoxib wegen ihrer kardiovaskulären Nebenwirkungen vom Markt genommen, sodass nur noch Celecoxib verfügbar ist, jedoch in niedrigeren Dosierungen als zuvor empfohlen.
Die Thienopyridin-Medikamente Ticlopidin und Clopidogrel haben keinen direkten Einfluss auf den Arachidonsäure-Stoffwechsel. Diese Medikamente verhindern die Thrombozytenaggregation, indem sie die Adenosindiphosphat (ADP)-Rezeptor-vermittelte Thrombozytenaktivierung hemmen. Sie modulieren auch die glatte Gefäßmuskulatur und reduzieren die Gefäßkontraktion. Ticlopidin wird selten verwendet, da es Neutropenie, thrombozytopenische Purpura und Hypercholesterinämie verursacht.
Clopidogrel wird aufgrund seines verbesserten Sicherheitsprofils und seiner nachgewiesenen Wirksamkeit bevorzugt. Es wurde festgestellt, dass es bei Patienten mit peripherer Gefäßerkrankung besser ist als Aspirin. Die maximale Hemmung der ADP-induzierten Thrombozytenaggregation mit Clopidogrel tritt 3–5 Tage nach Beginn einer Standarddosis (75 mg), aber innerhalb von 4–6 Stunden nach Verabreichung einer großen Aufsättigungsdosis von 300–600 mg auf. Normalerweise wird den Patienten vor einer perkutanen Koronarintervention (PCI) eine große Aufsättigungsdosis verabreicht. Es gibt einen Fallbericht über spinale Hämatome bei einem Patienten unter Ticlopidin. Obwohl bei einem Patienten unter Clopidogrel allein kein Fall eines intraspinalen Hämatoms aufgetreten ist, wurde ein Fall von Tetraplegie bei einem Patienten unter Clopidogrel, Diclofenac und Aspirin berichtet.
Für die Thienopyridin-Medikamente wird empfohlen, Ticlopidin für 10–14 Tage und Clopidogrel für 7 Tage vor der neuraxialen Injektion abzusetzen. Es liegen Fallberichte zur Sicherheit einer Spinalanästhesie 5 Tage nach Absetzen von Clopidogrel vor. Eine Studie zeigte, dass die meisten Patienten 5 Tage nach Absetzen von Clopidogrel eine minimale Thrombozytenhemmung aufwiesen. Wenn 5–6 Tage nach Absetzen von Clopidogrel ein neuraxialer Eingriff durchgeführt werden muss, sollte ein P2Y12-Test oder ein anderer geeigneter Test durchgeführt werden, um sicherzustellen, dass die Thrombozytenaktivität nur minimal oder gar nicht gehemmt wird.
NYSORA-Tipps
- Die ASRA-Leitlinien empfehlen ein 7-tägiges Intervall zwischen dem Absetzen von Clopidogrel und einem neuraxialen Eingriff.
- Wenn eine Spinal- oder Epiduralanästhesie indiziert ist, wird ein Test der Thrombozytenfunktion empfohlen, um sicherzustellen, dass die verbleibende Thrombozytenhemmung verschwunden oder vernachlässigbar ist.
Bei einer Rückenmarkstimulationsstudie kann eine 5-tägige Unterbrechung eingehalten werden, da der Patient während der Studie Clopidogrel abgesetzt wird. Ein Test der Thrombozytenfunktion (z. B. der VerifyNow P2Y12-Assay oder der Thrombozytenkartierungsteil des Thrombelastographen [TEG]) muss durchgeführt werden, um eine ausreichende Thrombozytenaktivität sicherzustellen.
Neuere Thrombozytenaggregationshemmer
Clopidogrel ist der häufig verwendete Thrombozytenaggregationshemmer in der dualen Thrombozytenaggregationshemmung, bei der Aspirin mit einem P2Y12-Rezeptor-Inhibitor bei Patienten mit akutem Koronarsyndrom kombiniert wird. Prasugrel ist ein Prodrug ähnlich wie Clopidogrel, aber mit heilsamen Eigenschaften gegenüber Clopidogrel, und Ticagrelor ist ein direkt wirkender P2Y12-Rezeptor-Inhibitor. Die mediane Zeit bis zum Einsetzen der maximalen Wirkung beträgt 1 Stunde mit Prasugrel und 4 Stunden mit Clopidogrel. Die mittlere Zeit bis zum Erreichen der maximalen Plasmakonzentration mit Prasugrel beträgt 30 Minuten und die mittlere Halbwertszeit 3.7 Stunden. Diese Werte spiegeln nicht die Dauer der Thrombozytenhemmung wider, da die Hemmung des P2Y12-Rezeptors irreversibel ist. Nach Absetzen von Prasugrel dauert es 7 Tage, bis sich die Thrombozytenaktivität normalisiert hat.
Prasugrel und Ticagrelor bewirken eine 90-prozentige Hemmung der Thrombozytenfunktion im Vergleich zu 60–70 % bei Clopidogrel. Patienten mit einem niedrigen Body-Mass-Index (BMI), Patienten über 75 Jahren und Patienten mit Schlaganfällen in der Vorgeschichte haben ein erhöhtes Blutungsrisiko. Im Gegensatz zu Clopidogrel wird Prasugrel zuverlässig in seinen aktiven Metaboliten umgewandelt und hat keine Arzneimittelwechselwirkungen. Außerdem ist es nicht anfällig für genetische Polymorphismen.
Ticagrelor bindet reversibel an den P2Y12-Rezeptor und blockiert die ADP-vermittelte Rezeptoraktivierung. Im Gegensatz zu den Thienopyridinen zeigen der aktive Metabolit und das Ausgangsarzneimittel eine Thrombozytenaggregationshemmung, wobei das Ausgangsarzneimittel für den Großteil der In-vivo-Blutplättchenhemmung verantwortlich ist. Die gerinnungshemmende Wirkung von Ticagrelor ist schnell; Die höchste Thrombozytenhemmung tritt 2 bis 4 Stunden nach der Einnahme auf, verglichen mit 24 Stunden bei Clopidogrel. Die mittlere Thrombozytenhemmung durch Ticagrelor beträgt 93 % im Vergleich zu 58 % für Clopidogrel. Die Erholung der Blutplättchen ist mit Ticagrelor schnell; 5 Tage nach der letzten Dosis ist die Thrombozytenaktivität normal.
Zeit zwischen Absetzen/Wiederaufnahme eines Thrombozytenaggregationshemmers und neuraxialer Injektion
Das Intervall zwischen dem Absetzen eines Thrombozytenaggregationshemmers und der neuraxialen Injektion basiert auf der prozentualen Thrombozytenhemmung und dem prozentualen Thrombozytenumsatz. Prasugrel und Ticagrelor bewirken eine Hemmung von 90 %. Zehn bis 15 Prozent des zirkulierenden Thrombozytenpools werden jeden Tag gebildet, was dazu führt, dass 50 bis 75 Tage nach Absetzen des Medikaments neue Thrombozyten 5–7 % des zirkulierenden Thrombozytenpools ausmachen. Für Ticagrelor wird ein Intervall von 5–7 Tagen und für Prasugrel ein Intervall von 7–10 Tagen empfohlen. Diese Empfehlungen sind angemessen, da sich die Thrombozytenaggregation 7 Tage nach Absetzen von Prasugrel und 5 Tage nach Ticagrelor normalisiert.
Die skandinavischen Richtlinien weisen darauf hin, dass es akzeptabel ist, die Thrombozytenaggregationshemmer zum Zeitpunkt der Katheterentfernung wieder aufzunehmen, während die Richtlinien der European Society of Anaesthesiology ein Intervall von 6 Stunden zwischen der Entfernung des Epiduralkatheters und der Wiederaufnahme der Behandlung mit Prasugrel oder Ticagrelor empfehlen. Andere Übersichtsarbeiten haben aufgrund ihrer schnellen Wirkung und starken Thrombozytenaggregationshemmung Vorsicht bei der Wiederaufnahme der Behandlung mit Prasugrel und Ticagrelor empfohlen. Bei diesen Wirkstoffen kann ein 24-Stunden-Intervall angemessener sein.
NYSORA-Tipps
- Prasugrel und Ticagrelor sollten 7 bzw. 5 Tage vor einer spinalen oder epiduralen Anwendung abgesetzt werden.
- Thrombozytenaggregationshemmer können 6–24 Stunden nach einem neuraxialen Eingriff oder einer Katheterentfernung wieder eingesetzt werden.
Überwachung der Thrombozytenfunktion
Die Ivy-Blutungszeit wurde als zuverlässiger Indikator für abnormale Blutungen bei Patienten angesehen, die Thrombozytenaggregationshemmer erhielten. Die Blutungszeit nach Aspirin ist jedoch kein zuverlässiger Indikator für die Thrombozytenfunktion. Die Testergebnisse weisen eine große intra- und interindividuelle Variabilität auf, und es gibt keine Hinweise darauf, dass die Blutungszeit die hämostatische Funktion vorhersagen kann, da Studien keine Korrelation zwischen der Aspirin-induzierten Verlängerung der Blutungszeit und dem chirurgischen Blutverlust zeigen konnten .
Zur Überwachung der Thrombozytenaggregation und -degranulation stehen jetzt spezielle Thrombozytenfunktionsassays zur Verfügung. Der Thrombozytenfunktionsanalysator (PFA) ist ein Test der Thrombozytenfunktion in vitro. Es ist ein guter Screening-Test für die von-Willebrand-Krankheit und überwacht die Wirkung der Desmopressin-Verabreichung. Die PFA ist nach einer Thrombozytenaggregationshemmung verlängert. Leider ist der PFA-100 kein sensitiver Test zur Überwachung der Thrombozytenaggregationshemmung der P2Y12-Hemmer Clopidogrel, Prasugrel und Ticagrelor. PFA-200, eine kürzliche Aktualisierung des PFA-100, scheint jedoch empfindlich auf die Wirkungen der P2Y12-Inhibitoren zu reagieren. Point-of-Care-Studien zu diesem neuen PFA-Test fehlen jedoch noch.
Zu den neueren Tests zur Überwachung der P2Y12-Rezeptoraktivität gehören der Vasodilatator-stimulierte Phosphoprotein (VASP)-Assay, der VerifyNow-Assay, der multiple Thrombozyten-Aggregometrie-Test (Multiplate) und die Thrombozyten-Mapping-Komponente des Thromboelastographen (TEG). Der VerifyNow-Assay kann die thrombozytenaggregationshemmenden Wirkungen von Aspirin und den P2Y12-Inhibitoren überwachen. Die Thrombozytenkartierungskomponente des TEG wird häufig in der Chirurgie und Anästhesiologie verwendet, während VerifyNow der vorherrschende Assay in der klinischen Kardiologie ist. Ein Übersichtsartikel zur Überwachung der Thrombozytenfunktion wurde in mehreren Übersichtsartikeln diskutiert und würde den Rahmen dieses Kapitels sprengen.
ORALE ANTIKOAGULANZIEN
Warfarin übt seine gerinnungshemmende Wirkung aus, indem es in die Synthese der Vitamin-K-abhängigen Gerinnungsfaktoren (VII, IX, X und Thrombin) eingreift (Figure 3). Es hemmt auch die gerinnungshemmenden Proteine C und S. Faktor VII hat eine relativ kurze Halbwertszeit (6–8 h), und die Prothrombinzeit (PT) kann innerhalb von 1.5–2 in den therapeutischen Bereich (24–36-mal normal) verlängert werden Std. Das gerinnungshemmende Protein C hat auch eine kurze Halbwertszeit (6–7 h). Die anfängliche Verlängerung der international normalisierten Ratio (INR) ist das Ergebnis konkurrierender Wirkungen von reduziertem Faktor VII und Protein C und der Auswaschung bestehender Gerinnungsfaktoren. Aus diesem Grund ist die INR während der Anfangsphase der Behandlung mit Warfarin unvorhersehbar. Faktor VII ist nur am extrinsischen Weg beteiligt, und eine ausreichende Antikoagulation wird nicht erreicht, bis die Spiegel der biologisch aktiven Faktoren II (Halbwertszeit von 50 h) und X ausreichend gesenkt sind. Dies erfordert 4-5 Tage. In den ersten 15–2 Tagen der Therapie werden gelegentlich hohe Aufsättigungsdosen von Warfarin (3 mg) angewendet, und die gewünschte gerinnungshemmende Wirkung wird innerhalb von 48–72 Stunden erreicht. Die gerinnungshemmende Wirkung von Warfarin hält für 4–6 Tage nach Beendigung der Therapie an, während neue biologisch aktive Vitamin-K-Faktoren synthetisiert werden. Zu den Nachteilen der Warfarin-Therapie gehören die Notwendigkeit, ihre Wirkung durch serielle Überwachung der INR, ihre Wechselwirkung mit anderen Arzneimitteln und die Notwendigkeit, sie einige Tage vor der Operation abzusetzen, zu überwachen. Die Wirkung von Warfarin kann durch die Transfusion von gefrorenem Frischplasma und Vitamin-K-Injektionen umgekehrt werden. Das 3-Faktor- oder 4-Faktor-Prothrombinkomplex-Konzentrat (PCC) kann verwendet werden, um Warfarin in Notfallsituationen zu antagonisieren.
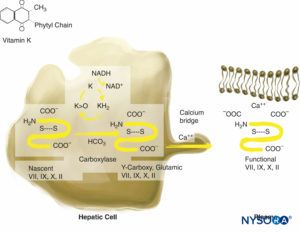
ABBILDUNG 3. Vitamin K-abhängige Gerinnungsfaktorsynthese. Vitamin K ist für die posttranslationale Modifikation von Prothrombin notwendig; Proteine C und S; und Faktoren VII, IX und X. Vitamin K wird in Hepatozyten gespeichert.
Es liegen nur wenige Daten zum Risiko eines spinalen Hämatoms bei Patienten mit Spinal- oder Epiduralverweilkathetern vor, die anschließend mit Warfarin antikoaguliert werden. Odoom und Sih führten 1000 kontinuierliche lumbale Epiduralanästhesien bei 950 Patienten durch, die sich vaskulären Eingriffen unterzogen und präoperative orale Antikoagulanzien erhalten hatten. Der Thrombotest (ein Test der Faktor-IX-Aktivität) war verringert und die aktivierte partielle Thromboplastinzeit (aPTT) war bei allen Patienten vor der Epiduralanlage verlängert. Heparin wurde auch intraoperativ verabreicht. Die Epiduralkatheter blieben postoperativ für 48 Stunden an Ort und Stelle, und es traten keine neurologischen Komplikationen auf. Leider wurde der Gerinnungsstatus der Patienten zum Zeitpunkt der Katheterentfernung nicht beschrieben. Obwohl die Ergebnisse dieser Studie beruhigend sind, schränkt die veraltete Natur des Thrombotests als Maß für die Antikoagulation in Verbindung mit dem unbekannten Gerinnungsstatus der Patienten zum Zeitpunkt der Katheterentfernung den Nutzen der Studie ein.
Die Verwendung eines epiduralen oder intrathekalen Verweilkatheters und der Zeitpunkt seiner Entfernung bei einem antikoagulierten Patienten sind umstritten. Obwohl das Trauma der Nadelplatzierung sowohl bei Einzeldosis- als auch bei kontinuierlichen Kathetertechniken auftritt, kann das Vorhandensein eines Verweilkatheters zu einer zusätzlichen Verletzung von Geweben und Gefäßstrukturen führen.
Da es nach Katheterentfernung zu intraspinalen Hämatomen gekommen ist, wird empfohlen, für das Legen und Entfernen des Epiduralkatheters die gleichen Laborwerte zu verwenden. Bei 192 Patienten, die eine postoperative Epiduralanalgesie in Verbindung mit niedrig dosiertem Warfarin nach Knietotalendoprothetik erhielten, wurden keine spinalen Hämatome berichtet.
In dieser Studie erhielten die Patienten Warfarin, um ihre PT auf 15.0–17.3 Sekunden zu verlängern. Die Epiduralkatheter wurden für 37 ± 15 Stunden (Bereich 13–96 Stunden) belassen. Die mittlere PT zum Zeitpunkt der Entfernung des Epiduralkatheters betrug 13.4 ± 2 Sekunden (Bereich 10.6–25.8 s). Diese und mehrere nachfolgende Studien haben die relative Sicherheit einer niedrig dosierten Antikoagulation mit Warfarin bei Patienten mit Epiduralverweilkatheter dokumentiert. Eine andere Studie zeigte, dass höhere INR-Werte (bis zu 1.9) für die Entfernung von Epiduralkathetern akzeptabel sind, solange dies innerhalb von 12–14 Stunden nach der Einnahme von Warfarin erfolgt. Eine Studie zeigte das Fehlen eines spinalen Hämatoms, wenn die Epiduralkatheter 2–3 Tage nach der Einnahme von Warfarin entfernt wurden, selbst bei deutlich erhöhten INRs. Das Ziehen des Epiduralkatheters 3 Tage nach Beginn der Behandlung mit Warfarin, wenn die Spiegel der Gerinnungsfaktoren VII, IX und X niedrig sind (Faktor-II-Spiegel können noch akzeptabel sein), muss untersucht werden. Dies ist insbesondere der Fall, da die Reaktion der Patienten auf Warfarin sehr unterschiedlich ist, was einige Autoren dazu veranlasst, eine engmaschige Überwachung des Gerinnungsstatus zu empfehlen, um eine übermäßige PT-Verlängerung zu vermeiden. Faktoren, die für eine verlängerte PT und PTT verantwortlich sind, sind in dargestellt Figuren 4 und 5.
Die ASRA empfahl einen INR-Wert von 1.4 oder weniger als akzeptabel für die Durchführung von neuraxialen Nervenblockaden. Dieser Wert basiert auf Studien, die bei einem INR-Wert von ≤1.5 eine hervorragende perioperative Hämostase zeigten. Studien zum Gehalt an Gerinnungsfaktoren bei unterschiedlichen INR-Werten haben gezeigt, dass die Abnahme dieser Faktoren bei einem INR von 1.5 möglicherweise nicht signifikant ist. Bei INR-Werten von 1.5–2.0 wurden Faktor-II-Konzentrationen von 74–82 % der Ausgangswerte festgestellt, während Faktor-VII-Spiegel 27–54 % der Ausgangswerte betrugen.
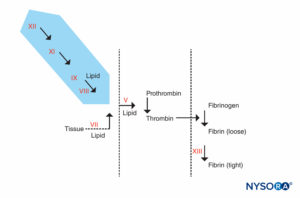
ABBILDUNG 4. Gerinnungsreaktion. Faktoren, die für eine verlängerte PTT verantwortlich sind, befinden sich im schattierten Bereich. Patienten mit abnormaler PTT, aber normaler PT und anderen Tests können in 2 Gruppen eingeteilt werden: diejenigen, die zu Blutungen neigen, und diejenigen, die dies nicht tun. Die Patienten, die nicht bluten, können eine extrem verlängerte PTT (90 Sekunden oder mehr) haben, haben aber keine Blutungen in der Vorgeschichte. Sie haben einen Mangel an Faktor XII, Präkalikrein oder Kininogen mit hohem Molekulargewicht. Diesen Patienten sollte eine Operation oder Periduralanästhesie nicht verweigert werden. Die andere Gruppe, Patienten mit Blutungen, haben sowohl eine verlängerte PTT als auch eine Vorgeschichte von Blutungen. Sie haben einen Mangel an Faktor VIII (Hämophilie A), Faktor IX (Hämophilie B oder Weihnachtskrankheit) oder Faktor XI.
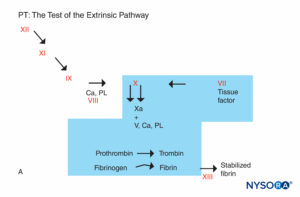
ABBILDUNG 5A. Gerinnungsreaktion. Faktoren, die an PT beteiligt sind, befinden sich im schattierten Bereich. Die PT wird durchgeführt, indem dem Plasma des Patienten eine Gewebefaktorquelle zusammen mit Calcium oder Phospholipid zugesetzt wird. Gewebefaktor bildet mit Faktor VII einen Komplex und aktiviert ihn. (Ca, Kalzium; PL, Phospholipid.)
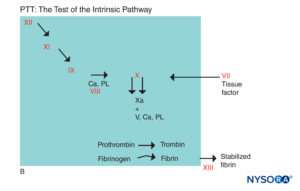
ABBILDUNG 5B. Gerinnungsreaktion. An der PTT beteiligte Faktoren sind im schattierten Bereich. Bei der Beurteilung der PTT wird die Gerinnung durch einen Wirkstoff initiiert, der den Hageman-Faktor-Kininogen-Präkalikrein-Komplex aktiviert. Die meisten Gerinnungsfaktoren werden durch PTT gescreent, außer den Faktoren VII und XIII, dem Protein, das Fibringerinnsel stabilisiert, indem es sie vernetzt, und Komponenten des fibrinolytischen Systems. (Ca, Kalzium; PL, Phospholipid.)
Bei INR-Werten von 2.1 ± 1 während der Anfangsphase der Warfarin-Verabreichung betrugen die Faktoren II und VII 65 ± 28 % und 25 ± 20 % der Kontrollwerte. Aktivitäten von 40 % gelten als ausreichend für eine normale Hämostase zum Zeitpunkt eines größeren chirurgischen Eingriffs. Eine andere Studie ergab, dass bei INRs von 1.3–2 unter stabiler Antikoagulation mit Warfarin die Konzentrationen der Gerinnungsfaktoren VII, IX und X innerhalb normaler Grenzen lagen.
Der Arzt sollte sich der Wirkung von Warfarin auf die Gerinnungskaskade und der Rolle der INR bei der Überwachung dieser Wirkung bewusst sein. Um das Risiko von Komplikationen zu minimieren, empfiehlt die ASRA mehrere Vorsichtsmaßnahmen. Eine chronische orale Warfarintherapie sollte beendet und die INR gemessen werden, bevor eine neuraxiale Nervenblockade durchgeführt wird. Die gleichzeitige Anwendung anderer Medikamente wie Aspirin, NSAIDs und Heparine, die den Gerinnungsmechanismus beeinflussen, erhöht das Risiko von Blutungskomplikationen, ohne die INR zu beeinflussen. Wenn vor der Operation eine Anfangsdosis Warfarin verabreicht wird, sollte die INR überprüft werden, wenn die Dosis mehr als 24 Stunden zuvor verabreicht wurde. Wenn Patienten während der Epiduralanalgesie mit niedrig dosiertem Warfarin (mittlere Tagesdosis etwa 5 mg) behandelt werden, sollte die INR täglich und vor dem Entfernen des Katheters überprüft werden, wenn die Anfangsdosis mehr als 36 Stunden zuvor verabreicht wurde. Höhere Tagesdosen erfordern möglicherweise eine intensivere Überwachung. Die Warfarin-Dosis sollte bei Patienten mit neuraxialen Verweilkathetern beibehalten oder reduziert werden, wenn die INR > 3 ist, um epidurale Hämatome und Hämarthrome zu verhindern. Während der Warfarin-Therapie sollte der neurologische Status des Patienten routinemäßig während der epiduralen Infusion von Analgetika sowie 24 Stunden nach Entfernung des Katheters überprüft werden. Verdünnte Konzentrationen von Lokalanästhetika sollten verwendet werden, um den Grad der sensorischen und motorischen Blockade zu minimieren. Bei Patienten mit therapeutischer Antikoagulation während der Neuraxialkatheter-Infusion muss klinisches Urteilsvermögen ausgeübt werden, um Entscheidungen über das Entfernen oder Beibehalten von Neuraxialkathetern zu treffen. Die Warfarin-Dosis sollte bei Patienten reduziert werden, die wahrscheinlich verstärkt auf das Medikament ansprechen, insbesondere bei älteren Patienten. Bei Patienten unter chronischer oraler Antikoagulation muss das Warfarin abgesetzt und die INR gemessen werden.
NYSORA-Tipps
- Ein INR-Wert von 1.4 ist ohne leichte Hämatome und normale Leberfunktion vor der neuraxialen Injektion bei Patienten mit geplanter neuraxialer Nervenblockade akzeptabel.
- Die INR sollte überprüft werden, wenn der Patient Warfarin vor mehr als 24 Stunden eingenommen hat.
- Die INR sollte 5 Tage nach Absetzen von Warfarin vor einem neuraxialen Eingriff normal sein
Heparin
Intravenöses Heparin
Heparin ist ein komplexes Polysaccharid, das seine gerinnungshemmende Wirkung durch Bindung an Antithrombin entfaltet. Die Konformationsänderung von Antithrombin beschleunigt seine Fähigkeit, die Thrombinfaktoren Xa und IXa zu inaktivieren.
Unfraktioniertes Heparin setzt den Tissue Factor Pathway Inhibitor aus dem Endothel frei und verstärkt seine Aktivität gegen Faktor Xa. Die gerinnungshemmende Wirkung von subkutanem Heparin dauert 1–2 Stunden, aber die Wirkung von intravenösem Heparin tritt sofort ein. Tatsächlich verlängert sich die Gerinnungszeit 2 Minuten nach der intravenösen Injektion von 4 Einheiten Heparin um das 5- bis 10,000-fache des Ausgangswertes. Heparin hat eine Halbwertszeit von 1.5–2 Stunden. Die therapeutische Dosis von Heparin endet 4–6 Stunden nach seiner Verabreichung. Die aPTT wird verwendet, um die Wirkung von Heparin zu überwachen; eine therapeutische Antikoagulation wird bei einer Verlängerung der aPTT um mehr als das 1.5-fache des Ausgangswerts oder einem Heparinspiegel von 0.2–0.4 U/mL erreicht. Die aPTT wird in der Regel durch die subkutane Gabe niedriger Heparindosen nicht verlängert und nicht überwacht. Protamin neutralisiert die Wirkung von intravenös verabreichtem Heparin.
Heparin ist nicht das ideale Antikoagulans, da es eine Mischung von Molekülen ist, von denen nur ein Bruchteil antikoagulierende Aktivität besitzt. Es bindet an den Thrombozytenfaktor 4 und an den von-Willebrand-Faktor. Der Heparin-Antithrombin-Komplex ist auch nicht sehr wirksam beim Neutralisieren von Gerinnsel-gebundenem Thrombin. Schließlich ist Heparin mit immunologischer Thrombozytopenie und immunvermittelter Thrombose assoziiert. Bei Patienten, die eine Standard-Heparintherapie erhalten, ist das Risiko von Blutungskomplikationen in Gegenwart anderer Medikamente erhöht, die andere Gerinnungsmechanismen beeinflussen, einschließlich Aspirin, NSAIDs, LMWHs und oralen Antikoagulanzien. Mehrere Studien haben die Sicherheit einer Spinal- oder Epiduralanästhesie mit anschließender systemischer Heparinisierung gezeigt, wenn bestimmte Vorsichtsmaßnahmen eingehalten werden. Rao und El-Etr berichteten über keine spinalen Hämatome bei über 4000 Patienten, die sich einer Gefäßoperation an den unteren Extremitäten unter kontinuierlicher Spinal- oder Epiduralanästhesie unterzogen. In ihrer Studie wurden Patienten mit vorbestehenden Gerinnungsstörungen ausgeschlossen, die Heparinisierung erfolgte mindestens 60 Minuten nach der Katheterplatzierung, die Höhe der Antikoagulation wurde sorgfältig überwacht und die Verweilkatheter wurden zu einem Zeitpunkt entfernt, als die Heparinaktivität niedrig war. Die Operation wurde bei Patienten abgebrochen, wenn offenes Blut in der Nadel festgestellt wurde, und am folgenden Tag unter Vollnarkose durchgeführt. Dieselben Befunde wurden in einem späteren Bericht in der neurologischen Literatur festgestellt. Ruff und Dougherty stellten spinale Hämatome bei 7 von 342 (2 %) Patienten fest, die sich einer Lumbalpunktion und anschließender Heparinisierung zur Beurteilung einer zerebralen Ischämie unterzogen.
Das Vorhandensein von Blut während des Eingriffs, eine begleitende Aspirintherapie und eine Heparinisierung innerhalb von 1 Stunde wurden als Risikofaktoren für die Entwicklung eines spinalen Hämatoms identifiziert. Die ASRA hat mehrere Empfehlungen für den Einsatz einer neuraxialen Technik in Gegenwart einer intraoperativen Antikoagulation abgegeben. Die ASRA empfiehlt, die Technik bei Patienten mit anderen Koagulopathien zu vermeiden. Zwischen der Nadelplatzierung und der Heparinverabreichung sollte eine Verzögerung von mindestens 1 Stunde liegen. Der Katheter sollte 2–4 Stunden nach der letzten Heparingabe und 1 Stunde vor der nächsten Heparingabe entfernt werden. Die aPTT oder aktivierte Gerinnungszeit (ACT) sollte überwacht werden, um eine übermäßige Heparinwirkung zu vermeiden. Der Patient sollte postoperativ überwacht werden, um ein Wiederauftreten der motorischen Blockade frühzeitig zu erkennen. Verdünnte Konzentrationen von Lokalanästhetika werden empfohlen, um motorische Blockaden zu minimieren.
Obwohl im Falle einer traumatischen (blutigen) oder schwierigen Nadelplatzierung ein erhöhtes Risiko bestehen kann, gibt es keine Daten, die eine obligatorische Absage der Operation unterstützen. Die Entscheidung, fortzufahren, sollte auf einer angemessenen klinischen Beurteilung und einer ausführlichen Diskussion mit dem Chirurgen und dem Patienten beruhen.
NYSORA-Tipps
- Zwischen einem neuraxialen Eingriff und der erneuten Verabreichung von Heparin sollte eine Verzögerung von mindestens 1 Stunde liegen.
- Der Katheter kann 2–4 Stunden nach der letzten Heparingabe entfernt werden.
Neuraxiale Eingriffe werden gelegentlich bei Patienten durchgeführt, die sich einem kardiopulmonalen Bypass unterziehen. Die folgenden Vorsichtsmaßnahmen wurden empfohlen, um die Entwicklung eines intraspinalen Hämatoms bei diesen Patienten zu verhindern:
- Bei Patienten mit bekannter Koagulopathie sollten neuroaxiale Eingriffe vermieden werden.
- Die Operation sollte bei Patienten mit einer traumatischen Punktion um 24 Stunden verschoben werden.
- Die Zeit vom neuraxialen Eingriff bis zur systemischen Heparinisierung sollte mehr als 1 Stunde betragen.
- Heparinisierung und Umkehrung sollten streng überwacht und kontrolliert werden.
- Der Epiduralkatheter sollte entfernt werden, wenn die normale Gerinnung wiederhergestellt ist, und der Patient sollte engmaschig auf Anzeichen eines spinalen Hämatoms überwacht werden.
Subkutanes Heparin
Die therapeutische Basis von niedrig dosiertem subkutanem Heparin zweimal täglich (5000 Einheiten alle 8–12 Stunden) ist die Heparin-vermittelte Hemmung des aktivierten Faktors X. Kleinere Heparindosen sind erforderlich, wenn sie zur Prophylaxe und nicht zur Behandlung einer thromboembolischen Erkrankung verabreicht werden. Nach der intramuskulären oder subkutanen Injektion von 5000 Einheiten Heparin wird die maximale Antikoagulationswirkung innerhalb von 40–50 Minuten beobachtet und kehrt innerhalb von 4 bis 6 Stunden zum Ausgangswert zurück. Die aPTT kann im Normbereich bleiben und wird oft nicht überwacht. Es wurden jedoch große Unterschiede in der individuellen Reaktion der Patienten auf subkutanes Heparin berichtet. Neuraxiale Techniken sind während der subkutanen Prophylaxe (Minidosis) nicht kontraindiziert, aber das Blutungsrisiko kann verringert werden, indem die Heparin-Gabe bis nach der Nervenblockade verschoben wird. Blutungen können bei geschwächten Patienten oder nach längerer Therapie verstärkt sein. Die Sicherheit einer großen neuraxialen Anästhesie in Gegenwart einer Antikoagulation mit zweimal täglicher subkutaner Gabe von unfraktioniertem Heparin wurde durch mehrere Studien dokumentiert. Das zweimal tägliche subkutane Heparin-Regime wurde in den meisten Krankenhäusern durch ein dreimal tägliches Regime ersetzt, um das Auftreten postoperativer venöser Thromboembolien zu verringern. Diese Praxis wurde jedoch mit spontanen Hämatomen in Verbindung gebracht. Aus diesem Grund raten die neuesten ASRA-Richtlinien von neuraxialen Verfahren bei Patienten mit dreimal täglicher Behandlung ab, bis weitere Daten verfügbar sind.
NYSORA-Tipps
- Neuraxiale Verfahren können bei Patienten durchgeführt werden, die zweimal täglich subkutanes Heparin erhalten.
- Aufgrund des Mangels an ausreichenden Daten empfiehlt die ASRA, dass neuroaxiale Eingriffe nicht bei Patienten durchgeführt werden, die dreimal täglich subkutanes Heparin erhalten.
Niedermolekulares Heparin
Unfraktioniertes Heparin ist eine heterogene Mischung von Polysaccharidketten, die in Fragmente mit verschiedenen Molekulargewichten getrennt werden können. Die gerinnungshemmende Wirkung von LMWH ähnelt der von unfraktioniertem Heparin; es aktiviert Antithrombin und beschleunigt die Wechselwirkung von Antithrombin mit Thrombin und Faktor Xa. LMWH hat eine größere Aktivität gegen Faktor Xa, während unfraktioniertes Heparin eine gleichwertige Aktivität gegen Thrombin und Faktor Xa hat. Die Plasmahalbwertszeit der LMWHs reicht von 2–4 Stunden nach einer intravenösen Injektion und 3–6 Stunden nach einer subkutanen Injektion; die Halbwertszeit eines LMWH ist 2- bis 4-mal so groß wie die von Standard-Heparin. Es hat eine geringe Affinität zu Plasmaproteinen, was zu einer höheren Bioverfügbarkeit führt. Zu den Vorteilen von LMWH gegenüber unfraktioniertem Heparin gehören eine höhere und besser vorhersagbare Bioverfügbarkeit nach subkutaner Verabreichung und eine längere biologische Halbwertszeit. Außerdem ist keine Laborüberwachung der gerinnungshemmenden Wirkung von LMWH erforderlich, und eine Dosisanpassung an das Gewicht ist nicht erforderlich (obwohl bei Patienten mit niedrigem BMI eine Überdosierung auftreten kann). LMWH zeigt eine dosisabhängige antithrombotische Wirkung, die durch Messung des Anti-Xa-Aktivitätsspiegels genau beurteilt werden kann. Die Erholung der Anti-Faktor-Xa-Aktivität nach einer subkutanen Injektion von LMWH nähert sich 100 %, was eine Laborüberwachung unnötig macht, außer bei Patienten mit Niereninsuffizienz oder solchen mit einem Körpergewicht von weniger als 50 kg oder mehr als 80 kg. Die Reaktionszeit aus dem Thrombelastogramm scheint mit der Serum-Anti-Xa-Konzentration zu korrelieren.
Die drei im Handel erhältlichen LMWHs in den Vereinigten Staaten sind Enoxaparin (Lovenox), Dalteparin (Fragmin) und Tinzaparin (Innohep), obwohl letzteres wegen geringer Verwendung eingestellt wurde. Enoxaparin wird entweder einmal täglich oder alle 12 Stunden gegeben, wenn es als Prophylaxe verwendet wird, und Dalteparin und Tinzaparin werden einmal täglich gegeben. Die drei Medikamente scheinen eine vergleichbare Wirksamkeit bei der Behandlung und Vorbeugung von venösen Thromboembolien zu haben. Enoxaparin und Dalteparin haben eine vergleichbare Wirksamkeit bei der Prävention von Tod oder Myokardinfarkt bei Patienten mit instabiler Angina pectoris.
Die empfohlene thromboprophylaktische Dosis in den Vereinigten Staaten beträgt 30 mg Enoxaparin zweimal täglich, obwohl einige Ärzte die Dosis bei übergewichtigen Patienten erhöhen (1.5 mg/kg täglich oder 1 mg/kg alle 12 Stunden). Das europäische Dosierungsschema ist Enoxaparin 20–40 mg einmal täglich, und die Patienten erhalten ihre Anfangsdosis 12 Stunden vor der Operation, eine Praxis, die in den Vereinigten Staaten nicht üblich ist.
Zahlreiche Fälle von neuraxialem Hämatom traten in den Vereinigten Staaten auf, was die FDA veranlasste, im Dezember 1997 eine Gesundheitsempfehlung herauszugeben und die erste ASRA-Konsensuskonferenz über Antikoagulation und neuraxiale Anästhesie einzuberufen. Die ASRA-Richtlinien empfehlen, die niedrigste wirksame Dosis von LMWH zu verabreichen. Die postoperative Verabreichung der LMWH-Therapie sollte so lange wie möglich hinausgezögert werden, für mindestens 12 Stunden und idealerweise 24 Stunden postoperativ. Eine Spinalanästhesie in Einzeldosis kann die sicherste neuroaxiale Technik bei Patienten sein, die präoperativ NMH erhalten. Es wird empfohlen, nach der prophylaktischen LMWH-Dosis mindestens 12 Stunden zu warten, bevor eine neuraxiale Technik durchgeführt wird. Patienten, die höhere Dosen von LMWH erhalten (z. B. Enoxaparin 1 mg/kg zweimal täglich), benötigen längere Verzögerungen (24 h). Der Katheter sollte entfernt werden, wenn die Antikoagulationsaktivität niedrig ist, mindestens 12 Stunden nach der prophylaktischen LMWH-Verabreichung und 4 Stunden vor der nächsten Dosis. Äußerste Wachsamkeit hinsichtlich des neurologischen Zustands des Patienten muss beobachtet werden, wenn eine NMH-Thromboseprophylaxe durchgeführt wird, während ein Verweilkatheter infundiert wird. Zur besseren Überwachung der neurologischen Funktion wird eine verdünnte Lokalanästhesielösung empfohlen. Die Verwendung anderer Medikamente, die die Hämostase beeinflussen, wie z. B. Thrombozytenaggregationshemmer, Standardheparin, Dextran oder orale Antikoagulanzien, in Kombination mit LMWH führt zu einem zusätzlichen Risiko von Blutungskomplikationen.
NYSORA-Tipps
- Bei Patienten, die eine prophylaktische Dosis von LMWH erhalten, wird ein 12-Stunden-Intervall vor einer neuraxialen Injektion empfohlen.
- Bei Patienten, die eine therapeutische Dosis von LMWH erhalten, ist ein Intervall von 24 Stunden angemessen.
- Die FDA hat eine 4-stündige Verzögerung nach Entfernung des Epiduralkatheters vor der Wiederaufnahme der NMH empfohlen.
THROMBOLYTISCHE THERAPIE
Thrombolytika lösen aktiv bereits gebildete Fibringerinnsel auf. Exogene Plasminogenaktivatoren wie Streptokinase und Urokinase lösen nicht nur Thromben auf, sondern beeinflussen auch zirkulierendes Plasminogen, was zu verringerten Plasminogen- und Fibrinspiegeln führt. Rekombinanter Plasminogenaktivator vom Gewebetyp (r-TPA), ein endogenes Mittel, ist Fibrin-selektiver und hat eine geringere Wirkung auf die zirkulierenden Plasminogenspiegel. Die Gerinnsellyse führt zu einer Erhöhung der Fibrinabbauprodukte, die durch Hemmung der Thrombozytenaggregation eine gerinnungshemmende Wirkung haben.
Obwohl die Platzierung von epiduralen oder spinalen Nadeln und Kathetern mit anschließender Heparinisierung relativ sicher erscheint, ist das Risiko eines spinalen Hämatoms bei Patienten, die eine Thrombolysetherapie erhalten, nicht genau definiert. In der Literatur wurde über Fälle von spinalem Hämatom bei Patienten mit Epiduralkathetern oder Epiduralverweilkathetern berichtet, die Thrombolytika erhielten.
Die ASRA-Leitlinien geben Empfehlungen zu neuraxialen Eingriffen nach thrombolytischer oder fibrinolytischer Therapie. Die gleichzeitige Anwendung von Heparin mit fibrinolytischen oder thrombolytischen Arzneimitteln setzt Patienten einem hohen Risiko für unerwünschte neuraxiale Blutungen während der Spinal- oder Epiduralanästhesie aus. Außer unter höchst ungewöhnlichen Umständen sollten Patienten, die eine fibrinolytische oder thrombolytische Therapie erhalten, vor einer Spinal- oder Epiduralanästhesie gewarnt werden. Es liegen keine Daten vor, um die angemessene Dauer nach Absetzen dieser Medikamente und die sichere Durchführung einer neuraxialen Technik eindeutig zu bestimmen. Die europäischen Leitlinien empfehlen, den Epiduralkatheter zu belassen, wenn ein Patient ein Thrombolytikum erhält, und ihn erst zu entfernen, wenn die Wirkung des Medikaments abgeklungen ist. Die skandinavischen Leitlinien empfehlen ein 24-Stunden-Intervall zwischen dem Absetzen des Medikaments und dem neuraxialen Eingriff. Bei Patienten, die nach einer fibrinolytischen oder thrombolytischen Therapie Blockaden der neuraxialen Nerven hatten, wird eine häufige neurologische Überwachung über einen angemessenen Zeitraum empfohlen. Wenn ein Patient eine kontinuierliche epidurale Infusion erhält und eine fibrinolytische oder thrombolytische Therapie erhalten hat, sollten Medikamente verwendet werden, die die sensorische und motorische Blockade minimieren. Es gibt keine endgültige Empfehlung zum Zeitpunkt der Entfernung von Neuraxialkathetern bei Patienten, die unerwartet eine fibrinolytische oder thrombolytische Therapie erhalten. Die Messung des Fibrinogenspiegels kann hilfreich sein, um eine Entscheidung über die Entfernung oder Wartung des Katheters zu treffen.
Kräutertherapie
Die am häufigsten verwendeten pflanzlichen Medikamente sind Knoblauch, Ginkgo und Ginseng. Knoblauch hemmt die Blutplättchenaggregation und seine Wirkung auf die Hämostase scheint 7 Tage anzuhalten. Ginkgo hemmt den Blutplättchen-aktivierenden Faktor und seine Wirkung hält 36 Stunden an. Ginseng hat vielfältige Wirkungen: Es hemmt die Thrombozytenaggregation in vitro und verlängert sowohl die Thrombinzeit (TT) als auch die aPTT bei Labortieren; seine Wirkung hält 24 Stunden an. Trotz ihrer Wirkung auf die Blutplättchenfunktion scheinen pflanzliche Arzneimittel selbst kein signifikantes zusätzliches Risiko für die Entwicklung eines spinalen Hämatoms bei Patienten mit Epidural- oder Spinalanästhesie darzustellen. Das obligatorische Absetzen dieser Medikamente oder der Abbruch der Operation bei Patienten, bei denen diese Medikamente fortgesetzt wurden, wird durch die verfügbaren klinischen Daten nicht gestützt. Die gleichzeitige Anwendung anderer Medikamente, die die Gerinnungsmechanismen beeinflussen, wie orale Antikoagulanzien oder Heparin, kann jedoch das Risiko von Blutungskomplikationen bei diesen Patienten erhöhen. Es gibt keinen anerkannten Test zur Beurteilung der Angemessenheit der Hämostase bei Patienten, die pflanzliche Medikamente eingenommen haben. Derzeit gibt es offenbar keine besonderen Bedenken hinsichtlich des Zeitpunkts der neuraxialen Nervenblockade in Bezug auf die Dosierung der Kräutertherapie, die postoperative Überwachung oder den Zeitpunkt der Entfernung des neuraxialen Katheters.
Thrombin-Inhibitoren
Rekombinante Hirudin-Derivate, einschließlich Desirudin und Bivalirudin, hemmen sowohl freies als auch gerinnselgebundenes Thrombin. Argatroban, ein L-Arginin-Derivat, hat einen ähnlichen Wirkmechanismus. Diese Arzneimittel werden hauptsächlich zur Behandlung von Heparin-induzierter Thrombozytopenie verwendet. Es gibt keine pharmakologische Umkehrung der Wirkung dieser Medikamente. Es liegen keine Fallberichte über spinale Hämatome im Zusammenhang mit einer neuraxialen Anästhesie bei Patienten vor, die einen Thrombininhibitor erhalten haben. Es wurde jedoch über spontane intrakranielle Blutungen berichtet. Gemäß den ASRA-Leitlinien kann keine Aussage zur Risikobewertung und zum Patientenmanagement getroffen werden.
Fondaparinux
Fondaparinux ist ein synthetisches Antikoagulans, das seine antithrombotische Wirkung durch selektive Hemmung von Faktor Xa entfaltet. Das Medikament zeigt Beständigkeit in seiner gerinnungshemmenden Wirkung, da es chemisch synthetisiert wird. Es ist zu 100 % bioverfügbar. Es wird schnell absorbiert und erreicht die maximale Konzentration innerhalb von 1.7 Stunden nach der Verabreichung. Seine Halbwertszeit beträgt 17–21 Stunden.
Fondaparinux wird als Antithrombotikum nach großen orthopädischen Eingriffen und als Erstbehandlung bei Lungenembolie empfohlen. Die verlängerte Halbwertszeit (ca. 20 Stunden) ermöglicht eine einmal tägliche Einnahme. Die FDA hat eine Black-Box-Warnung für Fondaparinux herausgegeben, ähnlich der für LMWHs und Heparin.
Das tatsächliche Risiko eines spinalen Hämatoms unter Fondaparinux ist nicht bekannt. Eine Studie zeigte keine Komplikationen bei Patienten, die neuraxiale Injektionen erhielten. In dieser Studie wurden die Katheter 36 Stunden nach der letzten Fondaparinux-Dosis entfernt, und die Verabreichung wurde um 12 Stunden nach Entfernung des Katheters verschoben. Patienten wurden aus der Studie ausgeschlossen, wenn bei der Durchführung des neuraxialen Eingriffs Schwierigkeiten auftraten (mehr als 3 Versuche erforderlich), der Eingriff durch Blutungen erschwert wurde, Thrombozytenaggregationshemmer erforderlich waren oder der Epiduralkatheter am Tag nach der Operation entfernt werden sollte. Aufgrund der unrealistischen Anforderungen in der klinischen Praxis rät die ASRA von der Anwendung von Fondaparinux in Gegenwart eines Epiduralverweilkatheters ab. Ihre Empfehlungen basieren auf der anhaltenden und irreversiblen antithrombotischen Wirkung von Fondaparinux, der frühen postoperativen Dosierung und dem während der ersten klinischen Studien mit dem Medikament berichteten spinalen Hämatom. Eine engmaschige Überwachung der Literatur auf Risikofaktoren im Zusammenhang mit chirurgischen Blutungen kann bei der Risikobewertung und Patientenbehandlung hilfreich sein. Die Durchführung von neuraxialen Techniken sollte unter Bedingungen erfolgen, die in klinischen Studien verwendet werden (Single-Needle-Pass, atraumatische Nadelplatzierung, Vermeidung von neuraxialen Verweilkathetern). Wenn dies nicht möglich ist, sollte eine alternative Prophylaxemethode in Betracht gezogen werden.
Zusammenfassung
Das Zeitintervall zwischen dem Absetzen des gerinnungshemmenden Mittels und dem neuraxialen Eingriff sowie zwischen dem Entfernen des Epiduralkatheters und der Wiederaufnahme des Medikaments ist in zusammengefasst Tabelle 1.
TABELLE 1. Empfohlene Zeitintervalle vor oder nach dem neuraxialen Eingriff und der Entfernung des Epiduralkatheters.
| Medikament | Zeit vor Neuraxial Verfahren oder Entfernung des Katheters | Zeit nach Neuraxial Verfahren oder Entfernung des Katheters | Ihre Nachricht |
|---|---|---|---|
| Aspirin | Andere | Andere | |
| NSAIDs | Andere | Andere | |
| Die Behandlung mit Clopidogrel | 7 Tage* | Nach Entfernung des Katheters | Gemäß europäischen und skandinavischen Richtlinien |
| Prasugrel | 7-10 Tage | 6h | Gemäß den europäischen Richtlinien |
| Ticagrelor | 5 Tage | 6h | (Wie oben) |
| Warfarin | 5 Tage (normale INR) | Nach Catering-Entfernung | |
| Heparin (i.v.) | 4-6 h | 1-2h | |
| Heparin | |||
| -(Sc, GEBOT) | Andere | Andere | |
| -(Sc, TID) | Unzutreffend | Neuroaxiales Verfahren | |
| LMWH | |||
| Prophylaktisch | 12 Stunden | 4 Stunden | FDA-Empfehlung |
| Therapeutisch | 24 Stunden | 4 Stunden | |
| Fondaparinux | 36-42 Stunden | 6-12 Stunden | Nach europäischen Richtlinien. ASRA empfahl gegen neuraxiale Eingriffe bei Patienten, die das Medikament einnehmen. *Wenn nach 5 Tagen ein neuraxialer Eingriff durchgeführt werden muss, wird ein Test der Thrombozytenfunktion empfohlen (siehe Text |
Neue Antikoagulantien
Eine Erörterung der neuen Antikoagulanzien Dabigatran, Rivaroxaban und Apixaban beinhaltet einen Überblick über bestimmte Hintergrundinformationen.
Das Intervall zwischen dem Absetzen des Antikoagulans und der neuraxialen Injektion und zwischen dem neuraxialen Eingriff oder Entfernung des Epiduralkatheters und Wiederaufnahme des Antikoagulans
Es wurde empfohlen, dass zwei Halbwertszeiten ein angemessener Kompromiss zwischen dem Risiko einer venösen Thromboembolie (VTE) und der Prävention eines spinalen Hämatoms sind. Die europäischen und skandinavischen Leitlinien empfahlen ein Intervall von 2 Halbwertszeiten zwischen dem Absetzen des Antikoagulans und der neuraxialen Injektion.
Diese Entscheidung war wie getroffen, da bei einem beträchtlichen Prozentsatz der Patienten unmittelbar nach der Operation eine subklinische VTE auftritt und eine verbleibende Antikoagulation dieses Auftreten verhindern könnte. Das Vorhandensein einer Restantikoagulation erleichtert den Übergang zu einer vollständigen Antikoagulation nach einem neuraxialen Eingriff. Nach 1, 2, 3, 4, 5 und 6 Halbwertszeiten verbleiben die folgenden Prozentsätze des Arzneimittels im Kreislauf: 50 %, 25 %, 12.5 %, 6.25 %,
3.125 % bzw. 1.5625 % (Tabelle 2). Diese Ergebnisse basieren jedoch auf Studien an jungen gesunden Probanden in pharmakokinetischen Studien mit Einzeldosis in Abwesenheit anderer Antikoagulanzien. Im Gegensatz dazu sind die Patienten in der klinischen Praxis meist älter und haben begleitende Komorbiditäten.
TABELLE 2. Empfohlene Zeitintervalle vor oder nach neuraxialem Eingriff und Epiduralkatheter für die neuen Antikoagulanzien.
| Medikament | Halbwertszeit | Europäische Richtlinien | Skandinavische Richtlinien | Fünf Halbwertszeiten |
|---|---|---|---|---|
| Dabigatran | 12-17h 28 Stunden (Nierenerkrankung) | (Kontraindiziert pro Hersteller) | Keine Daten verfügbar | 85h (4d) 6d (Nierenpatienten) |
| Rivaroxaban | 9-13h | 22-26h | 18h | 65h (3d) |
| Apixaban | 15.2 +/-8.5 Std | 26-30h | Keine Daten verfügbar | 75h (3-4d) |
Bei Patienten mit VTE-Risiko, wie z. B. bei Patienten mit Schlaganfall in der Vorgeschichte, kann ein 2- oder 3-Halbwertszeitintervall angemessen sein, da eine ausreichende Hämostase nicht gewährleistet ist. Bei Patienten ohne thrombotische Risikofaktoren gewährleistet ein Intervall von 4–6 Halbwertszeiten zwischen der letzten Dosis des Antikoagulans und der neuraxialen Injektion eine vollständigere Elimination des Arzneimittels und ein geringeres Blutungsrisiko. Ein Kompromiss zwischen den konservativen Empfehlungen von 4–6 Halbwertszeiten und 2–3 Halbwertszeiten ist ein Intervall von 5 Halbwertszeiten mit NMH-Brückentherapie.
Hinsichtlich der Wiederaufnahme des Antikoagulans nach neuraxialer Injektion oder Entfernung des Epiduralkatheters orientieren sich die skandinavischen Leitlinien an der Empfehlung von Rosencher et al. von 8 Stunden abzüglich der Zeit, die das Antikoagulans benötigt, um seine maximale Wirkung zu erreichen.
Es wurde angenommen, dass acht Stunden für die Stabilisierung des Gerinnsels ausreichend sind, eine Annahme, die durch die Wirksamkeit von Thrombolytika zur Auflösung eines Gerinnsels gestützt wird, wenn sie innerhalb von 6 Stunden nach der Gerinnselbildung verabreicht werden. Tertri und Kollegen stellten auch fest, dass die Gabe von Enoxaparin innerhalb von 24–48 Stunden nach einer intrazerebralen Blutung die Größe des Hämatoms nicht vergrößerte, sodass ein 24-Stunden-Intervall wahrscheinlich sicherer ist. Andere Autoren empfehlen einen konservativeren Ansatz, da die Wiederaufnahme der antithrombotischen Therapie innerhalb von 24 Stunden nach einem größeren Eingriff das Risiko einer periprozeduralen Blutung erhöhen könnte. Liew und Douketis empfehlen bei Patienten mit geringem Blutungsrisiko mindestens 24 Stunden und bei Patienten mit hohem Blutungsrisiko 48 Stunden, bevor die Behandlung mit Dabigatran, Rivaroxaban oder Apixaban wieder aufgenommen wird. Die Optionen sind daher entweder 8 Stunden oder 24 Stunden abzüglich der Spitzenwirkung des Medikaments.
Es gibt wahrscheinlich kaum einen Unterschied zwischen diesen beiden Optionen, da die Risiken von VTE, Schlaganfall oder akutem Koronarsyndrom wahrscheinlich gleich sind. Außerdem sind der Wirkungseintritt und die Zeiten bis zum Wirkmaximum der neuen Antikoagulanzien kurz.
Dabigatran
Dabigatranetexilat ist ein Prodrug, das durch Esterasen im Magen zum Wirkstoff hydrolysiert wird. Dabigatranetexilat hat eine Bioverfügbarkeit von 7.2 %. Dabigatran ist ein direkter Thrombininhibitor, der die Wechselwirkung von Thrombin mit verschiedenen Substraten blockiert. Maximale Plasmakonzentrationen werden 1.5–3 Stunden nach Einnahme des Prodrugs erreicht. Es hat eine Halbwertszeit von 14–17 Stunden. Die renale Clearance macht 80 % der Gesamtclearance von Dabigatran aus. Bei Nierenerkrankungen im Endstadium verdoppelt sich die Eliminationshalbwertszeit von 14 Stunden auf 28 Stunden.
Dabigatran ist wirksam bei der Behandlung akuter VTE und bei der Prävention rezidivierender VTE. Bei Patienten mit Vorhofflimmern reduziert Dabigatran die Häufigkeit von Schlaganfällen und systemischen Embolien in einem ähnlichen Ausmaß wie Warfarin. Es wurde nicht gezeigt, dass Dabigatran bei der Vorbeugung von VTE nach einer totalen Gelenkoperation konsistent ist. Studien haben gezeigt, dass es Enoxaparin entweder wirksamer, nicht unterlegen oder unterlegen ist. Eine Metaanalyse der Studien ergab bei keinem der analysierten Endpunkte Unterschiede zwischen Dabigatran und Enoxaparin. Der Hersteller weist darauf hin, dass Patienten, die Dabigatran erhalten, keine Epiduralkatheter gelegt werden sollten. Von Levy und Kollegen wurde ein Mindestintervall von 2 Stunden zwischen dem Entfernen des Verweilkatheters und der Verabreichung von Dabigatran empfohlen. Dieses Intervall scheint kürzer als 6 Stunden zu sein, d. h. die Differenz zwischen 8 Stunden minus der 2-Stunden-Zeit bis zum Erreichen der maximalen Wirkung des Arzneimittels. Es gibt Berichte über vermehrte Blutungen nach der Einnahme von Dabigatran. Die Hematology Society of Australia and New Zealand identifizierte 78 Blutungsepisoden bei ungefähr 7000 Patienten über einen Zeitraum von 2 Monaten. Ein Audit der FDA kam jedoch zu dem Schluss, dass es unter Dabigatran im Vergleich zu Warfarin zu keiner absoluten Zunahme von Blutungen kam.
Die aPTT ist nach Dabigatran verlängert, aber die Beziehung ist krummlinig. Die Thrombinzeit (TT), auch als Thrombingerinnungszeit (TCT) bekannt, reagiert sehr empfindlich auf die Wirkung von Dabigatran und wird besser zum Nachweis der antikoagulatorischen Wirkung von Dabigatran verwendet als zur Quantifizierung der Wirkung des Arzneimittels. Eine verdünnte TT ist über pharmakologisch relevante Dabigatran-Plasmakonzentrationen hinweg unbestimmt. Die Ecarin-Gerinnungszeit (ECT), die direkt die Thrombinbildung misst, wird durch Dabigatran dosisabhängig verlängert. Es ist der empfindlichste Assay für Dabigatran, aber nur wenige Institutionen haben den Test zur Verfügung. Die Prothrombinzeit (PT) ist der am wenigsten empfindliche Test. Der verdünnte TT und der ECT sind die Tests der Wahl für Dabigatran.
Bis heute gibt es kein Antidot, um die Wirkung von Dabigatran oder anderen neuen oralen Antikoagulanzien aufzuheben. Aktivkohle verhindert die Resorption des Arzneimittels, muss jedoch innerhalb von 2 Stunden nach der Einnahme von Dabigatran verabreicht werden. Die Dialyse könnte die Elimination des Arzneimittels beschleunigen. Plasmakomplexkonzentrate (PCCs), die entweder 3 (Faktoren II, IX und X) oder 4 (Faktoren II, VII, IX und X) Gerinnungsfaktoren enthalten, wurden vorgeschlagen, aber ihre Wirksamkeit wurde nicht bewiesen. Idarucizumab, ein monoklonales Antikörperfragment, das an freies und an Thrombin gebundenes Dabigatran bindet, wurde kürzlich von der FDA zugelassen.
NYSORA-Tipps
- Die Elimination von Dabigatran hängt hauptsächlich von den Nieren ab, und seine Halbwertszeit ist bei Patienten mit Nierenerkrankungen verdoppelt.
- Bei diesen Patienten wird ein längeres Intervall zwischen dem Absetzen des Medikaments und dem neuraxialen Eingriff empfohlen, wahrscheinlich 6 Tage.
Rivaroxaban
Rivaroxaban ist ein direkter Faktor-Xa-Hemmer. Maximale Plasmakonzentrationen werden innerhalb von 2.5–4 Stunden beobachtet, und die maximale Hemmung von Faktor Xa (bis zu 68 %) tritt 3 Stunden nach der Einnahme auf und hält mindestens 12 Stunden lang an, oder 24–48 Stunden, wenn höhere Dosen bei älteren Patienten verabreicht werden Patienten. Rivaroxaban hat eine terminale Halbwertszeit von 5.7–9.2 Stunden, die jedoch bei älteren Patienten aufgrund der altersbedingten Abnahme der Nierenfunktion bis zu 11–13 Stunden betragen kann. Ein Drittel des Arzneimittels wird über die Nieren ausgeschieden, ein Drittel fäkal/biliär und ein Drittel wird in inaktive Metaboliten umgewandelt. Die maximale Konzentration wird durch Adipositas (Patienten mit einem Gewicht von ≥ 120 kg) nicht beeinflusst, ist jedoch bei Patienten mit einem Gewicht von ≤ 24 kg um 50 % erhöht. Die renale Clearance von Rivaroxaban nimmt mit zunehmender Nierenfunktionsstörung ab.
Rivaroxaban ist wirksam bei der Behandlung symptomatischer VTE und Warfarin bei der Prävention von embolischen Schlaganfällen bei Vorhofflimmern nicht unterlegen. Die Zugabe von Rivaroxaban zur Standardtherapie mit Thrombozytenaggregationshemmern reduziert den zusammengesetzten Endpunkt aus Tod durch kardiovaskuläre Ursachen, Myokardinfarkt oder Schlaganfall bei Patienten mit kürzlich aufgetretenem akutem Koronarsyndrom. Es wurde berichtet, dass Rivaroxaban bei der Vorbeugung von VTE nach totalen Gelenkoperationen genauso wirksam oder besser als Enoxaparin ist. In den Studien RECORD 1, 2, 3 und 4 war Rivaroxaban ein wirksameres Thromboseprophylaktikum als Enoxaparin, mit einem ähnlichen Sicherheitsprofil. Rosencheret al. gaben an, dass Epiduralkatheter frühestens 2 Halbwertszeiten nach der letzten Rivaroxaban-Dosis entfernt wurden und die nächste Rivaroxaban-Dosis 4-6 Stunden nach Entfernung des Katheters verabreicht wurde. Keiner der 1141 Patienten, die Rivaroxaban erhielten und eine neuraxiale Anästhesie erhielten, entwickelte ein spinales Hämatom. Diese geringe Patientenzahl reicht jedoch nicht aus, um eine eindeutige Aussage über die perioperative Sicherheit dieses Behandlungsschemas zu treffen.
Die europäischen und skandinavischen Leitlinien empfehlen ein Intervall von 2 Halbwertszeiten zwischen dem Absetzen von Rivaroxaban und dem Legen oder Entfernen eines Epiduralkatheters (18 Stunden in den skandinavischen Leitlinien und 22–26 Stunden in den europäischen Leitlinien). Diese Leitlinien empfehlen auch ein 4–6-stündiges Intervall vor der Wiederaufnahme der nächsten Dosis, da Rivaroxaban 2.5–4 Stunden benötigt, um die maximale Wirkung zu erreichen.
Zwischen den Wirkungen von Rivaroxaban und PT wurde eine lineare Korrelation beobachtet. Allerdings gibt es deutliche Schwankungen in der Empfindlichkeit von PT-Reagenzien gegenüber Rivaroxaban, daher wird empfohlen, dass jedes Labor seine PT speziell für Rivaroxaban kalibriert. Der aPTT fehlt es an ausreichender Sensitivität, um die Wirkung von Rivaroxaban zu bestimmen. Die Hemmung von Faktor Xa kann auch ein Ersatz für die Plasmakonzentrationen von Rivaroxaban sein. Der PT und Anti-Xa sind die empfohlenen Tests zur Überwachung der Wirkung von Rivaroxaban.
Zur Entfernung von Rivaroxaban wurde die Anwendung von Aktivkohle empfohlen, die jedoch innerhalb von 8 Stunden nach der Einnahme von Rivaroxaban verabreicht werden muss. Es wurde gezeigt, dass ein 4-Faktor-PCC die gerinnungshemmende Wirkung von Rivaroxaban in vitro bei gesunden Probanden umkehrt. Aufgrund ihrer hohen Proteinbindung sind Rivaroxaban und Apixaban möglicherweise nicht dialysierbar.
Apixaban
Apixaban ist ein hochspezifischer Faktor-Xa-Hemmer. Es wird schnell resorbiert und erreicht Spitzenkonzentrationen in 1–2 Stunden. Studien haben gezeigt, dass die terminale Halbwertszeit von Apixaban 13.5 +/- 9.9 Stunden oder 15.2 +/- 8.5 Stunden nach einer Einzeldosis von 5 mg und 11.7 +/- 3.3 Stunden nach Mehrfachgabe von 5 mg beträgt. Die maximale Plasmakonzentration wird durch das Körpergewicht beeinflusst, wobei bei Patienten mit niedrigem Körpergewicht höhere Konzentrationen von Apixaban auftreten. Die Anti-Faktor-Xa-Aktivität im Plasma zeigte eine direkte lineare Beziehung zur Plasmakonzentration von Apixaban.
Apixaban hat eine orale Bioverfügbarkeit von mehr als 45 %. Nach oraler Gabe wird es über mehrere Eliminationswege sowie direkt renal und intestinal ausgeschieden. 29 bis 56 % der Dosis werden über die Nieren ausgeschieden und 5 % der Dosis werden im Stuhl wiedergefunden. Mehr als die Hälfte von Apixaban wird unverändert ausgeschieden, wodurch das Risiko metabolischer Arzneimittelwechselwirkungen verringert wird. Apixaban reduziert wirksam Schlaganfälle oder systemische Embolien, ohne das Blutungsrisiko zu erhöhen. Apixaban ist Warfarin bei der Vorbeugung von Schlaganfällen oder systemischen Embolien bei Patienten mit Vorhofflimmern überlegen. Apixaban bietet eine wirksame Thromboseprophylaxe bei Knietotalendoprothetik, vergleichbar mit Enoxaparin oder Warfarin. Apixaban ist bei der Vorbeugung von VTE nach Knietotalendoprothese (TKR) ebenso wirksam wie Enoxaparin, bei gleichzeitig geringerer oder ähnlicher Rate schwerer Blutungen. Apixaban ist wirksamer als Enoxaparin bei der Vorbeugung von VTE nach totalem Hüftersatz (THR) ohne erhöhte Blutungen. In dieser Studie wurden „Geräte in Verbindung mit intrathekaler oder epiduraler Anästhesie mindestens 12 Stunden vor der ersten Dosis“ von Apixaban entfernt. In allen Studien zu Apixaban wurde 24–XNUMX Stunden nach der Operation mit der Behandlung begonnen.
Im Vergleich zu Rivaroxaban hat Apixaban bei Gabe in zugelassenen Dosen nur geringe Auswirkungen auf die PT. Der verdünnte PT-Assay hat eine verbesserte Empfindlichkeit gegenüber herkömmlichem PT. Es scheint eine lineare Korrelation zwischen der Anti-Xa-Aktivität und den Plasmakonzentrationen von Apixaban zu bestehen. Der Anti-Xa-Assay wurde als empfindlicher als der PT und ebenso sensitiv wie der verdünnte PT-Assay festgestellt und scheint die beste Wahl für die klinische Überwachung der gerinnungshemmenden Wirkung von Apixaban zu sein. Aktivkohle, die innerhalb von 3 Stunden nach der Einnahme verabreicht wird, verringert die Resorption von Apixaban.
Andexanet ist ein rekombinant modifiziertes menschliches Faktor-Xa-Täuschprotein, das Faktor-Xa-Inhibitoren bindet und sequestriert. Studien an Probanden und Patienten zeigten, dass Andexanet die gerinnungshemmende Aktivität von Rivaroxaban und Apixaban umkehrt. Ab 2016 ist Andexanet in den Vereinigten Staaten noch nicht klinisch verfügbar.
Zusammenfassung der Empfehlungen für die neuen Antikoagulanzien
Während ein Intervall von 2–3 Halbwertszeiten bei Patienten mit hohem VTE- oder Schlaganfallrisiko akzeptabel sein kann, ist ein Intervall von 4–6 Halbwertszeiten zwischen dem Absetzen des Medikaments und der neuraxialen Injektion bei den meisten Patienten mit niedrigem Risiko wahrscheinlich sicherer Thrombosegefahr. Ein 5-Halbwertszeit-Intervall in Verbindung mit einer NMH-Überbrückungstherapie ist bei den meisten Patienten eine Alternative, wie in gezeigt Tabelle 2. Nach einem neuraxialen Eingriff oder Entfernung eines Epiduralkatheters kann die Antikoagulation 6 Stunden später (8 Stunden abzüglich des Einsetzens/Spitzeneffekts des Arzneimittels, der normalerweise 2 Stunden beträgt) wieder aufgenommen werden. Antikoagulanzien werden in der Regel innerhalb von 24–48 Stunden bei den meisten Patienten wieder aufgenommen, können aber bei Patienten mit einem höheren Risiko für VTE oder Schlaganfall früher wieder aufgenommen werden; das heißt, 24 Stunden abzüglich der Zeit bis zur maximalen Wirkung des Medikaments. Andere empfahlen ein 24-Stunden-Intervall (Tabelle 3)
TABELLE 3. Empfohlene Zeitintervalle für die Wiederaufnahme des Medikaments nach einem neuraxialen Eingriff oder einer Katheterentfernung.
| Medikament | Europäische Richtlinien | Skandinavische Richtlinien | Liew & Douketis (102); Connolly und Spyropoulos (98) |
|---|---|---|---|
| Dabigatran | 6h | 6h | 24h |
| Rivaroxaban | 4-6h | 6h | 24h |
| Apixaban | 4-6h | 6h | 24h |
Die Laborüberwachung der gerinnungshemmenden Wirkung ist in einigen Situationen angemessen, und Gegenmittel werden empfohlen, wenn eine schnelle Wiederherstellung der hämostatischen Funktion erforderlich ist.
NYSORA-Tipps
- Für die neuen Antikoagulanzien wird ein Intervall von 5 Halbwertszeiten zwischen dem Absetzen des Medikaments und dem neuraxialen Eingriff empfohlen, bis mehr Erfahrungen mit diesen Mitteln vorliegen.
- Es wird ein Intervall von entweder 8 oder 24 Stunden bis zum Erreichen der maximalen Wirkung des Medikaments empfohlen, bevor das Medikament nach Entfernung des Katheters wieder aufgenommen wird; ein 24-Stunden-Intervall ist wahrscheinlich am sichersten.
KLINISCHE MERKMALE, DIAGNOSE UND MANAGEMENT VON EPIDURALEN HÄMATAMEN
Patienten, die ein spinales Hämatom entwickeln, stellen sich in der Regel mit plötzlichen, starken, konstanten Rückenschmerzen mit oder ohne radikulärer Komponente vor. Percussion über die Wirbelsäule verschlimmert den Schmerz ebenso wie Manöver, die den intraspinalen Druck erhöhen, einschließlich Husten, Niesen oder Pressen. Darüber hinaus deutet die Rückkehr der motorischen Schwäche und/oder des sensorischen Defizits nach der offensichtlichen Auflösung der epiduralen oder spinalen Blockade stark auf die Bildung eines epiduralen oder spinalen Hämatoms hin. Motorische und sensorische Befunde hängen vollständig von der Höhe und Größe des Hämatoms ab, können aber Schwäche, Parese, Verlust der Darm- oder Blasenfunktion und praktisch jedes sensorische Defizit umfassen. Die Magnetresonanztomographie (MRT) ist die Diagnostik der Wahl. Die Differentialdiagnose umfasst Spinalabszess, epidurale Neoplasie, akuten Bandscheibenvorfall und spinale Subarachnoidalblutung. Eine Genesung ohne Operation ist selten, und eine neurochirurgische Beratung zur Erwägung einer notfallmäßigen dekompressiven Laminektomie sollte eingeholt werden, sobald der Verdacht auf ein spinales Hämatom besteht. Die funktionelle Erholung hängt hauptsächlich mit der Zeitdauer zusammen, die die Symptome vor der Operation vorhanden sind. Die klinischen Merkmale, Diagnose, Differentialdiagnose und Behandlung eines Patienten mit einem spinalen Hämatom werden ausführlicher in beschrieben Systemische Toxizität von Lokalanästhetika.
ZUSAMMENFASSUNG
Praktiker sollten ihre Wissensbasis regelmäßig über neue gerinnungshemmende Medikamente, Antikoagulationsprotokolle, aktuelle Leitlinienempfehlungen und FDA-Warnungen aktualisieren. Da ein spinales Hämatom auch ohne identifizierbare Risikofaktoren auftreten kann, ist Wachsamkeit bei der Überwachung entscheidend für die frühzeitige Beurteilung einer neurologischen Dysfunktion und ein sofortiges Eingreifen. Die Entscheidung zur Durchführung einer neuraxialen Blockade und der Zeitpunkt der Katheterentfernung bei einem Patienten, der eine gerinnungshemmende Therapie erhält, sollte individuell getroffen werden, wobei die Vorteile einer Regionalanästhesie gegen das geringe, aber eindeutige Risiko eines spinalen Hämatoms abzuwägen sind.
Antikoagulation und periphere Nervenblockaden
Gegebenenfalls können bei Patienten, die Antikoagulanzien einnehmen, periphere Nervenblockaden durchgeführt werden. Im Gegensatz zu neuroaxialen Eingriffen in Gegenwart von Antikoagulanzien gibt es keine prospektiven Studien zu peripheren Nervenblockaden in Gegenwart von Antikoagulanzien. Die ASRA empfiehlt die gleichen Richtlinien für periphere Nervenblockaden wie für neuraxiale Verfahren. Fälle von Psoas und retroperitonealen Hämatomen wurden nach lumbalen Plexus-Nervenblockaden und Psoas-Kompartment-Nervenblockaden berichtet. Diese Patienten erhielten entweder Enoxaparin, Ticlopidin oder Clopidogrel. In einigen Fällen trat das Hämatom trotz Einhaltung der ASRA-Richtlinien auf.
Die Symptome der Hämatombildung nach einer peripheren Nervenblockade können Schmerzen (flanken- oder paravertebrale Schmerzen oder Leistenschmerzen bei Psoasblutungen), Druckempfindlichkeit in diesem Bereich, ein stetiger Abfall des Hämoglobins/Hämatokrits, Hypotonie aufgrund von Hypovolämie und sensorisch-motorische Defizite umfassen. Die definitive Diagnose wird durch Computertomographie (CT) gestellt; Ultraschall kann auch verwendet werden, um das Vorhandensein eines subkapsulären Nierenhämatoms nach einer Nervenblockade des Psoas-Kompartiments zu erkennen. Die Behandlung kann eine chirurgische Beratung, Aufhebung der Antikoagulation, Bluttransfusion, falls erforderlich, und beobachtendes Abwarten im Vergleich zu einer chirurgischen Drainage umfassen.
Es ist wahrscheinlich zu restriktiv, die ASRA-Richtlinien zu neuraxialen Nervenblockaden an Patienten anzupassen, die sich einer peripheren Nervenblockade unterziehen. Die European Society of Anaesthesiology hat festgestellt, dass die Richtlinien für neuraxiale Nervenblockaden nicht routinemäßig für periphere Nervenblockaden gelten. Die Österreichische Gesellschaft für Anästhesiologie, Reanimation und Intensivmedizin hingegen hat vorgeschlagen, dass oberflächliche Nervenblockaden in Gegenwart von Antikoagulanzien sicher durchgeführt werden können. Wegen der Möglichkeit eines retroperitonealen Hämatoms verdienen Plexus lumbalis und paravertebrale Nervenblockaden die gleichen Empfehlungen wie für neuraxiale Injektionen. Die gleichen Richtlinien sollten auch für viszerale sympathische Nervenblockaden gelten. Die ASRA-Richtlinien können daher auf Nervenblockaden in vaskulären und nicht komprimierbaren Bereichen anwendbar sein, wie z. B. auf Blockaden des Plexus coeliacus, auf Blockaden des Plexus superior hypogastricus und auf Blockaden des Plexus lumbalis. Ärzte sollten ihre Entscheidung individuell treffen und die Risiken und Vorteile der Nervenblockade mit dem Patienten und dem Chirurgen besprechen. Am wichtigsten ist, dass der Arzt den Patienten nach der Platzierung der Nervenblockade engmaschig überwacht.
NYSORA-Tipps
- Die Richtlinien zu neuraxialen Injektionen sollten auch für lumbale Plexus-Nervenblockaden und viszerale sympathische Nervenblockaden gelten.
- Bei oberflächlichen Nervenblockaden können bei Vorliegen einer Restantikoagulation wahrscheinlich ultraschallgesteuerte regionale Nervenblockaden durchgeführt werden.
REFERENZEN
- Horlocker TT, Wedel DJ: Antikoagulation und neuraxiale Nervenblockade: historische Perspektive, anästhetische Implikationen und Risikomanagement. Reg Anesth Pain Med 1998;23:129–134.
- Tryba M: [Epidurale Regionalanästhesie und niedermolekulares Heparin: Pro]. Anasthesiol Intensivmed Notfallmed Schmerzther 1993;28:179–181.
- Pöpping DM, Zahn PK, Van Aken HK, Dasch B, Boche R, Pogatzki-Zahn EM: Effektivität und Sicherheit der postoperativen Schmerzbehandlung: eine Befragung von 18 925 konsekutiven Patienten zwischen 1998 und 2006 (2. Überarbeitung): eine Datenbankanalyse von prospektiv erhobene Daten. Br. J. Anaesth 2008;101:832–840.
- Moen V, Dahlgren N, Irestedt L: Schwere neurologische Komplikationen nach zentralen neuroaxialen Blockaden in Schweden 1990–1999. Anesthesiology 2004;101:950–959.
- Volk T, Wolf A, Van Aken H, Bürkle H, Wiebalck A, Steinfeldt T: Inzidenz spinaler Hämatome nach Epiduralpunktion: Analyse des Deutschen Netzwerks für Sicherheit in der Regionalanästhesie. Eur J Anaesthesiol 2012;29:170–176.
- Ehrenfeld JM, Agarwal AK, Henneman JP, Sandberg WS: Schätzung der Inzidenz eines vermuteten Epiduralhämatoms und der versteckten Bildgebungskosten der Epiduralkatheterisierung: eine retrospektive Überprüfung von 43,200 Fällen. Reg Anesth Pain Med 2013;38:409–414.
- Bateman BT, Mhyre JM, Ehrenfeld J, et al: Das Risiko und die Ergebnisse von epiduralen Hämatomen nach perioperativer und geburtshilflicher Epiduralkatheterisierung: ein Bericht des Forschungskonsortiums der multizentrischen Gruppe für perioperative Ergebnisse. Anesth Analg 2013: 116: 1380–1385.
- Horlocker T, Kopp S: Epiduralhämatom nach Epiduralblockade in den USA: Es ist nicht mehr nur niedermolekulares Heparin nach orthopädischer Operation. Anesth Analg 2013;116:1195–1197.
- Horlocker T: Neuraxialer Block bei Patienten mit Spinalkanalstenose: zwischen einem Felsen und einer harten Stelle. Anesth Analg 2010;110:1305.
- Gulur P, Tsui B, Pathak R, Koury KM, Lee H: Retrospektive Analyse der Inzidenz von Epiduralhämatomen bei Patienten mit Epiduralkathetern und anormalen Gerinnungsparametern. Br. J. Anaesth 2015;114:808–811.
- Heit JA, Horlocker TT (Hrsg.): Neuraxiale Anästhesie und Antikoagulation. Reg Anesth Pain Med 1998;23:S129–S193.
- Horlocker TT, Wedel DJ, Benzon HT, et al: Regionalanästhesie beim antikoagulierten Patienten: Definition der Risiken (Die zweite ASRA-Konsensuskonferenz zu neuraxialer Anästhesie und Antikoagulation). Reg Anesth Pain Med 2003;28:171–197.
- Horlocker TT, Wedel DJ, Rowlingson JC, et al: Regionalanästhesie bei Patienten, die eine antithrombotische oder thrombolytische Therapie erhalten: Evidenzbasierte Leitlinien der American Society of Regional Anästhesie und Schmerzmedizin (dritte Ausgabe). Reg Anesth Pain Med 2010;35:64–101.
- Gogarten W, Vandermeulen E, Van Aken H, Kozek S, Llau JV, Samama CM: Europäische Gesellschaft für Anästhesiologie. Regionalanästhesie und Antithrombotika: Empfehlungen der European Society of Anaesthesiology. Eur J Anaesthesiol 2010;27:999–1015.
- Breivik H., Bang U., Jalonen J., Vigfusson G., Alahuhta S., Lagerkranser M.: Nordische Leitlinien für neuraxiale Blockaden bei gestörter Hämostase von der Scandinavian Society of Anaesthesiology and Intensive Care Medicine. Acta Anaesthesiol Scand 2010;54:16–41.
- Cronberg S, Wallmark E, Söderberg I: Wirkung auf die Thrombozytenaggregation der oralen Verabreichung von 10 nichtsteroidalen Analgetika an Menschen. Scand J Haematol 1984;33:155–159.
- Locke GE, Giorgio AJ, Biggers SL Jr, et al.: Akutes spinales epidurales Hämatom als Folge einer Aspirin-induzierten verlängerten Blutung. Surger Neurol 1976;5:293–296.
- Vandermeulen EP, Van Aken H, Vermylen J: Antikoagulantien und Spinal-Epiduralanästhesie. Anesth Analg 1994;79:1165–1177.
- CLASP (Collaborative Low-Dose Aspirin Study in Pregnancy) Kollaborative Gruppe. CLASP: eine randomisierte Studie mit niedrig dosiertem Aspirin zur Vorbeugung und Behandlung von Präeklampsie bei 9364 schwangeren Frauen. Lancet 1994;343:619–629.
- Horlocker TT, Wedel DJ, Offord KP: Erhöht die präoperative Thrombozytenaggregationshemmung das Risiko von Blutungskomplikationen im Zusammenhang mit einer Regionalanästhesie? Anesth Analg 1990;70:631–634.
- Horlocker TT, Wedel DJ, Schroeder DR, et al: Die präoperative Thrombozytenaggregationshemmung erhöht nicht das Risiko eines spinalen Hämatoms im Zusammenhang mit einer Regionalanästhesie. Anesth Analg 1995;80:303–309.
- Benzon HT, Brunner EA, Vaisrub N: Blutungszeit und Nervenblockaden nach Aspirin. Reg Anesth 1984;9:86–90.
- Horlocker TT, Bajwa ZH, Ashraft Z, et al: Risikobewertung von hämorrhagischen Komplikationen im Zusammenhang mit nichtsteroidalen entzündungshemmenden Medikamenten bei Patienten in ambulanten Schmerzkliniken, die sich einer epiduralen Steroidinjektion unterziehen. Anesth Analg 2002;95: 1691–1697.
- Benzon HT, Wong HY, Siddiqui T, et al.: Vorsicht bei der Durchführung epiduraler Injektionen bei Patienten, die mehrere Thrombozytenaggregationshemmer einnehmen. Anästhesiologie 1999;91:1558–1559.
- Benzon HT, Huntoon M: Brauchen wir neue Leitlinien für interventionelle Schmerzbehandlungen bei Patienten unter Antikoagulanzien? Reg Anesth Pain Med 2014;39:1–3.
- Giberson CE, Barbosa J, Brooks ES, et al: Epidurale Hämatome nach Entfernung von perkutanen Rückenmarkstimulator-Studienleitungen: zwei Fallberichte. Reg Anesth Pain Med 2014;39:73–77.
- Williams KN, Jackowski A, Evans PJD: Epidurales Hämatom, das eine chirurgische Dekompression nach wiederholten zervikalen epiduralen Steroidinjektionen wegen chronischer Schmerzen erfordert. Schmerz 1990;42:197–199.
- Ain RJ, Vance MB: Epidurales Hämatom nach epiduraler Steroidinjektion bei einem Patienten, der Enoxaparin gemäß den Richtlinien abgesetzt hat. Anesthesiology 2005;102:701–703.
- Buvanendran A, Young A: Spinales epidurales Hämatom nach Platzierung der Testelektrode mit einem Rückenmarkstimulator bei einem Patienten, der Aspirin einnimmt. Reg Anesth Pain Med 2014;39:70–72.
- Desai MJ, Dua S: Perineurales Hämatom nach lumbaler transforaminaler Steroidinjektion, die eine akut-chronische lumbale Radikulopathie verursacht: ein Fallbericht. Schmerzpraxis 2014;14:271–277.
- Mahmoud J, Mathews M, Verna S, Basil B: Oxcarbazepin-induzierte Thrombozytopenie. Psychosomatik 2006;47:73–74.
- Meijer WEE, Heerdink ER, Nolen WA, Herings RMC, Leufkens HGM, Egberts ACG. Assoziation des Risikos abnormaler Blutungen mit dem Grad der Serotonin-Wiederaufnahmehemmung durch Antidepressiva. Arch Intern Med 2004;164:2367–2370.
- Narouze S, Benzon HT, Provenzano DA, et al: Interventionelle Wirbelsäulen- und Schmerzverfahren bei Patienten mit Thrombozytenaggregationshemmern und gerinnungshemmenden Medikamenten: Richtlinien der American Society of Regional Anästhesie und Schmerzmedizin, der Europäischen Gesellschaft für Regionalanästhesie und Schmerztherapie, der American Academy of Pain Medicine, der International Neuromodulation Society, der North American Neuromodulation Society und dem World Institute of Pain. Reg Anesth Pain Med 2015;40: 182–212.
- Gajraj NM: Cyclooxygenase-2-Inhibitoren. Anesth Analg 2003;96: 1720–1738.
- Buvanendran A, Kroin JS, Tuman KJ, et al: Auswirkungen der perioperativen Verabreichung eines selektiven Cyclooxygenase-2-Inhibitors auf die Schmerzbehandlung und Wiederherstellung der Funktion nach Kniegelenkersatz: eine randomisierte kontrollierte Studie. JAMA 2003;290:2411–2418.
- Gajraj NM, Joshi GP: Rolle von Cyclooxygenase-2-Inhibitoren bei der postoperativen Schmerzbehandlung. Anesthesiol Clin North America 2005;23:49–72.
- Desjardins PJ, Shu VS, Recker DP, et al.: Eine präoperative Einzeldosis Valdecoxib, ein neuer Cyclooxygenase-2-spezifischer Inhibitor, lindert Schmerzen nach oraler Operation oder Bunionektomie. Anesthesiology 2002;97:565–573.
- Sinatra RS, Shen QJ, Halaszynski T, et al: Präoperative orale Rofecoxib-Suspension als analgetische Ergänzung nach einer Operation im Unterbauch: die Auswirkungen eines anstrengungsabhängigen Schmerzes und einer Lungenfunktion. Anesth Analg 2003;98:135–140.
- Lessee PT, Hubbard RC, Karim A, et al.: Wirkungen von Celecoxib, einem neuartigen Cyclooxygenase-2-Inhibitor, auf die Thrombozytenfunktion bei gesunden Erwachsenen: eine randomisierte, klinische Studie. J Clin Pharmacol 2000;40:124–132.
- van Heeken H, Schwartz JI, Depre M, et al: Vergleichende inhibitorische Aktivität von Rofecoxib, Meloxicam, Diclofenac, Ibuprofen und Naproxen auf COX-2 versus COX-1 bei gesunden Freiwilligen. J Clin Pharmacol 2000;40:1109–1120.
- Greenberg H, Gottesdiener K, Huntington M, et al: Ein neuer Cyclooxygenase-2-Hemmer, Rofecoxib (VIOXX), veränderte die gerinnungshemmende Wirkung von niedrig dosiertem Aspirin bei gesunden Probanden nicht. J Clin Pharmacol 2000;40:1509–1515.
- Psaty BM, Furberg CD: Cox-2-Hemmer – Lektionen zur Arzneimittelsicherheit. N. Engl. J. Med. 2005;352:1133–1135.
- Schror K: Thrombozytenaggregationshemmer: eine vergleichende Übersicht. Drogen 1995;50:7–28.
- Yang LH, Fareed J: Vasomodulatorische Wirkung von Clopidogrel und Ticlopidin. Thromb Res 1997;86:479–491.
- CAPRIE-Lenkungsausschuss: Eine randomisierte Blindstudie mit Clopidogrel versus Aspirin bei Patienten mit einem Risiko für einen ischämischen Schlaganfall (CAPRIE). Lancet 1996;348:1329–1339.
- Helft G, Osende JI, Worthley SG, et al: Acute antithrombotic effect of a front-loaded Regime of Clopidogrel in patienten with atherosclerosis on aspirin. Arterioscler Thromb Vasc Biol 2000;29:2316–2321.
- Mayumi T, Dohi S: Spinales Subarachnoidalhämatom nach Lumbalpunktion bei einem Patienten mit Thrombozytenaggregationshemmern. Anesth Analg 1983;62:777–779.
- Benzon HT, McCarthy R, Benzon HA, et al: Bestimmung der verbleibenden gerinnungshemmenden Aktivität von Clopidogrel. Br. J. Anaesth 2011;107: 966–971.
- Halle R, Mazer CD: Thrombozytenaggregationshemmer: eine Überprüfung ihrer Pharmakologie und Verwaltung in der perioperativen Phase. Anesth Analg 2011;112: 292–318.
- Wallentin L: P2Y(12)-Hemmer: Unterschiede in Eigenschaften und Wirkungsmechanismen und mögliche Folgen für die klinische Anwendung. Eur Heart J 2009;30:1964–1977.
- Capodanno D, Ferreiro JL, Angiolillo DJ: Thrombozytenaggregationshemmung: neue pharmakologische Wirkstoffe und Paradigmenwechsel. J Thromb Haemost 2013;11(Ergänzung 1):316–329.
- Brandt JT, Payne CD, Wiviott SD, et al.: Ein Vergleich der Aufsättigungsdosen von Prasugrel und Clopidogrel auf die Thrombozytenfunktion: Das Ausmaß der Thrombozytenhemmung hängt mit der Bildung aktiver Metaboliten zusammen. Am Heart J 2007;153:66.e9–16.
- Dobesh PP: Pharmakokinetik und Pharmakodynamik von Prasugrel, einem Thienopyridin-P2Y12-Inhibitor. Pharmakotherapie 2009;29:1089–1102.
- Asai F, Jacubowski JA, Nagamura H, et al: Plättchenhemmende Aktivität und Pharmakokinetik von Prasugrel (CS-747), einem neuartigen Thienopyridin-P2Y12-Inhibitor: eine Studie mit ansteigender Einzeldosis bei gesunden Menschen. Blutplättchen 2006;17:209–217.
- Wiviott SD, Trenk D, Frelinger AL, et al: Prasugrel im Vergleich mit Clopidogrel mit hoher Aufsättigungs- und Erhaltungsdosis bei Patienten mit geplanter perkutaner Koronarintervention: Prasugrel im Vergleich zu Clopidogrel zur Hemmung der Thrombozytenaktivierung und -aggregation – Thrombolyse bei Myokardinfarkt 44 Studie. Auflage 2007;116: 2923–2932.
- Wiviott SD, Antman EM, Winters KJ, et al.: Randomisierter Vergleich von Prasugrel (CS-747, LY640315), einem neuartigen Thienopyridin-P2Y12-Antagonisten, mit Clopidogrel bei perkutaner Koronarintervention: Ergebnisse der Joint Utilization of Medications to Block Platelets Optimally (JUMBO )-TIMI 26-Studie. Auflage 2005;111:3366–3373.
- Brandt JT, Close SL, Iturria SJ, et al: Gemeinsame Polymorphismen von CYP2C19 und CYP2C9 beeinflussen die pharmakokinetische und pharmakodynamische Reaktion auf Clopidogrel, aber nicht auf Prasugrel. J Thromb Haemost 2007;5:2429–2436.
- Mega JL, Close SL, Wiviott SD, et al.: Genetische Cytochrom-P450-Polymorphismen und die Reaktion auf Prasugrel: Beziehung zu pharmakokinetischen, pharmakodynamischen und klinischen Ergebnissen. Auflage 2009;119:2553–2560.
- Teng R, Butler K: Pharmakokinetik, Pharmakodynamik, Verträglichkeit und Sicherheit von aufsteigenden Einzeldosen von Ticagrelor, einem reversibel bindenden oralen P2Y(12)-Rezeptorantagonisten, bei gesunden Probanden. Eur J Clin Pharmacol 2010;66:487–496.
- Teng R, Oliver S, Hayes MA, Butler K: Absorption, Verteilung, Metabolismus und Ausscheidung von Ticagrelor bei gesunden Probanden. Drug Metab Dispos 2010;38:1514–1521.
- Husted S, Emanuelsson H, Heptinstall S, Sandset PM, Wickens M, Peters G: Pharmakodynamik, Pharmakokinetik und Sicherheit des oralen reversiblen P2Y12-Antagonisten AZD6140 mit Aspirin bei Patienten mit Atherosklerose: ein doppelblinder Vergleich mit Clopidogrel mit Aspirin. Eur Heart J 2006;27:1038–1047.
- Gurbel PA, Bliden KP, Butler K, et al: Randomisierte doppelblinde Bewertung des ONSET und OFFSET der gerinnungshemmenden Wirkung von Ticagrelor versus Clopidogrel bei Patienten mit stabiler koronarer Herzkrankheit: die ONSET/OFFSET-Studie. Auflage 2009;120:2577–2585.
- George JN: Blutplättchen. Lancet 2000;355:1531–1539.
- van Giezen J, Nilsson L, Berntsson P, et al: Ticagrelor bindet an menschliches P2Y(12) unabhängig von ADP, antagonisiert jedoch die ADP-induzierte Rezeptorsignalisierung und Thrombozytenaggregation. J Thromb Haemost 2009;7:1556–1565.
- Baron TH, Kamath PS, McBane RD: Management der antithrombotischen Therapie bei Patienten, die sich invasiven Eingriffen unterziehen. N Engl J Med 2013;368:2113–2124.
- Rodgers RPC, Levin J: Eine kritische Neubewertung der Blutungszeit. Semin Thromb Hemost 1990;16:1–20.
- Ferraris VA, Swanson E: Aspiringebrauch und perioperativer Blutverlust bei Patienten, die sich unerwarteten Operationen unterziehen. Surg Gynecol Obstet 1983;156:439–442.
- Mammen EF, Comp PC, Gosselin R, et al: PFA-100-System. Eine neue Methode zur Beurteilung der Thrombozytenfunktionsstörung. Semin Thromb Hemost 1998;24:195–202.
- Edwards A, Jakubowski JA, Rechner AR, Sugidachi A, Harrison P: Evaluation of the INNOVANCE PFA P2Y Test Cartridge: Sensitivity to P2Y(12) Block and Influence of Antikoagulans. Blutplättchen 2012;23: 106–115.
- Gorog DA, Fuster V: Thrombozytenfunktionstests in der klinischen Kardiologie. J. Am. Coll. Cardiol 2013;61:2115–2129.
- Bouman HJ, Parlak E, van Werkum JW, et al: Welcher Thrombozytenfunktionstest ist geeignet, um das Ansprechen auf Clopidogrel zu überwachen? Eine pharmakokinetische Analyse des aktiven Metaboliten von Clopidogrel. J Thromb Haemost 2010;8:482–488.
- van Werkum JW, Harmsze AM, Elsenberg EH, Bouman HJ, ten Berg JM, Hackeng CM: Die Verwendung des VerifyNow-Systems zur Überwachung der Thrombozytenaggregationshemmung: eine Überprüfung der aktuellen Evidenz. Blutplättchen 2008;19:479–488.
- Mueller T, Dieplinger B, Poelz W, Haltmayer M: Utility of the PFA-100 instrument and the novel multiplate analyzer for the assessment of spirin and clopidogrel effects on platelet functioninpatients withcardial disease. Clin Appl Thromb Hemost 2009;15:652–659.
- Scharbert G, Auer A, Kozek-Langenecker S: Evaluation of the Platelet Mapping Assay on rotation thromboelastometry ROTEM. Blutplättchen 2009;20:125–130.
- Malinin A, Pokov A, Swaim L, Kotob M, Serebruany V: Validierung einer VerifyNow-P2Y12-Kartusche zur Überwachung der Thrombozytenhemmung mit Clopidogrel. Methoden Finden Exp Clin Pharmacol 2006;28:315.
- Benzon HT, Avram J, Green D, Bonow RO: Neue orale Antikoagulanzien und Regionalanästhesie. Br J Anaesth 2013;111(Suppl 1):i96–i113.
- Kearon C, Hirsh J: Management der Antikoagulation vor und nach einer elektiven Operation. N. Engl. J. Med. 1997;336:1506–1511.
- Harrison L, Johnston M, Massicote MP, et al: Vergleich von 5-mg- und 10-mg-Dosen zu Beginn der Warfarin-Therapie. Ann Intern Med 1997;126:133–136.
- Benzon HT, Benzon HA, Kirby-Nolan M, Avram MJ, Nader A: Faktor-VII-Spiegel und Risikofaktoren für ein erhöhtes international normalisiertes Verhältnis in der frühen Phase der Warfarin-Therapie. Anesthesiology 2010;112:298–304.
- Schulman S, Lockner D, Bergstrom K, Blomback M: Intensive anfängliche orale Antikoagulation und kürzere Heparinbehandlung bei tiefer Venenthrombose. Thromb Haemost 10984;52:276–280.
- Enneking FK, Benzon HT: Orale Antikoagulanzien und Regionalanästhesie: eine Perspektive. Reg Anesth Pain Med 1998;23:140–145.
- Odoom JA, Sih IL: Epidurale Analgesie und gerinnungshemmende Therapie. Anästhesie 1983;38:254–259.
- Horlocker TT: Wann muss ein Spinal- oder Epiduralkatheter bei einem antikoagulierten Patienten entfernt werden? Reg. Anesth 1993;18:264–265.
- Horlocker TT, Wedel DJ, Schlichting JL: Postoperative Epiduralanästhesie und orale Antikoagulanzientherapie. Anesth Analg 1994;79:89–93.
- Wu CL, Perkins FM: Orale Antikoagulanzienprophylaxe und Epiduralkatheterentfernung. Reg Anesth 1996;21:517–524.
- Liu SS, Buvanendran A, Viscusi ER, et al: Unkomplizierte Entfernung von Epiduralkathetern bei 4365 Patienten mit einem international normalisierten Verhältnis von mehr als 1.4 während der Einleitung einer Warfarin-Therapie. Reg Anesth Pain Med 2011;36:231–235.
- Weinstock DM, Chang P, Aronson DL, et al: Vergleich der Plasma-Prothrombin- und Faktor-VII- und Urin-Prothrombin-F1-Konzentrationen bei Patienten unter Langzeit-Warfarin-Therapie und Patienten in der Anfangsphase. Am J Hematol 1998;57:193–199.
- Jerkeman A, Astermark J, Hedner U, et al: Korrelation zwischen verschiedenen Intensitäten der Anti-Vitamin-K-Behandlung und Gerinnungsparametern. Thromb Res 2000;98:467–471.
- Abildgaard U, Lindahl AK, Sandset PM: Heparin benötigt für seine gerinnungshemmende Wirkung im menschlichen Blut sowohl Antithrombin als auch Inhibitoren des extrinsischen Signalwegs. Hämostase 1991;21:254–257.
- Murray DJ, Brodsnahan WJ, Pennell B, et al: Heparin-Nachweis durch die aktivierte Gerinnungszeit: Ein Vergleich der Empfindlichkeit von Gerinnungstests und Heparin-Assays. J Cardiothorac Vasc Anesth 1997; 11:24–28.
- Shapiro SS. Thrombosebehandlung im 21. Jahrhundert. N. Engl. J. Med. 2003;349:1762–1764.
- Rao TL, El-Etr AA: Antikoagulation nach Platzierung von Epidural- und Subarachnoidalkathetern: eine Bewertung neurologischer Folgen. Anesthesisology 1981;55:618–620.
- Ruff DL, Dougherty JH: Komplikationen der Antikoagulation, gefolgt von Antikoagulation. Schlaganfall 1981;12:879–881.
- Liu SS, Mulroy MF: Neuraxiale Anästhesie und Analgesie in Gegenwart von Standardheparin. Reg Anesth Pain Med 1998;23:157–163.
- Chaney MA: Intrathekale und epidurale Anästhesie und Analgesie für die Herzchirurgie. Anesth Analg 1997;84:1211–1221.
- Geerts WH, Bergqvist D, Pineo GF, et al: Prävention von venösen Thromboembolien. American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8. Ausgabe). Brust 2008;133: 381S–453S.
- King CS, Holley AB, Jackson JL, et al.: Zweimal versus dreimal tägliche Heparindosierung zur Thromboembolieprophylaxe in der Allgemeinbevölkerung: eine Metaanalyse. Brust 2007;131:507–516.
- Weitz JI. Medikamentöse Therapie: niedermolekulare Heparine. N. Engl. J. Med. 1997;337:688–698.
- Horlocker TT, Heit JA: Heparin mit niedrigem Molekulargewicht: Biochemie, Pharmakologie, perioperative Prophylaxeschemata und Richtlinien für das Regionalanästhesiemanagement. Anesth Analg 1997;85:874–885.
- Bara L, Billaud E, Gramond G, et al: Vergleichende Pharmakokinetik eines niedermolekularen Heparins (PK 10 169) und unfraktioniertem Heparin nach intravenöser und subkutaner Verabreichung. Thromb Res. 1985;39:631–636.
- Klein S, Slaughter T, Vail PT, et al: Thrombelastographie als perioperative Maßnahme der Antikoagulation durch niedermolekulares Heparin: ein Vergleich mit Anti-Xa-Konzentrationen. Anesth Analg 2000;91:1091–1095.
- Weiß RH: Niedermolekulare Heparine: Sind sie alle gleich? Br J Haematol 2003;121:12–20.
- Horlocker TT, Wedel DJ: Neuroaxiale Blockade und niedermolekulares Heparin: Balance zwischen perioperativer Analgesie und Thromboprophylaxe. Reg Anesth Pain Med 1998;23:164–177.
- US Food and Drug Administration. FDA Drug Safety Communication: Aktualisierte Empfehlungen zur Verringerung des Risikos von Wirbelsäulenblutungen und Lähmungen bei Patienten mit niedermolekularem Heparin. http://www.fda.gov/drugs/drugsafety/ucm373595.htm. Aktualisiert am 19. Januar 2016. Zugriff am 9. September 2015.
- Rosenquist RW, Brown DL: Neuraxiale Blutung: Fibrinolytika/Thrombolytika. Reg Anesth Pain Med 1998;23S:152–156.
- Bauer KA: Fondaparinux: grundlegende Eigenschaften und Wirksamkeit und Sicherheit in der venösen Thromboembolieprophylaxe. Am J. Orthop 2002;31:4–10.
- Turpie AG, Bauer KA, Eriksson BL, et al: Fondaparinux vs. Enoxaparin zur Prävention venöser Thromboembolien bei großen orthopädischen Eingriffen: eine Metaanalyse von 4 randomisierten Doppelblindstudien. Arch Intern Med 2002;162:1833–1840.
- The Matisse Investigators: Subkutanes Fondaparinux versus intravenöses unfraktioniertes Heparin bei der Erstbehandlung von Lungenembolien. N. Engl. J. Med. 2003;349:1695–1702.
- Singelyn FJ, Verheyen CC, Piovella F, Van Aken HK, Rosenceher N, EXPERT Study Investigators: The Safety and Effectiveness of Extended Thromboprophylaxis with Fondaparinux after major orthopedic operation of the lower limb with or without a neuraxial or deep peripheral nervecategory: the EXPERT Lernen. Anesth Analg 2007;105:1540–1547.
- Rosencher N, Bonnet MP, Sessler DI: Ausgewählte neue Antithrombotika und neuraxiale Anästhesie für große orthopädische Operationen: Managementstrategien. Anästhesie 2007;62:1154–1160.
- Greenblatt DJ: Eliminationshalbwertszeit von Drogen: Wert und Grenzen. Ann Rev Med 985;36:421–427.
- Olesen JB, Lip GY, Hansen ML, et al: Validierung von Risikostratifizierungsschemata zur Vorhersage von Schlaganfällen und Thromboembolien bei Patienten mit Vorhofflimmern: Bundesweite Kohortenstudie. BMJ 2011;342:d124.
- Connolly G, Spyropoulos AC: Praktische Probleme, Einschränkungen und periprozedurales Management der NOAKs. J Thromb Thrombolysis 2013;36:212–222.
- Garcia D, Barrett YC, Ramaciotti E, Weitz JI: Laborbewertung der gerinnungshemmenden Wirkung der nächsten Generation oraler Antikoagulanzien. J Thromb Haemost 2013;11:245–252.
- IST-3 Collaborative Group: Nutzen und Schaden einer intravenösen Thrombolyse mit rekombinantem Gewebe-Plasminogen-Aktivator innerhalb von 6 h nach akutem ischämischem Schlaganfall (die dritte internationale Schlaganfallstudie [IST-3]): eine randomisierte Studie. Lancet 2012;379:2352–2363.
- Tertri S, Hakal J, Juvela S, et al: Sicherheit von niedrig dosiertem subkutanem Enoxaparin zur Prävention venöser Thromboembolien nach primärer intrazerebraler Blutung. Thromb Res 2008;123:206–212.
- Liew A, Douketis J: Perioperatives Management von Patienten, die ein neuartiges orales Antikoagulans erhalten. Intern Emerg Med 2013;8:477–484.
- Blech S, Ebner T, Ludwig-Schwellinger E, Stangier J, Roth W: Der Metabolismus und die Disposition des oralen direkten Thrombininhibitors Dabigatran beim Menschen. Drug Metab Disposition 2008;36:386–399.
- Di Nisio M., Middeldorp S., Buller HR. Direkte Thrombininhibitoren. N. Engl. J. Med. 2005;353:1028–1040.
- Levy JH, Faraoni D, Spring JL, Douketis JD, Samana CM: Umgang mit neuen oralen Antikoagulanzien im perioperativen Umfeld und auf der Intensivstation. Anesthesiology 2013;118:1466–1474.
- Stangier J, Clemens A: Pharmakologie, Pharmakokinetik und Pharmakodynamik von Dabigatranetexilat, einem oralen direkten Thrombininhibitor. Clin Appl Thromb Hemost 2009;15(S1):9S–16S.
- Stangier J, Stahle H, Rathgen K, Fuhr R: Pharmakokinetik und Pharmakodynamik des direkten oralen Thrombininhibitors Dabigatran bei gesunden älteren Probanden. Clin Pharmacokinet 2008;47:47–59.
- Eisert WG, Hauel N., Stangier J., Wienen W., Clemens A., Van Ryn J.: Dabigatran: an oral new potent reversible nonpeptid inhibitor of thrombin. Arterioscler Thromb Vasc Biol 2010;30:1885–1889.
- Stangier J, Rathgen K, Stahle H, Mazur D: Einfluss einer Nierenfunktionsstörung auf die Pharmakokinetik und Pharmakodynamik von oralem Dabigatranetexilat. Eine Open-Label-, Parallelgruppen-, Single-Center-Studie. Clin Pharmacokinet 2010;49:259–268.
- Ezekowitz MD, Reilly PA, Nehmiz G, et al. Dabigatran mit oder ohne begleitendem Aspirin im Vergleich zu Warfarin allein bei Patienten mit nichtvalvulärem Vorhofflimmern (PETRO-Studie). Am J. Cardiol 2007;100: 1419–1426.
- Ericksson BI, Dahl OE, Buller HR, et al.; BISTRO-II-Studiengruppe: Ein neuer oraler direkter Thrombininhibitor, Dabigatranetexilat, verglichen mit Enoxaparin zur Vorbeugung von thromboembolischen Ereignissen nach totalem Hüft- oder Kniegelenkersatz: die randomisierte BISTRO-II-Studie. J Thromb Haemost 2005;3:103–111.
- Ericksson BI, Dahl OE, Rosencher N, et al.; RE-MODEL-Studiengruppe: Orales Dabigatranetexilat vs. subkutanes Enoxaparin zur Prävention venöser Thromboembolien nach Knie-Totalendoprothese: die randomisierte RE-MODEL-Studie. J Thromb Haemost 2007;5:2178–2185.
- Ericksson BI, Dahl OE, Rosencher N, et al.; RE-NOVATE-Studiengruppe. Dabigatranetexilat versus Enoxaparin zur Prävention venöser Thromboembolien nach Hüfttotalendoprothese: eine randomisierte, doppelblinde Nichtunterlegenheitsstudie. Lancet 2007;370:949–956.
- RE-MOBILIZE Writing Committee, Ginsberg JS, Davidson BL, Comp PC, et al.: Oral thrombin inhibitor dabigatran etexilate vs. North American enoxaparin Regime for Prevention of venous Thromboembolism after Knee Arthroplasty Surgery. J Arthroplasty 2009;24:1–9.
- Wolowacz SE, Roskell NS, Plumb JM, Caprini JA, Ericksson BI: Wirksamkeit und Sicherheit von Dabigatranetaxilat zur Prävention venöser Thromboembolien nach Hüft- oder Knieendoprothetik. Eine Metaanalyse. Thromb Haemost 2009;101:77–85.
- Harper P, Young L, Merriman E: Blutungsrisiko mit Dabigatran bei gebrechlichen älteren Menschen. N. Engl. J. Med. 2012;366:864–866.
- Tripodi A: Das Labor und die direkten oralen Antikoagulanzien. Blut 2013;121:4032–4035.
- Siegal DM, Cuker A: Umkehrung neuartiger oraler Antikoagulanzien bei Patienten mit schweren Blutungen. J Thromb Thrombolysis 2013;35:391–398.
- Miyares MA, Davis K: Neuere orale Antikoagulanzien: eine Überprüfung der Laborüberwachungsoptionen und Umkehrmittel bei hämorrhagischen Patienten. Am J Health Syst Pharm 2012;69:1473–1484.
- Baron TH, Kamath PS, McBane RD: Management der antithrombotischen Therapie bei Patienten, die sich invasiven Eingriffen unterziehen. N Engl J Med 2013;368:2113–2124.
- Breuer G, Weiss DR, Ringwald J: „Neue“ direkte orale Antikoagulanzien im perioperativen Setting. Curr Opin Anaesthesiol 2014;27:409–419.
- Lévy S: Neuere klinisch verfügbare Antithrombotika und ihre Gegenmittel. J Interv Card Electrophysiol 2014;40:269–275.
- Laux V, Perzborn E, Kubitza D, Misselwitz F: Präklinische und klinische Merkmale von Rivaroxaban: ein neuartiger, oraler, direkter Faktor-Xa-Inhibitor. Sem Thromb Hemost 2007;33:515–523.
- Kubitza D, Becka M, Wensing G, Voith B, Zuehlsdorf M: Sicherheit, Pharmakodynamik und Pharmakokinetik von BAY 59-7939 – ein oraler, direkter Faktor-Xa-Inhibitor – nach Mehrfachdosierung bei gesunden männlichen Probanden. Eur J Clin Pharmacol 2005;61:873–880.
- Jiang J, Hu Y, Zhang J, et al.: Sicherheit, Pharmakokinetik und Pharmakodynamik von Einzeldosen von Rivaroxaban – einem oralen, direkten Faktor-Xa-Inhibitor – bei älteren chinesischen Probanden. Thromb Haemost 2010;103:234–241.
- Kubitza D, Becka M, Roth A, Mueck W: Dosiseskalationsstudie zur Pharmakokinetik und Pharmakodynamik von Rivaroxaban bei gesunden älteren Probanden. Curr Med Res Opin 2008;24:2757–2765.
- Ericksson BI, Quinlan DJ, Weitz JI: Vergleichende Pharmakodynamik und Pharmakokinetik oraler direkter Thrombin- und Faktor-Xa-Inhibitoren in der Entwicklung. Clin Pharmacokinet 2009;48:1–22.
- Weitz JI, Eikelboom JW, Samama MM: Neue Antithrombotika. Brust 2012;141S:e120S–e151S.
- Kubitza D, Becka M, Mueck W, et al: Auswirkungen einer eingeschränkten Nierenfunktion auf die Pharmakokinetik, Pharmakodynamik und Sicherheit von Rivaroxaban, einem oralen, direkten Faktor-Xa-Inhibitor. Br J Clin Pharmacol 2010;70:703–712.
- Patel MR, Mahaffey KW, Garg J, et al.; ROCKET AF Investigators: Rivaroxaban versus Warfarin bei nichtvalvulärem Vorhofflimmern. N. Engl. J. Med. 2011;365:883–891.
- Eriksson BI, Borris LC, Friedman RJ, et al.; RECORD1-Studiengruppe: Rivaroxaban versus Enoxaparin zur Thromboseprophylaxe nach Hüftendoprothetik. N. Engl. J. Med. 2008;358:2765–2775.
- Kakkar AK, Brenner B, Dahl O, et al; RECORD2 Prüfärzte: Rivaroxaban mit verlängerter Dauer im Vergleich zu kurzzeitigem Enoxaparin zur Prävention venöser Thromboembolien nach totaler Hüftendoprothetik: eine doppelblinde, randomisierte, kontrollierte Studie. Lancet 2008;372:31–39.
- Lassen MR, Ageno W, Borris LC, et al.; RECORD3 Prüfärzte: Rivaroxaban versus Enoxaparin zur Thromboseprophylaxe nach Knietotalendoprothetik. N Eng J Med 2008;358:2776–2786.
- Turpie AG, Lassen MR, Davidson BL, et al.; RECORD4 Prüfärzte: Rivaroxaban versus Enoxaparin zur Thromboseprophylaxe nach Knietotalendoprothetik (RECORD4): eine randomisierte Studie. Lancet 2009;373: 1673–1680.
- Ericksson BI, Kakkar AK, Turpie AG, et al: Orales Rivaroxaban zur Prävention symptomatischer venöser Thromboembolien nach elektivem Hüft- und Kniegelenkersatz. J Bone Joint Surg Br 2009;91:636–644.
- Rosencher N, Liau JV, Mueck W, Loewe A, Berkowitz SD, Homering M: Inzidenz von neuraxialen Hämatomen nach totaler Hüft- oder Knieoperation: RECORD-Programm (Rivaroxaban vs. Enoxaparin). Acta Anaesthesiol Scand 2013;57:565–572.
- Samama MM: Welcher Test zur Messung der gerinnungshemmenden Wirkung von Rivaroxaban zu verwenden ist: der Anti-Faktor-Xa-Assay. J Thromb Haemost 2013;11:579–580.
- Raghavan N, Frost CE, Yu Z, et al: Apixaban Metabolismus und Pharmakokinetik nach oraler Verabreichung an Menschen. Drug Metab Dispos 2009;37:74–81.
- Frost C, Wang J, Nepal S, et al: Apixaban, ein oraler, direkter Faktor-Xa-Hemmer: Einzeldosissicherheit, Pharmakokinetik, Pharmakodynamik und Wirkung von Lebensmitteln bei gesunden Probanden. Br J Pharmacol 2013;75:476–487.
- Frost C, Nepal S, Wang J, et al.: Sicherheit, Pharmakokinetik und Pharmakodynamik von mehreren oralen Dosen von Apixaban, einem Faktor-Xa-Inhibitor, bei gesunden Probanden. Br J Clin Pharmacol 2013;76:776–786.
- Zhang D, He K, Raghavan N, et al.: Vergleichender Metabolismus von 14C-markiertem Apixaban bei Mäusen, Ratten, Kaninchen, Hunden und Menschen. Drug Metab Dispos 2009;37:1738–1748.
- Lassen MR, Davidson BL, Gallus A, Pineo G, Ansell J, Deitchman D: Die Wirksamkeit und Sicherheit von Apixaban, einem oralen, direkten Faktor-Xa-Inhibitor, als Thromboprophylaxe bei Patienten nach Kniegelenkersatz. J Thromb Haemost 2007;5:2368–2375.
- Lassen MR, Rasskob GE, Gallus A, Pineo G, Chen D, Portman RJ: Apixaban oder Enoxaparin zur Thromboprophylaxe nach Kniegelenkersatz. N. Engl. J. Med. 2009;361:594–604.
- Lassen MR, Raskob GE, Gallus A, Pineo G, Chen D, Hornick P; ADVANCE-2 Prüfärzte: Apixaban versus Enoxaparin zur Thromboseprophylaxe nach Kniegelenkersatz (ADVANCE-2): eine randomisierte Doppelblindstudie. Lancet 2010;375:807–815.
- Lassen MR, Gallus A, Raskob GE, Pineo G, Chen D, Ramirez LM; ADVANCE-3 Prüfärzte: Apixaban versus Enoxaparin zur Thromboseprophylaxe nach Hüftgelenkersatz. N Engl J Med 2010;363: 2487–2498.
- Barrett YC, Wang Z, Frost C, Shenker A: Klinische Labormessung von direkten Faktor-Xa-Inhibitoren: Der Anti-Xa-Assay ist dem Prothrombinzeit-Assay vorzuziehen. Thromb Haemost 2010;104:1263–1271.
- Kozek-Langenecker SA, Fries D, Gutl M, et al: Lokoregionale Anästhesie und Gerinnungshemmer. Empfehlungen der Task Force Perioperative Gerinnung der Österreichischen Gesellschaft für Anästhesiologie und Intensivmedizin. Anaesthesist 2005;54:476–484.
- Siegal DM, Curnutte JT, Connolly SJ, et al. Andexanet alfa zur Aufhebung der Faktor-Xa-Hemmeraktivität. N Engl J Med 2015;373: 2413–242

