Jeff Gadsden
EINFÜHRUNG
Die Inzidenz von Komplikationen aus der Vollnarkose ist in den letzten Jahrzehnten erheblich zurückgegangen, hauptsächlich aufgrund von Fortschritten bei der Überwachung der Atmungs- und Herz-Kreislauf-Funktion während der Verabreichung der Anästhesie. Die Verwendung objektiver Monitore wie Pulsoximetrie, Kapnographie, Elektrokardiographie usw. ermöglicht es Ärzten, sich ändernde physiologische Parameter rechtzeitig zu erkennen, schnell und angemessen einzugreifen und ihre therapeutischen Entscheidungen zu treffen.
Die Praxis der Regionalanästhesie leidet traditionell unter einem Mangel an objektiven Monitoren, die dem Praktiker dabei helfen, die Nadel-Nerv-Beziehung objektiver zu überwachen und neurologische Verletzungen zu verhindern. Die Praxis peripherer Nervenblockaden stützte sich traditionell auf subjektive Endpunkte, um das potenzielle Risiko für den Patienten abzuschätzen. Dies ändert sich jedoch mit der Einführung und Anwendung standardisierter Methoden, mit denen periphere Nervenblockaden sicher mit dem minimal möglichen Risiko für den Patienten durchgeführt werden können. Anstatt sich beispielsweise auf das Gefühl von „Klicks“, „Knallen“ und „Kratzern“ zu verlassen, um die Position der Nadelspitze zu identifizieren, können Ärzte jetzt die Interaktion an den Nadel-Faszien-Schichten mithilfe von Ultraschall überwachen. Ebenso kann die Quantifizierung der minimalen Stromstärke und des Injektionswiderstands verwendet werden, um zusätzliche Daten zu sammeln, die für die klinische Entscheidungsfindung nützlich sind, um das Risiko einer Nadelplatzierung in einer unerwünschten Gewebeebene, intravaskulär oder in empfindlichen anatomischen Strukturen, intraneural zu minimieren. Jüngste Fortschritte bei der Überwachung können daher die drei am meisten gefürchteten Komplikationen der peripheren Nervenblockade verringern: Nervenverletzung, Toxizität von Lokalanästhetika, und unbeabsichtigte Beschädigung benachbarter Strukturen („Needle Misadventure“).
Die objektive Überwachung und die Gründe für ihre Verwendung werden im ersten Teil dieses Abschnitts erörtert. Der letzte Abschnitt konzentriert sich auf die Dokumentation von Nervenblockadeverfahren, was eine logische Aufzeichnung der von den Monitoren erhaltenen objektiven Informationen ist. Eine objektive und belastbare Dokumentation darüber, wie eine Nervenblockade durchgeführt wurde, hat offensichtliche medizinrechtliche Implikationen und bietet eine nützliche Datenbank, um Fortschritte bei der Sicherheit und Wirksamkeit zu lenken.
ÜBERWACHUNG
Verfügbare Mittel zur Überwachung von Nadel-Nerven-Beziehungen
Monitore, wie sie in der medizinischen Praxis verwendet werden, sind Geräte, die einen bestimmten physiologischen Zustand beurteilen und den Arzt vor drohenden Schäden warnen. Zu den in diesem Kapitel besprochenen Monitoren gehören Monitore für die Nervenstimulation, Ultraschall und die Überwachung des Injektionsdrucks. Jede davon hat ihre eigenen Vor- und Nachteile und wird am besten in einer additiven, komplementären Weise verwendet (Figure 1), um das Risiko einer Verletzung des Patienten zu minimieren, anstatt sich nur auf die Informationen zu verlassen, die von einem Monitor geliefert werden. Es liegen genügend evidenzbasierte Informationen vor, dass die Kombination aller drei Monitore wahrscheinlich den sichersten Prozess während der Ausübung von peripheren Nervenblockaden erzeugt.
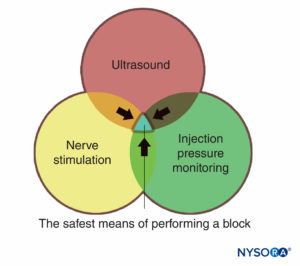
ABBILDUNG 1. Drei Modi zur Überwachung peripherer Nervenblockaden auf Patientenverletzungen. Der überlappende Bereich aller drei (blauer Bereich) stellt die sicherste Art dar, einen Block auszuführen.
Ein weiterer pharmakologischer Monitor, den viele Kliniker regelmäßig verwenden, ist die Verwendung von Epinephrin im Lokalanästhetikum. Es gibt einige Hinweise, die diese Praxis als Mittel zur Verbesserung der Sicherheit für die meisten Patienten während peripherer Nervenblockaden unterstützen. Erstens wirkt es als Marker der intravaskulären Absorption. Die intravenöse Injektion von 10 bis 15 µg Adrenalin erhöht zuverlässig den systolischen Blutdruck um mehr als 15 mmHg, selbst bei sedierten oder mit β-Blockern behandelten Patienten. Die Erkennung dieses Anstiegs kann eine frühzeitige Erkennung einer intravaskulären Injektion ermöglichen und ermöglicht es dem Kliniker, die Injektion sofort zu stoppen und die Wachsamkeit auf Anzeichen einer systemischen Toxizität zu erhöhen. Zweitens senkt Epinephrin den maximalen Plasmaspiegel des Lokalanästhetikums, was zu einem geringeren Risiko für systemische Toxizität führt. Bedenken hinsichtlich der vaskulären Wirkungen von Epinephrin, Vasokonstriktion und Nervenischämie wurden nicht begründet, und tatsächlich wurden Konzentrationen von 2.5 μg/ml (1:400,000) mit einer Zunahme des Nervendurchblutung in Verbindung gebracht, wahrscheinlich aufgrund der Dominanz von β -Wirkung des Medikaments. Daher kann Epinephrin die Sicherheit während der Verabreichung größerer Dosen von Lokalanästhetika ohne dokumentiertes Risiko einer Gliedmaßenischämie und eines neurologischen Todes erhöhen.
Bemerkenswert ist, dass die Verwendung von Ultraschallführung während peripherer Nervenblockaden das Risiko einer schweren systemischen Toxizität von Lokalanästhetika aus mehreren Gründen signifikant verringert hat. Dies liegt höchstwahrscheinlich daran, dass die Ultraschallführung eine Verringerung des Volumens und der Dosis des Lokalanästhetikums ermöglicht hat, um die meisten Nervenblockadeverfahren durch Überwachung seiner Ausbreitung durchzuführen. Darüber hinaus tragen die Beobachtung des Nadelwegs im Ultraschall, die Vermeidung einer intravaskulären Platzierung und die Bestätigung der Ausbreitung des Lokalanästhetikums im Gewebe zu einer höheren Sicherheit bei der ultraschallgesteuerten Regionalanästhesie bei.
Nervenstimulation
Die Neurostimulation hat in den 1980er Jahren Parästhesien als primäres Mittel zur Nervenlokalisierung weitgehend abgelöst. Seine Nützlichkeit als Methode zur genauen Lokalisierung von Nerven wurde jedoch kürzlich durch Daten mehrerer Studien in Frage gestellt, die zeigten, dass die evozierte motorische Reaktion (EMR) trotz intimen Nadel-Nerv-Kontakts fehlen kann, was durch Ultraschall bestätigt wurde. Tatsächlich kann bei einer Reihe von Nadel-Nerven-Kontakten oder sogar einer intraneuralen Nadelplatzierung eine unerwartet hohe Stromstärke erforderlich sein, um eine EMR hervorzurufen. Beispielsweise konnte in einigen Fällen eine EMR nur mit einer relativen Stromstärke von mehr als 1 mA erhalten werden, selbst bei intraneuraler Nadelplatzierung, wie im Ultraschall zu sehen ist.
Es gibt wahrscheinlich mehrere Faktoren, die zur Erklärung dieses Phänomens beitragen. Der wichtigste Faktor ist wahrscheinlich das Nebenschließen des elektrischen Stroms entlang des Pfades des geringsten Widerstandes (Impedanz). Mit anderen Worten, selbst wenn sich die Nadel in unmittelbarer Nähe des Nervs befindet, muss sich der elektrische Strom nicht notwendigerweise dafür entscheiden, in Richtung des Nervs zu fließen, sondern wandert eher entlang des Wegs des geringsten Widerstands, um über die Hautelektrode auszutreten. Ein zusätzlicher Faktor kann die ungleichmäßige Verteilung von motorischen und sensorischen Fasern im zusammengesetzten Nerv umfassen.
Dies bedeutet jedoch nicht, dass die elektrische Stimulation peripherer Nerven im Zeitalter der Ultraschallführung obsolet ist. Beispielsweise legten Daten aus mehreren Tier- und Humanstudien nahe, dass das Vorhandensein einer motorischen Reaktion bei sehr niedrigem Strom (d. h. < 0.2 mA) mit der Platzierung einer intraneuralen Nadelspitze und einer intraneuralen Entzündung nach einer Injektion in diesem Zustand verbunden ist (Tabelle 1). Völckel et al. berichteten, dass bei Injektion eines Lokalanästhetikums mit Strömen zwischen 0.3 und 0.5 mA das resultierende Nervengewebe keine Anzeichen eines Entzündungsprozesses zeigte, wohingegen Injektionen mit weniger als 0.2 mA zu einer lymphozytären und granulozytären Infiltration in 50 % der Nerven führten. Tsaiet al. führte eine ähnliche Studie durch, in der die Auswirkung des Abstands zum Nerv auf den erforderlichen Strom untersucht wurde; Während eine Reihe von Strömen für verschiedene Entfernungen aufgezeichnet wurden, waren die einzigen Fälle, in denen die motorische Reaktion bei weniger als 0.2 mA erhalten wurde, wenn die Nadelspitze intraneural platziert wurde.
TABELLE 1. Zusammenfassung neuerer Studien zum Nervenstimulationsstrom und zur Position der Nadelspitze.
| Studie | Betreff | Versandart | Befund |
|---|---|---|---|
| Völckel et al. (2005)11 | Schweine (n = 10) | • Beidseitig durchgeführte posteriore Ischiasnervblockaden • Zwei Gruppen – Injektion nach EMR bei 0.3–0.5 mA – Injektion nach EMR bei < 0.2 mA • 6 Stunden nach der Injektion werden die Ischiasnerven zur histologischen Analyse entnommen | • Normales, gesundes Aussehen der Nerven in der Hochstromgruppe • 50 % der Nerven in der Niedrigstromgruppe zeigten Hinweise auf sub- und peri-Lymphozyten und polymorphe Granulozyten. und intraneural • Eine Probe in der Niedrigstromgruppe zeigte eine grobe Störung des Perineuriums und mehrerer Nervenfasern |
| Tsai et al. (2008)12 | Schweine (n = 20) | • Vollnarkose • Ischiasnerven beidseitig freigelegt • Strom wird mit der Nadel in verschiedenen Abständen von 2 cm bis intraneural angelegt • Zwei verblindete Beobachter einigten sich auf den Mindeststrom, der erforderlich ist, um ein Hufzucken zu erhalten • 40 Versuche auf jeder Distanz | • Zuckungen des Ischiasnervs sind nur bei 0.1 cm oder näher erreichbar • Großer Strombereich, der erforderlich ist, um eine Motorreaktion hervorzurufen • Nur wenn intraneural, resultierte eine motorische Reaktion aus einem Strom < 0.2 mA |
| Bigeleisen et al. (2009)13 | Patienten für Hand-/Handgelenkchirurgie (n = 55) | • Supraklavikulärer Block • Aufgezeichneter Mindeststrom (mA) - Mit Nadel außerhalb des Nervenstamms (aber Kontakt mit dem Nerv) - Innerhalb des Stamms • „Intraneurale“ Lage sonographisch bestätigt mit 5-mL-Injektion des Lokalanästhetikums | • Mittlere minimale Stromschwelle außerhalb des Nervs 0.60 mA ± 0.37 mA • Die mittlere minimale Stromschwelle außerhalb des Nervs betrug 0.30 ± 0.19 mA • Zu keinem Zeitpunkt wurde EMR mit < 0.2 mA beobachtet, wenn die Nadel außerhalb des Nervs platziert wurde |
| Wiesmann et al. (2014)14 | Schweine (n = 6) | • Offenes Modell des Plexus brachialis • Stimulation an drei Positionen: intraneural, Nadel-Nerv-Kontakt und 1 mm vom Nerv entfernt • 3 Impulsdauern getestet (0.1, 0.3 und 1 ms) | • Die Stromstärke kann nicht zwischen intraneuralem und Nadel-Nerv-Kontakt unterscheiden • Motorische Reaktion < 0.2 mA (unabhängig von der Pulsdauer) zeigte intraneuralen oder Nadel-Nerv-Kontakt an |
Bigeleisenet al. untersuchten 55 Patienten, bei denen eine Operation an den oberen Extremitäten geplant war und die ultraschallgeführte supraklavikuläre Plexus-Blöcke erhielten. Die Autoren machten sich daran, die minimale Stromschwelle für die motorische Reaktion sowohl innerhalb als auch außerhalb des ersten angetroffenen Stammes zu bestimmen. Sie berichteten, dass die mittlere minimale Stimulationsschwelle außerhalb des Nervs 0.60 mA und innerhalb des Nervs 0.3 mA betrug. EMR wurde jedoch bei Stimulationsströmen von 0.2 mA oder weniger außerhalb des Nervs nicht beobachtet, wohingegen 36 % der Patienten eine EMR-Zuckung bei Strömen von weniger als 0.2 mA mit der intraneuralen Nadelplatzierung hatten. Um diese Beziehung weiter zu verfeinern, legten Wiesmann und Kollegen an drei verschiedenen Positionen (intraneural, wobei die Nadel das Epineurium berührt, und 1 mm vom Nerv entfernt) einen elektrischen Strom an den Plexus brachialis von Schweinen an, während sie die Impulsdauer variierten (0.1, 0.3 und 1.0 ms). Der minimale Schwellenstrom zum Auslösen einer motorischen Reaktion war zwischen den intraneuralen und Nadel-Nerven-Kontaktpositionen identisch, und beide waren signifikant niedriger als die Position 1 mm entfernt. Die Impulsdauer hatte keinen Einfluss auf den minimalen Schwellenstrom. Diese Autoren kamen zu dem Schluss, dass eine motorische Reaktion bei weniger als 0.2 mA (unabhängig von der Pulsdauer) entweder einen intraneuralen oder einen Nadel-Nerv-Kontakt anzeigte. Dies ist wichtig, da festgestellt wurde, dass selbst bei fehlender Punktion des Epineuriums selbst ein kräftiger Kontakt zwischen Nadel und Nerv (Epineurium) zu einer Entzündung und einer möglichen Nervenverletzung führt.
Zusammengenommen deuten die verfügbaren Daten darauf hin, dass die Sensitivität eines „niedrigen Stroms“, um eine EMR in einer potenziell gefährlichen Nadel-Nerv-Beziehung (intraneurale/epineurale Platzierung) hervorzurufen, etwa 75 % beträgt. Jedoch nähert sich die Spezifität der EMR, wenn sie bei weniger als 0.5 mA vorhanden ist, 100 %. Mit anderen Worten, eine motorische Reaktion wird durch einen Reizstrom niedriger Intensität (z. B. < 0.2 mA nach Voelckel et al.) ausgelöst, die Spitze ist immer intraneural oder eng mit dem Epineurium verbunden. Daher ist der Nutzen des Nervenstimulators offensichtlich: Das unerwartete Auftreten eines EMR bei 0.5 mA weist auf eine gefährliche Nadel-Nerv-Beziehung hin (z. B. Nadel-Nerv-Kontakt) und kann es dem Operateur ermöglichen, den Nadelvorschub zu stoppen, bevor die Nadel in den Nerv eintritt .
Es ist allgemein anerkannt, dass die Injektion eines Lokalanästhetikums in den Nerv einen Risikofaktor für Nervenverletzungen darstellt; daher ist die extraneurale Ablagerung des Lokalanästhetikums eine sicherere Praxis. Obwohl zweifellos nützlich, ist die Sonographie weit davon entfernt, eine unfehlbare Überwachung der Nadel-Nerv-Beziehung zu sein. Da die Injektion in ein Faszikel ein hohes Verletzungsrisiko birgt, ist eine zusätzliche elektrische Überwachung der Position der Nadelspitze aus Sicherheitsgründen sinnvoll, insbesondere bei Patienten mit schwieriger Ultraschallanatomie, wenn sich die Bildgebung als schwierig erweist oder die Bildqualität schlecht ist. Wenn ein EMR bei Strömen unter 0.5 mA ausgelöst wird, weist dies auf eine enge Nadel-Nerv-Beziehung hin, die zu einem leichten Zurückziehen der Nadel und einer vorsichtigen Injektion führen sollte, während ein Öffnungsinjektionsdruck von mehr als 15 psi vermieden wird. Insgesamt trägt die Nervenstimulation nur wenig zu den Kosten einer Nervenblockade in Bezug auf Zeit oder Kosten bei und kann auch als nützliche funktionelle Bestätigung des auf dem Ultraschallbildschirm angezeigten anatomischen Bildes dienen (z. B. „Ist das der Nervus medianus oder ulnaris? ?”). Aus diesen Gründen sollte die Nervenstimulation routinemäßig in Verbindung mit Ultraschall als wertvolle zusätzliche Überwachung der Position der Nadelspitze eingesetzt werden. Lerne mehr über Elektrische Nervenstimulatoren und Lokalisierung peripherer Nerven.
Ultraschall
Ultraschall hat die Praxis der Regionalanästhesie revolutioniert und eine wesentliche Entwicklung der Subspezialität von einer Kunst, die von wenigen praktiziert wird, zu einer Wissenschaft ermöglicht, die besser reproduzierbar ist. Die Vorteile liegen darin, dass Ultraschall es ermöglicht, die Nadel in Echtzeit zu sehen und somit die Nadel schneller und genauer zum Ziel zu führen. Ultraschall ermöglicht auch eine zusätzliche Injektion, wenn der erste Versuch nicht ausreicht, und das genaue Einbringen des Injektats in Gewebezwischenräume für eine reproduzierbare Nervenblockade. Außerdem ermöglicht Ultraschall die Durchführung einer Nervenblockade auch bei Patienten, die gelähmt sind, Amputierten, die keine Extremität für eine EMR haben, und so weiter.
Ultraschall hat aus mehreren Gründen das Potenzial, die Sicherheit peripherer Nervenblockaden zu verbessern. Angrenzende Strukturen von Bedeutung können gesehen und vermieden werden. Das Wiederaufleben der Popularität des supraklavikulären Blocks ist ein Beweis dafür. Vor dem Ultraschall war diese hochwirksame Blockade relativ unbeliebt als Mittel zur Anästhesie des Plexus brachialis aus Angst, einen Pneumothorax zu verursachen, aufgrund der Nähe des Plexus und der Sicht auf die Platzierung der Nadel an der Pleura und der Brusthöhle. Da jedoch der Plexus brachialis und vor allem Rippe, Pleura und A. subclavia im Ultraschall identifiziert werden können, ist die supraklavikuläre Blockade in der klinischen Praxis alltäglich geworden. Unabhängig davon sollte Ultraschall nicht als ausfallsicher angesehen werden, da Komplikationen, einschließlich Pneumothorax, immer noch unter Ultraschallführung auftreten. In ähnlicher Weise gibt es Berichte über intravaskuläre und intraneurale Nadelplatzierungen, die durch (und trotz der Verwendung von) Ultraschall beobachtet wurden.
Ein wichtiger Vorteil des Ultraschall-Screenings ist die Fähigkeit, den Abstand von der Haut zum Ziel zu bestimmen. In Verbindung mit Nadeln mit seitlich eingeätzten Tiefenmarkierungen bietet dies einen zusätzlichen Sicherheitsspielraum, indem der Arzt vor einem „Stoppabstand“ oder einer Tiefe gewarnt wird, über die er hinausgehen sollte, um die Nadel in tieferes Gewebe vorzuschieben und neu zu beurteilen. Ein weiterer wichtiger Vorteil des Ultraschalls ist die Möglichkeit, die Verteilung des Lokalanästhetikums in Echtzeit zu sehen. (Figure 2). Wenn zu Beginn der Injektion keine entsprechende Gewebeausdehnung zu sehen ist, befindet sich die Nadelspitze möglicherweise nicht dort, wo sie vermutet wird, und der Kliniker kann die Injektion anhalten und die Position der Nadelspitze neu beurteilen. Dies ist besonders wichtig in vaskulären Bereichen, da die fehlende Ausbreitung des Lokalanästhetikums eine intravaskuläre Nadelplatzierung signalisieren kann. Andererseits kann die Ultraschallüberwachung verwendet werden, um eine intraarterielle Nadelspitzenplatzierung zu diagnostizieren, wenn ein echogenes „Röten“ im Lumen der Arterie festgestellt wird, wodurch das Risiko einer systemischen Toxizität verringert wird.
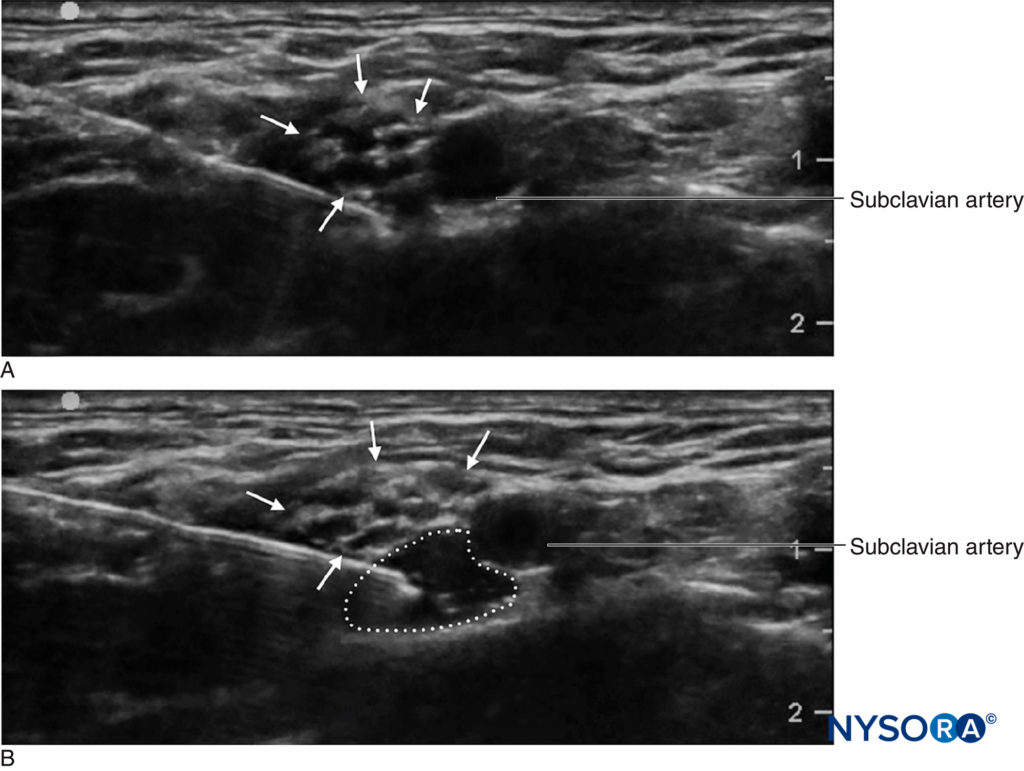
ABBILDUNG 2. Supraklavikulärer Plexus-brachialis-Block mit Plexus (Pfeile) neben der A. subclavia (SA). A Vor und B nach dem Auftragen von 10 ml Lokalanästhetikum (gestrichelte Umrandung).
Ultraschall scheint das Risiko einer systemischen Toxizität von Lokalanästhetika (LAST) zu verringern. In einer Analyse eines großen, multizentrischen Registers von peripheren Nervenblockaden (>25,000 periphere Nervenblockaden) wurde das LAST-Risiko durch die Verwendung von Ultraschallführung um mehr als 65 % reduziert. Der von den Autoren vorgeschlagene Mechanismus war die Fähigkeit, die Volumina und Dosen des Lokalanästhetikums, die erforderlich sind, um eine regionale Blockade zu erreichen, wesentlich zu reduzieren. In der Tat war die Verringerung der Dosis und des Volumens des Lokalanästhetikums, das für den Erfolg der Regionalanästhesie erforderlich ist, im letzten Jahrzehnt ein beständiger Trend. Zahlreiche Berichte haben eine erhebliche Reduzierung des Volumens dokumentiert, das erforderlich ist, um eine äquivalente Blockade im Vergleich zu präultraschallgesteuerten Regionalanästhesietechniken zu bewirken. Beispielsweise können Plexus-brachialis-Blockaden mit weniger als 10 ml Lokalanästhetikum durchgeführt werden, ohne dass die Wirksamkeit der Anästhesie oder Analgesie beeinträchtigt wird. Selbst wenn versehentlich das gesamte Injektatvolumen intravenös verabreicht wird, ist eine schwerwiegende LAST, die beispielsweise bei einer Menge von 7 ml 0.5 % Ropivacain bei einem Erwachsenen mittlerer Größe auftritt, unwahrscheinlich Blockaden hat das Risiko oder die Häufigkeit von Nervenverletzungen nicht verringert.
Diese enttäuschende Beobachtung wurde in mehreren Berichten dokumentiert und ist wahrscheinlich multifaktoriell. Die Fähigkeit, die Nadel-Nerv-Beziehung zu erkennen, ist benutzer- und anatomieabhängig. Tatsächlich haben Studien gezeigt, dass Ärzte ungefähr eine von sechs intraneuralen Injektionen verpassen können. Zweitens ist die aktuelle Auflösung des Ultraschallgeräts möglicherweise nicht ausreichend, um zwischen einer intraversalen extrafaszikulären Nadelspitzenposition zu unterscheiden. Dieser Unterschied ist entscheidend, da eine intraneurale (aber extrafaszikuläre) Injektion wahrscheinlich nicht mit einer Verletzung verbunden ist, während eine Injektion in die Faszikel selbst zu klinischen und histologischen Schäden führt. Wichtig ist, dass man sich nicht auf die Nervenschwellung als Warnung vor einer intraneuralen Injektion verlassen kann, denn sobald dies im Ultraschall bemerkt wird, kann es zu spät sein, um eine Verletzung zu verhindern. Dies liegt daran, dass selbst eine winzige Menge Lokalanästhetikum Schäden verursacht, wenn es in die Faszikel injiziert wird, aber solch kleine Mengen an Lokalanästhetikum (z. B. 0.1–0.5 ml) können durch Ultraschall möglicherweise nicht erkannt werden. Daher kann das Vertrauen auf die visuelle Bestätigung der Gewebeausdehnung zu Schäden führen, bevor die Ausdehnung auf dem Bildschirm erkannt wird.
Einspritzdrucküberwachung
Eine Injektion von Lidocain, während sich die Nadelspitze in einer intrafaszikulären Position in Ischiasnerven des Hundes befand, war mit einem hohen Öffnungsdruck (> 20 psi) verbunden, gefolgt von einer Rückkehr des Injektionsdruckverlaufs zum Normalwert (dh < 5 psi) nach dem Faszikularbruch. Im Gegensatz dazu ergaben perineurale und intraneurale extrafaszikuläre Injektionen niedrige Öffnungs- und Injektionsdrücke. Die Gliedmaßen, bei denen Injektionen in den Ischiasnerv mit hohen Öffnungsinjektionsdrücken verbunden waren, zeigten klinische Anzeichen einer Neuropathie (Muskelschwund, Schwäche) sowie histologische Anzeichen einer neurologischen Verletzung (Entzündung, Störung der Nervenarchitektur). Die Implikation ist, dass die Injektion in ein Kompartiment mit geringer Compliance, wie z. B. in perineuriumgebundene Faszikel, einen hohen Öffnungsinjektionsdruck erfordert, bevor die Injektion eingeleitet werden kann.
Die Position der intraneuralen Nadelspitze ist auch mit hohen Öffnungsinjektionsdrücken bei menschlichen Leichen verbunden. Orebaugh et al. platzierten mittels Ultraschall Nadeln in Zervixwurzeln von Leichen und quantifizierten den Druck im Verlauf einer 5-ml-Injektion von Ropivacain und Tinte über 15 s. Im Gegensatz zu den außerhalb der Wurzeln platzierten Kontrollnadeln (Spitzendruck < 20 psi) führten die intraneuralen Injektionen zu einem mittleren Spitzendruck von 49 psi (Bereich 37–66 psi). In ähnlicher Weise führten Krol et al. Ultraschall-geführte Injektionen intraneural und perineural in distalere Nerven frischer menschlicher Leichen (Median-, Ulnar- und Radialnerven) durch und berichteten auch, dass der Öffnungsinjektionsdruck intraneural mehr als 15 psi betrug, während der extraneurale Öffnungsinjektionsdruck waren weniger als 10 psi.
In einer klinischen Studie mit 16 Patienten, die sich einer Schulteroperation unterziehen mussten, war der Nadel-Nerv-Kontakt während einer Interskalenus-Blockade des Plexus brachialis mit einer Öffnungsinjektion von mehr als 15 psi verbunden. Tatsächlich konnte am Nadel-Nerv-Kontakt und kurz vor dem Eintritt der Nadel in die Wurzeln des Plexus brachialis der Injektatfluss bei Drücken von weniger als 15 psi nicht beginnen. Das Anhalten einer Injektion, wenn der erforderliche Öffnungsinjektionsdruck zum Beginnen einer Injektion 15 psi erreichte, ermöglichte es, die Injektion in dieser gefährlichen Position bei 97 % der Probanden zu vermeiden. Im Gegensatz dazu war eine Nadelposition 1 mm vom Nerv entfernt mit der Einleitung des Flusses bei Öffnungsdrücken von weniger als 15 psi verbunden. Daher war als Überwachung des Nadel-Nerv-Kontakts ein Öffnungsinjektionsdruck von mehr als 15 psi weitaus empfindlicher als ein minimaler Schwellenstrom von entweder 0.5 oder 0.2 mA oder das Auftreten von Parästhesien.
Diese Daten legen nahe, dass, wenn sich der Druck im System 15 psi nähert, ohne dass der Injektionsfluss beginnen kann, dieser hohe Öffnungsinjektionsdruck eine gefährliche Nadel-Nerv-Beziehung oder eine Nadelplatzierung in einer falschen Gewebeebene signalisieren kann. Daher sollte die Injektion gestoppt und die Nadelposition neu bewertet werden.
Wie sollte der Einspritzdruck überwacht werden? Die Verwendung des „Handgefühls“ zur Vermeidung eines hohen Einspritzdrucks ist leider nicht zuverlässig. Studien mit erfahrenen Praktikern, die für den Injektionsdruck blind waren und gebeten wurden, eine Scheininjektion mit Standardausrüstung durchzuführen, zeigten große Unterschiede im angewandten Druck, von denen einige die festgelegten Grenzwerte für die Sicherheit deutlich überschritten. In ähnlicher Weise schnitten Anästhesisten schlecht ab, wenn sie gebeten wurden, in einem Tiermodell zwischen einer intraneuralen Injektion und einer Injektion in andere Gewebe wie Muskeln oder Sehnen zu unterscheiden. Daher ist die einzig sinnvolle und reproduzierbare Überwachung die Verwendung einer objektiven und quantifizierbaren Methode zur Überwachung des Öffnungseinspritzdrucks.
Während die Praxis der Überwachung des Injektionsdrucks während peripherer Nervenblockaden relativ neu ist, gibt es mehrere Überwachungsoptionen. Tsui et al. beschrieben eine „Druckluftinjektionstechnik“, bei der 10 ml Luft zusammen mit dem Lokalanästhetikum in die Spritze gezogen werden. Wenn Sie die Spritze aufrecht halten, kann ein maximaler Schwellenwert von 1 atm (oder 14.7 psi) vermieden werden, indem Sie zulassen, dass nur der Gasanteil des Spritzeninhalts auf die Hälfte seines ursprünglichen Volumens oder 5 ml komprimiert wird (Figure 3). Dies basiert auf dem Gesetz von Boyle, das besagt, dass Druck × Volumen konstant sein muss. Ein Druck von 20 psi oder weniger wird als sichere Schwelle für das Einleiten der Injektion während peripherer Nervenblockaden angesehen. Das Gesetz von Boyle wurde auch in einem anderen einfachen Gerät verwendet, das einen Vierwegehahn und eine mit Luft gefüllte 1-ml-Spritze verwendet. Wenn der Flüssigkeitsmeniskus zu Beginn der Injektion den halben Punkt in der 1-ml-Spritze (dh 0.5 ml) erreicht, weist dies auf eine Verdoppelung des Drucks im System hin (dh eine andere Atmosphäre oder 14.7 psi). Dies sind sowohl kostengünstige als auch allgegenwärtige Möglichkeiten, den Injektionsdruck während peripherer Nervenblockaden zu begrenzen. Zu den praktischen Einschränkungen gehört die Notwendigkeit, die Spritze entweder aufrecht zu halten oder den Absperrhahn der 1-ml-Spritze beim Aspirieren regelmäßig zu schließen, damit keine Luft in den Injektionsschlauch eindringen kann.
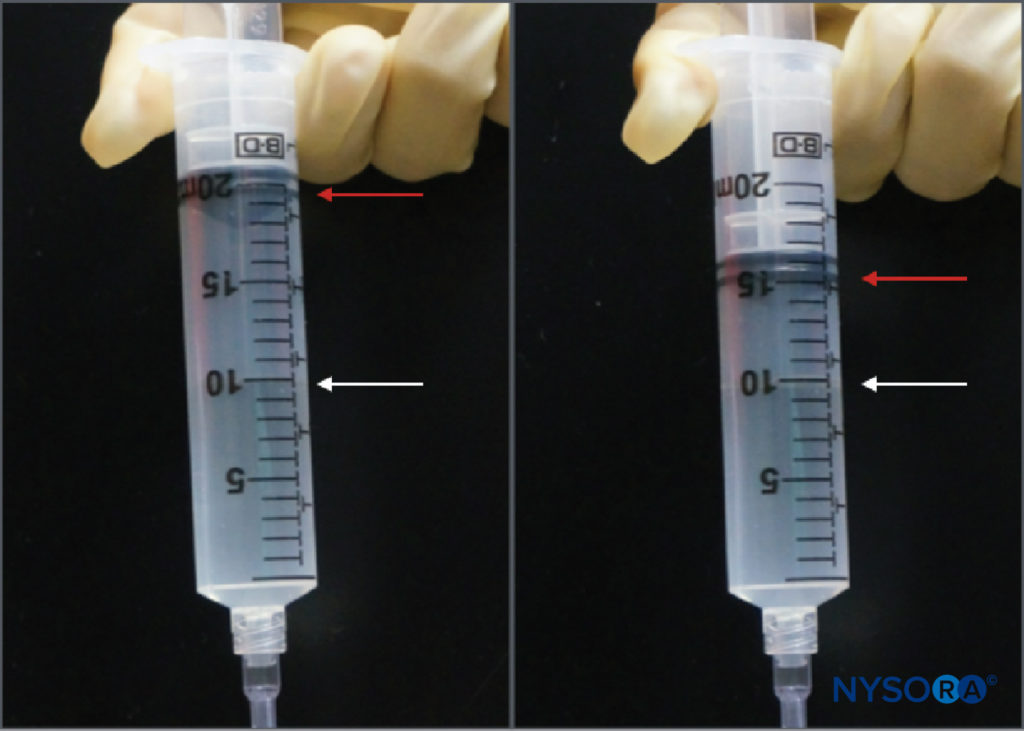
ABBILDUNG 3. Die Druckluftinjektionstechnik. Eine 10-ml-Luftblase wird in die Spritze mit dem Lokalanästhetikum gegeben, die dann umgedreht wird. Die Kompression dieser Blase in einem geschlossenen System auf die Hälfte ihres ursprünglichen Volumens (dh 5 ml) erhöht den Druck im System um 1 atm (14.7 psi).
Eine weitere Möglichkeit zur Überwachung des Injektionsdrucks ist die Verwendung von speziell für diesen Zweck hergestellten Inline-Einweg-Druckmanometern. Diese Vorrichtungen überbrücken die Spritze und den Nadelschlauch und ermöglichen dem Arzt über einen federbelasteten Kolben die kontinuierliche Überwachung des Drucks im Spritzen-Schlauch-Nadel-System. Auf dem Schaft des Kolbens befinden sich Markierungen, die drei verschiedene Druckschwellenwerte darstellen: weniger als 15 psi, 15–20 psi und mehr als 20 psi (Figure 4). Ein Vorteil dieses Verfahrens ist die Leichtigkeit, mit der ein Assistent, der die Injektion durchführt, die erreichten Drücke ablesen und mitteilen kann. Diese Methode ermöglicht auch eine objektive Dokumentation des Injektionsdrucks während einer peripheren Nervenblockade. Wichtig ist, dass der Öffnungsdruck (Druck, bei dem der Fluss beginnt) unabhängig von der Größe der Spritze, des Schlauchs und der Nadel oder der Injektionsgeschwindigkeit ist (Pascalsches Gesetz) (Figure 5). Während durch eine kleinere Spritze ein größerer Druck und durch eine schnelle Injektion ein höherer Injektionsdruck erreicht werden kann, ist der Öffnungsdruck, bei dem der Fluss beginnt, derselbe und unabhängig von diesen Variablen für gängige Spritzen-Schlauch-Nadel-Größen (dh 18– 25 Gauge). Wenn jedoch das Einspritzen beginnt, werden diese Faktoren den erreichten Einspritzdruck beeinflussen. Daher wird bei allen Nervenblockadeverfahren eine langsame, gleichmäßige Injektionsgeschwindigkeit empfohlen (10–15 ml/min). Der Öffnungsinjektionsdruck wird bei jeder Nadelumstellung und daraus folgenden Injektion relevant. Die Drucküberwachung kann eine nützliche Sicherheitsüberwachung in mehreren anderen Aspekten von peripheren Nervenblockaden sein. In einer Studie mit Patienten, die lumbale Plexusblockaden erhielten, die randomisiert auf niedrige (<15 psi) versus hohe (>20 psi) Drücke eingestellt wurden, zeigten Gadsden et al., dass 60 % der Patienten in der Hochdruckgruppe eine bilaterale Epiduralblockade erlitten.
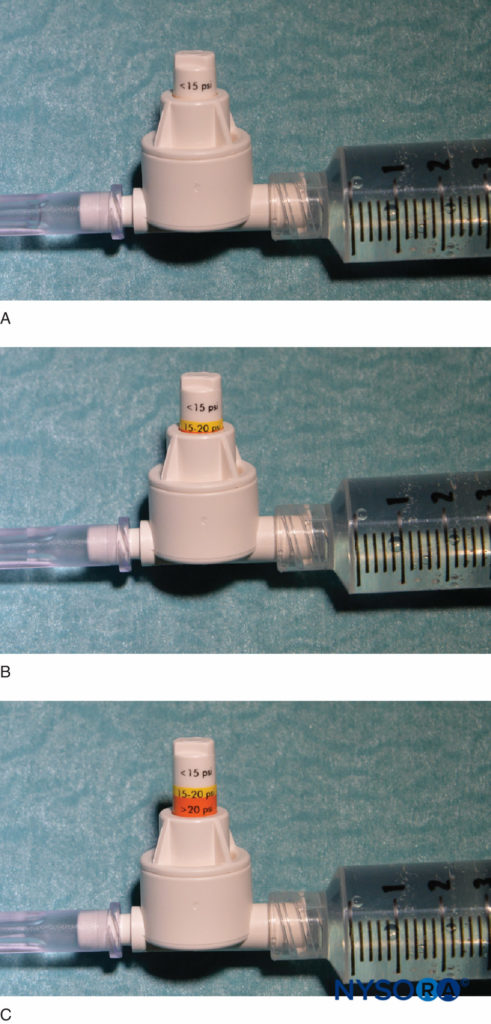
ABBILDUNG 4. Ein Beispiel für ein kommerziell erhältliches Inline-Druckmanometer (B-Smart, B. Braun Medical, Bethlehem, PA). Wie jeweils in A–C zu sehen, zeigt der Monitor Druckbereiche in Farbe auf dem beweglichen Kolben an: 0–15 psi (weiß), 15–20 psi (gelb) und mehr als 20 psi (orange). Bei der klinischen Anwendung ist der exakte Öffnungsinjektionsdruck (OIP) weniger wichtig als die Verhinderung einer Überschreitung des OIP-Bereichs, der mit einer faszikulären Verletzung verbunden ist (> 15 psi). Praktisch wird dies vermieden, indem die Injektion abgebrochen wird, wenn während des gesamten Injektionszyklus (> 15 psi) irgendeine Farbe auf dem Kolben erscheint. Wichtig ist, dass der Öffnungsdruck (Druck, bei dem der Fluss beginnt) unabhängig von der Größe der Spritze, des Schlauchs und der Nadel oder der Injektionsgeschwindigkeit ist (Pascalsches Gesetz).
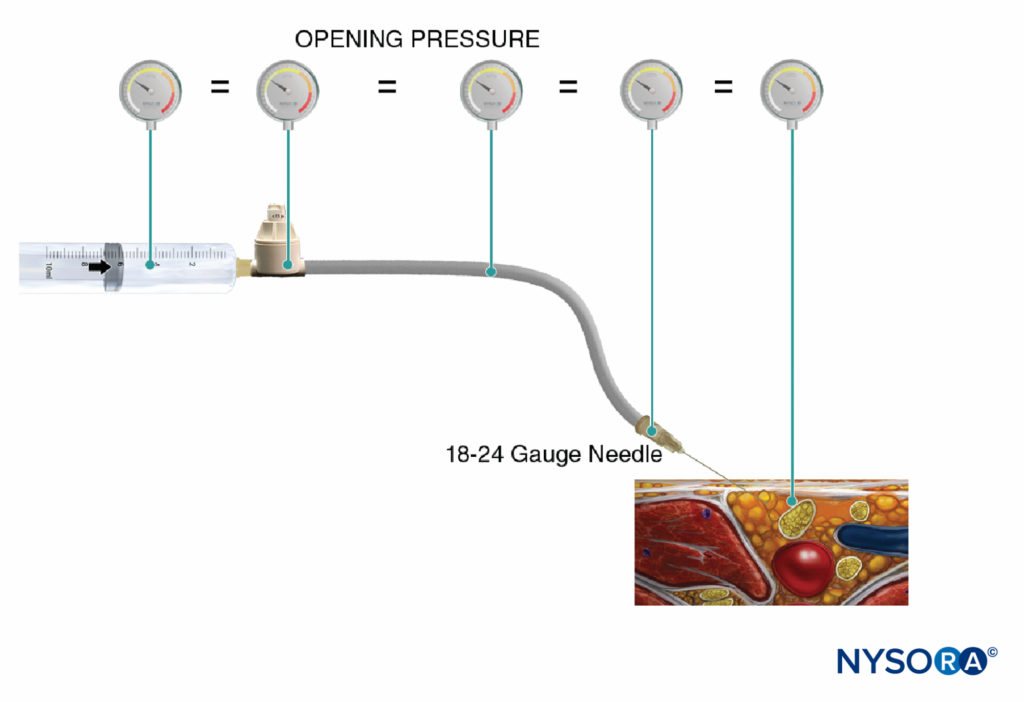
ABBILDUNG 5. Der Öffnungsinjektionsdruck (Druck, bei dem der Fluss beginnt) ist unabhängig von der Größe der Spritze, des Schlauchs und der Nadel oder der Injektionsgeschwindigkeit und im gesamten Injektionssystem gleich (Pascalsches Gesetz).
Darüber hinaus entwickelten 50 % der Patienten in derselben Gruppe einen epiduralen Block in der Thoraxverteilung, während kein Patient in der Gruppe mit niedrigem Druck einen bilateralen oder epiduralen Block erlitt. In ähnlicher Weise zeigten Gautier et al., dass bei randomisierter Auswahl von Freiwilligen für niedrige (<15 psi) versus hohe (>20 psi) Drücke während einer Interskalenus-Brachialplexus-Blockade bei 11 % der Hochdruckinjektionen eine zervikale epidurale Ausbreitung auftrat (gegenüber 0 % bei den Niederdruckgruppe). Darüber hinaus forderten alle Probanden, dass die Injektion im Hochdruckzustand aufgrund von Unbehagen angehalten werden sollte, aber nicht während der Niederdruckinjektion. Diese Daten legen nahe, dass die Überwachung des Öffnungsinjektionsdrucks für mehrere Aspekte der Sicherheit und des Patientenkomforts während der Durchführung peripherer Nervenblockaden wichtig ist.
Zusammenfassung
Die Regionalanästhesie hat einen Übergang von der Kunst zur Wissenschaft vollzogen, da strengere und präzisere Mittel zum Lokalisieren von Nerven entwickelt wurden. Derselbe Vorgang sollte für die Überwachung des Peripherieblocks erwartet werden. Die Verwendung von Neurostimulation, Ultraschall und Überwachung des Injektionsdrucks zusammen bietet ein ergänzendes Paket objektiver Daten, die Kliniker anleiten können, die sichersten Blockierungen durchzuführen.
Figure 6 ist ein Flussdiagramm, das skizziert, wie diese Monitore in unserer Praxis verwendet werden.
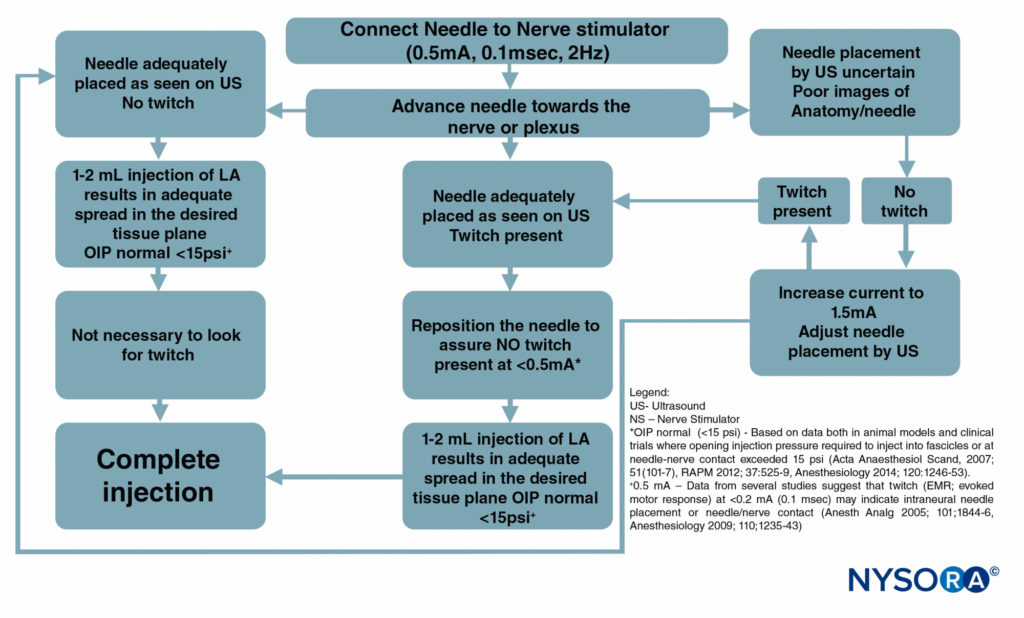
ABBILDUNG 6. Ein Flussdiagramm, das die Reihenfolge der korrekten Überwachung von Nervenblockadeverfahren durch Kombination von Ultraschall (US), Nervenstimulation (NS) und Überwachung des Injektionsdrucks darstellt. LA = Lokalanästhetikum.
DOKUMENTATION
Hinweise zum Blockverfahren
Die Dokumentation von Nervenblockadeverfahren ist hinter der Dokumentation der Vollnarkose zurückgeblieben und wird oft auf ein paar gekritzelte Zeilen in der Ecke des Anästhesieprotokolls reduziert. Zunehmender Druck aus rechtlichen, Abrechnungs- und behördlichen Quellen hat zu Bemühungen geführt, die Dokumentation für periphere Nervenblockaden zu verbessern. Muster eines Dokumentationsformulars für eine periphere Nervenblockade, das alle zuvor in diesem Kapitel erwähnten Überwachungselemente enthält, werden in gezeigt Figuren 7 und 8. Diese können übernommen und an individuelle Praktiken angepasst werden. Die Formulare weisen eine Reihe von Merkmalen auf, die von Institutionen berücksichtigt werden sollten, die versuchen, ihre eigene Verfahrensnotiz zu formulieren. Dazu gehören die folgenden:
Papierakten werden zunehmend durch elektronische Patientenaktensysteme ersetzt. Die Blockdokumentation ist mit computergestützten Systemen wie diesen einfach, da die Blockvariablen schnell aus einer Liste ausgewählt werden können, indem relevante Dokumentationselemente angegeben werden, während alle narrativen Elemente schnell über eine Tastatur eingegeben werden können (Figure 8). Lesbarkeit und Fehlerkorrekturfähigkeit sind Vorteile des e-Block-Vermerks.
Ein weiterer nützlicher Aspekt der Dokumentation peripherer Nervenblockaden ist die Aufzeichnung eines Ultraschallbildes oder Videoclips, die entweder als Papierkopie in der Patientenakte oder als digitale Kopie in der elektronischen Patientenakte (EHR) oder einer separaten sicheren Festplatte gespeichert werden. Dies ist nicht nur aus medizinrechtlicher Sicht eine gute Praxis, sondern auch ein erforderlicher Schritt, der unternommen werden muss, wenn der Kliniker die Verwendung der Ultraschallführung in Rechnung stellen möchte. An allen Ausdrucken sollte ein Patientenidentifikationsaufkleber angebracht sein, das Datum aufgezeichnet und alle relevanten Befunde mit einem Marker hervorgehoben sein, wie z. B. Ausbreitung des Lokalanästhetikums um den Nerv. Weitere Beispiele für eine äußerst praktische Dokumentation essentieller Nervenblockaden und Spinalanästhesieverfahren finden Sie in Figuren 9 und 10, Bzw.
| Nützliche Merkmale einer peripheren Nervenblockade Hinweis | Beispiel |
|---|---|
| Elemente, die den Praktiker anleiten, einen bestimmten Pflegestandard zu erfüllen | Ein Feld, um die Verwendung von Epinephrin in der Lokalanästhesielösung anzugeben, oder wenn keine verwendet wurde, warum nicht |
| Ein Kompromiss aus Effizienz und Individualisierbarkeit | Informationen, die sowohl mit Kontrollkästchen als auch mit Leerzeilen aufgezeichnet wurden |
| Dokumentation zum Schutz vor allgemeinen medizinrechtlichen Herausforderungen | Der Arzt muss den Bewusstseinsgrad des Patienten angeben |
| Dokumentation der Compliance mit Aufsichtsbehörden (z. B. Joint Commission) | Ankreuzfelder zeigen Lateralität an |
| Elemente zur Erleichterung einer erfolgreichen Abrechnung | Sprache, die von vielen Versicherungsgesellschaften gefordert wird und die speziell vom Chirurgen angeforderte Sperre angibt |
| Dokumentation der beteiligten Kliniker und in welcher Funktion | Führte die behandelnde Person die Blockade durch oder leitete sie einen Bewohner medizinisch an? |
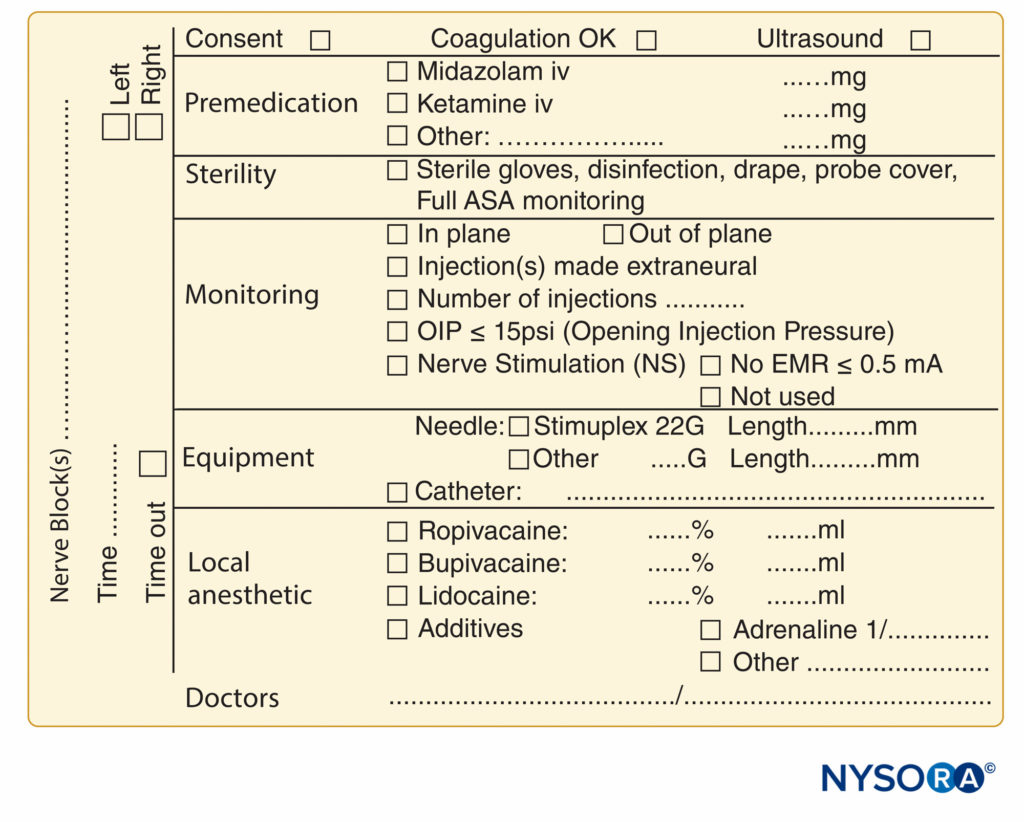
ABBILDUNG 9. Wesentliche Elemente der Dokumentation von peripheren Nervenblockadeverfahren, die am NYSORA-Europe CREER (Center for Research, Education, and Enhanced Recovery From Orthopaedic Surgery) am ZOL (Ziekenhuis Oost-Limburg), Genk, Belgien, verwendet werden.
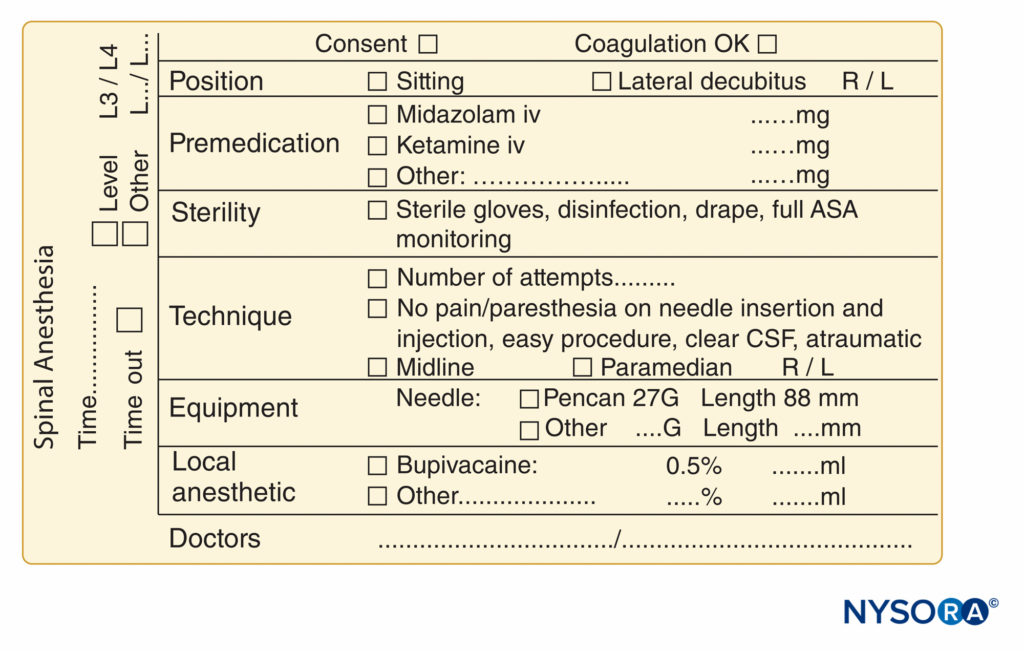
ABBILDUNG 10. Wesentliche Elemente der Dokumentation von Spinalanästhesieverfahren, die am NYSORA-Europe CREER (Center for Research, Education, and Enhanced Recovery From Orthopaedic Surgery) am ZOL (Ziekenhuis Oost-Limburg), Genk, Belgien, verwendet werden.
Informed Consent
Die Dokumentation der Einwilligungserklärung ist ein wichtiger Aspekt der Regionalanästhesiepraxis. Die Praxismuster in dieser Frage sind sehr unterschiedlich, und eine spezifische schriftliche Zustimmung für Nervenblockadeverfahren wird häufig nicht eingeholt. Die schriftliche Dokumentation dieses Prozesses kann jedoch aus mehreren Gründen wichtig sein:
- Die Patienten sind am Tag der Operation (wenn viele Zustimmungen eingeholt werden) oft abgelenkt und ängstlich und erinnern sich möglicherweise nicht mehr an die Einzelheiten eines Gesprächs mit ihrem Anästhesisten. Studien haben gezeigt, dass eine schriftliche Aufzeichnung des Einwilligungsprozesses die Patientenerinnerung an Risiken und Vorteile verbessert.
- Eine schriftliche Einwilligung bestätigt, dass zwischen dem Patienten und dem Arzt eine Diskussion über Risiken und Nutzen stattgefunden hat.
- Ein spezielles Dokument für die Regionalanästhesie kann so zugeschnitten werden, dass es alle üblichen und schwerwiegenden Risiken enthält; Dies ermöglicht es dem Arzt, sie dem Patienten routinemäßig zu erklären, und verringert die Wahrscheinlichkeit, dass wichtige Risiken ausgelassen werden.
Die folgenden Tipps können verwendet werden, um den Einwilligungsprozess zu optimieren:
| Vorschläge zur Verbesserung des Einwilligungsprozesses. |
|---|
| Fass dich kurz. Eine einfache, kurze Erklärung hilft bei der Erinnerung an die Risiken und Vorteile mehr als lange Absätze. |
| Beziehen Sie nicht nur schwerwiegende und große Risiken ein, sondern auch Vorteile und erwartete Ergebnisse des vorgeschlagenen Regionalanästhesieverfahrens. Es ist für Patienten schwierig, eine fundierte Entscheidung zu treffen, wenn nur Risiken besprochen werden. |
| Verwenden Sie den Zustimmungsprozess als Mittel, um den Patienten gleichzeitig aufzuklären. |
| Bieten Sie dem Patienten eine Kopie des Formulars an. Es hat sich gezeigt, dass dies beim Abrufen von einwilligungsbezogenen Informationen hilft. |
REFERENZEN
- Buhre W, Rossaint R: Perioperatives Management und Monitoring in der Anästhesie. Lancet 2003;362:1839–1846.
- Guinard JP, Mulroy MF, Carpenter RL, Knopes KD: Testdosen: optimaler Epinephringehalt mit und ohne akuter beta-adrenerger Blockade. Anesthesiology 1990;73:386–392.
- Tanaka M, Sato M, Kimura T, Nishikawa T: Die Wirksamkeit einer simulierten intravaskulären Testdosis bei sedierten Patienten. Anesth Analg 2001;93: 1612–1617, Inhaltsverzeichnis.
- Karmakar MK, Ho AM-H, Law BK, Wong ASY, Shafer SL, Gin T: Arterielle und venöse Pharmakokinetik von Ropivacain mit und ohne Epinephrin nach thorakaler paravertebraler Blockade. Anesthesiology 2005;103:704–711.
- Van Obbergh LJ, Roelants FA, Veyckemans F, Verbeeck RK: Bei Kindern verändert die Zugabe von Epinephrin die Pharmakokinetik von kaudal injiziertem Ropivacain. Can J Anaesth 2003;50:593–598.
- Neal JM: Wirkungen von Epinephrin in Lokalanästhetika auf das zentrale und periphere Nervensystem: Neurotoxizität und neuraler Blutfluss. Reg Anesth Pain Med 2003;28:124–134.
- Sites BD, Taenzer AH, Herrick MD, et al: Inzidenz von systemischer Toxizität von Lokalanästhetika und postoperativen neurologischen Symptomen im Zusammenhang mit 12,668 ultraschallgeführten Nervenblockaden: eine Analyse aus einem prospektiven klinischen Register. Reg Anesth Pain Med 2012;37(5):478–482.
- Perlas A, Niazi A, McCartney C, Chan V, Xu D, Abbas S: Die Empfindlichkeit der motorischen Reaktion auf Nervenstimulation und Parästhesie für die Nervenlokalisierung, wie durch Ultraschall bewertet. Reg Anesth Pain Med 2006;31:445–450.
- Chan VWS, Brull R, McCartney CJL, Xu D, Abbas S, Shannon P: Eine ultrasonographische und histologische Studie zur intraneuralen Injektion und elektrischen Stimulation bei Schweinen. Anesth Analg 2007;104:1281–1284, Inhaltsverzeichnis.
- Robards C, Hadzic A, Somasundaram L, et al: Intraneurale Injektion mit Niedrigstrom-Stimulation während poplitealer Ischiasnervblockade. Anesth Analg 2009;109:673–677.
- Voelckel WG, Klima G, Krismer AC, et al: Entzündungszeichen nach Ischiasnervenblockade bei Schweinen. Anesth Analg 2005;101:1844–1846.
- Tsai TP, Vuckovic I, Dilberovic F, et al: Die Intensität des stimulierenden Stroms ist möglicherweise kein zuverlässiger Indikator für die intraneurale Nadelplatzierung. Reg Anesth Pain Med 2008;33:207–210.
- Bigeleisen PE, Moayeri N, Groen GJ: Extraneurale versus intraneurale Stimulationsschwellen während einer ultraschallgeführten supraklavikulären Blockade. Anesthesiology 2009;110:1235–1243.
- Wiesmann T, Bornträger A, Vassiliou T, et al: Minimale Stromstärke, um eine evozierte motorische Reaktion hervorzurufen, kann nicht zwischen Nadel-Nerv-Kontakt und intraneuraler Nadeleinführung unterscheiden. Anesth Analg 2014;118:681–686.
- Steinfeldt T, Graf J, Schneider J, et al: Histologische Folgen des Nadel-Nerv-Kontakts nach Nervenstimulation in einem Schweinemodell. Anesthesiol Res Pract 2011;2011:591851.
- Steinfeldt T, Poeschl S, Nimphius W, et al: Forcierter Nadelvorschub während des Nadel-Nerv-Kontakts in einem Schweinemodell: histologisches Ergebnis. Anesth Analg 2011;113:417–420.
- Gadsden J, Latmore M, Levine DM, Robinson A: Ein hoher Öffnungsinjektionsdruck ist mit Nadel-Nerv- und Nadel-Faszien-Kontakt während einer Femoralnervenblockade verbunden. Reg Anesth Pain Med 2016;41(1):50–55.
- Hogan QH: Pathophysiologie der peripheren Nervenverletzung während der Regionalanästhesie. Reg Anesth Pain Med 2008;33:435–441.
- Whitlock EL, Brenner MJ, Fox IK, Moradzadeh A, Hunter DA, Mackinnon SE: Ropivacain-induzierte periphere Nerveninjektionsverletzung im Nagetiermodell. Anesth Analg 2010;111(1):214–220.
- Sala-Blanch X, Ribalta T, Rivas E, et al: Strukturelle Verletzung des menschlichen Ischiasnervs nach intraneuraler Nadeleinführung. Reg Anesth Pain Med 2009;34:201–205.
- Hadzic A, Dilberovic F, Shah S, et al: Die Kombination aus intraneuraler Injektion und hohem Injektionsdruck führt zu faszikulären Verletzungen und neurologischen Defiziten bei Hunden. Reg Anesth Pain Med 2004;29:417–423.
- Gauss A, Tugtekin I, Georgieff M, Dinse-Lambracht A, Keipke D, Gorsewski G: Inzidenz eines klinisch symptomatischen Pneumothorax bei ultraschallgeführter infraklavikulärer und supraklavikulärer Plexus brachialis-Blockade. Anästhesie 2014;69:327–336.
- Russon K, Blanco R: Versehentliche intraneurale Injektion in den muskulokutanen Nerv, sichtbar gemacht mit Ultraschall. Anesth Analg 2007;105:1504–1505, Inhaltsverzeichnis.
- Schafhalter-Zoppoth I, Zeitz ID, Grey AT: Unbeabsichtigte Femoralis-Pfählung und intraneurale Injektion, sichtbar gemacht durch Ultraschall. Anesth Analg 2004;99:627–628.
- Loubert C, Williams SR, Hélie F, Arcand G: Komplikation während der ultraschallgeführten regionalen Blockade: versehentliche intravaskuläre Injektion eines Lokalanästhetikums. Anesthesiology 2008;108:759–760.
- Vadeboncouer T, Weinberg G, Oswald S, Angelov F: Früherkennung einer intravaskulären Injektion während einer ultraschallgeführten supraklavikulären Plexus-Brachialis-Blockade. Reg Anesth Pain Med 2008;33:278–279.
- Martínez Navas A, DE LA Tabla González RO: Die ultraschallgeführte Technik ermöglichte die frühzeitige Erkennung einer intravaskulären Injektion während einer infraklavikulären Plexus-brachialis-Blockade. Acta Anaesthesiol Scand 2009;53:968–970.
- Barrington MJ, Kluger R: Die Ultraschallführung reduziert das Risiko einer systemischen Toxizität von Lokalanästhetika nach einer peripheren Nervenblockade. Reg Anesth Pain Med 2013;38:289–297.
- Orebaugh SL, Kentor ML, Williams BA: Unerwünschte Ergebnisse im Zusammenhang mit Nervenstimulator-geführten und Ultraschall-geführten peripheren Nervenblockaden durch beaufsichtigte Auszubildende: Aktualisierung einer Single-Site-Datenbank. Reg Anesth Pain Med 2012;37:577–582.
- Casati A, Baciarello M, Di Cianni S, et al: Auswirkungen der Ultraschallführung auf das minimale effektive Anästhetikumvolumen, das erforderlich ist, um den N. femoralis zu blockieren. Br. J. Anaesth 2007;98:823–827.
- Sandhu NS, Bahniwal CS, Capan LM: Durchführbarkeit einer infraklavikulären Blockade mit reduziertem Lidocainvolumen unter sonographischer Führung. J Ultrasound Med 2006;25:51–56.
- Vandepitte C, Gautier P, Xu D, Salviz EA, Hadzic A: Effektives Volumen von Ropivacain 0.75 % durch einen Katheter, der für eine Interskalenus-Blockade des Plexus brachialis erforderlich ist. Anesthesiology 2013;118:863–867.
- Riazi S, Carmichael N, Awad I, Holtby RM, McCartney CJL: Wirkung des Volumens des Lokalanästhetikums (20 vs. 5 ml) auf die Wirksamkeit und die Auswirkungen auf die Atemwege einer ultraschallgeführten Interskalenus-Blockade des Plexus brachialis. Br. J. Anaesth 2008;101:549–556.
- B. O'Donnell, J. Riordan, I. Ahmad, G. Iohom: Kurzberichte: Eine klinische Bewertung der Blockierungseigenschaften unter Verwendung von 2 ml 2010%igem Lidocain bei einer ultraschallgeführten Blockade des axillären Plexus brachialis. Anesth Analg 111;808:810–XNUMX.
- Krediet AC, Moayeri N, Bleys RLAW, Groen GJ: Intraneural oder extraneural: Diagnostische Genauigkeit der Ultraschallbeurteilung zur Lokalisierung von Injektionen mit geringem Volumen. Reg Anesth Pain Med 2014;39:409–413.
- Liu SS, YaDeau JT, Shaw PM, Wilfred S, Shetty T, Gordon M: Inzidenz unbeabsichtigter intraneuraler Injektionen und postoperativer neurologischer Komplikationen bei ultraschallgeführten interskalenären und supraklavikulären Nervenblockaden. Anästhesie 2011;66:168–174.
- Hara K, Sakura S, Yokokawa N, Tadenuma S: Häufigkeit und Auswirkungen einer unbeabsichtigten intraneuralen Injektion während einer ultraschallgeführten subglutealen Ischiasnervenblockade. Reg Anesth Pain Med 2012;37:289–293.
- Bigeleisen PE: Eine Nervenpunktion und offensichtliche intraneurale Injektion während einer ultraschallgeführten Axillarblockade führt nicht immer zu einer neurologischen Verletzung. Anesthesiology 2006;105:779–783.
- Selander D, Dhunér KG, Lundborg G: Periphere Nervenverletzung durch Injektionsnadeln zur Regionalanästhesie. Eine experimentelle Studie über die akuten Auswirkungen von Nadelstichverletzungen. Acta Anaesthesiol Scand 1977;21:182–188.
- Orebaugh SL, Mukalel JJ, Krediet AC, et al: Brachialplexus-Wurzelinjektion in einem menschlichen Leichenmodell: Injektionsverteilung und Auswirkungen auf die Neuraxis. Reg Anesth Pain Med 2012;37:525–529.
- Krol A, Szarko M, Vala A, De Andres J: Drucküberwachung von intraneuralen und perineuralen Injektionen in die medianen, radialen und ulnaren Nerven: Lehren aus einer Leichenstudie. Anesth Pain Med 2015;5:e22723.
- Gadsden JC, Choi JJ, Lin E, Robinson A: Der Öffnungsinjektionsdruck erkennt konsistent den Nadel-Nerv-Kontakt während der ultraschallgeführten Interskalenus-Blockade des Plexus brachialis. Anesthesiology 2014;120: 1246–1253.
- Claudio R, Hadzic A, Shih H, et al: Injektionsdrücke von Anästhesisten während einer simulierten peripheren Nervenblockade. Reg Anesth Pain Med 2004;29:201–205.
- Theron PS, Mackay Z, Gonzalez JG, Donaldson N, Blanco R: Ein Tiermodell des „Spritzengefühls“ während einer peripheren Nervenblockade. Reg Anesth Pain Med 2009;34:330–332.
- Tsui BCH, Knezevich MP, Pillay JJ: Reduzierte Injektionsdrücke unter Verwendung einer Druckluftinjektionstechnik (CAIT): eine In-vitro-Studie. Reg Anesth Pain Med 2008;33:168–173.
- Patil J, Ankireddy H, Wilkes A, Williams D, Lim M: Ein improvisiertes Druckmessgerät für regionale Nervenblockaden/Anästhesie-Injektionen: eine erste Studie. J Clin Monit Comput 2015. doi:10.1007/s10877-015-9701-z.
- Gadsden JC, Lindenmuth DM, Hadzic A, Xu D, Somasundarum L, Flisinski KA: Lumbaler Plexusblock mit Hochdruckinjektion führt zu einer kontralateralen und epiduralen Ausbreitung. Anesthesiology 2008;109: 683–688.
- Gautier P, Vandepitte C, Schaub I, et al: Die Disposition des Radiokontrasts im interskalenären Raum bei gesunden Freiwilligen. Anesth Analg 2015;120:1138–1141.
- Gerancher JC, Grice SC, Dewan DM, Eisenach J: Eine Bewertung der Einverständniserklärung vor der Epiduralanalgesie für Wehen und Entbindung. Int J Obstet Anesth 2000;9:168–173.