Vivian HY IP und Ban CH Tsui
EINFÜHRUNG
Die Regionalanästhesie ist in vielen Praxen weltweit gang und gäbe, da sich immer mehr Vorteile für die Patienten ergeben, wie z. B. eine Verringerung von pulmonalen und thromboembolischen Komplikationen, eine Verringerung des Opioidverbrauchs sowie eine Verringerung von Schmerzen und Zeit bis zur Entlassung und eine bessere Lebensqualität in der unmittelbaren Umgebung postoperative Phase. Die zunehmende Popularität der Regionalanästhesie hat zu Fortschritten bei Techniken und Geräten geführt. Die Praxis hat sich von der Parästhesie zur Nervenlokalisierung zur elektrischen Nervenstimulation und derzeit zum Ultraschall entwickelt. Dieses Kapitel gibt einen Überblick über die Ausstattung der Praxis für periphere Nervenblockaden. Es beschreibt auch die Ausrüstung, die in verschiedenen Phasen des Regionalanästhesieverfahrens benötigt wird, um sicherzustellen, dass es auf effiziente und sichere Weise abläuft. Die Praxis der Regionalanästhesie umfasst Geräte, Protokolle und Fähigkeiten, die erforderlich sind, um sicherzustellen, dass die Blockade so reibungslos und sicher wie möglich abläuft – vor, während und nach der Blockade.
VORBEREITUNG UND EINRICHTUNG DES REGIONALEN Blocks
Bereich und Überwachung
Eine ruhige Umgebung mit allen notwendigen Geräten, um regionale Leistungen zu erbringen Anästhesie, zusammen mit Medikamenten und Wiederbelebungsgeräten in Reichweite, ist von größter Bedeutung. Ein idealer Ort ist ein Einleitungsraum, in dem der Patient überwacht, mit Medikamenten versorgt und die regionale Blockade durchgeführt werden kann, bevor er in den Operationssaal gebracht wird. Ein ausgewiesener Blockbereich kann verwendet werden, um eine geeignete, überwachte Eingriffsumgebung bereitzustellen und gleichzeitig die Effizienz des Operationssaals zu optimieren.
Bei der Durchführung der Blockade sollte ein in Regionalanästhesie ausgebildeter Assistent anwesend sein, der die Ausrüstung vorbereitet und handhabt und beim Injektat hilft. Der Assistent sollte auch in der Durchführung von Reanimationen geschult werden, falls dies erforderlich wird.
Unabhängig davon, wo die Blockade durchgeführt wird, ist es wichtig, dass alle Geräte, Medikamente und die Überwachung griffbereit sind. Der beste Weg, alle notwendigen Geräte und Medikamente zu sammeln, ist der Aufbau eines Aufbewahrungswagens (Abbildung 1), die gut gekennzeichnet sein sollten, damit die Lieferungen leicht identifizierbar sind.
NYSORA-Tipps
- Ein Gerätewagen sollte alle für die Regionalanästhesie notwendigen Medikamente, Nadeln und Katheter sowie Reanimationsmedikamente und -geräte enthalten.

ABBILDUNG 1. Geräte-Aufbewahrungswagen mit eindeutiger Kennzeichnung von Verbrauchsmaterialien und Medikamenten.
Allgemeine Ausrüstung des Blockbereichs
Häufig verwendete Artikel sollten im Aufbewahrungswagen gelagert und bei Bedarf nachgefüllt werden. Der Lagerwagen sollte Folgendes enthalten:
- Sterile Hautvorbereitungslösung, Schwämme/Gaze, Abdecktuch, Markierstift, Lineal zur Erkennung von Orientierungspunkten, Ultraschallgel, Injektionsnadeln zur Hautinfiltration und zum Aufziehen von 5 % Dextrose (5 % Dextrose in Wasser, D5W).
- Eine Auswahl an Beruhigungsmitteln, z. B. Midazolam (0.5–3 mg i.v.) und kurz wirkende Opioide wie Fentanyl (50–100 μg i.v.) und Propofol (20–100 mg i.v.) für unangenehmere und unangenehmere Nervenblockaden erfordern eine tiefere Sedierung (z. B. Knöchelblockade).
- Lokalanästhetika und normale Kochsalzlösung zur Arzneimittelverdünnung, falls erforderlich. Lokalanästhetika werden idealerweise in einem separaten Fach von intravenösen Arzneimitteln aufbewahrt, um Arzneimittelfehler zu vermeiden.
- Intravenöse Kanülen. Allen Patienten sollte im Falle einer Toxizität des Lokalanästhetikums eine intravenöse Kanüle eingeführt werden.
- Verbände für intravenöse Kanülen, durchsichtige Verbände zum Abdecken des Ultraschallwandlers, der bei Single-Shot-Nervenblockaden verwendet wird, Schallkopfabdeckung, Gel und Verbände zum Einführen von Nervenblockadekathetern.
Notfallmedikamente und Wiederbelebungsgeräte
Die Verwendung von Ultraschall ermöglicht die Visualisierung des Injektats und hat daher das Risiko einer schweren systemischen Toxizität des Lokalanästhetikums (LAST) erheblich reduziert, aber nicht beseitigt. Reanimationsgeräte und Medikamente sollten jedoch immer sofort im Blockbereich verfügbar sein.
Wiederbelebungsausrüstung
- Sauerstoffversorgung, nasale Atemwege und O2-Masken
- Orale Atemwege unterschiedlicher Größe, Larynxmasken und Endotrachealtuben
- Laryngoskope (Macintosh- und Miller-Spatel)
- Beutel-Masken-Beatmungsgerät
- Sog
- Auswahl an intravenösen Kanülen in verschiedenen Größen
- Defibrillator
Reanimationsmedikamente und empfohlene Dosen intravenös
- Atropin (300–600 μg).
- Epinephrin (10–100 μg).
- Suxamethonium (40–100 mg).
- Ephedrin (5–15 mg).
- Phenylephrin (100–200 μg).
- Glycopyrrolat (200–400 μg).
- Intralipid® 20 % (1.5 ml/kg über 1–2 Minuten als anfänglicher Bolus, der bei anhaltender Asystolie zwei- bis dreimal wiederholt werden kann. Nach dem Bolus kann eine Infusion mit 0.25 ml/kg/min für 30 bis 60 Minuten begonnen werden ; Erhöhung der Infusionsgeschwindigkeit bei refraktärer Hypotonie). Idealerweise sollte Intralipid in einem Behältnis mit einem Gebrauchsprotokoll und einer Ausrüstung zum Aufziehen des Medikaments aufbewahrt werden.
NYSORA-Tipps
- Während einer ultraschallgeführten peripheren Nervenblockade kann die Visualisierung der Injektatausbreitung das Risiko einer intravaskulären Injektion minimieren. Die gesamte Dosis des Lokalanästhetikums sollte niemals injiziert werden, ohne dass die Ausbreitung des Injektats im Ultraschall zu sehen ist, da dies auf eine intravenöse Injektion hindeutet
Dokumentation
Eine Pre-Block-Checkliste ist von größter Bedeutung, um eine korrekte Blockierung an der entsprechenden Stelle am Körper des Patienten sicherzustellen, und umfasst die Dokumentation präoperativer Zustände (z. B. relevante neurologische Defizite und Komorbiditäten) und die Erörterung von Risiken und Vorteilen sowie die Einholung einer ordnungsgemäßen Zustimmung. In den meisten Ländern wurden standardisierte medizinische Dokumentationsprotokolle für die Einleitung und Aufrechterhaltung einer Vollnarkose eingeführt. Diese Dokumentation enthält Informationen über den arteriellen Blutdruck, die Herzfrequenz, die Sauerstoffversorgung und Einzelheiten zu gängigen Verfahren wie der Aufrechterhaltung des Atemwegsstatus und der Bereitstellung einer endotrachealen Intubation. Ebenso gibt es ähnliche Standardrichtlinien für die Dokumentation der neuraxialen Anästhesie, einschließlich Informationen zur Blockebene; Sterilitätsbestimmungen; verwendete Ausrüstung und Technik; das Auftreten von Liquor, Blut oder Parästhesien; und Injektion von Lokalanästhetika. Für die Dokumentation peripherer Nervenblockaden existieren dagegen keine derartigen Richtlinien, obwohl sie in der klinischen Praxis routinemäßig eingesetzt werden und die gleichen medizinrechtlichen Implikationen wie Allgemein- und Neuroaxialanästhesie haben. Eine Einschränkung des Fehlens eines Dokumentationsprotokolls für periphere Nervenblockaden ist der relative Mangel an verfügbaren Informationen für diejenigen, die ein regionales Verfahren aus Qualitätssicherungs-, Forschungs- oder rechtlichen Gründen nachträglich überprüfen möchten. Ein Beispiel für eine Blockdokumentation ist in zu sehen Figure 2.
Weitere Informationen zur Überwachung und Dokumentation von PNBs finden Sie unter „Überwachung, Dokumentation und Zustimmung zu Regionalanästhesieverfahren".
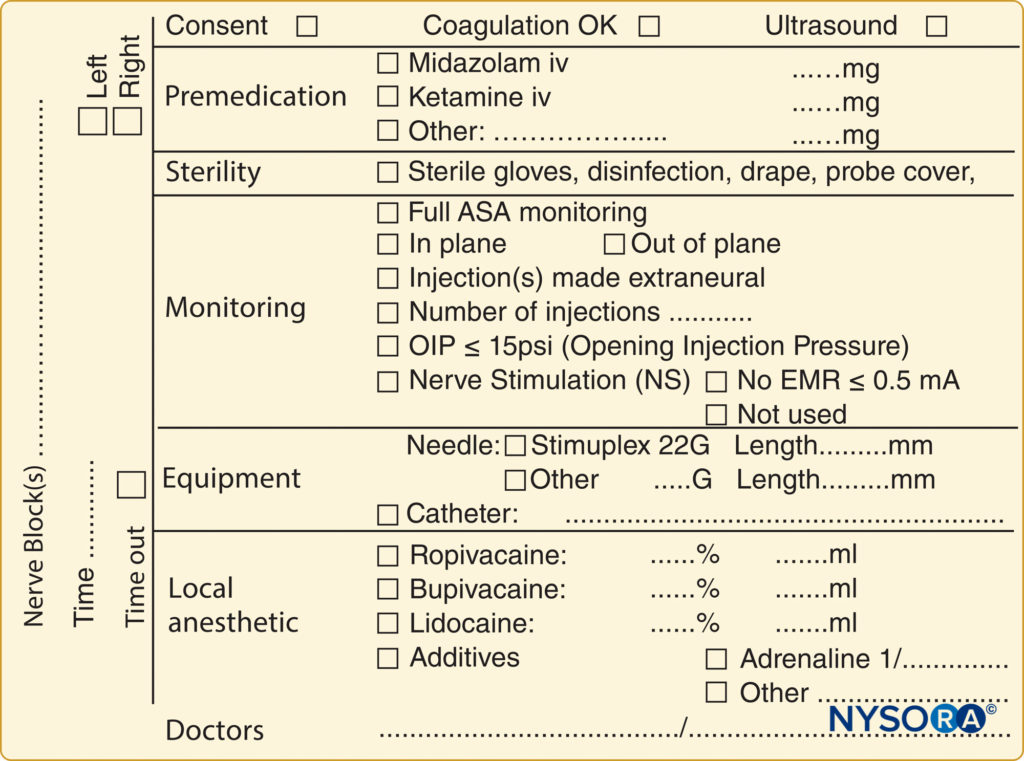
ABBILDUNG 2. Ein Beispiel für eine Blockdokumentation, wie sie bei NYSORA-Europe CREER (Center for Research, Education and Enhanced Recovery) bei ZOL (Ziekenhuis Oost-Limburg, Genk, Belgien) verwendet wird.
GERÄTE ZUR EINLEITUNG VON REGIONALANÄSTHESIEN
Nadeln für Single-Shot-Nervenblockaden
Derzeit gibt es auf dem Markt viele verschiedene Arten von Nadeln zur Blockierung peripherer Nerven. Isolierte Nadeln werden üblicherweise bei der Nervenstimulation verwendet. Mit der Einführung des Ultraschalls wurden echogene Nadeln zur besseren Visualisierung weit verbreitet verwendet. Kommerziell erhältliche Nadeln für Single-Shot-Nervenblockaden werden normalerweise mit einem vormontierten Verlängerungsschlauch geliefert, um die Aspiration und Injektion von D5W oder Lokalanästhetika zu erleichtern, und verfügen über einen weiblichen Aufsatz für den Anschluss an einen Nervenstimulator. Es ist zu beachten, dass sich der Luer-Lock des angeschlossenen Schlauchs gelegentlich lockern kann, was zum Austreten von injiziertem Lokalanästhetikum sowie Luft beim Ansaugen führen kann.
Nadelspitzen-Design
Eine Nervenverletzung kann durch direktes Eindringen in den Nerv oder durch gewaltsamen Nadel-Nerv-Kontakt verursacht werden. Die Abschrägung der Nadel kann das Ausmaß der Schädigung beim Nadeleinstich in der Nähe eines Nervs beeinflussen. Kurz abgeschrägte Nadeln (Figure 3) kann den Vorteil haben, dass Nervenschäden durch Schneiden oder Durchdringen des Nervs reduziert werden, während Nadeln mit langem Anschliff (14°) nachweislich eher Perineurium durchdringen und faszikuläre Verletzungen verursachen als Nadeln mit kurzem Anschliff (45°). Nadel, insbesondere wenn sie quer zu den Nervenfasern ausgerichtet ist. Andererseits können kurz abgeschrägte Nadeln bei Nerven- oder Faszikelpenetration größere Verletzungen verursachen. Stumpfe, nicht schneidende Nadeln und Tuohy-Nadeln bieten ein besseres Feedback und ein verbessertes Gefühl für den „Pop“, der auftritt, wenn durch die Faszie punktiert wird. Eine zu stumpfe Nadel kann jedoch die Faszienpunktion behindern, was zu einem höheren ausgeübten Druck und möglicherweise zu einem „Überschwingen“ nach der Punktion der Faszie führt. Pencil-Point- und Tuohy-Nadeln können auch stärkere posttraumatische Entzündungen, Myelinschäden und intraneurale Hämatome verursachen.
Neuraxiale Blockaden können mit Nadeln unterschiedlicher Spitzenformen durchgeführt werden. Trotz ihrer Beschreibung als atraumatisch, Whitacre- oder Sprotte-Nadeln (Figure 4) kann beim Eintritt traumatisch für das Gewebe sein, mit Reißen und schwerer Zerstörung von Kollagenfasern (siehe „Ultrastrukturelle Anatomie der Wirbelsäulenhäute und verwandter Strukturen“). Im Gegensatz dazu steht die Quincke-Nadel, eine sogenannte Schneidenadel (Figure 4), auch für neuraxiale Blockaden verwendet. Dennoch besteht allgemeiner Konsens darüber, dass neuraxiale Blockaden, die mit einer atraumatischen Nadel durchgeführt werden, mit einem geringeren Risiko für postpunktionelle Kopfschmerzen verbunden sind.

ABBILDUNG 4. Verschiedene Nadeln für die Spinalanästhesie: Whitacre (oben), Sprotte (Mitte) und Quincke (unten).
Nadellänge
Die Wahl der Nadellänge hängt vom jeweiligen Block ab. Zum Beispiel erfordern tiefere Blockaden, wie die Blockade des Ischiasnervs, längere Nadeln (z. B. 100–120 mm). Die Verwendung von Ultraschall kann helfen, die Entfernung der Trajektorie zum Zielnerv zu bestimmen. Eine zu kurze Nadel erreicht die Zielstelle nicht, während eine lange Nadel möglicherweise schwer zu manövrieren ist und zu tief vorgeschoben werden kann. Nadeln sollten Tiefenmarkierungen haben (Figure 5) zur Überwachung der Eindringtiefe in das Gewebe. Die richtige Nadellänge (so kurz wie möglich) ermöglicht eine bessere Handhabung und Manipulation.

ABBILDUNG 5. Nervenblockiernadel mit Zentimetermarkierungen, die als Beispiel zur Überwachung der Penetrationstiefe verwendet werden kann. Am distalen Ende sind auch Cornerstone-Reflektoren zu sehen, die die Visualisierung unter Ultraschall unterstützen.
Nadelstärke
Im Allgemeinen werden isolierte 22-Gauge-Nadeln wahrscheinlich am häufigsten für periphere Einzelschuss-Nervenblockaden verwendet. Bei der Nadelgröße muss ein Gleichgewicht zwischen dem Komfort des Patienten und dem Biegen der Nadel beim Durchstechen der Haut gesucht werden. Da längere Nadeln dazu neigen, sich während des Vorrückens leichter zu verbiegen und bei tiefen Blöcken schwieriger zu steuern sind, kann eine Nadel mit größerer Stärke erforderlich sein, da Nadeln mit kleinerer Stärke die Steifigkeit fehlen und sich leichter verbiegen. Nadeln mit größerer Stärke sollten mit Vorsicht verwendet werden, da sie mit einer erhöhten Schwere von Gewebeverletzungen und Hämatomen verbunden sind, während Nadeln mit kleinerer Stärke das größere Risiko bergen, dass die Spitze intrafaszikulär eingeführt wird. Auch neigt der Widerstand bei der Injektion mit Nadeln mit kleinerer Stärke dazu, erhöht zu werden, und es dauert auch länger, bis das Blut zurückgesaugt wird, wenn die Spitze intravaskulär ist.
Echogene Nadeln
Seit der Einführung ultraschallgeführter peripherer Nervenblockaden hat man sich bemüht, Nadeln mit verbesserter Sichtbarkeit im Ultraschall herzustellen. Echogene Nadeln reflektieren Ultraschallstrahlen durch eine Vielzahl von Mechanismen, einschließlich einer speziellen Beschichtung, die Mikroluftblasen einfängt, Rillen in der Nähe der Nadelspitze oder echogene „Punkte“, die durch „Eckstein“-Reflektoren erzeugt werden (siehe das distale Ende der Nadel in Figure 5). Nadeln mit verbesserter Echogenität können die Visualisierungszeit während ultraschallgeführter Verfahren verkürzen. Eine echogene Nadel, mit oder ohne Ultraschallstrahlsteuerung, wird im Vergleich zu einer nicht echogenen Nadel bei einem Einstichwinkel von 60°–70° besser sichtbar gemacht. Im Gegensatz dazu war die nicht echogene Nadel mit Beam Steering bei einem Einstichwinkel von 40° besser sichtbar als die echogene Nadel.
Kontinuierliche Katheteranordnungen
Die kontinuierliche Infusion eines Lokalanästhetikums hat sich bei der Bereitstellung einer langfristigen postoperativen Analgesie in einer Vielzahl von Situationen als wirksam erwiesen. Periphere Nervenblockadekatheter ermöglichen auch die Titration von Medikamenten in kleinen Aliquots. Ausrüstung für kontinuierliche periphere Nervenblockaden wird ausführlich in „Ausrüstung für kontinuierliche periphere Nervenblockaden“. Katheter-über-Nadel-Einheiten erfreuen sich zunehmender Beliebtheit für die Verabreichung kontinuierlicher Regionalanästhesie und Analgesie und werden in diesem Kapitel kurz besprochen.
Historisch gesehen ist allgemein bekannt, dass Perineuralkatheter mit Leckage und Migration verbunden sind. Das Design des Katheter-über-Nadel-Systems kann diese Hindernisse jedoch reduzieren und hat das Interesse an kontinuierlichen regionalen Techniken neu geweckt. Der Unterschied zwischen dieser Anordnung und herkömmlichen Katheter-durch-Nadel-Anordnungen besteht auch in der Position der Nadel in Bezug auf den Katheter, entweder innerhalb oder um den Katheter herum (Figure 6). Bei Katheter-durch-Nadel-Anordnungen verbleibt beim Entfernen der Nadel eine Lücke zwischen der Haut und dem Katheter. Im Gegensatz dazu beeinträchtigt das Zurückziehen der Nadel in der Katheter-über-Nadel-Anordnung nicht den festen Sitz des Katheters in der Haut, da die Nadel innerhalb des Katheters untergebracht ist.
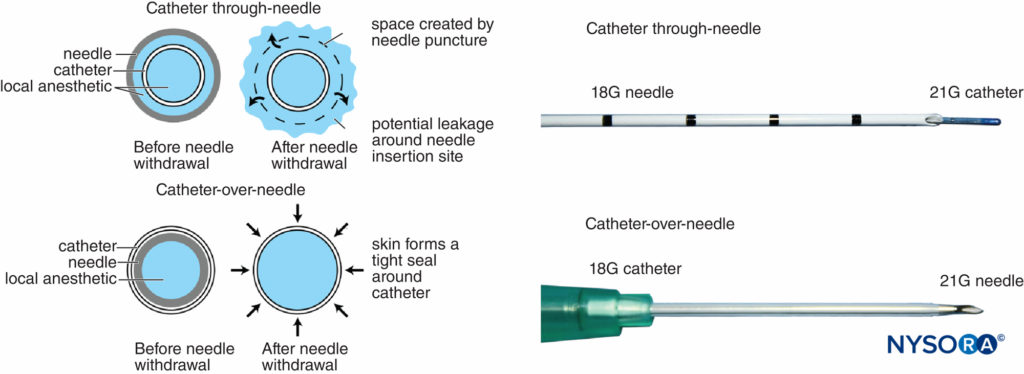
ABBILDUNG 6. Links, schematische Darstellung des Unterschieds zwischen herkömmlichen Katheter-durch-Nadel- (oben) und Katheter-über-Nadel-Designs (unten) in Bezug auf das Risiko einer Leckage aus der Hautpunktionsstelle. Bei ersterem ist der Durchmesser des Nadellochs größer als der Durchmesser des Katheters, wodurch Platz bleibt, damit das Lokalanästhetikum bei der Injektion austreten kann. Bei letzterem ist das Punktionsloch kleiner als der Katheterdurchmesser, wodurch der Katheter eng an der umgebenden Haut gehalten werden kann. Rechts, unterschiedliche distale Enden von Katheter-durch-Nadel- (oben) und Katheter-über-Nadel- (unten) Anordnungen.
Es gibt einige Variationen dieses Designs, die von verschiedenen Marken vertrieben werden. Zum Beispiel weist das Design von Contiplex (B-Braun Medical, Melsungen, Deutschland) den Katheter über der Nadel als eine einzelne Einheit auf (Figure 7).

ABBILDUNG 7. A: Die Contiplex (B-Braun Medical, Melsungen, Deutschland) Katheter-über-Nadel-Einheit, die eine lange Nadel aufweist, die vom Katheter bedeckt ist, und einen Clip, der zur einfachen Handhabung der Einheit entlang der Nadellänge bewegt werden kann. B: B. Braun Katheter-über-Nadel-Komponenten: Nadel mit Verlängerungen zur Nervenstimulation und Injektion (oben) und Katheter mit Zentimetermarkierungen (unten).
Eine weitere Variante ist der kürzlich eingeführte E-Cath (Pajunk MEDIZINTECHNOLOGIE GmbH, Geisingen, Deutschland) Kit mit einem „Katheter-in-Katheter“-Design, das aus zwei Komponenten besteht, der äußeren Katheterhülle und dem flexiblen inneren Katheter, die eine nicht knickbare Einheit bilden (Figure 8). Das anfängliche Gerät ähnelt einer intravenösen Kanüle mit einer Nadel im Außenkatheter, die unter Ultraschallkontrolle proximal zum Zielnerv eingeführt wird. Das distale Ende der Nadel steht aufgrund seiner elektrisch leitenden Eigenschaft hervor. Sobald die Nadel an Ort und Stelle ist, wird sie aus der Einheit herausgezogen, wobei der Außenkatheter in situ verbleibt, und ein Innenkatheter wird in den Außenkatheter eingeführt, um die Nadel zu ersetzen, und zur Injektion mit Luer fixiert (Figure 8). Der Innenkatheter ersetzt buchstäblich die Nadel, und die Innenkatheterspitze befindet sich im Wesentlichen genau an der Stelle, an der sich die Nadelspitze vor dem Herausziehen der Nadel befand.
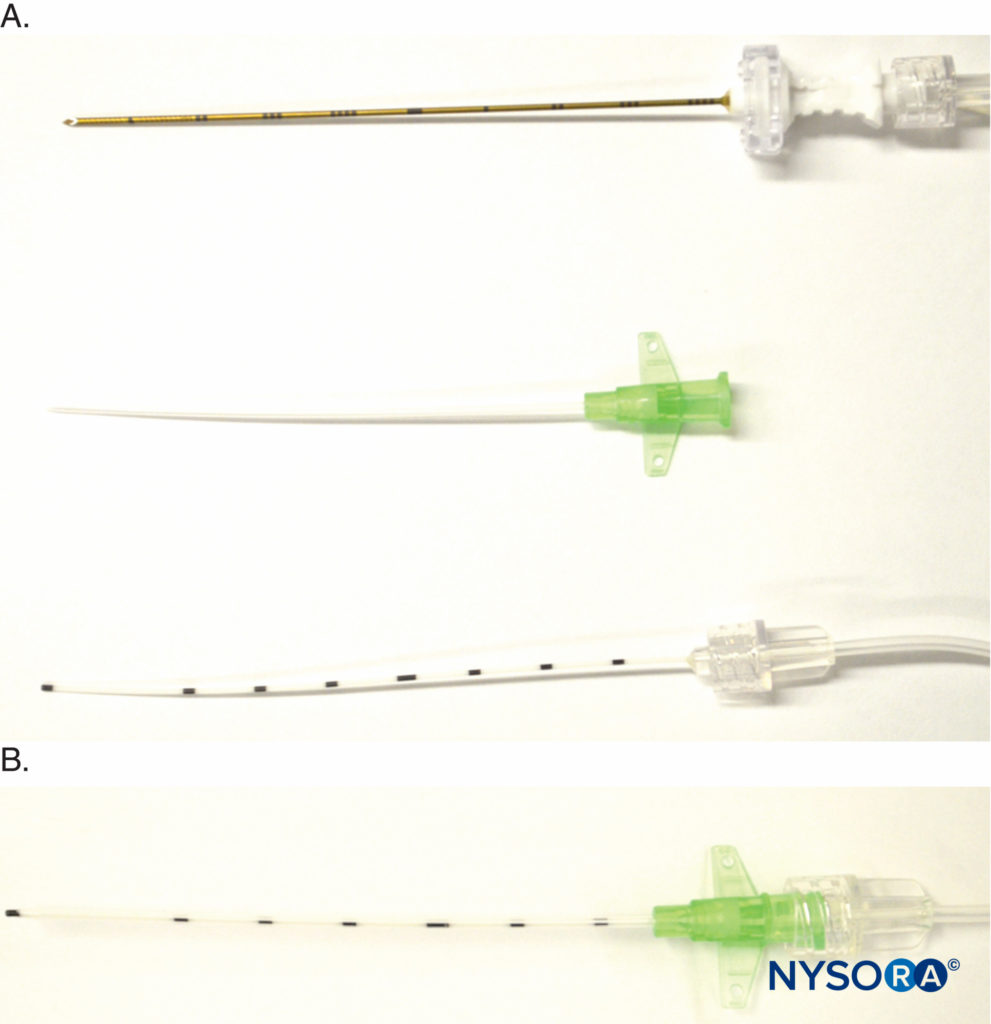
ABBILDUNG 8. Detail von E-Cath (Pajunk MEDIZINTECHNOLOGIE GmbH, Geisingen, Deutschland) Katheter-über-Nadel-Komponenten. A: Oben, Nadel mit Verlängerungsschlauch für einen Nervenstimulator und ein Flüssigkeitsgabeset; Mitte, der Katheter wird über der Nadel platziert, um eine einzelne zu bilden Einheit, die in der Nähe des Zielnervs eingeführt wird, unten wird der Innenkatheter nach Nadelrückzug in den Außenkatheter eingeführt, sobald sich die Katheter-über-Nadel-Einheit an der gewünschten Position befindet B: Luer-Lock, der Innen- und Außenkatheter zusammenhält.
Mehrere Vorteile des Katheter-über-Nadel-Designs beinhalten Potenzial:
- Einfache Anwendung mit einer Einführtechnik im Vergleich zu einer Single-Shot-Nervenblockade
- Weniger Leckagen an der Einführungsstelle des Katheters, z. B. bei Schulteroperationen, wenn sich der Patient in sitzender Position befindet, mit potenzieller Kontamination des Operationsfelds
- Geringeres Risiko einer Wundhaftung des Verbands
- Weniger Schritte und geringeres Risiko einer Verschiebung
- Einfache Visualisierung des Katheters, insbesondere der Katheterspitze
NervenortungsgerätePeriphere Nervenstimulatoren
Periphere Nervenstimulatoren waren in den Jahrzehnten vor der weitverbreiteten Verwendung der Ultraschallführung das primäre nervensuchende Gerät. Die kombinierte Verwendung von Ultraschall und Nervenstimulation schafft eine objektivere Methode, um genaue und sichere Blockaden zu erreichen, während gleichzeitig die Überwachung und Visualisierung der Blockadenadel und der Ziele in Echtzeit ermöglicht wird. Mit der Einführung des Ultraschalls hat sich die Rolle der Nervenstimulatoren von der Nervensuche zur Überwachung des Nadel-Nerv-Kontakts oder der Platzierung der intraneuralen Nadelspitze geändert. Darüber hinaus kann die Nervenstimulation als Bestätigungstechnik und Anleitung zur Platzierung von Epiduralkathetern mit dem Test der elektrischen Epiduralstimulation (Tsui) verwendet werden. Als nächstes werden die wichtigsten Eigenschaften von im Handel erhältlichen Nervenstimulatoren kurz hervorgehoben (Figure 9).
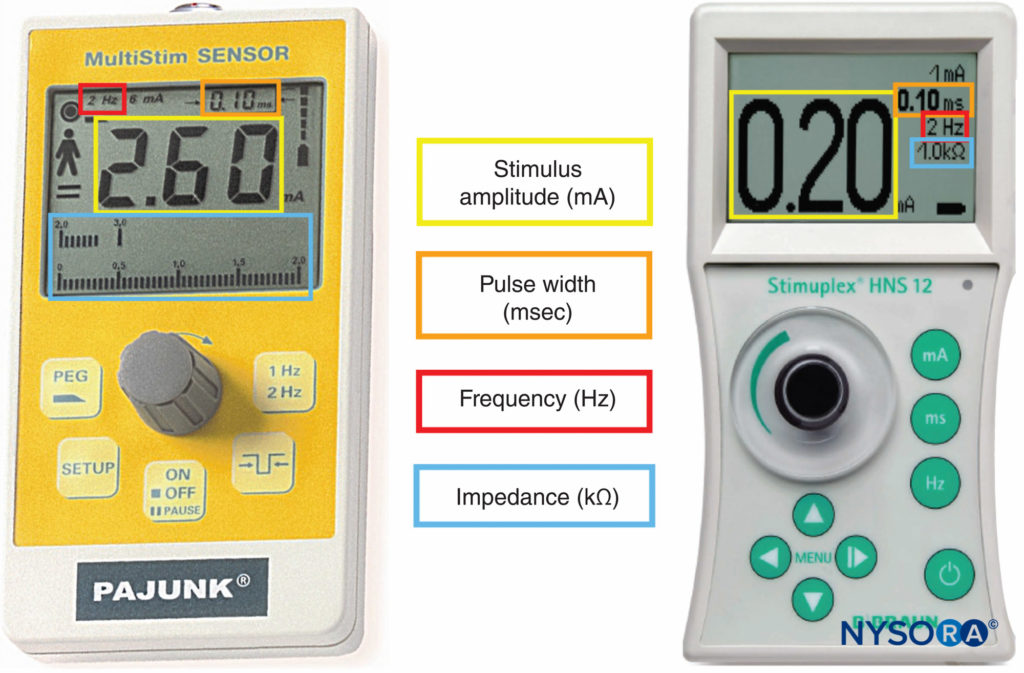
ABBILDUNG 9. Periphere Nervenstimulatoren, die die Messung von Stimulusamplitude, Impulsbreite, Frequenz und elektrischer Impedanz ermöglichen.
Konstantstromausgang und -anzeige
Die meisten modernen Modelle liefern jetzt Konstantstrom, und der Stromausgang kann in Frequenz, Impulsbreite und Strom in Milliampere (mA) eingestellt werden. Der Hauptvorteil eines Nervenstimulators mit konstanter Stromabgabe ist seine Fähigkeit, eine stabile Stromabgabe bei Vorhandensein unterschiedlicher Widerstände zu liefern.
Display
Eine klare Digitalanzeige mit einer Genauigkeit von zwei Dezimalstellen ist ein wichtiges Merkmal des elektrischen Nervenstimulators. Diese Anzeige muss den tatsächlich an den Patienten abgegebenen Strom und nicht nur die Sollstromeinstellung anzeigen. Einige Nervenstimulatoren sind mit einem niedrigen (bis zu 6 mA) und einem hohen Ausgangsbereich (bis zu 80 mA) ausgestattet. Der niedrigere Bereich wird hauptsächlich verwendet, um auf eine potenzielle intraneurale Nadelplatzierung hinzuweisen, während der höhere Bereich hauptsächlich für den epiduralen Stimulationstest (1–10 mA) verwendet wird.
Variable Impulsbreite
Kurze Impulsbreiten (dh 0.04 ms) sind ein besserer Indikator für den Abstand zwischen der Nadel und dem Nerv, basierend auf Stromänderungen. Im Gegensatz dazu gibt es bei langen Impulsbreiten (dh 1 ms) wenig Unterschied in dem Strom, der erforderlich ist, um den Nerv zu stimulieren, unabhängig davon, ob die stimulierende Nadel in direktem Kontakt mit dem Nerv oder 1 cm entfernt ist. Bei einer Impulsbreite von 0.04 ms gibt es einen großen Unterschied im erforderlichen Stimulationsstrom, wenn man den direkten Kontakt mit dem Nerv mit einem Abstand von 1 cm vergleicht.
Die Impulsbreite spielt auch eine Rolle bei der erfolgreichen Verwendung des elektrischen epiduralen Stimulationstests. Die richtige Impulsbreite muss für verschiedene Anwendungen des Tests verwendet werden, sei es eine periphere oder neuraxiale Blockade. Tabelle 1 fasst die geeignete Impulsbreite für verschiedene Anwendungen zusammen.
TABELLE 1. Impulsbreiten für verschiedene Anwendungen bei peripherer Nervenblockade und neuraxialer Blockade.
| Impulsbreite | Anwendung | Typischer Schwellenwertbereich |
|---|---|---|
| 0.1 ms | Motorischer peripherer Nerv | Vermeiden Sie < 0.3 mA |
| 0.2 ms | EpiduralraumIntrathekaler Raum | 1–15 mA < 1 mA |
| 1 ms | Epiduralraum | 6 mA |
Deutlich gekennzeichnete Polarität der Elektroden
Die Polarität der Nadel wirkt sich auf ihre Fähigkeit aus, den Nerv bei einem bestimmten Strom zu stimulieren, und sollte deutlich gekennzeichnet sein. Die Kathode (schwarz) wird als stimulierende Elektrode gewählt, da sie die Nervenmembran drei- bis viermal effektiver depolarisiert als die Anode.
Variable Impulsfrequenz
Die meisten neuen Stimulatoren haben eine Option zum Ändern der Frequenz, mit der der elektrische Impuls abgegeben wird. Obwohl einige im Handel erhältliche Stimulatoren für periphere Nerven eine Einstellung der Frequenz auf bis zu 5 Hz ermöglichen, liegt die optimale Frequenz des elektrischen Impulses zwischen 0.5 und 4 Hz. Die meisten Benutzer wählen eine Frequenz von 2 Hz. Bei Verwendung einer niedrigeren Frequenz, z. B. 1 Hz (ein Stimulus pro Sekunde), muss die Nadel langsam vorgeschoben werden, um zu vermeiden, dass der Nerv zwischen den Stimulationen verfehlt wird.
Trennungs- und Störungsanzeigen
Die Unterbrechung und Fehlfunktion von Nervenstimulatoren sollte leicht erkennbar sein, und eine Anzeige der Batterieleistung ist unerlässlich. Die meisten Nervenstimulatoren verwenden eine Ton- oder Lichtänderung, um zu warnen, wenn der Stromkreis nicht vollständig ist und der Impulsstrom nicht abgegeben werden kann. Der Wert der Ton/Licht-Änderung beim Trennen des Kreislaufs wurde kürzlich mit einer neuartigen Verwendung für einen peripheren Nervenstimulator demonstriert, bei dem eine isolierte Nadel mit einer nicht isolierten Spitze in das Tracheallumen zur Topisierung der Atemwege geführt wird. Die Änderung des Tons/Lichts zeigte an, ob die Spitze in Kontakt mit Gewebe war (geschlossener Kreislauf) oder in der luftgefüllten Luftröhre schwebte (offener Kreislauf) (Figure 10).
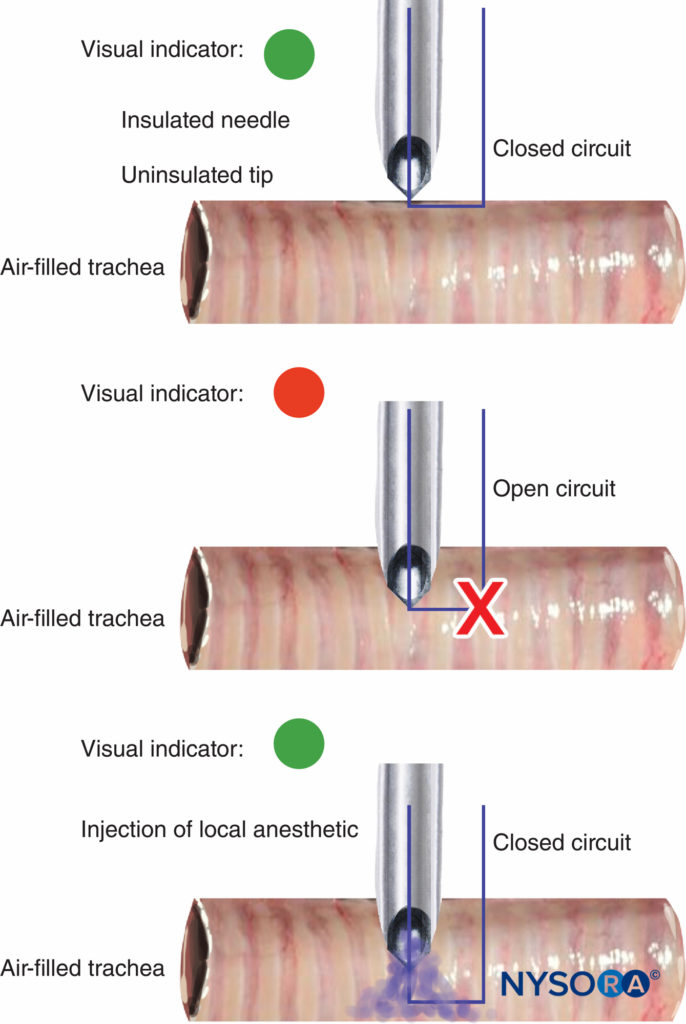
ABBILDUNG 10. Änderung des Licht- und Tonsignals des peripheren Nervenstimulators beim Eintritt der unisolierten Nadelspitze in das Tracheallumen während der Atemwegtopalisierung (oben und Mitte). Mit der Injektion des Lokalanästhetikums wird der elektrische Strom geschlossen, was zu einem weiteren Licht-/Tonsignalwechsel führt (unten).
Elektrische Impedanz
Einige moderne Nervenstimulatoren zeigen die Gesamtimpedanz zwischen Nadelspitze und Masseelektrode an. Die Bedeutung dieser Eigenschaft bei der Überwachung der intraneuralen Nadelspitzenplatzierung wird im Abschnitt über Überwachungsgeräte in diesem Kapitel erörtert.
Sonstiges Zubehör
Eine Sonde kann zur Durchführung einer perkutanen Elektrodenführung während der Oberflächennervenkartierung verwendet werden (Figure 11). Eine kleine Fernbedienung oder ein Fußpedal ermöglichen es einem einzelnen Bediener, die Stromabgabe eines Nervenstimulators ohne einen Assistenten einzustellen, obwohl dies selten klinisch verwendet wird (Figure 12).

ABBILDUNG 12. Ferngesteuerte handgesteuerte (links) und fußgesteuerte (rechts) Geräte zum Einstellen der Stromabgabe des Nervenstimulators.
Ultraschall
Die Einführung der Ultraschalltechnologie hat den Bereich der Regionalanästhesie revolutioniert und ermöglicht die Visualisierung von Nervenstrukturen, Nadeln und anderen subkutanen Objekten in Echtzeit. Ultraschall kann zweifellos die Sicherheit und Leichtigkeit der Durchführung von Nervenblockaden verbessern; dies ist jedoch weitgehend betreiberabhängig.
Es gibt eine Reihe von im Handel erhältlichen tragbaren Ultraschallgeräten, die für die Regionalanästhesie geeignet sind (Figure 13). Diese Geräte können leicht transportiert werden, und Bildqualität und Auflösung sind gleichwertig oder ähnlich denen stationärer Ultraschallgeräte. Der Schallkopf (oder die Sonde) ist das wichtigste Element des Ultraschallgeräts; Es sind Wandler mit verschiedenen Grundrissen und Strahlebenen erhältlich, die es dem Benutzer ermöglichen, die meisten Oberflächen von Personen mit unterschiedlichem Körperhabitus zu scannen. Die Qualität von Ultraschallgeräten wird ständig verbessert, mit besseren ergonomischen Optionen und Benutzerfreundlichkeit, einer höheren Auflösung mit verbesserten Schallköpfen, verbesserter Tragbarkeit und Kostensenkung.
Überwachungsgeräte Überwachung für den Patienten
Es ist wichtig, eine Routineüberwachung für Patienten anzuwenden, die sich einer Regionalanästhesie mit oder ohne Sedierung unterziehen. Toxizität durch Überdosierung von Lokalanästhetika und intravaskuläre Injektion und Übersedierung sind mögliche Komplikationen der Regionalanästhesie. Daher sollte man im Hinblick auf die Patientenüberwachung wachsam sein. Man sollte sich auch darüber im Klaren sein, dass Toxizität durch Lokalanästhetika innerhalb der ersten halben Stunde nach der Injektion des Medikaments aufgrund der Spitzenwerte der Plasmakonzentration (typischerweise 20–30 Minuten) auftreten kann. Die systemische Toxizität von Lokalanästhetika wird an anderer Stelle ausführlich diskutiert.
Die allgemeine Überwachung des Patienten umfasst die Untersuchung der folgenden Punkte:
- Elektrokardiogramm.
- Nichtinvasiver Blutdruck.
- Pulsoximetrie.
- Zur Beatmung: Die Angemessenheit der Beatmung bei Regionalanästhesie ohne Sedierung kann durch qualitatives klinisches Monitoring erfolgen. Bei Patienten, die eine Sedierung benötigen, sollte jedoch eine Kapnographie verwendet werden, es sei denn, der Patient, das Verfahren oder die Ausrüstung schließen dies aus.
Überwachung auf Parästhesie durch intraneurale Injektion
Vor der Einführung der Nervenstimulationstechnologie war die Parästhesie das einzige Mittel zur Nervenlokalisierung. Es gibt jedoch Hinweise darauf, dass schmerzhafte Parästhesien zu anhaltenden neurologischen Symptomen und Neuropathie führen können. Daher verzichten die meisten Kliniker nicht nur auf die Suche nach Parästhesien, sondern verwenden bei wachen oder leicht sedierten Patienten Parästhesien auch als Signal, um vor Nadel-Nerven-Nähe zu warnen.
Elektrische Nervenstimulation
Die Rolle des Nervenstimulators hat sich seit der Einführung des Ultraschalls verändert. In den meisten Fällen wird die Nervenstimulation nicht mehr als primäres Instrument zur Nervenlokalisierung verwendet, sondern wird stattdessen zur Überwachung verwendet, um die intraneurale Injektion zu minimieren. Nervenstimulatoren ermöglichen dem Benutzer, zwei elektrophysiologische Eigenschaften während einer Nervenblockade zu überwachen: die Nervenstimulationsschwelle und die elektrische Impedanz.
- Nervenreizschwelle: Eine Nervenstimulationsschwelle von weniger als 0.2 mA kann auf eine intraneurale Nadelspitzenposition oder einen Nadel-Nerv-Kontakt hindeuten. Bei alleiniger Anwendung ist die Nervenstimulation nicht empfindlich und sollte daher in Verbindung mit anderen Überwachungen, wie in diesem Abschnitt beschrieben, verwendet werden. Die Beobachtung einer motorischen Reaktion zeigt eine Nadel-Nerv-Nähe mit einem niedrigen Schwellenstrom an; Ein Mangel an motorischer Reaktion bei einer Schwelle von 0.2 mA oder weniger mit einer Impulsbreite von 0.1 ms schließt jedoch nicht immer eine intraneurale Nadelplatzierung aus.
- Elektrische Impedanz: Viele moderne Nervenstimulatoren sind in der Lage, die Impedanz zu messen. In einem elektrischen Stromkreis ist Gleichstrom (DC) der Fluss elektrischer Ladung in nur einer Richtung, während Wechselstrom (AC) den Fluss elektrischer Ladung beschreibt, der die Richtung periodisch umkehrt. Bei der Nervenstimulation wird pulsierender Gleichstrom verwendet. Da pulsierender Gleichstrom die Eigenschaften von Wechselstrom- und Gleichstromwellenformen gemeinsam hat, wird der elektrische Widerstand des Nervenstimulationsschaltkreises oft als Impedanz bezeichnet. Die Impedanz ist sehr empfindlich gegenüber der Gewebezusammensetzung und variiert in Abhängigkeit vom Wassergehalt des Gewebes. Da es Unterschiede im Wasser- und Lipidgehalt zwischen intraneuralen und extraneuralen Räumen gibt, wobei ersterer eine beträchtlich größere Menge an nichtleitendem Lipid und einen geringeren Wassergehalt aufweist, wurde ein signifikanter Unterschied in der intraneuralen und extraneuralen Impedanz gezeigt. Eine kürzlich durchgeführte Studie an erwachsenen Patienten zeigte auch, dass ein Anstieg der Impedanz von mehr als 4.3 % auf eine intraneurale Nadelplatzierung hindeuten kann. Darüber hinaus wurde die Unterscheidung zwischen Nervengewebe und anderen Gewebetypen verbessert, indem mehrere Impedanzvariablen bei mehreren Messfrequenzen kombiniert wurden, um die Genauigkeit zu erhöhen. Die elektrische Impedanz ändert sich auch bei intravaskulärer und perineuraler Injektion von D5W. Eine Änderung der Impedanz kann daher vor einer Injektion an einer Stelle warnen, die potenziell Nervenschäden oder andere Folgeerscheinungen verursachen könnte.
NYSORA-Tipps
- Eine plötzliche Änderung der Impedanz kann darauf hindeuten, dass die Nadel in verschiedene Gewebe eindringt.
Ultraschall-Bildgebung
Mit der zunehmenden Popularität der Ultraschallführung bei peripheren Nervenblockaden gab es ein weit verbreitetes Missverständnis, dass Ultraschall helfen kann, eine intraneurale Injektion zu vermeiden. Um den Sicherheitsspielraum zu verbessern, sollte die Nadelspitze während des Vorschiebens der Nadel während eines In-Plane-Ansatzes jederzeit sichtbar sein; Dies kann jedoch selbst in erfahrenen Händen eine Herausforderung darstellen. Darüber hinaus ist mit der Verwendung von Ultraschall in der Regionalanästhesie sowohl bei In-Plane- als auch bei Out-of-Plane-Ansätzen eine erhebliche Lernkurve verbunden. Wenn ein Ansatz außerhalb der Ebene verwendet wird, könnte der Nadelschaft mit der Spitze verwechselt werden, die sich weiter stromabwärts des Ultraschallstrahls befinden würde. Während der Injektion kann es auch schwierig sein, eine Nervenschwellung als Ergebnis einer intraneuralen Injektion in Echtzeit zu bemerken. Darüber hinaus kann es zu dem Zeitpunkt, zu dem eine Nervenschwellung bemerkt wird, zu spät sein, um eine Nervenverletzung zu verhindern, da nur eine winzige Menge Lokalanästhetikum benötigt wird, um das Perineurium zu durchbrechen, wenn die Nadel intrafaszikulär platziert wird. Schließlich ist die derzeitige Ultraschallauflösung nicht hoch genug, um eine intrafaszikuläre Injektion, das schwerwiegendste Ereignis in Bezug auf Nervenschäden, zu erkennen. Daher wird weiterhin über Nervenverletzungen mit peripheren Nervenblockaden trotz Verwendung von Ultraschall berichtet. Die Rate an verbleibenden Parästhesien oder Taubheitsgefühlen nach ultraschallgesteuerter peripherer Nervenblockade wird auf 0.18 % bis 16 % geschätzt. Daher sollte Ultraschall nicht als alleiniges Führungsinstrument verwendet werden, sondern in Verbindung mit anderen Überwachungsmodalitäten verwendet werden, um das Risiko einer intraneuralen Injektion zu minimieren.
Einspritzdrucküberwachung
Die Überwachung des Injektionsdrucks kann dabei helfen, die Position der Nadelspitze im perineuralen Gewebe von dem Nadel-Nerv-Kontakt oder der intrafaszikulären Nadelplatzierung (dh perineural vs. intraneural-intrafaszikulär) zu unterscheiden. Die Ergebnisse mehrerer Studien legen nahe, dass eine Hochdruckinjektion in den intraneuralen Raum selbst bei kleinen Volumina kann ein wesentlicher Beitrag zur mechanischen Verletzung von neurologischem Gewebe während peripherer Nervenblockaden geleistet werden. Die Begründung und Grundlage für Nervenschäden durch Hochdruckinjektion ist wahrscheinlich eine Kombination aus mechanischer Verletzung durch Verletzung des Perineuriums, die zu einer Störung der endoneuralen Mikrozirkulation führt, und chemischer Verletzung durch Neurotoxizität von Lokalanästhetika.
Unter Verwendung von Hundemodellen wurde gezeigt, dass ein hoher Injektionsdruck (>20 psi) zu anhaltenden neurologischen Schäden führen kann, die auf eine intrafaszikuläre Injektion hinweisen. Jedoch führt nicht jede intraneurale Injektion zu einem hohen Injektionsdruck und einem nachfolgenden neurologischen Defizit. Dies könnte darauf zurückzuführen sein, dass eine intraneurale extrafaszikuläre Injektion erfolgt ist oder dass sich die abgeschrägte Nadelspitze nicht vollständig im Nerv befindet. In diesen Fällen kann das Injektat den Nerv beiseite schieben, wodurch eine Hochdruckinjektion vermieden wird. Dennoch wird eine intraneurale Injektion im Allgemeinen nicht empfohlen. Es wurde auch gezeigt, dass ein kräftiger Nadel-Nerven-Kontakt und eine Verschiebung entzündliche Veränderungen an den Nerven verursachen. Da eine kürzlich durchgeführte Studie gezeigt hat, dass ein hoher Öffnungsinjektionsdruck (≥15 psi) – der Druck, der überwunden werden muss, bevor die Injektion beginnen kann – ein Hinweis auf eine intraneurale Nadelplatzierung sein kann, ist es wichtig, den Injektionsdruck während der Injektion des Lokalanästhetikums sorgfältig zu überwachen. Darüber hinaus kann ein hoher Injektionsdruck auch eine unerwünschte neuraxiale Ausbreitung während bestimmter regionaler Blockaden in der Nähe der Neuraxis verursachen, beispielsweise einer Blockade des Plexus lumbalis oder der Blockade des Plexus brachialis.
NYSORA-Tipps
- Es wurde vorgeschlagen, den Öffnungseinspritzdruck unter 15 psi zu halten, um die Sicherheit zu verbessern. Der Öffnungsdruck ist unabhängig von Nadelgröße, Nadeltyp, Injektionsgeschwindigkeit und Spritzengröße.
Zu den Methoden zur Überwachung des Injektionsdrucks gehören: Spritzengefühl, Inline-Druckmanometer und Druckluftinjektionstechnik (CAIT).
- Spritzengefühl. Traditionell wird in der klinischen Praxis eine subjektive „Spritzengefühl“-Technik verwendet, um den Widerstand gegen die Injektion eines Lokalanästhetikums zu beurteilen, und wird vom Anästhesisten oder Assistenten durchgeführt, während der Anästhesist die korrekte Nadelposition beibehält. Unnötig zu erwähnen, dass dieser subjektive Ansatz nicht zuverlässig und vom Bediener abhängig ist. Auch unterschiedliche Nadellängen, Durchmesser und Spritzentypen beeinflussen die Haptik.
- Inline-Druckmanometer. Im Handel erhältliche objektive Einweggeräte zur Messung des Injektionsdrucks, wie z. B. BSmart™ (B-Braun Medical, Melsungen, Deutschland) (Figure 14) zeigt kontinuierlich den Druck während der Injektion an, sodass Ärzte die Informationen zum Injektionsdruck quantifizieren und dokumentieren können. Das Manometer ist farbkodiert, sodass bei einem Druck von 20 psi oder mehr die Anzeige rot leuchtet, um den Bediener zu warnen. Der Inline-Druckmonitor wird proximal zur Nadel und in einer Linie mit dem nicht dehnbaren Schlauch platziert. Das andere Ende des Druckmonitors wird direkt an der Spritze befestigt. Das Prinzip ist das gleiche wie bei Inline-Drucksensoren in Geräten wie Spritzenpumpen zur kontinuierlichen Drucküberwachung. Das Hauptprinzip hinter der Verwendung eines Injektionsdruckwächters besteht darin, dass ein bestimmter Injektionsdruck (Öffnungsdruck) erreicht werden muss, bevor die Injektion (der Fluss des Anästhetikums) beginnen kann. Der kritische Öffnungsdruck, der erforderlich ist, um ein Lokalanästhetikum zu injizieren, wenn die Nadel in Kontakt mit dem Nerv oder intrafaszikulär ist, wurde in mehreren Studien auf mehr als 15 psi geschätzt. Wenn daher die Injektion angehalten wird, bevor der Öffnungsdruck erreicht ist, und der Anästhetikumfluss eingeleitet wird, kann eine Injektion in eine empfindliche Nadel-Nerv-Interaktion vermieden werden.
- Druckluftinjektionstechnik. Dies ist die klinische Anwendung des Gesetzes von Boyle (Druck × Volumen = Konstante). Bei konstanter Temperatur ändert sich ein eingestelltes Gasvolumen (Luft) umgekehrt zum Druck; Wenn beispielsweise das Volumen des Gases um 50 % reduziert wird, wird der Druck von 1 Atmosphäre auf 2 Atmosphären erhöht. Bei dieser von Tsui entwickelten Technik wird eine festgelegte Luftmenge über einem Injektatvolumen in einer Spritze angesaugt. Während der Injektion wird das Luftvolumen komprimiert und auf einem bestimmten Prozentsatz gehalten (Figure 15).
Bei 50 % Luftkompression betrug der Injektionsdruck 760 mm Hg oder weniger, weit unter dem Schwellenwert von weniger als 25 psi (1293 mm Hg). CAIT ist eine einfache und praktische Methode zur Standardisierung der Lokalanästhesie-Injektionsdrücke in Echtzeit, wodurch sichergestellt wird, dass der Injektionsdruck konstant unter dem Schwellenwert liegt und das Risiko einer klinisch signifikanten Nervenverletzung minimiert wird. Dieses Verfahren verringert auch unvermeidlich die Injektionsgeschwindigkeit, was wiederum das Risiko einer intrafaszikulären Injektion oder eines Absaugens des Lokalanästhetikums in unerwünschte Gewebeebenen verringert. Die von CAIT erzeugten Drücke bleiben auch während der gesamten Injektionsdauer konstant stabil, im Gegensatz zur Spritzenfühltechnik, die hohe Spitzendrücke erzeugt. Dies ist wahrscheinlich auf den „dämpfenden“ Effekt des Luftvolumens zurückzuführen, das den anfänglich hohen Druck dämpft.

ABBILDUNG 14. Kommerziell erhältliches Einweg-Inline-Drucküberwachungsgerät zur Überwachung des Injektionsdrucks während einer peripheren Nervenblockade (BSmart, BBraun Medical, Melsungen, GE).
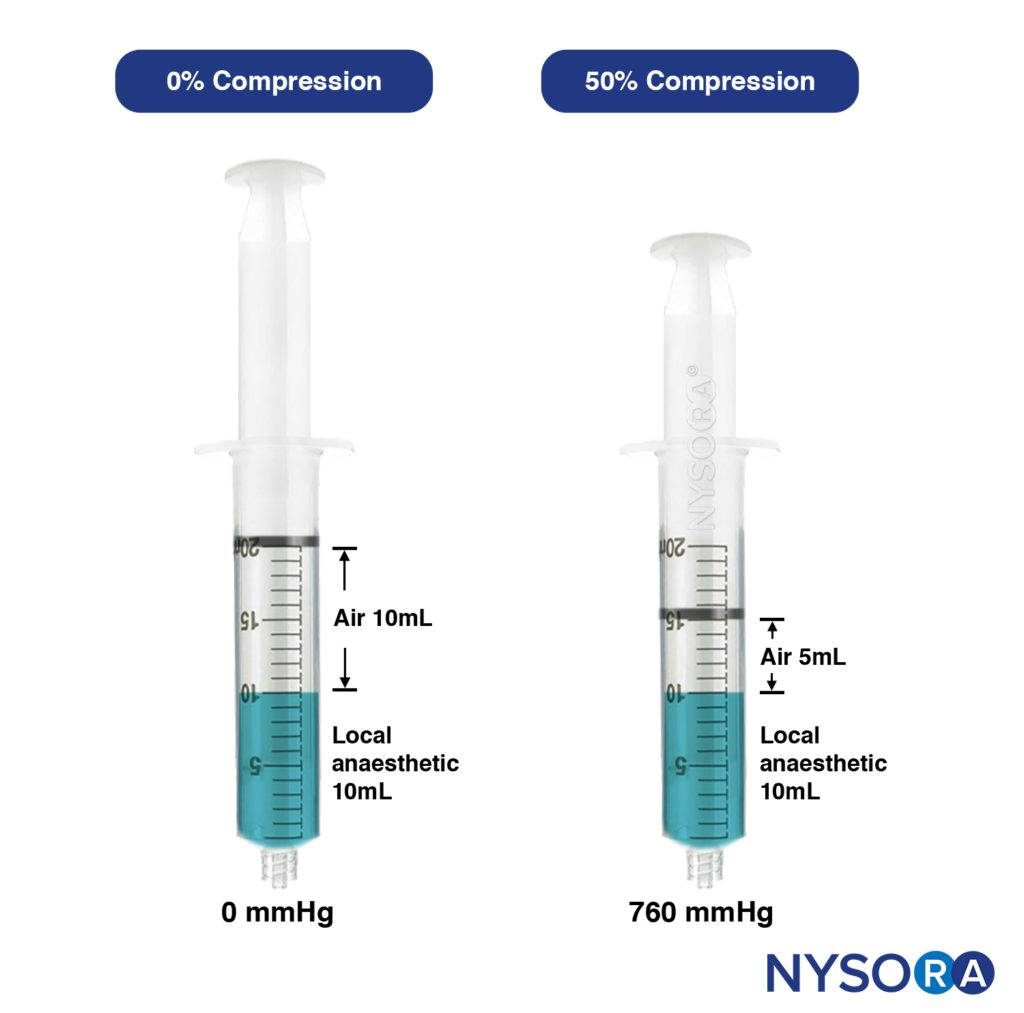
ABBILDUNG 15. Linke Spritze: Unkomprimiert, enthält 10 ml Luft und 10 ml Lokalanästhetikum. Rechte Spritze: Um 50 % komprimierte Luft ergibt einen ausgeübten Druck von 760 mmHg (ca. 15 psi).
NYSORA-Tipps
- Im Zeitalter ultraschallgesteuerter peripherer Nervenblockaden ist es wichtig, den Wert des Nervenstimulators und der Überwachung des Injektionsdrucks nicht zu vernachlässigen, um das Risiko einer Nervenverletzung zu minimieren.
- Es ist wichtig, eine Kombination von Monitoren zu verwenden, um das Risiko einer intraneuralen, intrafaszikulären Injektion und eines Nadel-Nerv-Traumas zu minimieren.
AUSRÜSTUNG ZUR POSTblock-VERWALTUNG
Bewertungstools blockieren
Es stehen verschiedene Tools und Techniken zur Verfügung, um den Fortschritt eines regionalen Blocks zu überwachen (Figure 16). Idealerweise sollte das Überwachungstool oder -gerät so objektiv wie möglich sein, aber aufgrund physiologischer Unterschiede zwischen Personen, die eine Blockade erhalten, ist dies selten der Fall. Bis heute gibt es keinen Konsens darüber, welches die effektivste Methode ist. Dennoch bieten die meisten Blocküberwachungsinstrumente im Allgemeinen eine akzeptable Interpretation dessen, wann eine chirurgische Anästhesie erreicht ist. In ähnlicher Weise sind die zur Beurteilung sensorischer und motorischer Blockaden verwendeten Instrumente und Skalen sehr unterschiedlich und bieten ein subjektives Feedback darüber, inwieweit eine Nervenblockade ihr gewünschtes Ziel erreicht. Üblicherweise werden Schmerzskalen oder -bewertungen verwendet, um das Wohlbefinden eines Patienten anzuzeigen; Wie bei Blocküberwachungsinstrumenten bieten diese Skalen und Bewertungen ein objektiveres und reproduzierbareres Mittel zur Beurteilung der Schmerzstärke.

ABBILDUNG 16. Auswahl an Geräten zur Überwachung von Nervenblockaden, darunter Geräte zur Messung der Stromwahrnehmungsschwelle (oben links), Monofilamente und Alkoholtupfer für die sensorische Wahrnehmung (unten links), Infrarot-Scanner (unten rechts) und Kraftaufnehmer mit drahtloser Datenerfassungsfunktion (oben Rechts).
Sensorische (Dermatom) Prüfung
Bewertungsinstrumente für regionale Blockaden basieren auf der Annahme, dass der Patient einen Stimulus auf dem blockierten Bereich nicht wahrnehmen kann. Diese Stimuli basieren normalerweise auf der Temperatur (Eis, Alkoholtupfer), aber ein abgestuftes Filament kann auch verwendet werden, um das nachlassende und wiederkehrende Hautgefühl zu messen. Im Fall von Rumpf-/neuraxialen Blockaden können diese Methoden dabei helfen, die Blockausbreitung zu bestimmen und zu verfolgen, indem beobachtet wird, welche Dermatome auf den Stimulus ansprechen.
Temperatur-/Infrarotaufzeichnung
Kürzlich wurde auch die Infrarot-Wärmebildgebung als Mittel zur Überwachung des Fortschreitens der Blockade getestet. Dieser Test basiert auf der Erkenntnis, dass die Hauttemperatur in den Fingern nach einer Plexus-brachialis-Blockade ansteigt. Die Studien zeigten, dass die Infrarot-Thermografie der Finger einen hohen positiven Vorhersagewert für den Blockerfolg nach einer Plexus-brachialis-Anästhesie hatte.
Aktuelle Wahrnehmungsschwelle
Die Stromwahrnehmungsschwelle (CPT) ist ein Mittel zum Anlegen von elektrischem Strom über eine perkutane Elektrode, die mit einem spezialisierten Stromgenerator (z. B. Neurometer) verbunden ist, um das sensorische Niveau zu testen. Dieses Verfahren wurde verwendet, um den Grad der Neuropathie bei Zuständen wie Diabetes mellitus zu quantifizieren. Kürzlich wurde die Reproduzierbarkeit dieses Verfahrens an Freiwilligen mit akzeptablen Ergebnissen unter Verwendung eines gewöhnlichen Stimulators für periphere Nerven getestet. In dieser Studie wurde ein peripherer Nervenstimulator (siehe vorherige Diskussion) verwendet, um einen elektrischen Stimulus auf den blockierten Bereich anzuwenden; Wenn der zum Auslösen einer sensorischen Reaktion erforderliche Strom im Laufe der Zeit größer war als der Ausgangsstrom (vor der Blockade oder nicht blockierte Region), war dies ein Indikator für das Fortschreiten der Blockade. Tatsächlich zeigte eine nachfolgende Studie, dass CPT ein objektives, zuverlässiges Instrument sein kann, um den Blockierungsbeginn in klinischen Szenarien zu überwachen.
Schmerzbeurteilung
Es gibt zahlreiche validierte Schmerzbewertungsskalen, wobei die beliebtesten Variationen auf der Skala von 0 bis 10 sind, wobei 0 „überhaupt keine Schmerzen“ und 10 „stärkste Schmerzen aller Zeiten“ bedeutet. Die numerische Bewertungsskala (NRS) und die visuelle Analogskala (VAS) sind zwei Beispiele dieser Art. Andere Schmerzbewertungsskalen, wie z. B. die Defense and Veterans Pain Rating Scale (DVPRS), enthalten Hinweise zur Auswirkung der Schmerzen auf das tägliche Leben, anhand derer die Schwere der Schmerzen genauer definiert werden kann. Der DVPRS enthält auch Gesichtskarikaturen, die verwendet werden können, um von Personen mit eingeschränkten Kommunikationsfähigkeiten Feedback zur Schmerzstärke zu erhalten. Bei älteren Patienten kann die Pain Assessment Checklist for Seniors With Limited Ability to Communicate (PACSLAC) verwendet werden, um Schmerzen bei Personen mit Demenz oder kognitiver Beeinträchtigung und Kommunikationsschwierigkeiten zu beurteilen. Für Kinder stehen verschiedene Schmerzskalen zur Verfügung, die für unterschiedliche Altersgruppen und Kommunikationsfähigkeiten eingesetzt werden können.
Bewertung der motorischen Blockade
Das gebräuchlichste motorische Bewertungsinstrument ist der Bromage-Score, eine 4-Punkte-Skala, die von 0 (vollständige Bewegung) bis 3 (vollständiger Block/keine Bewegung) reicht. Der ursprüngliche Bromage-Score wurde für Fälle von Blockaden der unteren Extremitäten verwendet, kann aber auch für die Beurteilung von Blockaden der oberen Extremitäten angepasst werden. Eine weitere objektivere Methode, mit der das Einsetzen und die Genesung einer Nervenblockade beurteilt werden kann, ist der Krafttest. Dies kann mit einem tragbaren Kraftaufnehmer erfolgen: Der Patient wird aufgefordert, mit der blockierten Extremität oder dem blockierten Körperteil Kraft auf den Aufnehmer auszuüben (z. B. Ellbogenstreckung zur Beurteilung der Funktion des N. radialis).
Einige moderne Kraftaufnehmer sind mit einem USB-Stick (Universal Serial Bus) ausgestattet, der zusammen mit einem tragbaren Computer die drahtlose Erfassung von Kraftdaten in Echtzeit ermöglicht (Figure 16).
Aufrechterhaltung der Regionalanästhesie
Die Praxis der Regionalanästhesie hat sich auf Infusionspumpen verlassen, um eine kontinuierliche Zufuhr von Lokalanästhetikum durch einen Perineuralkatheter bereitzustellen. Diese Methode bleibt die beliebteste Methode der kontinuierlichen Regionalanästhesie, aber neue Entwicklungen in Technologie und Praxis haben eine Flexibilität bei der postoperativen Analgesie ermöglicht. Herkömmliche Methoden für kontinuierliche Nervenblockaden werden ausführlicher in „Kontinuierliche periphere Nervenblockaden: Lokalanästhetische Lösungen und Infusionsstrategien" und "Ausrüstung für kontinuierliche periphere Nervenblockaden“; neue Entwicklungen werden hier kurz behandelt.
Intermittierender Bolus
Zusätzlich zum traditionellen kontinuierlichen Infusionsschema wird es immer beliebter, einen intermittierenden Bolus zur kontinuierlichen Behandlung peripherer Nervenblockaden zu verwenden. Mit ihrer Fähigkeit, Nervenstrukturen mit Präzision anzuvisieren, reduziert die Katheter-über-Nadel-Technologie (siehe vorherige Diskussion) das Risiko einer Kathetermigration oder -dislokation erheblich. Ein Vorteil von intermittierenden Boli besteht darin, dass auch das Risiko einer Toxizität des Lokalanästhetikums verringert wird, da eine konstante Abgabe des Lokalanästhetikums vermieden wird und die Gesamtdosis im Allgemeinen reduziert wird. Eine intermittierende Bolusgabe kann entweder patientengesteuert oder vorprogrammiert erfolgen.
NYSORA-Tipps
- Man sollte Pumpen in Betracht ziehen und auswählen, die sowohl die Abgabe von intermittierenden Boli als auch von Dauerinfusionen ermöglichen.
- Da Infusionspumpen vom Patienten gewartet und transportiert werden, wenn sie mobil sind, sollte die Pumpe tragbar und einfach zu verwenden sein.
Zukünftige Fortschritte
Kürzlich wurde die aufregende Aussicht beschrieben, die Infusion von Lokalanästhetika ferngesteuert zu steuern. In diesem System wurden die Pumpen so eingestellt, dass sie sich basierend auf den Antworten auf Fragen zu ihrer Schmerzkontrolle an die Bedürfnisse der Patienten anpassen, und falls die Einstellungen geändert werden mussten, konnten die Ärzte über einen sicheren Server aus der Ferne auf die Pumpeninformationen zugreifen, um dies zu vermeiden die Notwendigkeit, dass eine Krankenschwester oder ein Arzt physisch anwesend ist.
FAZIT
Mit Verbesserungen in Technologie und Ausrüstung hat sich die Regionalanästhesie von einer „Kunst“, die von wenigen praktiziert wird, zu einer „Wissenschaft“ entwickelt, die mit angemessener Ausbildung und Erfahrung von vielen praktiziert werden kann. Unabhängig davon, wer die Blockade durchführt oder wo sie durchgeführt wird, gibt es einige wichtige Richtlinien, die befolgt werden sollten, um eine sichere und effektive Regionalanästhesie zu gewährleisten. Es ist wichtig, dass es einen ausgewiesenen Bereich für die Durchführung von Nervenblockaden gibt und dass alle Medikamente und Geräte leicht verfügbar sind. Eine sorgfältige Dokumentation des Blockverfahrens sollte Standard jeder Institution sein. Eine angemessene Patientenüberwachung ist unerlässlich und sollte eine standardmäßige ASS-Überwachung sowie eine objektive Ultraschall-Nervenstimulator- und Injektionsdrucküberwachung umfassen, um eine Nervenverletzung zu verhindern. Die Verwendung der richtigen Ausrüstung, einschließlich geeigneter Nadellänge und -stärke, führt zu einer einfacheren und genaueren Nadelung. Wenn ein kontinuierlicher Block gewünscht wird, können neue Katheter-über-Nadel-Anordnungen dazu beitragen, die Probleme herkömmlicher Katheter-durch-Nadel-Designs zu mindern, und die jüngsten Entwicklungen bei langfristigen Lokalanästhesie-Verabreichungsmethoden, einschließlich intermittierender Bolus und Fernsteuerung, stellen wertvolle Optionen dar .
Zusammenfassend lässt sich sagen, dass die derzeitige Praxis der Regionalanästhesie von zahlreichen Instrumenten, Methoden und Überwachungsgeräten abhängt. Obwohl einige dieser Methoden und Instrumente einige Zeit in Anspruch nehmen, um eine angemessene Kompetenz zu erlangen, sind sie entscheidend, um sicherzustellen, dass der regionale Block in jeder Phase des Verfahrens auf die sicherste und effektivste Weise durchgeführt wird.
REFERENZEN
- van Lier F, van der Geest PJ, Hoeks SE, et al: Epidurale Analgesie ist mit verbesserten Gesundheitsergebnissen von chirurgischen Patienten mit chronisch obstruktiver Lungenerkrankung verbunden. Anesthesiology 2011;115:315–3121.
- Davies J, Fernando R: Wirkung von Ropivacain auf die Thrombozytenfunktion. Anästhesie 2001;56:709–710.
- Richman JM, Liu SS, Courpas G, et al.: Bietet eine kontinuierliche periphere Nervenblockade eine überlegene Schmerzkontrolle gegenüber Opioiden? Eine Metaanalyse. Anesth Analg 2006;102:248–257.
- Salviz EA, Xu D, Frulla A, et al: Kontinuierlicher interskalenöser Block bei Patienten mit ambulanter Operation zur Reparatur der Rotatorenmanschette: Eine prospektive randomisierte Studie. Anesth Analg 2013;117:1485–1492.
- Sites BD, Taenzer AH, Herrick MD, et al: Inzidenz von systemischer Toxizität von Lokalanästhetika und postoperativen neurologischen Symptomen im Zusammenhang mit 12,668 ultraschallgeführten Nervenblockaden: Eine Analyse aus einem prospektiven klinischen Register. Reg Anesth Pain Med 2012;37(5):478–482.
- Cave G, Harvey M: Intravenöse Lipidemulsion als Gegenmittel über die Toxizität von Lokalanästhetika hinaus: Eine systematische Überprüfung. Acad Emerg Med 2009;16:815–824.
- Weinberg G, Ripper R, Feinstein DL, Hoffman W: Lipidemulsionsinfusion rettet Hunde vor Bupivacain-induzierter Herztoxizität. Reg Anesth Pain Med 2003;28:198–202.
- Weinberg, G: Behandlungsschemata. 2015. http://www.lipidrescue.org/.
- Abbal B, Choquet O, Gourari A, et al: Erhöhte Sehschärfe mit echogenen Nadeln bei ultraschallgeführter axillärer Plexus brachialis-Blockade: Eine randomisierte, vergleichende, beobachterblinde Studie. Minerva Anestesiol 2015;81:369–378.
- Selander D, Dhuner KG, Lundborg G: Periphere Nervenverletzung durch Injektionsnadeln zur Regionalanästhesie. Eine experimentelle Studie über die akuten Auswirkungen von Nadelstichverletzungen. Acta Anaesthesiol Scand 1977;21:182–188.
- Selander D: Periphere Nervenverletzung durch Injektionsnadeln. Br. J. Anaesth 1993;71:323–325.
- Selander DE: Laborvortrag 2006. Regionalanästhesie: Aspekte, Gedanken und etwas ehrliche Ethik; über Nadelfasen und Nervenläsionen sowie Rückenschmerzen nach Spinalanästhesie. Reg Anesth Pain Med 2007;32:341–350.
- Mackinnon SE, Hudson AR, Llamas F, et al: Periphere Nervenverletzung durch Chymopapain-Injektion. J Neurosurg 1984;61:1–8.
- Steinfeldt T, Graf J, Schneider J, et al: Histologische Folgen des Nadel-Nerv-Kontakts nach Nervenstimulation in einem Schweinemodell. Anesthesiol Res Pract 2011;2011:591851.
- Steinfeldt T, Werner T, Nimphius W, et al: Histologische Analyse nach peripherer Nervenpunktion mit Bleistiftspitze oder Tuohy-Nadelspitze. Anesth Analg 2011;112:465–470.
- Reina MA, de Leon-Casasola OA, Lopez A, et al: Eine In-vitro-Studie von Duralläsionen, die durch 25-Gauge-Quincke- und Whitacre-Nadeln erzeugt wurden, bewertet durch Rasterelektronenmikroskopie. Reg Anesth Pain Med 2000;25:393–402.
- Castrillo A, Tabernero C, Garcia-Olmos LM, et al: Postduralpunktionskopfschmerz: Auswirkung des Nadeltyps, eine randomisierte Studie. Spine J 2015;15:1571–1576.
- Hammond ER, Wang Z, Bhulani N, et al: Nadeltyp und das Risiko von Kopfschmerzen nach Lumbalpunktion in der ambulanten neurologischen Klinik. J Neurol Sci 2011;306:24–28.
- Uppal V, Sondekoppam RV, Ganapathy S: Wirkung der Strahlsteuerung auf die Sichtbarkeit von echogenen und nicht echogenen Nadeln: Eine Laborstudie. Can J Anaesth 2014;61:909–915.
- Ip VH, Tsui BC: Die Katheter-über-Nadel-Anordnung erleichtert die Abgabe eines zweiten Lokalanästhetikum-Bolus zur Verlängerung der supraklavikulären Plexus-brachialis-Blockade ohne zeitaufwändige Katheterisierungsschritte: eine randomisierte kontrollierte Studie. Can J Anaesth 2013;60:692–699.
- Tsui BC, Tsui J: Weniger Leckage und Verlagerung mit einem Katheter-über-Nadel-Ansatz im Vergleich zu einem Katheter-durch-Nadel-Ansatz für die periphere Nervenblockade: Eine Ex-vivo-Studie. Can J Anaesth 2012;59:655–661.
- Ip VH, Rockley MC, Tsui BC: Die Katheter-über-Nadel-Anordnung bietet größere Stabilität und weniger Leckage im Vergleich zum traditionellen Gegenstück bei kontinuierlichen Interskalenus-Nervenblockaden: Eine randomisierte, patientenblinde Studie. Can J Anaesth 2013;60:1272–1273.
- Ip V, Bouliane M, Tsui B: Mögliche Kontamination der Operationsstelle durch Leckage eines interskalenären Katheters bei sitzendem Patienten: Ein Fallbericht. Can J Anaesth 2012;59:1125–1129.
- Tsui BC, Ip VH: Die Katheter-über-Nadel-Methode reduziert das Risiko einer perineuralen Katheterdislokation. Br. J. Anaesth 2014;112:759–760.
- Ip V, Tsui B. Die Sicherheit einer interskalenären Katheter-über-Nadel-Technik. Anästhesie 2013;68:774–775.
- Tsui BC, Gupta S, Finucane B: Bestätigung der Platzierung eines Epiduralkatheters durch Nervenstimulation. Can J Anaesth 1998;45:640–644.
- Green JS, Tsui BC: Verwendung eines Nervenstimulators zur Unterstützung der Krikothyroidmembranpunktion während einer schwierigen Atemwegstopalisierung. Can J Anaesth 2015;62:1126–1127.
- Becker DE, Reed KL: Grundlagen der Lokalanästhesie-Pharmakologie. Anesth Prog 2006;53:98–108.
- Bigeleisen PE, Moayeri N, Groen GJ: Extraneurale versus intraneurale Stimulationsschwellen während einer ultraschallgeführten supraklavikulären Blockade. Anesthesiology 2009;110:1235–1243.
- Robards C, Hadzic A, Somasundaram L, et al: Intraneurale Injektion mit Niedrigstrom-Stimulation während poplitealer Ischiasnervblockade. Anesth Analg 2009;109:673-677.
- Chan VW, Brull R, McCartney CJ, et al: Eine ultrasonographische und histologische Studie zur intraneuralen Injektion und elektrischen Stimulation bei Schweinen. Anesth Analg 2007;104:1281–1284, Tabellen.
- Byrne K, Tsui BC: Praktische Konzepte in der Nervenstimulation: Impedanz und andere neuere Fortschritte. Int Anesthesiol Clin 2011;49:81–90.
- Tsui BC, Pillay JJ, Chu KT, Dillane D: Elektrische Impedanz zur Unterscheidung der intraneuralen von der extraneuralen Nadelplatzierung in Schweinenerven während der direkten Exposition und Ultraschallführung. Anästhesiologie 2008;109:479–483.
- Bardou P, Merle JC, Woillard JB, et al: Elektrische Impedanz zur Erkennung versehentlicher Nervenpunktionen während ultraschallgeführter peripherer Nervenblockaden. Can J Anaesth 2013;60:253–258.
- Kalvoy H, Sauter AR: Nachweis der intraneuralen Nadelplatzierung mit Mehrfrequenz-Bioimpedanzüberwachung: eine neuartige Methode. J Clin Monit Comput 2106;30(2):185–192.
- Chin J, Tsui BC: Keine Änderung der Impedanz bei intravaskulärer Injektion von D5W. Can J Anaesth 2010;57:559–564.
- Cohen JM, Gray AT: Funktionelle Defizite nach intraneuraler Injektion während der interskalenären Blockade. Reg Anesth Pain Med 2010;35:397–399.
- Reiss W, Kurapati S, Shariat A, Hadzic A: Nervenverletzung, die eine ultraschall-/elektrostimulationsgeführte Blockade des supraklavikulären Plexus brachialis erschwert. Reg Anesth Pain Med 2010;35:400–401.
- Hara K, Sakura S, Yokokawa N, Tadenuma S: Häufigkeit und Auswirkungen einer unbeabsichtigten intraneuralen Injektion während einer ultraschallgeführten subglutealen Ischiasnervenblockade. Reg Anesth Pain Med 2012;37:289–293.
- Sites BD, Taenzer AH, Herrick MD, et al: Inzidenz von systemischer Toxizität von Lokalanästhetika und postoperativen neurologischen Symptomen im Zusammenhang mit 12,668 ultraschallgeführten Nervenblockaden: Eine Analyse aus einem prospektiven klinischen Register. Reg Anesth Pain Med 2012;37:478–482.
- Liu SS, YaDeau JT, Shaw PM, et al: Inzidenz unbeabsichtigter intraneuraler Injektionen und postoperativer neurologischer Komplikationen bei ultraschallgeführten interskalenären und supraklavikulären Nervenblockaden. Anästhesie 2011;66:168–174.
- Widmer B, Lustig S, Scholes CJ, et al: Inzidenz und Schweregrad von Komplikationen aufgrund von Femoralnervenblockaden bei Knieoperationen. Knie 2013;20:181–185.
- Bilbao Ares A, Sabate A, Porteiro L, et al: [Neurologische Komplikationen im Zusammenhang mit ultraschallgeführter interskalenöser und supraklavikulärer Blockade bei elektiven Eingriffen an Schulter und Arm. Prospektive Beobachtungsstudie in einem Universitätsklinikum. Rev. Esp Anestesiol Reanim 2013;60:384–391.
- Brull R, Hadzic A, Reina MA, Barrington MJ: Pathophysiologie und Ätiologie der Nervenverletzung nach peripherer Nervenblockade. Reg Anesth Pain Med 2015;40(5):479–490.
- Neal JM, Barrington MJ, Brull R, et al: Der zweite ASRA-Praxisratgeber zu neurologischen Komplikationen im Zusammenhang mit Regionalanästhesie und Schmerzmedizin: Zusammenfassung 2015. Reg Anesth Pain Med 2015;40(5):401–430.
- 46. Gadsden J, Latmore M, Levine DM, Robinson A: Ein hoher Öffnungsinjektionsdruck ist mit Nadel-Nerv- und Nadel-Faszien-Kontakt während einer Femoralnervenblockade verbunden. Reg Anesth Pain Med 2016;41(1):50–55.
- Gadsden JC, Choi JJ, Lin E, Robinson A: Der Öffnungsinjektionsdruck erkennt konsistent den Nadel-Nerv-Kontakt während der ultraschallgeführten interskalenären Plexus-Brachialis-Blockade. Anesthesiology 2014;120(5):1246–1253.
- Hadzic A, Dilberovic F, Shah S, et al: Die Kombination aus intraneuraler Injektion und hohem Injektionsdruck führt zu faszikulären Verletzungen und neurologischen Defiziten bei Hunden. Reg Anesth Pain Med 2004;29:417–423.
- Kapur E, Vuckovic I, Dilberovic F, et al: Neurologisches und histologisches Ergebnis nach intraneuraler Injektion von Lidocain in Ischiasnerven des Hundes. Acta Anaesthesiol Scand 2007;51:101–107.
- Gentili F, Hudson A, Kline DG, Hunter D: Periphere Nerveninjektionsverletzung: Eine experimentelle Studie. Neurochirurgie 1979;4:244–253.
- Gentili F, Hudson AR, Hunter D, Kline DG: Nerveninjektionsverletzung mit Lokalanästhetika: Eine licht- und elektronenmikroskopische, fluoreszenzmikroskopische und Meerrettichperoxidase-Studie. Neurochirurgie 1980;6:263–272.
- Myers RR, Kalichman MW, Reisner LS, Powell HC. Neurotoxizität von Lokalanästhetika: Veränderte perineurale Permeabilität, Ödeme und Nervenfaserverletzung. Anästhesiologie 1986;64:29–35.
- Selander D, Brattsand R, Lundborg G, et al: Lokalanästhetika: Bedeutung von Applikationsweise, Konzentration und Adrenalin für das Auftreten von Nervenläsionen. Eine experimentelle Studie zur axonalen Degeneration und Barriereschädigung nach intrafaszikulärer Injektion oder topischer Anwendung von Bupivacain (Marcain). Acta Anaesthesiol Scand 1979;23:127–136.
- Bigeleisen PE: Eine Nervenpunktion und offensichtliche intraneurale Injektion während einer ultraschallgeführten Axillarblockade führt nicht immer zu einer neurologischen Verletzung. Anesthesiology 2006;105:779–783.
- Steinfeldt T, Wiesmann T, Nimphius W, et al: Perineurales Hämatom kann zu Nervenentzündungen und Myelinschäden führen. Reg Anesth Pain Med 2014;39(6):513–519.
- Steinfeldt T, Poeschl S, Nimphius W, et al: Forcierter Nadelvorschub während des Nadel-Nerv-Kontakts in einem Schweinemodell: histologisches Ergebnis. Anesth Analg 2011;113(2):417–420.
- Gadsden JC, Lindenmuth DM, Hadzic A, et al: Lumbalplexus-Blockierung mit Hochdruckinjektion führt zu kontralateraler und epiduraler Ausbreitung. Anesthesiology 2008;109:683–688.
- Orebaugh SL, Mukalel JJ, Krediet AC, et al: Brachialplexus-Wurzelinjektion in einem menschlichen Leichenmodell: Injektionsverteilung und Auswirkungen auf die Neuraxis. Reg Anesth Pain Med 2012;37:525–529.
- Claudio R, Hadzic A, Shih H, et al: Injektionsdrücke von Anästhesisten während einer simulierten peripheren Nervenblockade. Reg Anesth Pain Med 2004;29(3):201–205.
- Theron PS1, Mackay Z, Gonzalez JG, Donaldson N, Blanco R. Ein Tiermodell des „Spritzengefühls“ während einer peripheren Nervenblockade. Reg Anesth Pain Med 2009;34(4):330–332.
- Tsui BC, Li LX, Pillay JJ: Druckluftinjektionstechnik zur Standardisierung von Blockinjektionsdrücken. Can J Anaesth 2006;53: 1098–1102.
- Asghar S, Bjerregaard LS, Lundstrom LH, et al: Distale Infrarot-Thermographie und Hauttemperatur nach ultraschallgeführter interskalenöser Plexus-Brachialis-Blockade: eine prospektive Beobachtungsstudie. Eur J Anaesthesiol 2014;31:626–634.
- Asghar S, Lundstrom LH, Bjerregaard LS, Lange KH: Ultraschallgeführter lateraler infraklavikulärer Block, bewertet durch Infrarotthermografie und distale Hauttemperatur. Acta Anaesthesiol Scand 2014;58:867–874.
- Masson EA, Veves A, Fernando D, Boulton AJ: Aktuelle Wahrnehmungsschwellen: Eine neue, schnelle und reproduzierbare Methode zur Beurteilung der peripheren Neuropathie bei Diabetes mellitus. Diabetologia 1989;32:724–728.
- Matsutomo R, Takebayashi K, Aso Y: Beurteilung der peripheren Neuropathie mittels Messung der aktuellen Wahrnehmungsschwelle mit dem Neurometer bei Patienten mit Typ-2-Diabetes mellitus. J Int Med Res 2005; 33:442–453.
- Nather A, Keng LW, Aziz Z, et al: Bewertung der sensorischen Neuropathie bei Patienten mit diabetischen Fußproblemen. Diabet Foot Ankle 2011;2:6367. doi:10.3402/dfa.v2i0.6367
- Tsui BC, Shakespeare TJ, Leung DH, et al: Reproduzierbarkeit der Stromwahrnehmungsschwelle mit dem Neurometer((R)) im Vergleich zum peripheren Nervenstimulator Stimpod NMS450 bei gesunden Freiwilligen: eine Beobachtungsstudie. Can J Anaesth 2013;60:753–760.
- Gaudreault F, Drolet P, Fallaha M, Varin F: Die Zuverlässigkeit der aktuellen Wahrnehmungsschwelle bei Freiwilligen und ihre Anwendbarkeit in einem klinischen Umfeld. Anesth Analg 2015;120:678–683.
- Huskisson EC: Visuelle Analogskalen. In Melczak R (Hrsg.): Schmerzmessung und -bewertung. Raven Press, 1983, S. 33–37.
- Buckenmaier CC III, Galloway KT, Polomano RC, et al: Vorläufige Validierung der Defense and Veterans Pain Rating Scale (DVPRS) in einer Militärpopulation. Pain Med 2013;14:110–123.
- Fuchs-Lacelle S, Hadjistavropoulos T: Entwicklung und vorläufige Validierung der Schmerzbewertungs-Checkliste für Senioren mit eingeschränkter Kommunikationsfähigkeit (PACSLAC). Pain Manager Nurs 2004;5:37–49.
- Bromage PR. Epidurale Analgesie. Saunders, 1978.
- Byeon GJ, Shin SW, Yoon JU, et al: Infusionsmethoden zur kontinuierlichen Interskalenus-Blockade des Plexus brachialis zur postoperativen Schmerzkontrolle nach arthroskopischer Reparatur der Rotatorenmanschette. Korean J Pain 2015;28:210–216.
- Patkar CS, Vora K, Patel H, et al: Ein Vergleich der kontinuierlichen Infusion und der intermittierenden Bolusverabreichung von 0.1 % Ropivacain mit 0.0002 % Fentanyl zur epiduralen Wehenanalgesie. J Anaesthesiol Clin Pharmacol 2015;31:234–238.
- Spencer AO, Tsui BC: Intermittierender Bolus über einen infraklavikulären Nervenkatheter unter Verwendung einer Katheter-über-Nadel-Technik bei einem pädiatrischen Patienten. Can J Anaesth 2014;61:684–685.
- Macaire P, Nadhari M, Greiss H, et al: Internet-Fernsteuerung der Pumpeneinstellungen für postoperative kontinuierliche periphere Nervenblockaden: Eine Machbarkeitsstudie an 59 Patienten. Ann Fr Anesth Reanim 2014;33:e1–e7.




