Manoj K. Karmakar, Roy A. Greengrass, Malikah Latmore und Matthew Levin
THORAKISCHER PARAVERTEBRALER BLOCK
Der thorakale paravertebrale Block (TPVB) ist die Technik der Injektion eines Lokalanästhetikums entlang des Brustwirbels in der Nähe der Stelle, an der die Spinalnerven aus dem Foramen intervertebrale austreten. Dies erzeugt eine einseitige, segmentale, somatische und sympathische Nervenblockade, die zur Anästhesie und zur Behandlung von akuten und chronischen Schmerzen einseitigen Ursprungs in der Brust und im Abdomen wirksam ist. Hugo Sellheim aus Leipzig (1871–1936) gilt als Pionier der TPVB im Jahr 1905. Kappis entwickelte 1919 die Technik der paravertebralen Injektion, die mit der heutigen vergleichbar ist.
Obwohl die paravertebrale Blockade (PVB) in den frühen 1900er Jahren ziemlich populär war, schien sie im späteren Teil des Jahrhunderts in Ungnade gefallen zu sein; der Grund dafür ist nicht bekannt. 1979 machten Eason und Wyatt die Technik erneut populär, nachdem sie die paravertebrale Katheterplatzierung beschrieben hatten. Unser Verständnis der Sicherheit und Wirksamkeit von TPVB hat sich in den letzten 25 Jahren erheblich verbessert, wobei das Interesse an dieser Technik wieder gestiegen ist. Derzeit wird es nicht nur zur Analgesie, sondern auch zur chirurgischen Anästhesie verwendet, und seine Anwendung wurde auf Kinder ausgedehnt. Einführung von Ultraschall zur Praxis der Regionalanästhesie führte zu erneuten Bemühungen, die Sicherheit und Konsistenz von PVBs zu erhöhen.
Anatomie
Der thorakale paravertebrale Raum (TPVS) ist ein keilförmiger Raum, der sich auf beiden Seiten der Wirbelsäule befindet (Figure 1). Die parietale Pleura bildet die anterolaterale Grenze. Die Basis bilden Wirbelkörper, Bandscheibe und das Foramen intervertebrale mit seinem Inhalt.
Der Querfortsatz und das Ligamentum costotransversum superior bilden die hintere Grenze. Zwischen der parietalen Pleura anterior und dem Ligamentum costotransverse superior liegt posterior eine fibroelastische Struktur, die endothorakale Faszie, die die tiefe Faszie des Thorax ist (Figuren 1 bis 3). Medial ist die endothorakale Faszie am Periost des Wirbelkörpers befestigt. Zwischen der parietalen Pleura und der endothorakalen Faszie liegt eine Schicht aus lockerem Areolarbindegewebe, die Fascia subserosa.
Daher gibt es im TPVS zwei potentielle Faszienkompartimente: das anteriore extrapleurale paravertebrale Kompartiment und das posteriore subendothorakale paravertebrale Kompartiment (vgl Figuren 1 und 2). Das TPVS enthält Fettgewebe, in dem der Interkostal-(Spinal-)Nerv, der dorsale Ast, die Interkostalgefäße und die Rami Communicantes und anterior die sympathische Kette liegen. Die Spinalnerven sind in kleine Bündel segmentiert und liegen frei im Fettgewebe des TPVS, was sie für in das TPVS injizierte Lokalanästhesielösungen zugänglich macht. Das TPVS kommuniziert medial mit dem Epiduralraum und lateral mit dem Interkostalraum.
Die TPVS auf beiden Seiten des Brustwirbels kommunizieren auch miteinander über den Epidural- und Prävertebralraum. Die kraniale Ausdehnung des TPVS ist schwierig zu definieren und kann erheblich variieren; es gibt jedoch eine direkte paravertebrale Ausbreitung des röntgendichten Kontrastmittels vom thorakalen zum zervikalen paravertebralen Raum, was auf eine anatomische Kontinuität hinweist. Das TPVS kommuniziert auch kaudal durch die medialen und lateralen Bogenbänder mit dem retroperitonealen Raum hinter der Fascia transversalis, wo sich die lumbalen Spinalnerven befinden.
Erfahren Sie mehr darüber Neuroaxiale Anatomie.
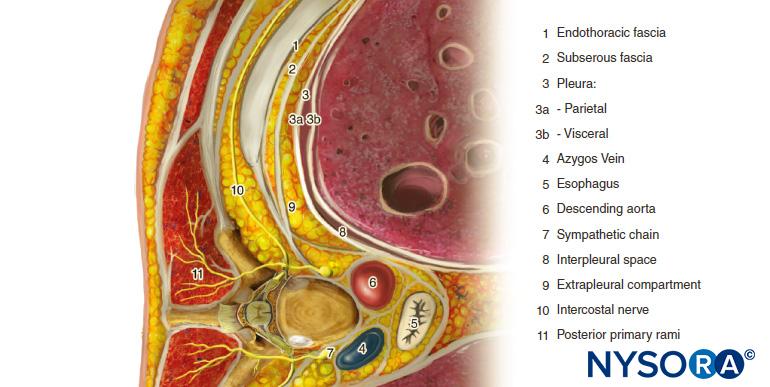
ABBILDUNG 1. Anatomie des thorakalen Paravertebralraums, der Brusthöhle und der Interkostalnerven.
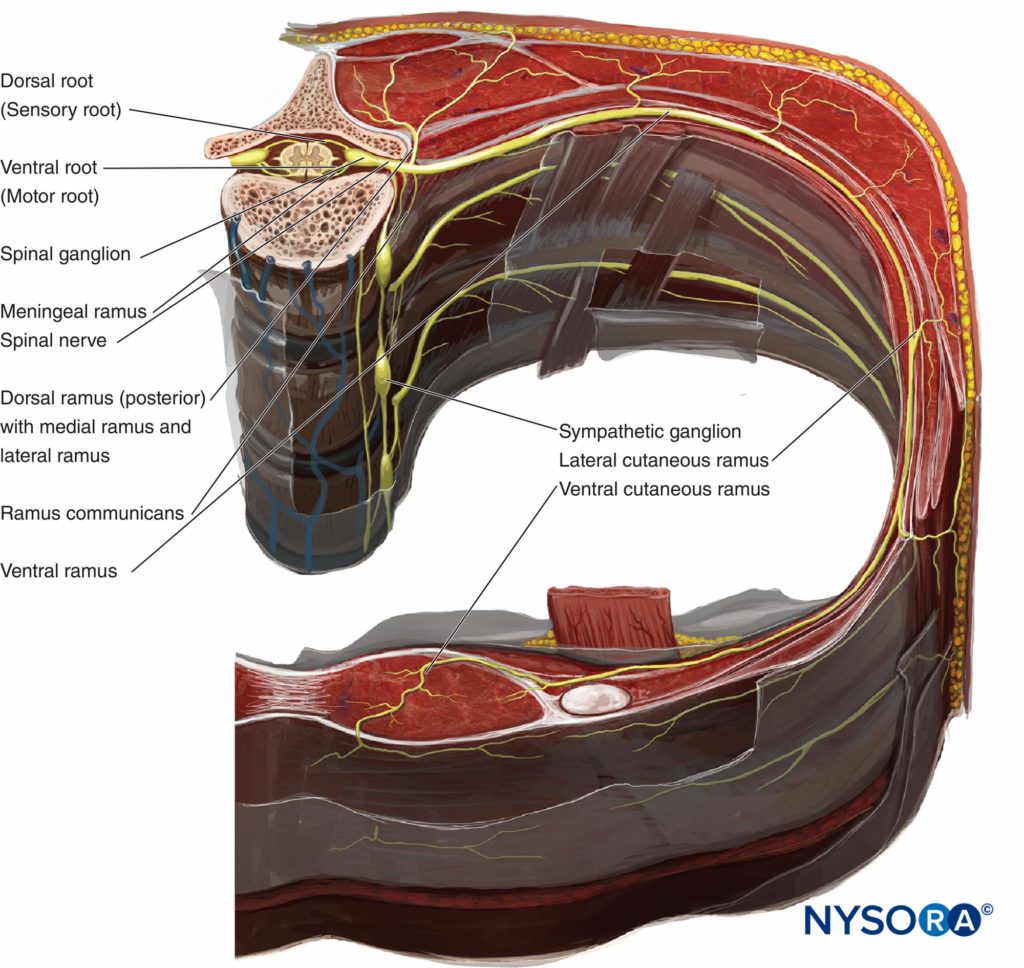
ABBILDUNG 2. Querschnittsanatomie des Wirbels und der Brustwand, die die Beziehung zwischen paraveretbralem Raum, sympathischen Ganglien, Spinal- und Interkostalnerven zeigt.
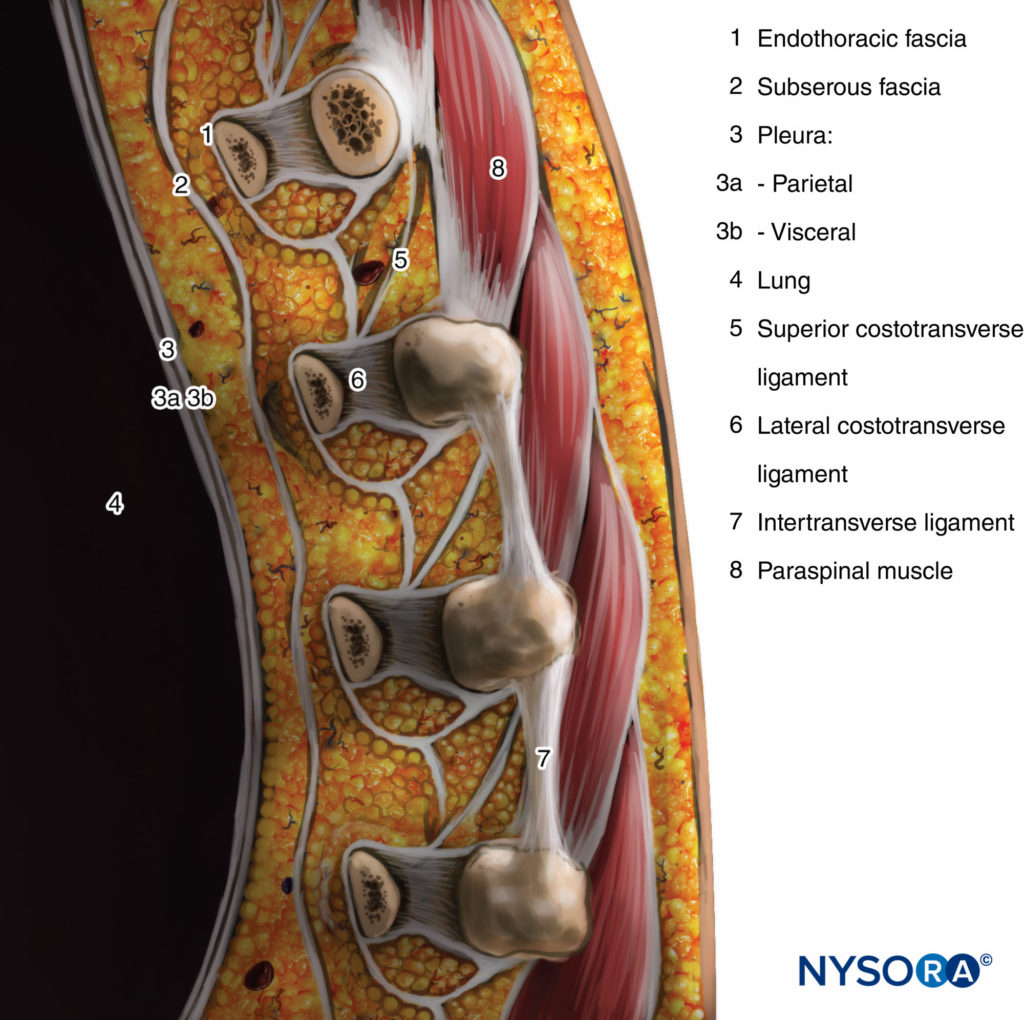
ABBILDUNG 3. Sagittalschnitt durch den thorakalen Paravertebralraum.
Mechanismus der Blockierung und Verteilung der Anästhesie
TPVB führt zu einer ipsilateralen somatischen und sympathischen Nervenblockade (Figure 4) durch direkte Wirkung des Lokalanästhetikums auf die somatischen und sympathischen Nerven im TPVS, Ausdehnung in den Interkostalraum lateral und den Epiduralraum medial. Der Gesamtbeitrag der epiduralen Ausbreitung zur dermatomalen Verteilung der Anästhesie nach einer TPVB ist nicht genau definiert. Bei der Mehrzahl der Patienten tritt jedoch wahrscheinlich ein gewisses Maß an ipsilateraler Ausbreitung des Lokalanästhetikums in Richtung des Epiduralraums auf, was zu einer größeren Verteilung des Anästhetikums führt als bei einer alleinigen paravertebralen Ausbreitung. Die dermatomale Verteilung der Anästhesie nach einer einzelnen Injektion eines großen Volumens variiert und ist oft unvorhersehbar, aber die injizierten Lösungen verteilen sich routinemäßig bis zu einem gewissen Grad sowohl kranial als auch kaudal an der Injektionsstelle (Figure 5). Dennoch ist die Mehrfachinjektionstechnik, bei der kleine Volumina (3–4 ml) des Lokalanästhetikums auf mehreren zusammenhängenden Thoraxebenen injiziert werden, einer einzelnen, großvolumigen Injektion vorzuziehen. Dies ist besonders wichtig, wenn eine zuverlässige Anästhesie über mehrere ipsilaterale thorakale Dermatome gewünscht wird, beispielsweise wenn TPVB zur Anästhesie während einer Brustoperation verwendet wird. Eine segmentale kontralaterale Anästhesie neben der Injektionsstelle tritt bei etwa 10 % der Patienten nach einer TPVB-Einzelinjektion auf und kann auf eine epidurale oder prävertebrale Ausbreitung zurückzuführen sein.

ABBILDUNG 4. Segmentale Thoraxanästhesie mit paravertebralen Blockaden.
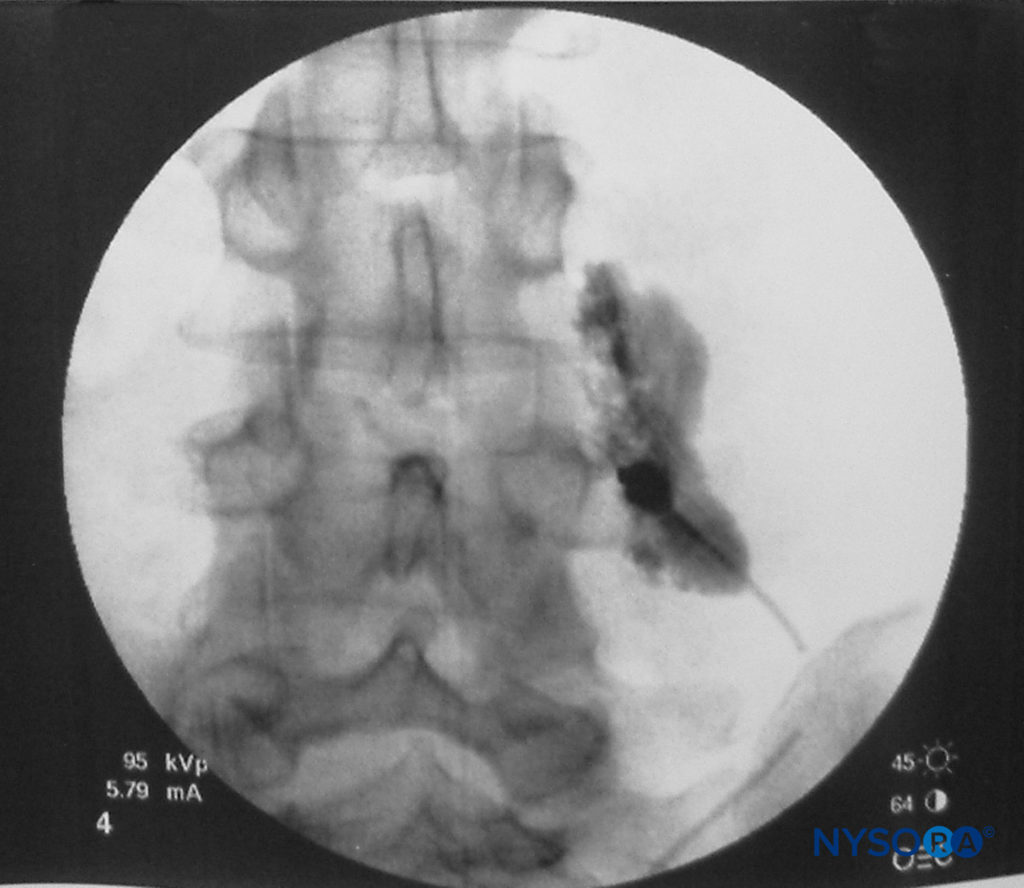
ABBILDUNG 5. Auftragen von 3 ml Lokalanästhesielösung nach einer paravertebralen Blockade (Lendenwirbelsäule).
Bilaterale symmetrische Anästhesie aufgrund ausgedehnter Epiduralausbreitung oder unbeabsichtigter intrathekaler Injektion in eine Duralmanschette kann auftreten, insbesondere wenn die Nadel nach medial gerichtet ist oder wenn ein größeres Volumen des Lokalanästhetikums (> 25 ml) verwendet wird. Aus diesem Grund sollten Patienten mit derselben Wachsamkeit und denselben Methoden überwacht werden wie bei der Injektion mit einer großvolumigen Einzelinjektion Epiduraltechnik. Die ipsilateralen N. ilioinguinalis und N. iliohypogastricus können gelegentlich auch nach paravertebralen Injektionen in den unteren Thorax betroffen sein. Dies ist entweder auf eine epidurale Ausbreitung oder eine ausgedehnte subendothorakale Faszienausbreitung in den retroperitonealen Raum zurückzuführen, wo sich die lumbalen Spinalnerven befinden. Die Wirkung der Schwerkraft auf die dermatomale Ausbreitung der Anästhesie nach TPVB ist unbekannt, aber es kann eine Tendenz zur bevorzugten Ansammlung der injizierten Lösung in Richtung der abhängigen Konzentrationen geben.
- Technik
Es ist vorzuziehen, die TPVB mit dem Patienten in sitzender Position durchzuführen, da die Oberflächenanatomie besser sichtbar ist und sich die Patienten oft wohler fühlen. Wenn dies jedoch nicht möglich oder praktikabel ist, kann die TPVB auch in Seiten- oder Bauchlage des Patienten durchgeführt werden. Anzahl und Höhe der Injektionen werden entsprechend der gewünschten Ausbreitung der Lokalanästhesie gewählt. In diesem Beispiel wird die Beschreibung des TPVB für die Brustchirurgie beschrieben. Oberflächenmarkierungen werden identifiziert und vor der Blockplatzierung mit einem Hautmarker markiert (Figure 6). Hautmarkierungen werden auch 2.5 cm lateral von der Mittellinie an den zu blockierenden Thoraxebenen gemacht.
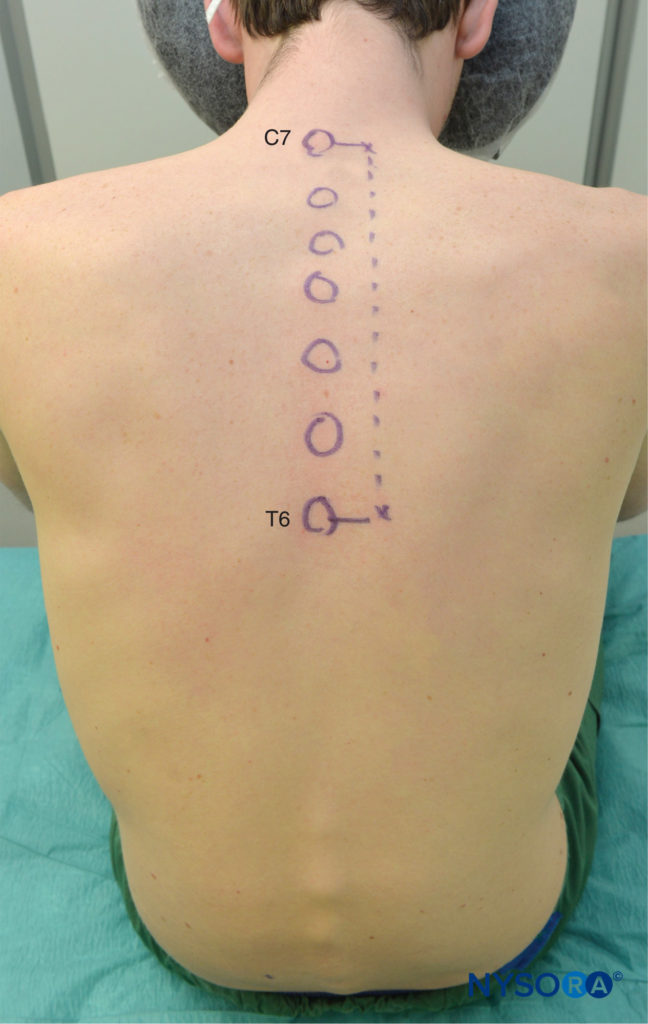
ABBILDUNG 6. Oberflächenmarkierungen für thorakale paravertebrale Blockaden.
Diese Markierungen zeigen die Einstichstellen der Nadel an und sollten über dem Querfortsatz des Wirbels liegen (Figure 7). Die Standard-Regionalanästhesie-Tablett ist vorbereitet, und während der Blockplatzierung sollte strenge Asepsis eingehalten werden. Für TPVB wird eine 22-Gauge-Tuohy-Nadel empfohlen (Figure 8). Idealerweise sollte die Nadel Tiefenmarkierungen auf ihrem Schaft haben. Alternativ kann ein Tiefenwächter (vgl Figure 8) ist empfohlen. Ein Epiduralbesteck wird verwendet, wenn das Einführen eines Katheters in das TPVS geplant ist. TPVB erfordert eine angemessene Prämedikation, um die Patientenakzeptanz und den Komfort während der Blockplatzierung sicherzustellen.
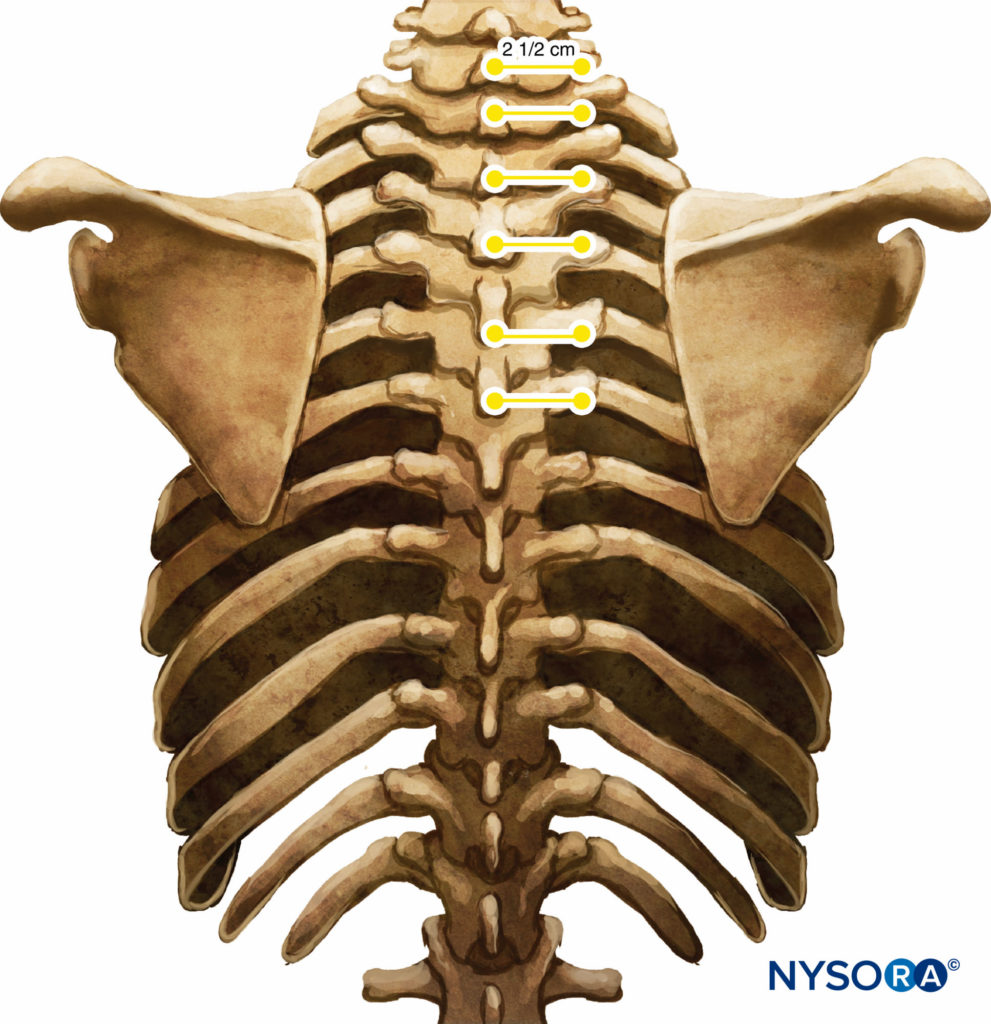
ABBILDUNG 7. Beziehung zwischen Dorn- und Querfortsätzen.
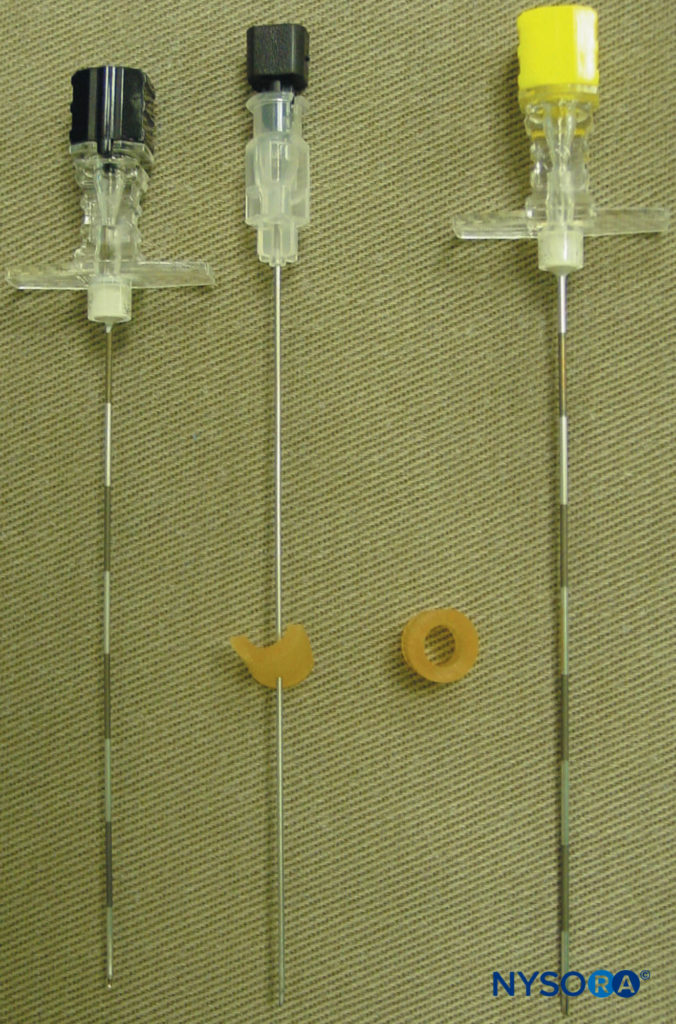
ABBILDUNG 8. Nadeln, die üblicherweise für eine thorakale paravertebrale Blockade mit Einzel- oder Mehrfachinjektion verwendet werden. Beachten Sie den Tiefenschutz, der an der Nadel angebracht ist, um die Tiefe zu beurteilen.
Loss-of-Resistance-Technik
Es gibt verschiedene TPVB-Techniken. Die klassische Technik besteht darin, den Widerstandsverlust hervorzurufen. Die Haut und das darunter liegende Gewebe werden mit Lidocain 1 % infiltriert, und die Blocknadel wird in allen Ebenen senkrecht zur Haut eingeführt, um den Querfortsatz des Wirbels zu kontaktieren. Beachten Sie, dass aufgrund der scharfen Winkelung der Brustwirbelsäule in der mittleren Brustregion der Querfortsatz, der kontaktiert wird, der des unteren Wirbels ist (Figuren 9 und 10).
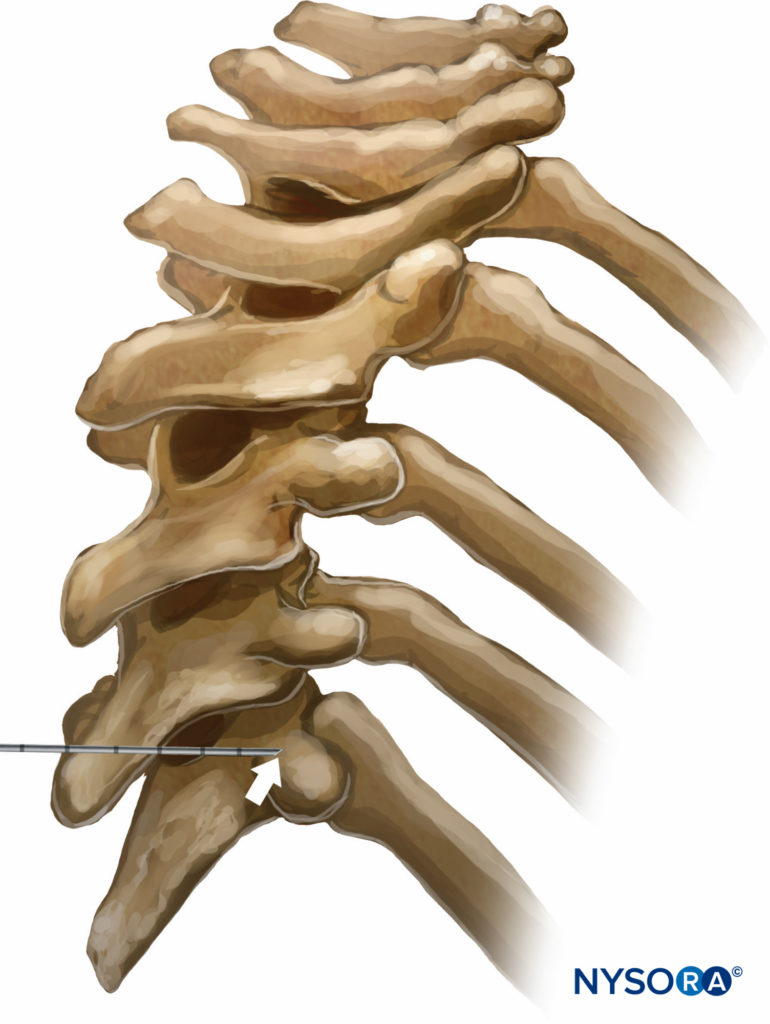
ABBILDUNG 9. Beziehung zwischen den Dorn- und Querfortsätzen auf Brusthöhe. Aufgrund der steilen Abwärtswinkelung der Dornfortsätze auf Brusthöhe berührt die auf Höhe der Dornfortsätze eingeführte Nadel den Querfortsatz des darunter liegenden Wirbels.
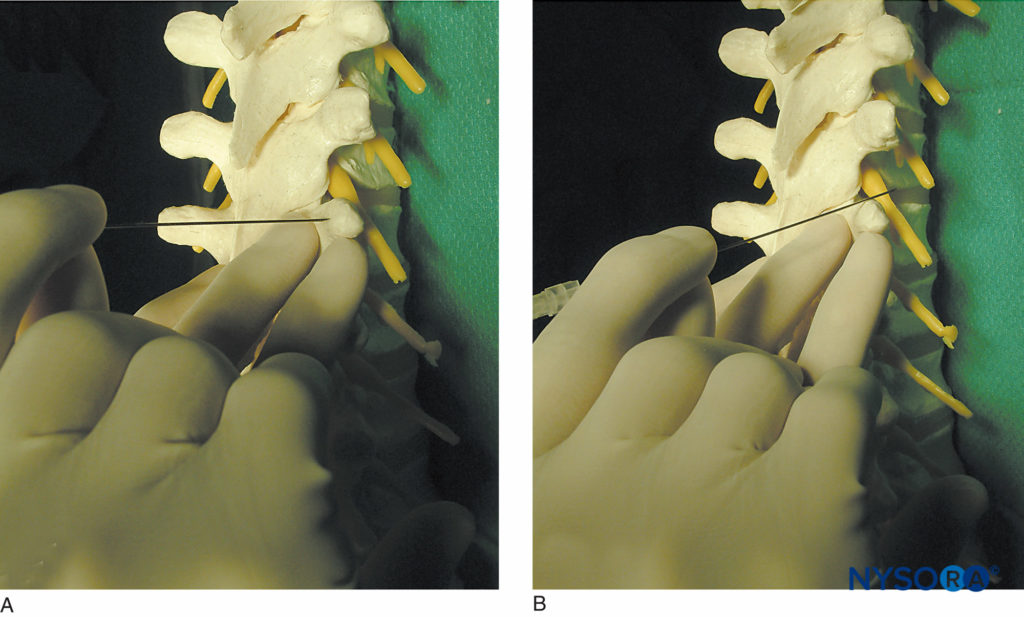
ABBILDUNG 10. Technik des „Abgehens“ des Querfortsatzes. A: Die Nadel berührt den Querfortsatz. B: Die Nadel läuft vom oberen Teil des Querfortsatzes ab. Das Gehen von unten nach unten kann auf Brusthöhe sicherer sein.
Die Tiefe, in der der Querfortsatz kontaktiert wird, variiert (3–4 cm) und hängt von der Statur des Individuums und der Höhe ab, in der die Nadel eingeführt wird. Die Tiefe ist auf Höhe der Hals- und Lendenwirbelsäule tiefer und auf Höhe der Brustwirbelsäule flacher.
Beim Einführen der Nadel ist es möglich, den Querfortsatz zu übersehen und versehentlich die Pleura zu punktieren. Daher ist es zwingend erforderlich, den Querfortsatz zu suchen und zu kontaktieren, bevor die Nadel zu tief vorgeschoben wird und eine Pleurapunktion riskiert wird. Um diese Komplikation zu minimieren, sollte die Blocknadel anfänglich nur bis zu einer maximalen Tiefe von 4 cm auf thorakaler und 5 cm auf zervikaler und lumbaler Ebene eingeführt werden. Bei fehlendem Knochenkontakt ist davon auszugehen, dass sich die Nadel zwischen zwei benachbarten Querfortsätzen befindet. Die Nadel sollte bis zum subkutanen Gewebe zurückgezogen und in kranialer oder kaudaler Richtung bis zur gleichen Tiefe (4 cm) erneut eingeführt werden, bis der Knochen berührt wird.
Wenn immer noch kein Knochen angetroffen wird, wird die Nadel um einen weiteren Zentimeter vorgeschoben und das obige Verfahren wiederholt, bis der Querfortsatz identifiziert ist. Die Nadel wird dann über oder unter (sicherer) dem Querfortsatz geführt und allmählich vorgeschoben, bis ein Widerstandsverlust ausgelöst wird, wenn die Nadel das obere costotransverse Ligament in das TPVS durchquert (Figure 11; sehen Figure 3).
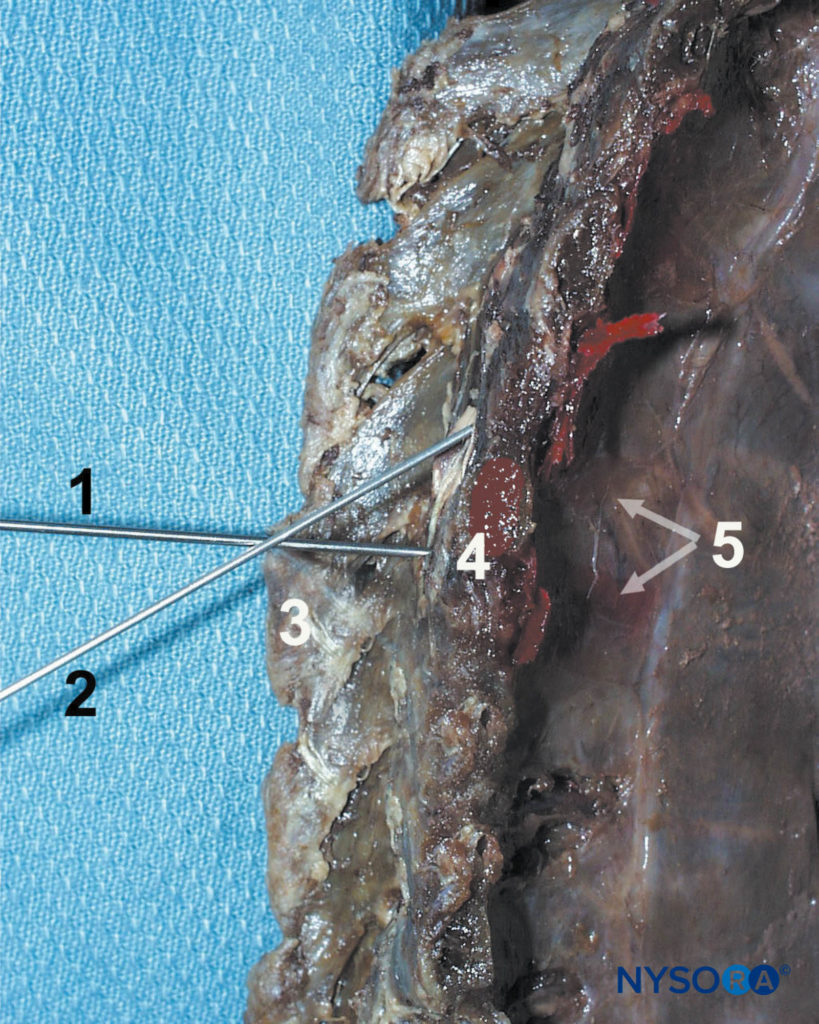
ABBILDUNG 11. Technik der paravertebralen Blockade. Die Nadel (1) wird zuerst vorgeschoben, um den Querfortsatz (4) zu kontaktieren, und dann nach kranial (2) oder kaudal umgelenkt, um den Querfortsatz zu verlassen und in den paravertebralen Raum einzutreten. Andere gezeigte Strukturen sind der Dornfortsatz (3) und die Verteilung des Farbstoffs im paravertebralen Raum und im interkostalen Sulcus.
NYSORA-Tipps
- Es wird empfohlen, von der unteren Seite des Querfortsatzes wegzulaufen, falls die Nadel eher die Rippe als den Querfortsatz berührt hat. Wenn dies passiert, kann das Gehen von der Rippe nach kranial zu einem Pneumothorax führen.
- Dies geschieht normalerweise innerhalb von 1.0–1.5 cm vom oberen Rand des Querfortsatzes (siehe Figure 3). Obwohl ein subtiles „Pop“ oder „Give“ wahrgenommen werden kann, wenn die Nadel den Processus costotransversum superior durchquert, sollte man sich nicht ausschließlich darauf verlassen. Stattdessen sollte sich die Tiefe der Nadelplatzierung am initialen Knochenkontakt (Haut-Querfortsatz + 1.0–1.5 cm) orientieren.
Vorbestimmte Abstandstechnik
TPVB kann auch durchgeführt werden, indem die Nadel um eine fest vorgegebene Strecke (1 cm) vorgeschoben wird, nachdem die Nadel vom Querfortsatz abgetreten wurde, ohne dass es zu einem Widerstandsverlust kommt (Abbildung 12A und B). Befürworter dieser Technik haben sie sehr erfolgreich mit geringem Pneumothorax-Risiko eingesetzt. Die Verwendung einer Tiefenmarkierung wird empfohlen, um eine versehentliche Pleura- oder Lungenpunktion zu vermeiden.
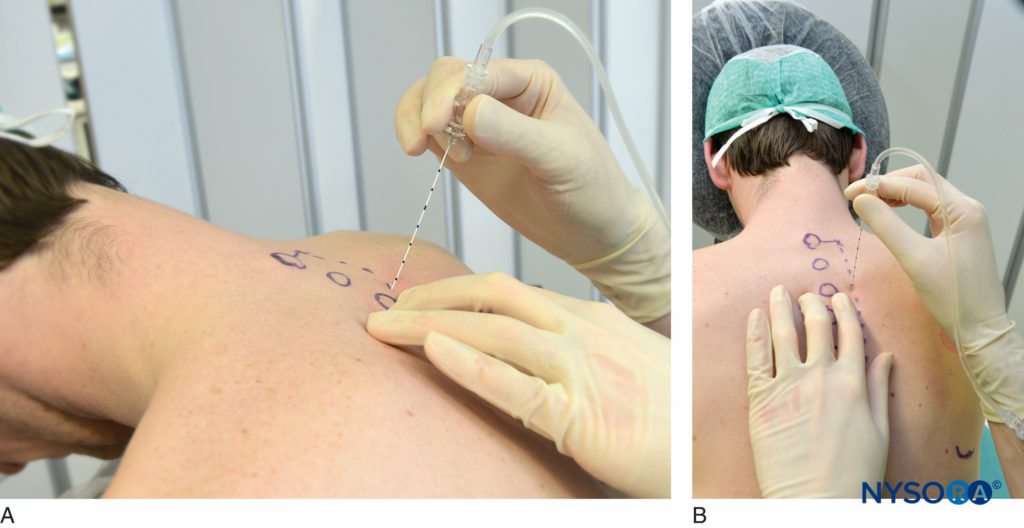
ABBILDUNG 12. Nadelwinkel, um den Querfortsatz zu kontaktieren (A) und um den Querfortsatz inferior zu verlassen (B). Sobald der Querfortsatz kontaktiert ist, wird die Nadel abgetreten und 1.5 cm tiefer eingeführt, wobei auf die Tiefenmarkierungen zu achten ist oder ein Gummistopfen verwendet wird (Abbildung 8).
NYSORA-Tipps
- Führen Sie TPVB mit dem Patienten in sitzender Position durch.
- Oberflächenmarkierungen sollten immer identifiziert und mit einem Hautmarker markiert werden.
- Verwenden Sie Nadeln mit Tiefenmarkierungen, um das Abschätzen der Einstichtiefe zu erleichtern.
- Es ist unbedingt erforderlich, den Querfortsatz zu suchen und zu kontaktieren, bevor die Nadel weiter vorgeschoben wird.
- Die Tiefe, in der der Querfortsatz kontaktiert wird, variiert bei demselben Patienten auf verschiedenen Thoraxebenen. Es ist am tiefsten in der zervikalen, oberen und unteren Brust und am flachsten in der mittleren Brustregion.
- Die Nadel sollte nicht weiter als 1.5 cm über den Kontakt mit dem Querfortsatz hinaus vorgeschoben werden.
- Vermeiden Sie es, die Nadel nach medial zu richten, um ein versehentliches Verrutschen der epiduralen oder intrathekalen Nadel zu vermeiden.
- Platzierung des thorakalen paravertebralen Katheters
Wenn eine kontinuierliche TPVB (CTPVB) geplant ist, a Katheter wird durch eine Tuohy-Nadel in das TPVS eingeführt. Im Gegensatz zur Epiduralkatheterisierung tritt beim Einführen des paravertebralen Katheters üblicherweise ein gewisser Widerstand auf. Dies kann erleichtert werden, indem vor dem Einführen des Katheters 5–10 ml Kochsalzlösung injiziert wird, um einen Zwischenraum zu schaffen. Eine ungewöhnlich nahtlose Passage des Katheters sollte den Verdacht auf eine interpleurale Platzierung wecken. Die vielleicht sicherste und einfachste Methode zum Einführen eines Katheters in das TPVS besteht darin, ihn unter direkter Sicht aus der offenen Brusthöhle zu platzieren. Offensichtlich erfordert dies einen geöffneten Thorax und wird daher ausschließlich bei Patienten durchgeführt, die sich einer Thorakotomie unterziehen.
Bei dieser Technik wird die parietale Pleura vom hinteren Wundrand über mehrere thorakale Segmente auf die Wirbelkörper gespiegelt, wodurch eine extrapleurale paravertebrale Tasche entsteht (Figure 13), in die ein perkutan eingeführter Katheter gegen die Winkel der freigelegten Rippen platziert wird. Die Pleura wird wieder an die Brustwand angelegt und der Thorax geschlossen. Dieses Verfahren kann sehr effektiv mit einer präinzisionalen, einmaligen, perkutanen thorakalen paravertebralen Injektion kombiniert werden, um eine perioperative Analgesie während einer Thoraxoperation bereitzustellen.
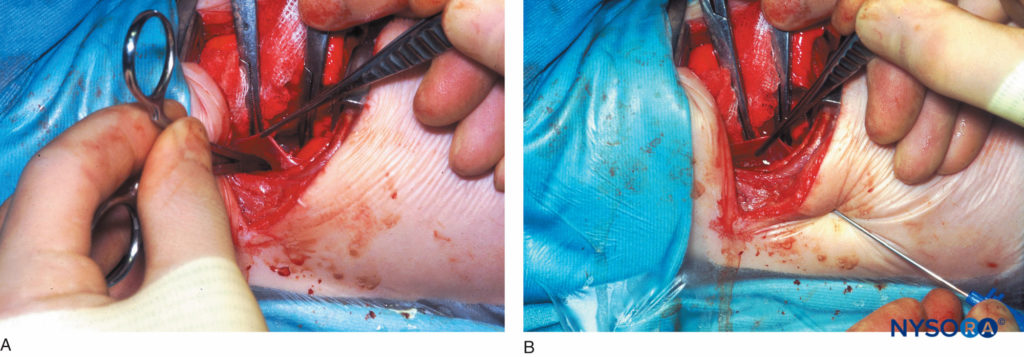
ABBILDUNG 13. A: Extrapleurale paravertebrale Katheterplatzierung unter direkter Sicht bei einem Säugling. Abbildung zeigt eine gebogene Arterienklemme, die in die extrapleurale paravertebrale Tasche eingeführt wurde, die durch Umspiegeln der parietalen Pleura vom hinteren Wundrand auf die Wirbelkörper über mehrere thorakale Dermatome entstanden ist. B: Extrapleurale paravertebrale Katheterplatzierung unter direkter Sicht bei einem Säugling. Abbildung zeigt eine Tuohy-Nadel, die vom unteren Zwischenrippenraum in den thorakalen paravertebralen Raum eingeführt wurde; .dh die zuvor geschaffene extrapleurale paravertebrale Tasche. Ein Katheter wird dann durch die Tuohy-Nadel eingeführt und an den Winkeln der freigelegten Rippen befestigt, wonach die Pleura wieder angelegt und die Brust verschlossen wird.
NYSORA-Tipps
- Die Injektion von Kochsalzlösung oder der Bolusdosis des Lokalanästhetikums vor dem Einführen des Katheters erleichtert das Einführen eines Katheters.
- Ein sehr leichter Durchgang des Katheters (> 6 cm) sollte den Verdacht auf eine intrapleurale Platzierung aufkommen lassen.- Der Katheter sollte nicht > 3 cm eingeführt werden, um eine Wanderung in den Epiduralraum zu verhindern.
Indikationen
TPVB ist zur Anästhesie und Analgesie bei einseitigen chirurgischen Eingriffen im Brust- und Bauchbereich indiziert. Häufig gemeldete Indikationen sind in aufgeführt Tisch 1. Die Anwendung von bilateraler TPVB wurde ebenfalls berichtet.
TABELLE 1. Indikationen für den thorakalen paravertebralen Block.
| Anästhesie |
|---|
| Brustoperation |
| Herniorrhaphie (thorakolumbale Anästhesie) |
| Exploration von Brustwunden |
| Postoperative Analgesie (als Teil eines ausgewogenen Analgetikaregimes) |
|---|
| Thorakotomie |
| Thorakoabdominelle Ösophaguschirurgie |
| Videoassistierte thorakoskopische Chirurgie |
| Cholezystektomie |
| Nierenchirurgie |
| Brustoperation |
| Herniorrhaphie |
| Leberresektion |
| Blinddarmentfernung |
| Minimalinvasive Herzchirurgie |
| Konventionelle Herzchirurgie (bilaterale TPVB) |
| Behandlung chronischer Schmerzen |
|---|
| Gutartige und bösartige Neuralgie |
| Weitere Anwendungsbereiche |
|---|
| Postzosterschmerz |
| Linderung von pleuritischen Brustschmerzen |
| Mehrere gebrochene Rippen |
| Behandlung von Hyperhidrose |
| Leberkapselschmerz nach stumpfem Bauchtrauma |
Gegenanzeigen
Kontraindikationen für TPVB umfassen Infektionen an der Stelle von Injektion, Allergie gegen ein Lokalanästhetikum, Empyem und eine neoplastische Masse, die den paravertebralen Raum einnimmt. Gerinnungsstörungen, Blutungsstörungen oder Patienten erhalten Antikoagulans Medikamente sind relative Kontraindikation für TPVB. Bei Patienten mit Kyphoskoliose oder deformierten Wirbelsäulen und solchen, die sich einer früheren Thoraxoperation unterzogen haben, ist Vorsicht geboten. Die Brustdeformität bei Ersterem kann zu einer unbeabsichtigten Thekal- oder Pleurapunktion prädisponieren, und die veränderte paravertebrale Anatomie aufgrund einer fibrotischen Obliteration des paravertebralen Raums oder Adhäsionen der Lunge an der Brustwand bei Letzterem kann zu einer Lungenpunktion prädisponieren.
Wahl des Lokalanästhetikums
Da TPVB nicht zu einer motorischen Schwäche der Extremitäten führt, ist bei TPVB fast immer eine lang anhaltende Analgesie wünschenswert. Folglich werden typischerweise lang wirkende Lokalanästhetika verwendet. Dazu gehören Bupivacain oder Levobupivacain 0.5 % und Ropivacain 0.5 %. Bei der Einzelinjektion von TPVB werden 20–25 ml Lokalanästhetikum in Aliquots injiziert, während bei der Mehrfachinjektion von TPVB 4–5 ml Lokalanästhetikum auf jeder geplanten Stufe injiziert werden. Bei älteren, schlecht ernährten und gebrechlichen Patienten muss die maximale Dosis des Lokalanästhetikums angepasst werden.
Das TPVS ist gut vaskularisiert, was zu einer relativ schnellen Absorption des Lokalanästhetikums in den systemischen Kreislauf führt. Folglich wird die maximale Plasmakonzentration des Lokalanästhetikums schnell erreicht. Epinephrin (2.5–5.0 mcg/ml) enthaltende Lokalanästhesielösungen können während der anfänglichen Injektion verwendet werden, da sie die systemische Resorption und damit das Toxizitätspotential verringern.
Epinephrin hilft auch bei der Erhöhung der maximal zulässigen Dosis des Lokalanästhetikums. Die Anästhesiedauer nach TPVB beträgt 3–4 h, die Analgesie dauert jedoch oft viel länger (8–18 h). Wenn eine kontinuierliche TPVB (CTPVB) geplant ist, z. B. zur postoperativen Analgesie nach Thorakotomie oder zur kontinuierlichen Schmerzlinderung bei multiplen Rippenfrakturen, dann ist eine Hanftee Bupivacain oder Levobupivacain 0.25 % oder Ropivacain 0.2 % mit 0.1–0.2 ml/kg/h wird nach der anfänglichen Bolusinjektion begonnen und für 3–4 Tage oder wie angezeigt fortgesetzt. Unserer Erfahrung nach führt die Verwendung einer höheren Konzentration des Lokalanästhetikums (z. B. Bupivacain 0.5 % anstelle von 0.25 %) für das CTPVB nicht zu einer besseren Qualität der Analgesie und kann das Potenzial für erhöhen lokale Betäubung Toxizität.
NYSORA-Tipps
- Erwägen Sie die Verwendung von Lidocain oder Chloroprocain für die Haut- und subkutane Infiltration, um die Gesamtdosis des toxischeren langwirksamen Lokalanästhetikums zu reduzieren.
- Verwenden Sie ein Epinephrin-haltiges (z. B. 1:200 oder 000:1) lang wirkendes Lokalanästhetikum, da es die systemische Absorption und damit das Potenzial für systemische Toxizität verringert.
- Bei älteren Patienten und Patienten mit eingeschränkter Leber- und Nierenfunktion sollte die Dosis des Lokalanästhetikums angepasst werden.
Praktisches Management des thorakalen paravertebralen Blocks
Brustchirurgie
Die thorakale paravertebrale Injektion eines Lokalanästhetikums auf mehreren Ebenen (C7 bis T6) in Verbindung mit einer intravenösen Sedierung ist für die chirurgische Anästhesie während einer größeren Brustoperation wirksam (Figure 14). Der Dornfortsatz C7 ist der prominenteste zervikale Dornfortsatz; der untere Rand des Schulterblatts entspricht T7. Im Vergleich zu Patienten, die nur eine Vollnarkose (GA) erhalten, haben Patienten, die eine TPVB-Mehrfachinjektion für größere Brustoperationen erhalten, weniger postoperative Schmerzen, benötigen weniger Analgetika und haben nach der Operation weniger Übelkeit und Erbrechen.
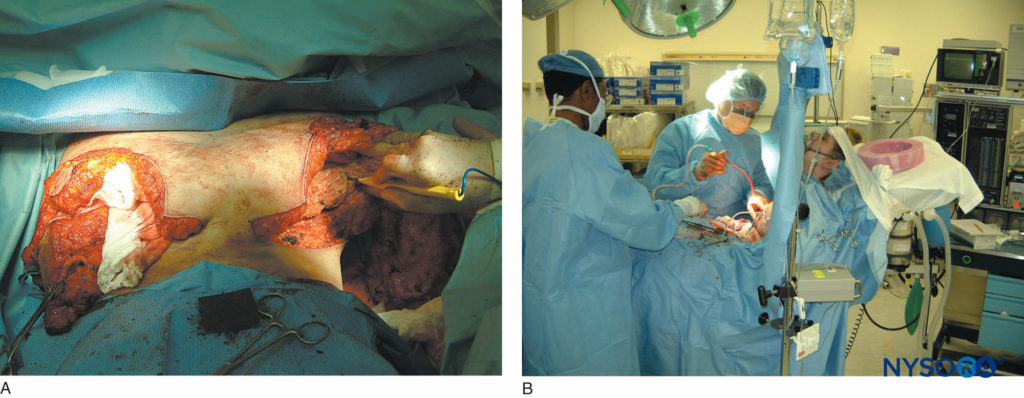
ABBILDUNG 14. A: Umfangreiche Brustrekonstruktionsoperationen, die unter paravertebraler Blockade durchgeführt werden. B: Der Patient wird mittels Propofol-Infusion sediert. Die Bilder zeigen, wie wirksam paravertebrale Blockaden sowohl als anästhetische als auch als analgetische Techniken sein können.
Um jedoch die TPVB-Mehrfachinjektionstechnik für die Anästhesie während einer Brustoperation effektiv einzusetzen, muss man die komplexe Innervation der Brust verstehen. Die vordere und seitliche Brustwand wird sensorisch von den vorderen und seitlichen Hautästen der Interkostalnerven (T2 bis T6), der Axilla (T1–T2), der infraklavikulären Region von den Supraklavikularnerven (C4–C5) und der Brust innerviert Muskeln der lateralen (C5–C6) und medialen (C7–C8) Brustnerven.
Es kann auch eine überlappende sensorische Innervation von der kontralateralen Seite des Brustkorbs geben. Diese komplexe Innervation der Brust von den Wirbelsäulensegmenten C4–T6 erklärt, warum TPVB möglicherweise keine vollständige Anästhesie für die Dissektion über dem Brustmuskel oder der Infraklavikularregion bietet. Dies kann jedoch durch eine angemessene Sedierung während der Operation sowie durch intraoperative Injektionen von Lokalanästhetika durch den Chirurgen in die empfindlichen Bereiche überwunden werden. Injektion eines Lokalanästhetikums subkutan entlang des unteren Randes des Schlüsselbeins oder ipsilateral oberflächlich durchzuführen zervikale Plexusblockade zur Anästhesie der Supraklavikularnerven (C4–C5) wird Beschwerden und den Bedarf an Beruhigungsmitteln und Analgetika während der Operation minimieren.
Eine Kombination aus Midazolam oder Propofol-Infusion oder IV-Opioid kann verwendet werden, um den Patienten intraoperativ Komfort zu bieten. Dexmedetomidin, ein hochselektiver α2-Adrenozeptor-Agonist, ist mit seinen sedierenden, analgetischen und minimalen oder keinen atemdepressiven Eigenschaften eine nützliche Alternative zur Sedierung während einer Brustoperation unter TPVB.
In Kombination mit Vollnarkose kann eine Einzelinjektion von TPVB mit Ropivacain (2 mg/kg verdünnt auf 20 ml mit 0.9 %iger Kochsalzlösung) mit 1:200 Epinephrin vor der Induktion von GA verwendet werden. Dies stellt eine hervorragende postoperative Analgesie bereit, reduziert den Bedarf an postoperativen Analgetika, reduziert postoperatives Erbrechen, erleichtert die frühere Wiederaufnahme der oralen Flüssigkeitsaufnahme, reduziert die postoperative Verschlechterung der Atmungsfunktion und verstärkt die Wiederherstellung der postoperativen Atmungsmechanik.
Schmerzlinderung nach Thorakotomie
CTPVB ist eine wirksame Methode zur Bereitstellung von Analgesie nach Thorakotomie (Figure 15). Idealerweise sollte TPVB vor der Thorakotomie-Inzision über einen perkutan eingeführten Katheter etabliert und 4–5 Tage nach der Operation fortgesetzt werden. Wenn jedoch während der Operation ein extrapleuraler paravertebraler Katheter unter direkter Sicht aus dem Brustkorb platziert wird, kann vor der chirurgischen Inzision eine TPVB mit einer einzigen Injektion auf Höhe der Thorakotomie-Inzision durchgeführt werden, und es wird mit einer kontinuierlichen Infusion eines Lokalanästhetikums begonnen nach der Katheteranlage. Die durch CTPVB erreichte Analgesie ist vergleichbar mit Epiduralanalgesie aber mit weniger Hypotonie, Harnverhalt und den Nebenwirkungen, die häufig bei der epiduralen Opioidverabreichung beobachtet werden. Der Opioidbedarf bei einem solchen Ansatz wird durch das CTPVB signifikant reduziert, und die Analgesie ist der alleinigen IVPCA überlegen.
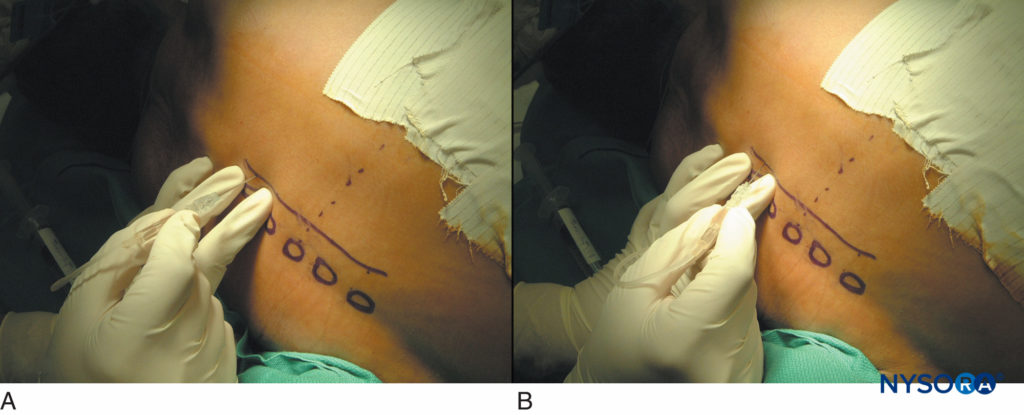
ABBILDUNG 15. Thorakale paravertebrale Blockaden bei Patienten nach Thorakotomie. Eine typische Abfolge des Berührens des Querfortsatzes (A) und des Gehens 1 cm tiefer zum Querfortsatz nach oben oder unten (B).
Mehrere gebrochene Rippen
TPVB ist eine wirksame Methode zur Schmerzlinderung bei Patienten mit einseitig mehrfach gebrochenen Rippen. Eine einzelne thorakale paravertebrale Injektion von 25 ml Bupivacain 0.5 % bewirkt eine Schmerzlinderung für eine mittlere Dauer von 10 h und verbessert die Atmungsfunktion und die arteriellen Blutgase. Um ein erneutes Auftreten von Schmerzen und eine Verschlechterung der Atemfunktion zu vermeiden, kann ein thorakaler paravertebraler Katheter auf halbem Weg zwischen der höchsten und der niedrigsten gebrochenen Rippe eingeführt werden, und eine CTPVB kann nach Verabreichung der anfänglichen Bolusinjektion begonnen werden.
CTPVB in Kombination mit einem NSAID sorgt für kontinuierliche Schmerzlinderung und führt zu einer nachhaltigen Verbesserung der Atmungsparameter und der arteriellen Oxygenierung. Da TPVB keine Harnretention verursacht oder die motorische Funktion der unteren Gliedmaßen beeinträchtigt, ist es bei Patienten mit mehreren gebrochenen Rippen nützlich, die auch gleichzeitig ein Lendenwirbelsäulentrauma haben, da es auch eine kontinuierliche Behandlung ermöglicht neurologische Beurteilung auf Anzeichen einer Rückenmarkskompression.
Pharmakokinetische Überlegungen
Während der CTPVB werden üblicherweise relativ hohe Dosen von Lokalanästhetika verwendet. Daher besteht das Potenzial für Toxizität von Lokalanästhetika, und die Patienten sollten während der CTPVB engmaschig überwacht und die Infusion abgebrochen werden, wenn sich Anzeichen entwickeln. Während einer verlängerten thorakalen paravertebralen Infusion kommt es zu einer fortschreitenden Akkumulation des Lokalanästhetikums im Plasma, und die Plasmakonzentration des Arzneimittels kann die Schwelle für eine Toxizität des zentralen Nervensystems überschreiten (z. B. 2.0–4.5 mcg/ml für Bupivacain). Trotz der systemischen Akkumulation ist eine Lokalanästhetika-Toxizität selten. Dies kann der Fall sein, weil, obwohl die Gesamtplasmakonzentration des Lokalanästhetikums postoperativ ansteigt, der freie Anteil des Arzneimittels unverändert bleibt und möglicherweise auf den postoperativen Anstieg der α1-Säure-Glykoproteinkonzentration zurückzuführen ist, dem Protein, das an Lokalanästhetika bindet . Es gibt auch einen größeren Anstieg des S-Bupivacain-Enantiomers, das mit einer geringeren Toxizität verbunden ist, als das R-Enantiomer. Aufgrund von Bedenken hinsichtlich der systemischen Akkumulation und der Toxizität von Lokalanästhetika bei verlängerter paravertebraler Infusion ist es vorzuziehen, ein Lokalanästhetikum mit geringerem Toxizitätspotenzial zu verwenden, wie z. B. Ropivacain. Auch bei der ist Vorsicht geboten älteren Generation und gebrechlichen Patienten sowie bei Patienten mit eingeschränkter Leber- und Nierenfunktion.
Komplikationen und wie man sie vermeidet
Basierend auf veröffentlichten Daten ist die Inzidenz von Komplikationen nach TPVB relativ gering und variiert zwischen 2.6 % und 5 %. Dazu gehören Gefäßpunktion (3.8 %), Hypotonie (4.6 %), Pleurapunktion (1.1 %) und Pneumothorax (0.5 %). Anders als beim Thorax Epiduralanästhesie, Hypotonie ist bei normovolämischen Patienten nach TPVB selten, da die sympathische Blockade einseitig ist. TPVB kann jedoch Hypovolämie demaskieren und zu Hypotonie führen. Daher sollte TPVB bei hypovolämischen oder hämodynamisch labilen Patienten mit Vorsicht angewendet werden. Trotzdem ist eine Hypotonie selbst nach bilateraler TPVB selten, wahrscheinlich aufgrund der segmentalen Natur des bilateralen Sympathikusblocks.
Pleurapunktion und Pneumothorax sind zwei Komplikationen, die Anästhesisten oft davon abhalten, eine TPVB durchzuführen. Eine versehentliche Pleurapunktion ist nach TPVB ungewöhnlich und führt möglicherweise nicht zu einem Pneumothorax, der normalerweise geringfügig ist und konservativ behandelt werden kann. Hinweise, die auf eine Pleurapunktion während einer TPVB hindeuten, ausgeprägter Widerstandsverlust beim Eindringen der Nadel in die Brusthöhle, Husten, Einsetzen scharfer Brust- oder Schulterschmerzen oder plötzliche Hyperventilation. Entgegen der landläufigen Meinung kann Luft nicht durch die Nadel aspiriert werden, es sei denn, die Lunge wird auch versehentlich punktiert oder Luft, die während des Entfernens des Mandrins in die Pleurahöhle eingedrungen sein könnte, wird aspiriert. Solche Patienten sollten engmaschig auf die mögliche Entwicklung eines Pneumothorax überwacht werden. Es sollte bedacht werden, dass der Beginn eines Pneumothorax verzögert sein kann und eine Röntgenaufnahme des Brustkorbs, die zu früh angefertigt wird, um einen Pneumothorax auszuschließen, möglicherweise nicht aussagekräftig ist. Sogar eine radiologische Kontrastuntersuchung unter Verwendung einer Röntgenaufnahme des Brustkorbs kann schwierig zu interpretieren sein, da sich der intrapleurale Kontrast schnell auflöst, keine spezifische anatomische Ebene definiert und dazu neigt, sich auf die Zwerchfellwinkel oder die horizontale Fissur auszubreiten. Systemische Toxizität von Lokalanästhetika kann durch versehentliche intravasale Injektion oder durch Anwendung einer zu hohen Dosis eines Lokalanästhetikums verursacht werden. Die Lokalanästhesielösung muss aliquotiert injiziert und die Dosierung bei älteren und gebrechlichen Patienten angepasst werden. Eine adrenalinhaltige Lokalanästhesielösung wird vorgeschlagen, um die Erkennung der intravasalen Injektion zu ermöglichen und die Aufnahme des Lokalanästhetikums in den Körperkreislauf zu reduzieren. Versehentlich Epidural, subdurale oder intrathekale Injektion und Spinalanästhesie kann auch vorkommen. Veröffentlichte Daten deuten darauf hin, dass diese Komplikationen häufiger auftreten, wenn die Nadel nach medial gerichtet ist, aber auch bei einer normal positionierten Nadel aufgrund der Nähe der Nadel zur Duramanschette und zum intervertebralen Foramen auftreten können. Daher darf die Nadel niemals nach medial gerichtet werden, und es muss darauf geachtet werden, dass eine intrathekale Injektion ausgeschlossen wird, indem vor der Injektion routinemäßig ein Aspirationstest durchgeführt wird. Nach TPVB kann sich gelegentlich ein transientes ipsilaterales Horner-Syndrom entwickeln. Dies ist auf eine kraniale Ausbreitung des Lokalanästhetikums zum Ganglion stellatum oder zu den präganglionären Fasern der ersten paar Segmente des thorakalen Rückenmarks zurückzuführen. Bilaterales Horner-Syndrom wurde ebenfalls berichtet und kann auf epidurale Ausbreitung oder prävertebrale Ausbreitung auf das kontralaterale Ganglion stellatum zurückzuführen sein. Nach einer TPVB können auch sensorische Veränderungen am Arm und an der unteren Extremität auftreten. Ersteres ist auf die Ausbreitung des Lokalanästhetikums auf die unteren Komponenten des ipsilateralen Plexus brachialis (C8 und T1) zurückzuführen, und letzteres auf die ausgedehnte subendothorakale Faszienausbreitung in den ipsilateralen retroperitonealen Raum, wo sich die lumbalen Spinalnerven befinden (vorher besprochen). , aber eine epidurale Ausbreitung als Ursache kann nicht ausgeschlossen werden. Eine motorische Blockade oder bilaterale symmetrische Anästhesie mit Beteiligung der unteren Extremität ist selten. Es deutet im Allgemeinen auf eine erhebliche epidurale Ausbreitung hin und kann häufiger auftreten, wenn große Mengen Lokalanästhetikum (> 25–30 ml) auf einmal injiziert werden. Wenn eine breite segmentale Verteilung der Anästhesie gewünscht wird, ist es daher vorzuziehen, die Mehrfachinjektionstechnik durchzuführen oder ein kleineres Volumen des Lokalanästhetikums auf mehreren Ebenen im Abstand von einigen Dermatomen zu injizieren.
LENDEN-PARAVERTEBRALER BLOCK
Der lumbale paravertebrale Block (LPVB) ist technisch ähnlich wie ein TPVB, aber aufgrund von Unterschieden in der Anatomie zwischen den thorakalen und lumbalen paravertebralen Räumen werden die beiden paravertebralen Techniken separat beschrieben. LPVB wird am häufigsten in Kombination mit einem TPVB als thorakolumbaler paravertebraler Block zur chirurgischen Anästhesie während einer Leistenbruchhernie verwendet.
Anatomie
Der lumbale paravertebrale Raum (LPVS) wird anterolateral durch den Musculus psoas major begrenzt; medial durch die Wirbelkörper, die Bandscheiben und das Foramen intervertebrale mit seinem Inhalt; und nach hinten durch den Querfortsatz und die Bänder, die zwischen den angrenzenden Querfortsätzen angeordnet sind. Im Gegensatz zum TPVS, das Fettgewebe enthält, wird das LPVS hauptsächlich vom M. psoas major besetzt. Der Musculus psoas major besteht aus einem fleischigen vorderen Teil, der den Hauptteil des Muskels bildet, und einem dünnen hinteren Teil. Die Hauptmasse stammt von der anterolateralen Fläche der Wirbelkörper und der akzessorische Teil stammt von der vorderen Fläche des Querfortsatzes. Die zwei Teile verschmelzen, um den M. psoas major zu bilden, außer in der Nähe der Wirbelkörper, wo die zwei Teile durch eine dünne Faszie getrennt sind, in der die lumbalen Spinalnervenwurzeln und die aufsteigenden Lendenvenen liegen. Die ventralen Äste der lumbalen Spinalnervenwurzeln erstrecken sich lateral in dieser intramuskulären Ebene, die von den beiden Teilen des M. psoas major gebildet wird, und bilden innerhalb der Substanz des M. psoas major den Plexus lumbalis. Der Psoas-Muskel ist von einer faserigen Hülle, der „Psoas-Hülle“, umhüllt, die sich seitlich als Faszie fortsetzt, die den M. quadratus lumborum bedeckt. Bei einer LPVB wird das Lokalanästhetikum vor dem Querfortsatz in einen dreieckigen Raum zwischen den beiden Teilen des M. psoas major injiziert, der die lumbale Spinalnervenwurzel enthält. Das LPVS kommuniziert medial mit dem Epiduralraum.
Eine Reihe von Sehnenbögen erstreckt sich über die verengten Teile der Lendenwirbelkörper, die von den Lendenarterien und -venen und sympathischen Fasern durchzogen werden. Diese Sehnenbögen können einen Weg für die Ausbreitung des Lokalanästhetikums vom LPVS zur anterolateralen Oberfläche des Wirbelkörpers, zum prävertebralen Raum und zur kontralateralen Seite darstellen und können der Weg sein, über den gelegentlich der ipsilaterale lumbale Sympathikus beteiligt sein kann.
Erfahren Sie mehr darüber Neuroaxiale Anatomie.
- Mechanismus der Blockierung und Verteilung von
Anästhesie
Eine lumbale paravertebrale Injektion erzeugt eine ipsilaterale dermatomale Anästhesie (Figure 16) durch direkte Wirkung des Lokalanästhetikums auf die lumbalen Spinalnerven und durch mediale Ausbreitung in den Epiduralraum über das Foramen intervertebrale. Der Beitrag von epidurale Ausbreitung zur Gesamtverteilung der Anästhesie nach einem LPVB ist unbekannt, tritt aber wahrscheinlich bei der Mehrzahl der Patienten auf und hängt von der Menge des injizierten Lokalanästhetikums ab.
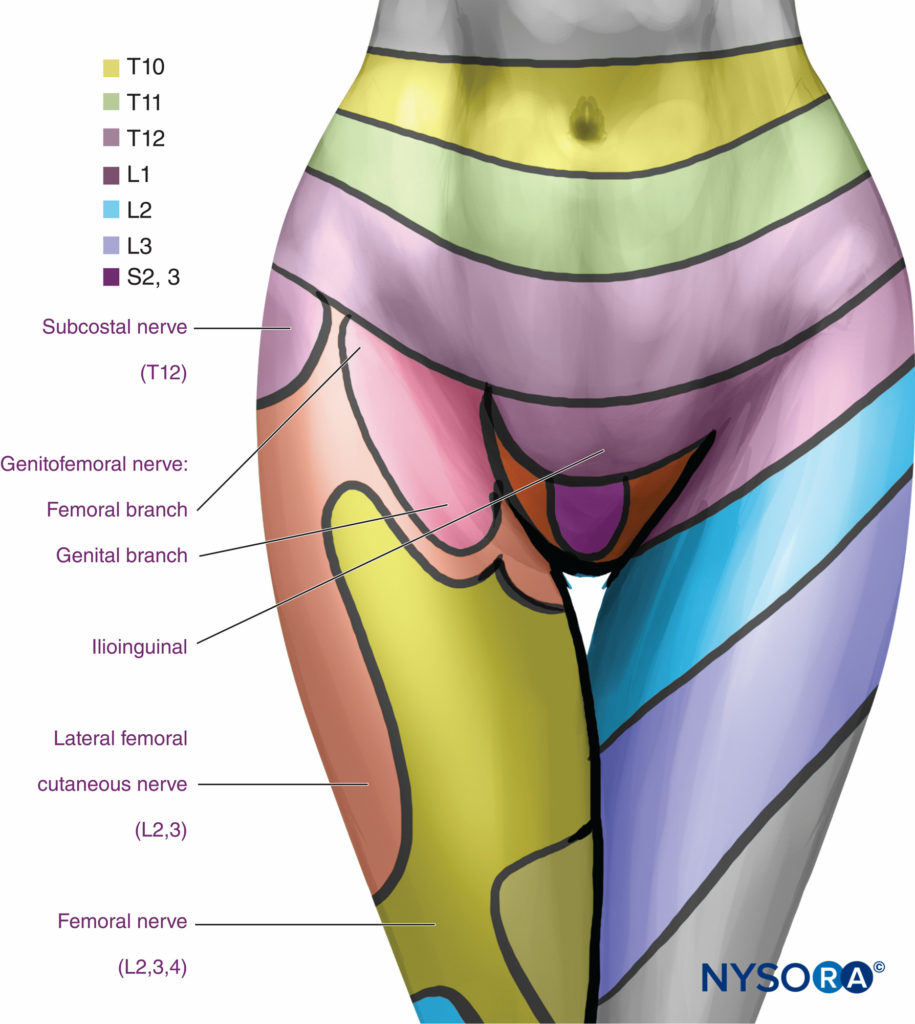
ABBILDUNG 16. Segmentale Verteilung der Anästhesie mit lumbalen paravertebralen Ebenen.
Eine ipsilaterale Sympathikusblockade kann auch aufgrund einer epiduralen Ausbreitung oder einer Ausbreitung des Lokalanästhetikums nach anterior über die Sehnenbögen zu den Rami Communicantes oder der lumbalen Sympathikuskette auftreten.
- Technik
Die lumbale paravertebrale Blockade kann im Sitzen, in Seitenlage oder in Bauchlage durchgeführt werden. Oberflächenmarkierungen müssen identifiziert und mit einem Hautmarker markiert werden, bevor der Block platziert wird. Der Dornfortsatz des Wirbels auf den zu blockierenden Ebenen stellt die Mittellinie dar, der Beckenkamm entspricht dem L3-L4-Zwischenraum und die Spitze des Schulterblatts entspricht dem T7-Dornfortsatz. Hautmarkierungen werden auch 2.5 cm lateral der Mittellinie an den zu blockierenden Ebenen angebracht (Abbildung 17A) oder man kann 2.5 cm lateral zur Mittellinie eine Linie ziehen und entlang dieser Linie die Injektionen durchführen (Abbildung 17B und C).
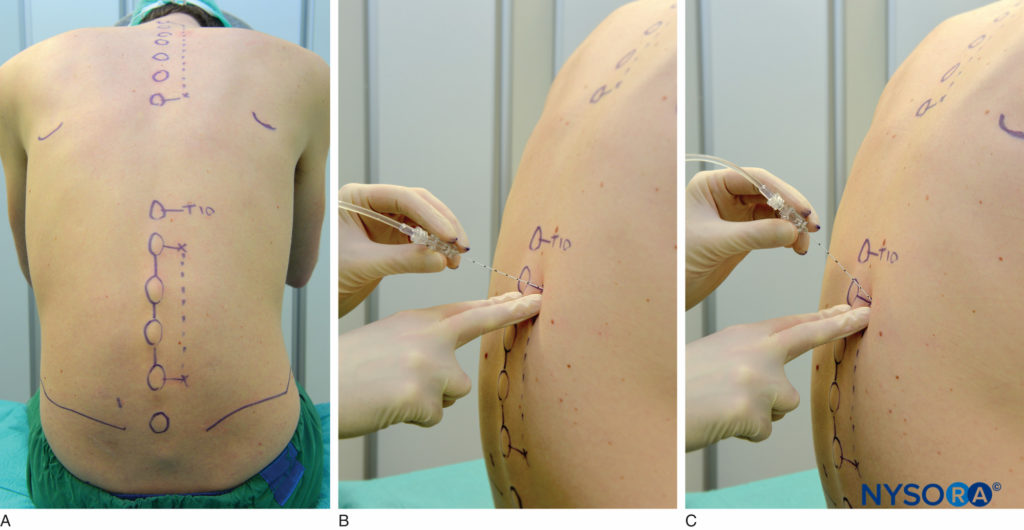
ABBILDUNG 17. A: Oberflächenmarkierungen und Nadeleinstichstellen für lumbalen paravertebralen Block. B und C: Nadeleinführung.
A Standard-Regionalanästhesie Tablett ist vorbereitet; Während der Blockierung sollte strenge Asepsis eingehalten werden. Eine 8-cm-22-Gauge-Nadel mit Tuohy-Spitze (vgl Abbildung 1–8) wird für LPVB verwendet. Ähnlich wie bei den Empfehlungen für TPVB ist die Verwendung von Nadeln mit Tiefenmarkierungen auf dem Nadelschaft oder einem die Tiefe anzeigenden Schutz (vgl Abbildung 1–8) ist empfohlen. Das Vorschieben der Nadel um eine fest vorgegebene Strecke (1.5–2.0 cm) über den Querfortsatz hinaus, ohne Parästhesien auszulösen, ist die am häufigsten verwendete Methode zur Durchführung von LPVB. Die Blocknadel wird senkrecht zur Haut eingestochen, bis der Querfortsatz berührt wird. Die Kontakttiefe des Querfortsatzes ist variabel (4–6 cm) und hängt vom Körperbau des Patienten ab. Sobald der Querfortsatz identifiziert ist, wird die Markierung auf der Nadel notiert oder die Tiefenmarkierung so eingestellt, dass sie 1.5–2.0 cm über der Tiefe des Hautquerfortsatzes liegt. Die Nadel wird dann bis zum subkutanen Gewebe zurückgezogen und in einem 10- bis 15-Grad-Winkel nach oben oder unten wieder eingeführt, so dass sie vom oberen oder unteren Rand des Querfortsatzes abgleitet, ähnlich wie bei der Technik beim thorakalen paravertebralen Block (siehe Figure 11). Die Nadel wird um weitere 1.5–2.0 cm über den Kontakt mit dem Querfortsatz hinaus oder bis zum Erreichen der Tiefenmarkierung vorgeschoben. Nach negativer Aspiration von Blut oder Liquor wird das Lokalanästhetikum injiziert. Da die Ausbreitung des Lokalanästhetikums nach einer einzigen großvolumigen lumbalen paravertebralen Injektion nicht vorhersehbar ist, wird häufiger die Mehrfachinjektionstechnik verwendet, bei der 4–5 ml Lokalanästhetikum auf jeder Ebene injiziert werden.
Wahl des Lokalanästhetikums
Wie bei TPVB werden bei LPVB üblicherweise lang wirkende Lokalanästhetika wie Bupivacain 0.5 %, Ropivacain 0.5 % oder Levobupivacain 0.5 % verwendet. Bei einer Mehrfachinjektion LPVB werden auf jeder Ebene 4–5 ml des Lokalanästhetikums injiziert. Die Anästhesie entwickelt sich in etwa 15–30 Minuten und dauert 3–6 h. Die Analgesie ist ebenfalls langanhaltend (12–18 h) und überdauert in der Regel die Narkosedauer. Es liegen keine Daten zur Pharmakokinetik von Lokalanästhetika nach LPVB vor. Dennoch kann die Zugabe von Epinephrin (2.5–5.0 µg/ml) zum Lokalanästhetikum die systemische Resorption verringern und das Toxizitätspotenzial verringern.
Indikationen und Kontraindikationen
LPVB wird üblicherweise in Kombination mit TPVB (T10 bis L2) zur chirurgischen Anästhesie während einer Leistenbruchhernie verwendet. Es kann auch zur Rettung von Patienten mit starken Schmerzen nach einem Hüfttotalersatz eingesetzt werden. Es kann auch zu diagnostischen Zwecken während der Beurteilung von Leisten- oder Genitalschmerzen verwendet werden, z. B. nach einem Nerveneinklemmungssyndrom nach einer Leistenhernienoperation.
Die Kontraindikationen für LPVB sind ähnlich wie bei TPVB, aber bei Patienten, die es sind, ist Vorsicht geboten antikoaguliert oder erhalten prophylaktische Antikoagulanzien, da über Psoas-Hämatome mit lumbaler Plexopathie berichtet wurde.
Komplikationen und wie man sie vermeidet
Veröffentlichte Daten deuten darauf hin, dass Komplikationen nach LPVB selten sind. Dennoch ist es möglich, während der LPVB versehentlich ein Lokalanästhetikum in den intravaskulären, epiduralen oder intrathekalen Raum zu injizieren, und dies kann häufiger vorkommen, wenn die Nadel nach medial gerichtet ist. Daher sollte die Richtung der Blocknadel während des Einführens senkrecht zur Haut gehalten und eine mediale Angulation vermieden werden. Eine intraperitoneale Injektion oder eine viszerale Verletzung (Niere) können ebenfalls auftreten, obwohl dies nur als Folge eines groben technischen Fehlers auftreten kann. Bei Blockade des Spinalnerven L2 (N. femoralis L2–L4) kann es zu einer motorischen Schwäche des ipsilateralen Quadrizepsmuskels kommen.
ZUSAMMENFASSUNG
Eine angemessene Ausbildung ist erforderlich, um stereotaktische Techniken zu erwerben, die für eine hohe Erfolgsquote erforderlich sind. Die thorakale paravertebrale Blockade erzeugt eine einseitige somatische und sympathische Nervenblockade, die für die chirurgische Anästhesie während einer Brustoperation und für die Analgesie geeignet ist, wenn der Schmerz einseitigen Ursprungs in der Brust oder im Abdomen ist. Es wurde auch als analgetische Notfalltherapie bei Patienten mit Rippenfrakturen und Beeinträchtigung der Atemwege beschrieben. Der lumbale paravertebrale Block wird in der klinischen Praxis weniger häufig verwendet. Als thorakolumbaler paravertebraler Block ist es für die chirurgische Anästhesie während der Leistenherniorrhaphie wirksam.
Die hämodynamische Stabilität wird normalerweise nach einer paravertebralen Blockade aufgrund der einseitigen Natur der Sympathikusblockade aufrechterhalten. Die motorische Funktion der Blase und der unteren Extremitäten bleibt ebenfalls erhalten, und während der postoperativen Phase ist keine zusätzliche pflegerische Wachsamkeit erforderlich. Auch über erfolgreiche klinische Anwendungen einer bilateralen paravertebralen Blockade wurde berichtet.
REFERENZEN
- Karmakar MK: Thorakale paravertebrale Blockade. Anesthesiology 2001;95:771–780.
- Richardson J, Lonnqvist PA: Thorakale paravertebrale Blockade. Br. J. Anaesth 1998;81:230–238.
- Cheema SP, Ilsley D, Richardson J, et al: Eine thermografische Studie zur paravertebralen Analgesie. Anästhesie 1995;50:118–121.
- Eason MJ, Wyatt R: Paravertebrale Thoraxblockade – eine Neubewertung. Anästhesie 1979;34:638–642.
- Coveney E, Weltz CR, Greengrass R, et al: Verwendung der paravertebralen Blockanästhesie bei der chirurgischen Behandlung von Brustkrebs: Erfahrung in 156 Fällen. Ann Surg 1998;227:496–501.
- Greengrass R, O'Brien F, Lyerly K, et al: Paravertebraler Block für Brustkrebsoperationen. Can J Anaesth 1996;43:858–861.
- Klein SM, Bergh A, Steele SM, et al: Thoracic Paravertebral Block for Breast Surgery. Anesth Analg 2000;90:1402–1405.
- Karmakar MK, Booker PD, Franks R, et al: Kontinuierliche extrapleurale paravertebrale Infusion von Bupivacain zur Post-Thorakotomie-Analgesie bei jungen Säuglingen. Br. J. Anaesth 1996;76:811–815.
- Lonnquist PA, Hesser U: Radiologische und klinische Verteilung der thorakalen paravertebralen Blockade bei Säuglingen und Kindern. Paediatr Anaesth 1993;3: 83–87.
- Lonnqvist PA: Kontinuierlicher paravertebraler Block bei Kindern. Erste Erfahrungen [siehe Kommentare]. Anästhesie 1992;47:607–609.
- Dugan DJ, Samson PC: Chirurgische Bedeutung der endothorakalen Faszie. Die anatomische Grundlage für Empyemektomie und andere extrapleurale Techniken. Am J Surg 1975;130:151–158.
- Karmakar MK, Kwok WH, Kew J: Thorakale paravertebrale Blockade: radiologischer Nachweis einer kontralateralen Ausbreitung anterior zu den Wirbelkörpern. Br. J. Anaesth 2000;84:263–265.
- Karmakar MK, Chung DC: Variabilität eines thorakalen paravertebralen Blocks. Ignorieren wir die endothorakale Faszie? [Buchstabe]. Reg Anesth Pain Med 2000;25:325–327.
- Moore DC, Bush WH, Scurlock JE: Interkostale Nervenblockade: eine röntgenographische anatomische Studie über Technik und Absorption beim Menschen. Anesth Analg 1980;59:815–825.
- Tenicela R, Pollan SB: Paravertebral-peridurale Blocktechnik: ein einseitiger Thoraxblock. Clin J. Pain 1990;6:227–234.
- Nunn JF, Slavin G: Posteriore Interkostalnervenblockade zur Schmerzlinderung nach Cholezystektomie. Anatomische Grundlagen und Wirksamkeit. Br. J. Anaesth 1980;52:253–260.
- Conacher ID: Harzinjektion von thorakalen paravertebralen Räumen. Br. J. Anaesth 1988;61:657–661.
- Purcell-Jones G, Pither CE, Justins DM: Paravertebrale somatische Nervenblockade: eine klinische, radiologische und computertomografische Studie bei chronischen Schmerzpatienten. Anesth Analg 1989;68:32–39.
- Karmakar MK, Gin T, Ho AM: Ipsilaterale thorako-lumbale Anästhesie und paravertebrale Ausbreitung nach niedriger thorakaler paravertebraler Injektion. Br. J. Anaesth 2001;87:312–316.
- Saito T, Gallagher ET, Cutler S, et al: Erweiterte einseitige Anästhesie. Neue Technik oder paravertebrale Anästhesie? Reg Anesth 1996;21:304–307.
- Saito T, Den S, Tanuma K, et al: Anatomische Grundlagen für die paravertebrale Anästhesieblockade: Flüssigkeitskommunikation zwischen den thorakalen und lumbalen paravertebralen Regionen. Surg Radiol Anat 1999;21:359–363.
- Karmakar MK, Critchley LA, Ho AM, et al: Kontinuierliche thorakale paravertebrale Infusion von Bupivacain zur Schmerzbehandlung bei Patienten mit mehreren gebrochenen Rippen. Chest 2003;123:424–431.
- Gilbert J, Hultman J: Thorakale paravertebrale Blockade: eine Methode zur Schmerzkontrolle. Acta Anaesthesiol Scand 1989;33:142–145.
- Richardson J, Jones J, Atkinson R: Die Wirkung der thorakalen paravertebralen Blockade auf die interkostalen somatosensorisch evozierten Potentiale. Anesth Analg 1998;87:373–376.
- Sabanathan S, Smith PJ, Pradhan GN, et al: Kontinuierliche Interkostalnervenblockade zur Schmerzlinderung nach Thorakotomie. Ann Thorac Surg 1988;46:425–426.
- Richardson J, Sabanathan S, Jones J, et al: Ein prospektiver, randomisierter Vergleich von präoperativem und kontinuierlichem ausgewogenem epiduralem oder paravertebralem Bupivacain auf Schmerzen nach Thorakotomie, Lungenfunktion und Stressreaktionen. Br. J. Anaesth 1999;83:387–392.
- Weltz CR, Greengrass RA, Lyerly HK: Ambulantes chirurgisches Management von Brustkrebs mit paravertebralem Block. Ann Surg 1995;222:19–26.
- Sabanathan S, Mearns AJ, Bickford SP, et al: Wirksamkeit einer kontinuierlichen extrapleuralen Interkostalnervenblockade bei Post-Thorakotomie-Schmerzen und Lungenmechanik. Br. J. Surg 1990;77:221–225.
- Matthews PJ, Govenden V: Vergleich von kontinuierlichen paravertebralen und extraduralen Infusionen von Bupivacain zur Schmerzlinderung nach Thorakotomie. Br. J. Anaesth 1989;62:204–205.
- Carabine UA, Gilliland H, Johnston JR, et al: Schmerzlinderung bei Thorakotomie. Vergleich des Morphinbedarfs unter Verwendung einer extrapleuralen Infusion von Bupivacain. Reg Anesth 1995;20:412–417.
- Karmakar MK, Chui PT, Joynt GM, et al: Thorakale paravertebrale Blockade zur Behandlung von Schmerzen im Zusammenhang mit mehreren Rippenbrüchen bei Patienten mit gleichzeitigem Lendenwirbelsäulentrauma. Reg Anesth Pain Med 2001;26:169–173.
- Dauphin A, Gupta RN, Young JE, et al: Serum-Bupivacain-Konzentrationen während kontinuierlicher extrapleuraler Infusion. Can J Anaesth 1997;44: 367–370.
- Berrisford RG, Sabanathan S, Mearns AJ, et al: Plasmakonzentrationen von Bupivacain und seinen Enantiomeren während einer kontinuierlichen extrapleuralen Interkostalnervenblockade. Br. J. Anaesth 1993;70:201–204.
- Clark BJ, Hamdi A, Berrisford RG, et al.: Umkehrphasen- und chiraler Hochleistungs-Flüssigkeitschromatographie-Assay von Bupivacain und seinen
Enantiomere in klinischen Proben nach kontinuierlicher extrapluraler Infusion. J Chromatogr 1991;553:383–390. - Lonnqvist PA, MacKenzie J, Soni AK, et al: Paravertebrale Blockade. Ausfallrate und Komplikationen. Anästhesie 1995;50:813–815.
- Richardson J, Sabanathan S: Thorakale paravertebrale Analgesie. Acta Anaesthesiol Scand 1995;39:1005–1015.
- Farny J, Drolet P, Girard M: Anatomie des hinteren Zugangs zum lumbalen Plexusblock. Can J Anaesth 1994;41:480–485.
- Klein SM, Greengrass RA, Weltz C, et al: Paravertebrale somatische Nervenblockade für ambulante inguinale Herniorrhaphy: ein erweiterter Fallbericht von 22 Patienten. Reg Anesth Pain Med 1998;23:306–310.
- Wassef MR, Randazzo T, Ward W: Die paravertebrale Nervenwurzelblockade bei Leistenbruch – ein Vergleich mit dem Field-Block-Ansatz. Reg Anesth Pain Med 1998;23:451–456.
- Murata H, Salviz EA, Chen S, Vandepitte C, Hadzic A. Fallbericht: Ultraschallgeführte kontinuierliche thorakale paravertebrale Blockade zur ambulanten akuten Schmerzbehandlung von einseitigen Rippenfrakturen auf mehreren Ebenen Anesth Analg. Januar 2013;116(1):255–257.

