John ButterworthIV
EINFÜHRUNG
Lokale und regionale Anästhesie und Analgesie scheinen eine Renaissance zu erleben, was sich an der Teilnahme an Fachtagungen und der erheblichen Zunahme der Forschungsaktivität zeigt, was sich in der wachsenden Zahl wissenschaftlicher Veröffentlichungen zeigt. Im Gegensatz zur Vollnarkose, bei der der molekulare Mechanismus weiterhin Gegenstand von Spekulationen ist, wurde die Stelle, an der Lokalanästhetika (LA) binden und Nervenblockaden erzeugen, geklont und mutiert. Dieses Kapitel konzentriert sich auf Mechanismen von Anästhesie und Toxizität, insbesondere da die Kenntnis dieser Mechanismen dem Kliniker helfen wird, eine sicherere und effektivere Regionalanästhesie durchzuführen.
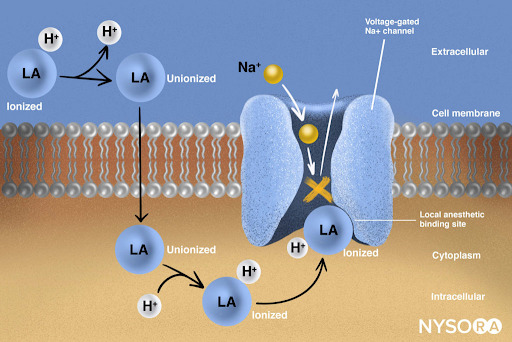
Aus dem Kompendium der Regionalanästhesie: Wirkmechanismus der Lokalanästhetika. Lokalanästhetika wirken, indem sie an die α-Untereinheit der spannungsgesteuerten Na+-Kanäle binden und so die Erzeugung und Weiterleitung von Nervenimpulsen verhindern. Anschließend können Na+-Ionen nicht in die Zelle fließen, wodurch die Weiterleitung der fortschreitenden Depolarisationswelle entlang des Nervs gestoppt wird. Der Anteil der Lokalanästhesiemoleküle liegt in ionisierter Form vor. Lokalanästhetische Moleküle ändern sich im Bruchteil einer Sekunde von ionisiert zu unionisiert.
Aus dem Kompendium der Regionalanästhesie: Infografik zum Wirkmechanismus von Lokalanästhetika.
VORGESCHICHTE UND GESCHICHTE
Die Inkas betrachteten Coca als Geschenk des Sohnes des Sonnengottes und beschränkten ihre Verwendung auf die „obere Schicht“ der Gesellschaft. Sie erkannten und nutzten die medizinischen Eigenschaften von Kokain, lange bevor die Verbindung nach Europa gebracht wurde, um ihre Eigenschaften zu „entdecken“. Die Inkas behandelten hartnäckige Kopfschmerzen manchmal mit einer Trepanation, und gelegentlich wurde Koka verwendet, um dieses Verfahren zu erleichtern. Lokalanästhesie wurde erreicht, indem der Operateur Kokablätter kaute und das mazerierte Fruchtfleisch auf die Haut und die Wundränder auftrug, während er ein Tumi-Messer verwendete, um durch den Knochen zu bohren. Im sechzehnten Jahrhundert begannen die Konquistadoren, nachdem sie die Inka-Gesellschaft gestört hatten, Arbeiter mit Kokainpaste zu bezahlen.
Die Arbeiter rollten die Kokainblätter im Allgemeinen zu Kugeln (Cocadas genannt), die durch Guano oder Maisstärke zusammengebunden wurden. Diese Cocadas setzten das freie Kokain als Folge der Alkalität des Guanos und des Kauens der Cocadas mit Asche oder Kalk frei (solche alkalischen Verbindungen erhöhen den pH-Wert und begünstigen die freie Kokainform gegenüber dem positiv geladenen Hydrochloridsalz) . Diese Praxis markiert wahrscheinlich die Geburtsstunde des „freien“ Kokains und ist der historische Vorläufer des „Rock“- oder „Crack“-Kokains, das in westlichen Gesellschaften so oft missbraucht wird. Kokain wurde von einem Entdecker/Arzt namens Scherzer nach Wien zurückgebracht. In Wien isolierte und kristallisierte der Chemiker Albert Niemann 1860 reines Kokainhydrochlorid. Die Firma Merck verteilte Chargen dieses Mittels zu Forschungszwecken an Ärzte. Sigmund Freud war der prominenteste dieser Kokain-Experimentatoren. Freud hat seine experimentelle Arbeit in einer dem Kokain gewidmeten Monographie Über Coca rezensiert. Freud und Carl Koller (Augenarzt in Ausbildung) nahmen Kokain oral ein und stellten fest, dass die Droge ihre Zunge unempfindlich machte. Koller und Joseph Gartner begannen eine Reihe von Experimenten mit Kokain, um eine topische Anästhesie der Bindehaut zu erzeugen.
Die Geburtsstunde der Lokal- und Regionalanästhesie geht auf das Jahr 1884 zurück, als Koller und Gartner über ihren Erfolg bei der Herstellung einer topischen Kokainanästhesie des Auges bei Frosch, Kaninchen, Hund und Mensch berichteten. Die Anwendung der Lokalanästhesie verbreitete sich schnell auf der ganzen Welt. Der amerikanische Chirurg William Halsted vom Roosevelt Hospital in New York berichtete über die Verwendung von Kokain zur Herstellung mandibuläre Nervenblockade im Jahr 1884 und um weniger als ein Jahr später einen Plexus-brachialis-Block zu erzeugen. Diese Blockaden wurden durchgeführt, indem die Nerven chirurgisch freigelegt und dann unter direkter Sicht injiziert wurden. Leonard Corning injizierte Kokain in die Nähe des Rückgrats von Hunden und produzierte wahrscheinlich das erste Epidural im Jahr 1885. Die Spina-Anästhesie mit Kokain wurde erstmals 1898 von August Bier durchgeführt. Kokain Spinalanästhesie wurde 1898 zur Behandlung von Krebsschmerzen eingesetzt. Die kaudale Epiduralanästhesie wurde 1902 von Sicard und Cathelin eingeführt. Bier beschrieben intravenöse Regionalanästhesie im Jahr 1909. 1911 berichtete Hirschel über die ersten drei perkutanen Anästhesien des Plexus brachialis. Fidel Pages berichtete 1921 über die Verwendung einer Epiduralanästhesie bei Bauchoperationen. Kokain wurde bald in viele andere Produkte eingearbeitet, einschließlich der ursprünglichen Formulierung von Coca-Cola, die 1886 von Pemberton entwickelt wurde.Figure 1). Diese Praxis endete, als Kokain Anfang des 1900. Jahrhunderts vom Vorläufer der Food and Drug Administration (FDA) reguliert wurde.

ABBILDUNG 1. Beispiele für Produkte, die Kokain in der Zeit enthielten, bevor es zu einer kontrollierten Substanz wurde. Als „Tonika“ waren mit Kokain angereicherte Weine besonders beliebt. (Verwendet mit Genehmigung der Addiction Research Unit, University of Buffalo.)
MEDIZINISCHE CHEMIE
Kokain und alle anderen LAs enthalten einen aromatischen Ring und ein Amin an entgegengesetzten Enden des Moleküls, getrennt durch eine Kohlenwasserstoffkette, und entweder eine Ester- oder eine Amidbindung (Figure 2). Kokain, der archetypische Ester, ist das einzige natürlich vorkommende LA. Procain, der erste synthetische Ester LA, wurde 1904 von Einhorn eingeführt. Die Einführung des Amids LA Lidocain im Jahr 1948 war transformativ. Lidocain wurde schnell für alle Formen der Regionalanästhesie verwendet. Später tauchten andere Amid-LAs auf, die auf der Lidocainstruktur (Prilocain, Etidocain) basierten. Eine verwandte Reihe von Amid-LAs auf Basis von 2',6'-Pipecoloxylidid wurde eingeführt (Mepivacain, Bupivacain, Ropivacain und Levobupivacain). Ropivacain und Levobupivacain sind die einzigen im Handel erhältlichen LAs mit einem einzelnen Enantiomer (einzelnes optisches Isomer). Beide sind S(–)-Enantiomere, wodurch die erhöhte Herztoxizität vermieden wird, die mit racemischen Mischungen und den R(+)-Isomeren verbunden ist (dies wird in einem nachfolgenden Abschnitt diskutiert). Alle anderen LAs liegen entweder als Racemate vor oder haben keine asymmetrischen Kohlenstoffe.
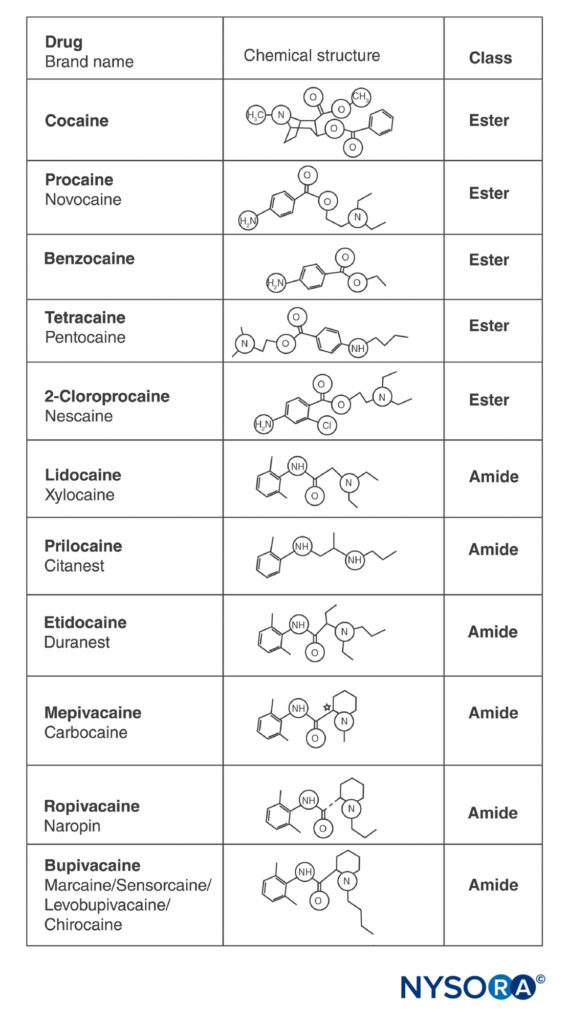
ABBILDUNG 2. Strukturen häufig verwendeter Lokalanästhetika.
NYSORA-Tipps
- Alle LAs enthalten einen aromatischen Ring und ein Amin an gegenüberliegenden Enden des Moleküls, getrennt durch eine Kohlenwasserstoffkette und entweder eine Ester- oder eine Amidbindung.
BIOPHYSIK VON SPANNUNGSGEGRENZTEN NATRIUMKANÄLEN UND LOKALEN ANÄSTHETIK
Studien der Mechanismen der LA-Wirkung auf periphere Nerven sind Studien der Wechselwirkungen zwischen LAs und spannungsgesteuerten Na-Kanälen, da Na-Kanäle die LA-Bindungsstelle enthalten. Na-Kanäle sind integrale Membranproteine, die Aktionspotentiale initiieren und weiterleiten Axone, Dendriten und Muskelgewebe; Initiierung und Aufrechterhaltung von Membranpotentialoszillationen in spezialisierten Herz- und Gehirnzellen; und formt und filtert synaptische Eingaben. Na-Kanäle teilen strukturelle Merkmale mit anderen ähnlichen spannungsgesteuerten Ionenkanälen, die als Tetramere existieren, von denen jeder sechs helikale Transmembransegmente aufweist (z. B. spannungsgesteuerte Ca- und K-Kanäle). Na-Kanäle enthalten eine größere α-Untereinheit und eine oder zwei kleinere β-Untereinheiten, abhängig von der Spezies und dem Ursprungsgewebe. Die α-Untereinheit, der Ort der Ionenleitung und LA-Bindung, hat vier homologe Domänen mit jeweils sechs α-helikalen membranüberspannenden Segmenten (Figure 3). Die äußere Oberfläche der α-Untereinheit ist stark glykosyliert, was dazu dient, den Kanal richtig innerhalb der Plasmamembran auszurichten (Figure 4). Wirbellose haben nur ein oder zwei Gene für die α-Untereinheit des Na-Kanals, und die normale physiologische Rolle dieser Kanäle ist unklar (Tiere überleben, wenn die Kanäle nicht vorhanden sind).
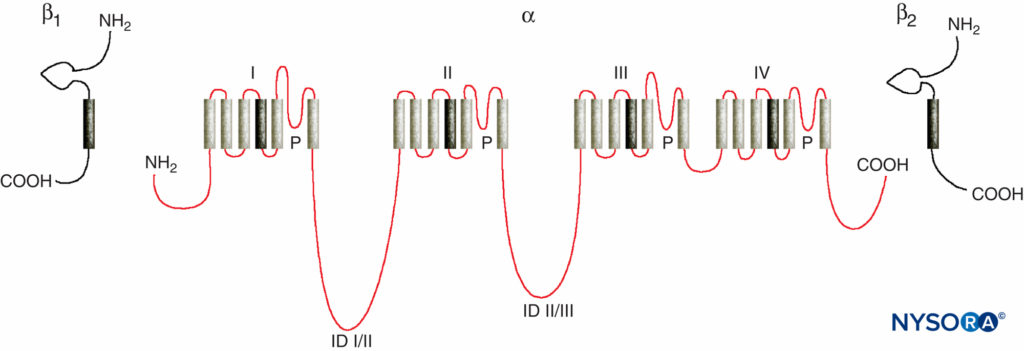
ABBILDUNG 3. „Cartoon“-Struktur von Na-Kanal-Untereinheiten. Beachten Sie, dass die α-Untereinheit vier Domänen hat, die jeweils sechs membranüberspannende Segmente enthalten. (Wiedergabe mit freundlicher Genehmigung von Plummer NW, Meisler MH: Evolution anddiversityofsäugetiernatriumkanalgene. Genomics. 1999 Apr 15;57(2):323-331.)
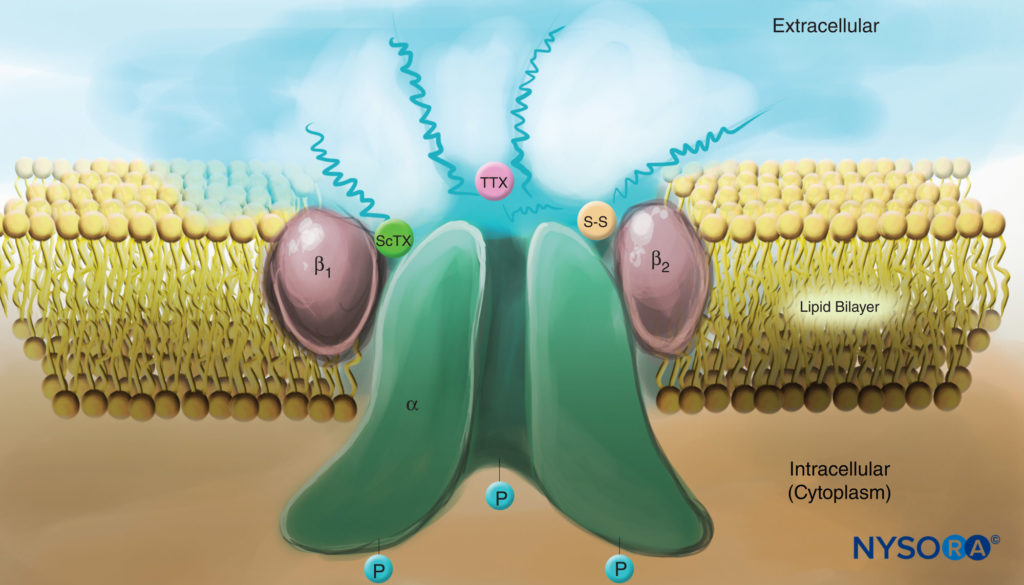
ABBILDUNG 4. Cartoon eines Na-Kanals in der Plasmamembran. Beachten Sie, dass alle drei Untereinheiten auf der extrazellulären Seite stark glykosyliert sind (siehe „Schnörkel“-Linien). Beachten Sie, dass im Gegensatz zu Lokalanästhetika sowohl Skorpiontoxine (ScTX) als auch Tetrodotoxin (TTX) Bindungsstellen an der äußeren Oberfläche des Kanals haben. Beachten Sie auch, dass die zytoplasmatische Seite des Kanals phosphoryliert ist. (Wiedergegeben mit Genehmigung von Catterall WA: Cellular and Molecular Biology of Voltage-Gated Sodium Channels. Physiol Rev. 1992 Oct;72(4 Suppl):S15-S48.)
TABELLE 1. Spannungsgesteuerter Na-Kanal – neurale Isoformen.
| Nav 1.1 | Nav 1.2 | Nav 1.3 | Nav 1.6 | Nav 1.7 | Nav 1.8 | Nav 1.9 | |
|---|---|---|---|---|---|---|---|
| Chromosom | 2 | 2 | 2 | 12 | 2 | 3 | 3 |
| Wo identifiziert | ZNS, DRG | CNS | ZNS hochreguliert, nach Verletzung | DRG (groß und klein), CNS, Ranvier | DRG (groß und klein) | DRG (klein) | DRG (klein) |
| Inaktivierung | Schnell | Schnell | Schnell | Schnell | Schnell | Bremst | Bremst |
| Ttx | Empfindliche | Empfindliche | Empfindliche | Empfindliche | Empfindliche | Unempfindlich | Unempfindlich |
Quelle: Angepasst mit Genehmigung von Novakovic SD, Eglen RM, Hunter JC: Regulation of Na+ channel distribution in the nerve system. Trends Neurosci. August 2001;24(8):473-478.
Im Gegensatz dazu haben Menschen neun aktive Gene für die α-Untereinheit des Na-Kanals auf vier Chromosomen mit zellspezifischer Expression und Lokalisierung von Genprodukten.10 Das Nav 1.4-Gen (konventionell bezeichnen Genetiker spannungsgesteuerte Na-Kanal-Isoformen als Nav 1.x) versorgt die Skelettmuskulatur mit Kanälen und die Nav 1.5-Gen versorgt den Herzmuskel mit Kanälen und hinterlässt sieben Nav Isoformen in Nervengewebe (Tabelle 1). Definierte Gene tragen spezifische Na-Kanalformen zu jedem der unmyelinisierten Axone, Ranvier-Knoten in motorischen Axonen und kleinen Spinalganglion-Nozizeptoren bei. Während alle α-Untereinheiten des Na-Kanals LAs in ähnlicher Weise binden, variiert ihre Affinität zur Bindung von Neurotoxinen. Mutationen der α- und β-Untereinheit des Na-Kanals führen zu Muskel-, Herz- und Nervenerkrankungen. Zum Beispiel vererbte Mutationen in Nav 1.5 wurden mit angeborenem Long-QT-Syndrom, Bruguda-Syndrom und anderen Erkrankungen des Reizleitungssystems in Verbindung gebracht. Es wurde gezeigt, dass bestimmte Nav Isoformen vermehren sich in Tiermodellen für chronische Schmerzen. Die Existenz spezifischer Nav Gen-α-Untereinheit-Produkte bietet die verlockende Möglichkeit, dass eines Tages Inhibitoren für jedes spezifische Na entwickelt werden könnenv Form der α-Untereinheit. Solche Entwicklungen, die für einige Nav-Isoformen bereits im Gange sind, könnten die Behandlung chronischer Schmerzen revolutionieren. Das Blockieren von Impulsen in einer Nervenfaser erfordert, dass eine definierte Nervenlänge unerregbar wird (um zu verhindern, dass der Impuls das blockierte Segment „überspringt“). Wenn also die LA-Konzentration zunimmt, muss sie entlang einer kürzeren Länge des Nervs angewendet werden, um eine Impulsleitung zu verhindern, wie in gezeigt Figure 5. Sowohl die normale Überleitung als auch die Art und Weise, wie LAs die Überleitung hemmen, unterscheiden sich zwischen myelinisierten und unmyelinisierten Nervenfasern. Die Leitung in myelinisierten Fasern erfolgt in Sprüngen von einem Ranvier-Knoten zum nächsten, ein Prozess, der als Saltatorische Leitung bezeichnet wird. Um Impulse in myelinisierten Nervenfasern zu blockieren, müssen LAs im Allgemeinen Kanäle in drei aufeinanderfolgenden Ranvier-Knoten hemmen (Figure 6). Unmyelinisierte Fasern, denen der Saltator-Mechanismus fehlt, leiten viel langsamer als myelinisierte Fasern. Unmyelinisierte Fasern sind trotz ihres kleineren Durchmessers relativ resistent gegenüber LAs, da sich Na-Kanäle in ihren Plasmamembranen ausbreiten. Diese Unterschiede zwischen Nervenfasern entstehen während der Entwicklung, wenn sich Na-Kanäle an Ranvier-Knoten in myelinisierten Axonen zu sammeln beginnen. Die Knotenbildung von Kanälen, die für die Hochgeschwindigkeitssignalübertragung wesentlich ist, wird von Schwann-Zellen im peripheren Nervensystem und von Oligodendrozyten im Zentralnervensystem (ZNS) initiiert. Na-Kanäle können in mindestens drei nativen Konformationen existieren: „ruhend“, „offen“ und „inaktiviert“, zuerst beschrieben von Hodgkin und Huxley. Während eines Aktionspotentials öffnen sich kurzzeitig neuronale Na-Kanäle, wodurch extrazelluläre Na-Ionen in die Zelle strömen und die Plasmamembran depolarisieren. Nach nur wenigen Millisekunden inaktivieren Na-Kanäle (wobei der Na-Strom aufhört). Na-Kanäle kehren durch Membranrepolarisation in die Ruhekonformation zurück. Der Prozess, durch den Kanäle von leitenden zu nichtleitenden Formen übergehen, wird Gating genannt. Es wird angenommen, dass Gating aus Bewegungen von Dipolen als Reaktion auf Potentialänderungen resultiert. Der Prozess, durch den spannungsgesteuerte Kanäle arbeiten, beinhaltet wahrscheinlich Bewegungen von paddelförmigen Spannungssensoren innerhalb des äußeren Umfangs des Kanals (Figure 7). Die Geschwindigkeit von Gating-Prozessen unterscheidet sich zwischen Nav Formen der α-Untereinheit: Skelettmuskel- und Nervenformen öffnen sich schneller als Herzformen.
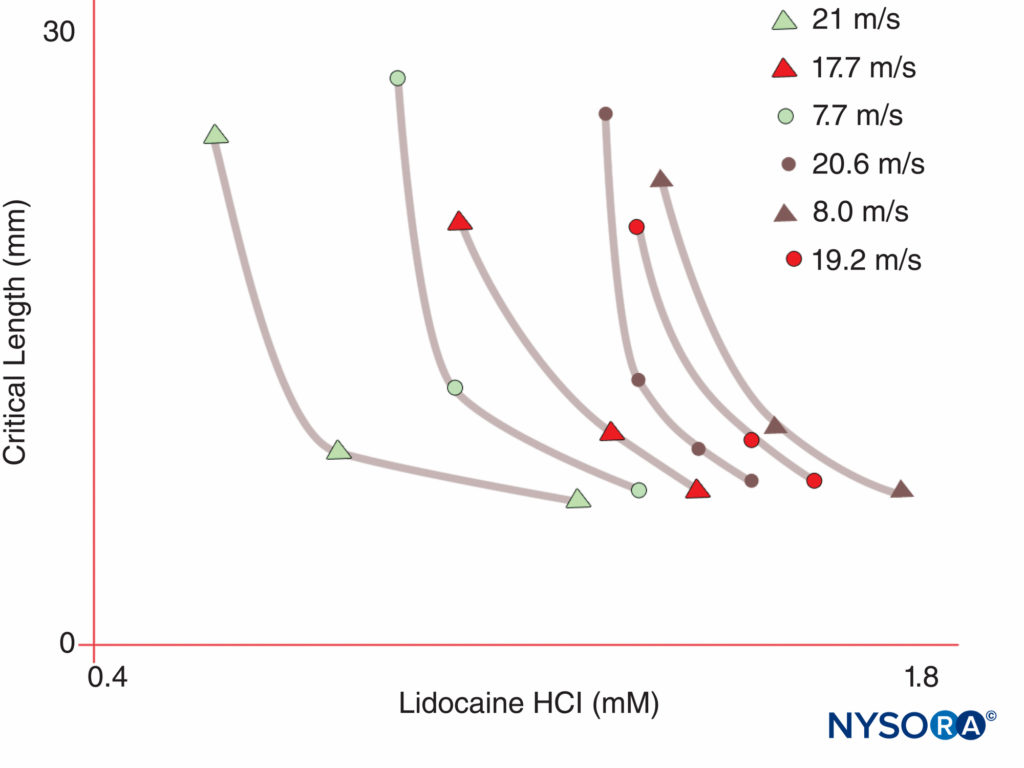
ABBILDUNG 5. Beachten Sie, dass die zur Erzeugung einer Nervenblockade erforderliche Konzentration des Lokalanästhetikums mit zunehmender Länge des dem Lokalanästhetikum ausgesetzten Nervs abnimmt. (Wiedergegeben mit Genehmigung von Raymond SA, Steffensen SC, Gugino LD, et al.: The role of length of nerve exponed to local anesthetics in impulse blocking action. Anesth Analg. 1989 May;68(5):563-570.)
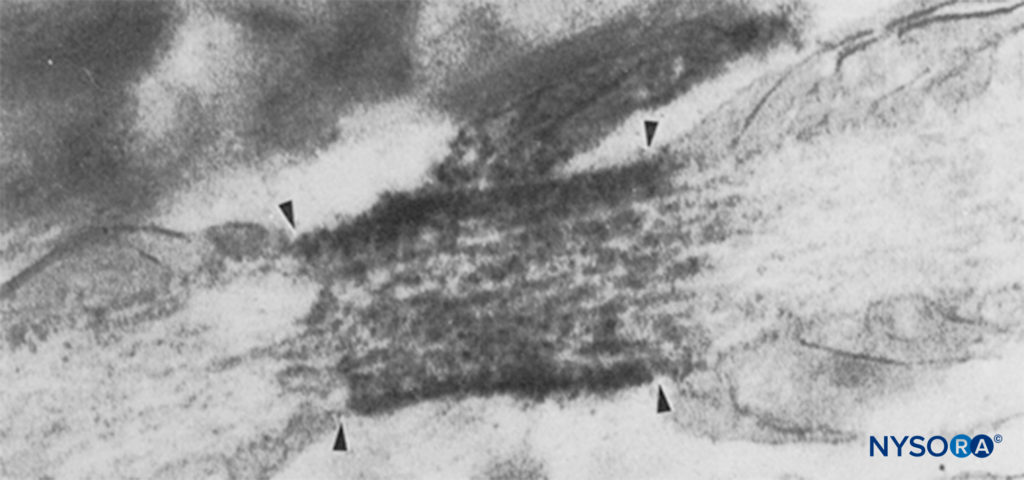
ABBILDUNG 6. Elektronenmikroskopische Aufnahme eines Knotens von Ranvier. Na-Kanäle wurden immunmarkiert und erscheinen als dichte Granula innerhalb der vier Pfeile. Die paranodale Region wird durch „pn“ angezeigt und ein Astrozyten wird durch „as“ angezeigt. (Wiedergegeben mit Genehmigung von Black JA, Friedman B, Waxman SG, et al.: Immunultrastructural localization of Natriumchannels at nodes of Ranvier and perinodal astro-cytes in rat optic nerve. Proc R Soc Lond B Biol Sci. 1989 Oct 23;238 (1290): 39-51.)
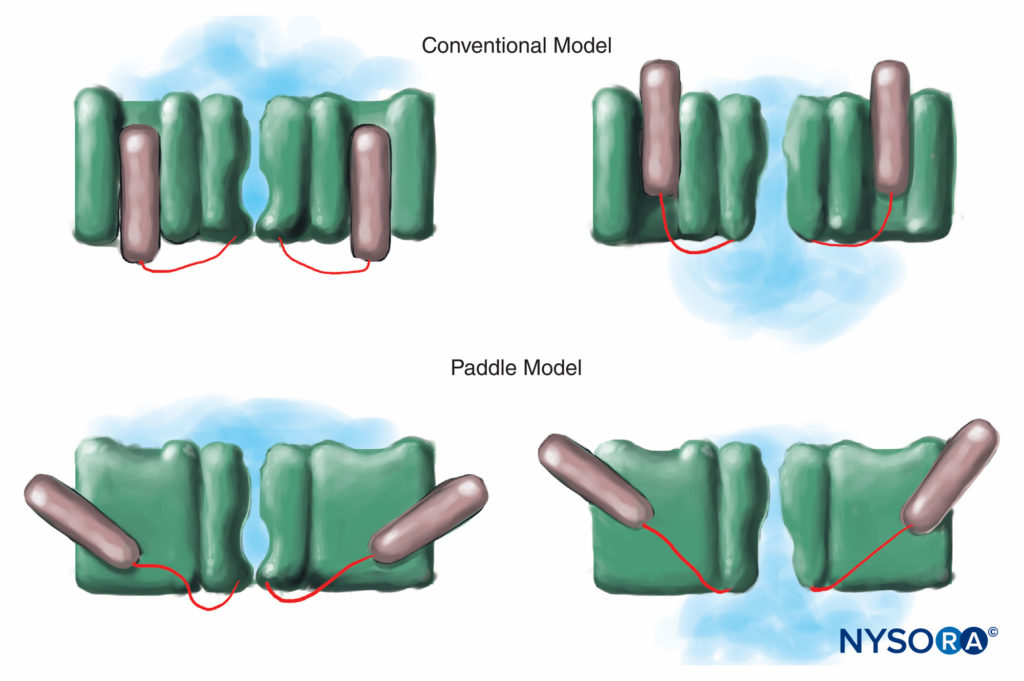
ABBILDUNG 7. Beim konventionellen Modell für Spannungs-Gating gleitet der spannungsmessende Teil des Kanals „in und aus“ der Membran. Neuere Röntgenbeugungsstudien des K-Kanals legen nahe, dass ein geeigneterer Mechanismus der von paddelartigen Strukturen ist, die diagonal durch die Plasmamembran gleiten. (Wiedergabe mit freundlicher Genehmigung von Arhem P: Voltage Sensing in Ion Channels: A 50-Year-Old Mystery Resolved? Lancet. 2004 Apr 10;363(9416):1221-1223.)
Eine Anästhesie entsteht, wenn LAs Na-Kanäle binden und die Na-Permeabilität hemmen, die den Aktionspotentialen zugrunde liegt. Unser Verständnis der LA-Mechanismen wurde durch mehrere wichtige Beobachtungen verfeinert. Taylor bestätigte, dass LAs selektiv Na-Kanäle in Nerven hemmen. Strichartz beobachtete erstmals eine nutzungsabhängige Blockierung mit LAs, was die Bedeutung der Kanalöffnung für die LA-Bindung zeigt. Die Nutzungs- (oder Frequenz-) Abhängigkeit beschreibt, wie die LA-Hemmung von Na-Strömen mit wiederholten Depolarisationen („Nutzung“) zunimmt. Wiederholte Folgen von Depolarisationen erhöhen die Wahrscheinlichkeit, dass ein LA auf einen offenen oder inaktivierten Na-Kanal trifft, wobei beide Formen eine größere LA-Affinität aufweisen als Ruhekanäle (Figure 8). Somit beeinflusst das Membranpotential sowohl die Na-Kanal-Konformation als auch die Na-Kanal-Affinität für LAs. Eine anwendungsabhängige Blockade scheint wichtig für die Funktion von LAs als Antiarrhythmika zu sein und kann auch der Wirksamkeit reduzierter LA-Konzentrationen bei der Schmerzbehandlung zugrunde liegen. Schließlich lokalisierten Ragsdale und Wang unter Verwendung von ortsgerichteter Mutagenese die LA-Bindung an spezifische Aminosäuren in D4S6 von Nav 1.2 und Nav 1.4. Einige optische LA-Isomere verleihen eine größere offensichtliche Sicherheit als ihr entgegengesetztes Enantiomer. Zum Beispiel hemmt das R(+)-Bupivacain-Isomer unter Spannungsklemme stärker kardiale Na-Ströme als das S(–)-Bupivacain (Levobupivacain)-Isomer (Figure 9). Viele andere Arten von Chemikalien binden und hemmen ebenfalls Na-Kanäle, darunter Vollnarkosemittel, Substanz-P-Hemmer, α2-adrenerge Agonisten, trizyklische Antidepressiva und Nervengifte. Nervengifte werden derzeit als möglicher Ersatz für LAs an Tieren und Menschen getestet.
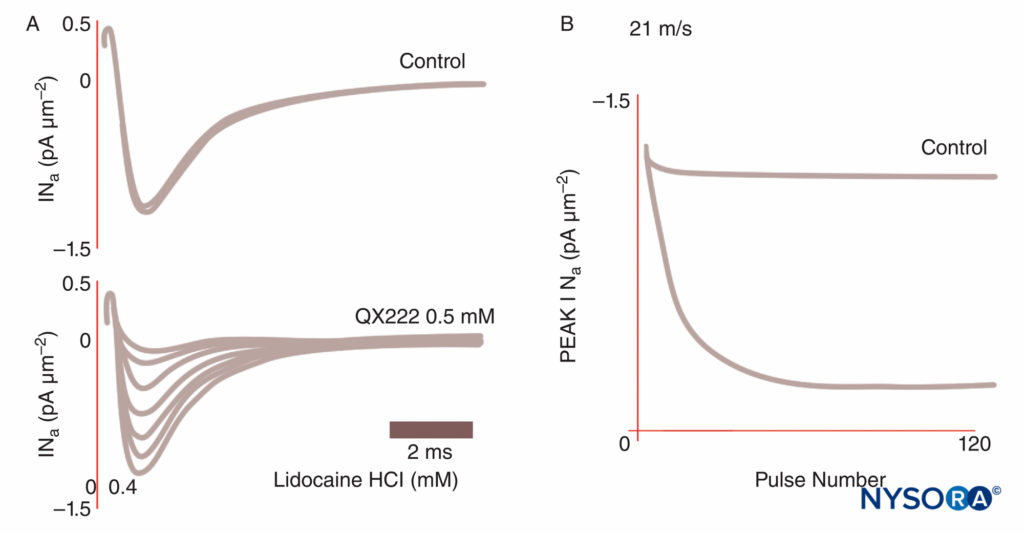
ABBILDUNG 8. Nutzungsabhängige Blockierung von Na-Strömen in Purkinje-Fasern. Unter Steuerbedingungen führt jeder einer Impulsfolge zu identischen Stromverläufen. In Gegenwart des Lokalanästhetikums QX222 hat der erste Impuls nahezu die gleiche Amplitude wie unter Kontrollbedingungen. Jeder nachfolgende Impuls ist kleiner (reduzierter Peak INa) und spiegelt einen sich anhäufenden Block von Na-Kanälen wider, bis ein Nadir erreicht ist. (Wiedergabe mit freundlicher Genehmigung von Hanck DA, Makielski JC, Sheets MF: Kinetic effects of quaternary lidocaine block of kardiale Natriumkanäle: eine Gating-Current-Studie. J Gen Physiol. 1994 Jan;103(1):19-43.)
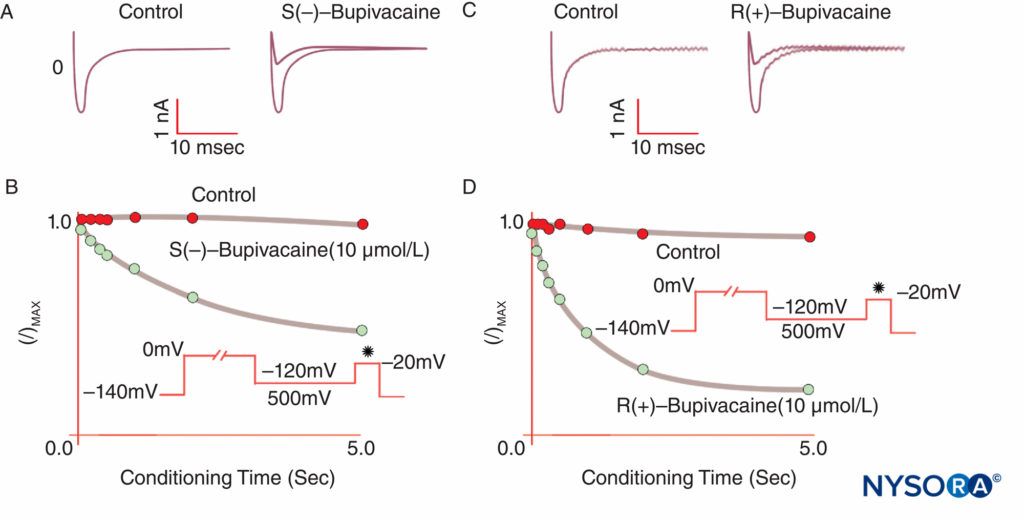
ABBILDUNG 9. Reduzierte Potenz von S(–)-Bupivacain im Vergleich zu R(+)-Bupivacain bei der Hemmung kardialer Na-Ströme unter Voltage-Clamp. Nach einer standardmäßigen „konditionierenden“ Depolarisation unterschiedlicher Länge erzeugt das S(–)-Isomer eine geringere Reduktion von I/Imax als das R(+)-Isomer. (Wiedergabe mit freundlicher Genehmigung von Valenzuela C., Snyders DJ, Bennett PB, et al.: Stereoselective block of kardiale Natriumkanäle durch Bupivacain in ventrikulären Myozyten des Meerschweinchens. Circulation. 1995 Nov 15;92(10):3014-3024.)
LOKALE ANÄSTHETISCHE PHARMAKODYNAMIK
In der klinischen Praxis werden LAs typischerweise durch ihre Potenz, Wirkungsdauer, Geschwindigkeit des Einsetzens und Neigung zu einer differentiellen sensorischen Nervenblockade beschrieben. Diese Eigenschaften werden nicht unabhängig voneinander sortiert.
Potenz und Dauer
Die nervenblockierende Potenz von LAs nimmt mit zunehmendem Molekulargewicht und zunehmender Lipidlöslichkeit zu. Größere, lipophilere LAs durchdringen leichter Nervenmembranen und binden Na-Kanäle mit größerer Affinität. Beispielsweise haben Etidocain und Bupivacain eine größere Lipidlöslichkeit und Wirksamkeit als Lidocain und Mepivacain, mit denen sie chemisch eng verwandt sind.
NYSORA-Tipps
- Die nervenblockierende Potenz von LAs nimmt mit zunehmendem Molekulargewicht und zunehmender Lipidlöslichkeit zu.
Lipidlöslichere LAs sind relativ wasserunlöslich, stark proteingebunden im Blut, werden weniger leicht durch den Blutstrom von Nervenmembranen entfernt und in vitro langsamer aus isolierten Nerven „ausgewaschen“. Somit ist eine erhöhte Lipidlöslichkeit mit einer erhöhten Proteinbindung im Blut, einer erhöhten Potenz und einer längeren Wirkungsdauer verbunden. Ausmaß und Dauer der Anästhesie können im Tierexperiment mit dem LA-Gehalt der Nerven korreliert werden. Bei Tieren entstehen Blöcke mit größerer Tiefe und längerer Dauer aus kleineren Volumina von stärker konzentriertem LA im Vergleich zu größeren Volumina von weniger konzentriertem LA.
Geschwindigkeit des Einsetzens
Viele Lehrbücher und Übersichtsartikel behaupten, dass sich der Beginn der Anästhesie in isolierten Nerven mit zunehmender LA-Lipidlöslichkeit und steigendem pKa verlangsamt (Tabelle 2). Bei jedem pH-Wert nimmt der Prozentsatz der in ungeladener Form vorliegenden LA-Moleküle, die hauptsächlich für die Membranpermeabilität verantwortlich sind, mit zunehmendem pKa ab. Von den beiden LAs mit dem schnellsten Wirkungseintritt ist Etidocain jedoch hochgradig fettlöslich und Chloroprocain hat einen höheren pKa anderer LAs. Schließlich ist die LA-Einsatzrate mit der wässrigen Diffusionsrate assoziiert, die mit zunehmendem Molekulargewicht abnimmt.
TABELLE 2. Lokalanästhetische Merkmale, die dazu neigen, sich zu sortieren.
Physikalisch und chemisch
- Erhöhung der Lipidlöslichkeit
- Erhöhte Proteinbindung
Pharmakologisch und toxikologisch
- Steigerung der Potenz
- Steigende Einwirkzeit
- Erhöhung der Wirkungsdauer
- Zunehmende Tendenz zu schwerer systemischer Toxizität
- Im Allgemeinen neigen alle dazu, zusammen zu sortieren
Differenzielle sensorische Nervenblockade
Regionalanästhesie und Schmerzmanagement würden durch ein LA transformiert, das die Schmerzübertragung selektiv hemmt, während andere Funktionen intakt bleiben. Eine für die Hautinzision ausreichende sensorische Anästhesie kann jedoch ohne motorische Beeinträchtigung in der Regel nicht erreicht werden. Wie erstmals 1929 von Gasser und Erlanger demonstriert, blockieren alle LAs Fasern mit kleinerem Durchmesser (Durchmesser) bei geringeren Konzentrationen, als erforderlich sind, um größere Fasern des gleichen Typs zu blockieren. Als Gruppe sind unmyelinisierte Fasern im Vergleich zu größeren myelinisierten A-δ-Fasern resistent gegen LAs. Bupivacain und Ropivacain sind relativ selektiv für sensorische Fasern. Bupivacain bewirkt einen schnelleren Beginn der sensorischen als der motorischen Blockade, während die eng verwandte Chemikalie Mepivacain keinen unterschiedlichen Beginn während medianer Nervenblockaden zeigt (Figure 10). Eine echte Differentialanästhesie kann möglich sein, wenn Nav-Isoform-selektive Antagonisten verfügbar werden. Es wurde festgestellt, dass bestimmte Nav-Isoformen in Spinalganglien vorherrschen, und (wie zuvor angemerkt) können sich die relativen Populationen verschiedener Nav-Isoformen als Reaktion auf verschiedene Schmerzzustände ändern.
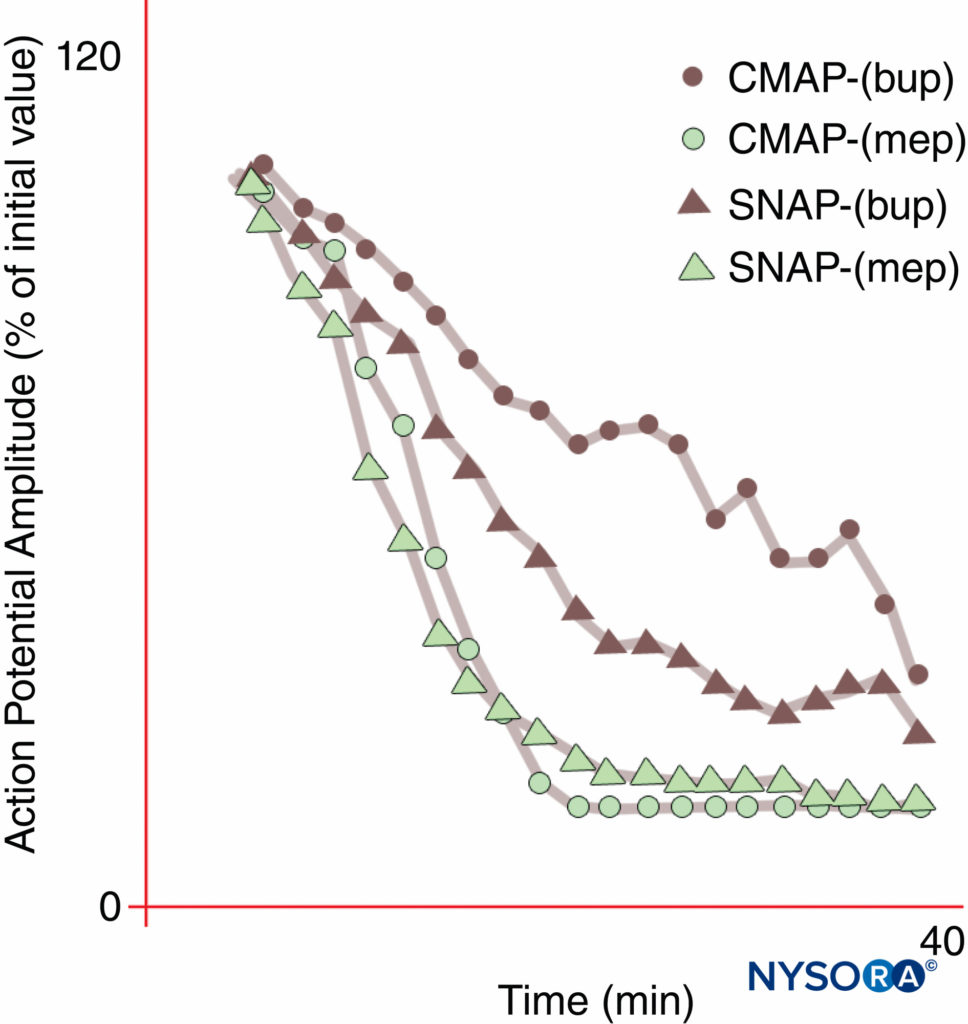
ABBILDUNG 10. Differentielles Einsetzen der medianen Nervenblockade mit Bupivacain 0.3 % (bup), aber nicht mit Mepivacain 1 % (mep). Beachten Sie, dass das zusammengesetzte motorische Aktionspotential (CMAP) während des Einsetzens der Bupivacain-Blockade bei diesen normalen freiwilligen Probanden weniger gehemmt wird als das sensorische Nervenaktionspotential (SNAP). Im Steady State (20 min) sind CMAP und SNAP vergleichbar gehemmt. Andererseits erzeugte Mepivacain eine schnellere Hemmung sowohl von CMAP als auch von SNAP, und es gab keinen unterschiedlichen Beginn der Blockade. (Wiedergabe mit freundlicher Genehmigung von Butterworth J, Ririe DG, Thompson RB, et al: Differential onset of median nerve block: randomized, double-blind Comparison of Mepivacaine and Bupivacaine in Healthy Volunteers. Br J Anaesth. 1998 Oct;81(4): 515-521.)
Andere Faktoren, die die örtliche Betäubungsaktivität beeinflussen
Viele Faktoren beeinflussen die Fähigkeit eines bestimmten LA, eine angemessene Regionalanästhesie zu erzeugen, einschließlich der Dosis, des Verabreichungsortes, Zusatzstoffe, Temperatur und Schwangerschaft. Mit zunehmender LA-Dosis steigen die Erfolgswahrscheinlichkeit und die Dauer der Anästhesie, während die Verzögerung des Einsetzens und die Neigung zum differentiellen Block abnehmen. Im Allgemeinen treten der schnellste Beginn und die kürzeste Dauer der Anästhesie bei spinalen oder subkutanen Injektionen auf; ein langsameres Einsetzen und eine längere Dauer werden mit Plexusblockaden erreicht.
NYSORA-Tipps
- Die Wirksamkeit eines bestimmten LA wird durch die Dosis, den Ort der Verabreichung, Zusatzstoffe, Temperatur und Veränderungen der neuralen Suszeptibilität beeinflusst, wie sie während der Schwangerschaft beobachtet werden.
Epinephrin wird LA-Lösungen häufig zugesetzt, um eine Vasokonstriktion zu bewirken und um als Marker für eine intravaskuläre Injektion zu dienen. Epinephrin und andere α1-Agonisten erhöhen die LA-Dauer hauptsächlich durch Verlängerung und Erhöhung der intraneuralen Konzentrationen von LAs. Der Blutfluss wird nur kurzzeitig verringert, und die Blockade hält noch lange an, nachdem sich die α1-adrenerge Wirkung auf den Blutfluss aufgelöst hat. Andere beliebte LA-Zusätze sind Clonidin, NaHCO3, Opioide, Dexamethason und Hyaluronidase. Ungeladene Lokalanästhetika haben bei basischem pH-Wert, wo ein erhöhter Anteil der LA-Moleküle ungeladen ist, eine größere scheinbare Wirksamkeit als bei saurerem pH-Wert (Figure 11). Ungeladene LA-Basen diffundieren leichter durch Nervenscheiden und Membranen als geladene LAs, was den Beginn der Anästhesie beschleunigt. Einige klinische Studien zeigten, dass die Zugabe von Natriumbicarbonat während der klinischen Nervenblockade eine widersprüchliche Wirkung hatte; jedoch zeigten nicht alle Studien einen schnelleren Beginn der Anästhesie. Man könnte erwarten, dass Bikarbonat seine größte Wirkung entfalten würde, wenn es LA-Lösungen zugesetzt würde, denen vom Hersteller Epinephrin zugesetzt wurde. Solche Lösungen sind saurer als „einfache“ (adrenalinfreie) LA-Lösungen, um die Haltbarkeit zu verlängern. Bikarbonat verkürzt die Wirkungsdauer von Lidocain bei Tieren. Merkwürdigerweise potenzieren H+-Ionen die nutzungsabhängige Blockierung, sobald LAs Zugang zur zytoplasmatischen Seite des Na-Kanals erhalten. Eine deutliche Verlängerung der Lokalanästhesie kann erreicht werden, indem LAs in Liposomen eingebaut werden, wie dies mit Bupivacain in einigen Formulierungen geschehen ist.
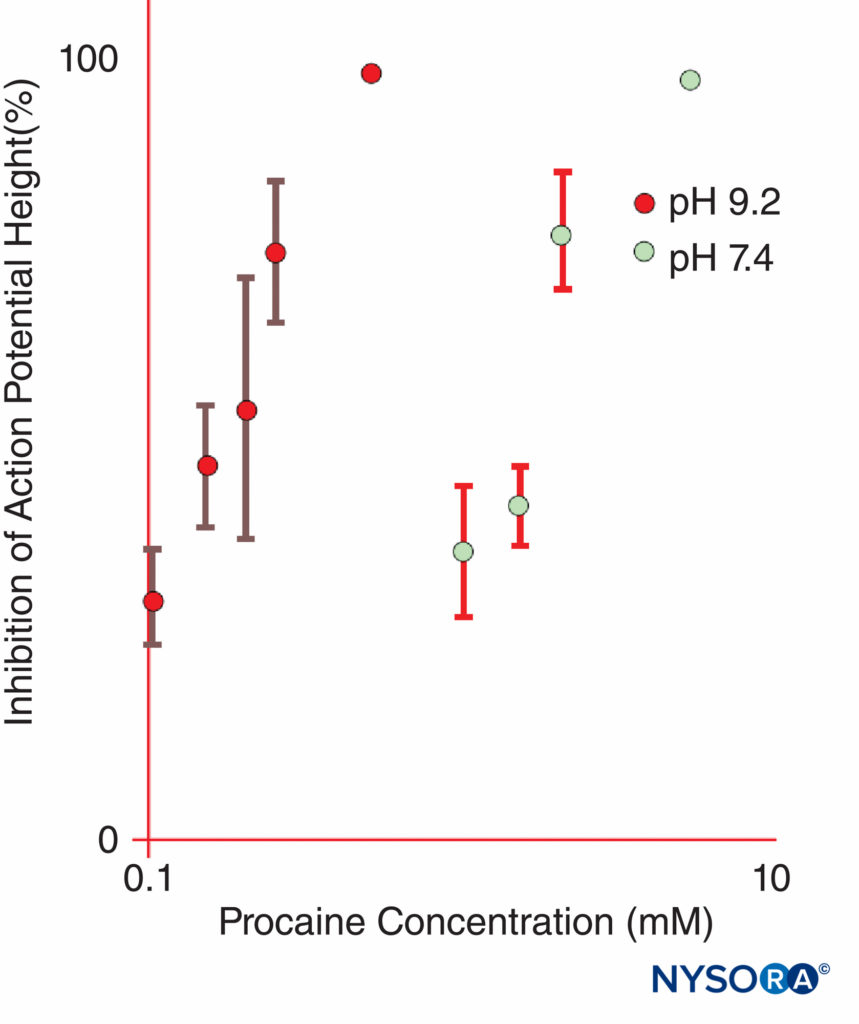
ABBILDUNG 11. Die Potenz von Procain bei der Hemmung von zusammengesetzten Aktionspotentialen in isolierten Ischiasnerven von Fröschen ist bei pH 9.2 im Vergleich zu pH 7.4 dramatisch erhöht. (Wiedergabe mit freundlicher Genehmigung von Butterworth JF, Lief PA, Strichartz GR: The pH-dependent local anesthetic activity of diethylaminoethanol, a procaine metabolite. Anesthesiology. 1988 Apr;68(4):501-506.)
NYSORA-Tipps
- Schwangerschaft erhöht die neurale Anfälligkeit für LAs.
Schwangere Frauen und trächtige Tiere zeigen eine erhöhte neurale Anfälligkeit für LAs. Darüber hinaus nimmt die Ausbreitung der neuraxialen Anästhesie wahrscheinlich während der Schwangerschaft aufgrund der Abnahme des thorakolumbalen Liquorvolumens zu.
BLUTKONZENTRATIONEN UND PHARMAKOKINETIK
Die LA-Spitzenkonzentrationen variieren je nach Injektionsstelle (Figure 12). Bei gleicher LA-Dosis Interkostalblöcke produzieren durchweg höhere LA-Spitzenkonzentrationen als Epidural oder Plexusblöcke. Wie kürzlich von anderen diskutiert wurde, macht es wenig Sinn, von „maximalen“ LA-Dosen zu sprechen, außer in Bezug auf ein bestimmtes Verfahren zur Nervenblockade, da die maximalen Blutspiegel je nach Blockadestelle stark variieren. Im Blut sind alle LA teilweise proteingebunden, primär an α1-saures Glykoprotein und sekundär an Albumin.
Die Affinität für α1-Säure-Glykoprotein korreliert mit der LA-Hydrophobie und nimmt mit der Protonierung (Azidität) ab. Das Ausmaß der Proteinbindung wird durch die Konzentration des α1-sauren Glykoproteins beeinflusst. Sowohl die Proteinbindung als auch die Proteinkonzentration nehmen während der Schwangerschaft ab. Während einer längerfristigen Infusion von LA und LA-Opioid-Kombinationen steigen die Konzentrationen von LA-bindenden Proteinen progressiv an. Es gibt eine beträchtliche First-Pass-Aufnahme von LAs durch die Lungen, und Tierstudien deuten darauf hin, dass Patienten mit Rechts-Links-Herz-Shunt davon betroffen sein könnten erwartet zu demonstrieren LA-Toxizität nach kleineren intravenösen Bolusdosen.
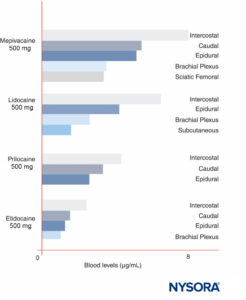
ABBILDUNG 12. Maximale Blutkonzentrationen von Lokalanästhetika nach verschiedenen Formen der Regionalanästhesie. Beachten Sie, dass Interkostalblockaden durchweg zu den größten Lokalanästhesiekonzentrationen im Blut führen, Plexusblockaden zu den geringsten Lokalanästhesiekonzentrationen im Blut führen und dass Epidural-/Caudal-Techniken dazwischen liegen. (Wiedergegeben mit Genehmigung von Covino BG, Vassallo HG: Local Anesthetics: Mechanisms of Action and Clinical Use. Grune & Stratton; 1976.)
NYSORA-Tipps
- Empfehlungen zu Maximaldosen von LAs, die üblicherweise in pharmakologischen Texten zu finden sind, sind in der Praxis der klinischen Regionalanästhesie nicht besonders nützlich.
- Die Serumkonzentrationen von LAs hängen von der Injektionstechnik, dem Ort der Injektion und der Zugabe von Additiven zum LA ab.
- Jede Empfehlung zur maximalen sicheren LA-Dosis kann nur in Bezug auf ein bestimmtes Verfahren zur Nervenblockade gültig sein.
Ester unterliegen einer schnellen Hydrolyse im Blut, katalysiert durch unspezifische Esterasen. Procain und Benzocain werden zu para-Aminobenzoesäure (PABA) metabolisiert, der Spezies, die der Anaphylaxie dieser Mittel zugrunde liegt. Höhere Dosen von Benzocain, typischerweise für die topische Anästhesie für die Endoskopie, können zu lebensbedrohlichen Methämoglobinämien führen. Die Amide werden in der Leber verstoffwechselt. Lidocain unterliegt einer oxidativen N-Dealkylierung (durch die Cytochrome CYP 1A2 und CYP 3A4 zu Monoethylglycinxylidid und Glycinxylidid). Bupivacain, Ropivacain, Mepivacain und Etidocain unterliegen ebenfalls einer N-Dealkylierung und Hydroxylierung. Prilocain wird zu o-Toluidin hydrolysiert, dem Mittel, das Methämoglobinämie verursacht. Es ist zu erwarten, dass Prilocain-Dosen von nur 400 mg bei fitten Erwachsenen Methämoglobinämie-Konzentrationen hervorrufen, die groß genug sind, um eine klinische Zyanose zu verursachen. Die Amid-LA-Clearance hängt stark von der hepatischen Durchblutung, der hepatischen Extraktion und der Enzymfunktion ab; Daher wird die Amid-LA-Clearance durch Faktoren reduziert, die den hepatischen Blutfluss verringern, wie z. B. β-adrenerge Rezeptor- oder H2-Rezeptorblocker, und durch Herz- oder Leberversagen. Die Disposition von Amid-LAs ist in der Schwangerschaft aufgrund eines erhöhten Herzzeitvolumens, des hepatischen Blutflusses und der Clearance sowie der zuvor erwähnten Abnahme der Proteinbindung verändert. Nierenversagen neigt dazu, das Verteilungsvolumen von Amid-LAs zu erhöhen und die Akkumulation von metabolischen Nebenprodukten von Ester- und Amid-LAs zu erhöhen. Theoretisch sollten Cholinesterasemangel und Cholinesterasehemmer das Risiko einer systemischen Toxizität von Ester-LAs erhöhen; Es liegen jedoch keine bestätigenden klinischen Berichte vor. Einige Medikamente hemmen verschiedene Cytochrome, die für den LA-Metabolismus verantwortlich sind; Die Bedeutung von Cytochrom-Inhibitoren variiert jedoch in Abhängigkeit von der spezifischen LA-Spezies. β-Blocker und H2-Rezeptorblocker hemmen CYP 2D6, was zu einem reduzierten Amid-LA-Metabolismus beitragen kann. Itraconazol hat keinen Einfluss auf die Leberdurchblutung, hemmt jedoch die Elimination von CYP 3A4 und Bupivacain um 20 %–25. Ropivacain wird durch CYP 1A2 hydroxyliert und durch CYP 2A6 zu 3′,4′-Pipecoloxylidid metabolisiert. Die Hemmung von CYP 1A2 durch Fluvoxamin verringert die Ropiva-Cain-Clearance um 70 %. Andererseits hat die gleichzeitige Verabreichung mit starken Inhibitoren von CYP 3A4 (Ketoconazol, Itraconazol) nur einen geringen Einfluss auf die Ropivacain-Clearance.
DIREKTE TOXISCHE NEBENWIRKUNGEN
Es ist eine verbreitete, aber fehlgeleitete Annahme, dass alle LA-Wirkungen, einschließlich toxischer Nebenwirkungen, aus der Wechselwirkung mit spannungsgesteuerten Na-Kanälen resultieren. Es gibt zahlreiche Beweise dafür, dass LAs neben Na-Kanälen viele andere Ziele binden, einschließlich spannungsgesteuerter K- und Ca-Kanäle, KATP-Kanäle, Enzyme, N-Methyl-D-Aspartat-Rezeptoren, β-adrenerge Rezeptoren, G-Protein-vermittelte Modulation von K- und Ca-Kanälen und Nikotin-Acetylcholin-Rezeptoren. Die LA-Bindung an eine oder alle dieser anderen Stellen könnte der LA-Produktion zugrunde liegen Spinale or Epiduralanalgesie und könnte zu toxischen Nebenwirkungen beitragen.
Nebenwirkungen des zentralen Nervensystems
Lokalanästhetische ZNS-Toxizität entsteht durch selektives Blockieren der Hemmung von Erregungswegen im ZNS, wodurch eine stereotype Abfolge von Anzeichen und Symptomen erzeugt wird, wenn die LA-Konzentration im Blut allmählich ansteigt (Tabelle 3). Bei erhöhten LA-Dosen können Anfälle in der Amygdala auftreten. Bei weiterer LA-Dosierung schreitet die Erregung des ZNS zu einer Depression des ZNS und schließlich zum Atemstillstand fort. Stärkere (bei Nervenblockade) LAs erzeugen Anfälle bei niedrigeren Blutkonzentrationen und bei niedrigeren Dosen als weniger starke LAs. In Tierversuchen verringerten sowohl metabolische als auch respiratorische Azidose die konvulsive Dosis von Lidocain.
TABELLE 3. Fortschreiten der Anzeichen und Symptome einer Toxizität, wenn die Dosis (oder Konzentration) des Lokalanästhetikums allmählich ansteigt.
- Vertigo
- Tinnitus
- Ominöse Gefühle
- Zirkumorale Taubheit
- Geschwätzigkeit
- Tremors
- Myoklonische Zuckungen
- Krämpfe
- Koma
- Herz-Kreislauf-Kollaps
Kardiovaskuläre Toxizität
In Laborexperimenten erzeugen die meisten LAs keine kardiovaskuläre (CV) Toxizität, bis die Blutkonzentration das Dreifache übersteigt, was zur Erzeugung von Anfällen erforderlich ist; es gibt jedoch klinische Berichte über gleichzeitige ZNS- und kardiovaskuläre Toxizität mit Bupivacain (Tabelle 4). Bei Hunden führen suprakonvulsive Dosen von Bupivacain häufiger zu Arrhythmien als suprakonvulsive Dosen von Ropivacain und Lidocain. LAs erzeugen kardiovaskuläre Anzeichen einer ZNS-Erregung (erhöhte Herzfrequenz, arterieller Blutdruck und Herzzeitvolumen) bei niedrigeren Konzentrationen als jene, die mit Herzdepression assoziiert sind. Hypokapnie reduziert Ropivacain-induzierte Veränderungen der ST-Strecken und der linksventrikulären Kontraktilität.
NYSORA-Tipps
- In Laborexperimenten erzeugen die meisten LA keine kardiovaskuläre Toxizität, bis die Blutkonzentration das Dreifache der zur Erzeugung von Anfällen erforderlichen Konzentration übersteigt.
TABELLE 4. Krampfhafte versus tödliche Dosen von Lokalanästhetika bei Hunden.
| Lidocain | Bupivacain | Tetracaine | |
|---|---|---|---|
| Dosis, die bei allen Tieren Krämpfe hervorruft (mg/kg) | 22 | 5 | 4 |
| Dosis, die bei allen Tieren zur Letalität führt (mg/kg) | 76 | 20 | 27 |
Lokalanästhetika binden und hemmen kardiale Na-Kanäle (Nav 1.5-Isoform). Bupivacain bindet stärker und länger als Lidocain an kardiale Na-Kanäle. Wie bereits erwähnt, binden bestimmte optische R(+)-Isomere stärker an kardiale Na-Kanäle als optische S(–)-Isomere. Diese Laborbeobachtungen führten zur klinischen Entwicklung von Levobupivacain und Ropivacain. Lokalanästhetika hemmen die Erregungsleitung im Herzen mit der gleichen Rangordnung der Potenz wie bei einer Nervenblockade. Lokalanästhetika erzeugen eine dosisabhängige myokardiale Depression, möglicherweise durch Interferenz mit Ca-Signalmechanismen innerhalb des Herzmuskels. Diese Anästhetika binden und hemmen kardiale spannungsgesteuerte Ca- und K-Kanäle bei Konzentrationen, die größer sind als diejenigen, bei denen die Bindung an Na-Kanäle maximal ist. Die LAs binden β-adrenerge Rezeptoren und hemmen die durch Epinephrin stimulierte Bildung von zyklischem Adenosinmonophosphat (AMP). Bei Ratten scheint die Rangfolge der Herztoxizität Bupivacain > Levobupivacain > Ropivacain zu sein. Bei Hunden war Lidocain am wenigsten wirksam, und Bupivacain und Levobupivacain waren wirksamer als Ropivacain bei der Hemmung der linksventrikulären Funktion, wie durch Echokardiographie festgestellt wurde (Tabelle 5). Bei Hunden lösten sowohl die programmierte elektrische Stimulation als auch die Epinephrin-Wiederbelebung nach Bupivacain und Levobupivacain mehr Arrhythmien aus als nach der Verabreichung von Lidocain oder Ropivacain. Der Mechanismus, durch den CV-Toxizität erzeugt wird, kann davon abhängen, welches LA verabreicht wurde. Wenn LAs bis zum Punkt extremer Hypotonie verabreicht wurden, konnten Hunde, die Lidocain erhielten, wiederbelebt werden, benötigten jedoch eine fortgesetzte Infusion von Epinephrin, um der LA-induzierten Myokarddepression entgegenzuwirken. Umgekehrt konnten viele Hunde, die Bupivacain oder Levobupivacain bis zum Punkt extremer Hypotonie erhielten, nicht wiederbelebt werden. Nach Bupivacain, Levobupivacain oder Ropivacain benötigten Hunde, die defibrilliert werden konnten, oft keine zusätzliche Therapie. In ähnlicher Weise betrug bei Schweinen beim Vergleich von Lidocain mit Bupivacain das Potenzverhältnis für Myokarddepression 1:4, während es für Arrhythmogenese 1:16 betrug. Die LAs erzeugen bei klinischen Konzentrationen eine Dilatation der vaskulären glatten Muskulatur. Kokain ist das einzige LA, das durchgängig eine lokale Vasokonstriktion hervorruft.
Allergische Reaktionen
NYSORA-Tipps
- Echte immunologische Reaktionen auf LA sind selten.
- Echte Anaphylaxie scheint bei Ester-LAs, die direkt zu PABA metabolisiert werden, häufiger vorzukommen als bei anderen LAs.
- Versehentliche intravenöse Injektionen von LA werden manchmal als allergische Reaktionen fehldiagnostiziert.
- Einige Patienten reagieren möglicherweise auf Konservierungsmittel wie Methylparaben, die in LAs enthalten sind.
Echte immunologische Reaktionen auf LA sind selten. Versehentliche intravenöse Injektionen von LA werden manchmal als allergische Reaktionen fehldiagnostiziert. Echte Anaphylaxie scheint bei Ester-LAs, die direkt zu PABA metabolisiert werden, häufiger vorzukommen als bei anderen LAs. Einige Patienten reagieren möglicherweise auf Konservierungsmittel wie Methylparaben, die in LAs enthalten sind. Mehrere Studien haben gezeigt, dass Patienten, die zur Untersuchung einer offensichtlichen LA-Allergie überwiesen wurden, selbst nach Auftreten von Anzeichen oder Symptomen einer Anaphylaxie, fast nie eine echte Allergie gegen das verabreichte LA zeigen. Andererseits hat der LA-Hauttest einen hervorragenden negativen Vorhersagewert. Mit anderen Worten, 97 % der Patienten, die auf LA-Hauttests nicht ansprechen, werden auch in einer klinischen Umgebung keine allergische Reaktion auf LA zeigen.
TABELLE 5. Auswirkungen von Lokalanästhetika auf bei Hunden gemessene Myokardfunktionsindizes.
| Lokale Betäubung | LVEDP (EG50 für 125% Basis) (µg/ml) | dP/dtmax (EG50 für 65% Basis) (µg/ml) | %FS (EG50 für 65% Basis) (µg/ml) |
|---|---|---|---|
| Bupivacain | 2.2 (1.2-4.4) | 2.3 (1.7-3.1) | 2.1 (1.47-3.08) |
| Levobupivacain | 1.7 (0.9-3.1) | 2.4 (1.9-3.1) | 1.3 (0.9-1.8) |
| Ropivacain | 4.0 (2.1-7.5)a/sup> | 4.0 (3.1-5.2)b | 3.0 (2.1-4.2)a/sup> |
| Lidocain | 6.8 (3.0-15.4)c | 8.0 (5.7-11.0)d | 5.5 (3.5-8.7)d |
Neurotoxische Wirkungen
Während der 1980er Jahre verursachte 2-Chloroprocain (damals formuliert mit Natriummetabisulfit bei einem relativ sauren pH) gelegentlich ein Cauda-Equina-Syndrom nach einer versehentlichen intrathekalen Injektion einer großen Dosis während einer versuchten epiduralen Verabreichung. Ob das „Toxin“ 2-Chloroprocain oder Natriummetabisulfit ist, bleibt ungeklärt: 2-Chloroprocain wird derzeit als Ersatz für Lidocain in der menschlichen Spinalanästhesie getestet, und eine Reihe von Veröffentlichungen legen nahe, dass es sicher und wirksam sein könnte. Gleichzeitig haben andere Forscher neurotoxische Reaktionen bei Tieren eher mit hohen Dosen von 2-Chloroprocain als mit Metabisulfit in Verbindung gebracht. Es gibt auch Kontroversen über vorübergehende neurologische Symptome und anhaltende sakrale Defizite nach Lidocain-Spinalanästhesie. Die Berichte und die Kontroverse haben viele Ärzte davon überzeugt, die Spinalanästhesie mit Lidocain aufzugeben. Im Gegensatz zu anderen spinalen LA-Lösungen unterbricht Lidocain 5 % dauerhaft die Reizleitung, wenn es auf isolierte Nerven oder isolierte Neuronen aufgetragen wird. Dies kann das Ergebnis von Lidocain-induzierten Erhöhungen des intrazellulären Calciums sein und scheint keine Na-Kanal-Blockierung zu beinhalten. Während es unmöglich ist, „die Sicherheit zu beweisen“, deuten mehrere Studien darauf hin, dass Lidocain für kurze Spinalanästhesien durch Chloroprocain oder Mepivacain ersetzt werden kann.
Behandlung der Toxizität von Lokalanästhetika
Die Behandlung von LA-Nebenwirkungen hängt von ihrem Schweregrad ab. Kleinere Reaktionen können spontan beendet werden. Durch LAs induzierte Anfälle sollten durch Aufrechterhaltung eines offenen Atemwegs und Sauerstoffzufuhr behandelt werden. Krampfanfälle können mit intravenösem Midazolam (0.05–0.10 mg/kg) oder Propofol (0.5–1.5 mg/kg) oder einer paralytischen Dosis Succinylcholin (0.5–1 mg/kg) beendet werden, gefolgt von Beatmung mit Beutel und Maske (oder Trachealintubation). LA CV-Depression, manifestiert durch mäßige Hypotonie, kann durch Infusion von intravenösen Flüssigkeiten und Vasopressoren (Phenylephrin 0.5–5 μg/kg/min, Norepinephrin 0.02–0.2 μg/kg/min oder Vasopressin 40 μg i.v.) behandelt werden. Bei Vorliegen einer Myokardinsuffizienz kann Epinephrin (1–5 μg/kg i.v. Bolus) erforderlich sein. Wenn die Toxizität bis zum Herzstillstand fortschreitet, sind die Richtlinien für die Behandlung der LA-Toxizität, wie sie von der American Society of Regional Anästhesie und Schmerzmedizin (ASRA) entwickelt wurden, angemessen und sicherlich den chaotischen Wiederbelebungsschemata vorzuziehen, die in einer nationalen Umfrage vor der Veröffentlichung der veröffentlicht wurden Richtlinie. Es ist sinnvoll, Lidocain durch Amiodaron zu ersetzen und, basierend auf mehreren Tierversuchen, dass anstelle von 1-mg-Boli anfänglich kleinere, inkrementelle Dosen von Epinephrin verwendet werden. Tierexperimente und klinische Berichte zeigen die bemerkenswerte Fähigkeit einer Lipidinfusion zur Wiederbelebung eines durch Bupivacain induzierten Herzstillstands (Figure 13). Angesichts des nahezu untoxischen Status der Lipidinfusion kann man kein überzeugendes Argument dafür vorbringen, diese Therapie einem Patienten vorzuenthalten, der aufgrund einer LA-Intoxikation wiederbelebt werden muss. Bei nicht ansprechender kardialer Toxizität von Bupivacain sollte ein kardiopulmonaler Bypass in Betracht gezogen werden. Es scheint, dass die Bedrohung durch eine schwere systemische Toxizität von Lokalanästhetika zurückgeht, sei es durch eine bessere Behandlung oder durch Änderungen der Techniken. Eine Minderheit würde argumentieren, dass das Risiko zumindest in erfahrenen Händen von Anfang an überschätzt wurde. Viele Praktiker glauben, dass die Ultraschallführung während peripherer Nervenblockaden zu sichereren Praktiken und weniger Risiken geführt hat. Während diese Ansicht umstritten bleibt, gibt es Studien, die diese Annahme stützen.
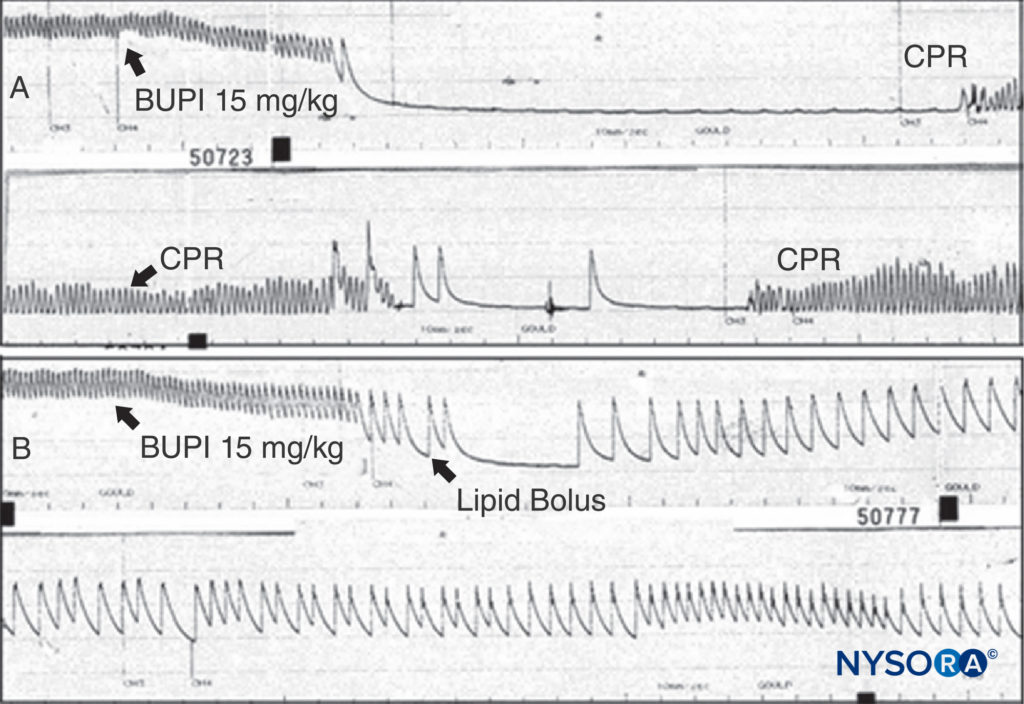
ABBILDUNG 13. A: Einer anästhesierten Ratte wird wie angegeben 15 mg/kg Bupivacain verabreicht. Der arterielle Blutdruck fällt schnell bis zum Herzstillstand ab. Es wird eine Herz-Lungen-Wiederbelebung (CPR) durchgeführt, aber es wird kein arterieller Druck beobachtet, wenn die CPR unterbrochen wird. B: Das gleiche Experiment wird durchgeführt, aber es wird ein Fettbolus gegeben; Beachten Sie, dass der arterielle Druck niemals verloren geht (obwohl dieselbe Dosis Bupivacain verwendet wird) und dass es nicht zu einem Herzstillstand kommt. (Wiedergabe mit freundlicher Genehmigung von Weinberg G: Aktuelle Konzepte bei der Wiederbelebung von Patienten mit lokaler anästhetischer Herztoxizität. Reg Anesth Pain Med. 2002 Nov-Dec;27(6):568-575.)
ZUSAMMENFASSUNG
Nach mehr als einem Jahrhundert der Verwendung in der westlichen Medizin bleiben LAs wichtige Werkzeuge für den Arzt des XNUMX. Jahrhunderts. Periphere Nervenblockaden sind mit ziemlicher Sicherheit das Ergebnis einer LA-Hemmung von spannungsgesteuerten Na-Kanälen in neuronalen Membranen. Die Mechanismen der Spinal- und Epiduralanästhesie sind noch unvollständig definiert. Die geeignete und sichere Dosis von LAs variiert mit dem spezifischen Verfahren zur Nervenblockade. Die Mechanismen, durch die unterschiedliche LAs kardiovaskuläre Toxizität erzeugen, variieren wahrscheinlich: Die stärkeren Wirkstoffe (z. B. Bupivacain) können Arrhythmien durch eine Na-Kanalwirkung hervorrufen, während die weniger wirksamen Wirkstoffe (z. B. Lidocain) über andere Wege eine Myokarddepression hervorrufen können. Befürchtungen über die systemische Toxizität von LA haben mit sichereren LAs, sichereren Regionalanästhesiepraktiken und verbesserten Behandlungen nachgelassen. Es werden erneut Anstrengungen unternommen, klinisch anwendbare Formulierungen von Lokalanästhetika mit verzögerter Freisetzung herzustellen, um die Dauer der derzeit verfügbaren LAs zu verlängern.
REFERENZEN
- Vandam LD: Einige Aspekte der Geschichte der Lokalanästhesie. In Strichartz GR (Hrsg): Local Anesthetics: Handbook of Experimental Pharmacology. Springer-Verlag, 1987, S. 1–19.
- Calatayud J, Gonzalez A: Geschichte der Entwicklung und Evolution der Lokalanästhesie seit dem Kokablatt. Anästhesiologie 2003;98:1503–1508.
- Strichartz GR: Lokalanästhetika: Handbuch der experimentellen Pharmakologie. Springer-Verlag, 1987.
- de Jong RH: Lokalanästhetika. Mosby-Jahrbuch, 1994.
- Keys TE: Die Geschichte der chirurgischen Anästhesie. Holzbibliothek, Museum für Anästhesiologie, 1996.
- Butterworth JF IV, Strichartz GR: Molekulare Mechanismen der Lokalanästhesie: Eine Übersicht. Anesthesiology 1990;72:711–734.
- Tetzlaff J: Klinische Pharmakologie der Lokalanästhetika. Butterworth-Heinemann, 2000.
- Ahern CA, Payandeh J, Bosmans F, Chanda B. Per Anhalter durch die spannungsgesteuerte Natriumkanalgalaxie. J. Gen. Physiol. 2016;147:1–24.
- de Lera Ruiz M, Kraus RL. Spannungsgesteuerte Natriumkanäle: Struktur, Funktion, Pharmakologie und klinische Indikationen. J MedChem. 2015;58:7093–7118.
- Lopreato GF, Lu Y, Southwell A, et al: Evolution und Divergenz von Natriumkanalgenen bei Wirbeltieren. Proc Natl Acad Sci USA 2001; 98:7588–7592.
- Savio-Galmiberti E. Gollob MH, Darbar D: Spannungsgesteuerte Natriumkanäle: Biophysik, Pharmakologie und verwandte Kanalopathien. Front Pharmacol 2012;3:1–19
- Chen-Izu Y, Shaw RM, Pitt GS, et al. Funktion, Regulation, Struktur, Transport und Sequestrierung des Na+-Kanals. J Physiol. 2015;593:1347–1360
- Hille B: Ionenkanäle erregbarer Membranen, 3. Aufl. Sinauer, 2001.
- Jiang Y, Lee A, Chen J, et al: Röntgenstruktur eines spannungsabhängigen K+-Kanals. Natur 2003;423:33–41.
- Freites JA, Tobias DJ. Spannungsmessung in Membranen: Von makroskopischen Strömen zu molekularen Bewegungen. J Member Biol. 2015;248:419–430.
- Taylor RE. Wirkung von Procain auf die elektrischen Eigenschaften der Axonmembran von Tintenfischen. Am J Physiol 1959;196:1070–1078.
- Strichartz GR. Die Hemmung von Natriumströmen in myelinisierten Nerven durch quaternäre Derivate von Lidocain. J. Gen. Physiol. 1973;62:37–57.
- Ragsdale DS, McPhee JC, Scheuer T, et al: Molekulare Determinanten der zustandsabhängigen Blockierung von Na+-Kanälen durch Lokalanästhetika. Wissenschaft 1994;265:1724–1728.
- Wang GK, Quan C, Wang S: Ein gemeinsamer Lokalanästhetikum-Rezeptor für Benzocain und Etidocain in spannungsgesteuerten mu1 Na+-Kanälen. Pflugers Arch 1998;435:293–302.
- Sudoh Y, Cahoon EE, Gerner P, et al: Trizyklische Antidepressiva als lang wirkende Lokalanästhetika. Schmerz 2003;103:49–55.
- Kohane DS, Lu NT, Gokgol-Kline AC, et al.: Die lokalanästhetischen Eigenschaften und die Toxizität von Saxitonin-Homologen für Ratten-Ischiasnervblockade in vivo. Reg Anesth Pain Med 2000;25:52–59.
- Butterworth JF IV, Strichartz GR: Die alpha-2-adrenergen Agonisten Clonidin und Guanfacin erzeugen einen tonischen und phasischen Leitungsblock in Ratten-Ischiasnervenfasern. Anesth Analg 1993;76:295–301.
- Sanchez V, Arthur GR, Strichartz GR: Grundlegende Eigenschaften von Lokalanästhetika. I. Die Abhängigkeit der Ionisierung von Lidocain und der Octanol:Puffer-Verteilung von Lösungsmittel und Temperatur. Anesth Analg 1987;66: 159–165.
- Strichartz GR, Sanchez V, Arthur GR, et al: Grundlegende Eigenschaften von Lokalanästhetika. II. Gemessene Octanol:Puffer-Verteilungskoeffizienten und pKa-Werte von klinisch verwendeten Arzneimitteln. Anesth Analg 1990;71:158–170.
- Popitz-Bergez FA, Leeson S, Strichartz GR, et al: Beziehung zwischen funktionellem Defizit und intraneuraler Lokalanästhesie während der peripheren Nervenblockade. Eine Studie am Ischiasnerv der Ratte. Anesthesiology 1995;83:583–592.
- Sinnott CJ, Cogswell LP III, Johnson A, et al: Über den Mechanismus, durch den Epinephrin die periphere Nervenblockade von Lidocain potenziert. Anesthesiology 2003;98:181–188.
- Nakamura T, Popitz-Bergez F, Birknes J, et al: Die kritische Rolle der Konzentration für die Lidocain-Blockierung peripherer Nerven in vivo: Studien zur Funktion und Arzneimittelaufnahme bei der Ratte. Anästhesiologie 2003;99: 1189–1197.
- Brouneus F, Karami K, Beronius P, et al: Diffusive Transporteigenschaften einiger Lokalanästhetika, die für die iontophoretische Formulierung der Arzneimittel geeignet sind. Int. J. Pharm. 2001;218:57–62.
- Gissen AJ, Covino BG, Gregus J: Differentielle Empfindlichkeiten von Säugetier-Nervenfasern gegenüber Lokalanästhetika. Anesthesiology 1980;53:467–474.
- Raymond SA, Gissen AJ: Mechanismen der differentiellen Nervenblockade. In Strichartz GR (Hrsg): Handbook of Experimental Pharmacology: Local Anesthetics. Springer-Verlag, 1987, S. 95–164.
- Butterworth J, Ririe DG, Thompson RB, et al: Differentieller Beginn der medianen Nervenblockade: Randomisierter, doppelblinder Vergleich von Mepivacain und Bupivacain bei gesunden Freiwilligen. Br J Anaesth 1998; 81:515–521.
- Novakovic SD, Eglen RM, Hunter JC: Regulierung der Verteilung von Na+-Kanälen im Nervensystem. Trends Neurosci 2001;24:473–478.
- Covino BG, Vasallo HG: Lokalanästhetika. Grune & Stratton, 1976.
- Kohane DS, Lu NT, Cairns BE, et al: Wirkungen von adrenergen Agonisten und Antagonisten auf Tetrodotoxin-induzierte Nervenblockade. Reg Anesth Pain Med 2001;26:239–245.
- Butterworth JF IV, Lief PA, Strichartz GR: Die pH-abhängige lokale anästhetische Aktivität von Diethylaminoethanol, einem Procain-Metaboliten. Anesthesiology 1988;68:501–506.
- Fagraeus L, Urban BJ, Bromage PR: Ausbreitung der Epiduralanalgesie in der Frühschwangerschaft. Anästhesiologie 1983;58:184–187.
- Butterworth JF IV, Walker FO, Lysak SZ: Die Schwangerschaft erhöht die Anfälligkeit des Nervus medianus für Lidocain. Anesthesiology 1990;72:962–965.
- Popitz-Bergez FA, Leeson S, Thalhammer JG, et al: Intraneurale Lidocainaufnahme im Vergleich zu analgetischen Unterschieden zwischen trächtigen und nicht trächtigen Ratten. Reg Anesth 1997;22:363–371.
- Scott DB, Jebson PJ, Braid DP, et al: Faktoren, die die Plasmaspiegel von Lignocain und Prilocain beeinflussen. Br. J. Anaesth 1972;44:1040–1049.
- Rosenberg PH, Veering BTh, Urmey WF: Maximale empfohlene Dosis von Lokalanästhetika: Ein multifaktorielles Konzept. Reg Anesth Pain Med 2004;29:564–575.
- Taheri S, Cogswell LP III, Gent A, et al: Hydrophobe und ionische Faktoren bei der Bindung von Lokalanästhetika an die Hauptvariante des menschlichen Alpha1-Säure-Glykoproteins. J Pharmacol Exp Ther 2003;304:71–80.
- Fragneto RY, Bader AM, Rosinia F, et al: Messungen der Proteinbindung von Lidocain während der Schwangerschaft. Anesth Analg 1994;79: 295–297.
- Thomas JM, Schug SA: Jüngste Fortschritte in der Pharmakokinetik von Lokalanästhetika. Langwirksame Amid-Enantiomere und kontinuierliche Infusionen. Clin Pharmacokinet 1999;36:67–83.
- Rothstein P, Arthur GR, Feldman HS, et al: Bupivacain für interkostale Nervenblockaden bei Kindern: Blutkonzentrationen und Pharmakokinetik. Anesth Analg 1986;65:625–632.
- Bokesch PM, Castaneda AR, Ziemer G, et al: Der Einfluss eines Rechts-Links-Herz-Shunts auf die Lidocain-Pharmakokinetik. Anästhesiologie 1987; 67:739–744.
- Palkama VJ, Neuvonen PJ, Olkkola KT: Wirkung von Itraconazol auf die Pharmakokinetik von Bupivacain-Enantiomeren bei gesunden Freiwilligen. Br. J. Anaesth 1999;83:659–661.
- Oda Y, Furuichi K, Tanaka K, et al: Metabolismus eines neuen Lokalanästhetikums, Ropivacain, durch menschliches hepatisches Cytochrom P450. Anästhesiologie 1995; 82:214–220.
- Ekstrom G, Gunnarsson UB: Ropivacain, ein neues Lokalanästhetikum vom Amidtyp, wird durch die Cytochrome P450 1A und 3A in menschlichen Lebermikrosomen metabolisiert. Drug Metab Dispos 1996;24:955–961.
- Hirota K, Browne T, Appadu BL, et al: Interagieren Lokalanästhetika mit Dihydropyridin-Bindungsstellen auf neuronalen Ca2+-Kanälen vom L-Typ? Br. J. Anaesth 1997;78:185–188.
- Olschewski A, Olschewski H, Brau ME, et al: Wirkung von Bupivacain auf ATP-abhängige Kaliumkanäle in Rattenkardiomyozyten. Br. J. Anaesth 1999;82:435–438.
- Sugimoto M., Uchida I., Fukami S. et al.: Die von der Alpha- und Gamma-Untereinheit abhängigen Wirkungen von Lokalanästhetika auf rekombinante GABA(A)-Rezeptoren. Eur J Pharmacol 2000;401:329–337.
- Englesson S, Grevsten S: Der Einfluss von Säure-Base-Veränderungen auf die zentralnervöse Toxizität von Lokalanästhetika. II. Acta Anaesthesiol Scand 1974;18:88–103.
- Feldman HS, Arthur GR, Covino BG: Vergleichende systemische Toxizität von konvulsiven und suprakonvulsiven Dosen von intravenösem Ropivacain, Bupivacain und Lidocain beim wachen Hund. Anesth Analg 1989;69: 794–801.
- Porter JM, Markos F, Snow HM et al.: Auswirkungen von respiratorischen und metabolischen pH-Änderungen und Hypoxie auf die Ropivacain-induzierte Kardiotoxizität bei Hunden. Br J Anaesth 2000;84:92–94.
- Chernoff DM: Kinetische Analyse der phasischen Hemmung neuronaler Natriumströme durch Lidocain und Bupivacain. Biophys J 1990;58:53–68.
- Feldman HS, Covino BM, Sage DJ: Direkte chronotrope und inotrope Wirkungen von Lokalanästhetika in isolierten Vorhöfen von Meerschweinchen. Reg Anesth 1982;7:149–156.
- Reiz S, Nath S: Kardiotoxizität von Lokalanästhetika. Br. J. Anaesth 1986;58:736–746.
- McCaslin PP, Butterworth J: Bupivacain unterdrückt [Ca(2+)](i)-Oszillationen in neonatalen Rattenkardiomyozyten mit erhöhtem extrazellulärem K+ und wird mit erhöhtem extrazellulärem Mg(2+) umgekehrt. Anesth Analg 2000;91:82–88.
- Butterworth JF IV, Brownlow RC, Leith JP, et al: Bupivacain hemmt die Produktion von zyklischem 3′,5′-Adenosinmonophosphat. Ein möglicher beitragender Faktor zur kardiovaskulären Toxizität. Anästhesiologie 1993;79:88–95.
- Butterworth J, James RL, Grimes J: Strukturaffinitätsbeziehungen und Stereospezifität mehrerer homologer Serien von Lokalanästhetika für den beta2-adrenergen Rezeptor. Anesth Analg 1997;85:336–342.
- Ohmura S, Kawada M, Ohta T, et al: Systemische Toxizität und Reanimation bei mit Bupivacain, Levobupivacain oder Ropivacain infundierten Ratten. Anesth Analg 2001;93:743–748.
- Dony P, Dewinde V, Vanderick B, et al: Die vergleichende Toxizität von Ropivacain und Bupivacain bei äquipotenten Dosen bei Ratten. Anesth Analg 2000;91:1489–1492.
- Chang DH, Ladd LA, Copeland S, et al: Direkte kardiale Wirkungen von intrakoronarem Bupivacain, Levobupivacain und Ropivacain bei Schafen. Br J Pharmacol 2001;132:649–658.
- Groban L, Deal DD, Vernon JC, et al: Ventrikuläre Arrhythmien mit oder ohne programmierte elektrische Stimulation nach schrittweiser Überdosierung mit Lidocain, Bupivacain, Levobupivacain und Ropivacain. Anesth Analg 2000;91:1103–1111.
- Groban L, Deal DD, Vernon JC, et al: Herzwiederbelebung nach inkrementeller Überdosierung mit Lidocain, Bupivacain, Levobupivacain und Ropivacain bei anästhesierten Hunden. Anesth Analg 2001;92:37–43.
- Groban L, Deal DD, Vernon JC, et al: Sagt die Stereoselektivität oder Struktur von Lokalanästhetika eine Myokarddepression bei anästhesierten Hunden voraus? Reg Anesth Pain Med 2002;27:460–468.
- Nath S., Haggmark S., Johansson G. et al.: Differentielle dämpfende und elektrophysiologische Kardiotoxizität von Lokalanästhetika: Eine experimentelle Studie mit besonderem Bezug zu Lidocain und Bupivacain. Anesth Analg 1986;65:1263–1270.
- Carpenter RL, Kopacz DJ, Mackey DC: Genauigkeit von Laser-Doppler-Kapillarflussmessungen zur Vorhersage des Blutverlusts durch Hautschnitte bei Schweinen. Anesth Analg 1989;68:308–311.
- deShazo RD, Nelson HS: Ein Ansatz für den Patienten mit einer Vorgeschichte von Lokalanästhesie-Überempfindlichkeit: Erfahrung mit 90 Patienten. J Allergy Clin Immunol 1979;63:387–394.
- Berkun Y, Ben-Zvi A, Levy Y, et al: Bewertung der Nebenwirkungen von Lokalanästhetika: Erfahrung mit 236 Patienten. Ann Allergy Asthma Immunol 2003;91:342–345.
- Gissen AJ, Datta S, Lambert D: Die Chloroprocain-Kontroverse. I. Eine Hypothese zur Erklärung der neuronalen Komplikationen von Chloroprocain-Epiduralanästhesie. Reg Anesth 1984;9:124–134.
- Gissen AJ, Datta S, Lambert D: Die Chloroprocain-Kontroverse. II. Ist Chloroprocain neurotoxisch? Reg Anesth 1984;9:135–145.
- Winnie AP, Nader AM: Santayanas Prophezeiung erfüllt. Reg Anesth Pain Med 2001;26:558–564.
- Kouri ME, Kopacz DJ: Spinales 2-Chloroprocain: Ein Vergleich mit Lidocain bei Freiwilligen. Anesth Analg 2004;98:75–80.
- Taniguchi M, Bollen AW, Drasner K: Natriumbisulfit: Sündenbock für die Neurotoxizität von Chloroprocain? Anesthesiology 2004;100:85–91.
- Lambert LA, Lambert DH, Strichartz GR: Irreversibler Leitungsblock in isoliertem Nerv durch hohe Konzentrationen von Lokalanästhetika. Anästhesiologie 1994;80:1082–1093.
- Gold MS, Reichling DB, Hampl KF, et al: Lidocain-Toxizität in primären afferenten Neuronen der Ratte. J Pharmacol Exp Ther 1998;285:413–421.
- Neal JM, Bernards CM, Butterworth JF 4th, et al. ASRA-Praxisberatung zur systemischen Toxizität von Lokalanästhetika. Reg Anesth Pain Med. 2010;35: 152–61
- Corcoran, W., Butterworth, J., Weller, RS, et al. Lokalanästhesie-induzierte Herztoxizität: eine Übersicht über zeitgenössische Praxisstrategien in akademischen Anästhesieabteilungen. Anesth Analg. 2006;103:1322–6
- El-Boghdadly K, Chin KJ. Systemische Toxizität von Lokalanästhetika: Kontinuierliche berufliche Entwicklung. Kann J Anaesth. 2016;63:330–349
- Krismer AC, Hogan QH, Wenzel V, et al: Die Wirksamkeit von Epinephrin oder Vasopressin zur Wiederbelebung während der Epiduralanästhesie. Anesth Analg 2001;93:734–742.
- Mayr VD, Raedler C, Wenzel V, et al: Ein Vergleich von Epinephrin und Vasopressin in einem Schweinemodell des Herzstillstands nach schneller intravenöser Injektion von Bupivacain. Anesth Analg 2004;98:1426–1431.
- Weinberg GL, VadeBoncouer T, Ramaraju GA, et al: Vorbehandlung oder Wiederbelebung mit einer Lipidinfusion verschiebt die Dosis-Antwort auf Bupivacain-induzierte Asystolie bei Ratten. Anesthesiology 1998;88:1071–1075.
- Weinberg G, Ripper R, Feinstein DL, et al.: Lipidemulsionsinfusion rettet Hunde vor Bupivacain-induzierter Herztoxizität. Reg Anesth Pain Med 2003;28:198–202.
- Fettiplace MR, Weinberg G. Vergangenheit, Gegenwart und Zukunft der Lipid-Reanimationstherapie. JPEN J Parenter Enteral Nutr. 2015;39 (1 Ergänzung): 72S-83S.
- Soltesz EG, van Pelt F, Byrne JG: Emergenter kardiopulmonaler Bypass für Bupivacain-Kardiotoxizität. J Cardiothorac Vasc Anesth 2003;17: 357–358.
- Vasques F, Behr AU, Weinberg G, et al. Eine Übersicht über Fälle von systemischer Toxizität bei Lokalanästhetika seit der Veröffentlichung der Empfehlungen der American Society of Regional AnAesthetics: To Whom It May Concern. Reg Anesth Pain Med. 2015;40:698–705.
- Liu SS, Ortolan S, Sandoval MV, Curren J, Fields KG, Memtsoudis SG, YaDeau JT. Herzstillstand und Krampfanfälle durch Lokalanästhesie Systemische Toxizität nach peripheren Nervenblockaden: Sollten wir den Reaper noch fürchten? Reg Anesth Pain Med. 2016;4:5–21.
- Barrington MJ, Kluger R. Ultraschallführung reduziert das Risiko einer systemischen Toxizität von Lokalanästhetika nach einer peripheren Nervenblockade. Reg Anesth Pain Med. 2013;38:289–299.
- Neal JM, Brull R, Horn JL, et al. Evidence-Based Medicine Assessment of Ultraschall-geführte Regionalanästhesie der Zweiten Amerikanischen Gesellschaft für Regionalanästhesie und Schmerzmedizin: Zusammenfassung. Reg Anesth Pain Med. 2016;41:181–194

