Adam K. Jacob, Sandra L. Kopp und James R. Hebl
EINFÜHRUNG
Vorbestehende neurologische Erkrankungen des peripheren Nervensystems, des zentralen Nervensystems und des Spinalkanals stellen sowohl für Patienten als auch für Anästhesisten, die regionale Anästhesietechniken anwenden möchten, eine einzigartige Herausforderung dar. Da jeder dieser klinischen Zustände eine Beeinträchtigung neuraler Strukturen beinhaltet, besteht die Sorge darin, dass eine weitere Schädigung durch chirurgische (z. B. intraoperative Dehnung oder Kompression, Tourniquet-Ischämie, Blutung) oder Anästhesie (z. B. mechanisches Trauma, Vasokonstriktor-induzierte Ischämie, Toxizität von Lokalanästhetika) Ursachen können zu neuen oder sich verschlechternden postoperativen neurologischen Defiziten führen.
Unabhängig von der zugrunde liegenden Ätiologie, das Vorhandensein einer chronischen neuronalen Beeinträchtigung infolge mechanischer (z. B. Spinalkanalstenose oder kompressive Radikulopathie), ischämischer (z. B. periphere Gefäßerkrankung), toxischer (z. B. Vincristin- oder Cisplatin-Chemotherapie), metabolischer (z. B. Diabetes mellitus). ) oder Autoimmunstörungen (z. B. Multiple Sklerose) können Patienten einem erhöhten Risiko weiterer neurologischer Verletzungen aussetzen. Upton und McComas waren die ersten, die das „Double-Crush-Phänomen“ beschrieben, das darauf hindeutet, dass Patienten mit vorbestehender neuraler Beeinträchtigung möglicherweise anfälliger für Verletzungen an einer anderen Stelle sind, wenn sie einem sekundären Insult ausgesetzt sind (Figure 1). Sekundäre Insulte können eine Vielzahl akuter chirurgischer oder anästhesiologischer Risikofaktoren umfassen, einschließlich derer regionaler Anästhesietechniken. Osterman betonte, dass nicht nur zwei geringgradige Verletzungen entlang eines peripheren Nervenstamms schlimmer seien als nur eine an einer einzigen Stelle, sondern dass der Schaden der doppelten Verletzung den erwarteten zusätzlichen Schaden durch jede isolierte Verletzung bei weitem übersteigt. Es kann ferner postuliert werden, dass der zweite Angriff nicht entlang des peripheren Nervenstamms selbst erfolgen muss, sondern vielmehr an jedem Punkt entlang des neuralen Übertragungswegs. Daher kann die Durchführung peripherer oder neuraxialer regionaler Techniken bei Patienten mit vorbestehenden neurologischen Störungen sie einem erhöhten Risiko für das Double-Crush-Phänomen aussetzen.
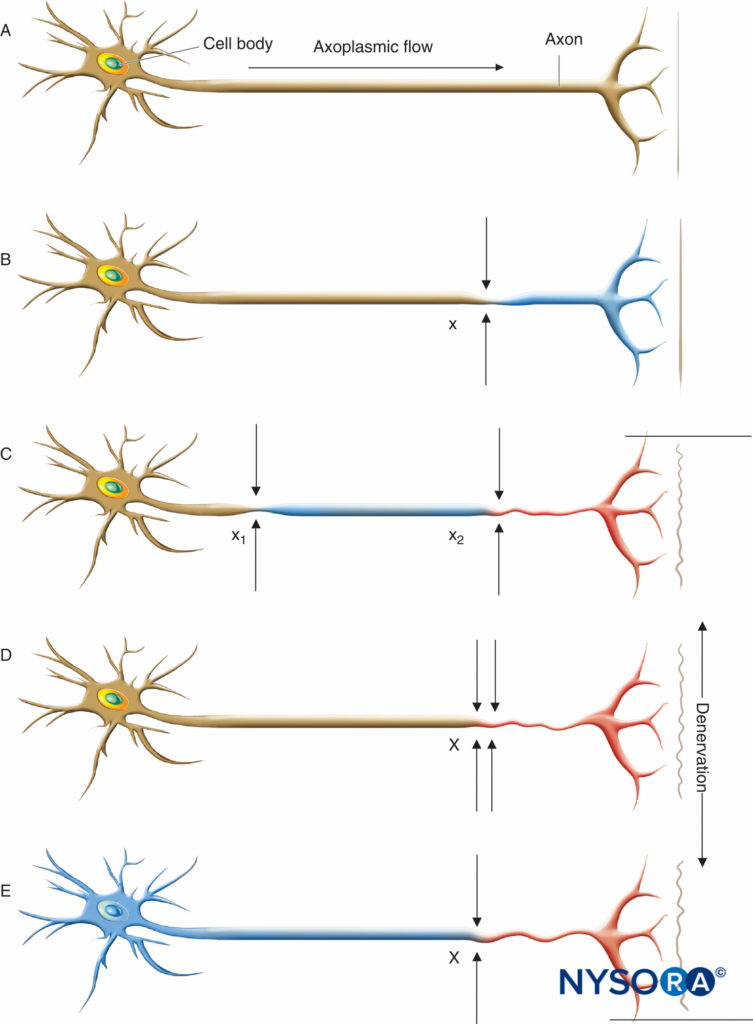
ABBILDUNG 1. Neurale Läsionen, die zu Denervation führen. Axoplasmatischer Fluss wird durch den Grad der Schattierung angezeigt. Ein vollständiger Verlust des axoplasmatischen Flusses führt zu einer Denervation (C, D, E). A: Normales Neuron. B: Eine leichte neuronale Verletzung an einer einzelnen Stelle (x) reicht nicht aus, um eine Denervation distal des Insults zu verursachen. C: Eine leichte neuronale Verletzung an zwei getrennten Stellen (x1 und x2) kann eine distale Denervation verursachen (dh „doppeltes Quetschen“). D: Eine schwere neuronale Verletzung an einer einzelnen Stelle (X) kann auch eine distale Denervation verursachen. E: Axon mit einem diffusen, vorbestehenden zugrunde liegenden Krankheitsprozess (toxisch, metabolisch, ischämisch) kann einen beeinträchtigten axonalen Fluss durch das Neuron aufweisen, der symptomatisch sein kann oder nicht, aber das Axon für eine distale Denervation nach einer einzelnen geringfügigen neuralen Verletzung bei x prädisponiert ( dh „doppelt verknallt“). (Reproduziert mit Genehmigung der Mayo Foundation for Medical Education and Research.)
Leider sind die verfügbaren Daten bezüglich einer Assoziation von vorbestehenden neurologischen Erkrankungen und postregionaler Anästhesie-Dysfunktion oft widersprüchlich in Bezug auf Ergebnisse und Schlussfolgerungen. Aus der bestehenden wissenschaftlichen Literatur lassen sich daher selten definitive Empfehlungen ableiten. Die folgende Diskussion bietet jedoch einen umfassenden Überblick über die verfügbare Literatur zu diesem Thema, damit Patienten und Ärzte eine fundierte Entscheidung hinsichtlich des potenziellen neurologischen Risikos der Durchführung einer Regionalanästhesie bei Vorliegen vorbestehender neurologischer Erkrankungen treffen können.
STÖRUNGEN DES PERIPHEREN NERVENSYSTEMS
Das periphere Nervensystem besteht aus zahlreichen Zelltypen, die verschiedenen sensorischen, motorischen und autonomen Funktionen dienen. Anzeichen und Symptome einer eingeschränkten Funktion hängen von der Verteilung und Schwere der Verletzung sowie von dem spezifischen Element des betroffenen Nervs ab. Mehr als 100 periphere Neuropathien wurden identifiziert, jede mit ihrer eigenen Pathophysiologie, Symptomen und Prognose.
Hereditäre periphere Neuropathie
Vererbte Neuropathien stellen eine heterogene Gruppe von Krankheiten dar, die oft die Merkmale eines schleichenden Beginns und eines trägen Verlaufs über Jahre bis Jahrzehnte gemeinsam haben. Eine breite Palette von Genotypen führt zu Phänotypen, die von leichten Symptomen und subklinischen Erkrankungen bis hin zu schweren, schwächenden Zuständen reichen. Die häufigsten erblichen Neuropathien sind eine Gruppe von Erkrankungen, die zusammenfassend als Charcot-Marie-Tooth (CMT)-Krankheit bezeichnet werden. CMT betrifft etwa 1 von 2500 Menschen und beginnt oft in der Kindheit oder Jugend. CMT-Neuropathien werden durch Mutationen in mehr als 30 Genen verursacht, die für die Herstellung von Neuronen oder der Myelinscheide verantwortlich sind. Typische Anzeichen und Symptome sind extreme motorische Schwäche und Muskelschwund in den distalen unteren Extremitäten und Füßen, Gangstörungen, Verlust der Sehnenreflexe und Taubheit in den unteren Gliedmaßen. Der berichtete Einsatz peripherer oder zentraler regionaler Anästhesietechniken bei Patienten mit CMT beschränkt sich auf kleine Fallserien und anekdotische Fallberichte. Alle Patienten erholten sich komplikationslos, ohne dass sich ihre neurologischen Zustände verschlechterten. Bemerkenswert ist, dass zwei Fälle mit regionaler Einzelinjektionstechnik (Epiduralanästhesie mit 18 ml 0.75 % Ropivacain und supraklavikuläre Analgesie mit 30 ml 0.5 % Bupivacain) über eine verlängerte Wirkung (12 Stunden bzw. 30 Stunden) der regionalen Technik im Vergleich zu berichteten voraussichtliche Dauer. In beiden Fällen kann die Verwendung höherer Konzentrationen von Lokalanästhetika zu der verzögerten Genesung beigetragen haben.
Hereditäre Neuropathie mit Anfälligkeit für Drucklähmung (HNPP) ist eine weitere seltene vererbte demyelinisierende periphere Neuropathie, bei der Personen nach kurzer Nervenkompression oder leichtem Trauma (dh Drucklähmung) an wiederholten motorischen und sensorischen Neuropathien leiden. Erstmals in den frühen 1990er Jahren beschrieben, wurde HNPP mit einer Mutation auf dem PMP-22-Gen in Verbindung gebracht, was zu einer verringerten Myelinproduktion führte. Der Nachweis für die Verwendung einer regionalen Technik bei der Einstellung von HNPP wurde auf einen Einzelfallbericht beschränkt. Lepski und Alderson berichteten über den erfolgreichen Einsatz einer Epiduralanästhesie bei einer 24-jährigen Gebärenden mit HNPP. Die Patientin erholte sich komplikationslos, ohne dass sich ihr neurologischer Zustand verschlechterte.
Aufgrund des Mangels an klinischer Evidenz können keine endgültigen Empfehlungen zur Sicherheit und Anwendung der Regionalanästhesie bei Patienten mit vorbestehenden erblichen peripheren Neuropathien gegeben werden. Einzelne Fallberichte deuten jedoch darauf hin, dass periphere und zentralregionale Techniken verwendet werden können, ohne den stabilen neurologischen Zustand eines Patienten zu verschlechtern. Es sollte jedoch darauf geachtet werden, andere Risikofaktoren für chirurgische (z. B. Tourniquet) und Anästhesie (z. B. reduzierte Konzentration oder Dosis eines Lokalanästhetikums) für perioperative Nervenverletzungen zu minimieren, wenn die Verwendung einer Regionalanästhesie bei dieser Patientengruppe in Betracht gezogen wird.
Erworbene periphere Neuropathie Diabetische Polyneuropathie
Die zunehmende Prävalenz von Diabetes mellitus (DM) und den damit verbundenen Komorbiditäten wird wahrscheinlich zu einer größeren Anzahl von Diabetikern führen, die sich zur Operation vorstellen. Trotz des klinischen Nutzens und der weit verbreiteten Anwendung der Regionalanästhesie (periphere und neuraxiale Blockade) bleiben Bedenken hinsichtlich ihrer Anwendung bei Patienten mit DM bestehen. Es wurde vermutet, dass Patienten mit einer Vorgeschichte von chronischen neuronalen Beeinträchtigungen infolge von Stoffwechselerkrankungen wie Diabetes einem erhöhten Risiko für eine Verschlechterung neurologischer Verletzungen nach einer neuraxialen oder peripheren Nervenblockade ausgesetzt sind.
Diabetes mellitus ist derzeit die häufigste Ursache einer systemischen Polyneuropathie. Es gibt mehrere Arten von Neuropathie im Zusammenhang mit DM, aber die distale symmetrische sensomotorische Polyneuropathie ist die häufigste Form und im Allgemeinen synonym mit dem Begriff diabetische Polyneuropathie (DPN). Die Häufigkeit der DPN reicht von 4–8 % zum Zeitpunkt der Diagnose bis zu über 50 % bei Patienten mit langjährigem Diabetes. Trotz der Tatsache, dass Patienten asymptomatisch sein können, weisen fast alle Anzeichen einer abnormalen Nervenleitung auf. Darüber hinaus ist es relativ üblich, dass sich Patienten entweder mit nicht diagnostiziertem Diabetes mellitus oder bekanntem Diabetes mit unkontrollierter Hyperglykämie zur Operation vorstellen.
Die Pathophysiologie von DPN ist kaum verstanden und wahrscheinlich multifaktoriell. Frühe Symptome wie Taubheit, Schmerzen und autonome Dysfunktion werden durch Schäden an kleinen Nervenfasern verursacht, die auftreten, bevor Schäden an großen Fasern sichtbar werden. Es gibt pathophysiologische Hinweise auf Anomalien sowohl in großen als auch in kleinen neuralen Blutgefäßen, die letztendlich zum Verlust multifokaler Fasern beitragen. Axonale Degeneration ist das hervorstechendste Merkmal von DPN und tritt sekundär zu der reduzierten Zufuhr von essentiellen Nährstoffen und anderen Komponenten (Sauerstoff, Blut, Adenosintriphosphat, Glucose) zum Axon auf. Zu den vorgeschlagenen Mechanismen gehören (1) Sorbitablagerung im Nerv aufgrund von Glucoseakkumulation; (2) lokale Gewebeischämie in sensorischen und autonomen Fasern als Folge endoneuraler Hypoxie; (3) abnormale Gewebereparaturmechanismen, die durch überschüssige Glukose verursacht werden; und (4) mitochondriale Dysfunktion innerhalb der Spinalganglien.
Derzeit gibt es eine Fülle von Tierdaten, die darauf hindeuten, dass diabetische Nerven im Vergleich zu nicht diabetischen Nerven ein erhöhtes Risiko für neurologische Verletzungen nach Regionalanästhesie haben. Kalichman und Calcutt stellten als erste die Hypothese auf, dass diabetische Nervenfasern aus zwei Gründen anfälliger für Neurotoxizität von Lokalanästhetika sein könnten: (1) der Nerv ist aufgrund chronischer ischämischer Hypoxie bereits gestresst; und (2) die Nerven sind aufgrund des verringerten perineuralen Blutflusses größeren Konzentrationen von Lokalanästhetika ausgesetzt. In jüngerer Zeit wurden diese Ergebnisse sowohl durch Tier- als auch durch klinische Daten gestützt. Lirk und Kollegen verwendeten Zucker-Diabetiker-Fettratten, die Hyperglykämie ausgesetzt waren, um zu zeigen, dass, obwohl der neuronale Gesamtüberlebensunterschied gering war, die Neurotoxizität von Lokalanästhetika in vitro in Neuronen von diabetischen Tieren ausgeprägter war. Die Autoren berichteten auch, dass eine vorbestehende subklinische Neuropathie zu einer erheblichen Verlängerung der Blockierungsdauer in vivo führte. Kroin und Kollegen berichteten auch, dass die Dauer der Ischiasnervenblockade mit 1 % Lidocain oder 0.5 % Ropivacain bei Streptozotocin-induzierten diabetischen Ratten länger war als bei nicht diabetischen Ratten, und dass die Dauer der Blockade mit der Degeneration der Nervenfasern korrelierte. In einer nachfolgenden Studie kamen die gleichen Autoren auch zu dem Schluss, dass diabetische Ratten bei kontinuierlicher glykämischer Kontrolle eine ähnliche Blockadedauer hatten wie nicht diabetische Ratten und 40 Minuten kürzer als bei diabetischen Ratten ohne glykämische Kontrolle. Interessanterweise verringerte die akute glykämische Kontrolle die Dauer der Nervenblockade nicht, was darauf hindeutet, dass die diabetische Neuropathie in diesem Tiermodell nicht schnell rückgängig gemacht wird. Derzeit ist unklar, ob die Ergebnisse aus Tierstudien mit experimentell induzierter Hyperglykämie verwendet werden können, um Empfehlungen für Patienten mit langjährigem Diabetes mellitus auszusprechen.
Obwohl Tierversuche übereinstimmend gezeigt haben, dass diabetische Nerven empfindlicher auf Lokalanästhetika reagieren und möglicherweise anfälliger für neurale Verletzungen sind, ist unklar, ob Diabetiker nach Regionalanästhesie eine höhere Inzidenz von neurologischen Verletzungen erleiden. Es liegen begrenzte klinische Daten vor, die darauf hindeuten, dass der Erfolg einer peripheren Nervenblockade (supraklavikulärer Plexus brachialis) bei Diabetikern unabhängig von anderen Erfolgsprädiktoren (z. B. Body-Mass-Index) im Vergleich zu Nicht-Diabetikern höher sein kann. Gebhard und Kollegen haben mehrere Theorien für diesen Befund vorgeschlagen, darunter (1) eine höhere Empfindlichkeit diabetischer Nervenfasern gegenüber Lokalanästhetika; (2) mögliche unbekannte intraneurale Penetration vor der Injektion; und (3) vorbestehende DPN mit begleitender verminderter Empfindung. Es wurde lange berichtet, dass eine vorbestehende Pathologie eine Rolle bei der Entwicklung einer postoperativen neurologischen Dysfunktion spielt. Ein kürzlich erschienener Fallbericht beschrieb eine persistierende postoperative femorale Neuropathie nach Absetzen eines femoralen Nervenkatheters bei einem Patienten mit vorbestehender subklinischer diabetischer Neuropathie, die präoperativ nicht diagnostiziert worden war.
Bei Patienten mit Diabetes mellitus kann eine verringerte Empfindlichkeit gegenüber elektrischer Stimulation in Kombination mit einer verminderten sensorischen Funktion und einer erhöhten Empfindlichkeit gegenüber Toxizität von Lokalanästhetika das Risiko einer intraneuralen Injektion während einer peripheren Nervenblockade unter Verwendung eines peripheren Nervenstimulators erhöhen. Derzeit fehlt es an klinischen Beweisen dafür, dass die Verwendung von Ultraschallführung in der Allgemeinbevölkerung sicherer ist als die periphere Nervenstimulation. Dieser Mangel an nachgewiesenem klinischem Nutzen ist jedoch für Diabetiker weniger klar. Beispielsweise gibt es eine begrenzte Anzahl von Tierversuchen und klinischen Studien, die darauf hindeuten, dass die Ultraschallführung eine wünschenswertere Methode zur neuralen Lokalisierung bei Diabetikern sein könnte. Tierversuche haben gezeigt, dass eine niederschwellige elektrische Stimulation möglicherweise keinen Schutz vor einer intraneuralen Injektion bei Vorhandensein einer Hyperglykämie bietet. Rigaud und Kollegen zeigten, dass alle Nadelinsertionen in einem hyperglykämischen Hundemodell zu einer intraneuralen Injektion führten (6/6), während bei Kontrollhunden nur eine (1/18) intraneurale Injektion auftrat. Standorte und Kollegen kamen auch zu dem Schluss, dass die Ultraschallführung eine bevorzugte Methode der neuralen Lokalisierung bei Diabetikern sein könnte, nachdem es bei zwei Patienten, die sich einer Ischiasnervenblockade unter peripherer Nervenstimulation unterzogen, keine motorische Reaktion oder Parästhesie hervorzurufen vermochte. Die Autoren beschrieben eine sehr schwache motorische Reaktion bei beiden Diabetikern bei einem Reizstrom von mehr als 2.4 mA trotz perineuraler Platzierung der Reiznadel unter Ultraschallführung. Eine weitere potenzielle Anwendung der Ultraschalltechnologie ist die Fähigkeit, den Querschnittsbereich eines peripheren Nervs zu verwenden, um eine klinische oder subklinische periphere Neuropathie zu identifizieren: eine Diagnose, die in der Vergangenheit komplexe Nervenleitungsstudien erfordert hätte.
Befunde zur Beteiligung des Rückenmarks bei Diabetikern legen nahe, dass derselbe oder ein ähnlicher Verletzungsmechanismus nicht nur periphere Nerven, sondern auch neurale Elemente innerhalb der zentralen Neuraxis betreffen kann. Mithilfe der Magnetresonanztomographie beschrieben Selvarahah und Kollegen eine frühe Beteiligung des zentralen Nervensystems, die aus einer signifikanten Verringerung der Querschnittsfläche des Rückenmarks bei Patienten mit sowohl subklinischer als auch klinisch nachweisbarer diabetischer peripherer Neuropathie bestand. Ein Fallbericht eines Diabetikers, der nach scheinbar komplikationsloser Epiduralanästhesie an einer anhaltenden Neuropathie der unteren Extremitäten litt, verstärkt die Bedenken, dass bei Diabetikern nach einer Neuraxialanästhesie ein erhöhtes Risiko für neurologische Verletzungen bestehen könnte. Eine retrospektive Überprüfung bewertete auch neurologische Komplikationen bei Patienten mit vorbestehender peripherer sensomotorischer Neuropathie oder diabetischer Polyneuropathie, die anschließend einer neuraxialen Anästhesie oder Analgesie unterzogen wurden. Von den 567 untersuchten Patienten traten bei zwei (0.4 %; 95 %-KI 0.1 %–1.3 %) neue oder fortschreitende postoperative neurologische Defizite im Vergleich zu präoperativen Befunden auf. Die Autoren kamen zu dem Schluss, dass das Risiko schwerer postoperativer neurologischer Verletzungen bei Diabetikern zwar selten ist, aber höher zu sein scheint als bei der Allgemeinbevölkerung. Obwohl die neuraxiale Technik nicht definitiv als primäre Ursache des neurologischen Insults in Verbindung gebracht werden konnte, könnte sie bei Patienten mit vorbestehender neuraler Beeinträchtigung ein beitragender Faktor gewesen sein.
Zusammenfassend lässt sich sagen, dass Patienten mit DPN wahrscheinlich neurale Elemente haben, die empfindlicher auf die Wirkung von Lokalanästhetika reagieren. Infolgedessen können diabetische periphere Nerven anfälliger für nachfolgende Verletzungen durch Toxizität von Lokalanästhetika oder ischämische Verletzungen sein. Letztendlich sollte die Entscheidung für den Einsatz einer Regionalanästhesie bei Diabetikern individuell nach einem ausführlichen Gespräch mit dem Patienten über die möglichen Risiken und Vorteile der Technik getroffen werden. Es sollte erwogen werden, die Konzentration oder Gesamtdosis des Lokalanästhetikums sowohl bei peripheren als auch bei neuraxialen Techniken zu verringern – insbesondere bei stark symptomatischen Patienten. Darüber hinaus kann die Verwendung von Ultraschallführung die perineurale Nadelplatzierung und die Verwendung geringerer Lokalanästhesievolumina bei Diabetikern erleichtern, obwohl derzeit definitive Daten fehlen, die eine erhöhte Sicherheit mit Ultraschallführung gewährleisten. Eine Verringerung der Konzentration oder Dosis des Lokalanästhetikums und die Eliminierung von Epinephrinzusätzen sollten ebenfalls in Betracht gezogen werden, da diabetische Nerven aufgrund von Veränderungen innerhalb der endoneuralen Mikrovaskulatur bereits einem Risiko für neurale Ischämie und Infarkt ausgesetzt sind.
Chemotherapie-induzierte Neuropathie
Chemotherapie-induzierte periphere Neuropathie (CIPN) ist eine häufige Nebenwirkung mehrerer häufig verwendeter Chemotherapeutika. Es handelt sich um eine dosislimitierende Nebenwirkung, die bei etwa 30–40 % der Patienten auftritt. Der genaue Verletzungsmechanismus ist unklar, obwohl eine Schädigung der Mikrotubuli, eine Störung des auf Mikrotubuli basierenden axonalen Transports, eine mitochondriale Störung und zytotoxische Wirkungen auf die DNA mögliche Mechanismen sind. Der Grad der Neurotoxizität hängt von dem verwendeten Wirkstoff, der Verabreichungsdauer und der erhaltenen kumulativen Dosis ab. Cisplatin, Oxaliplatin und Carboplatin induzieren charakteristischerweise eine rein sensorische, schmerzhafte periphere Neuropathie, während Vincristin, Paclitaxel und Suramin dazu neigen, eine gemischte sensomotorische Neuropathie mit oder ohne Beteiligung des autonomen Nervensystems zu induzieren. Die Symptome sind oft im „Handschuh-und-Strumpf“-Verteilung und bestehen aus Schmerzen oder Parästhesien. Zu den Patienten mit einem Risiko für die Entwicklung von CIPN gehören solche mit vorbestehenden neuralen Schäden infolge von Diabetes mellitus, übermäßigem Alkoholkonsum oder erblicher peripherer Neuropathie. Im Allgemeinen ist eine verlängerte Regenerationsphase erforderlich, um die neurologische Funktion wiederherzustellen, wobei eine unvollständige Erholung das häufigste Ergebnis ist. Patienten, die sich von CIPN erholen, haben jedoch ein erhöhtes Risiko, fortschreitende neuropathische Symptome zu entwickeln, wenn sie zusätzlichen neurotoxischen Mitteln ausgesetzt werden. Lokalanästhetika sind potenziell neurotoxisch, und bei der Entscheidung, ob bei Patienten, die Chemotherapeutika erhalten haben, von denen bekannt ist, dass sie CIPN verursachen, eine Regionalanästhesie durchgeführt werden soll, ist Vorsicht geboten. Es ist üblich, dass Patienten eine subklinische Neuropathie haben, die sich erst nach einem zweiten neurologischen Insult, wie einer peripheren oder neuraxialen Blockade, zeigt.
Einklemmungsneuropathie
Einklemmungsneuropathie, eine der am weitesten verbreiteten Erkrankungen des peripheren Nervensystems, tritt auf, wenn ein einzelner Nerv an einer bestimmten Stelle chronisch komprimiert oder mechanisch verletzt wird. Die Einklemmung des N. ulnaris am Ellbogen, die als „Cubital-Entrapment-Syndrom“ bezeichnet wird, ist die zweithäufigste Kompressionsneuropathie der oberen Extremitäten. Der N. ulnaris ist aufgrund seiner oberflächlichen Lage im Bereich des medialen Ellenbogens einem erhöhten Risiko ausgesetzt. Eine Verletzung des Nervs kann als Folge eines akuten Traumas, einer Kompression, wiederholten Zugs, einer Subluxation des Nervs, Osteoarthritis oder Gicht oder nach einem chirurgischen Eingriff an der oberen Extremität auftreten. Anfängliche Symptome sind Hyperästhesie im N. ulnaris-Verteiler, Ellbogenschmerzen und Parästhesien im Ring- und kleinen Finger. Diese Symptome sind oft intermittierend und können im Laufe von Monaten bis Jahren fortschreiten. In den späteren Stadien der Erkrankung kann eine Schwäche der intrinsischen Handmuskulatur mit oder ohne sichtbare Atrophie beobachtet werden. Gegenwärtig besteht die übliche Praxis darin, Patienten mit leichten Symptomen ohne Schwäche oder Atrophie konservativ zu behandeln, während eine Operation bei Patienten indiziert ist, bei denen sich nach einer konservativen Behandlung keine Besserung zeigt oder die schwere neurologische Anzeichen und Symptome aufweisen (z. B. anhaltende Parästhesie, objektive Schwäche, Muskelatrophie).
Allgemeine, regionale oder lokale Anästhesie kann zur chirurgischen Dekompression eines eingeklemmten Ulnarisnervs verwendet werden. Die Wahl des Anästhetikums hängt vom chirurgischen Eingriff ab, davon, ob die Nervenfunktion intraoperativ getestet werden soll, und vom Ausmaß der mit der Nervenverletzung einhergehenden Schädigung. In einer Kohortenstudie aus dem Jahr 2001 mit 360 Patienten mit vorbestehender ulnarer Neuropathie, die sich einer Transposition des N. ulnaris unterziehen, stellten Hebl und Kollegen fest, dass die Anästhesietechnik (Vollnarkose versus Regionalanästhesie) das neurologische Ergebnis unmittelbar nach der Operation oder zwei bis sechs Wochen postoperativ nicht beeinflusste. Ein präoperatives Gespräch mit dem Chirurgen zur Festlegung des intraoperativen Plans und zur Behandlung spezifischer Bedenken im Zusammenhang mit dem Krankheitsverlauf des Patienten hilft dem Anästhesisten bei der Auswahl der am besten geeigneten Anästhesietechnik.
Entzündliche Neuropathie Guillain-Barré-Syndrom
Das Guillain-Barré-Syndrom (GBS) ist eine akute, entzündliche demyelinisierende Polyneuropathie, die durch Areflexie und diffuse aufsteigende neuromuskuläre Lähmung gekennzeichnet ist. Die Ätiologie von GBS ist unklar, obwohl Infektionen, Schwangerschaft, Impfungen, Immunsuppression, systemische Erkrankungen und Transfusionen alle als mögliche Auslöser vorgeschlagen wurden. Der Grad und die Verteilung der Lähmung ist variabel und kann eine Beteiligung des sensorischen Nervs, des Hirnnervs und des autonomen Nervensystems umfassen. Die Symptome erreichen ihren Höhepunkt etwa zwei bis vier Wochen nach dem ersten Auftreten, wobei die meisten Patienten eine verlängerte Genesung erfahren. Leider leiden viele Patienten noch Jahre nach der Erstdiagnose an mittelschweren bis schweren neurologischen Beeinträchtigungen.
Es gibt mehrere Berichte über GBS, die in der postoperativen Phase nach einer Vielzahl von chirurgischen Eingriffen unter Verwendung verschiedener Arten von Anästhetika auftreten. Fallberichte über die Verwendung von Regionalanästhetika bei Patienten mit GBS sind jedoch im Allgemeinen auf die geburtshilfliche Population beschränkt. Einige Patienten mit GBS können eine autonome Instabilität aufweisen und zeigen anschließend eine übertriebene Reaktion auf eine neuraxiale Blockade, während andere GBS-Patienten eine normale Reaktion auf eine neuraxiale Anästhesie zeigen. Obwohl es Berichte über erfolgreiche neuroaxiale Anästhesie bei Gebärenden mit GBS gibt, kann das Potenzial von Lokalanästhetika, mit peripherem Myelin zu interagieren oder ein direktes Nerventrauma zu verursachen, nicht ignoriert werden. Es gibt Hinweise darauf, dass eine Epiduralanästhesie GBS Stunden bis Wochen nach der Operation auslösen oder reaktivieren kann. Es ist jedoch schwierig festzustellen, ob dies auf die Auswirkungen der Epiduralanästhesie, den natürlichen Krankheitsverlauf, den chirurgischen Eingriff oder die mit der Operation verbundene Stressreaktion zurückzuführen ist. Obwohl vorgeschlagen wurde, dass eine akute neuronale Entzündung eine relative Kontraindikation für eine Regionalanästhesie sein könnte, liefern die vorhandenen Daten wenig Informationen über die Sicherheit einer neuraxialen Anästhesie oder einer peripheren Nervenblockade bei Patienten mit GBS. Letztendlich sollte die Entscheidung zur Durchführung einer Regionalanästhesie individuell nach einem ausführlichen Gespräch mit dem Patienten über mögliche Risiken und Vorteile getroffen werden.
Postoperative entzündliche Neuropathie
Die postoperative entzündliche Neuropathie (PSIN) ist ein kürzlich beschriebener Autoimmun- oder Entzündungsprozess, der die Ursache für schwere postoperative neurologische Defizite sein kann. Mitarbeiter und Kollegen beschrieben kürzlich eine Serie von 33 Patienten, die innerhalb von 30 Tagen nach der Operation PSIN entwickelten. Die Diagnose wurde bei den meisten Patienten nach einer peripheren Nervenbiopsie bestätigt. Es wird angenommen, dass PSIN eine idiopathische, immunvermittelte Reaktion auf einen physiologischen Stress wie einen infektiösen Prozess, eine Impfung oder einen chirurgischen Eingriff ist. Der Zustand kann sich als fokale, multifokale oder diffuse neurologische Defizite im Rahmen einer negativen Röntgenbildgebung darstellen. Die Diagnose wird dadurch erschwert, dass der Beginn neurologischer Defizite während der unmittelbaren postoperativen Phase möglicherweise nicht offensichtlich ist und die Defizite in einer anatomischen Verteilung entfernt von der Operationsstelle oder der regionalen Anästhesietechnik auftreten können. Zu den Risikofaktoren oder potenziellen Auslösern für PSIN gehören bösartige Erkrankungen, Diabetes mellitus, Tabakkonsum, systemische Infektionen, die Anwendung flüchtiger Anästhetika und kürzlich erfolgte Bluttransfusionen. Die Unterdrückung der Immunantwort mit verlängerten hochdosierten Kortikosteroiden oder intravenösem Immunglobulin ist derzeit die Behandlung der Wahl. Das Ziel der Behandlung ist es, die Entzündungsreaktion ausreichend abzuschwächen, um eine axonale Regeneration zu ermöglichen. Glücklicherweise bessern sich die meisten Patienten mit den aktuellen Behandlungsempfehlungen, wobei Schmerzen und sensorische Defizite besser werden, bevor die motorischen Defizite verschwinden.
Das Ausmaß, in dem entzündliche Mechanismen bei der postoperativen neurologischen Dysfunktion eine Rolle spielen, ist unbekannt und kaum charakterisiert, insbesondere in der Anästhesieliteratur. Infolgedessen berücksichtigen Anästhesisten und Chirurgen diese potenzielle Ätiologie einer Nervenverletzung bei der Beurteilung von Patienten mit postoperativen Defiziten selten. Dies ist problematisch, da der übliche Ansatz des beobachtenden Abwartens und des konservativen Managements bei Patienten mit PSIN nicht wirksam ist. Vielmehr ist PSIN ein klinischer Zustand, der früh im Krankheitsprozess vermutet werden muss, damit eine endgültige Diagnose (über eine Nervenbiopsie) erhalten und eine aggressive Immuntherapie eingeleitet werden kann, um zu versuchen, das neurologische Ergebnis zu verbessern.
STÖRUNGEN DES ZENTRALEN NERVENSYSTEMS
In der Vergangenheit wurden neuroaxiale Anästhesietechniken Patienten mit vorbestehenden neurologischen Störungen des zentralen Nervensystems (z. B. Multiple Sklerose, Postpolio-Syndrom, amyotrophe Lateralsklerose) aus Angst vor einer Verschlechterung des neurologischen Ergebnisses nicht angeboten. Tatsächlich glauben viele Historiker, dass die Empfehlung von Dripps und Vandam aus dem Jahr 1956, bei Patienten mit vorbestehenden neurologischen Störungen eine Regionalanästhesie zu vermeiden, die klinische Behandlung seit fast einem halben Jahrhundert beeinflusst hat. Auf der Grundlage des Double-Crush-Phänomens wurden mehrere theoretische Mechanismen vorgeschlagen, einschließlich neurologischer Verletzungen durch Nadel- oder Katheter-induziertes Trauma, Lokalanästhesie-Neurotoxizität und neurale Ischämie aufgrund von Lokalanästhesie-Additiven. Die Vermeidung einer Regionalanästhesie bei dieser Patientengruppe kann jedoch auch auf Vorurteile von Arzt und Patient oder mögliche medizinrechtliche Bedenken zurückzuführen sein. Es gibt mehrere verwirrende Faktoren (Alter, Körperhabitus, chirurgisches Trauma, Tourniquetzeiten und -drücke, Positionierung, Anästhesietechnik), die es schwierig machen, die Ätiologie sich verschlechternder postoperativer neurologischer Defizite zu bestimmen.
In einer kürzlich durchgeführten Übersichtsarbeit wurden 139 Patienten mit einer oder mehreren Erkrankungen des zentralen Nervensystems in der Vorgeschichte untersucht, die sich anschließend einer neuroaxialen Anästhesietechnik unterzogen. Zu den präoperativen neurologischen Erkrankungen gehörten hauptsächlich das Postpolio-Syndrom (PPS), Multiple Sklerose (MS), Amyotrophe Lateralsklerose (ALS) und chronische Rückenmarksverletzung (SCI). Im Gegensatz zu den Ergebnissen von Vandam und Dripps vor mehreren Jahrzehnten identifizierten die Autoren in ihrer Patientenkohorte keine neuen oder sich verschlechternden postoperativen neurologischen Defizite (0.0 %; 95 % KI, 0.0 %–0.3 %). Und das, obwohl 74 % der Patienten während der unmittelbaren präoperativen Phase über aktive neurologische Symptome (Parästhesien, Dysästhesien, Hyperreflexie) oder sensomotorische Defizite berichteten und anschließend Standarddosen von Lokalanästhetika erhielten. Zwei kleinere Übersichtsarbeiten bei Gebärenden, die kleinere Dosen Lokalanästhetikum zur Analgesie der Wehen erhielten, berichteten über ähnliche Ergebnisse.
Offensichtlich sind weitere Untersuchungen mit einer größeren Anzahl von Patienten erforderlich, um endgültige Empfehlungen zu geben. Die aktuellen Daten deuten jedoch darauf hin, dass die Entscheidung zur Durchführung einer neuroaxialen Anästhesie bei Patienten mit vorbestehenden Erkrankungen des zentralen Nervensystems auf den Risiken und Vorteilen für jeden einzelnen Patienten basieren sollte. Einige Autoren haben postuliert, dass das neurologische Risiko bei Patienten mit fortschreitenden neurologischen Defiziten höher sein könnte als bei Patienten mit chronischen, stabilen sensomotorischen Symptomen, die sich über mehrere Monate oder Jahre nicht verändert haben.
Multiple Sklerose
Multiple Sklerose ist eine entzündliche Autoimmunerkrankung des zentralen Nervensystems mit einem Lebenszeitrisiko von 1 zu 400, was sie zur häufigsten schwächenden neurologischen Erkrankung bei jungen Erwachsenen macht. Es ist eine chronische, degenerative Erkrankung, die durch fokale Demyelinisierung im Rückenmark und Gehirn gekennzeichnet ist. Diese Demyelinisierung führt zu einer schwankenden Reizleitungsblockade, die ein klassisches „Wachstum und Abklingen“ der Symptome verursacht, das für die Krankheit charakteristisch ist. Anzeichen und Symptome sind sensorische oder motorische Defizite, Diplopie oder Sehverlust, Darm- oder Blasenfunktionsstörungen und Ataxie. Die genaue Ätiologie ist unklar; jedoch spielt wahrscheinlich eine Kombination aus genetischen Risikofaktoren und Umweltfaktoren eine Rolle. 15 Prozent der MS-Patienten sind im Wesentlichen asymptomatisch und ihre Aktivitäten des täglichen Lebens sind nicht beeinträchtigt. Bis zu 5 % der Patienten können jedoch innerhalb kurzer Zeit mit erheblichen sensomotorischen Defiziten schwerbehindert werden. Mehrere chirurgische Faktoren können den Krankheitsprozess negativ beeinflussen, darunter Hyperpyrexie, emotionaler Stress und Infektionen. Der Mechanismus der Verschlechterung der neurologischen Funktion bei Patienten mit MS ist unklar und kann unabhängig von der Anästhesietechnik zufällig innerhalb der postoperativen Phase auftreten. Die Evidenz zum Risiko einer Regionalanästhesie bei Patienten mit MS ist begrenzt. Trotz einiger Hinweise auf eine Demyelinisierung der peripheren Nerven bei MS gilt die periphere Nervenblockade traditionell als sicher. Ein kürzlich erschienener Bericht über eine schwere Armplexopathie nach einer ultraschallgeführten interskalenären Blockade hat jedoch die Besorgnis geweckt, dass ein Segment von MS-Patienten eine subklinische periphere Neuropathie haben könnte. Mehrere Forscher haben Hinweise auf axonale demyelinisierende periphere Läsionen (mehr sensorisch als motorisch) bei Patienten mit MS nachgewiesen. Misawa und Kollegen zeigten, dass eine periphere Demyelinisierung bei 47 % der MS-Patienten auftreten kann, während Pogorzelski und Kollegen berichteten, dass eine periphere Demyelinisierung bei bis zu 14.7 % der Patienten auftreten kann. In ähnlicher Weise haben Sarova-Pinhas und Kollegen Anomalien der Nervenleitung bei bis zu 2.4 % der peripheren Nerven bei MS-Patienten beschrieben, verglichen mit nur XNUMX % der Nerven in der Allgemeinbevölkerung. Trotz dieser Evidenz bleibt die allgemeine Inzidenz und klinische Relevanz dieser zugrunde liegenden peripheren Neuropathie im Rahmen der Durchführung einer peripheren Nervenblockade bei Patienten mit MS undefiniert.
Im Gegensatz zur peripheren Nervenblockade wurde das potenzielle Risiko neuer oder fortschreitender neurologischer Defizite bei MS-Patienten nach Spinalanästhesie erstmals 1937 beschrieben. Critchley und Kollegen beschrieben drei Patienten mit [disseminierter (multiple) Sklerose], bei denen sich die Symptome nach Spinalanästhesie verschlimmerten Anästhesie. Die Autoren schlussfolgerten, dass [die Spinalanästhesie ein Auslöser für die Entwicklung der disseminierten (multiple) Sklerose sein könnte.] Mehrere nachfolgende Studien zeigten ähnliche Ergebnisse mit der Entwicklung neuer oder sich verschlechternder neurologischer Defizite oder einer höheren Wahrscheinlichkeit einer Symptomverschlimmerung nach der Spinalanästhesie. Im Gegensatz dazu zeigte eine neuere Studie keine neuen oder sich verschlechternden neurologischen Symptome nach Spinalanästhesie bei 35 MS-Patienten, die sich verschiedenen chirurgischen Eingriffen unterzogen.
Die Sicherheit von Epiduralanästhesie und Analgesie bei MS-Patienten konzentrierte sich fast ausschließlich auf die geburtshilfliche Population, die nicht-schwangere MS-Patienten möglicherweise nicht genau repräsentiert. Die Schwangerschaft ist häufig mit einem Rückgang der Krankheitsrückfälle verbunden, während die Zeit nach der Geburt häufig mit einem erhöhten Rückfallrisiko verbunden ist. Es wird angenommen, dass der Übergang von der zellulären Immunität zur humoralen Immunität, die für das Immunsystem der Mutter erforderlich ist, um den Fötus zu tolerieren, während der Schwangerschaft schützend wirkt. Wenn sich jedoch die zellvermittelte Immunität während der Zeit nach der Geburt erholt, erleben die Patientinnen oft eine vorübergehende Verschlechterung der neurologischen Symptome, die fälschlicherweise neueren Regionalanästhesietechniken zugeschrieben werden könnte.
Confavreux und Kollegen haben eine der wenigen prospektiven Studien durchgeführt, in denen Risikofaktoren im Zusammenhang mit einem Krankheitsrückfall während der Zeit nach der Geburt untersucht wurden. Sie kamen zu dem Schluss, dass eine Epiduralanästhesie während der Wehen und der Entbindung nicht zu einem höheren Rückfallrisiko im Vergleich zu Patientinnen beitrug, die keine neuroaxialen Techniken erhielten. In ähnlicher Weise fand Kuczkowski keinen Zusammenhang zwischen irgendeiner Form geburtshilflicher regionaler Analgesie und der Verschlechterung der MS-Symptome bei geburtshilflichen Patienten. Epiduralanästhesie und Analgesie werden bei MS-Patienten traditionell gegenüber Spinalanästhesie empfohlen, da die Konzentration des Lokalanästhetikums in der weißen Substanz des Rückenmarks ein Viertel des Niveaus nach epiduraler Injektion im Vergleich zu intrathekaler Injektion beträgt. Es wird angenommen, dass der Mangel an Myelin das Rückenmark anfällig für die neurotoxischen Wirkungen von Lokalanästhetika machen kann. Obwohl definitive Studien zu den pharmakologischen Wirkungen von Lokalanästhesiekonzentrationen und -dosen fehlen, empfehlen viele, die neuraxialen Lokalanästhesiedosen und -konzentrationen auf das niedrigstmögliche Niveau zu begrenzen. Es gibt Hinweise darauf, dass Lidocain die Symptome von MS reversibel verschlimmern kann, indem es die Natriumkanäle in demyelinisierten Bereichen so weit blockiert, dass Symptome verursacht werden, im Vergleich zu gesunden myelinisierten Bereichen, die nicht betroffen sind. Im Hinblick auf die geburtshilfliche Patientin muss das Risiko einer neuroaxialen Anästhesie oder Analgesie gegen das erhöhte Risiko einer Allgemeinanästhesie abgewogen werden. Eine kürzlich aus dem Vereinigten Königreich durchgeführte Umfrage hat gezeigt, dass 90 % der geburtshilflichen Anästhesisten eine Spinalanästhesie für einen Notkaiserschnitt bei einem MS-Patienten durchführen würden, nachdem sie die potenziellen Risiken und Vorteile sorgfältig abgewogen haben.
Zusammenfassend lässt sich sagen, dass es nur wenige schlüssige Beweise gibt, die die Verwendung einer Regionalanästhesie bei Patienten mit MS unterstützen oder widerlegen. Die periphere Nervenblockade hat sich nicht eindeutig als schädlich bei MS erwiesen, und daher sollte MS nicht als absolute Kontraindikation für diese regionale Technik angesehen werden. Im Gegensatz dazu können Epiduralanästhesie und Analgesie angesichts der Tatsache, dass demyelinisierte Fasern anfälliger für die toxischen Wirkungen von Lokalanästhetika sind, als sicherer angesehen werden als Wirbelsäulentechniken. Es kann jedoch ratsam sein, die Konzentration des Lokalanästhetikums und die Gesamtdosis auf die niedrigsten wirksamen Werte zu reduzieren, sowohl für die periphere als auch für die neuraxiale Blockade. Alle Entscheidungen über den Einsatz von Regionalanästhesie und Analgesie bei Patienten mit MS müssen nach sorgfältiger Abwägung der potenziellen Risiken und Vorteile getroffen werden. Unabhängig von der gewählten Anästhesietechnik sollten die Patienten über das Risiko neuer oder sich verschlechternder neurologischer Symptome während der postoperativen Phase aufgrund der Exposition gegenüber mehreren verschlimmernden Faktoren informiert werden.
Postpolio-Syndrom
Postpolio-Syndrom bezieht sich auf neu auftretende neurologische Symptome, die sich mehrere Jahre nach einer akuten Poliomyelitis-Infektion entwickeln. Das Auftreten neuer oder fortschreitender Symptome kann bis zu 30 Jahre nach der ersten Poliomyelitis-Episode auftreten. PPS betrifft Vorderhornzellen im vorderen Teil des Rückenmarks und wird daher als Erkrankung der unteren Motoneuronen angesehen. Erste Symptome sind Muskelschwäche, Müdigkeit, Gangunsicherheit, Gelenkschmerzen und Muskelatrophie innerhalb von Muskelgruppen, die zuvor von der Krankheit betroffen waren. Sensibilitätsdefizite sind im Allgemeinen nicht charakteristisch für das Syndrom und werden nur beobachtet, wenn eine sekundäre Störung vorliegt (z. B. kompressive Radikulopathie oder Bandscheibenvorfall). Es wird angenommen, dass die motorischen Auswirkungen von PPS mit einem fortlaufenden Prozess der Denervation und Reinnervation zusammenhängen, der letztendlich endet, wenn die Denervation nicht mehr durch Reinnervation kompensiert wird.
Das Postpolio-Syndrom ist die am weitesten verbreitete Motoneuronerkrankung in Nordamerika. Da weiterhin akute Polio-Myelitis in Entwicklungsländern auftritt, wird PPS wahrscheinlich auch in den kommenden Jahren ein Anästhesieproblem bleiben. Es ist nicht ungewöhnlich, dass Patienten mit PPS orthopädische Eingriffe benötigen; Daher ist es wichtig, die Sicherheit regionaler Anästhesietechniken unter diesen klinischen Umständen zu bestimmen. Obwohl Patienten mit PPS weniger Motoneuronen als normal haben, ist es schwierig zu wissen, ob die verbleibenden Motoneuronen anfälliger für die toxischen Wirkungen von Lokalanästhetika sind. Es liegen keine Berichte über eine Verschlechterung des neurologischen Zustands nach einer neuroaxialen Anästhesie mit normalen Dosen von Tetracain und Bupivacain bei Patienten mit PPS vor. Dieser Befund bedeutet jedoch nicht, dass Regionalanästhesieverfahren risikolos sind. Wie bei allen Patienten muss das potenzielle Risiko einer Regionalanästhesie gegen die Nachteile einer Vollnarkose abgewogen werden, einschließlich einer Überempfindlichkeit gegenüber Beruhigungsmitteln oder Opioiden, dem Risiko der Anwendung von Muskelrelaxanzien und dem Risiko einer Hypoventilation und Aspiration. Die größte Serie von Patienten mit PPS (n = 79), die sich einer neuraxialen Anästhesie oder Analgesie unterzogen, zeigte keine Verschlechterung der neurologischen Symptome während der postoperativen Phase. Der Mangel an klinischen Daten zu diesem Thema verhindert jedoch, dass klare Empfehlungen zur Sicherheit einer neuraxialen Anästhesie oder einer peripheren Nervenblockade bei Patienten mit PPS abgegeben werden. Letztendlich sollte die Entscheidung für eine Regionalanästhesie nach eingehender Diskussion der möglichen Risiken und Vorteile mit jedem Patienten individuell getroffen werden. Angesichts der erhöhten Empfindlichkeit gegenüber Opioiden und Beruhigungsmitteln in dieser Patientenuntergruppe sollten diese Medikamente immer mit Vorsicht angewendet werden.
Amyotrophe Lateralsklerose
Amyotrophe Lateralsklerose ist eine fortschreitende degenerative Erkrankung der oberen und unteren Motoneuronen. Die Ursache ist unbekannt, aber Theorien umfassen Glutamat-Exzitotoxizität, oxidativen Stress, mitochondriale Dysfunktion, paraneoplastische Tumore, Autoimmunerkrankungen und Virusinfektionen. Anfänglich zeigt sich ALS als Atrophie, Schwäche und Faszikulationen in den intrinsischen Handmuskeln. Im weiteren Verlauf entwickeln sich Atrophie und Schwäche in allen Skelettmuskeln, einschließlich der Zunge, des Rachens, des Kehlkopfs und der Atemmuskulatur des Brustkorbs. Die Patienten verlieren die Fähigkeit zu husten, was das Aspirationsrisiko erhöht. Eine autonome Dysfunktion kann offensichtlich sein und äußert sich in einer orthostatischen Hypotonie und einer erhöhten Ruheherzfrequenz. Leider tritt bei der Mehrheit der Patienten der Tod durch Atemversagen innerhalb weniger Jahre nach Ausbruch der Krankheit ein.
Die vorhandenen Beweise, wenn auch begrenzt, haben die Befürchtung nicht gestützt, dass eine neuraxiale oder periphere Blockade bereits bestehende Symptome bei ALS-Patienten verschlimmern wird. Angesichts der Möglichkeit einer Verschlechterung der respiratorischen Insuffizienz nach Vollnarkose aufgrund der Anwendung von Muskelrelaxanzien und Opioidmedikamenten kann die Möglichkeit, Atemwegsmanipulationen zu vermeiden, bei dieser Patientenpopulation mit hohem Risiko als Vorteil angesehen werden. Unabhängig von der Anästhesietechnik ist die Wahrscheinlichkeit einer postoperativen respiratorischen oder neurologischen Verschlechterung bei Patienten mit ALS recht hoch. Letztendlich sollte die Entscheidung für eine Regionalanästhesie nach eingehender Diskussion der möglichen Risiken und Vorteile mit jedem Patienten individuell getroffen werden.
Spinalkanalstenose und lumbale Bandscheibenerkrankung
Spinalkanalpathologie wurde als potenzieller Risikofaktor für neurologische Komplikationen nach neuraxialer Blockade vorgeschlagen. Mehrere Verletzungsmechanismen wurden vorgeschlagen, einschließlich einer ischämischen oder kompressiven Wirkung nach der Injektion großer Volumina eines Lokalanästhetikums in einen relativ begrenzten Raum (dh Epiduralanästhesie) und Neurotoxizität von Lokalanästhetika (dh Spinalanästhesie). Obwohl der/die genaue(n) Verletzungsmechanismus/-mechanismen unklar bleiben, gibt es mehrere isolierte Fallberichte und große Fallserien, von denen angenommen wird, dass sie diese Hypothesen stützen.
Spinalkanalstenose tritt als altersbedingte Veränderung der Bandscheiben und Facettengelenke auf, die zu einer Verengung des Spinalkanals oder der neuralen Foramina führt. Zu den Veränderungen gehören Bandscheibendegeneration, Facettengelenkshypertrophie, Osteophytenbildung und eine Einfaltung des Ligamentum flavum. Der genaue Mechanismus, durch den die Kompression der Spinalnervenwurzel zu Anzeichen oder Symptomen einer Spinalkanalstenose führt, ist nicht vollständig geklärt. Klassische Symptome sind Rücken- und Beinwurzelschmerzen, die sich bei Streckung deutlich verschlimmern und bei Beugung gelindert werden. Vorbestehende spinale Stenose oder lumbale Bandscheibenerkrankung wurde als potenzieller Risikofaktor für neurologische Komplikationen nach einer neuraxialen (spinalen oder epiduralen) Technik vorgeschlagen. Zu den vorgeschlagenen Verletzungsmechanismen gehören mechanisches Trauma, Lokalanästhesie-Neurotoxizität, Ischämie oder eine multifaktorielle Ätiologie. Pathophysiologisch haben Patienten mit Spinalstenose einen reduzierten Durchmesser des Spinalkanals, was zu weniger anatomischem Raum für Flüssigkeitsansammlungen wie Blut oder Lokalanästhetika führt. Infolgedessen können kleine Flüssigkeitsmengen zu erheblichen Druckerhöhungen um die Neuraxis herum führen, die in einem weithin offenen Spinalkanal keine klinische Wirkung hätten.
Es wurden zwei relativ große Fallserien und mehrere Fallberichte veröffentlicht, die darauf hindeuten, dass eine nicht diagnostizierte Spinalkanalstenose ein Risikofaktor für neurologische Komplikationen nach einer neuroaxialen Blockade sein könnte. Die Mehrheit der Cauda-equina-Fälle beinhaltete eine Epiduralanalgesie, was auf eine ischämische Ätiologie (mechanische Kompression des Rückenmarks durch das infundierte Lokalanästhetikum) der Verletzung hindeuten kann. Hebl und Kollegen führten eine retrospektive Überprüfung von 937 Patienten mit vorbestehender spinaler Stenose oder lumbaler Bandscheibenerkrankung mit und ohne vorangegangene Wirbelsäulenoperationen in der Vorgeschichte durch und kamen zu dem Schluss, dass diese Patientenkohorte im Vergleich zu einem erhöhten Risiko für die Entwicklung oder Verschlechterung neurologischer Defizite bestand die allgemeine Bevölkerung, die sich einer neuraxialen Technik unterzieht. Darüber hinaus schienen Patienten mit mehr als einer neurologischen Diagnose (z. B. Spinalkanalstenose, kompressive Radikulopathie, vorbestehende periphere Neuropathie) ein noch höheres Verletzungsrisiko zu haben. In ähnlicher Weise führten Moen und Kollegen eine große epidemiologische Untersuchung in Schweden durch, die ähnliche Trends aufzeigte. Während eines 10-jährigen Studienzeitraums wurden 1,260,000 Spinalanästhetika und 450,000 Epiduralblockaden ausgewertet. Insgesamt identifizierten die Autoren 127 schwerwiegende Komplikationen, darunter 85 (67 %) Patienten mit bleibenden Verletzungen. Obwohl 14 Patienten eine vorbestehende Spinalkanalstenose hatten, wurden 13 (93%) davon in der postoperativen Phase während der Bewertung des neurologischen Defizits diagnostiziert. Die Autoren kamen zu dem Schluss, dass die Inzidenz schwerer anästhesiebedingter Komplikationen möglicherweise nicht so niedrig ist wie zuvor berichtet und dass eine vorbestehende Spinalkanalpathologie ein „vernachlässigter Risikofaktor“ sein könnte. Obwohl Patienten mit vorangegangener Wirbelsäulenoperation nach transforaminalen epiduralen Steroidinjektionen möglicherweise ein erhöhtes Risiko für Paraplegie haben, wurde bei Patienten nach neuraxialer Anästhesie oder Analgesie kein ähnliches Risiko festgestellt.
Zusammenfassend lässt sich sagen, dass Patienten mit spinaler Stenose oder lumbaler Bandscheibenerkrankung zwar ein erhöhtes Risiko für neurologische Komplikationen nach einer neuraxialen Blockade zu haben scheinen, die vorhandene Literatur jedoch keinen direkten Vergleich von chirurgischen Patienten mit ähnlicher spinaler Pathologie bietet, die sich einer Vollnarkose unterziehen. Daher ist unklar, ob die höhere Inzidenz neurologischer Komplikationen in dieser Patientenpopulation auf chirurgische Faktoren, die Anästhesietechnik, den natürlichen Krankheitsverlauf oder eine Kombination dieser Faktoren zurückzuführen ist.
Spinal Cord Injury
Eine Rückenmarksverletzung betrifft jedes Jahr über 10,000 Amerikaner. Davon treten etwa 50 % der Verletzungen auf zervikaler Ebene auf. Die meisten SCI-Fälle sind sekundär nach Kraftfahrzeugunfällen, wobei ein geringerer Prozentsatz auf Sportverletzungen, Stürze oder penetrierende Traumata zurückzuführen ist. Das Verhältnis von vollständigen zu unvollständigen neurologischen Defiziten in den Vereinigten Staaten scheint in den letzten zehn Jahren abzunehmen, was einen größeren Anteil unvollständiger Defizite widerspiegelt. Ein potenziell gefährlicher Zustand, der sich in den Monaten nach dem Abklingen des akuten spinalen Schocks entwickeln kann, ist die autonome Dysreflexie (AD). AD ist ein lebensbedrohliches Syndrom, das aus einer kutanen oder viszeralen Stimulation unterhalb der Ebene der Rückenmarksverletzung resultiert und zu einer extremen Gefäßinstabilität führt. Die Lebenszeitprävalenz von AD wird auf 17 % bis 70 % geschätzt, wobei die meisten Episoden in SCI-Fällen auftreten, wenn das Verletzungsniveau bei oder über T6 liegt.
Eine Vollnarkose mit niedrig konzentrierten flüchtigen Anästhetika bietet keinen Schutz vor AD. Obwohl höhere Konzentrationen des volatilen Anästhetikums wirksam sein können, wird eine anästhesiebedingte hämodynamische Instabilität von dieser Patientenpopulation möglicherweise nicht gut vertragen. Daher können neuroaxiale (spinale oder epidurale) Regionalanästhesietechniken wertvolle Hilfsmittel bei der Behandlung von Patienten mit chronischer SCI sein, die sich Eingriffen an den unteren Extremitäten, am Bauch, in der Geburtshilfe, in der Gynäkologie und in der Urologie unterziehen. Zahlreiche Fallberichte und Fallserien haben gezeigt, dass neuraxiale Techniken bei der Prävention von AD-Episoden bei SCI-Patienten sicher und wirksam sind, selbst bei Patienten mit hohen Rückenmarksläsionen. Zu diesem Zeitpunkt gibt es keine eindeutigen Hinweise darauf, dass die Verwendung regionaler Techniken möglicherweise vorbestehende neurologische Defizite bei Patienten mit SCI verschlimmern kann. Die Schwierigkeit bei der Bestimmung des angemessenen Anästhetikumspiegels, die Möglichkeit einer hämodynamischen Instabilität und Atembeschwerden sowie eine schwierige Blockplatzierung sind jedoch wichtige Überlegungen bei der Bewertung von Patienten mit QSL für eine neuraxiale Technik.
ZUSAMMENFASSUNG
Patienten mit vorbestehenden neurologischen Erkrankungen stellen eine einzigartige Herausforderung für den Anästhesisten dar, der eine regionale Anästhesietechnik in Erwägung zieht. Eine gründliche präoperative Beurteilung ist unerlässlich, um den neurologischen Ausgangszustand des Patienten festzustellen. Anästhesisten sollten sich bei der Auswahl geeigneter Kandidaten für eine zentrale oder periphere Blockade der Risikofaktoren für postoperative neurologische Komplikationen bewusst sein und ihre Technik anpassen, um diese Risiken so weit wie möglich zu minimieren. Obwohl die meisten vorbestehenden neurologischen Erkrankungen keine absoluten Kontraindikationen für eine Regionalanästhesie sind, sollte die Entscheidung, mit einer Regionalanästhesie fortzufahren, individuell und von Fall zu Fall getroffen werden, da ausgewählte Patienten von einer Regionalanästhesietechnik im Vergleich zu anderen Anästhetika profitieren können oder analgetische Optionen.
REFERENZEN
- Upton AR, McComas AJ: Der doppelte Crush bei Nerveneinklemmungssyndromen. Lancet 1973;2:359–362.
- Osterman AL: Das Double-Crush-Syndrom. Orthop Clin North Am 1988; 19:147–155.
- Neal JM, Bernards CM, Hadzic A, et al: ASRA-Praxisberatung zu neurologischen Komplikationen in der Regionalanästhesie und Schmerzmedizin. Reg Anesth Pain Med 2008;33:404–415.
- Jacob AK, Kopp, SL: Regionalanästhesie bei Patienten mit vorbestehenden neurologischen Erkrankungen. Fortschritte in der Anästhesie 2011;29:1–18.
- Skre H: Genetische und klinische Aspekte der Charcot-Marie-Tooth-Krankheit. Clin Genet 1974;6:98–118.
- Saporta AS, Sottile SL, Miller LJ, Feely SM, Siskind CE, Shy ME: Subtypen der Charcot-Marie-Tooth-Krankheit und Genteststrategien. Ann Neurol 2011;69:22–33.
- Bui AH, Marco AP: Periphere Nervenblockade bei einem Patienten mit Charcot-Marie-Tooth-Krankheit. Can J Anaesth 2008;55:718–719.
- Dhir S, Balasubramanian S, Ross D: Ultraschallgeführte periphere regionale Blockade bei Patienten mit Charcot-Marie-Tooth-Krankheit: eine Übersicht über drei Fälle. Can J Anaesth 2008;55:515–520.
- Fernandez Perez AB, Quesada Garcia C, Rodriguez Gonzalez O, Besada Estevez JC: [Obstetric epidural analgesia, a safe choice in a patient with Charcot-Marie-Tooth disease]. Rev. Esp Anestesiol Reanim 2011;58: 255–256.
- Schmitt HJ, Münster T, Schmidt J: Central neural block in Charcot-Marie-Tooth disease. Can J Anaesth 2004;51:1049–1050.
- Sugai K, Sugai Y: [Epiduralanästhesie für einen Patienten mit Charcot-Marie-Tooth-Krankheit, Asthma bronchiale und Hypothyreose]. Masui 1989;38: 688–691.
- Tanaka S, Tsuchida H, Namiki A: [Epiduralanästhesie für einen Patienten mit Charcot-Marie-Tooth-Krankheit, Mitralklappenprolaps-Syndrom und AV-Block II. Grades]. Masui 1994;43:931–933.
- Lepski GR, Alderson JD: Epiduralanalgesie während der Wehen bei einer Patientin mit hereditärer Neuropathie mit Neigung zu Drucklähmung. Int J Obstet Anesth 2001;10:198–201.
- Al-Nasser B: Toxische Wirkungen einer Epiduralanalgesie mit Ropivacain 0.2 % bei einem Diabetiker. J Clin Anesth 2004;16:220–223.
- Blumenthal S, Borgeat A, Maurer K, et al: Vorbestehende subklinische Neuropathie als Risikofaktor für Nervenverletzungen nach kontinuierlicher Ropivacain-Verabreichung durch einen femoralen Nervenkatheter. Anästhesiologie 2006; 105:1053–1056.
- Horlocker TT, O'Driscoll SW, Dinapoli RP: Wiederkehrende Neuropathie des Plexus brachialis bei einem Diabetiker nach Schulteroperation und kontinuierlicher Skalenusblockade. Anesth Analg 2000;91:688–690.
- Waters JH, Watson TB, Ward MG: Conus medullaris-Verletzung nach Tetracain- und Lidocain-Spinalanästhesie. J Clin Anesth 1996;8: 656–658.
- Kalichman MW, Calcutt NA: Durch Lokalanästhetika induzierter Leitungsblock und Nervenfaserverletzung bei Streptozotocin-diabetischen Ratten. Anesthesiology 1992;77:941–947.
- Dyck PJ, Kratz KM, Karnes JL, et al: Die Prävalenz nach abgestuftem Schweregrad verschiedener Arten von diabetischer Neuropathie, Retinopathie und Nephropathie in einer bevölkerungsbezogenen Kohorte: die Rochester Diabetic Neuropathy Study. Neurologie 1993;43:817–824.
- Ross MA: Neuropathien im Zusammenhang mit Diabetes. Med Clin North Am 1993;77:111–124.
- Centers for Disease Control and Prevention: National Diabetes Fact Sheet: Nationale Schätzungen und allgemeine Informationen zu Diabetes und Prädiabetes in den Vereinigten Staaten. Atlanta, GA: Centers for Disease Control and Prevention, US Department of Health and Human Services; 2011.
- Lirk P, Birmingham B, Hogan Q: Regionalanästhesie bei Patienten mit vorbestehender Neuropathie. Int Anesthesiol Clin 2011;49:144–165.
- Hebl JR, Kopp SL, Schroeder DR, Horlocker TT: Neurologische Komplikationen nach neuraxialer Anästhesie oder Analgesie bei Patienten mit vorbestehender peripherer sensomotorischer Neuropathie oder diabetischer Polyneuropathie. Anesth Analg 2006;103:1294–1299.
- Krishnan AV, Kiernan MC: Veränderte Nervenerregbarkeitseigenschaften bei etablierter diabetischer Neuropathie. Gehirn 2005;128:1178–1187.
- Sinnreich M, Taylor BV, Dyck PJ: Diabetische Neuropathien. Klassifikation, klinische Merkmale und pathophysiologische Grundlagen. Neurologe 2005;11: 63–79.
- Williams BA, Murinson BB, Grable BR, Orebaugh SL: Zukünftige Überlegungen zu pharmakologischen Adjuvantien bei Einzelinjektion peripherer Nervenblockaden bei Patienten mit Diabetes mellitus. Reg Anesth Pain Med 2009;34:445–457.
- Kroin JS, Buvanendran A, Tuman KJ, Kerns JM: Sicherheit von intrathekal verabreichten Lokalanästhetika bei diabetischen Ratten. Pain Med 2012; 13:802–807.
- Kroin JS, Buvanendran A, Williams DK, et al: Lokalanästhetische Ischiasnervblockade und Nervenfaserschädigung bei diabetischen Ratten. Reg Anesth Pain Med 2010;35:343–350.
- Williams BA: Auf dem Weg zu einem möglichen Paradigmenwechsel für die klinische Versorgung von Diabetikern, die eine perineurale Analgesie benötigen: Strategien zur Verwendung des diabetischen Nagetiermodells. Reg Anesth Pain Med 2010;35:329–332.
- Lirk P, Flatz M, Haller I, et al. Bei Zucker-diabetischen Fettratten erhöht die subklinische diabetische Neuropathie die Dauer der Lidocain-Blockade in vivo, aber nicht die Neurotoxizität in vitro. Reg Anesth Pain Med 2012;37:601–606.
- Williams BA, Murinson BB: Diabetes mellitus und subklinische Neuropathie: ein Ruf nach neuen Wegen in der Erforschung peripherer Nervenblockaden. Anesthesiology 2008;109:361–362.
- Gebhard RE, Nielsen KC, Pietrobon R, Missair A, Williams BA: Diabetes mellitus, unabhängig vom Body-Mass-Index, ist mit einer „höheren Erfolgsrate“ für supraklavikuläre Plexus-Blöcke verbunden. Reg Anesth Pain Med 2009;34:404–407.
- Alvine FG, Schurrer ME: Postoperative Ulnarisparese. Gibt es prädisponierende Faktoren? J Bone Joint Surg Am 1987;69:255–259.
- Chaudhry V, Glass JD, Griffin JW: Wallersche Degeneration bei peripheren Nervenerkrankungen. Neurol Clin 1992;10:613–627.
- Selander D, Edshage S, Wolff T: Parästhesien oder keine Parästhesien? Nervenläsionen nach Achselblockaden. Acta Anaesthesiol Scand 1979;23: 27–33.
- Bigeleisen PE: Eine Nervenpunktion und offensichtliche intraneurale Injektion während einer ultraschallgeführten Axillarblockade führt nicht immer zu einer neurologischen Verletzung. Anesthesiology 2006;105:779–783.
- Lok C, Kirk P: Probleme bei der Durchführung einer Ischiasnervenblockade bei einem Amputierten. Anästhesie 2003;58:289–290.
- Sites BD, Gallagher J, Sparks M: Ultraschall-geführte Poplitealblockade zeigt eine atypische motorische Reaktion auf Nervenstimulation bei 2 Patienten mit Diabetes mellitus. Reg Anesth Pain Med 2003;28:479–482.
- Liu SS, Ngeow JE, Yadeau JT: Ultraschallgeführte Regionalanästhesie und Analgesie: eine qualitative systematische Überprüfung. Reg Anesth Pain Med 2009; 34:47–59.
- Sites BD, Taenzer AH, Herrick MD, et al: Inzidenz von systemischer Toxizität von Lokalanästhetika und postoperativen neurologischen Symptomen im Zusammenhang mit 12,668 ultraschallgeführten Nervenblockaden: eine Analyse aus einem prospektiven klinischen Register. Reg Anesth Pain Med 2012;37:478–482.
- Rigaud M., Filip P., Lirk P., Fuchs A., Gemes G., Hogan Q.: Anleitung zur Blocknadeleinführung durch elektrische Nervenstimulation: Eine Pilotstudie zur resultierenden Verteilung der injizierten Lösung bei Hunden. Anästhesiologie 2008; 109:473–478.
- Lucchetta M, Pazzaglia C, Granata G, Briani C, Padua L: Ultraschalluntersuchung der peripheren Neuropathie beim POEMS-Syndrom. Muskelnerv 2011;44:868–872.
- Riazi S, Bril V, Perkins BA, et al: Kann Ultraschall des Schienbeinnervs eine diabetische periphere Neuropathie erkennen? Eine Querschnittsstudie. Diabetesversorgung 2012;35:2575–2579.
- Eaton SE, Harris ND, Rajbhandari SM, et al: Beteiligung des Rückenmarks bei diabetischer peripherer Neuropathie. Lancet 2001;358:35–36.
- Varsik P, Kucera P, Buranova D, Balaz M: Ist die Rückenmarksläsion bei Diabetes mellitus selten? Somatosensorisch evozierte Potentiale und zentrale Leitungszeit bei Diabetes mellitus. Med Sci Monit 2001;7:712–715.
- Selvarajah D, Wilkinson ID, Emery CJ, et al: Frühe Beteiligung des Rückenmarks bei diabetischer peripherer Neuropathie. Diabetespflege 2006; 29:2664–2669.
- Drasner K: Lokalanästhesie-Neurotoxizität: klinische Verletzung und Strategien, die das Risiko minimieren können. Reg Anesth Pain Med 2002;27:576–580.
- Koscielniak-Nielsen ZJ: Ultraschallgesteuerte periphere Nervenblockaden: Was sind die Vorteile? Acta Anaesthesiol Scand 2008;52:727–737.
- Pachman DR, Barton DL, Watson JC, Loprinzi CL: Chemotherapie-induzierte periphere Neuropathie: Prävention und Behandlung. Clin Pharmacol Ther 2011;90:377–387.
- Peters CM, Jimenez-Andrade JM, Kuskowski MA, Ghilardi JR, Mantyh PW: Eine sich entwickelnde zelluläre Pathologie tritt in Spinalganglien, peripheren Nerven und im Rückenmark nach intravenöser Verabreichung von Paclitaxel bei der Ratte auf. BrainRes 2007;1168:46–59.
- Quasthoff S, Hartung HP: Chemotherapie-induzierte periphere Neuropathie. J Neurol 2002;249:9–17.
- Pignata S., De Placido S., Biamonte R. et al.: Residual neurotoxicity in ovarial Cancer Patients in Clinical Remission after First-Line Chemotherapy with Carboplatin and Paclitaxel: the Multicenter Italian Trial in Ovarian Cancer (MITO-4) retrospektive Studie. BMC Cancer 2006;6:5.
- Kaley TJ, Deangelis LM: Therapie der Chemotherapie-induzierten peripheren Neuropathie. Br J Haematol 2009;145:3–14.
- Hebl JR, Horlocker TT, Pritchard DJ: Diffuse brachiale Plexopathie nach interskalenärer Blockade bei einem Patienten, der Cisplatin-Chemotherapie erhält: das pharmakologische Double-Crush-Syndrom. Anesth Analg 2001;92: 249–251.
- Caliandro P, La Torre G, Padua R, Giannini F, Padua L: Behandlung der ulnaren Neuropathie am Ellbogen. Cochrane Database Syst Rev 2012;7:CD006839.
- Hebl JR, Horlocker TT, Sorenson EJ, Schroeder DR: Regionalanästhesie erhöht nicht das Risiko einer postoperativen Neuropathie bei Patienten, die sich einer N. ulnaris-Transposition unterziehen. Anesth Analg 2001;93: 1606–1611, Inhaltsverzeichnis.
- Pithadia AB, Kakadia N: Guillain-Barré-Syndrom (GBS). Pharmacol Rep 2010;62:220–232.
- Bamberger PD, Thys DM: Guillain-Barré-Syndrom bei einem Patienten mit Bauchspeicheldrüsenkrebs nach Epidural-Vollnarkose. Anesthes Analg 2005;100:1197–1199.
- Gautier PE, Pierre PA, Van Obbergh LJ, Van Steenberge A: Guillain-Barré-Syndrom nach geburtshilflicher Epiduralanalgesie. Reg. Anesth 1989;14:251–252.
- Heyworth BE, Fabricant PD, Pizzurro MM, Beksac B, Salvati EA: Guillain-Barré-Syndrom imitiert eine Nervenverletzung nach totaler Hüftendoprothetik. HSS J 2011;7:286–289.
- Alici HA, Cesur M, Erdem AF, Gursac M: Wiederholte Anwendung der Epiduralanästhesie für die Entbindung per Kaiserschnitt bei einer Patientin mit Guillain-Barré-Syndrom. Int J Obstet Anesth 2005;14:269–270.
- McGrady EM: Management von Wehen und Entbindung bei einer Patientin mit Guillain-Barré-Syndrom. Anästhesie 1987;42:899.
- Perel A, Reches A, Davidson JT: Anästhesie beim Guillain-Barré-Syndrom. Ein Fallbericht und Empfehlungen. Anästhesie 1977;32: 257–260.
- Vassiliev DV, Nystrom EU, Leicht CH: Kombinierte Spinal- und Epiduralanästhesie für Wehen und Kaiserschnitt bei einer Patientin mit Guillain-Barre-Syndrom. Reg Anesth Pain Med 2001;26:174–176.
- N. Otsuka, M. Igarashi, Y. Shimodate, K. Nakabayashi, M. Asano, A. Namiki: [Anästhetische Behandlung von zwei Patienten mit amyotropher Lateralsklerose (ALS)]. Masui 2004;53:1279–1281.
- Steiner I, Argov Z, Cahan C, Abramsky O: Guillain-Barré-Syndrom nach Epiduralanästhesie: direkte Nervenwurzelschädigung kann Krankheit auslösen. Neurologie 1985;35:1473–1475.
- Staff NP, Engelstad J, Klein CJ, et al: Postoperative entzündliche Neuropathie. Gehirn 2010;133:2866–2880.
- Ahn KS, Kopp SL, Watson JC, Scott KP, Trousdale RT, Hebl JR: Postoperative entzündliche Neuropathie. Reg Anesth Pain Med 2011;36: 403–405.
- Bamford C, Sibley W, Laguna J: Anästhesie bei Multipler Sklerose. Can J Neurol Sci 1978;5:41–44.
- Dripps RD, Vandam LD: Exazerbation einer vorbestehenden neurologischen Erkrankung nach Spinalanästhesie. N. Engl. J. Med. 1956;255:843–849.
- Hebl JR, Horlocker TT, Schroeder DR: Neuraxiale Anästhesie und Analgesie bei Patienten mit vorbestehenden Erkrankungen des zentralen Nervensystems. Anesth Analg 2006;103:223–228, Inhaltsverzeichnis.
- Keschner M: Der Einfluss von Verletzungen und Krankheiten auf den Verlauf der Multiplen Sklerose. Res Publ Assoc Res Nerv Ment Dis 1950;28:533–547.
- Confavreux C, Hutchinson M, Hours MM, Cortinovis-Tourniaire P, Moreau T: Rate der schwangerschaftsbedingten Rückfälle bei Multipler Sklerose. Schwangerschaft in der Multiple-Sklerose-Gruppe. N. Engl. J. Med. 1998;339:285–291.
- Crawford JS: Epiduralanalgesie für Patienten mit chronischer neurologischer Erkrankung. Anesth Analg 1983;62:621–622.
- Noseworthy JH, Lucchinetti C, Rodriguez M, Weinshenker BG: Multiple Sklerose. N. Engl. J. Med. 2000;343:938–952.
- Compston A, Coles A: Multiple Sklerose. Lancet 2002;359: 1221–1231.
- Korn-Lubetzki I, Kahana E, Cooper G, Abramsky O: Aktivität der Multiplen Sklerose während Schwangerschaft und Wochenbett. Ann Neurol 1984;16:229–231.
- Pollock M, Calder C, Allpress S: Periphere Nervenanomalie bei Multipler Sklerose. Ann Neurol 1977;2:41–48.
- Koff MD, Cohen JA, McIntyre JJ, Carr CF, Sites BD: Schwere brachiale Plexopathie nach einer ultraschallgeführten Einzelinjektions-Nervenblockade für eine totale Schulterarthroplastik bei einem Patienten mit Multipler Sklerose. Anesthesiology 2008;108:325–328.
- Pogorzelski R, Baniukiewicz E, Drozdowski W: [Subklinische Läsionen des peripheren Nervensystems bei Patienten mit Multipler Sklerose]. Neurol Neurochir Pol 2004;38:257–264.
- Misawa S, Kuwabara S, Mori M, Hayakawa S, Sawai S, Hattori T: Demyelinisierung peripherer Nerven bei Multipler Sklerose. Klinisches Neurophysiol 2008;119:1829–1833.
- Sarova-Pinhas I, Achiron A, Gilad R, Lampl Y: Periphere Neuropathie bei Multipler Sklerose: eine klinische und elektrophysiologische Studie. Acta Neurol Scand 1995;91:234–238.
- Critchley EP: Multiple Sklerose, die sich anfänglich als Fazialisparese präsentiert. Aviat Space Environ Med 2004;75:1001–1004.
- Hammes E: Neurologische Komplikationen im Zusammenhang mit Spinalanästhesie (acht Fälle). Minn Med 1943;36:339–345.
- Keschner M: Der Einfluss von Verletzungen und Krankheiten auf den Verlauf der Multiplen Sklerose. Res Publ Assoc Res Nerv Ment Dis 1950;28:533–547.
- Stenuit J, Marchand P: [Folgen der Spinalanästhesie]. Acta Neurol Psychiatr Belg 1968;68:626–635.
- Kuczkowski KM: Geburtsanalgesie für Gebärende mit neurologischen Erkrankungen: Was muss ein Geburtshelfer wissen? Arch Gynecol Obstet 2006;274:41–46.
- Warren TM, Datta S, Ostheimer GW: Lumbale Epiduralanästhesie bei einem Patienten mit Multipler Sklerose. Anesth Analg 1982;61:1022–1023.
- Sakurai M, Mannen T, Kanazawa I, Tanabe H: Lidocain demaskiert stille demyelinative Läsionen bei Multipler Sklerose. Neurologie 1992;42: 2088–2093.
- Drake E, Drake M, Bird J, Russell R: Geburtshilfe-Regionalblöcke für Frauen mit Multipler Sklerose: eine Übersicht über Erfahrungen in Großbritannien. Int J Obstet Anesth 2006;15:115–123.
- Gonzalez H, Olsson T, Borg K: Management des Postpolio-Syndroms. Lancet Neurol 2010;9:634–642.
- Bordes J, Gaillard PE, Lacroix G, Palmier B: Computertomographische Spinalanästhesie bei einem Patienten mit schweren Post-Polio-Folgen. Br J Anaesth 2010;105:702–703.
- Higashizawa T, Sugiura J, Takasugi Y: [Spinalanästhesie bei einem Patienten mit Hemiparese nach Poliomyelitis]. Masui 2003;52:1335–1337.
- Lambert DA, Giannouli E, Schmidt BJ: Postpolio-Syndrom und Anästhesie. Anesthesiology 2005;103:638–644.
- Pratt AJ, Getzoff ED, Perry JJ: Amyotrophe Lateralsklerose: Update und neue Entwicklungen. Degener Neurol Neuromuscul Dis 2012;2012:1–14.
- Chen LK, Chang Y, Liu CC, Hou WY: Epiduralanästhesie kombiniert mit Propofol-Sedierung zur abdominalen Hysterektomie bei einer Patientin mit amyotropher Lateralsklerose – ein Fallbericht. Acta Anaesthesiol Sin 1998;36:103–106.
- Hara K, Sakura S, Saito Y, Maeda M, Kosaka Y: Epiduralanästhesie und Lungenfunktion bei einem Patienten mit amyotropher Lateralsklerose. Anesth Analg 1996;83:878–879.
- Hobaika AB, Neves BS: Kombinierter Spinal-Epidural-Block bei einem Patienten mit amyotropher Lateralsklerose: Fallbericht. Rev. Bras Anestesiol 2009;59:206–209.
- Kitoh T, Kobayashi K, Ina H, et al.: Auswirkungen einer lumbalen sympathischen Ganglienblockade bei einem Patienten mit amyotropher Lateralsklerose (ALS). J. Anesth 2006;20:109–112.
- Kochi T, Oka T, Mizuguchi T: Epiduralanästhesie für Patienten mit amyotropher Lateralsklerose. Anesth Analg 1989;68:410–412.
- Katz JN, Harris MB: Klinische Praxis. Lumbale Spinalkanalstenose. N. Engl. J. Med. 2008;358:818–825.
- Stambuough JL, Stamboough JB, Evans S: Akute Cauda-Equina-Syndrom nach Knie-Totalendoprothetik als Folge von Epiduralanästhesie und Spinalkanalstenose. J Arthroplasty 2000;15:375–379.
- Tetzlaff JE, Dilger JA, Wu C, Smith MP, Bell G: Einfluss der Pathologie der Lendenwirbelsäule auf das Auftreten von Parästhesien während der Spinalanästhesie. Reg Anesth Pain Med 1998;23:560–563.
- Moen V, Dahlgren N, Irestedt L: Schwere neurologische Komplikationen nach zentralen neuroaxialen Blockaden in Schweden 1990–1999. Anesthesiology 2004;101:950–959.
- Yuen EC, Layzer RB, Weitz SR, Olney RK: Neurologische Komplikationen der lumbalen Epiduralanästhesie und Analgesie. Neurologie 1995;45: 1795–1801.
- de Seze MP, Sztark F, Janvier G, Joseph PA: Schwere und lang anhaltende Komplikationen der Nervenwurzel und des Rückenmarks nach zentraler neuraxialer Blockade. Anesth Analg 2007;104:975–979.
- Hooten WM, Hogan MS, Sanemann TC, Maus TJ: Akute Wirbelsäulenschmerzen während eines versuchten lumbalen epiduralen Blutpflasters bei angeborener lumbaler Spinalkanalstenose und epiduraler Lipomatose. Schmerzarzt 2008;11: 87–90.
- Usubiaga JE, Wikinski JA, Usubiaga LE: Epiduraldruck und seine Beziehung zur Ausbreitung von Anästhesielösungen im Epiduralraum. Anesth Analg 1967;46:440–446.
- Hebl JR, Horlocker TT, Kopp SL, Schroeder DR: Neuraxialer Block bei Patienten mit vorbestehender Spinalkanalstenose, Bandscheibenerkrankung oder vorheriger Wirbelsäulenoperation: Wirksamkeit und neurologische Komplikationen. Anesth Analg 2010; 111:1511–1519.
- Horlocker TT: Neuraxiale Blockade bei Patienten mit Spinalkanalstenose: zwischen einem Stein und einer harten Stelle. Anesth Analg 2010;110:13–15.
- Kubina P, Gupta A, Oscarsson A, Axelsson K, Bengtsson M: Zwei Fälle von Cauda-equina-Syndrom nach Spinal-Epidural-Anästhesie. Reg Anesth 1997;22:447–450.
- Houten JK, Errico TJ: Paraplegie nach lumbosakraler Nervenwurzelblockade: Bericht über drei Fälle. Spine J 2002;2:70–75.
- Huntoon MA, Martin DP: Lähmung nach transforaminaler epiduraler Injektion und vorheriger Wirbelsäulenoperation. Reg Anesth Pain Med 2004;29: 494–495.
- Devivo MJ: Epidemiologie der traumatischen Rückenmarksverletzung: Trends und zukünftige Auswirkungen. Rückenmark 2012;50:365–372.
- Hagen EM, Faerestrand S, Hoff JM, Rekand T, Gronning M: Kardiovaskuläre und urologische Dysfunktion bei Rückenmarksverletzungen. Acta Neurol Scand Suppl 2011: 71–78.
- Crosby E, St-Jean B, Reid D, Elliott RD: Geburtshilfeanästhesie und Analgesie bei chronisch rückenmarksverletzten Frauen. Can J Anaesth 1992;39: 487–494.
- Hambly PR, Martin B: Anästhesie für chronische Rückenmarksläsionen. Anaesth 1998;53:273–289.
- Agostoni M, Giorgi E, Beccaria P, Zangrillo A, Valentini G: Kombinierte Spinal-Epiduralanästhesie für den Kaiserschnitt bei einer querschnittsgelähmten Frau: Schwierigkeit, das erwartete Blockadeniveau zu erreichen. Eur J Anaesthesiol 2000;17:329–331.

