Patienten mit Schmerzen, Taubheitsgefühl und Schwäche in der oberen Extremität werden häufig an Schmerzspezialisten überwiesen. Das Karpaltunnelsyndrom (CTS) in Kombination mit einem Impingement der Schulter kann leicht eine zervikale Radikulopathie und einen Bandscheibenvorfall imitieren [1, 2]. Chronische Schmerzen am Daumenballen nach einer Karpaltunneloperation können von einer okkulten Trigger-Daumen- oder Karpometakarpalgelenksarthritis (CMC) herrühren. Eine mediane Neuropathie am Handgelenk kombiniert mit einem Auftreffen der Sehne des M. flexor pollicis longus (FPL) auf eine Befestigungsplattenschraube nach einem Radiusbruch kann die Schmerzen, das Brennen und die Schwäche eines komplexen regionalen Schmerzsyndroms (CRPS) nachahmen. Diese und andere Erkrankungen der Hand, des Handgelenks und des Ellbogens können mit diagnostischer Sonographie und ultraschallgesteuerten Injektionen effektiv diagnostiziert und behandelt werden. Für ultraschallgeführte Injektionen in Hand, Handgelenk und Ellbogen gelten einige allgemeine Grundsätze. Die Strukturen sind klein und oberflächlich, daher ist ein kleiner Hochfrequenzwandler (>12 MHz) aufgrund seiner Manövrierfähigkeit und hohen Auflösung am besten geeignet. Ausreichendes Gel ist erforderlich, um beim Scannen über knöcherne Strukturen einen guten Hautkontakt aufrechtzuerhalten. Die Spitze einer gebogenen Gefäßklemme oder eines anderen kleinen Instruments oder der kleine Finger des Untersuchers können verwendet werden, um festzustellen, welche spezifischen Strukturen druckempfindlich sind, wie z. B. das CMC-Gelenk des Daumens oder das angrenzende Kahnbein-Trapez-Trapez-Gelenk (STT). Ein Modell der Hand, des Handgelenks und des Ellbogens, das neben dem Patienten und dem Ultraschallgerät platziert wird, kann für Lehrzwecke und die Visualisierung komplexer Anatomien, wie z. B. der knöchernen Konturen der Handwurzelknochen, nützlich sein [3].
1. ANATOMIE ULTRASCHALLGESTÜTZTE KARPALTUNNEL-INJEKTIONEN
Der Karpaltunnel enthält den Nervus medianus und neun Sehnen, darunter Flexor digitorum superficialis (FDS), Profundus (FDP) und Pollicis longus (FPL) (Abb. 1). Die Sehnen werden vom Flexor retinaculum gehalten, das sich vom Tuberculum des Trapeziums und des Scaphoids bis zum Hook des Hamatum und Pisiforme erstreckt. Die FDS- und FDP-Sehnen sind von einer gemeinsamen Synovialscheide umgeben, während die FPL eine separate Scheide hat. Der N. medianus befindet sich direkt unter dem Flexor retinaculum, medial des Flexor carpi radialis (FCR), oberflächlich des FPL und lateral des FDS; es kann sich jedoch bis zu einem Zentimeter oder mehr medial befinden; daher kann selbst die beste blinde Karpaltunnelinjektion den Nerv verletzen. Der normale N. medianus bewegt sich als Reaktion auf Fingerbewegungen, die mit dynamischer Ultraschallbildgebung sichtbar sind.
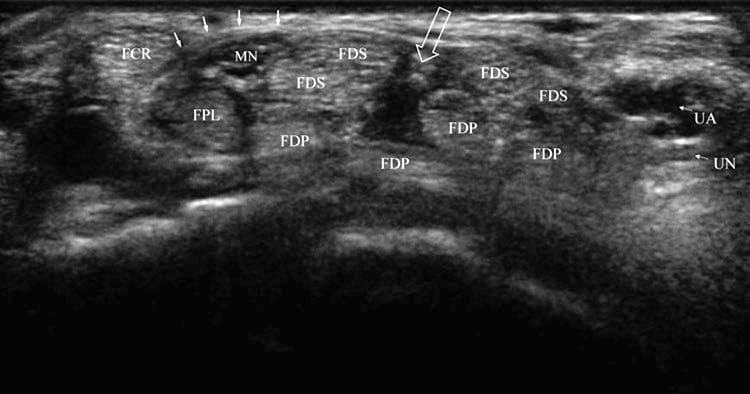
Abb. 1 Normaler Karpaltunnel. Kurzachsenansicht der distalen Handgelenksfalte und der Öffnung des Karpaltunnels, die die typische Anatomie bei einer nicht betroffenen Person zeigt. Der FCR ist durch das transversale Retinaculum (durchgezogene Pfeile) vom N. medianus (MN) und FPL getrennt. Eine Spalte oder Öffnung (offener Pfeil) ist zwischen den FDS-Sehnen auf halbem Weg zwischen N. medianus und ulnaris (UN) und Arterie (UA) zu sehen.
CTS ist das häufigste periphere Nerveneinklemmsyndrom. Zu den Symptomen gehören nächtliches Taubheitsgefühl in der Hand, Schmerzen, Schwäche und ein Gefühl, dass die Hand geschwollen ist. Die Empfindung ist im volaren Aspekt des Daumens, des Zeigefingers, der mittleren und radialen Hälfte des Ringfingers verringert. Der Goldstandard für die Diagnose bleibt Nervenleitungsstudien und Elektromyographie, aber Ultraschallkriterien für CTS wurden entwickelt und umfassen die mediane Nervenquerschnittsfläche (CSA) an der distalen Handgelenksfalte [4] > 15 mm2, medianes Nerven-CSA-Verhältnis zwischen distalem Handgelenk Falte und 12 cm proximal > 1.5 (wir verwenden > 2.0 für eine größere Spezifität) [5] und Krümmung des Flexor Retinaculum [6].
2. LITERATURÜBERSICHT ÜBER ULTRASCHALLGESTÜTZTE KARPALTUNNEL-INJEKTIONEN
Grassiet al. beschrieben eine Kurzachsentechnik zur Karpaltunnelinjektion bei einem durch rheumatoide Synovitis verursachten CTS, bei der die Nadel in das Intervall zwischen N. medianus und FCR-Sehne geführt wurde [7]. Unserer Erfahrung nach ist dieses Intervall zu eng, um bei den meisten Menschen einen einfachen Zugang zum Karpaltunnel zu ermöglichen, ist aber eine Option, wenn der Nervus medianus weiter medial liegt (Abb.. 2).
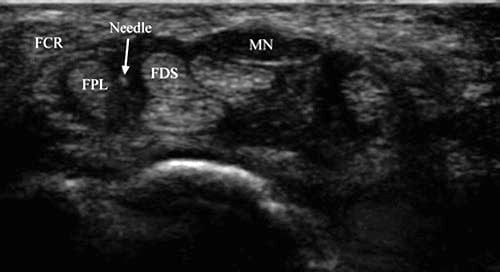
Abb. 2 Karpaltunnelsyndrom (Kurzachseninjektion) – nach medial verschobener N. medianus. Der N. medianus (MN) ist nach medial verschoben, und zwischen FPL- und FDS-Sehne ist eine Öffnung vorhanden, die den Durchgang der Nadel ermöglicht (Pfeil).
Smithet al. beschrieben eine langachsige ultraschallgeführte Karpaltunnelinjektionstechnik, die auf der Ebene des Pisiforme durchgeführt wird [8]. Die Nadel wird nur oberflächlich und seitlich des Nervus ulnaris und der Arterie eingeführt und in einem flachen Winkel auf den Nervus medianus gerichtet. Hydrodissektion wird verwendet, um den Nervus medianus von jeglichen Adhäsionen zu entfernen. Smithet al. über 50 Injektionen mit dieser Technik ohne Komplikationen durchgeführt. Die Langachsentechnik stellt sicher, dass Nadelspitze und -schaft jederzeit sichtbar sind. Wir haben festgestellt, dass diese Technik bei fehlgeschlagenen Karpaltunneloperationen besonders nützlich ist, wenn direkt in das transversale Karpalband oder in die Mitte des Karpaltunnels injiziert wird, wo Nerven und Sehnen dicht beieinander liegen.
Derzeit gibt es keine Ergebnisstudien, die ultraschallgeführte vs. blinde Karpaltunnelinjektionen vergleichen. Eine kürzlich durchgeführte Überprüfung von Kortikosteroidinjektionen im blinden Karpaltunnel ergab, dass 75 % der Patienten, die mit einer Karpaltunnelentfernungsoperation behandelt wurden, hervorragende Ergebnisse erzielten, während sich 8 % verschlechterten. Mit Injektionen hatten 70 % der Patienten kurzfristig hervorragende Ergebnisse, aber 50 % erlitten nach 1 Jahr einen Rückfall [9].
Armstronget al. entdeckten eine Verbesserung der Nervenfunktion, insbesondere die Rückkehr fehlender Aktionspotentiale des medianen sensorischen Nervs 2 Wochen nach blinden Karpaltunnel-Kortikosteroid-Injektionen, Befunde, die für alle Schmerzspezialisten von potenzieller Bedeutung sind, insbesondere für diejenigen, die die Wirbelsäule behandeln [10].
Der Vorteil einer Short-Axis-Technik besteht darin, dass die dünnstmögliche Nadel auf kürzestem Weg eingesetzt wird. Bei korrekter Durchführung ist es nahezu schmerzfrei; Wenn die Nadel jedoch in eine Sehne gestochen wird, verspürt der Patient Schmerzen. Wir haben die folgende Technik bei über 1800 ultraschallgesteuerten Karpaltunnelinjektionen mit nur einer Komplikation (Infektion bei einem Patienten mit einer Vorgeschichte von Infektionen) angewendet.
3. ULTRASCHALLGESTÜTZTE TECHNIK FÜR KARPALTUNNEL-INJEKTIONEN
Der Patient sitzt dem Schmerzinterventionisten gegenüber, wobei Handgelenk und Hand in Supination auf einem Kissen ruhen. Der Patient sitzt neben dem Ultraschallgerät, so dass der Interventionist seinen Kopf nicht drehen oder seinen Blick erheblich verändern muss, Faktoren, die die Genauigkeit der Nadelplatzierung beeinträchtigen könnten.
Die Finger werden gebeugt und die Hand entspannt, um den Abstand zwischen den Sehnen zu maximieren, und dann wird eine Kurzachsenansicht der distalen Handgelenksfalte erhalten. Eine Öffnung zwischen den Beugesehnen, normalerweise eine vertikale oder leicht diagonale Spalte, die sich auf halbem Weg zwischen den N. medianus und ulnaris und am häufigsten zwischen den FDS-Sehnen des Mittel- und Ringfingers befindet, wird identifiziert (Abb. 1 und 3a–c). Wenn Sie eine ultraschallgeführte Injektion in der kurzen oder langen Achse durchführen, ist es wichtig, daran zu denken, dass die Stelle der Nadeleinführung immer außerhalb des Sichtbereichs des Ultraschallbildschirms liegt. Daher ist es notwendig, kurz über die beabsichtigte Nadeleinstichstelle zu scannen, um sicherzustellen, dass keine empfindlichen Strukturen, wie z. B. der Nervus medianus oder ulnaris oder Arterie, im Weg sind [3]. Der N. medianus kann von den Sehnen aufgrund ihrer Anisotropie oder Änderung ihres Aussehens von hell zu dunkel unterschieden werden, wenn der Schallkopf in der Sagittalebene hin und her gekippt wird. Es sollte auch beachtet werden, dass der N. medianus je nach Ausrichtung und Position des Schallkopfs nach medial oder lateral subluxieren kann.
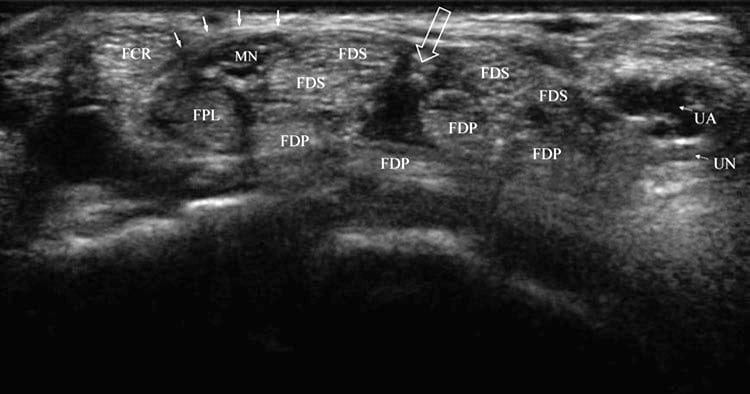
Abb. 1 Normaler Karpaltunnel. Kurzachsenansicht der distalen Handgelenksfalte und der Öffnung des Karpaltunnels, die die typische Anatomie bei einer nicht betroffenen Person zeigt. Der FCR ist durch das transversale Retinaculum (durchgezogene Pfeile) vom N. medianus (MN) und FPL getrennt. Eine Spalte oder Öffnung (offener Pfeil) ist zwischen den FDS-Sehnen auf halbem Weg zwischen N. medianus und ulnaris (UN) und Arterie (UA) zu sehen.
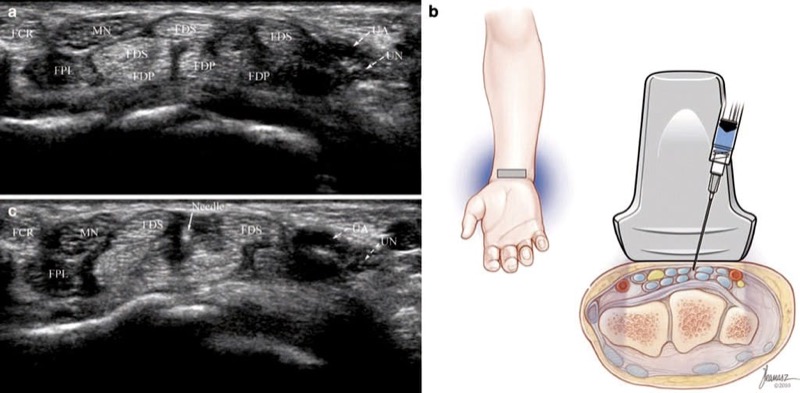
Abb. 3 Karpaltunnelsyndrom (Kurzachseninjektion). (a) Beachten Sie die Vergrößerung des N. medianus (MN) und die Öffnung zwischen den FDS-Sehnen. (b) Illustration, die die Nadel- und Wandlerposition vor der Injektion zeigt. Medizinische Illustrationen von Joseph Kanasz, BFA. (c) Das während der Injektion erhaltene Ultraschallbild zeigt die Nadelspitze (Pfeil), die von echofreiem Injektat umgeben ist.
Nachdem das Ziel auf dem Ultraschallbildschirm zentriert ist, wird der Abstand zwischen der Nadeleinführstelle und dem Ziel unter Verwendung des Messschiebers der Ultraschallmaschine berechnet oder auf der Grundlage der Skala auf dem Bildschirm geschätzt. Wir führen typischerweise eine 30-Gauge-25-mm-Nadel in die kurze Achse ein und führen sie leicht schräg durch die Spalte mit minimalem bis keinem Kontakt mit Sehnen. Wir halten die Spritze leicht in der Hand, um zu spüren, wie die Nadel zwischen die Sehnen rutscht, anstatt in sie zu stechen. Wenn sich die Nadelspitze innerhalb der oberflächlichen Sehnenreihe befindet, werden etwa 1.5 ml 20–40 mg Triamcinolonacetonid und physiologische Kochsalzlösung injiziert (Abb. 3b, c). Wenn das Medikament nicht gut gemischt ist oder die Nadel in eine Sehne sticht, kann es zu einer Verstopfung kommen, die das Einführen einer anderen möglicherweise größeren Nadel erforderlich macht.
Nachdem die Nadel zurückgezogen wurde, wird der Patient gebeten, die Finger vollständig zu strecken und so das Medikament in den Karpaltunnel zu ziehen. In Kombination mit der nächtlichen Verwendung einer Handgelenkschiene und der Vermeidung von exazerbierenden Aktivitäten kann die Injektion unserer Erfahrung nach eine vollständige Linderung der Symptome in leichten bis mittelschweren Fällen von CTS für bis zu 6 Monate oder länger bewirken.
4. ANATOMIE ULTRASCHALLGESTÜTZTE TRIGGERFINGERINJEKTIONEN
Die Auslösung erfolgt an der ersten ringförmigen (A1) Riemenscheibe, wo es zu einer Zunahme der Reibung oder zu einem Größenunterschied zwischen den Beugesehnen und der Riemenscheibe kommt. Die A1-Rolle besteht aus ringförmigen Bindegewebsbändern, die sich am und proximal des Metakarpophalangealgelenks (MCP) befinden und an die Sehnenscheide angrenzen [11]. Die mittlere Länge der A1-Rolle beträgt 12 mm für den erwachsenen Zeige-, Mittel- und Ringfinger und 10 mm für den kleinen Finger [12]. Zu den Befunden der Ultraschallbildgebung des Schnappfingers gehören Schwellung der Sehnen, echoarme Verdickung der A1-Rolle, Hypervaskularisation, Synovialscheidenerguss und dynamische Veränderungen der Form der Scheide während Beugung und Streckung [11, 13, 14].
Auf axialen Ultraschallansichten ist die A1-Rolle echoarm und wie eine umgekehrte Parabel geformt, die über den FDS- und FDP-Sehnen und der volaren Platte liegt. Beim Daumen hat die A1-Rolle eine kreisförmigere Form, da nur eine Sehne vorhanden ist, die FPL [11].
Der Schnappfinger ist ein häufiges Handproblem mit einer Lebenszeitprävalenz von 2.6 % in der Allgemeinbevölkerung und 10 % bei Diabetikern. Die Symptome können von einem vagen Spannungsgefühl in den Fingern oder Schmerzen in der Handfläche bis hin zu offensichtlichem Triggern und Blockieren reichen. Druckschmerz ist fast immer an der A1-Rolle vorhanden und kann in leichten Fällen der einzige Hinweis auf das Vorhandensein der Störung sein [11]. Der Abzugsfinger kann nach der Quinnell-Skala wie folgt eingestuft werden: 0, normale Bewegung; 1, ungleichmäßige Bewegung; 2, aktiv korrigierbare Verriegelung; 3, passiv korrigierbare Verriegelung; und 4, fixierte Deformität der Ziffer [15].
5. LITERATURÜBERSICHT ZU ULTRASCHALLGESTÜTZTEN TRIGGERFINGERINJEKTIONEN
Godeyet al. veröffentlichten eine Technik mit langer Achse und demonstrierten die Ablagerung von Steroiden unter und über der Riemenscheibe bei einem einzigen Patienten [16]. Bodor und Flossman beschrieben in ihrer prospektiven Studie an 50 von 52 aufeinanderfolgenden Triggerfingern eine Kurzachsentechnik und stellten ein vollständiges Verschwinden der Symptome bei 94 % der Finger nach 6 Monaten, 90 % nach 1 Jahr, 65 % nach 18 Monaten und 71 % fest. mit 3 jahren. Die Ergebnisse waren statistisch signifikant und im Vergleich zu den 56 % Erfolgsraten, die nach 1 Jahr für Blindinjektionen berichtet wurden, günstig [11, 17, 18].
6. ULTRASCHALLGESTÜTZTE TECHNIK FÜR TRIGGER-FINGER-INJEKTIONEN
Bei der Kurzachsentechnik ist das Injektionsziel ein Dreieck unter der A1-Rolle, deren Grenzen aus den FDS- und FDP-Sehnen und der palmaren Platte, dem distalen Mittelhandknochen und der Rolle bestehen (Abb. 4). Die Beugesehnen werden in axialer Ansicht auf Höhe der Grundphalanx identifiziert. An dieser Stelle erscheint die darunter liegende Oberfläche des Knochens konkav. Wenn der Schallkopf weiter proximal geführt wird, weicht die konkave Oberfläche der proximalen Phalanx der konvexen Oberfläche des Mittelhandknochens, wenn das MCP-Gelenk gekreuzt wird.
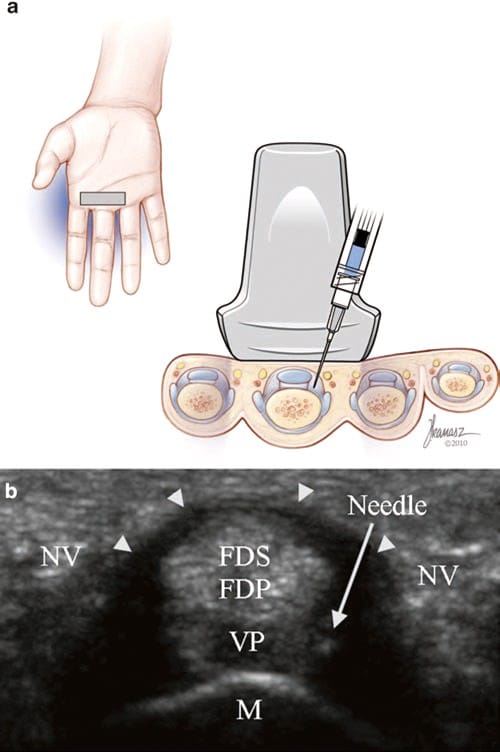
Abb. 4 Abzugsfinger (Kurzachseninjektion). (a) Illustration und medizinische Illustrationen von Joseph Kanasz, BFA (b) Kurzachsenansicht der A1-Rolle (Pfeilspitzen) mit der Nadelspitze innerhalb des Zieldreiecks, bestehend aus der A1-Rolle (Pfeilspitzen), FDS und FDP-Sehnen, Volarplatte (VP) und distaler Mittelhandknochen (M). Die neurovaskulären Bündel (NV) liegen auf beiden Seiten der Riemenscheibe.
Auf dieser Ebene werden die A1-Rolle und das Zieldreieck identifiziert und auf dem Bildschirm zentriert oder etwas links von der Mitte für jemanden, der mit der rechten Hand injiziert. Dabei spielt es keine Rolle, ob das Dreieck auf der radialen oder ulnaren Seite der Sehnen gewählt wird. Diese sowie andere Kurzachseninjektionen, die ein so hohes Maß an Genauigkeit erfordern, können erleichtert werden, indem eine Markierung an der Seite des Wandlers angebracht wird, die seine genaue Mitte angibt.
Wir verwenden einen distal-zu-proximalen Zugang und planen eine Trajektorie zur Hypotenuse des Dreiecks unter Verwendung eines ungefähr 70°-Winkels zur Horizontalen in der axialen Ebene und eines 45°-Winkels in der sagittalen Ebene. Sobald die 30-Gauge-Nadel die Haut durchsticht, injizieren wir 0.25 ml 4%iges Lidocain zur sofortigen Anästhesie und schieben dann die Nadel unter Echtzeit-Ultraschallführung vorsichtig in das Zieldreieck vor.
Wenn sich die Nadelspitze innerhalb des Dreiecks befindet, werden die Spritzen gewechselt und etwa 0.5–1.0 ml von 10–15 mg Triamcinolonacetonid und Lidocain 2–4 % injiziert, wobei darauf zu achten ist, den Fluss unter der A1-Rolle sichtbar zu machen. Wenn eine Strömung außerhalb der Riemenscheibe auftritt oder keine Strömung vorhanden ist, wird die Nadel eingestellt, bis eine Strömung erreicht wird. Manchmal wird anfangs ein hoher Ausflusswiderstand festgestellt, gefolgt von einem steilen Abfall des Widerstands, begleitet von einer sichtbaren Ausdehnung der Riemenscheibe. Die Riemenscheibe kann schwer zu durchdringen sein und die Nadel kann verstopfen, was das Einsetzen einer anderen möglicherweise größeren Nadel erfordert. Danach wird der Patient ermutigt, seine gewohnten Aktivitäten wieder aufzunehmen.
7. ANATOMIE ULTRASCHALLGESTÜTZTE HANDGELENK-INJEKTIONEN
Das Handgelenk besteht aus dem distalen Radius und der Ulna; die proximale Handwurzelreihe, einschließlich Kahnbein, Mondbein, Triquetrum und Pisiform; die distale Handwurzelreihe, einschließlich Trapez, Trapezoid, Capitatum und Hamatum; und die Basen der Mittelhandknochen. Die Handgelenke werden wie folgt gruppiert: distal radioulnar, radiocarpal, mediacarpal und carpometacarpal. Das distale Radioulnargelenk ermöglicht es dem Radius, sich während der Pronation und Supination um die Ulna zu drehen. Das bikonkave Radiokarpalgelenk erlaubt sowohl Flexion und Extension des Handgelenks als auch radiale und ulnare Abweichung. Die proximale Karpalreihe dient als starres interkaliertes Segment innerhalb der kinetischen Kette des Handgelenks und bildet mit der distalen Handwurzelreihe einen halbstarren Ring [19]. Die distale Handwurzelreihe dient als solide Stützbasis für die Mittelhandknochen, und eine komplexe Anordnung von Bändern, deren Beschreibung den Rahmen dieses Kapitels sprengen würde, verbindet und stabilisiert die Handwurzelknochen [20].
Das Handgelenk ist sowohl für akute als auch für chronische Verletzungen anfällig, einschließlich dorsaler und volarer Luxationen, chronischer Instabilitäten, rheumatoider und entzündlicher Arthritiden und Osteoarthritis. Arthrose kann als primär oder sekundär klassifiziert werden. Die häufigste Stelle der primären Osteoarthritis in der Hand und im Handgelenk betrifft das CMC-Gelenk des Daumens. Sekundäre Arthrose tritt typischerweise nach Frakturen oder nach einer Ruptur der beiden wichtigsten Bänder des Handgelenks auf, dem Scapholunatus und dem Lunotriquetral [21]. Etwa 95 % der Fälle von sekundärer Arthritis betreffen das Kahnbein [22].
8. LITERATURÜBERSICHT ÜBER ULTRASCHALLGEFÜHRTE HANDGELENK-INJEKTIONEN
Koskiet al. führte bei 50 Patienten mit aktiver rheumatoider Arthritis (RA) US-geführte Handgelenksinjektionen durch [23]. In der ersten Gruppe wurde den Patienten 20 mg Triamcinolonhexacetonid vollständig in das Radiokarpalgelenk injiziert, während in der zweiten Gruppe die Hälfte der Dosis dem Radiokarpalgelenk und die andere Hälfte dem Mittelkarpalgelenk verabreicht wurde. Nach 3 Monaten verbesserten sich die visuellen Analogwerte (VAS) in beiden Gruppen, wobei 19 von 25 Handgelenken in der ersten Gruppe klinisch als besser oder normal bewertet wurden und 22 von 25 in der zweiten Gruppe.
Bösen et al. injizierten das Radiokarpalgelenk von jedem der 17 RA-Patienten mit 1 ml Methylprednisolon 40 mg, 0.15 ml Gadolinium und 0.5 ml Lidocain 0.5 % mit dem Ziel, die Verteilung des Kontrastmittels auf die vier Kompartimente des Handgelenks zu beurteilen [24]. Es wurde ein Kurzachsen-Ansatz verwendet, wobei der Schallkopf sagittal zwischen dem distalen Radius und dem Mondbein ausgerichtet war. Ein Wert von 1 wurde für eine vollständige Streuung innerhalb eines Kompartiments vergeben, 0.5 für eine teilweise Streuung und 0 für keine Streuung. Der mittlere Verteilungs-Score betrug 2.4, wobei eine stärkere Verteilung bei Patienten mit höheren MRT-Synovitis-Scores und eine Verteilung in allen vier Kompartimenten bei nur zwei Patienten festgestellt wurde.
Lohman et al. stellten fest, dass 101 von 108 (93.5 %) Injektionen intraartikulär erfolgten [25]. Ihre Injektionstechnik bestand darin, das Handgelenk in eine leichte Volarflexion zu bringen und nach Listers Tuberkel zu palpieren. Ultraschallscanning in der kurzen Achse wurde verwendet, um den Raum zwischen dem dritten und vierten Sehnenfach am Radiokarpalgelenk zu identifizieren und zu markieren; der Wandler wurde um 90° gedreht und die Nadel in der langen Achse eingeführt.
Umphrey et al. führten US-geführte Kurzachseninjektionen des Trapeziometakarpalgelenks (TMC) oder des Daumen-CMC-Gelenks bei Leichen durch [26]. Fluoroskopische Bilder bestätigten den intraartikulären Kontrast in 16 von 17 (94 %) Gelenken nach einem einzigen Versuch. Mandlet al. berichteten über ähnliche Erfolgsraten (91 %) mit Blindinjektionen, wobei Ultraschall zur Bestätigung verwendet wurde [27].
In einer kürzlich durchgeführten Studie mit 18 Patienten haben Salini et al. stellten eine einzelne ultraschallgeführte Injektion von Natriumhyaluronat 1 % in das CMC-Gelenk des Daumens bereit und stellten bei der Nachbeobachtung nach 1 Monat eine Schmerzlinderung von 1.8 auf 0.5 in Ruhe und von 8 auf 4 bei Aktivitäten fest, wobei die Verwendung von NSAID eliminiert wurde bei 9 Patienten und Reduktion des NSAID-Einsatzes (2.5–1 Tablette pro Woche) bei 7 Patienten [28].
In einer gut kontrollierten, nicht ultraschallgesteuerten Studie mit 56 Patienten mit Daumen-CMC-Gelenkarthritis wiesen Fuchs et al. verglichen eine Injektion von 10 mg Triamcinolonacetonid (TA) mit drei Injektionen von 1 ml Natriumhyaluronat (SH) 1 % im Abstand von 1 Woche. Der VAS-Score stieg von 61 auf 20 auf 48 in der TA-Gruppe und von 64 auf 30 auf 28 in der SH-Gruppe 3 Wochen nach der letzten Injektion und nach 26 Wochen der letzten Nachuntersuchung [29].
9. ULTRASCHALLGESTÜTZTE TECHNIK FÜR HANDGELENK-INJEKTIONEN
Vor der Planung von Injektionen ist eine genaue sonographische Untersuchung ratsam. So wird beispielsweise bei der Behandlung von Schmerzen an der radialen Seite des Handgelenks das Radial-Scaphoideum-Gelenk visualisiert und auf dem Bildschirm zentriert und eine sorgfältige Palpation über dem Gelenk durchgeführt, um zu bestätigen, dass es der Schmerzgenerator ist. Um eine präzise Sonopalpation zu ermöglichen, empfehlen wir die Verwendung einer kleinen Sonde oder der Spitze des kleinen Fingers. Wenn ein bestimmtes Gelenk der Schmerzerzeuger ist, erwarten wir, dass es im Vergleich zu angrenzenden Strukturen schmerzempfindlich ist. Wir halten diese Technik für besonders nützlich bei der Identifizierung von Schmerzen, die von kleinen und schwer zugänglichen Strukturen wie den Pisotriquetral- (PT) und STT-Gelenken ausgehen.
Es werden zwei Techniken der Handgelenksinjektionen beschrieben, die erste unter Verwendung eines langachsigen Ansatzes und die zweite unter Verwendung eines kurzachsigen Ansatzes.
Für den langachsigen Zugang zum Radiokarpalgelenk sitzt der Patient neben dem Ultraschallgerät mit Blick auf den Arzt. Das Handgelenk befindet sich in Pronation und leichter Volarflexion und ruht auf einem Kissen. Der Tuberculum Lister wird in der kurzen Achse identifiziert. Daneben befindet sich ulnarseitig der Extensor pollicis longus (EPL), gefolgt vom Extensor digitorum communis (EDC). Das Intervall zwischen den EPL- und EDC-Sehnen wird auf dem Bildschirm zentriert, und der Schallkopf wird distal bewegt, bis die knöcherne Kortikalis des Radius verschwindet. Hier wird der Schallkopf um 90° gedreht, so dass das darunter liegende Radial-Kahnbein-Gelenk in der Längsachse zu sehen ist (Abb.. 5). Eine 27-Gauge-32-mm-Nadel wird dann in der Längsachse von distal nach proximal vorgeschoben, bis die Nadelspitze in das Gelenk eintritt.
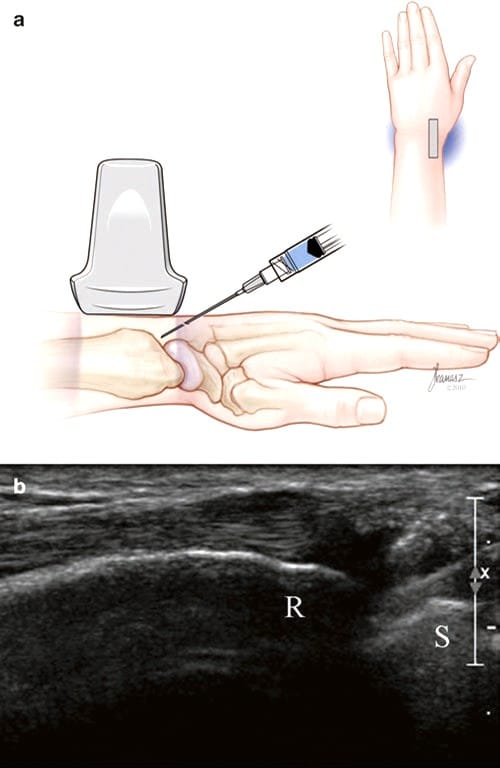
Abb.5 Längsachseninjektion des Handgelenks (Radial-Skaphoid)-Gelenk. (a) Illustration und medizinische Illustrationen von Joseph Kanasz, BFA. (b) Längsachsenansicht des Gelenks und Speiche (R) und Kahnbein (S) und Nadel von rechts eintretend gesehen. Injizierte Flüssigkeit umgibt die Nadelspitze.
Für kleine und oberflächliche Gelenkinjektionen wie das CMC-Gelenk des Daumens ist eine Kurzachseninjektion am einfachsten durchzuführen. Das Handgelenk wird in neutraler Position zwischen Pronation und Supination, in leichter Ulnardeviation für einen dorsalen Zugang und in Supination, Daumenadduktion und leichter Ulnardeviation für einen volaren Zugang platziert. Das Gelenk wird auf dem Bildschirm zentriert, und der Abstand zwischen der Haut und einem Punkt innerhalb des oberflächlichen Teils des Gelenks wird geschätzt. Eine 30-Gauge-, 12.5- oder 25-mm-Nadel wird in die kurze Achse eingeführt und auf das Gelenk gerichtet (Abb.. 6). Wenn sich die Nadel im Gelenk befindet, werden 0.5–1.0 ml Kortikosteroid, Lidocain oder Viskosupplement injiziert. Der Vorteil des dorsalen Zugangs besteht darin, dass er die empfindliche Haut der volaren Seite der Hand vermeidet, wohingegen der volare Zugang, wie von Umphrey et al. [26] vermeidet die darüber liegenden Daumensehnen.
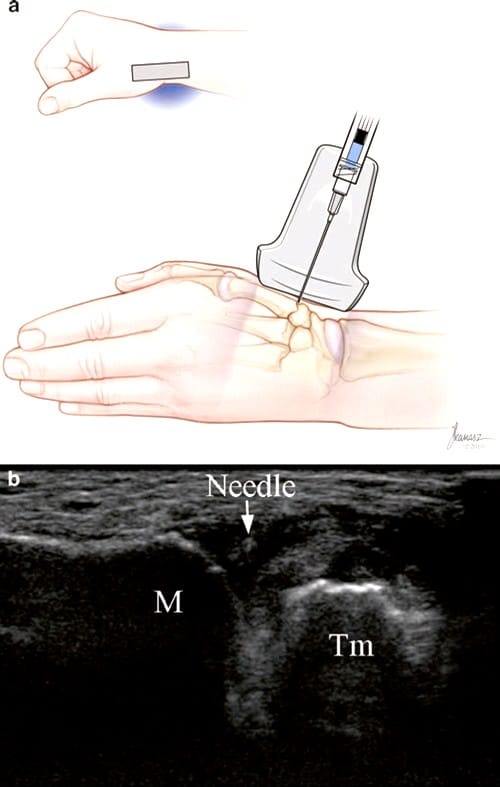
Abb.6 Injektion des CMC-Daumengelenks (kurzachsiger dorsaler Zugang). (a) Illustration und medizinische Illustrationen von Joseph Kanasz, BFA. (b) Kurzachsenansicht der Nadel (Pfeil), des proximalen Mittelhandknochens (M) und des Os trapezium (Tm) während der Injektion. Das Medikament wird über eine 30-Gauge-Nadel injiziert, was zu einer hohen Geschwindigkeit und Luftblasen führt, die tief in das Gelenk injiziert werden, wodurch ein etwas helleres Aussehen der Flüssigkeit zwischen M und Tm entsteht.
10. ANATOMIE ULTRASCHALLGESTÜTZTE INJEKTIONEN BEI SEHNENFEHLERFUNKTION
Die Strecksehnen sind am dorsalen Handgelenk und am Unterarm in sechs Kompartimente unterteilt: E1, M. abductor pollicis longus (APL) und M. extensor pollicis brevis (EPB); E2, Extensor carpi radialis longus und brevis (ECRL und ECRB); E3, EPL; E4, EDC; E5, Extensor digiti minimi (EDM); und E6, M. extensor carpi ulnaris (ECU). Die Sehnen neigen zu Reibung, Überbeanspruchung, Ergüssen und degenerativen Veränderungen. Die gemeinsame Strecksehne von ECRB, EDC, EDM und ECU entspringt dem lateralen Epicondylus des Humerus. Die Anatomie der Beugesehnen wird im Abschnitt Karpaltunnel besprochen.
11. SEHNENFUNKTION
Sehnenscheidenentzündung de Quervain
Fritz de Quervain beschrieb 1895 eine stenosierende Tenosynovitis der Sehnen des ersten Kompartiments, der APL und EPB [30]. Schmerzen bei Daumen- und Handgelenksbewegungen und Empfindlichkeit über dem radialen Styloid sind vorhanden. Die Inzidenz beträgt etwa 0.94–6.3 pro 1000 Personenjahre [31, 32], und Frauen, ältere Personen und Afroamerikaner sind stärker gefährdet [32]. Ultraschallbefunde sind Sehnen- und Synovialscheidenverdickung mit peritendinösen ödematösen Veränderungen [33].
Zingas et al. führten Blindinjektionen von Kortikosteroiden und Röntgenfarbstoffen bei 19 Patienten mit De-Quervain-Tenosynovitis durch [34]. Eine Linderung der Symptome trat bei 11 von 16 auf, bei denen Farbstoff in E1 vorhanden war, bei 4 von 5, bei denen Farbstoff innerhalb von E1 und um sowohl APL- als auch EPB-Sehnen gesehen wurde, und bei 0 von 3, bei denen Farbstoff nicht in E1 gelangte. Die Autoren kamen zu dem Schluss, dass die optimale Auflösung der Symptome von genauen Sehnenscheideninjektionen abhängt, und stellten die Hypothese auf, dass Injektionen und Operationen fehlschlagen können, wenn ein nicht erkanntes Septum die kleinere EPB von der größeren APL trennt.
Avci et al. führten eine randomisierte kontrollierte Studie bei schwangeren und stillenden Frauen durch, die eine vollständige Schmerzlinderung bei neun von neun Patienten zeigte, die mit blinden Kortikosteroid-Injektionen behandelt wurden, und bei null von neun Patienten, die Daumen-Spica-Schienen verwendeten [35].
Jeyapalan und Choudhary führten US-geführte Injektionen bei 17 Patienten mit De-Quervain-Tenosynovitis durch und stellten eine signifikante Linderung der Symptome bei 15 von 16 (94 %) Patienten fest, die für die Nachsorge verfügbar waren [36].
Intersection-Syndrom
Am Schnittpunkt der E1- (APL und EPB) und E2-Sehnenscheiden (ECRL und ECRB) im distalen Unterarm kommt es zum Intersection- oder Ruderer-Syndrom. Fokaler Druckschmerz bestätigt die Diagnose. Ultraschallbefunde können eine Verdickung der Sehnenscheiden oder das Vorhandensein eines Ergusses sein [37]. Eine ultraschallgesteuerte Kortikosteroid-Injektion und die Vermeidung von direktem Druck und verschlimmernden Aktivitäten können helfen, dieses Problem zu lösen. Ein selteneres Friktionssyndrom kann weiter distal am Schnittpunkt von E2 und E3 auftreten.
Laterale Epikondylitis
Laterale Epicondylitis (LE) oder Tennisarm haben eine Inzidenz von 0.4–0.7 % in der Allgemeinbevölkerung [38, 39]. LE ist sekundär durch Überbeanspruchung, Degeneration, mangelnde Regeneration (Tendinose) oder Mikrorisse der gemeinsamen Strecksehne [3, 40]. Die tiefen Fasern des ECRB-Teils der Sehne sind am häufigsten betroffen. Ultraschallbefunde umfassen eine diffuse Sehnenvergrößerung, echoarme Bereiche, lineare und komplexe Risse, intratendinöse Verkalkung und angrenzende Knochenunregelmäßigkeiten [3].
Kürzlich durchgeführte systematische Übersichtsarbeiten [41, 42] ergaben, dass Kortikosteroid-Injektionen eine gute kurzfristige Linderung der Symptome, aber keinen langfristigen Nutzen bringen, während eine physikalische Therapie die mittel- und langfristigen Ergebnisse im Vergleich zu keiner Intervention leicht verbessert. Zu den Risiken von Kortikosteroiden gehören eine gemeinsame Strecksehne und eine Ruptur des lateralen Seitenbandes.
Mischra et al. führte die erste randomisierte kontrollierte Studie mit Injektionen von plättchenreichem Plasma (PRP) bei chronischer lateraler Epicondylitis bei 20 Patienten durch, bei denen Kortikosteroid-Injektionen und physikalische Therapie fehlgeschlagen waren [43]. Nach 8 Wochen gab es bei den 60 Patienten in der PRP-Gruppe eine Verbesserung des VAS-Scores um 15 %, verglichen mit 16 % bei den 5 Patienten in der Bupivacain-Gruppe. Bei der letzten Nachuntersuchung, durchschnittlich 25.6 Monate später, gab es eine Verbesserung von 93 % in der PRP-Gruppe.
Neuere systematische Reviews [44, 45] kamen ebenfalls zu dem Schluss, dass Prolotherapie, Polidocanol, autologes Vollblut und PRP alle für LE wirksam sind, wobei weitere Studien im Gange sind. McShaneet al. berichteten gute bis sehr gute Ergebnisse bei 92 % der Patienten nach durchschnittlich 22 Monaten nach der sonographisch geführten perkutanen Nadeltenotomie bei LE [46].
Aufprall der Sehne
Aroraet al. berichteten über eine Serie von 141 Patienten, die mit einer palmaren Platte mit festem Winkel und offener Reposition interner Fixation (ORIF) behandelt wurden, wobei zwei Rupturen der FPL-Sehne, neun Fälle von Beugesehnen-Tenosynovitis, zwei EPL-Rupturen, vier Fälle von Strecksehnen-Synovitis, drei festgestellt wurden CTS und fünf mit CRPS [47]. Casalettoet al. beschrieben sieben Fälle von FPL-Ruptur in Verbindung mit einer palmaren Plattenfixation [48]. Adhamet al. beschrieben vier Fälle von Beugesehnenproblemen nach volarer Plattenfixation von distalen Radiusfrakturen, die alle mit engem Kontakt der Beugesehnen mit Schrauben oder dem distalen Rand der Platte verbunden waren [49].
12. ULTRASCHALLGESTÜTZTE TECHNIK BEI SEHNENFUNKTION
US-gesteuerte Injektionen bei de Quervain-Tenosynovitis werden wie folgt durchgeführt: Die APL- und EPB-Sehnen werden in der kurzen Achse an der Daumenbasis identifiziert und proximal bis zum Punkt der maximalen Druckempfindlichkeit verfolgt, normalerweise dort, wo sie das radiale Styloid kreuzen. Die E1-Sehnenscheide ist das Ziel für die Injektion, aber jede Sehne kann separat anvisiert werden, wenn ein Septum vorhanden ist oder sich der Fluss nicht über die gesamte Scheide ausbreitet. Nachdem die Spalte zwischen den Sehnen auf dem Bildschirm zentriert ist, wird eine Kurzachseninjektion mit einer 27-Gauge-32-mm-Nadel und 1–2 ml Lidocain/Kortikosteroid durchgeführt (Abb.. 7).
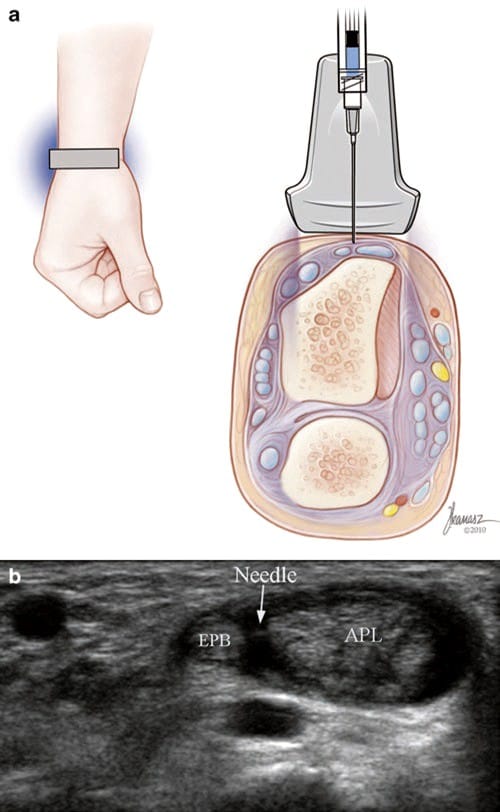
Abb.7 Tenosynovitis de Quervain (Kurzachseninjektion). (a) Illustration und medizinische Illustrationen von Joseph Kanasz, BFA. (b) Kurzachsenansicht der Nadelspitze (Pfeil), gesehen zwischen den APL- und EPB-Sehnen.
US-gesteuerte Injektionen für das Intersektionssyndrom werden auf ähnliche Weise durchgeführt. Die E1-Sehnen werden proximal bis zu dem Punkt verfolgt, an dem sie die E2-Sehnen kreuzen. Eine Kurzachseninjektion kann in die E1-Sehnenscheide zwischen der APL- und EPB-Sehne erfolgen, gefolgt von einem Vorschieben der Nadel in den Raum zwischen E1 und E2, wo mehr Medikament injiziert werden kann.
Die Ultraschalluntersuchung bei lateraler Epicondylitis ist am nützlichsten, um festzustellen, ob die gemeinsame Strecksehne geschwollen, degeneriert und teilweise oder vollständig gerissen ist, Faktoren, die das Ergebnis wahrscheinlich genauso beeinflussen wie die exakte Nadelplatzierung. Ultraschallführung kann in der kurzen oder langen Achse für eine Injektion von PRP in einen Riss oder zur Beurteilung der Ausbreitung von Injektat verwendet werden (Abb.. 8).
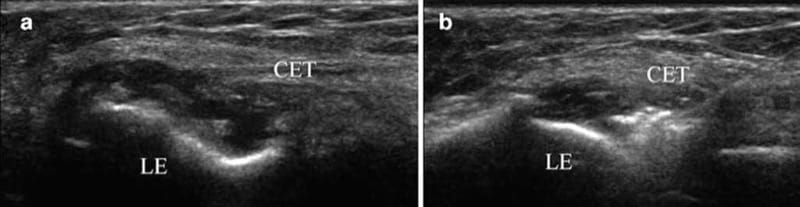
Abb.8 Laterale Epicondylitis. (a) Längsachsenansicht, die echofreie Flüssigkeit zwischen dem Ursprung der gemeinsamen Strecksehne (CET) und dem lateralen Epicondylus (LE) zeigt, was auf einen Riss hinweist. (b) Längsachsenansicht mit Nadel, die zeigt, wie PRP in den Riss injiziert wird.
US-gesteuerte Injektionen für Sehnenimpingement können nach der Verwendung dynamischer Bildgebung durchgeführt werden, um zu bestimmen, welche Sehne wo impingement ist. Da Kortikosteroide das Risiko eines Sehnenrisses erhöhen, wird nur eine Injektion eines Lokalanästhetikums verabreicht. Wenn die Schmerzquelle identifiziert ist, kann entschieden werden, ob die Hardware entfernt werden soll. Die Injektionstechnik für das Impingement einer Sehne wie der FPL ist ähnlich der für CTS. Es wird ein kurz- oder langachsiger Zugang verwendet, aber die Nadel wird über die oberflächliche Sehnenreihe hinaus vorgeschoben, sodass die Spitze zwischen der FPL und der Befestigungsplatte oder -schraube positioniert ist. Zu diesem Zeitpunkt werden 0.5–1.0 ml Lidocain 4 % oder Bupivacain 0.75 % injiziert, gefolgt von der Beurteilung von Schmerz und Funktion (Abb.. 9).
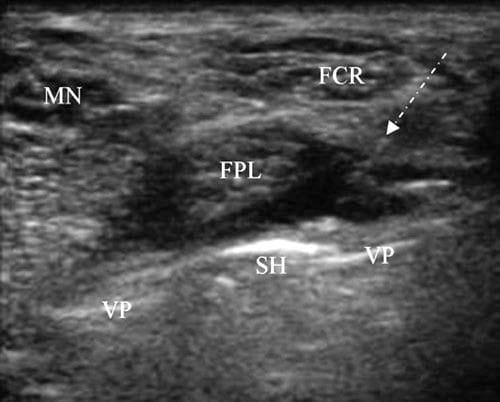
Abb.9 Impingement der FPL-Sehne. Kurzachsenansicht des distalen Radius mit einer volaren Fixationsplatte (VP) und einem hervorstehenden Schraubenkopf (SH) neben der FPL. Das Bild wurde während einer diagnostischen Injektion aufgenommen. Die FPL-Sehne wird durch Lokalanästhesie, die über einen langachsigen Zugang injiziert wird, vom SH weg verschoben. Die Nadel ist als Reihe von Punkten unterhalb des Pfeils zu sehen und aufgrund ihres hohen Winkels schwer zu erkennen.
13. ANATOMIE ULTRASCHALLGESTÜTZTE ELLBOGENINJEKTIONEN
Der Ellbogen ist ein zusammengesetztes Gelenk, das aus den Gelenken von drei Knochen gebildet wird, einschließlich Oberarmknochen, Speiche und Elle. Die ulno-humerale Artikulation nähert sich einem Scharniergelenk, während die radioulnaren und radio-humeralen Artikulationen eine axiale Rotation ermöglichen. Die Gelenkkapsel umhüllt das gesamte Ellenbogengelenk und ist in Ellenbogenstreckung straff und in Ellenbogenbeugung locker. Es enthält drei Fettpolster, von denen sich zwei in der Fossa capitellaris und trochlearis und das dritte in der Fossa olecrani befinden. Wenn ein Ellbogengelenkerguss vorliegt, sind die Fettpolster angehoben, was zu den röntgenologischen Anzeichen sichtbarer hinterer und erhöhter vorderer Fettpolster führt.
Um den Ellbogen herum befinden sich zahlreiche Schleimbeutel, einschließlich der Kubital- und Olecranon-Schleimbeutel. Zu den Kubitalschleimbeuteln gehören der bicipito-radiale Schleimbeutel und der interossäre Schleimbeutel [50]. Der Bursa cubitalis befindet sich zwischen der distalen Bizepssehne und dem Tuber radialis und verringert die Reibung während der Pronation des Unterarms. Kubitale Bursitis ist selten und verursacht Schmerzen und Schwellungen in der antekubitalen Fossa [51]. Posterior finden sich drei Schleimbeutel, darunter der oberflächliche Bursa olecrani, der sich hinter dem Olecranon im subkutanen Gewebe befindet. Dieser Schleimbeutel ist häufig nach direkter Verletzung oder wiederholtem Trauma oder bei entzündlichen Erkrankungen entzündet.
Die Kenntnis der Anatomie der peripheren Nerven um den Ellbogen herum ist wichtig, wenn interventionelle Verfahren in diesem Bereich durchgeführt werden. Der Nervus ulnaris liegt medial zwischen Processus olecrani und Epicondylus medialis, der Nervus radialis lateral unter dem Musculus brachioradialis, wo er sich in tiefe und oberflächliche Äste gabelt. Der tiefe Ast des N. radialis verläuft zwischen den beiden Köpfen des M. supinator, und der oberflächliche Ast verläuft unter dem M. brachioradialis auf seinem Weg zum dorsalen radialen Aspekt der Hand [52]. Der N. medianus liegt anterior, oberflächlich des Musculus brachialis und medial der A. brachialis [53].
14. LITERATURÜBERSICHT ZU ULTRASCHALLGESTÜTZTEN ELLBOGENINJEKTIONEN
Ultraschallgeführte Ellenbogengelenkinjektionen werden üblicherweise zur Diagnose und Behandlung von Schmerzen durchgeführt, die aus Osteoarthritis, rheumatoider Arthritis, Kristallarthropathien und Infektionen resultieren. Ultraschall kann ein wertvolles Hilfsmittel für den Arzt sein, der Ellbogenschmerzen behandelt, da die körperliche Untersuchung und das blinde Absaugen oft nicht das Vorhandensein eines Ergusses erkennen lassen.
Louiset al. und Bruynet al. beschrieben ähnliche Ansätze, bei denen der Ellbogen entweder über der Brust gebeugt oder hinter dem Rücken hervorsteht und die Hand auf einer flachen Oberfläche ruht [54, 55]. Der Schallkopf wird mit der Längsachse des Oberarms ausgerichtet und seitlich bewegt, bis er gerade aus dem Blickfeld der Trizepssehne kommt. Die Nadel wird unter Verwendung eines Langachsenzugangs eingeführt. Die N. medianus, radialis und ulnaris sind bei diesem Ansatz nicht verletzungsgefährdet, und die wichtigsten anatomischen Orientierungspunkte umfassen die konkave Fossa olecrani des Humerus, das hintere Fettpolster und das Olecranon.
15. ULTRASCHALLGEFÜHRTE ELLENBOW-INJEKTIONSTECHNIK
Der Patient sitzt dem Arzt abgewandt mit einem Kissen auf dem Schoß, die Hand ruht auf dem Kissen und der Ellbogen ist gebeugt. Eine Längsachsenansicht des Olekranons und der Trizepssehne wird erhalten (Abb. 10a). Während das untere Ende des Wandlers am Olecranon bleibt, wird das obere Ende um 30° im Uhrzeigersinn für den rechten oder 30° gegen den Uhrzeigersinn für den linken Ellbogen gedreht. Wenn der Schallkopf gedreht wird, kommt die konvexe Oberfläche der lateralen Trochlea des distalen Humerus mit ihrer dünnen Schicht aus echoarmem Knorpel zum Vorschein. Der Gelenkspalt ist die kleine Kerbe zwischen Olecranon und Trochlea (Abb. 10c).
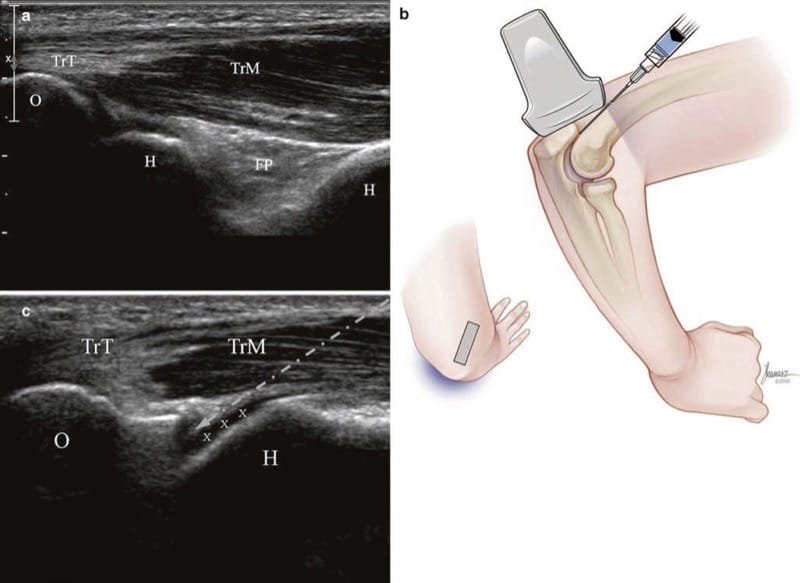
Abb. 10 Ellenbogen (Langachseninjektion). (a) Anfängliche Längsachsenansicht der Trizepssehne (TrT), des Muskels (TrM), des Olekranons (O), des Humerus (H), des hyaline Knorpels (x) und des hinteren Fettpolsters (FP). (b) Darstellung der Position nach seitlicher Drehung des oberen Endes des Wandlers um 30°. Medizinische Illustrationen von Joseph Kanasz, BFA. (c) Ultraschallbild (b) mit Darstellung der Trizepssehne (TrT), des Muskels (TrM) und der Nadelbahn (Pfeil), die durch den Muskel verläuft und die Sehne vermeidet.
Man muss darauf achten, nicht zu weit nach lateral zu rotieren – wenn die echoarme Knorpelschicht nicht sichtbar ist, kann die Knochenoberfläche, die oberhalb des Olecranon zu sehen ist, der posteriore laterale Epicondylus sein. Der Transducer wird dann nach unten bewegt, um die Distanz zu minimieren, die die Nadel bis zum Gelenkspalt zurücklegen muss. Wie üblich wird eine möglichst dünne Nadel verwendet und in der Längsachse von oben nach unten eingestochen (Abb. 10b). Wenn eine Aspiration durchgeführt werden muss (Abb.. 11), wird die Nadel zurückgezogen, während ihre Bahn betäubt wird, und eine Nadel mit größerer Stärke wird entlang ihrer Bahn eingeführt.
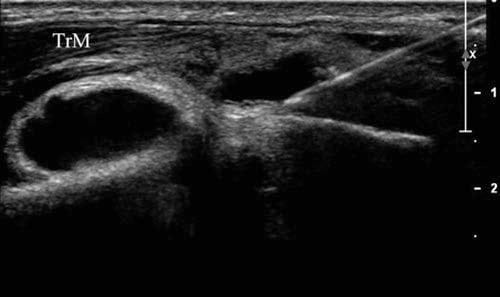
Abb.11 Ellbogengelenkaspiration. Längsachsenansicht einer 18-Gauge-Nadel, die während der Aspiration von 15 ml Synovialflüssigkeit aus dem Ellbogen eines Patienten mit Gicht entnommen wurde. Der Erguss befand sich oberhalb des Gelenks, sodass der gesamte darunter liegende Knochen, der in diesem Bild zu sehen ist, der distale laterale Humerus ist.