Kenneth D. Candido, Anthony R. Tharian und Alon P. Winnie
EINFÜHRUNG
Die Technik der intravenösen Regionalanästhesie (IVRA) oder „Bierblockade“ wurde erstmals 1908 von dem deutschen Chirurgen August Bier eingeführt. Ein Bier-Block besteht im Wesentlichen aus der Injektion von Lokalanästhesielösungen in das venöse System einer durch Kompression oder Schwerkraft entbluteten oberen oder unteren Extremität, die durch ein Tourniquet vom zentralen Kreislauf isoliert wurde. Bei Biers ursprünglicher Technik wurde das Lokalanästhetikum Procain in Konzentrationen von 0.25 % bis 0.5 % durch eine intravenöse Kanüle injiziert, die zwischen zwei Esmarch-Bandagen gelegt worden war, die als Tourniquets verwendet wurden, um den Arm in proximale und distale Komponenten zu unterteilen. Nach der Injektion des Lokalanästhetikums bemerkte Bier zwei unterschiedliche Arten der Anästhesie: ein fast sofortiges Einsetzen einer „direkten“ Anästhesie zwischen den beiden Tourniquets und dann, nach einer Verzögerung von 5 bis 7 Minuten, eine „indirekte“ Anästhesie distal zum distal platzierten Tourniquet. Durch Sektionen des Venensystems der oberen Extremität bei Leichen nach Injektion von Methylenblau konnte Bier feststellen, dass die direkte Anästhesie das Ergebnis einer Lokalanästhesie war, bei der blanke Nervenenden in das Gewebe gebadet wurden, während die indirekte Anästhesie höchstwahrscheinlich darauf zurückzuführen war Lokalanästhetikum wird über die Vasa nervorum in die Nervensubstanz transportiert, wo es zu einer typischen Reizleitungssperre kommt. Biers Schlussfolgerung war, dass zwei Anästhesiemechanismen mit dieser Technik verbunden sind: peripherer Infiltrationsblock und Leitungsblock. Die Technik, wie sie ursprünglich von Bier beschrieben wurde, ist in der modernen Praxis in den letzten 106 Jahren im Wesentlichen unverändert geblieben, mit Ausnahme der Einführung der pneumatischen Doppeltourniquet-Präparation, die in der gegenwärtigen klinischen Praxis verwendet wird (Figure 1).
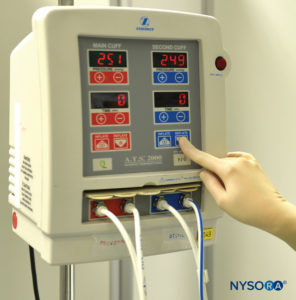
ABBILDUNG 1.Doppeltes pneumatisches Tourniquet-System zur Verwendung in der intravenösen Regionalanästhesie der oberen oder unteren Extremität.
Ein Bier-Block kann für kurze chirurgische Eingriffe oder Manipulationen an der oberen oder unteren Extremität verwendet werden. Die größte Akzeptanz hat die Technik jedoch für die Anwendung an der oberen Extremität gefunden, da Tourniquet-Probleme und andere Sicherheitsprobleme häufiger auftreten, wenn IVRA an den unteren Extremitäten verwendet wird. Die Bier-Blockade ist auch ein Verfahren, das sich als Behandlungszusatz für Patienten mit komplexen regionalen Schmerzsyndromen (CRPSs) (früher bekannt als sympathische Reflexdystrophie mit sympathisch aufrechterhaltenen Schmerzen) als Alternative zu wiederholten sympathischen Ganglienblockaden als nützlich erwiesen hat. In dieser Hinsicht hat sich gezeigt, dass IVRA die neurogene Entzündung verringert, ein Phänomen, das möglicherweise mit CRPS assoziiert ist, mit geringer Beeinträchtigung der sensorischen Funktion, zumindest wenn Mepivacain das für die Blockade gewählte Lokalanästhetikum ist. Das Kälteempfinden ist 10 bis 30 Minuten nach der Blockade deutlich reduziert, auch bei einer Verringerung der Hauttemperatur auf der blockierten Seite.
Die chemische Sympathektomie mittels IVRA mit Wirkstoffen wie Guanethidin oder Bretylium kann bis zu 5 Tage dauern, im Vergleich zu Lokalanästhetika-Blockaden, die typischerweise nur eine mehrstündige Analgesie bewirken. Quantitative sensorische Tests (QSART, quantitativer sudomotorischer Axonreflextest) vor und nach solchen Blockaden zeigten, dass es möglich ist, vorherzusagen, welche Patienten eine lang anhaltende Schmerzlinderung mit IVRA-Guanethidin-Blockaden nach einer traumatischen Verletzung oder Operation erfahren werden.
Obwohl IVRA eine sichere und wirksame Methode zur Verabreichung von Lokalanästhetika für die Extremitätenblockade sowohl für Operationen als auch für die Schmerzkontrolle ist, stellte eine große veröffentlichte Umfrage fest, dass die meisten Anästhesisten im dritten Jahr (CA-3) weniger als 10 solcher Blockaden während des gesamten Verlaufs durchgeführt hatten ihre Ausbildung.
ANATOMIE
Die einzig relevante Anatomie ist die Lage und Verteilung der Venen der Hand, der Fossa antecubitalis und der Fuß- und Knöchelregion.
INDIKATIONEN
Obere Extremität
Eine intravenöse Regionalanästhesie mit Lokalanästhetikum, am häufigsten Lidocain 0.5 %–1 % (Prilocain 1 % in Europa), ist für Operationen und Manipulationen der Extremitäten geeignet, die eine Anästhesie von bis zu 1 Stunde Dauer erfordern. Es eignet sich am besten für periphere Weichteiloperationen wie Ganglionektomie, Karpaltunnelentfernung, Dupuytren-Kontrakturchirurgie oder Reposition von Frakturen. Die Notwendigkeit, die Extremität mit einem Esmarch-Verband zu entbluten, ein potenziell schmerzhaftes Manöver, kann jedoch bestimmte Verfahren von der Durchführung dieser Technik ausschließen (Figure 2 und Figure 3).
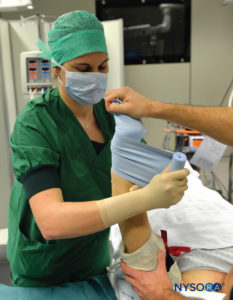
ABBILDUNG 2.Beginn der Entblutung der hochgezogenen linken oberen Extremität mit einem dicht gewickelten Esmarch-Verband von der distalen Hand bis zur proximalen oberen Extremität an der Basis des distalen Tourniquets.
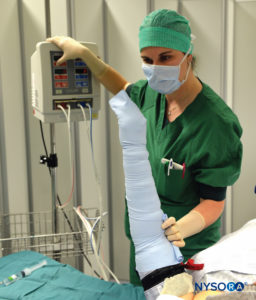
ABBILDUNG 3. Halten Sie die Esmarch-Bandage eng gewickelt, zuerst distal, dann proximale Tourniquets bis 50-100 mm Hg über dem systolischen arteriellen Blutdruck.
Ebenso können Manipulationen an den N. ulnaris, medianus oder radialis Parästhesien verursachen, die den Einsatz von adjuvanten parenteralen Analgetika oder Beruhigungsmitteln erfordern können. Eine neuartige Anwendung von IVRA ist die Betäubung der Hand vor der Injektion von Botulinumtoxin A (BTX-A) zur Behandlung von Hyperhidrose. BTX-A reduziert die Schweißproduktion signifikant, gemessen durch Minor's Test und quantifiziert durch Corneometer-Analyse, aber die Injektion ist schmerzhaft, wenn die Hand nicht vorher anästhesiert wird; IVRA hat sich für diesen Zweck als geeignet erwiesen. Laut einer kürzlich durchgeführten Studie gab es bei Patienten mit CRPS Typ 70, das die oberen Extremitäten betraf, keinen Unterschied im Ausmaß und in der Dauer der Analgesie zwischen IVRA und Sternganglienblock (SGB) unter Verwendung einer Kombination von 30 mg Lidocain und 1 μg Clonidin. Die Studie kam zu dem Schluss, dass IVRA SGB in diesem Setting vorzuziehen ist, da es ein geringeres Risiko für unerwünschte Nebenwirkungen und eine einfachere Ausführung als SGB hat.
IVRA der oberen Extremität wurde gelegentlich für längere Analgesie/Anästhesie (dh Operationen, die voraussichtlich länger als 1 Stunde dauern) verwendet, mit einer obligatorischen Tourniquet-Entleerungsperiode von mindestens 1 Minute vor Wiederherstellung des anästhesierten Zustands.
Untere Extremität
Eine intravenöse Regionalanästhesie kann für kurze chirurgische Eingriffe an der unteren Extremität in analoger Weise wie für die Operation an der oberen Extremität beschrieben verwendet werden. Zu den chirurgischen Eingriffen, die unter Verwendung dieses Ansatzes durchgeführt werden können, gehören die Exzision einer Masse; digitale Nervenreparatur; Phalanx-Fraktur-/Dislokationschirurgie; und akzessorische Strahlbeinexzision. Jeder orthopädische Eingriff an Fuß, Sprunggelenk oder distaler unterer Extremität, der etwa 45 Minuten oder weniger in Anspruch nimmt, kann für diese Modalität geeignet sein.
Obwohl IVRA mit einer erhöhten Inzidenz von in Verbindung gebracht wurde Kompartmentsyndrom bei der Behandlung von Schienbeinschaftfrakturen und wurde daher in solchen Fällen als kontraindiziert erachtet, zeigte eine Studie an Freiwilligen keinen signifikanten Unterschied im Gewebedruck vor und nach dem Aufblasen des Tourniquets, unabhängig vom Volumen der verwendeten Kochsalzlösung (≤1.5 ml/kg) oder in Abhängigkeit von Zeit nach der Injektion der Kochsalzlösung während des Aufblasens des Tourniquets. Die Autoren kamen zu dem Schluss, dass in der normalen atraumatischen Extremität eine simulierte IVRA unter Verwendung von normaler Kochsalzlösung (NS) den Gewebedruck im vorderen Kompartiment des Beins nicht erhöht.
Pädiatrie
Die intravenöse Regionalanästhesie ist bei ausgewählten pädiatrischen Patienten eine akzeptable Wahl zur Reposition von Frakturen der oberen Extremität. Eine retrospektive Studie, in der IVRA und bewusste Sedierung zur Reduzierung von Unterarmfrakturen bei Kindern verglichen wurden, ergab, dass IVRA eine sichere, effiziente und kostengünstige Methode zur Reduzierung von Unterarmfrakturen bei Kindern ist. Es gab 600 Patienten in der IVRA-Gruppe und 645 Patienten in der Sedierungsgruppe. Kein Patient hatte ein Kompartmentsyndrom oder die Notwendigkeit einer erneuten Aufnahme aufgrund der Gipsanwendung. Bei 28 Patienten (4.34 %) in der Gruppe mit prozeduraler Sedierung und bei 13 Patienten (2.16 %) in der IVRA-Gruppe war aufgrund von Engegefühl ein Eingriff am Gips erforderlich.
KONTRA
Die einzige absolute Kontraindikation für IVRA ist die Ablehnung durch den Patienten. Zu den relativen Kontraindikationen gehören:
• Quetschverletzungen einer Extremität
• Unfähigkeit, periphere Venen zu lokalisieren
• Lokale Hautinfektionen
• Zellulitis
• Zusammengesetzte Frakturen
• Patienten mit überzeugender Anamnese einer Allergie gegen Lokalanästhetika
• Patienten mit schweren Gefäßverletzungen an den Extremitäten
• Vorbestehende vaskuläre arteriovenöse Shunts und Patienten, bei denen ein Tourniquet ungeeignet ist (z. B. Patienten mit schwerer peripherer Gefäßerkrankung)
• Sichelzellenanämie
• Operationen, die für >1 Stunde geplant sind, sind aufgrund des Auftretens von Tourniquet-Schmerzen normalerweise keine gute Indikation für eine IV-Regionalanästhesie.

Aus dem Kompendium der Regionalanästhesie: Intravenöse Regionalanästhesie (IVRA, Bier-Block): Wirkmechanismus, Indikationen und Kontraindikationen Infografik.
AUSRÜSTUNG
Figure 1 zu Figure 8 Show-Ausrüstung, die in IVRA verwendet wird
1. Lokalanästhetika: Lidocain-HCl, 0.25 %–0.1 % (alternativ Prilocain, 0.5 %)
2. Ein Gummistauer (Penrose-Drain) mit einer Länge von 12–18 Zoll (30–45 cm) und 7/8 Zoll. breit (2.3 cm) zur Verwendung vor dem Platzieren der intravenösen Kanüle
3. Ein 20- oder 22-Gauge intravenöser Extrakatheter (Katheter über Nadel) (Figure 5)
4. Ein 500-ml- oder 1-l-Beutel mit intravenöser Lösung, verbunden mit einem Infusionsset (im Gegensatz zu einem Hep-Lock), das mit der intravenösen Kanüle verbunden wird, um ihre Durchgängigkeit aufrechtzuerhalten, bis die Anästhesielösung in die isolierte Extremität injiziert wird (kann ersetzen stattdessen ein mit Kochsalzlösung gespülter intravenöser Port)
5. Standardmonitore der American Society of Anesthesiologists (ASA) (Elektrokardiograph, Blutdruck, Pulsoximeter)
6. Reanimationsausrüstung (intravenöser Katheter, kristalloide Lösung und Infusionsset für die kontralaterale obere Extremität) (für IVRA der oberen Extremität)
7. Zwei pneumatische Tourniquets in geeigneter Größe für die ausgewählte Extremität (Figuren 6 und 9)
8. Eine Esmarch-Bandage 60 Zoll lang (152 cm) und 4 Zoll breit (10 cm) zum Ausbluten des Arms (Abbildungen 2, 3, und 7)
9. Steriles Hautvorbereitungsset
10. Eine 30- oder 50-ml-Luer-Lock-Spritze
11. Ein graduierter Messbecher zum Mischen der Lösung, vorzugsweise mit einem Fassungsvermögen von 100 ml
12. Klebeband, verschiedene Größen
Erfahren Sie mehr darüber Ausrüstung für die Regionalanästhesie.
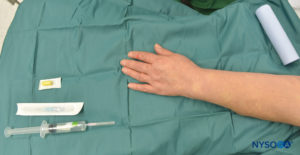
ABBILDUNG 4. Die Ausrüstung für IVRA besteht aus einem Esmarch-Verband, Fläschchen mit Lokalanästhetikum, einem Gummi-Tourniquet, einem intravenösen (IV) Extrakatheter (Katheter über der Nadel), Alkoholtupfern und einer Spritze zum Aufziehen des Lokalanästhetikums.
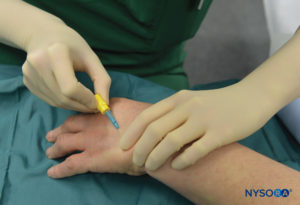
ABBILDUNG 5.Intravenöse Kanüle und Hep-Lock in einer distalen Handvene zur Vorbereitung auf IVRA.
PATIENTENVORBEREITUNG
Der Patient liegt in Rückenlage, solange die für die Platzierung ausgewählte Vene gut zugänglich ist. Die Beatmungsgeräte werden überprüft, die pneumatischen Tourniquets getestet und für den Einsatz vorbereitet. Bei Operationen am Ellbogen wird die Nadel in den Unterarm oder in die Fossa antecubitalis platziert. Bei Eingriffen an Hand oder Unterarm wird am besten eine Vene im Handrücken gewählt (Figure 5).
Für Eingriffe an den unteren Extremitäten wird eine Vene am Fuß, Knöchel oder Unterschenkel gewählt. Nach Erhalt eines intravenösen Zugangs an einer nicht operierten Extremität (alternativ kann ein zentralvenöser Zugang gesichert werden), eine vollständige Ergänzung von ASA überwacht angewendet, und die grundlegenden Vitalfunktionen werden bewertet. Wenn der Patient starke Schmerzen hat, können jetzt kleine Aliquots intravenöser Analgetika verabreicht werden (z. B. Fentanyl 1–2 μg/kg), um den Ausblutungsprozess zu erleichtern. Da eine vollständige Mitarbeit des Patienten für den Erfolg nicht unbedingt erforderlich ist, können zur Anxiolyse alternativ kleine Dosen eines wasserlöslichen Benzodiazepins (dh Midazolam 15–25 μg/kg) verabreicht werden. Ein wichtiger Vorteil bei der Wahl eines Benzodiazepins ist die Unterdrückung der krampfartigen Reaktion, die mit der Toxizität von Lokalanästhetika verbunden ist, ein berechtigtes Anliegen bei Patienten, die sich einer IVRA unterziehen, da das große Volumen des Mittels direkt in das Gefäßsystem verabreicht wird.
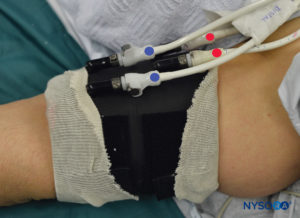
ABBILDUNG 6. Deutlich gekennzeichnete proximale (ROT) und distale (BLAU) Blutsperre des doppelten Blutsperresystems. Das Tourniquet wird immer in der folgenden Reihenfolge aufgeblasen: Distal, Proximal. Nach Überprüfung der Funktionalität wird das distale Tourniquet (BLAU) entleert.
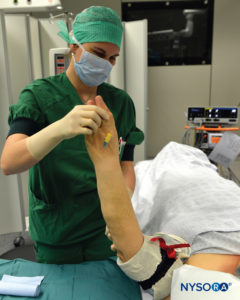
ABBILDUNG 7. Hochlagerung der Extremität zur passiven Entblutung.
ABBILDUNG 8. Die hochgezogene rechte untere Extremität wird mit einem eng gewickelten Esmarch-Verband um das Tourniquet gewickelt.
TECHNISCH

Aus dem Kompendium der Regionalanästhesie: Intravenöse Regionalanästhesie (IVRA, Bier-Block): Technik-Infografik.
Obere Extremität IVRA
Das Folgende ist die Technik für IVRA für Eingriffe an den oberen Extremitäten:
1. Ein Verweilkatheter aus Kunststoff wird eingeführt in eine periphere Vene so weit distal wie möglich unter strengen aseptischen Vorsichtsmaßnahmen (Figure 5).
2. An der proximalen Manschette wird hoch am Oberarm ein doppelpneumatisches Tourniquet angelegt (Figuren 6 und 7). Während die Tourniquets konventionell im Bizepsbereich platziert werden, fand eine Studie heraus, dass die Dosierung von Lidocain fast halbiert werden konnte, wenn die Tourniquets im Unterarm statt im Oberarm platziert wurden. Zwanzig Patienten, die sich Operationen am Unterarm und an der Hand unterziehen mussten, erhielten IVRA mit einer Kombination aus Lidocain 1.5 mg/kg und Ketorolac 0.15 mg/kg mit einem Tourniquet am Unterarm. Weitere 20 Patienten, die sich ähnlichen Eingriffen unterzogen, erhielten IVRA mit der doppelten Dosis der gleichen Medikamente und mit am Oberarm angelegtem Tourniquet. Die chirurgische Anästhesie wurde bei allen 20 Patienten in der Oberarm-Tourniquet-Gruppe als ausgezeichnet bewertet, während sie bei 19/20 Patienten in der Unterarm-Tourniquet-Gruppe als ausgezeichnet bewertet wurde. Sowohl der Beginn als auch die Regression der sensorischen Blockade waren in beiden Gruppen ähnlich. Eine kürzlich durchgeführte Studie zum Vergleich der Unterarm-Tourniquet-Platzierung (n = 28) mit 8 ml 2 % Lidocain und 10 mg Ketorolac und der Oberarm-Tourniquet-Platzierung (n = 28) mit 15 ml 2 % Lidocain und 20 mg Ketorolac ergab, dass Patienten im Unterarm Die Tourniquet-Gruppe hatte im Vergleich zur Gruppe mit Oberarm-Tourniquet weniger Beschwerden, weniger Sedierungsmaßnahmen und eine größere Wahrscheinlichkeit, die Postanästhesie-Station (PACU) zu umgehen.
3. Der gesamte Arm wird angehoben, um eine passive Entblutung zu ermöglichen (Figure 7), und eine Esmarch-Gummibinde wird spiralförmig von den Fingerspitzen der Hand bis zur distalen Manschette des doppelten Tourniquets um den Arm gewickelt, um den Arm zu entbluten (Figuren 2 und 3).
4. Die A. axillaris wird digital verschlossen, und unter Beibehaltung des Drucks wird die proximale pneumatische Manschette auf 50–100 mm Hg über dem systolischen arteriellen Blutdruck aufgeblasen, wonach der Esmarch-Verband entfernt wird.
5. Nach dem Aufblasen der proximalen Manschette und dem Entfernen des Esmarch-Verbands werden 30–50 ml 0.5 %ige Lidocain-HCl injiziert über den Plastikverweilkatheter, das Volumen hängt von der Größe des zu betäubenden Arms ab.
6. Die intravenöse Kanüle in der chirurgischen Extremität wird bis zur Höhe des OP-Tisches zurückgezogen und mit steriler Gaze schnell Druck auf die Stelle ausgeübt.
7. Etwa 25–30 Minuten nach Beginn der Anästhesie oder wenn ein Patient über Tourniquet-Schmerzen klagt, wird der distale Cuff aufgeblasen und der proximale Cuff entleert um die Entwicklung von Tourniquet-Schmerzen zu minimieren.
Untere Extremität IVRA
Der einzige signifikante Unterschied bei der IVRA für die oberen und unteren Extremitäten besteht darin, dass die IVRA-Technik für die unteren Extremitäten aufgrund der offensichtlichen Größenunterschiede zwischen den oberen und unteren Extremitäten relativ größere Volumina an Lokalanästhesielösungen erfordert. Dies ist notwendig, um das größere Gefäßkompartiment der unteren Extremität von der distal platzierten intravenösen Kanüle bis zum proximalen Tourniquet vollständiger zu füllen (100 ml vs. 50 ml).
PHARMAKOLOGISCHE ÜBERLEGUNGEN
Überlegungen zur Lokalanästhesie
Lidocain ist das prototypische Lokalanästhetikum, das in den Vereinigten Staaten für IVRA verwendet wird. In Europa wird Prilocain jedoch häufiger verwendet und war tatsächlich Gegenstand der meisten klinischen Studien. Es wurden Versuche unternommen, die Wirksamkeit von Lidocain zu maximieren und gleichzeitig Nebenwirkungen zu minimieren oder Toxizität des Agenten. Die Alkalisierung von 0.5 % Lidocain (unter Verwendung von 1.4 % Natriumbicarbonat) für IVRA wurde bei 31 Patienten untersucht. Die Autoren fanden keinen klinischen Vorteil für die Praxis der Alkalisierung von Lidocain in Bezug auf sensorische Blockade, motorische Blockade oder das Auftreten von postoperativen Schmerzen. Beim Vergleich von Lidocain mit alkalisiertem und nicht alkalisiertem 2-Chlorprocain, beide in 0.5 %iger Konzentration und ausschließlich für die Handchirurgie verwendet, verhielt sich alkalisiertes Chloroprocain ähnlich wie Lidocain, aber reines Chloroprocain bot keinen Nutzen und verursachte mehr Nebenwirkungen als bei Lidocain.
Eine weitere Studie vergleicht IVRA mit niedrig konzentriertem/hochvolumigem Lidocain (0.5 % Konzentration von 30–50 ml Lidocain) und höher konzentriertem/niedrigvolumigem Lidocain (2 % Konzentration von 12–15 ml Lidocain) bei Patienten, die sich einer Operation an den oberen Extremitäten unterziehen zeigten einen schnelleren Beginn und eine verzögerte Regression der sensorischen Blockade in der Gruppe mit höherer Konzentration/niedrigem Volumen. Es gab keine signifikanten Unterschiede in den hämodynamischen Daten wie systolischem und diastolischem Blutdruck, mittlerem Blutdruck und Herzfrequenz zwischen den beiden Gruppen.
Lidocain wurde in zwei getrennten Studien mit Ropivacain für die IVRA der oberen Extremitäten verglichen. Bei 1.2 Freiwilligen wurden zwei Dosen Ropivacain (1.8 und 3.0 mg/kg) mit einer Dosis Lidocain (15 mg/kg) verglichen. Die Erholung der sensorischen und motorischen Blockade nach dem Lösen des Tourniquets war bei der hochdosierten Ropivacain-Gruppe am langsamsten. Mehr Patienten in der Lidocain-Gruppe (5 von 5) litten unter Benommenheit nach dem Lösen des Tourniquets, im Vergleich zu nur 1 in der Hochdosis-Ropivacain-Gruppe. In der zweiten Studie erhielten 51 Patienten randomisiert entweder Ropivacain 0.375 % oder Lidocain 0.5 % in einem Volumen von 0.4 ml/kg bis zu 25 ml. Die postoperative Analgesie, gemessen an der ersten Nachfrage nach Analgetika, war in der Ropivacain-Gruppe überlegen.
Das Fortschreiten der sensorischen Blockade in der Hand nach IVRA mit 20 ml 0.3 % Ropivacain und einem im Unterarm platzierten doppelten Tourniquet wurde an 10 gesunden Freiwilligen untersucht. Das Lokalanästhetikum wurde durch einen intravenösen 22-Gauge-Katheter injiziert, der in einer prominenten Vene auf dem Handrücken platziert wurde, nachdem die Hand mit einem Esmarch-Verband entblutet und das distale Tourniquet sequenziell auf 150 mm Hg oder 20 mm Hg über dem systolischen Blut aufgeblasen worden war Druck (je nachdem, welcher höher war) und das proximale Tourniquet auf 250 mm Hg. Das distale Tourniquet wurde dann entleert und die Esmarch-Bandage wurde entfernt. Grundlinienwerte für Kälte- und Berührungsgefühl wurden vor der Blockade bestimmt, und aktualisierte Werte wurden wiederholt und kontinuierlich erhalten, beginnend 5 Minuten nach der Injektion des Lokalanästhetikums und fortgesetzt, bis ein Gefühlsverlust in allen Bereichen erreicht wurde. Es gab einen fast sofortigen Verlust der Kältewahrnehmung, gefolgt von einer verzögerten und ungleichmäßigen Ausbreitung des Verlusts der Berührungsempfindung. Die anfängliche Ausbreitung der Anästhesie wurde sowohl proximal als auch distal im Handrücken festgestellt und schritt dann zu den Fingerspitzen fort, mit einer verzögerten proximalen Ausbreitung über die palmare Oberfläche der Hand bis zum Handgelenk.
Prilocain wurde mit Lidocain sowie mit anderen für IVRA verwendeten Lokalanästhetika verglichen. Bei der Bewertung des Einsetzens einer sensorischen und motorischen Blockade wurden bei 40 Freiwilligen, die sich einer IVRA unterzogen, 0.5 ml 100 % Prilocain (10 mg) mit dem gleichen Volumen und der gleichen Konzentration von Chloroprocain verglichen. Der Beginn der motorischen Blockade unterschied sich nicht zwischen den Gruppen, und die Empfindung wurde fast gleich gut wiederhergestellt. Allerdings war die Erholung der motorischen Funktion in der Prilocain-Gruppe kürzer, und mehr Chloroprocain-Patienten zeigten 30–45 Minuten nach der Tourniquet-Entleerung Anzeichen einer venösen Reizung oder Urtikaria antecubitalis. Herzfrequenzveränderungen waren auch in der Chloroprocain-Gruppe deutlicher. Dieselbe Gruppe von Forschern weitete ihre Studie auf 60 Patienten aus, 30 in jeder der zuvor beschriebenen Gruppen. Nun fanden die Forscher heraus, dass die vollständige Wiederherstellung der sensorischen Blockade in der Prilocain-Gruppe schneller war (7.1 vs. 9.8 Minuten). Ansonsten blieb die Inzidenz von Nebenwirkungen in der Chloroprocain-Gruppe höher.
Als nächstes verglichen diese Forscher 0.5 % Prilocain mit der gleichen Konzentration von Articain (einem neueren Lokalanästhetikum vom Aminoamid-Typ, das Thiophen enthält und Mepivacain pharmakologisch ähnlich ist) für IVRA der oberen Extremitäten. Articain, ein starkes Lokalanästhetikum mit geringer Toxizität aufgrund seiner schnellen Verstoffwechselung mit Esterasen, wurde als geeignete Alternative zu Prilocain angesehen. Zehn Freiwillige nahmen an diesem doppelblinden Crossover-Vergleich der beiden Agenten teil.
Sie fanden keinen signifikanten Unterschied zwischen den beiden hinsichtlich des Einsetzens der Anästhesie oder der motorischen Blockade oder der Wiederherstellung der sensorischen oder motorischen Funktion. Allerdings traten bei 80 % der Probanden Hautausschläge auf, nachdem sie Articain erhalten hatten, gegenüber 20 % in der Prilocain-Gruppe.
Beim Vergleich von 0.5 % Prilocain mit den gleichen Konzentrationen von Articain oder Lidocain in drei Gruppen von jeweils 10 Patienten für IVRA wurde festgestellt, dass das Einsetzen der sensorischen Blockade in der Articain-Gruppe, die auch die niedrigsten Spitzenplasmakonzentrationen aufwies, signifikant kürzer war Lokalanästhesie nach Tourniquet-Freigabe. Einfaches Prilocain 1 % wurde mit demselben Lokalanästhetikum in Kombination mit vier verschiedenen Zusatzstoffen für IVRA verglichen: Bupivacain 0.25 %, Clonidin 150 μg, Sufentanil 25 μg oder Tenoxicam 20 mg. Die mit Sufentanil versetzte Gruppe zeigte den schnellsten Beginn der sensorischen Blockade; Die postoperativen Schmerzwerte wurden durch Zugabe von entweder Clonidin oder Tenoxicam verbessert. Ansonsten gab es keine signifikanten Unterschiede zwischen den fünf Gruppen in Bezug auf Beginn und Dauer der sensorischen Blockade. Im Gegensatz zu der Situation, die für Lidocain mit Zusatz von Bicarbonat als Adjuvans festgestellt wurde, scheint die Zugabe von Bicarbonat zu Prilocain die Einsetzzeit zu verkürzen und die Dauer der Anästhesie während IVRA zu verlängern.
Die Verwendung von Mepivacain für IVRA wurde untersucht. Sechzehn Patienten wurden mit insgesamt 1.4 mg/kg in 40 ml für IVRA im Vergleich zu Kochsalzlösungsblöcken bewertet, die bei denselben Personen am kontralateralen Arm durchgeführt wurden. Der arterielle Verschluss wurde für 20 Minuten aufrechterhalten. Die reaktive Hyperämie wurde in dem mit Mepivacain behandelten Arm während des 60-minütigen Untersuchungszeitraums abgeschwächt, was darauf hindeutet, dass Mepivacain ein potenter Vasokonstriktor mit langer Wirkungsdauer ist. Dieser Befund hat Auswirkungen auf die Anwendung von Mepivacain bei Personen mit eingeschränkter Durchblutung der oberen Extremitäten oder mit CRPS, für die es wahrscheinlich nicht als Lokalanästhetikum der Wahl angesehen werden sollte.
Die gleiche Studiengruppe bewertete die Wirkungen von Mepivacain IVRA auf intrakutane Capsaicin-induzierte brennende Schmerzen und auf die mikrovaskuläre Durchblutung der Haut, gemessen durch Doppler Perfusionsbildgebung. Die reaktive Hyperämie war in dem mit Mepivacain behandelten Arm 10 Minuten nach dem Lösen des Tourniquets geringer, und der Bereich des Aufflackerns war nach Capsaicin in den mit Mepivacain behandelten Armen kleiner. Die Autoren kamen zu dem Schluss, dass Mepivacain IVRA keine Auswirkungen auf die sensorische Funktion dünner afferenter Fasern nach IVRA hatte, aber die Ausbreitung von Capsaicin-induzierten Eruptionen unterschiedlich verringerte.
NYSORA-Tipps
• Lidocain ist das prototypische Medikament, das in den Vereinigten Staaten für IVRA verwendet wird; Prilocain wird in Europa bevorzugt.
• Die Alkalisierung von Lidocain verleiht kommerziellem Lidocain für IVRA, wenn überhaupt, einen minimalen Vorteil.
• Die starken vasokonstriktiven Eigenschaften von Mepivacain schmälern seine allgemeine Attraktivität als primäres Mittel für IVRA.
Ergänzungen zu Lokalanästhetika für IVRA
Eine systematische Literaturrecherche wurde durchgeführt, um die Verwendung von zu bewerten Ergänzungen zu Lokalanästhetika für IVRA. Neunundzwanzig Studien erfüllten die Kriterien, randomisiert, doppelblind und kontrolliert zu sein. Die Daten von 1217 Studienteilnehmern wurden überprüft, und die untersuchten Wirkstoffe umfassten Opioide (Fentanyl, Sufentanil, Meperidin und Morphin); Clonidin; Muskelrelaxantien (Atracurium, Pancuronium, Mivacurium); Tramadol; nichtsteroidale Antiphlogistika (NSAIDs) (Ketorolac, Tenoxicam, Acetylsalicylat); Alkalisierung mit Natriumbicarbonat; die Zugabe von Kalium; und Temperaturänderungen. Die Autoren fanden solide Beweise für die Verwendung von NSAIDs im Allgemeinen und Ketorolac im Besonderen zur Verbesserung der postoperativen Analgesie und Verlängerung der Tourniquet-Toleranz während der IVRA. Opioide schnitten schlecht ab, wenn sie für IVRA verwendet wurden, wobei nur Meperidin in Dosen von 30 mg oder mehr erhebliche postoperative Vorteile auf Kosten von Übelkeit, Erbrechen und Schwindel nach der Deflation zeigte. Muskelrelaxantien verbesserten die postoperative motorische Blockade und waren bei der Frakturreduktion von Vorteil, bei der Muskelrelaxation für gute Ergebnisse unerlässlich ist.
Alpha2-Agonisten (Clonidin und Dexmedetomidin)
Clonidin wurde sowohl zu Prilocain als auch zu Lidocain als Ergänzung zu IVRA für die Extremitätenchirurgie hinzugefügt. Als 2 μg/kg Prilocain 0.5 % in randomisierter, doppelblinder Weise bei 56 Patienten, die sich einer Operation an den oberen Extremitäten unterzogen, hinzugefügt wurden, gab es keinen Unterschied zwischen den Gruppen hinsichtlich des Beginns oder der Dauer der sensorischen oder motorischen Blockade. Die Patienten, die Clonidin erhielten, hatten eine signifikante Senkung des arteriellen Blutdrucks nach dem Lösen des Tourniquets (24 %–48 %), während die Herzfrequenz unverändert blieb.
Die Autoren kamen zu dem Schluss, dass Clonidin als Zusatz zu Lokalanästhetika von begrenztem Nutzen war.35 Die Zugabe von Clonidin zu Prilocain unterdrückte dramatisch die Tourniquet-Schmerzen, veränderte jedoch nicht die postoperativen Schmerzen nach Tourniquet-Entleerung.
Es wurde festgestellt, dass Clonidin keine messbaren Vorteile bietet, wenn es Lidocain für IVRA bei Patienten hinzugefügt wird, die sich einer Freisetzung aus dem Karpaltunnel unterziehen.
Dexmedetomidin ist entsprechend achtmal selektiver gegenüber den α-Adrenorezeptoren als Clonidin. Als solches wurde es in IVRA verwendet, um zu bestimmen, ob es einige der vorteilhaften Ergebnisse verbessern könnte, die mit dem letztgenannten Mittel festgestellt wurden. Dreißig Patienten, die sich einer Handoperation unter IVRA unterzogen, erhielten 0.5 % Lidocain allein oder Lidocain plus Dexmedetomidin 0.5 μg/kg.
Die Dexmedetomidin-Gruppe zeigte einen schnelleren Beginn der sensorischen und motorischen Blockade; verlängerte Erholung der sensorischen und motorischen Blockade; verlängerte Toleranz für das Tourniquet; und verbesserte Qualität der Analgesie im Vergleich zu der Gruppe, die nur ein Lokalanästhetikum erhielt.
Eine verkürzte Beginnzeit der sensorischen Blockade; verlängerte Erholungszeiten für sensorische und motorische Blockaden; verlängerte Dauer der Analgesie für Tourniquet; und verlängerte postoperative Analgesie wurden bei Patienten beobachtet, die sich einer IVRA mit Dexmedetomidin in einer anderen randomisierten, doppelblinden Studie unterzogen, in der die Wirkungen von Lornoxicam oder Dexmedetomidin bei IVRA mit Prilocain bei Patienten verglichen wurden, die sich einer Hand- oder Unterarmoperation unterziehen. In dieser Studie wurde IVRA mit 2 % Prilocain bei 3 mg/kg in der Kontrollgruppe (n = 25), 2 % Prilocain bei 3 mg/kg plus Dexmedetomidin 0.5 μg/kg in der Dexmedetomidingruppe (n = 25) erreicht. und 2 % Prilocain mit 3 mg/kg plus Lornoxicam 8 mg in der Lornoxicam-Gruppe (n = 25). In jeder Gruppe wurden die Arzneimittel mit 0.9 % normaler Kochsalzlösung auf ein Gesamtvolumen von 40 ml verdünnt.
Eine neuere Studie, die die Wirkungen von Dexmedetomidin als Zusatz zu Lidocain für IVRA und bei parenteraler Verabreichung als Prämedikation vor IVRA vergleicht, ergab, dass beide Gruppen eine ähnlich verbesserte Qualität der Anästhesie und perioperativen Analgesie aufwiesen. Diese Studie wurde an Patienten durchgeführt, die sich einer Karpaltunnelentfernung unterzogen und in drei Gruppen randomisiert wurden.
IVRA wurde unter Verwendung von 40 ml 0.5 % Lidocain durchgeführt. Eine Einzeldosis Dexmedetomidin 0.5 μg/kg und Placebo (Kochsalzlösung) in einem Gesamtvolumen von 20 ml wurde Gruppe P (n = 15) bzw. Gruppe S (n = 15) vor IVRA verabreicht. Dexmedetomidin mit 0.5 μg/kg wurde Lidocain in Gruppe A (n = 15) während IVRA hinzugefügt. Der Beginn und die Erholungszeit der sensorischen und motorischen Blockade, die intraoperativ-postoperative visuelle Analogskala (VAS), der Ramsay-Sedierungs-Score (RSS), der Bedarf an Analgetika, hämodynamische Variablen und Nebenwirkungen wurden notiert. Signifikant verkürzter Beginn der sensorischen Blockade und Erholungszeit in den Gruppen P und A, verkürzte Beginnzeit der motorischen Blockade in Gruppe P und verringerte intraoperative VAS-Scores und Analgetikabedarf in den Gruppen P und A wurden festgestellt. Der intraoperative RSS in Gruppe P und der postoperative RSS in den Gruppen P und A waren höher als in Gruppe S. Die intraoperative und postoperative Herzfrequenz und der postoperative mittlere arterielle Blutdruck (MAP) der Gruppe P waren signifikant niedriger als in den Gruppen A bzw. S.
Opioide
Da entdeckt wurde, dass Opiatrezeptoren im peripheren Nervensystem vorhanden sind, und mit dem Nachweis, dass Opioide eine wirksame, lang anhaltende Analgesie hervorrufen können, wenn sie in Verbindung mit Lokalanästhetika zur Blockade des Plexus brachialis injiziert werden, haben mehrere Forscher versucht, das Potenzial für eine lokale Toxizität zu verringern Anästhetikum-nur IVRA durch Zugabe von Opioiden, um die Konzentration von Lidocain zu reduzieren. Obwohl nicht bewiesen wurde, dass die Zugabe von Fentanyl zu Lidocain für IVRA zu einer verbesserten Analgesie bei gleichzeitiger Verringerung der Risiken führt, führte die Zugabe von Fentanyl in 200-μg-Dosen zu 0.5 % Prilocain zu einer vollständigeren Analgesie als bei Patienten, die 100 μg erhielten hinzugefügt, oder wenn reines Prilocain für IVRA verwendet wurde. Postoperative Übelkeit und Nebenwirkungen auf das Zentralnervensystem waren in den Gruppen, denen Fentanyl hinzugefügt wurde, höher als in den Gruppen, die nur ein Lokalanästhetikum erhielten. Zwei andere Studien fanden jedoch heraus, dass die Zugabe von Opioiden zu Prilocain den Erfolg mit dieser Technik nicht verbesserte. Weitere Untersuchungen zu den Auswirkungen der Zugabe von Opioiden zu Prilocain für IVRA könnten diese Diskrepanz letztendlich auflösen.
Einige Forscher haben herausgefunden, dass die Zugabe von Opioiden und Muskelrelaxantien zu 0.25 % Lidocain die gleiche Analgesie und Muskelentspannung bewirkt wie 0.5 % Lidocain allein, während die Wahrscheinlichkeit einer systemischen Toxizität verringert wird. Zu Lidocain hinzugefügte Adjuvantien umfassten Fentanyl 50 μg plus Pancuronium 0.5 mg, Fentanyl plus Rocuronium, Fentanyl plus D-Tubocurarin und Fentanyl plus Vecuronium. In jedem Fall berichteten die Autoren von hervorragenden Betriebsbedingungen, und da die Lidocain-Konzentration auf 0.20 % (dh mehr als die Hälfte der normalerweise verwendeten) reduziert werden konnte, das Potenzial für systemische Toxizität wurde mindestens halbiert.
Wenn Meperidin 0.25 %, 40 ml (100 mg), als alleiniges Mittel für IVRA verwendet wurde, wurde eine vollständige Motorblockade erzeugt, die genauso wirksam war wie die durch Lidocain erzeugte. Der Beginn der motorischen Blockade war bei jedem der 15 Patienten in dieser Studiengruppe so schnell wie oder schneller als der Beginn der sensorischen Blockade. Im Vergleich zu reinem Lidocain traten in dieser Studie jedoch häufiger Schwindel, Übelkeit und Schmerzen an der Injektionsstelle auf.
Tramadol
Tramadol wurde für die Anwendung bei IVRA der oberen Extremität evaluiert. Sechzig Freiwillige, aufgeteilt in vier Gruppen mit jeweils 15 Patienten, erhielten IVRA mit 40 ml Tramadol 0.25 % (100 mg), 0.9 % normaler Kochsalzlösung, Lidocain 0.5 % oder Lidocain plus Tramadol 0.25 %. Der Beginn und die Wiederherstellung der sensorischen und motorischen Blockade waren bei Tramadol und normaler Kochsalzlösung ähnlich. Die Zugabe von Tramadol zu Lidocain führte jedoch zu einem schnelleren Beginn der sensorischen Blockade auf Kosten einer Zunahme von Hautausschlägen und schmerzhaften brennenden Empfindungen bei der Injektion Seite? ˅. Die Schlussfolgerung der Autoren war, dass Tramadol allein keine lokalanästhetische Wirkung besitzt, aber die Wirkung modifizieren könnte, wenn es zu einem Lokalanästhetikum wie Lidocain hinzugefügt wird.
In einer anderen Studie, in der 0.5 % Lidocain mit und ohne 50 mg Tramadol für die IVRA der oberen Extremität verglichen wurde, hatte die Gruppe, der Tramadol hinzugefügt wurde, weniger Tourniquet-Schmerzen als die Gruppe, die nur lokal behandelt wurde, aber wie in der zuvor erwähnten Studie gab es mehrere Fälle von Hauturtikaria in der Tramadol-Gruppe, aber nicht in der Lidocain-only-Gruppe. Tramadol (100 mg), das zu Lidocain für IVRA zur Anästhesie der oberen Extremitäten hinzugefügt wurde, wirkte ähnlich wie Sufentanil (25 μg) oder Clonidin (1 μg/kg), das der Lokalanästhesie hinzugefügt wurde, in Bezug auf intraoperative hämodynamische Daten, Zeit bis zur Erholung der sensorischen Blockade, Beginn und Wiederherstellung von motorischer Blockade, Sedierungswerten und postoperativen Schmerzen.61 Zusammenfassend lässt sich sagen, dass Tramadol als Solomittel für IVRA unwirksam ist, aber einen gewissen Vorteil bieten kann, wenn es zu Lidocain hinzugefügt wird. Dieser Vorteil kann jedoch durch das signifikante Auftreten von dermatologischen Nebenwirkungen von intravenös verabreichtem Tramadol an einer ausgebluteten Extremität aufgehoben werden.
Muskelrelaxantien
Eine kleine Dosis eines nichtdepolarisierenden Muskelrelaxans kann zusätzlich zu dem für IVRA verabreichten Lokalanästhetikum gewählt werden; Da D-Tubocurarin jedoch selbst in vernünftigen Dosen Histamin freisetzt, ist es wahrscheinlich am besten, dieses Mittel ganz zu vermeiden. Atracurium wurde Lidocain hinzugefügt, um die Muskelentspannung während der IVRA zu verbessern, insbesondere während der Reposition von Frakturen und Luxationen der oberen Extremitäten. Die Zugabe von 3 mg Atracurium zu Lidocain für IVRA führte zu einer Verkürzung der Zeit bis zum Einsetzen der Analgesie in der Hand, aber nicht an der Tourniquet-Stelle. In derselben Studie ergab sich kein zusätzlicher Nutzen aus der Zugabe dieses Wirkstoffs oder der Zugabe von Alfentanil zu Lidocain. Eine Studie, in der 2 mg Atracurium zu 40 ml 0.5 %igem Lidocain für IVRA bei Handoperationen bei 40 Patienten, die randomisiert einer von zwei Gruppen zugeteilt wurden, verwendet wurden, ergab, dass die Zugabe von Atracurium zu einem höheren Grad an Muskelentspannung, einer leichteren Reduzierung von Frakturen und bessere OP-Bedingungen sowie weniger Schmerzen nach der Operation.
Neostigmin
Neostigmin wurde als Koanalgetikum vorgeschlagen, wenn es für verwendet wird Epidural und intrathekal Analgesie und Anästhesie, es fehlen jedoch Hinweise auf einen Nutzen im peripheren Nervensystem. In zwei Studien, eine mit Neostigmin als Zusatz zu Lidocain und die andere mit dem Adjuvans als Zusatz zu Prilocain, gab es widersprüchliche Ergebnisse. Als Neostigmin (1 mg) zu 0.5 % Lidocain für IVRA in einer Studie mit 54 Freiwilligen hinzugefügt wurde, die randomisiert einer von drei Studiengruppen zugeordnet wurden, wurde festgestellt, dass die Zugabe des Adjuvans im Vergleich zu den Kontrollen keinen Vorteil in Bezug auf Analgesie oder Anästhesie brachte. Als die Hälfte der Neostigmin-Dosis (0.5 mg) zu Prilocain (3 mg/kg) für IVRA bei 30 Patienten hinzugefügt wurde, die randomisiert einer von zwei Behandlungsgruppen zugeordnet wurden, wurde festgestellt, dass die adjuvante Gruppe einen verkürzten Beginn der sensorischen und motorischen Blockade zeigte Zeiten, verlängerte Erholungszeiten für sensorische und motorische Blockaden, verbesserte Qualität der Anästhesie und verlängerte Zeit bis zum ersten analgetischen Bedarf im Vergleich zur Gruppe mit reinem Prilocain.
Eine neuere Studie, die die Wirkung der Zugabe von 0.5 mg Neostigmin zu 40 ml 0.5 %igem Lidocain für IVRA bei Patienten untersuchte, die sich elektiven oder notfallmäßigen Unterarm- und Handoperationen unterzogen, wurde randomisiert in zwei Gruppen eingeteilt, wobei 1 ml isotonische Kochsalzlösung zu 40 ml 0.5 %igem Lidocain hinzugefügt wurde. Lidocain in der Kontrollgruppe, beobachteten im Vergleich zur Kontrollgruppe signifikant kürzere Beginnzeiten der sensorischen und motorischen Blockierung und längere Erholungszeiten in der Neostigmin-Gruppe. Die Qualität der intraoperativen Anästhesie und die Häufigkeit von Tourniquet-Schmerzen waren in beiden Gruppen ähnlich. Es scheint, dass die widersprüchlichen Ergebnisse mit zwei verschiedenen Neostigmin-Dosen zu Lidocain für IVRA durch zusätzliche Arbeiten bestätigt werden müssen, die größere Patientenproben umfassen, um die Diskrepanz in den beiden zuvor erwähnten kleinen Studien zu beseitigen.
Nichtsteroidale entzündungshemmende Mittel
Andere Versuche, IVRA mit Lidocain zu verbessern, umfassten die Verwendung von NSAIDs zur Unterdrückung von Tourniquet-Schmerzen bei gleichzeitiger Verbesserung der postoperativen Analgesie. Obwohl Ketorolac eine gewisse Wirksamkeit gezeigt hat, haben andere NSAIDs nicht so gut abgeschnitten. Ketorolac wurde als Adjuvans zu Lidocain bei Patienten, die sich einer Hand- oder Unterarmoperation unterziehen, unter Verwendung einer Unterarm- oder Oberarm-Tourniquet untersucht. In dieser Studie wurden die Patienten in zwei Gruppen randomisiert: Gruppe UA, bestehend aus 20 Patienten, die sich einer IVRA mit einem Oberarm-Tourniquet unterzogen; und Gruppe FA, bestehend aus 20 Patienten, die sich einer IVRA mit einem Unterarm-Tourniquet unterziehen. Patienten in der Oberarm-Tourniquet-Gruppe erhielten IVRA mit 0.5 % Lidocain in einer Dosis von 3 mg/kg plus Ketorolac 0.3 mg/kg. IVRA in der Unterarm-Tourniquet-Gruppe wurde mit 0.5 % Lidocain bei 0.15 mg/kg plus Ketorolac 0.15 mg/kg festgelegt. Zwischen den beiden Gruppen gab es keinen statistisch signifikanten Unterschied im Beginn und in der Dauer der sensorischen Blockade und der Notwendigkeit einer Schmerzmittelergänzung. Auch die postoperativen Schmerzwerte waren zwischen den beiden Gruppen ähnlich. Die Autoren kamen zu dem Schluss, dass IVRA mit 0.5 % Lidocain für den Unterarm in einer Dosis von 1.5 mg/kg plus 0.15 mg/kg Ketorolac eine sichere und klinisch praktikable Option ist, die eine ähnliche perioperative Anästhesie und Analgesie bietet wie die IVRA für Oberarm-Tourniquet mit 0.5 %. Lidocain in einer Dosis von 3 mg/kg plus Ketorolac 0.3 mg/kg, während die Dosis von Lidocain und Ketorolac um die Hälfte reduziert wird.
Ein weiteres NSAID, Tenoxicam, wurde Prilocain in einer Studie mit insgesamt 45 Patienten hinzugefügt. Eine 20-mg-Dosis des NSAID wurde bei Patienten angewendet, die sich einer IVRA zur Reduktion von Colles-Frakturen unterzogen, wobei die Patienten in drei Gruppen eingeteilt wurden. Eine Gruppe erhielt nur ein Lokalanästhetikum; einer erhielt lokal plus Tenoxicam; und eine Gruppe hatte IVRA nur mit Lokalanästhetikum plus einem intravenösen NSAID. In dieser letzten Gruppe wurde das Tenoxicam (20 mg) in den kontralateralen Arm injiziert, gegenüber dem IVRA-Behandlungsarm. Die Gruppe, die das NSAID zusätzlich zum Lokalanästhetikum erhielt, hatte eine überlegene Analgesie und niedrigere Schmerzwerte als jede der beiden anderen Patientengruppen.
Eine neuere Studie zum Vergleich der intraoperativen und postoperativen analgetischen Wirkungen von Lornoxicam und Fentanyl bei Zugabe zu Lidocain für IVRA bei Patienten, die sich einer Handoperation unterziehen, zeigte eine längere Erholungszeit von sensorischen Blockaden und eine Zeit bis zum ersten Bedarf an Analgetika in der Lornoxicam-Gruppe ohne erhöhtes Auftreten von Nebenwirkungen. verglichen mit der Lidocain-nur-Gruppe und der Lidocain-mit-Fentanyl-Gruppe. In dieser Studie wurden insgesamt 45 Patienten in drei Gruppen randomisiert. Patienten in Gruppe 1 erhielten 3 mg/kg 2 %iges Lidocain (40 ml); Gruppe 2 erhielt 3 mg/kg Lidocain, 38 ml plus Lornoxicam 2 ml (4 mg/ml); und Gruppe 3 erhielt 3 mg/kg Lidocain, 38 ml plus 2 ml Fentanyl (0.05 mg/ml). Diese Studie kam auch zu dem Schluss, dass die Zugabe von Fentanyl zu Lidocain IVRA (Gruppe 3) Lidocain IVRA (Gruppe 1) überlegen zu sein schien und Lornoxicam zu Lidocain IVRA (Gruppe 2) bei der Verringerung von Tourniquet-Schmerzen hinzugefügt wurde; Dies ging jedoch zu Lasten zunehmender Nebenwirkungen wie Juckreiz.
Dexketoprofen ist ein weiteres NSAID, das als Zusatz zu Lidocain für IVRA untersucht wurde. In dieser prospektiven, randomisierten, placebokontrollierten Studie wurden Patienten, bei denen eine elektive Hand- oder Unterarm-Weichteiloperation geplant war, nach dem Zufallsprinzip in drei Gruppen eingeteilt. Alle 45 Patienten erhielten 0.5 % Lidocain als IVRA. 50 mg Dexketoprofen wurden entweder intravenös verabreicht oder der IVRA-Lösung zugesetzt, und die Kontrollgruppe erhielt sowohl intravenös als auch als Teil der IVRA ein gleiches Volumen Kochsalzlösung. Die Zeitpunkte des Beginns der sensorischen und motorischen Blockade, die Erholungszeit und der postoperative Analgetikaverbrauch wurden aufgezeichnet. Im Vergleich zu den Kontrollen führte die Zugabe von Dexketoprofen zur IVRA-Lösung zu einem schnelleren Einsetzen der sensorischen und motorischen Blockade, einer längeren Erholungszeit, verringerten intra- und postoperativen Schmerzwerten und einem verringerten postoperativen Bedarf an Analgetika. Die in dieser Studie verwendete pharmakologische Formulierung von Dexketoprofen enthielt Ethanol als Hilfsstoff. Die Autoren stellten fest, dass die neurolytische Wirkung von Ethanol möglicherweise zu der schnelleren Entwicklung sensorischer und motorischer Blockaden und längeren Erholungszeiten in der IVRA-Gruppe in dieser Studie beigetragen hat.
Andere spezifische Wirkstoffe: Kortikosteroide
Die entzündungshemmenden Eigenschaften von Steroiden vom Glucocorticoid-Typ wurden untersucht, wenn diese Wirkstoffe zu Lokalanästhetika für IVRA bei Patienten mit rheumatoider Arthritis (RA) hinzugefügt wurden. In einer randomisierten, doppelblinden, Placebo-kontrollierten Crossover-Studie erhielten 20 Patienten mit RA entweder 50 mg Methylprednisolon in Mepivacain 0.25 % oder Mepivacain pur für IVRA der oberen Extremitäten. Die andere Extremität erhielt die entgegengesetzte Behandlung. Eine Woche später wurden die gleichen Medikamente jeweils in die kontralateralen Extremitäten injiziert. Fünfzig Prozent der Patienten berichteten von einer subjektiven Verbesserung nach 1 und 6 Wochen; objektive Parameter wie die Griffstärke änderten sich bis zur 6-wöchigen Auswertung nicht, zu diesem Zeitpunkt wurde eine signifikante Zunahme festgestellt, ebenso wie die Verringerung der Griffdiastase und der bewegungsbedingten Schmerzen. Dieser Bericht legt nahe, dass durch IVRA verabreichte Kortikosteroide bei bestimmten RA-Patienten eine anhaltende Analgesie bewirken können.
Steroid IVRA wurde auch als Zusatzbehandlung bei CRPS Typ 1 eingesetzt. Methylprednisolon (40 mg) wurde bei 22 Patienten randomisiert, doppelblind und placebokontrolliert zu Lidocain für IVRA hinzugefügt. Die Behandlungen wurden einmal pro Woche für bis zu drei Blocksitzungen durchgeführt. Die Untersucher fanden keinen Nutzen in der Zugabe des Steroids zum Lokalen im Hinblick auf eine Verbesserung der Schmerzstärke oder eine Verkürzung des Krankheitsverlaufs. Interessanterweise berichtete eine Fallserie mit 168 Patienten mit CRPS Typ 1 der oberen Extremität, die mit IVRA unter Verwendung von 25 ml 0.5 %igem Lidocain und 125 mg Methylprednisolon, verdünnt in 10 ml normaler Kochsalzlösung, behandelt und über einen Zeitraum von 5 Jahren nachbeobachtet wurden, von vollständiger Abwesenheit Schmerzen bei 92 % der Patienten am Ende der Nachbeobachtungszeit. IVRA wurde durchgeführt, während das Tourniquet 20 Minuten lang aufgeblasen gehalten wurde, während dieser Zeit wurde die betroffene Extremität manipuliert, um den Bewegungsbereich zu vergrößern. Das Tourniquet wurde dann allmählich entleert, um einen schnellen Eintritt der injizierten Mittel in den Kreislauf zu vermeiden.
Derselbe Vorgang wurde je nach Intensität und Dauer der Symptome des Patienten ein- oder zweimal pro Woche wiederholt, und zwischen den Sitzungen wurden die Patienten einer milden physikalischen Therapie unterzogen, die nicht verlängert oder belastend war. Durchschnittlich waren 4.8 Sitzungen nötig, um die Symptome zu lindern und eine funktionsfähige Extremität zu erhalten. Die Autoren führten die klinischen Ergebnisse auf das frühe Stadium des CRPS Typ 1 zu Beginn der Behandlung und die im Vergleich zu früheren Studien erhöhte Dosierung von Methylprednisolon zurück.
Acetaminophen
Aufgrund seiner bekannten analgetischen Wirkung wurde Acetaminophen (APAP) (Paracetamol) als Adjuvans zu Lokalanästhetika bei Patienten untersucht, die sich einer Handoperation unter IVRA unterziehen. Sechzig Patienten, die sich einer Handoperation unterzogen, wurden randomisiert in drei Gruppen eingeteilt. Alle Gruppen erhielten IVRA Lidocain (3 mg/kg), verdünnt mit normaler Kochsalzlösung auf ein Gesamtvolumen von 40 ml. Gruppe 1 erhielt IVRA Lidocain plus intravenöse Kochsalzlösung. Gruppe 2 erhielt IVRA-Lidocain und eine APAP-Mischung (300 mg) plus intravenöse Kochsalzlösung; und Gruppe 3 erhielt IVRA Lidocain plus intravenöses APAP (300 mg). Während der Operation wurden die Zeit des Beginns der sensorischen und motorischen Blockade, der Tourniquet-Schmerz und die Verwendung von Analgetika bewertet. Nach der Tourniquet-Entleerung wertet VAS nach 1, 2, 4, 6, 12 und 24 Stunden; die Zeit bis zum ersten analgetischen Bedarf; Gesamtverbrauch an Analgetika in den ersten 24 Stunden; und Nebenwirkungen wurden festgestellt. Zwischen den drei Gruppen gab es keinen signifikanten Unterschied beim Einsetzen sensorischer Blockaden; jedoch war die Dauer der sensorischen Blockade in Gruppe 2 signifikant länger. Die Zeit bis zum Einsetzen der motorischen Blockade war kürzer und die Dauer der motorischen Blockade war in Gruppe 2 länger. Tourniquet-Schmerzen wurden reduziert und die Qualität der Anästhesie-Scores wurde vom verblindeten Anästhesisten berichtet gegenüber dem Studienmedikament, war in Gruppe 2 ebenfalls signifikant höher. Es gab keine nachweisbare Abnahme der postoperativen Schmerzwerte zwischen den drei Gruppen. Die Autoren weisen auf die willkürliche Dosierung von APAP (300 mg) als Mangel der Studie hin. Weitere Dosisfindungsstudien sind erforderlich, um die Dosierung von Paracetamol zu optimieren, wenn es als Adjuvans zu Lidocain für IVRA verwendet wird.
Eine andere Studie, die die Wirkung von APAP bei Zugabe zu Lidocain in IVRA auf die Zeit des Beginns der sensorischen und motorischen Blockade, Tourniquet-Schmerzen und postoperative Analgesie untersuchte, fand eine kürzere Zeit des Beginns der sensorischen Blockade; verzögerter Beginn des Tourniquet-Schmerzes; und reduzierte postoperative Schmerzwerte und Analgetikaverbrauch. Die Dosierung von Acetaminophen war identisch mit der früheren Studie (0.5 % Lidocain verdünnt mit 300 mg intravenösem APAP auf ein Gesamtvolumen von 40 ml). Die Kontrollgruppe erhielt 0.5 % Lidocain verdünnt mit 0.9 % normaler Kochsalzlösung auf ein Gesamtvolumen von 40 ml. Zeitpunkt des Einsetzens und Dauer der motorischen Blockade wurden in dieser Studie nicht bewertet. In einem Versuch, das schnellere Einsetzen der sensorischen Blockade in der Lidocain-Acetaminophen-Gruppe zu erklären, untersuchten die Autoren den pH-Wert der Lidocain-Acetaminophen-Mischung und fanden heraus, dass der pH-Wert dieser Mischung 5.88 betrug, was niedriger war als der pH-Wert von Lidocain –normale Kochsalzmischung, die 6.16 war. Dies widerspricht der Tatsache, dass je höher der pH-Wert des Lokalanästhetikums ist, desto stärker die Nervendurchdringung und damit das schnellere Einsetzen einer neuralen Blockade. In dieser Studie führten die Autoren das schnellere Einsetzen der sensorischen Blockade auf mögliche antinozizeptive Wirkungen von APAP an peripheren Stellen zurück.
Nitroglycerin
Die Wirkung von Nitroglycerin (NTG) bei Zugabe zu Lidocain für IVRA wurde in einer prospektiven, randomisierten, doppelblinden Studie untersucht.76 Dreißig Patienten, die sich einer Handoperation unterzogen, wurden nach dem Zufallsprinzip zwei Gruppen zugeordnet. Die Kontrollgruppe (Gruppe C, n = 15) erhielt eine Gesamtdosis von 40 ml mit 3 mg/kg Lidocain, verdünnt mit physiologischer Kochsalzlösung, und die NTG-Gruppe (Gruppe NTG, n = 15) erhielt zusätzlich 200 μg NTG. Verkürzte Einsetzzeiten für sensorische und motorische Blockaden; verlängerte Erholungszeiten für sensorische und motorische Blockaden; verringerter Tourniquet-Schmerz; und verbesserte Qualität der Anästhesie wurden in der NTG-Gruppe festgestellt. Der Bedarf an postoperativen Analgetika war in der NTG-Gruppe ebenfalls signifikant verringert. Die kürzere Einsetzzeit der sensorischen und motorischen Blockade führten die Autoren auf die gefäßerweiternde Wirkung von NTG zurück, das die Verteilung des Lokalanästhetikums an die Nerven fördert. Einige der anderen Mechanismen, die zu der verbesserten Analgesie mit NTG beitragen können, können den Metabolismus von NTG zu Stickstoffmonoxid umfassen, was wiederum eine Erhöhung der intrazellulären Konzentration von zyklischem Guanosinmonophosphat verursacht, das produziert wird
Schmerzmodulation im zentralen und peripheren Nervensystem. Es wurde auch gezeigt, dass Stickoxidgeneratoren entzündungshemmende Wirkungen und Analgesie hervorrufen, indem sie Hyperalgesie und die neurogene Komponente von entzündlichen Ödemen durch topische Anwendung blockieren.
Midazolam
Es hat sich gezeigt, dass Midazolam das Einsetzen sensorischer und motorischer Blockaden beschleunigt und die postoperative Analgesie verbessert, wenn es zur Brachialplexusblockade zu Bupivacain hinzugefügt wird. In Tierversuchen wurde gezeigt, dass Midazolam analgetische Wirkungen hat, die durch GABA (γ-Aminobuttersäure)-Rezeptoren im Rückenmark vermittelt werden. GABA-Rezeptoren wurden auch in peripheren Nerven gefunden. Es wurde auch gezeigt, dass Midazolam die A-delta- und C-Faser-Aktivität reduziert.
In einer Studie zur Bewertung der Wirkung von Midazolam in Kombination mit Lidocain bei IVRA wurden 40 Patienten, die sich einer Handoperation unterzogen, nach dem Zufallsprinzip zwei Gruppen zugeordnet. Die Kontrollgruppe erhielt 3 mg/kg Lidocain, 2 % verdünnt mit Kochsalzlösung auf ein Gesamtvolumen von 40 ml, und die Midazolam-Gruppe erhielt zusätzlich 50 μg/kg Midazolam. Es gab keine statistisch signifikanten Unterschiede im Beginn der sensorischen und motorischen Blockade und in den Erholungszeiten zwischen den beiden Gruppen. Allerdings war ein subjektiver Schmerzbewertungswert unter Verwendung der numerischen Bewertungsskala (NRS) für Tourniquet-Schmerzen in der Midazolam-Gruppe signifikant verringert. Auch die Qualität der Anästhesie, wie sie vom Patienten und Chirurgen beurteilt wurde, war in der Midazolam-Gruppe signifikant besser.
Auch die postoperativen NRS-Schmerzwerte waren in der Midazolam-Gruppe für die ersten 2 Stunden nach der Operation signifikant niedriger.
Allerdings waren auch die Werte für die postoperative Sedierung in der Midazolam-Gruppe höher. Die Autoren weisen darauf hin, dass die verstärkte postoperative Analgesie nach Tourniquet-Deflation durch die systemische Wirkung von Midazolam zusätzlich zu der peripheren analgetischen Wirkung erklärt werden kann.
An einer anderen Studie nahmen 60 Patienten teil, die sich einer Handoperation unterzogen und randomisiert in zwei Gruppen eingeteilt wurden, wobei die Kontrollgruppe und die Midazolam-Gruppe IVRA mit genau der gleichen Dosierung von Lidocain und Midazolam wie in der vorherigen Studie erhielten. Diese Studie zeigte verkürzte Einsetzzeiten der sensorischen und motorischen Blockade und verlängerte Erholungszeiten der sensorischen und motorischen Blockade zusätzlich zu verringerten Tourniquet-Schmerzwerten und postoperativen Schmerzwerten. Die widersprüchlichen Ergebnisse in Bezug auf die Beginnzeiten der sensorischen und motorischen Blockade können weitere Studien mit größeren Stichprobenumfängen rechtfertigen, um die Diskrepanz aufzulösen. Derzeit kann nur festgestellt werden, dass Midazolam als Ergänzung zu Lokalanästhetika bei der IVRA der oberen Extremität einiges verspricht.
Ketamin
Ketamin ist ein starkes Analgetikum, dessen Hauptwirkungsmechanismus der Antagonismus von N-Methyl-D-Aspartat (NMDA)-Glutamatrezeptoren ist, die eine entscheidende Rolle bei der Schmerzverarbeitung auf der Ebene des Rückenmarks spielen. Tierversuche haben das Vorhandensein von NMDA-Rezeptoren in peripheren Nerven gezeigt. Es wurde auch gezeigt, dass Ketamin eine vorübergehende Blockade der Natrium- und Kaliumkanäle der peripheren Nerven hervorruft. Das mögliche Vorhandensein von NMDA-Rezeptoren in peripheren Nerven sowie die Fähigkeit von Ketamin, Natriumkanäle lokal zu blockieren, weist auf einen möglichen peripheren Wirkort für Ketamin hin, zusätzlich zu seinen gut etablierten zentralen Wirkorten.
Ketamin wurde als Adjuvans in Lidocain IVRA bei Patienten untersucht, die sich einer Handoperation unterziehen, und seine Wirksamkeit bei der Kontrolle von intraoperativen Tourniquet-Schmerzen, postoperativer Analgesie und Nebenwirkungen wurde mit der gleichen Dosis von systemisch verabreichtem Ketamin verglichen. In dieser randomisierten, doppelblinden, systemischen Kontrollstudie wurden 40 Patienten, die sich einer ambulanten Handoperation unterzogen, in zwei Gruppen randomisiert. In der Gruppe „IVRA“ wurden 0.1 mg/kg Ketamin in 1 ml normaler Kochsalzlösung zu dem IVRA-Lidocain hinzugefügt, und 1 ml normaler Kochsalzlösung wurde über eine periphere intravenöse Leitung verabreicht. In der Gruppe „systemisch“ wurde 1 ml physiologischer Kochsalzlösung in die IVRA-Spritze gegeben und 0.1 mg/kg Ketamin in 1 ml normaler Kochsalzlösung wurde über einen peripheren intravenösen Zugang verabreicht. Beide Gruppen erhielten 40 ml 0.5 % Lidocain für IVRA.
Die Studie fand keinen Unterschied zwischen den Gruppen in den genannten Studienparametern, und die Autoren kamen zu dem Schluss, dass IVRA-Ketamin und systemisches intravenöses Ketamin in Bezug auf intraoperative Tourniquet-Schmerzen und postoperativen Analgetikaverbrauch nicht zu unterscheiden waren. Die Geschwindigkeit des Einsetzens und die Dauer der sensorischen und motorischen Blockade wurden in dieser Studie nicht gemessen. Eine weitere Studie, in der die Wirksamkeit von Ketamin und Clonidin bei getrennter Zugabe zu 40 ml 0.5 % Lidocain für IVRA bei Patienten verglichen wurde, die sich einer Hand- oder Unterarmoperation unterziehen, ergab ein verzögertes Einsetzen von Tourniquet-Schmerzen und einen verringerten Analgetikaverbrauch in beiden Gruppen im Vergleich zur Kontrollgruppe Empfangen von 40 ml 0.5 % Lidocain mit hinzugefügter Kochsalzlösung. Ketamin hatte im Vergleich zu Clonidin eine stärkere Wirkung auf die Studienparameter. In dieser Studie mit 45 randomisierten Patienten in drei Gruppen wurde IVRA mit 40 ml 0.5 % Lidocain und Kochsalzlösung, 1 μg/kg Clonidin oder 0.1 mg/kg Ketamin durchgeführt.
Spezifische IVRA-Behandlungen für CRPS
Adrenerge Blocker oder Antagonisten, insbesondere diejenigen, die am α-Rezeptor wirksam sind, haben sich bei der Behandlung von CRPS als vielversprechend erwiesen, insbesondere wenn diese Mittel für IVRA verwendet werden. Andere adrenerge Adjuvantien setzen Norepinephrin frei und verhindern anschließend dessen Wiederaufnahme an der neurovaskulären Verbindung. Ihre Verwendung bei CRPS ist intuitiv, da vermutet wird, dass die Pathophysiologie der Erkrankung den α-Rezeptor umfasst und durch Norepinephrin vermittelt wird. Allerdings gibt es zu diesem Thema erhebliche Kontroversen, insbesondere wenn die aktuelle Forschung mit den Ergebnissen von Studien verglichen wird, die vor fast 40 Jahren durchgeführt wurden. Guanethidin, Reserpin und Bretylium wurden alle für IVRA bei CRPS evaluiert. Als 15 mg Guanethidin zu 0.5 % Prilocain in einer Gruppe von 57 Patienten mit CRPS der oberen Extremität und der Hand hinzugefügt wurden, wurde festgestellt, dass Guanethidin bei der Behandlung von Allodynie und brennenden Schmerzen bei CRPS nach distalen Radiusfrakturen nicht wirksamer war als normale Kochsalzlösung.
Diese Ergebnisse bestätigten die Arbeit, die 7 Jahre zuvor in einer doppelblinden, randomisierten, multizentrischen Studie durchgeführt worden war. Sechzig Patienten mit sympathischer Reflexdystrophie (RSD)/Kausalgie erhielten vier IVRA-Blöcke in 4-Tages-Intervallen mit entweder Guanethidin oder Placebo in 0.5 % Lidocain. Langfristig gab es keinen Unterschied zwischen der Placebo-Gruppe und der Guanethidin-Gruppe, und nur 35 % der Patienten insgesamt in allen Gruppen hatten eine Lösung ihres Problems.
Bretylium wurde auch bei CRPS verwendet. In einer randomisierten, kontrollierten Studie wurde 0.5 % Lidocain mit dem gleichen Lokalanästhetikum verglichen, dem Bretylium 1.5 mg/kg zugesetzt wurde. Eine Verringerung der Schmerzen um 30 % oder mehr wurde als signifikant angesehen. Die Gruppe mit lokalem Bretylium hatte eine Schmerzlinderung für 20 ± 17.5 Tage, im Gegensatz zur Gruppe mit Lidocain, bei der die Analgesie nur 2.7 ± 3.7 Tage anhielt. Das Bretylium war dem Lokalanästhetikum allein bei der Behandlung von CRPS in dieser Studie weit überlegen.
Eine intravenöse Regionalanästhesie mit Bretylium wurde verwendet, um zu zeigen, dass eine Verringerung des sympathischen Tonus der trainierenden Unterarmmuskulatur den Blutfluss erhöhen, die Muskelazidose verringern und die Reflexreaktionen dämpfen würde. IVRA mit Bretylium erhöhte den Blutfluss sowie den Sauerstoffverbrauch im trainierten Unterarm, obwohl sowohl der venöse Kalium- als auch der Wasserstoffionengehalt während der Trainingsphase erhöht waren, was darauf hindeutet, dass die Reflexwirkungen durch die Bretyliumblockade nicht beeinflusst wurden.
KOMPLIKATIONEN
Komplikationen aufgrund von IVRA können entweder als medikamenten- oder gerätebedingt (z. B. Tourniquet) klassifiziert werden. Arzneimittelbedingte Komplikationen hängen davon ab, dass die Mittel, einschließlich Lokalanästhetika und Adjuvantien, direkt in das Gefäßsystem verabreicht werden. Zu den gerätebedingten Komplikationen zählen alle Geräte und Techniken, mit denen der Gefäßraum vom Körperkreislauf isoliert wird. Unbeabsichtigtes oder unbeabsichtigtes Ablassen der Manschette, Manschettenversagen, ein plötzlicher Anstieg des Venendrucks im verschlossenen Gewebe auf ein Niveau, das höher ist als der Manschettendruck, und eine intakte interossäre Zirkulation können alle zu Komplikationen der IVRA beitragen.
Lidocain ist das am häufigsten verwendete Lokalanästhetikum für IVRA und ist daher das Mittel, über das die meisten Komplikationen berichtet wurden. Glücklicherweise reichert sich Lidocain in therapeutischen Plasmakonzentrationen nicht in großem Umfang an Natriumkanälen an, und da es sowohl schnell an den Kanal bindet als auch von diesem dissoziiert, sind toxische Akkumulationen des Arzneimittels am Kanal untypisch.97,98 Überhöhte Plasmakonzentrationen von Lidocain , wie sie mit intravenösen Boli hoher Dosen bei einem fehlerhaften Tourniquet-System verbunden sind, führen zu einer peripheren Vasodilatation und einer verminderten kardialen Kontraktilität, die normalerweise klinisch als Hypotonie gesehen wird. Der übliche Beginn von IVRA unter Verwendung von Lidocain in 0.5 % Konzentrationen ist schnell (ungefähr 4.5 ± 0.3 Minuten), und die Beendigung der Anästhesie, sobald das Tourniquet entleert wurde, ist ebenfalls schnell (5.8 ± 0.5 Minuten).99 Normalerweise gibt es keine Anzeichen oder Symptome einer kardiovaskulären oder zentralnervösen Toxizität, wenn das Tourniquet mindestens 30 Minuten nach der Injektion des Medikaments in das Venensystem entleert wird, obwohl Tinnitus in den 20- und 27-Sekunden-Perioden nach der Deflation nach den Standard-Aufblaszeiten festgestellt wurde.
Eine Literaturrecherche in PubMed® der American National Library of Medicine, in Embase® und in MEDLINE®, die sich über den Zeitraum von 1950 bis 2007 erstreckte, ergab jedoch 24 Fälle von Anfällen, wobei Anfälle Berichten zufolge in 12 Fällen auftraten, während die Manschette noch aufgeblasen war und in 9 Fällen, nachdem die Manschette entleert wurde. In drei Fällen lagen keine Informationen vor. Es wurde über Anfälle berichtet, die während des Aufpumpens des Tourniquets auftraten, wobei der Tourniquet-Druck den anfänglichen systolischen arteriellen Blutdruck um 150 mm Hg überstieg. Krampfanfälle nach Tourniquet-Entleerung wurden mit Tourniquet-Zeiten von bis zu 60 Minuten und mit einer Verzögerung von bis zu 10 Minuten nach Tourniquet-Entleerung gemeldet. Die niedrigste Dosis des Lokalanästhetikums im Zusammenhang mit einem Anfall betrug 1.4 mg/kg für Lidocain, 4 mg/kg für Prilocain und 1.3 mg/kg für Bupivacain.
Obwohl etwa 70 % der verabreichten Lidocain-Dosis nach der Tourniquet-Entleerung im Gewebe der isolierten Extremität verbleiben, treten die restlichen 30 % während der folgenden 45 Minuten in den systemischen Kreislauf ein. Viel mehr Arzneimittel wird aus den Geweben der isolierten Extremität in den Kreislauf nach der Tourniquet-Entleerung freigesetzt, wenn die Extremität unbeabsichtigt trainiert wird, was die Wichtigkeit unterstreicht, die zuvor anästhesierte Extremität unmittelbar nach der Tourniquet-Entleerung für einige Zeit ruhig zu halten.
Das andere häufig verwendete Lokalanästhetikum, das für IVRA verwendet wird, Prilocain, ist mit der Bildung von Methämoglobin (MetHb) verbunden, die etwa 4 bis 8 Stunden nach seiner Verabreichung auftritt. Glücklicherweise wurde keine signifikante Methämoglobinämie berichtet, wenn Prilocain für IVRA verwendet wurde. Prilocain (0.5 %), das für IVRA verabreicht wird, hat einen Beginn der Analgesie von etwa 11 Minuten (±6.8 Minuten), und das Ende der Analgesie nach Tourniquet-Entleerung beträgt durchschnittlich 7.2 Minuten (±4.6 Minuten).25 Die Verwendung dieses Mittels für IVRA scheint zu sein außerordentlich sicher. Tatsächlich gab es in einer Umfrage unter 45,000 Prilocain-IVRA-Blöcken keine schwerwiegenden Nebenwirkungen und keine Todesfälle, wenn dieses Medikament mit dieser Technik verwendet wurde.102 In Bezug auf die Wirksamkeit scheint Prilocain Lidocain bei der Verwendung für IVRA gleichwertig zu sein.
Wenn Opioide in Kombination mit Lokalanästhetika für IVRA verabreicht werden, um zu versuchen, die Analgesie nach einer Manschettenentleerung zu verlängern, können nach einer Manschettenentleerung gelegentliche Nebenwirkungen beobachtet werden, die typischerweise systemisch verabreichten Opioiden zugeschrieben werden. Dazu gehören Übelkeit, Erbrechen und leichte Sedierung.
Wenn neurovaskuläre Blocker zusammen mit Lokalanästhetika verabreicht werden, um die chirurgischen Bedingungen bei Patienten zu verbessern, die sich einer Frakturreduktion unterziehen, liegen keine Berichte über Komplikationen durch diese Adjuvantien vor.
NYSORA-Tipps
• Ein intaktes Blutsperresystem ist für die erfolgreiche und sichere Durchführung von IVRA unerlässlich.
• Ein unbeabsichtigtes Entleeren des Tourniquets oder das Vorhandensein einer vaskulären Verbindung selbst bei einem intakten, funktionierenden Tourniquet kann zu schwerer systemischer Toxizität führen.
• Wenn der chirurgische Eingriff kürzer als 30 Minuten dauert, kann das intermittierende Ablassen und Aufblasen der Manschette die Zeit bis zum Erreichen der maximalen arteriellen Konzentrationen des Lokalanästhetikums effektiv verlängern, ist jedoch möglicherweise nicht vollständig zuverlässig bei der Minimierung der Toxizität aufgrund der Freisetzung des Lokalanästhetikums in den Kreislauf.
• Das Tourniquet sollte nicht entleert werden, bis mindestens 30 Minuten nach der Injektion des Lokalanästhetikums (und gegebenenfalls der Adjuvantien) in das isolierte Venensystem verstrichen sind.
Außerdem kann das Tourniquet selbst eine Quelle von Komplikationen sein, da es ischämische Schmerzen und Beschwerden verursachen kann.
Eine systemische Hypertonie kann aus einer anhaltenden oder anhaltenden Tourniquet-Inflation resultieren. Gerätemissbrauch oder Fehlfunktion ist eine wichtige und vermeidbare Quelle von Komplikationen aufgrund dieser Technik. Selbst ein intaktes, voll funktionsfähiges Tourniquet kann mit einem Austritt verabreichter Medikamente aus einer vermeintlich isolierten Extremität in den systemischen Kreislauf verbunden sein.
Bei der IVRA der unteren Extremitäten kommt es zu fast 100 % zu einem Lokalanästhetikum-Austritt unterhalb des Tourniquets, im Vergleich zu einer etwa 25 %igen Inzidenz einer Blockade der oberen Extremitäten. Als Folge dieses Leckphänomens ist die Verwendung von IVRA zur Analgesie der unteren Extremitäten mit einer hohen Inzidenz von Blockaden schlechter Qualität verbunden (fast 40 % in einer prospektiven Studie). Das Medikament kann an einer scheinbar voll funktionsfähigen Manschette vorbei austreten und Zugang zum systemischen Kreislauf über den interossären Kreislauf erhalten, der nicht durch die Okklusion von Muskeln, Weichteilen und den darin enthaltenen begleitenden Gefäßkanälen beeinträchtigt wird. Dieser Faktor ist seit fast 50 Jahren bekannt, scheint jedoch für die Entstehung von Komplikationen aufgrund von IVRA nicht von Bedeutung zu sein.
Tourniquet-Deflation nach IVRA ist mit Anzeichen und Symptomen von verbunden systemische Toxizität von Lokalanästhetika, die von leichten Ereignissen im Zusammenhang mit dem zentralen Nervensystem wie Tinnitus und perioraler Taubheit über Krampfanfälle bis hin zu einem verheerenden kardiovaskulären Kollaps reichen. Diese korrelieren mit Lokalanästhetikakonzentrationen im arteriellen Blut und nicht mit venösen Konzentrationen.
Eine weitere Komplikation aufgrund von IVRA sind Tourniquet-Schmerzen, die nicht selten auftreten, wenn kein doppeltes pneumatisches Gerät verwendet wird (Figure 1 und Figure 9). Wir empfehlen die Verwendung eines solchen Tourniquets für alle Eingriffe, die mit IVRA durchgeführt werden und voraussichtlich länger als 30 Minuten dauern. Selbst wenn solche Richtlinien befolgt werden, treten jedoch nach einem „sicheren“ Zeitintervall nach Tourniquet-Entleerung unerwünschte Ereignisse auf. Sehr seltene, vereinzelte Berichte über neurologische Komplikationen, einschließlich Schäden an den medianen, ulnaren und muskulokutanen Nerven, sind mit IVRA verbunden. Die Ursache solcher Komplikationen scheint der direkte Druck des auf diese Nerven ausgeübten Tourniquets zu sein, die anschließend histologische Veränderungen aufweisen, die Quetschverletzungen ähneln. Es wird empfohlen, dass die Tourniquet-Zeit 2 Stunden nicht überschreitet, um die Wahrscheinlichkeit von Kapillar- und Muskelschäden infolge einer Gewebeazidose zu verringern.
Kompartmentsyndrom kann selten nach IVRA auftreten, insbesondere wenn IVRA zur Reposition von Frakturen der unteren Extremitäten verwendet wird, und kann sowohl auf die große Menge an Lokalanästhetikum zurückzuführen sein, das zur Bewirkung der Analgesie injiziert wird, als auch auf eine unzureichende oder unvollständige Entblutung der Extremität vor der Durchführung der Block. Es gibt einen Fallbericht über diese Komplikation nach versehentlicher Injektion von hypertoner Kochsalzlösung, wenn ein Lokalanästhetikum injiziert werden sollte.
Eine 33-jährige schwangere Patientin, die sich einer IVRA zur endoskopischen Freigabe des Karpaltunnels unterzog, erlebte nach der Injektion des Lokalanästhetikums eine schwere Episode von Phantomempfindungen.
Die Symptome verschwanden nach Auflösung des IVRA. Es gibt einen Bericht über die verheerende Notwendigkeit einer Armamputation bei einem 28-jährigen Patienten, dessen radiale und ulnare Arterien nach einer IVRA nach einer kurzen Tourniquet-Okklusionszeit thrombosierten. Ob dies auf eine unerwartete intraarterielle Injektion des Medikaments oder einen Fehler bei der Medikamentenverabreichung zurückzuführen ist oder vielleicht eine idiosynkratische Arzneimittelreaktion ist rein spekulativ. Im ASA Closed Claims Project wurden für die Jahre 1980 bis 1999 drei Fälle gemeldet, darunter entweder Tod oder dauerhafte Hirnschädigung im Zusammenhang mit IVRA. Einzelheiten zu diesen Fällen sind nicht bekannt.
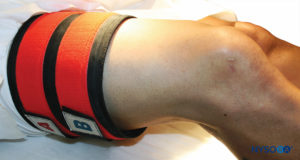
ABBILDUNG 9.Das doppelte Tourniquet-System wird als Vorbereitung für die IVRA der rechten unteren Extremität am proximalen rechten Oberschenkel platziert.
Toxizität von Lokalanästhetika
Obwohl Lidocain das am häufigsten verwendete Lokalanästhetikum für IVRA in den Vereinigten Staaten ist, wird in Europa Prilocain 0.5 % routinemäßig gewählt. Prilocain wird jedoch zu Orthotoluidin metabolisiert, einer oxidierenden Verbindung, die Hämoglobin in MetHb umwandeln kann. Dies ist normalerweise nur von Bedeutung, wenn die Dosis von Prilocain 600 mg übersteigt, was selbst bei einer IVRA der unteren Extremitäten, bei der Volumina von bis zu 100 ml verwendet werden, nicht erreicht werden sollte (d. h. 100 ml × 0.5 % Prilocain = 500 mg). .
NYSORA-Tipps
• Eine schwere Methämoglobinämie ist ein medizinischer Notfall, der umgehend erkannt und angemessen behandelt werden muss.
• Eine gute Anamnese und ein hohes Maß an Verdacht sind erforderlich, um die Diagnose zu stellen.
• Bei Methämoglobinämie aufgrund einer Arzneimittelexposition besteht die traditionelle Erstlinientherapie aus der Infusion von Methylenblau (MB).
• Dextrose sollte gegeben werden, da die Hauptquelle von NADH (reduziertes [hydriertes] Nicotinamidadenindinukleotid) in den roten Blutkörperchen der Zuckerabbau durch Glykolyse ist. Dextrose ist auch notwendig, um NADPH (reduziertes [hydriertes] NAD-Phosphat) durch den Hexosemonophosphat-Shunt zu bilden, was für die Wirksamkeit von MB erforderlich ist.
• Die MB-Dosis beträgt 1–2 mg/kg i.v. über 5 Minuten (die Gesamtdosis sollte 7–8 mg/kg nicht überschreiten).
• MB kann Dyspnoe, Brustschmerzen oder Hämolyse verursachen.
• MB stellt einen künstlichen Elektronentransporter für die Reduktion von MetHb über den NADPH-abhängigen Weg bereit. Die Reaktion ist schnell; die Dosis kann in wiederholt werden
1 Stunde, wenn der MetHb-Spiegel 1 Stunde nach der ersten Infusion immer noch hoch ist.
• Rebound-Methämoglobinämie kann bis zu 18 Stunden nach der MB-Verabreichung aufgrund verlängerter Absorption von lipophilen Wirkstoffen (Benzocain) aus dem Fettgewebe auftreten. Es ist sinnvoll, nach einer MB-Behandlung Serienmessungen des MetHb-Spiegels durchzuführen. MB sollte Patienten mit Glucose-6-Phosphat-Dehydrogenase (G6PD)-Mangel nicht verabreicht werden, da die Reduktion von MetHb durch MB von NADPH abhängt, das durch G6PD (Hämolyse) erzeugt wird. Eine alternative Behandlung für diese Patienten ist Ascorbinsäure (2 mg/kg).
• Bluttransfusionen oder Austauschtransfusionen können bei Schockpatienten hilfreich sein. In schweren Fällen wurde hyperbarer Sauerstoff mit anekdotischem Erfolg eingesetzt.
Das Entleeren des Tourniquets nach der Operation ist ein entscheidender Schritt zur Minimierung der Möglichkeit von Toxizität im Zusammenhang mit IVRA. Erstens ist es absolut obligatorisch, dass das Tourniquet nicht entleert wird, es sei denn, dass seit der Injektion des Lokalanästhetikums mindestens 30 Minuten vergangen sind, selbst wenn die Dauer des chirurgischen Eingriffs oder der Manipulation kurz war. Wenn die Operation kurz ist und sich der Patient in der PACU erholen muss, ist es akzeptabel, das distale Tourniquet abzuklemmen, während es aufgeblasen ist, den Patienten aus dem Operationsbereich zu entfernen (mit aufgeblasenem Tourniquet) und den Patienten in a zu überführen überwachte Pflegeeinrichtung. Zu keinem Zeitpunkt sollte jedoch jemand das abgeklemmte Tourniquet entfernen, bis die 30-Minuten-Periode, die mit der Injektion der Lokalanästhesielösung beginnt, verstrichen ist. Zu diesem Zeitpunkt sollte der Patient nach dem Lösen des Tourniquets in der PACU mindestens 15 Minuten lang kontinuierlich überwacht werden. Mindestens ein Fall von Herzstillstand wurde berichtet, als das Tourniquet kurz nach der Injektion eines Lokalanästhetikums gelöst wurde, wobei die Operationsdauer extrem kurz war.
Zweitens ist es unbedingt erforderlich, dass die Tourniquet-Entleerung „zyklisch“ wie folgt erfolgt: Die Manschette wird entleert (nach mindestens 30 Minuten) und sofort wieder aufgepumpt. Der Patient wird sorgfältig auf das Auftreten von Symptomen im Zusammenhang mit der Toxizität von Lokalanästhetika wie Tinnitus, Benommenheit, metallischer Geschmack im Mund usw. beobachtet oder befragt. Offensichtlich können auch Anzeichen einer Stimulation des Zentralnervensystems eine Lokalanästhetika-Toxizität darstellen und müssen ebenfalls gesucht werden. Wenn es nach etwa 1 Minute keine derartigen Anzeichen oder Symptome gibt, wird die Manschette noch einmal entleert und erneut sofort für einen Zeitraum von etwa 1 bis 2 Minuten wieder aufgepumpt, wobei der Patient beobachtet und auf systemische Toxizität des Lokalanästhetikums abgefragt wird. Wenn zu diesem Zeitpunkt keine erscheint, kann das Tourniquet sicher entleert und von der Extremität entfernt werden. Die Sicherheit eines solchen zyklischen Ablassens/Wiederaufblasens besteht darin, dass bei jedem Ablassen nur ein kleiner Bruchteil des verabreichten (und ungebundenen) Lokalanästhetikums in den systemischen Kreislauf gelangen kann, wodurch die Möglichkeit eines plötzlichen, anhaltenden Anstiegs des Blutspiegels minimiert wird das Lokalanästhetikum.
ZUSAMMENFASSUNG
Die intravenöse Regionalanästhesie ist eine wertvolle Ergänzung zum Rüstzeug von Ärzten aller Fachrichtungen, die sich mit akut verletzten Patienten befassen. Die Einfachheit der Technik und die relative Sicherheit (bei strikter Einhaltung des zuvor aufgeführten Protokolls) machen es zu einer attraktiven Alternative zu Plexus brachialis blockieren (für Operationen oder Manipulationen an den oberen Extremitäten) und Spinale or Epiduralblock (für Operationen oder Manipulationen an den unteren Extremitäten). Die einfache Möglichkeit, eine periphere Vene zu identifizieren und zugänglich zu machen und ein pneumatisches Tourniquet anzulegen, macht dies zu einer der „benutzerfreundlichsten“ regionalen Blockierungsmodalitäten in der klinischen Praxis. Es ist nicht erforderlich, mit einem peripheren Nervenstimulator umzugehen oder Bilder zu interpretieren, die von einem Ultraschallgerät erhalten wurden. Einer der einzigen potenziellen Nachteile, die mit IVRA verbunden sind, ist die begrenzte Dauer der Anästhesie/Analgesie, die mit seiner Verwendung verbunden ist. Eine relative Unfähigkeit, die Analgesie bis weit in die Zeit nach dem Eingriff zu verlängern, schmälert ihren Nutzen. Für diese Fälle bietet die kontinuierliche Kathetereinlage und -erhaltung durch Plexusanästhesie eine attraktive Alternative.
REFERENZEN
- Bier A: Uber einen neun weg Lokalanästhesie an den gliedmassen zuerzeugen. Arch Klin Chir 1908;86:1007–1016.
- Bier A: Über eine neue Methode der Lokalanästhesie. Münch Med Wschir 1909; 56:589.
- Bier A: Zur venösen Anästhesie. Berl Klin Wschr 1909;46: 477–489.
- Bier A: Zur Lokalanästhesie unter besonderer Berücksichtigung der Venenanästhesie. Edinburgh Med J 19105: 103–123.
- Morrison J: Intravenöse Lokalanästhesie. Br J Surg 1930–1931;18:641–647.
- Herreros L: Regionalanästhesie auf intravenösem Weg. Anästhesiologie 1946;7:558–560.
- Holmes CMcK: Intravenöse regionale Analgesie. Lancet 1963;1:245–247.
- Kalman S, Svenson H, Lisander B, et al: Quantitative sensorische Veränderungen beim Menschen nach intravenöser regionaler Blockierung mit Mepivacain. Reg Anesth Pain Med 1999;24:236–241.
- Wahren L, Torebjork E, Nystorm B: Quantitative sensorische Tests vor und nach regionaler Guanethidin-Blockade bei Patienten mit Neuralgie in der Hand. Schmerz 1991;46:23–30.
- Smith, M., Sprung, J., Zura, A., et al.: Eine Übersicht über den Umgang mit regionalen Anästhesietechniken in amerikanischen Anästhesie-Ausbildungsprogrammen. Reg Anesth Pain Med 1999;24:11–16.
- Blaheta H, Vollert B, Zuder D, et al: Die intravenöse Regionalanästhesie (Bier-Blockade) zur Botulimum-Toxin-Therapie der palmaren Hyperhidrose ist sicher und wirksam. Dermatol Surg 2002;28:666–671.
- Bosdotter Enroth S, Rystedt A, Covaciu L, et al: Bilaterale intravenöse Regionalanästhesie des Unterarms mit Prilocain zur Behandlung von palmarer Hyperhidrose mit Botulinumtoxin. J Am Acad Dermatol 2010;63(3): 466–474.
- Nascimento MSA, Klamt JG und Prado WA: Die intravenöse regionale Blockade ähnelt der sympathischen Ganglienblockade zur Schmerzbehandlung bei Patienten mit komplexem regionalen Schmerzsyndrom Typ 1. Braz J Med Biol Res 2010; 43(12):1239–1244.
- Glickman L, Mackinnon S, Rao T, et al: Kontinuierliche intravenöse Regionalanästhesie. J Hand Surg 1992;17:82–86.
- Mabee J, Shean C, Orlinsky M, et al.: Die Auswirkungen des simulierten Bier-Blocks IVRA auf den intrakompartimentellen Gewebedruck. Acta Anaesthesiol Scand 1997;41:208–213.
- Aarons CE, Fernandez MD, Willsey M, Peterson B, Key C, Fabregas J: Bier-Block-Regionalanästhesie und Casting bei Unterarmfrakturen: Sicherheit in der pädiatrischen Notaufnahme. J Pediatr Orthop 2014;34:45–49.
- Singh R, Bhagawat A, Bhadoria P, Kohli A: Forearm IVRA, Verwendung von 0.5 % Lidocain in einer Dosis von 1.5 mg/kg mit Ketorolac 0.15 mg/kg für Hand- und Handgelenkoperationen. Minerva Anestesiol 2010;76:109–114.
- Chiao FB, Chen J, Lesser JB, Resta-Flarer F, Bennett H: Unterarm-Tourniquet mit einer Manschette bei intravenöser Regionalanästhesie führt zu weniger Schmerzen und weniger Sedierungsanforderungen als Oberarm-Tourniquet. Br. J. Anaesth 2013;111(2):271–275.
- Benlabed M, Jullien P, Guelmi K, et al: Alkanisierung von 0.5 % Lidocain für die intravenöse Regionalanästhesie. Reg Anesth 1990;15:59–60.
- Lavin P, Henderson C, Vaghadia H: Nicht alkalisiertes und alkalisiertes 2-Chlorprocain versus Lidocain für die intravenöse Regionalanästhesie während der ambulanten Handchirurgie. Can J Anaesth 1999;46:939–945.
- Ulus A, Gurses E, Oztrurk I, Serin S: Vergleichende Bewertung von zwei verschiedenen Volumina von Lidocain in der intravenösen Regionalanästhesie. Med Sci Monit 2013;19:978–983.
- Chan V, Weisbrod M, Kaszas Z, et al: Vergleich von Ropivacain und Lidocain für die intravenöse Regionalanästhesie bei Freiwilligen: Eine vorläufige Studie zur anästhetischen Wirksamkeit und zum Blutspiegel. Anästhesiologie 1999;90: 1602–1608.
- Peng P, Coleman M, McCartney C, et al: Vergleich der anästhetischen Wirkung zwischen 0.375 % Ropivacain versus 0.5 % Lidocain bei der intravenösen Regionalanästhesie des Unterarms. Reg Anesth Pain Med 2002;27;595–599.
- Horn JL, Cordo P, Kunster D, et al: Fortschreiten der intravenösen Regionalanästhesie des Unterarms mit Ropivacain. Reg Anesth Pain Med 2011;36(2): 177-180.
- Pitkanen M, Suzuki N, Rosenberg P: Intravenöse Regionalanästhesie mit 0.5 % Prilocain oder 0.5 % Chlorprocain. Ein doppelblinder Vergleich bei Freiwilligen. Anästhesie 1992;47:618–619.
- Pitkanen M, Kytta J, Rosenberg P: Vergleich von 2-Chloroprocain und Prilocain zur intravenösen Regionalanästhesie des Arms: Eine klinische Studie. Anästhesie 1993;48:1091–1093.
- Pitkanen M, Xu M, Haasio J, et al: Vergleich von 0.5 % Articain mit 0.5 % Prilocain in der intravenösen Regionalanästhesie des Arms: Eine Crossover-Studie an Freiwilligen. Reg Anesth Pain Med 1999;24:131–135.
- Simon M, Gielen M, Albernik N, et al: Intravenöse Regionalanästhesie mit 0.5 % Articain, 0.5 % Lidocain oder 0.5 % Prilocain. Eine doppelblinde randomisierte klinische Studie. Reg Anesth 1997;22:29–34.
- Hoffman V, Vercauteren M, Van Steenberge A, et al: Intravenöse Regionalanästhesie. Bewertung von vier verschiedenen Zusätzen zu Prilocain. Acta Anaesthesiol Belg 1997;48:71–76.
- Armstrong P, Brockway M, Wildsmith J: Alkalisierung von Prilocain für die intravenöse Regionalanästhesie. Anästhesie 1990;45:11–13.
- Solak M, Akturk G, Erciyes N, et al: Die Zugabe von Natriumbicarbonat zur Prilocain-Lösung während der intravenösen Regionalanästhesie. Acta Anaesthesiol Scand 1991;35:572–574.
- Kalman S, Bjorn K, Tholen E, et al: Mepivacain als intravenöser regionaler Block stört die reaktive Hyperämie und verringert den Blutfluss im Steady-State. Reg Anesth 1997;22:552–556.
- Kalman S, Liderfalk C, Wardell K, et al: Differenzielle Wirkung auf Vasodilatation und Schmerzen nach intradermalem Capsaicin beim Menschen während des Abklingens einer intravenösen Regionalanästhesie mit Mepivacain. Reg Anesth Pain Med 1998;23:402–408.
- Choyce A, Peng P: Eine systematische Überprüfung von Hilfsmitteln für die intravenöse Regionalanästhesie für chirurgische Eingriffe. Can J Anaesth 2002;49: 32–45.
- Kleinschmidt S, Stockl W, Wilhelm W, et al: Die Zugabe von Clonidin zu Prilocain für die intravenöse Regionalanästhesie. Eur J Anaesthesiol 1997;14:40–46.
- Cucchia G, Chasot-Di Dio V, et al: Wirkung der Zugabe von Clonidin zum Lokalanästhetikum während des Bier-Blocks auf die prä- und postoperative Analgesie. Br J Anaesth 1997;78(Suppl 1):78–79.
- Ivie CS, Viscomi CM, Adams DC, Friend AF, Murphy TR, Parker CJ: Clonidin als Zusatz zur intravenösen Regionalanästhesie: Eine randomisierte, doppelblinde, placebokontrollierte Dosisfindungsstudie. Anaesthesiol Clin Pharmacol 2011;27(3):323–327.
- Memis D, Turan A, Karamanlioglu B, et al: Hinzufügen von Dexmedetomidin zu Lidocain für die intravenöse Regionalanästhesie. Anesth Analg 2004;98: 835–840.
- Kol IO, Ozturk H, Kaygusuz K, Gursoy S, Comert B, Mimaroglu C: Zugabe von Dexmedetomidin oder Lornoxicam zu Prilocain in der intravenösen Regionalanästhesie für Hand- oder Unterarmoperationen: Eine randomisierte kontrollierte Studie. Clin Drug Investig 2009;29(2):121–129.
- Mirzak A, Gul R, Erkutlu I, Alptekin M, Oner U: Prämedikation mit Dexmedetomidin allein oder zusammen mit 0.5 % Lidocain für IVRA. J Surgers 2010;164(2):242–247.
- Fields H, Emson P, Leigh B, et al: Mehrere Opiatrezeptorstellen auf primären afferenten Fasern. Natur 1980;284:351–353.
- Young W, Wamsley J, Zarbin M, et al: Opioidrezeptoren unterliegen einem axonalen Fluss. Wissenschaft 1980;210:76–78.
- Boogaerts J, Balatoni E, Lafont N, et al: Utilization des morphiniques dans les blocs nerveux peripheriques. Kongress Ser Ars Medicina 1985;3:143–150.
- Gobeaux D, Landais A: Utilization de deux morphiniques dans les blocs du plexus brachial. J Can Anesth 1988;36:437–440.
- Gobeaux D, Landais A, Bexon G, et al.: Adjonction de fentanyl la lidocaine adrenaline pour le blocage du plexus brachial. J Can Anesth 1987;35:195–199.
- Viel E, Eledjam J, de la Coussaye J, et al: Brachialplexusblock mit Opioiden zur postoperativen Schmerzlinderung: Vergleich zwischen Buprenorphin und Morphin. Reg. Anesth 1989;14:274–278.
- Candido K, Khan M, Raja D, et al: Plexus brachialis blockieren zur postoperativen Schmerzlinderung. Reg Anesth 2000;25:23.
- Arhtur J, Mian T, Heavner J, et al.: Fentanyl und Lidocain versus Lidocain für den Bier-Block. Reg Anesth 1992;17:223–227.
- Bobart V, Hartmannsgruber M, Atanassoff P, et al: Analgesie/Anästhesie nach Fentanyl plus Lidocain vs. einfaches Lidocain zur intravenösen Regionalanästhesie. Anesth Analg 1998:86:S-3.
- Pitkanen M, Rosenberg P, Pere P, et al: Fentanyl-Prilocain-Mischung zur intravenösen Regionalanästhesie bei Patienten, die sich einer Operation unterziehen. Anästhesie 1992;47:395–398.
- Armstrong P, Power I, Wildsmith J: Zugabe von Fentanyl zu Prilocain für die intravenöse Regionalanästhesie. Anästhesie 1991;46:278–280.
- Gupta A, Begntsson M, Bjornsson A, et al: Fehlende periphere analgetische Wirkung von niedrig dosiertem Morphin während der intravenösen Regionalanästhesie. Reg Anesth 1993;18:250–253.
- Abdulla W, Fadhil N: Ein neuer Ansatz zur intravenösen Regionalanästhesie. Anesth Analg 1992;75:597–601.
- Sztark F, Thicoipe M, Favarel-Garriques J, et al: Die Verwendung von 0.25 % Lidocain mit Fentnayl und Pancuronium für die intravenöse Regionalanästhesie. Anesth Analg 1997;84:777–779.
- Subxedar D, Gevirtz C, Malik V, et al: Intravenöse Regionalanästhesie: Prospektive Bewertung von 0.25 % Lidocain mit Fentanyl und Rocuronium. Reg Anesth 1997;22:41.
- Thapar P, Skerman J: Bewertung von 0.2 % Lidocain mit Fentanyl und D-Tubocurarin für die intravenöse Regionalanästhesie. Reg Anesth 1997; 84: S342.
- Santhosh MC, Rohini BP, Roopa S, Raghavendra PR: Studie von 0.5 % Lidocain allein und Kombination von 0.25 % Lidocain mit Fentanyl und Vecuronium in intravenöser Regionalanästhesie für Operationen an den oberen Extremitäten. Rev Bras Anestesiol 2013;63(3):254–257.
- Acalovschi I, Cristea T: Intravenöse Regionalanästhesie mit Meperidin. Anesth Analg 1995;81:539–543.
- Acalovschi I, Cristea T, Margarit S, et al: Tramadol hinzugefügt zu Lidocain für die intravenöse Regionalanästhesie. Anesth Analg 2001;92:209–214.
- Tan S, Pay L, Chan S: Intravenöse Regionalanästhesie mit Lignocain und Tramadol. Ann Acad Med Singapur 2001;30:516–519.
- Alayurt S, Memis D, Pamucku Z: Die Zugabe von Sufentanil, Tramadol oder Clonidin zu Lignocain für die intravenöse Regionalanästhesie. Anaesth Intensive Care 2004;32:22–27.
- Kurt N., Kurt I., Aygunes B. et al.: Effekte der Zugabe von Alfentanil oder Atracurium zu einer Lidocain-Lösung für die intravenöse Regionalanästhesie. Eur J Anaesthesiol 2002;19:522–525.
- Elhakim M, Sadek R: Zusatz von Atracurium zu Lidocain zur intravenösen Regionalanästhesie. Acta Anaesthesiol Scand 1994;38:542–544.
- McCartney C, Brill S, Rawson R, et al: Kein anästhetischer oder analgetischer Nutzen von Neostigmin 1 mg als Zusatz zu intravenöser Regionalanästhesie mit Lidocain 0.5 % für Handchirurgie. Reg Anesth Pain Med 2003;28:414–417.
- Turan A, Karamanlyoglu B, Memis D, et al: Intravenöse Regionalanästhesie mit Prilocain und Neostigmin. Anesth Analg 2002;95: 1419–1422.
- Sethi D, Wason R: Intravenöse Regionalanästhesie mit Lidocain und Neostigmin für Operationen an den oberen Extremitäten. J Clin Anesth 2010;22(5): 324–328.
- Singh R., Bhagwat A., Bhadoria P., Kohli A.: Forearm IVRA, Verwendung von 0.5 % Lidocain in einer Dosis von 1.5 mg/kg mit Ketorolac 0.15 mg/kg für Hand- und Handgelenkoperationen. Minerva Anestesiol 2010;76(2):109–114.
- Jones N, Pugh S: Die Zugabe von Tenoxicam zu Prilocain für die intravenöse Regionalanästhesie. Anästhesie 1996;51:446–448.
- Sertoz N, Kocaoglu N, Ayanoglu HO: Vergleich von Lornoxicam und Fentanyl bei Zugabe zu Lidocain in der intravenösen Regionalanästhesie. Rev Bras Anestesiol 2013;63(4):311–316.
- Yurtlu S, Hanci V, Kargi E, Erdogan G, et al.: Die analgetische Wirkung von Dexketoprofen bei Zusatz zu Lidocain zur intravenösen Regionalanästhesie: Eine prospektive, randomisierte, placebokontrollierte Studie. J Int Med Res 2011;39(5):1923–1931.
- Bengtsson A, Bengtsson M, Nilsson I, et al: Wirkungen der intravenösen regionalen Verabreichung von Methylprednisolon plus Mepivacain bei rheumatoider Arthritis. Scand J Rheumatol 1998;27:277–280.
- Taskaynatan M., Ozgul A., Tan A. et al.: Bier-Block mit Methylprednisolon und Lidocain bei CRPS Typ 1: Eine randomisierte, doppelblinde, placebokontrollierte Studie. Reg Anesth Pain Med 2004;29:408–412.
- Varitimidis SE, Papatheodorou LK, Dailiana ZH, Poultsides L, Malizos KN: Komplexes regionales Schmerzsyndrom Typ I als Folge eines Traumas oder einer Operation an der oberen Extremität: Behandlung mit intravenöser Regionalanästhesie unter Verwendung von Lidocain und Methylprednisolon. J Hand Surg Eur 2011;36(9):771–777.
- Sen H, Kulachi Y, Bicerer E, Ozkan S, Dagli G, Turan A: Die analgetische Wirkung von Paracetamol bei Zusatz zu Lidocain für die intravenöse Regionalanästhesie. Anesth Analg 2009;109(4):1327–1330.
- Ko MJ, Lee JH, Cheong SH, et al: Vergleich der Wirkungen von Paracetamol mit Ketorolac bei Zugabe zu Lidocain für die intravenöse Regionalanästhesie. Korean J Anesthesiol 2010;58(4):357–361.
- Sen S, Ugur B, Aydin ON, et al: Die analgetische Wirkung von Nitroglycerin, das Lidocain bei der intravenösen Regionalanästhesie zugesetzt wurde. Anesth Analg 2006;102(3):916–920.
- Lauretti GR, Perez MV, Reis MP, Pereira NL: Doppelblinde Bewertung von transdermalem Nitroglycerin als Adjuvans zu oralem Morphin zur Behandlung von Krebsschmerzen. J Clin Anesth 2002: 14: 83–86).
- Lauretti GR, de Olivera R, Reis MP, et al: Transdermales Nitroglycerin verstärkt die postoperative Analgesie von spinalem Sufentanil nach orthopädischen Eingriffen. Anesthesiology 1999;90:734–739.
- Ferreira SH, Lorenzette BB, Faccioli LH: Blockierung von Hyperalgesie und neurogenem Ödem durch topische Anwendung von NTG. Eur J Pharmacol 1992;217:207–209.
- Jaro K, Batra YK, Panda NB: Die Blockade des Plexus brachialis mit Midazolam und Bupivacain verbessert die Analgesie. Can J Anaesth 2005;52:822–826.
- Laig N, Khan MN, Arif M, Khan S: Midazolam mit Bupivacain zur Verbesserung der Analgesiequalität bei einer Blockade des Plexus brachialis bei Operationen an den oberen Extremitäten. J Coll Physicians Surg Pak 2008;18:674–678.
- Nishiyama T, Tamai H, Hanaoka K: Serum- und Liquorkonzentrationen von Midazolam nach epiduraler Verabreichung bei Hunden. Anesth Analg 2003;96:159–162.
- Bhisitkul RB, Villa JE, Kocsis JD: Axonale GABA-Rezeptoren sind selektiv in normalen und regenerierten sensorischen Fasern in peripheren Nerven der Ratte vorhanden. Exp Brain Res 1987: 66: 659–663.
- Brown DA, Marsh S: Axonale GABA-Rezeptoren in peripheren Nervenstämmen von Säugetieren. BrainRes 1978;156:187–191.
- Cairns BE, Sessle BJ, Hu JW: Die Aktivierung peripherer GABA-A-Rezeptoren hemmt die durch das Kiefergelenk hervorgerufene Kiefermuskelaktivität. J Neurophysiol 1999;81:1966–1969.
- Kontinen VK, Dickenson AH: Wirkungen von Midazolam im Modell der Spinalnervenligatur bei neuropathischen Schmerzen bei Ratten. Schmerz 2000;85:425–431.
- Farouk S, Aly AJ: Qualität der Lidocain-Analgesie mit und ohne Midazolam für die intravenöse Regionalanästhesie. J. Anesth 2010;24(6): 864–868.
- Kashefi P, Montazeri K, Honarmand A, Safavi M, Hosseini HM: Die analgetische Wirkung von Midazolam bei Zusatz zu Lidocain für die intravenöse Regionalanästhesie. J. Res. Med. Sci. 2011;16(9):1139–1148.
- Carlton SM, Hargett GL, Coggeshall RE: Lokalisierung und Aktivierung von Glutamatrezeptoren in ummyelinierten Axonen der kahlen Haut von Ratten. Neurosci Lett 1995;197:25–28.
- Brau ME, Sander F, Vogel W, Hempelmann G: Blocking-Mechanismen von Ketamin und seinen Enantiomeren in enzymatisch demyelinisierten peripheren Nerven, wie sie durch Einkanal-Experimente aufgezeigt wurden. Anesthesiology 1997;86:394–404.
- Viscomi CM, Friend C, Parker C, Murphy T, Yarnell M: Ketamin als Adjuvans bei der intravenösen Regionalanästhesie mit Lidocain: Eine randomisierte, doppelblinde, systemische Kontrollstudie. Reg Anesth Pain Med 2009;34(2): 130–133.
- Georgias NK, Maidatsi PG, Kyriakidis AM, et al: Clonidin versus Ketamin zur Verhinderung von Tourniquet-Schmerzen während der intravenösen Regionalanästhesie mit Lidocain. Reg Anesth Pain Med 2001;26(6):512–517.
- Livingstone J, Atkins R: Intravenöser regionaler Guanethidinblock bei der Behandlung des posttraumatischen komplexen regionalen Schmerzsyndroms 1 (Algodystrophie) der Hand. J Bone Joint Surg Br 2002;84:380–386.
- Ramamurthy S, Hoffman J: Intravenöses regionales Guanethidin bei der Behandlung von sympathischer Reflexdystrophie / Kausalgie. Eine randomisierte, doppelblinde Studie. Guanethidin-Studiengruppe. Anesth Analg 1995;81: 718–723.
- Hord A, Rooks M, Stephens B, et al: Intravenöses regionales Bretylium und Lidocain zur Behandlung der sympathischen Reflexdystrophie: Eine randomisierte, doppelblinde Studie. Anesth Analg 1992;74:818–821.
- Lee F., Shoemaker J., McQuillan P. et al.: Wirkungen des Unterarm-Bier-Blocks mit Bretylium auf die hämodynamischen und metabolischen Reaktionen auf den Handgriff. Am J Physiol Heart Circ 2000;279:H586–H593.
- Bader A, Concepcion M, Hurley R, et al: Vergleich von Lidocain und Prilocain für die intravenöse Regionalanästhesie. Anesthesiology 1988;69: 409–412.
- Tucker G, Boas R: Pharmakokinetische Aspekte der intravenösen Anästhesie. Anästhesiologie 1971;34:538–549.
- Ware R: Intravenöse Regionalanästhesie mit Bupivacain. Ein Doppelblindvergleich mit Lignocain. Anästhesie 1979;34:231–235.
- Smith C, Steinhaus J, Haynes C: Die Sicherheit und Wirksamkeit der intravenösen Regionalanästhesie. South Med J 1968;61:1057–1060.
- Guay J: Unerwünschte Ereignisse im Zusammenhang mit intravenöser Regionalanästhesie (Bier-Block): Eine systematische Überprüfung der Komplikationen. J Clin Anesth 2009;21: 585–594.
- Bartholomew K, Sloan J: Prilocaine für Biers Block: Wie sicher ist sicher? Arch Emerg Med 1990;7:189–195.
- Sukhani R, Garcia C, Munhall R, et al: Lidocain-Disposition nach intravenöser Regionalanästhesie mit verschiedenen Deflationstechniken Anesth Analg 1989;68:633–637.
- Mazze R, Dunbar R: Plasma-Lidocain-Konzentrationen nach kaudaler, lumbaler Epiduralanästhesie, Achselblock und intravenöser Regionalanästhesie. Anesthesiology 1966;27:574–579.
- Dunbar R, Mazze R: Intravenöse Regionalanästhesie: Erfahrung mit 779 Fällen. Anesth Analg 1967;46:806–813.
- Davies J, Walford A: Intravenöse Regionalanästhesie für die Fußchirurgie. Acta Anaesthesiol Scand 1986;30:145–147.
- Kim D, Shuman C, Sadr B: Intravenöse Regionalanästhesie für die ambulante Fuß- und Sprunggelenkschirurgie. Eine prospektive Studie. Orthopädie 1993:16; 1109–1113.
- Cotev S, Robin G: Experimentelle Studien zur intravenösen Regionalanästhesie mit radioaktivem Lignocain. Br. J. Anaesth 1966;38:936–940.
- Hargrove R, Hoyle J, Parker J: Lidocainspiegel im Blut nach intravenöser regionaler Analgesie. Anästhesie 1996;21:37–41.
- Larsen U, Hommelgaard P: Pneumatische Tourniquetparalyse nach intravenöser Regionalanästhesie. Anästhesie 1987;42:526–528.
- Shaw-Wilgis E: Beobachtungen zu den Auswirkungen der Tourniquet-Ischämie. J Bone Joint Surg 1971;1104:190.
- Mabee J, Bostwick T, Burke M: Iatrogenes Kompartmentsyndrom durch hypertone Kochsalzinjektion im Bier-Block. J Emerg Med 1994;12: 473-476.
- Quigley J, Popich G, Lanz U: Kompartmentsyndrom des Unterarms und der Hand: Ein Fallbericht. Clin Orthop 1981;161:247–251.
- Hastings H 2nd, Misamore G: Kompartmentsyndrom infolge intravenöser Regionalanästhesie. J Hand Surg 1987;12:559–562.
- Dominguez E: Belastendes Phantomgliedgefühl der oberen Extremität während intravenöser Regionalanästhesie. Reg Anesth Pain Med 2001;26:72–74.
- Luce E, Mangubat E: Verlust von Hand und Unterarm nach Bierblock: Ein Fallbericht. J Hand Surg 1983;8:280–283.
- Lee LA, Posner K, Domino KB, et al: Verletzungen im Zusammenhang mit Regionalanästhesie in den 1980er und 1990er Jahren. Eine geschlossene Schadensanalyse. Anesthesiology 2004;101:143–152.
- Kennedy B, Duthie A, Parbrook G, Carr T: Intravenöse Regionalanästhesie: Eine Bewertung. Br Med J 1965;5440:954–957.

