Colin JL McCartney und Stephen Choi
EINFÜHRUNG
Periphere Nervenblockaden bieten viele Vorteile für Patienten, einschließlich einer besseren Schmerzkontrolle und einer Verringerung der Nebenwirkungen im Zusammenhang mit der Vollnarkose. Um die Schmerzlinderung zu optimieren und gleichzeitig die Gesamtdosis des Lokalanästhetikums zu reduzieren, wäre es von Nutzen, ein Medikament hinzuzufügen, das sowohl das Einsetzen beschleunigt als auch die sensorische Blockade oder die analgetische Wirkung verlängert. Fortschritte in unserem Wissen über die Schmerzmechanismen des peripheren Nervensystems (PNS) ermöglichen es uns, Methoden zur Verlängerung der Analgesie zu entwickeln und gleichzeitig zentral und peripher vermittelte Nebenwirkungen zu reduzieren. In den letzten 20 Jahren wurde eine Reihe von Arzneimitteln getestet, und mehrere haben sich als klinisch nützlich erwiesen, wenn sie einem Lokalanästhetikum für eine periphere Nervenblockade hinzugefügt wurden oder wenn sie zur lokalen Infiltration oder intraartikulären Analgesie verwendet wurden. Diese Medikamente sind als analgetische Adjuvantien bekannt. Dieses Kapitel untersucht die Gründe und die aktuelle Evidenzbasis für die Verwendung analgetischer Adjuvantien und fasst die besten Strategien zur Optimierung der Schmerzkontrolle und Reduzierung von Nebenwirkungen nach Operationen unter peripherer Nervenblockade, lokaler Infiltration oder Injektion von Medikamenten in den intraartikulären Raum zusammen.
BEGRÜNDUNG FÜR DEN GEBRAUCH
Die Schmerzübertragung im ZNS und PNS umfasst eine komplexe Reihe von Neurotransmittern und Signalwegen, die nicht einfach durch einen Arzneimitteltyp oder eine Technik allein blockiert werden können. Die Beteiligung mehrerer Klassen von Neurotransmittern an der Verletzungsstelle, am peripheren Nerv, am Hinterhorn des Rückenmarks und an supraspinalen Stellen ist für die Übertragung der Nozizeption verantwortlich. Die Verwendung von Agonisten an inhibitorischen Rezeptoren und Antagonisten an exzitatorischen Rezeptoren ermöglicht einen „multimodalen“ Ansatz mit Optimierung der Schmerzkontrolle und Verringerung von Nebenwirkungen. Im Jahr 1645 schlug Descartes einen Mechanismus zur Schmerzübertragung vor, der darauf hindeutet, dass ein peripherer Schmerzimpuls durch ein „fest verdrahtetes“ System ohne zwischengeschaltete Modulation direkt von der Peripherie zum Gehirn übertragen wird (Figure 1).
Diese Theorie der Schmerzübertragung wurde bis vor 40 Jahren allgemein als wahr angesehen. 1965 schlugen Melzack und Wall ihre bahnbrechende Gate-Control-Theorie des Schmerzes vor, die darauf hindeutete, dass Schmerz an einer Reihe von Punkten im Schmerzweg moduliert oder „gated“ werden könnte. Nachfolgende Forschungen identifizierten das Dorsalhorn (Lamina II) des Rückenmarks als einen wichtigen Ort möglicher Modulation, und nachfolgende Behandlungen für akute und chronische Schmerzen haben dieses Wissen mit guter Wirkung genutzt. Behandlungen wie die Verwendung von spinalen Opioiden und transkutane elektrische Nervenstimulation (TENS) wurden im Lichte dieses Wissens entwickelt. Die Gate-Theorie veränderte auch viele (oftmals erfolglose) Schmerzbehandlungsstrategien von Techniken, bei denen wir versuchten, Schmerzwege entweder chemisch oder chirurgisch abzutragen, zu neueren Modulationstechniken, mit denen wir versuchen, erregende Einflüsse zu hemmen und hemmende Einflüsse innerhalb des Schmerzwegs zu verstärken. In den letzten Jahrzehnten wurden auch wichtige Fortschritte in unserem Wissen darüber erzielt, wie Schmerz erzeugt und vom PNS an das Zentralnervensystem (ZNS) übertragen wird. An der Schmerzmodulation im PNS sind auch zahlreiche Transmitter und Mechanismen beteiligt, die nozizeptive Bahnen sowohl anregen als auch hemmen. Im PNS werden unter normalen physiologischen Bedingungen nozizeptive Signale erzeugt, wenn A-α- und C-Fasern durch Hitze, Druck oder verschiedene Chemikalien stimuliert werden, die durch Gewebeschäden und Entzündungen entstehen (Kalium, Histamin, Bradykinin, Prostaglandine, Adenosintriphosphat [ATP]). . Nozizeptive Signale werden an die oberflächlichen Schichten der Lamina II des Hinterhorns im Rückenmark weitergeleitet, wo sie sowohl auf präsynaptischer als auch auf postsynaptischer Ebene sowie durch erregende und hemmende absteigende Kontrollbahnen aus dem Hirnstamm moduliert werden (Figure 2). Signale, die dieses Tor erfolgreich passieren, wandern weiter zum Hirnstamm und Thalamus, bevor sie die Großhirnrinde erreichen, um einen Schmerzreiz zu erzeugen. Chemische Mediatoren in einer breiten Palette werden im PNS produziert und haben sowohl erregende als auch hemmende Einflüsse auf die Übertragung peripherer sensorischer Nerven sowohl in der akuten als auch in der chronischen Phase der Verletzung (Figure 3). Diese können den Nerv direkt aktivieren (ATP, Glutamat, 5-Hydroxytryptamin [5-HT], Histamin, Bradykinin); verstärken die Depolarisation durch Sensibilisierung des Nervs für andere Stimuli (Prostaglandine, Prostacyclin und Zytokine wie Interleukine); oder eine regulatorische Rolle für das sensorische Neuron, Entzündungszellen und sympathische Fasern (Bradykinin, Tachykinin und Nervenwachstumsfaktor) übernehmen.
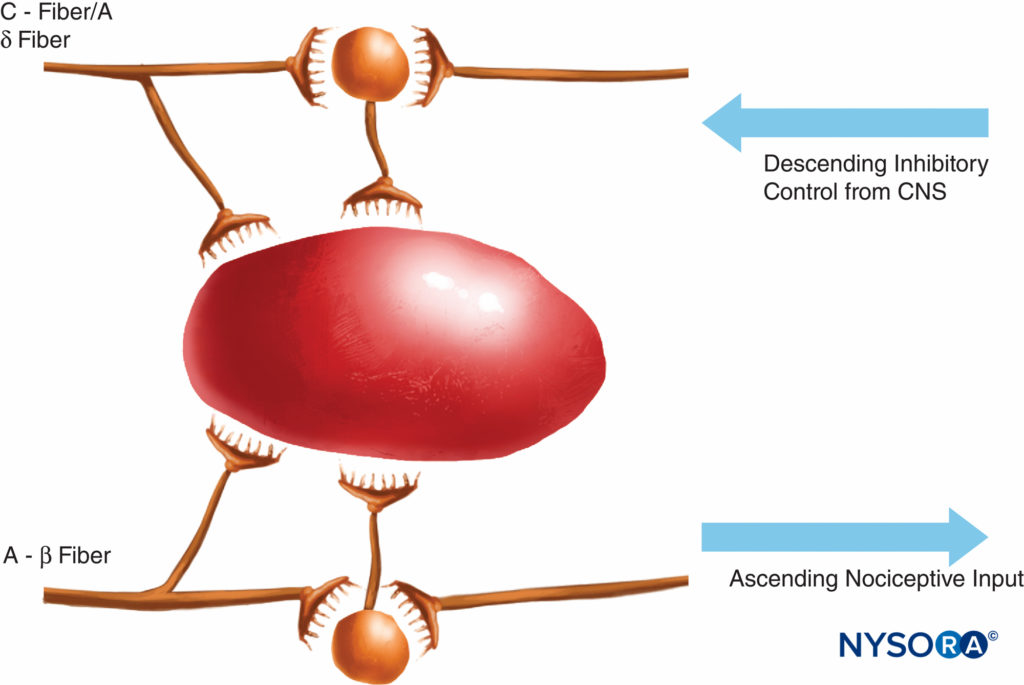
ABBILDUNG 2. Die Gate-Theorie schlug vor, dass kleine (C) Fasern Erregungssysteme (schwarzes Neuron) aktivierten, die anschließend Ausgangszellen erregten; die Aktivität dieser letzteren Zellen wurde durch das Gleichgewicht von durch große Fasern (A-β) vermittelten Hemmungen (vermittelt durch endogene Opioide) und auch durch absteigende Kontrollsysteme aus dem Zentralnervensystem (vermittelt durch Norepinephrin und Serotonin) kontrolliert.
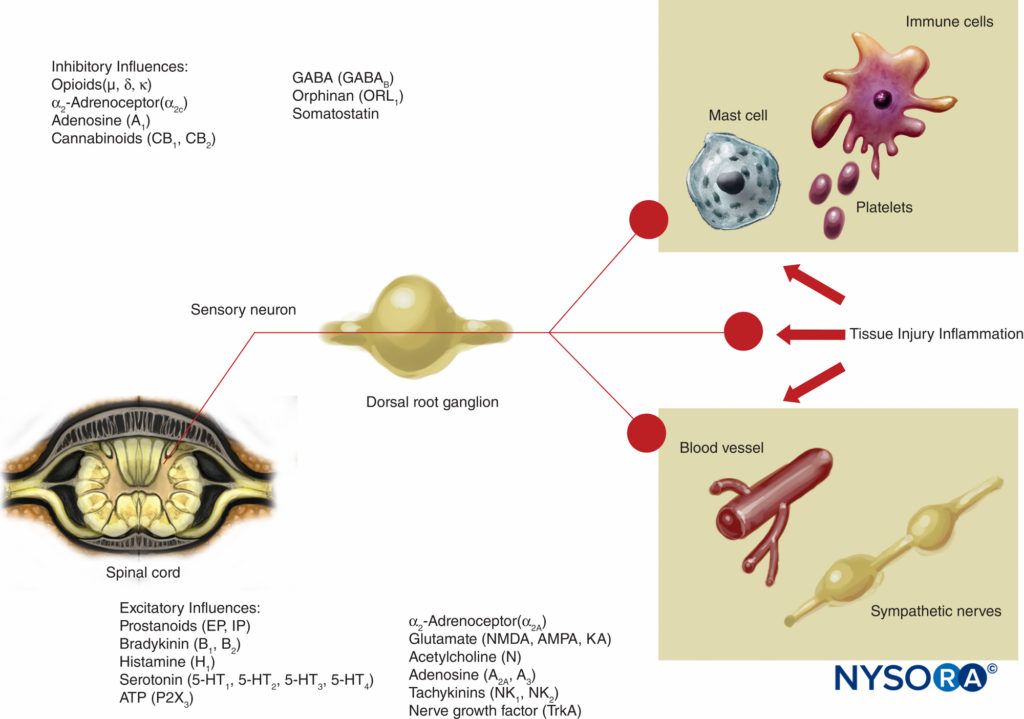
ABBILDUNG 3. Erregende und hemmende Einflüsse auf die periphere Nervenaktivität durch Mediatoren, die durch Gewebeverletzungen und Entzündungen freigesetzt werden, und durch eine Vielzahl von Wirkstoffen, die auf Neurorezeptoren einwirken. AMPA = α-Amino-3-hydroxy-5-methylisoxazol-4-propionsäure; KA = Kainsäure; NMDA = N-Methyl-d-aspartat; NK = Neurokinin; TrkA = Tropomyosin-Rezeptorkinase A.
BEGRÜNDUNG FÜR DIE VERWENDUNG VON ANALGETISCHEN ADJUVANTEN
Wie bereits erwähnt, umfasst die Schmerzübertragung im ZNS und PNS eine komplexe Reihe von Neurotransmittern und Signalwegen, die nicht einfach durch einen Arzneimitteltyp oder eine Technik allein blockiert werden können. Eine Reihe von Medikamenten im Arsenal des Anästhesisten, darunter Opioide, nichtsteroidale Antirheumatika (NSAIDs), α2-Agonisten, Dexamethason und N-Methylaspartat (NMDA)-Antagonisten, wirken an diesen Wirkorten und können von Nutzen sein, wenn im PNS angewendet. Wichtig ist, dass keine Neurotoxizität bei klinisch relevanten Konzentrationen gezeigt wurde.
Dieses Wissen kann dem Regionalanästhesisten in vielerlei Hinsicht helfen:
- Bei der Auswahl von Adjuvantien zu Lokalanästhetika, um den Wirkungseintritt zu beschleunigen, die Wirkung zu verlängern und die erforderliche Gesamtdosis zu reduzieren.
- Schlagen Sie Wirkstoffe vor, die die postoperative Analgesie verbessern können, ohne die Nebenwirkungen von Lokalanästhetika zu verlängern.
- Schlagen Sie Wirkstoffe vor, die überwiegend an peripheren Stellen ohne zentrale Wirkungen wirken, wodurch die Analgesie optimiert und gleichzeitig ZNS-Nebenwirkungen minimiert werden.
OPIOIDE ANALGETIKA
Während einer Entzündung werden Opioidrezeptoren in peripheren Sinnesfasern und Immunzellen exprimiert; Darüber hinaus werden endogene Opioide aus diesen Zellen freigesetzt und gleichen den durch Entzündungen hervorgerufenen erhöhten nozizeptiven Zustand aus. Eine zunehmende Zahl von Arbeiten deutet auf eine enge Beziehung zwischen endogenen Opioiden und dem Immunsystem hin. Christoph Stein und Kollegen in Berlin haben eine Reihe bahnbrechender Studien durchgeführt, die die Fähigkeit des Immunsystems beschrieben, endogene Opioide abzugeben, und die Fähigkeit von Entzündungen, die Bewegung von Opioidrezeptoren zur Verletzungsstelle zu stimulieren, wodurch eine Antinozizeption ermöglicht wird. Diese Veränderungen treten jedoch nicht unmittelbar nach der Verletzung auf und können bis zu 96 Stunden dauern. Opioidrezeptoren und Neuropeptide (z. B. Substanz P) werden im Spinalganglion synthetisiert und entlang intraaxonaler Mikrotubuli in zentrale und periphere Fortsätze des primär afferenten Neurons transportiert (Figure 4). An den Enden werden Opioidrezeptoren in die neuronale Membran eingebaut und werden zu funktionellen Rezeptoren. Bei Aktivierung durch exogene oder endogene Opioide (freigesetzt von Immunzellen) koppeln Opioidrezeptoren an hemmende G-Proteine. Dies führt zu einer direkten oder indirekten (durch Verringerung des zyklischen Adenosinmonophosphats) Unterdrückung von Ca2+- oder Na+-Strömen und einer anschließenden Abschwächung der Freisetzung von Substanz P.
Die Permeabilität des Perineuriums wird in entzündetem Gewebe erhöht, wodurch die Fähigkeit von Opioiden verbessert wird, Zielrezeptoren zu erreichen. Zahlreiche Studien haben Opioide im PNS entweder auf periphere Nerven oder den intraartikulären Raum angewendet. Obwohl viele Studien einen analgetischen Nutzen von peripher applizierten Opioiden behaupteten, schlossen nur wenige Studien eine Kontrollgruppe mit einem systemisch applizierten Opioid zum Vergleich ein. Ohne Einbeziehung einer Kontrolle ist es unmöglich zu interpretieren, ob das periphere Opioid eine echte periphere Wirkung hat oder stattdessen zum ZNS getragen wird, um Analgesie zu induzieren. Eine echte peripher vermittelte Opioid-Analgesie kann vorteilhaft sein, wenn dies im Vergleich zur systemischen Verabreichung mit einer verbesserten Analgesie oder geringeren Nebenwirkungen einhergeht. Wenn die Wirkung zentral vermittelt wird, gibt es keinen klaren Vorteil gegenüber der systemischen Verabreichung.
Perineurale Opioide
Auf primären afferenten Fasern identifizierte Opioidrezeptoren werden vom Spinalganglion zum Ort der Entzündung transportiert; während sie jedoch einem axonalen Transport unterzogen werden, können sie von Opioid-Agonisten nicht leicht erreicht werden. Dies könnte den Grund dafür erklären, dass zwei neuere systematische Reviews, die 1997 und 2000 veröffentlicht wurden, wenig Beweise für den Nutzen der Zugabe von Opioiden zu Lokalanästhetika bei peripherer Nervenblockade fanden. Eine aktualisierte Tabelle mit Studien zur Untersuchung der perineuronalen Verabreichung von Opioiden (mit Ausnahme von Buprenorphin und Tramadol) zeigt, dass der analgetische Nutzen nicht eindeutig ist (Tabelle 1). Darüber hinaus überprüften Peng und Choyce die Verwendung von Opioiden in der intravenösen Regionalanästhesie (IVRA) mit ähnlichen enttäuschenden Schlussfolgerungen.
TABELLE 1. Ergebnisse von Studien zur Untersuchung der Wirkung von perineuronalen/perineuralen Opioiden (ausgenommen Tramadol und Buprenorphin).
| Gesamtstudien | Gesamtergebnisse | Systemische Kontrollergebnisse |
|---|---|---|
| 19 Umfragen | 10 unterstützend | 7 systemische Kontrolle: 5 unterstützend; 2 negativ |
| 9 negativ | 12 keine systemische Kontrolle: 5 unterstützend; 7 negativ. |
Trotz dieser enttäuschenden Ergebnisse sind Buprenorphin und Tramadol die beiden Opioid-Agonisten, die bei perineuronaler Verabreichung analgetische Wirksamkeit gezeigt haben. Buprenorphin ist ein partieller µ-Rezeptoragonist mit sehr hoher Rezeptoraffinität im Vergleich zu Fentanyl (24-fach) oder Morphin (50-fach). Darüber hinaus hat es eine mittlere Lipidlöslichkeit, die es ihm ermöglicht, die neurale Membran zu durchqueren. Candido und Kollegen fügten 0.3 mg Buprenorphin (ein partieller Opioidagonist) zu einer Kombination aus Mepivacain und Tetracain bei einer axillären Blockade hinzu und stellten eine fast 100%ige Verlängerung der Dauer der Analgesie im Vergleich zur Verabreichung einer axillären Blockade plus der gleichen Dosis von intramuskulärem Buprenorphin fest keine signifikante Zunahme der Nebenwirkungen. Dies unterstützt die periphere analgetische Wirkung von Buprenorphin und die früheren Ergebnisse von zwei Studien, die Buprenorphin ohne eine systemische Kontrollgruppe untersuchten. Studien zu Buprenorphin werden ausführlicher dargestellt in Tabelle 2.
TABELLE 2. Studien zur Untersuchung von Buprenorphin als analgetisches Adjuvans mit Lokalanästhetika.
| Autor/Datum | Patienten/ Gruppen | Blocktyp | dosieren | Lokale Betäubung | Systemisch Control | Die Ergebnisse |
|---|---|---|---|---|---|---|
| Viel 1989 | 20/2 | Supraklavikulär | 3 µg/kg | Bupivacain 0.5 % 40 ml | Nein | Verlängerte Analgesie im Vergleich zur Morphingruppe (35 vs. 18.25 h); kein Unterschied in der sensorischen Blockade. |
| Bazin 1997 | 89/4 | Supraklavikulär | 3 μg/kg | Bupivacain 0.5 % Lidocain 1% | Nein | Verlängerte Analgesie im Vergleich zur Kontrollgruppe (20 vs. 11.5 h) |
| Candido 2001 | 40/2 | Supraklavikulär | 0.3 mg | Mepivacain 1% Tetracain 0.2 % | Nein | Verlängerte Analgesie im Vergleich zur Kontrollgruppe (17.4 vs. 5.3 h) |
| Candido 2002 | 60/3 | Achsel | 0.3 mg | Mepivacain 1% | Ja | Die mittlere Dauer der postoperativen Analgesie betrug 22.3 h in der Achselhöhlengruppe gegenüber 12.5 h in der IM-Gruppe und 6.6 h in der Placebogruppe. |
| Tetracain 0.2 % | IM |
Tramadol ist ein schwacher Opioid-Agonist mit einer gewissen Selektivität für den µ-Rezeptor, der auch die Wiederaufnahme von Norepinephrin hemmt und die Freisetzung von Serotonin im intrathekalen Raum stimuliert. Noradrenalin und Serotonin sind Botenstoffe für die absteigende Kontrollbahn im Rückenmark und verstärken die Analgesie. Kapral und Mitarbeiter verwendeten eine 100-mg-Dosis Tramadol als Adjuvans zu Mepivacain bei einer Blockade des axillären Plexus brachialis. Sie teilten 60 Patienten in drei Gruppen ein: Eine Gruppe erhielt 1 % Mepivacain mit 2 ml Kochsalzlösung, die zweite Gruppe erhielt 1 % Mepivacain mit 100 mg Tramadol und die dritte Gruppe erhielt 1 % Mepivacain mit 2 ml Kochsalzlösung und 100 mg Tramadol intravenös. Diese Studie zeigte eine verlängerte Dauer der motorischen und sensorischen Blockade in der axillären Tramadol-Gruppe, die signifikant (p < 01) sowohl eine intravenöse als auch eine Placebo-Gruppe überdauerte. Robaux und Kollegen führten anschließend eine Dosis-Wirkungs-Studie mit Placebo und 40-, 100- und 200-mg-Dosen von Tramadol durch, die zu einer festen Dosis von 1.5 % Mepivacain bei einer Achselblockade hinzugefügt wurden, und stellten fest, dass die 200-mg-Dosis die beste Analgesie lieferte ohne erhöhte Nebenwirkungen. Alemanno und Kollegen verwendeten eine 1.5-mg/kg-Dosis Tramadol als Adjuvans zu 0.5 % Levobupivacain (0.5 ml/kg) für die interskalenäre Blockade. Dabei wurden 120 Patienten in drei Gruppen eingeteilt: Eine Gruppe erhielt nur eine Lokalanästhesie, die zweite Gruppe eine Lokalanästhesie mit systemischem Tramadol und die dritte Gruppe eine Lokalanästhesie mit perineuralem Tramadol. Während beide Gruppen, die Tramadol erhielten, im Vergleich zu Placebo eine verlängerte Analgesie aufwiesen, erlebte die Gruppe, die perineurales Tramadol erhielt, eine verlängerte Analgesie im Vergleich zu systemischem Tramadol (14.5 vs. 10.1 Stunden; p < 001).
Intraartikuläre Opioide und andere periphere Verabreichungswege
Opioid-Agonisten, die in entzündetes Gewebe verabreicht werden, binden an Opioid-Rezeptoren an sensorischen Endigungen und induzieren Analgesie. Tierstudien zeigten, dass diese peripheren Opioidrezeptoren 96 Stunden nach der anfänglichen entzündlichen Verletzung exprimiert werden. Die intraartikuläre Verabreichung von Opioiden führt daher nur bei Patienten mit vorbestehender Entzündung zu Analgesie. Kalso und Mitarbeiter untersuchten 1997 systematisch die Rolle von intraartikulären Opioiden und stellten fest, dass es Beweise für einen anhaltenden Nutzen von intraartikulärem Morphin ohne signifikante Nebenwirkungen bei Dosen von 1 bis 5 mg gab. Es wurde keine Dosisreaktion festgestellt. Neuere Artikel unterstützten diesen Befund und zeigten den Nutzen von intraartikulärem Morphin, Tramadol, Buprenorphin und Sufentanil. Eine systematische Überprüfung der Wirkungen von intraartikulärem Morphin zeigte jedoch nur eine leichte analgetische Wirkung [visuelle Analogskala für Schmerzen (VAS) 12–17 mm Reduktion], konnte jedoch nicht ausschließen, dass die Wirkung durch systemische Absorption vermittelt wurde.
ALPHA2-AGONISTEN UND CLONIDIN
Clonidin ist ein α2-Agonist mit einigen α1-stimulierenden Wirkungen. Es wird traditionell als blutdrucksenkendes Mittel verwendet und hat seit vielen Jahren sedierende und analgetische Wirkungen. Kürzlich wurde festgestellt, dass α2-Rezeptoren im Hinterhorn des Rückenmarks vorhanden sind und die Stimulation dieser Rezeptoren analgetische Wirkungen erzeugt, indem sie die präsynaptische Freisetzung von exzitatorischen Transmittern, einschließlich Substanz P und Glutamat, hemmt. Intrathekales Clonidin vermittelt eine Analgesie, indem es die Acetylcholinspiegel erhöht, was wiederum die Muskarinrezeptoren stimuliert. Muscarinische Erregung erhöht die γ-Aminobuttersäurespiegel auf der primären afferenten Faser und hemmt die Freisetzung des exzitatorischen Neurotransmitters Glutamat. Clonidin, das mit oder ohne Lokalanästhetika in die Nähe von peripheren Nerven injiziert wird, scheint auf verschiedene Weise Analgesie zu vermitteln. Clonidin hat lokalanästhetische Eigenschaften und tonisch gehemmte zusammengesetzte Aktionspotentiale von C-Fasern, die größer sind als die A-α-Fasern im Ischiasnerv der Ratte, und war in seiner Fähigkeit, C-Fasern im Vagusnerv von Kaninchen zu hemmen, mit Lidocain vergleichbar. Clonidin hat auch eine pharmakokinetische Wirkung auf die Umverteilung von Lokalanästhetika, die durch eine vasokonstriktorische Wirkung am α1-Rezeptor vermittelt wird. Neuere Tiermodelle haben gezeigt und frühere Arbeiten unterstützt, dass Clonidin hauptsächlich die periphere Nervenblockade durch hyperpolarisationsaktivierten kationischen Strom erleichtert und dass diese Wirkung unabhängig von jeglicher Vasokonstriktorwirkung ist. Eine neuere Ergänzung der Auswahl an α2-Agonisten ist Dexmedetomidin, das für den α2-Rezeptor selektiv ist und derzeit hauptsächlich als Sedativum auf Intensivstationen untersucht wird. Es ist zu erwarten, dass Dexmedetomidin aufgrund der Selektivität der Wirkung nicht nur eine stärkere Analgesie, sondern auch größere Nebenwirkungen hervorruft. Die Stimulation des α2-Rezeptors führt bei höheren Dosen zu Hypotonie, Bradykardie und Sedierung, und diese Wirkungen können alle analgetischen Vorteile überwiegen, die durch die Verwendung dieser Mittel erzielt werden.
Perneuronale Anwendung
Inzwischen haben über 30 Studien am Menschen die Wirkung von Clonidin auf Lokalanästhetika bei peripherer Nervenblockade untersucht. Es gibt gute Hinweise aus diesen Studien, dass Clonidin in Dosen von bis zu 1.5 µg/kg die sensorische Blockade und Analgesie verlängert, wenn es zusammen mit Lokalanästhetika zur peripheren Nervenblockade verabreicht wird. Dies unterstützt die frühe Meinung von Murphy und Kollegen, dass Clonidin ein nützliches Adjuvans ist, wenn es zu einer peripheren Nervenblockade hinzugefügt wird, und dass die Wirkung höchstwahrscheinlich im PNS vermittelt wird. Obwohl eine Reihe von Studien die Wirkung von Clonidin als Zusatz zur peripheren Nervenblockade untersucht haben, haben nur wenige eine systemische Wirkung kontrolliert. Singelyn und Mitarbeiter untersuchten 30 Patienten, die eine Blockade des axillären Plexus brachialis mit 40 ml 1 % Mepivacain plus Epinephrin 5 µg/ml erhielten. Die Patienten wurden in drei Gruppen randomisiert und erhielten (1) Lokalanästhetikum allein, (2) Lokalanästhetikum plus 150 µg Clonidin, subkutan verabreicht, oder (3) 150 µg Clonidin in der Plexus-brachialis-Blockade mit Lokalanästhetikum. Clonidin, das der Blockade des axillären Plexus brachialis hinzugefügt wurde, verzögerte das Einsetzen von Schmerzen um das Zweifache, ohne Nebenwirkungen im Vergleich zur systemischen Kontrolle. Hutschala und Mitarbeiter haben kürzlich die periphere analgetische Wirkung von Clonidin bei Freiwilligen demonstriert, wenn es zu einer Blockade des Plexus brachialis mit 0.25 % Bupivacain hinzugefügt wurde.
Andere neuere Studien zeigten jedoch keinen Gesamtnutzen der Zugabe von Clonidin zu langwirksamen Lokalanästhetika wie Bupivacain und Ropivacain. Kürzlich schätzte eine Metaanalyse von Popping und Kollegen, dass Clonidin die postoperative Analgesie, sensorische Blockade und motorische Blockade um 122, 74 bzw. 141 Minuten verlängerte. Clonidin erhöhte jedoch auch die Wahrscheinlichkeit von Hypotonie (Odds Ratio [OR] 3.61), Ohnmacht (OR 5.07), Sedierung (OR 2.28) und Bradykardie (OR 3.09). Zwischen 30 und 300 µg wurde keine Dosiswirkung beobachtet, wobei die Mehrheit 150 µg erhielt. Die Zugabe von Clonidin zu kontinuierlichen peripheren Nervenblockaden ist nicht vorteilhaft. Ilfeld und Kollegen haben in zwei Studien gezeigt, dass sowohl 0.1 als auch 0.2 µg/ml Clonidin, das einer kontinuierlichen Infusion von 0.2 % Ropivacain zugesetzt wurde, die Schmerzwerte oder die Einnahme oraler Analgetika nach Operationen an den oberen Extremitäten nicht reduzierte. Dexmedetomidin erzeugt, wie zuvor postuliert, tatsächlich eine stärkere Wirkung auf die Analgesie, wenn es in Verbindung mit Lokalanästhetika perineural angewendet wird. Vier Studien haben dies kürzlich untersucht, und eine Metaanalyse legte nahe, dass Dexmedetomidin die analgetische Wirkung von Plexus-Brachialblockaden um 284 Minuten verlängert. Interessanterweise scheint dies trotz anfänglicher Bedenken, dass Dexmedetomidin größere hämodynamische Wirkungen als Clonidin haben könnte, nicht der Fall zu sein.
Intravenöse Regionalanästhesie
Die intravenöse Regionalanästhesie ist eine nützliche, einfache Technik der Regionalanästhesie, insbesondere für kleinere periphere Eingriffe an den oberen Extremitäten, die durch Tourniquet-Toleranz und schlechte postoperative Analgesie eingeschränkt sind. In einer Reihe von Studien wurde gezeigt, dass Clonidin die Wirkungszeit und die intraoperative Tourniquet-Toleranz verbessert. Nur eine Studie hat eine verbesserte postoperative Analgesie in der frühen postoperativen Phase im Vergleich zu Placebo gezeigt. Reuben und Mitarbeiter randomisierten 45 Patienten auf 40 ml 0.5 % Lidocain mit Clonidin 1 µg/kg, Lidocain allein mit intravenösem Clonidin und Lidocain allein mit intravenöser Kochsalzlösung. Patienten, denen Clonidin mit Lidocain verabreicht wurde, hatten signifikant weniger Schmerzen und verlangten weniger Analgetika als Patienten in den anderen beiden Gruppen. Höhere Dosen von Clonidin (150 µg) erzeugten signifikant mehr Sedierung und Auftreten von Hypotonie. Bisher hat nur eine Studie Dexmedetomidin bei IVRA verwendet. Memis und Kollegen fügten 0.5 µg/kg Dexmedetomidin zu 0.5 % Lidocain hinzu und zeigten im Vergleich zu Placebo eine Verringerung der Wirkungszeit und eine Verbesserung der postoperativen Analgesie ohne signifikante Nebenwirkungen.
Intraartikuläre Techniken
Die intraartikuläre Wirkung von Clonidin wurde bei Verabreichung mit und ohne Lokalanästhetikum untersucht und es wurde festgestellt, dass es positive Auswirkungen auf die postoperative Analgesie hat. Bei Zugabe von Morphin und Clonidin ist mit additiven Wirkungen zu rechnen. Zwei Studien sind dieser Frage nachgegangen, wobei die eine eine verbesserte Analgesie und die andere keinen Unterschied nachweisen konnte. Präklinische Studien haben gezeigt, dass Clonidin-vermittelte Analgesie, ähnlich wie bei Opioiden, durch Entzündungen verstärkt wird, obwohl der Mechanismus derzeit nicht offensichtlich ist.
DEXAMETHASON
Dexamethason ist ein potentes synthetisches Corticosteroid mit einer etwa siebenmal höheren entzündungshemmenden Potenz als Prednisolon und sehr geringer mineralocorticoider Aktivität. Die Halbwertszeit beträgt etwa 36 bis 54 Stunden im perioperativen Setting. Die Wirksamkeit von Dexamethason als postoperatives Antiemetikum (4 bis 10 mg intravenös) wurde durch über 60 randomisierte kontrollierte Studien bestätigt, wobei eine aktuelle Metaanalyse eine OR von 0.31 und eine NNT von 3.7 schätzt. Aufgrund seiner systemischen entzündungshemmenden Eigenschaften wurden die analgetischen Wirkungen einer präoperativen intravenösen Einzeldosis von Dexamethason in über 24 randomisierten Studien mit moderaten Wirkungen von bis zu 24 Stunden untersucht. Diese 2011 veröffentlichte Metaanalyse umfasste 2751 Patienten und schätzte, dass die Scores der verbalen Schmerzskala (VRS) bis zu 0.64 Stunden nach der Verabreichung von Dexamethason auf maximal 24 Punkte reduziert wurden. Vor diesen Übersichten ergaben In-vitro- und Mausstudien der spezifischen pharmakologischen Wirkung von Dexamethason mehrere neue Anwendungen zusätzlich zur systemischen Verabreichung.
Perineurale Anwendung
Es wird angenommen, dass perineurale Kortikosteroide ihre Wirkung über mehrere Mechanismen ausüben, darunter die Abschwächung der Freisetzung von Entzündungsmediatoren, die Verringerung der ektopischen neuronalen Entladung und die Hemmung der durch den Kaliumkanal vermittelten Entladung von nozizeptiven C-Fasern. Es wird allgemein angenommen, dass Dexamethason die Qualität und Dauer der peripheren Nervenblockade verbessert, wenn es in Verbindung mit Lokalanästhetika verabreicht wird. Die US Food and Drug Administration (FDA) (oder jede andere Aufsichtsbehörde) genehmigt Dexamethason jedoch nicht für die perineurale Verabreichung. Nichtsdestotrotz haben mehrere Studien die Wirkungen der Kombination von Dexamethason (4 bis 10 mg) mit einem Lokalanästhetikum bei peripheren Nervenblockaden untersucht. Periphere Nervenblockaden der oberen und unteren Extremitäten, die mit Dexamethason durchgeführt wurden, zeigten eine Verlängerung der Analgesie oder sensorischen/motorischen Blockade im Bereich von etwa 50 % bis 75 % über die hinaus, die mit Lokalanästhetikum allein durchgeführt wurde. Bisher hat nur eine Studie perineurales mit systemischem Dexamethason im Zusammenhang mit peripheren Nervenblockaden verglichen. Diese Studie randomisierte die Patienten für eine interskalenäre Plexus-brachialis-Blockade mit Placebo oder 8 mg perineuralem oder systemischem Dexamethason. Die Autoren zeigten eine Blockverlängerung in beiden Dexamethason-Gruppen von 12 Stunden auf etwa 20 bzw. 22 Stunden für die systemische bzw. perineurale Verabreichung und kamen zu dem Schluss, dass die systemische und die perineurale Dexamethason-Verabreichung gleichwertig waren. Weitere Studien zum Vergleich der Wirkungen von perineuralem und systemischem Dexamethason sind erforderlich, bevor endgültige Schlussfolgerungen gezogen werden können. Bedenken hinsichtlich Komplikationen im Zusammenhang mit Dexamethason, wie z. B. Auswirkungen auf den Blutzucker und Neurotoxizität durch das in Mehrdosenfläschchen verwendete Konservierungsmittel, sind in der Praxis nicht aufgetreten. Insbesondere eine Einzeldosis Dexamethason, ob perineural oder systemisch verabreicht, erhöhte den Blutzucker nicht in einem klinisch signifikanten Ausmaß. Studien an Mäusen mit Natriumbisulfit zeigten keine Neurotoxizität bei intrathekaler Verabreichung.
Intravenöse Regionalanästhesie
Bigat und Kollegen untersuchten in einer randomisierten Studie die Auswirkungen der Zugabe von Dexamethason zu Lidocain IVRA. 8 Patienten wurden randomisiert Lidocain mit Placebo, 8 mg Dexamethason mit Lidocain oder XNUMX mg systemisches Dexamethason zugeteilt. In dieser Studie übte systemisches Dexamethason keine Wirkung auf die Wirksamkeit von IVRA aus, während Lidocain plus Dexamethason verbesserte Blockierungseigenschaften zeigte.
N-METHYL-ASPARTAT-REZEPTOR-ANTAGONISTEN
Innerhalb des Hinterhorns des Rückenmarks sind sowohl ionotropes [N-Methyl- -aspartat (NMDA)], α-Amino-3-hydroxy-5-methylisoxazol-4-propionsäure (AMPA), Kainsäure (KA) als auch metabotrop Glutamatrezeptoren sind an der nozizeptiven Signalübertragung und zentralen Sensibilisierung bei chronischen Schmerzzuständen beteiligt. Kürzlich wurden mehrere Glutamatrezeptoren in peripheren Nervenenden gefunden und können zur peripheren Schmerzsignalisierung beitragen. Die Injektion des NMDA-Rezeptoragonisten Glutamat in den Massetermuskel erzeugt sowohl bei Ratten als auch bei Menschen Schmerzen. Die anschließende Injektion von NMDA-Rezeptorantagonisten wie Ketamin und Dextromethorphan lindert den Schmerz.
Eine Reihe von Studien hat die Wirkung von NMDA-Antagonisten bei der Herbeiführung einer peripher vermittelten Analgesie bei Patienten untersucht. Tverskoy und Kollegen infiltrierten Bupivacain mit 0.3 % Ketamin oder Placebo für Patienten mit Leistenbruch und stellten fest, dass Ketamin die anästhetische und analgetische Wirkung eines Lokalanästhetikums, das zur Infiltrationsanästhesie verabreicht wurde, signifikant verstärkte. Ketamin wurde als einziges Anästhetikum bei IVRA verwendet, aber die Patienten litten unter übermäßigen nachteiligen Auswirkungen auf die Deflation des Tourniquets. Andere Arbeiter haben Lidocain für IVRA mit Ketamin (0.1 mg/ml) oder Clonidin (1 µg/kg) versetzt. Patienten in der Ketamingruppe hatten die beste Schmerzkontrolle, obwohl sowohl Clonidin als auch Ketamin den Analgetikaverbrauch im Vergleich zu Lidocain allein signifikant reduzierten, mit leichten psychomimetischen Nebenwirkungen in der Ketamingruppe. Zwei Studien haben die Anwendung von intraartikulärem Ketamin untersucht. Dal und Mitarbeiter randomisierten Patienten für intraartikuläres Ketamin (0.5 mg/kg), Neostigmin, Bupivacain oder Placebo. Patienten, die alle drei Medikamente erhielten, zeigten ähnliche Verbesserungen der Analgesie bei Kniebeugung im Vergleich zu Placebo; die Ketamin-Gruppe hatte jedoch die längste Dauer der Analgesie. Brill und Kollegen führten eine Dosis-Wirkungs-Studie mit bis zu 1 mg/kg intraartikulärem Ketamin nach einer Kniearthroskopie durch und stellten fest, dass der analgetische Nutzen im Vergleich zu Placebo nur in der ersten Stunde nach der Operation eintrat. Magnesium hat NMDA-blockierende Wirkungen und blockiert den Ionenkanal am NMDA-Rezeptor während normaler physiologischer Zustände. Anhaltender nozizeptiver Input im Hinterhorn des Rückenmarks entfernt Magnesium, was den Kalziumeinstrom und intrazelluläre Veränderungen ermöglicht, die zu anhaltenden Schmerzzuständen führen. Turan et al nutzten dieses analgetische Potenzial im PNS, indem sie 1.5 g Magnesium zu 0.5 % Lidocain für IVRA hinzufügten. Magnesium verkürzte die Einsetzzeit und verlängerte die analgetische Wirkung bis zu 6 Stunden nach der Operation ohne Unterschied bei den Nebenwirkungen. Insgesamt könnten NMDA-Antagonisten ein erhebliches Potenzial haben, in Zukunft eine peripher vermittelte Analgesie hervorzurufen, obwohl derzeit verfügbare Mittel (mit Ausnahme von Magnesium in IVRA) begrenzte Wirkungen haben und bei höheren Dosen übermäßige Nebenwirkungen hervorrufen.
CYCLOOXYGENASE-HEMMUNG
Prostaglandine sensibilisieren periphere Nervenenden für die Wirkungen von endogenen chemischen Mediatoren, die während einer Gewebeverletzung freigesetzt werden. NSAIDs hemmen die Produktion von Prostaglandinen durch ihre wohlbekannte Wirkung der Hemmung der Cyclooxygenase (COX). Die Applikation von NSAIDs direkt im PNS erscheint daher als Mittel zur peripheren Schmerzreduktion sinnvoll.
Intravenöse Regionalanästhesie
Eine Reihe von Autoren hat IVRA Ketorolac in Dosen von 5 bis 60 mg zugesetzt, was zu einer Verbesserung der intraoperativen Tourniquet-Toleranz und der postoperativen Analgesie führte. Steinberg und Kollegen führten eine Dosis-Wirkungs-Studie mit Ketorolac bei IVRA unter Verwendung von Placebo, 5-, 10-, 15-, 20-, 30- und 60-mg-Dosen von Ketorolac durch. Es wurde festgestellt, dass 20 mg die ideale Dosis war, wobei niedrigere Dosen weniger Analgesie hervorriefen und höhere Dosen nicht wirksamer waren. Lysinacetylsalicylsäure 90 mg (entsprechend 50 mg Acetylsalicylsäure) wurde Prilocain für IVRA mit Verlängerung der postoperativen Analgesie hinzugefügt.
Intraartikuläre Verabreichung
Die Anwendung von Ketorolac allein mit Lokalanästhetikum oder Lokalanästhetikum und Morphin ist nicht wirksamer als Lokalanästhetikum allein, wenn es intraartikulär verabreicht wird. Lesen Sie mehr über Intraartikuläre und periartikuläre Infiltration von Lokalanästhetika.
Infiltration
Ketorolac wurde erfolgreich in einer Dosis von 30 bis 60 mg nach einer Hernienreparatur infiltriert, was eine ähnliche Wirkung wie die Infiltration mit Bupivacain ergab. Es wurde jedoch festgestellt, dass eine lokale Infiltration nicht wirksamer ist als eine systemische Verabreichung.
CHOLINERISCHE ANALGESIE
Muskarinrezeptoren vermitteln Analgesie im Hinterhorn des Rückenmarks, und Neostigmin hat Analgesie bewirkt, wenn es sowohl in den intrathekalen als auch in den epiduralen Raum verabreicht wurde. Neostigmin wurde in einer Reihe von Studien auch im PNS angewendet, mit allgemein enttäuschenden Ergebnissen. Van Elstraete und Mitarbeiter und Bone und Kollegen fügten 500 µg Neostigmin zu einem Lokalanästhetikum bei einer Blockade des axillären Plexus brachialis hinzu. Eine Studie zeigte keinen Unterschied und die andere fand nur eine signifikante Verringerung der Schmerzen nach 24 Stunden, ohne Unterschied zu anderen Zeitpunkten. Neostigmin als Zusatz zum Lokalanästhetikum für IVRA war ebenfalls enttäuschend. Turan und Mitarbeiter fügten 500 µg Neostigmin zu 0.5 % Prilocain hinzu und stellten eine Verbesserung des Einsetzens und Abklingens von sensorischen und motorischen Blockaden mit längerer Zeit bis zur ersten analgetischen Anforderung fest. McCartney und Kollegen führten jedoch eine ähnliche Studie mit 1 mg Neostigmin zu 0.5 % Lidocain durch, wobei keine Unterschiede zwischen den Gruppen festgestellt wurden. Insgesamt erscheint Neostigmin als analgetisches Adjuvans für periphere Nervenblockaden oder IVRA enttäuschend. Neostigmin wurde jedoch erfolgreich als analgetisches Adjuvans zur intraartikulären Anwendung nach einer Kniearthroskopie verwendet. Yang und Mitarbeiter führten eine Dosis-Wirkungs-Studie durch und stellten fest, dass 500 µg am wirksamsten waren, was wirksamer war als 2 mg intraartikuläres Morphin. Die Wirksamkeit des intraartikulären cholinergen Analgetikawegs im Vergleich zu den schlechten Ergebnissen bei perineuronaler Anwendung kann mit dem Vorhandensein der Entzündungsreaktion im intraartikulären Raum zusammenhängen, wodurch die analgetische Wirksamkeit von Acetylcholin durch einen noch zu definierenden Mechanismus erhöht wird .
ZUSAMMENFASSUNG
Periphere Nervenblockaden bieten unseren Patienten erhebliche anästhetische und analgetische Vorteile. Analgetische Adjuvantien wie Opioide, α2-Agonisten, NMDA-Rezeptorantagonisten und andere Mittel können Lokalanästhetika zugesetzt werden, um sowohl das Einsetzen zu erleichtern als auch die anästhetischen und analgetischen Wirkungen durch im PNS vorhandene Mechanismen zu verlängern. Mehrere Wirkstoffe sind wirksam, wenn sie im perineuronalen oder intraartikulären Raum verabreicht werden und wenn sie als IVRA oder lokale Infiltration verabreicht werden (Tabelle 3). Die Effektgröße jedes einzelnen Adjuvans ist variabel, wobei Dexamethason die größte Effektgröße erzeugt. Unser wachsendes Wissen über nozizeptive Mechanismen im PNS wird es ermöglichen, in Zukunft neuartige Techniken zu entwickeln, um die Schmerzbehandlung weiter zu verbessern.
TABELLE 3. Beste analgetische Adjuvantien im peripheren Nervensystem nach Verabreichungsweg.
| Straße | Wirkstoff und Dosis |
|---|---|
| Perineural/perineural | Dexamethason 4–10 mg; Buprenorphin 0.3 mg; Clonidin 1–2 μg/kg; Tramadol 200 mg |
| IVRA | Dexmedetomidin 0.5 μg/kg; Magnesium 1.5 g |
| Intraartikulär | Clonidin 150 μg; Morphin 5 mg |
| Lokale Infiltration | Ketamin 3 mg/ml |
NB: Auf mehrere Studien von Dr. S. Reuben, die inzwischen zurückgezogen wurden, wurde in der vorherigen Ausgabe dieses Textes verwiesen. Diese Verweise wurden entfernt. Auf alle verbleibenden Referenzen, an denen Dr. Reuben beteiligt war und die nicht zurückgezogen wurden, wird weiterhin verwiesen.
REFERENZEN
- Kehlet H, Dahl JB: Der Wert der „multimodalen“ oder „balancierten Analgesie“ in der postoperativen Schmerzbehandlung. Anesth Analg 1993;77:1048–1056.
- Raja SN, Meyer RA, Ringkamp M, et al: Periphere neuronale Mechanismen der Nozizeption. In Wall PD, Melzack R (Hrsg.): Textbook of Pain, 4. Aufl. Churchill-Livingstone, 1999, S. 11–57.
- Dickenson AH: Die Gate-Control-Theorie des Schmerzes hat sich bewährt. Br J Anaesth 2002;88:755–757.
- Millan MJ: Die Schmerzinduktion: Eine integrative Übersicht. Prog Neurobiol 1999;57:1–164.
- Sawynok J: Topisch und peripher wirkende Analgetika. Pharmacol. Rev. 2003;55:1–20.
- Williams BA, Hough KA, Tsui BY, Ibinson JW, Gold MS, Gebhart GF: Neurotoxizität von Adjuvantien, die in der perineuralen Anästhesie und Analgesie verwendet werden, im Vergleich zu Ropivacain. Reg Anesth Pain Med 2011; 36(3): 225–230.
- Likar R, Mousa SA, Philippitsch G, et al: Erhöhte Zahlen Opioid-exprimierender Entzündungszellen beeinflussen die intraartikuläre Morphin-Analgesie nicht. Br. J. Anaesth 2004;93:375–380.
- Brack A, Rittner HL, Machelska H, et al: Kontrolle von entzündlichen Schmerzen durch Chemokin-vermittelte Rekrutierung von opioidhaltigen polymorphkernigen Zellen. Schmerz 2004;112:229–238.
- Machelska H, Cabot PJ, Mousa SA, et al.: Schmerzkontrolle bei durch Selektine gesteuerter Entzündung. Nat Med 1998;4:1425–1428.
- Stein C, Schafer M, Machelska H: Den Schmerz an seiner Quelle angreifen: Neue Perspektiven auf Opioide. Nat Med 2003;9:1003–1008.
- Mousa SA, Zhang Q, Sitte N, et al: Beta-Endorphin-haltige Gedächtniszellen und Mu-Opioid-Rezeptoren werden zu peripherem entzündetem Gewebe transportiert. J Neuroimmunol 200;115:71–78.
- Picard PR, Tramer MR, McQuay HJ, et al: Analgetische Wirksamkeit von peripheren Opioiden (alle außer intraartikulär): Eine qualitative systematische Überprüfung randomisierter kontrollierter Studien. Schmerz 1997;72:309–318.
- Murphy DB, McCartney CJ, Chan VW: Neuartige analgetische Zusätze für die Plexus-brachialis-Blockade: Eine systematische Übersicht. Anesth Analg 2000;90: 1122–1128.
- Fanelli G, Casati A, Magistris L, et al: Fentanyl verbessert nicht die Nervenblockadeeigenschaften einer mit Ropivacain durchgeführten Anästhesie des axillären Plexus brachialis. Acta Anaesthesiol Scand 2001;45:590–594.
- Karakaya D, Buyukgoz F, Baris S, et al.: Die Zugabe von Fentanyl zu Bupivacain verlängert die Anästhesie und Analgesie bei axillären Plexus-Brachialis-Blockaden. Reg Anesth Pain Med 2001;26:434–438.
- Likar R, Koppert W, Blatnig H, et al: Wirksamkeit der peripheren Morphin-Analgesie in entzündetem, nicht entzündetem und perineuralem Gewebe von Patienten mit Zahnchirurgie. J Pain Symptom Manage 2001;21:330–337.
- Nishikawa K, Kanaya N, Nakayama M, et al: Fentanyl verbessert die Analgesie, verlängert aber das Einsetzen der axillären Plexus-brachialis-Blockade durch periphere Mechanismen. Anesth Analg 2000;91:384–387.
- Choyce A, Peng P: Eine systematische Überprüfung von Hilfsmitteln für die intravenöse Regionalanästhesie für chirurgische Eingriffe. Can J Anaesth 2002;49: 32–45.
- Gutstein H, Akil H: Opioid-Analgetika. In Hardman J, Limbird L (Hrsg.): Goodman & Gilman's The Pharmacologic Basis of Therapeutics, 10. Aufl. McGraw-Hill, 2001, S. 601.
- Lanz E, Simko G, Theiss D, et al: Epidurales Buprenorphin – Eine Doppelblindstudie zu postoperativer Analgesie und Nebenwirkungen. Anesth Analg 1984;63:593–598.
- Candido KD, Winnie AP, Ghaleb AH, et al: Buprenorphin als Zusatz zum Lokalanästhetikum für axillären Plexus brachialis verlängert die postoperative Analgesie. Reg Anesth Pain Med 2002;27:162–167.
- Candido KD, Franco CD, Khan MA, et al: Buprenorphin als Zusatz zum Lokalanästhetikum für die Blockade des Plexus brachialis zur postoperativen Analgesie bei ambulanten Patienten. Reg Anesth Pain Med 2001;26:352–356.
- Viel EJ, Eledjam JJ, De La Coussaye JE, et al: Brachialplexus-Blockierung mit Opioiden zur postoperativen Schmerzlinderung: Vergleich zwischen Buprenorphin und Morphin. Reg. Anesth 1989;14:274–278.
- Bazin JE, Massoni C, Bruelle P, et al.: Der Zusatz von Opioiden zu Lokalanästhetika bei der Blockade des Plexus brachialis: Die vergleichenden Wirkungen von Morphin, Buprenorphin und Sufentanil. Anästhesie 1997;52: 858–862.
- Alhashemi JA, Kaki AM: Wirkung der intrathekalen Verabreichung von Tramadol auf postoperative Schmerzen nach transurethraler Resektion der Prostata. Br. J. Anaesth 2003;91:536–540.
- Kapral S, Gollmann G, Waltl B, et al: Tramadol addiert zu Mepivacain verlängert die Dauer eines axillären Plexus brachialis. Anesth Analg 1999;88:853–856.
- Robaux S, Blunt C, Viel E, et al: Tramadol addiert zu 1.5 % Mepivacain für axillären Plexus-brachialis-Block verbessert die postoperative Analgesie dosisabhängig. Anesth Analg 2004;98:1172–1177.
- Alemmano F., Ghisi D., Fanelli A., et al.: Tramodol und 0.5 % Levobupivacain für einen Single-Shot-Interskalenblocker. Minerva Anestesiol 2013;78(3): 291–296.
- Kalso E, Tramer MR, Carroll D, et al: Schmerzlinderung durch intraartikuläres Morphin nach einer Knieoperation: Eine qualitative systematische Überprüfung. Schmerz 1997;71:127–134.
- Brandsson S, Karlsson J, Morberg P, et al: Intraartikuläres Morphin nach arthroskopischer ACL-Rekonstruktion: Eine doppelblinde, placebokontrollierte Studie mit 40 Patienten. Acta Orthop Scand 2000;71:280–285.
- Rasmussen S, Larsen AS, Thomsen ST, et al: Intraartikuläres Glucocorticoid, Bupivacain und Morphin reduzieren Schmerzen, Entzündungsreaktionen und Rekonvaleszenz nach arthroskopischer Meniskusentfernung. Schmerz 1998;78:131–134.
- Alagol A, Calpur OU, Kaya G, et al: Die Verwendung von intraartikulärem Tramadol zur postoperativen Analgesie nach einer arthroskopischen Knieoperation: Ein Vergleich verschiedener intraartikulärer und intravenöser Dosen. Knieoperation Sporttraumatol Arthrosc 2004;12:184–188.
- Varrassi G, Marinangeli F, Ciccozzi A, et al: Intraartikuläres Buprenorphin nach Kniearthroskopie. Eine randomisierte, prospektive, doppelblinde Studie. Acta Anaesthesiol Scand 1999;43:51–55.
- Vranken JH, Vissers KC, de Jongh R, et al: Die intraartikuläre Verabreichung von Sufentanil erleichtert die Genesung nach einer Kniearthroskopie am Tag. Anesth Analg 2001;92:625–628.
- Gupta A, Bodin L, Holmstrom B, Berggren: Eine systematische Übersicht über die peripheren analgetischen Wirkungen von intraartikulärem Morphin. Anesth Analg 2001;93(3):761–770.
- Unnerstall JR, Kopajtic TA, Kuhar MJ: Verteilung von Alpha-2-Agonist-Bindungsstellen im Zentralnervensystem der Ratte und des Menschen: Analyse einiger funktioneller, anatomischer Korrelate der pharmakologischen Wirkungen von Clonidin und verwandten adrenergen Mitteln. BrainRes 1984;319:69–101.
- Kuraishi Y, Hirota N, Sato Y, et al.: Noradrenerge Hemmung der Freisetzung von Substanz P aus den primären Afferenzen im Spinal-Hinterhorn des Kaninchens. BrainRes 1985;359:177–182.
- Fleetwood-Walker S. M., Mitchell R., Hope P. J., et al.: Ein Alpha-2-Rezeptor vermittelt die selektive Hemmung nozizeptiver Reaktionen identifizierter Hinterhornneuronen durch Noradrenalin. BrainRes 1985;334:243–254.
- Baba H, Kohno T, Okamoto M, et al: Muskarinische Erleichterung der GABA-Freisetzung in der Substantia gelatinosa des Rückenhorns der Ratte. J Physiol 1998;508:83–93.
- Butterworth JF 5th, Strichartz GR: Die alpha 2-adrenergen Agonisten Clonidin und Guanfacin erzeugen eine tonische und phasische Leitungsblockade in Ratten-Ischiasnervenfasern. Anesth Analg 1993;76:295–301.
- Gaumann DM, Brunet PC, Jirounek P: Clonidin verstärkt die Wirkung von Lidocain auf das C-Faser-Aktionspotential. Anesth Analg 1992;74:719–725.
- Eisenach JC, Gebhart GF: Intrathekales Amitriptylin. Antinozizeptive Wechselwirkungen mit intravenösem Morphin und intrathekalem Clonidin, Neostigmin und Carbamylcholin bei Ratten. Anesthesiology 1995;83: 1036–1045.
- Kroin JS, Buvanendran A, Beck DR, et al: Clonidin-Verlängerung der Lidocain-Analgesie nach Ischiasnervblockade bei Ratten wird über den hyperpolarisationsaktivierten Kationenstrom vermittelt, nicht durch Alpha-Adrenorezeptoren. Anesthesiology 2004;101:488–494.
- Singelyn FJ, Dangoisse M, Bartholomee S, et al: Das Hinzufügen von Clonidin zu Mepivacain verlängert die Dauer der Anästhesie und Analgesie nach einer Blockade des axillären Plexus brachialis. Reg Anesth 1992;17:148–150.
- Hutschala D, Mascher H, Schmetterer L, et al: Zu Bupivacain hinzugefügtes Clonidin verstärkt und verlängert die Analgesie nach einer Blockade des Plexus brachialis über einen lokalen Mechanismus bei gesunden Probanden. Eur J Anaesthesiol 2004; 21:198–204.
- Culebras X, Van Gessel E, Hoffmeyer P, et al: Clonidin in Kombination mit einem langwirksamen Lokalanästhetikum verlängert die postoperative Analgesie nach einer Plexus-brachialis-Blockade nicht, induziert aber hämodynamische Veränderungen. Anesth Analg 2001;92:199–204.
- Popping DM, Elia N., Marret E., Wenk M., Tramer MR. Clonidin als Adjuvans zu Lokalanästhetika bei peripheren Nerven- und Plexusblockaden: Eine Metaanalyse randomisierter Studien. Anesthesiology 2009;111(2): 406–415.
- Ilfeld BM, Morey TE, Enneking FK: Kontinuierliche infraklavikuläre perineurale Infusion mit Clonidin und Ropivacain im Vergleich zu Ropivacain allein: Eine randomisierte, doppelblinde, kontrollierte Studie. Anesth Analg 2003;97:706–712.
- Ilfeld BM, Morey TE, Thannikary LJ, et al.: Clonidin hinzugefügt zu einer kontinuierlichen interskalenären Ropivacain-Perineuralinfusion zur Verbesserung der postoperativen Analgesie: Eine randomisierte, doppelblinde, kontrollierte Studie. Anesth Analg 2005;100:1172–1178.
- Abdallah FW, Brull R: Fördernde Wirkungen von perineuralem Dexmedetomidin auf die neuraxiale und periphere Nervenblockade: eine systematische Überprüfung und Metaanalyse. Br. J. Anaesth 2013;110(6):915–925.
- Alayurt S, Memis D, Pamukcu Z: Die Zugabe von Sufentanil, Tramadol oder Clonidin zu Lignocain für die intravenöse Regionalanästhesie. Anaesth Intensive Care 2004;32:22–27.
- Gentili M, Bernard JM, Bonnet F: Die Zugabe von Clonidin zu Lidocain für die intravenöse Regionalanästhesie verhindert Tourniquet-Schmerzen. Anesth Analg 1999;88:1327–1330.
- Reuben SS, Steinberg RB, Klatt JL, et al: Intravenöse Regionalanästhesie mit Lidocain und Clonidin. Anesthesiology 1999;91:654–658.
- Lurie SD, Reuben SS, Gibson CS, et al.: Wirkung von Clonidin auf Tourniquet-Schmerzen der oberen Extremitäten bei gesunden Freiwilligen. Reg Anesth Pain Med 2000;25:502–505.
- Memis D, Turan A, Karamanlioglu B, et al: Hinzufügen von Dexmedetomidin zu Lidocain für die intravenöse Regionalanästhesie. Anesth Analg 2004;98:835–840.
- Joshi W, Reuben SS, Kilaru PR, et al: Postoperative Analgesie für ambulante arthroskopische Knieoperationen mit intraartikulärem Clonidin und/oder Morphin. Anesth Analg 2000;90:1102–1106.
- Tan PH, Buerkle H, Cheng JT, et al: Doppelblinder Parallelvergleich mehrerer Dosen von Apraclonidin, Clonidin und Placebo, die intraartikulär an Patienten verabreicht werden, die sich einer arthroskopischen Knieoperation unterziehen. Clin J. Pain 2004;20:256–260.
- Gentili M, Juhel A, Bonnet F: Periphere analgetische Wirkung von intraartikulärem Clonidin. Pain 1996;64:593–596.
- Gentili M, Houssel P, Osman M, et al: Intraartikuläres Morphin und Clonidin erzeugen eine vergleichbare Analgesie, aber die Kombination ist nicht wirksamer. Br. J. Anaesth 1997;79:660–661.
- Buerkle H, Schapsmeier M, Bantel C, et al: Thermische und mechanische antinozizeptive Wirkung von spinal vs. peripher verabreichtem Clonidin im entzündeten Kniegelenksmodell der Ratte. Br. J. Anaesth 1999;83:436–441.
- Steroide der Nebennierenrinde. In Drug Facts and Comparisons, 5. Aufl. Fakten und Vergleiche, 1997, S. 122–128.
- De Oliveira GS Jr., Castro-Alves LJ, Ahmad S., Kendall MC, McCarthy RJ: Dexamethason zur Vorbeugung von postoperativer Übelkeit und Erbrechen: Eine aktualisierte Metaanalyse randomisierter kontrollierter Studien. Anesth Analg 2013;116(1):58–74.
- De Oliveira GS Jr., Almeida MD, Benzon HT, McCarthy RJ: Systemisches Dexamethason mit perioperativer Einzeldosis bei postoperativen Schmerzen: Eine Metaanalyse randomisierter kontrollierter Studien. Anesthesiology 2011;115(3): 575–588.
- Attardi B, Takimoto K, Gealy R, Severns C, Levitan ES: Glucocorticoid induzierte Hochregulierung einer Hypophysen-K+-Kanal-mRNA in vitro und in vivo. Receptors Channels 1993;1:287–293.
- Eker HE, Cok OY, Aribogan A, Arslan G: Management von neuropathischen Schmerzen mit Methylprednisolon an der Stelle der Nervenverletzung. Pain Med 2012;13:443–451.
- Johansson A, Hao J, Sjolund B: Die lokale Anwendung von Kortikosteroiden blockiert die Übertragung in normalen nozizeptiven C-Fasern. Acta Anaesthesiol Scand 1990;34:335–338.
- Cummings KC 3rd, Napierkowski DE, Parra-Sanchez I, et al: Wirkung von Dexamethason auf die Dauer von interskalenären Nervenblockaden mit Ropivacain oder Bupivacain. Br. J. Anaesth 2011;107:446–453.
- Fredrickson MJ, Danesh-Clough TK, White R: Adjuvantes Dexamethason für Bupivacain-Ischias- und Knöchelblockaden: Ergebnisse aus 2 randomisierten placebokontrollierten Studien. Reg Anesth Pain Med 2013;38(4):300–307.
- Movafegh A, Razazian M, Hajimaohamadi F, Meysamie A: Dexamethason, das zu Lidocain hinzugefügt wird, verlängert die Blockade des axillären Plexus brachialis. Anesth Analg 2006;102:263–267.
- Parrington SJ, O'Donnell D, Chan VW, et al: Dexamethason, das Mepivacain hinzugefügt wird, verlängert die Dauer der Analgesie nach einer Blockade des supraklavikulären Plexus brachialis. Reg Anesth Pain Med 2010;35:422–426.
- Tandoc MN, Fan L, Kolesnikov S, Kruglov A, Nader ND: Adjuvantes Dexamethason mit Bupivacain verlängert die Dauer der Interskalenblockade: Eine prospektive randomisierte Studie. J. Anesth 2011;25:704–709.
- Vieira PA, Pulai I, Tsao GC, Manikantan P, Keller B, Connelly NR. Dexamethason mit Bupivacain verlängert die Dauer der Analgesie bei ultraschallgesteuerter Interskalenus-Blockade des Plexus brachialis. Eur J Anaesthesiol 2010;27:285–288.
- Desmet M, Braems H, Reynvoet M, et al: IV und perineurales Dexamethason sind bei der Verlängerung der analgetischen Dauer einer interskalenären Single-Shot-Blockade mit Ropivacain für Schulteroperationen gleichwertig: Eine prospektive, randomisierte, placebokontrollierte Studie. Br J Anaesth 2013; 111(3):445–452. Epub vor dem Druck.
- Thangaswamy CR, Rewari V, Trikha A, Dehran M, Chandralekha: Dexamethason vor totaler laparoskopischer Hysterektomie: Eine randomisierte kontrollierte Dosis-Wirkungs-Studie. J. Anesth 2010;24:24–30.
- Worni M, Schudel HH, Seifert E, et al: Randomisierte kontrollierte Studie mit Einzeldosis-Steroid vor Thyreoidektomie bei gutartiger Erkrankung zur Verbesserung von postoperativer Übelkeit, Schmerzen und Stimmfunktion. Ann Surg 2008;248: 1060–1066.
- Taniguchi M, Bollen AW, Drasner K. Natriumbisulfit: Sündenbock für die Neurotoxizität von Chloroprocain? Anesthesiology 2004;100(1):85–91.
- Bigat Z, Boztug N, Hadimioglu N, Cete N, Coskunfirat N, Ertok E: Verbessert Dexamethason die Qualität der intravenösen Regionalanästhesie und Analgesie? Eine randomisierte, kontrollierte klinische Studie. Anesth Analg 2006;102(2):605–609.
- Coderre TJ, Katz J, Vaccarino AL, et al: Beitrag der zentralen Neuroplastizität zu pathologischen Schmerzen: Überprüfung klinischer und experimenteller Beweise. Schmerz 1993;52:259–285.
- Price DD, Mao J, Mayer DJ: Zentrale neuronale Mechanismen normaler und abnormaler Schmerzzustände. In Fields HL, Liebskind JC (Hrsg.): Progress in Pain Research and Management. IASP Press, 1994;61–84.
- Dickenson AH, Chapman V, Green GM: Die Pharmakologie von exzitatorischen und inhibitorischen Aminosäure-vermittelten Ereignissen bei der Übertragung und Modulation von Schmerzen im Rückenmark. Gen Pharmacol 1997;28: 633–638.
- Alfredson H., Forsgren S., Thorsen K. et al.: Glutamat-NMDAR1-Rezeptoren lokalisiert an Nerven in menschlichen Achillessehnen. Konsequenzen für die Behandlung? Knieoperation Sporttraumatol Arthrosc 2001;9:123–126.
- Cairns BE, Hu JW, Arendt-Nielsen L, et al: Geschlechtsbezogene Unterschiede bei menschlichen Schmerzen und afferenter Entladung bei Ratten, hervorgerufen durch Injektion von Glutamat in den Massetermuskel. J Neurophysiol 2001;86:782–791.
- Svensson P, Cairns BE, Wang K, et al: Die Injektion von Nervenwachstumsfaktor in den menschlichen Massetermuskel ruft lang anhaltende mechanische Allodynie und Hyperalgesie hervor. Schmerz 2003;104:241–247.
- Cairns BE, Svensson P, Wang K, et al: Die Aktivierung peripherer NMDA-Rezeptoren trägt zu Schmerzen beim Menschen und afferenten Entladungen bei Ratten bei, die durch Injektion von Glutamat in den Massetermuskel hervorgerufen werden. J Neurophysiol 2003;90:2098–2105.
- Tverskoy M, Oren M, Vaskovich M, et al: Ketamin verstärkt die lokalanästhetische und analgetische Wirkung von Bupivacain durch peripheren Mechanismus: Eine Studie an postoperativen Patienten. Neurosci Lett 1996;215:5–8.
- Amiot JF, Bouju P, Palacci JH, et al: Intravenöse Regionalanästhesie mit Ketamin. Anästhesie 1985;40:899–901.
- Gorgias NK, Maidatsi PG, Kyriakidis AM, et al: Clonidin versus Ketamin zur Verhinderung von Tourniquet-Schmerzen während der intravenösen Regionalanästhesie mit Lidocain. Reg Anesth Pain Med 2001;26:512–517.
- Dal D, Tetik O, Altunkaya H, et al: Die Wirksamkeit von intraartikulärem Ketamin zur postoperativen Analgesie in der ambulanten arthroskopischen Chirurgie. Arthroscopy 2004;20:300–305.
- Brill S, McCartney CJ, Sawyer R, et al: Intraartikuläre Ketamin-Analgesie nach Kniearthroskopie: Eine Dosisfindungsstudie. Pain Clinic 2005;17: 25–29.
- Turan A, Memis D, Karamanlioglu B, et al: Intravenöse Regionalanästhesie mit Lidocain und Magnesium. Anesth Analg 2005;100: 1189–1192.
- Reuben SS, Steinberg RB, Kreitzer JM, et al: Intravenöse Regionalanästhesie mit Lidocain und Ketorolac. Anesth Analg 1995;81: 110–113.
- Steinberg RB, Reuben SS, Gardner G: Die Dosis-Wirkungs-Beziehung von Ketorolac als Bestandteil einer intravenösen Regionalanästhesie mit Lidocain. Anesth Analg 1998;86:791–793.
- Corpataux JB, Van Gessel EF, Donald FA, et al: Wirkung auf die postoperative Analgesie von niedrig dosiertem Lysinacetylsalicylat, das Prilocain während der intravenösen Regionalanästhesie zugesetzt wurde. Anesth Analg 1997;84:1081–1085.
- Reuben SS, Duprat KM: Vergleich der Wundinfiltration mit Ketorolac versus intravenöser Regionalanästhesie mit Ketorolac zur postoperativen Analgesie nach ambulanter Handchirurgie. Reg Anesth 1996;21:565–568.
- Ben-David B, Katz E, Gaitini L, et al: Vergleich von IM und lokaler Infiltration von Ketorolac mit und ohne Lokalanästhetikum. Br. J. Anaesth 1995;75:409–412.
- Connelly NR, Reuben SS, Albert M, et al: Verwendung von präinzisionalem Ketorolac bei Hernienpatienten: Intravenös versus Operationsstelle. Reg Anesth 1997; 22:229–232.
- Bosek V, Cox CE: Vergleich der analgetischen Wirkung von lokal und systemisch verabreichtem Ketorolac bei Mastektomiepatientinnen. Ann SurgOncol 1996;3:62–66.
- Van Elstraete AC, Pastureau F, Lebrun T, et al: Neostigmin als Zusatz zum Lidocain-Axillarplexus-Block zur postoperativen Analgesie. Eur J Anaesthesiol 2001;18:257–260.
- Bone HG, Van Aken H, Booke M, et al: Verbesserung der Anästhesie des axillären Plexus brachialis durch gleichzeitige Verabreichung von Neostigmin. Reg Anesth Pain Med 1999;24:405–410.
- Turan A, Karamanlyoglu B, Memis D, et al: Intravenöse Regionalanästhesie mit Prilocain und Neostigmin. Anesth Analg 2002;95(5): 1419–1422.
- McCartney CJ, Brill S, Rawson R, et al: Kein anästhetischer oder analgetischer Nutzen von Neostigmin 1 mg als Zusatz zu intravenöser Regionalanästhesie mit Lidocain 0.5 % für Handchirurgie. Reg Anesth Pain Med 2003;28: 414–417.
- Yang LC, Chen LM, Wang CJ, et al: Postoperative Analgesie durch intraartikuläres Neostigmin bei Patienten, die sich einer Kniearthroskopie unterziehen. Anesthesiology 1998;88:334–339.
- Gentili M, Enel D, Szymskiewicz O, et al: Postoperative Analgesie durch intraartikuläres Clonidin und Neostigmin bei Patienten, die sich einer Kniearthroskopie unterziehen. Reg Anesth Pain Med 2001;26:342–347.
Colin JL McCartney und Stephen Choi