Jason Choi、Liane Germond 和 Alan C. Santos
引言
大多数妇女在分娩和分娩过程中会经历中度至重度疼痛,通常需要某种形式的药物镇痛。 缺乏适当的心理准备加上恐惧和焦虑会大大增强患者对疼痛的敏感性,并进一步增加分娩过程中的不适感。 然而,熟练地进行产科镇痛,除了减轻疼痛和焦虑之外,还可能在许多其他方面使母亲受益。 本章重点关注产科患者的管理,主要关注区域麻醉技术。
妊娠的生理变化
怀孕会导致影响大多数母体器官系统的重大变化(表1)。 这些变化是由黄体和胎盘分泌的激素引发的。 这些变化对照顾怀孕患者的麻醉师具有重要意义。 本章回顾了与妊娠最相关的生理变化,并讨论了使用区域麻醉进行产科管理的方法。
心血管系统的变化
怀孕期间耗氧量会增加,因为母体心血管系统需要满足不断增长的胎儿不断增加的代谢需求。 这些变化的最终结果是与怀孕前的值相比,心率(15%–25%)和心输出量(高达 50%)增加。 此外,子宫、肾脏和其他血管床的血管阻力较低。 由于外周阻力的降低超过了心输出量的增加,这些变化导致动脉血压降低。 血管阻力降低主要是由于雌激素、黄体酮和前列环素的分泌。 由于收缩子宫的血容量增加,在分娩期间和产后即刻发生心输出量显着增加。
NYSORA 小贴士
- 晚期妊娠的心血管变化和陷阱包括以下内容:
- 增加心率(15%–25%)和心输出量(高达 50%)。
- 降低子宫、肾脏和其他血管床的血管阻力。
- 仰卧位压迫下主动脉可能会进一步降低子宫胎盘灌注并导致胎儿窒息。
- 与非孕妇相比,接受区域麻醉、需要进行子宫移位或骨盆侧倾操作、血管内预负荷和血管加压药的孕妇更容易发生显着低血压。
从妊娠中期开始,增大的子宫对主动脉腔静脉的压迫变得越来越重要,在 36-38 周时达到最大效果,之后随着胎头下降进入骨盆,它可能会有所缓解。 当患者处于仰卧位而不是侧卧位时,心输出量可能会减少。 生长中的胎儿静脉阻塞导致 10% 的孕妇出现仰卧位低血压综合征,表现为母体心动过速、动脉低血压、昏厥和苍白。
在这个位置压迫下主动脉可能会进一步减少子宫胎盘灌注并导致胎儿窒息。 在妊娠患者的麻醉管理过程中,应常规应用子宫移位或骨盆侧倾。 子宫移位最好通过将患者置于左侧卧位来实现。 在这个位置,与仰卧位相比,心脏迷走神经活动将增强。 在骨盆下方放置一个楔子已被用于实现子宫倾斜。 然而,最近已经证明,当母亲处于完全左侧卧位,然后仰卧到骨盆楔上时,子宫倾斜更有效。
心电图的变化在妊娠晚期很常见。 QRS 轴最初可能在妊娠早期向右移动,在妊娠晚期由于子宫扩张而向左旋转。 还存在 PR 和 QT 间期缩短和心率增加。 QT 间期缩短可能对患有长 QT 综合征的女性有影响。 事实上,塞思等人。 发现患有 QT 延长综合征的女性在怀孕期间发生心脏事件的风险降低(风险比 [RR] = 0.38)。 然而,还发现分娩后前 XNUMX 个月产后心脏事件的风险增加,这表明 QT 间期在分娩后早期再次延长。 也有发生房性早搏、窦性心动过速和阵发性室上性心动过速的趋势。
表1。 足月妊娠生理变化总结。
| 变量 | 更改 | 总金额 |
|---|---|---|
| 总血量 | 增加 | 25%-40% |
| 血浆体积 | 增加 | 40%-50% |
| 纤维蛋白原 | 增加 | 50% |
| 血清胆碱酯酶活性 | 减少 | 20%-30% |
| 心输出量 | 增加 | 30%-50% |
| 分钟通气 | 增加 | 50% |
| 肺泡通气 | 增加 | 70% |
| 功能剩余容量 | 减少 | 20% |
| 耗氧量 | 增加 | 20% |
| 动脉二氧化碳分压 | 减少 | 10毫米汞柱 |
| 动脉氧分压 | 增加 | 10毫米汞柱 |
| 最低肺泡浓度 | 减少 | 32%-40% |
呼吸系统的变化
分钟通气量从怀孕开始增加到足月正常水平的最大 50%。 这主要是潮气量增加 40% 和呼吸频率小幅增加的结果。 怀孕期间死腔没有明显变化; 因此,肺泡通气量在足月增加了 70%。 分娩后,随着血孕酮水平下降,通气会在 1-3 周内恢复正常。
膈肌抬高随着子宫大小的增加而发生。 到妊娠晚期,呼气储备量、残气量和功能残气量 (FRC) 会减少。 然而,由于吸气储备量也增加,总肺活量保持不变。 健康产妇的 FRC 降低通常是无症状的。 那些因吸烟、肥胖、脊柱侧弯或其他肺部疾病而预先存在闭合体积改变的人可能会在妊娠晚期出现早期气道闭合,从而导致低氧血症。 特伦德伦伯卧位和仰卧位也加剧了收盘量和 FRC 之间的异常关系。 剩余体积和FRC在分娩后不久恢复正常。
孕妇经常有鼻呼吸困难。 怀孕期间粘膜的脆性会导致严重出血,尤其是在气道器械上。 这些变化是由细胞外液增加和血管充血引起的。 对乳房增大的肥胖、短颈产妇进行喉镜检查也可能很困难。 事实证明,使用短柄喉镜很有帮助。
NYSORA 小贴士
孕妇气道水肿可能很严重,尤其是先兆子痫、长期使用特伦德伦伯卧位的孕妇以及使用宫缩抑制剂的孕妇。
代谢变化
孕早期的耗氧量增加,整个孕期增加了 20%。 无论如何,怀孕期间增加的肺泡通气量实际上会导致动脉血中的二氧化碳分压 (PaCO2) 降低至 32 mm Hg,而动脉血中的氧分压 (PaO2) 会升高至 106 mm Hg。 血浆缓冲液碱从 47 减少到 42 mEq; 因此,pH 值几乎保持不变。 由于肺泡通气量增加和 FRC 降低,母体吸入性麻醉剂的吸收和消除增加。 然而,FRC 降低和代谢率增加使母亲在呼吸暂停或通气不足期间容易发生低氧血症。
胃肠系统的变化
怀孕对胃肠系统的影响是有争议的。 有人提出,增强的孕酮产生会导致胃肠动力下降和食物吸收减慢。 胃分泌物酸性更强,食管下括约肌张力降低。 然而,最近使用射线照相、超声和染料稀释技术的研究表明,胃排空液体和固体物质在怀孕期间的任何时候都不会减少。
全身麻醉诱导时反流的风险部分取决于食管下括约肌和胃内压力之间的梯度。 在有“胃灼热”的产妇中,食管下括约肌张力大大降低。 不能肯定地推荐单一的常规预防方案。 与胃内容物混合不充分、给药时机不当以及抗酸剂有增加胃容量的趋势会降低预防性非颗粒抗酸剂的功效。 组胺 (H2) 受体拮抗剂(如西咪替丁和雷尼替丁)的给药需要预期和谨慎的时机,因为它们的起效相对缓慢。 对于那些风险最大的女性,可以在择期剖宫产前静脉注射 (IV) 甲氧氯普胺。 这种多巴胺拮抗剂可加速非妊娠和孕妇的胃排空并增加静息下食管括约肌张力。 然而,关于其疗效(可能是由于给药时机)和副作用频率(如锥体外系反应和短暂的神经功能障碍)的数据相互矛盾。
影响血浆容量、血液成分和葡萄糖代谢的内分泌变化
血浆量和总血量在妊娠早期开始增加,导致足月分别增加 40%–50% 和 25%–40%。 这些变化是由于怀孕期间盐皮质激素活性增加,导致钠潴留和体内水含量增加。 红细胞体积的相对较小的增加(20%)导致血红蛋白(至 11-12 g/L)和红细胞比容(至 35%)的相对减少; 然而,血小板计数保持不变。 正常妊娠期间血浆纤维蛋白原浓度增加约 50%,而凝血因子活性是可变的。 怀孕期间凝血因子 I、VII、VIII、IX、X 和 XII 增加,而因子 XI 和 XIII 浓度降低,而因子 II 和 V 浓度在怀孕期间保持不变。
到足月,血清胆碱酯酶活性下降至低于正常水平 20%,并在产褥期达到最低点。 这些血清胆碱酯酶变化的净效应与临床使用剂量的琥珀胆碱或酯型局部麻醉剂(2-氯普鲁卡因)的代谢无关。 白蛋白-球蛋白比率下降是因为白蛋白浓度下降幅度相对较大。 血清蛋白浓度的降低可能具有临床意义,因为可以预期蛋白结合药物的游离部分会增加。
人胎盘催乳素和皮质醇会增加高血糖和酮症的倾向,这可能会加剧先前存在的糖尿病。 患者处理葡萄糖负荷的能力下降,葡萄糖经胎盘通过可能会刺激胎儿分泌胰岛素,进而导致产后立即出现新生儿低血糖。
妊娠期药物反应改变
怀孕导致黄体酮介导的神经对局部麻醉剂的敏感性增加。 每个硬膜外或脊髓阻滞的皮节段需要较低剂量的局部麻醉剂。 这归因于硬膜外静脉充血导致局麻药在硬膜外和蛛网膜下腔的扩散增加以及黄体酮对局麻药阻滞的敏感性增强。 吸入剂的最低肺泡浓度在妊娠 8-12 周时降低,可能与孕酮水平升高有关。
NYSORA 小贴士
- 在怀孕期间,黄体酮介导的神经对局部麻醉剂的敏感性增加。
- 每个硬膜外或脊髓阻滞的皮节段需要降低局部麻醉剂的剂量。
局部麻醉剂的胎盘转移
局部麻醉剂很容易通过简单的扩散穿过胎盘。 影响药物向胎盘转移的因素有很多,包括药物本身的理化特性、母体血浆中的药物浓度、胎盘的性质以及母胎单位内的血流动力学事件。高脂溶性药物,如局麻药、交叉生物膜更容易形成,并且电离程度很重要,因为药物的非电离部分比电离药物更亲脂。 局麻药是弱碱,电离度较低,脂溶性较大。 以非电离和电离形式存在的药物的相对浓度可以通过 Henderson-Hasselbalch 方程估算:
pH值=pKa + 对数(碱)/(阳离子)
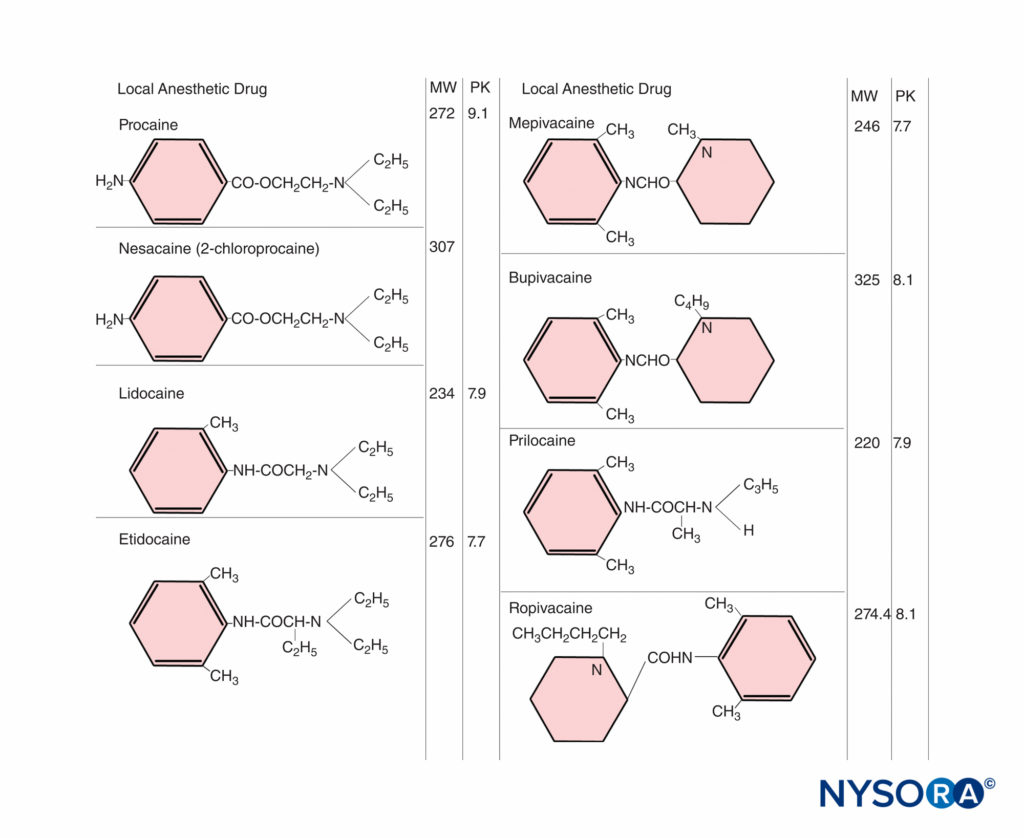
对于局部麻醉剂,碱与阳离子的比例变得尤为重要,因为非离子形式可穿透组织屏障,而离子形式在阻断神经传导方面具有药理活性。 PKa (酸解离常数)是游离碱和阳离子浓度相等时的 pH 值。 对于酰胺局麻药,pKa 值(7.7-8.1)足够接近生理 pH 值,因此母体或胎儿生化状态的变化可能会显着改变离子化和非离子化药物的比例(图1)。 在稳态下,胎儿和母体血浆中非离子局麻药的浓度相等。 对于胎儿酸中毒,药物更倾向于以电离形式存在,不能通过胎盘扩散回。 这会导致大量局部麻醉剂在胎儿血浆和组织中积聚。 这称为离子捕获。
NYSORA 小贴士
长时间使用高蛋白结合药物(如布比卡因)可能导致药物大量胎儿蓄积。
母体血浆蛋白结合对局部麻醉剂在胎儿体内积聚的速率和量的影响尚不清楚。 动物研究表明,与母体血浆蛋白广泛结合的药物(如布比卡因)的转移速度较慢。 然而,随着高蛋白结合药物(如布比卡因)的长期给药,药物可能会在胎儿体内大量积聚。
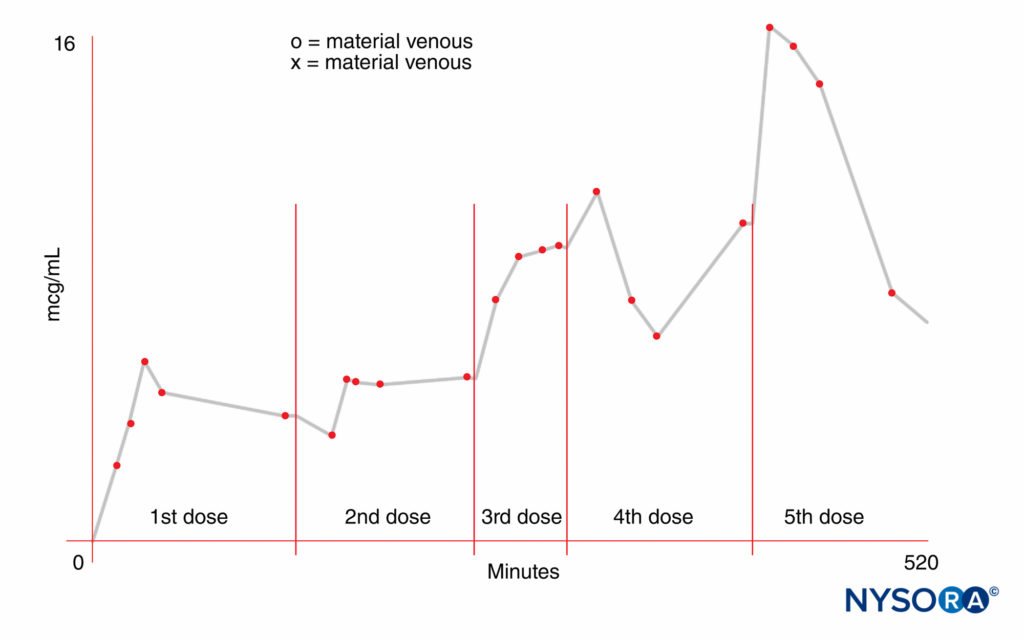
母体和胎儿血液之间的游离药物浓度梯度是一个重要因素。 在母体方面,给药剂量、给药方式和部位以及血管收缩剂的使用都会影响胎儿的暴露量。 药物的分布、代谢和排泄率可能不同,但同样重要。 更高的剂量导致更高的母体血液浓度。 吸收率会因注射部位而异。 例如,静脉推注会导致最高的血液浓度。 曾经认为鞘内给药导致局部麻醉剂的血浆浓度可忽略不计。 然而,我们现在知道用 75 mg 利多卡因诱导的脊髓麻醉导致母体血浆浓度与其他人在硬膜外麻醉后报告的相似。 此外,在出生时的脐静脉中可以发现显着水平的药物。 除了药物的动力学特性外,重复给药可导致高母体血浓度,这取决于重新注射的剂量和频率。 酰胺类局麻药的半衰期较长,反复注射可能导致在母体血浆中蓄积。图2)。 相反,2-氯普鲁卡因是一种酯类局部麻醉剂,在假胆碱酯酶存在下会发生快速酶水解。 硬膜外注射后,母亲的平均半衰期约为 3 分钟; 回注后仅2-5分钟即可在母体血浆中检测到10-氯普鲁卡因,且未发生该药蓄积。
怀孕与生理变化有关,这些生理变化也可能影响母体药代动力学和麻醉药物的作用。 这些变化在妊娠过程中可能是渐进的,并且通常难以预测单个药物。 尽管如此,已证明硬膜外注射后布比卡因的消除半衰期在孕妇和非孕妇中相似。
胎儿局部血流变化也会影响单个器官吸收的药物量。 例如,在窒息和酸中毒期间,较大比例的胎儿心输出量灌注胎儿大脑、心脏和胎盘。 与未窒息的对照胎儿相比,利多卡因的输注导致窒息狒狒胎儿心脏、大脑和肝脏的药物摄取增加。
药物暴露风险:胎儿与新生儿
在跨胎盘的游离药物的浓度梯度被逆转后,胎儿可以将局部麻醉剂排泄回母体循环。 即使母亲体内的总血浆药物浓度超过胎儿体内的总药物浓度,也可能发生这种情况,因为胎儿血浆中的蛋白质结合较低。 2-氯普鲁卡因是唯一一种在胎儿血液中代谢如此迅速的药物,即使出现酸中毒,也可以避免胎儿大量接触。
足月和早产儿都具有酰胺局部麻醉剂生物转化所必需的肝酶。 在一项比较研究中,利多卡因在成年母羊和胎儿/新生羔羊中的药代动力学表明,新生儿的代谢清除率与成人相似,肾脏清除率大于成人。 然而,新生儿的半衰期更长; 这与更大的分布体积和组织吸收有关,因此,在任何特定时刻,新生儿的肝脏和肾脏都暴露于体内积聚的较小比例的利多卡因。 在另一项涉及在新生儿重症监护病房中对人类婴儿施用利多卡因的研究中也报道了类似的结果。
新生儿抑郁症发生在甲哌卡因或利多卡因的血液浓度比成人全身毒性浓度低约 50% 时。 然而,当甲哌卡因水平降至成人惊厥阈值以下时,意外在子宫内注射甲哌卡因(用于产妇尾部麻醉)的婴儿停止惊厥。 已经在绵羊中研究了局部麻醉剂的相对中枢神经毒性和心肺毒性。 在胎儿和新生羔羊中产生毒性所需的剂量大于在母羊中所需的剂量。 在胎儿中,这种差异归因于药物在母体中的胎盘清除以及惊厥期间更好地维持血气张力,而在新生羔羊中,较大的分布容积可能是导致毒性作用所需的较高剂量的原因。
有人提出,布比卡因可能是新生儿黄疸的一个可能原因,因为它对胎儿红细胞膜具有高亲和力,导致过滤性和变形性降低,使受试者更容易发生溶血。 然而,最近的一项研究未能显示在分娩和分娩期间母亲接受布比卡因硬膜外麻醉的新生儿中可证明产生胆红素。
神经行为研究揭示了区域麻醉对新生儿神经和适应性功能的细微变化。 在大多数麻醉剂的情况下,这些变化是轻微和短暂的,仅持续 24-48 小时。
分娩和阴道分娩麻醉
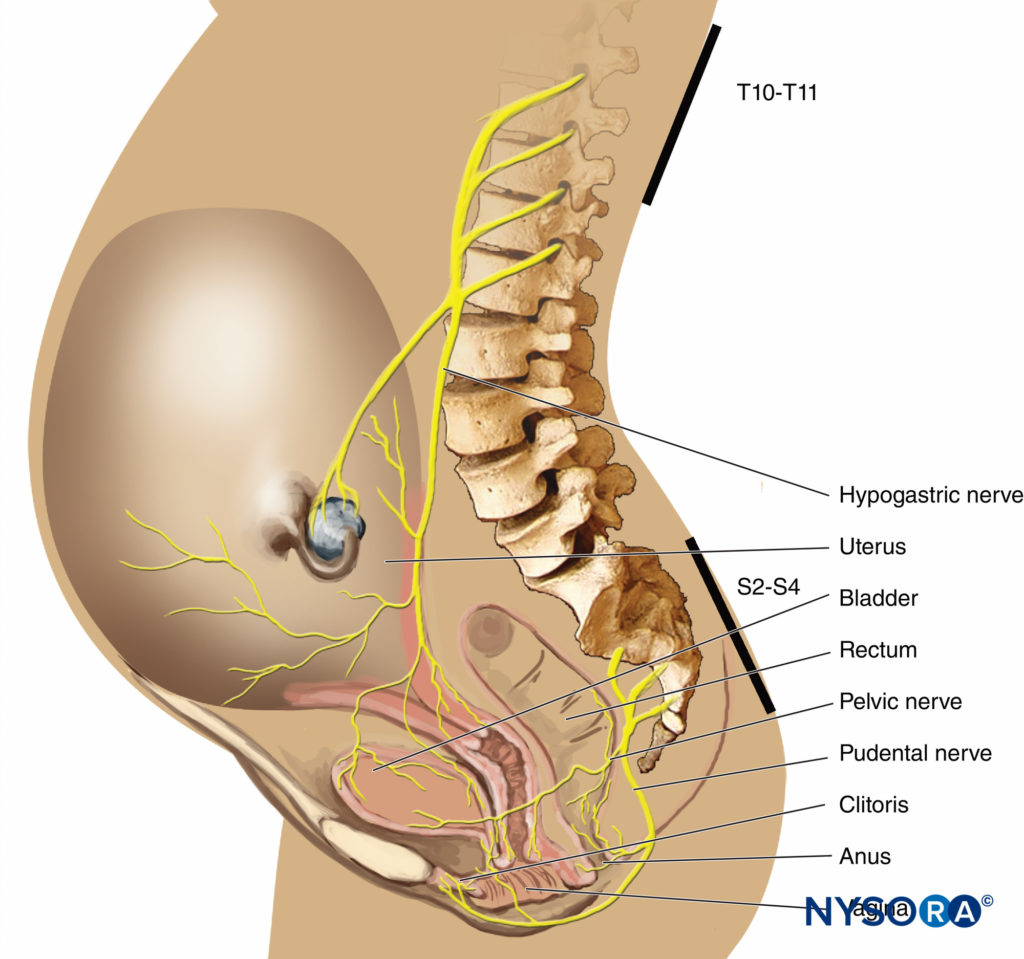
在分娩的第一阶段,疼痛是由与宫颈扩张和子宫下段扩张相关的子宫收缩引起的。 疼痛冲动在伴随交感神经的内脏传入 C 型纤维中传播。 在分娩早期,只有下胸部皮节(T11-T12)受到影响。 然而,在过渡期进行性宫颈扩张时,可能会累及相邻的皮节,并且疼痛从 T10 转移到 L1。 在第二阶段,由于阴道穹窿和会阴膨胀引起的额外疼痛冲动被传递到由下骶纤维(S2-S4)组成的阴部神经。
除了减轻疼痛和焦虑之外,局部镇痛还可能使母亲受益。 在动物研究中,疼痛可能导致母体高血压和子宫血流减少。 硬膜外镇痛可减缓因疼痛的子宫收缩和“下压”努力而导致的产妇心输出量、心率和血压的增加。 通过减少母体儿茶酚胺的分泌,硬膜外镇痛可以将以前功能失调的分娩模式转变为正常分娩模式。 局部镇痛可以通过消除母体过度换气引起的疼痛而使胎儿受益,由于母体氧-血红蛋白解离曲线向左移动,这通常导致胎儿动脉氧分压降低。
最常选择的缓解分娩疼痛的方法是心理预防、全身用药和局部镇痛。 吸入镇痛、常规脊髓镇痛和宫颈旁阻滞不太常用。 全身麻醉很少需要,但在一些复杂的分娩中可能用于子宫松弛。
全身镇痛
全身镇痛剂的优点包括易于给药和患者可接受性。 然而,必须仔细选择药物、剂量、时间和给药方法,以避免母婴抑郁症。 用于全身镇痛的药物是阿片类药物、镇静剂,偶尔还有氯胺酮。
全身性阿片类药物
过去,哌替啶是最常用的全身镇痛剂,用于缓解产程第一阶段的疼痛。 它可以通过静脉注射(5-10 分钟有效镇痛)或肌肉注射(40-50 分钟达到峰值)给药。 它也常用于一般人群的术后疼痛。 但随着其管理的普及,令人不安的副作用开始出现。 最严重的副作用之一是主要药物作用和药物代谢物去甲哌啶引起的癫痫发作。 在有癫痫发作风险的怀孕患者中——即患有妊娠高血压或先兆子痫——通过施用已知会导致癫痫发作的药物来混淆图片会使患者护理复杂化。 其他副作用包括恶心和呕吐、与剂量相关的通气抑制、体位性低血压、新生儿抑郁的可能性以及与镇痛作用不成比例的欣快感,从而导致药物滥用。 哌替啶还可能导致胎儿心率的短暂改变,例如心跳变异性降低和心动过速。 除其他因素外,新生儿抑郁症的风险与最后一次注射药物和分娩之间的间隔有关。 活性代谢物去甲哌啶的胎盘转移在新生儿中具有较长的消除半衰期(62 小时),也与导致新生儿抑郁和轻微的新生儿神经行为功能障碍有关。 全身给药哌替啶对分娩过程的影响是有争议的。 有人提出,哌替啶给药可能会延长产程的潜伏期,但会缩短第一产程的累积时间。 然而,最近的一项研究表明,为了可能缩短难产妇女的第一产程,给予哌替啶没有任何益处。
使用较新的合成阿片类药物(如芬太尼和阿芬太尼)的经验有限。 尽管它们很有效,但它们在分娩时的用处受限于它们的作用时间短。 然而,当需要快速起效但持续时间短的镇痛(例如,使用镊子)时,这些药物具有优势。 例如,单次静脉注射芬太尼(最高 1 mcg/kg)可迅速缓解疼痛,但不会出现严重的新生儿抑郁症,但持续时间很短。 与等效的哌替啶患者自控镇痛 (PCA) 相比,阿芬太尼可能与更严重的新生儿抑郁症有关。 在另一项研究中,与芬太尼 PCA 相比,阿芬太尼 PCA 未能提供足够的镇痛作用。 对于更长时间的镇痛,芬太尼可以通过患者控制的给药装置给药。 更常见的是,芬太尼 (15-25 mcg) 和舒芬太尼 (5-10 mcg) 已与局部麻醉剂一起使用,在初始脊髓剂量中使用局部麻醉剂,在放置连续的脊髓硬膜外分娩期间,可显着缓解疼痛。
瑞芬太尼是一种阿片类药物,可被血清和组织胆碱酯酶快速代谢,因此具有短(3 分钟)、上下文相关的半衰期。 当用于推注时(每次推注 0.3–0.8 mcg/kg),瑞芬太尼被发现具有可接受水平的母体副作用和对新生儿的最小影响。 瑞芬太尼穿过胎盘,似乎在新生儿体内快速代谢或重新分布。 在一项研究中,在硬膜外麻醉下剖宫产分娩期间,母亲接受静脉输注瑞芬太尼 0.1 mcg/kg/min 的新生儿的 Apgar 和神经行为评分良好。 当通过 PCA 给药时,与哌替啶相比,瑞芬太尼被发现可提供更好的疼痛缓解、等效的血流动力学稳定性、更少的镇静作用和更少的氧饱和度。 在最近的一项双盲试验中,将瑞芬太尼 PCA 与腰椎硬膜外麻醉的镇痛效果进行了比较。 瑞芬太尼组 56% 的女性报告了可接受的疼痛评分,而接受腰椎硬膜外镇痛的女性为 XNUMX%。 在美国以外的国家,间歇性一氧化二氮已用于分娩镇痛。 将瑞芬太尼与一氧化二氮进行比较时,发现瑞芬太尼可以更好地缓解疼痛,副作用更少。 然而,瑞芬太尼可导致通气不足和低氧血症,因此在瑞芬太尼 IV PCA 期间应常规监测氧饱和度。
阿片类激动剂-拮抗剂,例如布托啡诺和纳布啡,也已用于产科镇痛。 这些药物具有较低的恶心、呕吐和烦躁发生率,以及对通气抑制的“天花板效应”。 在一项双盲研究中,已将肌肉注射 (IM) 纳布啡与哌替啶进行了比较。 两组的镇痛效果相当; 然而,与哌替啶相比,纳布啡与增加产妇镇静作用有关。 布托啡诺可能是最流行的混合激动剂-拮抗剂。 与哌替啶不同,它被代谢成非活性代谢物,并且在剂量超过 2 mg 时对通气抑制具有天花板效应。 布托啡诺的产妇疼痛缓解效果与哌替啶相当,且阿普加评分无差异。 然而,与哌替啶相比,布托啡诺的使用与较少的孕产妇副作用有关,例如恶心、呕吐和头晕。 一个潜在的缺点是产妇镇静的发生率很高。 推荐剂量为 1-2 mg 静脉注射或肌肉注射。 纳布啡 10 mg IV 或 IM 是布托啡诺的替代品。纳洛酮是一种纯阿片类拮抗剂,不应在分娩前不久给予母亲以预防新生儿通气抑制,因为它会在最需要的时候逆转母体镇痛。 在某些情况下,据报道纳洛酮会导致母体肺水肿甚至心脏骤停。 如有必要,药物应直接给予新生儿肌肉注射(0.1 mg/kg)。
氯胺酮
氯胺酮是一种强效镇痛剂。 然而,它也可能导致不可接受的健忘症,可能会干扰母亲对出生的回忆。 尽管如此,氯胺酮是阴道分娩或产科操作期间不完全局部镇痛的有用辅助剂。 在低剂量(0.2–0.4 mg/kg)下,氯胺酮可提供足够的镇痛作用,而不会引起新生儿抑郁症。
局部镇痛技术
区域技术可提供出色的镇痛效果,而对母亲和胎儿的抑制作用最小。 最常用于分娩麻醉的技术包括中枢神经阻滞(脊髓、硬膜外和脊髓-硬膜外联合)、宫颈旁和阴部阻滞,以及较少见的腰部交感神经阻滞。 交感神经切除引起的低血压是中枢神经阻滞最常见的并发症。 因此,必须定期监测母体血压,通常在阻滞开始后每 2-5 分钟监测一次,持续约 15-20 分钟,之后定期监测。 如果存在严重的凝血功能障碍、急性低血容量或进针部位感染,则可能禁用局部镇痛。 无脓毒症的绒毛膜羊膜炎不是中央神经轴阻滞的禁忌症。
硬膜外镇痛
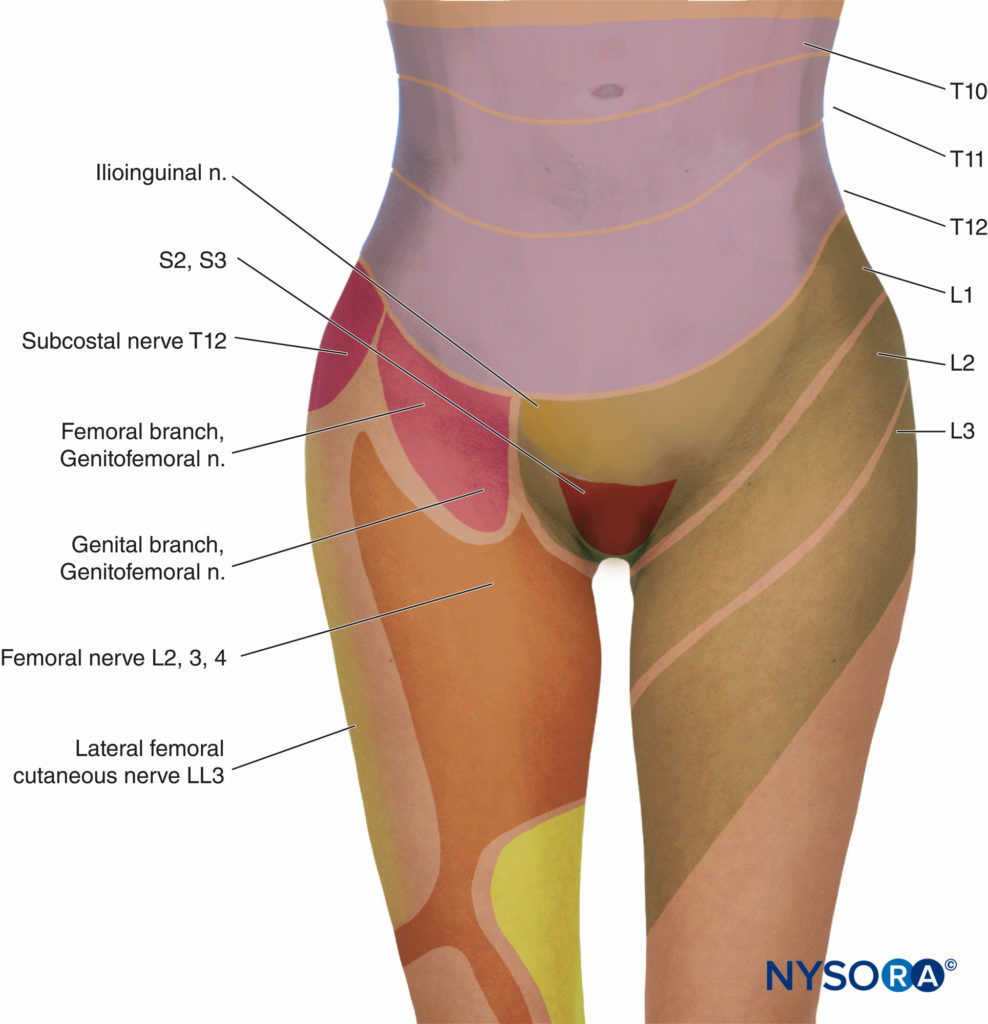
通过使用低浓度的局部麻醉剂(通常与脂溶性阿片类药物联合使用)阻断 T10-L2 皮节,可实现产程第一阶段的有效镇痛。 对于第二产程,由于阴道扩张和会阴压力引起的疼痛,阻滞应扩大至阴部,S4-XNUMX(数字3 和 4). 有人担心,在分娩潜伏期(宫颈扩张 2-4 cm)早期开始硬膜外镇痛可能会导致第一产程延长,难产和剖宫产的发生率更高,特别是在未生育的妇女。 一般来说,硬膜外镇痛不会延长第一产程,前提是要避免压迫主动脉。 栗子等人。 表明在潜伏期(扩张 4 cm)开始硬膜外镇痛的初产妇与在活动期开始镇痛的女性相比,剖宫产的发生率没有差异。 其他研究表明,与IV PCA相比,硬膜外镇痛与未产妇剖宫产率增加无关。
然而,据报道,未产妇女的第二产程延长,可能是由于胎儿的排出力减少或胎位不正。
因此,随着硬膜外镇痛的使用,美国妇产科学院 (ACOG) 将未产妇女的第二产程异常延长定义为超过 3 小时,而经产妇女则超过 2 小时。
通过使用超稀释的局部麻醉剂溶液和阿片类药物,可以最大限度地减少第二产程的时间。 长效酰胺类药物,如布比卡因、罗哌卡因和左布比卡因,是最常用的,因为它们产生出色的感觉镇痛作用,同时保留运动功能,特别是在用于硬膜外镇痛的低浓度下。
NYSORA 小贴士
- 分娩第一阶段的镇痛是通过用低浓度的局部麻醉剂阻断 T10-Ll 皮节来实现的(见 图3).
- 由于阴道扩张和会阴压力引起的疼痛,第二产程和分娩的镇痛需要阻滞 S2-4 节段。
第一产程镇痛可用 5–10 mL 布比卡因、罗哌卡因或左布比卡因 (0.125%–0.25%),然后连续输注 (8–12 mL/h) 0.0625% 布比卡因或左布比卡因,或 0.1% 罗哌卡因。 可添加芬太尼 1–2 mcg/mL 或舒芬太尼 0.3–0.5 mcg/mL。 在实际分娩过程中,可以在半卧位用 10 mL 0.5% 布比卡因、1% 利多卡因或,如果需要快速起效,用 2% 氯普卡因封闭会阴。使用局部麻醉剂的稀释溶液。
仅导管抽吸并不总是具有诊断意义。 出于这个原因,一些作者认为应该给予测试剂量以提高对鞘内或血管内放置的硬膜外导管的检测。 如果将 15 mcg 肾上腺素注射到血管中,则在给药后 20 秒内,心率会发生 30-30 bpm 的变化,血压会略有升高。 持续时间约为 30 秒。 麻醉师应在注射后的第一分钟内观察脉搏血氧仪,以确定是否发生了意外的血管内注射。 然而,与静脉内试验剂量的肾上腺素相关的心动过速并不是分娩期间血管内注射的可靠指标,因为它可能与疼痛的子宫收缩同时发生混淆。 此外,肾上腺素对接受β-肾上腺素能受体拮抗剂的患者不可靠。 血管内注射的其他微妙迹象可能包括忧虑或不安或心悸的感觉。 分割局部麻醉剂的总剂量并每隔一分钟观察患者是很重要的。
患者自控硬膜外镇痛 (PCEA) 是传统推注或输注技术的安全有效替代方案。 产妇接受度高,对麻醉人力的需求可能会减少。 研究表明,与没有基础速率硬膜外输注的 PCEA 相比,具有相对较低的连续硬膜外输注和充值的 PCEA 需要更少的麻醉干预。 初始镇痛是通过推注局部麻醉剂来实现的。 一旦母亲感到舒适,就可以开始 PCEA 维持输注 (8–12 mL/h) 局部麻醉剂(布比卡因、左旋布比卡因或罗哌卡因 0.0625%–0.125%),加或不加阿片类药物(芬太尼 1-2 mcg /mL 或 sufen-anil 0.3–0.5 mcg/mL)。 该机器可以被编程以管理 8 mL 的硬膜外需求推注,两次给药之间的锁定期为 10 分钟。
尾部而非腰部入路可能会导致会阴部镇痛起效更快,因此当预期阴道分娩即将进行时,可能比腰部硬膜外入路更可取。 然而,尾部镇痛不再流行,因为偶尔会出现针头放置疼痛、失败率高、注射部位的潜在污染以及胎儿意外注射的风险。 在尾部注射之前,必须进行直肠指检以排除针头放置在胎儿先露部位。 在现代实践中,低位脊髓“鞍座阻滞”实际上消除了对尾部麻醉的需要。
脊髓镇痛
用于分娩镇痛的单次鞘内注射,通常是阿片类药物和小剂量的局部麻醉剂,具有在分娩第一阶段可靠和快速起效的好处。 然而,长时间分娩可能需要重复鞘内注射,从而增加硬膜穿刺后头痛的风险。 此外,运动阻滞可能会让一些女性感到不舒服,并可能延长第二产程。 该技术最适用于在分娩过程中快速进展并需要在完全宫颈扩张和预期阴道分娩之前进行镇痛或短期麻醉的多产产妇,或在无法进行连续硬膜外镇痛的情况下。
微导管在 1980 年代被引入用于连续脊髓麻醉。 当发现它们与神经功能缺陷相关时,它们随后被撤回,这可能与马尾区局部麻醉剂的分布不均有关。 幸运的是,在最近的一项多机构研究中,未出现使用 28 号微导管对分娩妇女进行持续脊柱镇痛后出现神经系统症状的病例。 脊髓麻醉也是用于器械分娩的全身麻醉的一种安全有效的替代方法。
脊髓硬膜外联合镇痛
腰硬联合 (CSE) 镇痛是一种理想的分娩镇痛技术。 它结合了脊髓注射产生的快速、可靠的深度镇痛作用以及硬膜外技术的灵活性和更长的持续时间。 在最近的一项荟萃分析中,CSE 的镇痛起效明显快于硬膜外技术(2-5 分钟对 10-15 分钟)。
技术
在使用常规(或专用)硬膜外针确定硬膜外腔后,将一根较长(127 毫米)的铅笔尖脊髓针通过硬膜外针推进到蛛网膜下腔。 鞘内注射后,取出脊髓针,插入硬膜外导管。 鞘内注射芬太尼 10-25 mcg 或舒芬太尼 2.5-5 mcg,单独或与多达 1 mL 的 0.25% 异压布比卡因联合使用,可产生持续 60-120 分钟的深度镇痛,且运动阻滞最小。
应该注意的是,鞘内注射阿片类药物的瘙痒发生率高于硬膜外注射阿片类药物。 单独的阿片类药物可能为早期潜伏期提供足够的缓解,但添加布比卡因几乎总是必要的,以在晚期分娩期间获得令人满意的镇痛。 也使用了其他佐剂。 可乐定和新斯的明等佐剂的添加令人失望。 可在脊髓注射后 0.03 分钟内开始硬膜外输注 0.0625%–10% 的阿片类布比卡因。 或者,可以在必要时激活硬膜外成分。 不需要持续监测胎儿的血流动力学稳定且运动功能正常的女性可以在帮助下行走。 下床前,应在鞘内或硬膜外给药后观察妇女 30 分钟,以评估母体和胎儿的健康状况。 最近的一项研究表明,对未产妇女早期给予 CSE 镇痛剂不会增加剖宫产率。
NYSORA 小贴士
单独鞘内注射芬太尼 10-25 mcg 或舒芬特安尼 5-10 mcg,或者更常见的是与 1 mL 0.25% 异压布比卡因一起注射,可产生持续 90-120 分钟的深度镇痛,且运动阻滞最小。
鞘内阿片类药物最常见的副作用是瘙痒、恶心、呕吐和尿潴留。 芬太尼和舒芬太尼很少发生导致延迟性呼吸抑制的嘴部扩散,通常在注射后 30 分钟内发生。 由于子宫过度刺激,可能会出现短暂的、令人不安的胎儿心率模式,这可能是由于母体儿茶酚胺的快速减少导致催产素的无拮抗作用。
O'Gorman 等人的初步研究。 提示胎儿心动过缓可能在没有子宫过度刺激或低血压的情况下发生,并且与子宫胎盘功能不全无关。 经产妇女的胎儿心率异常的发生率可能在快速进展的痛苦分娩中更高。 大多数研究表明,CSE 镇痛的紧急剖宫产发生率并不高于常规硬膜外镇痛。 硬膜穿刺后头痛始终是鞘内注射后的风险。 然而,与标准硬膜外镇痛相比,CSE 镇痛的头痛发生率并不高。
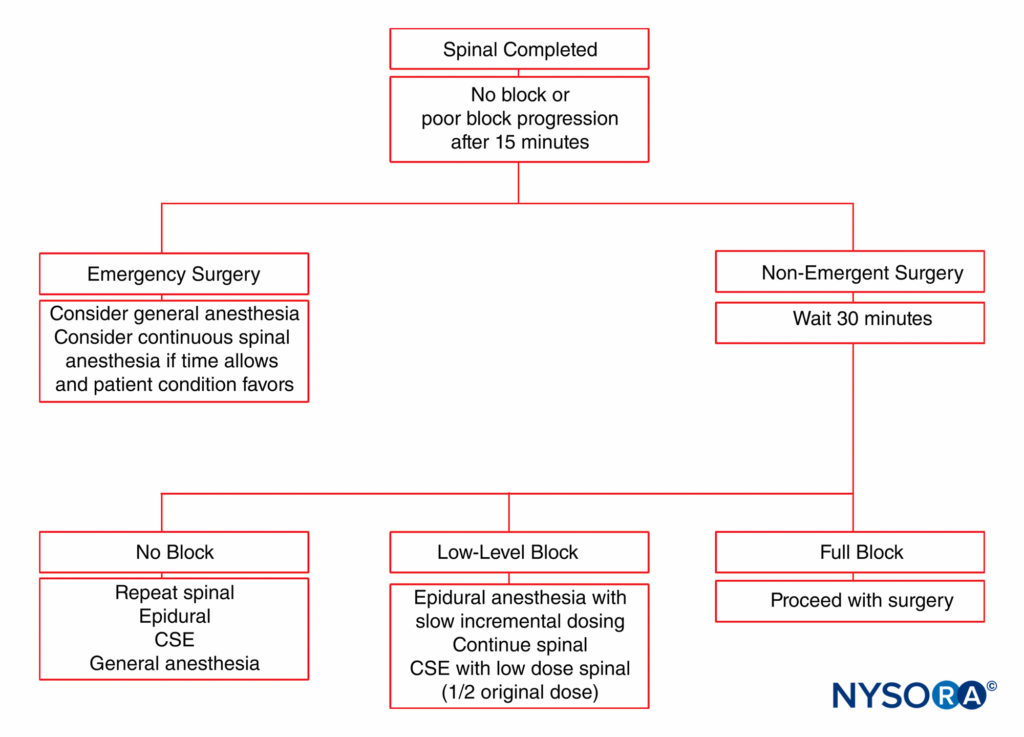
在使用 27 号脊髓针进行 CSE 镇痛后,通过硬脑膜穿刺部位意外放置鞘内导管也很少见。 硬膜外给药的药物存在通过硬膜穿刺鞘内渗漏的可能性,特别是在快速注射大量药物的情况下。 事实上,与使用标准腰椎硬膜外技术进行剖宫产分娩相比,使用 CSE 镇痛的硬膜外药物需求量减少了大约 30%。 一些临床医生不提倡 CSE 分娩镇痛技术,因为担心“未经证实的”硬膜外导管可能需要紧急用于剖宫产分娩。 患者的部分阻滞可能不足以进行硬膜外麻醉,这可能有效也可能无效。 硬膜外麻醉不完整时的患者管理算法见 图5.
宫颈阻滞
就在 2001 年,美国只有 2%–3% 的产妇在分娩时出现宫颈旁阻滞。 虽然宫颈旁阻滞可有效缓解第一产程的疼痛,但现在在美国很少使用,因为它与胎儿心动过缓的高发病率有关,尤其是在使用布比卡因时。 这可能与子宫动脉收缩或子宫张力增加有关。
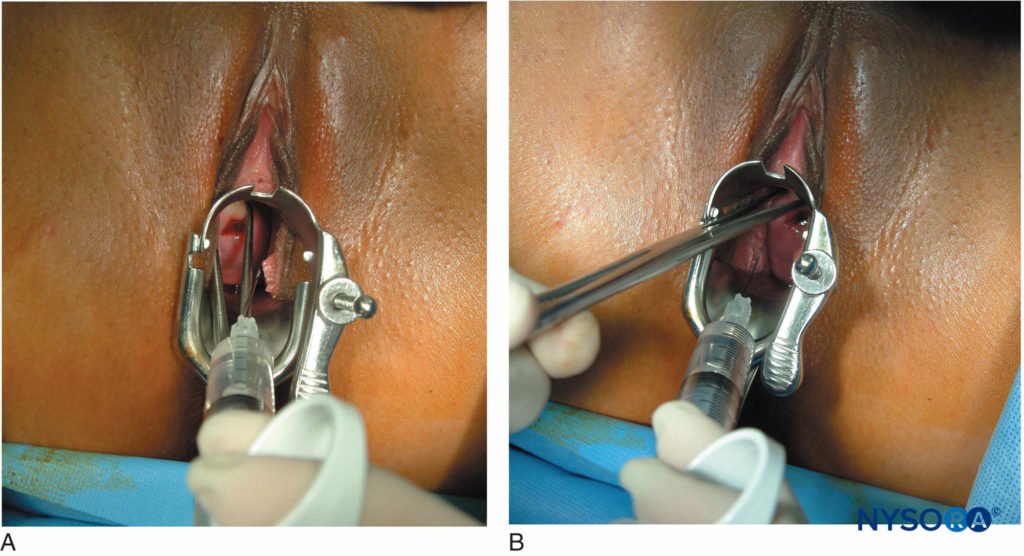
与消旋布比卡因相比,左旋布比卡因的使用已被证明可减少胎儿心动过缓。 宫颈旁阻滞是一种为刮宫术提供镇痛的有用技术。 该技术非常简单,包括在阴道穹窿处粘膜下注射局部麻醉剂,靠近支配子宫的神经纤维。图6).
椎旁腰交感神经阻滞
椎旁腰交感神经阻滞是中央神经阻滞的合理替代方案。 腰椎交感神经阻滞有效地中断了分娩第一阶段宫颈和子宫冲动的痛苦传递。 莱顿等人。 表明,与硬膜外镇痛相比,接受腰交感神经阻滞的女性在镇痛的前两小时内宫颈扩张速度更快,第二产程更短。 然而,在分娩活跃期的扩张率没有差异。 尽管与宫颈旁阻滞相比,腰交感神经阻滞导致胎儿心动过缓的风险较小,但与阻滞性能相关的技术困难和血管内注射的风险阻碍了其常规使用。 腰交感神经阻滞也可能发生低血压。
阴部神经阻滞
阴部神经源自下骶神经根(S2-4),供应阴道穹窿、会阴、直肠和膀胱部分。 神经在环绕坐骨棘的地方很容易经阴道阻塞。
最近的一项研究表明,阴部神经阻滞不能为第二产程提供可靠的镇痛,这可能与上阴道受腰椎而非骶骨纤维支配有关。 然而,该块可用于会阴切开术和修复。 阴部神经阻滞也可能对产后有益。 例如,使用罗哌卡因单侧神经刺激器引导的阴部神经阻滞与阴道分娩时会阴中侧切开后最初 48 小时内疼痛减轻和补充镇痛的需求减少有关。
剖宫产麻醉
剖宫产最常见的适应症包括未能进展、胎儿状况不可靠、头盆不称、先露不全、早产和先前涉及子宫体的子宫手术。 除了母亲和胎儿的状况外,麻醉的选择还应取决于手术的紧迫性。 在对所有麻醉方案的风险和益处进行全面讨论后,应考虑母亲的意愿。 在开始任何麻醉技术之前,应为母亲和新生儿准备好复苏设备(表2).
表2。 产房内的复苏设备。
| 辐射加热器 |
| 带压力计和吸水阱的吸力 |
| 吸引导管 |
| 带流量计的壁式氧气 |
| 复苏袋-面罩正压通气装置(≤750 mL) |
| 婴儿口罩 |
| 婴儿口咽气道 |
| 气管导管:2.5、3.0、3.5 和 4.0 mm |
| 气管导管探针 |
| 喉镜和刀片 |
| 无菌脐动脉插管托盘 |
| 针头、注射器、三通旋塞 |
| 药物和解决方案: • 1:10,000 肾上腺素 • 盐酸纳洛酮 • 碳酸氢钠 • 音量扩展器 |
产科患者局部麻醉的优势
剖宫产占所有分娩的 30% 以上,是美国最常见的外科手术,每年有超过 1 万例。 1992 年对美国产科麻醉实践的调查表明,大多数接受剖宫产手术的患者都是在脊髓或硬膜外麻醉下进行的。
区域性技术有几个优点:它们降低了胃误吸的风险,避免使用镇静麻醉药,并允许母亲在分娩期间保持清醒。 与全身麻醉相比,局部麻醉还可减少手术失血。 一般来说,使用区域技术,产前麻醉的持续时间不会影响新生儿结局,前提是没有长期的主动脉腔静脉压迫或低血压。 低血压的风险可能比阴道分娩更大,因为感觉阻滞必须至少延伸到 T4 皮节。 研究表明,预加载晶体液并不能可靠地预防椎管内麻醉引起的低血压。 事实上,最近的研究表明,鞘内注射时的静脉共同负荷与神经阻滞前的预水合一样有效。 如果尽管采取了这些措施仍出现低血压,则应增加左侧子宫移位,增加静脉输注速度,并增加静脉注射麻黄碱 5-15 mg(或去氧肾上腺素 25-50 mcg)。 在分娩前持续低剂量输注去氧肾上腺素是预防低血压的最大成功。
脊麻
蛛网膜下腔阻滞可能是剖宫产最常用的局部麻醉剂,因为它起效快且可靠性高。 它也已成为紧急剖宫产的全身麻醉的替代方案。
已使用 5% 利多卡因、1.0% 丁卡因或 0.75% 布比卡因的高压溶液。 然而,布比卡因现在已成为剖宫产腰麻最广泛使用的药物。 Norris 使用 0.75% 高压布比卡因表明,没有必要根据患者的身高调整药物剂量。 此外,患者的年龄、体重和脊柱长度不影响最终的椎管内阻滞。 最近的研究表明,与布比卡因相比,使用脊髓罗哌卡因的低血压较少且恢复较快,但起效较慢。 然而,有人质疑罗哌卡因能否产生与布比卡因相似的脊髓麻醉效果。 剖宫产期间的血流动力学监测应与其他外科手术中使用的相似,不同之处在于应在婴儿出生前至少每 3 分钟监测一次血压。 分娩前,应常规给予氧气以优化胎儿氧合。 短暂性神经系统综合征和/或马尾神经综合征的报道与剂量大于 60 mg 的利多卡因有关,无论是 5% 还是 2% 制剂。 这导致一些临床医生避免使用利多卡因进行鞘内给药(参见下文“局部麻醉剂的全身毒性”)。 表3 列出了蛛网膜下腔阻滞剖宫产常用的局麻药和剂量。
表3。 蛛网膜下腔阻滞常用于剖宫产分娩的局麻药。
| 患者每身高的剂量(厘米) | 布比卡因 0.75% 溶于 8.25% 葡萄糖 (mg) | 布比卡因 0.5%(等压)(mg) |
|---|---|---|
| 150–160厘米 | 8 | 8 |
| 160-180 | 10 | 10-12.5 |
| > 180厘米 | 12 | 12.5-15 |
| 起效 | 2–4分钟 | 5–10分钟 |
尽管有足够的皮节水平,但女性可能会经历不同程度的内脏不适,尤其是在子宫外展和腹部内脏牵引期间。 在局麻药溶液中加入芬太尼 20 mcg 或不含防腐剂的吗啡 0.1 mg 可改善围手术期镇痛效果。 不含防腐剂的吗啡在 0.1 至 0.25 毫克的剂量范围内产生显着的镇痛作用。 较高剂量的脊髓吗啡导致更严重的瘙痒。 脊髓吗啡可发生延迟性呼吸抑制,但极为罕见,且更常与肥胖等合并症有关。 呼吸抑制是由于蛛网膜下腔吗啡的嘴部扩散。 在一项对 1915 名接受脊髓吗啡 0.15 mg 剖宫产的产妇进行的回顾性研究中,0.26 名患者 (60%) 出现呼吸困难,150 名患者需要纳洛酮。 此外,XNUMX 至 XNUMX mcg 剂量的脊髓可乐定可改善剖宫产妇女的术中镇痛效果并减少颤抖。 然而,据报道脊髓可乐定可引起低血压和镇静,可能会限制其常规使用。 服用昂丹司琼或甲氧氯普胺可缓解恶心和呕吐。 如果可能,应避免产妇镇静。 如果初始阻滞不充分,则需要担心重复进行脊髓注射以及可能会因疏忽而导致高位脊髓麻醉。 看 图5 在脊髓麻醉无法证明足以进行手术的情况下,可提供一系列选择。
NYSORA 小贴士
- 即使有足够的皮层水平进行手术,接受剖宫产的女性也可能会感到不适,特别是在子宫外露和腹部内脏牵引期间。
- 在局麻药溶液中加入芬太尼 20 mcg 或不含防腐剂的吗啡 0.1 mg 可增强围手术期镇痛效果。
腰椎硬膜外麻醉
与脊髓麻醉相比,硬膜外麻醉起效较慢,并且需要较大的药物来建立足够的感觉阻滞。 优点是可以降低硬膜穿刺后头痛的风险,并且能够通过硬膜外导管滴定局部麻醉剂。 然而,正确放置硬膜外导管和避免无意的鞘内或血管内注射是必不可少的。
硬膜外导管抽吸血液或脑脊液对于检测导管错位不是 100% 可靠的。 出于这个原因,“测试剂量”通常用于排除无意的血管内或鞘内导管放置。 如果鞘内注射小剂量的局部麻醉剂,利多卡因 45 mg 或布比卡因 5 mg,会产生易于识别的感觉和运动阻滞。 然而,最近的一项研究表明,罗哌卡因 15 mg 不是一种有用的鞘内试验剂量,因为运动阻滞的缓慢发作可能会妨碍鞘内注射的及时诊断。 添加 15 mcg 肾上腺素并仔细连续监测心率和血压可能预示着血管内注射会导致心率和血压短暂升高。 然而,肾上腺素测试剂量不可靠,因为假阳性结果确实以与疼痛性子宫收缩相关的心动过速的形式出现。 此外,肾上腺素可能会降低某些患者的子宫胎盘灌注。 心电图和峰峰值心率标准的应用可以改善检测(肾上腺素注射前的最大心率超过 10 次)。 快速注入 1 mL 空气并同时进行胸前多普勒监测似乎是血管内导管放置的可靠指标。 最重要的是,阴性测试虽然令人放心,但并不能消除局部麻醉剂分次给药的需要。
NYSORA 小贴士
- 硬膜外导管抽吸血液或脑脊液对于检测导管错位并不是绝对可靠的。
- “测试剂量”通常用于排除无意的血管内或鞘内导管放置。
- 如果鞘内注射小剂量的局部麻醉剂,利多卡因 45 mg 或布比卡因 5 mg,会产生易于识别的感觉和运动阻滞。
- 添加肾上腺素 15 mcg 并仔细监测血流动力学可能会在心率和血压短暂增加时发出血管内注射信号。
- 然而,使用肾上腺素试验剂量是有争议的,因为在子宫收缩的情况下确实会出现假阳性结果。
局部麻醉剂选择
最常用的局部麻醉剂是 2% 的 3-氯普鲁卡因、0.5% 的布比卡因和 2% 的利多卡因与 1:200,000 的肾上腺素。 充分麻醉通常可以通过分次给药 15-25 mL 的局部麻醉剂来实现。 应像腰麻一样监测患者。 由于其在母体和胎儿血浆中的极高代谢率,2-氯普鲁卡因提供了一种起效迅速、可靠的阻滞剂,全身毒性风险最小。 在胎儿酸中毒的情况下,以及在为紧急剖宫产而快速延长已有的硬膜外阻滞时,它是首选的局部麻醉剂。 使用含有相对高浓度亚硫酸氢钠和低 pH 值的制剂,在不经意间大量鞘内给药后会出现神经功能障碍。
在 2-氯普鲁卡因 (Nesacaine-MPF) 的新配方中,乙二胺四乙酸 (EDTA) 已替代亚硫酸氢钠。 然而,在手术患者中硬膜外注射大量 Nesacaine-MPF 后,已经描述了严重的痉挛性背痛,但在产妇中没有。 这归因于 EDTA 诱导的椎旁肌肉中钙的浸出。 最新的 2-氯普鲁卡因配方不含添加剂,包装在琥珀色小瓶中以防止氧化。
布比卡因 0.5% 提供深度麻醉,剖宫产起效较慢,但作用持续时间较长。 这种药物引起了相当大的关注,因为据报道,无意的血管内注射不仅会导致抽搐,而且几乎同时会导致心脏骤停,患者通常难以复苏。 与其他酰胺类局麻药相比,布比卡因(和依替卡因)的心脏毒性更大,这一点已得到充分证实。当使用强效长效酰胺类局麻药时,诱导剂量的分割至关重要。 利多卡因的起效和持续时间介于 2-氯普鲁卡因和布比卡因之间。 需要在局部麻醉溶液中加入肾上腺素以确保充分的腰骶麻醉,这限制了利多卡因在产妇高血压和子宫胎盘功能不全的妇女中的使用。
硬膜外给予阿片类药物(例如 4 mg 吗啡)或使用 PCEA 可延长术后疼痛缓解。 使用吗啡可能会出现延迟性呼吸抑制; 因此,必须在术后期间仔细监测患者。 最近,一种脂质包裹的吗啡 (DepoDur) 制剂已被批准用于剖宫产术后镇痛。 它只能在硬膜外使用,可持续长达 48 小时,并且必须监测患者是否出现延迟性呼吸抑制。 产科的一个潜在限制是,一旦给药,在长达一小时的时间内不能通过硬膜外注射额外的局部麻醉剂,因为局部麻醉剂可能导致吗啡从脂质中不受控制地释放。 卡瓦略等人。 评估了 5、10 和 15 mg 缓释吗啡用于剖宫产术后镇痛的硬膜外给药,并证明 10 mg 和 15 mg 剂量在手术后长达 48 小时内提供了良好的镇痛作用。 没有观察到明显的副作用。 另一项研究表明,与不含防腐剂的吗啡相比,接受缓释吗啡的患者的疼痛评分更低,补充镇痛药的需求更少。 没有观察到恶心、瘙痒或镇静评分的差异。 此外,已发现硬膜外芬太尼(50-100 mcg)的推注给药可导致脊髓和脊髓上作用部位的活动并改善麻醉质量。
麻醉并发症
孕产妇死亡率
一项关于 1979 年至 1990 年间美国麻醉相关死亡的研究表明,全身麻醉的病死率是区域麻醉的 16.7 倍。 大多数与麻醉相关的死亡是在遇到困难确保气道时因低氧血症导致心脏骤停的结果。 妊娠引起的解剖和生理变化,例如 FRC 降低、耗氧量增加和口咽水肿可能使患者在呼吸暂停和通气不足期间面临严重的去饱和风险。
肺抽吸
孕妇吸入胃内容物的风险会增加,特别是在难以建立气道或气道反射迟钝的情况下。 降低误吸风险的措施包括综合气道评估、预防性使用非颗粒抗酸剂以及首选使用区域麻醉。 如果发生误吸,管理包括立即使用持续气道正压通气 (CPAP) 治疗低氧血症,并可能进行硬质支气管镜检查。 最近的研究不支持使用皮质类固醇或用盐水和碳酸氢盐进行肺灌洗来中和酸度。 不推荐使用预防性抗生素,因为胃内容物是无菌的。
低血压
区域麻醉可能与低血压有关,这与局麻引起的交感神经松解的程度和速度有关。 因此,硬膜外麻醉可以观察到更大的血流动力学稳定性,局部麻醉剂的逐渐滴定可以更好地控制阻滞水平,并为预期血压降低提供足够的血管加压药给药时间。
与非分娩女性相比,分娩女性发生低血压的风险较低。 在区域麻醉开始前用 15 mL/kg 乳酸林格溶液对产妇进行预水合,避免主动脉腔静脉受压,可能会降低低血压的发生率。 已经证明,为了有效预防低血压,预负荷增加的血容量必须足以导致心输出量显着增加。 这只有在施用 hetstarch 0.5-1 L 时才有可能。尽管如此,关于容量负荷在预防低血压方面的功效仍存在争议。 最近的一项研究使用预防性输注去氧肾上腺素结合鞘内注射时给予的快速晶体共同加载显着降低了脊髓麻醉引起的低血压的发生率。 如果在预补液后仍出现低血压,治疗措施应包括增加子宫位移、快速输注静脉输液、滴定静脉麻黄碱(5-10 mg)和给氧。 在产妇心动过速的情况下,可在子宫胎盘功能正常的女性中用 25-50 mcg 去氧肾上腺素替代麻黄碱。 持续警惕和积极管理低血压可以预防母亲和新生儿的严重后遗症。
高位脊髓麻醉
在现代实践中,高度或完全脊髓麻醉是鞘内注射的罕见并发症。 它发生在蛛网膜下腔局部麻醉剂过度向头部扩散时。 由于硬脑膜穿刺或导管迁移而导致的硬膜外药物意外鞘内给药也可能导致这种并发症。 可能需要左侧子宫移位和持续的液体和血管加压剂给药以实现血流动力学稳定性。 反向特伦德伦伯卧位不能防止向头侧扩散,并且可能由于与交感神经切除术相关的静脉汇集而导致心血管衰竭。 快速控制气道是必不可少的,可能需要气管插管以确保在没有误吸的情况下进行氧合。
NYSORA 小贴士
- 产科患者经常抱怨在椎管内麻醉下剖宫产时呼吸困难。
- 虽然最常见的原因是在腹部和胸段被麻醉(包括拉伸感受器)时无法感觉到“呼吸”,但从业者必须通过重复检查排除即将发生的“高位脊柱”麻醉。
- 以下操作有助于排除高度椎管内麻醉的可能性:
– 患者发声的能力
– 患者挤压医生手的能力(表明阻滞水平低于臂丛神经水平(C6-T1)
局麻药的全身毒性
反复硬膜外注射后意外的血管内注射或药物蓄积可导致局部麻醉剂的血清水平升高。 宫颈旁和阴部阻滞后也可能发生从高血管注射部位的局部麻醉剂的快速吸收。 进行任何主要神经阻滞时,应始终准备好复苏设备。 静脉通路、气道设备、急救药物和吸引设备应立即可用。 为避免局部麻醉剂的全身毒性,必须严格遵守推荐剂量并避免无意的血管内注射。
尽管采取了这些预防措施,但仍可能发生危及生命的抽搐,更罕见的是,可能会发生心血管衰竭。 已用静脉注射硫喷妥钠 25-50 mg 或地西泮 5-10 mg 治疗癫痫发作。 在目前的临床实践中,丙泊酚 20-50 mg 或咪达唑仑 2-4 mg 更常用。应评估气道并保持氧合。 如果确实发生心血管衰竭,则应遵循高级心脏生命支持 (ACLS) 算法。 在 2006 年的病例报告中,脂质乳剂用于治疗因布比卡因毒性引起的难治性心脏骤停。 作用机制尚不清楚,但可能是由于布比卡因对脂质的亲和力更大,或者因为脂质为布比卡因中毒的线粒体能量系统提供了底物。 需要进一步的研究来确定这种治疗的功效。 然而,对布比卡因中毒的孕妇的治疗似乎应包括在复苏早期给予脂质乳剂。 当前推荐的脂质拯救方案(参见 http://www.lipidrescue.org)涉及 20% 脂质乳剂:1.5 mL/kg 初始推注,然后 0.25 mL/kg/min 持续 30-60 分钟。 当血管内注射布比卡因时,早期给予脂质也被证明可以防止心脏骤停的进展。
每当发生产妇心脏骤停时,无论何种原因,如果复苏尝试未能缓解主动脉腔静脉压迫并确保心脏按摩的效率,应尽早分娩,通常在 5 分钟内分娩。
硬膜穿刺后头痛
如果发生意外硬膜穿刺,孕妇发生硬膜穿刺后头痛 (PDPH) 的风险更高。 在最近的一项荟萃分析中,硬膜外针意外穿刺硬膜后发生 PDPH 的风险为 52.1%(95% 置信区间 [CI],51.4-52.8%)。 降低的硬膜外压力增加了脑脊液通过硬膜开口泄漏的风险。 拉塞尔等人。 据报道,与重复硬膜外麻醉相比,在意外硬膜穿刺后放置鞘内导管并未降低头痛的发生率或对血液补片的需求。 与 16 号硬膜外针相比,使用 18 号针头的头痛发生率更高。 硬膜穿刺后头痛的病理生理学和治疗将在 硬膜穿刺后头痛.
神经系统并发症
中枢神经阻滞的神经系统后遗症虽然罕见,但已有报道。 针头或导管对脊神经根施加的压力会立即产生疼痛并需要重新定位。 硬膜外脓肿和脑膜炎等感染非常罕见,可能是全身性败血症的表现。 近年来,有数例产科患者硬膜外置管后发生硬膜外脓肿的报道。
从这些病例中确定的潜在危险因素是常见致病微生物(如金黄色葡萄球菌)的入口点感染、可能的全身感染源、无菌技术差和导管插入时间延长。 硬膜外血肿也可能发生,通常与凝血缺陷有关。 然而,硬膜外血肿也可能自发发生,与器械无关。 发病机制可能是由于硬膜外血管结构减弱所致。 神经根刺激可能会长期恢复,持续数周或数月。 即使在没有椎管内技术的情况下,由于器械、截石位或胎头压迫导致的周围神经损伤也可能发生。
复杂妊娠的区域麻醉
当伴有不利于母亲或胎儿或两者的健康状况的情况时,怀孕和分娩被认为是高风险的。 产妇问题可能与怀孕有关; 即先兆子痫-子痫、妊娠期高血压疾病或由前置胎盘或胎盘早剥引起的产前出血。 糖尿病; 心脏、慢性肾脏和神经系统问题; 镰状细胞性贫血症; 哮喘; 肥胖; 和药物滥用与怀孕无关,但经常受其影响。 早产(妊娠不足 37 周)、早产(妊娠 42 周或更长)、宫内发育迟缓和多胎妊娠是与风险相关的胎儿状况。 在分娩和分娩过程中,胎儿先露异常(如臀位、横卧位)、胎盘早剥、脐带受压(如脱垂、颈带)、急产或宫内感染(如胎膜延长)可能会增加对母亲或胎儿的风险。 一般来说,高危产妇的麻醉管理与健康母亲和胎儿的管理基于相同的母体和胎儿考虑。 然而,错误的余地较小,因为许多这些功能可能会在麻醉诱导之前受到损害。
先兆子痫-子痫病理生理学和体征和症状
大约 7% 的妊娠发生高血压疾病,是孕产妇死亡的主要原因。 子痫前期的最新诊断标准被称为“血压蛋白升高”。 是否存在水肿不再被视为所需标准之一。 现在认为血压始终高于基线 15%,而不是特定的血压升高。 抽搐的额外出现是子痫的诊断。 先兆子痫-子痫是人类独有的疾病,主要发生在年轻的未生育妇女中。 症状通常在妊娠第 XNUMX 周后出现,有时更早出现葡萄胎。 分娩婴儿和胎盘是唯一有效的治疗方法; 因此,先兆子痫是发达国家医源性早产的主要原因。
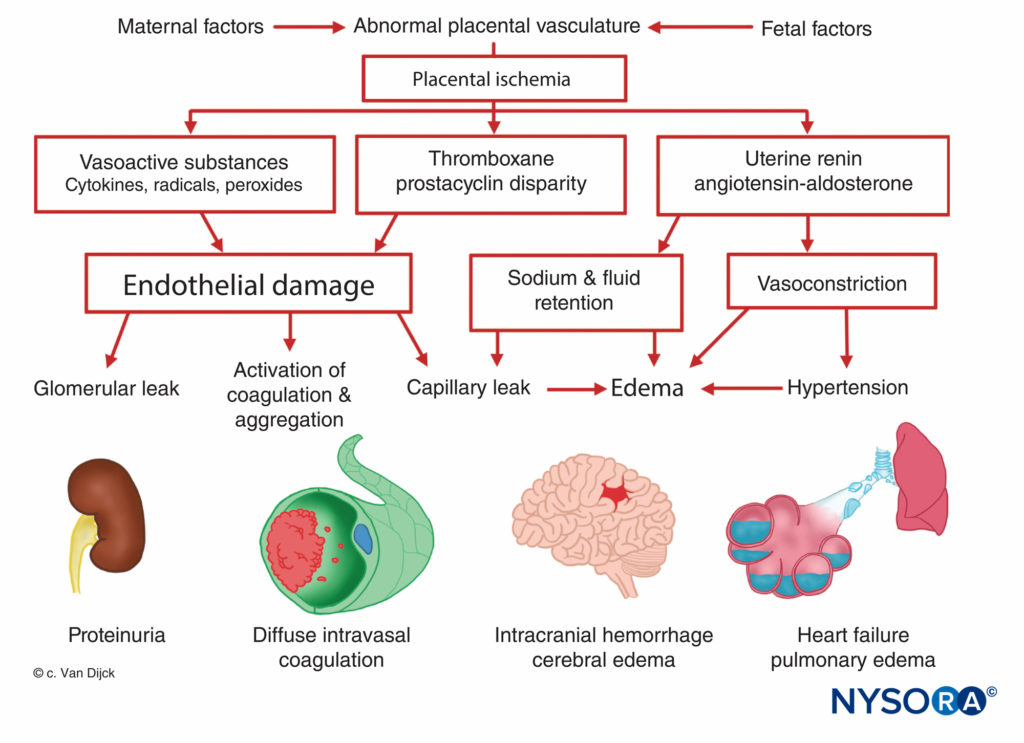
先兆子痫-子痫的起源尚不清楚,但所有患者均表现出胎盘缺血。 胎盘灌注减少发生在妊娠早期注定成为先兆子痫的妇女,并且正常滋养细胞侵袭失败。 在正常妊娠中,螺旋动脉的直径增加约四倍,形成松弛的管,为绒毛间空间提供低阻力通路。 这种血管生成是滋养层侵入螺旋动脉的蜕膜和子宫肌层的结果。 然而,在先兆子痫的女性中,子宫肌层没有受到侵犯。 这导致浅表胎盘植入,导致胎盘灌注减少和与僵硬、肌肉发达的螺旋动脉相关的缺血。 胎盘缺血导致子宫肾素释放、血管紧张素活性增加和广泛的小动脉血管收缩,导致高血压、组织缺氧和内皮损伤。图7)。 血小板固定在内皮损伤部位会导致凝血障碍,偶尔会导致弥散性血管内凝血。 增强的血管紧张素介导的醛固酮分泌导致钠重吸收增加和水肿。 蛋白尿是先兆子痫的征兆,也可归因于胎盘缺血,这会导致局部组织变性和促凝血酶原激酶的释放,随后纤维蛋白在收缩的肾小球血管中沉积。 结果,对白蛋白和其他血浆蛋白的渗透性增加。 此外,前列腺素 E 的产生减少,前列腺素 E 是滋养层中分泌的一种强效血管扩张剂,通常可以平衡肾素-血管紧张素系统的高血压作用。
与先兆子痫相关的许多症状,包括胎盘缺血、全身血管收缩和血小板聚集增加,可能是由于胎盘中前列环素和血栓素的产生失衡所致。 在正常怀孕期间,胎盘产生等量的两者,但在先兆子痫怀孕中,血栓素是前列环素的 XNUMX 倍。
根据最新理论,内皮细胞损伤是先兆子痫发展的核心。 这种损伤是由于胎盘灌注减少导致产生和释放引起内皮细胞损伤的物质(可能是脂质过氧化物酶)。 异常的内皮细胞功能通过释放纤连蛋白、内皮素和其他物质导致外周阻力增加和先兆子痫中注意到的其他异常。
在啮齿动物模型中,已鉴定出两种胎盘抗血管生成蛋白,它们可能在先兆子痫的发病机制中起作用。 可溶性 fms 样酪氨酸激酶 1 (sFlt-1) 在先兆子痫妇女的胎盘中上调。 升高的 sFlt-1 蛋白水平拮抗和减少血管内皮生长因子 (VEGF) 和胎盘生长因子 (PlGF)。 莱文等人。 证明增加的 sFlt-1 水平和降低的 PlGF 水平预示着先兆子痫的后续发展。 另一种抗血管生成蛋白可溶性内皮糖蛋白 (sEng) 在 HELLP 综合征(包括溶血、肝酶升高和血小板计数低)的情况下升高。
NYSORA 小贴士
如果先兆子痫与以下任何一项相关,则被归类为严重:
- 收缩压始终高于基线 15% 以上
- 舒张压始终高于基线 15% 以上
- 蛋白尿 5 g/24 h
- 400 mL/24 h 少尿
- 脑视觉障碍
- 肺水肿或发绀
- 上腹痛
- 宫内发育迟缓
在严重的先兆子痫-子痫中,由于广泛的血管痉挛,所有主要器官系统都会受到影响。 全球脑血流量并未减少,但不能排除局灶性低灌注。 尸检显示血栓前毛细血管附近有出血性坏死,提示血管强烈收缩。 水肿和小病灶退化归因于缺氧。 抽搐发作后常见瘀点出血。 与上述变化相关的症状包括头痛、眩晕、皮质盲、反射亢进和抽搐。 脑出血和脑水肿是先兆子痫-子痫的主要死因,合计约占死亡人数的 50%。 由于外周血管收缩和血液浓缩引起的血液粘度增加,严重的情况下可能会发生心力衰竭。 肝脏供血减少可能导致不同程度和严重程度的门静脉周围坏死。 包膜下出血是严重病例上腹痛的原因。在肾脏中,肾小球内皮细胞肿胀和纤维蛋白沉积,导致毛细血管腔收缩。 肾血流量和肾小球滤过率降低,导致尿酸清除率降低,在严重的情况下,肌酐升高。
虽然先兆子痫伴随着水和钠的过度潴留,但液体和蛋白质从血管内转移到血管外隔室可能导致低血容量、低蛋白血症和血液浓缩,蛋白尿可能会进一步加重。 子宫胎盘灌注不足和胎儿结局不佳的风险与母体血浆和蛋白质消耗的程度相关。
内皮损伤部位的血小板粘附可能导致消耗性凝血病,大约 20% 的先兆子痫患者会出现这种情况。 轻度血小板减少症,血小板计数为 100,000–150,000/mm,是最常见的发现。 凝血酶原和部分促凝血酶原激酶时间的延长表明促凝剂的消耗。 大约 25% 的血小板计数正常的患者出血时间延长,不再被认为是可靠的凝血测试。 HELLP 综合征是一种特殊形式的严重先兆子痫,其特征是溶血、肝酶升高和血小板减少。
先兆子痫患者的治疗目标是预防或控制惊厥、改善器官灌注、使血压正常化和纠正凝血异常。 美国抗惊厥治疗的主要支柱是硫酸镁。 其预防癫痫发作的功效已得到充分证实,但其作用机制仍存在争议。 患者通常在 4% 溶液中接受 20 g 的负荷剂量,在 5 分钟内给药,然后以 1-2 g/h 的速度连续输注。
先兆子痫的抗高血压治疗用于降低母亲脑出血的风险,同时维持甚至改善组织灌注。 没有证据表明抗高血压治疗可以延缓疾病进展或改善围产期结局。 血浆容量扩张与血管舒张相结合可以实现这些目标。 肼苯哒嗪是最常用的血管扩张剂,因为它可以增加子宫胎盘和肾脏的血流量。 然而,副作用包括心动过速、心悸、头痛和新生儿血小板减少症。 在喉镜检查和插管过程中使用硝普钠以防止血压升高的危险。 曲美沙芬是一种神经节阻滞剂,在出现脑水肿和颅内压升高的高血压急症时很有用,因为它不会引起大脑血管舒张。 其他已用于控制母体血压的药物包括 α-甲基多巴、硝酸甘油,以及现在更常见的拉贝洛尔。
消耗性凝血病可能需要输注新鲜全血、浓缩血小板、新鲜冷冻血浆和冷沉淀。 在难治性病例或妊娠接近足月的情况下需要分娩。 在严重的情况下,积极的管理应在分娩后至少持续 24-48 小时。
麻醉管理
硬膜外麻醉在分娩和分娩中的禁忌症很少。 在存在严重凝血异常或严重血浆容量不足的情况下,风险收益比有利于其他形式的麻醉。 在左侧子宫移位的容量不足患者中,硬膜外麻醉不会导致不可接受的血压降低,并导致胎盘灌注显着改善。 使用放射性氙后,硬膜外镇痛(75 mL 布比卡因 10%)后绒毛间血流增加约 0.25%。 酰胺类局麻药的母体总清除率在先兆子痫中延长,重复使用这些药物可导致比正常血压患者更高的血药浓度。
对于剖宫产,区域麻醉的感觉水平必须延伸到 T3-4,因此充分的液体治疗和左侧子宫移位更加重要。
在先兆子痫妇女中,硬膜外麻醉优于脊髓麻醉,因为它起效较慢且可控。 过去,与脊髓麻醉相关的交感神经切除术的快速发作与低血压有关,尤其是在容量不足的患者中。 然而,在最近的两项研究中,发现在剖宫产术中接受硬膜外或脊髓麻醉的先兆子痫妇女的低血压、围手术期补液和麻黄碱给药以及新生儿状况的发生率相似。 绫等人。 进行了一项前瞻性队列研究,表明与血压正常的孕妇相比,先兆子痫妇女发生显着脊髓麻醉引起的低血压的风险显着降低。 先兆子痫对血管加压药的敏感性增加; 因此,通常需要较低剂量的麻黄碱和去氧肾上腺素来纠正低血压。
产前出血
产前出血最常发生与前置胎盘(子宫下段异常胎盘着床和宫颈内口部分或完全闭塞)和胎盘早剥有关。 前置胎盘占所有妊娠的 0.11%,导致高达 0.9% 的孕产妇发生率和 17-26% 的围产期死亡率。 它可能与异常的胎儿先露有关,例如横卧或臀位。 每当患者出现无痛、鲜红色的阴道出血时,应怀疑前置胎盘,通常是在怀孕 2 个月后。 诊断由超声检查确定。 除非最低胎盘边缘距宫颈内口超过 XNUMX cm,否则通常需要腹部分娩。 如果出血不多且胎儿未成熟,产科管理是保守的以延长妊娠期。 在严重的情况下,或者如果胎儿在出现症状时已经成熟,则需要及时分娩,通常是剖宫产。 由于严重出血可能需要紧急子宫切除术,即使在胎盘分娩后,由于子宫乏力。 在既往接受过子宫手术,尤其是既往剖宫产的患者中,由于胎盘(胎盘绒毛穿透子宫肌层)的发生率较高,严重出血的风险甚至更大。
0.2-2.4% 的孕妇发生胎盘早剥,通常发生在妊娠的最后 10 周,并与高血压疾病有关。 并发症包括 Couvelaire 子宫(当渗出的血液在肌层纤维之间剥离时发生)、肾功能衰竭、弥散性血管内凝血和垂体前叶坏死(即,Sheehan 综合征)。 孕产妇死亡率很高(1.8-11.0%),围产儿死亡率更高(超过50%)。 胎盘早剥的诊断是基于子宫压痛、张力亢进和阴道出血的深色、凝结的血液。 如果胎盘边缘仍然附着在子宫壁上,则可能会隐藏出血。 如果失血严重,可能会出现母体血压和脉搏的变化,表明血容量不足。 急性缺氧期间胎儿运动可能会增加,如果缺氧是渐进的,则胎儿运动可能会减少。 可能会出现胎儿心动过缓和死亡。
麻醉管理
通常需要通过 14 或 16 号导管建立侵入性监测(动脉导管、中心静脉导管)和血容量置换。 如果存在凝血异常,可能需要血液成分和新鲜冷冻血浆、冷沉淀物和血小板浓缩物。 对于胎盘早剥的女性,麻醉剂的选择取决于母体和胎儿的状况以及需要进行的手术的紧急程度。 全身麻醉适用于失控的出血和凝血异常。
可以使用硬膜外麻醉,特别是如果在分娩时硬膜外麻醉有效并且没有血流动力学不稳定。 文森特等人。 观察到,在未经治疗的妊娠母羊出血期间,硬膜外麻醉显着恶化母体低血压、子宫血流、胎儿 PaO2 和 pH 值。 然而,这是未纠正的低血压,通过血管内补液的血流动力学,即使在硬膜外麻醉下也恢复正常。
早产
早产和分娩对麻醉师来说是一项重大挑战,因为母亲和婴儿都可能处于危险之中。 早产儿的定义被改变,以区分早产儿(在妊娠 2 周之前出生)和小于胎龄儿(可能足月出生但体重超过以下 8 个标准差)均值。 尽管早产发生在所有新生儿的 10-80% 中,但它占早期新生儿死亡的大约 24%。 早产儿容易出现呼吸窘迫综合征、颅内出血、低血糖、低钙血症和高胆红素血症等严重并发症。产科医生经常尝试抑制早产以获得胎儿肺成熟的时间。 如果给母亲服用糖皮质激素以提高胎肺成熟度,即使将分娩延迟 48-2 小时也可能是有益的。 多种药物已被用于抑制子宫活动(安胎),例如乙醇、硫酸镁、前列腺素抑制剂、β-拟交感神经药和钙通道阻滞剂。 β-肾上腺素能药物,如利托君和特布他林,是最常用的宫缩抑制剂。 它们的主要作用是刺激 βXNUMX 受体,从而导致肌层抑制、血管舒张和支气管扩张。 据报道,这些宫缩抑制剂会导致许多产妇并发症,包括低血压、低钾血症、高血糖、心肌缺血、肺水肿和死亡。
麻醉管理
由于与麻醉药物和技术的相互作用,可能会出现并发症。 在使用区域麻醉时,由 β-肾上腺素能刺激引起的外周血管扩张增加了在存在心动过速、低血压和低钾血症的情况下血流动力学不稳定的风险。 早产儿比新生儿更容易受到产科镇痛和麻醉药物的影响。 然而,很少有系统研究来确定整个妊娠期间药物的母体和胎儿药代动力学和动力学。
早产儿药物敏感性增强有几个假设原因:可用于药物结合的蛋白质减少; 更高水平的胆红素,可能与药物竞争蛋白质结合; 由于血脑屏障发育不良,药物更容易进入中枢神经系统; 更多的全身水和更低的脂肪含量; 以及代谢和排泄药物的能力下降。 然而,大多数用于麻醉的药物在胎儿血清中表现出低到中等程度的结合:布比卡因约 50%,利多卡因 25%,哌替啶 52%,硫喷妥钠 75%。作为早产儿,药物对新生儿的影响远不如预防窒息和胎儿创伤重要。 对于阴道分娩,实施良好的硬膜外麻醉有利于提供良好的会阴松弛。 在进行硬膜外阻滞之前,麻醉师应确定胎儿既不缺氧也不酸中毒。 窒息会导致胎儿心输出量的重新分配,从而增加向大脑、心脏和肾上腺等重要器官的氧气输送。 无论如何,布比卡因或氯普鲁卡因可能比利多卡因更好地保留早产胎儿的这些变化。 臀位早产儿通常通过剖宫产分娩。 区域麻醉可以成功地完全使用,如果需要,可以使用硝酸甘油来放松子宫。
NYSORA 小贴士
- 在分娩早产儿时,担心药物对新生儿的影响远不如预防窒息和胎儿创伤重要。
- 在进行硬膜外阻滞前,应确定胎儿既不缺氧也不酸中毒。
分娩和阴道分娩期间的局部镇痛已成为选定高危患者缓解疼痛的首选技术,因为它可以防止母亲迟钝和胎儿抑郁,并减少分娩的许多潜在不良生理影响,例如增加耗氧量和血流动力学改变。 对于剖宫产术,区域麻醉已成为高危产妇安全有效的技术,部分原因是增加了提供延长术后镇痛的能力。
孕妇的非产科手术
大约 1.6-2.2% 的孕妇因与分娩无关的原因接受手术。 除外伤外,最常见的急症是腹部、颅内动脉瘤、心脏瓣膜病和嗜铬细胞瘤。
当需要进行手术时,麻醉方面的考虑因素与妊娠期孕妇生理状况的变化、麻醉药物的致畸性、麻醉对子宫胎盘血流的间接影响以及流产或早产的可能性有关。 必须平衡风险,以便为母亲和孩子提供最有利的结果。 五项主要研究试图将人类怀孕期间的手术和麻醉与由异常、早产或宫内死亡确定的胎儿结局联系起来。 尽管这些研究未能将手术和麻醉剂暴露与先天性异常联系起来,但所有研究都表明胎儿死亡的发生率增加,尤其是在妊娠头三个月进行手术后。 没有涉及特定的麻醉剂或技术。 需要手术的条件是最相关的因素,盆腔手术或产科手术后胎儿死亡率最高; 也就是宫颈机能不全。
麻醉剂的细胞毒性与生物降解密切相关,而生物降解又受氧合和肝血流量的影响。 因此,与麻醉相关的并发症——产妇缺氧、低血压、血管加压剂给药、高碳酸血症、低碳酸血症和电解质紊乱——可能是比使用药物本身更大的致畸因素。
简要讨论了暴露于特定药物和试剂的实验证据,但要了解很难将实验室数据外推到人类的临床情况。 在确定其安全性之前,必须有大量患者接触可疑的致畸剂。 复杂因素包括产妇接触多种药物的频率; 难以将潜在疾病过程和手术治疗的影响与所用药物的影响区分开来; 不同妊娠阶段的风险程度; 以及与一个代理相关的异常的多样性,而不是一致性。 关于局部麻醉剂,局部麻醉剂未显示在动物或人类中具有致畸作用。
由于有几份报告描述了地西泮与口腔裂隙之间的特定关系,因此在放置块之前已谨慎使用镇静剂; 然而,其他研究并未证实这一点。 一项对 854 名在孕早期服用地西泮的女性进行的前瞻性研究并未显示出更高的腭裂或唇裂风险。 目前,地西泮不是一种已证实的致畸剂。
最近,人们担心在胎儿期接触麻醉剂的儿童会产生不良的神经认知影响。 事实上,暴露于子宫内全身麻醉的新生大鼠比对照组有更大程度的神经适应缺陷。 同样,与区域麻醉相比,在剖宫产全身麻醉下出生的婴儿也被发现表现出轻度认知障碍。 这项研究的困难在于它本质上是回顾性的,并且存在患者选择偏倚的可能性。 例如,全身麻醉仅用于紧急情况,例如胎儿状况不佳或胎盘早剥,在我们看来,这比麻醉剂更能影响神经认知。 最令人担忧的是,通过阴道分娩出生的婴儿与通过全身麻醉剖宫产出生的婴儿具有相似的特征。 尽管如此,由于之前讨论过的母体和胎儿考虑,在怀孕期间避免全身麻醉而不是区域技术似乎是谨慎的做法。 指导医疗决策的数据很少,但应考虑改变手术技术的类型(例如,从腹腔镜转为开腹阑尾切除术)以促进区域麻醉的使用。 由于母体疼痛和忧虑可能导致子宫血流量减少和胎儿恶化(类似于输注肾上腺素或去甲肾上腺素),应考虑通过局部技术(即周围神经阻滞或硬膜外输注)进行早期干预以缓解术后疼痛。
NYSORA 小贴士
未显示局部麻醉剂对动物或人类有致畸作用。
概要
怀孕会导致许多显着的生理变化,需要调整麻醉和镇痛技术,以便安全有效地管理孕妇。 如果可能,将手术推迟到婴儿出生后是谨慎的做法。 在孕早期只应考虑紧急手术。在分娩和阴道分娩期间,局部技术已成为最被接受的止痛方法。 同样,椎管内技术现在是剖宫产分娩麻醉剂最常用的技术。 与全身麻醉相比,局部麻醉的进步及其广泛的常规使用已显着提高了产妇的安全性。
参考文献:
- Melzack R、Taenzer P、Feldman P、Kinch RA:在准备好分娩训练后,分娩仍然很痛苦。 Can Med Assoc J 1981;125:357。
- Goodman RP, Killom AP, Brash AR, Branch RA:怀孕期间的前列环素生产:正常怀孕期间的生产与妊娠合并高血压的比较。 Am J Obstet Gynecol 1982; 142:817。
- Kerr MG、Scott DB、Samuel E:妊娠晚期下腔静脉的研究。 英国医学杂志 1964;1:532。
- Howard BK、Goodson JH、Mengert WE:妊娠晚期仰卧位低血压综合征。 妇产科 1953;1:371。
- Kuo CD, Chen GY, Yang MJ, Tsai YS: 孕晚期体位对自主神经活动的影响。 麻醉 1997;52:1161–1165。
- Kundra P、Velraj J、Amirthalingam U 等:从仰卧位和左侧卧位到左侧倾斜的体位对足月产妇的母体血流速度和波形的影响。 麻醉 2012;67:889–893。
- Carruth JE、Mivis SB、Brogan DR、Wenger NK:正常妊娠的心电图。 Am Heart J 1981;102:1075–1078。
- Seth R、Moss AJ、McNitt S 等:长 QT 综合征和妊娠。 J Am Coll Cardiol 2007;49:1092–1098。
- Prowse CM,Gaensler EA:怀孕期间的呼吸和酸碱变化。 麻醉学 1965;26:381。
- Moya F, Smith BE:药物和麻醉剂的摄取、分布和胎盘转运。 麻醉学 1965;26:465。
- Archer GW,Marx GF:产妇呼吸暂停期间的动脉氧合。 Br J Anaesth 1974;46:358。
- Whitehead EM,Smith M,Dean Y,O'Sullivan G:妊娠期和产褥期胃排空时间的评估。 麻醉 1993;48:53-57。
- La Salvia LA,Steffen EA:分娩时胃排空时间延迟。 Am J Obstet Gynecol 1950;59:1075–1081。
- Wong CA、Loffredi M、Ganchiff JN 等:足月妊娠时胃排空水。 麻醉学 2002;96:1395–1400。
- Davison JS、Davison MC、Hay DM:妊娠晚期和分娩时的胃排空时间。 J Obstet Gynaecol Br Commonw 1970;77:37-41。
- Brock-Utne JG、Dow TGB、Dimopoulos GE 等:妊娠早期的胃和食管下括约肌 (LOS) 压力。 Br J Anaesth 1981;53:381。
- Wyner J,Cohen SE:妊娠早期的胃容量:甲氧氯普胺的影响。 麻醉学 1982;57:209。
- Cohen SE、Woods WA、Wyner J:氟哌利多和甲氧氯普胺的止吐功效。 麻醉学 1984;60:67。
- Scheller MS,Sears KL:与术前使用甲氧氯普胺相关的术后神经功能障碍。 Anesth Analg 1987;66:274。
- Lund CJ、Donovan JC:怀孕期间的血容量。 Am J Obstet Gynecol 1967;98:393。
- Pritchard J,MacDonald P:母亲对怀孕的适应。 在 Williams JW、Pritchard J、MacDonald P(编辑)、Williams Obstetrics,第 16 版。 纽约:Appleton-Century-Crofts,1980 年,p。 236.
- Gerbasi FR、Buttoms S、Farag A、Mammen E:与妊娠相关的血管内凝血增加。 妇产科 1990;75:385–389。
- Wildsmith JAW:血清假胆碱酯酶、妊娠和琥珀胆碱酯酶。 麻醉 1972;27:90。
- Coryell MN、Beach EF、Robinson AR 等:生殖周期中女性的代谢:XVII。 整个周期和分娩后血浆蛋白电泳模式的变化。 临床投资杂志 1950;29:1559。
- Datta S、Kitzmiller JL、Naulty JS 等:剖宫产腰麻后糖尿病母亲及其婴儿的酸碱状态。 Anesth Analg 1982;61:662。
- Datta S、Lambert DH、Gregus J 等:怀孕期间哺乳动物神经纤维的差异敏感性。 Anesth Analg 1983;62:1070。
- Gin T, Chan MTV:孕妇异氟醚最低肺泡浓度降低。 麻醉学 1994;81:829。
- Brown WU、Bell GC、Alper MH:酸中毒、局部麻醉剂和新生儿。 妇产科 1976;48:27。
- Hamshaw-Thomas A、Rogerson N、Reynolds F:布比卡因、利多卡因和杜冷丁在兔胎盘中的转移:母体蛋白结合和胎儿流量的影响。 胎盘素 1984;5:61。
- Kennedy RL、Miller RP、Bell JU 等人:胎儿羔羊中布比卡因的摄取和分布。 麻醉学 1986;65:247。
- Kuhnert PM、Kuhnert BR、Stitts JM、Gross TL:使用选定的离子监测技术研究剖宫产硬膜外麻醉后布比卡因在母亲、胎儿和新生儿中的处置。 麻醉学 1981;55:611。
- Kuhnert BR、Philipson EH、Pimental R 等:脊髓麻醉后母亲、胎儿和新生儿的利多卡因处置。 Anesth Analg 1986;65:139。
- Morishima HO、Daniel SS、Finster M 等人:盐酸甲哌卡因(卡博卡因)在人胎盘中的传播。 麻醉学 1966;27:147。
- Kuhnert BR、Kuhnert PM、Prochaska AL、Gross TL:产科患者及其新生儿硬膜外麻醉后 2-氯普鲁卡因的血浆水平。 麻醉学 1980;53:21。
- Pihlajamaki K、Kanto J、Lindberg R 等人:布比卡因的硬膜外给药:孕妇和非孕妇的药代动力学和代谢。 Br J Anaesth 1990;64:556。
- Morishima HO,Covino BG:利多卡因在非窒息和窒息狒狒胎儿中的毒性和分布。 麻醉学 1981;54:182。
- Morishima HO、Finster M、Pedersen H 等人:利多卡因在胎儿和新生羔羊和成年绵羊中的药代动力学。 麻醉学 1979;50:431。
- Mihaly GW、Moore RG、Thomas J 等:苯胺类局麻药在新生儿中的药代动力学和代谢。 Eur J Clin Pharmacol 1978;13:143。
- Finster M、Poppers PJ、Sinclair JC 等人:在尾部麻醉期间用局部麻醉药意外中毒胎儿。 Am J Obstet Gynecol 1965;92:922。
- Morishima HO、Pedersen H、Finster M 等人:利多卡因对成年羊、新生羊和胎儿羊的毒性。 麻醉学 1981;55:57。
- Gale R、Ferguson JE II、Stevenson D:盐酸布比卡因硬膜外镇痛对新生儿胆红素产生的影响。 妇产科 1987;70:692。
- Brockhurst NJ、Littleford JA、Halpern SH:神经和适应能力评分:对其在产科麻醉研究中的应用的系统评价。 麻醉学 2000;92:237。
- Morishima HO、Yeh MN、James LS:急性母体压力减少的子宫血流量和胎儿低氧血症:怀孕狒狒的实验观察。 Am J Obstet Gynecol 1979;134:270。
- Ueland K,Hansen JM:母体心血管动力学:生病。局部和尾部镇痛下的分娩和分娩。 Am J Obstet Gynecol 1969; 103:8。
- Moir DD, Willocks J:连续硬膜外镇痛下子宫动作不协调的管理。 英国医学杂志 1967;2:396。
- Miller FC、Petrie RH、Arce JJ 等:分娩时过度换气。 Am J Obstet Gynecol 1974;120:489。
- Beaule PE,Smith MI,Nguyen VN:哌替啶引起的髋关节翻修术后癫痫发作。 J 关节成形术 2005;19:516–519。
- Hagmeyer KO,Mauro LS,Mauro VF:与患者自控镇痛泵相关的哌替啶相关癫痫发作。 Ann Pharmacother 1993;27:29-32。
- Kaiko RF、Grabinski PY、Heidrick G 等:哌替啶对癌症患者的中枢神经系统兴奋作用。 安神经 1983;13:180–185。
- Kuhnert BR, Linn PL, Kennard MJ, Kuhnert PM:低剂量哌替啶对新生儿行为的影响。 Anesth Analg 1985;64:335。
- Sosa CG、Balagueer E、Alonso JG 等:哌替啶治疗第一产程难产:一项随机对照试验。 Am J Obstet Gynecol 2004;191:1212–1218。
- Eisele JH、Wright R、Rogge P:剖宫产时新生儿和产妇芬太尼水平。 Anesth Analg 1982;61:179。
- Shannon KT,Ramanathan S:分娩镇痛的全身用药。 产科疼痛管理 1995;2:1-6。
- Morley-Foster PK,Reid DW,Vandeberghe H:患者自控镇痛药芬太尼和阿芬太尼用于分娩镇痛的比较。 Can J Anaesth 2000;47:113-119。
- Muir HA、Breen T、Campbell DC 等:静脉注射 PCA 芬太尼是提供分娩镇痛的有效方法吗? 麻醉学 1999; (补充):A28。
- Vercauteren M、Bettens K、Van Springel G 等:鞘内分娩镇痛:我们可以使用与硬膜外相同的混合物吗? Int J Obstet Anesth 1997;6:242–246。
- Breen TW、Giesinger Cm、Halpern SH:硬膜外利多卡因和芬太尼与鞘内注射舒芬太尼在分娩早期镇痛中的比较。 Int J Obstet Anesth 1999;8:226–230。
- Kapila A、Glass PS、Jacobs JR 等人:测量瑞芬太尼和阿芬太尼的上下文相关半衰期。 麻醉学 1995;83:968–975。
- Evron S、Glezerman M、Sadan O 等人:瑞芬太尼:一种用于分娩疼痛的新型全身镇痛剂。 Anesth Analg 2005;100:233–238。
- Kan RE、Hughes SC、Rosen M 等人:静脉注射瑞芬太尼:胎盘移植、母体和新生儿影响。 麻醉学 1998;88:1467。
- Thurlow JA、Laxton CH、Dick A 等人:瑞芬太尼通过患者自控镇痛与肌肉注射哌替啶相比,用于缓解分娩疼痛。 Br J Anaesth 2002;88:374–378。
- Volmanen P、Sarvela J、Akural EI 等:静脉注射瑞芬太尼与硬膜外左布比卡因联合芬太尼缓解早期分娩疼痛:一项随机、对照、双盲研究。 Acta Anaesthesiol Scand 2008;52:249–255。
- Volmanen P、Akural E、Raudaskoski T 等人:瑞芬太尼和一氧化二氮在分娩镇痛中的比较。 Acta Anaesthesiol Scand 2005;49:453–458。
- Maduska AL,Hajghassemali M:分娩时布托啡诺和哌替啶的双盲比较:产妇疼痛缓解和对新生儿的影响。 Can Anaesth Soc J 1978;25:398。
- Wilson CM、McClean E、Moore J、Dundee JW:分娩时肌注哌替啶和纳布啡的双盲比较。 麻醉 1986;41:1207–1213。
- Hodgkinson R、Huff RW、Hayashi RH、Husain FJ:静脉注射布托啡诺和哌替啶后母体镇痛和新生儿神经行为的双盲比较。 J Int Med Res 1979;7:224-230。
- Thorp JA、Hu DH、Albin RM 等:产时硬膜外镇痛对初产妇的影响:一项随机、对照、前瞻性试验。 Am J Obstet Gynecol 1993;169:851。
- Sharma SK、Sidawi JE、Ramin SM 等:剖宫产:分娩时硬膜外麻醉与患者自控哌替啶镇痛的随机试验。 麻醉学 1997;87:487。
- Halpern SH、Leighton BL、Ohlsson A 等:硬膜外与肠外阿片类药物镇痛对分娩过程的影响:荟萃分析。 1998 年美国医学会杂志;280:2105。
- Ramin SM、Gambling DR、Lucas MJ 等:分娩时硬膜外麻醉与静脉内镇痛的随机试验。 妇产科 1995;86:783。
- Chestnut DH、Vincent RD、McGrath JM 等:早期硬膜外镇痛是否会影响接受静脉注射催产素的初产妇的产科结局? 麻醉学 1994;80:1193。
- Chestnut DH、McGrath JM、Vincent RD 等:早期硬膜外镇痛是否会影响自然分娩的未产妇的产科结局? 麻醉学 1994;80:1201。
- 美国妇产科学院:产科钳。 AGOG 妇产科和胎儿医学委员会,委员会意见,1989 年。
- Chestnut DH、Laszewski LJ、Pollack RL 等人:在第二产程中连续硬膜外输注 0.0625% 布比卡因-0.0002% 芬太尼。 麻醉学 1990;72:613。
- Birnbach DJ,Chestnut DH:产科实践中的硬膜外试验剂量:它是否已经过时了? Anesth Analg 1999;88:971。
- Norris MC、Ferrenbach D、Dalman H 等:肾上腺素能否提高分娩硬膜外镇痛期间误吸的诊断准确性? Anesth Analg 1999;88:1073。
- Guinard JP、Mulroy MF、Carpenter RL、Knopes KD。 试验剂量:有和没有急性β-肾上腺素能阻滞的最佳肾上腺素含量。 麻醉学 1990;73:386–392。
- Visconti C,Eisenach JC:分娩时患者自控硬膜外镇痛。 妇产科 1991;77:348。
- Halpern S:患者自控硬膜外分娩镇痛的最新进展。 Curr Opin Anaesthesiol 2005;18:247–251。
- Minty RG、Kelly L、Minty A、Hammett DC:单剂量鞘内镇痛以控制分娩疼痛:它是硬膜外镇痛的有用替代方法吗? Can Fam 医师 2007;53:437–442。
- Rigler ML、Drasner K、Krejcie TC 等:连续脊髓麻醉后的马尾综合征。 Anesth Analg 1991;72:275。
- Arkoosh VA、Palmer CM、Van Maren GA 等:连续鞘内分娩镇痛:安全性和有效性。 麻醉学 1998;(增刊):A8。
- Simons SW、Cyna AM、Dennis AT、Hughes D:分娩时的硬脊膜外联合镇痛与硬膜外镇痛。 Cochrane 数据库系统修订版 2007;3:CD003401。
- Campbell DC、Camann WR、Datta S:在鞘内舒芬太尼中添加布比卡因用于分娩镇痛。 Anesth Analg 1995;81:305。
- Labbene I、Gharsallah H、Abderrahaman A 等人:在布比卡因和舒芬太尼中添加 15 mcg 鞘内可乐定对分娩镇痛的影响。 突尼斯医学 2011;89:853–859。
- Collis RE、Davies DWL、Aveling W:分娩时联合脊髓硬膜外和标准硬膜外镇痛的随机比较。 柳叶刀 1995;345:1413。
- McLeod A、Fernando R、Page F 等:使用计算机体位法评估产妇平衡和步态。 麻醉学 1999; (补充):A8。
- Wong CA、Scavone BM、Peaceman AM 等:早期分娩与晚期分娩采用椎管内镇痛的剖宫产风险。 N Engl J Med 2005;352:655。
- Cohen SE、Cherry CM、Holbrook RH 等人:用于分娩镇痛的鞘内舒芬太尼:感觉变化、副作用和胎心率变化。 Anesth Analg 1993;77:1155。
- Clarke VT、Smiley RM、Finster M:分娩时鞘内注射芬太尼镇痛后子宫过度活跃:胎儿心动过缓的原因? 麻醉学 1994;81:1083。
- O'Gorman DA、Birnbach DJ、Kuczkowski KM 等人:使用脐血流测速法评估产妇联合硬膜外镇痛后胎儿心动过缓的发病机制。 麻醉学 2000;(增刊):A2。
- Riley ET、Vogel TM、EI-Sayed YY 等:患者选择偏倚会导致分娩时联合硬膜外镇痛后胎儿心动过缓的发生率增加。 麻醉学 1999;91:A1054。
- Nielson PE、Erickson R、Abouleish E 等:鞘内舒芬太尼或硬膜外布比卡因分娩镇痛后胎心率变化:发生率和临床意义。 Anesth Analg 1996;83:742。
- Albright GA, Forester RM:硬膜外镇痛联合蛛网膜下腔舒芬太尼会增加急诊剖宫产的发生率吗? Reg Anesth 1997;22:400。
- Norris MC、Grieco WM、Borkowski M 等人:分娩镇痛的并发症:硬膜外与联合脊髓硬膜外技术。 Anesth Analg 1995;79:529。
- Leighton BL, Arkoosh VA, Huffnagle S, et al: 硬膜外布比卡因在有和没有预先鞘内注射舒芬太尼的情况下的皮肤扩散。 Anesth Analg 1996;83:526。
- Bucklin BA、Hawkins JL、Anderson JR、Ullrich FA:产科麻醉劳动力调查:二十年更新。 麻醉学 2005;103:645–653。
- Baxi LV、Petrie RH、James LS:宫颈旁阻滞后的人类胎儿氧合。 Am J Obstet Gynecol 1979;135:1109。
- Palomaki O、Huhtala H、Kirkinen P:0.25% 左旋布比卡因和 0.25% 消旋布比卡因用于第一产程宫颈旁阻滞的安全性比较研究。 Acta Obstet Gynecol Scand 2005;84:956–961。
- Leighton BL、Halpern SH、Wilson DB:腰椎交感神经阻滞加速未生育妇女的早期和第二阶段引产。 麻醉学 1999;90:1039–1046。
- Pace MC、Aurilio C、Bulletti C 等:晚期分娩中的蛛网膜下腔镇痛:晚期分娩中蛛网膜下腔镇痛和阴部阻滞的比较。 镇痛质量和产科结果。 Ann NY Acad Sci 2004;1034:356–363。
- Aissaoui Y、Bruyere R、Mustapha H 等人:阴部神经阻滞用于外阴切开术后疼痛缓解的随机对照试验。 Anesth Analg 2008;107:625–629。
- Berghella V、Baxter JK、Chauhan SP:剖宫产的循证手术。 Am J Obstet Gynecol 2005;193:1607–1617。
- Hawkins JL、Gibbs CP、Orleans M 等人:1992 年与 1981 年产科麻醉劳动力调查。麻醉学 1994;81:A1128。
- Shnider SM,Levinson G:剖宫产麻醉。 在 Shnider SM, Levinson G (eds): Anesthesia for Obstetrics, 第 2 版。 巴尔的摩:Williams & Wilkins,1987 年,p。 159.
- Dyer RA、Farina Z、Joubert IA 等:选择性剖宫产脊髓麻醉诱导后晶体液预加载与快速晶体液给药的比较。 麻醉重症监护 2004;32:35-35-7。
- 马克思 GF、Luykx WM、Cohen S:剖宫产后胎儿窘迫的胎儿状态。 Br J Anaesth 1984;56:1009。
- Norris MC:身高、体重和蛛网膜下腔高压布比卡因在分娩期间的分布。 Anesth Analg 1988;67:555。
- Hartwell BL、Aglio LS、Hauch MA 等:高压蛛网膜下腔布比卡因在分娩期的脊柱长度和扩散。 Reg Anesth 1991;16:17-19。
- Ogun CO、Kirgiz EN、Duman A 等:鞘内等压布比卡因-吗啡和罗哌卡因-吗啡剖宫产的比较。 Br J Anaesth 2003;90:659–664。
- Hunt GO、Naulty S、Bader AM 等:剖宫产用蛛网膜下腔芬太尼-布比卡因围手术期镇痛。 麻醉学 1989;71:535。
- Palmer CM、Emerson S、Volgoropolous D 等:鞘内注射吗啡用于剖宫产术后镇痛的剂量反应关系。 麻醉学 1999;90:437–444。
- Kato R、Shimamoto H、Terui K 等:剖宫产术中鞘内注射 0.15 mg 吗啡导致的延迟性呼吸抑制。 回顾 1915 例。 麻醉杂志 2008;22:112-116。
- Roelants F:在产科中使用椎管内辅助药物(新斯的明、可乐定)。 Curr Opin Anaesthesiol 2006;19:233–237。
- Ngan Kee WD、Khaw KS、Lee BB 等:罗哌卡因与肾上腺素作为产妇硬膜外试验剂量的局限性。 Anesth Analg 2001;92:1529–1531。
- Leighton BL、Norris MC、Sosis M 等:肾上腺素作为分娩妇女血管内注射标志物的局限性。 麻醉学 1987;66:688。
- Gissen AJ、Datta S、Lambert D:氯普鲁卡因争议:氯普鲁卡因有神经毒性吗? Reg Anaesth 1984;9:135。
- Hynson JM、Sessler DI、Glosten B:用氯普鲁卡因硬膜外麻醉后志愿者的背痛。 Anesth Analg 1991;72:253。
- Albright GA:使用依替卡因或布比卡因进行区域麻醉后心脏骤停。 麻醉学 1979;51:285。
- Carvalho B、Riley E、Cohen SE 等:单剂量、缓释硬膜外吗啡治疗择期剖宫产术后疼痛:一项多中心随机对照研究的结果。 Anesth Analg 2005;100:1150–1158。
- Carvalho B、Roland LM、Chu FL 等:单剂量、缓释硬膜外吗啡 (DepoDur) 与常规硬膜外吗啡治疗剖宫产后疼痛的比较。 Anesth Analg 2007;105:176–183。
- Ginsar Y、Riley ET、Anst MS:硬膜外芬太尼在人体中的作用部位:输注和推注给药的区别。 Anesth Analg 2003;97:1428–1438。
- Marik PE:吸入性肺炎和吸入性肺炎。 N Engl J Med 2001;344:665–671。
- Brizgys RV、Dailey PA、Shnider SM 等:剖宫产硬膜外麻醉期间产妇低血压的发生率和新生儿影响。 麻醉学 1987;67:782。
- Ueyama H、He YL、Tanigami H 等:晶体液和胶体预负荷或血容量对选择性剖宫产腰麻产妇的影响。 麻醉学 1999;91:1571。
- Rout CC, Roche DA:与剖宫产相关的脊髓低血压:预负荷会起作用吗? 麻醉学 1999;91:1565。
- Ngan Kee WD, Kaw KS, Ng FF:预防剖宫产脊髓麻醉期间的低血压:使用去氧肾上腺素输注和晶体液水合联合的有效技术。 麻醉学 2005;103:744–750。
- Ramanathan S,Grant GJ:对硬膜外麻醉引起的低血压进行血管加压治疗。 Acta Anaesthesiol Scand 1988;32:559。
- Rosenblatt MA、Abel M、Fischer GW 等人:成功使用 20% 脂质乳剂对假定的布比卡因相关心脏骤停后的患者进行复苏。 麻醉学 2006;105:217–218。
- Kasten GW,Martin ST:部分下腔静脉闭塞期间布比卡因诱导的心血管毒性的复苏。 Anesth Analg 1986;65:341。
- Choi PT、Galinski SE、Takeuchi L 等:PDPH 是产妇椎管内阻滞的常见并发症:产科研究的荟萃分析。 Can J Anaesth 2003;50:460–469。
- Russell IF:一项前瞻性对照研究,对分娩时意外硬膜穿刺后连续脊髓镇痛与重复硬膜外镇痛进行比较。 Int J Obstet Anesth 2012;21:7-16。
- Maynard SE、Min JY、Merchan J 等:过量的胎盘可溶性 fms 样酪氨酸激酶 1 (sFlt1) 可能导致子痫前期的内皮功能障碍、高血压和蛋白尿。 临床投资杂志 2003;111:649–658。
- Tada S、Yasue A、Nishizawa H、Sekiya T、Hirota Y、Udagawa Y:妊娠期自发性脊髓硬膜外血肿:三例报告。 J Obstet Gynaecol Res 2011;37:1734–1738。
- Bodurka D:妇产科的新变化。 J Am Coll Surg 2005;201:265–274。
- Basso O、Rasmussen S、Weinberg CR 等:先兆子痫后胎儿和婴儿存活率的趋势。 JAMA 2006;296:1357–1362。
- Luttun A,Carmeliet P:可溶性 VEGF 受体 Flt1:发现了难以捉摸的先兆子痫因子? 临床投资杂志 2003;111:60-62。
- Keogh RJ、Harris LK、Freeman A 等:胎儿衍生的滋养层使用凋亡细胞因子肿瘤坏死因子-α 相关的凋亡诱导配体来诱导平滑肌细胞死亡。 Circ Res 2007;100:834–841。
- Walsh S:先兆子痫:胎盘前列环素和血栓素生成失衡。 Am J Obstet Gynecol 1985;152:335。
- Roberts J、Taylor R、Musci T 等人:先兆子痫:一种内皮细胞疾病。 Am J Obstet Gynecol 1989;152:1200。
- Venkatesha S、Toporsian M、Lam C 等:可溶性内皮糖蛋白有助于先兆子痫的发病机制。 Nat Med 2006;12:642。
- Levine RJ、Karumanchi SA:先兆子痫中的循环血管生成因子。 临床妇产科 2005;48:372–386。
- Chesley L:怀孕期间的血浆和红细胞体积。 Am J Obstet Gynecol 1972:112:440。
- Rodgers R,Levin J:对出血时间的批判性重新评估。 Semin Thromb Hemost 1990:16:1-20。
- Abalos E, Duley L, Steyn DW, Henderson-Smart DJ:妊娠期轻度至中度高血压的抗高血压药物治疗。 Cochrane 数据库系统修订版 207;1:CD002252。
- Groenendijk R、Trimbos M、Wallenburg H:先兆子痫的血流动力学测量:初步观察。 Am J Obstet Gynecol 1984; 150:232。
- Aya AG、Vialles N、Tanoubi I 等:脊髓麻醉引起的低血压:严重先兆子痫患者与接受早产剖宫产的健康女性之间的风险比较。 麻醉分析 2005;101:869–875。
- Cotton D、Gonik B、Dorman K、Harris R:重度妊娠高血压的心血管改变:中心静脉压与肺毛细血管楔压的关系。 Am J Obstet Gynecol 1985;151:762。
- Hogg B、Hauth J、Caritis S 等:重度高血压病女性分娩硬膜外麻醉的安全性。 美国妇产科杂志 1999;181:1099。
- Newsome L、Bramwell R、Curling P:腰椎硬膜外麻醉的血流动力学效应。 Anesth Analg 1986;65:31。
- Jouppila P、Jouppila R、Hollmen A、Koivula A:腰椎硬膜外镇痛以改善严重先兆子痫分娩时的绒毛间血流。 妇产科 1982;52:158。
- Ramanathan J、Botorff M、Jeter J 等:硬膜外利多卡因对先兆子痫的药代动力学和母婴影响。 Anesth Analg 1986;65:120。
- Wallace D、Leveno KJ、Cunningham F 等:在妊娠合并严重先兆子痫的剖宫产中全身麻醉和区域麻醉的随机比较。 妇产科 1995;86:193。
- Hood D,Curry R:严重先兆子痫患者剖宫产的脊髓麻醉与硬膜外麻醉:回顾性调查。 麻醉学 1999;90:1276。
- Oyelese Y、Smulian JC:前置胎盘、胎盘增生和前置血管。 妇产科 2006;107:927–941。
- Chestnut DH、Dewan D、Redick L 等:产科子宫切除术的麻醉管理:一项多机构研究。 麻醉学 1989;70:607。
- Vincent RD Jr、Chestnut DH、Sipes SL 等:硬膜外麻醉会恶化妊娠母羊出血期间的子宫血流和胎儿氧合。 麻醉学 1992;76:799–806。
- Santos A、Tun E、Bobby P 等:布比卡因、l-硝基-l-精氨酸甲酯和去氧肾上腺素对早产羔羊心血管适应窒息的影响。 Anesth Analg 1997;84:1299。
- Morishima HO、Pedersen H、Santos AS 等:母体给予利多卡因对窒息早产羔羊的不良影响。 麻醉学 1989;71:110。
- Shnider SM,Webster G:怀孕期间手术对母体和胎儿的危害。 Am J Obstet Gynecol 1965;92:891。
- Brodsky J、Cohen E、Brown BJ 等:妊娠期手术和胎儿结局。 Am J Obstet Gynecol 1980;138:1165。
- Smith B:妊娠期麻醉后的胎儿预后。 Anesth Analg 1963;42:521。
- Duncan P、Pope W、Cohen M、Greer N:怀孕期间麻醉和手术的胎儿风险。 麻醉学 1986;64:790。
- Heinonen O、Slone O、Shapiro S:妊娠期出生缺陷和药物。 在妊娠期的出生缺陷和药物。 马萨诸塞州利特尔顿:出版科学集团,1977 年,p。 516.
- Grabowski C,Paar J:分级剂量缺氧对鸡胚的致畸作用。 Am J Anat 1958;103:313。
- Saxen I, Saxen L:母亲摄入地西泮与口腔裂隙之间的关联。 柳叶刀 1975;2:498。
- Safra M,Oakley G:唇裂伴或不伴腭裂与产前接触地西泮之间的关联。 柳叶刀 1975;2:478。
- Shiono PH,Mills JL:怀孕期间使用口腔裂隙和地西泮。 N Engl J Med 1984;311:919–920。
- Shepard TH:致畸剂目录,第 7 版。 巴尔的摩:约翰霍普金斯大学出版社,1992 年。
- Palanisamy A、Baxter MG、Keel PK、Xie Z、Crosby G、Culley DJ:在妊娠早期暴露于子宫内异氟醚的大鼠在成年时行为异常。 麻醉学 2011;114:521–528。
- Sprung J、Fleich RP、Wilder RT 等:剖宫产麻醉和基于人群的出生队列中的学习障碍。 麻醉学 2009;111:302-310。
- Adamsons K,Mueller-Heubach E,Myers R:通过给母亲施用儿茶酚胺在恒河猴中产生胎儿窒息。 Am J Obstet Gynecol 1971;109:148。