Jason Choi、Liane Germond、およびAlan C. Santos
はじめに
ほとんどの女性は分娩中および出産中に中等度から重度の痛みを経験し、しばしば何らかの形の薬理学的鎮痛を必要とします。 恐怖や不安と組み合わされた適切な心理的準備の欠如は、患者の痛みに対する感受性を大幅に高め、分娩中および分娩中の不快感をさらに増す可能性があります。 しかし、痛みや不安を和らげるだけでなく、巧みに行われた産科鎮痛は、他の多くの点で母親に利益をもたらす可能性があります。 この章では、主に局所麻酔技術に焦点を当てた産科患者の管理に焦点を当てます。
妊娠の生理学的変化
妊娠は、ほとんどの母体の臓器系に影響を与える重大な変化をもたらします(テーブル1)。 これらの変化は、黄体と胎盤から分泌されるホルモンによって開始されます。 このような変化は、妊娠中の患者をケアする麻酔科医にとって重要な意味を持っています。 この章では、妊娠の最も関連性のある生理学的変化をレビューし、局所麻酔を使用した産科管理へのアプローチについて説明します。
心臓血管系の変化
成長中の胎児の代謝要求の増加に対応するために母体の心臓血管系が必要とされるため、妊娠中の酸素消費量は増加します。 これらの変化の最終結果は、妊娠前の値と比較して、心拍数(15%〜25%)と心拍出量(最大50%)の増加です。 さらに、より低い血管抵抗は、子宮、腎臓、および他の血管床で見られます。 これらの変化は、心拍出量の増加を超える末梢抵抗の減少のために、動脈血圧を低下させます。 血管抵抗の低下は、主にエストロゲン、プロゲステロン、およびプロスタサイクリンの分泌によるものです。 心拍出量の特に有意な増加は、収縮した子宮からの追加の血液量のために、分娩中および分娩直後の期間に発生します。
NYSORAのヒント
- 進行した妊娠における心血管系の変化と落とし穴には、次のものがあります。
- 心拍数(15%〜25%)と心拍出量(最大50%)の増加。
- 子宮、腎臓、およびその他の血管床における血管抵抗の減少。
- 仰臥位での下部大動脈の圧迫は、子宮胎盤灌流をさらに減少させ、胎児仮死を引き起こす可能性があります。
- 有意な低血圧は、局所麻酔を受けている妊娠中の女性と妊娠していない女性で発生する可能性が高く、子宮の変位または骨盤傾斜の外側操作、血管内の前負荷、および昇圧剤が必要です。
妊娠後期以降、子宮の肥大による大動静脈圧迫は次第に重要になり、36〜38週間で最大の効果に達します。その後、胎児の頭が骨盤に下がるにつれて、ある程度緩和される可能性があります。 心拍出量は、患者が仰臥位にあるが側臥位にない場合に減少する可能性があります。 成長中の胎児による静脈閉塞は、妊婦の10%に仰臥位低血圧症候群を引き起こし、母体の頻脈、動脈性低血圧、失神、および蒼白として現れます。
この位置での下部大動脈の圧迫は、子宮胎盤灌流をさらに減少させ、胎児仮死を引き起こす可能性があります。 妊娠中の患者の麻酔管理中は、子宮の変位または骨盤傾斜を定期的に適用する必要があります。 子宮の変位は、患者を左側臥位に置くことによって最もよく達成されます。 この位置では、仰臥位と比較して心臓の迷走神経活動が増強されます。 骨盤の下にくさびを置くことは、子宮の傾きを達成するために使用されてきました。 しかし、最近、母親が完全な左側臥位に置かれ、その後、骨盤のくさびの上に仰向けにされたときに、子宮の傾きがより効果的であることが実証されました。
心電図の変化は妊娠後期によく見られます。 QRS軸は、子宮の拡張の結果として、最初のトリメスターの間に最初に右にシフトし、0.38番目のトリメスターまでに左軸に回転する可能性があります。 PRおよびQT間隔の短縮と心拍数の増加も見られます。 QT間隔の短縮は、QT延長症候群の女性に影響を与える可能性があります。 確かに、セス等。 QT延長症候群の女性の妊娠中の心臓イベントのリスクの低下(リスク比[RR] = XNUMX)を発見しました。 ただし、分娩後の最初のXNUMXか月で分娩後の心臓イベントのリスクの増加も見られました。これは、QT間隔が分娩後の早い時期に再び延長されることを示唆しています。 心房性期外収縮、洞性頻脈、発作性上室性頻脈の傾向もあります。
表1 満期時の妊娠の生理学的変化の要約。
| 変数 | 変更する | 金額合計 |
|---|---|---|
| 総血液量 | 増える | 25%〜40% |
| 血漿量 | 増える | 40%〜50% |
| フィブリノゲン | 増える | 視聴者の38%が |
| 血清コリンエステラーゼ活性 | 減る | 20%〜30% |
| 心拍出量 | 増える | 30%〜50% |
| ミニッツベンチレーション | 増える | 視聴者の38%が |
| 肺胞換気 | 増える | 視聴者の38%が |
| 機能的残容量 | 減る | 視聴者の38%が |
| 酸素消費量 | 増える | 視聴者の38%が |
| 動脈の二酸化炭素張力 | 減る | 10mmHg |
| 動脈血酸素分圧 | 増える | 10mmHg |
| 最小肺胞内濃度 | 減る | 32%〜40% |
呼吸器系の変化
分時換気量は、妊娠初期から満期までに通常より最大50%増加します。 これは主に、一回換気量が40%増加し、呼吸数がわずかに増加した結果です。 デッドスペースは妊娠中に大きく変化することはありません。 したがって、肺胞換気量は満期で70%増加します。 出産後、血中プロゲステロンレベルが低下すると、換気は1〜3週間以内に正常に戻ります。
横隔膜の上昇は、子宮のサイズが大きくなると発生します。 呼気予備量、残気量、および機能的残気量(FRC)は、妊娠後期までに減少します。 ただし、吸気予備量も増加するため、総肺気量は変化しません。 FRCの低下は、通常、健康な出産者では無症候性です。 喫煙、肥満、脊柱側弯症、またはその他の肺疾患の結果として閉鎖容積に既存の変化がある人は、妊娠が進むにつれて早期の気道閉鎖を経験し、低酸素血症につながる可能性があります。 トレンデレンブルグ体位と仰臥位も、クロージングボリュームとFRCの間の異常な関係を悪化させます。 残容量とFRCは、配送後すぐに通常の状態に戻ります。
妊娠中の女性はしばしば鼻呼吸が困難です。 妊娠中の粘膜のもろさは、特に気道器具で重度の出血を引き起こす可能性があります。 これらの変化は、細胞外液と鬱血の増加によって引き起こされます。 また、乳房が肥大している肥満の首の短い分娩者では喉頭鏡検査を行うのが難しい場合があります。 ハンドルの短い喉頭鏡の使用が役立つことが証明されています。
NYSORAのヒント
気道浮腫は、妊娠中の女性、特に子癇前症の女性、トレンデレンブルグ体位が長期間使用されている女性、および子宮収縮抑制剤が使用されている女性で重症になる可能性があります。
代謝の変化
酸素消費量は妊娠初期に増加し、期間ごとに全体で20%増加します。 とにかく、妊娠中に発生する肺胞換気の増加は、実際には動脈血中の二酸化炭素分圧(PaCO2)を32 mm Hgに低下させ、動脈血中の酸素分圧(PaO2)を106mmHgに上昇させます。 血漿緩衝液の塩基は47から42mEqに減少します。 その結果、pHは実質的に変化しません。 肺胞換気量の増加とFRCの減少により、母体の吸入麻酔薬の取り込みと除去が強化されます。 ただし、FRCの低下と代謝率の上昇により、母親は無呼吸または低換気の期間中に低酸素血症を発症しやすくなります。
消化器系の変化
妊娠が消化器系に及ぼす影響については議論の余地があります。 プロゲステロン産生の増強は、胃腸の運動性の低下と食物の吸収の遅延を引き起こすことが提案されています。 胃液分泌物はより酸性になり、食道括約筋の緊張が低下します。 ただし、X線撮影、超音波、および色素希釈技術を使用した最近の研究では、妊娠中のどの時点でも液体および固体物質の胃内容排出が減少しないことが示されています。
全身麻酔の導入による逆流のリスクは、部分的には、下部食道括約筋と胃内圧との間の勾配に依存します。 「胸焼け」のある産婦人科では、下部食道括約筋の緊張が大幅に低下します。 単一のルーチンの予防レジメンを確実に推奨することはできません。 予防的非粒子制酸剤の有効性は、胃内容物との不適切な混合、不適切な投与タイミング、および制酸剤が胃の容積を増加させる傾向によって低下します。 シメチジンやラニチジンなどのヒスタミン(H2)受容体拮抗薬の投与は、作用の開始が比較的遅いため、予測と注意深いタイミングが必要です。 最もリスクの高い女性では、選択的帝王切開分娩の前に静脈内(IV)メトクロプラミドを投与することについて議論することができます。 このドーパミン拮抗薬は、妊娠していない女性と妊娠している女性の両方で、胃内容排出を促進し、安静時の下部食道括約筋の緊張を高めます。 しかし、その有効性(おそらく投与のタイミングによる)と錐体外路反応や一過性の神経機能障害などの副作用の頻度に関して矛盾するデータがありました。
血漿量、血液組成、および糖代謝に影響を与える内分泌の変化
血漿量と総血液量は妊娠初期に増加し始め、その結果、満期でそれぞれ40%〜50%と25%〜40%増加します。 これらの変化は、妊娠中の鉱質コルチコイド活性の増加によるものであり、その結果、ナトリウムの保持と体内水分量の増加がもたらされます。 赤血球量の比較的小さな増加(20%)は、ヘモグロビン(11〜12 g / L)とヘマトクリット値(35%)の相対的な減少を説明します。 ただし、血小板数は変化しません。 血漿フィブリノーゲン濃度は通常の妊娠中に約50%増加しますが、凝固因子の活性は変動します。 凝固因子I、VII、VIII、IX、X、およびXIIは妊娠中に増加しますが、因子XIおよびXIIIの濃度は減少し、因子IIおよびVの濃度は妊娠中に変化しません。
血清コリンエステラーゼ活性は、満期までに通常より20%低いレベルまで低下し、産褥の最下点に達します。 血清コリンエステラーゼにおけるこれらの変化の正味の効果は、臨床的に使用される用量のスクシニルコリンまたはエステル型局所麻酔薬(2-クロロプロカイン)の代謝とは無視できるほどの関連性があります。 アルブミン濃度の低下が比較的大きいため、アルブミンとグロブリンの比率は低下します。 血清タンパク質濃度の低下は、タンパク質結合薬物の遊離画分が増加すると予想されるという点で、臨床的に重要である可能性があります。
ヒト胎盤性ラクトゲンとコルチゾールは、高血糖とケトーシスの傾向を高め、既存の糖尿病を悪化させる可能性があります。 ブドウ糖負荷を処理する患者の能力は低下し、ブドウ糖の経胎盤通過は、インスリンの胎児分泌を刺激し、次に、分娩直後の新生児低血糖症につながる可能性があります。
妊娠中の薬物反応の変化
妊娠は、局所麻酔薬に対する神経感受性のプロゲステロン媒介性の増加をもたらします。 硬膜外または脊髄ブロックの皮膚セグメントごとに、より低用量の局所麻酔薬が必要です。 これは、硬膜外静脈の充血およびプロゲステロンによる局所麻酔薬ブロックに対する感受性の向上の結果として、硬膜外およびくも膜下腔における局所麻酔薬の広がりの増加に起因しています。 吸入剤の最小肺胞内濃度は、妊娠8〜12週間で減少し、プロゲステロンレベルの上昇に関連している可能性があります。
NYSORAのヒント
- 妊娠中は、局所麻酔薬に対する神経感受性がプロゲステロンを介して増加します。
- 硬膜外または脊髄ブロックの皮膚セグメントごとに、局所麻酔薬の投与量を減らす必要があります。
局所麻酔薬の胎盤移行
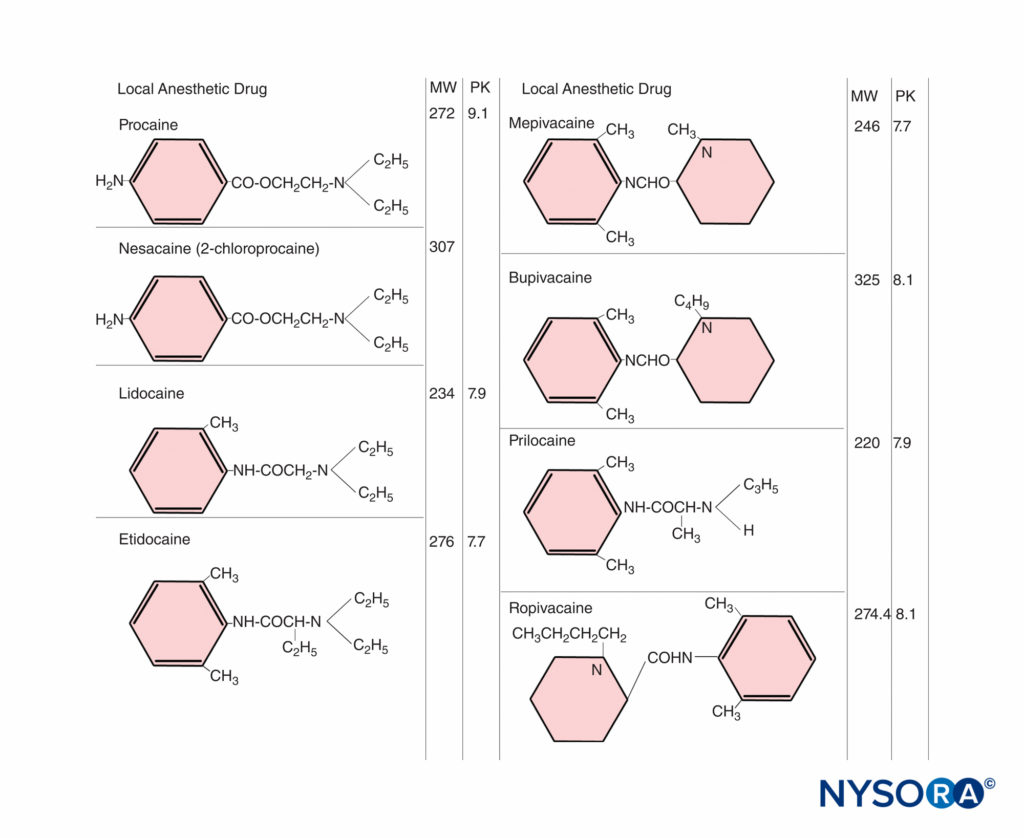
局所麻酔薬は、単純な拡散によって胎盤を容易に通過します。 薬物自体の物理化学的特性、血漿中の母体薬物濃度、胎盤の特性、および胎児母体ユニット内の血行動態イベントなど、いくつかの要因が薬物の胎盤移行に影響を及ぼします。局所麻酔薬などの脂溶性の高い薬物は交差します。生物学的膜はより容易であり、薬物の非イオン化部分はイオン化された薬物よりも親油性であるため、イオン化の程度が重要です。 局所麻酔薬は弱塩基であり、イオン化の程度は比較的低く、脂質の溶解度はかなり高くなります。 非イオン化およびイオン化された形態で存在する薬物の相対濃度は、ヘンダーソン・ハッセルバルチの式から推定できます。
pH = pKa +ログ(ベース)/(カチオン)
非イオン化形態は組織バリアを貫通するのに対し、イオン化形態は神経伝導を遮断するのに薬理学的に活性であるため、陽イオンに対する塩基の比率は局所麻酔薬で特に重要になります。 pKa (酸解離定数)は、遊離塩基と陽イオンの濃度が等しくなるpHです。 アミド局所麻酔薬の場合、pKa 値(7.7–8.1)は生理学的pHに十分に近いため、母体または胎児の生化学的状態の変化により、イオン化薬物と非イオン化薬物の比率が大幅に変化する可能性があります(図1)。 定常状態では、胎児と母体の血漿中の非イオン化局所麻酔薬の濃度は等しくなります。 胎児のアシドーシスでは、薬物がイオン化された形で存在する傾向が高く、胎盤全体に拡散して戻ることはできません。 これにより、局所麻酔薬の総量が胎児の血漿および組織に蓄積します。 これはイオントラッピングと呼ばれます。
NYSORAのヒント
高度にタンパク質に結合した薬物(例えば、ブピバカイン)の長期投与は、薬物の実質的な胎児の蓄積につながる可能性があります。
胎児に蓄積する局所麻酔薬の速度と量に対する母体血漿タンパク結合の影響は十分に理解されていません。 動物実験では、ブピバカインなどの母体の血漿タンパク質に広範囲に結合している薬物の場合、移動速度が遅いことが示されています。 しかし、ブピバカインなどのタンパク質結合性の高い薬物の長期投与により、胎児に薬物がかなり蓄積する可能性があります。
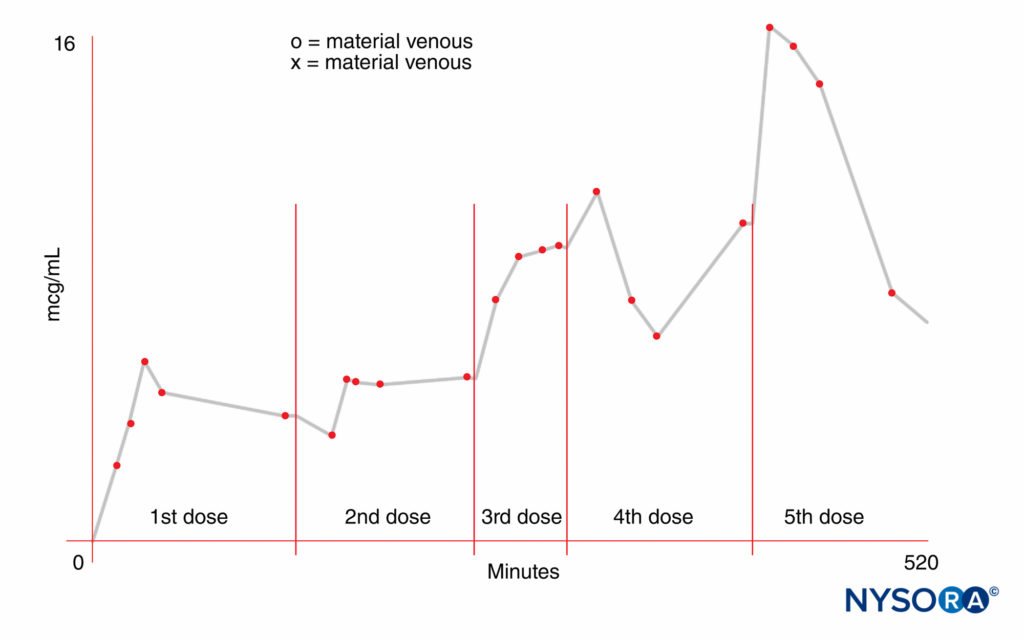
母体血と胎児血の間の遊離薬物の濃度勾配は重要な要因です。 母体側では、投与量、投与方法と投与部位、および血管収縮剤の使用が胎児の曝露に影響を与える可能性があります。 薬物の分布、代謝、および排泄の速度は、変動する可能性がありますが、同様に重要です。 より高い用量はより高い母体血中濃度をもたらします。 吸収率は注射部位によって異なります。 たとえば、IVボーラスは最高の血中濃度をもたらします。 髄腔内投与は局所麻酔薬の血漿濃度を無視できる程度にすると信じられていました。 しかし、75 mgのリドカインで誘発された脊髄くも膜下麻酔は、硬膜外麻酔後に他の人が報告したものと同様の母体血漿濃度をもたらすことがわかっています。 さらに、出生時の臍帯静脈にかなりのレベルの薬物が見られます。 繰り返し投与すると、薬物の動態特性に加えて、再注射の用量と頻度に応じて、母体の血中濃度が高くなる可能性があります。 アミド局所麻酔薬の半減期は比較的長いため、注射を繰り返すと母体血漿に蓄積する可能性があります(図2)。 対照的に、エステル局所麻酔薬である2-クロロプロカインは、偽コリンエステラーゼの存在下で急速な酵素加水分解を受けます。 硬膜外注射後、母親の平均半減期は約3分です。 再注射後、2-クロロプロカインは母体血漿でわずか5〜10分間検出され、この薬剤の蓄積は発生していません。
妊娠は、母体の薬物動態および麻酔薬の作用にも影響を与える可能性のある生理学的変化に関連しています。 これらの変化は妊娠の過程で進行する可能性があり、個々の薬剤を予測するのは難しいことがよくあります。 それにもかかわらず、硬膜外注射後のブピバカインの消失半減期は、妊娠中の女性と妊娠していない女性で類似していることが示されています。
胎児の局所的な血流の変化も、個々の臓器に取り込まれる薬物の量に影響を与える可能性があります。 たとえば、窒息およびアシドーシスの間、胎児の心拍出量の大部分が胎児の脳、心臓、および胎盤に灌流します。 リドカインの注入は、窒息していない対照胎児と比較して、窒息したヒヒ胎児の心臓、脳、および肝臓における薬物取り込みの増加をもたらした。
薬物曝露のリスク:胎児と新生児
胎盤を横切る遊離薬物の濃度勾配が逆転した後、胎児は局所麻酔薬を母体循環に排泄することができます。 これは、母親の総血漿中薬物濃度が胎児の総血漿中薬物濃度を超えている場合でも、胎児の血漿中のタンパク質結合が低いために発生する可能性があります。 2-クロロプロカインは、胎児の血液中で非常に速く代謝される唯一の薬剤であるため、アシドーシスがあっても、胎児への実質的な曝露は回避されます。
正期産児と早産児の両方が、アミド局所麻酔薬の生体内変化に必要な肝酵素を持っています。 比較研究では、成体の雌羊と胎児/新生児の子羊の間のリドカインの薬物動態は、新生児の代謝クリアランスが成体のそれと類似しており、腎クリアランスがそれよりも大きいことを示しました。 しかし、半減期は新生児の方が長かった。 これは、より多くの分布と組織への取り込みに関連しているため、いつでも、新生児の肝臓と腎臓は、体内に蓄積されたリドカインのごく一部にさらされます。 同様の結果が、新生児集中治療室の人間の乳児へのリドカイン投与を含む別の研究で報告されています。
新生児のうつ病は、メピバカインまたはリドカインの血中濃度が成人の全身毒性を引き起こす濃度よりも約50%低い場合に発生します。 しかし、メピバカイン(母体の尾側麻酔を目的とした)を誤って子宮内に注射した乳児は、メピバカインのレベルが成人のけいれんのしきい値を下回ると、けいれんを停止しました。 局所麻酔薬の相対的な中枢神経毒性と心肺毒性が羊で研究されています。 胎児および新生子羊に毒性を生じさせるために必要な用量は、雌羊に必要な用量よりも多かった。 胎児では、この違いは母親への薬物の胎盤クリアランスと痙攣中の血液ガス張力のより良い維持に起因しましたが、新生子羊では、より多くの分布容積がおそらく毒性効果を誘発するために必要なより高い用量の原因でした。
ブピバカインは、胎児の赤血球膜に対する親和性が高いため、新生児黄疸の考えられる原因として関係している可能性があり、その結果、濾過性と変形性が低下し、被験者は溶血しやすくなることが示唆されています。 しかし、最近の研究では、分娩中および分娩中に硬膜外麻酔のために母親にブピバカインを投与された新生児における実証可能なビリルビン産生を示すことができませんでした。
神経行動学的研究により、局所麻酔による新生児の神経学的および適応機能の微妙な変化が明らかになりました。 ほとんどの麻酔薬の場合、これらの変化は軽微で一過性であり、24〜48時間しか持続しません。
分娩および膣分娩のための麻酔
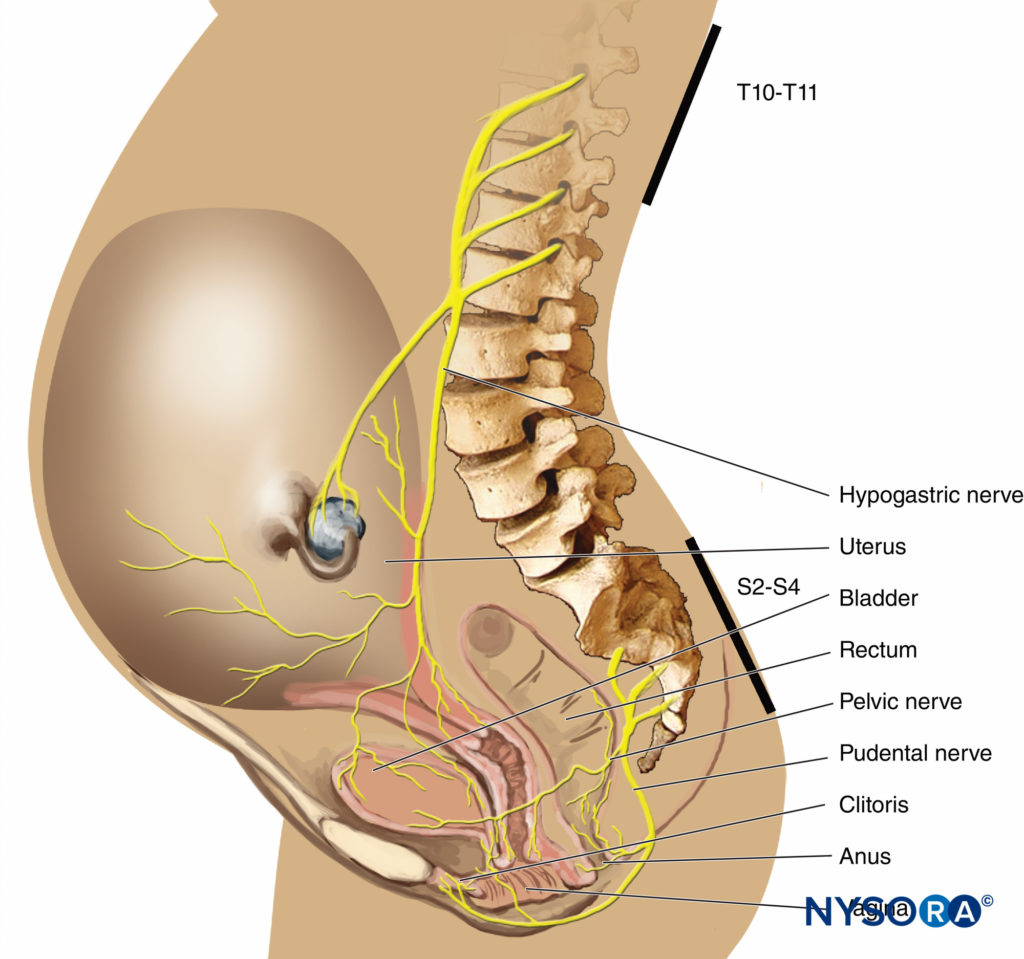
分娩の最初の段階では、痛みは子宮頸部の拡張と子宮下部の膨満に関連する子宮収縮によって引き起こされます。 痛みの衝動は、交感神経に付随する内臓求心性C型線維で運ばれます。 初期の陣痛では、下部胸椎(T11–T12)のみが影響を受けます。 ただし、移行期に進行性の頸部拡張を伴う場合、隣接する皮膚炎が関与し、T10からL1に痛みが生じる可能性があります。 第2段階では、膣円蓋と会陰の膨張による追加の痛みの衝動が、下部仙骨線維(S4〜SXNUMX)で構成される陰部神経に運ばれます。
局所鎮痛は、痛みや不安を和らげる以外の方法で母親に利益をもたらす可能性があります。 動物実験では、痛みが母体の高血圧や子宮の血流の低下を引き起こす可能性があります。 硬膜外鎮痛は、痛みを伴う子宮収縮と「抑制」努力によって発生する母体の心拍出量、心拍数、および血圧の上昇を鈍らせます。 カテコールアミンの母体分泌を減らすことにより、硬膜外鎮痛は、以前は機能していなかった分娩パターンを正常なものに変える可能性があります。 局所鎮痛は、痛みを伴う母体の過呼吸を排除することによって胎児に利益をもたらす可能性があり、母体の酸素-ヘモグロビン解離曲線の左方向へのシフトにより、胎児の動脈酸素分圧の低下につながることがよくあります。
分娩の痛みを和らげるために最も頻繁に選択される方法は、精神予防、全身薬、および局所鎮痛です。 吸入鎮痛、従来の脊髄くも膜下麻酔、および頸部傍ブロックはあまり一般的に使用されていません。 全身麻酔が必要になることはめったにありませんが、一部の複雑な分娩では子宮の弛緩が必要になる場合があります。
全身鎮痛
全身鎮痛薬の利点には、投与の容易さと患者の受容性が含まれます。 ただし、母体および新生児のうつ病を回避するために、薬物、用量、タイミング、および投与方法を慎重に選択する必要があります。 全身鎮痛に使用される薬は、オピオイド、精神安定剤、そして時にはケタミンです。
全身性オピオイド
過去には、メペリジンは分娩の最初の段階で痛みを改善するために最も一般的に使用される全身鎮痛薬でした。 静脈内注射(5〜10分で効果的な鎮痛)または筋肉内(40〜50分で効果のピーク)によって投与することができます。 また、一般の人々の術後の痛みにも一般的に使用されていました。 しかし、その政権の人気とともに、不穏な副作用が現れ始めました。 最も深刻な副作用の62つは、一次薬の効果と薬の代謝物であるノルペチジンの両方からの発作の発生でした。 発作のリスクがある妊娠中の患者、つまり妊娠高血圧症または子癇前症では、発作を引き起こすことが知られている薬の投与によって画像が混乱し、患者のケアが複雑になります。 他の副作用は、吐き気と嘔吐、用量に関連した換気の低下、起立性低血圧、新生児のうつ病の可能性、および鎮痛効果に比例しない陶酔感であり、薬物の誤用につながります。 メペリジンはまた、心拍変動の減少や頻脈など、胎児の心拍数の一過性の変化を引き起こす可能性があります。 他の要因の中でも、新生児のうつ病のリスクは、最後の薬物注射と分娩の間の間隔に関連しています。 新生児での排泄半減期が長い(XNUMX時間)活性代謝物であるノルペチジンの胎盤移行も、新生児のうつ病および微妙な新生児の神経行動障害の一因とされています。 分娩過程に対する全身投与されたメペリジンの効果は物議を醸しています。 メペリジンの投与は分娩の潜伏期を延長するかもしれないが、分娩の第一段階の累積的な長さを短くするかもしれないことが示唆されています。 しかし、最近の研究では、難産の女性の分娩の第一段階を短縮するためにメペリジンを投与しても効果がないことが示されました。
フェンタニルやアルフェンタニルなどの新しい合成オピオイドの使用経験は限られています。 それらは強力ですが、分娩中のそれらの有用性は、それらの短い作用期間によって制限されます。 しかし、これらの薬は、急速に発症するが短時間の鎮痛が必要な場合(例えば、鉗子の適用)に利点を提供します。 たとえば、1 mcg / kgまでのフェンタニルの単回IV注射は、重度の新生児うつ病を伴わずに、短期間で迅速な痛みの緩和をもたらします。 アルフェンタニルは、同等のメペリジン患者管理鎮痛薬(PCA)よりも大きな新生児うつ病と関連している可能性があります。 別の研究では、アルフェンタニルPCAは、フェンタニルPCAと比較して適切な鎮痛を提供できませんでした。 より長期の鎮痛のために、フェンタニルは患者が制御する送達装置で投与することができます。 より一般的には、フェンタニル(15〜25 mcg)およびスフェンタニル(5〜10 mcg)は、痛みの優れた緩和を伴う分娩のための連続的な脊椎硬膜外麻酔の配置中に、局所麻酔薬とともに局所麻酔薬とともに使用されてきました。
レミフェンタニルは、血清および組織のコリンエステラーゼによって急速に代謝されるオピオイドであり、その結果、短い(3分)状況依存の半減期があります。 レミフェンタニルをボーラス投与(ボーラスあたり0.3〜0.8 mcg / kg)で使用すると、許容レベルの母体の副作用があり、新生児への影響は最小限であることがわかっています。 レミフェンタニルは胎盤を通過し、新生児で急速に代謝されるか、再分布するようです。 ある研究では、硬膜外麻酔下で帝王切開分娩中に母親にレミフェンタニルの静脈内注入を0.1 mcg / kg / min投与した新生児では、アプガー指数と神経行動スコアが良好でした。 PCAによって投与された場合、レミフェンタニルは、メペリジンと比較して、より優れた疼痛緩和、同等の血行力学的安定性、より少ない鎮静、およびより少ない酸素飽和度を提供することが見出されています。 最近の二重盲検試験では、レミフェンタニルPCAが同等の鎮痛のために腰部硬膜外と比較されました。 レミフェンタニルグループの女性の56%は、腰部硬膜外鎮痛を受けた女性のXNUMX%と比較して、許容できる痛みのスコアを報告しました。 米国以外の国では、断続的な亜酸化窒素が陣痛鎮痛に使用されています。 レミフェンタニルを亜酸化窒素と比較すると、レミフェンタニルはより少ない副作用でより良い痛みの緩和を提供することがわかりました。 ただし、レミフェンタニルは低換気および低酸素血症を引き起こす可能性があるため、レミフェンタニルIVPCA中は酸素飽和度を定期的に監視する必要があります。
ブトルファノールやナルブフィンなどのオピオイド作動薬-拮抗薬も、産科鎮痛に使用されています。 これらの薬には、吐き気、嘔吐、不快気分の発生率が低いという提案された利点と、換気の低下に対する「天井効果」があります。 筋肉内(IM)ナルブフィンは、二重盲検試験でメペリジンと比較されています。 鎮痛は両方のグループで同等でした。 ただし、ナルブフィンはメペリジンと比較して母体の鎮静の増加と関連していた。 ブトルファノールは、おそらく最も人気のある混合アゴニスト-アンタゴニストです。 メペリジンとは異なり、それは不活性な代謝物に代謝され、2mgを超える用量で換気の低下に天井効果があります。 ブトルファノールは、メペリジンに匹敵する母体の痛みの軽減をもたらし、アプガースコアに差はありません。 ただし、ブトルファノールの使用は、メペリジンよりも、吐き気、嘔吐、めまいなどの母親の副作用が少ないことに関連していました。 潜在的な不利な点は、母体の鎮静の発生率が高いことです。 推奨用量は、IVまたはIM注射で1〜2mgです。 ナルブフィン10mgIVまたはIMは、ブトルファノールの代替品です。純粋なオピオイド拮抗薬であるナロキソンは、最も必要なときに母親の鎮痛を逆転させるため、新生児の換気抑制を防ぐために、出産直前に母親に投与しないでください。 場合によっては、ナロキソンは母体の肺水腫、さらには心停止を引き起こすことが報告されています。 必要に応じて、薬剤は新生児IM(0.1 mg / kg)に直接投与する必要があります。
ケタミン
ケタミンは強力な鎮痛剤です。 しかし、それはまた、母親の出産の記憶を妨げる可能性のある容認できない健忘症を誘発する可能性があります。 それにもかかわらず、ケタミンは、経膣分娩中の不完全な局所鎮痛または産科手術のための有用な補助剤です。 低用量(0.2〜0.4 mg / kg)では、ケタミンは新生児のうつ病を引き起こすことなく適切な鎮痛を提供します。
地域鎮痛技術
地域の技術は、母親と胎児への抑制効果を最小限に抑えた優れた鎮痛を提供します。 分娩麻酔に最も一般的に使用される技術には、中枢性脊髄幹麻酔(脊髄、硬膜外、および脊髄くも膜下硬膜外の組み合わせ)、頸部傍、陰部ブロック、およびまれに腰部交感神経ブロックが含まれます。 交感神経切除術に起因する低血圧は、中央脊髄幹麻酔で発生する最も一般的な合併症です。 したがって、母体の血圧は定期的に監視する必要があります。通常、ブロックの開始後約2〜5分間は15〜20分ごとに、その後は定期的に監視する必要があります。 局所鎮痛は、重度の凝固障害、急性循環血液量減少、または針挿入部位の感染症の存在下では禁忌となる場合があります。 敗血症のない絨毛羊膜炎は、中枢性脊髄幹麻酔の禁忌ではありません。
硬膜外鎮痛
労働の第一段階で効果的な鎮痛は、T10–L2皮膚麻酔薬を低濃度の局所麻酔薬で、しばしば脂溶性オピオイドと組み合わせて遮断することによって達成されます。 分娩の第4段階では、膣膨満と会陰圧による痛みのため、ブロックを拡張して陰部セグメントSXNUMX–XNUMXを含める必要があります(図3 & 4)分娩の潜伏期(2〜4 cmの頸部拡張)で硬膜外鎮痛を早期に開始すると、分娩の第4段階が延長し、特に難産と帝王切開の発生率が高くなる可能性があることが懸念されています。未産婦。 一般的に言えば、大動静脈圧迫が回避されれば、硬膜外鎮痛によって分娩の第一段階が延長されることはありません。 栗ら。 帝王切開分娩の発生率は、活動期に鎮痛が開始された女性と比較して、潜伏期(XNUMXcm拡張時)に硬膜外鎮痛が開始された未経産女性で差がないことを示した。 他の人は、硬膜外鎮痛が、未産婦のIVPCAと比較して帝王切開分娩の発生率の増加と関連していないことを示しています。
しかし、分娩の第XNUMX段階の延長は、おそらく排泄力の低下または胎児の位置異常が原因で、未産婦で報告されています。
したがって、硬膜外鎮痛を使用して、アメリカ産科婦人科学会(ACOG)は、異常に延長された分娩の第3段階を、未産婦では2時間以上、経産婦ではXNUMX時間以上と定義しました。
陣痛のより長い第XNUMX段階は、オピオイドと組み合わせた超希釈局所麻酔薬の使用によって最小限に抑えることができます。 ブピバカイン、ロピバカイン、レボブピバカインなどの長時間作用型アミドは、特に硬膜外鎮痛に使用される低濃度で運動機能を温存しながら優れた感覚鎮痛をもたらすため、最も頻繁に使用されます。
NYSORAのヒント
- 分娩の第一段階での鎮痛は、低濃度の局所麻酔薬でT10–LXNUMX皮膚炎を遮断することによって達成されます(参照 図3).
- 分娩と分娩の第2段階の鎮痛には、膣膨満と会陰圧による痛みのため、S4–XNUMXセグメントのブロックが必要です。
分娩の第5段階の鎮痛は、10〜0.125 mLのブピバカイン、ロピバカイン、またはレボブピバカイン(0.25%〜8%)と、それに続く12%のブピバカインまたはレボブピバカインの持続注入(0.0625〜0.1 mL / h)で達成できます。または1%ロピバカイン。 フェンタニル2〜0.3 mcg / mLまたはスフェンタニル0.5〜10 mcg/mLを追加できます。 実際の分娩中に、会陰は0.5 mLの1%ブピバカイン、2%リドカイン、または迅速な効果が必要な場合は半横臥位のXNUMX%クロロプルカインでブロックされる可能性があります。局所麻酔薬の希薄溶液を使用します。
カテーテルの吸引だけでは、必ずしも診断に役立つとは限りません。 そのため、一部の著者は、髄腔内または血管内に配置された硬膜外カテーテルの検出を改善するために、試験用量を投与する必要があると考えています。 15 mcgのエピネフリンを血管に注入すると、心拍数が20〜30 bpm変化し、投与後30秒以内に血圧がわずかに上昇します。 所要時間は約30秒です。 麻酔科医は、注射後の最初のXNUMX分間にパルスオキシメータを観察して、偶発的な血管内注射が発生したかどうかを判断する必要があります。 ただし、エピネフリンの静脈内試験用量に関連する頻脈は、痛みを伴う子宮収縮と同時に混乱する可能性があるため、分娩中の血管内注射の信頼できる指標ではありません。 さらに、エピネフリンは、ベータアドレナリン受容体拮抗薬を投与された患者では信頼できません。 血管内注射の他の微妙な兆候には、不安感、不安感、動悸などがあります。 局所麻酔薬の総投与量を分割し、XNUMX分間隔で患者を観察することが重要です。
患者管理の硬膜外鎮痛(PCEA)は、従来のボーラスまたは注入技術に代わる安全で効果的な方法です。 母体の受容性は優れており、麻酔マンパワーへの要求は軽減される可能性があります。 研究によると、硬膜外持続注入と補充が比較的少ないPCEAは、基礎レートの硬膜外注入がないPCEAと比較して、必要な麻酔介入が少なくて済みます。 最初の鎮痛は、局所麻酔薬のボーラス投与で達成されます。 母親が快適になったら、PCEAは、オピオイド(フェンタニル8〜12 mcg)の有無にかかわらず、局所麻酔薬(ブピバカイン、レボブピバカイン、またはロピバカイン0.0625%〜0.125%)の維持注入(1〜2 mL / h)で開始できます。 / mLまたはsufent-anil0.3–0.5 mcg / mL)。 マシンは、投与の間に8分のロックアウト期間で10mLの硬膜外デマンドボーラスを投与するようにプログラムすることができます。
腰部ではなく尾側のアプローチは、会陰鎮痛のより早い発症をもたらす可能性があり、したがって、切迫した膣分娩が予想される場合、腰部硬膜外アプローチよりも好ましい可能性があります。 しかし、時折痛みを伴う針の配置、高い失敗率、注射部位での潜在的な汚染、および偶発的な胎児注射のリスクのために、尾側鎮痛はもはや一般的ではありません。 尾側注射の前に、直腸指診を実施して、胎児提示部分への針の配置を除外する必要があります。 低脊椎の「サドルブロック」により、現代の診療では尾側麻酔の必要性が事実上なくなりました。
脊髄くも膜下麻酔
労働鎮痛のための、通常はオピオイドと少量の局所麻酔薬の単回髄腔内注射には、労働の第一段階での信頼性が高く迅速な鎮痛の開始という利点があります。 ただし、長時間の陣痛には髄腔内注射を繰り返す必要があるため、硬膜穿刺後の頭痛のリスクが高まります。 さらに、モーターブロックは一部の女性にとって不快であり、陣痛の第XNUMX段階を長引かせる可能性があります。 この技術は、分娩が急速に進行し、完全な子宮頸管拡張および予想される膣分娩の前に短時間の鎮痛または麻酔を必要とする、または継続的な硬膜外鎮痛が不可能な状況で、多産の分娩者に最も有用です。
マイクロカテーテルは、1980年代に継続的な脊髄くも膜下麻酔のために導入されました。 その後、馬尾領域における局所麻酔薬の偏在に関連している可能性のある神経学的欠損に関連していることが判明した場合、それらは取り下げられました。 幸いなことに、最近の多施設共同研究では、労働している女性の継続的な脊髄くも膜下麻酔のために28ゲージのマイクロカテーテルを使用した後、神経学的症状の症例は発生しませんでした。 脊髄くも膜下麻酔は、器具による分娩のための全身麻酔の安全で効果的な代替手段でもあります。
脊髄くも膜下硬膜外鎮痛の併用
脊髄くも膜下硬膜外(CSE)鎮痛法は、陣痛中に使用するのに理想的な鎮痛法です。 それは、脊椎注射に起因する深遠な鎮痛の迅速で信頼性の高い発症と、硬膜外技術の柔軟性およびより長い期間を組み合わせたものです。 最近のメタアナリシスでは、CSEの鎮痛の開始は、硬膜外法よりも有意に速かった(2〜5分対10〜15分)。
テクニック
従来の(または特殊な)硬膜外針を使用して硬膜外腔を特定した後、より長い(127 mm)ペンシルポイントの脊髄針を硬膜外針を通してくも膜下腔に進めます。 髄腔内注射後、脊髄針を抜去し、硬膜外カテーテルを挿入します。 フェンタニル10〜25 mcgまたはスフェンタニル2.5〜5 mcgを単独で、または最大1 mLの等圧ブピバカイン0.25%と組み合わせて髄腔内注射すると、最小限の運動ブロックで60〜120分間持続する重度の鎮痛が得られます。
掻痒の発生率は、硬膜外オピオイド投与よりも髄腔内オピオイド投与の方が高いことに注意する必要があります。 オピオイドだけでも初期の潜伏期を十分に緩和できる可能性がありますが、高度な分娩中の十分な鎮痛には、ほとんどの場合、ブピバカインの追加が必要です。 他のアジュバントも使用されています。 クロニジンやネオスチグミンなどのアジュバントの追加は期待外れでした。 ブピバカイン0.03%〜0.0625%とオピオイドの硬膜外注入は、脊髄注射から10分以内に開始できます。 あるいは、硬膜外成分は必要に応じて活性化することができます。 継続的な胎児モニタリングを必要としない血行力学的安定性と保存された運動機能を持つ女性は、援助を受けて歩き回ることができます。 歩行前に、髄腔内または硬膜外薬物投与後30分間女性を観察して、母体および胎児の健康状態を評価する必要があります。 最近の研究では、未経産の女性にCSE鎮痛薬を早期に投与しても、帝王切開分娩率は上昇しなかったことが示されました。
NYSORAのヒント
フェンタニル10〜25 mcgまたはスフェンタニル5〜10 mcgを単独で、またはより一般的には1 mLの等圧ブピバカイン0.25%とともに髄腔内注射すると、最小限の運動ブロックで90〜120分間持続する重度の鎮痛作用が得られます。
髄腔内オピオイドの最も一般的な副作用は、そう痒、吐き気、嘔吐、および尿閉です。 フェンタニルとスフェンタニルでは、呼吸抑制の遅延をもたらす吻側の広がりはまれであり、通常、注射から30分以内に発生します。 一過性の不安な胎児の心拍数パターンは、おそらく母体のカテコールアミンの急速な減少の結果として、オキシトシンの反対されない効果をもたらす子宮の過剰刺激のために発生する可能性があります。
O'Gormanらによる予備研究。 胎児の徐脈は、子宮の過刺激または低血圧がない場合に発生する可能性があり、子宮胎盤機能不全とは無関係であることを示唆しています。 胎児の心拍数の異常の発生率は、急速に進行する痛みを伴う陣痛を伴う経産婦の方が高い可能性があります。 ほとんどの研究は、緊急帝王切開分娩の発生率は、従来の硬膜外鎮痛後よりもCSE鎮痛の方が高くないことを示しています。 硬膜穿刺後の頭痛は、髄腔内注射後は常にリスクです。 ただし、頭痛の発生率は、標準的な硬膜外鎮痛と比較して、CSE鎮痛では大きくありません。
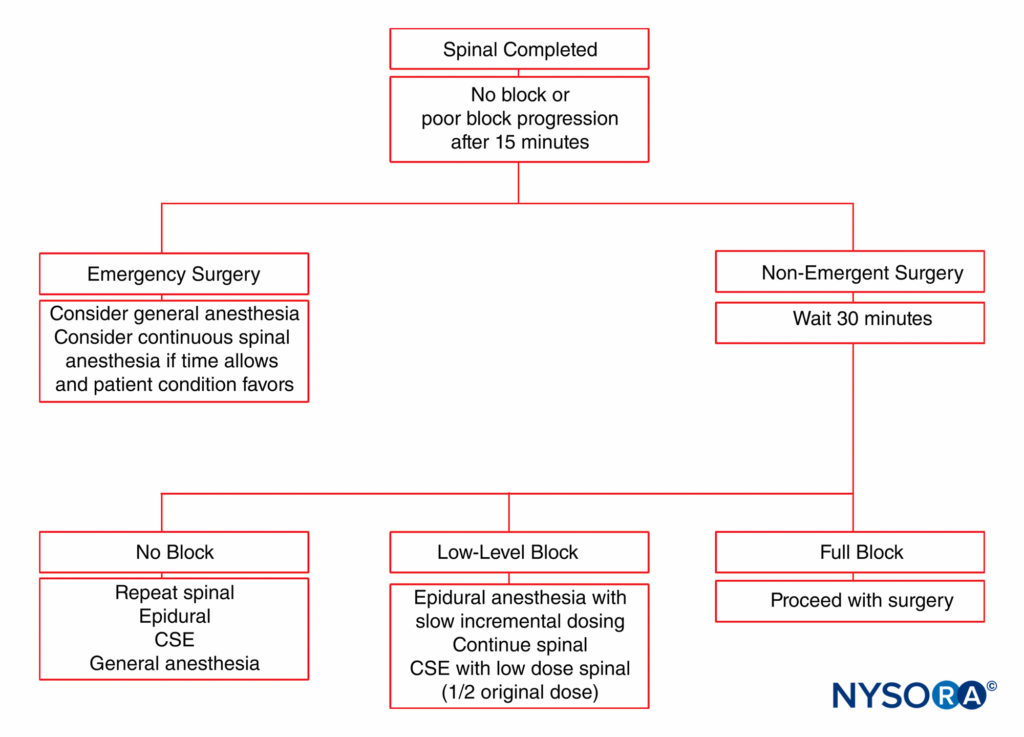
CSE鎮痛のために27ゲージの脊椎針を使用した後、硬膜穿刺部位を介した意図しない髄腔内カテーテル留置もまれです。 特に大量の薬剤が急速に注射された場合、硬膜外に投与された薬剤が硬膜穿刺を通して髄腔内に漏れる可能性があります。 実際、CSE鎮痛では、帝王切開分娩のための標準的な腰部硬膜外技術よりも硬膜外薬物の必要量が約30%少なくなります。 一部の臨床医は、帝王切開分娩に緊急に使用する必要があるかもしれない「証明されていない」硬膜外カテーテルへの懸念から、分娩のためのCSE鎮痛技術を提唱していません。 患者は、硬膜外麻酔が効く場合と効かない場合がある手術には不十分な部分的なブロックを持っている可能性があります。 硬膜外麻酔が不完全な場合の患者管理のアルゴリズムは、 図5.
頸部傍ブロック
最近では2001年に、米国の出産者の2%〜3%だけが分娩中に子宮頸管傍ブロックを受けました。 子宮頸部傍ブロックは、陣痛の最初の段階で効果的に痛みを和らげますが、特にブピバカインの使用により、胎児の徐脈の発生率が高いため、現在、米国ではめったに使用されていません。 これは、子宮動脈の収縮または子宮の緊張の増加に関連している可能性があります。
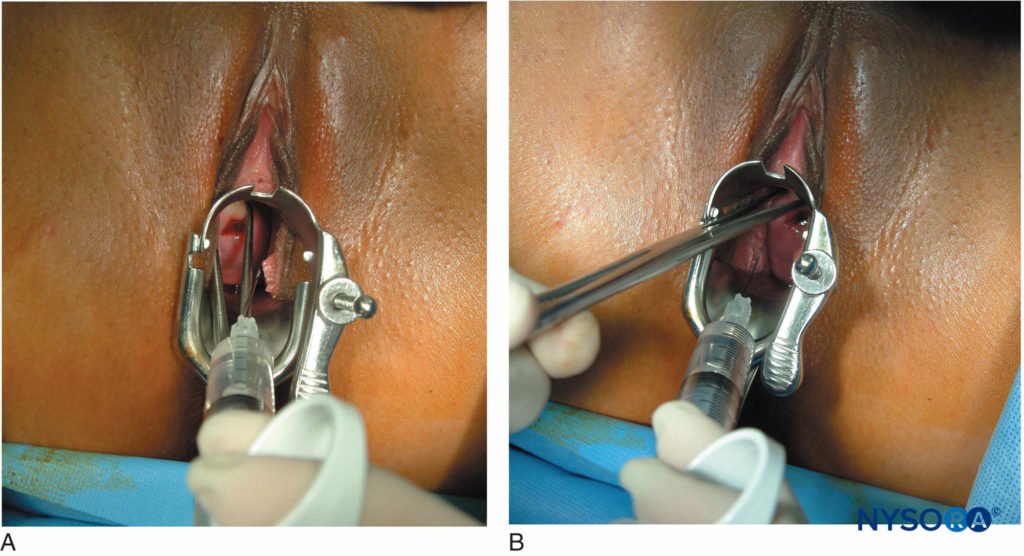
ラセミ体のブピバカインと比較してレボブピバカインを使用すると、胎児の徐脈が少なくなることが実証されています。 子宮頸管傍ブロックは、子宮掻爬術に鎮痛を提供するための有用な技術です。 この技術は非常に単純で、子宮を神経支配する神経線維の近くの膣円蓋に局所麻酔薬を粘膜下注射します(図6).
傍脊椎腰部交感神経ブロック
傍脊椎腰部交感神経ブロックは、中央脊髄幹麻酔の合理的な代替手段です。 腰部交感神経ブロックは、陣痛の最初の段階で、子宮頸部および子宮の衝動の痛みを伴う伝達を効果的に遮断します。 レイトン等。 腰部交感神経ブロックを受けた女性は、硬膜外鎮痛と比較して、鎮痛の最初のXNUMX時間の間に頸部拡張の速度が速く、分娩の第XNUMX段階が短かったことを示しました。 しかし、陣痛の活発な段階では、拡張率に差はありませんでした。 頸部傍ブロックと比較して腰部交感神経ブロックを伴う胎児徐脈のリスクは少ないが、ブロックの性能に関連する技術的困難および血管内注射のリスクがその日常的な使用を妨げてきた。 低血圧は、腰部交感神経ブロックでも発生する可能性があります。
陰部神経ブロック
陰部神経は仙骨下部神経根(S2–4)に由来し、膣円蓋、会陰、直腸、および膀胱の切片に供給されます。 神経は、坐骨棘の周りをループする場所で経膣的に簡単にブロックされます。
最近の研究では、陰部神経ブロックは、おそらく仙骨ではなく腰部の繊維によって神経支配されている上部膣に関連して、分娩の第48段階に信頼できる鎮痛を提供しないことが示されました。 ただし、ブロックは会陰切開と修復に役立ちます。 陰部神経ブロックの産後の利点もあるかもしれません。 たとえば、ロピバカインによる片側神経刺激装置誘導陰部神経ブロックは、膣送達での内側会陰切開の実施後の最初のXNUMX時間の痛みの軽減と、補足的な鎮痛の必要性の減少に関連していました。
帝王切開分娩のための麻酔
帝王切開分娩の最も一般的な適応症には、進行の失敗、安心できない胎児の状態、児頭骨盤不均衡、胎位異常、未熟児、およびコーパスを含む以前の子宮手術が含まれます。 麻酔の選択は、母親と胎児の状態に加えて、手順の緊急性に依存する必要があります。 すべての麻酔オプションのリスクと利点について包括的に話し合った後、母親の欲求を検討する必要があります。 麻酔技術を開始する前に、母親と新生児用の蘇生装置を利用できるようにする必要があります(テーブル2).
表2 配達室の蘇生装置。
| ラディアントウォーマー |
| マノメーターと吸引トラップによる吸引 |
| 吸引カテーテル |
| 流量計付き壁酸素 |
| 蘇生バッグマスク陽圧換気装置(≤750mL) |
| 幼児用フェイスマスク |
| 乳児の口腔咽頭気道 |
| 気管内チューブ:2.5、3.0、3.5、および4.0 mm |
| 気管内チューブスタイレット |
| 喉頭鏡とブレード |
| 滅菌臍帯動脈カテーテルトレイ |
| 針、注射器、三方活栓 |
| 薬と解決策: •1:10,000エピネフリン •ナロキソン塩酸塩 • 重炭酸ナトリウム •ボリュームエキスパンダー |
産科患者における局所麻酔の利点
帝王切開分娩は全出生の30%以上を占め、米国で行われる最も一般的な外科手術であり、毎年1万人以上が行われています。 米国での産科麻酔の実践に関する1992年の調査では、帝王切開分娩を受けているほとんどの患者は、脊髄または硬膜外麻酔下で行われていることが示されました。
地域の技術にはいくつかの利点があります。それらは胃の誤嚥のリスクを減らし、抑制性の麻酔薬の使用を避け、出産中に母親が目を覚まし続けることを可能にします。 手術による失血は、全身麻酔と比較して局所麻酔でも減少する可能性があります。 一般的に言えば、局所技術では、長時間の大動静脈圧迫または低血圧がない限り、分娩前麻酔の期間は新生児の転帰に影響を与えません。 感覚ブロックは少なくともT4ダーマトームまで拡張する必要があるため、低血圧のリスクは経膣分娩中よりも高くなる可能性があります。 研究によると、晶質液のプレロードは、脊髄幹麻酔によって誘発される低血圧を確実に防ぐことはできません。 実際、最近の研究では、髄腔内注射時の静脈内同時負荷は、ニューロブロック前の事前水和と同じくらい効果的であることが示されています。 これらの対策にもかかわらず低血圧が発生した場合は、左子宮置換を増やし、IV注入速度を上げ、IVエフェドリン5〜15 mg(またはフェニレフリン25〜50 mcg)を段階的に投与する必要があります。 低血圧の予防における最大の成功は、出産までフェニレフリンの継続的な低用量注入で発見されました。
脊椎麻酔
くも膜下ブロックは、その発症速度と信頼性のために、おそらく最も一般的に投与される帝王切開分娩用の局所麻酔薬です。 また、緊急帝王切開の全身麻酔の代替手段にもなりました。
リドカイン5%、テトラカイン1.0%、またはブピバカイン0.75%の高圧溶液が使用されています。 しかし、ブピバカインは現在、帝王切開分娩のための脊髄くも膜下麻酔に最も広く使用されている薬剤になっています。 ノリスは、0.75%の高圧ブピバカインを使用して、患者の身長に基づいて薬剤の投与量を調整する必要がないことを示しました。 さらに、患者の年齢、体重、脊柱の長さは、結果として生じる脊髄幹麻酔に影響を与えません。 脊髄ロピバカインを使用した最近の研究では、ブピバカインと比較して、低血圧が少なく、回復が速いが、発症が遅いことが示されています。 しかし、ロピバカインがブピバカインと同様の品質の脊髄くも膜下麻酔を行うかどうかは疑問視されています。 帝王切開中の血行力学的モニタリングは、赤ちゃんが生まれる前に少なくとも3分ごとに血圧をモニタリングする必要があることを除いて、他の外科的処置に使用されるものと同様である必要があります。 出産前に、胎児の酸素化を最適化するために酸素を定期的に投与する必要があります。 一過性の神経学的症候群および/または馬尾症候群の報告は、60%または5%の製剤であるかどうかにかかわらず、2mgを超える用量のリドカインと関連しています。 これにより、一部の臨床医は髄腔内投与にリドカインを使用しないようになりました(以下の「局所麻酔薬の全身毒性」を参照)。 テーブル3 局所麻酔薬と、くも膜下ブロックを伴う帝王切開分娩に一般的に使用される投与量を示します。
表3 くも膜下ブロックを伴う帝王切開分娩に一般的に使用される局所麻酔薬。
| 患者の身長あたりの投与量(cm) | 0.75%デキストロース中のブピバカイン8.25%(mg) | ブピバカイン0.5%(等圧)(mg) |
|---|---|---|
| 150〜160 cm | 8 | 8 |
| 160-180 | 10 | 10-12.5 |
| > 180 cm | 12 | 12.5-15 |
| 行動の開始 | 2〜4分 | 5〜10分 |
適切な皮膚レベルにもかかわらず、女性は、特に子宮の外面化および腹部内臓の牽引中に、さまざまな程度の内臓不快感を経験する可能性があります。 フェンタニル20mcgまたは防腐剤を含まないモルヒネ0.1mgを局所麻酔薬溶液に添加することにより、周術期鎮痛を改善することができます。 防腐剤を含まないモルヒネは、0.1〜0.25mgの範囲の用量で有意な鎮痛をもたらします。 脊髄モルヒネの投与量が多いと、そう痒が大きくなります。 呼吸抑制の遅延-脊髄モルヒネで発生する可能性がありますが、非常にまれであり、肥満などの併存疾患に関連していることがよくあります。 呼吸抑制は、くも膜下モルヒネの吻側への広がりによるものです。 帝王切開のために脊髄モルヒネ1915mgを投与された0.15人の分娩者を対象とした後ろ向き研究では、0.26人の患者(60%)が緩徐呼吸を経験し、150人の患者がナロキソンを必要としました。 さらに、XNUMX〜XNUMX mcgの用量の脊髄クロニジンは、帝王切開を受けている女性の術中鎮痛を改善し、震えを軽減します。 ただし、低血圧と鎮静は脊髄クロニジンで報告されており、その日常的な使用を制限する可能性があります。 オンダンセトロンまたはメトクロプラミドの投与により、悪心および嘔吐を軽減することができます。 可能であれば、母体の鎮静は避けるべきです。 最初のブロックが適切でない場合は、脊髄くも膜下注射の繰り返しと、不注意による高脊髄くも膜下麻酔の可能性に関する懸念があります。 見る 図5 脊髄くも膜下麻酔が手術に十分であると証明できない状況で利用可能なさまざまなオプションについて。
NYSORAのヒント
- 手術に十分な皮膚レベルがあっても、帝王切開を受けている女性は、特に子宮の露出と腹部内臓の牽引中に不快感を感じることがあります。
- 周術期鎮痛は、フェンタニル20mcgまたは防腐剤を含まないモルヒネ0.1mgを局所麻酔薬溶液に添加することで強化できます。
腰部硬膜外麻酔
硬膜外麻酔は、脊髄くも膜下麻酔と比較して、作用の開始が遅く、適切な感覚ブロックを確立するために必要な薬物が大きくなります。 利点は、硬膜外穿刺頭痛のリスクが低いと認識されていることと、硬膜外カテーテルを介して局所麻酔薬を滴定できることです。 ただし、硬膜外カテーテルを正しく配置し、不注意による髄腔内または血管内注射を回避することが不可欠です。
血液または脳脊髄液に対する硬膜外カテーテルの吸引は、カテーテルの置き忘れを検出するために100%信頼できるわけではありません。 このため、「テスト用量」は、不注意による血管内または髄腔内カテーテルの留置を除外するためによく使用されます。 少量の局所麻酔薬であるリドカイン45mgまたはブピバカイン5mgは、髄腔内に注射すると、容易に識別できる感覚および運動ブロックを生成します。 しかし、最近の研究では、運動ブロックの開始が遅いと髄腔内注射のタイムリーな診断が妨げられる可能性があるため、ロピバカイン15mgは有用な髄腔内試験用量ではないことが示唆されています。 注意深い継続的な心拍数と血圧のモニタリングを伴うエピネフリン15mcgの追加は、心拍数と血圧の一時的な増加を伴う血管内注射の前兆となる可能性があります。 ただし、エピネフリンのテスト用量は、痛みを伴う子宮収縮に関連する頻脈の形で偽陽性の結果が発生するため、信頼できません。 さらに、エピネフリンは、一部の患者の子宮胎盤灌流を潜在的に減少させる可能性があります。 心電図検査とピークツーピーク心拍数基準の適用により、検出が改善される可能性があります(エピネフリン注射前の最大心拍数を10拍上回ります)。 前胸部ドップラーモニタリングを同時に行う1mLの空気の迅速な注入は、血管内カテーテル留置の信頼できる指標であるように思われます。 最も重要なのは、陰性の検査は安心ですが、局所麻酔薬の部分投与の必要性を排除するものではありません。
NYSORAのヒント
- 血液または脳脊髄液のための硬膜外カテーテルの吸引は、カテーテルの置き忘れを検出するために絶対的に信頼できるものではありません。
- 「テスト用量」は、不注意な血管内または髄腔内カテーテルの留置を除外するためによく使用されます。
- 少量の局所麻酔薬であるリドカイン45mgまたはブピバカイン5mgは、髄腔内に注射すると、容易に識別できる感覚および運動ブロックを生成します。
- 注意深い血行力学的モニタリングを伴うエピネフリン15mcgの追加は、心拍数と血圧の一時的な増加が続く場合、血管内注射の合図となる可能性があります。
- ただし、子宮収縮の存在下で偽陽性の結果が発生するため、エピネフリン試験用量の使用については議論の余地があります。
局所麻酔薬の選択
最も一般的に使用される局所麻酔薬は、2-クロロ-プロカイン3%、ブピバカイン0.5%、およびリドカイン2%とエピネフリン1:200,000です。 十分な麻酔は通常、15〜25mLの局所麻酔薬を分割して投与することで達成できます。 脊髄くも膜下麻酔と同様に、患者を監視する必要があります。 母体および胎児の血漿中の代謝率が非常に高いため、2-クロロプロカインは、全身毒性のリスクを最小限に抑えながら、迅速に発症し、信頼性の高いブロックを提供します。 これは、胎児のアシドーシスが存在する場合、および既存の硬膜外ブロックを緊急帝王切開分娩のために急速に拡張する場合に選択される局所麻酔薬です。 薬物の大量の不注意な髄腔内投与後の神経学的欠損は、低pHで比較的高濃度の亜硫酸水素ナトリウムを含む製剤で発生しました。
2-クロロプロカイン(ネサカイン-MPF)の新しい製剤では、亜硫酸水素ナトリウムの代わりにエチレンジアミン四酢酸(EDTA)が使用されています。 しかし、外科患者に大量のネサカイン-MPFを硬膜外注射した後、重度のけいれん性腰痛が報告されていますが、分娩者には報告されていません。 これは、EDTAによって誘発された椎前筋からのカルシウムの浸出に起因しています。 2-クロロプロカインの最新の製剤は添加物を含まず、酸化を防ぐために琥珀色のバイアルに包装されています。
ブピバカイン0.5%は、帝王切開分娩の開始が遅いが、作用期間が長いという深遠な麻酔を提供します。 意図しない血管内注射は、けいれんだけでなく、ほぼ同時に心停止を引き起こし、患者はしばしば蘇生に抵抗することが報告されているため、この薬にはかなりの注意が向けられています。 他のアミド局所麻酔薬と比較してブピバカイン(およびエチドカイン)のより大きな心毒性は十分に確立されています。強力な長時間作用型アミド局所麻酔薬を使用する場合、誘導用量を分割することが重要です。 リドカインの発症と持続時間は、2-クロロプロカインとブピバカインの中間です。 適切な腰仙骨麻酔を確実にするために局所麻酔薬溶液にエピネフリンを含める必要があるため、母体の高血圧と子宮胎盤機能不全の女性におけるリドカインの使用が制限されます。
モルヒネ4mgなどのオピオイドの硬膜外投与またはPCEAの使用により、術後の疼痛緩和を延長することができます。 モルヒネを使用すると、呼吸抑制の遅延が発生する可能性があります。 したがって、術後は患者を注意深く監視する必要があります。 最近、脂質でカプセル化されたモルヒネ製剤(DepoDur)が、帝王切開後の分娩鎮痛薬として承認されました。 硬膜外にのみ使用でき、最長48時間持続する可能性があり、患者は呼吸抑制の遅延を監視する必要があります。 産科における潜在的な制限は、局所麻酔薬が脂質からのモルヒネの制御されない放出を引き起こす可能性があるため、薬物が投与されると、追加の局所麻酔薬を最大5時間硬膜外に注射できないことです。 Carvalhoetal。 帝王切開後の鎮痛のために10、15、および10 mgの徐放性モルヒネの硬膜外投与を評価し、15mgおよび48mgの用量が術後50時間まで良好な鎮痛を提供することを実証しました。 重大な副作用は観察されませんでした。 別の研究では、防腐剤を含まないモルヒネと比較して、徐放性モルヒネを投与されている患者の疼痛スコアが低く、鎮痛剤の必要量が少ないことが示されました。 悪心、そう痒、または鎮静スコアの違いは観察されませんでした。 さらに、硬膜外フェンタニル(100〜XNUMX mcg)のボーラス投与は、脊髄および脊髄上作用部位の両方で活性をもたらし、麻酔の質を改善することがわかっています。
麻酔の合併症
妊産婦死亡率
1979年から1990年までの米国における麻酔関連の死亡に関する研究では、全身麻酔による致死率は、局所麻酔による致死率の16.7倍であることが示されました。 麻酔関連の死亡のほとんどは、気道確保の困難に遭遇したときの低酸素血症による心停止の結果でした。 FRCの低下、酸素消費量の増加、口腔咽頭浮腫などの妊娠による解剖学的および生理学的変化は、無呼吸および低換気の期間中に患者を不飽和化の深刻なリスクにさらす可能性があります。
誤嚥
妊娠中の女性では、特に気道の確立が困難な場合、または気道反射が鈍化した場合に、胃内容物の吸入のリスクが高まります。 誤嚥のリスクを減らすための対策には、包括的な気道評価、非粒子制酸剤の予防的投与、および局所麻酔の好ましい使用が含まれます。 誤嚥が発生した場合、管理には持続的気道陽圧法(CPAP)による低酸素血症の即時治療と可能性のある硬性気管支鏡検査が含まれます。 最近の研究では、酸性度を中和するための生理食塩水と重炭酸塩によるコルチコステロイドまたは肺洗浄の投与はサポートされていません。 胃内容物は無菌であるため、予防的抗生物質は推奨されません。
低血圧
局所麻酔は、局所麻酔薬による交感神経遮断の程度と速さに関連する低血圧と関連している可能性があります。 したがって、硬膜外麻酔ではより大きな血行力学的安定性が観察される可能性があり、局所麻酔薬の段階的な滴定により、血圧低下を見越して昇圧剤を投与するための適切な時間だけでなく、ブロックレベルのより良い制御が可能になります。
低血圧のリスクは、非労働者の女性と比較して労働者の女性の方が低くなっています。 局所麻酔を開始する前に15mL/ kgの乳酸リンガー溶液で母体を事前に水和し、大動静脈圧迫を回避すると、低血圧の発生率が低下する可能性があります。 低血圧を効果的に予防するには、プレロードによる血液量の増加が心拍出量の有意な増加をもたらすのに十分でなければならないことが実証されています。 これは、ヘタスターチ0.5–1 Lの投与でのみ可能でした。それにもかかわらず、低血圧の予防におけるボリュームローディングの有効性に関しては論争があります。 髄腔内注射時に与えられる急速な晶質の同時負荷と組み合わせた予防的フェニレフリン注入を使用した最近の研究は、脊髄くも膜下麻酔によって誘発される低血圧の発生率を著しく減少させました。 水分補給前にもかかわらず低血圧が発生した場合、治療措置には、子宮の変位の増加、IV液の急速注入、IVエフェドリン(5〜10 mg)の滴定、および酸素投与が含まれる必要があります。 母体の頻脈が存在する場合、正常な子宮胎盤機能を持つ女性では、フェニレフリン25〜50mcgがエフェドリンの代わりに使用される可能性があります。 継続的な警戒と低血圧の積極的な管理は、母親と新生児の両方の深刻な後遺症を防ぐことができます。
高脊髄くも膜下麻酔
高い、または完全な脊髄くも膜下麻酔は、現代の診療における髄腔内注射のまれな合併症です。 これは、くも膜下腔に局所麻酔薬が頭側に過度に広がることで発生します。 硬膜穿刺またはカテーテル移動の結果としての硬膜外薬の意図しない髄腔内投与も、この合併症を引き起こす可能性があります。 血行力学的安定性を達成するには、左子宮変位と継続的な水分および昇圧剤の投与が必要な場合があります。 逆トレンデレンブルグ体位は、頭側の広がりを妨げず、交感神経切除術に関連する静脈貯留のために心血管虚脱を引き起こす可能性があります。 気道の迅速な管理は不可欠であり、吸引せずに酸素化を確実にするために気管内挿管が必要になる場合があります。
NYSORAのヒント
- 産科の患者は、脊髄幹麻酔下で帝王切開分娩中に呼吸困難を訴えることがよくあります。
- 最も一般的な理由は、腹部と胸部のセグメントが麻酔されているため「呼吸」を感じることができないことですが(ストレッチ受容体を含む)、開業医は繰り返し検査することで差し迫った「高脊髄」麻酔薬を除外する必要があります。
- 次の操作は、可能性を排除するのに役立ちます-高脊髄幹麻酔の可能性:
–患者が電話をかける能力
–開業医の手を握る患者の能力(ブロックレベルが腕神経叢のレベル(C6–T1)を下回っていることを示します)
局所麻酔薬の全身毒性
硬膜外注射を繰り返した後の意図しない血管内注射または薬物の蓄積は、局所麻酔薬の高い血清レベルをもたらす可能性があります。 血管の多い注射部位からの局所麻酔薬の急速な吸収は、頸部傍および陰部の閉塞後にも発生する可能性があります。 主要な神経ブロックが行われる場合は、蘇生装置を常に利用できるようにする必要があります。 IVアクセス、気道器具、救急薬、および吸引装置はすぐにアクセスできる必要があります。 局所麻酔薬の全身毒性を回避するには、推奨用量を厳守し、意図しない血管内注射を回避することが不可欠です。
これらの予防策にもかかわらず、生命を脅かすけいれん、そしてまれに心血管虚脱が発生する可能性があります。 発作活動は、IVチオペンタール25〜50 mgまたはジアゼパム5〜10mgで治療されています。 現在の臨床診療では、プロポフォール20〜50 mgまたはミダゾラム2〜4 mgがより一般的に使用されています。気道を評価し、酸素化を維持する必要があります。 心血管虚脱が発生した場合は、二次心肺蘇生法(ACLS)アルゴリズムに従う必要があります。 2006年の症例報告では、脂質エマルジョンを使用して、ブピバカインの毒性に起因する難治性心停止を治療しました。 作用機序は不明ですが、脂質に対するブピバカインの親和性が高いこと、または脂質がブピバカインに毒されたミトコンドリアエネルギーシステムの基質を提供するために生じる可能性があります。 この治療の有効性を判断するには、さらなる研究が必要です。 しかし、ブピバカインに酔った妊婦の治療には、蘇生の早い段階で脂質エマルジョンの投与を含めるべきであることが賢明であるように思われます。 脂質レスキューの現在推奨されているプロトコル(http://www.lipidrescue.orgを参照)には、20%脂質エマルジョンが含まれます。1.5mL/ kgの初期ボーラス、続いて0.25 mL / kg / minで30〜60分間です。 ブピバカインを血管内に注射した場合、脂質の早期投与は心停止への進行を防ぐことも示されています。
母体の心停止があるときはいつでも、原因に関係なく、蘇生の試みが大動静脈圧迫を緩和し、心臓マッサージの効率を確保することに失敗した場合、胎児は早期に、通常5分以内に出産されるべきです。
硬膜穿刺後の頭痛
妊娠中の女性は、不注意による硬膜穿刺が発生した場合に、硬膜穿刺後頭痛(PDPH)を発症するリスクが高くなります。 最近のメタアナリシスでは、硬膜外針による偶発的な硬膜穿刺後のPDPHのリスクは52.1%(95%信頼区間[CI]、51.4〜52.8%)でした。 硬膜外圧が低下すると、硬膜開口部から脳脊髄液が漏れるリスクが高まります。 ラッセル等。 偶発的な硬膜穿刺後の髄腔内カテーテルの留置は、硬膜外麻酔を繰り返す場合と比較して、頭痛の発生率または血液パッチの必要性を低下させなかったと報告しました。 頭痛の発生率は、16ゲージの硬膜外針と比較して18ゲージを使用した方が高かった。 硬膜穿刺後の頭痛の病態生理学と管理については、 硬膜穿刺後の頭痛.
神経学的合併症
まれではあるが、中央脊髄幹麻酔の神経学的後遺症が報告されている。 脊髄神経根に針またはカテーテルによって加えられる圧力は、即時の痛みを引き起こし、再配置を必要とします。 硬膜外膿瘍や髄膜炎などの感染症は非常にまれであり、全身性敗血症の症状である可能性があります。 近年、産科患者の硬膜外カテーテル挿入後に硬膜外膿瘍のいくつかの症例が報告されています。
これらの症例から特定された潜在的な危険因子は、通常の原因菌(黄色ブドウ球菌など)からの侵入点感染、全身感染源の可能性、無菌操作の不備、およびカテーテル留置の長期化です。 硬膜外血腫も発生する可能性があり、通常は凝固障害に関連しています。 ただし、硬膜外血腫は、器具とは関係なく、自然に発生することもあります。 病因は、硬膜外血管構造の弱体化が原因である可能性があります。 神経根の炎症は、数週間または数ヶ月続く長期の回復をもたらす可能性があります。 器具、砕石位、または胎児の頭による圧迫の結果としての末梢神経損傷は、脊髄幹麻酔がなくても発生する可能性があります。
複雑な妊娠中の局所麻酔
妊娠と出産は、母親または胎児、あるいはその両方の幸福に不利な状態を伴う場合、リスクが高いと見なされます。 母体の問題は妊娠に関連している可能性があります。 つまり、子癇前症-子癇前症、妊娠高血圧症、または前置胎盤早期剥離または胎盤早期剥離に起因する分娩前出血。 糖尿病; 心臓、慢性腎臓、および神経学的問題; かま状赤血球症; 喘息; 肥満; 薬物乱用は妊娠とは関係ありませんが、妊娠の影響を受けることがよくあります。 未熟児(妊娠37週未満)、未熟児(妊娠42週以上)、子宮内胎児発育遅延、および多胎妊娠は、リスクに関連する胎児の状態です。 分娩中、胎児の奇形(例、ブリーチ、横臥位)、胎盤早期剥離、臍帯の圧迫(例、脱出、頸髄)、急な分娩、または子宮内感染(例、膜の長期破裂)は、母親または胎児へのリスク。 一般に、高リスクの出産者の麻酔管理は、健康な母親と胎児の管理と同じ母体と胎児の考慮事項に基づいています。 ただし、これらの機能の多くは麻酔導入前に損なわれる可能性があるため、エラーの余地は少なくなります。
子癇前症-子癇前症病理生理学および徴候と症状
高血圧性疾患は、すべての妊娠の約7%で発生し、妊産婦死亡の主な原因です。 子癇前症の最新の診断基準は、「タンパク性血圧上昇」と呼ばれています。 浮腫の有無は、もはや必要な基準の15つとは見なされません。 特定の血圧上昇ではなく、ベースラインを常にXNUMX%上回る血圧が診断と見なされるようになりました。 けいれんの追加の外観は子癇の診断です。 子癇前症-子癇前症は、主に若い未経産の女性に発生する、人間に特有の病気です。 症状は通常、妊娠XNUMX週後に現れますが、胞状奇胎の場合はそれよりも早く現れることもあります。 乳児と胎盤の出産が唯一の効果的な治療法です。 その結果、子癇前症は、先進国における医原性早産の主な原因です。
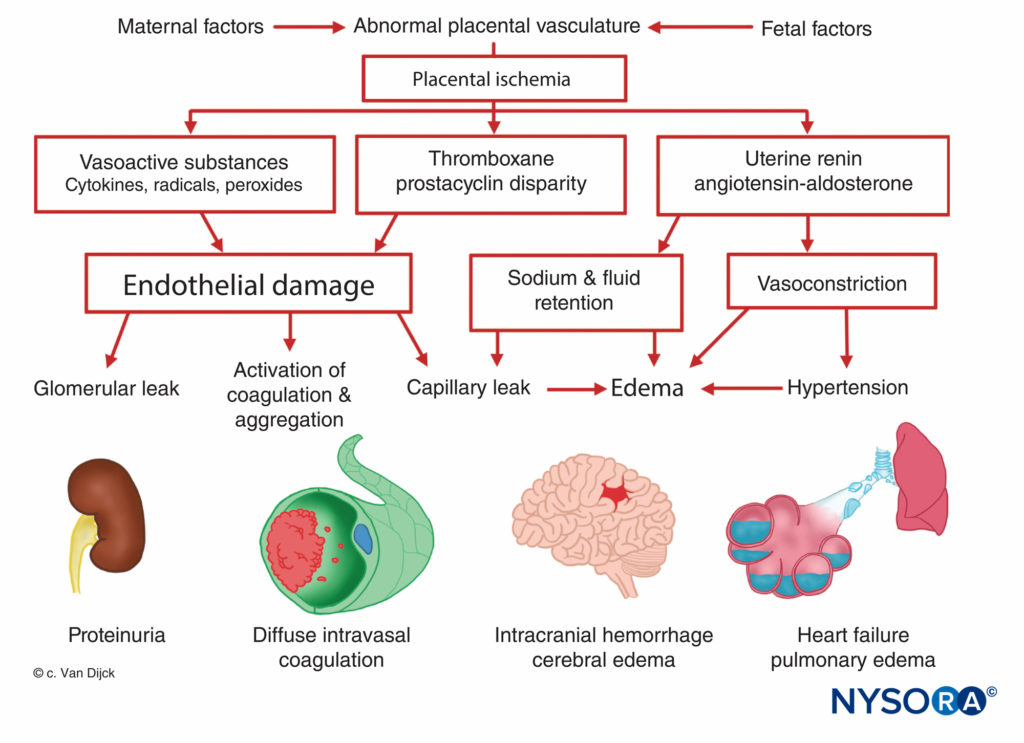
子癇前症-子癇前症の原因は不明ですが、すべての患者が胎盤虚血を示します。 胎盤の灌流の低下は、子癇前症になる運命にある女性の妊娠初期に起こり、正常な栄養膜浸潤の失敗があります。 通常の妊娠では、らせん状動脈の直径は約XNUMX倍に増加し、絨毛間腔への低抵抗経路を提供するたるんだ管を作成します。 この血管新生は、らせん状動脈の脱落膜および子宮筋層への栄養膜浸潤の結果です。 しかし、子癇前症の女性では、子宮筋層は侵略されていません。 これにより、表在性胎盤着床が引き起こされ、硬くて筋肉質のらせん状動脈に関連する胎盤灌流および虚血が減少します。 胎盤虚血は、子宮レニンの放出、アンギオテンシン活性の増加、および高血圧、組織低酸素症、および内皮損傷を引き起こす広範な細動脈血管収縮をもたらす(図7)。 内皮損傷部位での血小板の固定は、凝固障害を引き起こし、時には播種性血管内凝固症候群を引き起こします。 アンギオテンを介したアルドステロン分泌の増強は、ナトリウムの再吸収と浮腫の増加につながります。 子癇前症の徴候であるタンパク尿はまた、胎盤虚血に起因し、これは、局所組織変性およびトロンボプラスチンの放出をもたらし、その後、狭窄した糸球体血管にフィブリンが沈着する。 その結果、アルブミンやその他の血漿タンパク質に対する透過性が高まります。 さらに、栄養膜に分泌される強力な血管拡張剤であるプロスタグランジンEの産生が減少します。これは通常、レニン-アンジオテンシン系の高血圧作用のバランスを取ります。
子癇前症に関連する症状の多くは、胎盤虚血、全身性血管収縮、血小板凝集の増加など、プロスタサイクリンとトロンボキサンの胎盤産生の不均衡に起因する可能性があります。 通常の妊娠中、胎盤はXNUMXつを同量生成しますが、子癇前症の妊娠では、プロスタサイクリンのXNUMX倍のトロンボキサンが存在します。
最新の理論によると、内皮細胞損傷は子癇前症の発症の中心です。 この損傷は、胎盤灌流の低下の結果として発生し、内皮細胞損傷を引き起こす物質(おそらく脂質ペルオキシダーゼ)の生成と放出につながります。 異常な内皮細胞機能は、フィブロネクチン、エンドセリン、およびその他の物質の放出を通じて、子癇前症で認められる末梢抵抗およびその他の異常の増加に寄与します。
げっ歯類モデルでは、1つの胎盤抗血管新生タンパク質が同定されており、子癇前症の病因に関与している可能性があります。 可溶性fms様チロシンキナーゼ-1(sFlt-1)は、子癇前症の女性の胎盤でアップレギュレーションされます。 上昇したsFlt-1タンパク質レベルは、血管内皮増殖因子(VEGF)および胎盤増殖因子(PlGF)に拮抗し、減少します。 Levineetal。 sFlt-XNUMXレベルの増加とPlGFレベルの減少が子癇前症のその後の発症を予測することを示した。 別の抗血管新生タンパク質である可溶性エンドグリン(sEng)は、HELLP症候群(溶血、肝酵素の上昇、血小板数の減少からなる)の場合に上昇します。
NYSORAのヒント
子癇前症は、以下のいずれかに関連している場合、重症として分類されます。
- 収縮期血圧は一貫してベースラインを15%以上上回っています
- 拡張期血圧は一貫してベースラインを15%以上上回っています
- 5g/24時間のタンパク尿
- 400mL/24時間の乏尿
- 脳視覚障害
- 肺水腫またはチアノーゼ
- 上腹部痛
- 子宮内胎児発育遅延
重度の子癇前症-子癇前症では、広範な血管痙攣のためにすべての主要な臓器系が影響を受けます。 全体的な脳血流は減少しませんが、限局性低灌流を除外することはできません。 死後検査により、血栓化した前毛細血管の近くに出血性壊死が明らかになり、激しい血管収縮が示唆された。 浮腫および変性の小さな病巣は、低酸素症に起因している。 点状出血は、けいれんの発症後によく見られます。 上記の変化に関連する症状には、頭痛、めまい、皮質盲、反射亢進、およびけいれんが含まれます。 脳出血と浮腫は子癇前症-子癇前症の主な死因であり、これらを合わせると死亡の約50%を占めます。 心不全は、末梢血管収縮および血液濃縮による血液粘度の上昇の結果として、重症の場合に発生する可能性があります。 肝臓への血液供給の減少は、さまざまな程度と重症度の門脈周囲壊死につながる可能性があります。 被膜下出血は、重症例で遭遇する上腹部痛の原因となります。腎臓では、糸球体内皮細胞の腫れとフィブリンの沈着があり、毛細血管腔の収縮を引き起こします。 腎血流量と糸球体濾過率が低下し、尿酸クリアランスが低下し、重症の場合はクレアチニンが上昇します。
子癇前症は、水分とナトリウムの過剰な保持を伴いますが、血管内から血管外コンパートメントへの体液とタンパク質の移動は、循環血液量減少、低タンパク血症、および血中濃度をもたらす可能性があり、タンパク尿によってさらに悪化する可能性があります。 子宮胎盤低灌流および胎児転帰不良のリスクは、母体の血漿およびタンパク質の枯渇の程度と相関しています。
内皮損傷部位での血小板の付着は、子癇前症の患者の約20%で発症する消費凝固障害を引き起こす可能性があります。 血小板数が100,000〜150,000 / mmの軽度の血小板減少症が、最も一般的な所見です。 プロトロンビンおよび部分トロンボプラスチン時間の延長は、凝固促進剤の消費を示しています。 血小板数が正常な患者の約25%で延長される出血時間は、もはや凝固の信頼できる検査とは見なされていません。 HELLP症候群は、溶血、肝酵素の上昇、血小板の減少を特徴とする重度の子癇前症の特定の形態です。
前子癇-子癇-子癇の患者の管理の目標は、けいれんを予防または制御し、臓器灌流を改善し、血圧を正常化し、凝固異常を矯正することです。 米国における抗けいれん療法の主力は硫酸マグネシウムです。 発作の予防におけるその有効性は十分に立証されていますが、その作用機序については議論の余地があります。 患者は通常、4%溶液に20 gの負荷量を投与し、5分間かけて投与した後、1〜2 g/hの持続注入を行います。
子癇前症の降圧療法は、組織灌流を維持または改善しながら、母親の脳出血のリスクを軽減するために使用されます。 降圧療法が疾患の進行を遅らせたり、周産期の転帰を改善したりすることを示唆する証拠はありません。 血管拡張と組み合わせた血漿量の拡大は、これらの目標を達成します。 ヒドララジンは、子宮胎盤および腎臓の血流を増加させるため、最も一般的に使用される血管拡張剤です。 ただし、副作用には、頻脈、動悸、頭痛、および新生児血小板減少症が含まれます。 ニトロプルシドは、喉頭鏡検査および挿管中に、危険な血圧上昇を防ぐために使用されます。 神経節遮断薬であるトリメタファンは、脳浮腫や頭蓋内圧の上昇が懸念される高血圧緊急症に有用です。これは、脳に血管拡張を引き起こさないためです。 母体の血圧を制御するために使用されてきた他の薬剤には、α-メチルドパ、ニトログリセリン、そして今ではより頻繁にラベタロールが含まれます。
消費凝固障害には、新鮮な全血、血小板濃縮物、新鮮凍結血漿、およびクリオプレシピテートの注入が必要になる場合があります。 出産は、難治性の場合、または妊娠が満期に近い場合に示されます。 重症の場合、積極的な管理は、出産後少なくとも24〜48時間継続する必要があります。
麻酔管理
分娩および分娩における硬膜外麻酔の禁忌はほとんどありません。 重度の凝固異常または重度の血漿量不足が存在する場合、リスクとベネフィットの比率は他の形態の麻酔に有利に働きます。 左子宮変位で位置付けられた容量が枯渇した患者では、硬膜外麻酔は許容できない血圧の低下を引き起こさず、胎盤灌流の有意な改善につながります。 放射性キセノンを使用すると、硬膜外鎮痛(75 mLブピバカイン10%)の導入後、絨毛間血流が約0.25%増加することが示されました。 子癇前症では、アミド局所麻酔薬の母体全体のクリアランスが延長され、これらの薬剤を繰り返し投与すると、正常血圧の患者よりも血中濃度が高くなる可能性があります。
帝王切開分娩の場合、局所麻酔の感覚レベルはT3–4まで拡張する必要があり、適切な輸液療法と左子宮置換がさらに重要になります。
硬膜外麻酔は、子癇前症の女性の脊髄くも膜下麻酔よりも、作用の開始が遅く、制御性があるために好まれてきました。 過去には、脊髄くも膜下麻酔に関連する交感神経切除術の急速な発症は、特に容量が減少した患者において、低血圧と関連していた。 ただし、最近のXNUMXつの研究では、帝王切開分娩のために硬膜外麻酔または脊髄くも膜下麻酔を受けた子癇前症の女性で、低血圧、周術期液およびエフェドリン投与の発生率、および新生児の状態が類似していることがわかりました。 綾他有意な脊髄くも膜下麻酔によって誘発される低血圧のリスクが正常血圧の妊婦と比較して子癇前症の女性で有意に低いことを示した前向きコホート研究を実施しました。 子癇前症では昇圧剤に対する感受性が高まります。 したがって、低血圧を矯正するには、通常、低用量のエフェドリンとフェニレフリンが必要です。
分娩前出血
分娩前出血は、前置胎盤(子宮下部への異常な胎盤着床および子宮頸部内口の部分的または完全な閉塞)および胎盤早期剥離に関連して最も一般的に発生します。 前置胎盤はすべての妊娠の0.11%で発生し、その結果、母体の発生率は最大0.9%、周産期死亡率の発生率は17〜26%になります。 これは、横臀部や臀部などの異常な胎児の症状に関連している可能性があります。 前置胎盤は、患者が痛みのない真っ赤な膣からの出血を示すときはいつでも、通常は妊娠2か月後に疑われるべきです。 診断は超音波検査によって確認されます。 胎盤の最下部が子宮頸部の内部口からXNUMXcm以上離れていない限り、通常は腹部分娩が必要です。 出血が多くなく、胎児が未熟である場合、産科管理は妊娠を延長するために保守的です。 重症の場合、または症状の発症時に胎児が成熟している場合は、通常は帝王切開で迅速な分娩が示されます。 子宮のアトニーのために、胎盤の分娩後であっても、重度の出血のために緊急子宮摘出術が必要になる場合があります。 以前に子宮手術、特に以前に帝王切開を受けた患者では、癒着胎盤(胎盤絨毛による子宮筋層の貫通)の発生率が高いため、重度の出血のリスクはさらに高くなります。
胎盤早期剥離は、妊娠中の女性の0.2〜2.4%で発生し、通常は妊娠の最後の10週間で、高血圧性疾患に関連して発生します。 合併症には、クーベレール子宮(子宮筋層の間で血管外漏出血液が解剖されるときに発生する)、腎不全、播種性血管内凝固症候群、および下垂体前葉壊死(すなわち、シーハン症候群)が含まれます。 妊産婦死亡率は高く(1.8〜11.0%)、周産期死亡率はさらに高くなっています(50%を超える)。 胎盤早期剥離の診断は、子宮の圧痛、緊張亢進、および暗く凝固した血液の膣からの出血の存在に基づいています。 胎盤の縁が子宮壁に付着したままの場合、出血が隠される可能性があります。 失血がひどい場合は、血液量減少を示す母体の血圧と脈拍数の変化が起こる可能性があります。 胎児の動きは、急性低酸素症の間に増加し、低酸素症が段階的である場合は減少する可能性があります。 胎児の徐脈と死が続く可能性があります。
麻酔管理
通常、侵襲的モニタリング(動脈ライン、中心静脈カテーテル)の確立と、14ゲージまたは16ゲージのカテーテルによる血液量の交換が必要です。 凝固異常が存在する場合は、血液成分と新鮮凍結血漿、クリオプレシピテート、および血小板濃縮物が必要になる場合があります。 胎盤早期剥離のある女性のための麻酔薬の選択は、母体と胎児の状態、および手順をどれだけ緊急に実行する必要があるかによって異なります。 全身麻酔は、制御不能な出血と凝固異常の存在下で示されます。
硬膜外麻酔は、特に分娩中に破裂時に機能している硬膜外麻酔があり、血行力学的不安定性がない場合に使用できます。 ヴィンセント等。 硬膜外麻酔は、妊娠中の雌羊の未治療の出血中に、母体の低血圧、子宮の血流、胎児のPaO2とpHを著しく悪化させることを観察しました。 しかし、これは矯正されていない低血圧であり、血管内補液の血行動態により、硬膜外麻酔でも正常に戻りました。
早産
早産は、母親と乳児の両方が危険にさらされる可能性があるため、麻酔科医にとって重大な課題となります。 未熟児の定義は、妊娠2週より前に生まれた早産児と、満期で生まれる可能性があるが体重が8標準偏差を超える低出生体重児とを区別するために変更されました。平均。 早産は全出生の10〜80%で発生しますが、新生児早期死亡の約24%を占めています。 呼吸窮迫症候群、頭蓋内出血、低血糖症、低カルシウム血症、高ビリルビン血症などの重篤な合併症は、早産児に発症する傾向があります。 糖質コルチコイドを母親に投与して胎児の肺の成熟度を高める場合は、出産を48〜2時間遅らせることも有益です。 エタノール、硫酸マグネシウム、プロスタグランジン阻害剤、β交感神経刺激薬、カルシウムチャネル遮断薬など、さまざまな薬剤が子宮活動(子宮収縮抑制)を抑制するために使用されてきました。 リトドリンやテルブタリンなどのβアドレナリン作動薬は、最も一般的に使用される子宮収縮抑制薬です。 それらの主な効果はβXNUMX受容体刺激であり、これは子宮筋層の抑制、血管拡張、および気管支拡張をもたらします。 これらの子宮収縮抑制剤の結果として、低血圧、低カリウム血症、高血糖、心筋虚血、肺水腫、および死亡を含む多数の母体の合併症が報告されています。
麻酔管理
麻酔薬や技術との相互作用が原因で合併症が発生する可能性があります。 局所麻酔を使用すると、βアドレナリン作動性刺激によって引き起こされる末梢血管拡張は、既存の頻脈、低血圧、および低カリウム血症の存在下での血行力学的不安定性のリスクを高めます。 未熟児は、産科の鎮痛および麻酔で使用される薬の効果に対して、新生児という用語よりも脆弱であることが知られています。 ただし、妊娠中の母体および胎児の薬物動態と薬物動態を決定するための体系的な研究はほとんどありません。
早産児の薬剤感受性が高まる原因はいくつか考えられます。薬剤結合に利用できるタンパク質が少ない。 高レベルのビリルビン。これは、タンパク質結合について薬物と競合する可能性があります。 血液脳関門の発達が不十分なため、中枢神経系への薬物アクセスが増加します。 より多くの全身水分とより低い脂肪含有量; 薬物を代謝および排泄する能力の低下。 ただし、麻酔で使用されるほとんどの薬は、胎児の血清で低から中程度の結合度を示します:ブピバカインで約50%、リドカインで25%、メペリジンで52%、チオペンタールで75%早産児の場合、新生児への薬物の影響に関する懸念は、麻酔や胎児への外傷を防ぐことほど重要ではありません。 経膣分娩の場合、良好な会陰弛緩を提供するには、十分に実施された硬膜外麻酔が有利です。 硬膜外ブロックを導入する前に、麻酔科医は胎児が低酸素でも酸性でもないことを確認する必要があります。 窒息は胎児の心拍出量の再分布をもたらし、脳、心臓、副腎などの重要な臓器への酸素供給を増加させます。 とにかく、早産児のこれらの変化は、リドカインよりもブピバカインまたはクロロプロカインの方がよく保存される可能性があります。 骨盤位の早産児は通常、帝王切開で出産します。 局所麻酔は成功裏に使用でき、必要に応じてニトログリセリンを子宮の弛緩に利用できます。
NYSORAのヒント
- 早産児を出産する場合、新生児への薬物の影響に関する懸念は、窒息や胎児への外傷を防ぐことよりもはるかに重要ではありません。
- 硬膜外ブロックを誘発する前に、胎児が低酸素でも酸性でもないことを確認する必要があります。
分娩中および経膣分娩中の局所鎮痛は、母親の昏睡および胎児の鬱病を防ぎ、酸素消費量の増加など、分娩の潜在的な生理的悪影響の多くを軽減するため、選択された高リスク患者の疼痛緩和の好ましい技術になりました。と血行動態の変化。 帝王切開分娩の場合、局所麻酔は、リスクの高い分娩者において安全で効果的な技術として浮上してきました。これは、術後鎮痛を延長する能力が追加されたことも一因です。
妊娠中の女性におけるNONOBSTETRIC手術
妊娠中の女性の約1.6〜2.2%は、分娩とは関係のない理由で手術を受けます。 外傷とは別に、最も一般的な緊急事態は、腹部、頭蓋内圧亢進症、心臓弁膜症、および褐色細胞腫です。
手術の必要性が生じた場合、麻酔の考慮事項は、妊娠の進行に伴う母体の生理学的状態の変化、麻酔薬の催奇形性、子宮胎盤血流に対する麻酔の間接的影響、および流産または早産の可能性に関連しています。 母と子に最も好ましい結果を提供するには、リスクのバランスをとる必要があります。 XNUMXつの主要な研究が、異常、早産、または子宮内死によって決定される胎児の転帰に、人間の妊娠中の手術と麻酔を関連付けることを試みました。 これらの研究は、手術と麻酔薬の曝露を先天性異常と相関させることができませんでしたが、すべての研究は、特に最初の学期に行われた手術後の胎児死亡の発生率の増加を示しました。 特定の麻酔薬や技術は関係していませんでした。 手術を必要とした状態が最も関連性の高い要因であり、骨盤手術または産科の適応症のために行われた手技の後に胎児の死亡率が最大でした。 つまり、頸管無力症です。
麻酔薬の細胞毒性は生分解と密接に関連しており、生分解は酸素化と肝血流の影響を受けます。 したがって、麻酔に関連する合併症(母体の低酸素症、低血圧、昇圧剤投与、高炭酸ガス血症、低炭酸ガス血症、および電解質障害)は、薬剤自体の使用よりも催奇形性の大きな要因である可能性があります。
実験室のデータを人間の臨床状況に外挿することは困難であるという理解の下で、特定の薬物および薬剤への曝露に関する実験的証拠について簡単に説明します。 非常に多くの患者は、その安全性を確認する前に、疑わしいテラトゲンにさらされなければなりません。 複雑な要因には、多数の薬物への母親の曝露の頻度が含まれます。 基礎疾患のプロセスと外科的治療の効果を、投与された薬剤の効果から分離することの難しさ。 妊娠段階によるリスクの程度の違い; そして、一貫性ではなく、XNUMXつのエージェントに関連して現れる異常の多様性。 局所麻酔薬に関しては、局所麻酔薬が動物や人間に催奇形性を示すことは示されていません。
ジアゼパムと口腔裂の特定の関係を説明しているいくつかの報告があるため、ブロックを配置する前に鎮静剤に注意が払われています。 しかし、他の研究者はこれを確認していません。 妊娠初期にジアゼパムを摂取した854人の女性を対象とした前向き研究では、口蓋裂または口唇裂のリスクが高いことは示されていませんでした。 現在、ジアゼパムは証明された催奇形物質ではありません。
最近、胎児期に麻酔薬にさらされた子供たちの神経認知への悪影響に関する懸念があります。 確かに、子宮内全身麻酔にさらされた新生児ラットは、対照群よりも神経適応障害の程度が大きかった。 同様に、帝王切開分娩のための全身麻酔下で生まれた乳児も、局所麻酔と比較して軽度の認知障害を示すことがわかっています。 この研究の難しさは、それが本質的に遡及的であり、患者選択バイアスの可能性が存在したことです。 たとえば、全身麻酔の使用は、麻酔よりも神経認知に影響を与えると思われる、胎児の状態を回復させない、または胎盤早期剥離などの緊急事態のために予約されています。 最も気になるのは、経膣分娩で生まれた乳児が、全身麻酔で帝王切開で生まれた子供と同様のプロファイルを持っていたことです。 それにもかかわらず、以前に議論された母体および胎児の考慮事項のために、妊娠中の局所技術よりも全身麻酔を避けることが賢明であるように思われる。 医学的意思決定を導くためのデータはほとんどありませんが、局所麻酔の使用を容易にするために、外科的手法の種類を変更すること(たとえば、腹腔鏡から虫垂切除術への変換)を楽しむ必要があります。 母体の痛みと不安は子宮血流の減少と胎児の悪化をもたらす可能性があるため(エピネフリンまたはノルエピネフリンの注入と同様)、局所的な技術(すなわち、末梢神経ブロックまたは硬膜外注入)による術後の痛みを和らげるための早期介入を検討する必要があります。
NYSORAのヒント
局所麻酔薬は、動物や人間に催奇形性があることは示されていません。
概要
妊娠は、妊娠中の患者の安全で効果的な管理のために麻酔と鎮痛技術の調整を必要とする多くの重要な生理学的変化をもたらします。 可能であれば、乳児の出産後まで手術を遅らせることが賢明です。 緊急手術のみを最初の学期に検討する必要があります。分娩および経膣分娩中の痛みの緩和には、地域の技術が最も受け入れられています。 同様に、現在、帝王切開分娩用の麻酔薬を投与するために最も頻繁に使用される技術は、脊髄幹麻酔です。 局所麻酔の進歩とその日常的な使用により、全身麻酔と比較して母体の安全性が大幅に向上しました。
参考文献
- Melzack R、Taenzer P、Feldman P、Kinch RA:準備された出産トレーニングの後、労働は依然として苦痛です。 Can Med Assoc J 1981; 125:357。
- Goodman RP、Killom AP、Brash AR、Branch RA:妊娠中のプロスタサイクリン産生:正常妊娠中と高血圧を合併した妊娠中の産生の比較。 Am J Obstet Gynecol 1982; 142:817。
- Kerr MG、Scott DB、Samuel E:妊娠後期における下大静脈の研究。 BMJ 1964; 1:532。
- ハワードBK、グッドソンJH、メンガートWE:妊娠後期の仰臥位降圧症候群。 Obstet Gynecol 1953; 1:371。
- Kuo CD、Chen GY、Yang MJ、Tsai YS:妊娠後期の自律神経活動に対する姿勢の影響。 麻酔1997;52:1161–1165。
- Kundra P、Velraj J、Amirthalingam U、et al:満期産婦人科の母体の血流速度と波形に対する、仰臥位と左側臥位から左側臥位へのポジショニングの影響。 麻酔2012;67:889–893。
- Carruth JE、Mivis SB、Brogan DR、Wenger NK:正常な妊娠中の心電図。 Am Heart J 1981; 102:1075-1078。
- Seth R、Moss AJ、McNitt S、et al:QT延長症候群と妊娠。 J Am Coll Cardiol 2007; 49:1092-1098。
- Prowse CM、Gaensler EA:妊娠中の呼吸および酸塩基の変化。 麻酔学1965;26:381。
- Moya F、Smith BE:薬物および麻酔薬の摂取、分布、および胎盤輸送。 麻酔学1965;26:465。
- Archer GW、Marx GF:出産した女性の無呼吸時の動脈酸素化。 Br J Anaesth 1974; 46:358。
- Whitehead EM、Smith M、Dean Y、O'Sullivan G:妊娠中および産褥期の胃内容排出時間の評価。 麻酔1993;48:53–57。
- La Salvia LA、Steffen EA:陣痛における胃の排出時間の遅延。 Am J Obstet Gynecol 1950; 59:1075–1081。
- Wong CA、Loffredi M、Ganchiff JN、et al:妊娠期間中の胃内容排出。 Anesthesiology 2002; 96:1395–1400。
- Davison JS、Davison MC、Hay DM:妊娠後期および陣痛における胃内容排出時間。 J Obstet Gynaecol Br Commonw 1970; 77:37–41。
- Brock-Utne JG、Dow TGB、Dimopoulos GE、et al:妊娠初期の胃および下部食道括約筋(LOS)圧。 Br J Anaesth 1981; 53:381。
- Wyner J、Cohen SE:妊娠初期の胃容量:メトクロプラミドの効果。 麻酔学1982;57:209。
- Cohen SE、Woods WA、Wyner J:ドロペリドールとメトクロプラミドの制吐効果。 麻酔学1984;60:67。
- Scheller MS、Sears KL:メトクロプラミドの術前投与に関連する術後神経機能障害。 Anesth Analg 1987; 66:274。
- Lund CJ、Donovan JC:妊娠中の血液量。 Am J Obstet Gynecol 1967; 98:393。
- プリチャードJ、マクドナルドP:妊娠への母親の適応。 ウィリアムズJW、プリチャードJ、マクドナルドP(編)、ウィリアムズ産科、第16版。 ニューヨーク:Appleton-Century-Crofts、1980年、p。 236。
- Gerbasi FR、Buttoms S、Farag A、Mammen E:妊娠に伴う血管内凝固の増加。 Obstet Gynecol 1990; 75:385–389。
- Wildsmith JAW:血清シュードコリンエステラーゼ、妊娠およびスキサメトニウム。 麻酔1972;27:90。
- Coryell MN、Beach EF、Robinson AR、et al:生殖周期中の女性の代謝:XVII。 サイクル中および送達後の血漿タンパク質の電気泳動パターンの変化。 J Clin Invest 1950; 29:1559。
- Datta S、Kitzmiller JL、Naulty JS、et al:帝王切開のための脊髄くも膜下麻酔後の糖尿病の母親とその乳児の酸塩基状態。 Anesth Analg 1982; 61:662。
- Datta S、Lambert DH、Gregus J、et al:妊娠中の哺乳類の神経線維の感受性の違い。 Anesth Analg 1983; 62:1070。
- Gin T、Chan MTV:妊娠中のヒトにおけるイソフルランの最小肺胞内濃度の低下。 麻酔学1994;81:829。
- ブラウンWU、ベルGC、アルパーMH:アシドーシス、局所麻酔薬、新生児。 Obstet Gynecol 1976; 48:27。
- Hamshaw-Thomas A、Rogerson N、Reynolds F:ウサギの胎盤を通過するブピバカイン、リグノカイン、およびペチジンの移動:母体のタンパク質結合と胎児の流れの影響。 胎盤1984;5:61。
- Kennedy RL、Miller RP、Bell JU、et al:子羊におけるブピバカインの摂取と分布。 麻酔学1986;65:247。
- Kuhnert PM、Kuhnert BR、Stitts JM、Gross TL:帝王切開の硬膜外麻酔後の母親、胎児、新生児のブピバカインの体内動態を研究するための選択されたイオンモニタリング技術の使用。 麻酔学1981;55:611。
- Kuhnert BR、Philipson EH、Pimental R、et al:脊髄くも膜下麻酔後の母親、胎児、および新生児におけるリドカインの傾向。 Anesth Analg 1986; 65:139。
- Morishima HO、Daniel SS、Finster M、et al:ヒト胎盤を通過する塩酸メピバカイン(カルボカイン)の伝達。 麻酔学1966;27:147。
- Kuhnert BR、Kuhnert PM、Prochaska AL、Gross TL:硬膜外麻酔後の産科患者とその新生児における2-クロロプロカインの血漿レベル。 麻酔学1980;53:21。
- Pihlajamaki K、Kanto J、Lindberg R、et al:ブピバカインの硬膜外投与:妊娠中および非妊娠中の女性における薬物動態および代謝。 Br J Anaesth 1990; 64:556。
- Morishima HO、Covino BG:窒息していないヒヒと窒息したヒヒの胎児におけるリドカインの毒性と分布。 麻酔学1981;54:182。
- Morishima HO、Finster M、Pedersen H、et al:胎児および新生児の子羊および成羊におけるリドカインの薬物動態。 麻酔学1979;50:431。
- Mihaly GW、Moore RG、Thomas J、et al:新生児におけるアニリド局所麻酔薬の薬物動態と代謝。 Eur J Clin Pharmacol 1978; 13:143。
- Finster M、Poppers PJ、Sinclair JC、et al:尾側麻酔中の局所麻酔薬による胎児の中毒。 Am J Obstet Gynecol 1965; 92:922。
- Morishima HO、Pedersen H、Finster M、et al:成羊、新生児および胎児の羊におけるリドカインの毒性。 麻酔学1981;55:57。
- ゲイルR、ファーガソンJE II、スティーブンソンD:新生児のビリルビン産生に対する塩酸ブピバカインによる硬膜外鎮痛の効果。 Obstet Gynecol 1987; 70:692。
- Brockhurst NJ、Littleford JA、Halpern SH:神経学的および適応能力スコア:産科麻酔研究におけるその使用の系統的レビュー。 麻酔学2000;92:237。
- Morishima HO、Yeh MN、James LS:急性母体ストレスによる子宮血流量の減少と胎児低酸素血症:妊娠中のヒヒでの実験的観察。 Am J Obstet Gynecol 1979; 134:270。
- Ueland K、Hansen JM:母体の心臓血管のダイナミクス:Ill。局所および尾側鎮痛下での分娩と分娩。 Am J Obstet Gynecol 1969; 103:8。
- Moir DD、Willocks J:継続的な硬膜外鎮痛下での不調和な子宮作用の管理。 BMJ 1967; 2:396。
- Miller FC、Petrie RH、Arce JJ、et al:分娩中の過呼吸。 Am J Obstet Gynecol 1974; 120:489。
- Beaule PE、Smith MI、Nguyen VN:人工股関節置換術後のメペリジン誘発性発作。 J関節形成術2005;19:516–519。
- Hagmeyer KO、Mauro LS、Mauro VF:患者管理の鎮痛ポンプに関連するメペリジン関連の発作。 Ann Pharmacother 1993; 27:29–32。
- Kaiko RF、Grabinski PY、Heidrick G、et al:癌患者におけるメペリジンの中枢神経系興奮性効果。 Ann Neurol 1983; 13:180–185。
- Kuhnert BR、Linn PL、Kennard MJ、Kuhnert PM:新生児の行動に対する低用量のメペリジンの影響。 Anesth Analg 1985; 64:335。
- Sosa CG、Balagueer E、Alonso JG、et al:分娩の第一段階における難産のメペリジン:ランダム化比較試験。 Am J Obstet Gynecol 2004; 191:1212–1218。
- Eisele JH、Wright R、Rogge P:帝王切開での新生児および母体のフェンタニルレベル。 Anesth Analg 1982; 61:179。
- シャノンKT、ラマナサンS:陣痛鎮痛のための全身薬。 Obstet Pain Manage 1995; 2:1–6。
- Morley-Foster PK、Reid DW、Vandeberghe H:分娩鎮痛のための患者管理鎮痛フェンタニルとアルフェンタニルの比較。 Can J Anaesth 2000; 47:113–119。
- Muir HA、Breen T、Campbell DC、et al:静脈内PCAフェンタニルは無痛分娩を提供するための効果的な方法ですか? 麻酔学1999; (補足):A28。
- Vercauteren M、Bettens K、Van Springel G、et al:髄腔内分娩鎮痛:硬膜外に使用されるのと同じ混合物を使用できますか? Int J Obstet Anesth 1997; 6:242–246。
- Breen TW、Giesinger Cm、Halpern SH:早期陣痛における鎮痛のための硬膜外リドカインおよびフェンタニルと髄腔内スフェンタニルの比較。 Int J Obstet Anesth 1999; 8:226–230。
- Kapila A、Glass PS、Jacobs JR、他:レミフェンタニルとアルフェンタニルの測定された状況依存の半減期。 麻酔学1995;83:968–975。
- Evron S、Glezerman M、Sadan O、et al:レミフェンタニル:陣痛のための新しい全身鎮痛薬。 Anesth Analg 2005; 100:233–238。
- Kan RE、Hughes SC、Rosen M、et al:静脈内レミフェンタニル:胎盤移行、母体および新生児への影響。 麻酔学1998;88:1467。
- Thurlow JA、Laxton CH、Dick A、et al:分娩時の痛みを和らげるための筋肉内メペリジンと比較した患者管理鎮痛によるレミフェンタニル。 Br J Anaesth 2002; 88:374–378。
- Volmanen P、Sarvela J、Akural EI、et al:早期陣痛の疼痛緩和のための静脈内レミフェンタニル対フェンタニルを伴う硬膜外レボブピバカイン:無作為化、対照、二重盲検試験。 Acta Anaesthesiol Scand 2008; 52:249–255。
- Volmanen P、Akural E、Raudaskoski T、et al:分娩鎮痛におけるレミフェンタニルと亜酸化窒素の比較。 Acta Anaesthesiol Scand 2005; 49:453–458。
- Maduska AL、Hajghassemali M:分娩中のブトルファノールとメペリジンの二重盲検比較:母体の痛みの緩和と新生児への影響。 Can Anaesth Soc J 1978; 25:398。
- Wilson CM、McClean E、Moore J、Dundee JW:分娩中の筋肉内ペチジンとナルブフィンの二重盲検比較。 麻酔1986;41:1207–1213。
- Hodgkinson R、Huff RW、Hayashi RH、Husain FJ:ブトルファノールとメペリジンの静脈内投与後の母体の鎮痛と新生児の神経行動の二重盲検比較。 J Int Med Res 1979; 7:224–230。
- Thorp JA、Hu DH、Albin RM、et al:分娩時の硬膜外鎮痛が未経産分娩に及ぼす影響:無作為化対照前向き試験。 Am J Obstet Gynecol 1993; 169:851。
- Sharma SK、Sidawi JE、Ramin SM、et al:帝王切開分娩:分娩中の硬膜外対患者管理メペリジン鎮痛のランダム化試験。 麻酔学1997;87:487。
- Halpern SH、Leighton BL、Ohlsson A、et al:分娩の進行における硬膜外対非経口オピオイド鎮痛の効果:メタアナリシス。 JAMA 1998; 280:2105。
- Ramin SM、Gambling DR、Lucas MJ、et al:分娩における硬膜外鎮痛と静脈内鎮痛のランダム化試験。 Obstet Gynecol 1995; 86:783。
- 栗DH、Vincent RD、McGrath JMら:硬膜外鎮痛の早期投与は、オキシトシンの静脈内投与を受けている未経産女性の産科転帰に影響を及ぼしますか? 麻酔学1994;80:1193。
- 栗DH、McGrath JM、Vincent RD、他:硬膜外鎮痛の早期投与は、自然分娩中の未産婦の産科転帰に影響を及ぼしますか? 麻酔学1994;80:1201。
- American College of Obstetrics and Gynecology:産科鉗子。 産科母体および胎児医学に関するAGOG委員会、委員会の意見、1989年。
- 栗DH、Laszewski LJ、Pollack RL他:分娩の第0.0625段階での0.0002%ブピバカイン-1990%フェンタニルの持続硬膜外注入。 麻酔学72;613:XNUMX。
- Birnbach DJ、Chestnut DH:産科診療における硬膜外試験の線量:それはその有用性よりも長生きしましたか? Anesth Analg 1999; 88:971。
- Norris MC、Ferrenbach D、Dalman H、et al:エピネフリンは分娩硬膜外鎮痛中の吸引の診断精度を改善しますか? Anesth Analg 1999; 88:1073。
- ギナールJP、マルロイMF、カーペンターRL、ノペスKD 試験用量:急性ベータアドレナリン作動性ブロックがある場合とない場合の最適なエピネフリン含有量。 麻酔学1990;73:386–392。
- Visconti C、Eisenach JC:分娩中の患者管理の硬膜外鎮痛。 Obstet Gynecol 1991; 77:348。
- Halpern S:分娩のための患者管理硬膜外鎮痛の最近の進歩。 Curr Opin Anaesthesiol 2005; 18:247–251。
- Minty RG、Kelly L、Minty A、Hammett DC:陣痛を制御するための単回投与の髄腔内鎮痛:硬膜外鎮痛の有用な代替法ですか? Can Fam Physician 2007; 53:437–442。
- Rigler ML、Drasner K、Krejcie TC、et al:継続的な脊髄くも膜下麻酔後の馬尾症候群。 Anesth Analg 1991; 72:275。
- Arkoosh VA、Palmer CM、Van Maren GA他:継続的な髄腔内分娩鎮痛:安全性と有効性。 麻酔学1998;(補足):A8。
- Simons SW、Cyna AM、Dennis AT、Hughes D:陣痛における脊髄くも膜下硬膜外鎮痛と硬膜外鎮痛の併用。 Cochrane Database Syst Rev 2007; 3:CD003401。
- Campbell DC、Camann WR、Datta S:分娩鎮痛のための髄腔内スフェンタニルへのブピバカインの追加。 Anesth Analg 1995; 81:305。
- Labbene I、Gharsallah H、Abderrahaman A、et al:分娩鎮痛のためにブピバカインとスフェンタニルに添加された15mcgの髄腔内クロニジンの効果。 チュニスメッド2011;89:853–859。
- Collis RE、Davies DWL、Aveling W:陣痛における脊髄くも膜下硬膜外鎮痛と標準硬膜外鎮痛の組み合わせのランダム化比較。 Lancet 1995; 345:1413。
- McLeod A、Fernando R、Page F、et al:コンピューター化された姿勢記録を使用した母体のバランスと歩行の評価。 麻酔学1999; (補足):A8。
- Wong CA、Scavone BM、Peaceman AM、他:早期分娩と後期分娩での脊髄幹麻酔による帝王切開のリスク。 N Engl J Med 2005; 352:655。
- Cohen SE、Cherry CM、Holbrook RH、et al:分娩鎮痛のための髄腔内スフェンタニル:感覚の変化、副作用、胎児の心拍数の変化。 Anesth Analg 1993; 77:1155。
- Clarke VT、Smiley RM、Finster M:分娩中の鎮痛のためのフェンタニルの髄腔内注射後の子宮活動亢進:胎児徐脈の原因? 麻酔学1994;81:1083。
- O'Gorman DA、Birnbach DJ、Kuczkowski KM、et al:分娩者における複合脊髄硬膜外鎮痛後の胎児徐脈の病因の評価における臍帯血流速度測定の使用。 麻酔学2000;(補足):A2。
- Riley ET、Vogel TM、EI-Sayed YY、et al:患者選択バイアスは、分娩のための脊髄くも膜下硬膜外鎮痛を組み合わせた後の胎児徐脈の発生率の増加に寄与します。 麻酔学1999;91:A1054。
- Nielson PE、Erickson R、Abouleish E、et al:分娩鎮痛のための髄腔内スフェンタニルまたは硬膜外ブピバカイン後の胎児心拍数の変化:発生率と臨床的意義。 Anesth Analg 1996; 83:742。
- Albright GA、Forester RM:硬膜外鎮痛とくも膜下スフェンタニルの併用は、緊急帝王切開の発生率を増加させますか? Reg Anesth 1997; 22:400。
- Norris MC、Grieco WM、Borkowski M、et al:陣痛鎮痛の合併症:硬膜外技術と脊髄くも膜下硬膜外技術の組み合わせ。 Anesth Analg 1995; 79:529。
- Leighton BL、Arkoosh VA、Huffnagle S、et al:事前の髄腔内スフェンタニルの有無による硬膜外ブピバカインの皮膚拡散。 Anesth Analg 1996; 83:526。
- Bucklin BA、Hawkins JL、Anderson JR、Ullrich FA:産科麻酔労働力調査:2005年の更新。 Anesthesiology 103; 645:653–XNUMX。
- Baxi LV、Petrie RH、James LS:頸部傍ブロック後のヒト胎児の酸素化。 Am J Obstet Gynecol 1979; 135:1109。
- Palomaki O、Huhtala H、Kirkinen P:分娩の第0.25段階における頸部傍ブロックに対する0.25%レボブピバカインと2005%ラセミブピバカインの安全性の比較研究。 Acta Obstet Gynecol Scand 84; 956:961–XNUMX。
- Leighton BL、Halpern SH、Wilson DB:腰部交感神経ブロックは、未産婦の初期および第1999段階の誘発分娩を加速します。 麻酔学90;1039:1046-XNUMX。
- Pace MC、Aurilio C、Bulletti C、et al:高度な陣痛におけるくも膜下鎮痛:高度な陣痛におけるくも膜下鎮痛と陰部ブロックの比較。 鎮痛の質と産科の結果。 Ann NY Acad Sci 2004; 1034:356–363。
- Aissaoui Y、Bruyere R、Mustapha H、et al:会陰切開後の疼痛緩和のための陰部神経ブロックのランダム化比較試験。 Anesth Analg 2008; 107:625–629。
- Berghella V、Baxter JK、Chauhan SP:帝王切開分娩のためのエビデンスに基づく手術。 Am J Obstet Gynecol 2005; 193:1607–1617。
- Hawkins JL、Gibbs CP、Orleans M、et al:1992年対1981年の産科麻酔労働力調査。麻酔学1994; 81:A1128。
- Shnider SM、Levinson G:帝王切開のための麻酔。 Shnider SM、Levinson G(eds):Anesthesia for Obstetrics、2nded。 ボルチモア:ウィリアムズ&ウィルキンス、1987年、p。 159。
- Dyer RA、Farina Z、Joubert IA、et al:選択的帝王切開のための脊髄くも膜下麻酔導入後の、晶質液の前負荷と急速な晶質液の投与。 Anaesth Intensive Care 2004; 32:35–35-7。
- Marx GF、Luykx WM、Cohen S:胎児機能不全の帝王切開後の胎児-新生児の状態。 Br J Anaesth 1984; 56:1009。
- Norris MC:身長、体重、および分娩期におけるくも膜下高圧ブピバカインの広がり。 Anesth Analg 1988; 67:555。
- Hartwell BL、Aglio LS、Hauch MA、et al:脊柱の長さと分娩期の高圧くも膜下ブピバカインの広がり。 Reg Anesth 1991; 16:17–19。
- Ogun CO、Kirgiz EN、Duman A、et al:帝王切開分娩のための髄腔内等圧ブピバカイン-モルヒネとロピバカイン-モルヒネの比較。 Br J Anaesth 2003; 90:659–664。
- Hunt GO、Naulty S、Bader AM、et al:帝王切開分娩のためのくも膜下フェンタニル-ブピバカインによる周術期鎮痛。 麻酔学1989;71:535。
- Palmer CM、Emerson S、Volgoropolous D、et al:髄腔内モルヒネの髄腔内モルヒネの用量反応関係。 Anesthesiology 1999; 90:437–444。
- 加藤R、島本H、照井Kら:帝王切開用髄腔内モルヒネ0.15mgに伴う呼吸抑制の遅延。 1915年のケースのレビュー。 J Anesth 2008; 22:112–116。
- Roelants F:産科における脊髄幹麻酔薬(ネオスチグミン、クロニジン)の使用。 Curr Opin Anaesthesiol 2006; 19:233–237。
- Ngan Kee WD、Khaw KS、Lee BB、他:分娩者の硬膜外試験用量としてのエピネフリンによるロピバカインの限界。 Anesth Analg 2001; 92:1529–1531。
- Leighton BL、Norris MC、Sosis M、et al:働く女性の血管内注射のマーカーとしてのエピネフリンの限界。 麻酔学1987;66:688。
- Gissen AJ、Datta S、Lambert D:クロロプロカイン論争:クロロプロカインは神経毒性ですか? Reg Anaesth 1984; 9:135。
- Hynson JM、Sessler DI、Glosten B:クロロプロカインによる硬膜外麻酔後のボランティアの腰痛。 Anesth Analg 1991; 72:253。
- Albright GA:エチドカインまたはブピバカインによる局所麻酔後の心停止。 麻酔学1979;51:285。
- Carvalho B、Riley E、Cohen SE、et al:選択的帝王切開分娩後の術後疼痛の管理における単回投与、徐放性硬膜外モルヒネ:多施設無作為化対照研究の結果。 Anesth Analg 2005; 100:1150–1158。
- Carvalho B、Roland LM、Chu FL、et al:帝王切開後の痛みに対する従来の硬膜外モルヒネと比較した単回投与の徐放性硬膜外モルヒネ(DepoDur)。 Anesth Analg 2007; 105:176–183。
- Ginsar Y、Riley ET、Anst MS:ヒトにおける硬膜外フェンタニルの作用部位:注入とボーラス投与の違い。 Anesth Analg 2003; 97:1428–1438。
- Marik PE:誤嚥性肺炎および誤嚥性肺炎。 N Engl J Med 2001; 344:665–671。
- Brizgys RV、Dailey PA、Shnider SM、et al:帝王切開の硬膜外麻酔中の母体低血圧の発生率と新生児への影響。 麻酔学1987;67:782。
- 上山秀樹、He YL、谷上秀樹ほか:選択的帝王切開のために脊髄くも膜下麻酔を受けている分娩者における晶質およびコロイドの前負荷または血液量の影響。 麻酔学1999;91:1571。
- Rout CC、Roche DA:帝王切開に関連する脊髄低血圧:プリロードは機能しますか? 麻酔学1999;91:1565。
- Ngan Kee WD、Kaw KS、Ng FF:帝王切開分娩のための脊髄くも膜下麻酔中の低血圧の予防:フェニレフリン注入と晶質共水和の組み合わせを使用した効果的な技術。 Anesthesiology 2005; 103:744–750。
- ラマナサンS、グラントGJ:硬膜外麻酔による低血圧の昇圧剤療法。 Acta Anaesthesiol Scand 1988; 32:559。
- Rosenblatt MA、Abel M、Fischer GW、et al:ブピバカイン関連の心停止と推定された後の患者の蘇生のための20%脂質エマルジョンの使用の成功。 Anesthesiology 2006; 105:217–218。
- Kasten GW、Martin ST:部分的な下大静脈閉塞中のブピバカイン誘発性心血管毒性からの蘇生。 Anesth Analg 1986; 65:341。
- Choi PT、Galinski SE、Takeuchi L、et al:PDPHは、産科研究のメタアナリシスである、分娩者における脊髄幹麻酔の一般的な合併症です。 Can J Anaesth 2003; 50:460–469。
- ラッセルIF:分娩中の偶発的な硬膜穿刺後の継続的な脊髄くも膜下鎮痛と反復硬膜外鎮痛の前向き対照研究。 Int J Obstet Anesth 2012; 21:7–16。
- Maynard SE、Min JY、Merchan J、et al:過剰な胎盤可溶性fms様チロシンキナーゼ1(sFlt1)は、子癇前症における内皮機能障害、高血圧、およびタンパク尿の一因となる可能性があります。 J Clin Invest 2003; 111:649–658。
- 多田S、安江A、西沢H、関谷T、廣田Y、宇田川Y:妊娠中の自発性脊髄硬膜外血腫:2011症例報告。 J Obstet Gynaecol Res 37; 1734:1738–XNUMX。
- Bodurka D:婦人科と産科の新機能。 J Am Coll Surg 2005; 201:265–274。
- Basso O、Rasmussen S、Weinberg CR、et al:子癇前症後の胎児および乳児の生存率の傾向。 JAMA 2006; 296:1357–1362。
- Luttun A、Carmeliet P:可溶性VEGF受容体Flt1:とらえどころのない子癇前症因子が発見されましたか? J Clin Invest 2003; 111:60–62。
- Keogh RJ、Harris LK、Freeman A、et al:胎児由来の栄養膜は、アポトーシスサイトカイン腫瘍壊死因子-α関連のアポトーシス誘導リガンドを使用して、平滑筋細胞死を誘導します。 Circ Res 2007; 100:834–841。
- Walsh S:子癇前症:胎盤のプロスタサイクリンとトロンボキサンの産生の不均衡。 Am J Obstet Gynecol 1985; 152:335。
- Roberts J、Taylor R、Musci T、et al:子癇前症:内皮細胞障害。 Am J Obstet Gynecol 1989; 152:1200。
- Venkatesha S、Toporsian M、Lam C、et al:可溶性エンドグリンは子癇前症の病因に寄与しています。 Nat Med 2006; 12:642。
- Levine RJ、Karumanchi SA:子癇前症における循環血管新生因子。 Clin Obstet Gynecol 2005; 48:372–386。
- Chesley L:妊娠中の血漿および赤血球の量。 Am J Obstet Gynecol 1972:112:440。
- Rodgers R、Levin J:出血時間の批判的な再評価。 Semin Thromb Hemost 1990:16:1–20。
- Abalos E、Duley L、Steyn DW、Henderson-Smart DJ:妊娠中の軽度から中等度の高血圧に対する降圧薬療法。 Cochrane Database Syst Rev 207; 1:CD002252。
- Groenendijk R、Trimbos M、Wallenburg H:子癇前症の血行力学的測定:予備的観察。 Am J Obstet Gynecol 1984; 150:232。
- Aya AG、Vialles N、Tanoubi I、et al:脊髄くも膜下麻酔による低血圧:重度の子癇前症の患者と早産の帝王切開を受けている健康な女性とのリスク比較。 Anesth Analg 2005; 101:869–875。
- コットンD、ゴニックB、ドーマンK、ハリスR:重度の妊娠高血圧症における心血管系の変化:中心静脈圧と肺毛細血管楔入圧との関係。 Am J Obstet Gynecol 1985; 151:762。
- Hogg B、Hauth J、Caritis S、et al:重度の高血圧性疾患の女性に対する分娩硬膜外麻酔の安全性。 Am J Obstet Gynecol 1999; 181:1099。
- Newsome L、Bramwell R、Curling P:腰部硬膜外麻酔の血行力学的効果。 Anesth Analg 1986; 65:31。
- Jouppila P、Jouppila R、Hollmen A、Koivula A:重度の子癇前症の分娩中の絨毛間血流を改善するための腰部硬膜外鎮痛。 Obstet Gynecol 1982; 52:158。
- ラマナサンJ、ボトルフM、ジェターJら:子癇前症における硬膜外リドカインの薬物動態と母体および新生児への影響。 Anesth Analg 1986; 65:120。
- Wallace D、Leveno KJ、Cunningham F、et al:重度の子癇前症を合併した妊娠における帝王切開分娩のための全身麻酔と局所麻酔のランダム化比較。 Obstet Gynecol 1995; 86:193。
- フードD、カレーR:重度の子癇前症患者の帝王切開に対する脊髄くも膜下麻酔と硬膜外麻酔:遡及的調査。 麻酔学1999;90:1276。
- Oyelese Y、Smulian JC:前置胎盤、前置胎盤、前置血管。 Obstet Gynecol 2006; 107:927–941。
- 栗DH、Dewan D、Redick Lら:産科子宮摘出術のための麻酔管理:多施設研究。 麻酔学1989;70:607。
- Vincent RD Jr、Chestnut DH、Sipes SL、et al:硬膜外麻酔は、妊娠中の雌羊の出血中に子宮の血流と胎児の酸素化を悪化させます。 Anesthesiology 1992; 76:799–806。
- Santos A、Tun E、Bobby P、et al:早産児の子羊の窒息への心血管適応に対するブピバカイン、l-ニトロ-1997-アルギニン-メチルエステルおよびフェニレフリンの効果。 Anesth Analg 84; 1299:XNUMX。
- Morishima HO、Pedersen H、Santos AS、et al:窒息した早産子羊に対する母体投与のリドカインの悪影響。 麻酔学1989;71:110。
- Shnider SM、Webster G:妊娠中の手術による母体および胎児の危険性。 Am J Obstet Gynecol 1965; 92:891。
- Brodsky J、Cohen E、Brown BJ、et al:妊娠中の手術と胎児の転帰。 Am J Obstet Gynecol 1980; 138:1165。
- スミスB:妊娠中の麻酔後の胎児の予後。 Anesth Analg 1963; 42:521。
- Duncan P、Pope W、Cohen M、Greer N:妊娠中の麻酔と手術の胎児リスク。 麻酔学1986;64:790。
- Heinonen O、Slone O、Shapiro S:先天性欠損症と妊娠中の薬物。 妊娠中の先天性欠損症と薬物。 リトルトン、マサチューセッツ州:出版科学グループ、1977年、p。 516。
- Grabowski C、Paar J:ニワトリ胚に対する段階的用量の低酸素症の催奇形性効果。 Am J Anat 1958; 103:313。
- Saxen I、Saxen L:ジアゼパムの母親の摂取量と口の裂け目との関連。 Lancet 1975; 2:498。
- Safra M、Oakley G:口蓋裂の有無にかかわらず口唇裂とジアゼパムへの出生前曝露との関連。 Lancet 1975; 2:478。
- 塩野PH、ミルズJL:妊娠中の口腔裂傷とジアゼパムの使用。 N Engl J Med 1984; 311:919–920。
- シェパードTH:催奇形性物質のカタログ、第7版。 ボルチモア:ジョンズホプキンス大学出版局、1992年。
- パラニサミーA、バクスターMG、キールPK、謝Z、クロスビーG、カリーDJ:妊娠初期に子宮内でイソフルランに曝露されたラットは、成体として行動異常です。 麻酔学2011;114:521–528。
- Sprung J、Fleich RP、Wilder RT、et al:人口ベースの出生コホートにおける帝王切開分娩と学習障害のための麻酔。 麻酔学2009;111:302–310。
- Adamsons K、Mueller-Heubach E、Myers R:母親へのカテコールアミンの投与によるアカゲザルの胎児仮死の発生。 Am J Obstet Gynecol 1971; 109:148。