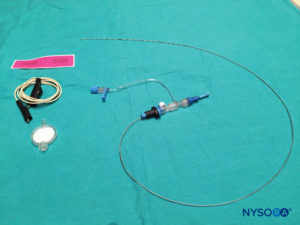
Belen De Jose Maria, Luc Tielens e Steve Roberts
ANESTESIA EPIDURALE NEI BAMBINI
INTRODUZIONE
L'analgesia epidurale è comunemente usata in aggiunta all'anestesia generale e per gestire il dolore postoperatorio. Un efficace sollievo dal dolore postoperatorio dall'analgesia epidurale ha numerosi vantaggi tra cui una deambulazione precoce, facilitando lo svezzamento dai ventilatori, riducendo il tempo trascorso in uno stato catabolico e abbassando i livelli di ormone dello stress circolante. Il posizionamento preciso degli aghi epidurali per le tecniche di iniezione singola e dei cateteri per l'anestesia epidurale continua assicura che i dermatomi coinvolti nella procedura chirurgica siano bloccati selettivamente, consentendo l'uso di dosi più basse di anestetici locali e risparmiando blocchi non necessari nelle regioni non desiderate. L'approccio allo spazio epidurale può essere a livello caudale, lombare o toracico.
ANATOMIA E IMPLICAZIONI FISIOLOGICHE
Ci sono differenze anatomiche significative nei bambini rispetto agli adulti che dovrebbero essere considerate quando si usa l'anestesia neuroassiale. Ad esempio, nei neonati e nei lattanti, il cono midollare si trova più in basso nella colonna vertebrale (all'incirca alla vertebra L3) rispetto a quello degli adulti, nei quali è situato all'incirca alla vertebra L1. Questo è il risultato di diversi tassi di crescita tra il midollo spinale e la colonna vertebrale ossea nei bambini. Tuttavia, a circa 1 anno di età, il cono midollare raggiunge il livello L1 simile a quello di un adulto.
Consigli NYSORA
- Nei neonati e nei lattanti, il cono midollare termina all'incirca al livello L3 rispetto agli adulti, dove si trova all'incirca alla vertebra L1.
- A circa 1 anno di età, il cono midollare raggiunge il livello L1, simile a quello di un adulto.
Anche l'osso sacro dei bambini è più piatto e stretto rispetto alla popolazione adulta. Alla nascita, la placca sacrale, che è formata da cinque vertebre sacrali, non è completamente ossificata e continua a fondersi fino a circa 8 anni di età (sebbene possano essere necessari fino a 21 anni di età). C'è un'incidenza del 6% di atresia sacrale. La fusione incompleta dell'arco vertebrale sacrale forma lo iato sacrale. Lo spazio epidurale caudale è facilmente accessibile nei neonati e nei bambini attraverso lo iato sacrale. A causa del continuo sviluppo del tetto del canale sacrale, vi è una notevole variazione nello iato sacrale. Nei bambini piccoli, lo iato sacrale si trova più cefalico rispetto ai bambini più grandi e il sacco durale può terminare più caudalmente: a S4 nei bambini di età inferiore a 1 anno e a S2 nei bambini più grandi. Pertanto, a causa dell'aumentato rischio di puntura durale accidentale, è necessaria cautela quando si posizionano blocchi caudali nei neonati.
Consigli NYSORA
- Nei bambini piccoli, lo iato sacrale si trova più cefalico rispetto ai bambini più grandi e il sacco durale può terminare più caudalmente (a S4 nei bambini di età inferiore a 1 anno).
- Si raccomanda cautela con l'uso di blocchi caudali nei bambini a causa del rischio di puntura durale.
La valutazione ecografica (US) delle strutture neuroassiali è meno impegnativa nei bambini più piccoli perché l'ossificazione è meno sviluppata. Nei neonati, le fibre del midollo spinale, il liquido cerebrospinale (CSF) e la dura madre sono facilmente identificabili utilizzando sonde ecografiche lineari ad alta frequenza. È stato anche suggerito che il grasso epidurale sia meno denso nei bambini rispetto agli adulti. Il grasso epidurale poco compatto può facilitare la diffusione dell'anestetico locale e aiutare a ottenere un inizio più rapido del blocco. Può anche consentire l'avanzamento senza ostacoli dei cateteri epidurali dallo spazio epidurale caudale ai livelli lombare e toracico. Tuttavia, è meglio monitorare il posizionamento finale della punta di un catetere direttamente sotto guida ecografica o indirettamente identificando l'iniezione di anestetico locale.
La quantità di liquido cerebrospinale per peso corporeo è maggiore nei neonati e nei lattanti (4 ml/kg) rispetto agli adulti (2 ml/kg) e il liquido cerebrospinale è localizzato principalmente nel canale spinale. Inoltre, il midollo spinale nei neonati è ancora non mielinico, il che significa che possono essere utilizzate in modo efficace concentrazioni più basse di anestetico locale. Poiché i bambini hanno una gittata cardiaca maggiore rispetto agli adulti, l'assorbimento sistemico dell'anestetico locale avviene più velocemente. Ciò può portare a livelli plasmatici tossici e una durata più breve del blocco.
Consigli NYSORA
- Rispetto ai bambini più grandi, lo iato sacrale nei neonati si trova più cefalica e il sacco durale termina più in basso, aumentando il rischio di puntura durale accidentale.
- L'imaging ecografico può essere utilizzato per valutare l'anatomia neuroassiale e l'approccio allo spazio epidurale.
ANESTESI LOCALI PER ANESTESIA EPIDURALE NEI BAMBINI
Poiché la maggior parte dei pazienti pediatrici riceve analgesia epidurale in combinazione con un anestetico generale, lo scopo principale del catetere epidurale è fornire una soluzione anestetica locale sufficiente per un'analgesia intraoperatoria e postoperatoria efficace. Come per l'anestesia epidurale negli adulti, la concentrazione e il volume dell'anestetico locale sono fattori importanti nel determinare la densità e il livello di blocco. Tuttavia, nei pazienti pediatrici, anche la conoscenza della dose totale del farmaco è importante per evitare la tossicità dell'anestetico locale. Una descrizione più dettagliata delle soluzioni anestetiche locali, delle loro caratteristiche e del potenziale di tossicità è stata descritta in Farmacologia clinica degli anestetici locali.
La bupivacaina, la ropivacaina e la levobupivacaina sono gli anestetici locali più comunemente usati per l'anestesia neuroassiale nei bambini. La lidocaina non viene spesso utilizzata a causa del suo eccessivo blocco motorio. Come regola generale, alte concentrazioni di anestetici locali, come bupivacaina allo 0.5% o ropivacaina allo 0.5%, sono usate raramente nei blocchi epidurali nei bambini. Invece, volumi maggiori di anestetico locale più diluito sono più comunemente usati per coprire più dermatomi. Il peso corporeo è solitamente una correlazione migliore rispetto all'età del paziente nel predire la diffusione dell'anestetico locale dopo un blocco caudale. La dose massima sicura di bupivacaina è 2.5 mg/kg. Per l'uso caudale, la concentrazione ottimale di bupivacaina è 0.125%–0.175%. Rispetto alla preparazione allo 0.25%, questa concentrazione fornisce una durata simile dell'analgesia postoperatoria (4–8 ore) ma con un blocco motorio inferiore. Alcuni medici preferiscono somministrare le dosi in base al volume per peso. Una dose di 1.0 ml/kg di una soluzione diluita, come bupivacaina allo 0.125%, fino a un volume massimo di 20 ml può talvolta fornire un blocco sensoriale T10 senza superare i livelli massimi raccomandati in letteratura. Nei neonati, possono essere somministrati volumi più elevati, come 1.25 ml/kg o anche 1.5 ml/kg, per fornire un blocco più cefalico senza il rischio di tossicità da anestetico locale. Per l'infusione epidurale continua, una linea guida di dosaggio comunemente accettata per la bupivacaina è 0.2 mg/kg/ora per i neonati e 0.4 mg/kg/ora per i bambini più grandi. La tossicità cumulativa è un problema anche a tassi più bassi di infusioni di soluzioni di anestetico locale. Pertanto, la durata delle infusioni epidurali neonatali deve essere limitata a 48 ore.
La ropivacaina ha un indice terapeutico più elevato rispetto al vecchio anestetico locale bupivacaina. A basse concentrazioni, la ropivacaina può produrre un minor blocco motorio e un'analgesia equivalente rispetto alla bupivacaina con una ridotta incidenza di tossicità cardiaca e del sistema nervoso centrale. A causa delle sue possibili proprietà vasocostrittrici, la ropivacaina può subire un assorbimento sistemico più lento rispetto alla bupivacaina. Ciò può avere implicazioni cliniche quando viene utilizzata un'infusione di anestetico locale prolungata in bambini con funzionalità epatica compromessa. Per un blocco caudale a iniezione singola, si raccomanda un bolo di 1 ml/kg di ropivacaina allo 0.2%. Un'infusione di ropivacaina allo 0.1% a 0.2 mg/kg/h nei neonati e 0.4 mg/kg/h nei bambini più grandi, della durata non superiore a 48 ore, si è anche dimostrata efficace e sicura.
La levobupivacaina, l'isomero S (–) della bupivacaina, ha meno probabilità di causare depressione miocardica e aritmie fatali ed è anche meno tossica per il sistema nervoso centrale rispetto alla bupivacaina racemica. Una dose di 0.8 ml/kg di levobupivacaina allo 0.25% iniettata caudalmente fornisce analgesia nei bambini sottoposti a chirurgia del pene o dell'inguine. Per l'infusione epidurale continua, la dose di levobupivacaina è simile a quella della bupivacaina racemica.
Consigli NYSORA
- Alte concentrazioni di anestetico locale, come bupivacaina allo 0.5% o ropivacaina allo 0.5%, non sono raccomandate nella popolazione pediatrica. Poiché la mielinizzazione non è completa, sono efficaci concentrazioni più basse di anestetici locali aminoammidici (p. es., 0.125% di levobupivacaina).
- Invece, volumi maggiori di anestetici locali più diluiti sono più comunemente usati per coprire diversi dermatomi di interesse.
- Nei pazienti pediatrici, il peso corporeo fornisce una migliore correlazione rispetto all'età del paziente nel predire la diffusione dell'anestetico locale dopo un blocco caudale.
- Una semplice regola per una singola iniezione caudale nei bambini di peso inferiore a 20 kg consiste nell'usare bupivacaina 0.125%–0.175% o ropiva-caina 0.2% e somministrare un bolo di uno dei seguenti:
- 0.5 ml/kg per raggiungere un livello chirurgico sacrale
- 1.0 ml/kg per ottenere un livello chirurgico lombare elevato
- 1.25 ml/kg per ottenere un livello chirurgico toracico basso
- Per l'infusione epidurale continua, viene spesso utilizzata bupivacaina 0.125% a una velocità di 0.2 mg/kg/ora per i neonati e 0.4 mg/kg/ora per i bambini più grandi. La ropivacaina allo 0.1% a una velocità di 0.2 mg/kg/ora per i neonati e di 0.4 mg/kg/ora per i bambini più grandi per 48 ore ha dimostrato di essere un regime efficace e sicuro.
COADIUVANTI PER ANESTESIA EPIDURALE NEI BAMBINI
Un blocco caudale a iniezione singola con anestetico locale viene utilizzato principalmente per interventi chirurgici minori a causa della sua durata limitata dell'analgesia. Gli adiuvanti possono essere utilizzati per prolungare la durata del blocco e sono stati sperimentati diversi farmaci. L'adiuvante più comunemente usato per gli anestetici locali è stata l'adrenalina. L'adrenalina in una concentrazione di 1:200,000 viene utilizzata per diminuire il tasso di assorbimento dell'anestetico locale e ha l'ulteriore vantaggio di fungere da possibile marker per un'iniezione intravascolare involontaria. Ricerche recenti si sono concentrate sull'uso di una moltitudine di adiuvanti. Sono stati studiati anche midazolam e neostigmina; tuttavia, non ci sono prove che questi farmaci forniscano alcun beneficio analgesico quando somministrati per via epidurale. Gli oppioidi, la clonidina e la ketamina meritano tutti maggiore considerazione e saranno quindi discussi in modo più dettagliato.
Gli oppiacei
Gli oppioidi epidurali possono potenziare l'effetto degli anestetici locali e prolungare l'analgesia. Tuttavia, alcuni oppioidi potrebbero non essere consigliabili in ambito ambulatoriale a causa del potenziale rischio di depressione respiratoria e altri effetti collaterali inaccettabili (p. es., nausea e vomito, prurito, ritenzione urinaria). Di conseguenza, l'uso di oppioidi epidurali caudali nei bambini dovrebbe essere limitato a situazioni cliniche speciali al di fuori dell'ambiente ambulatoriale. Una dose di 2 mcg/kg di fentanil per l'anestesia caudale a iniezione singola insieme alla soluzione di anestetico locale standard è stata raccomandata per procedure più estese o dolorose e nei pazienti che hanno un catetere urinario nel periodo postoperatorio. L'aggiunta di 1–2 mcg/mL di fentanil allo 0.1% di bupivacaina per le infusioni epidurali continue è stata utilizzata con successo anche nei bambini in un ambiente ospedaliero ben monitorato. Tuttavia, il fentanil non deve essere utilizzato nelle infusioni epidurali neonatali. La morfina epidurale può essere utilizzata anche per i pazienti ricoverati sottoposti a chirurgia addominale o toracica maggiore. Se aggiunto a blocchi epidurali caudali a iniezione singola, aumenterà il livello di blocco a causa della sua dispersione rostrale (poiché la morfina è una molecola idrofila). Le dosi di morfina caudale variano da 30 a 90 mcg/kg a seconda del tipo di intervento chirurgico. La morfina epidurale comporta un potenziale rischio di depressione respiratoria; pertanto, la pulsossimetria continua è consigliata con dosi più basse di morfina caudale ed è obbligatoria con dosi medie. Quando vengono utilizzate dosi più elevate di morfina caudale, deve essere pianificato il ricovero postoperatorio in terapia intensiva.
Clonidina
Tra i vari coadiuvanti non oppioidi utilizzati nei blocchi epidurali nei bambini, la clonidina offre il profilo migliore. La clonidina è un α1-agonista e agisce stimolando le vie medullospinali noradrenergiche discendenti, che inibisce il rilascio di neurotrasmettitori nocicettivi nel corno dorsale del midollo spinale. L'aggiunta di clonidina (1-5 mcg/kg) può migliorare l'effetto analgesico degli anestetici locali per il blocco caudale a iniezione singola e prolungare la durata d'azione dell'anestetico locale senza gli effetti collaterali indesiderati degli oppioidi epidurali. Per le infusioni epidurali continue è stata utilizzata con buoni risultati la clonidina 0.1 mcg/kg/h. Va avvertito che dosi più elevate sono state associate a sedazione e instabilità emodinamica sotto forma di ipotensione e bradicardia. Con dosi in bolo di 2 mcg/kg, questi effetti collaterali sono insoliti. Inoltre, la clonidina epidurale attenua la risposta ventilatoria all'aumento dei livelli di anidride carbonica di fine espirazione (PCO2). Sebbene la depressione respiratoria non sembri essere un problema comune, è stata segnalata apnea in un neonato a termine che ha ricevuto un blocco caudale costituito da 1 ml/kg di ropivacaina allo 0.2% con 2 mcg/kg di clonidina. Si deve usare cautela quando si usa la clonidina nei bambini molto piccoli a causa della sedazione e dell'ipotensione che possono derivarne.
Ketamina
L'aggiunta di S-ketamina a un blocco caudale a iniezione singola prolunga l'effetto analgesico degli anestetici locali. I principali svantaggi della ketamina sono i suoi effetti psicomimetici. Tuttavia, a piccole dosi (0.25-0.5 mg/kg), la ketamina è efficace senza evidenti effetti collaterali comportamentali. La ketamina 1 mg/kg può essere utilizzata anche come analgesico caudale efficace esclusivamente senza l'aggiunta di una soluzione di anestetico locale. La combinazione di S (+)-ketamina (0.5–1 mg/kg) e clonidina (1 o 2 mcg/kg) ha dimostrato di fornire un'analgesia efficace dopo l'erniotomia inguinale nei bambini con una durata dell'effetto prolungata (> 20 ore) senza alcun effetto negativo sul sistema nervoso centrale (SNC) o compromissione motoria. Una preoccupazione per quanto riguarda l'uso della ketamina nei neonati riguarda una serie controversa di studi sugli animali che suggeriscono che la ketamina può produrre neurodegenerazione apoptotica nel cervello in via di sviluppo. Altri studi su animali infantili hanno dimostrato che la ketamina può avere un effetto neuroprotettivo. Tuttavia, molti anestesisti sono riluttanti a introdurre la S-ketamina caudale nella loro pratica clinica di routine ed è improbabile che la ketamina venga ampiamente adottata nei paesi in cui non sono disponibili formule senza conservanti.
COMPLICANZE ASSOCIATE ALL'ANESTESIA EPIDURALE
Le complicanze maggiori dovute a blocchi epidurali a iniezione singola o continui sono rare se viene utilizzata una tecnica adeguata.
Lesione neurologica
Un ampio studio prospettico, che ha riassunto i dati di oltre 15,000 blocchi centrali nei bambini, non ha riportato l'incidenza di lesioni neurologiche permanenti e ha concluso che l'incidenza delle complicanze è rara. Tuttavia, tre decessi infantili e altri due casi di paraplegia e tetraplegia sono stati riportati in un altro ampio rapporto retrospettivo pubblicato nel 1995 con oltre 24,000 blocchi epidurali nei bambini. Questo studio ha anche riportato due casi di parestesia transitoria. Sebbene il rischio complessivo sembri basso, possono verificarsi complicazioni devastanti dovute a danni diretti al midollo spinale, in particolare con il posizionamento dell'ago epidurale toracico e lombare alto. Inoltre, l'ipotensione può compromettere la perfusione spinale. Poiché il posizionamento di aghi e cateteri epidurali viene solitamente eseguito con il paziente in sedazione o anestesia generale, il fatto che i pazienti privi di sensi non siano in grado di segnalare dolore o parestesia (il segnale di avvertimento attualmente accettato dell'invasione dell'ago nel midollo spinale) desta preoccupazione. Come misura di sicurezza è stato suggerito di mantenere il paziente a respirare spontaneamente durante l'esecuzione del blocco neuroassiale. L'ecografia preprocedurale dell'anatomia neuroassiale, ove disponibile, è altamente raccomandata per valutare la profondità dello spazio epidurale.
Un caso clinico di lesione del midollo spinale dopo aver posizionato un'epidurale toracica a iniezione singola in anestesia generale per appendicectomia evidenzia l'importanza della valutazione di routine del rapporto rischio-beneficio del posizionamento di un'epidurale toracica diretta per un intervento chirurgico meno esteso. In particolare, l'uso del catetere epidurale toracico e lombare alto dovrebbe essere riservato solo a procedure toraciche e addominali estese e dovrebbe essere eseguito da anestesisti con esperienza nel posizionamento dell'epidurale toracica. Per ridurre al minimo il rischio di lesioni del midollo spinale (e il rischio di puntura), è importante la conoscenza della profondità prevista dello spazio epidurale. Come regola generale, lo spazio epidurale nei bambini di peso superiore a 10 kg si trova a 1 mm/kg di peso corporeo. Esistono altre formule basate sul peso corporeo o sull'età del paziente per calcolare questa profondità. Tuttavia, l'opzione migliore è misurare la profondità mediante l'imaging ecografico preprocedurale dell'anatomia neuroassiale (Tabella 1)
Consigli NYSORA
Come regola generale, lo spazio epidurale nei bambini di peso superiore a 10 kg si trova a una profondità di 1 mm/kg di peso corporeo. Tuttavia, l'imaging ecografico preprocedurale è utile per determinare la profondità dello spazio epidurale.
TABELLA 1. Formule per determinare la profondità dello spazio epidurale dalla pelle.
| Nota: | Una valutazione ecografica pre-procedurale individuale è il metodo preferito per determinare la profondità dello spazio epidurale dalla pelle. |
| 1. Stima approssimativa: 1 mm/kg di peso corporeo | |
| 2. Profondità (cm) = 1 + (0.15 × età in anni) | |
| 3. Profondità (cm) = 0.8 + (0.05 × peso in chilogrammi) |
Ematoma epidurale
L'ematoma epidurale associato all'analgesia epidurale nei bambini è raro. Ciò può essere dovuto al fatto che i protocolli anticoagulanti sono raramente indicati durante il periodo perioperatorio nei pazienti pediatrici. Tuttavia, l'analgesia epidurale deve essere evitata nei pazienti con coagulopatia o trombocitopenia clinicamente significative. Le linee guida per l'uso dell'anestesia epidurale nei pazienti adulti devono essere applicate anche ai pazienti pediatrici sottoposti a terapia antitrombotica o trombolitica.
Infezione
Sebbene il tasso complessivo di infezione associato ai cateteri epidurali caudali sembri essere basso, esistono segnalazioni di casi isolati di infezione correlata ai cateteri epidurali nei bambini. Rispetto ai cateteri epidurali lombari, vi è una certa preoccupazione per l'infezione del catetere con l'uso prolungato di cateteri posizionati caudalmente a causa della vicinanza dello iato sacrale al retto. Sebbene gli studi non abbiano trovato prove cliniche di tassi di infezione più elevati con l'approccio caudale, è stato segnalato che la colonizzazione batterica è maggiore. Lo Staphylococcus epidermidis è il microrganismo predominante colonizzato sulla pelle e sui cateteri dell'epidurale lombare e caudale. Batteri gram-negativi sono stati trovati anche sulla punta dei cateteri caudali. Anche con blocchi caudali a iniezione singola ampiamente utilizzati, possono ancora verificarsi infezioni come l'osteomielite sacrale. Per ridurre il rischio di contaminazione da feci e urine, possono essere utilizzate tecniche come il tunneling del catetere e il fissaggio del catetere con una medicazione occlusiva in direzione cefalica. Deve essere utilizzata anche una rigorosa tecnica asettica che includa l'uso di un sistema sterile di infusione chiusa e occorre prestare attenzione per evitare traumi tissutali locali. È importante anche l'ispezione quotidiana della medicazione e del sito di ingresso, sebbene la medicazione non debba essere cambiata a meno che non sia strettamente necessario. Se il bambino sviluppa una febbre persistente superiore a 38°C di origine sconosciuta, il catetere deve essere rimosso e inviato per la coltura.
Puntura durale e mal di testa da puntura postdurale
La puntura durale durante l'analgesia epidurale caudale è rara se si presta attenzione per evitare di far avanzare l'ago troppo nel canale sacrale. L'uso dell'imaging ecografico in tempo reale per controllare la posizione dell'ago rende questo rischio estremamente basso. Il trattamento per il mal di testa da puntura postdurale (PDPH) comprende riposo a letto, idratazione orale o endovenosa (IV), analgesia (p. es., paracetamolo regolare, farmaci antinfiammatori non steroidei [FANS]) e antiemetici. Il riposo a letto, sebbene allevia la gravità del mal di testa, non ha alcun effetto sull'incidenza o sulla durata del PDPH.
Negli adulti, la caffeina è stata utilizzata sia per la profilassi che per il trattamento del PDPH. La caffeina provoca vasocostrizione cerebrale bloccando i recettori dell'adenosina, che dilatano i vasi quando attivati. La riduzione del flusso sanguigno cerebrale diminuisce la quantità di sangue nel cervello e può ridurre la trazione sulle strutture intracraniche sensibili al dolore, alleviando così il PDPH. Tuttavia, la caffeina non è usata frequentemente nei bambini per alleviare il PDPH e non è nota una dose ottimale. L'uso del cerotto epidurale per il trattamento del PDPH è stato utilizzato con successo negli adulti dal 1960. Ora ci sono molti rapporti sul suo uso efficace in anche i bambini. Si ritiene che un cerotto epidurale sia efficace attraverso la formazione di una copertura gelatinosa sul foro durale da parte del sangue iniettato. A breve termine, il cerotto epidurale sigilla il foro e allevia l'ipotensione del liquido cerebrospinale sia per effetto della massa dovuto allo spostamento cranico del liquido cerebrospinale sia aumentando il volume e la pressione intracranici. La guarigione effettiva avviene a lungo termine. Nei bambini, si raccomanda di iniettare circa 0.3 ml/kg di sangue autologo nel paziente sveglio o leggermente sedato, se possibile, per rilevare la comparsa di sintomi radicolari. Una discussione più completa sul PDPH è presentata in Mal di testa da puntura postdurale.
Effetti emodinamici e anestesia spinale totale
Cambiamenti significativi della pressione sanguigna sono rari nei pazienti pediatrici dopo l'accurata somministrazione di analgesia epidurale. È stato riscontrato che un blocco caudale a iniezione singola ad alto simpatico al T6 non evoca cambiamenti significativi nella frequenza cardiaca, nell'indice cardiaco o nella pressione sanguigna nei bambini. Anche quando il blocco epidurale toracico è combinato con l'anestesia generale, la stabilità cardiovascolare viene solitamente mantenuta in pazienti pediatrici altrimenti sani. Pertanto, l'ipotensione dovrebbe far sorgere il sospetto di un'anestesia spinale totale e/o di un'iniezione intravascolare che porti a tossicità da anestetico locale. Dopo aver escluso queste complicanze, devono essere valutate altre cause, come lo stato di idratazione, la pressione di riempimento intravascolare e lo stato inotropo e la profondità dell'anestesia.
Se si è verificata un'anestesia spinale totale, devono essere fornite misure di supporto fino a quando l'effetto del blocco non si è dissipato. Tuttavia, in caso di un'estensione pericolosa per la vita di un'anestesia spinale totale, se le tentate misure di supporto non sono efficaci né un'opzione, il lavaggio cerebrospinale può essere considerato come l'ultima manovra. Un case report ha suggerito che 20-30 ml di liquido cerebrospinale possono essere prelevati e sostituiti con 30-40 ml di soluzione fisiologica normale senza conservanti, lattato di Ringer o Plasmalyte attraverso il catetere epidurale. Questo intervento può ridurre i tempi di recupero, minimizzare il potenziale danno neurotossico e ridurre l'incidenza della puntura postdurale. Tuttavia, alla luce dell'esperienza e delle informazioni limitate sul lavaggio cerebrospinale, i potenziali rischi e benefici dovrebbero essere valutati caso per caso prima di utilizzare questa tecnica nei bambini.
Consigli NYSORA
- L'anestesia epidurale e l'analgesia in bambini altrimenti sani causano raramente instabilità cardiovascolare.
- Il verificarsi di ipotensione dovrebbe far sorgere il sospetto di un'anestesia spinale totale e/o di un'iniezione intravascolare che porti a tossicità da anestetico locale.
- Dopo aver escluso queste complicanze, devono essere valutate altre cause, come lo stato di idratazione, la pressione di riempimento intravascolare e lo stato inotropo e la profondità dell'anestesia.
Tossicità sistemica anestetica locale
Tossicità sistemica dell'anestetico locale (ULTIMO) spesso deriva da un'iniezione intravascolare accidentale nei vasi sanguigni epidurali. Questa complicazione può essere spesso evitata utilizzando un'aspirazione attenta e un dosaggio di prova. Tabella 2 riassume le raccomandazioni per il dosaggio di prova nel blocco epidurale. Per un blocco caudale a iniezione singola, è più probabile che si verifichino puntura vascolare e assorbimento di anestetico locale quando si utilizzano aghi a punta affilata. Per l'infusione epidurale continua, i neonati e i bambini molto piccoli sono maggiormente a rischio di tossicità da anestetico locale rispetto ai bambini più grandi. Sono state riportate convulsioni in bambini che hanno ricevuto infusioni continue di anestetici locali. Ciò può essere evitato utilizzando soluzioni diluite di anestetici locali (≤ 0.125% di bupivacaina) e seguendo le attuali raccomandazioni di dosaggio (vedere "Anestetici locali per l'anestesia epidurale nei bambini", sopra).
Ancora più importante, un monitoraggio vigile durante la somministrazione dell'analgesia epidurale dovrebbe essere una priorità. Le linee guida per l'ULTIMO trattamento dovrebbero essere facilmente accessibili in tutte le aree ospedaliere in cui vengono utilizzati anestetici locali. Tutto il personale dei reparti in cui vengono assistiti i pazienti sottoposti a infusione epidurale deve essere formato al riconoscimento dei sintomi e al trattamento di LAST. Inoltre, accanto al diagramma delle osservazioni del paziente dovrebbe essere presente una registrazione completa della tecnica regionale e dell'infusione utilizzata in ciascun caso.
TABELLA 2. Dosaggio di prova per il blocco epidurale.
| 1. | Utilizzare il dosaggio di prova di routine, anche se il dosaggio di prova per tutti gli agenti disponibili non è sensibile al 100%. Inoltre, poiché la vera incidenza del posizionamento intravascolare è relativamente bassa, la maggior parte dei test positivi (cioè l'aumento della frequenza cardiaca) saranno falsi positivi. Quando c'è una risposta borderline, la ripetizione della dose di prova aumenta la specificità e la sensibilità del test. |
| 2. | Monitorare continuamente l'ECG e far scorrere ripetutamente il bracciale per la pressione sanguigna. Con soluzioni contenenti adrenalina, se la frequenza cardiaca non aumenta, un aumento della pressione sanguigna dovrebbe far sorgere il sospetto di un posizionamento intravascolare. |
| 3. | Evitare di eseguire il dosaggio di prova quando il bambino si trova in un piano di anestesia molto leggero o quando c'è stimolazione (p. es., riposizionamento del paziente sul tavolo operatorio, strumentazione delle vie aeree, incisione). L'esecuzione della dose di prova in queste condizioni aumenta la probabilità di falsi positivi, aumenti indotti dalla stimolazione della frequenza cardiaca o della pressione sanguigna. |
| 4. | Dopo la dose di prova, il resto della dose intera deve essere somministrato in modo incrementale. Il dosaggio incrementale e il monitoraggio continuo contribuiscono ad aumentare le probabilità che venga rilevato un posizionamento intravascolare e che l'ulteriore iniezione venga interrotta prima che vengano somministrate le dosi complete di cardiodepressivo. |
| 5. | Quando possibile, mantenere il paziente in ventilazione spontanea durante tutto il posizionamento e la somministrazione iniziale del blocco epidurale. Qualsiasi cambiamento nel pattern respiratorio del paziente è un avviso che potrebbe essersi verificata un'iniezione intravascolare o intratecale involontaria: tachipnea se dolore all'iniezione; depressione respiratoria in caso di assorbimento sistemico di anestetico locale; o tachipnea seguita da bradipnea causata da anestesia spinale totale se l'anestetico locale è stato somministrato per via intratecale. |
Altri effetti avversi
In una revisione retrospettiva basata su dati prospettici raccolti da 286 pazienti pediatrici, prurito (26.1%), nausea e vomito (16.9%) e ritenzione urinaria (20.8%) sono stati gli effetti collaterali più comuni riscontrati durante l'anestesia epidurale con un'infusione di bupivacaina e fentanil. Sedazione e blocco eccessivo si sono verificati ciascuno in meno del 2% dei pazienti. L'incidenza della depressione respiratoria è stata del 4.2%, ma la somministrazione di naloxone per la depressione respiratoria grave non è mai stata necessaria. La perforazione del retto può verificarsi se l'ago caudale è angolato troppo ripidamente. Tabella 3 riassume i trattamenti raccomandati per gli effetti avversi comuni.
TABELLA 3. Riassunto dei trattamenti raccomandati degli effetti nei blocchi epidurali.
| Prurito | |
| 1. Escludere e/o correggere altre cause rimediabili. | |
| 2. Utilizzare infusioni di naloxone a basso dosaggio, agonisti-antagonisti parziali (p. es., nalbufina) o antistaminici. | |
| 3. Se il prurito persiste, rimuovere l'oppioide dall'infusione epidurale e considerare la clonidina. | |
| Nausea | |
| 1. Escludere e/o correggere altre cause rimediabili. | |
| 2. Utilizzare antagonisti 5-HT (p. es., ondansetron, dolasetron) | |
| 3. Utilizzare infusioni di naloxone a basso dosaggio o nalbufina | |
| 4. Evitare gli oppioidi nelle infusioni e considerare la clonidina. | |
| Ileo e disfunzione intestinale | |
| 1. Escludere e/o correggere altre cause rimediabili. | |
| 2. Somministrare lassativi se non altrimenti controindicato. | |
| 3. Evitare gli oppioidi nelle infusioni e considerare la clonidina. | |
| 4. Utilizzare infusioni di naloxone a basso dosaggio o nalbufina. | |
| 5. Utilizzare antagonisti oppioidi periferici o enteralmente vincolati; per esempio, metilnaltrexone o alvimopan (attualmente in fase di sperimentazione). | |
| Sedazione o ipoventilazione | |
| 1. Escludere e/o correggere altre cause rimediabili. | |
| 2. A seconda della gravità, ridurre o sospendere la somministrazione di oppioidi o clonidina. | |
| 3. Risveglia, stimola e incoraggia la respirazione profonda. | |
| 4. Se grave, considerare il naloxone o la ventilazione assistita secondo necessità. | |
| Ritenzione urinaria | |
| 1. Escludere e/o correggere altre cause rimediabili. | |
| 2. Evitare l'uso di anticolinergici o antistaminici se sono disponibili alternative. | |
| 3. Utilizzare infusioni di naloxone a basso dosaggio o nalbufina. | |
| 4. Utilizzare il cateterismo vescicale. | |
Blocco EPIDURALE PER CHIRURGIA PEDIATRICA: TECNICHE
L'analgesia epidurale può essere somministrata tramite una tecnica a iniezione singola o continua. Gli aghi e i cateteri possono essere inseriti a livello caudale, lombare o toracico. L'obiettivo principale della tecnica epidurale è posizionare accuratamente l'ago e/o il catetere nello spazio epidurale. I test di aspirazione e le dosi di prova indicano una possibile somministrazione intravascolare o intratecale di farmaci involontari. Oltre all'imaging a raggi X convenzionale, sono state sviluppate tecniche di stimolazione epidurale, elettrocardiogramma epidurale (ECG) e ecografia per facilitare il posizionamento accurato dell'ago epidurale o del catetere.
Conferma del corretto posizionamento dell'ago epidurale o del catetere
Aspirazione e dose di prova
Viene utilizzato un test di aspirazione eseguito prima dell'iniezione di anestetico locale per evitare iniezioni spinali e intravascolari totali. Tuttavia, un'aspirazione negativa di sangue o liquido cerebrospinale non dovrebbe essere considerata un indicatore assoluto del corretto posizionamento dell'ago e del catetere. Le vene sono così piccole che possono collassare facilmente all'aspirazione; pertanto, si consiglia di utilizzare una siringa da 2 ml, aspirare lentamente e considerare l'apertura all'aria per cercare un flusso libero.
L'ECG del paziente deve essere continuamente monitorato durante l'iniezione di anestetico locale nello spazio caudale. Le variazioni della specificità dell'ECG (ossia, aumento > 25% dell'onda T) dopo l'iniezione di una dose di test di adrenalina (0.5 mcg/kg) possono aiutare a prevedere l'iniezione intravascolare.
Se possibile, il paziente deve essere mantenuto in ventilazione spontanea durante tutto il posizionamento e la somministrazione iniziale del blocco epidurale. Qualsiasi cambiamento nel pattern respiratorio del paziente è un segnale che potrebbe accadere qualcosa accidentalmente: depressione respiratoria se c'è assorbimento sistemico di anestetico locale; tachipnea se c'è dolore all'iniezione; o tachipnea seguita da bradipnea se c'è stata una somministrazione intratecale di anestetico locale (vedi Tabella 2). Tabella 4 riassume vari metodi per confermare il posizionamento del catetere epidurale.
TABELLA 4. Conferma della posizione del catetere epidurale.
| Intraoperatoriamente (mentre il paziente è in anestesia generale) |
| 1. L'ecografia è altamente raccomandata per valutare la diffusione dell'anestetico locale sulla punta del catetere o all'interno dello spazio epidurale. |
| 2. Garantire l'aspirazione negativa; iniettare l'anestetico locale lentamente a piccoli incrementi attraverso il catetere; e valutare la risposta all'intervento chirurgico. Se possibile, mantenere la ventilazione spontanea. |
| 3. Radiografia con contrasto. |
| 4. Tecnica di stimolazione elettrica e/o ECG. |
| Postoperatorio (mentre il paziente è sveglio, indipendentemente dal fatto che possa o meno dare risposte verbali) |
| 1. L'ecografia è il metodo attualmente raccomandato. Questo è indolore e può essere fatto nella PACU senza disturbare troppo il bambino. |
| 2. Se gli Stati Uniti non sono disponibili, è possibile utilizzare il test della cloroprocaina. Ciò comporta il dosaggio incrementale di una soluzione di cloro-procaina al 3% per dimostrare l'analgesia (mediante autovalutazione o misure comportamentali a seconda dei casi) e segni di effetto segmentale: un. Punta del catetere lombare: • Almeno parziale blocco sensoriale e motorio in entrambe le gambe • Riscaldamento della superficie palmare delle dita dei piedi b. Punta del catetere toracico inferiore: • Forza ridotta nella flessione dell'anca • Ridotti riflessi cutanei addominali • Una certa riduzione della frequenza cardiaca e della pressione sanguigna c. Punta del catetere toracico superiore: • Una certa riduzione della frequenza cardiaca e della pressione sanguigna • Riscaldamento della superficie palmare delle mani • Sindrome di Horner unilaterale o bilaterale |
Metodi radiografici
L'imaging a raggi X in combinazione con un agente di contrasto identifica con precisione la punta del catetere a un livello spinale specifico.
Una radiografia senza contrasto, tuttavia, non è in grado di distinguere il posizionamento involontario del catetere intratecale o subdurale dal corretto posizionamento epidurale. Inoltre, la radiografia standard non consente all'anestesista di regolare la posizione del catetere durante l'inserimento, a meno che non venga utilizzata la fluoroscopia. Sebbene la fluoroscopia consenta il monitoraggio e la regolazione in tempo reale dell'avanzamento dei cateteri, richiede una configurazione aggiuntiva, comporta maggiori spese e aumenta l'esposizione del paziente alle radiazioni ionizzanti. Di conseguenza, la fluoroscopia non è raccomandata di routine e di solito è limitata a circostanze difficili e/o speciali, come il posizionamento di un catetere epidurale a lungo termine per il dolore da cancro.
Test di stimolazione epidurale (Tsui Test) e tecnica ECG epidurale
Un test di stimolazione elettrica a bassa corrente (il test Tsui; Figure 1 ) è stato suggerito per monitorare e guidare la posizione del catetere epidurale durante l'inserimento. La configurazione richiede che l'elettrocatetere catodico (nero per blocco) dello stimolatore nervoso sia collegato al catetere epidurale tramite un adattatore per elettrodo mentre l'elettrocatetere anodico è collegato a un elettrodo sulla pelle del paziente come sito di messa a terra. Per evitare interpretazioni errate della risposta di stimolazione (p. es., una contrazione muscolare locale può essere confusa con la stimolazione epidurale), l'elettrodo con messa a terra viene posizionato sull'estremità inferiore per le epidurali toraciche e sull'estremità superiore per le epidurali lombari. Il corretto posizionamento della punta del catetere epidurale (1–2 cm dalle radici nervose) è indicato da una risposta motoria provocata con una corrente compresa tra 1 mA e 10 mA. Una risposta motoria osservata con una corrente di soglia significativamente più bassa (< 1 mA) suggerisce che il catetere si trova nello spazio subaracnoideo o subdurale o si trova in prossimità di una radice nervosa. Sebbene la stimolazione cronica del midollo spinale sia un mezzo sicuro ed efficace per la gestione del dolore, la sicurezza di questo test di stimolazione epidurale non è completamente nota. Tuttavia, si prevede che il rischio di una breve stimolazione elettrica intermittente derivante da questo test sia minimo. Tabella 5 riassume le diverse posizioni del catetere in base alla risposta motoria e alla corrente elettrica.
TABELLA 5. Prova di stimolazione elettrica.
| Posizione del catetere | Risposta del motore | Corrente |
|---|---|---|
| Sottocutaneo | Nessuna | > 10 mA |
| subdurale | Bilaterale (molti segmenti) | <1 mA |
| subaracnoidea | Unilaterale o bilaterale | <1 mA |
| Spazio epidurale | ||
| - Contro la radice nervosa | Unilaterale | <1 mA |
| - Non intravascolare | Unilaterale o bilaterale | 1–10 mA (aumento della corrente di soglia dopo l'iniezione di LA) |
| - Intravascolare | Unilaterale o bilaterale | 1–10 mA (nessuna variazione della corrente di soglia dopo l'iniezione di LA) |
Uno svantaggio della tecnica di stimolazione epidurale è che non può essere eseguita in modo affidabile se è presente un blocco neuromuscolare clinico significativo o se sono stati somministrati anestetici locali nello spazio epidurale. Per superare questa limitazione, è stata suggerita una tecnica di monitoraggio alternativa utilizzando il monitoraggio ECG. Un ECG di riferimento viene monitorato al livello spinale richiesto per l'intervento chirurgico; questo viene quindi confrontato con l'ECG formato dalla punta del catetere epidurale poiché è cefalica filettata. Sfortunatamente, questa tecnica non può differenziare facilmente i complessi QRS sottili in cui il catetere è infilato a breve distanza; né riconosce il posizionamento del catetere intravascolare o intratecale.
Tecniche ecoguidate
Poiché l'obiettivo principale di un blocco epidurale è posizionare accuratamente l'ago e/o il catetere nello spazio epidurale, la conoscenza della profondità prevista dalla superficie cutanea allo spazio epidurale è estremamente importante. Tabella 1 riassume alcune formule per calcolare questa profondità nei bambini. Ove disponibile, l'ecografia consente l'identificazione in tempo reale dei punti di riferimento anatomici e una stima molto più precisa della profondità dello spazio epidurale. Si consiglia vivamente di scansionare l'anatomia con l'ecografia in tutti i bambini prima di eseguire il blocco e soprattutto nei casi difficili, come i pazienti con scoliosi o fossette sacrali. L'ecografia consente anche la visualizzazione dell'ago all'interno dello spazio epidurale nei neonati. Nei neonati, l'ecografia può rilevare l'avanzamento del catetere epidurale, direttamente o indirettamente, osservando l'iniezione di liquido.
Approcci epidurali
I tipi più comuni di analgesia epidurale sono l'analgesia caudale (che costituisce la tecnica regionale più comunemente utilizzata nei bambini), l'analgesia epidurale lombare e l'analgesia epidurale toracica.
Analgesia epidurale caudale: tecnica a iniezione singola
Il blocco epidurale caudale a iniezione singola è ampiamente utilizzato per fornire analgesia perioperatoria nella pratica pediatrica. In una singola iniezione, offre un blocco affidabile ed efficace per i pazienti sottoposti a chirurgia urologica, generale e ortopedica che interessano l'addome inferiore e gli arti inferiori. Un'epidurale caudale a iniezione singola potrebbe non essere adatta a tutti i casi perché ha una distribuzione dermatomale limitata e una breve durata d'azione. Nuovi anestetici locali e adiuvanti, così come approcci con catetere continuo, possono superare queste limitazioni.
Scelta dell'ago per analgesia caudale
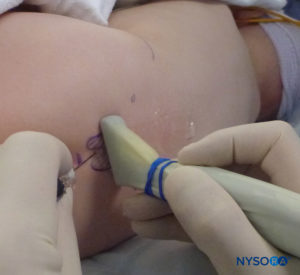
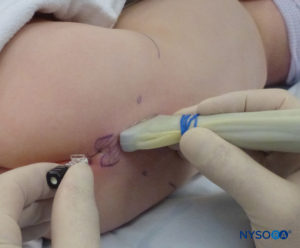
È disponibile una varietà di aghi per il blocco caudale a iniezione singola. La dimensione o il tipo di ago non sembra influenzare la percentuale di successo o l'incidenza di complicanze del blocco caudale. Gli aghi Tuohy o Crawford a smusso corto (5 cm di lunghezza) con stiletti offrono una migliore sensazione tattile quando viene perforato il legamento sacrococcigeo. Per i bambini di età pari o superiore a 1 anno viene utilizzato un ago calibro 22; per i bambini di età inferiore a 1 anno può essere utilizzato un ago calibro 25. L'uso di un ago con stiletto può ridurre il rischio di introdurre un tappo dermico nello spazio caudale, sebbene non sia stato ancora segnalato un tumore dell'innesto di cellule epidermiche nello spazio epidurale. Alcuni autori sostengono l'uso di un angiocath calibro 22, suggerendo che è più facile rilevare il posizionamento intravascolare e il posizionamento intraosseo con questo ago. L'angiocath viene utilizzato solo per il blocco caudale a iniezione singola e viene sospeso dopo la somministrazione della dose (cioè, non deve essere un catetere caudale epidurale). Per evitare il carotaggio dei tessuti con l'angiocath, l'ago deve essere rimosso prima di qualsiasi iniezione.
Tecnica per l'esecuzione di un blocco epidurale caudale a iniezione singola
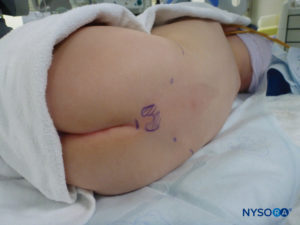
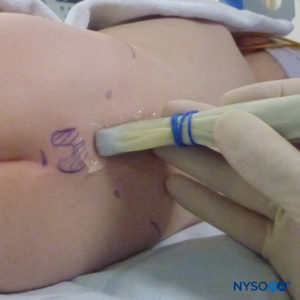
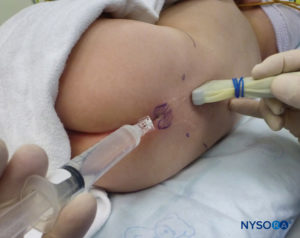
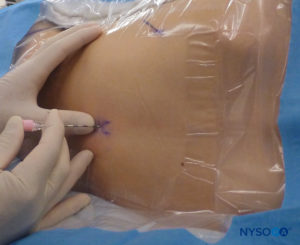
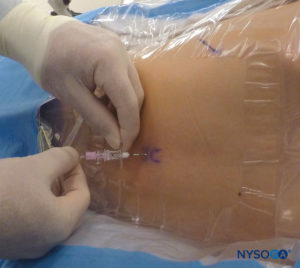
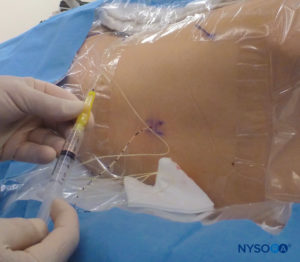
In tutti i bambini è importante garantire un'adeguata prevenzione della dispersione di calore durante la procedura. Nei neonati, si consiglia di prevenire la perdita di calore con un telo trasparente sterile in quanto ciò consentirà anche la visualizzazione della respirazione del paziente (Figure 2 ). Il paziente viene posto in posizione di decubito laterale con il collo flesso e le ginocchia tese al torace. Dopo il corretto posizionamento, i punti di riferimento per il blocco epidurale caudale (Figure 3 ) sono facilmente identificabili nei bambini: inizialmente si identifica il coccige e, continuando a palpare sulla linea mediana in modo cefalico, si può sentire la cornua sacrale su entrambi i lati della linea mediana a circa 1 cm di distanza. Lo iato sacrale è percepito come una depressione tra due protuberanze ossee della corna sacrale. In condizioni sterili, l'ago viene inserito e fatto avanzare nello iato sacrale con un angolo di circa 70 gradi rispetto alla pelle fino a quando non si avverte un caratteristico "pop" quando il legamento sacrococcigeo viene perforato. Dopo questa puntura, l'angolo dell'ago deve essere ridotto a circa 20–30 gradi mentre l'ago viene fatto avanzare di 2–4 mm nel canale caudale. Qualsiasi avanzamento oltre questo punto non è raccomandato perché il rischio di puntura durale involontaria aumenta in modo significativo. Se viene utilizzato un angiocath, il catetere di plastica deve essere fatto avanzare facilmente sopra l'ago nello spazio epidurale caudale.
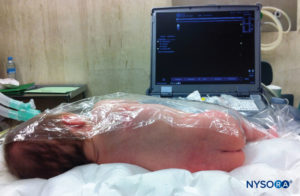
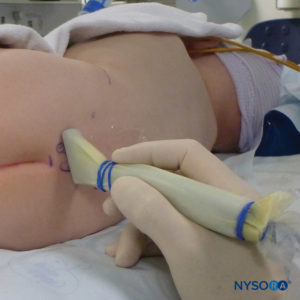
FIGURA 2. Copertura trasparente utilizzata nei neonati e nei lattanti per consentire la visualizzazione del paziente e prevenire la perdita di calore. La macchina americana è posizionata sul lato opposto.
Consigli NYSORA
È necessario prestare attenzione per garantire la prevenzione della perdita di calore durante la procedura.
L'ecografia può essere utilizzata per valutare l'anatomia caudale prima della tecnica basata sul punto di riferimento o per guidare il posizionamento dell'ago. La pre-valutazione è particolarmente utile nello screening di bambini con stigmate cutanee di disrafismo spinale. Il paziente viene posto in decubito laterale con le ginocchia flesse verso il torace. La macchina US è posizionata di fronte all'operatore in modo che possa guardare oltre le proprie mani verso lo schermo. Il paziente viene preparato e la sonda ecografica viene coperta sterile. Viene utilizzata una sonda ad alta frequenza: nei neonati viene utilizzata una sonda lineare a mazza da hockey, mentre una sonda con un'impronta ampia è preferibile nei bambini di peso superiore a 10 kg, poiché consente di acquisire più spazi intervertebrali alla volta nel piano sagittale.
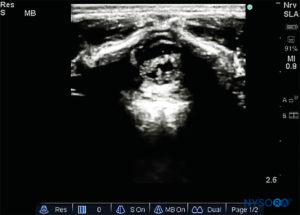
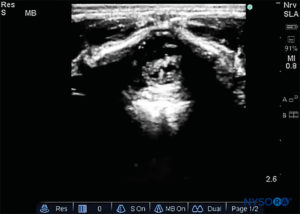
La sonda viene posizionata prima su un piano trasversale a livello dell'osso sacro; questa è chiamata vista ad asse corto (SAX). Viene definita l'esatta posizione della cornua e della membrana sacrococcigea (SCM) (Figure 4 ). Con la membrana sacrococcigea al centro dell'immagine (Figure 5 ), la sonda viene quindi ruotata di 90 gradi in una posizione sagittale della linea mediana sopra l'osso sacro inferiore, che è chiamata vista dell'asse lungo (LAX; Figure 6 ). L'SCM e lo strato ventrale e dorsale dell'osso sacro, con lo spazio epidurale caudale nel mezzo, sono facilmente identificabili. Nei bambini piccoli, il sacco durale può essere visibile in questa posizione, anche se nei bambini più grandi è necessario scansionare di più in una direzione più cefalica (Figure 7 ). Questi movimenti possono essere eseguiti nell'ordine opposto, ma si consiglia un'esplorazione completa dello spazio in entrambi gli assi.
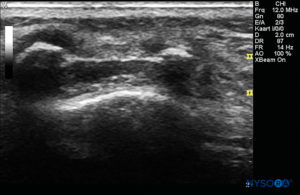
FIGURA 5. Immagine degli Stati Uniti nella vista dell'asse corto che mostra la cornea sacrale e la membrana sacrococcigea.
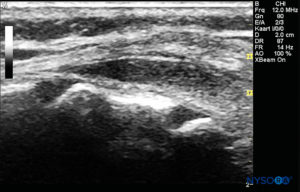
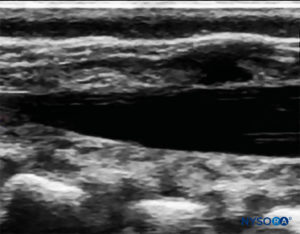
FIGURA 7. Immagine degli Stati Uniti nella vista dell'asse lungo che mostra la membrana sacrococcigea e lo spazio epidurale caudale nell'osso sacro
Dopo questa valutazione ecografica pre-procedurale dell'anatomia caudale, l'ago può essere introdotto nello iato sacrale con la sonda su entrambi gli assi. Se la sonda viene tenuta nel SAX, l'inserimento dell'ago avverrà automaticamente nell'approccio fuori piano (OOP) (Figure 8 ). Se la sonda viene tenuta nel LAX, l'inserimento dell'ago sarà quindi nell'approccio in-plane (IP) (Figure 9 ).
L'angolo di inserimento dell'ago viene annotato durante la scansione. L'ago può essere fatto avanzare di 2–4 mm nello spazio caudale e lo stiletto viene rimosso. Per garantire un posizionamento caudale ottimale dell'ago, viene somministrato un piccolo bolo di soluzione fisiologica o anestetico locale sotto guida ecografica con la sonda sulla linea mediana (LAX; Figure 10 ). La sonda è posizionata cefalica quanto necessario per visualizzare il sacco durale nello schermo US (Figure 11 ). Quando inizia l'iniezione, noterai che la dura madre viene spostata ventralmente, specialmente nei bambini più piccoli. La diffusione dell'anestetico locale può essere monitorata spostando la sonda cefalica lungo la colonna vertebrale nella linea mediana o in un asse sagittale paramediano (Figure 12 ). Lo stesso movimento della dura madre può essere visualizzato con la sonda nel SAX nelle posizioni più cefaliche (Figure 13 ed 14).
Conferma della corretta distribuzione dell'anestetico locale
Il classico "pop" sentito quando l'SCM viene perforato viene solitamente cercato per confermare il corretto posizionamento dell'ago caudale. L'assenza di rigonfiamento sottocutaneo e la mancanza di resistenza all'iniezione sono ulteriori segni del corretto posizionamento dell'ago e della distribuzione dell'anestetico locale. L'aspirazione dell'ago deve essere priva di sangue e liquido cerebrospinale e deve essere utilizzata anche una risposta negativa a una dose di prova di adrenalina per escludere il posizionamento intravascolare. L'ecografia è stata utilizzata per fornire una guida dell'ago in tempo reale nello spazio caudale e per valutare la diffusione dell'anestetico locale. Recenti studi statunitensi hanno dimostrato che il volume dell'anestetico locale non è correlato alla sua diffusione cranica durante il blocco caudale nei neonati e nei bambini. Inizialmente, si pensava che la valutazione ecografica della diffusione dell'anestetico locale fosse un predittore del dermatomo raggiunto, ma ciò si è rivelato non essere il caso poiché la maggior parte dei blocchi caudali ha successo nonostante una mancanza immediatamente monitorata di diffusione cefalica. Tuttavia, è stato riscontrato che esiste una diffusione secondaria dell'anestetico locale nello spazio epidurale. Ciò si verifica in due modelli: una ridistribuzione intrasegmentale orizzontale dallo spazio epidurale dorsale a quello ventrale e una diffusione cranica longitudinale ritardata quando la dura madre ritorna alla sua posizione originale, spingendo così la cefalea anestetica locale epidurale. Il movimento bidirezionale osservato del liquido cerebrospinale (denominato "meccanismo di rimbalzo del liquido cerebrospinale") aiuta anche a spiegare una componente della differenza tra la diffusione iniziale valutata negli Stati Uniti e l'effetto finale più cefalico determinato dai test cutanei. Sono necessari ulteriori studi con l'ecografia per determinare il modo migliore per prevedere la diffusione dell'anestetico locale.
Analgesia epidurale caudale: tecnica continua
L'analgesia epidurale caudale continua supera la durata limitata e l'effetto segmentale di una tecnica a iniezione singola. I cateteri caudali possono essere avanzati a livello lombare o toracico. La tecnica di inserimento dell'ago per l'analgesia caudale continua è molto simile all'approccio caudale a iniezione singola. Può essere fatto con un catetere IV (un angiocatetere calibro 18 per un catetere epidurale calibro 20 o un angiocatetere calibro 16 per un catetere epidurale calibro 19) o con un ago Crawford o Tuohy calibro 18 inserito attraverso la membrana sacrococcigea , come descritto per la tecnica a iniezione singola. Il catetere epidurale viene quindi fatto avanzare con cautela dallo spazio caudale al livello target. Una minore resistenza al passaggio del catetere può essere generalmente superata mediante semplice flessione o estensione della colonna vertebrale del paziente e/o iniettando contemporaneamente normale soluzione fisiologica attraverso il catetere. Alcuni autori utilizzano un catetere epidurale di stimolazione specializzato (il sistema di posizionamento epidurale che utilizza il test Tsui, Arrow International Inc., Reading, PA).
È estremamente importante sapere dove si trova finalmente la punta del catetere: un livello della punta del catetere troppo basso provocherà una scarsa analgesia; troppo alto può causare depressione respiratoria. Tuttavia, poiché i cateteri non viaggiano linearmente nello spazio epidurale, la misurazione della lunghezza del catetere contro la schiena del paziente non determina con precisione il livello chirurgico mirato. Pertanto, la posizione della punta del catetere deve essere verificata mediante un test oggettivo, come descritto nella sezione precedente (ossia, radiografia, stimolazione nervosa, elettrocardiografia o, preferibilmente, ecografia).
Queste tecniche possono essere considerate ingombranti o ridondanti e, nei bambini di età superiore a 1 anno, lo sviluppo di una curva lombare durante l'infanzia potrebbe impedire un facile avanzamento cefalico del catetere. Pertanto, alcuni hanno suggerito che il posizionamento del catetere caudale dovrebbe essere limitato ai pazienti di età inferiore a 1 anno. È opinione degli autori che, almeno nei bambini di età superiore a 1 anno, i cateteri dovrebbero essere posizionati il più vicino possibile al dermatomo chirurgico. Si raccomanda pertanto un'adeguata formazione pediatrica ed ecografica in tutti i casi e obbligatoria prima di eseguire l'epidurale lombare o toracica nei bambini piccoli.
Anestesia epidurale lombare
L'analgesia epidurale lombare è comunemente usata per le infusioni continue ed è usata raramente come tecnica a iniezione singola. Un approccio lombare diretto è indicato principalmente per il controllo del dolore durante e dopo un intervento chirurgico agli arti inferiori. Il posizionamento dell'epidurale lombare, in particolare nei bambini piccoli, viene eseguito dopo l'induzione dell'anestesia generale. Tuttavia, questo approccio può essere eseguito anche da svegli in un gruppo selezionato di bambini e adolescenti cooperativi. Si deve prestare attenzione ogni volta che si esegue l'analgesia epidurale lombare al di sopra del livello dell'estremità del midollo spinale per evitare traumi diretti con l'ago.
È preferibile un approccio della linea mediana al posizionamento dell'ago epidurale lombare. L'identificazione dello spazio epidurale è comunemente ottenuta mediante perdita di resistenza (LOR) alla soluzione salina. LOR all'aria dovrebbe essere evitato a causa del rischio di introdurre un'embolia gassosa venosa, in particolare nei neonati e nei lattanti. I bambini devono essere posizionati in posizione di decubito laterale per il posizionamento diretto dell'epidurale lombare. Nei bambini di età superiore a 1 anno viene spesso utilizzato un ago Tuohy calibro 18, 5 cm, segnato ogni 0.5 cm, con un catetere epidurale calibro 20. Nei bambini di età inferiore a 1 anno, deve essere preso in considerazione un ago di Tuohy calibro 20, 5 cm, segnato ogni 0.5 cm, con un catetere calibro 22. Tuttavia, questi cateteri più stretti si attorcigliano, si occludono e perdono più spesso. Sebbene l'identificazione dello spazio intervertebrale e del legamento flavum nella maggior parte dei pazienti pediatrici sia facile, il ligamentum flavum può essere meno teso nei bambini; quindi un caratteristico "pop" potrebbe non essere facilmente percepito quando si penetra in questo strato. Inoltre, la distanza dalla pelle allo spazio epidurale può essere molto superficiale. Sono state proposte formule per stimare la distanza dalla pelle allo spazio epidurale (vedi Tabella 1). Tuttavia, le formule sono solo una linea guida e cambiano in base all'angolo di posizionamento dell'ago epidurale. Oggi, il miglior metodo disponibile per valutare la profondità epidurale è l'imaging ecografico. Con la sonda in un piano sagittale obliquo paramediano, la distanza dalla pelle al legamento flavum viene misurata con il calibro della macchina US. Questa misurazione fornisce una buona stima della profondità alla quale il LOR verrà percepito. Pertanto, è altamente raccomandata una valutazione ecografica pre-procedurale di ogni singolo paziente.
Per una descrizione esatta della tecnica epidurale lombare, vedere "Anestesia epidurale toracica" di seguito (le figure illustrano un posizionamento epidurale toracico).
Approccio epidurale lombare-toracico
I cateteri posizionati attraverso la via lombare possono essere cefalea avanzata ai livelli vertebrali toracici. Analogamente ai problemi riscontrati durante l'avanzamento dei cateteri nello spazio caudale nei bambini più grandi, una resistenza significativa impedisce anche il facile avanzamento dei cateteri epidurali lombari ai livelli toracici. Nonostante i risultati favorevoli utilizzando la stimolazione tramite un approccio caudale, solo un caso clinico ha dimostrato il posizionamento riuscito di un catetere epidurale toracico attraverso la via lombare con guida di stimolazione epidurale. Pertanto, gli autori raccomandano di posizionare il catetere il più vicino possibile al sito chirurgico.
Analgesia epidurale toracica
Esiste una controversia sulla sicurezza del posizionamento dell'epidurale toracica sotto pesante sedazione o anestesia generale, perché i pazienti incoscienti non sono in grado di segnalare sintomi che potrebbero avvisare l'anestesista di potenziali complicazioni neurologiche Il trauma diretto dell'ago al midollo spinale durante l'inserimento dell'epidurale è raro ma può causare complicazioni devastanti . I rapporti hanno casi dettagliati di trauma da ago diretto al midollo spinale durante il posizionamento epidurale in pazienti sia svegli che anestetizzati. Per la chirurgia toracica, il catetere deve essere introdotto il più vicino possibile al livello dermatomico dell'incisione.
L'avanzamento dei cateteri dagli spazi epidurali lombare e caudale al livello toracico è un'alternativa solo nei bambini fino a 1 anno di età. Tuttavia, l'avanzamento dei cateteri nello spazio epidurale diventa sempre più difficile con l'avanzare dell'età a causa dello sviluppo della curvatura lombare.
Il posizionamento diretto dei cateteri epidurali toracici è più comune nei centri di assistenza terziaria, dove anestesisti pediatrici ben addestrati eseguono i blocchi sui bambini sottoposti a interventi chirurgici importanti. L'imaging ecografico preprocedurale è fortemente raccomandato. Inoltre, gli autori ritengono che la formazione in epidurale toracica assistita dagli Stati Uniti dovrebbe essere fornita agli anestesisti disposti a eseguire l'epidurale toracica nei bambini.
Consigli NYSORA
- I bambini richiedono un volume (dose) di anestetico locale significativamente più alto rispetto agli adulti per ottenere la stessa diffusione dermatomatica.
- L'avanzamento previsto del catetere toracico alto da un sito di inserimento lombare raramente ha successo.
- L'inserimento del catetere epidurale toracico deve essere eseguito solo da professionisti esperti nella tecnica dell'epidurale toracica pediatrica.
- L'inserimento dell'ago epidurale nei pazienti pediatrici può essere eseguito in qualsiasi interspazio toracico utilizzando un approccio della linea mediana o paramediano; tuttavia, è spesso preferito un approccio della linea mediana.
Analgesia epidurale toracica: approccio della linea mediana
L'uso dell'approccio della linea mediana offre il vantaggio di essere simile all'approccio lombare (con l'ago angolato su un solo piano). Utilizzando l'approccio della linea mediana, l'inserimento dell'ago è più facile a livello toracico inferiore (T10–T12) che a livello mediotoracico (T4–T7). Il bordo inferiore della scapola, che è all'altezza della settima vertebra toracica, è comunemente usato come punto di riferimento anatomico. Il paziente viene posto in posizione di decubito laterale e si presta attenzione per evitare la perdita di calore. Una valutazione dell'anatomia del paziente può essere eseguita in una configurazione non sterile prima dell'esecuzione del blocco; questo è utile anche per scopi didattici.
Il processo spinoso del livello vertebrale mirato dovrebbe essere identificato contando dalla linea di Tuffier e contando alla rovescia dalla vertebra cervicale C7 più prominente (Figure 15 ). L'imaging ecografico preprocedurale viene eseguito con la sonda su tre piani: trasversale (SAX), sagittale mediano (LAX mediano) e sagittale obliquo paramediano (LAX obliquo paramediano). In questo modo è possibile misurare la distanza dalla pelle del paziente allo spazio epidurale. Nel SAX (Figure 16 ), deve essere trovata la finestra tra due processi spinosi e il complesso anteriore della colonna vertebrale (legamento longitudinale posteriore, dura anteriore e corpo vertebrale) nella profondità dell'immagine saranno le prime strutture ad essere identificate. Il complesso posteriore (ligamentum flavum e dura posteriore) può essere più difficile da visualizzare ma sarà approssimativamente a livello della lamina (Figure 17 ).
FIGURA 15. Analgesia epidurale toracica: posizionamento del paziente e punti di riferimento per un approccio della linea mediana.
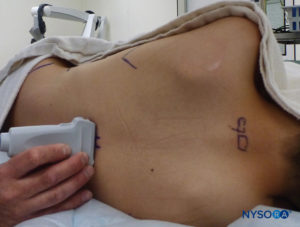
FIGURA 16. Scansione pre-procedurale con configurazione non sterile per scopi didattici; la sonda US è nella vista dell'asse corto.
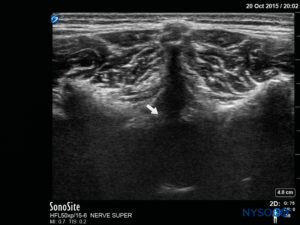
FIGURA 17. Immagine degli Stati Uniti nella vista dell'asse corto, che mostra il complesso posteriore con la dura (freccia bianca).
Se il paziente è un neonato e le strutture ossee della colonna vertebrale non sono ancora completamente ossificate, un LAX mediano (Figure 18 ) fornisce immagini chiare e reali dell'anatomia coinvolta. Con questa posizione della sonda, il processo spinoso nell'immagine raggiungerà quasi la pelle (o la parte superiore dello schermo US). Tra il processo spinoso, la dura madre sarà vista come un doppio strato bianco; si trova un po' meno profondo del livello in cui si trova il complesso posteriore nel SAX (Figure 19 ).Nell'obliquo paramediano LAX (Figure 20 ), è possibile visualizzare il processo trasversale e/o la lamina, a seconda di quanto è posizionata lateralmente e obliquamente la sonda. Il complesso anteriore è di nuovo facilmente visualizzabile e la maggior parte delle volte la pia madre può essere vista nei bambini piccoli. Nell'immagine si possono trovare le caratteristiche "teste di cavallo" e nel mezzo si vedrà la dura madre, a un livello più profondo (Figure 21 ). La profondità della dura madre sarà più o meno uguale, come nelle posizioni SAX e LAX mediana.
FIGURA 18. Scansione pre-procedurale con configurazione non sterile per scopi didattici; la sonda US si trova nella vista mediana dell'asse lungo. La sonda deve essere esattamente sulla linea mediana, ma in questa foto è stata posizionata nella vista paramediana dell'asse lungo per vedere la direzione.
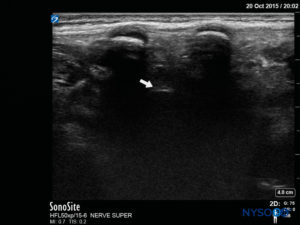
FIGURA 19. Immagine degli Stati Uniti nella vista dell'asse lungo mediano, che mostra la dura (freccia bianca).
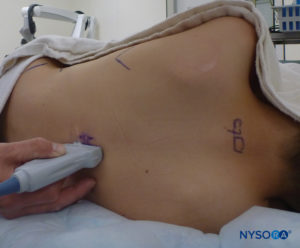
FIGURA 20. Scansione pre-procedurale con configurazione non sterile per scopi didattici; la sonda US si trova nella vista dell'asse lungo obliquo paramediano. L'inclinazione della sonda può essere paragonata a quella mostrata in Figure 16 .
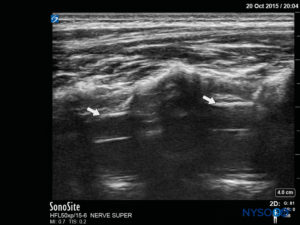
FIGURA 21. Immagine degli Stati Uniti nella vista dell'asse lungo obliquo paramediano, che mostra il complesso posteriore con la dura (frecce bianche).
Dopo l'imaging preprocedurale per misurare la profondità alla quale verrà raggiunto lo spazio epidurale, la pelle del bambino viene preparata e drappeggiata (Figure 22 ). Un ago epidurale Tuohy calibro 18, lungo 5 cm, con segni ogni 0.5 cm, viene quindi inserito nell'intercapedine con un angolo cefalico di circa 70 gradi rispetto all'asse longitudinale della colonna vertebrale. Una manovra utile è quella di inserire l'ago con un angolo simile a quello con cui si teneva la sonda ecografica quando si misurava la distanza verso lo spazio epidurale (Figure 23 ). Si dovrebbe avvertire una resistenza continua quando l'ago viene inserito attraverso i legamenti sopraspinali e interspinali. Quando si raggiunge il legamento interspinoso, lo stiletto viene rimosso e una siringa LOR riempita di soluzione fisiologica viene collegata all'ago. Viene esercitata una pressione continua sullo stantuffo quando l'ago è più avanzato (Figure 24 ). Nei bambini più grandi, inizialmente si avverte un aumento della resistenza quando si entra nel legamento flavum, appena prima che si avverta il LOR. Tuttavia, nei bambini più piccoli, la resistenza incontrata a livello del legamento flavum potrebbe non essere notevolmente diversa da quella degli altri legamenti.
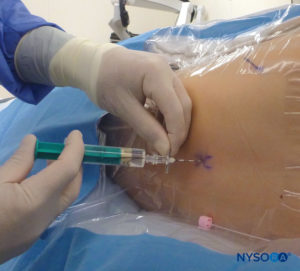
FIGURA 24. Avanzamento dell'ago con pressione continua esercitata sullo stantuffo con la mano destra mentre la mano sinistra fa avanzare l'ago.
L'ago non deve essere inserito a una profondità maggiore della profondità pre-procedurale dello spazio epidurale stimata dagli ecografi. Lo spazio epidurale toracico è identificato con LOR a salino; l'aria non è raccomandata nei bambini. La siringa viene quindi rimossa e, dopo aver escluso la puntura durale, viene inserito il catetere (Figure 25 ). La lunghezza del catetere inserito dovrebbe essere solo di circa 2 cm oltre la punta dell'ago se la puntura epidurale è stata eseguita al livello appropriato. Se la puntura è stata eseguita un livello più in basso, il catetere può essere inserito fino a 3-4 cm, ma bisogna tenere presente che nei bambini piccoli pochi centimetri possono rappresentare più segmenti vertebrali.
Dopo aver estratto l'ago e aver verificato che una lunghezza adeguata del catetere sia mantenuta in posizione, il connettore viene fissato al catetere. A questo punto, è imperativo controllare la caduta del menisco ed eseguire un'aspirazione lenta e attenta attraverso il catetere per verificare la presenza di sangue o liquido cerebrospinale (Figure 26 ). Il filtro viene quindi collegato e possono essere somministrate dosi incrementali di anestetico locale con la diffusione valutata mediante imaging ecografico.
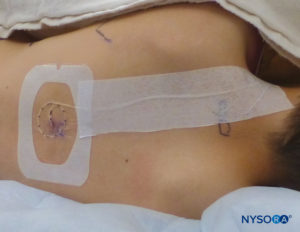
Si consiglia di eseguire il tunneling del catetere o di utilizzare una benda liquida o l'adesivo cutaneo topico Histoacryl per chiudere il foro di ingresso per evitare perdite. È importante prevenire la fuoriuscita di anestetico locale nei pazienti pediatrici, poiché la fuoriuscita di anestetico può consistere in una percentuale significativa del farmaco totale somministrato. Perdite sotto il dispositivo di fissaggio o Tegaderm possono presentare un problema per la fissazione del catetere stesso. Si raccomanda un dispositivo di fissazione epidurale trasparente per consentire l'osservazione di eventuali perdite di anestetico locale o segni di infezione (Figure 27 ).
Consigli NYSORA
- Esistono varie formule per calcolare il volume di anestetico locale necessario per bloccare un dato numero di segmenti.
- Per stabilire il blocco viene somministrato un bolo di 1.0 mg/kg di bupivacaina allo 0.25% o ropivacaina allo 0.2%.
- Nei bambini in età prescolare e soprattutto nei neonati, possono verificarsi irritabilità o agitazione nonostante un'analgesia epidurale apparentemente ben funzionante. Questo è molto probabilmente il risultato della linea IV, del sondino nasogastrico, del catetere urinario o dell'ambiente ospedaliero.
- Una sedazione soddisfacente può essere ottenuta con uno dei seguenti:
– boli EV di morfina 25 mcg/kg secondo necessità, oppure
– Aggiunta di clonidina 0.5 mcg/mL alla miscela epidurale
GESTIONE DELL'INFUSIONE EPIDURALE POSTOPERATORIA
Per un'analgesia epidurale efficace e sicura, si consiglia un approccio sistematico e basato su protocolli alla cura del paziente. Un team dedicato al dolore acuto pediatrico, composto da anestesisti e infermieri, è fondamentale per garantire valutazioni standardizzate del dolore, un attento monitoraggio del paziente e il corretto trattamento degli effetti avversi. Il posizionamento preciso di aghi e cateteri epidurali è la chiave per un'analgesia epidurale di successo. Ciò richiede l'uso di un metodo affidabile per confermare la posizione della punta del catetere (es. ecografia, stimolazione epidurale). La durata media dell'infusione epidurale è di circa 72 ore, anche se può essere necessario continuare l'infusione per periodi più lunghi, soprattutto nei bambini con anamnesi complicata o con necessità prolungata di analgesia. Nei neonati, la durata dell'infusione epidurale deve essere limitata a 48 ore a causa del rischio di tossicità sistemica. Un team di personale dedicato con un focus sulla gestione del dolore dovrebbe prendersi cura di questi pazienti. Quando sono in atto piani per interrompere l'infusione epidurale, si dovrebbe prendere in considerazione un oppioide per consentire un'adeguata analgesia. Infine, il successo del processo si basa su ordini scritti correttamente, una parte cruciale dell'esecuzione di un'analgesia adeguata.
Consigli NYSORA
Per l'analgesia postoperatoria, la bupivacaina 0.125% o la ropivacaina 0.1–0.2%, con o senza fentanil 1–2 mcg/mL, vengono somministrate alle seguenti velocità:
- Età > 3 mesi: 0.20–0.35 ml/kg/ora (< 0.4 mg/kg/ora bupivacaina)
- Età < 3 mesi: 0.1–0.15 ml/kg/ora (< 0.2 mg/kg/ora bupivacaina)
ANESTESIA SPINALE NEI BAMBINI
INTRODUZIONE
L'anestesia spinale è forse una delle modalità più antiche e studiate per fornire sollievo dal dolore nei pazienti sottoposti a intervento chirurgico. J. Leonard Corning è accreditato di aver somministrato il primo anestetico spinale nel 1885 e la sua esperienza è stata successivamente pubblicata in una rivista medica. Sebbene l'uso dell'anestesia intratecale nei bambini sia stato descritto all'inizio del XX secolo, questa tecnica è stata utilizzata raramente nella popolazione pediatrica fino a quando Melman non ha riportato una serie di bambini ad alto rischio che sono stati sottoposti con successo a un intervento chirurgico in anestesia spinale. Rapporti di apnea dopo anestesia generale in neonati pretermine sono apparsi in letteratura all'inizio degli anni '1980 e una serie di Abajian et al. ha offerto ai professionisti uno slancio per offrire una tecnica alternativa con meno complicazioni rispetto all'anestesia generale. Da allora sono state riportate numerose serie in tutte le fasce di età per una varietà di procedure chirurgiche che attestano la sicurezza e l'efficacia dell'anestesia spinale.
TABELLA 6. Differenze anatomiche tra adulti e bambini nel canale spinale.
| Il cono midollare termina a L2–L3 nei neonati rispetto a L1 negli adulti. |
| I neonati hanno una piccola pelvi e l'osso sacro inizia più cefalea che negli adulti. |
| Il sacco durale termina più caudad nei neonati rispetto agli adulti. |
ANATOMIA
Comprendere le differenze anatomiche tra adulti e neonati è fondamentale per somministrare in sicurezza l'anestesia spinale nei bambini in modo tecnicamente competente (Tabella 6). Il midollo spinale termina a livello molto più caudale nei neonati e nei lattanti rispetto agli adulti. Il cono midollare termina approssimativamente a L1 negli adulti e al livello L2 o L3 nei neonati e nei lattanti. Per evitare potenziali lesioni al midollo spinale, la puntura durale deve essere eseguita al di sotto del livello del midollo spinale; cioè, al di sotto di L2–L3 nei neonati e nei lattanti. Negli adulti, l'anestesia spinale viene spesso eseguita nell'interspazio più vicino a una linea immaginaria che si estende attraverso la sommità delle creste iliache, la linea intercristale o di Tuffier, corrispondente all'interspazio L3–L4. Tuttavia, neonati e bambini hanno un bacino proporzionalmente più piccolo rispetto agli adulti e l'osso sacro si trova più cefalica rispetto alle creste iliache. Pertanto, la linea di Tuffier attraversa la linea mediana della colonna vertebrale nell'interspazio L4–L5 o L5–S1, ben al di sotto della terminazione del midollo spinale, rendendo questo punto di riferimento applicabile a tutti i pazienti pediatrici. Anche il sacco durale nei neonati e nei lattanti termina in una posizione più caudale rispetto a quella degli adulti, di solito a circa il livello di S3 rispetto al livello adulto di S1. La terminazione più caudale del sacco durale rende più probabile una puntura durale involontaria durante l'esecuzione di un blocco caudale a iniezione singola se l'ago è avanzato troppo nello spazio epidurale.
Il volume del liquido cerebrospinale è maggiore su base millilitro per chilogrammo nei neonati e nei neonati (4 ml/kg) rispetto agli adulti (2 ml/kg). Inoltre, il liquido cerebrospinale nei neonati è distribuito relativamente più nel canale spinale che nella testa, contrariamente alla distribuzione negli adulti. Ciò può, in parte, spiegare la maggiore richiesta di dose di anestetico locale e la minore durata d'azione dell'anestesia spinale nei neonati. L'elevata gittata cardiaca caratteristica della popolazione pediatrica riduce ulteriormente la durata dei blocchi spinali nei bambini.
ANESTETICI LOCALI
In letteratura sono stati descritti vari anestetici locali e dosi, tra cui bupivacaina86 e ropivacaina. La bupivacaina 0.5%, 0.5-1 mg/kg, è generalmente utilizzata per l'anestesia spinale nei bambini di peso inferiore a 10 kg. Per i bambini più piccoli è preferita una dose verso l'estremità più alta dell'intervallo; il rischio di anestesia spinale totale è basso fintanto che la procedura viene eseguita diligentemente (Tabella 7). Si preferisce un "lavaggio con epinefrina" della siringa, piuttosto che una dose standard di epinefrina. Una soluzione di bupivacaina iperbarica con glucosio 8% fornisce un blocco di qualità e durata simile a bupivacaina isobarica con glucosio 0.9%.
Sono stati descritti anche adiuvanti agli anestetici locali nei blocchi spinali. È stato dimostrato che la clonidina in una dose di 1 mcg/kg in aggiunta alla bupivacaina (1 mg/kg) utilizzata nell'anestesia spinale per i neonati prolunga la durata del blocco fino a quasi il doppio della durata dell'anestesia spinale senza clonidina. Tuttavia, l'uso di 2 mcg/kg di clonidina può causare una transitoria diminuzione della pressione sanguigna e una maggiore sedazione postoperatoria. Può essere consigliabile utilizzare una dose di caffeina di 10 mg/kg per via endovenosa per prevenire una potenziale apnea postoperatoria, soprattutto se la clonidina viene utilizzata nella soluzione di anestetico spinale.
Nei casi di riparazione dell'ernia bilaterale negli ex neonati prematuri, il blocco spinale può essere integrato con un blocco caudale. Il paziente viene girato sul lato dell'ernia più grande mentre viene eseguito il blocco; un'iniezione spinale di 0.8 mg/kg di bupivacaina è seguita immediatamente da un'iniezione caudale di bupivacaina allo 0.1%. Questa tecnica prolunga la durata dell'anestesia e dell'analgesia. In alternativa, una soluzione ipobarica di anestetico locale può essere iniettata con il lato operatorio rivolto verso l'alto.
TABELLA 7. Dosaggio dell'anestesia spinale nei bambini.
| Soluzione anestetica locale: ropivacaina o bupivacaina 0.5% 0.5–1 mg/kg. | ||
| Un modo semplice per calcolare la dose per una singola riparazione dell'ernia nei neonati è il seguente: | ||
| Età (mesi) | Peso (kg) | Dose di bupivacaina 0.5% |
| 1 | 3 | 1 mg / kg |
| 2 | 4 | 0.8 mg / kg |
| 3 | 5 | 0.6 mg / kg |
| > 4 | 6 | 0.4 mg / kg |
| Possibili additivi: • Lavaggio con adrenalina • Clonidina 1 mcg/kg • Morfina 10 mcg/kg solo per cardiochirurgia per facilitare l'estubazione precoce) |
||
EFFETTI COLLATERALI
Gli effetti avversi dell'anestesia spinale comunemente osservati negli adulti sono meno comuni nei bambini. Questi includono ipotensione, bradicardia, PDPH e sintomi radicolari transitori.
L'ipotensione e la bradicardia sono rare nei bambini nonostante gli alti livelli di blocco richiesti. Il carico di liquidi per aumentare il precarico è raramente necessario nei bambini ma, se necessario, può essere eseguito a una velocità di 10 ml/kg. Sebbene alcuni autori ottengano l'accesso venoso agli arti inferiori del paziente dopo l'esecuzione del blocco spinale (posizionamento indolore del catetere IV), si consiglia di ottenere l'accesso venoso prima di eseguire il blocco spinale. Pucuh et al. hanno riportato la loro esperienza con 1132 anestetici spinali consecutivi in cui l'ipotensione è stata segnalata raramente: solo una lieve diminuzione della pressione sanguigna è stata segnalata in 9 su 942 pazienti di età inferiore a 10 anni e in 8 su 190 pazienti di età superiore a 10 anni.
L'incidenza di PDPH è inferiore nei bambini rispetto agli adulti. Tuttavia, è stata riportata un'incidenza dell'8% nei pazienti oncologici dopo frequenti punture lombari per prelievo lombare. L'uso di diversi tipi di aghi spinali è stato studiato in questo sottogruppo di pazienti, ma non è stata riscontrata alcuna differenza nell'incidenza del mal di testa (15% Quincke; 9% Whitacre a punta di matita; p = 0.43). Inoltre, l'incidenza del mal di testa non era diversa per fascia di età, con 8 PDPH su 11 che si verificavano in bambini di età inferiore a 10 anni e il più giovane riportato in un bambino di 23 mesi. I PDPH sono stati trattati con riposo a letto e caffeina negli adulti, ma sono seguiti da un cerotto sanguigno se il mal di testa non si risolve. Nei bambini non è nota una dose ottimale di caffeina e viene eseguito un cerotto epidurale con 0.3 ml/kg di sangue quando il mal di testa persiste. Nei bambini sono stati segnalati sintomi radicolari transitori ma senza effetti avversi a lungo termine.
RELATIVE CONTROINDICAZIONI
La principale controindicazione per una tecnica spinale in un bambino non sedato è una durata dell'intervento di oltre 60 minuti. L'anestesia spinale deve essere evitata nei neonati e nei bambini che potrebbero avere un aumento della pressione intracranica. Nei bambini con malattie neuromuscolari, shunt ventricolari (atriali o peritoneali) e convulsioni scarsamente controllate, l'uso dell'anestesia spinale è controverso. Altre controindicazioni all'anestesia spinale sono simili a quelle nella popolazione adulta e comprendono gravi deformità anatomiche, infezioni sistemiche o al sito della puntura, coagulopatia sottostante e instabilità emodinamica (Tabella 8).
Quando si considera l'anestesia spinale, è necessario prestare particolare attenzione ai bambini con una nota difficoltà delle vie aeree. Sebbene l'anestesia spinale possa essere una scelta ragionevole in questi pazienti, la prima considerazione dovrebbe essere la capacità del medico di gestire le vie aeree. La necessità di sedazione EV nei bambini in età prescolare e scolare pone una serie di rischi nei pazienti pediatrici con vie aeree difficili. Anche il sito chirurgico, la durata prevista della procedura e la posizione chirurgica (cioè supina, laterale o prona) sono fattori importanti da considerare.
TABELLA 8. Controindicazioni relative all'anestesia spinale nei bambini.
| Anomalie anatomiche della colonna vertebrale |
| Malattia neuromuscolare degenerativa |
| Paziente e dissenso familiare |
| Coagulopatia |
| Infezione batterica |
| Aumento della pressione intracranica |
| Shunt ventricolo-peritoneali |
Consigli NYSORA
Considerazioni speciali per neonati e bambini sottoposti ad anestesia spinale includono quanto segue:
- L'esperienza del fornitore di anestesia
- La motivazione del chirurgo
- La durata stimata dell'intervento è inferiore a 90 minuti
ANESTESIA SPINALE PER PAZIENTI PEDIATRICI: TECNICA
PREPARAZIONE
Una miscela eutettica di crema di anestetico locale (EMLA) o LMX (crema di lidocaina al 4%) può essere applicata al sito di inserimento, sebbene il rischio di metaemoglobinemia debba essere preso in considerazione nei neonati prematuri molto piccoli. La sala operatoria deve essere riscaldata prima di portare il paziente nella stanza. Le coperte calde e le lampade riscaldanti radianti aiutano a ridurre la perdita di calore nei bambini. Con i bambini più grandi, la stanza dovrebbe essere silenziosa e, se possibile, gli strumenti chirurgici coperti per ridurre al minimo l'ansia del paziente. Le sale operatorie pediatriche possono essere dotate di apparecchiature stereo o video, che possono essere utilizzate per distrarre i bambini più grandi se il blocco viene eseguito senza sedazione. I dispositivi di monitoraggio standard (pulsossimetro, elettrocardiogramma e bracciale per la pressione sanguigna) devono essere applicati prima di eseguire il blocco.
Deve essere predisposto un piano per quanto riguarda l'uso concomitante di sedazione EV o anestesia generale per inalazione. L'approccio dovrebbe essere dettato dalle condizioni mediche e dall'età del paziente, dal livello di comfort dell'operatore dell'anestesia e dalla natura e dalla durata prevista della procedura chirurgica. L'anestesia generale può predisporre i neonati molto pretermine all'apnea e alla bradicardia. L'anestesia spinale nei neonati non dura più di 90 minuti a causa delle loro caratteristiche fisiologiche. Pertanto, negli ex neonati pretermine sottoposti a procedure addominali inferiori di durata inferiore a 90 minuti, può essere eseguita l'anestesia spinale senza sedazione adiuvante. Tuttavia, a volte può essere necessario un breve periodo di anestesia generale per inalazione o sedazione EV supplementare durante l'esecuzione del blocco, soprattutto se non è stata utilizzata la crema EMLA. I bambini più grandi possono richiedere una sedazione supplementare o una leggera anestesia generale prima di eseguire il blocco. In alcuni casi, l'anestesia spinale può essere combinata con l'anestesia caudale o epidurale per prolungare l'analgesia.
Posizione del paziente
L'anestesia spinale viene solitamente somministrata in posizione laterale o seduta nei bambini. Se si preferisce la posizione laterale, il paziente viene posizionato sul bordo estremo del tavolo operatorio e tenuto saldamente da un assistente. In caso contrario, il paziente può essere posizionato al centro del tavolo operatorio ma sopra diverse coperte; questi daranno l'altezza necessaria per posizionare comodamente le mani dell'anestesista durante l'esecuzione del blocco (Figure 28 ). Se si preferisce la posizione seduta, è necessario prestare particolare attenzione nei bambini per assicurarsi che il collo non sia flesso, poiché ciò potrebbe causare ostruzione delle vie aeree (Figure 29 ). È essenziale monitorare attentamente la saturazione di ossigeno nei bambini durante l'esecuzione della colonna vertebrale per garantire l'adeguatezza e la pervietà delle vie aeree. Inoltre, la flessione del collo non è necessaria perché non facilita l'esecuzione del blocco nei bambini piccoli. Nei bambini più grandi dovrebbe essere presente un assistente per mantenere il posizionamento corretto e per rassicurare e distrarre il bambino mentre viene eseguito il blocco. L'uso di un ciuccio, mentre il blocco viene eseguito in un bambino non sedato, di solito è utile.
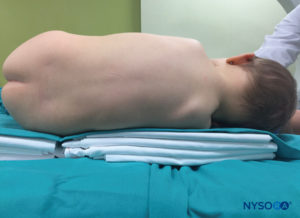
FIGURA 28. Anestesia spinale in posizione laterale. Il bambino viene posizionato sopra diverse coperte per guadagnare altezza per le mani dell'anestesista durante l'esecuzione del blocco.
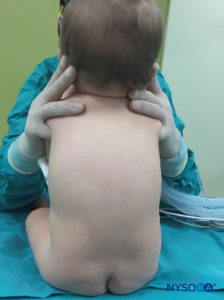
FIGURA 29. Anestesia spinale in posizione seduta. La flessione della testa deve essere evitata per prevenire l'ostruzione delle vie aeree.
Tecnica
Nei neonati, dovrebbe essere identificato l'interspazio L4–L5 o L5–S1; l'interspazio L3–L4 può essere utilizzato nei bambini più grandi. L'area deve essere preparata e drappeggiata in modo sterile. Se la crema anestetica topica non è stata applicata prima dell'intervento, l'anestesia locale deve essere somministrata prima del blocco in pazienti svegli o leggermente sedati. La dose desiderata di anestetico locale spinale deve essere calcolata e preparata in una siringa prima della puntura durale per garantire che venga somministrata la dose corretta. Poiché il volume di anestetico locale necessario nei neonati può essere piccolo, è importante misurare il volume corrispondente al centro dell'ago e contare anche questo volume nella dose totale di anestetico locale. Una siringa da insulina è utile per misurare con precisione la dose esatta. Viene spesso utilizzato un ago spinale corto, calibro 22 o 25 (Figure 30 ). Un approccio della linea mediana è generalmente raccomandato rispetto a un approccio paramediano. Il ligamentum flavum è molto morbido nei bambini e un caratteristico "pop" potrebbe non essere percepito quando viene penetrata la dura madre (Figure 31 ). Una volta che il liquido cerebrospinale esce dall'ago, i farmaci possono essere somministrati e, soprattutto, devono essere iniettati lentamente (Figure 32 ).
FIGURA 30. Apparecchiature utilizzate per l'anestesia spinale nei neonati: ago spinale e siringa con anestetico locale.
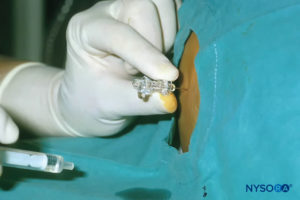
FIGURA 32. Anestesia spinale: il liquido cerebrospinale esce dall'ago e viene iniettato anestetico locale.
Il metodo del barbotaggio non è raccomandato, poiché può causare livelli inaccettabilmente elevati di blocco motorio e ha un potenziale blocco spinale totale. Gli arti inferiori del paziente non devono essere sollevati per il posizionamento dell'elettrodo di ritorno dell'elettrocauterizzazione sulla schiena del bambino, poiché l'anestesia spinale totale può derivare dalla diffusione dell'anestetico locale a un livello spinale più alto. Per prolungare la durata dell'anestesia chirurgica in caso di riparazione dell'ernia bilaterale, l'anestesia spinale può essere integrata con un blocco caudale.
Valutazione del blocco
La valutazione del livello di blocco può rivelarsi difficile nei neonati e nei bambini piccoli, in particolare nei pazienti che hanno ricevuto sedazione o in quelli in cui il blocco viene eseguito in anestesia generale. Nei neonati può essere utilizzata la puntura di spillo o la risposta a stimoli freddi (p. es., un tampone imbevuto di alcol), così come l'osservazione della velocità e del pattern di ventilazione. Nei bambini di età superiore ai 2 anni viene utilizzata la scala Bromage. Dopo il blocco occorre prestare attenzione per evitare di posizionare il paziente in posizione Trendelenburg o di sollevare gli arti inferiori; ad esempio, per posizionare un tampone per elettrocauterizzazione sulla schiena del bambino. In caso di un livello di blocco in rapido aumento, il paziente può essere posizionato nella posizione di Trendelenburg inversa.
Consigli NYSORA
Valutazione dell'anestesia spinale: la scala di bromage
- Nessun blocco: è possibile il libero movimento di ginocchia e piedi
- Blocco parziale: in grado di flettere solo le ginocchia ma è ancora possibile il libero movimento dei piedi
- Blocco quasi completo: impossibile flettere le ginocchia ma è ancora possibile la flessione dei piedi
- Completo: Impossibile muovere gambe o piedi
USI CLINICI
Apnea ed ex neonati pretermine
L'indicazione più comune per l'anestesia spinale nei pazienti pediatrici è nei neonati prematuri sottoposti a riparazione unilaterale dell'ernia inguinale (Tabella 9). L'apnea può verificarsi negli ex pazienti pretermine dopo un'anestesia generale. L'anestesia regionale può diminuire, se non eliminare, il rischio di apnea postoperatoria e sicuramente diminuisce il rischio di desaturazione e bradicardia.
TABELLA 9. Indicazioni per l'anestesia spinale nei bambini.
| Riparazione dell'ernia inguinale |
| Riparazione del mielomeningocele |
| Chirurgia degli arti inferiori e dell'addome inferiore |
| Estubazione precoce desiderata dopo un intervento di cardiochirurgia |
Tuttavia, vi è un notevole disaccordo riguardo all'incidenza dell'apnea e all'età concettuale in cui un ex neonato pretermine può sottoporsi in sicurezza all'anestesia generale in regime ambulatoriale. La mancanza di uniformità nel disegno dello studio, le dimensioni ridotte della popolazione di pazienti e le variazioni nella metodologia probabilmente spiegano le differenze rilevate. Cote al. ha eseguito una meta-analisi di otto studi, comprendenti 255 pazienti, che hanno esaminato l'apnea postoperatoria negli ex neonati pretermine dopo anestesia generale. Nel complesso, il rischio era correlato indipendentemente sia all'età gestazionale che all'età concettuale. Ulteriori fattori di rischio per l'apnea postoperatoria erano un ematocrito inferiore al 30% e episodi di apnea continua a casa. Lo studio ha stratificato i bambini in due gruppi: un gruppo a rischio del 5% e un gruppo a rischio dell'1%. Per i pazienti con un'età gestazionale di 35 settimane, il rischio di apnea post-operatoria non è sceso al di sotto del 5% (con un intervallo di confidenza statistico del 95%) fino a quando i pazienti non hanno raggiunto un'età post-concettuale di 48 settimane e non è sceso al di sotto dell'1% fino al neonato raggiunto un'età post-concettuale di 54 settimane. In pazienti più pretermine, come quelli con un'età gestazionale di 32 settimane, il rischio di apnea non è sceso al di sotto dell'1% (con un intervallo di confidenza statistica del 95%) fino a quando i bambini non hanno raggiunto un'età post-concettuale di 56 settimane.
È stato anche riportato che l'uso concomitante di ketamina come sedativo negli ex neonati pretermine aumenta l'incidenza di apnea postoperatoria rispetto a quella riportata nei pazienti di controllo. Tuttavia, questi sono tutti studi un po' più vecchi. Nel frattempo, ci sono stati progressi sostanziali nella gestione ventilatoria dei neonati prematuri e dei lattanti, rendendo il rischio di apnea controverso al giorno d'oggi. Inoltre, i miglioramenti nell'anestesia, come l'uso prolungato del sevoflurano invece dell'alotano e delle maschere laringee invece dell'intubazione tracheale, hanno ulteriormente ridotto l'incidenza degli effetti deleteri dell'anestesia generale nei bambini. Craven et al. ha esaminato diversi studi randomizzati controllati e ha trovato solo un vantaggio statistico borderline dell'anestetico spinale rispetto all'anestesia generale. A nostro avviso, la somministrazione di sevoflurano durante la ventilazione spontanea per un breve periodo di tempo può talvolta essere utile per aiutare nell'esecuzione del blocco spinale, soprattutto se non viene utilizzata la crema EMLA.
L'anestesia spinale è stata utilizzata anche per una varietà di altre procedure, inclusa la riparazione del mielomeningocele e altre procedure addominali, urologiche e ortopediche nei bambini. Il primo rapporto di Abajian et al. includevano non solo i bambini sottoposti a erniorrafia inguinale, ma anche altri pazienti non infantili che secondo gli autori avrebbero dovuto affrontare un rischio maggiore di anestesia generale. Questo studio ha incluso pazienti con una varietà di condizioni mediche, tra cui laringomalacia, macroglossia, micrognazia, cardiopatie congenite, sindrome di Down, sindrome adrenogenitale, ritardo della crescita e artrogriposi. Blaise et al. riportato 30 pazienti di età compresa tra 7 settimane e 13 anni che sono stati sottoposti ad anestesia spinale per una varietà di procedure chirurgiche. Kokki et al. hanno riportato un'anestesia soddisfacente in 92 dei 93 bambini di età compresa tra 1 e 17 anni sottoposti ad anestesia spinale con ropivacaina per procedure dell'addome inferiore o degli arti inferiori. Nella cardiochirurgia sono state utilizzate tecniche regionali per facilitare l'estubazione precoce. Questa ampia serie di indagini sull'anestesia spinale per la cardiochirurgia proviene da un'analisi prospettica randomizzata della Stanford University. Il gruppo che ha ricevuto l'anestesia spinale per alleviare il dolore postoperatorio ha avuto un fabbisogno di oppioidi inferiore nel periodo postoperatorio dopo chirurgia cardiaca elettiva con estubazione precoce in sala operatoria.
In sintesi, l'anestesia spinale in pediatria è più comunemente utilizzata nei neonati pretermine sottoposti ad anestesia per la riparazione dell'ernia inguinale. L'anestesia spinale può anche essere utilizzata efficacemente nei bambini per alleviare il dolore postoperatorio in cardiochirurgia, soprattutto se vengono utilizzati oppioidi.
BIBLIOGRAFIA
- Peutrell JM, Lonnqvist PA: blocchi neuroassiali per anestesia e analgesia nei bambini. Curr Opin Anaesthesiol 2003;16:461–470. 2
- Suresh S, Long J, Birmingham PK, et al: i blocchi caudali per il controllo del dolore sono sicuri nei bambini? Un'analisi di 18,650 blocchi caudali dal database Pediatric Regional Anesthesia Network (PRAN). Anesth Analg 2015; 120: 151–156.
- Gunter JB, Eng C: Anestesia epidurale toracica attraverso l'approccio caudale nei bambini. Anestesiologia 1992;76:935–938.
- Larsson BA, Lonnqvist PA, Olsson GL: Concentrazioni plasmatiche di bupivacaina nei neonati dopo infusione epidurale continua. Anesth Analg 1997;84:501–505.
- Luz G, Innerhofer P, Bachmann B, et al: concentrazioni plasmatiche di bupivacaina durante l'anestesia epidurale continua nei neonati e nei bambini. Anesth Analg 1996;82:231–234.
- Berde C: Anestetici locali nei neonati e nei bambini: un aggiornamento. Paediatr Anaesth 2004;14:387–393.
- Gunter JB, Dunn CM, Bennie JB, et al: concentrazione ottimale di bupivacaina per l'anestesia combinata caudale-generale nei bambini. Anestesiologia 1991;75:57–61.
- Tsui BC, Berde CB: analgesia caudale e tecniche di anestesia nei bambini. Curr Opin Anaesthesiol 2005;18:283–288.
- Lönnqvist PA: articolo di revisione. Tossicità degli anestetici locali: una prospettiva pediatrica. Paediatr Anaesth 2012;22:39–43.
- Da Conceicao MJ, Coelho L, Khalil M: Ropivacaina 0.25% rispetto a bupivacaina 0.25% per via caudale. Paediatr Anaesth 1999; 9:229–233.
- Eledjam JJ, Gros T, Viel E, et al: Sovradosaggio di ropivacaina e tossicità sistemica. Terapia intensiva di Anaesth 2000;28:705–707.
- Ivani G, Lampugnani E, Torre M, et al: Confronto di ropivacaina con bupivacaina per blocco caudale pediatrico. Fr. J Anaesth 1998;81: 247–248.
- Karmakar MK, Aun CS, Wong EL, et al: La ropivacaina subisce un assorbimento sistemico più lento dallo spazio epidurale caudale nei bambini rispetto alla bupivacaina (tabella). Anesth Analg 2002;94:259–265.
- Kokko TI, Karinen J, Raiha E, et al: farmacocinetica dello 0.75% di ropivacaina e dello 0.5% di bupivacaina dopo il blocco del nervo ileoinguinale-ileoipogastrico nei bambini. Fr. J Anaesth 2002;89:438–441.
- Gunter JB: Benefici e rischi degli anestetici locali nei neonati e nei bambini. Farmaci pediatrici 2002;4:649–672.
- Bosenberg A, Thomas J, Lopez T, et al: L'efficacia della ropivacaina caudale 1, 2 e 3 mg × l(-1) per l'analgesia postoperatoria nei bambini. Paediatr Anaesth 2002;12:53–58.
- Ivani G. Ropivacaine: è tempo di bambini? Paediatr Anaesth 2002; 12:383–387.
- Taylor R, Eyres R, Chalkiadis GA, et al: Efficacia e sicurezza dell'iniezione caudale di levobupivacaina, 0.25%, nei bambini di età inferiore a 2 anni sottoposti a riparazione dell'ernia inguinale, circoncisione o orchidopessi. Paediatr Anaesth 2003;13:114–121.
- Lonnqvist PA: Aggiunte al blocco caudale nei bambini: Quo vadis? Fr. J Anaesth 2005;95:431–433.
- Lonnqvist PA, Ivani G, Moriarty T: Uso di oppioidi caudale-epidurali nei bambini: ancora lo stato dell'arte o l'inizio della fine? Paediatr Anaesth 2002;12:747–749.
- Attia J, Ecoffey C, Sandouk P, et al: Morfina epidurale nei bambini: farmacocinetica e sensibilità alla CO2. Anestesiologia 1986;65:590–594.
- Ansermino M, Basu R, Vandebeek C, et al: Additivi non oppioidi agli anestetici locali per il blocco caudale nei bambini: una revisione sistematica. Paediatr Anaesth 2003;13:561–573.
- De Negri P, Ivani G, Visconti C, et al: La relazione dose-risposta per la clonidina aggiunta a un'infusione epidurale continua postoperatoria di ropivacaina nei bambini. Anesth Analg 2001;93:71–76.
- Penon C, Ecoffey C, Cohen SE: risposta ventilatoria all'anidride carbonica dopo l'iniezione epidurale di clonidina. Anesth Analg 1991;72:761–991.
- Fellmann C, Gerber AC, Weiss M: Apnea in un neonato pretermine dopo bupivacaina caudale con clonidina per erniorrafia inguinale. Paediatr Anaesth 2002;12:637–640.
- Passariello M, Almenrader N, Canneti A, et al: Analgesia caudale nei bambini: S(+)-ketamina vs S(+)-ketamina più clonidina. Paediatr Anaesth 2004;14:851–855.
- Hager H, Marhofer P, Sitzwohl C, et al: La clonidina caudale prolunga l'analgesia dalla S (+)-ketamina caudale nei bambini. Anesth Anal 2002; 94:1169–1172.
- Hayashi H, Dikkes P, Soriano SG: La somministrazione ripetuta di ketamina può portare alla degenerazione neuronale nel cervello del ratto in via di sviluppo. Paediatr Anaesth 2002;12:770–774.
- Proescholdt M, Heimann A, Kempski O: Neuroprotezione dell'isomero della ketamina S(+) nell'ischemia proencefalo globale. Brain Res 2001; 904: 245–251.
- Suresh S, Wheeler M: Pratica anestesia regionale pediatrica. Anesthesiol Clin North Am 2002;20:83–113.
- Giaufre E, Dalens B, Gombert A: Epidemiologia e morbilità dell'anestesia regionale nei bambini: un'indagine prospettica di un anno della Società di anestesisti pediatrici di lingua francese. Anesth Analg 1996;83:904–912
- Flandin-Blety C, Barriera G: incidenti a seguito di analgesia extradurale nei bambini. I risultati di uno studio retrospettivo. Paediatr Anaesth 1995;5:41–46.
- Fischer HB: Esecuzione dell'inserzione epidurale in anestesia generale. Anestesia 2000;55:288–289.
- Kasai T, Yaegashi K, Hirose M, et al: Lesione del midollo spinale in un bambino causata da una puntura durale accidentale con un ago epidurale toracico a colpo singolo. Anesth Analg 2003;96:65–67.
- Horlocker T, Wedel DJ, Rowlingson JC, et al: Anestesia regionale nel paziente che riceve una terapia antitrombotica o trombolitica. Linee guida basate sull'evidenza della società americana di anestesia regionale e medicina del dolore (terza edizione). Reg Anesth Antidolorifico 2010;35:64–101.
- Kost-Byerly S, Tobin JR, Greenberg RS, et al: Colonizzazione batterica e tasso di infezione dei cateteri epidurali continui nei bambini. Anesth Analg 1998;86:712–716.
- Wittum S, Hofer CK, Rolli U, et al: Osteomielite sacrale dopo anestesia epidurale a colpo singolo tramite approccio caudale in un bambino. Anestesiologia 2003;99:503–505.
- Bubeck J, Boos K, Krause H, Thies KC: Il tunneling sottocutaneo dei cateteri caudali riduce il tasso di colonizzazione batterica a quello dei cateteri epidurali lombari. Anesth Analg 2004;99:689–693.
- Oliver A: Punture durali nei bambini: cosa dobbiamo fare? Paediatr Anaesth 2002;12:473–477.
- Liley A, Manoharan M, Upadhyay V: La gestione di un mal di testa post-puntura durale in un bambino. Paediatr Anaesth 2003;13:534–537.
- Janssens E, Aerssens P, Alliet P, et al: Mal di testa post-puntura durale nei bambini. Una rassegna della letteratura. Eur J Pediatr 2003;162:117–121.
- Tsuji MH, Horigome H, Yamashita M: le funzioni del ventricolo sinistro non sono compromesse dopo l'anestesia epidurale lombare nei bambini piccoli. Paediatr Anaesth 1996;6:405–409.
- Tsui BC, Malherbe S, Koller J, et al: inversione di un anestetico spinale non intenzionale mediante lavaggio cerebrospinale. Anesth Analg 2004;98:434–436.
- Tobias JD: Blocco epidurale caudale: una revisione del dosaggio di prova e riconoscimento dell'iniezione sistemica nei bambini. Anesth Analg 2001;93:1156–1161.
- Neal JM, Mulroy MF, Weinberg GF: Società americana di anestesia regionale e medicina del dolore. Lista di controllo per la gestione della tossicità sistemica da anestetico locale: versione 2012. Reg Anesth Antidolorifico 2012;37:16Y18.
- Flandin-Blety C, Barriera G: incidenti a seguito di analgesia extradurale nei bambini. I risultati di uno studio retrospettivo. Paediatr Anaesth 1995; 5:41–46.
- Valairucha S, Seefelder C, Houck CS: Cateteri epidurali toracici posizionati per via caudale nei neonati: l'importanza della conferma radiografica. Paediatr Anaesth 2002;12:424–428.
- Tsui BC, Gupta S, Finucane B: Conferma del posizionamento del catetere epidurale mediante stimolazione nervosa. Can J Anaesth 1998;45:640–644.
- Tsui BC, Seal R, Koller J, et al: Analgesia epidurale toracica tramite l'approccio caudale in pazienti pediatrici sottoposti a fundoplicatio utilizzando la guida della stimolazione nervosa. Anesth Analg 2001;93:1152–1155.
- Tsui BC, Gupta S, Finucane B: rilevamento del posizionamento del catetere epidurale subaracnoideo e intravascolare. Can J Anaesth 1999;46: 675–678.
- Tsui BC, Gupta S, Emery D, Finucane B: rilevamento del posizionamento subdurale del catetere epidurale mediante stimolazione nervosa. Can J Anaesth 2000;47:471–473.
- Tsui BC: posizionamento del catetere epidurale toracico nei neonati tramite l'approccio caudale sotto guida elettrocardiografica: semplificazione della tecnica originale. Anesth Analg 2004;98:273.
- Chen CP, Tang SF, Hsu TC, et al: guida ecografica nel posizionamento dell'ago epidurale caudale. Anestesiologia 2004;101:181–184.
- Chawathe MS, Jones RM, Gildersleve CD, et al: rilevamento di cateteri epidurali con ultrasuoni nei bambini. Paediatr Anaesth 2003;13: 681–684.
- Baris S, Guldogus F, Baris YS, et al: Il carotaggio tissutale è un vero problema dopo l'iniezione caudale nei bambini? Paediatr Anaesth 2004;14:755–758.
- Lam DK, Corry GN, Tsui BC: Prove per l'uso dell'ecografia nell'anestesia regionale pediatrica: una revisione sistematica. Reg Anesth Antidolorifico 2016;41:229–241.
- Rubin K, Sullivan D, Sadhasivam S: i blocchi periferici e neuroassiali con guida ecografica sono più efficaci e sicuri nei bambini? Paediatr Anaesth 2009; 19:92–96.
- Perlas A: Evidenze per l'uso degli ultrasuoni nei blocchi neuroassiali. Reg Anesth Pain Med 2010;35(2 Suppl):S43–46.
- Triffterer L, Machata AM, Latzke D, et al: Valutazione ecografica della diffusione cranica durante il blocco caudale nei bambini: effetto della velocità di iniezione di anestetici locali. Fr. J Anaesth 2012;108:670–674.
- Brenner L, Marhofer P, Kettner SC, et al: Valutazione ecografica della diffusione cranica durante il blocco caudale nei bambini: l'effetto di diversi volumi di anestetici locali. Fr. J Anaesth 2011; 107:229–235.
- Lundblad M, Lönnqvist PA, Eksborg S, et al: Distribuzione segmentale dell'anestesia caudale ad alto volume nei neonati, nei neonati e nei bambini piccoli come valutata dall'ecografia. Paediatr Anaesth 2010;21:121–127.
- Lundblad M, Eksborg S, Lönnqvist PA: diffusione secondaria del blocco caudale valutata mediante ecografia. Fr. J Anaesth 2012;108:675–681.
- Tamai H, Sawamura S, Kanamori Y, et al: Inserimento del catetere epidurale toracico utilizzando l'approccio caudale assistito con uno stimolatore nervoso elettrico nei bambini piccoli. Reg Anesth Antidolorifico 2004;29:92–95.
- Tsui BC, Wagner A, Cave D, et al: Analgesia epidurale toracica e lombare tramite l'approccio caudale utilizzando la guida della stimolazione elettrica nei pazienti pediatrici: una revisione di 289 pazienti. Anestesiologia 2004;100:683–689.
- Tsui BC, Entwistle L: analgesia epidurale toracica attraverso l'approccio lombare utilizzando la stimolazione nervosa in un paziente pediatrico con sindrome di Down. Acta Anaesthesiol Scand 2005;49:712–714.
- Fischer HB: Esecuzione dell'inserzione epidurale in anestesia generale. Anestesia 2000;55:288–289.
- Kasai T, Yaegashi K, Hirose M, et al: Lesione del midollo spinale in un bambino causata da una puntura durale accidentale con un ago epidurale toracico a colpo singolo. Anesth Analg 2003;96:65–67.
- Bromage PR, Benumof JL: Paraplegia a seguito di iniezione intracorde durante tentata anestesia epidurale in anestesia generale. Reg Anesth Antidolorifico 1998;23:104–107.
- Chawathe MS, Jones RM, Gildersleve CD, et al: rilevamento di cateteri epidurali con ultrasuoni nei bambini. Paediatr Anaesth 2003;13: 681–684.
- Corning JL: Anestesia spinale e medicazione locale del midollo. NY J Med 1885;42:483–485.
- Gray H: uno studio sull'anestesia spinale nei bambini e nei neonati: da una serie di 200 casi. Lancetta 1909;2:913–917.
- Bainbridge W: Analgesia nei bambini mediante iniezione spinale con una relazione su un nuovo metodo di sterilizzazione del fluido di iniezione. Med Rec 1900;58:937–940.
- Melman E, Penuelas JA, Marrufo J: Anestesia regionale nei bambini. Anesth Analg 1975;54:387–390.
- Gregory GA, Steward DJ: Apnea perioperatoria pericolosa per la vita nell'ex "premie". Anestesiologia 1983;59:495–498.
- Steward DJ: Sindrome da apnea postoperatoria nei neonati prematuri. Ovest J Med 1992; 157:567.
- Steward DJ: I neonati pretermine sono più inclini a complicazioni dopo un intervento chirurgico minore rispetto ai neonati a termine. Anestesiologia 1982;56:304–306.
- Cote CJ, Zaslavsky A, Downes JJ, et al: Apnea postoperatoria negli ex neonati pretermine dopo erniorrafia inguinale. Un'analisi combinata [vedi commenti]. Anestesiologia 1995;82:809–822.
- Liu LM, Cote CJ, Goudsouzian NG, et al: Apnea pericolosa per la vita nei neonati che si stanno riprendendo dall'anestesia. Anestesiologia 1983;59:506–510.
- Abajian JC, Mellish RW, Browne AF, et al: Anestesia spinale per chirurgia nel neonato ad alto rischio. Anesth Analg 1984;63:359–362.
- Frumiento C, Abajian JC, Vane DW: Anestesia spinale per neonati pretermine sottoposti a riparazione dell'ernia inguinale. Arch Surg 2000;135:445–451.
- Blaise GA, Roy WL: Anestesia spinale per chirurgia pediatrica minore. Can Anaesth Soc J 1986;33:227–230.
- Kokki H, Tuovinen K, Hendolin H: Anestesia spinale per chirurgia pediatrica diurna: un confronto prospettico in doppio cieco, randomizzato, a gruppi paralleli di bupivacaina isobarica e iperbarica. Fr. J Anaesth 1998;81:502–506.
- Busoni P, Messeri A: Anestesia spinale nei bambini: anatomia di superficie. Anesth Analg 1989;68:418–419.
- Busoni P, Messeri A: Anestesia spinale nei neonati: potrebbe essere più sicuro un approccio L5-S1? Anestesiologia 1991;75:168–169.
- Gray H: Anatomy of the Human Body: Gray's Anatomy, 30a ed. Filadelfia: Lippincott Williams & Wilkins, 1985.
- Puncuh F, Lampugnani E, Kokki H: Uso dell'anestesia spinale nei pazienti pediatrici: un'esperienza in un unico centro con 1132 casi. Paediatr Anaesth 2004;14:564–567.
- Kokki H, Ylonen P, Laisalmi M, et al: Ropivacaina isobarica 5 mg/mL per l'anestesia spinale nei bambini. Anesth Analg 2005;100:66–70.
- Kokki H, Hendolin H: bupivacaina iperbarica per anestesia spinale in bambini di età compresa tra 7 e 18 anni: confronto di bupivacaina 5 mg mL-1 in soluzioni di glucosio allo 0.9% e all'8%. Fr. J Anaesth 2000; 84:59–62.
- Rochette A, Raux O, Troncin R, et al: La clonidina prolunga l'anestesia spinale nei neonati: uno studio prospettico di dosaggio. Anesth Analg 2004;98:56–59.
- Welborn LG, de Soto H, Hannallah RS, et al: L'uso della caffeina nel controllo dell'apnea post-anestetica negli ex neonati prematuri. Anestesiologia 1988;68:796–798.
- Oberlander TF, Berde CB, Lam KH, et al: I neonati tollerano l'anestesia spinale con cambiamenti autonomici complessivi minimi: analisi della variabilità della frequenza cardiaca negli ex neonati prematuri sottoposti a riparazione dell'ernia. Anesth Analg 1995;80:20–27.
- Ramamoorthy C, Geiduschek JM, Bratton SL, et al: Mal di testa da puntura postdurale nei pazienti oncologici pediatrici. Clin Pediatr 1998;37:247–251.
- Kokki H, Salonvaara M, Herrgard E, Onen P: Il mal di testa da puntura postdurale non è un sintomo correlato all'età nei bambini: s studio prospettico, randomizzato, a gruppi paralleli che confrontano un Quincke calibro 22 con un ago Whitacre calibro 22. Paediatr Anaesth 1999;9:429–434.
- Salmela L, Aromaa U: Irritazione radicolare transitoria dopo anestesia spinale indotta con soluzioni iperbariche di lidocaina diluita nel liquido cerebrospinale 50 mg/mL o mepivacaina 40 mg/mL o bupivacaina 5 mg/mL. Acta Anaesthesiol Scand 1998;42:765–769.
- Welborn LG, Rice LJ, Hannallah RS, et al: Apnea postoperatoria negli ex neonati pretermine: confronto prospettico tra anestesia spinale e generale. Anestesiologia 1990;72:838–842.
- Gleason CA, Martin RJ, Anderson JV, et al: Posizione ottimale per un prelievo spinale nei neonati pretermine. Pediatria 1983;71:31–35.
- Krane EJ, Haberkern CM, Jacobson LE: apnea postoperatoria, bradicardia e desaturazione di ossigeno in neonati prematuri: confronto prospettico di anestesia spinale e generale. Anesth Analg 1995;80:7–13.
- Craven PD, Badawi M, Henderson-Smart DJ, O'Brien M: anestesia regionale (spinale, epidurale, caudale) rispetto a quella generale nei neonati pretermine sottoposti a erniorrafia inguinale nella prima infanzia. Sistema di database Cochrane Rev 2003;(3):CD003669.
- Viscomi CM, Abajian JC, Wald SL, et al: Anestesia spinale per la riparazione del meningomielocele nei neonati. Anesth Analg 1995;81:492–495.
- Kokki H, Hendolin H. Confronto dell'anestesia spinale con l'anestesia epidurale in chirurgia pediatrica. Acta Anaesthesiol Scand 1995;39: 896–900.
- Hammer GB, Ramamoorthy C, Cao H, et al: Analgesia postoperatoria dopo blocco spinale in neonati e bambini sottoposti a chirurgia cardiaca. Anesth Analg 2005;100:1283–1288.