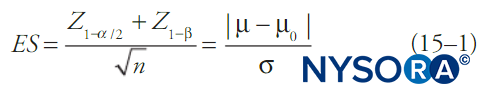Andrew Neice e Michael J. Barrington
INTRODUZIONE
L'anestesia regionale è praticata al meglio nel contesto di protocolli chirurgici e anestetici standardizzati; questi piani sono generalmente indicati come percorsi anestetici. Per un paziente sottoposto a un intervento chirurgico che utilizza un percorso anestetico, molte delle decisioni sulla cura del paziente non vengono prese al letto del paziente nell'immediato periodo preoperatorio, ma piuttosto molto prima dell'intervento, considerando attentamente i rischi e i benefici di varie anestesie e trattamenti perioperatori opzioni.Se ben progettati, i percorsi anestetici possono migliorare l'assistenza ai pazienti garantendo che i pazienti ricevano cure coerenti, coordinate e basate sull'evidenza. Possono anche ridurre i costi eliminando gli interventi non necessari e riducendo le complicazioni. Naturalmente, i percorsi non dovrebbero essere seguiti indiscriminatamente poiché alcuni pazienti richiederanno modifiche per espiare condizioni mediche specifiche o preferenze del paziente. Indipendentemente da ciò, i percorsi anestetici consentono ai medici di concentrarsi sulle caratteristiche uniche di un paziente anziché sulle caratteristiche comuni di un'intera coorte, che erano già state esaminate durante lo sviluppo del percorso.
Al centro, i percorsi anestetici (o i percorsi clinici in qualsiasi campo) sono una serie di decisioni mediche. In qualità di leader della casa chirurgica perioperatoria, gli anestesisti sono i più adatti a guidare il loro progetto. Ci sono spesso molti problemi sottili che emergono nello sviluppo di un percorso che potrebbe non essere familiare a nessuno tranne che a un medico che è frequentemente e personalmente coinvolto nella cura del paziente. Inoltre, i rapporti di lavoro degli anestesisti con i chirurghi, gli amministratori e l'intero team di sala operatoria sono fondamentali per lo sviluppo e il successo dei percorsi dei pazienti. Il coordinamento interspecialistico è vitale per lo sviluppo di successo dei percorsi anestetici. Le decisioni anestetiche influiranno frequentemente sulla capacità dei pazienti di riabilitarsi nell'immediato periodo postoperatorio, quindi i percorsi anestetici e chirurgici devono essere progettati da uno sforzo di squadra.
Poiché ci sono prove che l'uso dell'anestesia regionale può influenzare la mortalità e la morbilità degli interventi chirurgici comuni e poiché il controllo del dolore nel periodo postoperatorio è spesso difficile, l'anestesia regionale (blocco neuroassiale o periferico) è spesso una caratteristica chiave delle vie anestetiche. Pertanto, lo sviluppo di percorsi è di particolare interesse per i professionisti la cui pratica clinica include l'anestesia regionale.
La progettazione e l'implementazione di percorsi clinici richiedono competenze spesso non insegnate durante la formazione in residenza. I medici personalizzano i loro trattamenti tenendo conto delle caratteristiche uniche di ogni paziente. Ciò è correlato alla formazione del medico progettata per ottenere e sintetizzare dati per un paziente specifico. I percorsi clinici, al contrario, devono essere progettati per ottimizzare l'esperienza media di una coorte di pazienti, spesso facendo compromessi e compromessi nel processo. La conoscenza dell'epidemiologia e della statistica sono vitali per un'efficace progettazione del percorso clinico. La stima numerica degli esiti probabili e la scelta di quelli che valutano più favorevolmente è fondamentale per lo sviluppo del percorso.
I benefici di un percorso di anestesia dipenderanno ovviamente dalle peculiarità del percorso stesso, dall'istituto, dalle tecniche chirurgiche e anestetiche e dagli altri operatori sanitari che utilizzano il percorso (come assistenza infermieristica, terapia fisica, ecc.). Un percorso progettato per un'istituzione potrebbe non essere appropriato per un'altra istituzione, motivo per cui in questo capitolo abbiamo scelto di enfatizzare il processo di sviluppo del percorso invece di presentare percorsi specifici. Inoltre, gli obiettivi di un percorso anestetico possono variare: alcuni percorsi possono essere progettati per ridurre la morbilità o la mortalità, mentre altri possono essere focalizzati sulla riduzione dei costi mantenendo un livello elevato di assistenza al paziente. Gli obiettivi comuni di un percorso anestetico includono la riduzione della morbilità e della mortalità in ospedale, la riduzione della durata della degenza ospedaliera, la riduzione dei costi, il miglioramento della soddisfazione del paziente, la riduzione delle riammissioni e il miglioramento dei risultati funzionali a lungo termine.
Nonostante questa eterogeneità, ci sono prove che, in generale, i percorsi clinici migliorano la cura del paziente. Una recente meta-analisi dei percorsi clinici ha rilevato che erano associati a tassi più bassi di complicanze per i pazienti (p. es., infezioni della ferita, sanguinamento e polmonite), nonché a una migliore documentazione. La maggior parte degli studi inclusi nella meta-analisi ha anche mostrato una riduzione della durata della degenza e dei costi ospedalieri senza un aumento del rischio di tassi di riammissione e mortalità. Tuttavia, è possibile che anche alcuni percorsi clinici possano effettivamente migliorare questi risultati. La notevole eterogeneità dei percorsi clinici di successo non ha consentito ai ricercatori di identificare le caratteristiche comuni ai percorsi clinici di successo (o non riusciti). Tuttavia, i principi di base della gestione del rischio possono essere applicati per aiutare nella progettazione di percorsi clinici e lo sviluppo di un quadro comune riutilizzabile per l'approccio ai percorsi clinici sembra aumentare le probabilità di successo.
In questo capitolo, presentiamo un quadro per lo sviluppo di percorsi clinici e rivediamo alcune delle conoscenze prerequisite richieste per questo processo. Presentiamo anche scenari di casi che illustrano le sottigliezze nell'applicazione della letteratura medica esistente ai percorsi clinici. Infine, presentiamo i componenti di un percorso chirurgico per l'artroplastica totale del ginocchio.
QUADRO PER VIE ANESTETICHE
Un esempio di una singola componente di un percorso clinico è mostrato in Tabella 1. Questo è un componente di un percorso più ampio per l'artroplastica articolare totale, che verrà ulteriormente discusso nella sezione finale di questo capitolo. Questo componente descrive le premedicazioni orali standard per l'intervento chirurgico e contiene informazioni specifiche sulla dose, controindicazioni comuni e aggiunte comuni al percorso che potrebbero essere necessarie per alcuni pazienti. Sebbene lo sviluppo di un percorso clinico spesso comporti lunghe analisi con incertezze, gli elementi finali del percorso dovrebbero essere brevi e specifici. Oltre ai premedicati consigliati, i percorsi possono avere molti elementi diversi; ad esempio, vedere quelli mostrati in Tabella 2.
Va notato che, sebbene i percorsi sviluppati dagli anestesisti riguardino principalmente la gestione dell'anestesia del paziente, sono progettati per combaciare con il percorso chirurgico corrispondente. Ad esempio, la scelta dell'anestesia regionale può consentire al paziente di completare la terapia fisica il giorno 1 postoperatorio.
TABELLA 1. Esempio di item del percorso: premedicazione orale per artroplastica totale di ginocchio.
| Premedicazioni orali consigliate prima dell'intervento chirurgico (solo esempio) | |
|---|---|
| Acetaminofene 1 g per bocca | Evitare in quelli con cirrosi, test di funzionalità epatica elevati |
| Celecoxib 400 mg per via orale | Evitare in quelli con allergia al sulfa, disfunzione renale |
| Gabapentin 600 mg per via orale | Da evitare in pazienti con disfunzione renale, pazienti ambulatoriali, pazienti con età avanzata o demenza |
TABELLA 2. Esempi di elementi di percorso.
- Enumerazione degli obiettivi del percorso
- Criteri per la selezione del paziente, la preparazione all'intervento chirurgico e l'istruzione prima dell'intervento chirurgico
- Ottimizzazione preoperatoria (p. es., obiettivi di pressione sanguigna, obiettivi di ematocrito, interventi farmacologici associati)
- Anestesia chirurgica consigliata
- Tecnica di anestesia sistemica multimodale raccomandata
- Anestesia/analgesia regionale consigliata per il trattamento del dolore postoperatorio
- Terapia profilattica raccomandata per nausea e vomito postoperatori
- Obiettivi o criteri di trasfusione raccomandati per il fluido intraoperatorio o l'ematocrito
- Gestione intraoperatoria raccomandata dell'emodinamica (p. es., pressione sanguigna preferita, pressori preferiti, ecc.)
- Farmaci adiuvanti consigliati (p. es., antibiotici preferiti, anticoagulanti, antifibrinolitici)
- Monitoraggio adiuvante raccomandato (p. es., potenziali evocati, indice bispettrale, ossigenazione cerebrale)
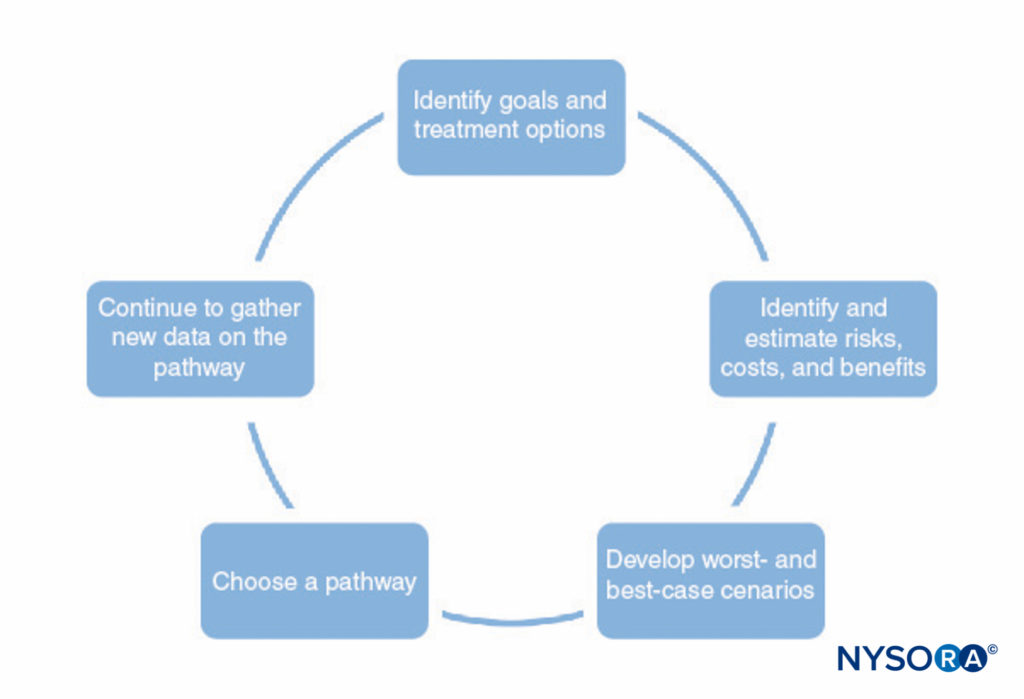
Un processo per lo sviluppo di percorsi clinici è mostrato in Figure 1 . Questo processo consiste in quanto segue:
- Identificare gli obiettivi del percorso e diverse opzioni di trattamento per aiutare a raggiungere tali obiettivi. Ciò dovrebbe includere tutte le fasi dell'anestesia e della chirurgia, compreso il recupero postoperatorio.
- Identificare i modi in cui ogni trattamento interagisce con gli altri (p. es., il tipo di anestesia regionale può influenzare la capacità del paziente di eseguire la terapia fisica nel postoperatorio, le premedicazioni possono ritardare la dimissione a causa della sedazione).
- Identificare possibili rischi, costi e benefici di ciascun trattamento, inclusi mortalità, morbilità, soddisfazione del paziente, capacità istituzionali, costi finanziari e altri fattori.
- Fare stime numeriche dei rischi, dei costi e dei benefici identificati nella fase 3. Alcune di queste informazioni (ad es. informazioni sui costi) possono essere raccolte e tabulate. Tuttavia, la maggior parte delle informazioni non può essere conosciuta con certezza. In molti casi, la letteratura medica può fornire stime delle probabilità coinvolte, purché il medico comprenda i limiti di uno studio particolare.
- Utilizzare le stime sviluppate nel passaggio 4 per sviluppare risultati probabili e scenari peggiori e migliori per ciascun percorso.
- Scegli il percorso che più probabilmente gioverà al paziente in base al passaggio 5.
- Affinare continuamente le stime di rischi, costi e benefici man mano che nuove informazioni diventano disponibili e perfezionare i percorsi clinici.
Se potessimo quantificare i rischi ei benefici di ogni intervento con la stessa facilità con cui potremmo quantificare i costi finanziari delle procedure e delle attrezzature, i passaggi 4, 5 e 6 sarebbero banali. Tuttavia, questo è raramente il caso. In molti casi, potrebbero non esserci dati pubblicati adeguati per guidare il processo. A volte, potrebbe esserci qualche incongruenza tra gli studi disponibili e le informazioni desiderate: gli unici studi disponibili potrebbero essere stati condotti su popolazioni di pazienti simili, ma diverse; hanno analizzato procedure chirurgiche simili, ma diverse; o può descrivere interventi che non puoi replicare esattamente nel tuo istituto. Tuttavia, la corrispondenza più vicina alle proprie condizioni istituzionali può essere utilizzata per stimare le probabilità utilizzate nel passaggio 5.
Un altro rischio da considerare include quelle complicazioni che potrebbero non manifestarsi fino a molto tempo dopo il periodo di trattamento. Ad esempio, i farmaci, le procedure o le terapie introdotte di recente per definizione avranno rischi sconosciuti a lungo termine. Riconoscere i limiti dell'evidenza esistente per ogni intervento in letteratura è cruciale nello sviluppo del protocollo. Sebbene le statistiche inferenziali migliorino il giudizio di un medico oltre ciò che può essere ottenuto semplicemente facendo affidamento sulle loro osservazioni personali storiche, sfortunatamente qualsiasi dato studio può avere pregiudizi imprevisti che potrebbero rendere lo studio meno di una guida ideale per il protocollo in fase di sviluppo. Pertanto, quando si sviluppano scenari "caso peggiore" e "caso migliore", è necessario tenere conto della possibilità che uno studio abbia commesso un errore di tipo I o (più comunemente) di tipo II.
REVISIONE DI CONCETTI STATISTICI RELATIVI ALLO SVILUPPO DI VIE ANESTETICHE
Una buona analogia per il ruolo delle statistiche nel migliorare il giudizio clinico è confrontarlo con il ruolo che una lente d'ingrandimento gioca nel migliorare la vista. Farmaci o interventi che hanno effetti ampi e coerenti (p. es., l'effetto dell'insulina sul glucosio o dell'epinefrina sulla frequenza cardiaca) possono essere facilmente apprezzati dal medico senza alcun tipo di studio corroborante, proprio come generalmente non è necessaria una lente d'ingrandimento per vedere frank pus in una ferita. Allo stesso modo, uno studio sottodimensionato potrebbe non essere in grado di rilevare effetti sottili, proprio come una semplice lente manuale non è abbastanza potente per visualizzare i singoli batteri. Mentre pochi medici tenterebbero di diagnosticare un'infezione batterica solo con una lente d'ingrandimento, i medici spesso commettono l'errore di presumere che un risultato negativo riportato sia sinonimo di nessun effetto, senza considerare il limite di rilevamento dello studio. Complicanze rare ma catastrofiche sono di particolare interesse poiché potrebbe essere necessario un numero estremamente elevato di pazienti per alimentare adeguatamente uno studio.
Un test statistico può segnalare o che i dati osservati sono coerenti con la casualità (l'ipotesi nulla, un risultato "negativo") o rifiutare l'ipotesi nulla e affermare che esiste un'associazione tra un trattamento e un risultato (un risultato "positivo"). . In realtà, potrebbe esserci o meno un'associazione tra un trattamento e un risultato. Ci sono quindi quattro possibilità per qualsiasi test statistico, due delle quali implicano il trarre la conclusione corretta e due delle quali sono errori. Questi sono tradizionalmente mostrati utilizzando una tabella 2 × 2 come mostrato in Tabella 3.
TABELLA 3. Possibili risultati di un test statistico.
| L'ipotesi è vera | L'ipotesi è falsa | |
|---|---|---|
| L'ipotesi è accolta | Decisione corretta | Errore di tipo I (alfa) |
| L'ipotesi è respinta | Errore di tipo II (beta) | Decisione corretta |
I due tipi di errori possibili sono un errore di tipo I (alfa), che implica concludere erroneamente che un'associazione esiste quando non ne esiste una, e un errore di tipo II (beta), che implica concludere erroneamente che non esiste alcuna associazione quando in realtà si fa . Ovviamente, le probabilità di commettere i due tipi di errori sono correlate. Immagina un test statistico che affermi sempre che esiste un'associazione tra il trattamento e l'esito, indipendentemente dai dati. Questa tecnica commetterà frequentemente errori di tipo I ma non commetterà mai un errore di tipo II (perché non afferma mai un risultato negativo).
Per convenzione, i test statistici calcolano la probabilità che un insieme di dati sia dovuto a un caso casuale (il valore p) e se questa è al di sotto di una certa soglia fissa (alfa), l'idea che i dati siano dovuti a un caso casuale viene rifiutata. In genere viene riportato anche un intervallo di confidenza. Quando l'alfa è fisso, più comunemente a 0.05, il beta sarà una funzione delle altre caratteristiche del test statistico. Una delle formule più semplici relative a alfa, beta, variazione della media, deviazione standard dei dati e dimensione del campione è mostrata in Equazione 1. Equazione 1 descrive le relazioni di potere per un test su un ampio campione di una variabile di risultato continua in una singola popolazione con media nota e deviazione standard:
dove n è la dimensione del campione, σ è la deviazione standard del campione, μ è la media del campione, μ0 è la media della popolazione, ES è la dimensione dell'effetto e Z è il punteggio Z corrispondente al valore in pedice. Diversi test statistici (ad es. t test per variabili continue, t test per proporzioni, χ2 test, test di analisi della varianza [ANOVA], ecc.) avranno formule leggermente diverse per beta, ma in generale beta (e quindi la probabilità di un errore di tipo II) diminuirà con dimensioni del campione più grandi, scelte meno restrittive di alfa, deviazioni standard più piccole nei dati e dimensioni dell'effetto maggiori.
La potenza statistica è semplicemente 1–β ed è più frequentemente referenziata di β. Sebbene l'alfa sia più comunemente fissato a 0.05, una potenza statistica di 0.8 è generalmente considerata adeguata per il rilevamento delle associazioni, sebbene in alcuni casi venga aumentata a 0.9. Sfortunatamente, mentre la scelta dell'alfa è quasi sempre esplicitamente dichiarata in una pubblicazione, spesso è lasciato al clinico dedurre il potere dello studio, in particolare per i risultati secondari. Fortunatamente, formule come Equazione 1 possono essere facilmente trovati nei libri di testo comuni o nei pacchetti software statistici. Inoltre, molti dipartimenti di statistica accademica hanno messo a disposizione strumenti online per calcolare la potenza statistica. Formule come Equazione 1 può essere utilizzato per calcolare la dimensione dell'effetto più piccola che è probabile che uno studio particolare rilevi. Spetta quindi al medico decidere se questa dimensione dell'effetto è sufficientemente piccola da rendere clinicamente irrilevante dimensioni dell'effetto inferiori. Se dimensioni dell'effetto inferiori sono ancora clinicamente rilevanti, il medico che sviluppa un percorso deve tenere conto della possibilità che vi sia una dimensione dell'effetto piccola ma reale, che sia stato commesso un errore di tipo II e adattare di conseguenza gli scenari migliori o peggiori .
ESEMPI DI SVILUPPO DI PERCORSI
Forniamo ora alcuni esempi illustrativi dell'analisi discussa in precedenza. In primo luogo, presentiamo uno scenario di caso che illustra il tipo di analisi descritto. Quindi, esaminiamo alcuni esempi di farmaci introdotti nei protocolli chirurgici di routine che hanno causato danni ai pazienti; questo illustra le insidie nello sviluppo del percorso. Infine, presentiamo i componenti di un percorso per la sostituzione totale del ginocchio.
Caso illustrativo: adiuvanti per l'anestesia spinale
Supponiamo che sia stato sviluppato un nuovo farmaco (farmaco X) che aumenta la durata dell'anestesia spinale quando viene aggiunto alla bupivacaina. Il tuo gruppo esegue l'artroplastica totale dell'anca e del ginocchio in anestesia spinale, ma occasionalmente deve passare all'anestesia generale a causa di tempi chirurgici inaspettatamente lunghi. Il percorso articolare totale attualmente utilizza spine spinali di sola bupivacaina, ma sta valutando l'aggiunta del farmaco X al percorso articolare totale per prolungare la durata dell'anestetico spinale e ridurre le conversioni impreviste all'anestesia generale. Uno studio iniziale ha confrontato l'anestesia spinale con bupivacaina rispetto al farmaco X più bupivacaina, con 500 pazienti nel gruppo di trattamento e 500 nel gruppo di controllo. Lo studio ha rilevato che l'anestesia spinale con bupivacaina ha fornito un'adeguata anestesia chirurgica solo per 180 minuti, mentre la bupivacaina con il farmaco X ha fornito un'adeguata anestesia chirurgica per 200 minuti (IC 95% 195–205 minuti, p <.05). Gli esiti secondari includevano l'incidenza di vomito nei giorni 1-3 postoperatori e la ritenzione urinaria che richiedeva il cateterismo di Foley. Nel braccio di controllo, il 3% e nel braccio di trattamento il 4% dei pazienti ha vomitato dopo l'intervento, ma questo risultato non era statisticamente significativo. Nel braccio di controllo, il 2% e nel braccio di trattamento il 3% dei pazienti presentava ritenzione urinaria; tuttavia, anche questo non era statisticamente significativo. Il farmaco costa $ 50 per dose.
Analisi di costi e benefici
Anche per una domanda relativamente semplice (e artificiosa) come questa, un'analisi completa può diventare complessa. Vi presentiamo quindi una versione abbreviata della procedura:
- Identificare obiettivi e opzioni di trattamento. Ci limitiamo all'obiettivo di allungare l'anestesia spinale per ridurre le conversioni in anestesia generale. Dovrebbero essere esplorate alternative all'inclusione del farmaco X. Il farmaco X deve essere valutato non nel vuoto ma in competizione con altre tecniche. Ad esempio, possono essere disponibili altri farmaci che allungano l'anestesia spinale per un tempo comparabile, o semplicemente aumentare il dosaggio spinale può essere fattibile per allungare l'anestesia chirurgica. In alternativa, è possibile identificare la sottopopolazione che potrebbe avere un tempo operatorio più lungo e questi pazienti potrebbero ricevere automaticamente l'anestesia generale o il farmaco X potrebbe essere riservato solo a loro. I rischi e i benefici di ciascuna di queste opzioni devono essere considerati individualmente e confrontati con l'uso di routine del farmaco X.
- Identificare i modi in cui ogni trattamento interagisce con il resto del percorso. Sebbene non siano state menzionate restrizioni, dovremmo confermare che l'uso del farmaco X non richiede un monitoraggio postoperatorio speciale (come la pulsossimetria continua), un'alterazione dell'assistenza infermieristica (come la modifica delle precauzioni contro le cadute) o un cambiamento nella terapia fisica ( come ritardare la mobilizzazione) o richiedere alterazioni ad altre parti del percorso anestetico e chirurgico. Se vengono identificate restrizioni o interazioni, devono essere contabilizzate nel passaggio 3.
- Identificare rischi, costi e benefici. Per questa illustrazione, limitiamo le analisi ai rischi, ai benefici e ai costi a cui si fa riferimento nello studio. Il vantaggio principale sarebbe una maggiore durata dell'anestesia chirurgica e una ridotta necessità di conversione all'anestesia generale, che ovviamente comporta una serie di rischi e costi associati. I rischi includono un aumento del rischio di ritenzione urinaria e vomito postoperatorio. Sebbene lo studio iniziale non abbia collegato nessuno di questi risultati al farmaco X, vedremo nel passaggio 4 che lo scenario peggiore deve includere il rischio che questo studio abbia commesso un errore di tipo II. I costi sono più facili da quantificare: questo aggiungerà $ 50 di costi per i farmaci a ciascun intervento chirurgico.
- Effettuare stime numeriche dei rischi, dei costi e dei benefici identificati nella fase 3. I benefici di questo farmaco dipenderanno dalle specifiche del tuo istituto. Ad esempio, supponiamo che, esaminando i tuoi record, trovi di aver eseguito 500 artroplastica articolare totale nell'ultimo anno e 5 di loro hanno richiesto una conversione inaspettata all'anestesia generale. I tempi chirurgici totali per i cinque casi sono stati 195, 250, 200, 190 e 220 minuti. Utilizzando l'intervallo di confidenza pubblicato, l'uso del farmaco X potrebbe aver eliminato la necessità di convertire in anestesia generale in 2 casi (se allunga il tempo a 195 minuti) in 3 casi (se allunga il tempo a 205 minuti).
I costi di questo farmaco, se utilizzato su tutti i pazienti, sarebbero di $ 25,000 in più all'anno. Se fosse possibile identificare una sottopopolazione ad alto rischio per l'uso del farmaco, questo potrebbe essere potenzialmente ridotto. Lo studio non ha riscontrato alcun legame tra ritenzione urinaria o vomito postoperatorio con il farmaco X, quindi nel migliore dei casi, l'aggiunta del farmaco X non introduce eventuali nuovi rischi di complicanze. Tuttavia, consideriamo il potere di questo studio. Presumibilmente, i dati sulla ritenzione urinaria e sul vomito postoperatorio sono stati analizzati utilizzando il test per le proporzioni. Utilizzando calcolatori di potenza online o pacchetti di statistiche, possiamo stimare la dimensione dell'effetto che verrebbe rilevato. Assumendo un tasso basale di ritenzione urinaria del 2% (basato sul braccio di controllo dello studio), il farmaco dovrebbe aumentare il tasso al 5%–6% per raggiungere una potenza di circa 0.8. Le dimensioni dell'effetto inferiori a questa non verranno rilevate in modo affidabile. Per il vomito postoperatorio, una potenza di 0.8 corrisponde al farmaco che aumenta il tasso di vomito al 7%. Se i tassi di vomito postoperatorio e ritenzione urinaria fossero più che raddoppiati, la maggior parte dei medici considererebbe un aumento clinicamente rilevante, ma non sarebbe rilevato in modo affidabile dallo studio discusso. Pertanto, dobbiamo considerare la possibilità che lo studio abbia commesso un errore di tipo II e adattare il nostro scenario peggiore in modo appropriato.
Se lo studio ha commesso un errore di tipo II, cosa dovremmo usare per le nostre stime della dimensione dell'effetto? La stima più ragionevole può essere ottenuta esaminando lo studio stesso; man mano che i soggetti vengono aggiunti, i tassi convergono verso i loro valori reali e alla fine possono superare una soglia di significatività statistica. Nello studio discusso, il vomito postoperatorio era del 3% nel braccio di controllo e del 4% nel braccio di trattamento e la ritenzione urinaria era del 2% nel braccio di controllo e del 3% nel braccio di trattamento. Possiamo utilizzare questi aumenti per informare le nostre stime.
Supponendo che il nostro istituto abbia tassi simili di vomito nei giorni postoperatori 1-3 (3%) e tassi simili di ritenzione urinaria (2%), stimiamo che aumenterebbero al 4% e al 3%. Con un volume chirurgico di 500 pazienti all'anno, ciò corrisponde a 5 casi in più di ritenzione urinaria e 5 casi in più di vomito postoperatorio all'anno. - Utilizzare le stime per costruire gli scenari migliori e peggiori. Caso migliore: eliminare tre conversioni all'anestesia generale all'anno. Aggiungi $ 25,000 ai costi sanitari. Caso peggiore: eliminare due conversioni all'anestesia generale all'anno. Aggiungi $ 25,000 ai costi sanitari. Crea cinque casi extra di ritenzione urinaria e cinque casi extra di vomito postoperatorio. In questo caso particolare, notiamo che i benefici del farmaco possono essere migliorati se siamo in grado di identificare con precisione una sottopopolazione che potrebbe trarne beneficio. Ad esempio, se il farmaco viene somministrato solo al 10% dei pazienti a più alto rischio di lunghi tempi chirurgici, sia il costo che la morbilità associati al vomito postoperatorio e alla ritenzione urinaria diminuirebbero di un fattore 10. Se la sottopopolazione è accuratamente identificato, il numero di conversioni dell'anestesia generale può essere inalterato o minimamente influenzato.
- Scegli il percorso che più probabilmente gioverà al paziente. A seconda dei rischi coinvolti nelle conversioni all'anestesia generale, questo farmaco potrebbe o meno valere la pena aggiungere al percorso dell'anestesia. In definitiva, per prendere una decisione è necessario il giudizio clinico. Tuttavia, utilizzando la struttura discussa, il clinico è significativamente più informato che se il clinico prendesse semplicemente una decisione basata sulla sola intuizione.
- Affinare continuamente le stime di rischi, costi e benefici. In questo scenario, il volume chirurgico annuo dell'istituto (500) è pari al numero di pazienti coinvolti in ciascun braccio dello studio. Detto questo, se l'istituto tiene traccia dei propri tassi di complicanze prima e dopo il cambiamento, dovrebbe essere in grado di accertare rapidamente i veri rischi, benefici e costi dell'intervento e prendere una decisione più informata rispetto all'analisi iniziale.
Sorprendentemente, accade spesso che il numero di pazienti arruolati negli studi nella letteratura pubblicata sia molto inferiore al numero di interventi chirurgici eseguiti anche in piccoli istituti. Ad esempio, una recente meta-analisi sugli effetti degli oppioidi spinali includeva solo circa 100-150 soggetti e controlli per l'analisi del vomito postoperatorio e della ritenzione urinaria per il fentanil intratecale, nonostante l'uso lungo e diffuso del fentanil nell'anestesia spinale. Per questo motivo, l'analisi dei dati interni è spesso utile per valutare il successo o il fallimento del percorso. L'uso dei dati interni elude anche il problema degli studi pubblicati che utilizzano popolazioni di pazienti, farmaci o tecniche leggermente diversi da quelli utilizzati nell'istituto di origine.
ESEMPI DI PERCORSI CHE HANNO CAUSATO DANNI AL PAZIENTE
La sezione precedente era un'illustrazione ipotetica dello sviluppo di una parte di un percorso. In questa sezione, ci prendiamo un momento per discutere di casi storici in cui il danno al paziente è derivato dall'introduzione di un nuovo farmaco come parte della cura perioperatoria di routine. Sebbene questi farmaci siano stati introdotti prima che la nozione di percorsi chirurgici e anestetici diventasse comune, l'esperienza con questi farmaci fornisce informazioni su alcuni dei rischi dell'applicazione di nuovi trattamenti a grandi coorti di pazienti.
Profilassi di enoxaparina e tromboembolismo venoso
L'enoxaparina è stata la prima eparina a basso peso molecolare approvata dalla Food and Drug Administration degli Stati Uniti per uso generale. Poco dopo l'approvazione del farmaco nel maggio 1993, è entrato nell'uso diffuso e di routine come profilassi per il tromboembolismo venoso. Poiché molti interventi chirurgici ortopedici, inclusa l'artroplastica totale dell'articolazione, rappresentano un rischio elevato di tromboembolismo venoso e l'anestesia epidurale o spinale era spesso l'anestetico preferito per questi casi, l'enoxaparina è stata spesso utilizzata insieme all'anestesia neuroassiale.
Prima dello sviluppo dell'enoxaparina, l'eparina sottocutanea non frazionata era stata ampiamente utilizzata per la profilassi del tromboembolismo venoso. Sebbene il rischio di ematoma epidurale associato alla somministrazione di enoxaparina fosse inizialmente ritenuto paragonabile a quello della somministrazione sottocutanea di eparina, le differenze farmacologiche tra eparina a basso peso molecolare ed eparina non frazionata erano state sottovalutate.
Poco dopo l'introduzione, la Food and Drug Administration statunitense ha iniziato a ricevere segnalazioni di ematoma epidurale associato alla somministrazione di enoxaparina. Nel dicembre 1997, l'amministrazione ha emesso un avviso di salute pubblica in cui affermava di aver ricevuto oltre 30 segnalazioni di ematoma epidurale postneurassiale associato all'enoxaparina e richiedeva che l'enoxaparina recasse un avviso di scatola nera che indicava un rischio significativo di danno per il paziente. Nell'aprile 1998, il numero di segnalazioni era aumentato a più di 40. La Food and Drug Administration degli Stati Uniti ha contattato la Società americana di anestesia regionale e medicina del dolore per sviluppare nuove linee guida per l'uso dell'enoxaparina con anestesia neuroassiale. Queste linee guida sono state pubblicate nel novembre 1998 e raccomandavano un uso molto più conservativo dell'enoxaparina.
Aprotinina e riduzione delle trasfusioni perioperatorie
L'aprotinina è una piccola molecola peptidica che agisce come antifibrinolitico inibendo la tripsina e i relativi enzimi proteolitici. È stato utilizzato più comunemente in cardiochirurgia, dove è stato dimostrato che riduce significativamente i requisiti trasfusionali e il suo uso è stato studiato in altri tipi di interventi chirurgici, come le procedure ortopediche. Sebbene una meta-analisi non abbia mostrato un aumento del rischio di mortalità, infarto del miocardio o insufficienza renale, ampi studi osservazionali hanno contraddetto questi risultati e hanno dimostrato un aumento del rischio di insufficienza renale postoperatoria. Ulteriori studi osservazionali si sono concentrati sul follow-up a lungo termine e hanno confermato l'aumento della morbilità e della mortalità associate all'aprotinina, in particolare per quanto riguarda non solo l'insufficienza renale, ma anche ictus, morte e infarto miocardico non fatale. Le vendite di aprotinina sono state interrotte nel 2008; l'aprotinina è stata ampiamente sostituita dall'acido tranexamico e dall'acido aminocaproico. Rimane qualche controversia sul fatto che gli aumenti osservati nell'insufficienza renale fossero dovuti all'effetto dell'aprotinina o di qualche altro fattore confondente.
Discussione
In entrambi questi esempi, un danno significativo per il paziente è risultato dall'introduzione di un nuovo farmaco in un percorso anestetico e chirurgico perché non c'erano dati sufficienti per indicare il potenziale danno per il paziente. I rischi sono diventati evidenti solo dopo che un numero maggiore di pazienti è stato trattato e si sono verificate complicazioni significative per i pazienti.
Nel primo caso, eparine a basso peso molecolare e anestesia neuroassiale, la difficoltà nel prevedere il danno del paziente era dovuta in gran parte alla frequenza estremamente bassa dell'evento avverso. Se si presume che il rischio di base di ematoma spinale sia 1:150,000, anche un aumento relativamente ampio del rischio di ematoma richiede campioni di grandi dimensioni per rilevare un aumento del rischio. Campioni così grandi spesso non possono essere realisticamente ottenuti prima dell'introduzione di un farmaco e solo la sorveglianza post-approvazione o lo sviluppo di registri clinici di alta qualità rileveranno tali eventi avversi rari, ma potenzialmente catastrofici.
Nel secondo caso, aprotinina e insufficienza renale, è possibile identificare una serie di fattori. Le indagini iniziali non si sono concentrate sull'aumento del rischio di insufficienza renale e o non hanno indagato su questo rischio o lo studio era sottodimensionato. Inoltre, alcuni ritenevano che le complicanze associate all'aprotinina fossero di natura transitoria e che non vi fossero rischi a lungo termine associati all'aprotinina. Ovviamente, questo non poteva essere studiato fino a anni dopo l'entrata in uso dell'aprotinina.
Questi casi evidenziano i rischi associati ai nuovi agenti terapeutici o ai vecchi agenti terapeutici utilizzati in nuove situazioni. Gli studi preliminari possono indagare sui rischi sbagliati o essere sottodimensionati, oppure i rischi possono essere a lungo termine e potrebbero non diventare evidenti fino a molto tempo dopo il periodo di studio. Detto questo, quando si considerano i rischi ei benefici per il paziente, il medico deve anche considerare il rischio sconosciuto o non quantificato e includere l'agente solo se il rapporto tra rischi e benefici noti e quantificabili è estremamente positivo. Per i farmaci con una lunga storia di utilizzo e rischi ben definiti, è necessaria una minore cautela.
COMPONENTI DI UN PERCORSO COMPLETO: ARTROPLASTICA TOTALE DEL GINOCCHIO
In questa sezione presentiamo i componenti di un percorso chirurgico per l'artroplastica totale del ginocchio. Questo è mostrato in Tabella 4. Tuttavia, invece di presentare raccomandazioni finali (come si farebbe in un percorso completato), mettiamo in evidenza le questioni comuni che vengono affrontate quando si sviluppano diversi aspetti del percorso, nonché i farmaci e le tecniche che vengono frequentemente impiegati. Questo viene fatto per evitare di implicare che ci sia un consenso finale sul percorso "corretto" per l'artroplastica totale dell'articolazione, anche se tale consenso esistesse, diventerebbe rapidamente obsoleto man mano che nuovi studi, farmaci e tecniche diventano disponibili. I fornitori con diverse popolazioni di pazienti e diverse sottospecialità possono sviluppare percorsi diversi appropriati per la loro istituzione.
TABELLA 4
| Percorso anestetico per artroplastica articolare totale |
|---|
| Obiettivi del percorso Gli obiettivi del percorso dovrebbero essere chiaramente indicati e includere comunemente la riduzione della mortalità, della morbilità e dei costi; aumento della soddisfazione del paziente; e un migliore controllo del dolore. Gli obiettivi dovrebbero coinvolgere reali endpoint clinici quando possibile ed essere agnostici rispetto ai mezzi, ad esempio, ridurre i punteggi del dolore postoperatorio è un obiettivo più appropriato rispetto alla riduzione del consumo postoperatorio di oppioidi. |
| Selezione del paziente Fattori di rischio modificabili, come fumo, diabete scarsamente controllato, obesità e uso ricreativo di droghe, possono influenzare i tassi di complicanze chirurgiche. Il percorso può affrontare quando l'intervento chirurgico dovrebbe essere ritardato per affrontare questi fattori. Inoltre, comorbidità non modificabili possono creare un rischio chirurgico inaccettabile; i criteri per la selezione dei pazienti possono essere inclusi in un percorso. Ovviamente, questo deve essere coordinato con l'ortopedia. |
| Educazione preoperatoria e pianificazione pre-ricovero Frequentemente, i pazienti vengono visitati di routine in una clinica preoperatoria di anestesia. Questa parte del percorso offre l'opportunità di identificare le caratteristiche del paziente che sono in conflitto con gli elementi predefiniti nel percorso anestetico e affrontarli prima dell'intervento. Ad esempio, un paziente con un'allergia alla penicillina può ricevere un test cutaneo per determinare se al paziente possono essere somministrate cefalosporine. Inoltre, se il percorso include cateteri nervosi periferici continui, ciò può fornire un'opportunità per l'educazione del paziente. |
| Lista di controllo preliminare Questo elemento del percorso comprende frequentemente l'identificazione del paziente, la marcatura del sito, la conferma di allergie e comorbidità, la conferma della disponibilità di emoderivati, la conferma dello stato anticoagulante e il controllo finale dei valori di laboratorio. |
| Premedicazione orale/analgesia multimodale L'ottimizzazione del controllo del dolore deve essere bilanciata con effetti collaterali indesiderati come un'eccessiva sedazione. Di seguito sono elencati gli agenti comuni utilizzati, insieme ai loro vantaggi e svantaggi. |
| Agente | Benefici | svantaggi |
|---|---|---|
| Paracetamolo | Ridurre i punteggi del dolore postoperatorio, il risparmio di oppioidi | epatotossicità |
| Gabapentin/pregabalin | Ridurre i punteggi del dolore postoperatorio, il risparmio di oppioidi, può ridurre l'incidenza del dolore post-chirurgico cronico e avere beneficio nei pazienti con dolore cronico esistente | Aumento della sedazione, in particolare negli anziani; aumento della depressione respiratoria con dosi > 300 mg |
| Inibitori della ciclossigenasi 2 | Ridurre i punteggi del dolore postoperatorio, il risparmio di oppioidi | Insufficienza renale; base di prove indebolita da pubblicazioni ritirate |
| Oppioidi orali (p. es., ossicodone SR) | Ridurre i punteggi del dolore postoperatorio | Aumento del rischio di depressione respiratoria con dose di ossicodone > 10 mg |
| Percorso anestetico per artroplastica articolare totale |
|---|
| Uso dell'anestesia regionale per il controllo del dolore postoperatorio Esiste un ampio spettro di tecniche di anestesia regionale associate all'artroplastica totale del ginocchio, insieme a variazioni significative in termini di costi ed efficacia. La scelta della tecnica influenzerà altri elementi del percorso anestetico e chirurgico. Inoltre, gli approcci si stanno evolvendo rapidamente man mano che nuove tecniche, attrezzature e agenti diventano disponibili. Di seguito sono elencati i siti comuni utilizzati per l'anestesia regionale, insieme a vantaggi e svantaggi. |
| Tecnica | Benefici | svantaggi |
|---|---|---|
| Blocco epidurale | Considerato il gold standard per l'analgesia postoperatoria per una serie di interventi chirurgici | Il profilo degli effetti collaterali può interferire con il moderno percorso terapeutico e un piccolo rischio di esiti catastrofici (p. es., ematoma epidurale). |
| Blocco del nervo femorale | Allevia la maggior parte del dolore postoperatorio, senza inconvenienti di epidurale,; associato a risultati migliori a 6 settimane in uno studio | La debolezza muscolare può interferire con la riabilitazione. Rischio ridotto (2-4 su 10,000) di lesioni nervose a lungo termine, ma la scelta generale dell'anestetico cambia il rischio di lesioni nervose. |
| Blocco del nervo sciatico | Dolore al ginocchio posteriore ridotto | Rischio di neuropatia simile al blocco del nervo femorale. I risultati degli studi variano, dal miglioramento dell'analgesia alla mobilizzazione precoce aggiungere poca o nessuna analgesia al blocco femorale esistente. L'uso del blocco sciatico è controverso ed è improbabile che migliorino i risultati a lungo termine. |
| Blocco selettivo del nervo tibiale | Ridotta probabilità di caduta del piede | Iniezione più vicina alla piega poplitea; rischio di lesione del nervo peroneo con approccio laterale-mediale o danno vascolare. |
| Canale adduttore | Sollievo dal dolore simile al blocco del nervo femorale con ridotta debolezza muscolare; efficace nel trattamento del dolore severo esistente | Più vicino al sito chirurgico; tecnica in evoluzione. |
| Analgesia da infiltrazione locale | Facile e veloce da eseguire, nessuna debolezza muscolare | Prove in evoluzione per l'efficacia in questo contesto. Tuttavia, gli esperti sottolineano la scarsa qualità di alcuni degli studi esistenti. Successo della tecnica probabilmente dipendente dall'operatore. Associato a paralisi transitoria del nervo peroneo. |
| Una volta scelti uno o più siti per l'anestesia regionale, il fornitore può utilizzare diverse tecniche per ottenere l'analgesia postoperatoria, riassunte di seguito. | ||
| Colpo singolo | Veloce da eseguire; a basso costo; efficace. | Durata più breve (può essere utile se è necessario un rapido recupero della forza muscolare per la terapia fisica). |
| Catetere nervoso | Miglioramento dell'analgesia rispetto alla tecnica a iniezione singola. Durata più lunga dell'analgesia; titolabile; controllo del grado di blocco motore modificando la portata. | Più difficile e dispendioso in termini di tempo da eseguire; più costoso; richiede sorveglianza postoperatoria. |
| Formulazioni a rilascio prolungato di anestetico locale (p. es., bupivacaina liposomiale) | Veloce da eseguire come un blocco a colpo singolo, con una maggiore durata del blocco. | Rispetto alla bupivacaina, attualmente poche prove di efficacia. Costoso. Limita la capacità di rifare il blocco. Profilo di sicurezza ed effetti collaterali attualmente emergente. |
| Anestesia chirurgica Le opzioni per l'anestesia chirurgica sono riassunte di seguito. |
||
| Anestesia | Benefici | svantaggi |
|---|---|---|
| Spinale | Associato a risultati migliori, requisiti ridotti per i servizi di terapia intensiva. | Può essere tecnicamente difficile su alcuni pazienti. Occasionali esiti catastrofici (p. es., ematoma epidurale). La durata dell'anestesia spinale può essere inadeguata per un intervento chirurgico. I pazienti possono essere riluttanti a essere "svegli" per un intervento chirurgico |
| Epidurale | Benefici simili a quelli spinali, ma possono essere utilizzati per l'analgesia postoperatoria e per interventi chirurgici di lunga durata. | Può essere tecnicamente difficile su alcuni pazienti. Occasionali esiti catastrofici (es ematoma epidurale). I pazienti possono essere riluttanti a essere "svegli" per un intervento chirurgico. |
| Generale | Amnesia completa. | Associato a scarsi risultati rispetto alla colonna vertebrale. Occasionale esito catastrofico (p. es., vie aeree difficili); aumento del rischio di depressione respiratoria. |
| L'anestesia neuroassiale è stata associata a risultati migliori; tuttavia, questa modalità non è sempre la modalità preferita. Se viene impiegata l'anestesia neuroassiale, devono essere prese decisioni riguardanti l'inclusione o l'esclusione di oppioidi a lunga o breve durata d'azione; questa decisione può essere complessa in quanto influisce su molti elementi del percorso successivo (monitoraggio postoperatorio, riabilitazione, ecc.). Anche i pazienti che ricevono un'anestesia neuroassiale di solito richiedono sedazione e alcuni percorsi possono specificare gli agenti oi livelli di sedazione desiderati, in parte per evitare di sedare eccessivamente i pazienti. Inoltre, è probabile che alcuni pazienti non siano adatti per l'anestesia neuroassiale, ad esempio a causa del tempo chirurgico previsto per le revisioni articolari; questo e altri criteri (come la spina dorsale difficile) per procedere all'anestesia generale possono essere descritti in questa sezione. | ||
| Farmaci intraoperatori I farmaci intraoperatori possono includere antibiotici di prima e seconda linea, antiemetici preferiti per l'anestesia spinale rispetto all'anestesia generale e sedativi preferiti se viene scelta l'anestesia spinale o epidurale. L'anticoagulazione è di solito iniziata nel periodo postoperatorio dal team chirurgico, ma può essere commentata qui. Da notare che il desametasone intraoperatorio sembra migliorare i punteggi del dolore postoperatorio oltre a fornire un efficace antiemetico, senza aumentare il rischio di infezione o altre complicanze perioperatorie. |
| Percorso anestetico per artroplastica articolare totale |
|---|
| Obiettivi trasfusionali intraoperatori e opzioni di conservazione del sangue La trasfusione di sangue presenta una serie di rischi,53 e uno degli obiettivi del percorso potrebbe essere quello di ridurre al minimo la perdita di sangue e quindi i requisiti di trasfusione. Un'ampia varietà di tecniche può ridurre al minimo la perdita di sangue, alcune delle quali sono riassunte di seguito. |
| Tecnica | Benefici | svantaggi |
|---|---|---|
| Ipotensione intraoperatoria | Perdita di sangue ridotta. | Sono richiesti maggiore vigilanza e monitoraggio. Rischio di ischemia degli organi terminali. La sottorianimazione può contribuire all'intolleranza ortostatica postoperatoria, compromettendo la mobilizzazione precoce. |
| Uso del laccio emostatico | Perdita di sangue ridotta e protocolli per un uso appropriato. | Rischio di danno ischemico o neuropatia assonale o effetto sulla funzione del quadricipite. |
| Termoregolazione adeguata | Perdita di sangue ridotta grazie al mantenimento della cascata di coagulazione, recupero migliorato. | |
| Scavenging cellulare | Ridotto fabbisogno di emoderivati allogenici. | Costo e complessità aggiunti. |
| Scarichi di reinfusione | Ridotto fabbisogno di emoderivati allogenici. | Costo e complessità aggiunti. |
| Acido tranexamico | Perdita di sangue ridotta grazie all'antifibrinolisi. | Associazione con convulsioni. Non è noto un aumento del rischio di eventi trombotici, ma è entrato in uso solo di recente in questa popolazione chirurgica. |
| Controllo del dolore postoperatorio I percorsi spesso affrontano il controllo del dolore per i pazienti con dolore cronico o uso di oppioidi, così come quelli senza. In generale, questa sezione commenterà sia le velocità di infusione previste per eventuali cateteri nervosi periferici, sia adiuvanti come la somministrazione di oppioidi controllata dal paziente, la ketamina o altri agenti. |
||
| Considerazioni sul percorso chirurgico ortopedico I percorsi a volte commentano i modi in cui interagiscono con il percorso del chirurgo per chiarire il motivo per cui vengono formulate raccomandazioni particolari. |
||
I singoli elementi del percorso comprendono argomenti così diversi come la pianificazione preoperatoria, l'educazione del paziente, la gestione dell'anestesia intraoperatoria, la gestione del dolore postoperatorio e gli obiettivi fluidi ed emodinamici. Un percorso completato, oltre a contenere raccomandazioni precise e dettagliate sulla gestione, conterrebbe un addendum che delinea le prove utilizzate per prendere decisioni sul percorso. Come abbiamo visto, tuttavia, anche dopo aver individuato la letteratura appropriata, c'è spesso una quantità significativa di analisi e giudizio che deve essere utilizzata nell'applicare la letteratura al percorso.
Un percorso finale è utile solo se è ampiamente distribuito a tutti i fornitori interessati. Oltre alla distribuzione elettronica, i percorsi possono essere visualizzati sotto forma di poster. Ciò consente all'operatore dell'anestesia di avere i passaggi del percorso facilmente disponibili nelle diverse fasi della cura del paziente. I luoghi comuni per visualizzare le informazioni sul percorso includono aree preoperatorie, baie per anestesia regionale, sale operatorie e sale di lavoro per anestesia. Inoltre, con l'avvento dei sistemi di cartelle cliniche elettroniche, molte istituzioni hanno la capacità di creare set di ordini, che creano automaticamente ordini associati al percorso.
CONCLUSIONE
I percorsi di anestesia e analgesia perioperatori forniscono un modo unico per migliorare l'assistenza ai pazienti e ridurre i costi implementando le risorse e la tecnologia esistenti in modo basato sull'evidenza. Lo sviluppo del percorso dovrebbe, quindi, essere considerato una componente vitale della pratica dell'anestesista.
BIBLIOGRAFIA
- Pugely AJ, Martin CT, Gao Y, Mendoza-Lattes S, Callaghan JJ: differenze nelle complicanze a breve termine tra anestesia spinale e generale per l'artroplastica totale del ginocchio primaria. J Bone Joint Surg Am 2013;95(3):193–199.
- Memtsoudis SG, Sun X, Chiu YL, et al. Efficacia comparativa perioperatoria della tecnica anestetica nei pazienti ortopedici. Anestesiologia 2013;118(5):1046–1058.
- Stundner O, Chiu YL, Sun X, et al: Risultati perioperatori comparativi associati all'anestesia neuroassiale rispetto a quella generale per l'artroplastica totale bilaterale simultanea del ginocchio. Reg Anesth Pain Med 2012;37(6):638–644.
- Memtsoudis SG, Stundner O, Rasul R, et al: Apnea notturna e artroplastica articolare totale in vari tipi di anestesia: uno studio basato sulla popolazione degli esiti perioperatori. Reg Anesth Pain Med 2013;38(4):274–281.
- Liu J, Ma C, Elkassabany N, Fleisher LA, Neuman MD: L'anestesia neuroassiale riduce il rischio di infezione sistemica postoperatoria rispetto all'anestesia generale nell'artroplastica del ginocchio. Anesth Analg 2013;117(4):1010–1016.
- Rotter T, Kinsman L, James E, et al: Percorsi clinici: effetti sulla pratica professionale, sui risultati dei pazienti, sulla durata della degenza e sui costi ospedalieri. Sistema di database Cochrane Rev 2010(3):CD006632.
- Shiboski S. Epidemiologia e biostatistica. 2015. http://www.epibiostat.ucsf.edu/biostat/samplesize.html. Accesso il 30 giugno 2015.
- Brant R. Calcoli delle dimensioni del campione. 2015. http://www.stat.ubc.ca/~rollin/stats/ssize/. Accesso il 30 giugno 2015.
- Popping DM, Elia N, Marret E, Wenk M, Tramer MR: oppioidi aggiunti agli anestetici locali per l'anestesia intratecale a colpo singolo in pazienti sottoposti a chirurgia minore: una meta-analisi di studi randomizzati. Dolore 2012;153(4):784–793.
- Horlocker TT, Wedel DJ: blocco neuroassiale ed eparina a basso peso molecolare: bilanciamento dell'analgesia perioperatoria e della tromboprofilassi. Reg Anesth Pain Med 1998;23(6 Suppl 2):164–177.
- Usignolo SL. Dalla Food and Drug Administration. JAMA 1999;282(1):19.
- Wysowski DK, Talarico L, Bacsanyi J, Botstein P: ematoma spinale ed epidurale ed eparina a basso peso molecolare. N Inglese J Med 1998;338(24):1774–1775.
- Bidstrup BP, Royston D, Sapsford RN, Taylor KM: riduzione della perdita di sangue e del consumo di sangue dopo bypass cardiopolmonare con aprotinina ad alto dosaggio (Trasylol). J Thorac Cardiovasc Surg 1989;97(3):364–372.
- Royston D, Bidstrup BP, Taylor KM, Sapsford RN: Effetto dell'aprotinina sulla necessità di trasfusioni di sangue dopo ripetuti interventi chirurgici a cuore aperto. Lancet 1987;2(8571):1289–1291.
- Mahdy AM, Webster NR: agenti emostatici sistemici perioperatori. Fr. J Anaesth 2004;93(6):842–858.
- Shiga T, Wajima Z, Inoue T, Sakamoto A: Aprotinina nella chirurgia ortopedica maggiore: una revisione sistematica di studi randomizzati e controllati. Anesth Analg 2005;101(6):1602–1607.
- Sedrakyan A, Treasure T, Elefteriades JA: Effetto dell'aprotinina sugli esiti clinici nella chirurgia dell'innesto di bypass coronarico: una revisione sistematica e una meta-analisi di studi clinici randomizzati. J Thorac Cardiovasc Surg 2004;128(3):442-–448.
- Mangano DT, Tudor IC, Dietzel C, Studio multicentrico sull'ischemia perioperatoria Ricerca G, Ischemia R, Educazione F: Il rischio associato all'aprotinina nella chirurgia cardiaca. N Inglese J Med 2006;354(4):353–365.
- Shaw AD, Stafford-Smith M, White WD, et al: L'effetto dell'aprotinina sull'esito dopo l'innesto di bypass coronarico. N Inglese J Med 2008;358(8):784–793.
- Mangano DT, Miao Y, Vuylsteke A, et al: Mortalità associata all'aprotinina durante 5 anni dopo un intervento chirurgico di bypass dell'arteria coronaria. JAMA 2007;297(5):471–479.
- Furnary AP, Wu Y, Hiratzka LF, Grunkemeier GL, Pagina US 3: L'aprotinina non aumenta il rischio di insufficienza renale nei pazienti sottoposti a cardiochirurgia. Diffusione 2007;116(11 Suppl):I127–I133.
- Schroeder DR: Statistiche: rilevamento di una rara reazione avversa al farmaco utilizzando segnalazioni spontanee. Reg Anesth Pain Med 1998;23(6 Suppl 2):183–189.
- Peersman G, Laskin R, Davis J, Peterson M: Infection in total knee replacement: una revisione retrospettiva di 6489 protesi totali di ginocchio. Clin Orthop Relat Res 2001(392):15–23.
- Zhou TJ, Tang J, White PF: propacetamolo contro ketorolac per il trattamento del dolore postoperatorio acuto dopo sostituzione totale dell'anca o del ginocchio. Anesth Analg 2001;92(6):1569–1575.
- Mishriky BM, Waldron NH, Habib AS: Impatto del pregabalin sul dolore postoperatorio acuto e persistente: una revisione sistematica e una meta-analisi. Fr. J. Anaesth. 2015;114(1):10–31.
- Clarke H, Bonin RP, Orser BA, Englesakis M, Wijeysundera DN, Katz J: La prevenzione del dolore post-chirurgico cronico mediante gabapentin e pregabalin: una revisione sistematica combinata e una meta-analisi. Anesth Analg 2012;115(2):428–442.
- Sawan H, Chen AF, Viscusi ER, Parvizi J, Hozack WJ: Pregabalin riduce il consumo di oppioidi e migliora l'esito nei pazienti con dolore cronico sottoposti ad artroplastica totale del ginocchio. Phys Sportsmed 2014;42(2):10–18.
- Weingarten TN, Jacob AK, Njathi CW, Wilson GA, Sprung J: protocollo analgesico multimodale e depressione respiratoria postanestesia durante il recupero di fase I dopo artroplastica totale dell'articolazione. Reg Anesth Antidolorifico 2015;40(4):330–336.
- Lin J, Zhang L, Yang H: Somministrazione perioperatoria di inibitori selettivi della ciclossigenasi-2 per la gestione del dolore postoperatorio nei pazienti dopo artroplastica totale del ginocchio. J Artroplastica. 2013;28(2):207–213 e2.
- Rothwell MP, Pearson D, Hunter JD, et al: L'ossicodone orale offre un'analgesia equivalente all'analgesia endovenosa controllata dal paziente dopo la sostituzione totale dell'anca: uno studio randomizzato, monocentrico, non in cieco, di non inferiorità. Fr. J Anaesth 2011;106(6):865–872.
- Pumberger M, Memtsoudis SG, Stundner O, et al: un'analisi della sicurezza dell'anestesia neuroassiale epidurale e spinale in oltre 100,000 sostituzioni articolari degli arti inferiori maggiori consecutive. Reg Anesth Antidolorifico 2013;38(6):515–519.
- Bateman BT, Mhyre JM, Ehrenfeld J, et al: Il rischio e gli esiti degli ematomi epidurali dopo il cateterismo epidurale perioperatorio e ostetrico: un rapporto del Multicenter Perioperative Outcomes Group Research Consortium. Anesth Analg 2013;116(6):1380–1385.
- Paul JE, Arya A, Hurlburt L, et al: Il blocco del nervo femorale migliora i risultati dell'analgesia dopo l'artroplastica totale del ginocchio: una meta-analisi di studi randomizzati controllati. Anestesiologia 2010;113(5):1144–1162.
- Carli F, Clemente A, Asenjo JF, et al: Analgesia e risultato funzionale dopo artroplastica totale del ginocchio: infiltrazione periarticolare vs blocco del nervo femorale continuo. Fr. J Anaesth 2010;105(2):185–195.
- Neal JM, Barrington MJ, Brull R, et al: Il secondo avviso di pratica ASRA sulle complicanze neurologiche associate all'anestesia regionale e al sommario esecutivo della medicina del dolore 2015. Reg Anesth Pain Med 2015;40(5):401–430.
- Jacob AK, Mantilla CB, Sviggum HP, Schroeder DR, Pagnano MW, Hebl JR: Lesione nervosa perioperatoria dopo artroplastica totale del ginocchio: rischio di anestesia regionale durante uno studio di coorte di 20 anni. Anestesiologia 2011;114(2):311–317.
- Sato K, Adachi T, Shirai N, Naoi N: blocco del nervo sciatico continuo rispetto a iniezione singola aggiunto al blocco del nervo femorale continuo per analgesia dopo artroplastica totale del ginocchio: uno studio prospettico, randomizzato, in doppio cieco. Reg Anesth Pain Med 2014;39(3):225–229.
- 38. Cappelleri G, Ghisi D, Fanelli A, Albertin A, Somalvico F, Aldegheri G: Il blocco del nervo sciatico continuo migliora l'analgesia postoperatoria e la riabilitazione precoce dopo l'artroplastica totale del ginocchio? Uno studio prospettico, randomizzato, in doppio cieco. Reg Anesth Pain Med 2011;36(5):489–492.
- Abdallah FW, Chan VW, Gandhi R, Koshkin A, Abbas S, Brull R: Gli effetti analgesici del blocco del nervo sciatico prossimale, distale o assente sul dolore al ginocchio posteriore dopo l'artroplastica totale del ginocchio: uno studio randomizzato in doppio cieco controllato con placebo. Anestesiologia 2014;121(6):1302–1310.
- Safa B, Gollish J, Haslam L, McCartney CJ: confronto degli effetti del blocco del nervo sciatico a colpo singolo rispetto all'infiltrazione anestetica locale della capsula posteriore sull'analgesia e sull'esito funzionale dopo l'artroplastica totale del ginocchio: uno studio prospettico, randomizzato, in doppio cieco, controllato. J Artroplastica 2014;29(6):1149–1153.
- Wegener JT, van Ooij B, van Dijk CN, et al: Dolore a lungo termine e disabilità funzionale dopo artroplastica totale del ginocchio con e senza blocco del nervo sciatico a iniezione singola o continuo oltre al blocco del nervo femorale continuo: A prospettico, 1 anno follow-up di uno studio randomizzato controllato. Reg Anesth Pain Med 2013;38(1):58–63.
- Sinha SK, Abrams JH, Arumugam S, et al: Il blocco del nervo femorale con blocco del nervo tibiale selettivo fornisce un'analgesia efficace senza caduta del piede dopo l'artroplastica totale del ginocchio: uno studio prospettico, randomizzato, in cieco per l'osservatore. Anesth Analg 2012;115(1):202–206.
- Jaeger P, Zaric D, Fomsgaard JS, et al: blocco del canale adduttore contro blocco del nervo femorale per analgesia dopo artroplastica totale del ginocchio: uno studio randomizzato, in doppio cieco. Reg Anesth Antidolorifico 2013;38(6):526–532.
- Jaeger P, Grevstad U, Henningsen MH, Gottschau B, Mathiesen O, Dahl JB: Effetto del blocco del canale adduttore sul dolore postoperatorio grave e accertato dopo artroplastica totale del ginocchio: uno studio randomizzato. Acta Anaesth Scand 2012;56(8):1013–1019.
- Andersen LO, Kehlet H: Efficacia analgesica dell'analgesia da infiltrazione locale nell'artroplastica dell'anca e del ginocchio: una revisione sistematica. Fr. J Anaesth 2014;113(3):360–374.
- Tsukada S, Wakui M, Hoshino A: Analgesia epidurale postoperatoria rispetto all'iniezione periarticolare intraoperatoria per il controllo del dolore dopo l'artroplastica totale del ginocchio in anestesia spinale: uno studio controllato randomizzato. J Bone Joint Surg Am 2014;96(17):1433–1438.
- Bingham AE, Fu R, Horn JL, Abrahams MS: blocco del nervo periferico continuo rispetto al blocco del nervo periferico a iniezione singola: una revisione sistematica e una meta-analisi di studi randomizzati controllati. Reg Anesth Pain Med 2012;37(6):583–594.
- Schroer WC, Diesfeld PG, LeMarr AR, Morton DJ, Reedy ME: La bupivacaina liposomiale a rilascio prolungato controlla meglio il dolore rispetto alla bupivacaina dopo la TKA? Uno studio clinico prospettico randomizzato. J Artroplastica 2015;30(9 Suppl):64–67.
- Ilfeld BM, Viscusi ER, Hadzic A, et al: Profilo di sicurezza ed effetti collaterali del liposoma bupivacaina (Exparel) nei blocchi nervosi periferici. Reg Anesth Antidolorifico 2015;40(5):572–582.
- Memtsoudis SG, Sun X, Chiu YL, et al: Utilizzo dei servizi di terapia intensiva tra i pazienti sottoposti ad artroplastica totale dell'anca e del ginocchio: epidemiologia e fattori di rischio. Anestesiologia 2012;117(1):107–116.
- Fleischut PM, Eskreis-Winkler JM, Gaber-Baylis LK, et al: Variabilità nella cura anestetica per l'artroplastica totale del ginocchio: un'analisi dell'istituto di qualità dell'anestesia. Am J Med Qual 2015;30(2):172–179.
- Backes JR, Bentley JC, Politi JR, Chambers BT: il desametasone riduce la durata del ricovero e migliora il dolore postoperatorio e la nausea dopo l'artroplastica totale dell'articolazione: uno studio prospettico, randomizzato e controllato. J Artroplastica 2013;28(8 Suppl):11–17.
- Goodnough LT: Rischi di trasfusione di sangue. Crit Care Med 2003;31(12 Suppl):S678–S686.
- Fitzgibbons PG, Digiovanni C, Hares S, Akelman E: Uso sicuro del laccio emostatico: una revisione delle prove. J Am Acad Orthop Surg 2012;20(5):310–319.
- Nitz AJ, Dobner JJ, Matulionis DH: applicazione del laccio emostatico pneumatico e integrità del nervo: funzione motoria ed elettrofisiologia. Exp Neurol 1986;94(2):264–279.
- Kornbluth ID, Freedman MK, Sher L, Frederick RW: paralisi del nervo femorale e safenico dopo l'uso del laccio emostatico: un caso clinico. Arch Phys Med Rehab 2003;84(6):909–911.
- Weingarden SI, Louis DL, Waylonis GW: cambiamenti elettromiografici nei pazienti postmeniscectomia. Ruolo del laccio emostatico pneumatico. JAMA 1979;241(12):1248–1250.
- Saunders KC, Louis DL, Weingarden SI, Waylonis GW: Effetto del tempo del laccio emostatico sulla funzione postoperatoria del quadricipite. Clin Orthop Relat Res 1979(143):194–199.
- Kagoma YK, Crowther MA, Douketis J, Bhandari M, Eikelboom J, Lim W: Uso della terapia antifibrinolitica per ridurre la trasfusione nei pazienti sottoposti a chirurgia ortopedica: una revisione sistematica di studi randomizzati. Trombosi Res 2009;123(5):687–696.
- Murkin JM, Falter F, Granton J, Young B, Burt C, Chu M: L'acido tranexamico ad alte dosi è associato a crisi cliniche non ischemiche nei pazienti cardiochirurgici. Anesth Analg 2010;110(2):350–353.