Kenneth D. Candido, Anthony R. Tharian et Alon P. Winnie
INTRODUCTION
L'anesthésie caudale a été décrite au tournant du siècle dernier par deux médecins français, Fernand Cathelin et Jean-Anthanase Sicard. La technique est antérieure à l'abord lombaire bloc nerveux épidural par plusieurs années. L'anesthésie caudale, cependant, n'a pas gagné en popularité immédiatement après sa création. L'une des principales raisons pour lesquelles l'anesthésie caudale n'a pas été adoptée est les grandes variations anatomiques des os sacrés et le taux d'échec conséquent associé aux tentatives de localisation du hiatus sacré. Le taux d'échec de 5 % à 10 % a rendu l'anesthésie péridurale caudale impopulaire jusqu'à un regain d'intérêt dans les années 1940, mené par Hingson et ses collègues, qui l'ont utilisée dans anesthésie obstétricale. L'anesthésie péridurale caudale a de nombreuses applications, y compris l'anesthésie chirurgicale chez les enfants et les adultes, ainsi que la gestion des états de douleur aiguë et chronique. Des taux de réussite de 98 % à 100 % peuvent être atteints chez les nourrissons et les jeunes enfants avant l'âge de la puberté, ainsi que chez les adultes maigres. La technique du bloc nerveux épidural caudal dans la gestion de la douleur a été grandement améliorée par l'utilisation du guidage fluoroscopique et de l'épidurographie, dans lesquels des taux de réussite élevés peuvent être atteints.
Malheureusement, les indications cliniques et en particulier les interventions thérapeutiques pour le soulagement de la douleur chronique chez les personnes atteintes du syndrome d'échec de la chirurgie du dos sont souvent plus répandues chez les patients présentant des repères caudaux difficiles. Il a été suggéré que le bloc nerveux péridural lombaire traditionnel ne devrait pas être tenté en utilisant une approche nécessitant le placement d'une aiguille à travers une cicatrice de chirurgie rachidienne en raison de la probabilité de déchirure de la dure-mère et de la possibilité d'induire la formation d'un hématome sur la queue de cheval lorsque le sang de la procédure devient piégé entre les couches de tissu cicatriciel et conjonctif. Dans ces circonstances, il est recommandé d'effectuer un bloc nerveux épidural caudal guidé par fluoroscopie au lieu de l'approche de palpation traditionnelle. Alternativement, l'utilisation de l'échographie peut être appropriée pour identifier le hiatus sacré, et cette technique a été récemment décrite. La deuxième recrudescence de la popularité de l'anesthésie caudale s'est accompagnée du besoin croissant de trouver des alternatives sûres au bloc nerveux péridural lombaire conventionnel chez certaines populations de patients, telles que les personnes atteintes du syndrome de l'échec de la chirurgie du dos.
CONSIDÉRATIONS ANATOMIQUES
Le sacrum est un gros os de forme triangulaire formé par la fusion des cinq vertèbres sacrées. Il a un sommet caudal émoussé qui s'articule avec le coccyx. Sa large base supérieure s'articule avec la cinquième vertèbre lombaire à l'angle lombo-sacré (voir Figure 1A). Sa face dorsale est convexe et présente une crête médiane interrompue surélevée avec quatre (parfois trois) tubercules épineux représentant des épines sacrées fusionnées. Flanquant la crête médiane, la face postérieure est formée de lames fusionnées. Latéralement à la crête médiane, quatre paires de foramens dorsaux mènent au canal sacré par des foramens intervertébraux, dont chacun transmet la branche dorsale d'un nerf rachidien sacré (voir Figure 1A). Sous le quatrième (ou troisième) tubercule épineux, un hiatus sacré arqué est identifié dans la paroi postérieure du canal sacré en raison de l'échec de la cinquième paire de lames à se rencontrer, exposant la surface dorsale du cinquième corps vertébral sacré. L'ouverture caudale du canal est le hiatus sacré (voir Figures 1B et 1C) couvert par la membrane élastique ferme, le ligament sacro-coccygien, qui est une extension du ligament jaune. Les cinquièmes processus articulaires inférieurs se projettent caudalement et flanquent le hiatus sacré sous forme de cornes sacrées, reliées aux cornes coccygiennes par des ligaments intercornuels.
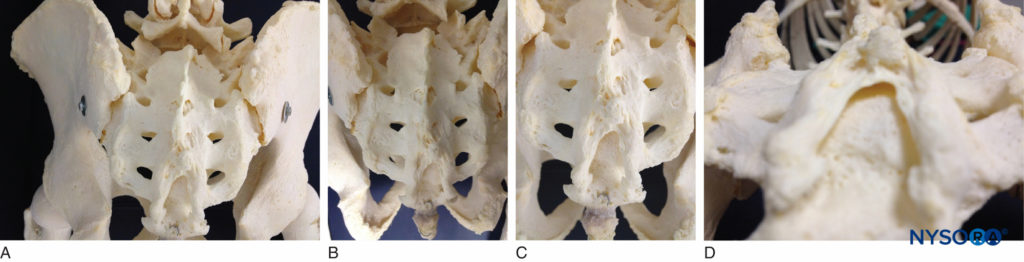
FIGURE 1. A : Spécimen squelettique du sacrum vu de la tête à la caudade montrant les quatre paires de foramens dorsaux, situés bilatéralement. B : Modèle squelettique démontrant le hiatus sacré et sa relation avec le coccyx et le sacrum. Les cinquièmes processus articulaires inférieurs se projettent caudalement et flanquent le hiatus sacré sous forme de cornes sacrées. C : Modèle squelettique montrant le hiatus sacré avec la surface dorsale exposée du cinquième corps vertébral sacré. D : Spécimen squelettique vu du dessous du hiatus sacré
Le canal sacré est de forme triangulaire. C'est une continuation du canal rachidien lombaire. Chaque paroi latérale présente quatre foramens intervertébraux, à travers lesquels le canal est contigu aux foramens sacrés pelviens et dorsaux. Les foramens sacrés postérieurs sont plus petits que leurs homologues antérieurs. Le canal sacré contient la queue de cheval (y compris le filum terminale) et les méninges spinales. Près de son niveau médian (généralement le tiers médian de S2, mais variant du milieu de S1 au milieu de S3), les espaces sous-arachnoïdien et sous-dural cessent d'exister, et les racines vertébrales sacrées inférieures et le filum terminale percent l'arachnoïde et la dure-mère. mater. Cependant, les variations de la terminaison du sac dural ainsi que des conditions pathologiques telles que la méningocèle sacrée ou les kystes périnerveux sacrés peuvent augmenter les risques de ponction durale accidentelle lors de la réalisation d'un bloc nerveux caudal chez ces patients présentant une anatomie anormale.
La marge la plus basse du filum terminale émerge au hiatus sacré et traverse la surface dorsale de la cinquième vertèbre sacrée et l'articulation sacro-coccygienne pour atteindre le coccyx. Les cinquièmes racines nerveuses sacrées émergent également à travers le hiatus médian de chacune des cornes sacrées. Le canal sacré contient le plexus veineux épidural, qui se termine généralement en S4 mais qui peut continuer plus caudalement. La plupart de ces vaisseaux sont concentrés dans la partie antérolatérale du canal. Le reste du canal sacré est rempli de tissu adipeux, qui est sujet à une diminution de sa densité liée à l'âge. Ce changement peut être responsable de la transition de la propagation prévisible des anesthésiques locaux administrés pour l'anesthésie caudale chez les enfants à la propagation segmentaire limitée et imprévisible observée chez les adultes.
Une variabilité considérable se produit dans l'anatomie du hiatus sacré chez des individus d'origines, de race et de stature apparemment similaires. À mesure que les individus vieillissent, les ligaments sus-jacents et les cornes s'épaississent considérablement. Les marges hiatales défient souvent la reconnaissance même du bout des doigts. Les problèmes pratiques liés à l'anesthésie caudale sont principalement attribuables aux grandes variations anatomiques de taille, de forme et d'orientation du sacrum. Trotter résume les principales variations anatomiques du sacrum. Le hiatus sacré peut être presque fermé, asymétriquement ouvert ou largement ouvert en raison d'anomalies dans le schéma de fusion des lames des arcs sacrés. Un spina bifida sacré a été observé chez environ 2 % des hommes et chez 0.3 % des femmes. La profondeur antéropostérieure du canal sacré peut varier de moins de 2 mm à plus de 1 cm. Les personnes dont les canaux sacrés ont un diamètre antéro-postérieur (AP) inférieur à environ 3 mm peuvent ne pas être en mesure d'accueillir quoi que ce soit de plus grand qu'une aiguille de calibre 21 (5 % de la population).
De plus, la largeur latérale du canal sacré varie considérablement. Étant donné que la profondeur et la largeur peuvent varier, le volume du canal lui-même peut également varier. Trotter a constaté que les volumes sacrés variaient entre 12 et 65 ml, avec un volume moyen de 33 ml. Une étude d'imagerie par résonance magnétique (IRM) chez 37 patients adultes a révélé que le volume (à l'exclusion des foramens et du sac dural) était de 14.4 ml, avec une plage de 9.5 à 26.6 ml. Les patients ayant des capacités plus petites peuvent ne pas être en mesure d'accueillir les volumes typiques d'anesthésiques locaux administrés pour l'anesthésie péridurale par la voie caudale. Dans une étude cadavérique de 53 spécimens, la distance moyenne entre la pointe du sac dural et le bord supérieur du hiatus sacré, comme indiqué par la membrane sacro-coccygienne, était de 45 mm, avec une plage de 16 à 75 mm. Dans l'étude IRM mentionnée, la distance moyenne s'est avérée être de 60.5 mm, avec une plage de 34 à 80 mm.
La membrane sacro-coccygienne n'a pas pu être identifiée chez 10.8 % des sujets utilisant l'IRM. Une évaluation anatomique de 92 sacres isolés a révélé que 42 % des cas présentaient à la fois un hiatus et une corne ; 4% des cas ont montré une absence de hiatus. L'apex du hiatus sacré, dans cette étude, était noté dans 64% des cas pour sortir au niveau S4. Le hiatus était fermé dans 3 % des cas.
Les foramens sacrés offrent des passages anatomiques qui permettent la propagation des solutions injectées, telles que les anesthésiques locaux et les adjuvants (voir Figure 1A). Les foramens sacrés postérieurs sont essentiellement scellés par les muscles multifidus et sacrospinalis, mais les foramens antérieurs ne sont pas obstrués par les muscles et les ligaments, permettant une sortie facile des solutions à travers eux. La courbure sacrée varie considérablement. Dans une étude cadavérique, portant sur l'anatomie de l'espace péridural caudal, les cornes sacrées n'étaient pas palpables bilatéralement dans 14.3 % des cas et palpables unilatéralement dans 24.5 % des spécimens. Le niveau de courbure maximale du sacrum était à S3 dans 69.4 % des cas. Cette variabilité a tendance à être plus sévère chez les hommes que chez les femmes.
La signification clinique de cette découverte est qu'une aiguille péridurale non incurvée passera plus facilement dans le canal des femmes que des hommes. L'angle entre l'axe du canal lombaire et le canal sacré varie entre 7° et 70° chez les sujets présentant une lordose marquée. L'implication clinique de cette découverte est que le flux céphalique des solutions injectées par voie caudale peut être plus limité chez les patients lordotiques avec des angles lombo-sacrés exagérés que chez ceux avec des angles lombo-sacrés plus plats, chez qui les axes des canaux lombaire et sacré sont plus étroitement alignés.
Conseils NYSORA
- Une variabilité considérable se produit dans l'anatomie du hiatus sacré.
- Avec l'âge, les ligaments sus-jacents et les cornes s'épaississent; par conséquent, l'identification des marges hiatales sacrées devient plus difficile.
- Le taux de réussite de l'anesthésie caudale dépend largement des variations anatomiques de la taille, de la forme et de l'orientation du sacrum.
En savoir plus sur Anatomie neuraxiale.
INDICATIONS POUR LE BLOC DU NERF ÉPIDURAL CAUDAL
Les indications du bloc nerveux épidural caudal sont essentiellement les mêmes que pour bloc nerveux péridural lombaire, mais son utilisation peut être préférée lorsque la propagation par le nerf sacré des anesthésiques et des adjuvants est préférée à la propagation par le nerf lombaire. La propagation céphalique imprévisible des anesthésiques administrés dans le canal caudal limite l'utilisation de cette technique dans les situations où il est essentiel de fournir un bloc neuraxial thoracique inférieur et abdominal supérieur. Bien que cette modalité soit décrite pour une utilisation périopératoire (rôle décroissant) et pour la prise en charge de scénarios de douleur chronique chez l'adulte (rôle croissant), le bloc du nerf caudal a un large éventail d'indications (Tableau 1). Traitement réussi de céphalée post-ponction durale en effectuant un patch sanguin péridural à travers une aiguille placée caudalement a été rapporté.
TABLE 1. Indications du bloc nerveux péridural caudal.
| Chirurgie, obstétrique, diagnostic et pronostic | |
|---|---|
| 1. | Anesthésie chirurgicale |
| 2. | Anesthésie obstétricale |
| 3. | Bloc neural différentiel pour évaluer la douleur pelvienne, vésicale, périnéale, génitale, rectale, anale et des membres inférieurs |
| 4. | Indicateur pronostique avant destruction des nerfs sacrés |
| La douleur aiguë | |
|---|---|
| 1. | Lombalgie aiguë |
| 2. | Radiculopathie lombaire aiguë |
| 3. | Palliation dans les urgences douloureuses aiguës |
| 4. | La douleur postopératoire |
| 5. | Douleur pelvienne et des membres inférieurs secondaire à un traumatisme |
| 6. | Douleur du zona aigu |
| 7. | Insuffisance vasculaire aiguë des membres inférieurs |
| 8. | Hydradénite suppurée |
| Douleur bénigne chronique | |
|---|---|
| 1. | Radiculopathie lombaire |
| 2. | Sténose spinale |
| 3. | Syndrome du bas du dos |
| 4. | Fractures de compression vertébrales |
| 5. | Polyneuropathie diabétique |
| 6. | Névralgie post-zostérienne |
| 7. | Dystrophie sympathique réflexe |
| 8. | Orchialgie |
| 9. | Proctalgie |
| 10. | Syndromes douloureux pelviens |
| Douleur du cancer | |
|---|---|
| 1. | Douleur secondaire à une tumeur maligne pelvienne, périnéale, génitale ou rectale |
| 2. | Métastases osseuses au bassin |
| 3. | Neuropathie périphérique liée à la chimiothérapie |
| Situations spéciales | |
|---|---|
| 1. | Patients ayant déjà subi une chirurgie du rachis lombaire |
| 2. | Patients « anticoagulés » ou atteints de coagulopathie |
Conseils NYSORA
- Les indications du bloc nerveux épidural caudal sont essentiellement les mêmes que celles du bloc nerveux épidural lombaire.
- Le bloc du nerf caudal peut être préféré au bloc du nerf épidural lombaire lorsque la propagation du nerf sacré des anesthésiques et des adjuvants est préférée à la propagation du nerf lombaire.
- L'imprévisibilité de la vérification de la propagation céphalique cohérente des anesthésiques administrés par le canal caudal limite l'utilité de cette technique lorsqu'il est essentiel de fournir un bloc neuraxial thoracique inférieur et abdominal supérieur.
D'autres indications plus récentes chez l'adulte méritent d'être mentionnées et sont décrites plus loin dans ce chapitre, y compris la réalisation de la neuroplastie péridurale percutanée ; l'utilisation de l'analgésie caudale après une chirurgie rachidienne lombaire ; analgésie caudale après chirurgie orthopédique des membres inférieurs ; les adjuvants anesthésiques locaux pour l'analgésie postopératoire ; et un bloc nerveux caudal pour effectuer une neurolyse pour le traitement de la douleur cancéreuse réfractaire.
LA TECHNIQUE DU BLOC NERVEUX ÉPIDURAL CAUDAL
La technique classique du bloc nerveux épidural caudal implique la palpation, l'identification et la ponction. Les patients sont évalués comme pour tout bloc nerveux péridural, et les indications et contre-indications relatives et absolues à sa réalisation sont identiques. Un ensemble complet de moniteurs non invasifs est appliqué et les signes vitaux de base sont évalués. Il faut décider si un continu or technique du coup unique seront employés. Pour les techniques continues, une aiguille de type Tuohy avec un orifice latéral est préférée.
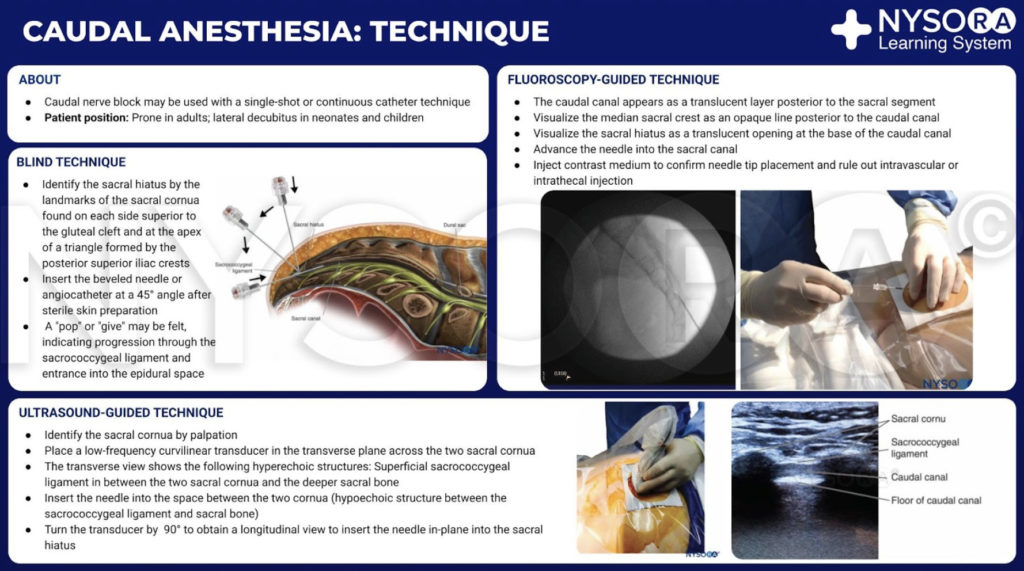
Extrait du Compendium d'anesthésie régionale : Infographie sur les techniques d'anesthésie caudale.
Positionnement du patient
Plusieurs positions peuvent être utilisées chez l'adulte, par rapport à la position en décubitus latéral chez le nouveau-né et l'enfant. La position latérale est souvent préférée en pédiatrie car elle permet un accès facile aux voies respiratoires lorsqu'une anesthésie générale ou une sédation lourde a été administrée avant d'effectuer le bloc nerveux. Chez les patients pédiatriques, les blocs nerveux peuvent être réalisés avec le patient complètement anesthésié ; ceci n'est pas recommandé pour les enfants plus âgés et les adultes. Chez l'adulte, la position ventrale est la plus fréquemment utilisée, mais la position en décubitus latéral ou la position genou-poitrine (aussi appelée « genou-coude ») peut être utilisée. En position couchée, la table d'intervention ou la table de salle d'opération doit être fléchie, ou un oreiller peut être placé sous la symphyse pubienne et les crêtes iliaques pour produire une légère flexion des hanches. Cette manœuvre facilite la palpation du canal caudal. Les jambes sont séparées avec les talons tournés vers l'extérieur pour lisser la partie supérieure de la fente anale, tout en relaxant simultanément les muscles fessiers. Pour le placement du bloc nerveux épidural caudal chez la parturiente, la position latérale (position de Sim) et la position genou-coude sont les plus couramment utilisées.
Repères anatomiques
Un tampon de gaze sèche est placé dans la fente interfessière pour protéger la région anale et les organes génitaux de la povidone iodée ou d'autres désinfectants (en particulier l'alcool) utilisés pour désinfecter la peau. Les repères anatomiques sont ensuite évalués. Les plis cutanés des fesses sont des guides utiles pour localiser le hiatus sacré sous-jacent. Alternativement, un triangle peut être marqué sur la peau au-dessus du sacrum, en utilisant les épines iliaques postéro-supérieures (PSIS) comme base, avec l'apex pointant vers le bas (caudalement). Normalement, cet apex se trouve au-dessus ou juste à côté du hiatus sacré. Cependant, une étude récente a indiqué que l'identification du hiatus sacré à l'aide de cette méthode peut être inexacte car le triangle réel formé par le hiatus sacré et les PSIS n'est pas équiangulaire. Une fois le hiatus marqué, le bout de l'index est posé sur la pointe du coccyx dans la fente interfessière tandis que le pouce de la même main palpe les deux cornes sacrées situées 3 à 4 cm plus rostralement à l'extrémité supérieure de la fente interfessière. fendu. Les cornes sacrées peuvent être identifiées en déplaçant doucement l'index palpé d'un côté à l'autre (Figure 2). Le pouce qui palpe doit s'enfoncer dans le creux entre les deux cornes, comme entre deux phalanges d'un poing. La préparation stérile de la peau et le drapage de toute la région sont effectués de la manière habituelle.
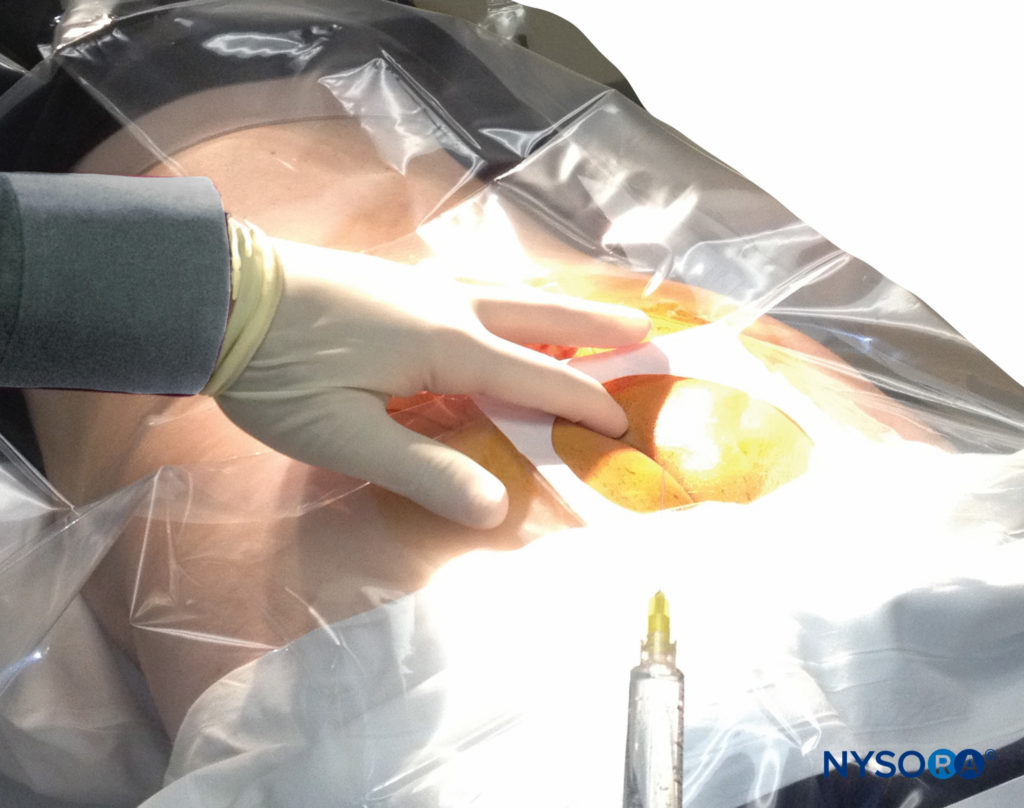
FIGURE 2. Technique de palpation de la ligne médiane au-dessus du hiatus sacré. L'index palpatoire et le majeur sont répartis sur le cinquième corps vertébral sacré. Le ligament sacro-coccygien se trouve directement sous le doigt palpateur.
Technique utilisant la fluoroscopie
Une aiguille de petit calibre de 1.5 pouce est ensuite utilisée pour infiltrer la peau au-dessus du hiatus sacré à l'aide de 3 à 5 mL de chlorhydrate de lidocaïne ordinaire à 1 % à 1.5 % (Figure 3). Si la fluoroscopie est utilisée, une vue latérale est obtenue pour démontrer les limites anatomiques du canal sacré. Nous laissons systématiquement l'aiguille d'infiltration anesthésique locale in situ pour cette vue, car elle démontre si l'approche est au niveau approprié pour l'avancement ultérieur de l'aiguille péridurale. Avec la fluoroscopie, le canal caudal apparaît comme une couche translucide postérieure aux segments sacrés. La crête sacrée médiane est visualisée comme une ligne opaque postérieure au canal caudal. Le hiatus sacré est généralement visualisé comme une ouverture translucide à la base du canal caudal. Le coccyx peut être vu articulant avec la surface inférieure du sacrum (Figure 4).
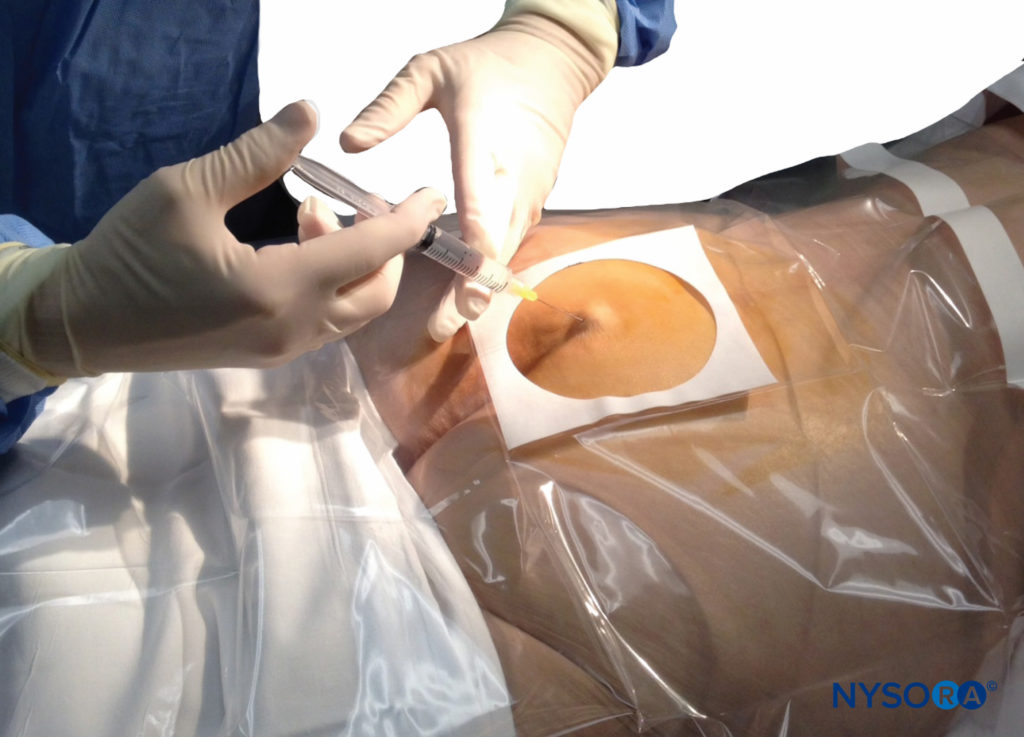
FIGURE 3. Technique d'infiltration cutanée sous anesthésie locale. L'aiguille est insérée d'abord au-dessus puis dans la substance du ligament sacro-coccygien.
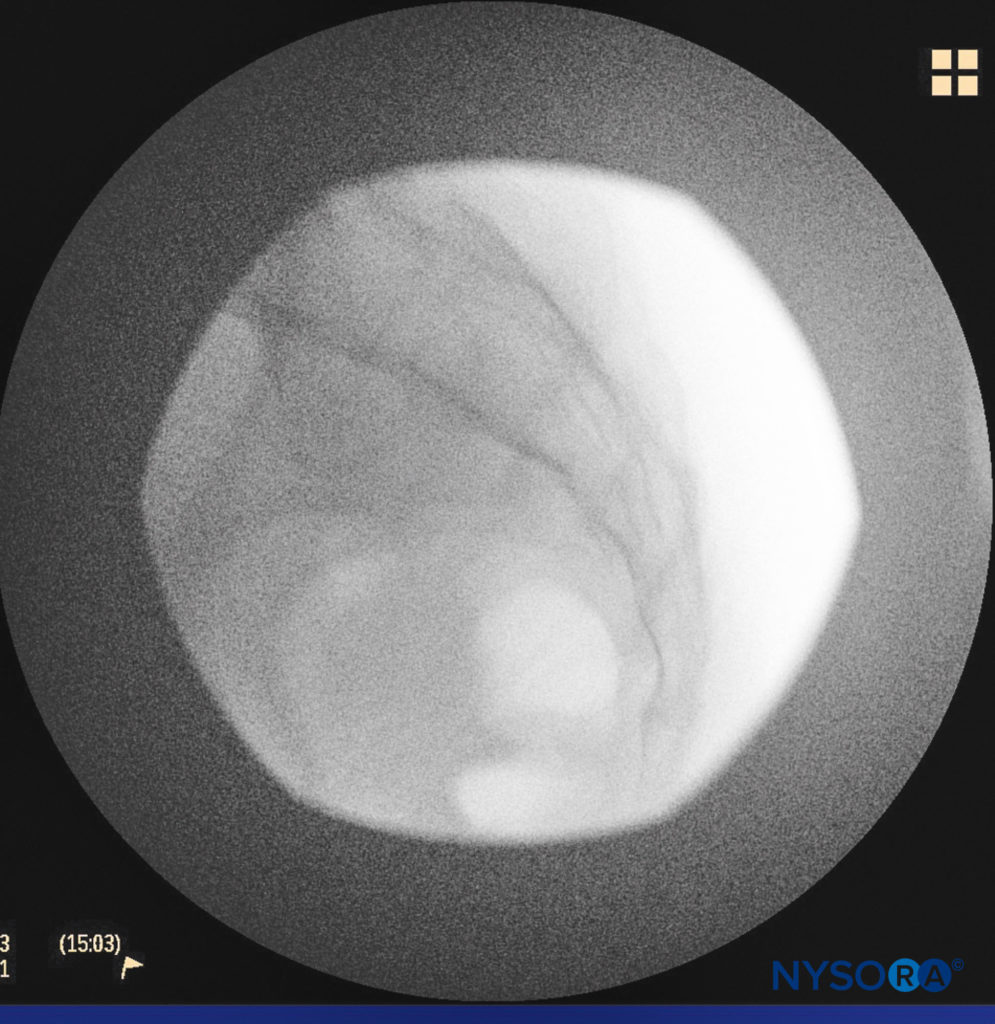
FIGURE 4. Image fluoroscopique latérale montrant les limites du canal caudal.
Une fois les tissus recouvrant le hiatus anesthésiés, une aiguille de type Tuohy de calibre 17 ou 18 est insérée soit dans la ligne médiane, soit, par voie latérale, dans le canal caudal (Figure 5, Figure 6). Une sensation de léger « claquement » peut être appréciée lorsque l'aiguille qui avance perce le ligament sacro-coccygien. Une fois que l'aiguille atteint la paroi ventrale du canal sacré, elle est lentement retirée et réorientée, la dirigeant plus crânialement (en appuyant sur le moyeu et en avançant) pour une insertion ultérieure dans le canal.
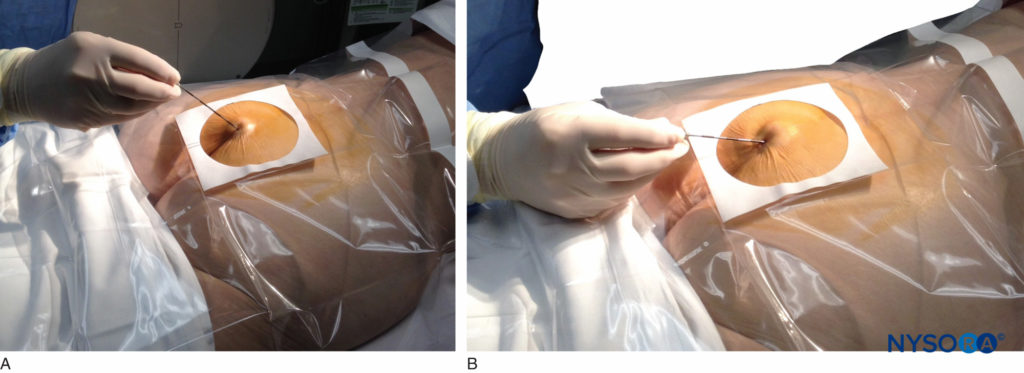
FIGURE 5. Une aiguille de calibre 18 de type Tuohy est avancée de la peau dans le hiatus sacré à travers le ligament sacro-coccygien. Habituellement, lorsque la fluoroscopie n'est pas disponible pour vérifier le placement correct de l'aiguille, une seringue chargée d'air ou de solution saline est attachée à l'aiguille et la technique de perte de résistance est utilisée pour identifier l'espace épidural.
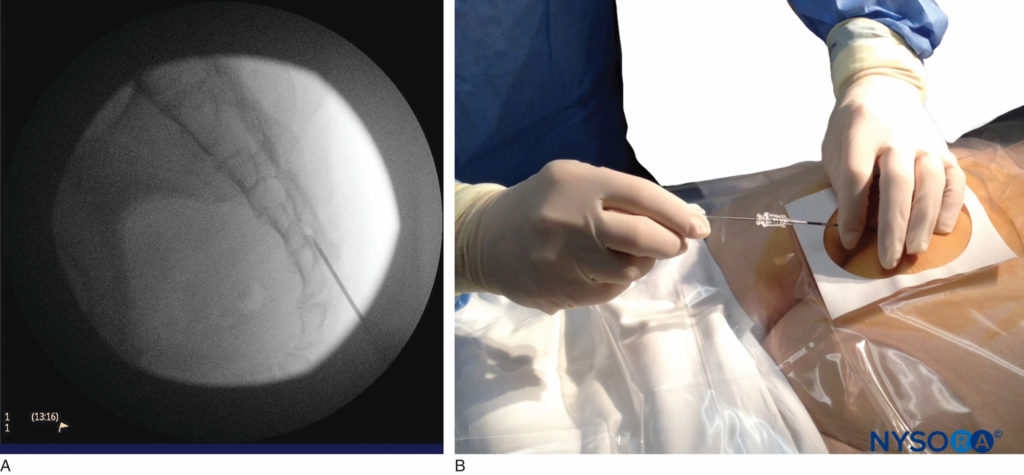
FIGURE 6. Image fluoroscopique latérale montrant l'aiguille de Tuohy de calibre 18 correctement placée dans l'espace épidural caudal.
Nous utilisons la vue antéropostérieure une fois que l'aiguille péridurale est placée en toute sécurité dans le canal et que le cathéter péridural est avancé vers l'avant (Figure 7, Figure 8). Dans cette projection, les crêtes sacrées intermédiaires apparaissent comme des lignes verticales opaques de part et d'autre de la ligne médiane. Les foramens sacrés sont visualisés comme des zones translucides et presque circulaires latérales aux crêtes sacrées intermédiaires. La présence de gaz intestinaux peut obscurcir la reconnaissance de ces structures. Une seringue remplie d'air ou de solution saline contenant une petite bulle d'air est ensuite attachée à l'aiguille, et la technique de perte de résistance est utilisée pour établir l'entrée dans l'espace épidural.

FIGURE 7. Un cathéter continu avec un stylet en place est avancé à travers l'aiguille Tuohy de calibre 18 placée dans le canal.
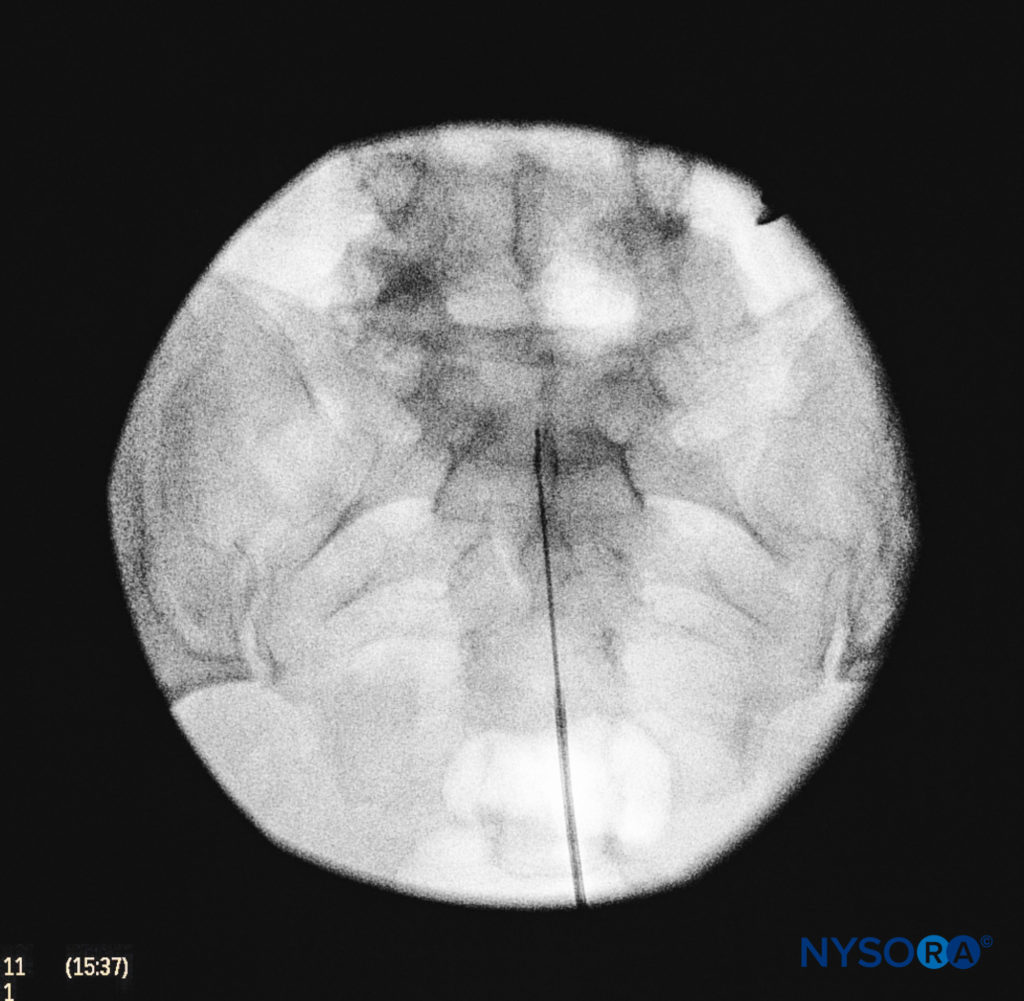
FIGURE 8. Imagerie fluoroscopique antéropostérieure montrant le bon placement de l'aiguille.
Conseils NYSORA
- La pointe de l'aiguille doit rester en dessous du niveau S2 pour éviter de déchirer la dure-mère.
- L'aiguille ne doit jamais être avancée dans l'espace trop profond.
- La peau correspondant à environ 1 cm en dessous des PSIS indique le niveau S2 (extension la plus caudale de la dure-mère).
- Le sac dural s'étend plus bas chez les enfants que chez les adultes, et les aiguilles péridurales doivent être soigneusement avancées pas plus profondément que le niveau S3 ou S4.
Un test acoustique, également appelé test « whoosh », a été décrit pour identifier le placement correct de l'aiguille dans le canal caudal. Ce son caractéristique a été noté lors de l'auscultation de la région thoraco-lombaire lors de l'injection de 2 à 3 ml d'air dans l'espace péridural caudal. Le "test de swoosh", décrit par Orme et Berg, substitue une solution saline ou un anesthésique local au lieu de l'air comme injectat.
Sur les 108 patients avec un bloc nerveux réussi dans une étude, 98 ont eu un test positif, sans résultats faussement positifs. Une fois que le placement correct de l'aiguille est confirmé, un cathéter est inséré à l'emplacement souhaité (profondeur) et sa position confirmée par fluoroscopie si nécessaire (Figure 9). Échographie Doppler couleur a également été décrit pour guider l'insertion de l'aiguille dans l'espace péridural et pour confirmer toute injection intravasculaire.
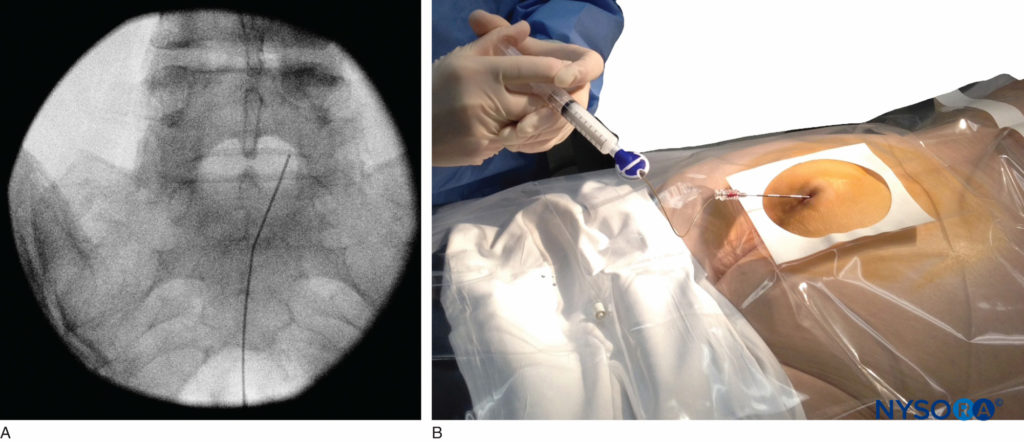
FIGURE 9. Image fluoroscopique antéropostérieure montrant le cathéter avancé dans l'espace intermédiaire L5-S1.
BLOC DU NERF CAUDAL GUIDÉ PAR ÉCHOGRAPHIE
L'échographie a joué un rôle croissant dans l'anesthésie régionale et la gestion de la douleur, le guidage échographique peut être utilisé pour identifier le hiatus sacré, facilitant ainsi l'entrée de l'aiguille dans le hiatus, ainsi que pour visualiser l'avancement de l'aiguille dans le canal caudal. Étant donné que les blocs nerveux caudaux sont relativement faciles à réaliser dans la population pédiatrique, l'échographie peut ne pas être significativement avantageuse par rapport aux techniques basées sur les points de repère. Cependant, chez les patients adultes, pour lesquels l'anatomie du hiatus sacré, du canal caudal et du sac dural est variable, le guidage échographique peut s'avérer utile pour réduire le risque de complications telles qu'un traumatisme tissulaire, une ponction durale, toxicité anesthésique locale, et atteinte vasculaire.
Technique
Le patient étant en décubitus ventral, les cornes sacrées sont repérées par palpation selon la technique décrite dans le chapitre sur les repères anatomiques. Une préparation stérile de la peau et un drapage de toute la région sont effectués. Une sonde curviligne basse fréquence est placée dans le plan transversal entre les deux cornes sacrées (Figure 10). Les cornes sacrées peuvent être visualisées comme deux arcs hyperéchogènes symétriques, avec une nuance hypoéchogène sous les deux lignes, reliant ces deux structures. Traversant cette zone hypoéchogène se trouvent deux lignes hyperéchogènes, la superficielle étant le ligament sacro-coccygien et la plus profonde étant la surface osseuse dorsale du sacrum (Figure 11). Une aiguille de calibre 22 est insérée dans l'espace entre les deux cornes. Un « pop » distinct est ressenti lorsque la pointe de l'aiguille pénètre dans le ligament sacro-coccygien.
FIGURE 10. Une sonde à ultrasons curviligne basse fréquence gainée d'un couvre-sonde stérile contenant du gel est placée dans le plan transversal à travers les deux cornes sacrées.
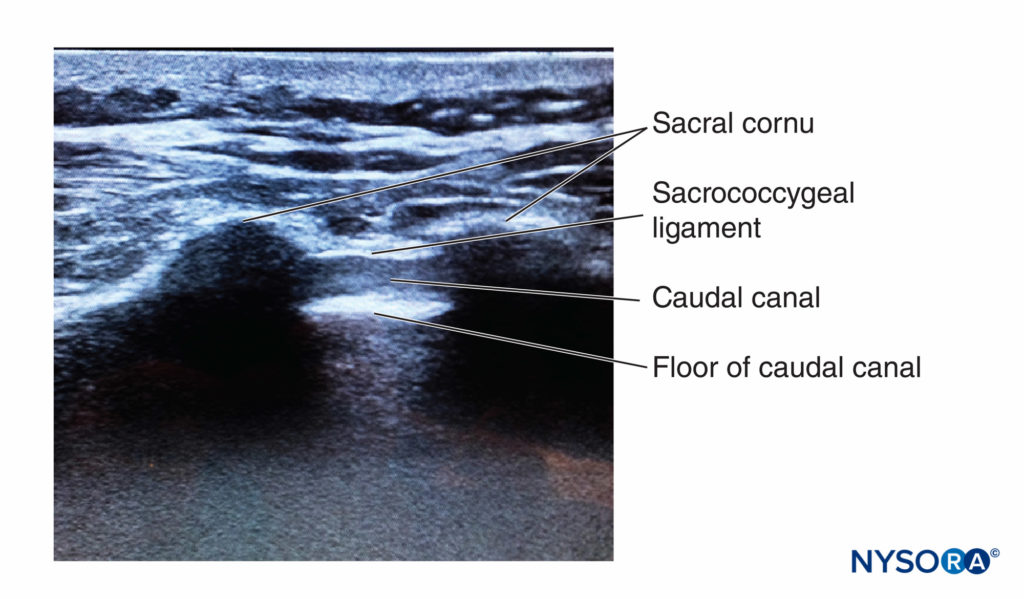
FIGURE 11. Image échographique le long du petit axe du canal caudal, représentant les cornes sacrées, le ligament sacro-coccygien et le canal caudal.
À ce stade, l'orientation de la sonde est changée dans le plan sagittal (Figure 12), et le canal caudal est identifié comme un canal hypoéchogène se rétrécissant caudalement et bordé par des bandes hyperéchogènes dorsales et ventrales. La bande dorsale est formée par la face osseuse dorsale du canal caudal crânialement et le ligament sacro-coccygien caudalement. La bande ventrale est formée par la surface osseuse ventrale du canal caudal (Figure 13).
FIGURE 12. La sonde curviligne basse fréquence placée dans le plan sagittal le long du grand axe du canal caudal.
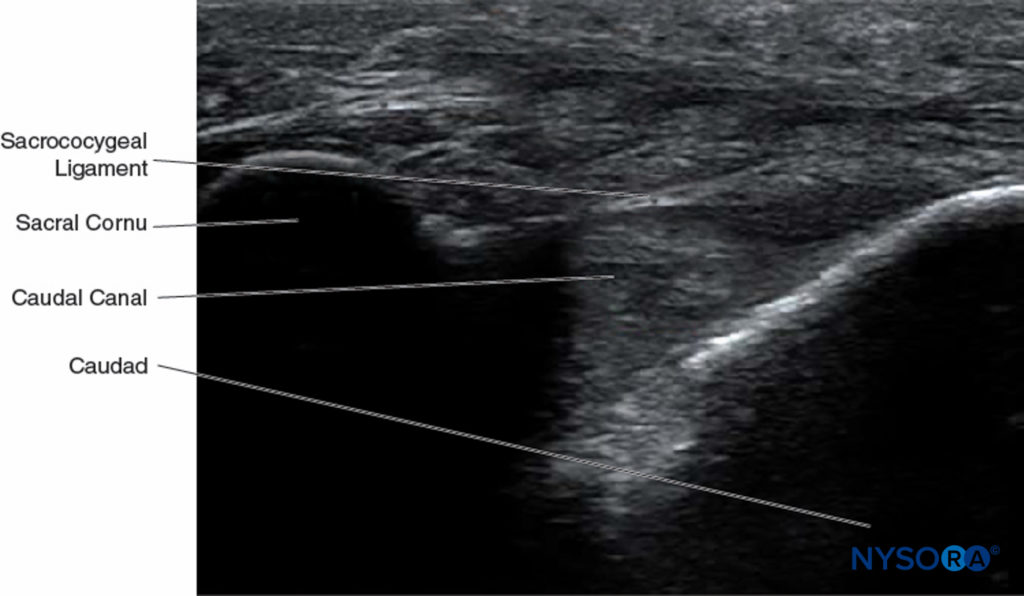
FIGURE 13. Image échographique le long du grand axe du canal caudal représentant la vue grand axe du canal caudal.
Conseils NYSORA
- Chez les patients pédiatriques, la stimulation électrique a été utilisée pour déterminer le placement correct de l'aiguille dans le canal caudal. La contraction du sphincter anal (correspondant à la stimulation de S2-S4) est recherchée avec des courants de 1 à 10 mA.
- Si l'aiguille a été insérée correctement, déplacer le moyeu d'un côté à l'autre, tandis que la tige est maintenue au niveau de la membrane sacro-coccygienne, permettra à la pointe de se balancer librement dans le canal sacré comme un point d'appui.
- Si du liquide céphalo-rachidien (LCR) est obtenu après aspiration, l'aiguille doit être retirée et l'injection ne doit pas être entreprise.
- Si du sang est aspiré, l'aiguille doit être retirée et réinsérée jusqu'à ce qu'il n'y ait plus de sang apparent au niveau du moyeu.
- Lorsque l'injection d'air (ou de solution saline) pour la technique de perte de résistance entraîne un renflement sur le sacrum, la pointe de l'aiguille se trouve très probablement dorsale au sacrum dans les tissus sous-cutanés.
- Si la pointe de l'aiguille est sous-périostée, l'injection rencontrera une résistance importante, entraînant un inconfort important pour le patient. La couche corticale de l'os sacré est souvent mince, en particulier chez les nourrissons et les sujets âgés, et sa pénétration peut facilement se produire, surtout si une force est exercée lors de l'avancement de l'aiguille. La sensation de pénétrer dans l'os spongieux n'est pas sans rappeler la pénétration de la membrane sacro-coccygienne ; il y a une sensation de résistance qui est soudainement surmontée, et l'aiguille avance plus librement et l'injection ultérieure n'est pas gênée.
Plusieurs complications liées à la technique opératoire ont été décrites. Les solutions injectées peuvent être rapidement absorbées par la moelle osseuse et entraîner des réactions toxiques aux médicaments. Dans cette situation, une douleur est généralement notée sur la partie caudale du sacrum lors de l'injection. Si cela se produit, l'aiguille doit être légèrement retirée et tournée sur son axe jusqu'à ce qu'elle puisse être réinsérée dans une direction légèrement différente.
Si l'injection est faite en avant du sacrum, il est possible de perforer le rectum ou, chez les parturientes, la tête du bébé peut être blessée. Cela limite l'utilisation du bloc nerveux caudal chez les femmes en travail une fois que la présentation est descendue dans le périnée. Une ponction veineuse par inadvertance peut également se produire, et l'incidence de celle-ci a été rapportée comme étant d'environ 0.6 %.
Le bloc nerveux caudal peut être utilisé avec une technique de cathéter à injection unique ou continue. Pour le bloc nerveux continu, le cathéter peut être avancé antérograde (classiquement) ou rétrograde. Le bloc nerveux caudal continu peut être réalisé de manière rétrograde en utilisant l'insertion d'une aiguille dans l'espace péridural lombaire, mais dirigé vers le bas plutôt que vers le haut. Dans une étude portant sur 10 patients, des cathéters périduraux ont été avancés à travers des aiguilles péridurales de type Tuohy de calibre 18 de manière rétrograde à partir de l'espace entre L4 et L5. Cette technique était associée à un taux d'échec de 20 %, le cathéter pénétrant dans les espaces paravertébraux ou rétrorectaux, malgré une entrée aisée dans l'espace épidural. En utilisant l'approche conventionnelle, une aiguille Tuohy à pointe Huber est utilisée comme conduit pour faire passer le cathéter péridural dans le canal. Cette aiguille a une pointe biseautée incurvée qui limite son accrochage ou son accrochage sur le périoste sacré. L'aiguille est insérée avec son épaulement tourné vers l'avant et son orifice vers le dos. En variante, un assemblage standard de cathéter sur aiguille de calibre 16 ou 17 (angiocathéter) peut servir d'aiguille d'introduction pour le placement ultérieur du cathéter. Le cathéter est avancé sous contrôle fluoroscopique, en particulier lorsqu'il est réalisé pour la gestion de la douleur chronique dans le syndrome d'échec de la chirurgie du dos.
Les cathéters doivent être avancés doucement car il y a eu des rapports de ponction durale avec un avancement rapide ou agressif. Des vues fluoroscopiques latérales et antéropostérieures doivent être obtenues pour démontrer le placement du cathéter dans l'espace épidural (Chiffres 14 et 9) et de suivre sa trajectoire dans une direction céphalique ou céphalo-latérale. Lorsque le niveau souhaité est atteint, des produits de contraste non ioniques iodés peuvent être injectés, suivis de l'injection d'anesthésiques locaux, de corticostéroïdes ou d'adjuvants (Figure 15). Habituellement, le cathéter n'est pas avancé plus haut que le niveau du corps vertébral L4, bien qu'il puisse être avancé jusqu'aux niveaux L1 ou L2 pour des indications spécifiques. Certains auteurs recommandent de ne pas avancer le cathéter de plus de 8 à 12 cm en avant.
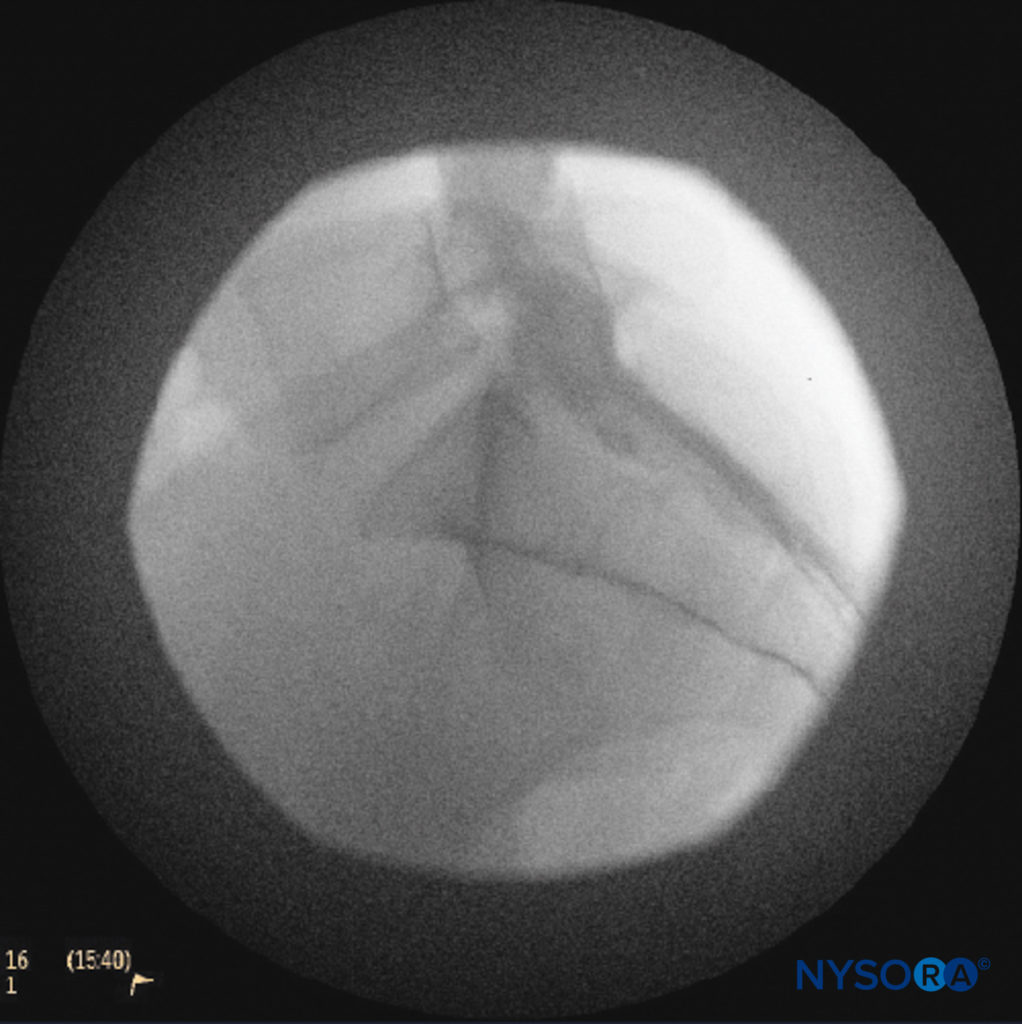
FIGURE 14. Image fluoroscopique latérale montrant un produit de contraste radio-opaque dans les espaces épiduraux caudal et lombaire inférieur. L'image montre une propagation considérable, à la fois en avant et en arrière, après l'injection de 2 ml de colorant.
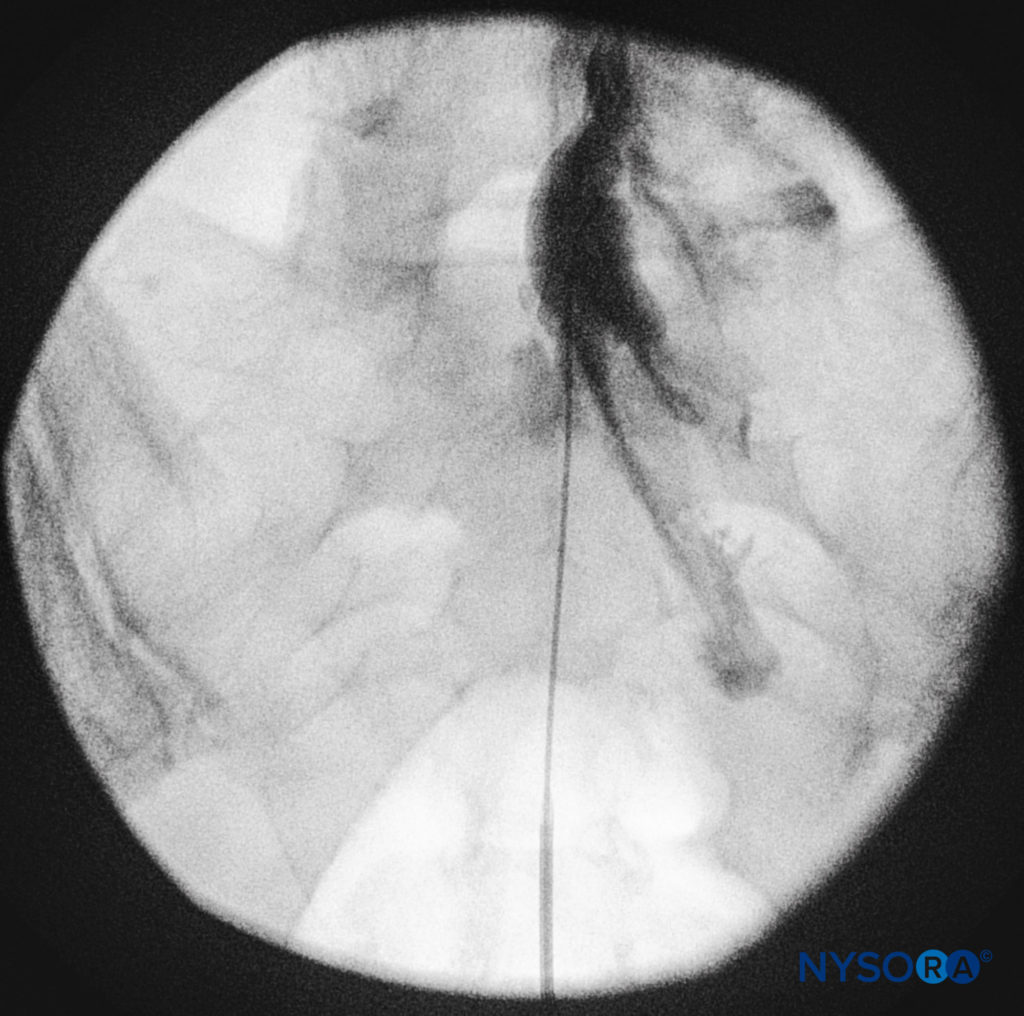
FIGURE 15. Image fluoroscopique antéropostérieure montrant un produit de contraste radio-opaque dans l'espace épidural
Conseils NYSORA
- La propagation des solutions anesthésiques locales injectées dans l'espace péridural caudal chez l'adulte est influencée par le volume injecté, la vitesse d'injection et le positionnement du patient.
- Il n'y a pas de corrélation entre la vitesse d'injection et la propagation de l'anesthésique local chez les enfants subissant une anesthésie caudale.
CARACTÉRISTIQUES DU BLOC NERVEUX ÉPIDURAL CAUDAL CHEZ L'ADULTE
Le bloc nerveux épidural caudal entraîne un bloc nerveux sensoriel et moteur des racines sacrées et un bloc nerveux autonome limité. La contribution sacrée du système nerveux parasympathique est bloquée, entraînant une perte de la fonction viscéromotrice de la vessie et des intestins en aval de l'angle splénique du côlon. Le bloc nerveux sympathique, bien que limité par rapport au bloc nerveux péridural lombaire ou thoracique, se produit. Cependant, l'écoulement sympathique des fibres sympathiques préganglionnaires de la moelle épinière se termine au niveau L2 ; par conséquent, le bloc du nerf caudal ne devrait pas entraîner systématiquement une vasodilatation périphérique des membres inférieurs au degré observé avec le bloc péridural lombaire. Le bloc nerveux anesthésique local péridural caudal chez l'adulte peut être choisi pour les chirurgies du bas-ventre, du périnée ou des membres inférieurs. Les mélanges et les doses d'anesthésiques locaux sont similaires à ceux du bloc nerveux épidural lombaire (Tableau 2). Une étude récente examinant l'effet du sexe sur les concentrations minimales d'anesthésique local (MLAC) de ropivacaïne pour l'anesthésie caudale chez les patients subissant une chirurgie anorectale a révélé que la MLAC pour l'anesthésie caudale chez les femmes est 31 % plus élevée que chez les hommes.
TABLE 2. Anesthésiques locaux couramment utilisés pour l'anesthésie caudale chez l'adulte
| Agent | Concentration | Dose (mg) | Début sensoriel (Répartition sur 4 segments) | Durée (Régression à 2 segments) |
|---|---|---|---|---|
| Lidocaïne | 1.5% –2% | 300-600 | 10 – 20 min | 90 – 150 min |
| Chloroprocaïne | 2% –3% | 400-900 | 8 – 15 min | 45 – 80 min |
| Mépivacaïne | 2% | 400-600 | 10 – 20 min | 90 – 240 min |
| Ropivacaïne | 0.75% –1% | 150-300 | 15 – 25 min | 120 – 210 min |
| Bupivacaïne/lévobupivacaïne | 0.5% –0.75% | 100-225 | 10 – 25 min | 180 – 270 min |
Diffusion des solutions anesthésiques locales
La grande capacité du canal sacré accueille en conséquence de grands volumes de solution ; des volumes importants peuvent être perdus à travers les larges foramens sacrés antérieurs. Par conséquent, les exigences de dose caudale des anesthésiques locaux pour obtenir la même propagation segmentaire sont significativement plus importantes que les doses lombaires correspondantes. Environ deux fois la dose d'anesthésique local péridural lombaire est nécessaire pour que le bloc caudal atteigne des niveaux similaires d'analgésie et d'anesthésie, et les solutions injectées dans l'espace caudal prennent plus de temps à se répandre (Tableau 2). Bromage a noté que l'âge n'est pas corrélé à la propagation segmentaire caudale chez les adultes et que le niveau supérieur d'analgésie résultant de doses de 20 ml de solution anesthésique locale varie considérablement entre S2 et T8. Cette imprévisibilité limite l'utilité de l'application d'une anesthésie caudale pour les interventions chirurgicales qui nécessitent des niveaux d'analgésie céphalique au-dessus du niveau pelvien ou de l'ombilic. Une étude plus récente a confirmé les découvertes de Bromage. Chez 172 femmes subissant une chirurgie gynécologique mineure sous anesthésie caudale avec 20 ml de lidocaïne à 1.5 %, le niveau de dermatome sensoriel le plus élevé atteint était inférieur à T10.
Conseils NYSORA
- Le canal sacré contient la queue de cheval (y compris le filum terminale), les méninges spinales, le tissu adipeux et le plexus veineux sacré.
- Le volume du canal sacré est en moyenne de 14.4 mL.
- Les indications d'un bloc nerveux épidural caudal sont les mêmes que celles d'un bloc nerveux épidural lombaire.
- La neuroplastie épidurale percutanée est une technique d'administration d'anesthésiques locaux, de corticostéroïdes, d'hyaluronidase et de solution saline hypertonique à travers un cathéter caudal dans le but de lyser les adhérences épidurales.
- Les patients adultes sont généralement placés en décubitus ventral pour le bloc nerveux, alors que la position de décubitus latéral est préférée pour la pédiatrie.
- Le bloc caudal en pédiatrie est principalement utilisé pour le contrôle de la douleur périopératoire, alors que chez l'adulte, il est principalement utilisé pour la gestion de la douleur chronique.
- Chez les adultes, environ deux fois la dose d'anesthésique local est nécessaire pour atteindre la même propagation segmentaire avec un bloc nerveux caudal par rapport à la dose utilisée pour le bloc nerveux épidural lombaire.
Indications de l'analgésie péridurale caudale chez l'adulte
Un bloc nerveux péridural caudal est indiqué chaque fois que la zone de la chirurgie implique les racines nerveuses sacrées et lombaires inférieures. La technique convient à la chirurgie anale (hémorroïdectomie et dilatation anale), aux procédures gynécologiques, à la chirurgie du pénis ou du scrotum et aux chirurgies des membres inférieurs. En utilisant une technique de cathéter, il est possible d'utiliser le bloc nerveux épidural caudal pour la césarienne, l'hystérectomie vaginale et l'herniorraphie inguinale.
Un bloc nerveux épidural caudal est utilisé moins fréquemment que le bloc nerveux épidural lombaire ou thoracique pour l'analgésie périopératoire chez l'adulte. Le bassin s'élargit nettement à la puberté, tandis que la graisse épidurale dans la région lombo-sacrée subit un compactage et une augmentation du contenu fibreux. Cela empêche la propagation céphalique des solutions, en particulier par rapport à la propagation chez les enfants.
Comme alternative au bloc nerveux épidural caudal chez l'adulte, on pourrait envisager une approche médiane du bloc nerveux épidural transsacré. Dans la description originale de cette technique, 87 % des blocs nerveux ont réussi pour la résection transurétrale des tumeurs de la vessie contre 100 % de succès pour les procédures sacrées. Le niveau d'anesthésie, les effets secondaires et l'hémodynamique étaient similaires entre les deux groupes étudiés dans le rapport initial.
BLOC DU NERF CAUDAL POUR L'ANALGÉSIE DU TRAVAIL
Le canal sacré participe à l'engorgement général des veines extradurales qui se produit en fin de grossesse ou dans toute condition clinique dans laquelle la veine cave inférieure (VCI) est partiellement obstruée. Étant donné que le volume effectif du canal caudal est nettement diminué pendant la dernière partie de la grossesse, la posologie caudale doit être réduite proportionnellement chez les femmes à terme. La propagation segmentaire des anesthésiques locaux peut augmenter considérablement chez les femmes enceintes à terme, nécessitant une diminution de 28 % à 33 % de la dose requise dans cette population de patientes. Le choix d'un cathéter continu ou d'une technique à injection unique pendant le travail actif est limité par le manque relatif de stérilité au hiatus sacré, qui peut être contaminé par des matières fécales et du méconium.
De rares cas de syndrome de Horner ont été signalés lorsque de fortes doses d'anesthésiques locaux sont injectées par voie caudale pendant l'administration d'analgésie pendant le travail. Ceci est plus susceptible de se produire si l'injection est faite avec la patiente sur le dos (l'engorgement du plexus veineux épidural et la compression de la VCI sont maximaux).
La technique dite duale (lombaire et caudale) de bloc nerveux péridural pour le travail n'est plus largement utilisée. Étant donné que la douleur des contractions utérines est médiée par les fibres du système nerveux sympathique provenant des segments rachidiens T10 à L2, un cathéter épidural lombaire suffit à la fois pour les stades I et II de la parturition, avec des ajustements posologiques effectués en fonction des circonstances et des besoins exacts (voir Anesthésie régionale obstétricale).
INDICATIONS DE L'ANALGESIE PÉRIDURALE CAUDALE CHEZ L'ENFANT
Caractéristiques du bloc
Le hiatus sacré est généralement facile à palper chez les nourrissons et les enfants, ce qui rend cette technique beaucoup plus facile et prévisible. Par conséquent, dans de nombreux établissements accueillant un grand nombre de patients pédiatriques, le bloc du nerf péridural caudal fait partie intégrante des procédures per- et postopératoires. gestion de la douleur chez les enfants subissant un large éventail d'interventions chirurgicales à la fois au-dessous et au-dessus du diaphragme. La technique s'apprend facilement; une étude a démontré un taux de réussite de 80 % chez les stagiaires résidents après avoir effectué 32 procédures effectuées sans guidage fluoroscopique. Chez les nourrissons et les jeunes enfants, une aiguille de calibre 21 à biseau court de 1 pouce peut être utilisée pour les techniques d'injection unique. Pour les blocs nerveux continus, un cathéter péridural standard peut être avancé à travers un angiocathéter de calibre 18 ou à travers une aiguille péridurale à paroi mince de calibre 18. Il a été noté qu'à l'âge de 4 ou 5 ans, le canal sacré est généralement suffisamment grand pour accepter une telle aiguille pour le passage d'un cathéter. L'électrocardiogramme a été utilisé pour vérifier le placement approprié de l'extrémité du cathéter thoracique (électrocardiographie péridurale).
Diffusion des solutions anesthésiques locales
La propagation segmentaire de l'analgésie après l'administration caudale est plus prévisible chez les enfants jusqu'à environ 12 ans. Certaines études ont suggéré que la propagation céphalique des solutions caudales chez les enfants n'est pas entravée par les mêmes contraintes anatomiques qui se développent à partir de la puberté. Avant la puberté, les barrières anatomiques à la jonction lombo-sacrée ne se sont pas encore développées à un degré marqué, et les solutions caudales peuvent s'écouler librement vers le haut dans les cavités supérieures du canal rachidien. En conséquence, la propagation rostrale de l'anesthésie caudale est plus étendue et plus prévisible chez les enfants que chez les adultes.
Indications chez l'enfant
Chez l'enfant, le bloc du nerf caudal est généralement associé à une anesthésie générale légère avec ventilation spontanée. Au cours de la chirurgie abdominale basse et génito-urinaire chez les enfants, il a été démontré que le bloc du nerf caudal avec 0.25 % de bupivacaïne (2 mg/kg) réduisait les réponses métaboliques et endocriniennes au stress, mesurées par les concentrations de glucose ; taux moyens de prolactine ; insuline; et les concentrations de cortisol, par rapport à l'anesthésie générale seule. La mise en place thoracique des cathéters est possible chez les nouveau-nés et les jeunes enfants. Cependant, une étude radiographique de 115 nourrissons a révélé que 10 cathéters placés caudalement se trouvaient dans la région thoracique haute ou basse cervicale, alors que leur site prévu se trouvait dans les segments thoraciques inférieurs.
Les trois groupes d'indications du bloc du nerf péridural caudal chez l'enfant sont les suivants :
- Patients nécessitant un bloc nerveux sacré (circoncision, chirurgie anale)
- Patients nécessitant un bloc nerveux thoracique inférieur (herniorraphie inguinale)
- Patients nécessitant une analgésie des dermatomes thoraciques supérieurs (chirurgie thoracique)
Considérations pharmacologiques pour l'anesthésie péridurale caudale chez les enfants
Il a été constaté que le bloc du nerf caudal avec de la bupivacaïne (4 mg/kg) et de la morphine (150 μg/kg) réduisait les besoins en fentanyl pendant la chirurgie cardiaque et raccourcissait les temps d'extubation dans un groupe de 30 patients pédiatriques randomisés pour recevoir une anesthésie générale seule ou une combinaison d'anesthésie générale. ou bloc nerveux caudal.
La dose d'anesthésique requise est d'environ 0.1 ml/segment par an pour la lidocaïne à 1 % ou la bupivacaïne à 0.25 %.1 La dose peut également être calculée en fonction du poids corporel. La relation entre l'âge et les doses requises est strictement linéaire, avec un degré élevé de corrélation jusqu'à 12 ans. Une étude récente utilisant la fluoroscopie avec 0.2 % de ropivacaïne contenant un colorant radio-opaque dans un rapport de 1:4 a montré que les doses basées sur le poids pour la bupivacaïne à 0.2 % administrée par voie caudale étaient également applicables à la ropivacaïne à 0.2 %. Les concentrations plasmatiques de bupivacaïne chez les enfants recevant un bloc nerveux caudal avec 0.2 % de l'anesthésique local (2 mg/kg) étaient inférieures aux doses équivalentes administrées par bloc nerveux ilio-inguinal-iliohypogastrique pour le contrôle de la douleur après une herniotomie ou une orchidopexie. De plus, les temps de pic des concentrations plasmatiques étaient plus rapides dans le groupe des blocs nerveux périphériques, ce qui indique que le bloc nerveux caudal est une alternative sûre aux techniques d'infiltration locale en chirurgie inguinale.
Dans une étude portant sur des enfants de 1 à 6 ans ayant subi une orchidopexie, un bloc du nerf caudal utilisant de plus grands volumes de bupivacaïne diluée (0.2 %) s'est avéré plus efficace qu'un plus petit volume de la concentration standard (0.25 %) pour bloquer le réponse péritonéale à la traction du cordon spermatique, sans modification de la qualité de l'analgésie postopératoire. Dans cette étude, la dose totale de bupivacaïne était identique dans les deux groupes (20 mg). Il a été démontré que la ropivacaïne à 0.5 % fournit une durée d'analgésie significativement plus longue après une herniorraphie inguinale chez les enfants âgés de 1.5 à 7 ans par rapport à la ropivacaïne à 0.25 % ou à la bupivacaïne à 0.25 %. Tous les enfants ont reçu 0.75 mL/kg d'anesthésique local. Cependant, les délais de la première miction et de la station debout ont été significativement retardés dans le groupe recevant 0.5 % de ropivacaïne, et il y a eu un cas de bloc nerveux moteur des membres inférieurs.
Une autre étude a comparé la ropivacaïne à volume élevé/à faible concentration (1.5 ml/kg de solution à 0.15 %) et à faible volume/à forte concentration (1.0 ml/kg de solution à 0.225 %) pour l'analgésie caudale chez les enfants âgés de 1 à 5 ans en cours d'orchiopexie. Cette étude a montré qu'un plus grand volume de ropivacaïne diluée offrait une meilleure qualité et une plus longue durée d'analgésie après la sortie qu'un plus petit volume de ropivacaïne plus concentrée.
La ropivacaïne a également été utilisée pour le blocage du nerf caudal pour la réparation de l'hypospadias dans une étude randomisée en double aveugle chez 26 enfants. La concentration anesthésique locale efficace minimale de ropivacaïne s'est avérée être de 0.11 %, pour fournir une analgésie caudale efficace chez les enfants sous anesthésie générale avec une concentration alvéolaire minimale de 0.5 d'enflurane.
Les concentrations plasmatiques de ropivacaïne après bloc du nerf caudal chez 20 enfants âgés de 1 à 8 ans, en utilisant 2 mg/mL, 1 mL/kg, ont démontré des fractions libres de 5 %, une clairance de 7.4 mL/kg/min et une demi-vie terminale de 3.2 heures, bien en deçà de celles associées aux symptômes toxiques chez l'adulte. Une autre étude portant sur la concentration analgésique locale minimale de ropivacaïne pour l'analgésie caudale peropératoire chez les enfants d'âge préscolaire et scolaire subissant une réparation de l'hypospadias a révélé qu'une concentration plus élevée de ropivacaïne était nécessaire pour les enfants d'âge scolaire que les enfants d'âge préscolaire pour fournir une analgésie caudale peropératoire lorsqu'elle est combinée avec anesthésie générale. Sur les trois anesthésiques locaux couramment utilisés pour l'anesthésie caudale en une seule injection (bupivacaïne, ropivacaïne et lévobupivacaïne), aucune supériorité en termes d'efficacité clinique n'a été trouvée pour aucun de ces médicaments dans une méta-analyse de 17 essais contrôlés randomisés portant sur un seul anesthésie caudale pédiatrique avec au moins deux des trois médicaments en question. La bupivacaïne et la ropivacaïne ont montré l'incidence la plus élevée et la plus faible de bloc nerveux moteur, respectivement.
Une revue systématique quantitative d'essais contrôlés randomisés portant sur l'innocuité et l'efficacité de la clonidine en tant qu'additif pour l'anesthésie régionale caudale a suggéré que la clonidine peut fournir une durée prolongée d'analgésie avec une incidence réduite pour les besoins de sauvetage analgésique et peu d'effets indésirables par rapport aux anesthésiques locaux caudaux seul. Les données de 20 essais contrôlés randomisés ont été utilisées dans cette méta-analyse pour évaluer l'innocuité et l'efficacité de la clonidine caudale ajoutée aux anesthésiques locaux par rapport aux anesthésiques locaux seuls chez les enfants subissant une chirurgie urologique, abdominale ou des membres inférieurs. Il a été démontré que la dexmédétomidine (1 μg/kg) procurait une durée prolongée de soulagement de la douleur lorsqu'elle était ajoutée à la bupivacaïne 2.5 mg/mL, 1 mL/kg, par rapport à une dose identique de bupivacaïne seule chez les enfants âgés de 1 à 6 ans subissant une chirurgie inguinale unilatérale. cure de hernie/orchidopexie. Une autre étude a comparé les effets analgésiques et les effets secondaires de la dexmédétomidine et de la clonidine ajoutées à la bupivacaïne chez des patients pédiatriques subissant des chirurgies abdominales basses. Soixante patients âgés de 6 mois à 6 ans ont été répartis de manière égale et aléatoire en trois groupes en double aveugle. Chaque patient a reçu une dose caudale unique de bupivacaïne 0.25 % (1 ml/kg) associée à de la dexmédétomidine 2 μg/kg dans une solution saline normale 1 ml, de la clonidine 2 μg/kg dans une solution saline normale 1 ml ou un volume correspondant de solution saline normale. Les résultats ont démontré que même si les deux additifs augmentaient la période d'analgésie, il n'y avait aucun avantage significatif à sélectionner la dexmédétomidine par rapport à la clonidine.
Les anesthésiques locaux généralement administrés pour les blocs nerveux caudaux en une seule injection chez les patients pédiatriques sont répertoriés dans Tableau 3.
TABLE 3. Anesthésiques locaux typiques pour bloc nerveux caudal en pédiatrie (single shot).
| Agent | Concentration (%) | Dose (mg) | Début (minutes) | Durée de l'action (minutes) |
|---|---|---|---|---|
| Ropivacaïne74 | 0.2 | 2 mg / kg | 9 | 520 |
| Bupivacaïne74 | 0.25 | 2 mg / kg | 12 | 253 |
| Ropivacaïne75 | 0.2 | 0.7 mg / kg | 11.7 | 491 |
| Bupivacaïne75 | 0.25 | 0.7 mg / kg | 13.1 | 457 |
| Ropivacaïne76 | 0.2 | 1 ml/kg | 8.4 | Indisponible |
| Lévobupivacaïne76 | 0.25 | 1 ml/kg | 8.8 | Indisponible |
| Bupivacaïne76 | 0.25 | 1 ml/kg | 8.8 | Indisponible |
Conseils NYSORA
- La relaxation du sphincter anal après l'injection d'un anesthésique local peut prédire le succès d'un bloc nerveux caudal.
- Ceci est particulièrement utile chez les enfants car la plupart des blocs nerveux caudaux sont effectués pendant que l'enfant est anesthésié, et il n'est pas possible d'évaluer l'efficacité du bloc nerveux en testant les niveaux d'analgésie sensorielle.
- Une étude a démontré que la présence d'un sphincter anal relâché à la fin de la chirurgie était corrélée à la réduction du besoin d'administrer des opioïdes en périopératoire.
Autres considérations relatives à l'utilisation de l'anesthésie péridurale caudale chez les enfants
Bien que le bloc du nerf caudal soit un pilier des soins périopératoires gestion de la douleur en chirurgie pédiatrique et représente probablement 60 % de toutes les techniques d'anesthésie régionale pratiquées dans cette population de patients, toutes les études n'ont pas démontré un bénéfice marqué du bloc du nerf caudal pour l'analgésie postopératoire par rapport aux autres modalités. Après une herniorraphie inguinale unilatérale, le bloc du nerf caudal s'est avéré efficace, mais non supérieur, pour la gestion de la douleur par rapport à l'infiltration locale de la plaie chez 54 enfants. Les effets secondaires et les besoins en analgésie de secours ne différaient pas entre les deux groupes. Le bloc nerveux épidural caudal chez les enfants peut induire des changements significatifs dans le flux sanguin aortique descendant tout en maintenant la fréquence cardiaque et la pression artérielle moyenne. Dans une étude portant sur 10 enfants âgés de 2 mois à 5 ans, une sonde Doppler transœsophagienne a été utilisée pour calculer les variables hémodynamiques après l'injection de 1 mL/kg de bupivacaïne à 0.25 % avec de l'épinéphrine à 5 μg/mL. Le volume d'éjection aortique a augmenté et la résistance vasculaire aortique a diminué d'environ 40 %. Une autre étude portant sur l'hémodynamique périphérique à l'aide d'une échographie Doppler chez des enfants anesthésiés au sévoflurane avant et après un bloc nerveux caudal a montré des schémas de flux significativement modifiés après le bloc nerveux. La vitesse maximale a augmenté de 24 % ; le débit volumique a augmenté de 76 % et le diamètre de l'artère pédieuse dorsale a augmenté de 20 %. Cependant, les pressions artérielles et les fréquences cardiaques n'étaient pas significativement affectées par le bloc du nerf caudal. Ces données suggèrent que le bloc du nerf caudal entraîne une vasodilatation secondaire au bloc du système nerveux sympathique.
APPLICATIONS DU BLOC NERVEUX ÉPIDURAL CAUDAL DANS LA GESTION DE LA DOULEUR AIGUË ET CHRONIQUE
Radiculopathie réfractaire au traitement conventionnel
Dans les cas de radiculopathie réfractaire aux thérapies antalgiques conventionnelles, les techniques d'analgésie péridurale caudale peuvent réduire de manière significative et fiable la douleur. L'une de ces techniques est la neuroplastie épidurale percutanée : un cathéter caudal est laissé en place jusqu'à 3 jours dans le but d'injecter des solutions hypertoniques dans l'espace épidural pour traiter la radiculopathie avec lombalgie et cicatrisation épidurale associée, généralement d'une chirurgie rachidienne lombaire antérieure. En plus des anesthésiques locaux et des corticostéroïdes, une solution saline hypertonique et de la hyaluronidase sont ajoutées à l'injectat. La technique nécessite l'utilisation d'un guidage fluoroscopique et d'une épidurographie caudale en raison de son efficacité à corréler un défaut de remplissage de produit de contraste non ionique iodé injecté avec le niveau de douleur signalé par le patient.
L'injection de solutions dans l'espace péridural d'un patient présentant des adhérences méningées est généralement douloureuse en raison de l'étirement des racines nerveuses affectées. La dexaméthasone ou la bétaméthasone ont été recommandées à la place de la méthylprednisolone ou de la triamcinolone car les stéroïdes particulaires peuvent obstruer un cathéter péridural ou éventuellement provoquer une ischémie spinale suite à une injection intravasculaire involontaire.
Une solution saline hypertonique est utilisée pour prolonger le soulagement de la douleur en raison de ses effets anesthésiques locaux et de sa capacité à réduire l'œdème dans les racines nerveuses précédemment cicatrisées ou enflammées. Une approche latérale à l'aiguille est recommandée dans le canal caudal, en dirigeant l'aiguille et le cathéter vers le côté affecté. Le placement latéral a tendance à minimiser la probabilité de pénétrer dans le sac dural ou d'injecter sous-dural. Lorsque 5 à 10 ml de produit de contraste sont injectés dans le canal caudal via un cathéter épidural, une apparence de « sapin de Noël » se développe à mesure que le colorant se propage dans les structures périneurales à l'intérieur du canal osseux et le long des nerfs à leur sortie de la colonne vertébrale. Les adhérences épidurales empêchent la propagation du colorant, de sorte que les nerfs impliqués ne sont pas délimités par le contraste. Une fois que le placement correct du cathéter dans l'espace épidural est assuré, 1500 unités de hyaluronidase dans 10 ml de solution saline sans conservateur sont injectées rapidement. Ceci est suivi d'une injection de 10 ml de ropivacaïne à 0.2% et de 40 mg de triamcinolone. Après ces deux injections, un volume supplémentaire de 9 mL de solution saline hypertonique à 10 % est perfusé en 20 à 30 minutes. Les deuxième et troisième jours, l'injection d'anesthésique local (ropivacaïne) est suivie de la solution saline hypertonique.
Une étude a comparé l'efficacité de l'adhésiolyse péridurale percutanée en utilisant une injection de 5 mL de lidocaïne à 2 % sans conservateur, suivie de 6 mL de solution de chlorure de sodium à 10 % et de 6 mg de bétaméthasone non particulaire via un placement ciblé guidé par fluoroscopie d'un cathéter caudal (groupe 1) versus une injection de la même solution avec 6 mL de solution de chlorure de sodium à 0.9 % à la place du sérum physiologique hypertonique via un cathéter placé dans le canal caudal avec son embout au niveau de S3 (groupe 2). L'étude a révélé un soulagement significatif de la douleur (76 %) dans le groupe de solution saline hypertonique à un an de suivi, contre 1 % des patients du groupe de solution saline normale.
Une étude prospective, à double insu et randomisée examinant le rôle de l'ajout d'hyaluronidase à des injections péridurales caudales de stéroïdes et de solution saline hypertonique guidées par fluoroscopie chez des patients atteints du syndrome d'échec de la chirurgie du dos a montré une amélioration significative du soulagement de la douleur à long terme chez les patients ayant reçu de l'hyaluronidase. Au total, 38 patients ont été inclus dans l'étude. Vingt patients ont reçu des injections caudales guidées par fluoroscopie de 10 mL de solution de bupivacaïne à 0.25 % contenant 80 mg de méthylprednisolone et 30 mL de solution saline hypertonique à 3 % (groupe 1). Dix-huit patients ont reçu la même quantité d'anesthésique local et de stéroïdes, suivis de 1500 UI de hyaluronidase (qui a été remplacée par un volume équivalent de solution saline normale chez les patients du groupe 1) et 30 mL de solution saline hypertonique à 3 % (groupe 2).
Un autre essai randomisé, contrôlé et en double aveugle d'injections épidurales caudales guidées par fluoroscopie a comparé 10 mL de lidocaïne 0.5 % et 9 mL de lidocaïne 0.5 % mélangés à 6 mg de bétaméthasone ou 40 mg de méthylprednisolone (volume total 10 mL). Cette étude a montré une supériorité potentielle des stéroïdes par rapport à l'anesthésique local seul à 1 an de suivi.
Analgésie postopératoire chez les patients subissant une chirurgie de la colonne lombaire
Une autre application unique du bloc nerveux caudal est la fourniture d'une analgésie postopératoire chez les patients subissant des chirurgies de la colonne lombaire. Dans une série de cas, les patients ont reçu 20 mL de bupivacaïne à 0.25 % avec 0.1 mg de buprénorphine par voie épidurale caudale, réalisée avant l'incision chirurgicale. Les patients ont subi une fusion intersomatique postérieure et une laminotomie pour une sténose spinale, et le contrôle de la douleur postopératoire a été comparé dans le groupe caudal avec un groupe traité avec des opioïdes parentéraux conventionnels. Le groupe caudal a nécessité moins de doses de médicament analgésique de secours pendant les 12 premières heures suivant la chirurgie. Une réduction de la pression artérielle chez les patients du groupe caudal subissant une laminotomie, mais pas de fusion, a été notée chez les patients ayant une durée prolongée (24 heures) d'analgésie postopératoire.
Autres applications
Le bloc nerveux épidural caudal a également été comparé aux opioïdes intramusculaires dans le traitement de la douleur après une chirurgie orthopédique d'urgence des membres inférieurs. Le groupe caudal qui a reçu 20 ml de bupivacaïne à 0.5 % a eu 8 heures d'analgésie supérieure et a également eu une réduction significative du besoin de médicaments opioïdes de secours.
L'injection caudale de clonidine (75 μg avec 7 mL de bupivacaïne 0.5 % et 7 mL de lidocaïne 2 % avec épinéphrine 5 μg/mL) a été utilisée pour l'analgésie postopératoire après une hémorroïdectomie élective. Trente-deux adultes ont reçu la combinaison clonidine-locale, tandis qu'un groupe témoin a reçu un anesthésique local seul.
L'analgésie a duré en moyenne 12 heures dans le groupe clonidine, contre moins de 5 heures dans le groupe ne recevant qu'un anesthésique local. Une bradycardie est survenue chez environ 22 % des patients du groupe clonidine. Cela contraste avec les résultats d'une évaluation de la clonidine utilisée comme adjuvant pour l'anesthésie caudale pédiatrique comme indiqué précédemment.
Des injections caudales d'alcool ou de phénol ont été utilisées pour traiter les douleurs réfractaires dues au cancer. Dans une étude de 67 blocs nerveux, il a été constaté que les racines sacrées inférieures étaient facilement atteintes avec l'injection caudale et que les racines S1 et S2 (contribution du plexus lombo-sacré) étaient épargnées.
COMPLICATIONS ASSOCIÉES AU BLOC NERVEUX ÉPIDURAL CAUDAL
Les complications du bloc nerveux caudal sont les mêmes que celles survenant après bloc nerveux épidural et peuvent inclure ceux liés à la technique elle-même et ceux liés à l'injectat (anesthésique local ou autre substance injectée). Heureusement, les complications graves surviennent rarement. La liste des complications potentielles comprend l'abcès épidural, la méningite, hématome épidural, ponction durale et céphalée post ponction durale, injection sous-durale, pneumocéphalie et embolie gazeuse, maux de dos et cathéters épiduraux cassés ou noués. D'autres complications rares qui ont été signalées avec l'anesthésie caudale comprennent un gonflement parotidien unilatéral, un hoquet persistant après une perfusion caudale continue de ropivacaïne à 0.1 % et une céphalée d'hypotension intracrânienne après une injection épidurale caudale non compliquée.

Extrait du Compendium d'anesthésie régionale : infographie sur les complications de l'anesthésie caudale.
Toxicité systémique des anesthésiques locaux
L'incidence de convulsions induites par l'anesthésie locale après bloc nerveux caudal semble être plus élevé que celui des voies d'abord lombaire ou thoracique. Dans une étude rétrospective de 25,697 1985 patients ayant reçu des blocs nerveux du plexus brachial, des blocs nerveux épiduraux caudaux ou des blocs nerveux épiduraux lombaires de 1992 à 26, Brown a noté 70 épisodes convulsifs. La fréquence des crises chez les adultes par ordre décroissant était le bloc nerveux caudal, du plexus brachial, le bloc nerveux épidural lombaire ou thoracique. Neuf cas ont été attribués à des blocs nerveux caudaux, huit survenus avec la chloroprocaïne et un avec la lidocaïne. L'incidence des réactions toxiques anesthésiques locales était 0.69 fois plus élevée avec l'anesthésie péridurale caudale (XNUMX %) qu'avec l'anesthésie péridurale lombaire ou thoracique chez l'adulte.
Conseils NYSORA
- L'incidence des convulsions induites par l'anesthésie locale après un bloc du nerf péridural caudal est plus élevée qu'après les approches lombaires ou thoraciques.
- Le risque relatif de toxicité de l'anesthésique local suit cet ordre : caudal > bloc nerveux du plexus brachial > bloc nerveux épidural lombaire ou thoracique.
- Une élévation de la fréquence cardiaque de plus de 10 battements par minute ou une augmentation de la pression artérielle systolique de plus de 15 mm Hg après l'injection d'un anesthésique local contenant de l'épinéphrine est évocatrice d'une injection intravasculaire.
Chez les enfants, cependant, une étude rétrospective n'a identifié que deux réactions toxiques (c'est-à-dire des convulsions induites par un anesthésique local) dans 15,000 0.4 blocs nerveux caudaux. Le groupe de Dalens a constaté que l'injection intravasculaire non intentionnelle se produit dans jusqu'à 70 % des blocs nerveux caudaux pédiatriques,10 démontrant l'importance d'effectuer des tests de dosage contenant de l'épinéphrine dans ce groupe d'âge. Il a été suggéré qu'une élévation de la fréquence cardiaque de plus de 15 battements par minute ou une augmentation de la pression artérielle systolique de plus de 90 mm Hg devrait être considérée comme indicative d'une injection systémique. Les modifications de l'onde T sur l'ECG se produisent le plus tôt possible après l'injection intravasculaire, suivies des modifications de la fréquence cardiaque et enfin des modifications de la pression artérielle. Ces changements peuvent être retardés jusqu'à XNUMX secondes après l'injection. Pour plus d'informations, voir Toxicité systémique des anesthésiques locaux.
Occurrence de l'anesthésie rachidienne totale
Total anesthésie rachidienne peut survenir lorsqu'une dose injectée d'anesthésique local destiné à l'espace épidural accède à l'espace sous-arachnoïdien. Dans le rapport de cas d'un enfant de 18 mois pesant 10 kg qui a reçu un bloc du nerf caudal en postopératoire après avoir subi une réparation d'urgence d'une hernie diaphragmatique récurrente, 4 mL de bupivacaïne à 0.5 % et 2.5 μg/kg de buprénorphine ont été injectés dans un total volume de 10 mL. L'ouverture des yeux et le mouvement des mains ont été retardés de 3 heures suite à cette complication. Chez un autre nourrisson subissant une révision d'une fundoplicature de Nissen, un cathéter placé en position caudale a été involontairement avancé dans la région rachidienne cervicale. La stimulation électrique du cathéter (test de Tsui) a entraîné une stimulation du nerf phrénique. Le cathéter a été repositionné avec succès et les soins ultérieurs n'ont pas été compliqués. Ce rapport de cas illustre la relative facilité de passage du cathéter à des niveaux vertébraux élevés chez les nourrissons par opposition aux adultes.
Infection
Un rapport de cas a documenté la rare occurrence d'une discite à distance et d'une ostéomyélite vertébrale impliquant des niveaux de saut et sans le développement de la formation d'un abcès épidural chez une femme âgée qui a reçu un stéroïde péridural caudal et un anesthésique local pour un spondylolisthésis dégénératif. Un mois plus tard, elle développe une discite infectieuse L2–L3 et L4–L5, associée à une ostéomyélite vertébrale adjacente. Les cultures ont démontré la croissance de Pseudomonas aeruginosa, qui a été traitée avec des antibiotiques.
RÉSUMÉ
Le bloc nerveux épidural caudal est une technique d'analgésie et d'anesthésie des racines nerveuses lombo-sacrées qui est antérieure aux approches lombaires conventionnelles. Le bloc nerveux a connu plusieurs périodes d'acceptabilité, et bien qu'il soit rarement appliqué aux cas chirurgicaux de routine chez l'adulte, il s'agit de la technique d'anesthésie régionale la plus couramment pratiquée chez les nourrissons et les enfants. Le bloc nerveux caudal chez les patients adultes a connu une recrudescence ces derniers temps, principalement parce qu'il offre une voie alternative à l'espace épidural lombaire lorsque l'accès direct est limité par des chirurgies antérieures et pour effectuer une épiduroscopie. Les cliniciens qui utilisent régulièrement la fluoroscopie et l'imagerie par ultrasons trouveront qu'il a de nombreuses applications, à la fois pour les cas courants et compliqués.
Références
- Bromage PR : Analgésie péridurale. Saunders, 1978, pp 258–282.
- Racz G : Communication personnelle, 12 octobre 2003, réunion annuelle de l'American Society of Anesthesiologists, San Francisco.
- Trotter M : Variations du canal sacré : leur importance dans l'administration de l'analgésie caudale. Anesth Analg 1947;26:192–202.
- MacDonald A, Chatrath P, Spector T, et al : Niveau de terminaison de la moelle épinière et du sac dural : une étude par résonance magnétique. Clin Anat; 1999;12:149–152.
- Joo J, Kim J, Lee J : La prévalence des variations anatomiques qui peuvent provoquer une ponction durale accidentelle lors de l'exécution d'un bloc nerveux caudal chez les Coréens : Une étude utilisant l'imagerie par résonance magnétique. Anesthésie 2010;65 (1):23–26.
- Igarashi T, Hirabayashi Y, Shimizu R, et al : La structure extradurale lombaire change avec l'âge. Br J Anaest 1997;78:149–152.
- Crighton I, Barry B, Hobbs G : Une étude de l'anatomie de l'espace caudal à l'aide de l'imagerie par résonance magnétique. Br J Anaesth 1997;78:391–395.
- Sekiguchi M, Yabuki S, Satoh K, et al : Une étude anatomique du hiatus sacré. Une base pour un bloc nerveux épidural réussi. Clin J Pain 2004;20:51–54.
- Bryce-Smith R : La propagation des solutions dans l'espace extradural. Anesthésie 1954 ; 9 : 201–205.
- Brenner E : Anesthésie sacrée. Ann Surg 1924;79:118–123.
- Aggarwal A, Kaur H, Batra YK, et al : Considération anatomique de l'espace épidural caudal : une étude sur des cadavres. Clin Anat 2009;22(6):730–737.
- Waldman S : bloc du nerf péridural caudal. Dans Waldman S (ed): Interventional Pain Management, 2e éd. Saunders, 2001, p 520.
- Winnie A, Candido KD : Bloc neural différentiel pour le diagnostic de la douleur. Dans Waldman S (ed): Interventional Pain Management, 2e éd. Saunders, 2001, p. 162-173.
- Candido KD, Stevens RA : Blocs neurolytiques intrathécaux pour le soulagement de la douleur cancéreuse. Best Pract Res Clin Anaesthesiol 2003;17:407–428.
- Lou L, Racz G, Heavner J : Neuroplastie épidurale percutanée. Dans Waldman S (ed): Interventional Pain Management, 2e éd. Saunders, 2001, p. 434–445.
- Cook RA, Driver RP Jr : Patch sanguin épidural. WV Med J 2009;105(5): 28–29.
- Heavner J, Racz G, Raj P : Neuroplastie épidurale percutanée : évaluation prospective de 0.9 % de NaCl contre 10 % de NaCl avec ou sans hyaluronidase. Reg Anesth Pain Med 1999;24:202–207.
- Manchikanti L, Bakhit C, Pampati V : Rôle de l'épidurographie dans la neuroplastie caudale. Pain Digest 1998;8:277–281.
- Kakiuchi M, Abe K : Bloc épidural caudal pré-incisionnel et soulagement de la douleur après des opérations de la colonne lombaire. Int Orthop 1997;21:62–66.
- McCrirrick A, Ramage D : Bloc caudal pour l'analgésie postopératoire : un complément utile aux opiacés intramusculaires après une chirurgie orthopédique d'urgence de la jambe inférieure. Anaesth Intensive Care 1991;19:551–554.
- Van Elstraete A, Pastureau F, Lebrun T, et al : clonidine caudale pour l'analgésie postopératoire chez l'adulte. Br J Anaesth 2000;84:401–402.
- Porges P, Zdrahal F: [Neurolyse alcoolique intrathécale des racines sacrées inférieures dans le cancer du rectum inopérable]. Anesthésiste 1985;34:627–629.
- Ivani G, DeNegri P, Conio A, et al : comparaison de la bupivacaïne racémique, de la ropivacaïne et de la lévobupivacaïne pour l'anesthésie caudale pédiatrique. Effets sur l'analgésie postopératoire et le bloc moteur. Reg Anesth Pain Med 2002;27:157–161.
- Chan S, Tay H, Thomas E : test « Whoosh » comme aide pédagogique dans le bloc caudal. Anaesth Intensive Care 1993;21:414–415.
- Orme R, Berg S : Le test "swoosh" - une évaluation d'un test "whoosh" modifié chez les enfants. Br J Aneaesth 2003;90:62–65.
- Kim MS, Han KH, Kim EM, et al : Le mythe du triangle équilatéral pour l'identification du hiatus sacré chez les enfants réfuté par l'échographie. Reg Anesth Pain Med 2013;38(3):243–247.
- Yoon JS, Sim KH, Kim SJ, Kim WS, Koh SB, Kim BJ : La faisabilité de l'échographie Doppler couleur pour l'injection péridurale caudale de stéroïdes. Douleur 2005 ; 118 : 210–214.
- Tsui B, Tarkkila P, Gupta S, Kearney R : Confirmation du placement de l'aiguille caudale par stimulation nerveuse. Anesthésiologie 1999 ;91 : 374–378.
- Digiovanni A : injection interosseuse par inadvertance - un risque d'anesthésie caudale. Anesthésiologie 1971;34:92–94.
- Lofstrom B : Anesthésie caudale. Dans Ejnar Eriksson (éd.) : Manuel illustré d'anesthésie locale. Astra, 1969, pp 129-134.
- Bloc caudal. Dans Covino BG, Scott DB (eds) : Manuel d'anesthésie péridurale et d'analgésie. Grune & Stratton, 1985, pp 104–108.
- Dawkins C : Une analyse des complications du bloc extradural et caudal. Anesthésie 1969 ; 24 : 554–563.
- Chung Y, Lin C, Pang W, et al : Un bloc caudal continu alternatif avec cathétérisme caudal via l'espace interlombaire inférieur chez les patients adultes. Acta Anaesthesiol Scand 1998;36:221–227.
- Triffterer L, Machata AM, Latzke D, et al : évaluation échographique de la propagation crânienne pendant le bloc caudal chez les enfants : effet de la vitesse d'injection des anesthésiques locaux. Br J Anaesth 2012;108(4):670–674.
- Li Y, Zhou Y, Chen H, Feng Z : L'effet du sexe sur la concentration analgésique locale minimale de ropivacaïne pour l'anesthésie caudale en chirurgie anorectale. Anesth Analg 2010;110:1490–1493.
- Wong S, Li J, Chen C, et al : Bloc péridural caudal pour les procédures gynécologiques mineures en chirurgie ambulatoire. Chang Gung Med J 2004;27:116–121.
- Nishiyama T, Hanaoka K, Ochiai Y : L'approche médiane du bloc péridural transsacré. Anesth Analg 2002;95:1067–1070.
- Schuepfer G, Konrad C, Schmeck J, et al : Génération d'une courbe d'apprentissage pour les blocs épiduraux caudaux pédiatriques : Une évaluation empirique des compétences techniques chez les anesthésiologistes novices et expérimentés. Reg Anesth Pain Med 2000;25:385–388.
- Tsui B, Seal R, Koller J : Placement d'un cathéter épidural thoracique par l'approche caudale chez les nourrissons en utilisant le guidage électrocardiographique. Anesth Analg 2002;95:326–330.
- Lundblad M, Lonnqvist PA, Eksborg S, Marhofer P : Distribution segmentaire de l'anesthésie caudale à volume élevé chez les nouveau-nés, les nourrissons et les tout-petits, évaluée par échographie. Paediatr Anaesth 2011;21(2): 121–127.
- Tuncer S, Yosunkaya A, Reisli R, et al : Effet du bloc caudal sur la réponse au stress chez les enfants. Pediatr Int 2004;46:53–57.
- Valairucha S, Seefelder C, Houck C : Cathéters périduraux thoraciques placés par la voie caudale chez les nourrissons : L'importance de la conformation radiographique. Paediatr Anaest 2002;12:424–428.
- Rojas-Perez E, Castillo-Zamora C, Nava-Ocampo A : Un essai randomisé de bloc caudal avec bupivacaïne 4 mg x kg-l (1.8 ml x kg-l) vs anesthésie générale avec fentanyl pour la chirurgie cardiaque. Pédiatre Anaesth 2003; 13:311–317.
- Koo BN, Hong JY, Kil HK : Propagation de la ropivacaïne par une formule basée sur le poids dans un bloc caudal pédiatrique : Un examen fluoroscopique. Acta Anaesthesiol Scand 2010;54(5):562–565.
- Stow P, Scott A, Phillips A, et al : Concentrations plasmatiques de bupivacaïne pendant l'analgésie caudale et le bloc nerveux ilio-inguinal-iliohypogastrique chez les enfants. Anesthésie 1998 ; 43 : 650–653.
- Verghese S, Hannallah R, Rice LJ, et al : Anesthésie caudale chez les enfants : effet du volume par rapport à la concentration de bupivacaïne sur le blocage de la réponse de traction du cordon spermatique pendant l'orchidopexie. Anesth Analg 2002;95 : 1219–1223.
- Koinig H, Krenn C, Glaser C, et al : La dose-réponse de la ropivacaïne caudale chez les enfants. Anesthésiologie 1999 ; 90 : 1339–1344.
- Jeong-Yeon Hong MD, Sang W, Han MD, et al : une comparaison de la ropivacaïne à volume élevé/faible concentration et à faible volume/concentration élevée dans l'analgésie caudale pour l'orchiopexie pédiatrique. Anesth Analg 2009;109; 1073-1078.
- Deng S, Xiao, W, Tang G, et al : La concentration anesthésique locale minimale de ropivacaïne pour l'analgésie caudale chez les enfants. Anesth Analg 2002;94:1465–1468.
- Lonnqvist P, Westrin P, Larsson B, et al : pharmacocinétique de la ropivacaïne après bloc caudal chez les enfants de 1 à 8 ans. Br J Anaesth 2000;85 : 506–511.
- Deng XM, Xiao WJ, Tang GZ, Luo MP, Xu KL : Concentration analgésique locale minimale de ropivacaïne pour l'analgésie caudale peropératoire chez les enfants d'âge préscolaire et scolaire. Anesthésie 2010;65(10):991–995.
- Dobereiner EF, Cox RG, Ewen A, Lardner DR : Mise à jour clinique fondée sur des données probantes : quel médicament anesthésique local pour le bloc caudal pédiatrique offre une efficacité optimale avec le moins d'effets secondaires ? Can J Anaesth 2010;57(12):1102–1110.
- Schnabel A, Poepping DM, Pogatzki-Zahn EM, Zahn PK : Efficacité et innocuité de la clonidine en tant qu'additif pour l'anesthésie régionale caudale : Une revue systématique quantitative d'essais contrôlés randomisés. Pediatr Anesth 2011;21:1219–1230.
- Saadawy I, Bolker A, Elshahawy MA, et al : effet de la dexmédétomidine sur les caractéristiques de la bupivacaïne dans un bloc caudal en pédiatrie. Acta Anesthesiol Scand 2009;53:251–256.
- El-Hennawy M, Abd-Elwahab AM, Abd-Elmaksoud AM, et al : l'ajout de clonidine ou de dexmédétomidine à la bupivacaïne prolonge l'analgésie caudale chez les enfants. Br J Anaesth 2009;103(2):268–274.
- Verghese S, Mostello L, Patel R : Le test du tonus du sphincter anal prédit l'efficacité de l'analgésie caudale chez les enfants. Anesth Analg 2002;94 : 1161–1164.
- Schindler M, Swann M, Crawford M : Une comparaison de l'analgésie postopératoire fournie par l'infiltration de la plaie ou l'analgésie caudale. Anesth Intensive Care 1991;19:46–49.
- Larousse E, Asehnoune K, Dartayet B, et al : Les effets hémodynamiques de l'anesthésie caudale pédiatrique évalués par Doppler œsophagien. Anesth Analg 2002;94:1165–1168.
- Hong JY, Ahn S, Kil HK : Modifications du schéma de flux de l'artère pédieuse dorsale après bloc caudal chez les enfants : étude observationnelle à l'aide d'une échographie duplex. Pediatr Anesth 2011;21:116–120.
- Manchikanti L, Cash KA, McManus CD, et al. Les résultats préliminaires d'une évaluation comparative de l'efficacité de l'adhésiolyse et des injections épidurales caudales dans la prise en charge des lombalgies chroniques secondaires à une sténose spinale : un essai randomisé contrôlé par équivalence. médecin de la douleur 2009 ; 12:E341–E354.
- Yousef AA, El-Deen AS, Al-Deeb AE : Le rôle de l'ajout d'hyaluronidase à l'injection caudale de stéroïdes et de solution saline hypertonique guidée par fluoroscopie chez les patients atteints du syndrome d'échec de la chirurgie du dos : une étude prospective, en double aveugle et randomisée. Pain Pract 2010;10(6):548–553.
- Manchikanti L, Singh V, Cash KA, Pampati V : Un essai randomisé, contrôlé et en double aveugle d'injections épidurales caudales fluoroscopiques dans le traitement de la hernie discale lombaire et de la radiculite. Spine 2011;36(23): 1897–1905.
- Joshi W, Connelly R, Freeman K, et al : effet analgésique de la clonidine ajoutée à la bupivacaïne à 0.125 % dans le bloc caudal pédiatrique. Paediatr Anaesth 2004;14:483–486.
- Valois T, Otis A, Ranger M, Muir JG : Incidence des douleurs dorsales auto-limitantes chez les enfants après un bloc caudal : une étude exploratoire. Pediatr Anesth 2010;20:844–850.
- Lin J, Zuo YX : Gonflement parotidien unilatéral, suite à un bloc caudal sans mise en place d'un appareil respiratoire. Pediatr Anesth 2011;21:169–178.
- Bagdure DN, Reiter PD, Bhoite GR, et al : hoquet persistant associé à la ropivacaïne épidurale chez un nouveau-né. Ann Pharmacother 2011 ; 45(6):e35.
- Thomas R, Thanthulage S : Céphalée d'hypotension intracrânienne après injection épidurale caudale non compliquée. Anesthésie 2012 ; 67 : 416–419.
- Brown D, Ransom D, Hall J, et al : Anesthésie régionale et toxicité systémique induite par l'anesthésique local : fréquence des crises et modifications cardiovasculaires associées. Anesth Analg 1995;81:321–328.
- Giaufre E, Dalens B, Gombert A : Épidémiologie et morbidité de l'anesthésie régionale chez l'enfant : Une enquête prospective d'un an de la Société des anesthésistes pédiatres de langue française. Anesth Analg 1996:83 : 904–912.
- Dalens B, Hansanoui A : Anesthésie caudale en chirurgie pédiatrique : taux de réussite et effets indésirables chez 750 patients consécutifs. Anesth Analg 1989;8:83–89.
- Afshan G, Khan F : Anesthésie rachidienne totale après bloc caudal avec bupivacaïne et buprénorphine. Paediatr Anaesth 1996;6:239–242.
- Tsui B, Malherbe S : Placement accidentel d'un cathéter épidural cervical par voie caudale à l'aide d'une stimulation électrique. Anesth Analg 2004;99 : 259–261.
- Yue W, Tan S : Discite de niveau de saut à distance et ostéomyélite vertébrale après injection épidurale caudale : rapport de cas d'une complication rare des injections épidurales. Colonne vertébrale 2003 ; 1 : 209–211.
- Ivani G, Mereto N, Lampugnani E, et al : Ropivacaïne en chirurgie pédiatrique : résultats préliminaires [Résumé]. Paediatr Anaesth 1998;8 : 127–129.
- Ivani G, Lampugnani E, De Negri P, et al : Ropivacaïne contre bupivacaïne en chirurgie majeure chez les nourrissons [résumé]. Can J Anaesth 1999;46 : 467–469.
- Ivani G, De Negri P, Conio A, et al : Comparaison de la bupivacaïne racémique, de la ropivacaïne et de la lévobupivacaïne pour l'anesthésie pédiatrique de la queue. Effets sur l'analgésie postopératoire et le bloc moteur. Reg Anesth Pain Med 2002;27:157–161.

