Adam K. Jacob, Sandra L. Kopp et James R. Hebl
INTRODUCTION
Les maladies neurologiques préexistantes du système nerveux périphérique, du système nerveux central et du canal rachidien représentent un défi unique pour les patients et les anesthésistes qui souhaitent utiliser des techniques d'anesthésie régionale. Étant donné que chacune de ces conditions cliniques implique une atteinte aux structures neurales, la préoccupation est qu'une autre atteinte chirurgicale (par exemple, étirement ou compression peropératoire, ischémie du garrot, hémorragie) ou anesthésique (par exemple, traumatisme mécanique, ischémie induite par vasoconstricteur, toxicité anesthésique locale) les causes peuvent entraîner l'apparition ou l'aggravation de déficits neurologiques postopératoires.
Quelle que soit l'étiologie sous-jacente, la présence d'atteinte neurale chronique secondaire à des troubles mécaniques (p. ex., sténose spinale ou radiculopathie compressive), ischémiques (p. ex., maladie vasculaire périphérique), toxiques (p. ex., chimiothérapie à la vincristine ou au cisplatine), métaboliques (p. ex., diabète sucré ), ou des troubles auto-immuns (par exemple, la sclérose en plaques) peuvent exposer les patients à un risque accru de lésions neurologiques supplémentaires. Upton et McComas ont été les premiers à décrire le «phénomène de double écrasement», ce qui suggère que les patients présentant un compromis neuronal préexistant peuvent être plus susceptibles de se blesser à un autre site lorsqu'ils sont exposés à une agression secondaire (Figure 1). Les insultes secondaires peuvent inclure une variété de facteurs de risque chirurgicaux ou anesthésiques aigus, y compris ceux des techniques d'anesthésie régionale. Osterman a souligné que non seulement deux insultes de bas grade le long d'un tronc nerveux périphérique sont pires qu'une seule sur un seul site, mais que les dommages de la double blessure dépassent de loin les dommages additifs attendus causés par chaque insulte isolée. On peut en outre postuler que la deuxième agression n'a pas besoin d'être le long du tronc nerveux périphérique lui-même, mais plutôt à n'importe quel point le long de la voie de transmission neurale. Par conséquent, la performance des techniques régionales périphériques ou neuraxiales chez les patients présentant des troubles neurologiques préexistants peut les exposer à un risque accru de phénomène de double écrasement.
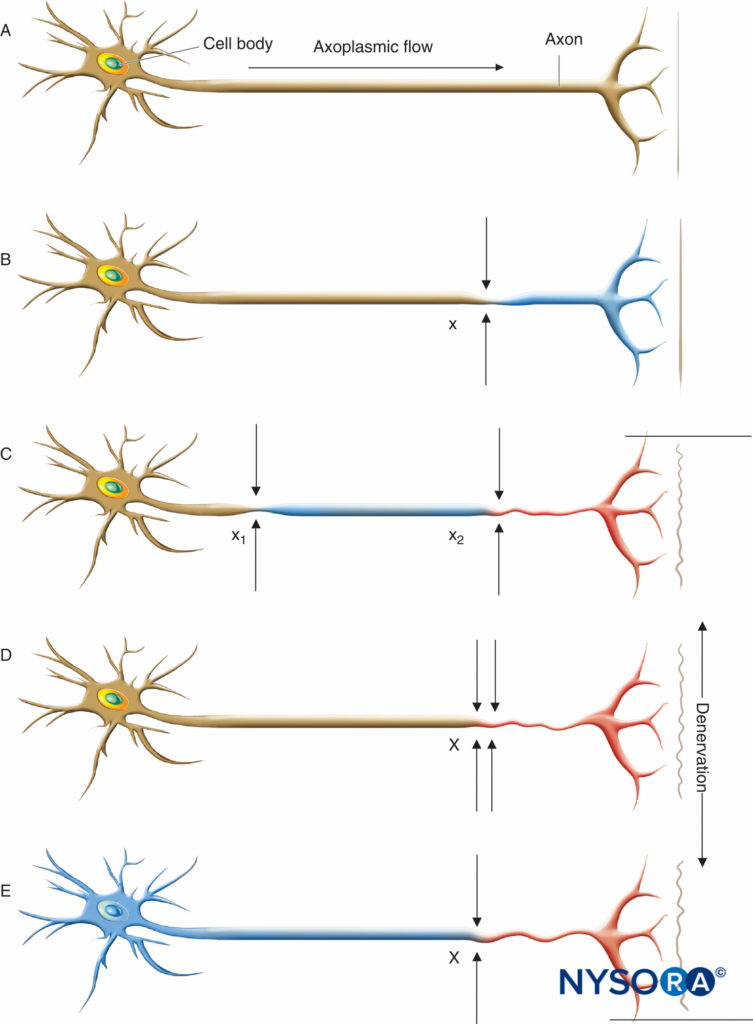
FIGURE 1. Lésions neurales entraînant une dénervation. Le flux axoplasmique est indiqué par le degré d'ombrage. La perte complète du flux axoplasmique entraîne une dénervation (C, D, E). A : Neurone normal. B : Une lésion neuronale légère sur un seul site (x) est insuffisante pour provoquer une dénervation en aval de l'insulte. C : Une lésion neuronale légère à deux sites distincts (x1 et x2) peut provoquer une dénervation distale (c'est-à-dire un « double écrasement »). D : Une lésion neuronale sévère à un seul site (X) peut également provoquer une dénervation distale. E : Un axone avec un processus pathologique sous-jacent diffus et préexistant (toxique, métabolique, ischémique) peut avoir un flux axonal altéré dans tout le neurone, qui peut être symptomatique ou non, mais prédispose l'axone à la dénervation distale après une seule atteinte neurale mineure à x ( c'est-à-dire "double écrasement"). (Reproduit avec la permission de la Mayo Foundation for Medical Education and Research.)
Malheureusement, les données disponibles concernant toute association entre une maladie neurologique préexistante et un dysfonctionnement de l'anesthésie post-régionale sont souvent contradictoires en termes de résultats et de conclusions. En conséquence, des recommandations définitives peuvent rarement être faites à partir de la littérature scientifique existante. Cependant, la discussion suivante fournit une revue complète de la littérature disponible sur le sujet afin que les patients et les cliniciens puissent prendre une décision éclairée concernant le risque neurologique potentiel d'effectuer une anesthésie régionale en présence de troubles neurologiques préexistants.
TROUBLES DU SYSTÈME NERVEUX PÉRIPHÉRIQUE
Le système nerveux périphérique est composé de nombreux types de cellules qui remplissent diverses fonctions sensorielles, motrices et autonomes. Les signes et les symptômes d'une altération de la fonction dépendent de la distribution et de la gravité de la blessure, en plus de l'élément spécifique du nerf qui est affecté. Plus de 100 neuropathies périphériques ont été identifiées, chacune avec sa physiopathologie, ses symptômes et son pronostic.
Neuropathie périphérique héréditaire
Les neuropathies héréditaires représentent un groupe hétérogène de maladies qui partagent souvent les caractéristiques d'un début insidieux et d'une évolution indolente sur des années, voire des décennies. Un large éventail de génotypes entraîne des phénotypes allant de symptômes légers et de maladies subcliniques à des conditions graves et débilitantes. Les neuropathies héréditaires les plus courantes sont un groupe de troubles collectivement appelés maladie de Charcot-Marie-Tooth (CMT). La CMT affecte environ 1 personne sur 2500, commençant souvent dans l'enfance ou l'adolescence. Les neuropathies CMT sont causées par des mutations dans plus de 30 gènes responsables de la fabrication des neurones ou de la gaine de myéline. Les signes et symptômes typiques comprennent une faiblesse motrice extrême et une fonte musculaire dans les membres inférieurs et les pieds distaux, des anomalies de la marche, une perte de réflexes tendineux et un engourdissement dans les membres inférieurs. L'utilisation signalée de techniques d'anesthésie régionale périphérique ou centrale chez les patients atteints de CMT a été limitée à de petites séries de cas et à des rapports de cas anecdotiques. Tous les patients se sont rétablis sans incident sans aggravation de leurs conditions neurologiques. Il convient de noter que deux cas impliquant des techniques régionales à injection unique (anesthésie péridurale avec 18 mL de ropivacaïne à 0.75 % et analgésie supraclaviculaire avec 30 mL de bupivacaïne à 0.5 %) ont rapporté un effet prolongé (respectivement 12 heures et 30 heures) de la technique régionale par rapport à la durée prévue. Dans les deux cas, l'utilisation de concentrations plus élevées d'anesthésique local peut avoir contribué au retard de récupération.
La neuropathie héréditaire responsable de la paralysie par pression (HNPP) est une autre neuropathie périphérique démyélinisante héréditaire rare dans laquelle les individus souffrent de neuropathies motrices et sensorielles répétées suite à une brève compression nerveuse ou à un traumatisme léger (c'est-à-dire des paralysies par pression). Décrit pour la première fois au début des années 1990, le HNPP a été lié à une mutation du gène PMP-22 entraînant une réduction de la production de myéline. Les preuves de l'utilisation d'une technique régionale dans le cadre de l'HNPP ont été limitées à un seul rapport de cas. Lepski et Alderson ont rapporté l'utilisation réussie d'une péridurale pour l'analgésie du travail chez une parturiente de 24 ans atteinte de HNPP. La patiente s'est rétablie sans incident sans aggravation de son état neurologique.
Sur la base du manque de preuves cliniques, des recommandations définitives ne peuvent être faites sur la sécurité et l'utilisation de l'anesthésie régionale chez les patients atteints de neuropathies périphériques héréditaires préexistantes. Cependant, des rapports de cas isolés suggèrent que les techniques régionales périphériques et centrales peuvent être utilisées sans aggraver l'état neurologique stable d'un patient. Cependant, il convient de faire preuve de prudence pour minimiser les autres facteurs de risque chirurgicaux (p. ex., utilisation d'un garrot) et anesthésiques (p. ex., concentration ou dose réduite d'anesthésique local) de lésion nerveuse périopératoire lorsque l'on envisage l'utilisation d'une anesthésie régionale au sein de cette population de patients.
Neuropathie périphérique acquise Polyneuropathie diabétique
La prévalence croissante du diabète sucré (DM) et de ses comorbidités associées se traduira probablement par un plus grand nombre de patients diabétiques se présentant pour une intervention chirurgicale. Malgré les avantages cliniques et l'utilisation généralisée de l'anesthésie régionale (bloc périphérique et neuraxial), des inquiétudes subsistent quant à son utilisation chez les patients atteints de diabète sucré. Il a été suggéré que les patients ayant des antécédents d'atteinte neurale chronique secondaire à des conditions métaboliques telles que le diabète pourraient présenter un risque accru d'aggravation des lésions neurologiques après un bloc nerveux neuraxial ou périphérique.
Le diabète sucré est actuellement la cause la plus fréquente de polyneuropathie systémique. Il existe plusieurs types de neuropathie associée au DM, mais la polyneuropathie sensorimotrice symétrique distale est la forme la plus courante et est généralement synonyme du terme polyneuropathie diabétique (DPN). La fréquence des DPN varie de 4 % à 8 % au moment du diagnostic à plus de 50 % chez les patients atteints de diabète de longue date. Malgré le fait que les patients peuvent être asymptomatiques, presque tous auront des signes de conduction nerveuse anormale. En outre, il est relativement courant que des patients se présentent pour une intervention chirurgicale avec un diabète sucré non diagnostiqué ou un diabète connu avec une hyperglycémie non contrôlée.
La physiopathologie de la DPN est mal comprise et probablement multifactorielle. Les premiers symptômes, tels que l'engourdissement, la douleur et le dysfonctionnement autonome, sont causés par des dommages aux petites fibres nerveuses, qui surviennent avant que les dommages aux grosses fibres ne deviennent apparents. Il existe des preuves physiopathologiques d'anomalies dans les grands et les petits vaisseaux sanguins neuraux, contribuant finalement à la perte de fibres multifocales. La dégénérescence axonale est la caractéristique la plus importante de la DPN et survient secondairement à la réduction de l'apport de nutriments essentiels et d'autres composants (oxygène, sang, adénosine triphosphate, glucose) à l'axone. Les mécanismes proposés comprennent (1) le dépôt de sorbitol dans le nerf dû à l'accumulation de glucose ; (2) ischémie tissulaire locale dans les fibres sensorielles et autonomes secondaire à l'hypoxie endoneurale ; (3) des mécanismes de réparation tissulaire anormaux provoqués par un excès de glucose ; et (4) un dysfonctionnement mitochondrial dans les ganglions de la racine dorsale.
Actuellement, il existe une abondance de données animales qui suggèrent que les nerfs diabétiques peuvent avoir un risque accru de lésions neurologiques après une anesthésie régionale par rapport aux nerfs non diabétiques. Kalichman et Calcutt ont été les premiers à émettre l'hypothèse que les fibres nerveuses diabétiques pourraient être plus sensibles à la neurotoxicité des anesthésiques locaux pour deux raisons : (1) le nerf est déjà stressé en raison d'une hypoxie ischémique chronique ; et (2) les nerfs sont exposés à des concentrations plus importantes d'anesthésiques locaux en raison d'une diminution du débit sanguin périneural. Plus récemment, ces résultats ont été étayés par des données animales et cliniques. Lirk et ses collègues ont utilisé des rats gras diabétiques de Zucker exposés à l'hyperglycémie pour démontrer que bien que la différence globale de survie neuronale soit faible, la neurotoxicité anesthésique locale in vitro était plus prononcée dans les neurones d'animaux diabétiques. Les auteurs ont également signalé qu'une neuropathie subclinique préexistante entraînait un allongement substantiel de la durée du bloc in vivo. Kroin et ses collègues ont également signalé que la durée du bloc du nerf sciatique avec la lidocaïne à 1 % ou la ropivacaïne à 0.5 % était plus longue chez les rats diabétiques induits par la streptozotocine par rapport aux rats non diabétiques et que la durée du bloc était corrélée à la dégénérescence des fibres nerveuses. Dans une étude ultérieure, les mêmes auteurs ont également conclu qu'avec un contrôle glycémique continu, les rats diabétiques avaient une durée de bloc similaire à celle des rats non diabétiques et 40 minutes plus courte que chez les rats diabétiques sans contrôle glycémique. Fait intéressant, le contrôle glycémique aigu n'a pas diminué la durée du bloc nerveux, ce qui suggère que la neuropathie diabétique n'est pas rapidement inversée dans ce modèle animal. Actuellement, il n'est pas clair si les résultats des études animales utilisant l'hyperglycémie induite expérimentalement peuvent être utilisés pour formuler des recommandations pour les patients atteints de diabète sucré de longue date.
Bien que les études animales aient constamment montré que les nerfs diabétiques sont plus sensibles aux anesthésiques locaux et potentiellement plus sensibles aux lésions neurales, il n'est pas clair si les patients diabétiques subissent une incidence plus élevée de lésions neurologiques après une anesthésie régionale. Il existe des données cliniques limitées suggérant que le succès du bloc nerveux périphérique (plexus brachial supraclaviculaire) peut être plus élevé chez les patients diabétiques indépendamment d'autres facteurs prédictifs de succès (p. ex., indice de masse corporelle) par rapport aux patients non diabétiques. Gebhard et ses collègues ont proposé plusieurs théories pour cette découverte, notamment (1) une sensibilité plus élevée des fibres nerveuses diabétiques aux anesthésiques locaux ; (2) possible pénétration intraneurale inconnue avant l'injection ; et (3) DPN préexistant accompagné d'une sensation diminuée. On rapporte depuis longtemps que la pathologie préexistante joue un rôle dans le développement d'un dysfonctionnement neurologique postopératoire. Un rapport de cas récent a décrit une neuropathie fémorale postopératoire persistante après l'arrêt d'un cathéter du nerf fémoral chez un patient présentant une neuropathie diabétique subclinique préexistante qui n'avait pas été diagnostiquée avant l'opération.
Chez les patients atteints de diabète sucré, une diminution de la sensibilité à la stimulation électrique associée à une diminution de la fonction sensorielle et une sensibilité accrue à la toxicité de l'anesthésique local peuvent augmenter le risque d'injection intraneurale lors d'un bloc nerveux périphérique à l'aide d'un stimulateur nerveux périphérique. Actuellement, il existe un manque de preuves cliniques suggérant que l'utilisation du guidage échographique est plus sûre que la stimulation des nerfs périphériques au sein de la population générale. Cependant, cette absence de bénéfice clinique établi est moins claire pour les patients diabétiques. Par exemple, il existe un nombre limité d'études animales et cliniques qui suggèrent que le guidage par ultrasons peut être une méthode plus souhaitable de localisation neurale chez les patients diabétiques. Des études animales ont montré que la stimulation électrique à bas seuil peut ne pas offrir de protection contre l'injection intraneurale en présence d'hyperglycémie. Rigaud et ses collègues ont démontré que toutes les insertions d'aiguilles dans un modèle de chien hyperglycémique ont entraîné une injection intraneurale (6/6), alors qu'une seule injection intraneurale (1/18) s'est produite chez les chiens témoins. Les sites et leurs collègues ont également conclu que le guidage échographique peut être une méthode préférée de localisation neurale chez les patients diabétiques après avoir échoué à susciter une réponse motrice ou une paresthésie chez deux patients subissant un bloc du nerf sciatique à l'aide d'une stimulation nerveuse périphérique. Les auteurs ont décrit une réponse motrice très faible chez les deux patients diabétiques avec un courant de stimulation supérieur à 2.4 mA malgré la mise en place périneurale de l'aiguille de stimulation sous guidage échographique. Une autre application potentielle de la technologie des ultrasons est la capacité d'utiliser la section transversale d'un nerf périphérique pour identifier une neuropathie périphérique clinique ou subclinique : un diagnostic qui, historiquement, aurait nécessité des études complexes de conduction nerveuse.
Les résultats de l'implication de la moelle épinière chez les patients diabétiques suggèrent que le même mécanisme de blessure ou un mécanisme similaire peut affecter non seulement les nerfs périphériques, mais également les éléments neuraux dans le neuraxis central. À l'aide de l'imagerie par résonance magnétique, Selvarahah et ses collègues ont décrit une atteinte précoce du système nerveux central consistant en une réduction significative de la section transversale de la moelle épinière chez les patients atteints de neuropathie périphérique diabétique subclinique et cliniquement détectable. Un rapport de cas d'un patient diabétique souffrant d'une neuropathie persistante des membres inférieurs après ce qui semblait être une analgésie péridurale sans incident renforce les inquiétudes selon lesquelles les patients diabétiques pourraient être exposés à un risque accru de lésion neurologique après une anesthésie neuraxiale. Une revue rétrospective a également évalué les complications neurologiques chez les patients atteints de neuropathie sensorimotrice périphérique préexistante ou de polyneuropathie diabétique qui ont ensuite subi une anesthésie ou une analgésie neuraxiale. Sur les 567 patients étudiés, deux (0.4 % ; IC à 95 % 0.1 % à 1.3 %) ont présenté des déficits neurologiques postopératoires nouveaux ou progressifs par rapport aux résultats préopératoires. Les auteurs ont conclu que bien que le risque de lésions neurologiques postopératoires sévères chez les patients diabétiques soit rare, il semble être plus élevé que celui rapporté dans la population générale. Bien que la technique neuraxiale ne puisse pas être définitivement impliquée comme la cause principale de l'atteinte neurologique, elle peut avoir été un facteur contributif chez les patients présentant une atteinte neurale préexistante.
En résumé, les patients atteints de DPN ont probablement des éléments neuronaux qui sont plus sensibles aux effets de l'anesthésique local. En conséquence, les nerfs périphériques diabétiques peuvent être plus sensibles aux lésions ultérieures dues à la toxicité de l'anesthésique local ou aux agressions ischémiques. En fin de compte, la décision d'utiliser l'anesthésie régionale chez les patients diabétiques doit être prise sur une base individuelle après une discussion approfondie avec le patient concernant les risques et les avantages potentiels de la technique. Il faut envisager de diminuer la concentration ou la dose totale d'anesthésique local pour les techniques périphériques et neuraxiales, en particulier chez les patients profondément symptomatiques. De plus, l'utilisation du guidage échographique peut faciliter le placement de l'aiguille périneurale et l'utilisation de volumes d'anesthésie locale plus faibles chez les patients diabétiques, bien que des données définitives garantissant une sécurité accrue avec le guidage échographique fassent actuellement défaut. La diminution de la concentration ou de la dose d'anesthésique local et l'élimination des additifs d'épinéphrine doivent également être envisagées étant donné que les nerfs diabétiques sont déjà à risque d'ischémie neurale et d'infarctus en raison de modifications de la microvasculature endoneurale.
Neuropathie induite par la chimiothérapie
La neuropathie périphérique induite par la chimiothérapie (NPCI) est un effet secondaire fréquent de plusieurs agents chimiothérapeutiques couramment utilisés. Il s'agit d'un effet secondaire dose-limitant qui survient chez environ 30 à 40 % des patients. Le mécanisme exact de la lésion n'est pas clair, bien que les dommages aux microtubules, l'interférence avec le transport axonal basé sur les microtubules, la perturbation mitochondriale et les effets cytotoxiques sur l'ADN soient tous des mécanismes possibles. Le degré de neurotoxicité dépend de l'agent utilisé, de la durée d'administration et de la dose cumulée reçue. Le cisplatine, l'oxaliplatine et le carboplatine induisent typiquement une neuropathie périphérique douloureuse sensorielle pure, alors que la vincristine, le paclitaxel et la suramine ont tendance à induire une neuropathie sensorimotrice mixte avec ou sans atteinte du système nerveux autonome. Les symptômes se situent souvent dans la distribution « gant et bas » et consistent en des douleurs ou des paresthésies. Les patients à risque de développer une CIPN comprennent ceux qui présentent des lésions neurales préexistantes secondaires au diabète sucré, à une consommation excessive d'alcool ou à une neuropathie périphérique héréditaire. En général, une période prolongée de régénération est nécessaire pour restaurer la fonction neurologique, une récupération incomplète étant le résultat le plus courant. Cependant, les patients qui se remettent d'une CIPN ont un risque accru de développer des symptômes neuropathiques progressifs s'ils sont exposés à des agents neurotoxiques supplémentaires. Les anesthésiques locaux sont potentiellement neurotoxiques, et la prudence s'impose au moment de décider d'effectuer ou non une anesthésie régionale chez les patients qui ont reçu des agents chimiothérapeutiques connus pour causer la NPIC. Il est courant que les patients présentent une neuropathie subclinique qui ne se présente qu'à la suite d'une deuxième atteinte neurologique, telle qu'un bloc périphérique ou neuraxial.
Neuropathie de piégeage
La neuropathie par piégeage, l'un des troubles les plus répandus du système nerveux périphérique, survient lorsqu'un seul nerf est chroniquement comprimé ou blessé mécaniquement à un endroit spécifique. Le piégeage du nerf cubital au niveau du coude, appelé « syndrome de piégeage cubital », est la deuxième neuropathie de compression des membres supérieurs la plus fréquente. Le nerf cubital présente un risque accru en raison de sa localisation superficielle dans la région du coude médial. Une lésion nerveuse peut survenir à la suite d'un traumatisme aigu, d'une compression, d'une traction répétitive, d'une subluxation du nerf, d'arthrose ou de goutte ou à la suite d'une intervention chirurgicale des membres supérieurs. Les symptômes initiaux comprennent une hyperesthésie dans la distribution du nerf cubital, des douleurs au coude et des paresthésies dans l'annulaire et les petits doigts. Ces symptômes sont souvent intermittents et peuvent évoluer au fil des mois, voire des années. Aux stades avancés de la maladie, une faiblesse des muscles intrinsèques de la main avec ou sans atrophie visible peut être observée. À l'heure actuelle, la pratique la plus courante consiste à traiter de manière conservatrice les patients présentant des symptômes légers sans faiblesse ni atrophie, tandis que la chirurgie est indiquée chez les patients qui ne s'améliorent pas après une prise en charge conservatrice ou qui présentent des signes et symptômes neurologiques sévères (p. ex., paresthésie persistante, faiblesse objective, atrophie musculaire).
L'anesthésie générale, régionale ou locale peut être utilisée pour la décompression chirurgicale d'un nerf cubital coincé. Le choix de l'anesthésique dépend de l'intervention chirurgicale, si la fonction nerveuse sera testée en peropératoire et de l'étendue des dommages accompagnant la lésion nerveuse. Dans une étude de cohorte de 2001 portant sur 360 patients atteints de neuropathie ulnaire préexistante subissant une transposition du nerf ulnaire, Hebl et ses collègues ont découvert que la technique d'anesthésie (anesthésie générale par rapport à anesthésie régionale) n'affectait pas le résultat neurologique immédiatement après la chirurgie ou deux à six semaines après l'opération. Une discussion préopératoire avec le chirurgien pour déterminer le plan peropératoire et répondre aux préoccupations spécifiques liées au processus pathologique du patient aidera l'anesthésiste à choisir la technique d'anesthésie la plus appropriée.
Neuropathie inflammatoire Syndrome de Guillain-Barré
Le syndrome de Guillain-Barré (SGB) est une polyneuropathie démyélinisante inflammatoire aiguë caractérisée par une aréflexie et une paralysie neuromusculaire ascendante diffuse. L'étiologie du SGB n'est pas claire, bien que l'infection, la grossesse, les vaccinations, l'immunosuppression, les maladies systémiques et la transfusion aient toutes été proposées comme déclencheurs potentiels. Le degré et la distribution de la paralysie sont variables et peuvent inclure une atteinte des nerfs sensoriels, des nerfs crâniens et du système nerveux autonome. Les symptômes culminent environ deux à quatre semaines après l'apparition initiale, la plupart des patients connaissant une récupération prolongée. Malheureusement, de nombreux patients souffrent de troubles neurologiques modérés à sévères pendant des années après le diagnostic initial.
Il existe plusieurs rapports de SGB survenant dans la période postopératoire suite à une variété d'interventions chirurgicales utilisant divers types d'anesthésiques. Cependant, les rapports de cas d'utilisation de l'anesthésie régionale chez les patients atteints de SGB sont généralement limités à la population obstétricale. Certains patients atteints de SGB peuvent présenter une instabilité autonome et présenteront par la suite une réponse exagérée au bloc neuraxial, tandis que d'autres patients atteints de SGB présenteront une réponse normale à l'anesthésie neuraxiale. Bien qu'il y ait eu des rapports d'anesthésie neuraxiale réussie chez des parturientes atteintes de SGB, le potentiel des anesthésiques locaux d'interagir avec la myéline périphérique ou de provoquer un traumatisme nerveux direct ne peut être ignoré. Certaines preuves suggèrent que l'anesthésie péridurale peut précipiter ou réactiver le SGB quelques heures à plusieurs semaines après la chirurgie. Cependant, il est difficile de déterminer si cela est dû aux effets de la péridurale, à la progression naturelle de la maladie, à l'intervention chirurgicale ou à la réponse au stress liée à la chirurgie. Bien qu'il ait été suggéré que l'inflammation neuronale aiguë puisse être une contre-indication relative à l'anesthésie régionale, les données existantes fournissent peu d'informations concernant la sécurité de l'anesthésie neuraxiale ou du bloc nerveux périphérique chez les patients atteints de SGB. En fin de compte, la décision d'effectuer une anesthésie régionale doit être prise sur une base individuelle après une discussion approfondie avec le patient concernant les risques et les avantages potentiels.
Neuropathie inflammatoire post-chirurgicale
La neuropathie inflammatoire post-chirurgicale (PSIN) est un processus auto-immun ou inflammatoire récemment décrit qui peut être à l'origine de déficits neurologiques postopératoires sévères. Le personnel et ses collègues ont récemment décrit une série de 33 patients qui ont développé un PSIN dans les 30 jours suivant la chirurgie. Le diagnostic a été confirmé chez la plupart des patients après une biopsie du nerf périphérique. On pense que le PSIN est une réponse idiopathique à médiation immunitaire à un stress physiologique tel qu'un processus infectieux, une vaccination ou une intervention chirurgicale. La condition peut se présenter sous la forme de déficits neurologiques focaux, multifocaux ou diffus dans le cadre d'une imagerie radiographique négative. Compliquant le diagnostic, l'apparition de déficits neurologiques peut ne pas être apparente pendant la période postopératoire immédiate, et les déficits peuvent être dans une distribution anatomique éloignée du site chirurgical ou de la technique d'anesthésie régionale. Les facteurs de risque ou les déclencheurs potentiels du PSIN comprennent la malignité, le diabète sucré, le tabagisme, l'infection systémique, l'utilisation d'anesthésiques volatils et une transfusion sanguine récente. La suppression de la réponse immunitaire avec des corticostéroïdes à forte dose prolongée ou des immunoglobulines intraveineuses est le traitement de choix actuel. L'objectif du traitement est d'atténuer suffisamment la réponse inflammatoire pour permettre la régénération axonale. Heureusement, la plupart des patients s'améliorent avec les recommandations de traitement actuelles, la douleur et les déficits sensoriels s'améliorant avant la résolution des déficits moteurs.
Le degré auquel les mécanismes inflammatoires jouent un rôle dans le dysfonctionnement neurologique postopératoire est inconnu et mal caractérisé, en particulier dans la littérature sur l'anesthésie. En conséquence, les prestataires d'anesthésie et les chirurgiens considèrent rarement cette étiologie potentielle de lésion nerveuse lors de l'évaluation des patients présentant des déficits postopératoires. Ceci est problématique, car l'approche commune d'attente vigilante et de gestion conservatrice ne sera pas efficace chez les patients atteints de PSIN. Au contraire, le PSIN est une condition clinique qui doit être suspectée tôt dans le processus de la maladie afin qu'un diagnostic définitif puisse être obtenu (via une biopsie nerveuse) et une immunothérapie agressive initiée pour tenter d'améliorer les résultats neurologiques.
TROUBLES DU SYSTÈME NERVEUX CENTRAL
Historiquement, les techniques d'anesthésie neuraxiale n'ont pas été proposées aux patients présentant des troubles neurologiques préexistants du système nerveux central (p. ex., sclérose en plaques, syndrome postpolio, sclérose latérale amyotrophique) par crainte d'une aggravation des résultats neurologiques. En fait, de nombreux historiens pensent que la recommandation de Dripps et Vandam en 1956 d'éviter l'anesthésie régionale chez les patients souffrant de troubles neurologiques préexistants a eu un impact sur la gestion clinique pendant près d'un demi-siècle. Plusieurs mécanismes théoriques ont été proposés sur la base du phénomène de double écrasement, y compris les lésions neurologiques causées par un traumatisme induit par une aiguille ou un cathéter, la neurotoxicité anesthésique locale et l'ischémie neurale due aux additifs anesthésiques locaux. Cependant, l'évitement de l'anesthésie régionale au sein de cette population de patients peut également être dû à des préjugés du médecin et du patient ou à des préoccupations médico-légales potentielles. Il existe plusieurs facteurs confondants (âge, habitus corporel, traumatisme chirurgical, temps et pressions de garrot, positionnement, technique d'anesthésie) qui rendent difficile la détermination de l'étiologie de l'aggravation des déficits neurologiques postopératoires.
Une revue récente a évalué 139 patients ayant des antécédents d'un ou plusieurs troubles du système nerveux central qui ont ensuite subi une technique d'anesthésie neuraxiale. Les troubles neurologiques préopératoires comprenaient principalement le syndrome postpolio (SPP), la sclérose en plaques (SEP), la sclérose latérale amyotrophique (SLA) et les lésions chroniques de la moelle épinière (SCI). Contrairement aux conclusions de Vandam et Dripps il y a plusieurs décennies, les auteurs n'ont identifié aucun déficit neurologique postopératoire nouveau ou aggravé (0.0 % ; IC à 95 %, 0.0 % à 0.3 %) au sein de leur cohorte de patients. Ceci malgré le fait que 74% des patients ont signalé des symptômes neurologiques actifs (paresthésies, dysesthésies, hyperréflexie) ou des déficits sensorimoteurs pendant la période préopératoire immédiate et ont ensuite reçu des doses standard d'anesthésiques locaux. Deux revues plus petites portant sur des parturientes recevant de plus petites doses d'anesthésique local pour l'analgésie du travail ont rapporté des résultats similaires.
De toute évidence, d'autres investigations avec un plus grand nombre de patients sont nécessaires pour faire des recommandations définitives. Cependant, les données actuelles suggèrent que la décision d'effectuer une anesthésie neuraxiale chez les patients présentant des troubles préexistants du système nerveux central doit être basée sur les risques et les avantages pour chaque patient. Certains auteurs ont postulé que le risque neurologique pourrait être plus élevé chez les patients présentant des déficits neurologiques progressifs par rapport à ceux présentant des symptômes sensori-moteurs chroniques et stables qui n'ont pas changé au cours de plusieurs mois ou années.
Sclérose en plaque
La sclérose en plaques est une maladie inflammatoire auto-immune du système nerveux central avec un risque à vie de 1 sur 400, ce qui en fait la maladie neurologique débilitante la plus courante chez les jeunes adultes. Il s'agit d'une maladie dégénérative chronique caractérisée par une démyélinisation focale dans la moelle épinière et le cerveau. Cette démyélinisation se traduit par un bloc de conduction fluctuant qui provoque une classique "croissance et décroissance" des symptômes caractéristiques de la maladie. Les signes et symptômes comprennent des déficits sensoriels ou moteurs, une diplopie ou une perte de vision, un dysfonctionnement intestinal ou vésical et une ataxie. L'étiologie précise n'est pas claire; cependant, une combinaison de facteurs de risque génétiques et de facteurs environnementaux joue probablement un rôle. Vingt-cinq pour cent des patients atteints de SEP sont essentiellement asymptomatiques et leurs activités de la vie quotidienne ne sont pas affectées. Cependant, jusqu'à 15 % des patients peuvent devenir gravement handicapés avec des déficits sensori-moteurs importants en peu de temps. Plusieurs facteurs communs à la chirurgie peuvent avoir un impact négatif sur le processus de la maladie, notamment l'hyperpyrexie, le stress émotionnel et l'infection. Le mécanisme d'aggravation de la fonction neurologique chez les patients atteints de SEP n'est pas clair et peut survenir par coïncidence au cours de la période postopératoire, indépendamment de la technique d'anesthésie. Les preuves concernant le risque d'anesthésie régionale chez les patients atteints de SEP sont limitées. Malgré certaines preuves de démyélinisation des nerfs périphériques dans la SEP, le bloc nerveux périphérique a traditionnellement été considéré comme sûr. Cependant, un rapport récent de plexopathie brachiale sévère suite à un bloc interscalénique guidé par échographie a soulevé la préoccupation qu'un segment de patients atteints de SEP puisse avoir une neuropathie périphérique subclinique. Plusieurs chercheurs ont mis en évidence des lésions périphériques démyélinisantes axonales (plus sensorielles que motrices) chez les patients atteints de SEP. Misawa et ses collègues ont démontré qu'une démyélinisation périphérique peut survenir chez 5 % des patients atteints de SEP, tandis que Pogorzelski et ses collègues ont rapporté qu'une démyélinisation périphérique peut survenir chez jusqu'à 47 % des patients. De même, Sarova-Pinhas et ses collègues ont décrit des anomalies de la conduction nerveuse dans jusqu'à 14.7 % des nerfs périphériques chez les patients atteints de SEP, contre seulement 2.4 % des nerfs dans la population générale. Malgré ces preuves, l'incidence globale et la pertinence clinique de cette neuropathie périphérique sous-jacente restent indéfinies dans le cadre de la réalisation d'un bloc nerveux périphérique chez les patients atteints de SEP.
Contrairement au bloc nerveux périphérique, le risque potentiel de déficits neurologiques nouveaux ou progressifs chez les patients atteints de SEP après une rachianesthésie a été décrit pour la première fois en 1937. Critchley et ses collègues ont décrit trois patients atteints de [sclérose (en plaques) disséminée] qui ont présenté une aggravation des symptômes après une rachianesthésie. anesthésie. Les auteurs ont conclu que [la rachianesthésie peut être un agent précipitant dans l'évolution de la sclérose en plaques (sclérose en plaques).] Plusieurs études ultérieures ont démontré des résultats similaires avec le développement de déficits neurologiques nouveaux ou aggravés ou une probabilité plus élevée d'exacerbation des symptômes après la rachianesthésie. En revanche, une étude plus récente n'a démontré aucun symptôme neurologique nouveau ou aggravé après une rachianesthésie chez 35 patients atteints de SEP subissant diverses interventions chirurgicales.
La sécurité de l'anesthésie péridurale et de l'analgésie chez les patients atteints de SEP a été concentrée presque exclusivement sur la population obstétricale, qui peut ne pas représenter avec précision la patiente SEP non enceinte. La grossesse est fréquemment associée à une diminution des rechutes de la maladie, tandis que la période post-partum est souvent associée à un risque accru de rechute. La transition de l'immunité cellulaire à l'immunité humorale nécessaire au système immunitaire de la mère pour tolérer le fœtus est considérée comme protectrice pendant la grossesse. Cependant, à mesure que l'immunité à médiation cellulaire rebondit pendant la période post-partum, les patientes subiront souvent une aggravation transitoire des symptômes neurologiques qui pourraient être faussement attribuées aux techniques récentes d'anesthésie régionale.
Confavreux et ses collègues ont réalisé l'une des rares études prospectives évaluant les facteurs de risque associés à la rechute de la maladie pendant la période post-partum. Ils ont conclu que l'analgésie péridurale pendant le travail et l'accouchement ne contribuait pas à un risque plus élevé de rechute par rapport aux patients qui n'avaient pas reçu de techniques neuraxiales. De même, Kuczkowski n'a trouvé aucune association entre toute forme d'analgésie régionale obstétricale et l'aggravation des symptômes de la SEP chez les patientes obstétricales. L'anesthésie péridurale et l'analgésie ont traditionnellement été recommandées par rapport à la rachianesthésie chez les patients atteints de SEP parce que la concentration d'anesthésique local dans la substance blanche de la moelle épinière est un quart du niveau après l'injection péridurale par rapport à l'injection intrathécale. On pense que le manque de myéline peut laisser la moelle épinière sensible aux effets neurotoxiques des anesthésiques locaux. Bien que des études définitives sur les effets pharmacologiques des concentrations et des doses d'anesthésiques locaux fassent défaut, beaucoup recommandent de limiter les doses et les concentrations d'anesthésiques locaux neuraxiaux au niveau le plus bas possible. Il existe certaines preuves que la lidocaïne peut aggraver de manière réversible les symptômes de la SEP en bloquant suffisamment les canaux sodiques dans les zones démyélinisées pour provoquer des symptômes par rapport aux zones myélinisées saines qui ne sont pas affectées. En ce qui concerne la patiente obstétricale, le risque d'anesthésie ou d'analgésie neuraxiale doit être mis en balance avec le risque accru d'anesthésie générale. Une enquête récente menée au Royaume-Uni a démontré que 90 % des anesthésiologistes obstétriciens effectueraient une rachianesthésie pour une césarienne d'urgence chez une patiente atteinte de SEP après avoir soigneusement évalué les risques et les avantages potentiels.
En résumé, il reste peu de preuves concluantes pour soutenir ou réfuter l'utilisation de l'anesthésie régionale chez les patients atteints de SEP. Le bloc nerveux périphérique n'a pas été définitivement démontré comme nocif dans le cadre de la SEP, et par conséquent la SEP ne doit pas être considérée comme une contre-indication absolue à cette technique régionale. En revanche, étant donné que les fibres démyélinisées peuvent être plus sujettes aux effets toxiques des anesthésiques locaux, l'anesthésie péridurale et l'analgésie peuvent être considérées comme plus sûres que les techniques rachidiennes. Cependant, la réduction de la concentration d'anesthésique local et de la dose totale aux niveaux efficaces les plus bas peut être prudente pour le bloc périphérique et neuraxial. Toutes les décisions concernant l'utilisation de l'anesthésie et de l'analgésie régionales chez les patients atteints de SEP doivent être prises après un examen attentif des risques et des avantages potentiels. Quelle que soit la technique d'anesthésie choisie, les patients doivent être informés du risque d'apparition ou d'aggravation de symptômes neurologiques pendant la période postopératoire en raison de l'exposition à de multiples facteurs aggravants.
Syndrome postpoliomyélitique
Syndrome postpoliomyélitique fait référence à des symptômes neurologiques d'apparition récente qui se développent plusieurs années après une infection aiguë par la poliomyélite. L'apparition de symptômes nouveaux ou progressifs peut survenir jusqu'à 30 ans après l'épisode initial de poliomyélite. Le SPP affecte les cellules de la corne antérieure dans la partie antérieure de la moelle épinière et est donc considéré comme un trouble du motoneurone inférieur. Les premiers symptômes comprennent la faiblesse musculaire, la fatigue, l'instabilité de la démarche, les douleurs articulaires et l'atrophie musculaire au sein des groupes musculaires qui étaient auparavant touchés par la maladie. Les déficits sensoriels ne sont généralement pas caractéristiques du syndrome et ne sont observés qu'en présence d'un trouble secondaire (p. ex., radiculopathie compressive ou hernie discale). On pense que les effets moteurs du SPP sont liés à un processus continu de dénervation et de réinnervation qui se termine finalement lorsque la dénervation n'est plus compensée par la réinnervation.
Le syndrome postpolio est la maladie du motoneurone la plus répandue en Amérique du Nord. De plus, étant donné que la polio-myélite aiguë continue de se produire dans les pays en développement, le SPP restera probablement une préoccupation anesthésique pour les années à venir. Il n'est pas rare que les patients atteints de SPP aient besoin d'interventions orthopédiques ; par conséquent, il est important de déterminer la sécurité des techniques d'anesthésie régionale dans ces circonstances cliniques. Bien que les patients atteints de SPP aient moins de motoneurones que la normale, il est difficile de savoir si les motoneurones restants sont plus sensibles aux effets toxiques des anesthésiques locaux. Il n'y a eu aucun rapport d'aggravation de l'état neurologique après une anesthésie neuraxiale avec des doses normales de tétracaïne et de bupivacaïne chez des patients atteints de SPP. Cependant, ce constat n'implique pas que les techniques d'anesthésie locorégionale soient sans risque. Comme pour tous les patients, le risque potentiel de l'anesthésie régionale doit être mis en balance avec les inconvénients de l'anesthésie générale, y compris une hypersensibilité aux médicaments sédatifs ou opioïdes, le risque d'utilisation de relaxants musculaires et le risque d'hypoventilation et d'aspiration. La plus grande série de patients atteints de SPP (n = 79) subissant une anesthésie ou une analgésie neuraxiale n'a montré aucune aggravation des symptômes neurologiques pendant la période postopératoire. Cependant, la rareté des données cliniques sur ce sujet empêche de formuler des recommandations claires concernant la sécurité de l'anesthésie neuraxiale ou du bloc nerveux périphérique chez les patients atteints de SPP. En fin de compte, la décision d'utiliser l'anesthésie régionale doit être prise sur une base individuelle après une discussion approfondie des risques et des avantages potentiels avec chaque patient. Étant donné la sensibilité accrue aux médicaments opioïdes et sédatifs au sein de ce sous-groupe de patients, ces médicaments doivent toujours être utilisés avec prudence.
La sclérose latérale amyotrophique
La sclérose latérale amyotrophique est une maladie dégénérative progressive des motoneurones supérieurs et inférieurs. La cause est inconnue, mais les théories incluent l'excitotoxicité du glutamate, le stress oxydatif, le dysfonctionnement mitochondrial, les tumeurs paranéoplasiques, les maladies auto-immunes et les infections virales. Initialement, la SLA se présente comme une atrophie, une faiblesse et des fasciculations dans les muscles intrinsèques de la main. Au fur et à mesure de sa progression, une atrophie et une faiblesse se développent dans tous les muscles squelettiques, y compris ceux de la langue, du pharynx, du larynx et des muscles respiratoires de la poitrine. Les patients perdent la capacité de tousser, ce qui augmente le risque d'aspiration. Un dysfonctionnement autonome peut être évident et se manifeste par une hypotension orthostatique et une augmentation de la fréquence cardiaque au repos. Malheureusement, chez la majorité des patients, le décès par insuffisance respiratoire survient quelques années après l'apparition de la maladie.
Les preuves existantes, bien que limitées, n'ont pas soutenu la crainte qu'un bloc neuraxial ou périphérique exacerbe les symptômes préexistants chez les patients SLA. Cependant, étant donné le potentiel d'aggravation de l'insuffisance respiratoire après une anesthésie générale due à l'utilisation de relaxants musculaires et de médicaments opioïdes, la capacité d'éviter la manipulation des voies respiratoires peut être considérée comme un avantage au sein de cette population de patients à haut risque. Quelle que soit la technique d'anesthésie, la possibilité d'une détérioration respiratoire ou neurologique postopératoire est assez élevée chez les patients atteints de SLA. En fin de compte, la décision d'utiliser l'anesthésie régionale doit être prise sur une base individuelle après une discussion approfondie des risques et des avantages potentiels avec chaque patient.
Sténose spinale et discopathie lombaire
La pathologie du canal rachidien a été proposée comme un facteur de risque potentiel de complications neurologiques après un blocage neuraxial. Plusieurs mécanismes de lésion ont été proposés, notamment un effet ischémique ou compressif après l'injection de grands volumes d'anesthésique local dans un espace relativement confiné (c'est-à-dire l'anesthésie péridurale) et la neurotoxicité de l'anesthésique local (c'est-à-dire la rachianesthésie). Bien que le ou les mécanismes précis de la blessure restent flous, plusieurs rapports de cas isolés et de grandes séries de cas sont censés étayer ces hypothèses.
La sténose rachidienne se produit sous forme de changements liés à l'âge dans les disques intervertébraux et les articulations facettaires, entraînant un rétrécissement du canal rachidien ou des foramens neuraux. Les changements comprennent la dégénérescence discale, l'hypertrophie des facettes articulaires, la formation d'ostéophytes et un repliement du ligament jaune. Le mécanisme précis par lequel la compression des racines nerveuses spinales entraîne des signes ou des symptômes de sténose spinale n'est pas complètement compris. Les symptômes classiques comprennent des douleurs radiculaires au dos et aux jambes qui s'aggravent considérablement avec l'extension et sont atténuées avec la flexion. Une sténose spinale préexistante ou une discopathie lombaire compressive a été proposée comme un facteur de risque potentiel de complications neurologiques suite à une technique neuraxiale (rachidienne ou péridurale). Les mécanismes de blessure proposés comprennent les traumatismes mécaniques, la neurotoxicité des anesthésiques locaux, l'ischémie ou une étiologie multifactorielle. Sur le plan physiopathologique, les patients atteints de sténose rachidienne présentent une réduction du diamètre du canal rachidien, ce qui réduit l'espace anatomique pour les collections de fluides tels que le sang ou l'anesthésique local. En conséquence, de petites quantités de fluide peuvent entraîner des augmentations significatives de la pression autour du neuraxis qui n'auraient aucun effet clinique dans un canal rachidien largement perméable.
Deux séries de cas relativement importantes et plusieurs rapports de cas ont été publiés qui suggèrent qu'une sténose vertébrale non diagnostiquée peut être un facteur de risque de complications neurologiques après un bloc neuraxial. La majorité des cas de queue de cheval impliquaient une analgésie péridurale, ce qui peut suggérer une étiologie ischémique (compression mécanique de la moelle par l'anesthésique local perfusant) à la blessure. Hebl et ses collègues ont effectué une étude rétrospective de 937 patients présentant une sténose spinale préexistante ou une discopathie lombaire avec et sans antécédents de chirurgie vertébrale et ont conclu que cette cohorte de patients présentait un risque accru de développement ou d'aggravation de déficits neurologiques par rapport à la population générale subissant une technique neuraxiale. De plus, les patients avec plus d'un diagnostic neurologique (p. ex., sténose spinale, radiculopathie compressive, neuropathie périphérique préexistante) semblaient avoir un risque encore plus élevé de blessure. De même, Moen et ses collègues ont réalisé une vaste enquête épidémiologique en Suède qui a révélé des tendances similaires. Au cours d'une période d'étude de 10 ans, 1,260,000 450,000 127 rachianesthésies et 85 67 blocs périduraux ont été évalués. Au total, les auteurs ont identifié 14 complications graves, dont 13 (93%) patients avec des lésions permanentes. Bien que XNUMX patients aient eu une sténose spinale préexistante, XNUMX (XNUMX %) d'entre eux ont été diagnostiqués dans la période postopératoire lors de l'évaluation du déficit neurologique. Les auteurs ont conclu que l'incidence des complications graves liées à l'anesthésie n'est peut-être pas aussi faible que celle rapportée précédemment et que la pathologie préexistante du canal rachidien peut être un « facteur de risque négligé ». Enfin, bien que les patients ayant déjà subi une chirurgie de la colonne vertébrale puissent avoir un risque accru de paraplégie suite à des injections péridurales transforaminales de stéroïdes, aucun risque similaire n'a été trouvé chez les patients après une anesthésie ou une analgésie neuraxiale.
En résumé, bien qu'il semble que les patients atteints de sténose rachidienne ou de maladie discale lombaire compressive puissent être exposés à un risque accru de complications neurologiques après un bloc neuraxial, la littérature existante ne parvient pas à fournir une comparaison directe des patients chirurgicaux présentant une pathologie rachidienne similaire subissant une anesthésie générale. Par conséquent, il n'est pas clair si l'incidence plus élevée de complications neurologiques dans cette population de patients est due à des facteurs chirurgicaux, à la technique d'anesthésie, à la progression naturelle du processus pathologique ou à une combinaison de ces facteurs.
Lésion de la moelle épinière
Les lésions de la moelle épinière touchent plus de 10,000 50 Américains chaque année. Parmi ceux-ci, environ 17% des blessures surviennent au niveau cervical. La plupart des cas de lésions médullaires sont secondaires à des accidents de véhicules à moteur, un pourcentage plus faible résultant de blessures sportives, de chutes ou de traumatismes pénétrants. Le rapport des déficits neurologiques complets aux déficits incomplets aux États-Unis semble avoir diminué au cours de la dernière décennie, reflétant une plus grande proportion de déficits incomplets. Une condition potentiellement dangereuse qui peut se développer dans le(s) mois suivant la résolution d'un choc spinal aigu est la dysréflexie autonome (AD). La MA est un syndrome potentiellement mortel résultant d'une stimulation cutanée ou viscérale sous le niveau de la lésion de la moelle épinière, entraînant une instabilité vasculaire extrême. La prévalence à vie de la MA a été estimée entre 70 % et 6 %, la plupart des épisodes survenant dans des cas de lésion médullaire si le niveau de blessure est égal ou supérieur à TXNUMX.
L'anesthésie générale avec un anesthésique volatil à faible concentration n'offre pas de protection contre la MA. Bien que des concentrations plus élevées d'anesthésique volatil puissent être efficaces, l'instabilité hémodynamique liée à l'anesthésie peut ne pas être bien tolérée au sein de cette population de patients. Par conséquent, les techniques d'anesthésie régionale neuraxiale (rachidienne ou péridurale) peuvent être des compléments précieux dans la prise en charge des patients atteints de lésions médullaires chroniques subissant des procédures des membres inférieurs, abdominales, obstétriques, gynécologiques et urologiques. De nombreux rapports de cas et séries de cas ont démontré que les techniques neuraxiales sont sûres et efficaces pour prévenir les épisodes de MA chez les patients blessés médullaires, même ceux présentant des lésions médullaires hautes. À ce stade, il n'y a aucune preuve claire suggérant que l'utilisation de techniques régionales peut potentiellement aggraver les déficits neurologiques préexistants chez les patients atteints de SCI. Cependant, la difficulté à déterminer le niveau d'anesthésie approprié, le potentiel d'instabilité hémodynamique et de difficulté respiratoire, et le placement difficile du bloc sont des considérations importantes lors de l'évaluation des patients atteints de SCI pour une technique neuraxiale.
RÉSUMÉ
Les patients atteints d'une maladie neurologique préexistante représentent un défi unique pour l'anesthésiste qui envisage une technique d'anesthésie régionale. Une évaluation préopératoire approfondie est essentielle afin d'établir l'état neurologique de base du patient. Les prestataires d'anesthésie doivent être conscients des facteurs de risque de complications neurologiques postopératoires lors de leur sélection de candidats appropriés pour un bloc central ou périphérique et adapter leur technique pour minimiser ces risques autant que possible. Bien que la plupart des troubles neurologiques préexistants ne soient pas des contre-indications absolues à l'anesthésie régionale, la décision de procéder à une technique régionale doit être prise au cas par cas, car certains patients peuvent bénéficier d'une technique d'anesthésie régionale par rapport à d'autres anesthésiques. ou options antalgiques.
Références
- Upton AR, McComas AJ : Le double écrasement dans les syndromes de piégeage nerveux. Lancet 1973 ; 2 : 359–362.
- Osterman AL : Le syndrome du double écrasement. Orthop Clin North Am 1988 ; 19:147–155.
- Neal JM, Bernards CM, Hadzic A, et al : Avis de pratique de l'ASRA sur les complications neurologiques en anesthésie régionale et en médecine de la douleur. Reg Anesth Pain Med 2008;33:404–415.
- Jacob AK, Kopp, SL : Anesthésie régionale chez le patient présentant des troubles neurologiques préexistants. Advances in Anesthesia 2011;29:1–18.
- Skre H : Aspects génétiques et cliniques de la maladie de Charcot-Marie-Tooth. Clin Genet 1974;6:98–118.
- Saporta AS, Sottile SL, Miller LJ, Feely SM, Siskind CE, Shy ME : sous-types de la maladie de Charcot-Marie-Tooth et stratégies de dépistage génétique. Ann Neurol 2011;69:22–33.
- Bui AH, Marco AP : bloc nerveux périphérique chez un patient atteint de la maladie de Charcot-Marie-Tooth. Can J Anaesth 2008;55:718–719.
- Dhir S, Balasubramanian S, Ross D : Bloc régional périphérique échoguidé chez des patients atteints de la maladie de Charcot-Marie-Tooth : revue de trois cas. Can J Anaesth 2008;55:515–520.
- Fernandez Perez AB, Quesada Garcia C, Rodriguez Gonzalez O, Besada Estevez JC : [L'analgésie péridurale obstétricale, un choix sûr chez une patiente atteinte de la maladie de Charcot-Marie-Tooth]. Rev Esp Anestesiol Reanim 2011;58 : 255–256.
- Schmitt HJ, Muenster T, Schmidt J : bloc neural central dans la maladie de Charcot-Marie-Tooth. Can J Anaesth 2004;51:1049–1050.
- Sugai K, Sugai Y : [Anesthésie péridurale pour un patient atteint de la maladie de Charcot-Marie-Tooth, d'asthme bronchique et d'hypothyroïdie]. Masui 1989;38 : 688–691.
- Tanaka S, Tsuchida H, Namiki A : [Anesthésie péridurale pour un patient atteint de la maladie de Charcot-Marie-Tooth, syndrome de prolapsus de la valve mitrale et bloc AV du IIe degré]. Masui 1994;43:931–933.
- Lepski GR, Alderson JD : Analgésie épidurale pendant le travail chez une patiente atteinte de neuropathie héréditaire avec risque de paralysie par pression. Int J Obstet Anesth 2001;10:198–201.
- Al-Nasser B : Effets toxiques de l'analgésie péridurale avec la ropivacaïne 0.2 % chez un patient diabétique. J Clin Anesth 2004;16:220–223.
- Blumenthal S, Borgeat A, Maurer K, et al : neuropathie subclinique préexistante en tant que facteur de risque de lésion nerveuse après administration continue de ropivacaïne via un cathéter nerveux fémoral. Anesthésiologie 2006 ; 105:1053–1056.
- Horlocker TT, O'Driscoll SW, Dinapoli RP : Neuropathie récurrente du plexus brachial chez un patient diabétique après chirurgie de l'épaule et bloc interscalénique continu. Anesth Analg 2000;91:688–690.
- Waters JH, Watson TB, Ward MG : lésion du cône médullaire après une rachianesthésie à la tétracaïne et à la lidocaïne. J Clin Anesth 1996;8 : 656–658.
- Kalichman MW, Calcutt NA : bloc de conduction induit par un anesthésique local et lésion des fibres nerveuses chez des rats diabétiques à la streptozotocine. Anesthésiologie 1992 ; 77 : 941–947.
- Dyck PJ, Kratz KM, Karnes JL, et al : La prévalence par stade de gravité de divers types de neuropathie diabétique, de rétinopathie et de néphropathie dans une cohorte basée sur la population : l'étude sur la neuropathie diabétique de Rochester. Neurologie 1993;43:817–824.
- Ross MA : Neuropathies associées au diabète. Med Clin North Am 1993;77:111–124.
- Centers for Disease Control and Prevention : Fiche d'information nationale sur le diabète : estimations nationales et informations générales sur le diabète et le prédiabète aux États-Unis. Atlanta, GA : Centres pour le contrôle et la prévention des maladies, Département américain de la santé et des services sociaux ; 2011.
- Lirk P, Birmingham B, Hogan Q : Anesthésie régionale chez les patients atteints de neuropathie préexistante. Int Anesthesiol Clin 2011;49:144–165.
- Hebl JR, Kopp SL, Schroeder DR, Horlocker TT : Complications neurologiques après anesthésie ou analgésie neuraxiale chez des patients atteints de neuropathie sensorimotrice périphérique préexistante ou de polyneuropathie diabétique. Anesth Analg 2006;103:1294–1299.
- Krishnan AV, Kiernan MC : Altération des propriétés d'excitabilité nerveuse dans la neuropathie diabétique établie. Cerveau 2005;128:1178–1187.
- Sinnreich M, Taylor BV, Dyck PJ : Neuropathies diabétiques. Classification, caractéristiques cliniques et bases physiopathologiques. Neurologue 2005;11 : 63–79.
- Williams BA, Murinson BB, Grable BR, Orebaugh SL : considérations futures pour les adjuvants pharmacologiques dans les blocs nerveux périphériques à injection unique pour les patients atteints de diabète sucré. Reg Anesth Pain Med 2009;34:445–457.
- Kroin JS, Buvanendran A, Tuman KJ, Kerns JM : Sécurité des anesthésiques locaux administrés par voie intrathécale chez les rats diabétiques. Douleur Med 2012 ; 13:802–807.
- Kroin JS, Buvanendran A, Williams DK, et al : blocage du nerf sciatique anesthésique local et lésions des fibres nerveuses chez les rats diabétiques. Reg Anesth Pain Med 2010;35:343–350.
- Williams BA : Vers un changement de paradigme potentiel pour les soins cliniques des patients diabétiques nécessitant une analgésie périneurale : stratégies d'utilisation du modèle de rongeur diabétique. Reg Anesth Pain Med 2010;35:329–332.
- Lirk P, Flatz M, Haller I, et al. Chez les rats gras diabétiques de Zucker, la neuropathie diabétique subclinique augmente la durée du bloc de lidocaïne in vivo, mais pas la neurotoxicité in vitro. Reg Anesth Pain Med 2012;37:601–606.
- Williams BA, Murinson BB : Diabète sucré et neuropathie subclinique : un appel à de nouvelles voies dans la recherche sur les blocs nerveux périphériques. Anesthésiologie 2008 ; 109 : 361–362.
- Gebhard RE, Nielsen KC, Pietrobon R, Missair A, Williams BA : Le diabète sucré, indépendant de l'indice de masse corporelle, est associé à un taux de "réussite plus élevé" pour les blocs du plexus brachial supraclaviculaire. Reg Anesth Pain Med 2009;34:404–407.
- Alvine FG, Schurrer ME : Paralysie postopératoire du nerf cubital. Existe-t-il des facteurs prédisposants ? J Bone Joint Surg Am 1987;69:255–259.
- Chaudhry V, Glass JD, Griffin JW : Dégénérescence wallérienne dans les maladies des nerfs périphériques. Neurol Clin 1992;10:613–627.
- Selander D, Edshage S, Wolff T : Paresthésies ou pas de paresthésies ? Lésions nerveuses après blocs axillaires. Acta Anaesthesiol Scand 1979;23 : 27–33.
- Bigeleisen PE : La ponction nerveuse et l'injection intraneurale apparente pendant le bloc axillaire guidé par échographie n'entraînent pas invariablement de lésions neurologiques. Anesthésiologie 2006 ; 105 : 779–783.
- Lok C, Kirk P : Problèmes lors de la réalisation d'un bloc du nerf sciatique chez un amputé. Anesthésie 2003 ; 58 : 289–290.
- Sites BD, Gallagher J, Sparks M : Le bloc poplité échoguidé démontre une réponse motrice atypique à la stimulation nerveuse chez 2 patients atteints de diabète sucré. Reg Anesth Pain Med 2003;28:479–482.
- Liu SS, Ngeow JE, Yadeau JT : Anesthésie et analgésie régionales guidées par ultrasons : une revue systématique qualitative. Reg Anesth Pain Med 2009; 34:47–59.
- Sites BD, Taenzer AH, Herrick MD, et al : Incidence de la toxicité systémique des anesthésiques locaux et des symptômes neurologiques postopératoires associés à 12,668 2012 blocs nerveux guidés par échographie : une analyse d'un registre clinique prospectif. Reg Anesth Pain Med 37;478:482–XNUMX.
- Rigaud M, Filip P, Lirk P, Fuchs A, Gemes G, Hogan Q : Guidage de l'insertion de l'aiguille en bloc par stimulation nerveuse électrique : une étude pilote de la distribution résultante de la solution injectée chez le chien. Anesthésiologie 2008 ; 109:473–478.
- Lucchetta M, Pazzaglia C, Granata G, Briani C, Padoue L : Évaluation échographique de la neuropathie périphérique dans le syndrome POEMS. Nerf musculaire 2011;44:868–872.
- Riazi S, Bril V, Perkins BA, et al : L'échographie du nerf tibial peut-elle détecter la neuropathie périphérique diabétique ? Une étude transversale. Diabetes Care 2012;35:2575–2579.
- Eaton SE, Harris ND, Rajbhandari SM, et al : implication de la moelle épinière dans la neuropathie périphérique diabétique. Lancet 2001;358:35–36.
- Varsik P, Kucera P, Buranova D, Balaz M : La lésion de la moelle épinière est-elle rare dans le diabète sucré ? Potentiels évoqués somatosensoriels et temps de conduction centrale dans le diabète sucré. Med SciMonit 2001;7:712–715.
- Selvarajah D, Wilkinson ID, Emery CJ, et al : implication précoce de la moelle épinière dans la neuropathie périphérique diabétique. Soins du diabète 2006 ; 29:2664–2669.
- Drasner K : Neurotoxicité des anesthésiques locaux : blessure clinique et stratégies susceptibles de minimiser les risques. Reg Anesth Pain Med 2002;27:576–580.
- Koscielniak-Nielsen ZJ : Blocs nerveux périphériques échoguidés : quels sont les bénéfices ? Acta Anaesthesiol Scand 2008;52:727–737.
- Pachman DR, Barton DL, Watson JC, Loprinzi CL : Neuropathie périphérique induite par la chimiothérapie : prévention et traitement. Clin Pharmacol Ther 2011;90:377–387.
- Peters CM, Jimenez-Andrade JM, Kuskowski MA, Ghilardi JR, Mantyh PW : Une pathologie cellulaire évolutive se produit dans les ganglions de la racine dorsale, le nerf périphérique et la moelle épinière après l'administration intraveineuse de paclitaxel chez le rat. Brain Res 2007;1168:46–59.
- Quasthoff S, Hartung HP : Neuropathie périphérique induite par la chimiothérapie. J Neurol 2002;249:9–17.
- Pignata S, De Placido S, Biamonte R, et al : Neurotoxicité résiduelle chez les patientes atteintes d'un cancer de l'ovaire en rémission clinique après une chimiothérapie de première intention avec du carboplatine et du paclitaxel : étude rétrospective de l'essai italien multicentrique sur le cancer de l'ovaire (MITO-4). BMC Cancer 2006;6:5.
- Kaley TJ, Deangelis LM : Thérapie de la neuropathie périphérique induite par la chimiothérapie. Br J Haematol 2009;145:3–14.
- Hebl JR, Horlocker TT, Pritchard DJ : Plexopathie brachiale diffuse après bloc interscalénique chez un patient recevant une chimiothérapie au cisplatine : le syndrome de double écrasement pharmacologique. Anesth Analg 2001;92 : 249–251.
- Caliandro P, La Torre G, Padua R, Giannini F, Padua L : Traitement de la neuropathie ulnaire au coude. Cochrane Database Syst Rev 2012;7:CD006839.
- Hebl JR, Horlocker TT, Sorenson EJ, Schroeder DR : L'anesthésie régionale n'augmente pas le risque de neuropathie postopératoire chez les patients subissant une transposition du nerf ulnaire. Anesth Analg 2001;93 : 1606–1611, table des matières.
- Pithadia AB, Kakadia N : Syndrome de Guillain-Barré (SGB). Pharmacol Rep 2010;62:220–232.
- Bamberger PD, Thys DM : Syndrome de Guillain-Barré chez un patient atteint d'un cancer du pancréas après une anesthésie générale péridurale. Anesthes Analg 2005;100:1197–1199.
- Gautier PE, Pierre PA, Van Obbergh LJ, Van Steenberge A : Syndrome de Guillain-Barré après analgésie péridurale obstétricale. Reg Anesth 1989;14:251–252.
- Heyworth BE, Fabricant PD, Pizzurro MM, Beksac B, Salvati EA : Syndrome de Guillain-Barré imitant une lésion nerveuse après une arthroplastie totale de la hanche. HSS J 2011;7:286–289.
- Alici HA, Cesur M, Erdem AF, Gursac M : Utilisation répétée de l'anesthésie péridurale pour un accouchement par césarienne chez une patiente atteinte du syndrome de Guillain-Barré. Int J Obstet Anesth 2005;14:269–270.
- McGrady EM : Prise en charge du travail et de l'accouchement chez une patiente atteinte du syndrome de Guillain-Barré. Anesthésie 1987;42:899.
- Perel A, Reches A, Davidson JT : Anesthésie dans le syndrome de Guillain-Barré. Un rapport de cas et des recommandations. Anesthésie 1977;32 : 257–260.
- Vassiliev DV, Nystrom EU, Leicht CH : anesthésie rachidienne et péridurale combinée pour le travail et l'accouchement par césarienne chez une patiente atteinte du syndrome de Guillain-Barré. Reg Anesth Pain Med 2001;26:174–176.
- Otsuka N, Igarashi M, Shimodate Y, Nakabayashi K, Asano M, Namiki A : [Gestion anesthésique de deux patients atteints de sclérose latérale amyotrophique (SLA)]. Masui 2004;53:1279–1281.
- Steiner I, Argov Z, Cahan C, Abramsky O : Syndrome de Guillain-Barré après anesthésie péridurale : des dommages directs aux racines nerveuses peuvent déclencher une maladie. Neurologie 1985;35:1473–1475.
- Personnel NP, Engelstad J, Klein CJ, et al : Neuropathie inflammatoire post-chirurgicale. Cerveau 2010;133:2866–2880.
- Ahn KS, Kopp SL, Watson JC, Scott KP, Trousdale RT, Hebl JR : Neuropathie inflammatoire post-chirurgicale. Reg Anesth Pain Med 2011;36 : 403–405.
- Bamford C, Sibley W, Laguna J : Anesthésie dans la sclérose en plaques. Can J Neurol Sci 1978;5:41–44.
- Dripps RD, Vandam LD : Exacerbation d'une maladie neurologique préexistante après une rachianesthésie. N Engl J Med 1956;255:843–849.
- Hebl JR, Horlocker TT, Schroeder DR : Anesthésie et analgésie neuraxiales chez les patients présentant des troubles préexistants du système nerveux central. Anesth Analg 2006;103:223–228, table des matières.
- Keschner M : L'effet des blessures et des maladies sur l'évolution de la sclérose en plaques. Res Publ Assoc Res Nerv Ment Dis 1950;28:533–547.
- Confavreux C, Hutchinson M, Hours MM, Cortinovis-Tourniaire P, Moreau T : Taux de rechute liée à la grossesse dans la sclérose en plaques. Groupe Grossesse dans la sclérose en plaques. N Engl J Med 1998;339:285–291.
- Crawford JS : Analgésie épidurale pour les patients atteints de maladies neurologiques chroniques. Anesth Analg 1983;62:621–622.
- Noseworthy JH, Lucchinetti C, Rodriguez M, Weinshenker BG : Sclérose en plaques. N Engl J Med 2000;343:938–952.
- Compston A, Coles A : Sclérose en plaques. Lancet 2002 ;359 : 1221–1231.
- Korn-Lubetzki I, Kahana E, Cooper G, Abramsky O : Activité de la sclérose en plaques pendant la grossesse et la puerpéralité. Ann Neurol 1984;16:229–231.
- Pollock M, Calder C, Allpress S : Anomalie du nerf périphérique dans la sclérose en plaques. Ann Neurol 1977;2:41–48.
- Koff MD, Cohen JA, McIntyre JJ, Carr CF, Sites BD : Plexopathie brachiale sévère après un bloc nerveux à injection unique guidé par échographie pour une arthroplastie totale de l'épaule chez un patient atteint de sclérose en plaques. Anesthésiologie 2008 ;108 : 325–328.
- Pogorzelski R, Baniukiewicz E, Drozdowski W: [Lésions subcliniques du système nerveux périphérique chez les patients atteints de sclérose en plaques]. Neurol Neurochir Pol 2004;38:257–264.
- Misawa S, Kuwabara S, Mori M, Hayakawa S, Sawai S, Hattori T : Démyélinisation des nerfs périphériques dans la sclérose en plaques. Clinique Neurophysiol 2008;119:1829–1833.
- Sarova-Pinhas I, Achiron A, Gilad R, Lampl Y : Neuropathie périphérique dans la sclérose en plaques : une étude clinique et électrophysiologique. Acta Neurol Scand 1995;91:234–238.
- Critchley EP : Sclérose en plaques se présentant initialement comme une paralysie faciale. Aviat Space Environ Med 2004;75:1001–1004.
- Hammes E : Complications neurologiques associées à la rachianesthésie (huit cas). Minn Med 1943;36:339–345.
- Keschner M : L'effet des blessures et des maladies sur l'évolution de la sclérose en plaques. Res Publ Assoc Res Nerv Ment Dis 1950;28:533–547.
- Stenuit J, Marchand P : [Séquelles de la rachianesthésie]. Acta Neurol Psychiatr Belg 1968;68:626–635.
- Kuczkowski KM : Analgésie du travail pour la parturiente atteinte d'une maladie neurologique : que doit savoir un obstétricien ? Arch Gynecol Obstet 2006;274:41–46.
- Warren TM, Datta S, Ostheimer GW : Anesthésie péridurale lombaire chez un patient atteint de sclérose en plaques. Anesth Analg 1982;61:1022–1023.
- Sakurai M, Mannen T, Kanazawa I, Tanabe H : La lidocaïne démasque les lésions démyélinisantes silencieuses dans la sclérose en plaques. Neurologie 1992;42 : 2088–2093.
- Drake E, Drake M, Bird J, Russell R : Blocs régionaux obstétricaux pour les femmes atteintes de sclérose en plaques : une enquête sur l'expérience britannique. Int J Obstet Anesth 2006;15:115–123.
- Gonzalez H, Olsson T, Borg K : Prise en charge du syndrome postpolio. Lancet Neurol 2010;9:634–642.
- Bordes J, Gaillard PE, Lacroix G, Palmier B : Rachianesthésie guidée par tomodensitométrie chez un patient présentant des séquelles post-polio sévères. Br J Anaesth 2010;105:702–703.
- Higashizawa T, Sugiura J, Takasugi Y : [Rachianesthésie chez un patient atteint d'hémiparésie après poliomyélite]. Masui 2003;52:1335–1337.
- Lambert DA, Giannouli E, Schmidt BJ : Syndrome postpolio et anesthésie. Anesthésiologie 2005 ; 103 : 638–644.
- Pratt AJ, Getzoff ED, Perry JJ : Sclérose latérale amyotrophique : mise à jour et nouveaux développements. Degener Neurol Neuromuscul Dis 2012; 2012 : 1–14.
- Chen LK, Chang Y, Liu CC, Hou WY : Anesthésie péridurale associée à une sédation au propofol pour une hystérectomie abdominale chez une patiente atteinte de sclérose latérale amyotrophique : à propos d'un cas. Acta Anesthesiol Sin 1998;36:103–106.
- Hara K, Sakura S, Saito Y, Maeda M, Kosaka Y : Anesthésie péridurale et fonction pulmonaire chez un patient atteint de sclérose latérale amyotrophique. Anesth Analg 1996;83:878–879.
- Hobaika AB, Neves BS : bloc rachidien-péridural combiné chez un patient atteint de sclérose latérale amyotrophique : rapport de cas. Rev Bras Anestesiol 2009;59:206–209.
- Kitoh T, Kobayashi K, Ina H, et al : effets du bloc ganglionnaire sympathique lombaire pour un patient atteint de sclérose latérale amyotrophique (SLA). J Anesth 2006;20:109–112.
- Kochi T, Oka T, Mizuguchi T : Anesthésie péridurale pour les patients atteints de sclérose latérale amyotrophique. Anesth Analg 1989;68:410–412.
- Katz JN, Harris MB : Pratique clinique. Sténose lombaire. N Engl J Med 2008;358:818–825.
- Stambough JL, Stambough JB, Evans S : Syndrome aigu de la queue de cheval après arthroplastie totale du genou à la suite d'une anesthésie péridurale et d'une sténose vertébrale. J Arthroplasty 2000;15:375–379.
- Tetzlaff JE, Dilger JA, Wu C, Smith MP, Bell G : Influence de la pathologie de la colonne lombaire sur l'incidence de la paresthésie pendant la rachianesthésie. Reg Anesth Pain Med 1998;23:560–563.
- Moen V, Dahlgren N, Irestedt L : Complications neurologiques sévères après des blocs neuraxiaux centraux en Suède 1990–1999. Anesthésiologie 2004 ; 101 : 950–959.
- Yuen EC, Layzer RB, Weitz SR, Olney RK : Complications neurologiques de l'anesthésie et de l'analgésie épidurales lombaires. Neurologie 1995;45 : 1795–1801.
- de Seze MP, Sztark F, Janvier G, Joseph PA : Complications sévères et durables de la racine nerveuse et de la moelle épinière après bloc neuraxial central. Anesth Analg 2007;104:975–979.
- Hooten WM, Hogan MS, Sanemann TC, Maus TJ : douleur rachidienne aiguë lors d'une tentative de patch sanguin épidural lombaire dans la sténose rachidienne lombaire congénitale et la lipomatose épidurale. Médecin de la douleur 2008;11 : 87–90.
- Usubiaga JE, Wikinski JA, Usubiaga LE : La pression épidurale et sa relation avec la propagation des solutions anesthésiques dans l'espace épidural. Anesth Analg 1967;46:440–446.
- Hebl JR, Horlocker TT, Kopp SL, Schroeder DR : Bloc neuraxial chez les patients présentant une sténose spinale préexistante, une discopathie lombaire ou une chirurgie antérieure de la colonne vertébrale : efficacité et complications neurologiques. Anesth Analg 2010; 111:1511–1519.
- Horlocker TT : Bloc neuraxial chez les patients atteints de sténose rachidienne : entre le marteau et l'enclume. Anesth Analg 2010;110:13–15.
- Kubina P, Gupta A, Oscarsson A, Axelsson K, Bengtsson M : Deux cas de syndrome de la queue de cheval suite à une anesthésie spino-épidurale. Reg Anesth 1997;22:447–450.
- Houten JK, Errico TJ : Paraplégie après bloc radiculaire lombo-sacré : à propos de trois cas. Spine J 2002;2:70–75.
- Huntoon MA, Martin DP : Paralysie après injection péridurale transforaminale et chirurgie vertébrale antérieure. Reg Anesth Pain Med 2004;29 : 494–495.
- Devivo MJ : Épidémiologie des lésions traumatiques de la moelle épinière : tendances et implications futures. Moelle épinière 2012 ; 50 : 365–372.
- Hagen EM, Faerestrand S, Hoff JM, Rekand T, Gronning M : Dysfonctionnement cardiovasculaire et urologique dans les lésions de la moelle épinière. Acta Neurol Scand Suppl 2011 : 71–78.
- Crosby E, St-Jean B, Reid D, Elliott RD : Anesthésie et analgésie obstétricales chez les femmes atteintes de lésions médullaires chroniques. Can J Anaesth 1992;39 : 487–494.
- Hambly PR, Martin B : Anesthésie pour les lésions chroniques de la moelle épinière. Anaesth 1998;53 :273–289.
- Agostoni M, Giorgi E, Beccaria P, Zangrillo A, Valentini G : anesthésie rachi-péridurale combinée pour césarienne chez une femme paraplégique : difficulté à obtenir le niveau de bloc attendu. Eur J Anaesthesiol 2000;17:329–331.

