Ariana Nelson, Honorio T. Benzon et Rasha S. Jabri
INTRODUCTION
L'hématome épidural spinal (SEH) est une accumulation de sang dans le tissu aréolaire lâche entre les vertèbres et la dure-mère du canal rachidien. En règle générale, l'hématome est asymptomatique, mais dans de rares cas, il comprime la moelle épinière, avec des conséquences neurologiques potentiellement dévastatrices. Ces symptômes comprennent une perturbation sensorielle, une incontinence intestinale et urinaire, une faiblesse motrice ou, dans les cas graves, une paralysie complète des membres affectés. Cette entité clinique a été décrite pour la première fois dans la littérature médicale en 1682 sous le nom d'hématome spinal avec apoplexie spinale dans l'Histoire de l'Académie Royale des Sciences (Volume 2 ; GJ Duverney). Près de 200 ans plus tard, en 1869, un rapport du premier diagnostic clinique de SEH a été publié dans le Lancet.
Les SEH peuvent être de nature spontanée ou peuvent survenir dans le cadre d'une procédure invasive, telle qu'une ponction lombaire, anesthésie neuraxiale, ou chirurgie de la colonne vertébrale. L'hématome est plus susceptible d'être symptomatique dans les régions cervicale et thoracique, étant donné le canal rachidien rétréci dans cette zone par rapport au plus grand espace disponible pour la compensation de volume dans la région lombaire et en particulier la région de la queue de cheval.
HÉMATOME ÉPIDURAL RACHIDIEN
Incidence
L'ESH symptomatique représente moins de 1 % de toutes les lésions occupant de l'espace dans la colonne vertébrale4 et n'affecte que 1 personne sur 1 million chaque année. Les SEH proviennent d'une myriade d'étiologies, mais le plus souvent d'une procédure effectuée dans ou à proximité de l'espace épidural. Par exemple, la présence de SEH peut être trouvée sur l'imagerie postopératoire chez 33 % à 100 % des patients après une chirurgie rachidienne, mais les patients présenteront rarement un déficit neurologique. Une revue systématique de 2010 a trouvé une incidence globale calculée de SEH symptomatique après une chirurgie de la colonne vertébrale de 0.2 %, avec des calculs d'étude individuels compris entre 0 % et 1.0 %. Par conséquent, l'incidence de SEH est systématiquement citée comme l'incidence de SEH symptomatique; désormais dans ce chapitre, le qualificatif symptomatique est implicite.
L'incidence de SEH après anesthésie neuraxiale a été historiquement estimée à moins de 1 sur 150,000 1 placements épiduraux et à moins de 220,000 sur 1 18,000 anesthésies rachidiennes. Cependant, selon des études épidémiologiques récentes, l'incidence pourrait être en augmentation. Cette estimation a été confirmée par une étude suédoise à grande échelle qui a trouvé une incidence de SEH après bloc péridural de 1:200,000 1, un chiffre qui résulte de la moyenne d'une incidence obstétricale de 3600:1 4741 et d'une incidence remarquablement élevée de 1:1000 calculée dans une population de patientes âgées subissant une arthroplastie du genou. Une autre étude a montré une incidence globale de SEH de XNUMX:XNUMX qui augmentait à XNUMX:XNUMX si la population évaluée était réduite pour inclure uniquement les femmes âgées subissant une chirurgie des membres inférieurs.
Cette grande disparité peut être attribuée à la présence ou à l'absence de facteurs de risque dans ces populations de patients incongrues. La grossesse induit un état relativement hypercoagulable et les patientes obstétricales sont également plus jeunes avec un espace péridural plus large et plus conforme que les patientes âgées. La plus faible incidence de SEH chez les patientes obstétricales a été confirmée dans une étude récente dans laquelle il n'y avait aucun cas reconnu de SEH chez 709,837 1 patientes évaluées pendant la période péripartum. Cette étude a noté une incidence de 9000:95 (intervalle de confiance [IC] à 1 % : 20,189:1–4330:XNUMX) chez les patients ayant reçu des placements périduraux périopératoires.
Facteurs de risque
L'augmentation de l'âge entraîne un risque accru de SEH. La réduction de la taille de l'espace péridural avec l'âge a été signalée pour la première fois en 1967 dans une étude sur la propagation des anesthésiques locaux.
Cela peut être extrapolé pour tenir compte de l'incidence plus élevée de SEH chez les personnes âgées, car un volume de sang équivalent entraînera une augmentation de la pression dans l'espace péridural plus petit d'un patient âgé par rapport à un homologue plus jeune. Aucune prédilection raciale n'a été signalée, mais SEH est plus fréquent chez les femmes. Cela pourrait potentiellement s'expliquer par la prévalence plus élevée de l'ostéoporose chez les patientes, qui provoque des déformations ou des fractures vertébrales et une hypertrophie des corps vertébraux, entraînant un rétrécissement du canal rachidien. Le rétrécissement ostéoporotique de l'espace péridural pourrait donc expliquer à la fois les prédilections de sexe et d'âge de SEH et peut contribuer à la probabilité accrue de plus de 50 fois de SEH après une anesthésie péridurale pour arthroplastie du genou par rapport à l'analgésie péridurale pendant le travail. Cependant, la thromboprophylaxie est une nécessité dans la population chirurgicale orthopédique, ce qui peut également contribuer à leur incidence relativement plus élevée de SEH par rapport aux patientes obstétriques, qui ne nécessitent pas de prophylaxie de routine contre la thrombose veineuse profonde.
En effet, le facteur de risque le plus important de SEH est la présence d'un trouble physiologique ou iatrogène du système de coagulation, tel qu'une maladie hépatique, l'alcoolisme, une thrombocytopénie ou une anticoagulation pharmacologique. Une étude rétrospective récente a également identifié une augmentation significative du SEH après une chirurgie de la colonne vertébrale chez les patients de groupe sanguin Rh+, une perte de sang peropératoire supérieure à 1 L, un taux d'hémoglobine inférieur à 10 g/dL et un rapport international normalisé supérieur à 2.0 dans les 48 premiers heures. Le traitement anticoagulant en association avec l'analgésie neuraxiale ainsi que la durée et l'intensité de l'anticoagulation ont été identifiés comme les facteurs de risque les plus importants d'hématome épidural. Environ un quart à un tiers de tous les cas de SEH sont associés à un traitement anticoagulant. Dans un examen approfondi de tous les cas de SEH associés à une anesthésie neuraxiale, 87 % des patients présentaient soit une anomalie hématologique, soit une procédure compliquée par une difficulté technique. Les cas d'hématomes spontanés sont rares, mais lorsqu'ils surviennent, ils sont souvent associés à une anticoagulation, une thrombolyse, des dyscrasies sanguines, des coagulopathies, une thrombocytopénie, des néoplasmes, des malformations vasculaires ou un hémangiome vertébral.
La diminution du poids du patient, qui peut exagérer la réponse anticoagulante, représente une préoccupation théorique pour la tendance aux saignements et a été suggérée comme explication du risque accru chez les femmes et les personnes âgées. Cependant, en Suède, il n'a pas été démontré qu'une dose réduite spécifique au sexe d'héparine de bas poids moléculaire pour la prophylaxie contre la thrombose veineuse profonde améliore l'incidence accrue bien décrite de SEH chez les femmes. La thérapie thrombolytique impose le plus grand risque de complications hémorragiques et les procédures neuraxiales doivent être soigneusement évitées chez les patients qui ont récemment subi une thrombolyse. En savoir plus sur Anesthésie neuraxiale et blocs nerveux périphériques chez les patients sous anticoagulants.
Perle clinique
- Des études récentes sur l'incidence du risque d'hématome rachidien chez les patients sans facteurs de risque manifestes ont montré une augmentation à 1:18,000 1 après péridurale et 3600:1, voire 1000:XNUMX, chez les patients âgés subissant une chirurgie des membres inférieurs.
Étiologie et localisation de l'hématome
Les facteurs proposés qui causent l'ESH comprennent les traumatismes, l'anticoagulation, la thrombolyse, la ponction lombaire, l'anesthésie péridurale ou rachidienne, les procédures ou chirurgies interventionnelles de la colonne vertébrale, la coagulopathie ou la diathèse hémorragique, la maladie hépatique avec hypertension portale, la malformation vasculaire, la hernie discale, la maladie de Paget des os vertébraux. , manœuvre de Valsalva et hypertension. Les causes les plus importantes de SEH spontané sont les troubles de la coagulation, qui peuvent être acquis (p. ex., traitement anticoagulant, tumeurs malignes) ou congénitaux (p. ex., hémophilie). Les malformations vasculaires sont rarement responsables d'hématomes épiduraux spontanés ; seulement 4 % dans une série de 158 cas et 6.5 % dans une série de 199 cas étaient dus à une malformation vasculaire. Les facteurs prédisposants moins courants comprennent le lupus érythémateux disséminé, la spondylarthrite ankylosante, la polyarthrite rhumatoïde, la maladie de Paget, la hernie discale et l'hypertension.
Le plexus veineux dorsal est la source d'hémorragie la plus souvent impliquée car ce plexus est dépourvu de valves et permet l'inversion du flux sanguin lors d'une augmentation de la pression intravasculaire due à l'activité physique. Ces veines manquent de protection car elles ne sont entourées que de tissu aréolaire lâche et sont donc vulnérables aux augmentations soudaines de la pression intra-abdominale ou intrathoracique, entraînant une rupture et une hémorragie. Le plexus veineux épidural est le plus important dans la colonne thoracique, et le SEH spontané survient le plus souvent dans la région thoracique et cervicothoracique, suivie de la région thoraco-lombaire. SEH est généralement postérieur ou postérolatéral au sac thécal (Figure 1) parce que la ferme adhérence du sac dural au ligament longitudinal postérieur dans la face ventrale du canal rachidien empêche l'accumulation d'hématome. L'aspect dorsal de la région thoracique ou lombaire est couramment impliqué et l'expansion est généralement limitée à quelques niveaux vertébraux.
Chez les femmes enceintes, il a été proposé que l'augmentation de la pression veineuse due à l'hypertrophie utérine, en association avec les changements hémodynamiques de la grossesse, puisse prédisposer à la rupture d'une paroi pathologique préexistante du plexus veineux épidural. Bien qu'une source veineuse soit la plus largement acceptée, le débat se poursuit concernant une source artérielle potentielle de SEH, les partisans de cette théorie affirmant que la pression artérielle veineuse est inférieure à la pression intrathécale ; par conséquent, bien que l'écoulement vers l'avant soit possible dans l'espace épidural à basse pression, le sang veineux ne peut pas provoquer de compression de la moelle épinière.
Conseils NYSORA
- L'hémorragie dans le canal rachidien se produit le plus souvent dans l'espace épidural en raison du plexus veineux épidural proéminent.
- L'ESH peut être spontanée ou peut faire suite à un traumatisme mineur, comme une ponction lombaire ou une anesthésie neuraxiale.
- SEH survient principalement chez les patients anticoagulés ou thrombocytopéniques.
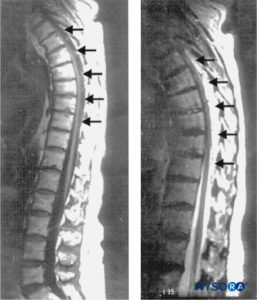
FIGURE 1. Images de résonance magnétique sagittale du rachis thoraco-lombaire. Un volumineux hématome épidural complexe s'étendant de T3 à T10 en passant par T11 est observé avec des caractéristiques de signal hypo- et isodense sur une image pondérée en T1 (gauche ; flèches) et des caractéristiques de signal hyperintense sur une image pondérée en T2 (droite ; flèches). Au centre de l'hématome, la moelle épinière bute contre la face postérieure de la vertèbre thoracique
corps (à gauche). Aucune anomalie de signal du cordon lui-même n'est observée. (Reproduit avec la permission de Schwarz SK, Wong CL,
McDonald WN : Récupération spontanée d'un hématome épidural rachidien avec présentation atypique chez un nonagénaire. Can J Anesth. 2004 juin-juillet;51(6):557–561.)
Antécédents et examen physique
Classiquement, le symptôme initial de SEH est une lombalgie axiale aiguë qui irradie vers les dermatomes correspondants et évolue vers un déficit neurologique focal avec des signes de compression des racines nerveuses ou de la moelle épinière. La douleur est généralement décrite comme une douleur dorsale constante, sévère et localisée avec ou sans composante radiculaire pouvant imiter une hernie discale, en particulier dans la colonne lombaire.
Les maux de dos sont amplifiés par les percussions sur la colonne vertébrale, ainsi que par les manœuvres qui augmentent la pression intraspinale, comme la toux, les éternuements ou les efforts. Cependant, une analyse de 2010 a démontré que la faiblesse des membres inférieurs est le signe de présentation le plus courant, bien que les maux de dos soient toujours un symptôme précoce courant. Les symptômes associés peuvent inclure un engourdissement, une faiblesse et une incontinence urinaire ou fécale. L'apparition de la douleur est parfois liée à un effort mineur, comme lors du soulèvement, de la toux, des éternuements ou des manœuvres de Valsalva, bien que dans la majorité des cas, l'apparition de la douleur soit spontanée.
Selon le niveau et la taille de l'hématome, les signes physiques peuvent inclure une faiblesse unilatérale ou bilatérale, des déficits sensoriels avec des paresthésies radiculaires unilatérales ou bilatérales, diverses altérations des réflexes tendineux profonds et des altérations du tonus de la vessie ou du sphincter anal. Des signes de dysfonctionnement de la moelle épinière et des racines nerveuses apparaissent rapidement et peuvent évoluer vers une paraparésie ou, dans les localisations thoraciques ou cervicales hautes, vers une quadriparésie. En cas de SEH lié à une anesthésie neuraxiale ou à une ponction lombaire, la présence de symptômes neurologiques postopératoires nouveaux ou progressifs doit alerter le médecin sur un éventuel hématome épidural.
Conseils NYSORA
- Le patient peut présenter une douleur dorsale sévère, localisée et constante avec ou sans composante radiculaire pouvant imiter une hernie discale.
- Les symptômes associés peuvent inclure une faiblesse, un engourdissement et une incontinence urinaire ou fécale.
- Le retour du déficit sensitif ou moteur plusieurs heures après la disparition du bloc rachidien ou péridural (avec ou sans dorsalgie) est hautement pathognomonique et doit être considéré et traité comme un hématome rachidien ou péridural jusqu'à preuve du contraire.
- Une récupération neurologique après une prise en charge conservatrice a été rapportée chez des patients souffrant de douleurs dorsales et de faiblesse des jambes sans paralysie.
- La récupération neurologique peut se produire si la chirurgie et la décompression sont effectuées dans les 36 heures suivant un déficit moteur complet et dans les 48 heures suivant un déficit partiel.
Diagnostic
Comme indiqué précédemment, les signes cliniques de l'ESH incluent généralement des douleurs dorsales et des déficits moteurs/sensoriels pouvant évoluer rapidement vers une paraplégie, une quadriplégie ou un dysfonctionnement autonome.
Un hématome épidural se présente généralement dans les 24 à 48 premières heures après une intervention. Tout symptôme neurologique nouveau ou progressif justifie une évaluation clinique immédiate et un bilan diagnostique pour exclure toute lésion occupant de l'espace, y compris l'hématome épidural. Un déficit neurologique survenant en présence d'une analgésie péridurale impose l'arrêt immédiat de la perfusion, avec le cathéter laissé en place, pour exclure toute contribution de l'anesthésique local.
Si la perfusion péridurale est à l'origine de la manifestation neurologique, on notera un retour des fonctions sensorielles et motrices. Sinon, un bilan immédiat et des études d'imagerie radiographique doivent être obtenus et une consultation avec un chirurgien du rachis doit être recherchée pour exclure une lésion épidurale évolutive.
Chez un patient présentant une lombalgie axiale aiguë avec progression des déficits neurologiques, une évaluation immédiate de la présence d'entités pathologiques associées à une compression des racines nerveuses et de la moelle épinière est nécessaire pour différencier les lésions diverses simulant l'HE. La présentation clinique d'un patient suspecté d'hématome épidural peut ressembler à la présentation d'un abcès épidural, d'une maladie de la moelle épinière, d'un néoplasme ou d'une hernie discale aiguë. Le diagnostic différentiel des symptômes neurologiques postopératoires nouveaux ou progressifs comprend la neuropraxie chirurgicale, le bloc neuraxial prolongé ou exagéré, le syndrome de l'artère spinale antérieure, l'exacerbation d'un trouble neurologique préexistant et la présentation d'une affection neurologique précédemment non diagnostiquée.
Une numération globulaire complète avec plaquettes doit être ordonnée pour évaluer l'étendue du saignement et déterminer la présence d'une infection. Le temps de prothrombine et le temps de thromboplastine partielle activée déterminent la présence d'une diathèse hémorragique.
Une évaluation radiologique rapide est essentielle pour minimiser le délai de traitement de l'ESH. Actuellement, l'imagerie par résonance magnétique (IRM) est la méthode d'imagerie diagnostique de choix pour les urgences rachidiennes car elle permet une évaluation rapide et non invasive de la colonne vertébrale et de la moelle épinière dans tous les plans. L'IRM rachidienne peut délimiter la localisation d'un hématome épidural et identifier une malformation vasculaire associée ; il fournira également des informations concernant l'étendue de l'hématome ainsi que le degré de compression du cordon. L'IRM peut également aider à évaluer l'âge de l'hématome (Figure 1).
Les caractéristiques chronologiques d'une IRM de SEH sont similaires à celles observées avec une hémorragie intracrânienne. Au stade hyperaigu (6 premières heures), le SEH apparaît isointense par rapport à la moelle épinière sur les images pondérées en T1 et légèrement hyperintense et hétérogène sur les images pondérées en T2, en raison de la présence d'oxyhémoglobine intracellulaire. Au stade aigu (7 à 72 heures), l'hématome est encore isointense en pondération T1 et devient hypointense en pondération T2. Cela est dû à la présence de désoxyhémoglobine intracellulaire, qui provoque un raccourcissement de T2. Lorsque la concentration de méthémoglobine augmente, l'hématome devient hyperintense et homogène sur les images pondérées en T1 et T2. L'artériographie par résonance magnétique (ARM) rehaussée au gadolinium peut mieux définir l'étendue d'une malformation artério-veineuse.
La tomodensitométrie (TDM) conventionnelle a le potentiel de diagnostiquer un hématome épidural, mais peut donner des résultats faussement négatifs si l'hématome est isodense au sac thécal ou à la moelle épinière et si la qualité de l'image est affectée par des artefacts souvent observés dans la région thoracique supérieure. La tomodensitométrie vertébrale peut être non diagnostique dans la colonne thoracique, où la résolution est plus faible que dans la colonne lombaire et cervicale en raison du contraste élevé entre le parenchyme pulmonaire et l'os vertébral. Une angiographie conventionnelle peut être nécessaire pour démontrer définitivement la présence d'une alformation vasculaire.
La myélographie, puis la myélographie CT, étaient auparavant les principales modalités de diagnostic de l'hématome épidural. Combinée à la tomodensitométrie vertébrale, la myélographie affichera SEH comme une lésion intraspinale biconvexe et hyperdense avec une densité équivalente au sang. Bien que cela puisse démontrer une lésion épidurale avec bloc rachidien partiel ou complet, les résultats ne sont pas spécifiques. De plus, la myélographie est invasive et peut aggraver l'état clinique du patient. De plus, bien qu'elle puisse mettre en évidence des signes de compression avec visualisation d'un bloc de contraste non spécifique ou d'une compression convexe extradurale, la myélographie ne permet pas de déterminer la nature et l'étendue réelle de la lésion. Ces techniques sont maintenant rarement utilisées aux États-Unis car l'IRM est devenue la mesure diagnostique de référence.
Prévention, traitement et pronostic
La ponction lombaire ou l'anesthésie péridurale doivent être évitées chez les personnes qui suivent un traitement anticoagulant, ont reçu un traitement thrombolytique ou sont suspectées d'avoir une diathèse hémorragique. Les anesthésistes sont priés d'être à jour sur leurs connaissances des protocoles d'anticoagulation, des nouveaux médicaments anticoagulants et des recommandations actuelles des lignes directrices. La décision d'effectuer un bloc neuraxial et le moment du retrait du cathéter chez un patient recevant un traitement antithrombotique doivent être pris sur une base individuelle, en évaluant les risques d'hématome rachidien avec les avantages de l'anesthésie régionale pour un patient spécifique. L'American Society of Regional Anesthesia et la European and Scandinavian Society of Anesthesiologists ont publié des déclarations de consensus sur l'anesthésie neuraxiale et l'anticoagulation, qui fournissent une source à jour de lignes directrices dans le processus de prise de décision lors de la réalisation d'une anesthésie neuraxiale chez un patient à risque. (voir Anesthésie neuraxiale et blocs nerveux périphériques chez les patients sous anticoagulants).
En revanche, il n'existe aucune recommandation concernant l'anticoagulation chez les patients chirurgicaux. Des études rétrospectives récentes concernant l'incidence des hématomes postopératoires après une chirurgie de la colonne vertébrale ont conclu que les patients devraient peut-être recevoir une prophylaxie de la thrombose veineuse profonde car cela ne semble pas avoir d'impact sur la probabilité de formation de SEH. Cependant, d'autres études prospectives sont nécessaires avant l'institution généralisée de la thromboprophylaxie après une chirurgie de la colonne vertébrale étant donné les conséquences dévastatrices de la SEH. Des rapports de cas ont décrit une gestion conservatrice réussie de l'hématome épidural. Un traitement non opératoire avec de bons résultats a été principalement rapporté dans les hématomes localisés au niveau de la queue de cheval et ceux avec un léger déficit neurologique. Il semble qu'une guérison complète puisse se produire avec une prise en charge conservatrice lorsque le patient signale des maux de dos et une faiblesse ou un engourdissement des jambes, mais ne présente pas de paralysie des jambes. L'inversion des anomalies de la coagulation, l'observation attentive des déficits neurologiques et, dans de rares cas, l'administration de stéroïdes peuvent donner de bons résultats sans chirurgie. Une approche pratique de la prise en charge d'un hématome épidural suspecté est présentée dans Figure 2.
La décompression chirurgicale urgente est le traitement de choix pour SEH entraînant une altération aiguë de la fonction du cordon. La laminectomie est suivie de l'évacuation de l'hématome, de la coagulation des sites de saignement et de l'inspection de la dure-mère. La dure-mère est ensuite fixée à l'os et, occasionnellement, des drains épiduraux sont utilisés pendant 24 heures. Bien qu'historiquement l'efficacité des drains ait été controversée, des données récentes suggèrent que les drains sous-fasciaux diminuent considérablement la formation de SEH. La récupération après une paralysie prolongée sans chirurgie est rare, et une consultation chirurgicale pour envisager une laminectomie décompressive urgente doit être obtenue dès que possible. Le taux de mortalité global est de 8 %. En définitive, l'équipe chirurgicale doit décider d'observer ou d'opérer au cas par cas. Les facteurs critiques de récupération après SEH sont le niveau de déficit neurologique préopératoire et l'intervalle opératoire. Le pronostic de récupération neurologique dépend principalement de l'état neurologique préopératoire du patient et de la durée du dysfonctionnement neurologique. Le pronostic est moins bon lorsqu'il y a un délai entre la blessure et l'intervention chirurgicale.
Auparavant, une récupération neurologique complète était considérée comme peu probable si plus de 8 heures s'étaient écoulées entre le développement de la paralysie et l'intervention chirurgicale. Cependant, d'autres auteurs ont noté une récupération lorsque la chirurgie est pratiquée dans les 12 heures suivant la paralysie.
Ce délai recommandé pour l'intervention a été davantage délimité par la découverte récente selon laquelle la récupération peut être obtenue lorsque la chirurgie est effectuée dans les 48 heures suivant un déficit moteur incomplet et dans les 36 heures suivant un déficit moteur complet (Tableau 1). Il est intéressant de noter qu'une récupération fonctionnelle après 72 heures de symptômes a été rapportée. S'il est rassurant que la récupération fonctionnelle puisse survenir après de tels intervalles, l'évaluation des symptômes du patient et l'IRM d'urgence prennent du temps. Par conséquent, une consultation avec un chirurgien de la colonne vertébrale concernant une éventuelle évacuation urgente de l'hématome doit être obtenue dès que possible.
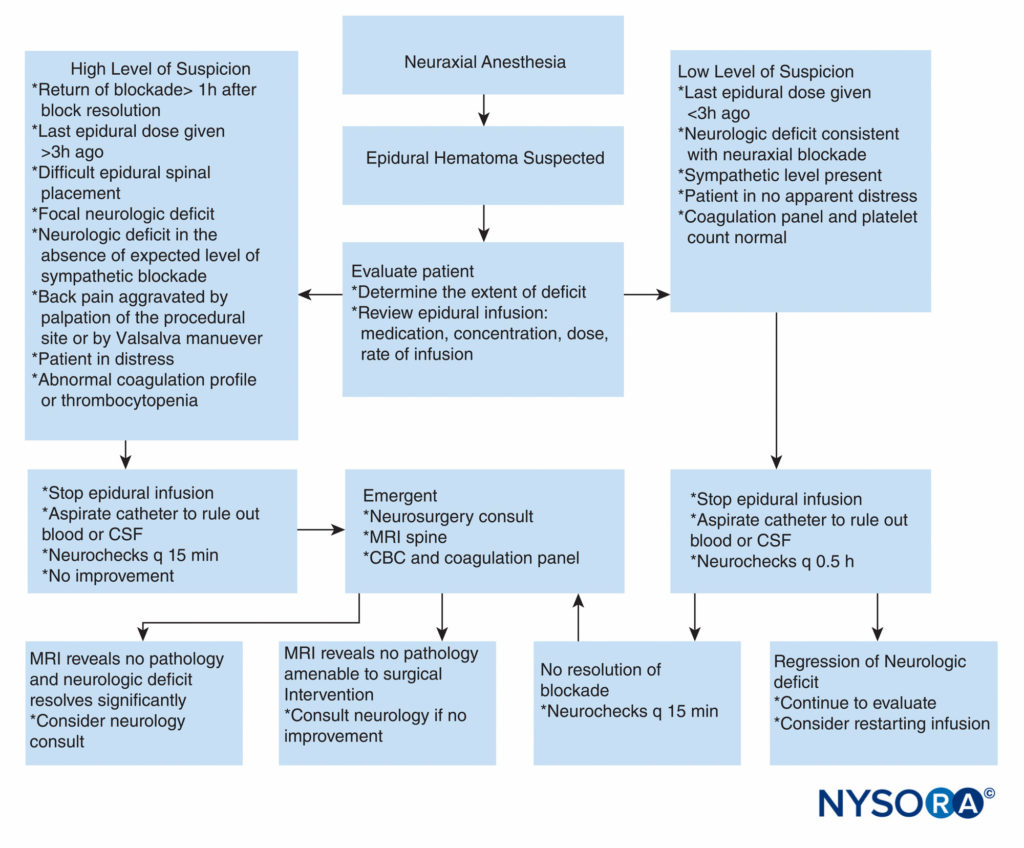
FIGURE 2. Approche pratique de la prise de décision dans le bilan et le traitement d'un patient suspecté d'hématome épidural. CBC = numération globulaire complète ; LCR = liquide céphalo-rachidien ; IRM = imagerie par résonance magnétique ; q = chaque.
TABLE 1. Récupération neurologique en relation avec le moment de la chirurgie.
| Auteur | Intervalle entre la paralysie et la récupération |
|---|---|
| Wulf68 | 8 heures 36 heures d'un complet déficit moteur |
| Lawton et coll.48 | 12 heures 48 heures d'un incomplet déficit moteur |
| Groen et Van Alphen69 |
Hématome épidural spinal : résumé
L'hématome épidural spinal est une source rare de détérioration neurologique et peut entraîner des troubles autonomes, sensoriels et moteurs à des degrés divers selon la localisation et la taille de l'hémorragie. L'ESH peut être aiguë ou chronique, spontanée, post-traumatique ou iatrogène. Les facteurs de risque connus comprennent une procédure neuraxiale techniquement difficile, la présence d'une coagulopathie intrinsèque ou acquise, le sexe féminin et l'âge avancé. Les facteurs de risque potentiels mis en évidence par des données incohérentes dans la littérature comprennent un faible taux d'hémoglobine, la présence d'anticorps Rh + et des anomalies anatomiques de la moelle épinière. Étant donné que SEH est une cause rare mais potentiellement réversible de compression de la moelle épinière, il est essentiel que le diagnostic soit posé sans délai pour permettre une guérison complète. Un hématome rachidien peut survenir même en l'absence de facteurs de risque identifiables ; par conséquent, les fournisseurs de soins de santé doivent maintenir un indice élevé de suspicion et de vigilance dans la surveillance de nouveaux symptômes neurologiques.
Bien que l'IRM ne puisse pas être réalisée avec la rapidité d'un scanner, c'est la modalité diagnostique de choix car elle est à la fois sensible et spécifique. La détection rapide de la détérioration neurologique est essentielle à l'imagerie diagnostique précoce et à une intervention rapide. Il est rassurant de noter que la guérison peut se faire sans chirurgie en l'absence de paralysie. En cas de paralysie, la décompression chirurgicale de la moelle épinière et des racines nerveuses peut entraîner une récupération fonctionnelle complète lorsqu'elle est effectuée dans un intervalle raisonnablement rapide. Si l'intervention est retardée, les séquelles permanentes de SEH peuvent inclure des déficits sensoriels, une paraplégie, une spasticité, des douleurs neuropathiques et un dysfonctionnement du sphincter urinaire ou anal.
HÉMATOME PÉRIPHÉRIQUE APRÈS BLOCS NERVEUX
L'hématome dans l'espace péridural est certainement la séquelle hémorragique la plus dévastatrice de l'anesthésie régionale neuraxiale ou périphérique, mais l'hématome peut également survenir en périphérie après des blocs nerveux ponctuels ou continus. Les facteurs de risque les plus courants semblent être la difficulté procédurale et l'anticoagulation concomitante ou le traitement antiplaquettaire. Cette complication est extrêmement rare, avec moins de 30 cas d'hématome après bloc nerveux périphérique (PNB) rapportés dans la littérature à ce jour, et les conséquences sont également moins graves par rapport à SEH étant donné que l'hémorragie se produit dans un espace périphérique compressible.
Contrairement à SEH, le symptôme d'hématome après PNB est rarement un dysfonctionnement neurologique, mais plus généralement des ecchymoses visibles (Figure 3), sensibilité locale, diminution de l'hémoglobine/hématocrite ou hypotension relative due à une perte de sang. Cela ne veut pas dire que la nature compliante de l'espace périphérique exclut une morbidité et une mortalité importantes, car il y a un cas rapporté de décès de patient secondaire à une hémorragie rétropéritonéale après un bloc sympathique lombaire dans le cadre d'un traitement antiplaquettaire. L'autopsie a révélé que le patient avait perdu 3 L de sang dans son espace rétropéritonéal, ce qui témoigne de la menace occulte présentée par la périphérie conforme. En effet, plusieurs autres cas ont été rapportés où les patients ont souffert d'une morbidité importante due à un hématome PNB, y compris un séjour prolongé à l'hôpital, la nécessité d'une transfusion ou une insuffisance rénale aiguë.
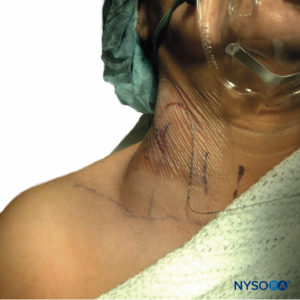
FIGURE 3. Hématome du cou chez un patient dont la veine jugulaire externe a été ponctionnée avec une aiguille de style Tuohy de calibre 18 lors de l'insertion d'un cathéter dans le sillon interscalénique. L'hématome montré était autonome et a été traité de manière conservatrice avec une compression locale.
Étant donné que dans tous les cas rapportés dans la littérature, le déficit neurologique, s'il était présent, avait disparu en 1 an, il semble que la source de morbidité la plus préoccupante soit la perte de sang dans l'hématome. Cependant, en raison de la nature rare de cette complication, il est difficile pour les experts de faire des recommandations concernant cette procédure dans le cadre de l'anticoagulation. Cette difficulté est exacerbée par l'existence de rapports de cas dans lesquels un hématome s'est produit alors que les praticiens suivaient les directives de l'American Society of Regional Anesthesia and Pain Medicine (ASRA). De plus, des cas d'hématomes spontanés ont été rapportés chez des patients sous énoxaparine ou héparine trois fois par jour. Pris ensemble, ces faits ont conduit à des directives quelque peu contrastées dans différents pays. Par exemple, la Société allemande d'anesthésiologie et de soins intensifs a émis des recommandations concernant l'arrêt de l'anticoagulation avant la PNB, mais la Société autrichienne déclare que les PNB distaux, tels que les blocs sciatiques ou axillaires, peuvent être effectués chez un patient sous anticoagulation.
Les recommandations de l'ASRA stipulent que les recommandations concernant les techniques neuraxiales doivent être appliquées aux blocs du plexus profond et aux PNB. Par conséquent, les patients sous anticoagulation ne sont pas candidats à ces techniques d'anesthésie, mais certains chercheurs ont suggéré qu'avec l'avènement du guidage échographique, ces patients sous anticoagulation pourraient subir en toute sécurité un bloc des nerfs périphériques. De plus, des études ont montré non seulement une incidence réduite de ponction vasculaire avec l'utilisation des ultrasons, mais également une diminution du taux de toxicité des anesthésiques locaux. Cette option a le potentiel d'améliorer la sécurité des patients, étant donné que les patients sous anticoagulation présentent souvent des facteurs de risque pour l'anesthésie générale et gagneraient à éviter les fluctuations résultantes de l'hémodynamique et de l'état des fluides.
La tomodensitométrie est actuellement la technique d'imagerie la plus courante pour le diagnostic du sang dans les tissus périphériques, en particulier l'espace rétropéritonéal. Cependant, l'échographie a été utilisée pour démontrer la présence d'un hématome sous-capsulaire rénal93 et pourrait potentiellement être une technique de diagnostic plus facilement accessible que la tomodensitométrie dans les régions du corps se prêtant à cette méthode de visualisation. L'utilisation accrue de l'échographie dans le placement initial des PNB pourrait faciliter le diagnostic des cas suspects d'hématome post-bloc, car l'équipement d'échographie sera facilement disponible.
Bien qu'un diagnostic rapide soit idéal, le traitement ultérieur de l'hématome après les PNB est généralement une prise en charge dans l'expectative. Une équipe chirurgicale est habituellement consultée, des transfusions sanguines sont ordonnées si nécessaire et le drainage chirurgical n'est envisagé que chez les patients critiques ou dont l'état se détériore rapidement. Certains rapports de cas d'hématome du psoas se sont résolus sans évacuation chirurgicale de l'hématome, et les patients ont retrouvé leur état sensoriel et moteur quelques jours à 4 mois après le diagnostic. En ce qui concerne les hématomes concomitants avec un cathéter nerveux périphérique, ceux-ci sont également souvent spontanément résolutifs, mais il existe des rapports indiquant qu'un drainage chirurgical a été effectué.
Compte tenu du manque de données disponibles concernant l'hémorragie après PNB ou bloc nerveux continu, il peut être difficile de déterminer avec précision la supériorité d'une certaine technique d'anesthésie pour un patient spécifique. Les anesthésiologistes doivent individualiser leur décision en fonction de la pertinence des PNB chez les patients sous anticoagulants et, comme toujours, discuter en détail des risques et des avantages du bloc avec le patient et le chirurgien. Si un bloc est réalisé, le patient doit être étroitement surveillé pendant la période périopératoire afin de détecter tout signe ou symptôme d'hématome périphérique.
Références
- Plagne R : L'hématome extra-dural rachidien non traumatique (hématome épidural spontané) [mémoire]. Clermont-Ferrand, France : Université de Clermont-Ferrand, 1961.
- Jackson R : Cas d'apoplexie spinale. Lancet 1869;2:538–539.
- Holtas S, Heiling M, Lonntoft M : Hématome épidural spinal spontané : découvertes à l'IRM et corrélation clinique. Radiologie 1996;199 : 409–413.
- Alexiadou-Rudolf C, Ernestus R, Nanassis K, et al : hématomes épiduraux spinaux aigus non traumatiques. Spine 1998;23:1810–1813.
- Tekkok IH, Cataltepe O, Tata K, et al : hématome extradural après anesthésie extradurale continue. Br J Anaesth 1991;67:112–115.
- Hejazi N, Thaper PY, Hassler W : Neuf cas d'hématome épidural spinal non traumatique. Neurol Med Chir 1998;38:718–723.
- Sokolowski MJ, Garvey TA, Perl J, et al : étude prospective de l'hématome épidural lombaire postopératoire. Spine 2008;33:108–113.
- Glotzbecker MP, Bono CM, Wood KB, Harris M : Hématome épidural spinal postopératoire : une revue systématique. Colonne vertébrale 2010;35:E413–E420.
- Tryba M : Anesthésie régionale péridurale et héparine de bas poids moléculaire : pro [en allemand]. Anasthesiol Intensivmed Notfallmed Schmerzther 1993;28:179–181.
- Horlocker T : Complications de l'anesthésie régionale et de la gestion de la douleur aiguë. Anesthesiol Clin 2011;29:257–278.
- Moen V, Dahlgren N, Irestedt L : Complications neurologiques graves après des blocs neuraxiaux centraux en Suède en 1990-1999. Anesthésiologie 2004 ; 101 : 950–959.
- Popping DM, Zahn PK, Van Aken HK, Dasch B, Boche R, Pogatzki-Zahn EM : Efficacité et sécurité de la gestion de la douleur postopératoire : une enquête auprès de 18,925 1998 patients consécutifs entre 2006 et 2 (2008e révision) : une analyse de la base de données Les données. Br J Anaesth 101;832:840–XNUMX.
- Horlocker T, Kopp S : Hématome épidural après bloc épidural aux États-Unis : il ne s'agit plus seulement d'héparine de bas poids moléculaire après une chirurgie orthopédique. Anesth Analg 2013;116:1195–1197.
- Bateman BT, Mhyre JM, Ehrenfeld J, et al : Le risque et les résultats des hématomes épiduraux après un cathétérisme épidural périopératoire et obstétrical : un rapport du consortium de recherche multicentrique sur les résultats périopératoires. Anesth Analg 2013;116:1380–1385.
- Usubiaga JE, WJ, Usabiaga LE : La pression épidurale et sa relation avec la propagation des solutions anesthésiques dans l'espace épidural. Anesth Analg 1967;46:440–446.
- Cummings SR, Nevitt MC, Browner WS, et al : L'étude du groupe de recherche sur les fractures ostéoporotiques : facteurs de risque de fracture de la hanche chez les femmes blanches. N Engl J Med 1995;332:767–773.
- Hasserius R, Johnell O, Nilsson BE, et al : les patients ayant subi une fracture de la hanche ont plus de déformations vertébrales que les sujets dans les études basées sur la population. Os 2003 ; 32:180–184.
- Awad JK, Kebaish KM, Donigan J, Cohen DB, Kostuik JP : Analyse des facteurs de risque pour le développement d'un hématome épidural rachidien postopératoire. J Bone Joint Surg Br 2005;87:1248–1252.
- Horlocker TT, Wedel DJ : Bloc neuraxial et héparine de bas poids moléculaire : équilibrer l'analgésie périopératoire et la thromboprophylaxie. Reg Anesth 1998;23:164–177.
- Johnston RA: La gestion de la compression aiguë de la moelle épinière. J Neurol Neurosurg Psychiatr 1993;56:1046–1054.
- Wysowski DK, Talarico L, Bacsanyi J, et al : hématome spinal et épidural et héparine de bas poids moléculaire. N Engl J Med 1998;338 : 1774–1775.
- Vandermeulen E, Van Aken H, Vermylen J : Anticoagulants et anesthésie rachidienne. Anesth Analg 1994;79:1165–1177.
- Dickman CA, Shedd SA, Spetzler RF : Hématome épidural rachidien associé à une anesthésie péridurale : complications de l'héparinisation systémique chez les patients recevant un traitement thrombolytique vasculaire périphérique. Anesthésiologie 1990 ; 72 : 947–950.
- Mattle H, Sieb JP, Rohner M, et al : hématomes épiduraux et sous-duraux non traumatiques de la colonne vertébrale. Neurologie 1987 ; 37 : 1351–1356.
- Levine MN, Goldhaber SZ, Gore JM, et al : complications hémorragiques de la thérapie thrombolytique dans le traitement de l'infarctus du myocarde et de la thromboembolie veineuse. Chest 1995;108(Suppl 4):291S–301S.
- Graziani N, Bouillot P, Figarella-Bragner D, et al : Angiomes caverneux et malformations artério-veineuses de l'espace épidural rachidien : rapport de 11 cas. Neurochirurgie 1994;35:856–864.
- Harik S, Raichle M, Reis D : Hématome épidural spinal à rémission spontanée chez un patient sous anticoagulants. N Engl J Med 1971;284 : 1355–1357.
- Zuccarello M, Scanarini M, D'Avella, et al : hématome extradural rachidien spontané au cours d'un traitement anticoagulant. Surg Neurol 1980;14:411–413.
- Chen C, Fang W, Chen C, et al : hématomes épiduraux rachidiens spontanés avec rémission et rechute répétées. Neuroradiologie 1997;39:737–740.
- Groen R, Ponssen H : L'hématome épidural spinal spontané : une étude de l'étiologie. J Neurolog Sci 1990;98:121–138.
- Packer N, Cummins B : Hémorragie épidurale spontanée : une urgence chirurgicale. Lancet 1978 ; 1 : 356–358.
- Hebl JR, Horlocker TT, Kopp SL, Schroeder DR : Bloc neuraxial chez les patients présentant une sténose spinale préexistante, une discopathie lombaire ou une chirurgie antérieure de la colonne vertébrale : efficacité et complications neurologiques. Anesth Analg 2010;111:1511–1519.
- Joseph A, Vinen J : Hématome épidural spinal aigu. J Emerg Med 1993;11:437–441.
- Beatty RM, Winston KR : Hématome épidural cervical spontané. Un examen de l'étiologie. J Neurosurg 1984;61:143–148.
- Pan G, Kulkarni M, MacDougall DJ, et al : Hématome épidural traumatique de la colonne cervicale : diagnostic par imagerie par résonance magnétique. J Neurosurg 1988;68:798–801.
- Foo D, Rossier A : état neurologique préopératoire dans la prédiction des résultats chirurgicaux des hématomes épiduraux spinaux. Surg Neurol 1981;15:389–340.
- David S, Salluzzo RF, Bartfield JM, et al : Hamatome épidural cervicothoracique spontané suite à une Valsalva prolongée secondaire au jeu de la trompette. Am J Emerg Med 1997;15:73–75.
- Fukui M, Swarnkar A, Williams R : Hématomes spinaux épiduraux spontanés aigus. Am J Neuroradiol 1999;20:1365–1372.
- Joseph A, Vinen J : Hématome épidural spinal aigu. J Emerg Med 1993;11:437–441.
- Bidzinski J: Hématome épidural rachidien spontané pendant la grossesse. J Neurosurg 1966;24:1017–1018.
- Carroll S, Malhotra R, Eustace D, et al : hématome extradural spinal spontané pendant la grossesse. J Matern Fetal Med 1997;6:218–219.
- Stoll AS, Sanchez M : Hématome épidural après bloc épidural : implications pour son utilisation dans la gestion de la douleur. Surg Neurol 2002;57:235–240.
- Bruyn GW, Bosma NJ : Hématome extradural spinal. Dans Vinken PJ, Bruyn GW (eds): Manuel de neurologie clinique. Hollande du Nord, 1976, pp 1–30.
- Horlocker T, Wedel DJ, Rowlingson JC, et al : Anesthésie régionale chez le patient recevant un traitement antithrombotique ou thrombolytique : Directives fondées sur des preuves de l'American Society of Regional Anesthesia and Pain Medicine (troisième édition). Reg Anesth Pain Med 2010;35:64–101.
- Matsume M, Shimoda M, Shibuya N : Hématome péridural cervical spontané. Surg Neurol 1987;28:381–384.
- Lonjon M, Paquis P, Chanalet S, et al : Hématome épidural rachidien non traumatique : rapport de quatre cas et revue de la littérature. Neurochirurgie 1997;41:483–487.
- Cwik J : Considérations postopératoires sur l'anesthésie neuraxiale. Anesthesiol Clin 2012;30:433–443.
- Lawton M, Porter R, Heiserman J, et al : Prise en charge chirurgicale de l'hématome épidural rachidien : relation entre le moment chirurgical et le résultat neurologique. J. Neurosurg 1995 ; 83 : 1–7.
- Avrahami E, Tadmor R, Ram Z, et al : démonstration par IRM d'un hématome épidural aigu spontané de la colonne vertébrale thoracique. Neuroradiologie 1989;31:89–92.
- Mattle H, Sieb J, Rohner M, et al : hématomes épiduraux et sous-duraux non traumatiques de la colonne vertébrale. Neurologie 1987 ; 37 : 1351–1356.
- Beatty RM, Winston KR : Hématome épidural cervical spontané. Un examen de l'étiologie. J Neurosurg 1984;61:143–148.
- Cooper DW : Hématome épidural rachidien spontané. Rapport de cas. J Neurosurg 1967;26:343–345.
- Uribe JM, Moza K, Jimenez O, Green B, Levi AD : Hématomes épiduraux spinaux postopératoires retardés. Spine J 2003;3:125–129.
- Gogarten W, Vandermeulen E, Van Aken H, Kozek S, Llau JV, Samama CM ; Société européenne d'anesthésiologie : Anesthésie régionale et agents antithrombotiques : recommandations de la Société européenne d'anesthésiologie. Eur J Anaesthesiol 2010;27:999–1015.
- Breivik H, Bang U, Jalonen J, Vigfusson G, Alahuhta S, Lagerkranser M : Directives nordiques pour les blocs neuraxiaux dans l'hémostase perturbée de la Société scandinave d'anesthésiologie et de médecine de soins intensifs. Acta Anaesthesiol Scand 2010;54:16–41.
- Jacobs LJ, Woods BI, Chen AF, Lunarini DJ, Holh JB, Lee JY : La sécurité de la chimioprophylaxie thromboembolique chez les patients traumatisés de la colonne vertébrale nécessitant une stabilisation chirurgicale. Colonne vertébrale 2013;38:E1041–7.
- Pahapill PA, Lownie SP : traitement conservateur de l'hématome épidural spinal spontané aigu. Can J Anaesth 1998;25:159–163.
- Schwarz SK, Wong CL, McDonald WN : Récupération spontanée d'un hématome épidural spinal avec présentation atypique chez un nonagénaire. Can J Anesth 2004;51:557–561.
- Benzon HT, Snitzer J, Hoxie S, Pollina R, Nelson A : examen des rapports de cas d'hématome spinal. Présenté à la réunion annuelle de l'American Society of Anesthesiologists, Washington, DC, 16 octobre 2012.
- Tailleur J, Dunn IF, Smith E : gestion conservatrice de l'hématome épidural spinal spontané associé à un traitement anticoagulant oral chez un enfant. Childs Nerv Syst 2006;22:1643–1645.
- Connoly SE, Winfree CJ, McCormick PC : Prise en charge de l'hématome épidural spinal après activateur tissulaire du plasminogène. Un rapport de cas. Spine 1996;21:1694–1698.
- Lopez AG, Lara JMP, Hidalgo RH, Gonzalo PE ; Hématome épidural rachidien après traitement thrombolytique pour infarctus aigu du myocarde. Orthopédie 1999;22:987–988.
- Marzai H, Eminoglu M, Orguc S : Les drains sont-ils utiles pour la chirurgie des disques lombaires ? Une étude clinique prospective randomisée. J Spinal Disord Tech 2006;19:171–177.
- Hejazi N, Thaper PY, Hassler W : Neuf cas d'hématome épidural spinal non traumatique. Neurol Med Chir 1998;38:718–723.
- Wolfgang P, Klaus M : Hématome rachidien non lié à une chirurgie antérieure : analyse de 15 cas consécutifs traités dans un même établissement sur une période de 10 ans. Spine 2004;24:555–561.
- Rohde V, Küker W, Reinges MHT, et al : traitement microchirurgical des hématomes épiduraux rachidiens spontanés et non spontanés : résultat neurologique en relation avec l'étiologie. Acta Neurochir 2000;142 : 787–793.
- Wulf H : Anesthésie péridurale et hématome rachidien. Can J Anaesth 1996;43:1260–1271.
- Mukerji N, Todd N. Hématome épidural spinal ; facteurs influençant le résultat. Br J Neurosurg 2013;27:712–717.
- Groen RT, Van Alphen HA : Traitement opératoire des hématomes épiduraux rachidiens spontanés : une étude des facteurs déterminant les résultats postopératoires. Neurochirurgie 1996;39:494–508.
- Enomato T, Maki Y, Nakagawa K, et al : Hématome épidural spinal spontané : rapport d'un cas. Neurol Surg 1980;8:875–880.
- Klein SM, D'Ercole F, Greengrass RA, et al : énoxaparine associée à un hématome du psoas et à une plexopathie lombaire après un bloc du plexus lombaire. Anesthésiologie 1997 ;87 :1576–1579.
- Weller RS, Gerancher JC, Crews JC, et al : Hématome rétropéritonéal étendu sans déficit neurologique chez deux patients ayant subi un bloc du plexus lombaire et ayant ensuite été anticoagulés. Anesthésiologie 2003;98:581–583.
- Maier C, Gleim M, Weiss T, Sachetzki U, Nicolas V, Zenz M : Saignement sévère suite à un bloc sympathique lombaire chez deux patients sous médication avec des inhibiteurs irréversibles de l'agrégation plaquettaire. Anesthésiologie 2002;97 :740–743.
- Poivert C, Malinovsky JM : Hématome de la cuisse après bloc du nerf sciatique et fondaparinux. Ann Fr Anesth Reanim 2012;31:484–485.
- Ferraro LH, Tardelli MA, Yamashita AM, Cardone JD, Kishi JM : blocs nerveux fémoraux et sciatiques guidés par échographie chez un patient anticoagulé. Les rapports de cas. Rev Bras Anestesiol 2010;60:422–428.
- Clendenen SR, Robards CB, Wang RD, Greengrass RA : bloc interscalénique continu associé à un hématome cervical et à une septicémie postopératoire. Anesth Analg 2010;110:1236–1238.
- Johr M : Une complication du bloc continu du nerf fémoral. Reg Anaesth (allemand) 1987; 10: 37–38.
- Neuberger M, Breithbarth J, Reisig F, Lang D, Buttner J : Complications et événements indésirables dans l'anesthésie régionale périphérique continue. Résultats d'investigations sur 3,491 2006 cathéters [en allemand]. Anesthésiste 55 ; 33 : 40–XNUMX.
- Wiegel M, Gottschaldt U, Hennebach R, Hirschberg T, Reske A : Complications et effets indésirables associés aux blocs nerveux périphériques continus chez les patients orthopédiques. Anesth Analg 2007;104 : 1578–1582.
- Enneking FK, Chan V, Greger J, Hadzic A, Lang SA, Horlocker TT : Bloc nerveux périphérique des membres inférieurs : éléments essentiels de notre compréhension actuelle. Reg Anesth Pain Med 2005;30:4–35.
- Antonelli D, Fares L, Anene C : Enoxaparine associée à d'énormes hématomes de la paroi abdominale : à propos de deux cas. Suis Chirurgien 2000;66:797–800.
- Dickinson LD, Miller L, Patel CP, et al : l'énoxaparine augmente l'incidence des hémorragies intracrâniennes postopératoires lorsqu'elle est initiée en préopératoire pour la prophylaxie de la thrombose veineuse profonde avec tumeurs cérébrales. Neurochirurgie 1998;43:1074–1081.
- Ho KJ, Gawley SD, Young MR : Hématome du psoas et neuropathie fémorale associés au traitement par énoxaparine. Int J Clin Pract 2003;57:553–554.
- Houde JP, Steinberg G : Hémorragie intrahépatique après utilisation d'héparine de bas poids moléculaire pour une arthroplastie totale de la hanche. J Arthroplasty 1999;14:372–374.
- King CS, Holley AB, Jackson JL, et al : Dosage d'héparine deux fois contre trois fois par jour pour la prophylaxie thromboembolique dans la population générale : une méta-analyse. Poitrine 2007 ; 131 : 507–516.
- Kozek-Langenecker SA, Fries D, Gutl M, et al : anesthésie locorégionale et coagulation chez les inhibiteurs. Recommandations du groupe de travail sur la coagulation périopératoire de la Société autrichienne d'anesthésiologie et de médecine de soins intensifs [en allemand]. Anesthésiste 2005 ;54 :476–484.
- Abrahams MS, Aziz MF, Fu RF, Horn JL : Guidage par ultrasons comparé à la neurostimulation électrique pour le bloc nerveux périphérique : une revue systématique et une méta-analyse d'essais contrôlés randomisés. Br J Anaesth 2009;102:408–417.
- Barrington MJ, Watts SA, Gledhill RA, et al : résultats préliminaires de l'Australasian Regional Anesthesia Collaboration : un audit prospectif de plus de 7000 2009 blocs nerveux et plexus périphériques pour les complications neurologiques et autres. Reg Anesth Pain Med 34;534:541–XNUMX.
- Sites BD, Taenzer AH, Herrick MD, et al : incidence de la toxicité systémique locale et des symptômes neurologiques postopératoires associés à 12,668 2012 blocs nerveux guidés par échographie. Une analyse d'un registre clinique prospectif. Reg Anesth Pain Med 37;478:482–XNUMX.
- Orebaugh SL, Mentor ML, Williams BA : Résultats indésirables associés aux blocs nerveux périphériques guidés par stimulateur nerveux et guidés par ultrasons par des stagiaires supervisés : mise à jour d'une base de données à site unique. Reg Anesth Pain Med 2012;37:577–582.
- Barrington MJ, Kluger R : Le guidage échographique réduit le risque de toxicité anesthésique locale après un bloc nerveux périphérique. Reg Anesth Pain Med 2013;38:289–299.
- Monib S, Ritchie A, Thabet E : Hématome rétropéritonéal idiopathique. Représentant de cas J Surg Tech 2011 ; 3 : 49-51.
- Aida S, Takahashi H, Shimoji K : Hématome sous-capsulaire rénal après bloc du plexus lombaire. Anesthésiologie 1996 ;84 : 452–455.

