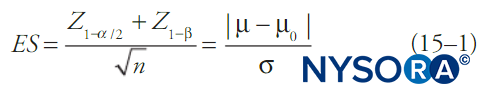Andrew Neice und Michael J. Barrington
EINFÜHRUNG
Die Regionalanästhesie wird am besten im Rahmen standardisierter Anästhesie- und Operationsprotokolle praktiziert; diese Pläne werden allgemein als Anästhesiepfade bezeichnet. Bei einem Patienten, der sich einer Operation unter Verwendung eines Anästhesiewegs unterzieht, werden viele Entscheidungen über die Versorgung des Patienten nicht unmittelbar vor der Operation am Krankenbett getroffen, sondern lange vor der Operation, indem die Risiken und Vorteile verschiedener Anästhetika und perioperativer Behandlungen sorgfältig abgewogen werden Optionen. Gut konzipierte Anästhesiepfade können die Patientenversorgung verbessern, indem sichergestellt wird, dass Patienten eine konsistente, koordinierte und evidenzbasierte Versorgung erhalten. Sie können auch Kosten senken, indem sie unnötige Eingriffe vermeiden und Komplikationen reduzieren. Natürlich sollten Behandlungspfade nicht wahllos befolgt werden, da einige Patienten eine Modifikation benötigen, um für bestimmte medizinische Bedingungen oder Patientenpräferenzen zu büßen. Unabhängig davon ermöglichen Anästhesiepfade den Ärzten, sich auf die einzigartigen Merkmale eines Patienten zu konzentrieren, anstatt auf die gemeinsamen Merkmale einer ganzen Kohorte, die bereits während der Pfadentwicklung untersucht wurden.
Anästhesiewege (oder klinische Wege in jedem Bereich) sind im Kern eine Reihe medizinischer Entscheidungen. Als Leiter des perioperativen chirurgischen Heims sind Anästhesisten am besten geeignet, ihr Design zu leiten. Es gibt oft viele subtile Probleme, die bei der Entwicklung eines Behandlungspfads auftreten, die möglicherweise niemandem vertraut sind, außer einem Arzt, der häufig und persönlich in die Patientenversorgung involviert ist. Darüber hinaus sind die Arbeitsbeziehungen von Anästhesisten mit Chirurgen, Verwaltungspersonal und dem gesamten OP-Team von größter Bedeutung für die Entwicklung und den Erfolg von Patientenpfaden. Die interdisziplinäre Koordination ist für die erfolgreiche Entwicklung von Anästhesiepfaden von entscheidender Bedeutung. Anästhesieentscheidungen wirken sich häufig auf die Rehabilitationsfähigkeit der Patienten in der unmittelbaren postoperativen Phase aus, daher müssen Anästhesie- und Operationswege in Teamarbeit entworfen werden.
Da es Belege dafür gibt, dass die Anwendung der Regionalanästhesie die Mortalität und Morbidität bei häufigen Operationen beeinflussen kann, und weil die Schmerzkontrolle in der postoperativen Phase oft eine Herausforderung darstellt, ist die Regionalanästhesie (entweder neuraxiale oder periphere Blockade) oft ein Schlüsselmerkmal der Anästhesiewege. Daher ist die Entwicklung von Pfaden von besonderem Interesse für Praktiker, deren klinische Praxis Regionalanästhesie umfasst.
Das Entwerfen und Implementieren klinischer Pfade erfordert Fähigkeiten, die während der Facharztausbildung oft nicht vermittelt werden. Ärzte passen ihre Behandlungen an die einzigartigen Eigenschaften jedes Patienten an. Dies steht im Zusammenhang mit der Ausbildung von Ärzten, die darauf ausgelegt ist, Daten für einen bestimmten Patienten zu erheben und zu synthetisieren. Im Gegensatz dazu müssen klinische Pfade so gestaltet werden, dass sie die durchschnittliche Erfahrung einer Kohorte von Patienten optimieren, wobei häufig Kompromisse und Kompromisse eingegangen werden müssen. Kenntnisse in Epidemiologie und Statistik sind für ein effektives klinisches Pathway-Design von entscheidender Bedeutung. Die numerische Schätzung wahrscheinlicher Ergebnisse und die Auswahl derjenigen, die am günstigsten bewertet werden, ist von zentraler Bedeutung für die Entwicklung des Pfads.
Die Vorteile eines Anästhesiepfads hängen natürlich von den Besonderheiten des Pfads selbst, der Einrichtung, den chirurgischen und anästhetischen Techniken und den anderen Gesundheitsdienstleistern ab, die den Pfad verwenden (z. B. Krankenpflege, Physiotherapie usw.). Ein Studiengang, der für eine Institution entworfen wurde, ist möglicherweise nicht für eine andere Institution geeignet, weshalb wir uns in diesem Kapitel dafür entschieden haben, den Prozess der Studiengangsentwicklung hervorzuheben, anstatt spezifische Studiengänge vorzustellen. Darüber hinaus können die Ziele eines Anästhesiepfads variieren – einige Pfade können darauf ausgelegt sein, die Morbidität oder Mortalität zu reduzieren, während andere auf die Reduzierung der Kosten bei gleichzeitiger Aufrechterhaltung eines hohen Niveaus der Patientenversorgung ausgerichtet sein können. Zu den allgemeinen Zielen eines Anästhesiepfads gehören die Verringerung der Morbidität und Mortalität im Krankenhaus, die Verkürzung der Krankenhausaufenthaltsdauer, die Verringerung der Kosten, die Verbesserung der Patientenzufriedenheit, die Verringerung der Wiedereinweisungen und die Verbesserung der langfristigen funktionellen Ergebnisse.
Trotz dieser Heterogenität gibt es Hinweise darauf, dass klinische Pfade im Allgemeinen die Patientenversorgung verbessern. Eine kürzlich durchgeführte Metaanalyse klinischer Behandlungspfade ergab, dass sie mit geringeren Raten von Patientenkomplikationen (z. B. Wundinfektionen, Blutungen und Lungenentzündung) sowie einer verbesserten Dokumentation verbunden waren. Die meisten der in die Metaanalyse eingeschlossenen Studien zeigten auch eine Reduktion der Verweildauer und der Krankenhauskosten ohne erhöhtes Risiko für Wiederaufnahmeraten und Mortalität. Es ist jedoch möglich, dass einige klinische Wege diese Ergebnisse tatsächlich auch verbessern könnten. Die beträchtliche Heterogenität erfolgreicher klinischer Wege hat es den Forschern nicht ermöglicht, gemeinsame Merkmale erfolgreicher (oder nicht erfolgreicher) klinischer Wege zu identifizieren. Nichtsdestotrotz können Grundprinzipien des Risikomanagements eingesetzt werden, um bei der Gestaltung klinischer Pfade zu helfen, und die Entwicklung eines wiederverwendbaren, gemeinsamen Rahmens für die Herangehensweise an klinische Pfade scheint wahrscheinlich die Erfolgswahrscheinlichkeit zu erhöhen.
In diesem Kapitel stellen wir einen Rahmen für die Entwicklung klinischer Behandlungspfade vor und gehen auf einige der für diesen Prozess erforderlichen Grundkenntnisse ein. Wir stellen auch Fallbeispiele vor, die die Feinheiten bei der Anwendung bestehender medizinischer Literatur auf klinische Pfade veranschaulichen. Schließlich präsentieren wir Komponenten eines chirurgischen Pfads für die totale Knieendoprothetik.
RAHMEN FÜR ANÄSTHESISCHE PATHWAYS
Ein Beispiel für eine einzelne Komponente eines klinischen Signalwegs ist in gezeigt Tabelle 1. Dies ist eine Komponente eines größeren Weges für die Totalgelenksendoprothetik, die im letzten Abschnitt dieses Kapitels weiter diskutiert wird. Diese Komponente beschreibt die standardmäßigen oralen Prämedikationen für die Operation und enthält spezifische Informationen zur Dosis, häufigen Kontraindikationen und häufigen Ergänzungen des Verabreichungswegs, die für einige Patienten erforderlich sein können. Obwohl die Entwicklung eines klinischen Pfads oft langwierige Analysen mit Unsicherheiten beinhaltet, sollten die endgültigen Pfadelemente kurz und spezifisch sein. Neben den empfohlenen Prämedikationen können Wege viele verschiedene Elemente haben; siehe zum Beispiel die in Tabelle 2.
Es ist zu beachten, dass sich die von Anästhesisten entwickelten Pfade zwar primär mit dem anästhetischen Management des Patienten befassen, aber so gestaltet sind, dass sie mit dem entsprechenden chirurgischen Pfad verzahnt sind. Beispielsweise kann die Wahl der Regionalanästhesie es dem Patienten ermöglichen, die Physiotherapie am 1. postoperativen Tag abzuschließen.
TABELLE 1. Beispiel eines Pathway-Items: orale Prämedikation für Knie-Totalendoprothetik.
| Empfohlene orale Prämedikation vor der Operation (nur Beispiel) | |
|---|---|
| Paracetamol 1 g durch den Mund | Vermeiden Sie bei Patienten mit Zirrhose erhöhte Leberfunktionstests |
| Celecoxib 400 mg zum Einnehmen | Vermeiden Sie bei Personen mit Sulfonamid-Allergie, Nierenfunktionsstörungen |
| Gabapentin 600 mg zum Einnehmen | Vermeiden Sie bei Patienten mit Nierenfunktionsstörungen, ambulanten Patienten, Patienten mit fortgeschrittenem Alter oder Demenz |
TABELLE 2. Beispiele für Pfadelemente.
- Aufzählung der Ziele des Weges
- Kriterien für die Patientenauswahl, Vorbereitung auf die Operation und Aufklärung vor der Operation
- Präoperative Optimierung (z. B. Blutdruckziele, Hämatokritziele, assoziierte pharmakologische Interventionen)
- Empfohlene chirurgische Anästhesie
- Empfohlene systemische multimodale Anästhesietechnik
- Empfohlene Regionalanästhesie/Analgesie zur Behandlung postoperativer Schmerzen
- Empfohlene prophylaktische Therapie bei postoperativer Übelkeit und Erbrechen
- Empfohlene intraoperative Flüssigkeits- oder Hämatokritziele oder Transfusionskriterien
- Empfohlenes intraoperatives Management der Hämodynamik (z. B. bevorzugte Blutdruckwerte, bevorzugte Pressoren usw.)
- Empfohlene adjuvante Medikamente (z. B. bevorzugte Antibiotika, Antikoagulation, Antifibrinolytika)
- Empfohlene adjuvante Überwachung (z. B. evozierte Potenziale, bispektraler Index, zerebrale Oxygenierung)
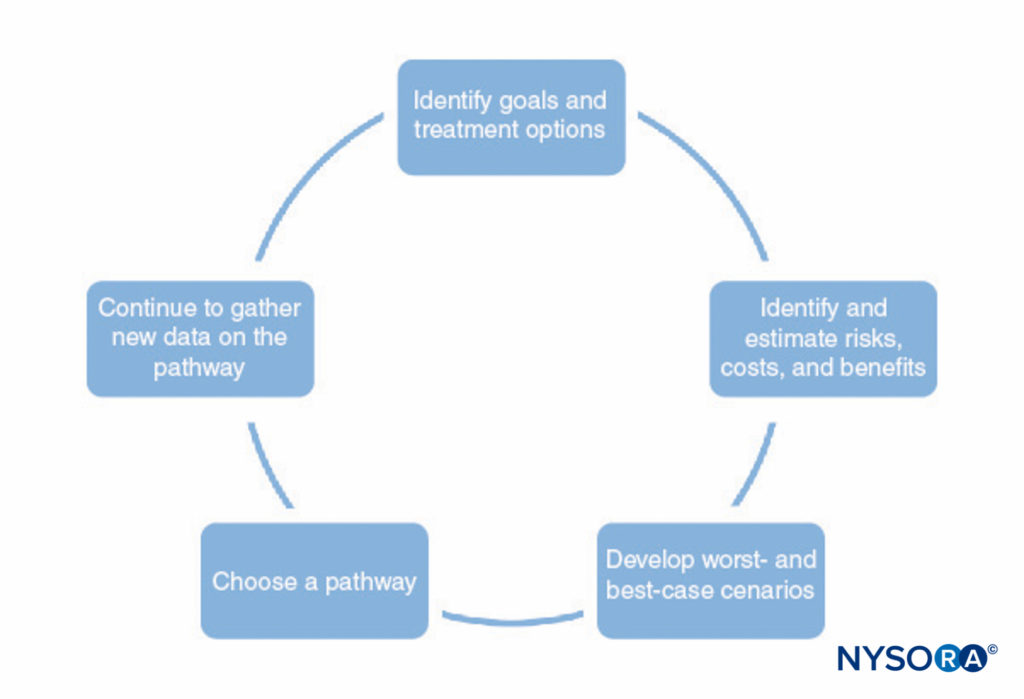
Ein Verfahren zur Entwicklung klinischer Behandlungspfade ist in dargestellt Figure 1. Dieser Prozess besteht aus Folgendem:
- Identifizierung der Ziele des Behandlungspfads und verschiedener Behandlungsoptionen, um diese Ziele zu erreichen. Dies sollte alle Stadien der Anästhesie und Operation umfassen, einschließlich der postoperativen Genesung.
- Identifizieren, wie jede Behandlung mit den anderen interagiert (z. B. kann die Art der Regionalanästhesie die Fähigkeit des Patienten beeinträchtigen, postoperativ Physiotherapie durchzuführen, Prämedikation kann die Entlassung aufgrund von Sedierung verzögern).
- Identifizierung möglicher Risiken, Kosten und Vorteile jeder Behandlung, einschließlich Mortalität, Morbidität, Patientenzufriedenheit, institutionelle Möglichkeiten, finanzielle Kosten und andere Faktoren.
- Numerische Schätzungen der Risiken, Kosten und Vorteile, die in Schritt 3 identifiziert wurden. Einige dieser Informationen (z. B. Informationen zu den Kosten) können gesammelt und tabellarisch dargestellt werden. Die meisten Informationen können jedoch nicht mit Sicherheit bekannt sein. In vielen Fällen kann die medizinische Literatur Schätzungen der beteiligten Wahrscheinlichkeiten liefern, solange der Arzt die Einschränkungen einer bestimmten Studie versteht.
- Verwenden Sie die in Schritt 4 entwickelten Schätzungen, um wahrscheinliche Ergebnisse und Worst-Case- und Best-Case-Szenarien für jeden Pfad zu entwickeln.
- Wählen Sie basierend auf Schritt 5 den Weg, der dem Patienten am wahrscheinlichsten zugute kommt.
- Verfeinern Sie die Schätzungen der Risiken, Kosten und Vorteile kontinuierlich, sobald neue Informationen verfügbar werden, und verfeinern Sie die klinischen Behandlungspfade.
Wenn wir die Risiken und Vorteile jedes Eingriffs so einfach quantifizieren könnten wie die finanziellen Kosten für Verfahren und Ausrüstung, wären die Schritte 4, 5 und 6 trivial. Dies ist jedoch selten der Fall. In vielen Fällen gibt es möglicherweise keine angemessenen veröffentlichten Daten, um den Prozess zu leiten. Manchmal kann es zu Unstimmigkeiten zwischen verfügbaren Studien und den gewünschten Informationen kommen – die einzigen verfügbaren Studien wurden möglicherweise an ähnlichen, aber unterschiedlichen Patientenpopulationen durchgeführt; haben ähnliche, aber unterschiedliche chirurgische Verfahren analysiert; oder kann Interventionen beschreiben, die Sie an Ihrer Institution nicht genau replizieren können. Dennoch kann die beste Übereinstimmung mit den eigenen institutionellen Bedingungen verwendet werden, um die in Schritt 5 verwendeten Wahrscheinlichkeiten zu schätzen.
Ein weiteres zu berücksichtigendes Risiko sind Komplikationen, die sich möglicherweise erst lange nach der Behandlungsdauer manifestieren. Zum Beispiel haben kürzlich eingeführte Medikamente, Verfahren oder Therapien per Definition unbekannte Langzeitrisiken. Das Erkennen der Grenzen der bestehenden Evidenz für jede Intervention in der Literatur ist bei der Protokollentwicklung von entscheidender Bedeutung. Obwohl Inferenzstatistiken das Urteilsvermögen eines Arztes über das hinaus verbessern, was durch einfaches Vertrauen auf seine historischen persönlichen Beobachtungen erreicht werden kann, kann leider jede gegebene Studie unvorhergesehene Verzerrungen aufweisen, die die Studie zu einer weniger als idealen Anleitung für das zu entwickelnde Protokoll machen können. Daher muss bei der Entwicklung von „Worst-Case“- und „Best-Case“-Szenarien die Möglichkeit berücksichtigt werden, dass eine Studie einen Fehler XNUMX. oder (häufiger) einen Fehler XNUMX. Art gemacht hat.
ÜBERPRÜFUNG VON STATISTISCHEN KONZEPTEN, DIE FÜR DIE ENTWICKLUNG VON ANÄSTHESISCHEN VERFAHREN RELEVANT SIND
Eine gute Analogie für die Rolle der Statistik bei der Verbesserung des klinischen Urteilsvermögens ist der Vergleich mit der Rolle, die eine Lupe bei der Verbesserung des Sehvermögens spielt. Medikamente oder Interventionen, die große, konsistente Wirkungen haben (z. B. die Wirkung von Insulin auf Glukose oder Epinephrin auf die Herzfrequenz), können vom Kliniker ohne irgendeine Art von bestätigender Studie leicht geschätzt werden, ebenso wie eine Lupe im Allgemeinen nicht notwendig ist, um klar zu sehen Eiter in einer Wunde. Ebenso kann eine zu schwache Studie subtile Effekte möglicherweise nicht erkennen, genauso wie eine einfache Handlinse nicht stark genug ist, um einzelne Bakterien abzubilden. Während nur wenige Kliniker versuchen würden, eine bakterielle Infektion nur mit einer Lupe zu diagnostizieren, machen Kliniker häufig den Fehler anzunehmen, dass ein gemeldetes negatives Ergebnis gleichbedeutend mit keiner Wirkung ist, ohne die Nachweisgrenze der Studie zu berücksichtigen. Seltene, aber katastrophale Komplikationen sind besonders besorgniserregend, da möglicherweise eine extrem große Anzahl von Patienten erforderlich ist, um eine Studie ordnungsgemäß durchzuführen.
Ein statistischer Test kann entweder melden, dass die beobachteten Daten mit dem Zufall übereinstimmen (die Nullhypothese, ein „negatives“ Ergebnis) oder die Nullhypothese zurückweisen und behaupten, dass es einen Zusammenhang zwischen einer Behandlung und einem Ergebnis gibt (ein „positives“ Ergebnis). . In Wirklichkeit kann es einen Zusammenhang zwischen einer Behandlung und einem Ergebnis geben oder auch nicht. Es gibt daher für jeden statistischen Test vier Möglichkeiten, von denen zwei die richtige Schlussfolgerung beinhalten und zwei davon Fehler sind. Diese werden traditionell mithilfe einer 2 × 2-Tabelle angezeigt, wie in gezeigt Tabelle 3.
TABELLE 3. Mögliche Ergebnisse eines statistischen Tests.
| Hypothese ist wahr | Hypothese ist falsch | |
|---|---|---|
| Hypothese wird akzeptiert | Richtige Entscheidung | Fehler XNUMX. Art (Alpha) |
| Hypothese wird verworfen | Fehler XNUMX. Art (Beta) | Richtige Entscheidung |
Die zwei Arten möglicher Fehler sind ein Fehler erster Art (Alpha), bei dem fälschlicherweise geschlussfolgert wird, dass eine Assoziation besteht, obwohl keine vorhanden ist, und ein Fehler zweiter Art (Beta), bei dem fälschlicherweise geschlussfolgert wird, dass keine Assoziation besteht, obwohl dies tatsächlich der Fall ist . Offensichtlich hängen die Wahrscheinlichkeiten, die beiden Arten von Fehlern zu machen, zusammen. Stellen Sie sich einen statistischen Test vor, der unabhängig von den Daten immer behauptet, dass es einen Zusammenhang zwischen der Behandlung und dem Ergebnis gibt. Diese Technik macht häufig Fehler vom Typ I, aber niemals einen Fehler vom Typ II (weil sie niemals ein negatives Ergebnis behauptet).
Konventionell berechnen statistische Tests die Wahrscheinlichkeit, dass ein Datensatz auf zufälligen Zufall zurückzuführen ist (der p-Wert), und wenn dieser unter einem festen Schwellenwert (Alpha) liegt, wird die Vorstellung, dass die Daten auf zufälligen Zufall zurückzuführen sind, abgelehnt. Im Allgemeinen wird auch ein Konfidenzintervall angegeben. Wenn Alpha festgelegt ist, am häufigsten bei 0.05, ist Beta eine Funktion der anderen Merkmale des statistischen Tests. Eine der einfacheren Formeln in Bezug auf Alpha, Beta, Mittelwertänderung, Standardabweichung der Daten und Stichprobengröße ist in dargestellt Gleichung 1. Gleichung 1 beschreibt Machtbeziehungen für einen Test einer großen Stichprobe einer kontinuierlichen Ergebnisvariablen in einer einzelnen Grundgesamtheit mit bekanntem Mittelwert und bekannter Standardabweichung:
wobei n der Stichprobenumfang ist, σ die Standardabweichung der Stichprobe ist, μ der Stichprobenmittelwert ist, μ0 ist der Populationsmittelwert, ES ist die Effektgröße und Z ist der Z-Score, der dem tiefgestellten Wert entspricht. Verschiedene statistische Tests (z. B. t-Tests für kontinuierliche Variablen, t-Tests für Anteile, χ2 Tests, Varianzanalysetests [ANOVA] usw.) haben etwas andere Formeln für Beta, aber im Allgemeinen nimmt Beta (und damit die Wahrscheinlichkeit eines Typ-II-Fehlers) mit größeren Stichprobenumfängen und weniger restriktiven Auswahlmöglichkeiten ab Alpha, kleinere Standardabweichungen in den Daten und größere Effektstärken.
Die statistische Aussagekraft ist einfach 1–β und wird häufiger als β angegeben. Während Alpha am häufigsten auf 0.05 festgelegt wird, wird eine statistische Power von 0.8 im Allgemeinen als ausreichend für die Erkennung von Assoziationen angesehen, obwohl diese in einigen Fällen auf 0.9 erhöht wird. Während die Wahl von Alpha in einer Publikation fast immer ausdrücklich angegeben wird, bleibt es leider oft dem Kliniker überlassen, die Aussagekraft der Studie zu bestimmen, insbesondere für sekundäre Ergebnisse. Glücklicherweise sind Formeln wie z Gleichung 1 sind leicht in gängigen Lehrbüchern oder in statistischen Softwarepaketen zu finden. Darüber hinaus haben viele akademische Statistikabteilungen Online-Tools zur Berechnung der statistischen Aussagekraft bereitgestellt. Formeln wie z Gleichung 1 kann verwendet werden, um die kleinste Effektgröße zu berechnen, die eine bestimmte Studie wahrscheinlich entdecken wird. Es obliegt dann dem Kliniker zu entscheiden, ob diese Effektstärke klein genug ist, dass kleinere Effektstärken klinisch irrelevant sind. Wenn kleinere Effektstärken immer noch klinisch relevant sind, dann muss der Kliniker, der einen Signalweg entwickelt, die Möglichkeit berücksichtigen, dass es eine kleine, aber reale Effektstärke gibt, ein Typ-II-Fehler gemacht wurde, und die Best- oder Worst-Case-Szenarien entsprechend anpassen .
BEISPIELE FÜR DIE WEGENTWICKLUNG
Wir stellen nun einige veranschaulichende Beispiele der zuvor diskutierten Analyse bereit. Zunächst stellen wir ein Fallbeispiel vor, das die beschriebene Art der Analyse veranschaulicht. Dann gehen wir einige Beispiele von Medikamenten durch, die in routinemäßige chirurgische Protokolle eingeführt wurden und Patienten Schaden zufügten; Dies veranschaulicht Fallstricke bei der Pfadentwicklung. Zuletzt präsentieren wir Komponenten eines Wegs für den totalen Kniegelenkersatz.
Illustrativer Fall: Adjuvantien zur Spinalanästhesie
Angenommen, ein neuartiges Medikament (Medikament X) wurde entwickelt, das die Dauer der Spinalanästhesie verlängert, wenn es zu Bupivacain hinzugefügt wird. Ihre Gruppe führt Hüft- und Knieendoprothetik in Spinalanästhesie durch, muss aber aufgrund unerwartet langer Operationszeiten gelegentlich auf Vollnarkose umstellen. Der gesamte Gelenkpfad verwendet derzeit nur Bupivacain-Wirbelsäulen, erwägt jedoch, Medikament X zum gesamten Gelenkpfad hinzuzufügen, um die Dauer der Spinalanästhesie zu verlängern und unerwartete Umstellungen auf eine Vollnarkose zu reduzieren. Eine erste Studie verglich Spinalanästhesie mit Bupivacain mit Medikament X plus Bupivacain. mit 500 Patienten in der Behandlungsgruppe und 500 in der Kontrollgruppe. Die Studie ergab, dass eine Spinalanästhesie mit Bupivacain nur für 180 Minuten eine adäquate chirurgische Anästhesie lieferte, während Bupivacain mit Medikament X für 200 Minuten eine adäquate chirurgische Anästhesie lieferte (95 % CI 195–205 Minuten, p < 05). Zu den sekundären Endpunkten gehörten das Auftreten von Erbrechen an den postoperativen Tagen 1–3 und Harnverhalt, der eine Foley-Katheterisierung erforderte. Im Kontrollarm erbrachen 3 % und im Behandlungsarm 4 % der Patienten postoperativ, aber dieses Ergebnis war statistisch nicht signifikant. Im Kontrollarm hatten 2 % und im Behandlungsarm 3 % der Patienten einen Harnverhalt; dies war jedoch ebenfalls nicht statistisch signifikant. Das Medikament kostet 50 Dollar pro Dosis.
Analyse von Kosten und Nutzen
Selbst für eine relativ einfache (und erfundene) Frage wie diese kann eine vollständige Analyse komplex werden. Wir stellen daher eine verkürzte Version des Verfahrens vor:
- Identifizieren Sie Ziele und Behandlungsoptionen. Wir beschränken uns auf das Ziel, die Spinalanästhesie zu verlängern, um Umstellungen auf Allgemeinanästhesie zu reduzieren. Alternativen zur Aufnahme von Medikament X sollten untersucht werden. Medikament X muss nicht in einem Vakuum bewertet werden, sondern im Wettbewerb mit anderen Techniken. Beispielsweise können andere Medikamente verfügbar sein, die die Spinalanästhesie um eine vergleichbare Zeit verlängern, oder es kann eine einfache Erhöhung der Spinaldosis möglich sein, um die chirurgische Anästhesie zu verlängern. Alternativ kann die Subpopulation identifiziert werden, die wahrscheinlich eine längere Operationszeit hat, und diese Patienten könnten automatisch eine allgemeine Anästhesie erhalten oder Medikament X könnte nur für sie reserviert werden. Die Risiken und Vorteile jeder dieser Optionen müssen individuell abgewogen und mit der routinemäßigen Anwendung von Medikament X verglichen werden.
- Identifizieren Sie, wie jede Behandlung mit dem Rest des Signalwegs interagiert. Obwohl keine Einschränkungen erwähnt wurden, müssten wir bestätigen, dass die Anwendung von Medikament X keine spezielle postoperative Überwachung (wie z. wie Verzögerung der Mobilisierung) oder Änderungen an anderen Teilen des Anästhesie- und Operationswegs erfordern. Wenn Einschränkungen oder Wechselwirkungen festgestellt werden, müssen diese in Schritt 3 berücksichtigt werden.
- Identifizieren Sie Risiken, Kosten und Vorteile. Für diese Veranschaulichung beschränken wir die Analysen auf die in der Studie angesprochenen Risiken, Nutzen und Kosten. Der Hauptvorteil wäre eine verlängerte Dauer der chirurgischen Anästhesie und eine geringere Notwendigkeit, auf eine Vollnarkose umzustellen, was natürlich eine Reihe von begleitenden Risiken und Kosten mit sich bringt. Zu den Risiken gehören ein erhöhtes Risiko für Harnverhalt und postoperatives Erbrechen. Obwohl die ursprüngliche Studie keines dieser Ergebnisse mit Medikament X in Verbindung gebracht hat, werden wir in Schritt 4 sehen, dass das Worst-Case-Szenario das Risiko beinhalten muss, dass diese Studie einen Typ-II-Fehler gemacht hat. Die Kosten sind am einfachsten zu quantifizieren: Dies erhöht die Arzneimittelkosten für jede Operation um 50 USD.
- Nehmen Sie numerische Schätzungen der Risiken, Kosten und Vorteile vor, die in Schritt 3 identifiziert wurden. Die Vorteile dieses Medikaments hängen von den Besonderheiten Ihrer Einrichtung ab. Angenommen, Sie stellen beim Durchsehen Ihrer Aufzeichnungen fest, dass Sie im vergangenen Jahr 500 totale Gelenkarthroplastiken durchgeführt haben und 5 davon eine unerwartete Umstellung auf Vollnarkose erforderten. Die gesamten Operationszeiten für die fünf Fälle betrugen 195, 250, 200, 190 und 220 Minuten. Unter Verwendung des veröffentlichten Konfidenzintervalls könnte die Verwendung von Medikament X die Notwendigkeit beseitigt haben, in 2 der Fälle (wenn es die Zeit auf 195 Minuten verlängert) bis 3 der Fälle (wenn es die Zeit auf 205 Minuten verlängert) auf eine Vollnarkose umzustellen.
Die Kosten für dieses Medikament, wenn es bei allen Patienten angewendet wird, würden zusätzliche 25,000 $ pro Jahr betragen. Wenn eine Subpopulation mit hohem Risiko für die Verwendung des Medikaments identifiziert werden könnte, könnte dies möglicherweise reduziert werden. Die Studie fand keinen Zusammenhang zwischen Harnverhalt oder postoperativem Erbrechen mit Medikament X, sodass im besten Fall die Zugabe von Medikament X nicht einführt alle neuen Risiken von Komplikationen. Betrachten wir jedoch die Aussagekraft dieser Studie. Vermutlich wurden die Daten zu Harnverhalt und postoperativem Erbrechen mit einem Test auf Proportionen analysiert. Mithilfe von Online-Power-Rechnern oder Statistikpaketen können wir die Effektgröße abschätzen, die festgestellt werden würde. Geht man von einer Ausgangsrate der Harnverhaltung von 2 % aus (basierend auf dem Kontrollarm der Studie), müsste das Medikament die Rate auf 5 % bis 6 % erhöhen, um eine Potenz von etwa 0.8 zu erreichen. Niedrigere Effektstärken werden nicht zuverlässig erkannt. Bei postoperativem Erbrechen entspricht eine Potenz von 0.8 dem Medikament, das die Erbrechensrate auf 7 % erhöht. Wenn sich die Raten von postoperativem Erbrechen und Harnverhalt mehr als verdoppeln würden, würden die meisten Kliniker dies als klinisch relevanten Anstieg betrachten, der jedoch von der besprochenen Studie nicht zuverlässig erkannt werden würde. Daher müssen wir die Möglichkeit in Betracht ziehen, dass die Studie einen Typ-II-Fehler gemacht hat, und unser Worst-Case-Szenario entsprechend anpassen.
Wenn die Studie einen Typ-II-Fehler gemacht hat, was sollten wir für unsere Schätzungen der Effektgröße verwenden? Die vernünftigste Schätzung kann durch Untersuchung der Studie selbst erhalten werden; Wenn Probanden hinzugefügt werden, nähern sich die Raten ihren wahren Werten an und können schließlich eine Schwelle statistischer Signifikanz überschreiten. In der besprochenen Studie betrug das postoperative Erbrechen 3 % im Kontrollarm und 4 % im Behandlungsarm und die Harnretention 2 % im Kontrollarm und 3 % im Behandlungsarm. Wir können diese Erhöhungen verwenden, um unsere Schätzungen zu informieren.
Unter der Annahme, dass unsere Einrichtung ähnliche Erbrechensraten an den postoperativen Tagen 1–3 (3 %) und ähnliche Raten von Harnverhalt (2 %) aufweist, würden wir schätzen, dass sie auf 4 % und 3 % ansteigen würden. Bei einem Operationsvolumen von 500 Patienten pro Jahr entspricht dies 5 zusätzlichen Fällen von Harnverhalt und 5 zusätzlichen Fällen von postoperativem Erbrechen pro Jahr. - Verwenden Sie die Schätzungen, um Best- und Worst-Case-Szenarien zu erstellen. Bester Fall: Eliminieren Sie drei Umstellungen auf Vollnarkose pro Jahr. Fügen Sie 25,000 $ zu den Gesundheitskosten hinzu. Worst Case: Eliminierung von zwei Umstellungen auf Vollnarkose pro Jahr. Fügen Sie 25,000 $ zu den Gesundheitskosten hinzu. Erstellen Sie fünf zusätzliche Fälle von Harnverhalt und fünf zusätzliche Fälle von postoperativem Erbrechen. In diesem speziellen Fall stellen wir fest, dass der Nutzen des Medikaments verbessert werden kann, wenn wir eine Subpopulation, die wahrscheinlich profitieren wird, genau identifizieren können. Wenn das Medikament beispielsweise nur den 10 % der Patienten mit dem höchsten Risiko für lange Operationszeiten verabreicht wird, würden sowohl die Kosten als auch die Morbidität im Zusammenhang mit postoperativem Erbrechen und Harnverhalt um den Faktor 10 sinken identifiziert, kann die Anzahl der Umstellungen in Vollnarkose unbeeinflusst oder minimal beeinträchtigt sein.
- Wählen Sie den Weg, der dem Patienten am wahrscheinlichsten zugute kommt. Abhängig von den Risiken, die mit der Umstellung auf Vollnarkose verbunden sind, kann es sich lohnen, dieses Medikament dem Anästhesieweg hinzuzufügen oder nicht. Letztendlich ist eine klinische Beurteilung erforderlich, um eine Entscheidung zu treffen. Durch die Verwendung des diskutierten Frameworks ist der Kliniker jedoch wesentlich besser informiert, als wenn der Kliniker einfach eine Entscheidung allein auf der Grundlage seiner Intuition treffen würde.
- Verfeinern Sie kontinuierlich die Schätzungen von Risiken, Kosten und Nutzen. In diesem Szenario entspricht das jährliche chirurgische Volumen der Institution (500) der Anzahl der Patienten, die an jedem Arm der Studie beteiligt sind. Wenn die Institution ihre eigenen Komplikationsraten vor und nach der Änderung verfolgt, sollte sie in Anbetracht dessen in der Lage sein, die wahren Risiken, Vorteile und Kosten des Eingriffs schnell zu ermitteln und eine fundiertere Entscheidung zu treffen als die ursprüngliche Analyse.
Überraschenderweise ist die Zahl der in Studien eingeschlossenen Patienten in der veröffentlichten Literatur oft viel kleiner als die Zahl der Operationen, die selbst in kleinen Einrichtungen durchgeführt werden. Beispielsweise umfasste eine kürzlich durchgeführte Metaanalyse zu den Wirkungen von Spinal-Opioiden nur etwa 100–150 Probanden und Kontrollpersonen zur Analyse von postoperativem Erbrechen und Harnverhalt für intrathekales Fentanyl, trotz der langen und weit verbreiteten Verwendung von Fentanyl in der Spinalanästhesie. Aus diesem Grund ist die Analyse interner Daten oft hilfreich, um den Erfolg oder Misserfolg des Pfades zu bewerten. Die Verwendung interner Daten umgeht auch das Problem veröffentlichter Studien, bei denen geringfügig andere Patientenpopulationen, Medikamente oder Techniken als an der Heimatinstitution verwendet werden.
BEISPIELE FÜR WEGE, DIE PATIENTEN SCHÄDEN VERURSACHT HABEN
Der vorherige Abschnitt war eine hypothetische Illustration der Entwicklung eines Teils eines Signalwegs. In diesem Abschnitt nehmen wir uns einen Moment Zeit, um historische Fälle zu diskutieren, in denen Patienten durch die Einführung eines neuen Medikaments im Rahmen der routinemäßigen perioperativen Versorgung geschädigt wurden. Obwohl diese Medikamente eingeführt wurden, bevor die Vorstellung von chirurgischen und anästhetischen Pfaden üblich wurde, bietet die Erfahrung mit diesen Medikamenten einen Einblick in einige der Gefahren der Anwendung neuer Behandlungen bei großen Patientenkohorten.
Enoxaparin und venöse Thromboembolie-Prophylaxe
Enoxaparin war das erste Heparin mit niedrigem Molekulargewicht, das von der US-amerikanischen Food and Drug Administration für den allgemeinen Gebrauch zugelassen wurde. Kurz nach der Zulassung des Medikaments im Mai 1993 trat es in die weitverbreitete Routineanwendung als Prophylaxe für venöse Thromboembolien ein. Da viele orthopädische Operationen, einschließlich totaler Gelenkarthroplastik, ein hohes Risiko für venöse Thromboembolien darstellen und Epidural- oder Spinalanästhesie häufig das bevorzugte Anästhetikum für diese Fälle war, wurde Enoxaparin häufig in Verbindung mit neuraxialer Anästhesie verwendet.
Vor der Entwicklung von Enoxaparin wurde unfraktioniertes subkutanes Heparin häufig zur Prophylaxe von venösen Thromboembolien verwendet. Während das Risiko eines epiduralen Hämatoms im Zusammenhang mit der Verabreichung von Enoxaparin zunächst als vergleichbar mit dem einer subkutanen Heparinverabreichung eingeschätzt wurde, waren die pharmakologischen Unterschiede zwischen niedermolekularem und unfraktioniertem Heparin unterschätzt worden.
Kurz nach der Einführung erhielt die US Food and Drug Administration Berichte über epidurale Hämatome im Zusammenhang mit der Verabreichung von Enoxaparin. Im Dezember 1997 gab die Regierung eine öffentliche Gesundheitsberatung heraus, in der sie feststellte, dass sie über 30 Berichte über postneuraxiale epidurale Hämatome im Zusammenhang mit Enoxaparin erhalten hatte, und verlangte, dass Enoxaparin mit einer Black-Box-Warnung versehen ist, die auf ein erhebliches Risiko einer Schädigung des Patienten hinweist. Bis April 1998 war die Zahl der Berichte auf mehr als 40 gestiegen. Die US-amerikanische Food and Drug Administration wandte sich an die American Society of Regional Anästhesie und Schmerzmedizin, um neue Richtlinien für die Verwendung von Enoxaparin mit neuraxialer Anästhesie zu entwickeln. Diese Richtlinien wurden im November 1998 veröffentlicht und empfahlen eine viel konservativere Anwendung von Enoxaparin.
Aprotinin und Reduktion perioperativer Transfusionen
Aprotinin ist ein kleines Peptidmolekül, das als Antifibrinolytikum wirkt, indem es Trypsin und verwandte proteolytische Enzyme hemmt. Es wurde am häufigsten in der Herzchirurgie eingesetzt, wo sich gezeigt hat, dass es den Transfusionsbedarf erheblich reduziert, und seine Verwendung wurde bei anderen Arten von Operationen, wie z. B. orthopädischen Eingriffen, untersucht. Obwohl eine Metaanalyse kein erhöhtes Risiko für Mortalität, Myokardinfarkt oder Nierenversagen zeigte, widersprachen große Beobachtungsstudien diesen Ergebnissen und zeigten ein erhöhtes Risiko für postoperatives Nierenversagen. Weitere Beobachtungsstudien konzentrierten sich auf die Langzeitnachsorge und bestätigten eine erhöhte Morbidität und Mortalität im Zusammenhang mit Aprotinin, insbesondere nicht nur im Hinblick auf Nierenversagen, sondern auch auf Schlaganfall, Tod und nicht tödlichen Myokardinfarkt. Der Verkauf von Aprotinin wurde 2008 eingestellt; Aprotinin wurde weitgehend durch Tranexamsäure und Aminocapronsäure ersetzt. Es bleibt umstritten, ob die beobachtete Zunahme der Niereninsuffizienz auf die Wirkung von Aprotinin oder auf einen anderen Confounder zurückzuführen ist.
Diskussion
In beiden Beispielen resultierte ein erheblicher Patientenschaden aus der Einführung eines neuen Medikaments in einen Anästhesie- und chirurgischen Pfad, da nicht genügend Daten vorlagen, um auf das Potenzial für Patientenschäden hinzuweisen. Risiken wurden erst sichtbar, nachdem eine größere Anzahl von Patienten behandelt wurde und signifikante Patientenkomplikationen aufgetreten waren.
Im ersten Fall, niedermolekulare Heparine und neuraxiale Anästhesie, war die Schwierigkeit, den Schaden für den Patienten vorherzusagen, zum großen Teil auf die extrem geringe Häufigkeit des unerwünschten Ereignisses zurückzuführen. Geht man davon aus, dass das Ausgangsrisiko für ein spinales Hämatom 1:150,000 beträgt, erfordert selbst ein relativ starker Anstieg des Hämatomrisikos große Stichprobenumfänge, um ein erhöhtes Risiko zu erkennen. Stichprobengrößen dieser Größe können vor der Einführung eines Medikaments oft nicht realistisch erfasst werden, und nur die Überwachung nach der Zulassung oder die Entwicklung hochwertiger klinischer Register werden solche ungewöhnlich seltenen, aber möglicherweise katastrophalen unerwünschten Ereignisse erkennen.
Im zweiten Fall, Aprotinin und Nierenversagen, können mehrere Faktoren identifiziert werden. Erste Untersuchungen konzentrierten sich nicht auf ein erhöhtes Risiko für Nierenversagen und entweder untersuchten sie dieses Risiko nicht oder die Studie war zu schwach. Darüber hinaus glaubten einige, dass die mit Aprotinin verbundenen Komplikationen vorübergehender Natur seien und dass mit Aprotinin keine langfristigen Risiken verbunden seien. Offensichtlich konnte dies erst Jahre nach dem Einsatz von Aprotinin untersucht werden.
Diese Fälle verdeutlichen die Risiken, die mit neuen Therapeutika oder alten Therapeutika verbunden sind, die in neuen Situationen verwendet werden. Vorstudien können die falschen Risiken untersuchen oder zu schwach sein, oder Risiken können langfristig sein und erst lange nach dem Studienzeitraum offensichtlich werden. Vor diesem Hintergrund muss der Kliniker bei der Abwägung von Risiken und Nutzen für den Patienten auch unbekannte oder nicht quantifizierte Risiken berücksichtigen und den Wirkstoff nur dann einbeziehen, wenn das Verhältnis von bekannten, quantifizierbaren Risiken und Vorteilen überwiegend positiv ist. Bei Arzneimitteln mit langer Anwendungsgeschichte und genau definierten Risiken ist weniger Vorsicht geboten.
KOMPONENTEN EINES VOLLSTÄNDIGEN PATHWAYS: TOTAL KNEE ARTHROPLASTY
In diesem Abschnitt stellen wir Komponenten eines chirurgischen Pfads für die totale Knieendoprothetik vor. Dies ist in gezeigt Tabelle 4. Anstatt jedoch endgültige Empfehlungen zu präsentieren (wie dies bei einem abgeschlossenen Behandlungspfad der Fall wäre), heben wir die allgemeinen Probleme hervor, die bei der Entwicklung verschiedener Aspekte des Behandlungspfads auftreten, sowie Medikamente und Techniken, die häufig eingesetzt werden. Dies geschieht, um zu vermeiden, dass es einen endgültigen Konsens über den „richtigen“ Weg für die totale Gelenkendoprothetik gibt – selbst wenn ein solcher Konsens existierte, würde er schnell veraltet sein, wenn neue Studien, Medikamente und Techniken verfügbar werden. Anbieter mit unterschiedlichen Patientenpopulationen und unterschiedlichen Fachgebieten können unterschiedliche Behandlungspfade entwickeln, die für ihre Einrichtung geeignet sind.
TABELLE 4
| Anästhesieweg für die totale Gelenkendoprothetik |
|---|
| Ziele des Weges Die Ziele des Behandlungspfads sollten klar angegeben werden und umfassen üblicherweise die Verringerung von Mortalität, Morbidität und Kosten; Steigerung der Patientenzufriedenheit; und verbesserte Schmerzkontrolle. Die Ziele sollten nach Möglichkeit reale klinische Endpunkte umfassen und unabhängig von den Mitteln sein, z. B. ist die Reduzierung der postoperativen Schmerzwerte ein angemesseneres Ziel als die Reduzierung des postoperativen Opioidkonsums. |
| Patientenauswahl Modifizierbare Risikofaktoren wie Rauchen, schlecht kontrollierter Diabetes, Fettleibigkeit und Freizeitdrogenkonsum können die Rate chirurgischer Komplikationen beeinflussen. Der Weg kann ansprechen, wann eine Operation verschoben werden sollte, um diese Faktoren anzugehen. Darüber hinaus können nicht modifizierbare Komorbiditäten ein inakzeptables chirurgisches Risiko darstellen; Kriterien für die Patientenauswahl können in einem Pfad enthalten sein. Dies muss natürlich mit der Orthopädie abgestimmt werden. |
| Präoperative Ausbildung und Planung vor der Aufnahme Häufig werden die Patienten routinemäßig in einer präoperativen Anästhesieklinik gesehen. Dieser Teil des Behandlungspfads bietet die Möglichkeit, Patientenmerkmale zu identifizieren, die im Widerspruch zu den Standardelementen des Anästhesiepfads stehen, und präoperativ darauf einzugehen. Beispielsweise kann ein Patient mit einer Penicillin-Allergie einen Haut-Prick-Test erhalten, um festzustellen, ob dem Patienten Cephalosporine verabreicht werden können. Wenn der Weg kontinuierliche periphere Nervenkatheter umfasst, kann dies außerdem eine Gelegenheit zur Patientenaufklärung bieten. |
| Checkliste vor dem Eingriff Dieser Teil des Behandlungspfads umfasst häufig die Patientenidentifikation, Standortmarkierung, Bestätigung von Allergien und Komorbiditäten, Bestätigung der Verfügbarkeit von Blutprodukten, Bestätigung des Antikoagulationsstatus und abschließende Überprüfung der Laborwerte. |
| Orale Prämedikation/multimodale Analgesie Die Optimierung der Schmerzkontrolle muss mit unerwünschten Nebenwirkungen wie übermäßiger Sedierung abgewogen werden. Im Folgenden werden häufig verwendete Mittel mit ihren Vor- und Nachteilen aufgeführt. |
| Makler | Benefits | Nachteile |
|---|---|---|
| Acetaminophen | Reduzieren Sie die postoperativen Schmerzwerte, Opioid-Einsparung | Hepatotoxizität |
| Gabapentin/Pregabalin | Reduzieren Sie postoperative Schmerzwerte, Opioid-Einsparung, kann das Auftreten chronischer postoperativer Schmerzen verringern und haben einen Nutzen bei Patienten mit bestehenden chronischen Schmerzen | Erhöhte Sedierung, insbesondere bei älteren Menschen; verstärkte Atemdepression bei Dosen > 300 mg |
| Cyclooxygenase-2-Hemmer | Reduzieren Sie die postoperativen Schmerzwerte, Opioid-Einsparung | Nierenfunktionsstörung; Evidenzbasis durch zurückgezogene Veröffentlichungen geschwächt |
| Orale Opioide (z. B. Oxycodon SR) | Reduzieren Sie die postoperativen Schmerzwerte | Erhöhtes Risiko einer Atemdepression bei einer Oxycodon-Dosis > 10 mg |
| Anästhesieweg für die totale Gelenkendoprothetik |
|---|
| Einsatz von Regionalanästhesie zur postoperativen Schmerzkontrolle Es gibt ein breites Spektrum regionaler Anästhesietechniken im Zusammenhang mit Knietotalendoprothetik, zusammen mit erheblichen Unterschieden in Kosten und Wirksamkeit. Die Wahl der Technik wirkt sich auf andere Elemente des anästhetischen und chirurgischen Wegs aus. Darüber hinaus entwickeln sich Ansätze schnell weiter, da neue Techniken, Geräte und Wirkstoffe verfügbar werden. Im Folgenden sind gängige Stellen für die Regionalanästhesie mit Vor- und Nachteilen aufgeführt. |
| Technik | Benefits | Nachteile |
|---|---|---|
| Epidurale Blockade | Gilt als Goldstandard für die postoperative Analgesie bei einer Reihe von Operationen | Das Nebenwirkungsprofil kann moderne Behandlungspfade und ein geringes Risiko für katastrophale Folgen (z. B. Epiduralhämatom) beeinträchtigen. |
| Femorale Nervenblockade | Lindert die meisten postoperativen Schmerzen, ohne die Nachteile der Epiduralanästhesie,; in einer Studie mit verbesserten Ergebnissen nach 6 Wochen verbunden | Muskelschwäche kann die Rehabilitation beeinträchtigen. Geringes Risiko (2–4 von 10,000) einer langfristigen Nervenverletzung, Die Wahl des Anästhetikums insgesamt ändert jedoch das Risiko einer Nervenverletzung. |
| Blockade des Ischiasnervs | Reduzierte hintere Knieschmerzen | Risiko einer Neuropathie ähnlich einer Femoralnervenblockade. Die Ergebnisse der Studien variieren und reichen von der Verbesserung der Analgesie bis zur Frühmobilisierung wenig oder keine Analgesie zu einer bestehenden femoralen Blockade hinzuzufügen. Die Verwendung von Ischiasblockaden ist umstritten und es ist unwahrscheinlich, dass sie die langfristigen Ergebnisse verbessern. |
| Selektive tibiale Nervenblockade | Reduzierte Wahrscheinlichkeit eines Fußabfalls | Injektion näher an der Kniekehle; Risiko einer Peronaeus-Nerv-Verletzung bei lateral-medialem Zugang oder Gefäßverletzung. |
| Adduktorenkanal | Ähnliche Schmerzlinderung wie bei einer N. femoralis-Blockade mit reduzierter Muskelschwäche; wirksam bei der Behandlung bestehender starker Schmerzen | Näher an der Operationsstelle; sich entwickelnde Technik. |
| Lokale Infiltrationsanalgesie | Einfach und schnell durchzuführen, keine Muskelschwäche | Evidenz für die Wirksamkeit in diesem Zusammenhang. Experten weisen jedoch auf die schlechte Qualität einiger der vorhandenen Studien hin. Erfolg der Technik wahrscheinlich bedienerabhängig. Assoziiert mit transienter Peronaeuslähmung. |
| Sobald eine Stelle oder Stellen für die Regionalanästhesie ausgewählt sind, kann der Anbieter verschiedene Techniken anwenden, um eine postoperative Analgesie zu erhalten, die im Folgenden zusammengefasst wird. | ||
| Single shot | Schnell durchzuführen; kostengünstig; Wirksam. | Kürzeste Dauer (kann von Vorteil sein, wenn eine schnelle Wiederherstellung der Muskelkraft für die Physiotherapie erforderlich ist). |
| Nervenkatheter | Verbesserte Analgesie im Vergleich zur Einzelinjektionstechnik. Längste Analgesiedauer; titrierbar; Kontrolle über den Grad der Motorblockierung durch Änderung der Durchflussrate. | Schwieriger und zeitaufwendiger durchzuführen; teurer; erfordert eine postoperative Überwachung. |
| Retardformulierungen von Lokalanästhetika (z. B. liposomales Bupivacain) | So schnell wie ein Single-Shot-Block, mit längerer Blockdauer. | Im Vergleich zu Bupivacain derzeit wenig Wirksamkeitsnachweis. Teuer. Schränkt die Möglichkeit ein, Blocks zu wiederholen. Sicherheits- und Nebenwirkungsprofil, das sich derzeit herausbildet. |
| Chirurgische Anästhesie Optionen für die chirurgische Anästhesie werden als nächstes zusammengefasst. |
||
| Anästhesie | Benefits | Nachteile |
|---|---|---|
| Spinale | Verbunden mit verbesserten Ergebnissen, verringerte Anforderungen an Intensivpflegedienste. | Kann bei bestimmten Patienten technisch schwierig sein. Gelegentlich katastrophale Folgen (z. B. Epiduralhämatom). Die Dauer der Spinalanästhesie kann für die Operation unzureichend sein. Die Patienten zögern möglicherweise, für die Operation „wach“ zu sein |
| Epidural | Ähnliche Vorteile wie für die Wirbelsäule, kann jedoch für postoperative Analgesie und länger andauernde Operationen verwendet werden. | Kann bei bestimmten Patienten technisch schwierig sein. Gelegentliche katastrophale Folgen (z Epiduralhämatom). Die Patienten zögern möglicherweise, für die Operation „wach“ zu sein. |
| Allgemeines | Vollständige Amnesie. | Verbunden mit schlechten Ergebnissen im Vergleich zu spinal. Gelegentliches katastrophales Ergebnis (z. B. schwieriger Atemweg); erhöhtes Risiko einer Atemdepression. |
| Neuraxiale Anästhesie wurde mit verbesserten Ergebnissen in Verbindung gebracht; diese Modalität ist jedoch nicht immer die bevorzugte Modalität. Wenn eine neuraxiale Anästhesie angewendet wird, müssen Entscheidungen über den Einschluss oder Ausschluss von lang- oder kurzwirksamen Opioiden getroffen werden; Diese Entscheidung kann komplex sein, da sie viele nachfolgende Pfadelemente betrifft (postoperative Überwachung, Rehabilitation usw.). Selbst Patienten, die eine neuraxiale Anästhesie erhalten, benötigen normalerweise eine Sedierung, und einige Wege können die gewünschten Mittel oder Sedierungsgrade spezifizieren, teilweise um eine übermäßige Sedierung der Patienten zu vermeiden. Darüber hinaus sind einige Patienten wahrscheinlich nicht für eine neuraxiale Anästhesie geeignet, beispielsweise aufgrund der erwarteten Operationszeit für Gelenkrevisionen; Diese und andere Kriterien (z. B. schwierige Wirbelsäule) für die Einleitung einer Vollnarkose können in diesem Abschnitt beschrieben werden. | ||
| Intraoperative Medikamente Zu den intraoperativen Arzneimitteln können Antibiotika der ersten und zweiten Wahl, bevorzugte Antiemetika für die Spinalanästhesie gegenüber der Vollnarkose und bevorzugte Sedativa gehören, wenn eine Spinal- oder Epiduralanästhesie gewählt wird. Die Antikoagulation wird in der Regel in der postoperativen Phase vom OP-Team begonnen, kann aber hier kommentiert werden. Bemerkenswerterweise scheint intraoperatives Dexamethason die postoperativen Schmerzwerte zu verbessern und ein wirksames Antiemetikum bereitzustellen, ohne das Infektionsrisiko oder andere perioperative Komplikationen zu erhöhen. |
| Anästhesieweg für die totale Gelenkendoprothetik |
|---|
| Intraoperative Transfusionsziele und Blutkonservierungsmöglichkeiten Bluttransfusionen haben eine Reihe von Risiken,53 und eines der Ziele des Weges kann darin bestehen, den Blutverlust und damit den Transfusionsbedarf zu minimieren. Eine Vielzahl von Techniken kann den Blutverlust minimieren, von denen einige im Folgenden zusammengefasst werden. |
| Technik | Benefits | Nachteile |
|---|---|---|
| Intraoperative Hypotonie | Reduzierter Blutverlust. | Erhöhte Wachsamkeit und Überwachung erforderlich. Risiko einer Endorganischämie. Eine unzureichende Reanimation kann zu einer postoperativen orthostatischen Intoleranz beitragen und die Frühmobilisierung beeinträchtigen. |
| Tourniquet-Verwendung | Reduzierter Blutverlust und Protokolle für eine angemessene Verwendung sind vorhanden. | Risiko einer ischämischen Verletzung oder axonalen Neuropathie oder Wirkung auf die Quadrizepsfunktion. |
| Angemessene Thermoregulation | Reduzierter Blutverlust durch Aufrechterhaltung der Gerinnungskaskade, verbesserte Erholung. | |
| Zellreinigung | Reduzierte Anforderungen an allogene Blutprodukte. | Zusätzliche Kosten und Komplexität. |
| Reinfusionsabläufe | Reduzierte Anforderungen an allogene Blutprodukte. | Zusätzliche Kosten und Komplexität. |
| Tranexamsäure | Reduzierter Blutverlust durch Antifibrinolyse. | Assoziation mit Anfällen. Kein bekanntes erhöhtes Risiko für thrombotische Ereignisse, wird aber erst seit kurzem in dieser chirurgischen Population eingesetzt. |
| Postoperative Schmerzkontrolle Pathways befassen sich häufig mit der Schmerzkontrolle bei Patienten mit chronischen Schmerzen oder Opioidkonsum sowie bei Patienten ohne. Im Allgemeinen kommentiert dieser Abschnitt sowohl die erwarteten Infusionsraten für alle peripheren Nervenkatheter als auch Adjuvantien wie patientenkontrollierte Opioidverabreichung, Ketamin oder andere Wirkstoffe. |
||
| Überlegungen zum orthopädischen Operationsweg Pfade kommentieren manchmal die Art und Weise, wie sie mit dem Pfad des Chirurgen interagieren, um deutlich zu machen, warum bestimmte Empfehlungen ausgesprochen werden. |
||
Die einzelnen Elemente des Pfades umfassen so unterschiedliche Themen wie präoperative Planung, Patientenaufklärung, intraoperatives Anästhesiemanagement, postoperatives Schmerzmanagement sowie Flüssigkeits- und hämodynamische Ziele. Ein abgeschlossener Behandlungspfad würde zusätzlich zu festen, detaillierten Empfehlungen zum Management einen Anhang enthalten, der die Evidenz umreißt, die verwendet wurde, um Behandlungspfadentscheidungen zu treffen. Wie wir jedoch gesehen haben, ist selbst nach der Identifizierung der geeigneten Literatur oft eine beträchtliche Menge an Analyse und Urteilsvermögen erforderlich, um die Literatur auf den Pfad anzuwenden.
Ein endgültiger Pfad ist nur dann sinnvoll, wenn er breit an alle relevanten Anbieter verteilt wird. Neben der elektronischen Verteilung können Pfade in Form eines Posters angezeigt werden. Dies ermöglicht es dem Anästhesieanbieter, die Schritte des Behandlungspfads in verschiedenen Phasen der Patientenversorgung leicht verfügbar zu haben. Häufige Orte zum Anzeigen von Pfadinformationen sind präoperative Bereiche, Regionalanästhesiekabinen, Operationssäle und Anästhesiearbeitsräume. Darüber hinaus haben viele Institutionen mit dem Aufkommen elektronischer Gesundheitsaufzeichnungssysteme die Möglichkeit, Anordnungssätze zu erstellen, die automatisch Anordnungen erstellen, die mit dem Pfad verbunden sind.
FAZIT
Perioperative Anästhesie- und Analgesiepfade bieten eine einzigartige Möglichkeit, die Patientenversorgung zu verbessern und die Kosten zu senken, indem vorhandene Ressourcen und Technologien auf evidenzbasierte Weise eingesetzt werden. Die Pathway-Entwicklung sollte daher als wesentlicher Bestandteil der Praxis des Anästhesisten betrachtet werden.
REFERENZEN
- Pugely AJ, Martin CT, Gao Y, Mendoza-Lattes S, Callaghan JJ: Unterschiede bei kurzfristigen Komplikationen zwischen Spinal- und Vollnarkose bei primärer Knie-Totalendoprothetik. J Bone Joint Surg Am 2013;95(3):193–199.
- Memtsoudis SG, Sun X, Chiu YL, et al. Perioperative vergleichende Wirksamkeit der Anästhesietechnik bei orthopädischen Patienten. Anesthesiology 2013;118(5):1046–1058.
- Stundner O, Chiu YL, Sun X, et al: Vergleichende perioperative Ergebnisse im Zusammenhang mit neuraxialer versus Vollnarkose bei simultaner bilateraler Knie-Totalendoprothetik. Reg Anesth Pain Med 2012;37(6):638–644.
- Memtsoudis SG, Stundner O, Rasul R, et al: Schlafapnoe und Totalgelenkarthroplastik unter verschiedenen Anästhesiearten: Eine bevölkerungsbezogene Studie zu perioperativen Ergebnissen. Reg Anesth Pain Med 2013;38(4):274–281.
- Liu J, Ma C, Elkassabany N, Fleisher LA, Neuman MD: Die neuroaxiale Anästhesie verringert das postoperative systemische Infektionsrisiko im Vergleich zur Vollnarkose bei der Knieendoprothetik. Anesth Analg 2013;117(4):1010–1016.
- Rotter T, Kinsman L, James E, et al: Klinische Wege: Auswirkungen auf die Berufspraxis, Patientenergebnisse, Aufenthaltsdauer und Krankenhauskosten. Cochrane Database Syst Rev. 2010(3):CD006632.
- Shiboski S. Epidemiologie und Biostatistik. 2015. http://www.epibiostat.ucsf.edu/biostat/samplesize.html. Abgerufen am 30. Juni 2015.
- Brant R. Berechnungen der Stichprobengröße. 2015. http://www.stat.ubc.ca/~rollin/stats/ssize/. Abgerufen am 30. Juni 2015.
- Popping DM, Elia N., Marret E., Wenk M., Tramer MR: Opioide zu Lokalanästhetika für intrathekale Einzelschussanästhesie bei Patienten, die sich einer kleineren Operation unterziehen: Eine Metaanalyse randomisierter Studien. Schmerz 2012;153(4):784–793.
- Horlocker TT, Wedel DJ: Neuraxialer Block und niedermolekulares Heparin: Balance zwischen perioperativer Analgesie und Thromboseprophylaxe. Reg Anesth Pain Med 1998;23(6 Suppl 2):164–177.
- Nachtigall SL. Von der Food and Drug Administration. JAMA 1999;282(1):19.
- Wysowski DK, Talarico L, Bacsanyi J, Botstein P: Spinales und epidurales Hämatom und niedermolekulares Heparin. N. Engl. J. Med. 1998;338(24):1774–1775.
- Bidstrup BP, Royston D, Sapsford RN, Taylor KM: Reduzierung des Blutverlustes und des Blutverbrauchs nach kardiopulmonalem Bypass mit hochdosiertem Aprotinin (Trasylol). J Thorac Cardiovasc Surg 1989;97(3):364–372.
- Royston D, Bidstrup BP, Taylor KM, Sapsford RN: Wirkung von Aprotinin auf die Notwendigkeit einer Bluttransfusion nach wiederholter Operation am offenen Herzen. Lancet 1987;2(8571):1289–1291.
- Mahdy AM, Webster NR: Perioperative systemische Hämostatika. Br. J. Anaesth 2004;93(6):842–858.
- Shiga T, Wajima Z, Inoue T, Sakamoto A: Aprotinin in der großen orthopädischen Chirurgie: Eine systematische Überprüfung randomisierter kontrollierter Studien. Anesth Analg 2005;101(6):1602–1607.
- Sedrakyan A, Treasure T, Elefteriades JA: Wirkung von Aprotinin auf klinische Ergebnisse bei Koronararterien-Bypass-Chirurgie: Eine systematische Überprüfung und Metaanalyse randomisierter klinischer Studien. J Thorac Cardiovasc Surg 2004;128(3):442–448.
- Mangano DT, Tudor IC, Dietzel C, Multicenter Study of Perioperative Ischemia Research G, Ischemia R, Education F: Das mit Aprotinin verbundene Risiko in der Herzchirurgie. N. Engl. J. Med. 2006;354(4):353–365.
- Shaw AD, Stafford-Smith M, White WD, et al.: Die Wirkung von Aprotinin auf das Ergebnis nach Koronararterien-Bypass-Operation. N. Engl. J. Med. 2008;358(8):784–793.
- Mangano DT, Miao Y, Vuylsteke A, et al: Mortalität im Zusammenhang mit Aprotinin während 5 Jahren nach Koronararterien-Bypass-Operation. JAMA 2007;297(5):471–479.
- Furnary AP, Wu Y, Hiratzka LF, Grunkemeier GL, Seite US 3rd: Aprotinin erhöht nicht das Risiko einer Niereninsuffizienz bei Herzoperationspatienten. Auflage 2007;116(11 Suppl):I127–I133.
- Schroeder DR: Statistik: Erkennung einer seltenen unerwünschten Arzneimittelwirkung anhand von Spontanmeldungen. Reg Anesth Pain Med 1998;23(6 Suppl 2):183–189.
- Peersman G., Laskin R., Davis J., Peterson M.: Infektion bei Knietotalendoprothesen: Eine retrospektive Überprüfung von 6489 Knietotalprothesen. Clin Orthop Relat Res 2001(392):15–23.
- Zhou TJ, Tang J, White PF: Propacetamol versus Ketorolac zur Behandlung akuter postoperativer Schmerzen nach Hüft- oder Kniegelenkersatz. Anesth Analg 2001;92(6):1569–1575.
- Mishriky BM, Waldron NH, Habib AS: Einfluss von Pregabalin auf akute und anhaltende postoperative Schmerzen: Eine systematische Überprüfung und Metaanalyse. Br J Anaesth. 2015;114(1):10–31.
- Clarke H, Bonin RP, Orser BA, Englesakis M, Wijeysundera DN, Katz J: Die Prävention chronischer postoperativer Schmerzen mit Gabapentin und Pregabalin: Eine kombinierte systematische Überprüfung und Metaanalyse. Anesth Analg 2012;115(2):428–442.
- Sawan H, Chen AF, Viscusi ER, Parvizi J, Hozack WJ: Pregabalin reduziert den Opioidverbrauch und verbessert das Ergebnis bei Patienten mit chronischen Schmerzen, die sich einer totalen Knieendoprothetik unterziehen. Phys Sportsmed 2014;42(2):10–18.
- Weingarten TN, Jacob AK, Njathi CW, Wilson GA, Sprung J: Multimodales Analgetikaprotokoll und Atemdepression nach der Anästhesie während der Erholungsphase I nach totaler Gelenkarthroplastik. Reg Anesth Pain Med 2015;40(4):330–336.
- Lin J, Zhang L, Yang H: Perioperative Verabreichung von selektiven Cyclooxygenase-2-Inhibitoren zur postoperativen Schmerzbehandlung bei Patienten nach Knie-Totalendoprothetik. J Endoprothetik. 2013;28(2):207–213e2.
- Rothwell MP, Pearson D, Hunter JD, et al: Orales Oxycodon bietet gleichwertige Analgesie wie intravenöse patientenkontrollierte Analgesie nach totalem Hüftersatz: Eine randomisierte, monozentrische, nicht verblindete Studie zur Nichtunterlegenheit. Br. J. Anaesth 2011;106(6):865–872.
- Pumberger M, Memtsoudis SG, Stundner O, et al: Eine Analyse der Sicherheit der epiduralen und spinalen neuraxialen Anästhesie bei mehr als 100,000 aufeinanderfolgenden großen Gelenkersatzoperationen an den unteren Extremitäten. Reg Anesth Pain Med 2013;38(6):515–519.
- Bateman BT, Mhyre JM, Ehrenfeld J, et al: Das Risiko und die Ergebnisse von epiduralen Hämatomen nach perioperativer und geburtshilflicher Epiduralkatheterisierung: Ein Bericht des Multicenter Perioperative Outcomes Group Research Consortium. Anesth Analg 2013;116(6):1380–1385.
- Paul JE, Arya A, Hurlburt L, et al: Femoralnervblock verbessert die Analgesie-Ergebnisse nach Knie-Totalendoprothetik: Eine Meta-Analyse randomisierter kontrollierter Studien. Anesthesiology 2010;113(5):1144–1162.
- Carli F, Clemente A, Asenjo JF, et al: Analgesie und funktionelles Ergebnis nach totaler Knieendoprothetik: Periartikuläre Infiltration vs. kontinuierliche femorale Nervenblockade. Br. J. Anaesth 2010;105(2):185–195.
- Neal JM, Barrington MJ, Brull R, et al: Die zweite ASRA-Praxisberatung zu neurologischen Komplikationen im Zusammenhang mit Regionalanästhesie und Schmerzmedizin, Zusammenfassung 2015. Reg Anesth Pain Med 2015;40(5):401–430.
- Jacob AK, Mantilla CB, Sviggum HP, Schroeder DR, Pagnano MW, Hebl JR: Perioperative Nervenverletzung nach totaler Knieendoprothetik: Regionalanästhesierisiko während einer 20-jährigen Kohortenstudie. Anesthesiology 2011;114(2):311–317.
- Sato K., Adachi T., Shirai N., Naoi N.: Kontinuierliche versus Einzelinjektions-Ischiasnervenblockade zusätzlich zur kontinuierlichen Femoralnervenblockade zur Analgesie nach totaler Knieendoprothetik: Eine prospektive, randomisierte, doppelblinde Studie. Reg Anesth Pain Med 2014;39(3):225–229.
- 38. G. Cappelleri, D. Ghisi, A. Fanelli, A. Albertin, F. Somalvico, G. Aldegheri: Verbessert die kontinuierliche Blockade des Ischiasnervs die postoperative Analgesie und die frühe Rehabilitation nach Knietotalendoprothetik? Eine prospektive, randomisierte, doppelblinde Studie. Reg Anesth Pain Med 2011;36(5):489–492.
- Abdallah FW, Chan VW, Gandhi R, Koshkin A, Abbas S, Brull R: Die analgetischen Wirkungen einer proximalen, distalen oder fehlenden Ischiasnervenblockade auf hintere Knieschmerzen nach Knietotalendoprothetik: Eine doppelblinde, placebokontrollierte, randomisierte Studie. Anesthesiology 2014;121(6):1302–1310.
- Safa B, Gollish J, Haslam L, McCartney CJ: Vergleich der Auswirkungen einer Single-Shot-Blockade des Ischiasnervs im Vergleich zur Lokalanästhesieinfiltration mit hinterer Kapsel auf die Analgesie und das funktionelle Ergebnis nach einer Knietotalendoprothetik: eine prospektive, randomisierte, doppelblinde, kontrollierte Studie. J Arthroplasty 2014;29(6):1149–1153.
- Wegener JT, van Ooij B, van Dijk CN, et al: Langfristige Schmerzen und funktionelle Behinderung nach Knietotalendoprothetik mit und ohne Einzelinjektion oder kontinuierlicher Ischiasnervblockade zusätzlich zu kontinuierlicher Femoralnervenblockade: A prospektiv, 1 Jahr Follow-up einer randomisierten kontrollierten Studie. Reg Anesth Pain Med 2013;38(1):58–63.
- Sinha SK, Abrams JH, Arumugam S, et al.: Eine Femoralnervenblockade mit selektiver Tibianervblockade bietet eine wirksame Analgesie ohne Fußheber nach einer Knietotalendoprothetik: Eine prospektive, randomisierte, beobachterblinde Studie. Anesth Analg 2012;115(1):202–206.
- Jaeger P, Zaric D, Fomsgaard JS, et al.: Blockade des Adduktorenkanals versus Blockade des N. femoralis zur Analgesie nach totaler Knieendoprothetik: Eine randomisierte, doppelblinde Studie. Reg Anesth Pain Med 2013;38(6):526–532.
- Jaeger P, Grevstad U, Henningsen MH, Gottschau B, Mathiesen O, Dahl JB: Wirkung einer Adduktorenkanalblockade auf etablierte, schwere postoperative Schmerzen nach Knietotalendoprothetik: Eine randomisierte Studie. Acta Anaesth Scand 2012;56(8):1013–1019.
- Andersen LO, Kehlet H: Analgetische Wirksamkeit der lokalen Infiltrationsanalgesie in der Hüft- und Knieendoprothetik: Eine systematische Übersicht. Br. J. Anaesth 2014;113(3):360–374.
- Tsukada S, Wakui M, Hoshino A: Postoperative Epiduralanalgesie im Vergleich mit intraoperativer periartikulärer Injektion zur Schmerzkontrolle nach Knietotalendoprothetik unter Spinalanästhesie: Eine randomisierte kontrollierte Studie. J Bone Joint Surg Am 2014;96(17):1433–1438.
- Bingham AE, Fu R, Horn JL, Abrahams MS: Kontinuierliche periphere Nervenblockade im Vergleich zur peripheren Nervenblockade mit Einzelinjektion: Eine systematische Überprüfung und Metaanalyse randomisierter kontrollierter Studien. Reg Anesth Pain Med 2012;37(6):583–594.
- Schroer WC, Diesfeld PG, LeMarr AR, Morton DJ, Reedy ME: Kontrolliert liposomales Bupivacain mit verlängerter Freisetzung Schmerzen besser als Bupivacain nach TKA? Eine prospektive, randomisierte klinische Studie. J Arthroplasty 2015;30(9 Suppl):64–67.
- Ilfeld BM, Viscusi ER, Hadzic A, et al: Sicherheits- und Nebenwirkungsprofil von Liposom Bupivacain (Exparel) bei peripheren Nervenblockaden. Reg Anesth Pain Med 2015;40(5):572–582.
- Memtsoudis SG, Sun X, Chiu YL, et al: Inanspruchnahme von Intensivpflegediensten bei Patienten, die sich einer totalen Hüft- und Knieendoprothetik unterziehen: Epidemiologie und Risikofaktoren. Anesthesiology 2012;117(1):107–116.
- Fleischut PM, Eskreis-Winkler JM, Gaber-Baylis LK,et al: Variabilität in der anästhetischen Versorgung bei totaler Knieendoprothetik: Eine Analyse des Anästhesie-Qualitätsinstituts. Am J Med Qual 2015;30(2):172–179.
- Backes JR, Bentley JC, Politi JR, Chambers BT: Dexamethason reduziert die Dauer des Krankenhausaufenthalts und verbessert postoperative Schmerzen und Übelkeit nach Totalgelenksendoprothetik: Eine prospektive, randomisierte, kontrollierte Studie. J Arthroplasty 2013;28(8 Suppl):11–17.
- Goodnough LT: Risiken einer Bluttransfusion. Crit Care Med 2003;31(12 Suppl):S678–S686.
- Fitzgibbons PG, Digiovanni C, Hares S, Akelman E: Sichere Tourniquet-Nutzung: Eine Überprüfung der Beweise. J Am Acad Orthop Surg 2012;20(5):310–319.
- Nitz AJ, Dobner JJ, Matulionis DH: Pneumatische Tourniquet-Anwendung und Nervenintegrität: Motorik und Elektrophysiologie. Exp Neurol 1986;94(2):264–279.
- Kornbluth ID, Freedman MK, Sher L, Frederick RW: Femorale Lähmung des Saphenusnervs nach Tourniquet-Einsatz: Ein Fallbericht. Arch Phys Med Rehab 2003;84(6):909–911.
- Weingarden SI, Louis DL, Waylonis GW: Elektromyographische Veränderungen bei Postmeniskektomie-Patienten. Rolle des pneumatischen Tourniquets. JAMA 1979;241(12):1248–1250.
- Saunders KC, Louis DL, Weingarden SI, Waylonis GW: Wirkung der Tourniquet-Zeit auf die postoperative Quadrizepsfunktion. Clin Orthop Relat Res 1979(143):194–199.
- Kagoma YK, Crowther MA, Douketis J, Bhandari M, Eikelboom J, Lim W: Verwendung einer antifibrinolytischen Therapie zur Reduzierung der Transfusion bei Patienten, die sich einer orthopädischen Operation unterziehen: Eine systematische Überprüfung randomisierter Studien. Thrombosis Res 2009;123(5):687–696.
- Murkin JM, Falter F, Granton J, Young B, Burt C, Chu M: Hochdosierte Tranexamsäure wird mit nicht-ischämischen klinischen Anfällen bei herzchirurgischen Patienten in Verbindung gebracht. Anesth Analg 2010;110(2):350–353.