Marina Gitman, Michael Fettiplace und Guy Weinberg
EINFÜHRUNG
Die Einführung von Kokain als erster lokale Betäubung (LA) im späten neunzehnten Jahrhundert wurde bald von Berichten über seine systemische Toxizität begleitet. Die Toxizitätssymptome wurden häufig als Krampfanfälle oder Atemstillstand beschrieben, in einigen Fällen wurde jedoch auch über unerwünschte Herzwirkungen berichtet. Oft wurde die tödliche systemische Toxizität von Lokalanästhetika (LAST) mit Koffein, Ammoniak oder sogar subkutanem Äther behandelt. Die Entwicklung von Procain im Jahr 1904 löste das Problem der systemischen Toxizität nicht, und das Committee for the Study of Toxic Effects of Local Anesthetics veröffentlichte einen Bericht über 43 tödliche Fälle im Zusammenhang mit der Verwendung von LAs. Die Identifizierung der beitragenden Faktoren, die Betonung der Prävention und die fast vollständige Eliminierung von Kokain aus der klinischen Praxis trugen dazu bei, die Inzidenz von LAST für fast 50 Jahre zu verringern.
Die Synthese von langwirksamen, fettlöslichen LAs wie Bupivacain in den späten 1950er Jahren mit anschließenden damit verbundenen Berichten über LAST führte jedoch zur Rückkehr von tödlichem LAST. Dazu gehörten mehrere Fälle von fötalem Tod im Zusammenhang mit parazervikalen Nervenblockaden, Kammerflimmern nach einem interskalenäre Nervenblockade, und was als „Sentinel“-Fall eines jungen Mannes gilt, der nach einer Schwanznervenblockade einen Herzstillstand erlitt. Die folgenden Jahrzehnte wurden von isolierten Berichten geplagt, die ein gemeinsames Problem beschrieben: kardiovaskulärer (CV) Tod im Zusammenhang mit LAST, das besonders resistent gegen verfügbare Wiederbelebungsmaßnahmen wie Vasopressoren (z. B. Adrenalin) und Defibrillation war.
MECHANISMUS DER LOKALEN ANÄSTHETISCHEN TOXIZITÄT
Lokalanästhetika sind im Allgemeinen sicher und wirksam, wenn sie auf den Ort der Therapie beschränkt sind, wie z. B. eine Gewebeinfiltration, in der Nähe eines Nervs oder eines Nervengeflechts. Wenn jedoch große Mengen von LA in den systemischen Kreislauf gelangen, können supratherapeutische Blut- und Gewebespiegel Toxizität verursachen. Dieser Übergang in das Blut kann auf eine unbeabsichtigte intravaskuläre Injektion oder eine vaskuläre Aufnahme durch lokale Ausbreitung zurückzuführen sein. Am Zielort reduzieren LAs den Natriumionenfluss durch spannungsabhängige Natriumkanäle durch eine Kombination aus erhöhter Energiebarriere und sterischer Hinderung. Diese Nervenblockade tritt von der intrazellulären Seite auf und erfordert, dass LAs zuerst über die Lipiddoppelschicht wandern. LAs blockieren in ähnlichen Konzentrationen auch Nervenkanäle und andere Kanäle. Bei niedrigeren Konzentrationen blockieren LAs-Nervenproteinkinase-Signale, die durch den Tumornekrosefaktor α induziert werden. Bei höheren Konzentrationen können LAs andere Kanäle, Enzyme und Rezeptoren, einschließlich der Carnitin-Acylcarnitin-Translokase in den Mitochondrien, hemmen.
Erfahren Sie hier mehr über Wirkmechanismus von Lokalanästhetika
Obwohl es keinen klaren Konsens gibt, wird die Herztoxizität wahrscheinlich durch die Kombination von elektrophysiologischer und kontraktiler Dysfunktion verursacht. Im Vergleich zu anderen klinisch gebräuchlichen LAs ist Bupivacain lipophiler und hat eine größere Affinität zu den spannungsgesteuerten Natriumkanälen. Diese Eigenschaften können zu seinem kardiotoxischen Profil beitragen. Zu beachten ist, dass bei Serumkonzentrationen, die niedriger als erwartet sind, Toxizität auftreten kann, da sich LAs in Mitochondrien und Herzgewebe in einem Verhältnis von etwa 6:1 (oder mehr) relativ zu Plasma anreichern.
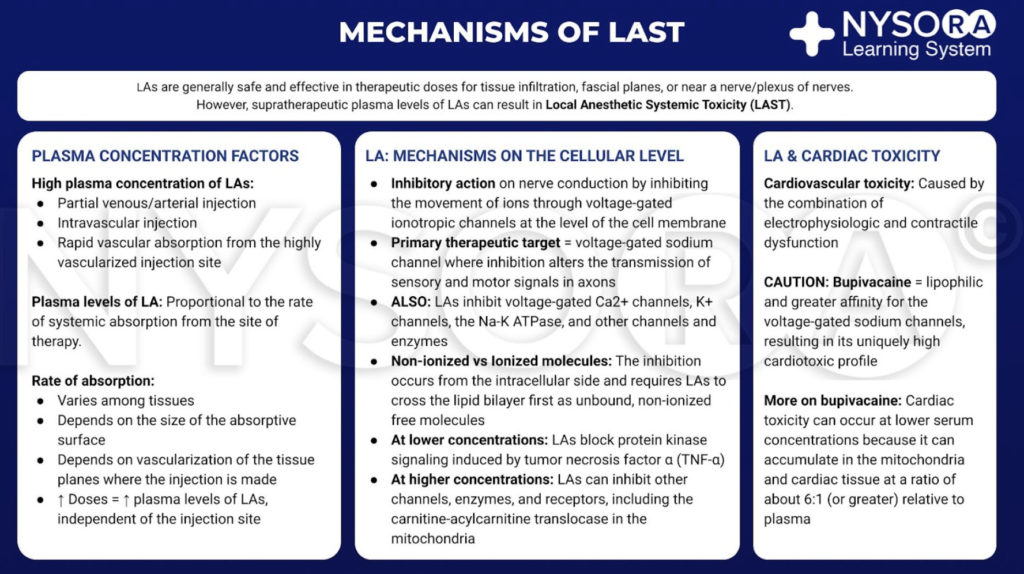
Aus dem Kompendium der Regionalanästhesie: Infografik zu Mechanismen der systemischen Toxizität von Lokalanästhetika.
DIAGNOSE UND BEITRAGENDE FAKTOREN
Das typische Erscheinungsbild von LAST beginnt normalerweise mit prodromalen Symptomen und Anzeichen wie perioraler Taubheit, Tinnitus, Unruhe, Dysarthrie und Verwirrtheit. Diese können von schwereren Störungen des Zentralnervensystems (ZNS) wie Krampfanfällen und Koma gefolgt werden. Auch kardiovaskuläre Störungen können auftreten, die sich zunächst in Hypertonie und Tachykardie, dann Bradykardie und Hypotonie zeigen, mit Fortschreiten zu schwerwiegenderen Komplikationen, einschließlich ventrikulärer Arrhythmien und Asystolie. Die meisten unerwünschten Ereignisse treten innerhalb von 1 Minute nach der LA-Injektion auf, aber nicht alle Fälle folgen diesem Muster. Die Toxizität kann einen verzögerten Beginn von mehr als 1 Stunde nach der Injektion haben und sich als isolierte kardiovaskuläre Dysfunktion oder als Kombination von ZNS- und kardiovaskulären Anzeichen ohne die klassische Progression manifestieren.
Zu den Variablen, die das Toxizitätsrisiko erhöhen, gehören die Art des LA und die Dosis, die Injektionsstelle, die Komorbiditäten des Patienten, extremes Alter und geringe Größe oder begrenzte Muskelmasse. Die Lipophilie eines LA ist mit Toxizität verbunden. Lipophilere LAs wie Bupivacain haben ein erhöhtes Toxizitätsrisiko im Vergleich zu weniger lipophilen LAs wie Mepivacain und Lidocain.
Eine höhere Gesamtdosis und das Dosis-Gewichts-Verhältnis des Arzneimittels können möglicherweise die Wahrscheinlichkeit von LAST erhöhen. Insbesondere wirkt der Skelettmuskel als Depot für systemisch absorbiertes LA, was für das klinische Risiko von LAST bei schmächtigen Patienten, deren Muskelmasse wesentlich geringer als normal ist, verantwortlich sein kann. Dementsprechend bergen Nervenblockaden und Epiduralanästhetika, die größere Dosen erfordern, ein inhärentes Risiko für solche Patienten. Beispielsweise können bilaterale Blockaden des N. transversus abdominus plane, die mit bis zu 40 ml 0.5 %igem Ropivacain durchgeführt werden, zu einer erhöhten Inzidenz lokaler Toxizität führen.
Nicht zuletzt trägt auch die Injektionsstelle zum Risiko einer vaskulären Ausbreitung des Arzneimittels bei. Die klassische Lehre, dass die vaskuläre Resorption von LAs am höchsten ist interkostale Nervenblockaden gefolgt von Epidural und Plexus-brachialis-Injektionen entspricht den klinischen Daten, die zeigen, dass die höchste Inzidenz von LAST bei auftritt paravertebrale Nervenblockaden, gefolgt von Nervenblockaden der oberen Extremität und des Rumpfes/der unteren Extremität.
Zu den patientenabhängigen Risikofaktoren gehören Organfunktionsstörungen, der Serumspiegel der Bindungsproteine und das Alter. Bereits vorhanden Herzerkrankung können Patienten anfälliger für die arrhythmogenen und myokardial dämpfenden Wirkungen von LAs machen. Bei Patienten mit dekompensierter Herzinsuffizienz, schwerer Herzklappenerkrankung oder eingeschränkter Ventrikelfunktion ist äußerste Vorsicht geboten. Eine hepatische oder renale Dysfunktion kann zu einer verminderten Metabolisierung und Clearance und einem höheren Spiegel des zirkulierenden Arzneimittels führen. Darüber hinaus können Leber-/Nierenversagen, Mangelernährung oder andere Krankheitsprozesse, die zu einem verringerten Albuminspiegel im Serum führen, den Spiegel des freien Arzneimittels für eine gegebene Dosis indirekt erhöhen.
Patienten im extremen Alter sind anfälliger für Toxizität, ein Befund, der mit einer Reihe von Faktoren zusammenhängen kann. Das älteren Generation haben mit größerer Wahrscheinlichkeit Organfunktionsstörungen, die zur Toxizität beitragen. Darüber hinaus können sowohl ältere als auch pädiatrische Patienten eine verminderte Muskelmasse aufweisen und erhalten daher mit größerer Wahrscheinlichkeit eine höhere Dosis des Arzneimittels für ihr Gewicht. Die meisten Kinder werden betäubt, wenn eine Nervenblockade gesetzt wird, so dass die frühen Symptome übersehen werden und ernstere ZNS-/Herzstörungen das erste Anzeichen einer Toxizität sein könnten.

Aus dem Kompendium der Regionalanästhesie: Infografik zu Symptomen, Diagnose und Behandlung der systemischen Toxizität von Lokalanästhetika.
AUFTRETEN VON TOXIZITÄT
Neuraxiale Anästhesie und periphere Nervenblockaden (PNBs) sind die am häufigsten durchgeführten Verfahren, die die Verwendung von LAs erfordern. Das für die intrathekale Verabreichung erforderliche geringe Arzneimittelvolumen stellt selten ein Problem dar. Allerdings erfordert die hohe Lautstärke z Epiduralanästhesie und PNBs erhöhen das Risiko von LAST. Derzeit verfügbare Daten zeigen, dass die Inzidenz von LAST im Zusammenhang mit PNB von 1.6–2/1000 in den 1990er Jahren auf 0.08–0.98/1000 zwischen 2003 und 2013 zurückgegangen ist. Tatsächlich beobachtete eine kürzlich durchgeführte Studie keine Fälle von LAST mit mehr als 9000 PNB über einen Zeitraum von 6 Jahren. Ebenso sank die Inzidenz von LAST mit Epiduralanästhesie von 9.75/1000 in den frühen 1980er Jahren auf 0.1–1.2/1000 in den 1990er Jahren und blieb 0.1 bei 1000/2003.
Während große Bevölkerungsstudien meist auf Epiduralanästhesie und PNB beschränkt sind, gibt es zahlreiche Berichte, die LAST mit anderen Arten der Lokalanästhesie beschreiben. Zum Beispiel gab es mit der jüngsten Popularität einer Nervenblockade in der Transversus-Abdominus-Ebene für abdominale Eingriffe mehrere Fälle von LAST, nachdem diese Nervenblockaden für Kaiserschnitte durchgeführt wurden.
Neurologische Toxizität wurde auch nach der topischen Anwendung von LAs beschrieben, die Anästhesisten häufig vor der Instrumentierung der Atemwege verwenden Wachintubation. Dies wird wahrscheinlich zu wenig berichtet, da die neurologischen Symptome leicht sein können (periorale Taubheit, Tinnitus, Unruhe) und durch eine präoperative Sedierung maskiert werden, die der Einleitung einer Vollnarkose unmittelbar nach der Wachintubation vorausgeht.
Gelegentliche Ursachen von LAST außerhalb des üblichen Rahmens eines Anästhesisten umfassen retrobulbäre Nervenblockaden für ophthalmologische Chirurgie u untere Alveolarnervenblockaden für zahnärztliche Eingriffe. Die Toxizität einer retrobulbären Nervenblockade wird durch subarachnoidale Ausbreitung des Anästhetikums verursacht, das eine Hirnstammanästhesie verursacht; die sich als veränderter Geisteszustand, Apnoe und Krampfanfälle manifestieren können. Spezifische Berichte über LAST nach inferioren Alveolarnervenblockaden sind selten, aber es ist eindeutig ein potenzielles Risiko. Der gefäßreiche Bereich des Pterygomandibularraums erhöht das Risiko einer intravaskulären Nadelplatzierung, das selbst bei erfahrenen Oralchirurgen bis zu 15.3 % betragen kann. Schließlich gibt es in letzter Zeit einen Anstieg der Verwendung regionaler Nervenblockaden in Notaufnahmen und entsprechende Berichte über LAST in der Notaufnahme, aber das Ausmaß dieses Problems ist derzeit unbekannt.
BEHANDLUNG
Gegenwärtig bestehen die drei Säulen der LAST-Behandlung aus der Behandlung von Anfällen, der erweiterten kardialen Lebenserhaltung (ACLS) und der sofortigen Verabreichung einer 20%igen Lipidemulsion. Bei hämodynamisch stabilen Patienten mit isolierter Krampfaktivität können intravenöse Benzodiazepine verwendet werden. Kleine Propofol-Dosen werden von einigen als akzeptable Alternative zur Anfallskontrolle angesehen, können jedoch eine Herzfunktionsstörung verschlimmern, die sich unter LAST entwickeln kann. Zusätzlicher Sauerstoff ist für jeden Patienten geeignet, der Anzeichen von LAST zeigt, aber für Patienten mit Apnoe, hämodynamisch instabilen Arrhythmien oder Herzstillstand ist ein sofortiges, aggressiveres Atemwegsmanagement oder eine Kreislaufunterstützung erforderlich. Die Ziele sind die Aufrechterhaltung der Lungenventilation und der adäquaten Organperfusion mit gut sauerstoffreichem Blut und die Vermeidung einer weiteren Azidose bis zum Beginn der Lipidemulsionstherapie.
Vor der Einführung der Lipidemulsionstherapie war die Behandlung schwerer kardialer Toxizität auf ACLS und kardiopulmonalen Bypass beschränkt. Die Anwendung von Vasopressoren während der Wiederbelebung verschlimmerte möglicherweise Azidose und Arrhythmien. In einigen Fällen wurde der kardiopulmonale Bypass verwendet; Leider haben nicht alle Krankenhäuser diese Möglichkeit. Die Idee, dass eine lipidreiche Substanz das Potenzial hat, die Wirkung bestimmter Medikamente umzukehren, entstand in den 1960er Jahren, als mehrere Tierversuche zeigten, dass die intravenöse Verabreichung einer Ölemulsion die Wirkungsdauer von Thiopental verringerte oder den freien Anteil von Chlorpromazin verringerte Blut. 1997 inspirierte der zufällige Fall von LAST bei einer jungen Frau mit Isovalerianazidämie und Carnitinmangel eine Reihe von Tierversuchen. Carnitin wird für den Transport von Fettsäuren in die Mitochondrien für die β-Oxidation benötigt, und die Akkumulation von zytoplasmatischen Acylcarnitinen (z. B. während Myokardischämie) ist mit Arrhythmien verbunden. Daher stellten Weinberg et al. die Hypothese auf, dass eine Überladung der Zellen mit exogenen Fettsäuren durch die Infusion einer Lipidemulsion die LA-Toxizität verschlimmern würde. Überraschenderweise wurde das Gegenteil beobachtet. Die Infusion einer Fettemulsion verringerte und kehrte die LA-Toxizität sogar um.
Im Jahr 2006 wurde die erste erfolgreiche Wiederbelebung eines menschlichen Patienten mit einer Lipidemulsion berichtet. Seitdem gab es viele klinische Berichte, die eine wirksame Aufhebung von LAST bei Erwachsenen und Kindern beschreiben. Die Behandlung der Toxizität mit einer intravenösen Lipidemulsion wurde als Lipid-Reanimationstherapie (LRT) bezeichnet. Der Mechanismus der LRT ist multimodel in Aktion, wobei Lipid sowohl eine reinigende Wirkung (früher als „Lipidsenke“ bekannt) als auch eine direkte kardiotonische Wirkung ausübt.
Die Abfangwirkung wird durch die Fähigkeit der Lipidemulsion gemildert, lipophile Anteile aufzunehmen und sie um das Blut herum zu Speicher- und Entgiftungsstellen zu transportieren. Dies sorgt für einen „Lipid-Shuttle“-Effekt. Der Scavenging-Effekt reicht jedoch nicht aus, um die schnelle Erholung zu erklären. Ein zweiter Effekt tritt auf, wobei in Labormodellen die Infusion der Lipidemulsion das Herzzeitvolumen durch eine Kombination aus Volumen und direkten kardiotonischen Effekten erhöht, um das Herzzeitvolumen zu verbessern, sobald die Herzkonzentration des Arzneimittels unter die Ionenkanalblockierungsschwelle fällt. Eine 20%ige Lipidemulsion ist wirksam bei der Behandlung von LAST, das durch Bupivacain sowie andere weniger lösliche LAs, wie Ropivacain, Mepivacain und Lidocain, verursacht wird.
Es wurde festgestellt, dass die in einem Rattenmodell getestete Lipidemulsion LD50 (mittlere tödliche Dosis) viel höher war als die Dosen, die für die Lipidrettung beim Menschen verwendet wurden. Zu den möglichen Nebenwirkungen gehören Störungen bei klinischen Labormessungen (Hämoglobin, Methämoglobin, Elektrolyte, Basenüberschuss); allergische Reaktionen; Übelkeit/Erbrechen; Dyspnoe; und Brustschmerzen. Nichtsdestotrotz beschränken sich die tatsächlich gemeldeten Nebenwirkungen auf Bronchospasmus, Hyperamylasämie und Störungen der Labormessungen.
Transaminitis, Hepatosplenomegalie und bakterielle Kontamination sind typischerweise mit einer längeren Anwendung einer Lipidemulsion verbunden und spielen bei der kurzfristigen Verabreichung von LAST keine Rolle. Obwohl die Anwendung großer Mengen Lipidemulsion (insbesondere 30 %) bei Frühgeborenen und Neugeborenen mit niedrigem Geburtsgewicht mit dem Tod durch Fettansammlung in der Lunge in Verbindung gebracht wurde, gibt es Fallberichte bei Neugeborenen, Kleinkindern und älteren Kindern über eine erfolgreiche Aufhebung des Medikaments Überdosierung (Bupivacain und Nicht-LAs) mit empfohlenen Standardregimen von 20 % Lipid. Zuletzt sollte man, wie erwähnt, bei der Anwendung von Propofol in dieser Situation Vorsicht walten lassen: Es ist kein Ersatz für eine Lipidemulsion. Der Lipidgehalt in standardmäßigen sedierenden oder antikonvulsiven Dosen von Propofol ist nicht ausreichend, um einen Vorteil bei einer Überdosierung zu erzielen; Propofol kann jedoch die CV-Stabilität beeinträchtigen.
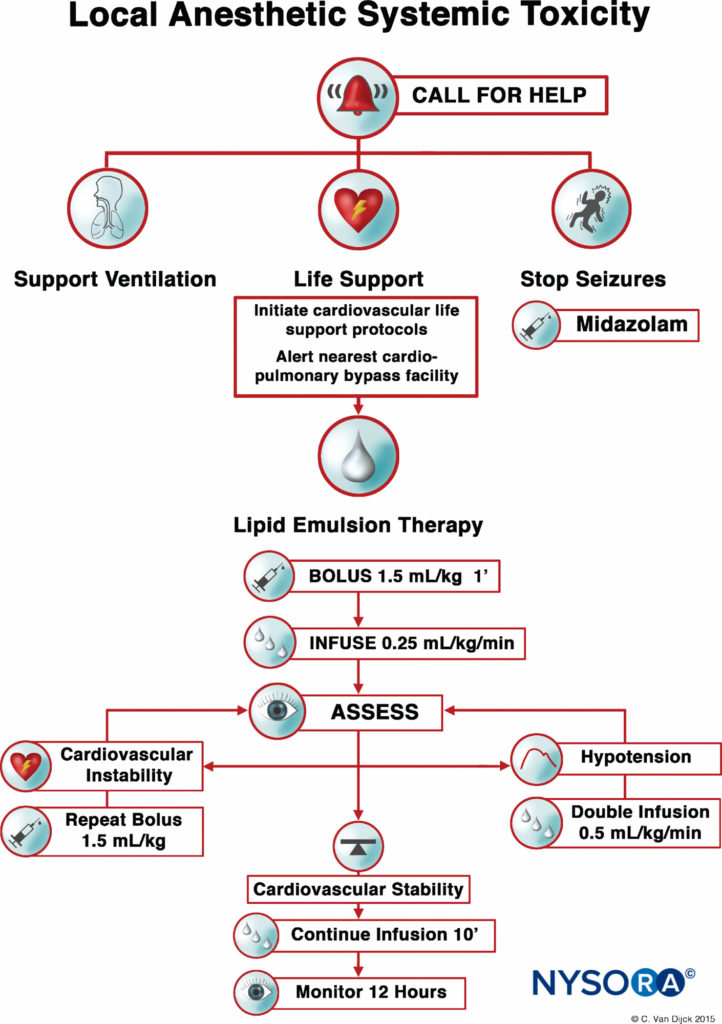
ABBILDUNG 1. Checkliste für das Management der systemischen Toxizität von Lokalanästhetika.
Nachdem zahlreiche Fallberichte die Rolle der LRT als wirksame Behandlung von LAST validiert hatten, gab die American Society of Regional Anästhesie und Schmerzmedizin (ASRA) 2010 einen Praxisratgeber heraus, gefolgt 2012 von einer Checkliste für den Umgang mit LAST (Figure 1). Die Leitlinien betonen die Wichtigkeit einer sofortigen Herz-Lungen-Wiederbelebung und liefern einen detaillierten Algorithmus für die Dosierung und Verabreichung der Lipidemulsion.
Die rechtzeitige Verwendung des LRT bei den frühesten Anzeichen einer Toxizität kann die Wiederbelebungsbemühungen verbessern und die Menge der verwendeten Vasopressoren verringern. Wie bei jedem lebensbedrohlichen Notfall ist die Sicherung des intravenösen Zugangs unerlässlich; Die intraossäre Verabreichung einer Lipidemulsion ist jedoch eine mögliche Alternative, wenn sich der intravenöse Zugang als problematisch erweist.
PRÄVENTION
Wie immer ist die beste Behandlung die Vorbeugung. Dies gilt insbesondere für LAST. Die Wirksamkeit und Verfügbarkeit von LRT verringert die potenzielle Morbidität selbst bei erfolgreicher Behandlung nicht. Das Vorhandensein einer „Wunderwaffe“ entbindet nicht von der Notwendigkeit der Vorsicht. Aus diesem Grund wird die Verwendung von Ultraschall, intravaskulären Markern, inkrementeller Injektion mit Aspiration, weniger toxischen Medikamenten und der niedrigsten wirksamen Dosis empfohlen.
NYSORA-Tipps
- Es besteht eine größere Wahrscheinlichkeit für eine systemische LA-Toxizität bei zierlichen Patienten (geringe Muskelmasse), solchen im extremen Alter und Patienten mit vorbestehender Herzerkrankung oder Carnitinmangel.
- Ungefähr die Hälfte der Fälle von LAST sind atypisch, ohne Anfälle (andere ZNS-Symptome), nur kardiovaskuläre Toxizität oder verzögerter Beginn.
- Die Inzidenz von Toxizität steigt mit Injektionen in der Nähe von reich vaskulären Bereichen. Sie ist am höchsten bei paravertebralen Injektionen, gefolgt von PNBs der oberen und unteren Extremität.
- Die Prävention von LAST-bedingter Morbidität erfordert die Optimierung eines kompletten Systems für die Regionalanästhesie: Patientenauswahl, Auswahl der Nervenblockade, Medikament und Dosis, vollständige Überwachung und Verwendung von USGRA, wenn möglich, und Vorbereitung auf LAST, indem ein Kit zur Verfügung steht und mit Simulation geübt wird.
- Zur Prävention gehört auch die Sensibilisierung und Schulung unserer nicht anästhesiologischen Kollegen über die ordnungsgemäße Anwendung von LAs und Risiken, einschließlich des Managements von LAST.
Ultraschall bietet mehrere potentielle Vorteile. Es ermöglicht die direkte Visualisierung der injizierbaren Ausbreitung des Arzneimittels, die Erkennung einer unbeabsichtigten intravaskulären Injektion und die Verwendung kleinerer LA-Volumen. Darüber hinaus gibt es Hinweise darauf, dass die Verwendung von Ultraschall bei PNBs die Inzidenz von LAST reduzieren kann.
Ein intravaskulärer Marker wie 10–15 μg Epinephrin hat eine angemessene (wenn auch unvollkommene) Empfindlichkeit und einen positiven Vorhersagewert und kann mit einer Testdosis verabreicht werden. Ein Anstieg der Herzfrequenz von 10 Schlägen/Minute oder mehr oder ein Anstieg des systolischen Blutdrucks von 15 mmHg oder mehr deutet auf eine intravasale Injektion hin. Inkrementelle Injektionen von LAs (normalerweise 3–5 ml) und häufiges Absaugen wurden regelmäßig empfohlen und haben zusammen mit der Verwendung der Testdosis möglicherweise zur Verringerung der Inzidenz von LAST beigetragen, die bei Epiduralanästhesie beobachtet wurde.
Schließlich bietet die Verwendung der niedrigsten wirksamen Dosis einen zusätzlichen Sicherheitsspielraum. Es ist auch sinnvoll, die Dosis bei Patienten, bei denen eine Erkrankung bekannt ist, die ihre Anfälligkeit für LAST erhöhen könnte, nach unten anzupassen. Dies erscheint etwas überflüssig, wenn man immer die niedrigste Dosis verwendet, die für eine Nervenblockade erforderlich ist. Vorsicht ist der Punkt. Keine dieser Maßnahmen ist an sich präzise oder perfekt; Daher ist es wichtig, sich nicht auf einen einzigen Präventionsschritt zu verlassen, sondern mehrere plus gesunden Menschenverstand zu integrieren, um die Patientensicherheit an erste Stelle zu setzen.
BEWUSSTSEIN UND BILDUNG
Anästhesisten verwenden LAs täglich an verschiedenen Praxisstandorten und für eine Vielzahl von Eingriffen. Daher sollte jeder Ort, an dem LAs in potenziell toxischen Dosen verwendet werden, mit einer grundlegenden Reanimationsausrüstung und einer 20%igen Lipidemulsion ausgestattet sein. Darüber hinaus kann die ASRA-Checkliste für die Behandlung von LAST als Orientierungshilfe für den Behandlungsprozess dienen. Es wurde gezeigt, dass ein elektronisches Entscheidungsunterstützungstool die Einhaltung der Richtlinien während der Simulation des Managements von LAST verbessert und in tatsächlichen Fällen von Vorteil sein kann. Schließlich ist die Aufklärung von Nichtanästhesieanbietern entscheidend, um ihr Bewusstsein sowohl für das Risiko von LAST als auch für seine Behandlung zu schärfen. Patienten könnten gerettet werden, wenn solche sehr seltenen Ereignisse von Nicht-Anästhesisten oder anderen Uneingeweihten, die sonst das Risiko nicht kennen, richtig diagnostiziert und behandelt werden. Die Ausbildung unterscheidet sich zwischen Institutionen und Abteilungen, aber es gibt suboptimale Kenntnisse über LA-Dosierung, Sicherheitsvorkehrungen und Behandlung von LAST unter anderen Fachgebieten. Aus diesem Grund können die ASRA-Checkliste und das elektronische Entscheidungsunterstützungstool für Ärzte im Falle einer LA-Toxizität von unschätzbarem Wert sein.
REFERENZEN
- Drasner K: Systemische Toxizität von Lokalanästhetika. Eine historische Perspektive. Reg Anesth Pain Med 2010;35:162–166.
- Mayer E: Die toxischen Wirkungen nach der Verwendung von Lokalanästhetika: eine Analyse der Berichte über dreiundvierzig Todesfälle, die dem Ausschuss für die Untersuchung toxischer Wirkungen von Lokalanästhetika der American Medical Association vorgelegt wurden, und der Empfehlungen des Ausschusses. JAMA 1924;82:875–876.
- Edde RR, Deutsch S: Herzstillstand nach interskalenärem Brachialplexus-Block. Anesth Analg 1977;56:446–447.
- Prentiss JE: Herzstillstand nach kaudaler Anästhesie. Anästhesiologie 1979;50:51–53.
- Clarkson CW, Hondeghem LM: Mechanismus der Bupivacain-Depression der Herzleitung: schneller Block der Natriumkanäle während des Aktionspotentials mit langsamer Erholung vom Block während der Diastole. Anesthesiology 1985;62:396–405.
- Coyle DE, Sperelakis N: Bupivacain und Lidocain blockieren kalziumvermittelte langsame Aktionspotentiale im Ventrikelmuskel von Meerschweinchen. J Pharmacol Exp Ther 1987;242:1001–1005.
- Piegeler T, Votta-Velis, Bakhshi FR, et al: Schutz der Endothelbarriere durch Lokalanästhetika: Ropivacain und Lidocain blockieren Tumornekrosefaktor-a-induzierte Endothelzellen-Src-Aktivierung. Anesthesiology 2014;120: 1414–1428.
- Weinberg GL, Palmer JW, VadeBoncouer, et al: Bupivacain hemmt den Acylcarnitin-Austausch in kardialen Mitochondrien. Anesthesiology 2000;92: 523–528.
- Wolfe JW, Butterworth JF: Systemische Toxizität von Lokalanästhetika: Update zu Mechanismen und Behandlung. Curr Opin Anesthesiol 2011;24:561–566.
- Albright EA: Herzstillstand nach Regionalanästhesie mit Etidocain oder Bupivacain. Anästhesiologie 1979;51:285–287.
- Heavner JE: Herztoxizität von Lokalanästhetika im intakten isolierten Herzmodell: eine Übersicht. Reg Anesth Pain Med 2002;27:545–555.
- Hiller N., Mirtschink P., Merkel C. et al.: Die myokardiale Akkumulation von Bupivacain und Ropivacain ist mit reversiblen Wirkungen auf die Mitochondrien und einer reduzierten Myokardfunktion verbunden. Anesth Analg 2013; 116: 83-92.
- Fettiplace MR, Pichurko A, Ripper R, et al: Durch Kokain oder Kokaethylen induzierte Herzdepression wird durch Lipidemulsion wirksamer gelindert als durch Sulfobutylether-B-Cyclodextrin. Acad Emerg Med 2015;22:508–517.
- Di Gregorio, Neal JM, Rosenquist RW, et al: Klinische Darstellung der systemischen Toxizität von Lokalanästhetika. Ein Überblick über veröffentlichte Fälle, 1979–2009. Reg Anesth Pain Med 2010;35:181–187.
- Pertrar S: Die Verabreichung eines vollständigen Lokalanästhetikums ist integraler Bestandteil des Syndroms der systemischen Toxizität des Lokalanästhetikums. Anesthesiology 2014;121: 1130–1131.
- Barrington MJ, Kluger R: Die Ultraschallführung reduziert das Risiko einer systemischen Toxizität von Lokalanästhetika nach einer peripheren Nervenblockade. Reg Anesth Pain Med 2013;38:289–299.
- Eng HC, Ghosh SM, Chin KJ: Praktische Anwendung von Lokalanästhetika in Regionalanästhesie. Curr Opin Anesthesiol 2015;27:382–387.
- Calenda E, Baste JM, Hajjej R, et al: Toxische Plasmakonzentration von Ropivacain nach einer paravertebralen Blockade bei einem Patienten mit schwerer Hypalbuminämie. J Clin Anesth 2014;26:149–151.
- Fagenholz PJ, Bowler GM, Carnochan FM, et al: Systemisch lokal anästhetische Toxizität durch kontinuierlichen thorakalen paravertebralen Block. Br. J. Anaesth 2012;109:260–262.
- Lonnqvist PA: Toxizität von Lokalanästhetika: eine pädiatrische Perspektive. Paediatr Anaesth 2012;22:39–43.
- Auroy Y, Narchi P, Messiah A, et al: Schwerwiegende Komplikationen im Zusammenhang mit Regionalanästhesie: Ergebnisse einer prospektiven Umfrage in Frankreich. Anesthesiology 1997;87:447–486.
- Auroy Y, Benhamou D, Barques L, et al: Schwerwiegende Komplikationen der Regionalanästhesie in Frankreich: der SOS-Hotline-Service für Regionalanästhesie. Anästhesiologie 2002;97:1274–1280.
- Brown, Ransom DM, Hall JA, et al: Regionalanästhesie und lokal Anästhesie-induzierte systemische Toxizität: Anfallshäufigkeit und begleitende kardiovaskuläre Veränderungen. Anesth Analg 1995;81:321–328.
- Barrington MJ, Watts SA, Gledhill SR, et al: Vorläufige Ergebnisse der australischen Regionalanästhesie-Kollaboration. Eine prospektive Prüfung von mehr als 7000 peripheren Nerven- und Plexusblockaden auf neurologische und andere Komplikationen. Reg Anesth Pain Med 2009;34:534–541.
- Sites BD, Taenzer AH, Herrick MD, et al: Inzidenz von systemischer Toxizität von Lokalanästhetika und postoperativen neurologischen Symptomen im Zusammenhang mit 12,668 ultraschallgesteuerten Nervenblockaden. Eine Analyse aus einem prospektiven klinischen Register. Reg Anesth Pain Med 2012;37:478–482.
- Orebaugh SL, Kentor ML, Williams BA: Nebenwirkungen verbunden mit Nervenstimulator-geführtem und Ultraschall-geführtem peripherem Nerv Blöcke durch betreute Auszubildende: Aktualisierung einer Standortdatenbank. Reg Anesth Pain Med 2012;37:577–582.
- Tanaka K, Watanabe R, Harada T, et al: Extensive Anwendung von Epiduralanästhesie und Analgesie in einem Universitätskrankenhaus: Häufigkeit von Komplikationen im Zusammenhang mit der Technik. Reg Anesth 1993;18:34–38.
- Kenepp NB, Gutsche BB: Unbeabsichtigte intravaskuläre Injektionen während der lumbalen Epiduralanästhesie. Anesthesiology 1981;54:172–173.
- Griffiths JD, Le NV, Grant S, et al: Symptomatische Lokalanästhesie-Toxizität und Ropivacain-Plasmakonzentrationen nach Transversus-Abdominis-Plane-Block für Kaiserschnitt. Br. J. Anaesth 2013;110:996–1000.
- Weiss E, Jolly C, Dumoulin JL, et al: Konvulsionen bei 2 Patienten nach bilateralen ultraschallgeführten Transversus-Abdominis-Plane-Blocks für den Kaiserschnitt. Reg Anesth Pain Med 2014;39:248–251.
- Giordano D, Panini A, Pernice C, et al: Neurologische Toxizität von Lidocain während der Wachintubation bei einem Patienten mit Zungengrundabszess. Fallbericht. Am J. Otoralyngol 2014;35:62–65.
- Gunja N, Varshney K: Hirnstammanästhesie nach retrobulbärer Blockade: eine seltene Ursache für Koma, die in der Notaufnahme vorstellig wird. Emerg Med Australas 2006;18:83–85.
- Dahle JM, Iserson KV: ED-Behandlung der Hirnstammanästhesie nach
retrobulbärer Block. Am J Emerg Med 2007;25:105–106. - Tatum PL, Defalque RJ: Subarachnoidale Injektion während retrobulbärer Blockade: ein Fallbericht. Am Assoc Nurse Anesth J 1994;62:49–52.
- Zenous AT, Ebrahimi H, Mahdipour M, et al: Die Inzidenz von intravaskulärer Nadeleintritt während der Injektion der unteren Alveolarnervenblockade. J Dent Res Dent Clin Prospects 2008;2:38–41.
- Hahn C, Nagdev A: Farbdoppler-Ultraschall-geführter supraklavikulärer Plexus-brachialis-Block zur Verhinderung einer Gefäßinjektion. West J Emerg Med 2014;15:703–705.
- Monti M, Monti A, Borgognoni F, et al: Behandlung mit Lipidtherapie zur Wiederbelebung eines Patienten, der an Toxizität aufgrund von Lokalanästhetika leidet. Notfallversorgung J 2014;10:41–44.
- Harvey M, Cave G, Chanwai G, et al: Erfolgreiche Wiederbelebung nach Bupivacain-induziertem kardiovaskulärem Kollaps mit intravenöser Lipidemulsion nach Femoralnervenblockade in einer Notaufnahme. Emerg Med Australas 2014;23:209–214.
- Weinberg GL: Behandlung der systemischen Toxizität von Lokalanästhetika. Reg Anesth Pain Med 2010;35:188–193.
- Soltesz EG, van Pelt F, Byrne JG, et al: Emergenter ardiopulmonaler Bypass für Bupivacain-Kardiotoxizität. J Cardiothorc Vasc Anesth 2003;17: 357–358.
- Russell RL, Westfall BA: Linderung von Barbiturat-Depression. Anesth Analg 1962;41:582–585.
- Krieglstein J, Meffert A, Niemeyer DH: Einfluss von emulgiertem Fett auf die Verfügbarkeit von Chlorpromazin im Kaninchenblut. Experientia 1974;30: 924–926.
- Corr PB, Yamada KA: Ausgewählte metabolische Veränderungen im ischämischen Herzen und ihre Beiträge zur Arrhythmogenese. Herz 1995;20:156–168.
- Weinberg GL, Laurito CE, Geldner P, et al: Maligne ventrikuläre Dysrhythmien bei einem Patienten mit isovalerischer Akademie, der eine allgemeine und lokale Anästhesie für eine Sauglipektomie erhält. J Clin Anesth 1997;9:668–670.
- Weinberg GL, Ripper R, Murphy P, et al.: Lipidinfusion beschleunigt die Entfernung von Bupivacain und die Erholung von der Bupivacain-Toxizität im isolierten Rattenherz. Reg Anesth Pain Med 2006;31:296–303.
- Rosenblatt MA, Abel M, Fischer GW, et al: Erfolgreiche Verwendung einer 20%igen Lipidemulsion zur Wiederbelebung eines Patienten nach einem mutmaßlich Bupivacain-bedingten Herzstillstand. Anästhesiologie 2006;105:217–218.
- Cave G, Harvey M, Willers J, et al: LIPAEMIC-Bericht: Ergebnisse der klinischen Anwendung einer intravenösen Lipidemulsion bei Arzneimitteltoxizität, die einem Online-Lipidregister gemeldet wurden. J Med Toxicol 2014;10:133–142.
- Presley JD, Chyka PA: Intravenöse Lipidemulsion zur Umkehrung der akuten Arzneimitteltoxizität bei pädiatrischen Patienten. Ann Pharmacother 2013;47:735–743.
- Fettiplace MR, Weinberg G: Vergangenheit, Gegenwart und Zukunft der Lipid-Reanimationstherapie. JPEN J Parent Enteral Nutr 2015;39(1 Suppl):72S–83S, 2015.
- Wagner M, Zausiq YA, Ruf S, et al: Lipid Rescue kehrt die durch Bupivacain induzierte Blockierung des schnellen Na+-Stroms (INa) in Kardiomyozyten des linken Ventrikels der Ratte um. Anesthesiology 2014;120:724–736.
- Mazoit JX, Le Guen R, Beloeil H, et al: Bindung lang anhaltender Lokalanästhetika an Lipidemulsionen. Anästhesiologie 2009;110:380–386.
- Kuo IK, Akpa BS: Gültigkeit der Lipidsenke als Mechanismus zur Umkehrung der systemischen Toxizität von Lokalanästhetika. Anästhesiologie 2013;118:1350–1361.
- Fettiplace MR, Ripper R, Lis K, et al: Schnelle kardiotonische Wirkung der Lipidemulsionsinfusion. Crit Care Med 2013;41:e156–e162.
- Fettiplace MR, Akpa BS, Ripper R, et al: Reanimation mit Lipidemulsion: Die dosisabhängige Erholung von der kardialen Pharmakotoxizität erfordert eine kardiotonische Wirkung. Anesthesiology 2014;120:915–925.
- Ozcan MS, Weinberg G: Update zur Verwendung von Lipidemulsionen bei der systemischen Toxizität von Lokalanästhetika: Ein Fokus auf unterschiedliche Wirksamkeit und Lipidemulsion als Teil der erweiterten kardialen Lebenserhaltung. Int Anesthesiol Clin 2011;49:91–103.
- Hiller DB, DiGrigorio G, Kelly K, et al: Safety of high volume lipid emulsion infusion. Eine erste Annäherung an LD50 bei Ratten. Reg Anesth Pain Med 2010;35:140–144.
- Ozcan MS, Weinberg G: Intravenöse Lipidemulsion zur Behandlung von Arzneimitteltoxizität. J Intensive Care Med 2014;29:59–70.
- Brull SJ: Lipidemulsion zur Behandlung von Lokalanästhetika-Toxizität: Auswirkungen auf die Patientensicherheit. Anesth Analg 2008;106:1337–1339.
- Neal JM, Bernards CM, Butterworth JF 4th, et al: ASRA-Praxisberatung zur systemischen Toxizität von Lokalanästhetika. Reg Anesth Pain Med 2010, 35: 152-161.
- Neal JM, Mulroy MF, Weinberg GL: American Society of Regional
Anästhesie- und Schmerzmedizin-Checkliste für den Umgang mit Lokalanästhetika
systemische Toxizität: Version 2012. Reg Anesth Pain Med 2012;37:16–18. - Fettiplace MR, Ripper R, Lis K, et al: Intraossäre Lipidemulsion: eine wirksame Alternative zur IV-Verabreichung in Notfallsituationen. Crit Care Med 2014;42:157–160.
- Neal JM: Ultraschallgeführte Regionalanästhesie und Patientensicherheit. Reg Anesth Pain Med 2010;35:S59–S67.
- Orebaugh SL, Williams BA, Vallejo M, et al: Unerwünschte Ergebnisse im Zusammenhang mit stimulatorbasierten peripheren Nervenblockaden mit versus ohne Ultraschallvisualisierung. Reg Anesth Pain Med 2009;34:251–255.
- Salinas FV, Hanson NA: Evidenzbasierte Medizin für ultraschallgeführte Regionalanästhesie. Anesthesiol Clin 2014;32:771–787.
- Mulroy MF, Hejtmanek MR: Prävention von Lokalanästhetika systemisch
Toxizität. Reg Anesth Pain Med 2010;35:177–180. - Neal JM: Systemische Toxizität von Lokalanästhetika. Schritt für Schritt die Patientensicherheit verbessern. Reg Anesth Pain Med 2013;38:259–261.
- Neal JM, Hsiung Rl, Mulroy MF, et al: Die ASRA-Checkliste verbessert die Leistung der Auszubildenden während einer simulierten Episode einer systemischen Toxizität von Lokalanästhetika. Reg Anesth Pain Med 212;37:8–15.
- McEvoy MD, Hand WR, Stoll WD, et al: Die Einhaltung der Richtlinien für das Management der systemischen Toxizität von Lokalanästhetika wird durch ein elektronisches Entscheidungsunterstützungstool und einen ausgewiesenen „Reader“ verbessert. Reg Anesth Pain Med 2014;392:299–305.
- Sagir A, Goyal R: Eine Bewertung des Bewusstseins für die systemische Toxizität von Lokalanästhetika bei Postgraduierten mit mehreren Fachgebieten. J Anesth 2015; 29:299–302.
Marina Gitman, Michael Fettiplace und Guy Weinberg

